| Алюминий –
металл будущего
«Серебро из глины»
- Немецкий учёный Ф. Велер (1827 г.)
получил алюминий при нагревании
хлорида алюминия со щелочными
металлами калий и натрий.
Из истории открытия
В период открытия алюминия - металл был дороже золота. Англичане хотели почтить богатым подарком великого русского химика Д.И Менделеева, подарили ему химические весы, в которых одна чашка была изготовлена из золота, другая - из алюминия. Чашка из алюминия стала дороже золотой. Полученное «серебро из глины» заинтересовало не только учёных, но и промышленников и даже императора Франции.
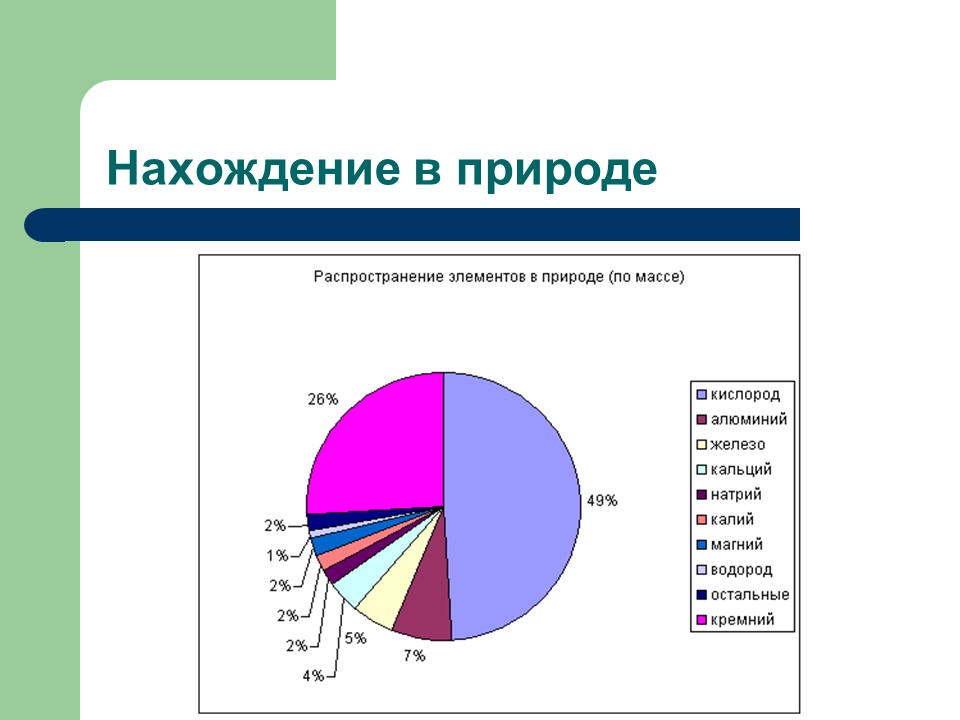
Нахождение в природе
Физические свойства
- Алюминий – металл серебристо- белого цвета, лёгкий ( q- 2,7 г./ см.3
), плавится при температуре 6600
С. обладает хорошей ковкостью, пластичностью, электрической проводимостью и теплопроводностью, легко поддаётся обработке, образует лёгкие и прочные сплавы.
Химические свойства
- Алюминий восстанавливает все элементы, находящиеся справа от него в электрохимическом ряду напряжения металлов, простые вещества – неметаллы. Из сложных соединений алюминий восстанавливает ионы водорода и ионы менее активных металлов. Однако при комнатной температуре на воздухе алюминий не изменяется, поскольку его поверхность покрыта защитной оксидной плёнкой.
Применение алюминия
Металл будущего
- Обладая такими свойствами как лёгкость, прочность, коррозионноустойчивость, устойчивость к действию сильных химических реагентов - алюминий нашёл большое занимают в авиационном и космическом транспорте применение во многих отраслях народного хозяйства. Особое место алюминий и его сплавы, электротехнике, а за ними будущее нашей науки и техники.
Аллотропные Модификации
- Белый фосфор – P4
запах чесночный, Н в воде, Р в органических растворителях, летуч, Tпл
= 440
С, молекулярная кристаллическая решётка, активен, на воздухе окисляется, в темноте светится, ЯДОВИТ!!!
Аллотропные Модификации
- Красный фосфор – цвет красно-бурый, не ядовит, Не растворим в воде и органических растворителях, атомная кристаллическая решётка, устойчив
.
Аллотропные Модификации
- черный фосфор – без запаха, похож на графит, жирный на ощупь, Не растворим в воде и органических растворителях, атомная кристаллическая решетка, полупроводник
, Ткип
= 453°С (возгонка), Тпл
= 1000°С (при р=1,8 • 109
Па), устойчив
.
Реклама

5С + 3SiO2
+ Са3
(РО4
)2
= 5СО + 3CaSi03
+ 2Р (сплавление в электрической печи)
- Взаимодействие с кислородом.
- 4Р°+502
=t
2Р+
5
2
O5
белый Т = 40°С красный Т = 260°С черный Т = 400°С
- 4Р°+ ЗО2
= 2Р+
3
2
O3
(недостаток О2
)
2. Взаимодействие с галогенами.
- 2Р°+ЗСl2
= 2Р+3
С13
легко разлагается водой
- РС13
+ ЗН2
О = Н3
РО3
+ ЗНС1
3. Взаимодействие с азотной кислотой.
- ЗР°+ 5HNO3
+ 2Н2
О = ЗН3
Р+
5
O4
+ 5NO
















|