| Санкт-Петербургский государственный университет
Химический факультет
Курсовая работа
Тема: "Комплексные соединения хрома.
Синтез соли Рейнеке NH4
[Cr (NH3
) 2
(NCS) 4
] "
Студент I курса
Воронаев Иван Геннадьевич
2 группа.
Преподаватель
профессор, д. х. н.
Хрипун Мария Кирилловна
Санкт-Петербург 2010
Оглавление
Введение
§1. Степени окисления, электронные конфигурации, координационные числа и геометрия соединений хрома
§ 2. Хром (II)
§3. Хром (III) (d3
).
3.1 Общая характеристика комплексных соединений хрома (III)
3.2 Соль Рейнеке
3.2.1 Общие сведения
3.2.2 Применение
3.3 Многоядерные комплексы хрома (III)
3.4 Электронное строение комплексов хрома (III)
3.5 Фосфоресцирующие комплексы
3.6 Получение комплексных соединений хрома (III)
§4. Высшие состояния окисления хрома
4.1 Соединения хрома (IV) (d2
)
4.2 Соединения хрома (V) (d1
)
4.3 Соединения хрома (VI) (d0
)
§5. Практическая часть
5.1 Реактивы, используемые в работе
5.2 Синтез соли Рейнеке
5.3 Данные рентгеноструктурного анализа
5.4 Изучение свойств соли Рейнеке
Выводы
Список литературы
Все возрастающее значение комплексных соединений в различных областях теоретического и практического применения диктует настоятельную необходимость их глубокого и всестороннего изучения.
Подразделение всех химических соединений на так называемые простые (атомные) и комплексные (молекулярные), наметилось после создания учения о валентности и внедрения в химию структурных представлений А.М. Бутлерова. Основоположником учения о комплексных соединениях является А. Вернер, он разделил все вещества на два типа: соединения первого порядка (простые соединения) и соединения высшего порядка (продукты взаимного сочетания соединений первого порядка), к ним он относил комплексные соединения. Другие крупные специалисты в данной области (Л.А. Чугаев, П. Прейффер и др.) определяют комплексные соединения как продукты сочетания молекул соединений первого порядка. Все же это определение отнюдь не является безупречным.
Понятие комплекса в растворе до сих пор не получило точного определения. Сегодня мы знаем, что комплексная частица может диссоциировать, и по константе диссоциации можно судить об ее устойчивости. Правда, комплексы в растворе не характеризуются высокой степенью диссоциации, как сильные электролиты, и далеко не всегда комплексная частица бывает соединением высшего порядка. И, наконец, известно, что не существует никаких принципиальных различий между "обычными" и "координационными" связями.
Реклама

После всего сказанного очевидно, что безупречного определения понятия комплексное соединение существовать не может. Но так как все же желательно дать хотя бы приближенное определение понятия, то можно остановиться на следующем.
Комплексные соединения - это частицы, которые образуются в результате присоединения к данному иону (или атому), называемому комплексообразователем (центральным атомом или металлоцентром), нейтральных молекул или других ионов, называемых лигандами.
Явление комплексообразования лежит в основе целого ряда биологических процессов, каталитических реакций, электролитического осаждения. Особенно велико значение комплексных соединений в растворах, поскольку в широком смысле можно считать, что химия растворов - это химия комплексных соединений. Д.И. Менделеев указывал на роль химического взаимодействия между компонентами в растворе: "Все формы взаимодействия в растворе, а следовательно, и равновесие в нем, связаны прежде всего с химической природой как растворителя, так и растворенных в нем веществ".
В связи с изложенным, представляется интересным изучение комплексных соединений.
Следуя общим тенденциям заполнения d-подуровня при движении по периоду для элементов VI группы нужно было бы предположить конфигурацию валентных электронов в основном состоянии (n-1) d4
ns2
. В атоме хрома выигрыш энергии, вызванный стабилизацией наполовину заполненного подуровня и полным отсутствием дестабилизирующего вклада энергии спаривания, оказывается больше энергии, которую необходимо затратить на переход одного из s-электронов на d-подуровень. Это приводит к "перескоку" ("провалу") электрона, т.к известно, что электроны с параллельными спинами испытывают меньшее взаимное отталкивание, чем электроны с противоположными спинами, разность энергий у хрома достигает своего максимума - 3d5
4s1 (
3d4
4s2
). [1]
В различных соединениях хром проявляет степени окисления от - 4 до +6.
| Степень окисления
|
Электронная конфигурация
|
Координационное число
|
Геометрия
|
Примеры соединений
|
| -4
|
d10
|
4
|
Тетраэдр
|
Na4
[Cr (CO) 4
]
|
| -2
|
d8
|
5
|
Тригональная
бипирамида
|
Na2
[Cr (CO) 5
]
Реклама

|
| -1
|
d7
|
6
|
Октаэдр
|
Na2
[Cr2
(CO) 10
]
|
| 0
|
d6
|
6
|
Октаэдр
|
Cr (CO) 6
, [Cr (CO) 5
I] -
|
| +1
|
d5
|
6
|
Октаэдр
|
K3
[Cr (CN) 5
NO], [Cr ({C5
H4
N}2
) 3
] +
или [Cr (dipy) 3
] +
|
| +2
|
d4
|
4
|
Плоский
квадрат
Октаэдр
|
Cr (CH3
COCHCOCH3
) 2
или Cr (acac
) [2]
2
K4
[Cr (CN) 6
], CrF2
|
| +3
|
d3
|
4
6
|
Тетраэдр
Октаэдр
|
[CrCl4
] -
[Cr (NH3
) 6
] 3+
|
| +4
|
d2
|
6
|
Октаэдр
|
K2
[CrF6
]
|
| +5
|
d1
|
6
|
Октаэдр
|
K2
[CrOCl5
]
|
| +6
|
d0
|
4
|
Тетраэдр
Октаэдр
|
CrO4
2-
CrF6
|
Известно много соединений хрома (II), все они сильные и быстродействующие восстановители. Водные растворы, содержащие ион Cr2+
, имеют небесно-голубой цвет. Этот ион очень легко окисляется Cr3+
+ ē → Cr2+
(Е°= - 0,41 В). Легко окисляются кислородом воздуха: 4 [Cr (H2
O) 6
] 2+
+O2
+4H+
=4 [Cr (H2
O) 6
] 3+
+2H2
O. Будет восстанавливать воду с выделением водорода, причем скорость разложения зависит от кислотности раствора. Высокоспиновые[3]
октаэдрические комплексы характеризуются большим магнитным моментом (4,7 - 4,9 μВ
[4]
). Это свидетельствует о тетрагональном искажении, которое является следствием эффекта Яна-Теллера[5]
и вызвано наличием одного электрона на eg
-орбитали, что приводит к геометрическому искажению и понижению симметрии d4
-комплексов: два аксиальных лиганда находятся на большем расстоянии от атома Cr (II), чем четыре экваториальных. Такая структура обусловливает склонность высокоспиновых комплексов к гидролизу. Помимо аквакомплексов ([Cr (H2
O) 4
(OH) 2
; [Cr (H2
O) 6
] 2+
) к высокоспиновым относятся ацетилацетонат (Cr (acac) 2
), а также аммиакаты ([Cr (NH3
) 5
Cl] Cl, [Cr (NH3
) 6
] Cl2
).
Низкоспиновые комплексы хром (II) образует с лигандами сильного поля, например с цианидом K4
[Cr (CN) 6
]. Эти комплексы интенсивно окрашены, их магнитный момент составляет 2,74-3,40 μВ
, а связь Cr-L характеризуется существенной долей π-связывания.
Так же для хрома (II) известны и кластерные соединения, простейшее из них - ацетат хрома (II) Cr2
(CH3
COO) 4
(H2
O) 2
, выпадающий красный осадок при действии на CrII
ацетатов, либо уксусной кислоты:
2CrCl2
+4NaCH3
COO+2H2
O= [Cr2
(H2
O) 2
(CH3
COO) 4
] ↓+4NaCl
На наличие связи Cr-Cr указывает диамагнетизм этого соединения: в нем нет неспаренных электронов. Поскольку каждый ион Cr2+
содержит четыре неспаренных электрона, связь имеет кратность 4. Именно поэтому расстояние Cr-Cr в ацетате (0,230 нм) оказывается короче, чем в металлическом хроме (0,256 нм). Атомы хрома соединены друг с другом также четырьмя бидентатными мостиковыми ацетатными группами. Координационную сферу каждого атома хрома дополняет молекула воды.


По методу валентных связей (ВС) четырехкратная связь Cr-Cr образуется в результате объединения неспаренных 3
d
- электронов двух ионов хрома в четыре электронные пары, принадлежащие совместно обоим атомам. Вакантные орбитали ионов Cr2+
выступают в качестве акцепторов для образования пяти ковалентных связей с ацетатными группами и молекулами воды. В образующейся частице все электроны спарены, т.е. она является диамагнитной (см. рис 1 (б))
. При нагревании в вакууме до 120°С ацетат хрома теряет воду, превращаясь в коричневый порошок, в котором кластеры Cr2
(CH3
COO) 4
связаны между собой дополнительным взаимодействием атомов хрома с атомами кислорода соседних ацетатных групп (см. рис 1 (в))
. Образование связи Cr-Cr по методу молекулярных орбиталей (МО) представлено на рис.2
. Для простоты рассмотрено взаимодействие двух фрагментов молекулы состава Cr (CH3
COO) 2
, каждый из которых имеет форму плоского квадрата, что видно из расщепления исходных d-
орбиталей хрома. Из пяти d
-орбиталей каждого фрагмента четыре идут на образование связи Cr-Cr, а одна - на образование σ-связи с молекулой воды. Из восьми d
-орбиталей, предоставленных в общее пользование двумя атомами хрома, образуются восемь молекулярных орбиталей (МО) - две из них σ-типа, четыре - π-типа и две δ-типа. Электронами заполнены четыре связывающие МО, что обусловливает образование четырехкратной связи Cr-Cr.
Благодаря кластерному строению ацетат хрома (II) гораздо более устойчив к окислению, чем простые соли хрома (II). В качестве исходного вещества его используют для синтеза других соединений CrII
.
Степень окисления +3 наиболее характерна для хрома. Для этого состояния характерно большое число кинетически устойчивых комплексов. Именно из-за такой кинетической инертности удалось выделить в твердом состоянии большое число комплексных соединений хрома, которые в растворе остаются неизменными в течение длительного времени.
Наличие трех неспаренных электронов обусловливает парамагнетизм соединений Cr (III), большинство из которых интенсивно окрашены. [6]
В литературе описано множество комплексов трехвалентного хрома. Во всех без исключения комплексах CrIII
имеет координационное число (КЧ) шесть.
Ярко выраженная способность трехвалентного хрома к образованию комплексных соединений особенно отчетливо проявляется в его различных комплексных продуктов присоединения аммиака.
В соответствии со своим КЧ 6 ион хрома (III) может координационно связать шесть молекул аммиака. При этом образуется комплексный ион [Cr (NH3
) 6
] 3+
, заряд которого совпадает с зарядом хрома, фигурирующего в качестве центрального атома, поскольку молекулы аммиака не заряжены.
Вследствие прочного связывания молекул аммиака при растворении в воде соединений, содержащих комплекс [Cr (NH3
) 6
] 3+
, не происходит моментального распада комплекса - он существует в растворе как ион и лишь постепенно происходит замещение аммиака молекулами воды.
[Cr (NH3
) 6
] 3+
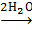 [Cr (H2
O) 2
(NH3
) 4
] 3+ [Cr (H2
O) 2
(NH3
) 4
] 3+
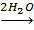 [Cr (H2
O) 4
(NH3
) 2
] 3+ [Cr (H2
O) 4
(NH3
) 2
] 3+
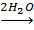 [Cr (H2
O) 6
] 3+ [Cr (H2
O) 6
] 3+
Исследования поведения гексаакваиона хрома (III) в растворах соляной кислоты во времени, позволили установить, что равновесие в системе Cr3+
-H2
O-Cl -
[7]
устанавливается примерно 3,5 месяца.
Комплексообразование в этих растворах протекает последовательно по ступеням во времени:
[Cr (H2
O) 6
] 3+
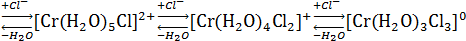
Спектры поглощения растворов показывают, что даже в самом концентрированном относительно соляной кислоты растворе (12 н
) комплексообразование заканчивается на третьей ступени.
Таким образом, реакция внедрения ионов хлора в координационную сферу комплекса протекает крайне медленно, инертными являются не только гексааквокомплекс, но и смешанные аквахлориды хрома (III) по отношению к реакции обмена молекул воды на хлорид-ионы, происходящего в процессе образования комплексов; инертность смешанных комплексов уменьшается с увеличением числа ионов хлора в координационной сфере комплекса.
Процессы акватации транс- и цис- дихлородиэтилендиамминхромихлорида:
[Cr (en) 2
Cl2
] +
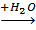 [Cr (en) 2
Cl (H2
O)] 2+ [Cr (en) 2
Cl (H2
O)] 2+
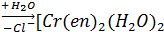 ] 3+
+Cl- ] 3+
+Cl-
Гидроксил может образоваться из молекулы воды, содержащейся во внутренней координационной сфере, в результате отщепления протона. Вероятность образования гидроксила во внутренней координационной сфере растет при повышении рН и уменьшается при понижении рН. Поэтому прибавление кислоты понижает вероятность образования гидроксила во внутренней координационной сфере и, следовательно замедляет процессы акватации именно тех ацидокомплексов, во внутренней координационной сфере которых содержится молекула воды. Если же во внутренней координационной сфере нет молекулы воды, то такого рода влияние величины рН исключается.
Достаточно широко исследовано влияние ионов Cr2+
на процессы акватации ацидохроми-комплексов. Оказалось, что ионы Cr2+
катализируют процессы акватации изученных ацидохроми-комплексов.
Например, каталитический процесс акватации транс-дихлородиаминхроми-хлорида протекает следующим образом. Вероятно, катализатор образует промежуточный комплекс, в котором связь между атомами Cr2+
и Cr3+
осуществляется через ион хлора:
Транс - [CrIII
(en) 2
Cl2
] +
+ [CrII
(H2
O) 6
] 2+
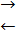 [Cl (en) 2
CrIII
, I
I
- Cl - CrII
, I
II
(H2
O) 5
] 3+
. [Cl (en) 2
CrIII
, I
I
- Cl - CrII
, I
II
(H2
O) 5
] 3+
.
После передачи электрона может произойти распад комплекса. Наиболее вероятен распад по связи CrII
- Cl:
[Cl (en) 2
CrII
-Cl-CrIII
(H2
O) 5
] 3+
→ [Cl (en) 2
CrII
(H2
O)] +
+ [ClCrIII
(H2
O) 5
] 2+
,
освободившееся координационное место у CrII
заняла молекула воды.
Замена во внутренней сфере одних лигандов другими часто сопровождается отчетливым изменением окраски комплекса.
Ион [Cr (H2
O) 6
] 3+
поглощает свет в красной, голубой частях видимого спектра, а также в ближайшей ультрафиолетовой области, поэтому имеет фиолетовую окраску, вызванную наложением двух дополнительных цветов.
Известно много комплексных анионов состава [CrX6
] 3-
, где Х - монодентатный лиганд типа F-
, Cl-
, NCS-
, CN-
, или часть полидентатного аниона типа оксалата (C2
O4
2-
). Существует, разумеется, множество смешанных ацидоамино - и и ацидоакво - комплексов.
Проведем некоторую их классификацию[8]
:
1) [Cr (NH3
) 6
] 3+
, [Cr (NH3
) 5
(H2
O)] 3+
, [Cr (NH3
) 4
(H2
O) 2
] 3+
, [Cr (NH3
) 3
(H2
O) 3
] 3+
, [Cr (NH3
) 2
(H2
O) 4
] 3+
, [Cr (H2
O) 6
] 3+
2) [Cr (NH3
) 5
Cl] 2+
, [Cr (NH3
) 4
(H2
O) Cl] 2+
, [Cr (NH3
) 3
(H2
O) 2
Cl] 2+
, [Cr (NH3
) 2
(H2
O) 3
Cl] 2+
, [Cr (H2
O) 5
Cl] 2+
3) [Cr (NH3
) 4
(SCN) 2
] +
, [Cr (NH3
) 3
(H2
O) (SCN) 2
] +
, [Cr (NH3
) 2
(H2
O) 2
(SCN) 2
] +
, [Cr (H2
O) 4
(SCN) 2
] +
4) [Cr (NH3
) 3
(OH) 3
], [Cr (NH3
) 2
(H2
O) (OH) 3
], [Cr (H2
O) 3
(OH) 3
]
5) [Cr (NH3
) 2
(SCN) 4
] -
, [Cr (H2
O) 2
(SCN) 4
] -
6) [Cr (H2
O) (SCN) 5
] 2-
7) [CrCl6
] 3-
Важно заметить, что во всех рядах отсутствуют моноамминные соединения, и отсутствуют только они, указывает на существование какой-то закономерности, проявляющейся в неспособности к существованию моноамминных соединений.

Большой интерес представляют соединения типа: [CrAm4
R2
] +
[CrAm2
R4
] -
. Из соединений первого типа известны главным образом соединения этилендиамина. Они интересны ввиду наблюдающегося у них явления изомерии (стереоизомерии) [9]
. При октаэдрическом расположении комплексно связанных групп А и В вокруг центрального атома комплекс с общей формулой [ZA4
B2
] может существовать в двух формах (см. рис.3
)
В случае этилендиаминных соединений различие заключается еще и в том, что в противоположность транс-соединению цис-соединение представляет собой смесь двух оптически активных форм, поскольку, как видно из рис.4, в этом случае могут существовать две цис-формы, относящиеся друг к другу, как предмет к его зеркальному отражению.

Переходя к рассмотрению второго типа соединений, нужно подчеркнуть, что поскольку в состав комплекса входят четыре отрицательных эквивалента, он представляет собой анион и образует соли с металлами. Хорошо известно соединение, принадлежащее к данному классу, так называемая соль Рейнеке
NH4
[
Cr (
NCS) 4
(
NH3
) 2
] ×
H2
O,
анион которой часто применяют для осаждения больших катионов, как органических, так и неорганических, соль Рейнеке удобно использовать для количественного определения меди, так как можно легко провести осаждение последней в форме Cu [Cr (NCS) 4
(NH3
) 2
], не удаляя из раствора другие металлы (кроме Ag, Hg, Tl). Реакция с солью Рейнеке может служить также и как очень чувствительная качественная проба на медь.
Из тетрацидодиаминовых комплексов хрома (III) наиболее давно известным является соль эмпирического состава Cr (NCS) 3
×NH4
SCN×2NH3
×2H2
O. Координационная формула этого соединения представляется в виде NH4
[
Cr (
NCS) 4
(
NH3
) 2
] ×
H2
O.
Соль эта, следовательно, может быть рационально названа тетрароданодиамминхромиат аммония.
Однако как эту соль, так и другие, образующиеся из нее путем замены аммония на другие катионы, часто называют просто солями Рейнеке. Свободную кислоту Н [Cr (NCS) 4
(NH3
) 2
], которая может быть получена при взаимодействии Ba [Cr (NCS) 4
(NH3
) 2
] 2
с разбавленной серной кислотой, также часто называют кислотой Рейнеке. В литературе даже встречается иногда и термин "рейнекат" ("рейнекеат"), применяемый для обозначения солей Рейнеке.
Пространственное строение данной соли было выяснено с помощью рентгеноструктурного анализа.
Оказалось, что молекулы аммиака расположены в транс-положении друг к другу[10]
. В этой же работе было также показано, что в анионе соли Рейнеке роданогруппа связана с хромом через атом азота. [11]
Получены также производные иона тетрароданодиамминхрома (III), содержащие вместо одной роданогруппы остаток ОН-
, т.е. соли типа М [Cr (NH3
) 2
(NCS) 3
OH]. Также получены диоксалатодиамминхромиаты типа Me [CrPy2
(NCS) 4
] и другие аналогичные соли.
Как уже отмечалось, соль Рейнеке довольно широко применяется в аналитической химии, для определения ионов меди, серебра, ртути, кадмия и висмута образуя пучки тонких игл. На серебро, как правило, используют соль Рейнеке в сочетании с тиомочевинной, образуется осадок состава: [Ag (SCN2
H4
) 2
] × [Cr (NH3
) 2
(SCN) 4
], предел обнаружения 0,4 мкг, предел разбавления 1: 2500 (г/г).
Также она применяется и в органическом анализе, например для определения никотина[12]
, атропина[13]
, морфина[14]
:



Сведения о соединениях содержащих анион [Cr (NH3
) 2
(NCS) 4
] -
достаточно ограничены, не смотря на то, что тетраизотиоцианатодиамминхроматные комплексы могут обладать рядом специфических свойств.
Многоядерные амминные комплексы хрома (III) содержат несколько центральных атомов хрома. В большинстве случаев они связаны между собой ОН-группами.
Важнейшими представителями двухъядерных комплексов являются так называемые родо- и эритрохромовые соли и соли ди-μ-гидроксодихрома (III).
Магнитные моменты биядерных комплексов зависят от температуры, а их значения несколько ниже, чем обычные для октаэдрического CrIII
, что указывает на слабое антиферромагнитное взаимодействие через изогнутые мостики Cr-O (H) - Cr. Более сильное антиферромагнитное взаимодействие обнаружено у [ (NH3
) 5
Cr (μ-OH) Cr (NH3
) 5
] X5
:
[ (NH3
) 5
Cr (μ-OH) Cr (NH3
) 5
] 5+
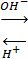 [ (NH3
) 5
Cr-O-Cr (NH3
) 5
] 4+ [ (NH3
) 5
Cr-O-Cr (NH3
) 5
] 4+
красный синий
Линейный мостик Cr-O-Cr, очевидно, допускает спаривание d-
электронов двух атомов металла посредством dπ
-
pπ
- связей намного легче, чем изогнутый мостик Cr-O (H) - Cr.
Гидролизованные полиядерные комплексы CrIII
имеют большое значение в промышленном получении красителей и дубильных веществ. В первом случае они служат протравкой для красителя. В производстве кожи необходимо обрабатывать шкуры животных для предотвращения гниения, чтобы они были мягкими после высушивания. После вымачивания в серной кислоте шкуры насыщают раствором, содержащим CrIII
. Раствор постепенно делают щелочным, при этом образуются полиядерные комплексы и связывают мостиками соседние цепочки белков, в основном координируясь к их карбоксильным группам.
Магнитные свойства октаэдрических комплексов хрома (III) можно объяснить довольно просто. Во всех таких комплексах должно быть три неспаренных электрона независимо от силы поля лигандов, что подтверждается на опыте для всех известных одноядерных соединений. Далее, теория предсказывает, что значения магнитных моментов должны приближаться или быть несколько ниже чисто спинового значения. Это также подтверждается данными эксперимента.
Спектры комплексных соединений CrIII
также легко поддаются теоретической интерпретации. Здесь возможны три перехода, разрешенные по спину, которые и наблюдаются у большинства комплексов.
Интересными должны быть магнитные свойства комплексных ацетатов хрома с 2,2-dipy и 1,10-phen. Поскольку карбоксилатам хрома (III) свойственно образование кластеров типа [Cr3
O (Ac) 6
H2
O] +
, здесь наблюдается понижение магнитных моментов по сравнению с только спиновыми.
От всех рассмотренных выше комплексов отличается производное нитрата фенантролинового комплекса Cr (phen) 2
(NO3
) I2
. Этой формуле отвечает пятерная координация центрального иона, и именно этим, очевидно, можно объяснить спектральные особенности, проявляющиеся в отсутсвии каких-либо признаков расщепления, характерного для искаженных октаэдрических полей. По-видимому, каждый атом хрома в катионе окружен двумя молекулами бидентатного лиганда, на внешней сфере - ионы йода, и взаимодействие спинов происходит через NO3
-
.
Конечно, аномалии магнитных свойств некоторых комплексов хрома обусловлены не только антиферромагнетизмом, но и другими факторами: спин-орбитальное взаимодействие, тетрагональное искажение и др.
Первоначальное возбуждение комплекса обычно приводит к заселению состояния посредством перехода, разрешенного по спину, поэтому механизм фосфоресценции включает безызлучательное превращение начального возбужденного состояния в другое возбужденное состояние, отличающееся по мультиплетности[16]
. Это второе состояние действует как накопитель энергии, потому что переход в основное состояние запрещен по спину. Излучательный переход в основное состояние происходит медленно, так что фосфоресценция комплексов хрома, как и всех d
-металлов может длиться в течение нескольких микросекунд или даже дольше. Известный пример фосфоресценции представляет собой рубин, в котором ионы Cr3+
замещают небольшую часть ионов Al3+
в оксиде алюминия. Каждый ион Cr3+
окружен октаэдрически шестью ионами O2-
, и исходным возбуждением является разрешенный по спину процесс:
t2g
2
eg
1
← t2g
3
: 4
T2g
← 4
A2g
и 4
T1g
← 4
A2g
.
Поглощение наблюдается в зеленой и фиолетовой областях спектра и отвечает за красный цвет драгоценного камня (см. рис.5).

Интеркомбинационная конверсия на терм 2
Eg
t2
g
3
- конфигурации происходит за несколько пикосекунд или быстрее. Это красное излучение добавляется к красному цвету, возникающего за счет поглощения зеленого и фиолетового цвета из белого света, и придает блеск драгоценному камню.
Подобная 2
Е → 4
А фосфоресценция может наблюдаться для многих комплексов хрома (III) в растворе. Испускание происходит всегда в красной области, и значения длин волн близки к длине волны излучения рубина. Терм 2
Е принадлежит t2
g
3
- конфигурации, которая является основным состоянием, и сила поля лигандов не имеет значение.
Соединения хрома (III) инертны, т.е. реакции замещения в их растворах протекают с низкой скоростью. Инертные комплексы не удается синтезировать по реакциям обмена в водных растворах. Для получения инертных комплексов либо используют очень большой избыток лиганда, что, например, достигается проведением реакции аминирования непосредственно в жидком аммиаке:
CrCl3
+6NH3 (
ж
)
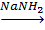 [Cr (NH3
) 6
] Cl3 [Cr (NH3
) 6
] Cl3
либо проводят окислительно-восстановительную реакцию:
4 [Cr (NH3
) 6
] Cl2
+2NH4
Cl+O2
=2 [ (NH3
) 5
Cr (OH) Cr (NH3
) 5
] Cl5
↓+6NH3
Хром в степени окисления +4 имеет электронную конфигурацию d2
.
Все известные соединения хрома в этой степени окисления высокоспиновые, диамагнитные, содержащие связь металл-металл.
Соединения хрома (IV) часто выступают в роли интермедиатов при восстановлении хроматов (VI) или окисления солей хрома (III). Как правило, они обладают низкой устойчивостью и не имеют практического значения.
Известны комплексные фториды состава МCrF5
и М2
CrF6
. Они имеют магнитный момент порядка 3,1 μВ
и построены из октаэдров [CrF6
] 2-
.
Степень окисления +5 для хрома неустойчива - в настоящее время известно около трех десятков соединений, лишь половина из которых способна существовать в водном растворе. Являясь интермедиатами, соединения хрома (V) могут быть зафиксированы методом электронного парамагнитного резонанса. Введение в раствор α-гидроксикарбоновых кислот позволяет стабилизировать ситуацию благодаря возникновению устойчивых хелатов (см. Рис.6).

Это используют для изучения механизмов реакций восстановления хроматов в водных растворах. Например, с помощью хелатных соединений было доказано, что реакция хромата (VI) с иодид-ионами протекает как последовательность трех одноэлектронных переносов:
Cr (VI) → Cr (V) → Cr (IV) → Cr (III).
Единственным доказательством в пользу существования соединений CrV
в растворе было получено при попытке растворить хроматы (VI) в 65% -ном олеуме. Данные о количестве выделившегося О2
и о магнитных свойствах образующегося голубого раствора согласуются с представлением об образовании CrV
.
Галогенидные комплексы типа [МX6+
x
] x -
неизвестны, поэтому координационная химия хрома в этой степени окисления относится в основном к оксо - и пероксокомплексам.
Соединения хрома (VI) очень широко известны, в качестве сильных окислителей они активно используются в технике и лабораторной практике.
Синтез соли Рейнеке
NH4
[
Cr (
NCS) 4
(
NH3
) 2
] ×
H2
O.
В настоящей работе была синтезирована соль тетрароданодиамминхромат (III) аммония, соль Рейнеке.
Для проведения синтеза соли использовали бихромат аммония, роданид аммония квалификации "х. ч."
Растереть в ступке 8,5 г Бихромата аммония и 10 г Роданида аммония в тонкую смесь. Оставшиеся 40 г роданида аммония нагреть в фарфоровой чашке до 160ºС (при этом наблюдается его плавление) и, не допуская нагрева выше 160ºС (иначе происходит разложение соли), добавить смесь бихромата и роданида аммония маленькими порциями (по 0,6-0,9 г), постоянно помешивая расплав термометром. Температуру поддерживать постоянно160ºС. После добавления очередной порции смеси наблюдается выделение газа (аммиак NH3
-ТЯГА!) и разогрев расплава. Идет реакция:
(NH4
) 2
Cr2
O7
+8
NH4
CNS=2
NH4
[
Cr (
CNS) 4
(
NH3
) 2
] ×
H2
O +2
NH3
↑+
N2
↑+5
H2
O
.
Дальнейшее нагревание смеси необязательно, т.к выделяющейся энергии достаточно для поддержания температуры 160°С. После добавления всей смеси остудить расплав, постоянно помешивая термометром. После застывания смесь ещё теплой растереть в порошок и залить 37мл ледяной воды. Через 15 мин отфильтровать раствор и остаток без промывания растворить в 125 мл воды, нагретой до 60ºС. [17]
Не допускать нагревания раствора выше 65°С, т.к при этом соль Рейнеке разлагается, что сопровождается посинением раствора и выделением газа (синильная кислота НСN - ТЯГА!!!).
NH4
[
Cr (
NH3
) 2
(
NCS) 4
] ×
H2
O
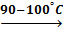 HCN↑+
S↓+3
NH3
↑+
Cr (
NCS) 3
+
H2
O
HCN↑+
S↓+3
NH3
↑+
Cr (
NCS) 3
+
H2
O
Отфильтровать горячий раствор и фильтрат оставить на ночь в холодильнике. Выпавшие кристаллы отфильтровать и высушить. Соль Рейнеке легко разлагается под действием ультрафиолетового и видимого света, поэтому на протяжении всех стадий отчистки соли Рейнеке желательно препятствовать попаданию прямого солнечного света на растворы и твёрдые вещества, содержащие её, посредством оборачивания ёмкостей, содержащих их, алюминиевой фольгой. Хранить соль в бюксе, обёрнутом фольгой.
Рентгенофазовый анализ проводился на дифрактометре ДРОН-1 с использованием CuKα
-
излучения. Данные анализа обработаны с помощью Powder Diffraction File, PDF - картотеки (карточка №38-683
).
Результаты обработаны и занесены в таблицу:
| Межплоскостные расстояния, Ǻ
|
| Данные картотеки
|
Экспериментальные данные
|
| 4,729
|
4,657
|
| 3,869
|
3,889
|
| 3,5709
|
3,5797
|
| 3,349
|
3,366
|
| 3,159
|
3,155
|
| 2,9875
|
2,9895
|
| 2,620
|
2,614
|
| 2,438
|
2,448
|
| 2,369
|
2,361
|
| 2,224
|
2,226
|
| 2,0609
|
2,0699
|
| 2,019
|
2,025
|
| 1,9270
|
1,9278
|
| 1,888
|
1,889
|
| 1,670
|
1,670
|
Данные рентгенофазового анализа согласуются с данными картотеки, следовательно, полученное в ходе синтеза вещество является рейнекатом аммония (дифрактограмма прилагается).
Соль Рейнеке-рубиново-красные блестящие кристаллы (красный кристаллический порошок), чувствительные к действию света. Молекулярный вес: 354,42
г/моль
. При 70-90 °С теряет кристаллизационную воду, при дальнейшем нагревании разлагается. Слабо растворима в холодной воде, но хорошо в горячей. Растворима в этаноле, 50% -ном ацетоне и эфире, образуя растворы красного цвета. Нерастворима в бензоле. В водном растворе соль постепенно разлагается, раствор синеет и выделяет цианистый водород. При комнатной температуре раствор устойчив до двух недель, при нагревании выше 65 °С разложение происходит очень быстро; разлагается также в кипящем этаноле.
Риск при использовании: вредна при вдыхании, при попадании на кожные покровы (раздражает кожные покровы, является гипераллергеном), при проглатывании, раздражает слизистые оболочки.
При действии на раствор соли Рейнеке концентрированной соляной кислотой, происходит замещение NH4
+
на H+
образуется кислота Рейнеке, красивые блестящие листочки (в эфире), хорошо растворимые в воде, спирте, ацетоне. При длительном нагревании кристаллизационная вода уходит, получается безводная кислота, приобретая более темную окраску.
NH4
[
Cr (
NH3
) 2
(
NCS) 4
] ×
H2
O+
HCl (конц)
→
H [
Cr (
NH3
) 2
(
NCS) 4
] ×2
H2
O+
NH4
Cl
1. Рассмотрено разнообразие комплексов хрома (II) и (III).
2. Проанализировано комплексообразование хлоридов хрома (III) во времени в растворах различной концентрации соляной кислоты. В результате установлено, что комплексообразование протекает по ступеням, причем формы существования комплексов зависят как от концентрации растворов соляной кислоты, так и от времени протекания реакции.
3. Рассмотрена акватация комплексных хлоридов хрома (III) в водном растворе. Установлено, что комплексные хлориды, содержащие более трех ионов хлора в координационной сфере комплекса, являются лабильными, в то время как остальные - инертны. Инертность комплексов возрастает по мере увеличения числа молекул воды в координационной сфере хрома.
4. Подробно рассмотрена и синтезирована одна из солей трехвалентного хрома - соль Рейнеке. Подробно рассмотрено применение ее как в неорганическом, так и органическом анализе.
5. Данные рентгенофазового анализа показали, что синтезированное мной вещество является тетратиоционатодиамминохроматом (III) аммония.
6. В результате синтеза получено 3,7 г соли Рейнеке, это составляет 20% от теоретически возможного.
1. Ф. Коттон, Дж. Уилкинсон "Современная неорганическая химия", Москва: "Мир", 1969, 3 часть (стр.228, 235, 242).
2. Л.С. Лилич, М.К. Хрипун "Растворы как химические системы", Санкт-Петербург, издательство СПбГУ, 1994 (стр.105-110, 116-119).
3. А. А. Гринберг "Введение в химию комплексных соединений", изд. "Химия", Ленинградское отделение, 1971 (стр.46, 55, 97, 162, 187, 503, 571).
4. "Неорганическая химия", под ред. академика Третьякова, Москва "Академия", 2007, том 3, книга 1 (стр.38-42, 186, 188, 189, 192, 195, 199, 202).
5. Б.В. Некрасов "Основы общей химии", Санкт-Петербург, 2003 (стр.521, 380, 367, 371, 378, 377, 511).
6. А. Уэлс "Структурная неорганическая химия", Москва "МИР", 1988, том 3 (стр.347).
7. Ф. Коттон, Дж. Уилкинсон "Основы неорганической химии", Москва "МИР", 1979 (стр.458, 460, 464).
8. Г. Блументаль, З. Энгельс "Анорганикум", Москва "МИР", 1984, том 1 (стр.618, 622).
9. Н.А. Костромина, В.Н. Кумок, Н.А. Скорик "Химия координационных соединений", Москва "Высшая школа", 1990 (стр.12, 15, 102, 384-386, 417).
10. Д. Шрайвер, П. Эткинс "Неорганическая химия", том 2, Моксва "МИР", 2004 (стр.23, 32).
11. Г. Реми "Курс неорганической химии", том II, Москва "Издательство иностранной литературы", 1966 (стр.137, 154, 157, 148, 170).
12. Г. Брауэр "Руководство по неорганическому синтезу", том 5, Москва "МИР", 1985 (стр.1619).
13.Ю. Ю. Лурье "Справочник по аналитической химии", Москва "Химия", 1971 (стр. 208, 210).
14. М.Х. Карапетьянц, С.И. Дракин "Общая и неорганическая химия", Москва "Химия", 1981 (стр.119, 125, 377, 529, 542).
15. А. Салли, Э. Брэндз "ХРОМ", Москва "Металлургия", 1971.
16. А.К. Лаврухина, Л.В. Юкина "Аналитическая химия ХОМА", Москва "Наука", 1979 (стр.12, 23, 63, 109, 151).
17. Ф. Басоло, Р. Джонсон "Химия координационных соединений", Москва "МИР", 1966 (стр.27-28).
18. Дж. Хьюи "Неорганическая химия", Москва "Химия", 1987 (стр.389, 390, 508).
19. А.В. Суворов, А.Б. Никольский "Общая химия", Санкт-Петербург "ХИМИЗДАТ", 2000 (стр.535, 545).
20. Потапова "Изучение комплексообразования в системе CrIII
-H2
O-Cl -
по электронным спектрам", автореферат, каф. неорганической химии химического факультета ЛГУ им. Жданова (СПбГУ), 1969.
21. Братушко "Кинетика акватации некоторых цианохроми-комплексов", автореферат, Киев, 1966.
[1]
 Cr-хром, VI группа ПС, число стабильных изотопов:4, электронная конфигурация: [
Ar]3
d5
4
s1
, I1
=653,20 кДж/моль Cr-хром, VI группа ПС, число стабильных изотопов:4, электронная конфигурация: [
Ar]3
d5
4
s1
, I1
=653,20 кДж/моль
[2]
acac
– анион ацетилацетона, «ацетилацетонато»
[3]
,6
Схема образования высокоспиновых и низкоспиновых комплексов:

[4]
μВ
– магнетон Бора, единица элементарного магнитного момента («кванта» магнитного момента электрона); μВ
= 5,79 × 10-5
эВ/Тл
[5]
Эффект (теорема) Яна-Теллера: «Любая нелинейная молекула в вырожденном электронном состоянии неустойчива и самопроизвольно претерпевает искажение, понижающее ее симметрию и приводящее к снятию вырождения». Эффект Яна-Теллера с наибольшей силой проявляется в комплексах с неравноценно заполненными eg
– орбиталями, т.е. с конфигурациями t2
g
3
eg
1
(соответсвует иону d4
), t2
g
6
eg
3
(d9
), t2
g
6
eg
1
(d7
), в остальных случаях эффект Яна-Теллера незначителен. Следует помнить, что ионы с конфигурациями d3
,
d5
(в слабом поле),
d3
,
d6
(в сильном поле) и
d8
,
d10
ни при каких условиях не являются ян-теллеровскими. Строго говоря, лишь конфигурации d3
и d6
(в сильном поле)
всегда обеспечивают правильную октаэдрическую геометрию. Эффект проявляется в неравноценности длин связей во многих комплексах, в немонотонном изменении ступенчатых констант устойчивости комплексов.
[6]
Окраска комплексов.
Окраска комплексов d-
элементов связана с переходами электронов с одной d-
орбитали на другую. В случае комплексов с большим числом электронов картина спектра усложняется: появляются дополнительные полосы. Это связано с тем, что возбужденное состояние может быть реализовано несколькими способами в зависимости от того, на каких двух d
-орбиталях находятся электроны. Чтобы описать электронные спектры более детально, необходимо ввести некоторые понятия. Любое расположение электронов на подуровне называют микросостоянием. Каждое микросостояние характеризуется собственными значениями спинового и углового моментов. Набор микросостояний с одинаковыми энергиями называют термом.
Окраску комплексов помимо d-
d
переходов с одной d-
орбитали на другую (с t2
g
-
на eg
-
в октаэдрических комплексах) обусловливают еще три фактора: переходы с орбиталей лиганда на орбитали металла, взаимодействие комплекса с растворителем и переходы внутри орбиталей лиганда.
[7]
Cr-H2
O-Cl – условное обозначение растворов, содержащих гидратированные ионы трехвалентного хрома и хлорид - ионы.
[8]
В качестве лигандов могут выступать NH3
,
 , ,
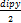 ,
CH3
NH2
,
py;
Hal-
,
NCS-
,
CN-
,
NO3
-
,
OH-
и т.д. ,
CH3
NH2
,
py;
Hal-
,
NCS-
,
CN-
,
NO3
-
,
OH-
и т.д.
[9]
Пространственная изомерия (стереоизомерия) возникает в результате различий в пространственной конфигурации молекул, имеющих одинаковое химическое строение. Этот тип изомеров подразделяют на энантиомерию (оптическую изомерию) и диастереомерию
.
Энантиомерами
(оптическими изомерами, зеркальными изомерами) являются пары оптических антиподов — веществ, характеризующихся противоположными по знаку и одинаковыми по величине вращениями плоскости поляризации света при идентичности всех других физических и химических свойств (за исключением реакций с др. оптически активными веществами и физических свойств в хиральной среде).
Диастереомерными
считают любые комбинации пространственных изомеров, не составляющие пару оптических антиподов.
Хиральность (молекулярная хиральность)
— в химии свойство молекулы быть несовместимой со своим зеркальным отражением любой комбинацией вращений и перемещений в трёхмерном пространстве.
[10]
Данные исследования опубликованы в работе Y. Takeushi, Y. Saito, Bull. Soc. Chim. Japan, 30, 319 (1957)
[11]
«Спектральным методом доказано, что роданид – ионы связаны с металлом – комплексообразователем посредством атома азота».
[12]
Никотин — алкалоид, содержащийся в растениях семейства паслёновых, преимущественно в табаке и, в меньших количествах, в томатах, картофеле, баклажанах, зелёных болгарских перцах.
[13]
Атропин — антихолинергическое (М — холиноблокатор) средство. Химически представляет собой тропиновый эфир d, l-троповой кислоты.
[14]
Морфин — один из главных алкалоидов опия, содержится в маке снотворном
[15]
Люминесценцией
называют свечение вещества (в частности, комплекса) после того, как оно подверглось электронному возбуждению, посредством поглощения излучения.
Флуоресценция
– это излучение при переходе из возбужденного состояния той же мультиплетности, что и основное состояние. Переход является разрешенным по спину и быстрым.
Фосфоресценция
– это излучение при переходе из возбужденного состояния, отличающегося по мультиплетности от основного состояния. Этот переход запрещен по спину и, следовательно, часто происходит медленно.
[16]
Мультиплетность — величина, характеризующая спин атома или молекулы.
[17]
Полученная смесь содержит дихромат аммония, соль Рейнеке и малорастворимую соль Морланда.
[18]
Рентгеноструктурный анализ (рентгенодифракционный анализ) — один из дифракционных методов исследования структуры вещества. В основе данного метода лежит явление дифракции рентгеновских лучей на трехмерной кристаллической решетке. Метод позволяет определять атомную структуру вещества, включающую в себя пространственную группу элементарной ячейки, ее размеры и форму, а также определить группу симметрии кристалла.
|