.
С.Ю. Елисеев
Токсичность продуктов горения и разложения полимеров (продукты полного и неполного горения, деполимеризация).
Зависимость пожарной опасности полимеров от их химического строения (наличие в структуре цианидных групп, атомов фтора, бензольных колец).
Основные методы получения огнестойких материалов на основе полимеров (пропитка неорганическими и органическими солями).
Важнейшие представители полимеров (древесина, полиэтилен, полипропилен, ПВХ, тефлон и т.д.).
Токсичность продуктов горения и разложения полимеров
Газообразные продукты (NH3, HCI, CI2, SO2, HCN), растворимые в воде, поглощаются носовой полостью.
Нерастворимые в воде (СО) продукты проникают в лёгкие, где происходит интенсивный газообмен с кровью.
[Гопкалит – смесь 60 % MnO2 и 40 % СuО (наполнитель патронов в противогазе для доокисления СО).
(CO + MnO2 ¾® CO2 + MnO )
(2MnO + O2 (в-х) ¾® 2MnO2 )]
Твёрдые продукты горения проникают также в дыхательные пути (бронхи, лёгкие).
 Токсичные продукты горения: СО, СО2, NH3, Br2, CI2, COCI2, HCN, H2S, SO2, HCI, HBr, HF, COF2, CH3CI, C2H5Br, CH2=CHCI, HCOH, CH3COH и т.д. Их токсичное действие увеличивается при понижении концентрации О2 в атмосфере. Токсичные продукты горения: СО, СО2, NH3, Br2, CI2, COCI2, HCN, H2S, SO2, HCI, HBr, HF, COF2, CH3CI, C2H5Br, CH2=CHCI, HCOH, CH3COH и т.д. Их токсичное действие увеличивается при понижении концентрации О2 в атмосфере.
Кислород- в воздухе 21 %, Ткип. = —185 оС; при 14 % - головокружение, головная боль, утомляемость; при 6 % - смерть в течении 6-8 минут.
СО2 (в воздухе 0,05-0,04 %). Наркотическое действие. При 9 % - через 4 часа падение давления и смерть.
СО – мало растворим в воде. Получается при неполном сгорании органики. СО легко проникает через пористые материалы. Связь гемоглобина с СО прочнее, чем с О2. Вдыхание 5 % СО в составе воздушной смеси в течении 5-10 минут - смертельно.
HCl - резкий запах, хорошо растворим в воде. Вызывает раздражение слизистых оболочек глаз, носа. Образуется при сгорании Cl – содержащих полимеров. Вызывает коррозию металлов, разрушение бетона, цемента.
HF - резкий запах, хорошо растворим в воде (плавиковая кислота). Образуется при сгорании фторсодержащих полимеров. Сильно раздражает верхние дыхательные пути человека. Вызывает коррозию металлов.
Н2S – запах тухлых яиц. Скапливается на дне ям колодцев и т.д. Горюч. Образуется при горении шерсти, резины и т. д. В небольших количествах вызывает жжение, слезотечение, светобоязнь. В больших концентрациях – судороги и смерть от остановки дыхания. Углеводороды усиливают его действия.
Реклама

SO2 – характерный острый запах. Раздражает слизистые, травмирует лёгкие. Сухой кашель, жжение и боль в горле, слезотечение, кровотечение.
HCN – бесцветная очень неподвижная жидкость. Ткип. =25,7 оС. Легче воздуха. Хорошо растворим в воде. В присутствии влаги и щелочей гидролизуется до NH3 и НСООН, частично полимеризуется. Горюч. Хорошо проникает, действует на нервную систему. Текстильные волокна и пористые материалы легко сорбируют пары (100г влажной соломы – до 126,3мг HCN).
NO – при сгорании азотсодержащих полимеров образуются. Действует на кровь.
NO2 - бурый газ. Раздражение слизистых. Оттёк лёгких.
NH3 – при сгорании азотсодержащих полимеров образуется аммиак. Обладает резким запахом. Хорошо растворим в воде. Горюч. Раздражающее действие.
COCI2 – запах прелых фруктов или сена. Тяжелее воздуха. Хорошо растворяется в органике, плохо в холодной воде. При нагревании может разлагаться: COCI2=CO+CI2. В воде быстро гидролизуется: COCI2+H2O = HCI+CO2.
Хлор – поражает лёгкие.
Обычно действует смесь продуктов горения на человека. Повышение температуры и влажности, понижение парциального давления О2 усиливают токсичное действие ядов.
Зависимость пожарной опасности полимеров от их химического строения
Упрочнение химических связей, соединяющих основные звенья углеродной цепи, под действием акрилонитрильных группы – СН2—СН- и
I
CN
атомов фтора приводит к повышению термической устойчивости полимеров. Так, в сополимере стирола и акрилонитрила под действием акрилонитрильной группы прочность связи С-С в основной цепи повышается с 247,8 кДж/моль (в полистироле) до 289,8 кДж/моль (в сополимере). Высокой термической стойкостью характеризуется политетрафторэтилен (-CF2-CF2-)n. В этом полимере прочность связи С-С составляет 361,2 кДж/моль, а прочность связи С-F- 453,6 кДж/моль. На прочность связи С-С повлияли атомы фтора.
Введение в основную цепь бензольных колец также повышает
  термостойкость полимеров. Полифенилен [— — —]n (хрупкий) термостойкость полимеров. Полифенилен [— — —]n (хрупкий)
выдерживает нагревание до 240 оС в течение 72 ч. 86 % массы сохраняется вплоть до температуры 817 оС. Это связано с большой термостойкостью самого бензольного ядра (энергия образования ароматического ядра 4368,0 кДж/моль).
При наличии в полимерах связей: С=О, О-Н, Р =О, S=O, C=N, Si-О, B=N, P=N, энергия которых велика, горючесть полимеров снижается.
Реклама

Кратные связи обуславливают жёсткость и высокую термическую стойкость [полиены (-CH=CH-)n- устойчивы до 800 оС, полиины (карбин (-СºС-)n - до 2300 оС].
Классификация реакций синтеза полимеров
Полимеризация – это процесс получения ВМС, при котором молекула полимера образуется путём последовательного присоединения молекул мономера (низкомолекулярные вещества) и активному центру на конце растущей цепи
n M ¾® M n' ;
где n-число отдельных молекул; n’-степень полимеризации; М – молекулярная масса мономера.
Полимеризация бывает радикальной и ионной
Радикальная полимеризация протекает с участием свободных радикалов. Стадии: инициирования, роста цепи, обрыва цепи.
Инициирование:
нагреванием (термическая активация): t ··
СН2=СН2 ¾® СН2-СН2 бирадикал.
····
Далее СН2=СН2 + СН2-СН2 + СН2=СН2 ¾® СН2-(СН2)4-СН2 и т.д.
радиационный способ активации:
hg··
CН2=СН2 ¾® СН2-СН2
введением специальных инициаторов:
tо
 (С6Н5СОО)2 ¾® [ 2С6Н5СОО× ]=2R (С6Н5СОО)2 ¾® [ 2С6Н5СОО× ]=2R
 перекись бензоила перекись бензоила
·
Далее R× + CH2=CH2 ¾® R-CH2-CH2 и т. д.
Обрыв цепи:
R—(CH2)n× + ×(CH2)n–R' ¾® R—(CH2)n—(CH2)n –R’.
Степень полимеризации указывает количество звеньев, входящих в макромолекулу: n= М полимера / М мономера, n~ 100-1000 и более.
Ионная полимеризация – процесс с участием ионов, протекающий под действием катализаторов (AlCl3, TiCl4, BF3, NaNH2, (C2H5)3Al )
Катионная: (C2H5)3Al
Ti4+Cl4 ¾¾¾® [Ti3+Cl4]-
[Ti3+Cl4]- + CH=CH2 ¾® [Ti3+Cl4]-—CH—C+H2
  I I карбкатион I I карбкатион
    n n
[Ti3+Cl4]--CH-C+H2 + nCH=CH2 ® [Ti3+Cl4]--CH-CH2--CH-CH2--CH-C+H2
       I I I I I I I I I I
    обрыв n обрыв n
¾¾¾® TiCl4 + CH2—CH2— CH—CH2—CH=CH2
      I I I I I I
NH3
Анионная: NaNH2 ¾® Na+ + NH2-
NH2- + CH2=CH ¾® NH2—CH2—C-H
  I I и д.т. I I и д.т.
Мономерами (для полимеризации) могут быть вещества, содержащие кратные связи или циклы, раскрывающиеся в результате реакции. Для поликонденсации – вещества, содержащие не менее двух функциональных групп.
Мономеры: этилен СН2=СН2; стирол СН2=СН; капролактам NH2-(CH2)5COOH, I
C6H5
метилметакрилат СН2= С-СООСН3, изопрен СН2=С-СН=СН2,
I I
CH3 CH3
CI
I
бутадиен СН2=СН-СН=СН2, хлоропрен СН2=С-СН=СН2; винилхлорид СH2=CHCl; акрилонитрил CH2=CH—CN и другие.
Если в процессе участвует несколько видов мономеров, то имеем сополимеризацию (бутадиеннитрильный, бутадиенстирольный каучуки и т.д.)
Поликонденсация - процесс получения полимеров из би – или полифункциональных соединений (мономеров), сопровождающийся выделением побочных низкомолекулярных веществ - воды, спирта, ННal и т. д. Мономер должен содержать не менее двух функциональных групп. Низкомолекулярный продукт надо выводить из зоны реакции, иначе может наступить снижение химического равновесия.
В зависимости от структуры образующегося полимера различают линейную и трёхмерную поликонденсацию.
Линейная поликонденсация – это процесс, приводящий к образованию макромолекул линейной структуры. Это обеспечивается участием в реакции только бифункциональных мономеров.
Трёхмерной поликонденсацией называется процесс, приводящий к образованию макромолекул трёхмерной структуры (три и более функциональных групп).
Линейная поликонденсация (этиленгликоля и терефталевой кислоты):
  HOCH2CH2OH + HOOC- -COOH ® HOCH2CH2OCO- -COOH + H2O HOCH2CH2OH + HOOC- -COOH ® HOCH2CH2OCO- -COOH + H2O
 ® + HOCH2CH2OCO- -COOH ® ® + HOCH2CH2OCO- -COOH ®
 
  ® [HO(CH2)2OCO- -COO(CH2)2OCO- -СООН]n + nH2O ® [HO(CH2)2OCO- -COO(CH2)2OCO- -СООН]n + nH2O
лавсанКапрон:
H2N-R-COOH + H2N-R-COOH ® H2O + H2N-R-C-NH-R-COOH
II
О
Трёхмерная поликонденсация:
 CH2OH HOOC O O CH2OH HOOC O O
   I II II I II II
 CHOH + ¾® HOCH2-CH-CH2O-C- -C-OH + H2O CHOH + ¾® HOCH2-CH-CH2O-C- -C-OH + H2O
 I I I I
CH2OH HOOC OH
 O COOH O COOH
  II II
  + HOCH2-CH-CH2-O-C- -COOH + 2 ® + HOCH2-CH-CH2-O-C- -COOH + 2 ®
 I I
OH COOH
O O
II II
  ® HO-CH2-CH-CH2OC- -C-OCH2-CH-CH2OH идалееидетеще ® HO-CH2-CH-CH2OC- -C-OCH2-CH-CH2OH идалееидетеще
I I сшивка.
  O O O O
C= O C=O
  I I I I
 
 
COOH COOH
Основные методы получения огнестойких материалов на основе полимеров
Способы защиты полимеров от огня:
а) обработка, пропитка полимера неорганической солью – инертный способ,
соль не гасит огонь, а лишь препятствует его распространению от одного
волокна к другому, образуя корку.
б) обработка полимера веществом, разлагающимся под действием огня с
выделением негорючих газов. Образуется над поверхностью материала
защитная газовая подушка.
При введении в материал огнезащитных добавок (антипиринов) изменяется состав и структура материала, что зачастую приводит к снижению горючести. Антипирины снижают горючесть различным образом: 1) ингибируют реакцию горения; 2) изменяют долю возвращённой теплоты горения; 3) приводят к получению менее горючих продуктов пиролиза; 4) снижают скорость диффузии горючих продуктов пиролиза к фронту пламени. Антипиринами могут быть вещества, которые содержат фосфор, галоген, азот, сурьму в своём составе. К этой категории могут быть причислены гидроокись алюминия, соединения бора, силикаты, карбонаты.
Наиболее эффективными и практически универсальными антипиринами являются фосфор - и галогенсодержащие соединения.
Важнейшие представители полимеров
Пластичными массами называют материалы, полученные на основе полимеров, содержащие различные добавки и способные под влиянием температуры и давления, становиться пластичными. В состав пластмасс, кроме полимера, входят наполнители, пластификаторы, стабилизаторы, красители, отвердители, смазывающие вещества и другие.
В качестве наполнителей применяют порошкообразные, волокнистые и листообразные горючие и негорючие вещества. Содержание наполнителя в пластмассах 30 % - 70 %.
К порошкообразным наполнителям относятся вещества минерального происхождения – кварцевая мука, мел, тальк и другие измельчённые материалы. Эти наполнители придают пластмассе теплостойкость, кислотостойкость, увеличивают твёрдость, а такие удешевляют пластмассу и повышают её долговечность, что основано важно для пластмасс, применяемых в строительстве.
Волокнистые наполнители – асбестовое волокно, хлопковое очесы, древесное волокно, стеклянное волокно – также увеличивают прочность пластмасс и снижают их хрупкость, повышают теплостойкость (асбест, волокно, короткое стекловолокно).
Листообразными наполнителями для пластмасс является бумага, х/б и стеклоткани, асбестокартон и т. д.
Пластификаторы вводят в пластмассы для увеличения их эластичности. Кроме того, пластификаторы улучшают другие свойства полимеров морозостойкость, огнестойкость, стойкость к действию Уф-света, а также облегчают условия переработки. Пластификаторы должны совмещаться с полимером, быть химически инертными и мало летучими. В качестве пластификаторов в пластмассах применяют главным образом сложные эфиры различных кислот, а также низкомолекулярные полиэфиры.
Стабилизаторы – вещества, которые вводят в пластмассы для повышения их стойкости к действию тепла, света, кислорода воздуха и т. д., т. е. замедления сгорания полимера, протекающего при переработке и эксплуатации. В качестве стабилизаторов применяют большое количество органических и металлоорганических соединений.
Красители и пигменты придают пластмассам определённый цвет. Они должны иметь живые тона, не давать грязноватого оттенка, обладать химической стабильностью. В качестве красителей применяют такие органические красители, как нитрозин, пигмент жёлтый, хризондин, в качестве пигментов - охру, сурик, умбру, ультрамарин, окись хрома, белила.
Отвердители вводят в некоторые полимеры для перевода их в неплавкое и нерастворимое соединение. В качестве отвердителей применяют различные перекиси и гидроперекиси, третичные амины, ангидриды различных кислот и др. В ряде случаев для сокращения времени отверждения применяют ускорители отверждения.
Смазывающие вещества вводят в пластмассы для предотвращения прилипания к пресс-формам (олеиновая кислота, стеарин и другие).
Пластмассы на основе полиэтилена устойчивы к действию растворителей и концентрированных кислот; хорошие диэлектрики Тпл. ~ 300 оC. При температуре 100 оС происходит их окисление и изменение физических свойств. Горят светящимся пламенем. Твоспл. – 300 оС, Твсп.- 400 оС. Qсгор. – 11135 ккал/кг. При нагревании идёт деполимеризация с образованием горючих смесей [трубы, плёнка, электроизоляция …].
Пластмассы на основе полистирола – твёрдые, прозрачные, хрупкие вещества, растворимые в бензоле, толуоле и др. ароматике, диэлектрики. С целью уменьшения хрупкости проводят сополимеризацию полистирола с каучуком. В этом случае получают ударопрочное вещество. Тпл. и Твоспл. – 200 оС, Твсп. – 400 оС. Горит сильно коптящим пламенем. Q – 9000 ккал/кг. Пыль пожаровзрывоопасна. [ванны, раковины, детали холодильников, облицовочная плитка, пенопласты и т. д.].
Пластмассы на основе ПВХ – твёрдые, прозрачные вещества. Не растворяются в кислотах, щелочах, в большинстве органических растворителей. Диэлектрики. Тразмягчения 80-100 оС. При температуре 120-150 оС разлагаются. При нагревании вспучиваются, обугливаются с выделением НСI. Твоспл. =1100 оС. Пыль взрывоопасна. Без пластификатора – винипласт, с пластификатором – пластикат. [Линолеум, искусственная кожа, плёнка, трубы, травильные ванны, и т. д.].
Волокна.
Натуральные Химические
  (полученные химическим (полученные химическим
  путем) путем)
органические неорганические искусственные синтетические
  (асбестовое волокно) (асбестовое волокно)

(химическая обработка
природных материалов)
вискозное, медно-аммиачное,
происхождение: ацетатное.
растительное (хлопок, лён);
от животных (шерсть, шёлк). (получают из синтетических полимеров)
капрон, анид, лавсан, полиакрилонитрильные,
полипропиленовые.
Строение волокон характеризуется упорядоченным, ориентированным вдоль оси волокна, расположением линейных молекул. При таком расположении молекул, в волокне возникают большие силы притяжения, что обеспечивает его высокую прочность. Чем больше молекулы, тем больше силы, удерживающие их друг возле друга. Для того, чтобы молекулы могли перемещаться, необходимо ослабить межмолекулярное воздействие. Это достигается либо растворением полимера, либо его плавлением, либо переводом в пластичное состояние путём нагревания. В связи с этим существует два способа формования волокон из полимеров – прядение из раствора и прядение из расплава (или из пластичного соединения).
Волокно капрон
Получают прядением из расплава капролактама. Поликапролактам получают полимеризацией капролоктама при 250-260 оС. Реакция идёт ступенчато. Вначале при реакции капролоктама (циклическое строение) с водой образуется аминокапроновая кислота
HN(CH2)5CO+HOH ¾® H2N(CH2)5COOH
  

Аминокапроновая кислота соединяется с другой молекулой капролактама, образуя димер:
  
H2N(CH2)COOH + HN(CH2)5СО¾® H2N(CH2)5CO – NH(CH2)5COOH.
Далее димер вступает с новой молекулой капролактама, образуя тример, и т.д. до образования поликапролактама.
В качестве стабилизатора молекулярного веса полимера применяют уксуснокислый бутиламин. Для предотвращения окисления полимера процесс полимеризации ведут в атмосфере азота. Полученный полиамид (капрон) перерабатывают в крошку, которая затем продавливается через фильеры. Полученные тонкие капроновые нити обдувается воздухом и застывают. Затем нити скручивают в нить и вытягивают.
В химическом отношении капроновые волокна нестойкие. Под действием кислот и щелочей, даже малой концентрации, они растворяются. Плотность их 140 кг/м3. Тпл.=208-215 оС, при 300 оС волокно начинает разлагаться с выделением различных продуктов разложения. Волокно легко воспламеняется, в расплавленном состоянии интенсивно горит с выделением большого количества дыма, в котором содержатся много продуктов разложения. К тепловому самовозгоранию волокно не склонно.
Применение: добавки в шерстяные изделия, искусственные меха, капроновые карды в шинной промышленности, тяжёлые транспортные ленты, приводные ремни, спасательные верёвки, рыболовные снасти.
Волокно лавсан.
Получение – 2 стадии:
1. Получение дигликолевого эфира терефталевой кислоты
O O
II II ацетаты Co, Mn, Zn
  H3C-O-C- -C-O-CH3 + 2HO(CH2)2OH <===============> H3C-O-C- -C-O-CH3 + 2HO(CH2)2OH <===============>
избыток
O O
II II
  <=> HO-(CH2)2-O-C- -C-O-(CH2)2-OH + 2CH3OH <=> HO-(CH2)2-O-C- -C-O-(CH2)2-OH + 2CH3OH
200 оС отгонка.
2. Получение полиэтилентерефталата путём поликонденсации дигликолевого эфира терефталевой кислоты:
O O O O
    II II 270 0C II II II II 270 0C II II
    HO-(CH2)2-O-C- -C-O-(CH2)2OH <===> -О-C- -C-O(CH2)2-O- n + HO-(CH2)2-O-C- -C-O-(CH2)2OH <===> -О-C- -C-O(CH2)2-O- n +
 
(n-1)C2H5OH.
Лавсан (терилен) по своим свойствам близок к натуральной шерсти. Он имеет самую высокую прочность, изделия из него не сминаются. Из всех видов синтетических волокон, волокно лавсан наиболее термически стойкое. Только при 1800 С оно теряет 50% первоначальной прочности. Оно может работать в диапазоне температур от –70 до +1750С. Изделия из лавсана имеют высокую светостойкость. Диэлектрик.
Лавсан относится к химически устойчивым волокнам. Он стоек к действию органических и минеральных кислот. Твоспл. =390 оС. В расславленном состоянии интенсивно горит ярким, сильно коптящим пламенем. К тепловому возгоранию волокно не склонно.
Применение: гибкие рукава, корд, транспортные ленты, приводные ремни, заменитель шерстяного волокна.
Волокно нитрон.
Полиакрилонитрил получают полимеризацией акрилонитрила
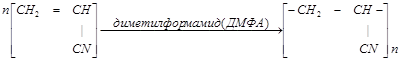
[ДМФА - диметилформамид НСО—N(CH3)2.]
Волокно очень прочное, упругое, эластичное. Термостойкость удовлетворительное: при 120-130 оC его можно эксплуатировать в течение нескольких недель, снижения прочности при этом не происходит.
Нитрон достаточно светоустойчив. Устойчивость к истиранию ниже, чем у полиамидных волокон.
Волокно легко воспламеняется под действием пламени (Твоспл.=200 оС). При 220-230 оС оно размягчается и одновременно разлагается. Горит ярким, коптящим пламенем. К тепловому самовозгоранию не склонно.
В химическом отношении нитрон менее стоек, чем лавсан, но более стоек, чем капрон. По внешнему виду напоминает шерсть. Нитрон дешевле капрона и лавсана.
Применение: верхний трикотаж, техничные изделия, ткани, специальная одежда, рукава и т. д.
Волокно хлорин.
Получение
[CH2=CH]n ¾® [-CH2-CH-]n n=50000-1500000
I I
Cl Cl
Волокно получают методом прядения из растворов. Растворитель: ацетон, ДМФА.
При -20 оС волокно становится хрупким, при 70 оС размягчается, а при 180 оС разлагается с выделением HCI и CI2. Стойкое к действию кислот и щелочей, к большинству растворителей (кроме ацетона, альдегидов и кетонов). Относится к трудно сгораемым материалам. К самовозгоранию не склонно.
Применение: фильтры, спецодежда, лечебное бельё и т. д.
Натуральный каучук.
  Содержится в млечном соке некоторых деревьев – каучуконосов (гевея, Бразилия). Добываемый из них млечный сок (латекс) содержит 55-60 % Н2О и 35-40 % каучука в виде мелких глобул. Для выделения каучука, латекс обрабатывают уксусной или муравьиной кислотой, в результате чего происходит коагуляция глобул. Содержится в млечном соке некоторых деревьев – каучуконосов (гевея, Бразилия). Добываемый из них млечный сок (латекс) содержит 55-60 % Н2О и 35-40 % каучука в виде мелких глобул. Для выделения каучука, латекс обрабатывают уксусной или муравьиной кислотой, в результате чего происходит коагуляция глобул.
  Приблизительная формула: - СН2-С=СН-СН2- Приблизительная формула: - СН2-С=СН-СН2-
I
  CH3 n Мср ~350000 CH3 n Мср ~350000
Длинные молекулы натурального каучука беспорядочно свёрнуты и непрерывно меняют форму.
Этим и объясняется его высокая прочность, но при –60 оС прекращается беспорядочное движение молекул, каучук теряет свою эластичность и становится хрупким.
По внешнему виду натуральный каучук представляет собой упругое смолоподобное вещество светло-коричневого цвета. Он хорошо растворяется во многих органических растворителях: углеводородах (предельных и ароматических), в простых и сложных эфирах и т. д. В спиртах и минеральных маслах набухает. Плотность 910-914 кг/м. При 120 оС он размягчается, а при дальнейшем нагревании переходит в коричневую смолоподобную жидкость. При 250 оС разлагается с выделением газообразных и жидких продуктов, главным образом изопрена С5Н8, дипентена и других. Не проводит электрического тока, газонепроницаем.
Каучук является реакционно-способным веществом. Взаимодействует с Н2, НаI, HНaI, нитро - и нитрозосоединениями и т. д. Особенно активно воздействует на него О2 и другие окислители.
Скорость окисления увеличивается в присутствии солей меди, железа, марганца, кобальта.
Различные перекиси действуют на каучук ещё более активно, чем атмосферный кислород.
Из всех видов каучуков натуральный каучук наиболее пожароопасен, он имеет сравнительно низкую температуру самовоспламенения (129 оС). Разложение каучука при температурах выше 250 оС, сопровождающиеся выделением различных газообразных продуктов, способствует образованию взрывоопасных концентраций продуктов разложения и при определённых условиях может повлечь за собой взрыв.
При горении каучук плавится и растекается. Температура горения может достигать 1500-1700 оС. Пламя яркое, коптящее, характеризуется большим тепловым излучением.
Синтетические каучуки.
Преимущества:
1. Их производство может быть организовано в широких масштабах; оно не
зависит от климатических условий.
Синтетический каучук можно получить с заранее заданными свойствами.
Производство более экономичное.
Недостатки:
малая клейкость,
пониженная эластичность,
более низкая прочность.
Сырьё для производства:
бутадиен, получаемый из бутана, этанола, ацетилена;
изопрен, получаемый из крекинг-газов;
хлоропрен, получаемый из ацетилена и хлора;
стирол, получаемый конденсацией бензола и этилена в присутствии AICI3;
акрилонитрил, получаемый путём каталитического дегидрирования этиленциангидрина.
Натрий-бутадиеновый каучук (СКБ).
Каучук горюч, горит ярким коптящим пламенем. Склонен при определённых условиях к химическому самовозгоранию.
Получение по Лебедеву:
1). Получение бутадиена путём каталитического дегидрирования и дегидратирования этиленового спирта
2C2H5OH ¾® CH2=CH-CH=CH2 + H2 + 2H2О
2). Полимеризациябутадиена
Na
n(CH2=CH-CH=CH2) ¾¾¾¾® [-CH2-CH=CH-CH2-]n
(на пов-ти твёрдого Мср~130000
металл. натрия)
Это каучук общего назначения, применяется в резиновой, кабельной, обувной промышленности. Из него готовят мягкие и эбонитовые изделия, резиновую обувь, наружные оболочки различных кабелей и т. д.
Резины из СКБ содержат до 60 % сажи, хорошо сопротивляются тепловому сгоранию и многократным деформациям.
Хлоропреновые каучуки.
Процесс полимеризации ведут в эмульсии при 40 оС:
   
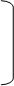 
 n CH2=C-CH=CH2 ¾® -CH2-C=CH-CH2- + Q n CH2=C-CH=CH2 ¾® -CH2-C=CH-CH2- + Q
I I
CI CI n
наирит, для вулканизации приме-
няют окислы металлов.
Мср.~100000, 37 % хлора.
Каучуки типа наирит в основном горючи. Резины на основе наирита - свето - и озоностойкости, хорошо сопротивляются истиранию, некоторые из них не горючи и имеют повышенную масло стойкость.
Применение: резиновая и кабельная промышленность (ремни, транспортные ленты, рукава, формовые изделия, наружные оболочки кабелей, специальные озоно - и маслостойкие изделия).
Бутадиен-стирольный каучук (СКС, Буна S).
Это продукт сополимеризации бутадиена со стиролом. Содержаниестирола - 20 – 40 %.
n(CH2=CH-CH=CH2) + (CH2=CH)n ¾® (-CH2-CH=CH-CH2-CH2-CH-)n
    I I I I
Мср.~150000-200000.
Марки: СКС-30 АРКМ-15, СКС-30 АРМ, СКС-30, СКС-10.
Хорошо растворяются в углеводородах и хлорированных углеводородах, петролейном эфире, бензине. Каучуки СКС горючи. Горят ярким, сильно коптящим пламенем. При определённых условиях каучуки СКС склонны к самовозгоранию.
Каучук СКС уступает натуральному по эластичности, теплостойкости и клейкости. Резины из СКС по морозостойкости в большинстве случаев уступают натуральным, но по износостойкости, сопротивлению тепловому, озоновому и естественному старению, пароводонепроницаемости каучуки СКС превосходят натуральные. Работоспособность шин из них на 10 % больше, чем из других эмульсионных каучуков общего назначения.
Список литературы
1. Врублевский А.В., Бутылина И.Б. Полимеры и материалы на их основе. Учебно-методическое пособие. Мн., КИИ МЧС РБ, 2000, 38с.
2. Писаренко А.П., Хавин З.Я. Курс органической химии. М., Высшая школа, 1975. 510 с.
3. Нечаев А.П. Органическая химия. М., Высшая школа, 1976. 288 с.
4. Артеменко А.И. Органическая химия. М., Высшая школа, 2000. 536 с.
5. Березин Б.Д., Березин Д.Б. Курс современной органической химии. М., Высшая школа, 1999. 768 с.
6. Ким А.М. Органическая химия. Новосибирск, Сибирское университетское издательство, 2002. 972 с.
|