Министерство общего и профессионального образования
Российской Федерации
Воронежский Государственный Педагогический Университет
Выпускная квалификационная работа по специальности 011000 «Химия»
«Исследование некоторых физико-химических свойств
протеиназы
Penicillium
wortmannii
.»
Исполнитель:
ст-ка V курса
Естественно-географического факультета
Шишкина Е.Ф.
Научный руководитель:
кандидат технических наук, доцент
Кочергина Н.И.
ВОРОНЕЖ 1999 г.
СОДЕРЖАНИЕ
Введение. 3
Глава 1. Обзор литературы. 5
1.1 Протеиназы микробного происхождения. 5
1.2 Ферменты, их физико-химические свойства. 9
1.3 Выделение и очистка препаратов протеиназы. 13
1.4 Расщепление коллагенсодержащего сырья и его применение. 17
Глава 2. Материалы и методы исследования. 27
2.1 Определение рН. 27
2.2 Определение протеолитической активности. 27
2.3 Определение коллагеназной активности. 27
2.4 Определение молекулярной массы. 28
2.5 Определение содержания аминного азота. 28
2.6 Электрофоретические исследования. 29
2.6.1 Определение гомогенности очищенных препаратов 29
2.6.2 Идентификация протеиназ в ПААГ. 30
Глава 3. Получение препаратов протеиназы Penicillium wortmannii 2091
и исследование их физико-химических свойств. 31
3.1 Разработка условий выделения препарата
Penicillium wortmannii BKMF 2091. 31
3.2 Фракционирование протеолитического комплексного
препарата ферментов. 36
3.3 Влияние температуры и рН на активность фермента. 37
3.4 Определение молекулярной массы. 40
3.5 Исследование процессов кислотной и термической инактивации. 40
3.6 Влияние ионов металлов и ингибиторов на активный центр фермента. 44
3.7 Субстратная специфичность. 46
3.8 Гидролиз коллагенсодержащего сырья: ноги птиц, шквара. 47
Глава 4. Методическая часть. 57
4.1 Межпредметность – современный принцип обучения. 57
4.2 Межпредметные связи на уроках химии. 61
4.3 Методические рекомендации по реализации принципов
межпредметных связей при изучении тем, связанных
с понятием «ферментные препараты». 63
Выводы. 70
Список литературы. 71
ВВЕДЕНИЕ.
Важнейшим свойством ряда белков является их каталитическая активность. Вещества белковой природы, способные каталитически ускорять химические реакции, называют ферментами. Роль ферментов в жизнедеятельности животных, растений и микроорганизмов колоссальна. В настоящее время в биологических объектах обнаружено несколько тысяч индивидуальных ферментов, а несколько сотен из них выделено и изучено.
Реклама

Биологические катализаторы по ряду признаков резко отличаются от неорганических катализаторов. Будучи белками, ферменты обладают всеми их свойствами. Сюда относятся термолабильность ферментов, зависимость их действия от значения рН среды, специфичность, подверженность влиянию активаторов и ингибиторов.
Термолабильность ферментов объясняется тем, что температура, с одной стороны, воздействует на белковую часть фермента, приводя при слишком высоком значении к денатурации белка и снижению каталитической функции, а с другой стороны, оказывает влияние на скорость реакции образования фермент-субстратного комплекса и на все последующие этапы преобразования субстрат. Кроме того, для каждого фермента существует оптимальное значение рН среды, при котором он проявляет максимальную активность. Большинство ферментов имеет максимальную активность в зоне рН поблизости от нейтральной точки. Специфичность – одно из наиболее выдающихся свойств ферментов. Данное свойство ферментов объясняется в первую очередь совпадением пространственных конфигураций субстрата и субстратного центра фермента. Ферменты могут обладать абсолютной, относительной, стереохимической специфичностью. Влияние на ферменты активаторов и ингибиторов впервые было изучено А.Я.Данилевским. Ингибиторы тормозят действие ферментов. Механизм ингибирующего действия сводится к двум типам торможения (необратимое и обратимое). Обратимое ингибирование действия ферментов может быть конкурентным и неконкурентным.
Будучи выделены из организма, ферменты не утрачивают способности осуществлять каталитическую функцию, на чем основано их применение в различных областях промышленности. В хлебопекарной промышленности применяют ферментные препараты, относящиеся к роду Aspergillus. В пивоваренной и спиртовой промышленности применяют амилазы – ферменты, ускоряющие реакцию осахаривания крахмала. В кожевенном и меховом производстве применяют препараты протеиназ. Ферменты находят большое применение в медицине. Пепсин, трипсин, химотрипсин, липазу и амилазу применяют для лечения заболеваний ЖКТ. Протеолитические ферменты – плазмин и активирующие его стрептокиназу и урокиназу – для растворения тромбов в кровеносных сосудах. Кроме того, специфическую область применения ферментов в медицине составляет энзимодиагностика (заболевание может быть тестировано по уровню содержания фермента или соотношения его множественных форм в крови или реже в моче).
Реклама

ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ
1.1 Протеиназы микробного происхождения.
Протеолитические ферменты синтезируются практически всеми живыми существами. В промышленных целях как источник протеиназ используются животные ткани, растения и клетки микроорганизмов. Наиболее перспективным источником протеиназ следует признать микроорганизмы по ряду существенных преимуществ, связанных, прежде всего, с неограниченностью источников, возможностью широко варьировать свойства методами селекции и генной инженерии, подбором условий биосинтеза, широким спектром ферментных комплексов и глубиной воздействия на различные субстраты, а так же простотой и относительной дешевизной технологии.
Продуценты протеолитических ферментов обнаружены среди самых различных групп микроорганизмов: бактерий (Bacillus, Micrococcus, Pseudomonas), микромицетов (Aspergillus, Rhizopus, Penicillium), актиномицетов (Streptomyces, Actinomyces). На их основе у нас в стране и за рубежом создано крупнотоннажное производство ферментных препаратов протеолитического действия.
Многие широко распространённые микроорганизмы секретируют значительное количество протеолитических биокатализаторов в окружающую среду, что значительно облегчает задачу их выделения и очистки. Возможность управления образованием ферментов за счёт подбора соответствующей питательной среды и условий культивирования позволяет не только увеличить выход протеолитических ферментов, но и получать ферментные препараты с определёнными свойствами. Методы селекции и генной инженерии значительно увеличивают возможности целенаправленного биосинтеза ферментов. Существенна способность микроорганизмов вырабатывать ферменты, уникальные по своей субстратной специфичности (кератиназы, коллагеназы, эластазы).
Большое внимание, уделяемое изучению протеолитических ферментов микроорганизмов, привело к получению значительного числа препаратов бактериальных и грибных протеиназ в высокоочищенном состоянии.
В настоящее время в номенклатуру и классификацию ферментов внесено большое количество протеолитических ферментов микробного происхождения, которые относятся к различным подклассам. По современной классификации протеолитические ферменты относятся к классу гидролаз и образуют подкласс пептид-гидролаз, или протеаз. Протеазы обычно подразделяются на пептидазы и протеиназы. Однако чёткого разделения по этому признаку нет, так как установлено, что протеиназы (пепсин, трипсин, папаин и другие) гидролизуют пептидные связи не только в белках, но и различных полипептидах. За последние годы значительно изменились представления о протеолитических ферментах. Согласно классификации Бергмана, подкласс пептид-гидролаз делится на две группы: эндопептидазы и экзопептидазы, которые отличаются специфичностью действия на субстрат. Эндопептидазы гидролизуют пептидные связи, отщепляя последовательно концевые аминокислоты. Эндопептидазы могут действовать на центральные участки пептидной связи и расщеплять молекулу белка на более мелкие фрагменты. Экзопептидазы не могут гидролизовать пептидные связи, находящиеся в середине цепи и действуют, отщепляя последовательно одну за другой концевые аминокислоты.
Необходимо отметить, что многие из протеолитических ферментов микробного происхождения получены в кристаллическом виде, например, субтилизин КФ 3.4.21.14, сериновая эндопептидаза Alternaria КФ 3.4.21.16, сериновая протеиназа Arthrobacter КФ 3.4.21.14, кислая протеиназа Aspergillus oryzae КФ 3.4.23.6, кислая протеиназа Penicillium janthinellum КФ 3.4.26.6. и другие. Часто под одним номером находится очень много ферментов, получаемых из различных источников, но имеющих сходные свойства.
В промышленности чаще всего получают комплекс протеолитических ферментов, достоинства которого определяются с учётом аспектов последующего применения ферментного препарата. Общая протеолитическая активность препаратов определяется на стандартных субстратах (казеине, гемоглобине, казеинате натрия) в соответствии с известными методами и используется для сравнения эффективности их действия на специфические субстраты (коллаген, эластин, кератин, желатин и т.д.).
Следует отметить, что у нас в стране проведены определённые исследования и обобщения по эффективности микробных протеиназ при расщеплении белков животных тканей. Однако лишь для немногих из них глубоко изучены физико-химические свойства, проведена идентификация функциональных групп каталитического центра, исследованы кинетика гидролиза субстратов и субстратная специфичность, расшифрована первичная структура.
Производство протеолитических препаратов организовано на основе микроскопических грибов родов Aspergillus и Rhizopus при поверхностном культивировании продуцентов, а также на основе бактерий Bacillus (subtilis, mesentericus, licheniformis, cereus и др.) при глубинном культивировании.
Протеиназы, полученные из этих культур, обладают высокой активностью. Они находят широкое применение в различных отраслях промышленности для гидролиза животных и растительных белков. Среди микроорганизмов – продуцентов протеиназ не менее важное место, чем бактерии, занимают актиномицеты Streptomyces (bradia, griseus, fradiospiralis). Впервые способность синтезировать протеиназы актиномицетами была показана Ваксманом, а затем Красильниковым. С тех пор большое число работ советских и зарубежных учёных посвящено изучению протеолитических ферментов актиномицетов [6, 17]. В настоящее время появились работы, где описано использование актиномицетов в качестве продуцентов кератиназы [24], эластазы [28], коллагеназы [26]. Однако промышленный выпуск протеиназ из актиномицетов развит слабо. Известны лишь препараты протеиназ Streptomyces griseus и Streptomyces fradie.
Однако проведение глубоких исследований ферментов у микроорганизмов осложняется высокой гетерогенностью синтезируемых протеолитических комплексов, требующих особо тонких и чувствительных методов выделения и очистки. Комплексные препараты, получаемые на практике, дают специфические эффекты при гидролизе субстратов. Так, например, протеолитические ферменты бактериального и грибного происхождения действуют в основном на белки мышечной ткани. Вместе с тем, известны комплексные препараты, проявляющие активность в отношении коллагена и эластина. При исследовании различных субтилизинов установлена их высокая каталитическая активность и невысокая специфичность гидролитического действия, что допускает их использование в различных пищевых технологиях.
Протеиназа из Actinomyces fradiae,отнесённая к типу трипсиноподобных, способна также гидролизовать казеин, денатурированный коллаген, но не активна в отношении эластина.
Из культуральной жидкости Bacillus mesentericum 316М выделяют комплексный ферментный препарат, обладающий высокой протеолитической активностью к фибриллярным белкам, в том числе коллагену и эластину.
Из отходов производства антибиотиков получен протеолитический препарат (источник Streptomyces griseus). Он обладает высокой казеинолитической активностью, подвергая при этом гидролизу гемоглобин, эластин, коллаген и желатин.
Получение высокоочищенных фракций ферментов – длительный, сложный и дорогой процесс, а применение комплексных препаратов не всегда даёт желаемый эффект и требует исследования условий гидролиза не только на чистых субстратах, но и при обработке сложных белковых систем. При этом интерес представляет как глубина протеолиза, так и качественная характеристика продуктов реакции, поскольку именно они определяют не только функциональные, биологические и технологические свойства продуктов, но и могут проявлять физиологические эффекты в составе пищи.
1.2 Ферменты, их физико-химические свойства.
Протеиназы, включающие ферменты микробного происхождения, составляют около половины производства препаратов на мировом рынке. Их эффективность и мощность намного превосходят синтетические катализаторы. Они высокоспецифичны по отношению к своим субстратам и ускоряют строго определённые химические реакции без образования побочных продуктов; ферменты функционируют в разбавленных водных растворах при физиологических значениях рН и температуры.
Ферменты – функциональные единицы клеточного метаболизма. Действуя в строго определённой последовательности, они катализируют сотни многостадийных реакций, в ходе которых расщепляются молекулы питательных веществ, запасается и преобразуется химическая энергия, и из простых молекул-предшественников строятся макромолекулы, входящие в состав клетки.
Ферментативный катализ происходит на расстоянии длины химической связи, поэтому акт катализа совершается на определённом участке поверхности макромолекулы, называемом активным центром. Современный уровень экспериментальных исследований позволил доказать, что он представляет собой набор небольшого числа функциональных групп, расположенных близко друг от друга и имеет вид впадин, выемок на поверхности молекулы фермента. Функциональные группы активного центра могут принадлежать звеньям полипептидной цепи, весьма удалённым друг от друга. Сближение их связано с формированием третичной структуры молекулы фермента.
Вполне логично, что активный центр не имеет автономного существования. Нельзя провести какую-либо грань между активным центром фермента и остальной частью белковой молекулы. Именно это и является одной из причин высокой чувствительности и лабильности активного центра к различным воздействиям.
К наиболее важным характеристикам ферментных препаратов, которые определяют возможность их применения на практике, относят рН, температурный оптимум, субстратную специфичность. Кривые строятся на основе данных, полученных при измерении скоростей реакции, протекающей в буферных растворах с разными значениями рН.
В 1964 году была получена в высокоочищенном состоянии нейтральная протеиназа Bacillus subtilis. Фермент имеет довольно широкий оптимум рН 6,5 – 8,0. В щелочной области рН её активность снижается, достигая при рН 9,0 – 30% максимальной величины. Таким образом, ферменты активны только в определённом интервале рН. В большинстве случаев для каждого фермента имеется определённый оптимум рН. Это объясняется несколькими причинами:
- истинное, обратимое влияние рН на скорость реакции (когда фермент насыщен субстратом);
- влияние рН на сродство фермента к субстрату (в этом случае падение активности по обе стороны от оптимума рН будет следствием понижения насыщения фермента субстратом в силу понижения сродства);
- влияние рН на стабильность фермента, который может необратимо инактивироваться при рН по одну или обе стороны от оптимума.
Перечисленные факторы могут действовать и в комбинации друг с другом. Например, падение активности по одну сторону от оптимума рН может быть результатом уменьшения сродства фермента к субстрату, а по другую – результатом инактивации фермента.
Итак, для всех известных ферментов зависимость скорости реакции от рН графически выражается в виде «колоколообразной» функции. Такие кривые строятся на основе данных, полученных при измерении скоростей реакции, протекающей в буферных растворах с разными значениями рН.
Форма кривых, описывающих зависимость скорости ферментативной реакции от рН, отражает способность важных для данного фермента протон - донорных связей или протон – акцепторных групп в его каталитическом центре переходить при определённых значениях рН в состояние требуемой степени ионизации.
Методы анализа температурных зависимостей кинетических и равновесных параметров ферментативных реакций основываются на классических принципах термодинамики и кинетики. Ферментативные реакции характеризуются также наличием «колоколообразной» зависимости скорости реакции от температуры в достаточно широком температурном интервале, что приводит к температурному оптимуму реакции. Эта способность влияния температуры на кинетику ферментативных реакций объясняется наложением двух эффектов (возрастание скорости реакции при увеличении температуры и ускорением тепловой денатурации белковой молекулы, приводящей к инактивации фермента при высоких температурах).
Многообразие форм, в которых проявляется влияние температуры на скорость ферментативных реакций, даёт основание ожидать, что анализ этого явления должен представлять большие трудности. В действительности, однако, влияние температуры легко установить экспериментально. Влияние этого фактора на стабильность фермента можно изучить, инкубируя фермент при различных значениях температуры в течение определённого периода времени, а за тем определяя его активность в той температурной зоне, в которой он остаётся стабильным.
Хорошо изученными являются протеиназа из Bacillus amyloliguefarias [31] и протеиназа из Bacillus thermoproteolyticus (термолизин). Они довольно близки по своим свойствам. Однако термостабильность их значительно различается, так термолизин теряет 50% максимальной активности при температуре 84о
С, за 15 минут при рН 7,2 , в то время как протеиназа Bacillus amyloliguefacieus теряет за то же время 50% активности при температуре 59о
С.
Ферментативная реакция в целом состоит, по крайней мере, из трёх последовательных стадий: образование фермент-субстратного комплекса, превращение этого комплекса в комплекс фермент-продукт и диссоциация промежуточного продукта. Влияние температуры на реакцию в целом является результатом её влияния на каждую из этих стадий.
Известно много ферментов, для которых естественные условия их действия не совпадают с оптимальными параметрами рН и температуры. Таким образом, внешние факторы позволяют с достаточным эффектом регулировать интересующие процессы, особенно при технологической обработке биологических объектов, например мяса и мясных продуктов.
Специфичность ферментов объясняется в первую очередь совпадением пространственных конфигураций субстрата и субстратного центра фермента. По-видимому, только тогда, когда совпадение это достаточно полно, может образоваться фермент-субстратный комплекс и, следовательно, начаться процесс ферментативного катализа. Детальное изучение специфичности ферментов показало, что пределы её у разных ферментов различны. Одни ферменты обладают абсолютной специфичностью, т.е. каталитически ускоряют одну – единственную реакцию. Примером такого фермента может служить уреаза. Другие ферменты осуществляют катализ реакций определённого типа независимо от того, какие конкретные вещества в них взаимодействуют или распадаются. Основным признаком для ферментов этого типа является характер связи. Такие ферменты характеризуются, следовательно, групповой специфичностью. Наконец, некоторые ферменты отличаются стереохимической специфичностью, т.е. действуют только на один из пространственных изомеров. Примером могут служить ферменты, расщепляющие a- и b-метилглюкозиды.
Катализируемая химическая реакция представляет тот специфический признак, по которому один фермент отличается от другого. Современная классификация основана на этом признаке. Ферменты делят на группы в зависимости от типа катализируемой реакции и на подгруппы, более точно характеризующие эту реакцию.
Часто на практике протеолитические ферменты, известные и тем более мало изученные, подразделяются на группы в зависимости от оптимального значения рН действия на субстраты. Как правило, выделяют три группы:
1. Щелочные протеиназы, стабильные и активно действующие в области рН 5 – 10. Максимальная их активность обнаруживается при рН 9,5 – 10,5. Установлено, что это главным образом сериновые протеиназы (для акта катализа важную роль играют функциональные группы серина); они активно ингибируются диизопропилфторфосфатом (ДФФ).
2.Нейтральные протеиназы с оптимумом рН для протеолиза около 7,0. В эту группу объединяют большинство металлоферментов, чувствительных к таким аддентам, как ЭДТА и о-фенантролин. Они не ингибируются ДФФ и тиоловыми реагентами, устойчивы при рН 6 – 9.
3.Кислые протеиназы, активные при рН 2 – 5, не чувствительные к сульфгидрильным реагентам, металлохелатным агентам, тяжёлым металлам и к ДФФ. Для акта катализа этой группы ферментов важны остатки карбоксильных групп глутаминовой и аспарагиновой кислот.
Вместе с тем отметим, что зависимость активность – рН носит подчинительный характер и связана со структурой активного центра,
определяющего механизм действия.
1.3 . Выделение и очистка препаратов протеиназы.
Современный уровень науки и техники позволяет получить не только комплексные, но и гомогенные, кристаллические ферменты. Их, как правило, выделяют непосредственно из биомассы гриба или культуральной жидкости, а так же из экстрактов поверхностных культур.
В качестве осадителей при получении комплекса препаратов протеиназ применяют сульфат аммония [14, 17], этанол [17], ацетон, изопропанол [24].
Отмечается, что в зависимости от применяемого осадителя выход фермента бывает различным. Так при использовании различных органических растворителей в концентрации 80% , выход протеолитических ферментов составил: 56% - для этанола, 78% - изопропанола, 65% - ацетона.
Вместе с тем, сочетание различных осадителей приводит к более полному отделению от сопутствующих веществ. К. А. Калунянц с соавторами [13] для очистки препарата реннинопузилин П10х воспользовались осаждением сульфатом аммония. Полученный осадок растворяли в воде, фракционировали этиловым спиртом. При этом авторам удалось отделить значительную часть сопутствующих белков.
Таким способом получают комплексные ферментные препараты. Их можно применять в народном хозяйстве, не проводя дальнейших этапов очистки. Более полная очистка возможна с помощью таких методов разделения как гельфильтрации на сефадексе, хроматографии на ДЭАЭ-сефадексе, КМ-сефадексе, КМ-целлюлозе, ДЭАЭ-целлюлозе.
Например, протеиназа Torula thermofila была выделена и очищена в 11 раз в результате диализа препарата, полученного осаждением сульфатом аммония, с последующей гельфильтрацией на сефадексе У-100.
Для разделения коллагеназы и нейтральной протеиназы Achromobacter iophagus препарат, полученный осаждением сульфатом аммония, подвергли диализу, а так же хроматографии на ДЕ-32 целлюлозе.
Наиболее изученные протеолитические ферменты, продуцируемые Bac. Subtilis, получены в кристаллическом состоянии. Схема очистки этих препаратов включает: высаливание сульфатом аммония 75% насыщения с последующим диализом против ацетатного буфера. Затем двух кратное осаждение 67% ацетоном и диализ против трисбуфера с последующей хроматографией на ДЕАЕ-сефадексе А-50 [30].
При разделении нейтральной и щелочной протеиназ Asp. Oryzae ОИТ-5038 использовали осаждение сульфатом аммония 80% насыщения, с последующей хроматографией на ДЕАЕ-целлюлозе и сефадексе У-100.
Для отделения баластных белков и пигментов от протеиназы Asp. Terricola Войнарским разработан метод очистки на биогеле Р-10. В результате активность протеиназы возросла в 30 раз, а содержание пигментов уменьшилось в 100 раз.
В результате ионообменной хроматографии на ДЭАЭ-целлюлозе был получен препарат нейтральной протеиназы Streptomyces acidoresistous 1403 с десятикратной степенью очистки.
Наиболее эффективным методом выделения и очистки ферментов является афинная хроматография. Метод основан на использовании взаимодействий, аналогичных взаимодействию фермента с субстратом. Как правило, ферменты, полученные с помощью афинной хроматографии, являются гомогенными или смесью изоферментов. Это подтверждается данными электрофокусирования, электрофореза в полиакриламидном геле, определением аминокислотной последовательности [20].
В настоящее время достаточно широко применяется для очистки метод ультрафильтрации растворов ферментов. Преимуществом ультрафильтрации являются отсутствие тепловой инактивации и небольшие энергозатраты. Ультрафильтрация позволяет провести концентрирование раствора без фазового превращения при комнатной температуре, при одновременном освобождении от баластных веществ (пигментов, низкомолекулярных соединений). Например, Рожанская с соавторами [27] с успехом использовали метод ультрафильтрации при очистке протеиназ из Asp. terricola и Streptomyces sp.
Приведённые литературные данные, касающиеся вопросов выделения и очистки протеолитических ферментов, свидетельствуют о том, что сочетание различных методов позволяет получить гомогенные ферментные препараты из культур микроорганизмов. Применение того или иного из них зависит от индивидуальных свойств фермента, конечной цели при его применении, физико-химических факторов.
Анализируя литературные данные, мы пришли к выводу, что молекулярная масса нейтральных протеиназ находится в интервале 20000 – 50000. Все они имеют довольно высокий температурный оптимум, лежащий в интервале 40 – 60o
С, оптимальное значение рН 7,0 – 8,0, диапазон стабильности характеризуется значениями рН 5,0 – 10,0. Так нейтральная протеиназа Bac. Subtilis имеет оптимум рН 7,0 и температурный оптимум 52o
С. Протеолитические ферменты Bac. Subtilis, выделенные А.А. Глемжай и сотрудниками, имеют несколько оптимумов рН (от 6,5 до 10,5). Молекулярная масса нейтральной протеиназы 38000 – 45000, щелочной – 27000 – 29000.
Препараты протеиназ Pseudomonas aeruginosa 700/75 имеют рН оптимум от 7,5 до 10,0. Протеиназы различных фракций обладали различными рН оптимумами. Фермент с молекулярной массой 28000 имеет оптимум рН 10,5. Уменьшение молекулярной массы коррелировало со снижением оптимума рН. Так, протеиназа с молекулярным весом 20000 характеризуется рН оптимумом 7,0.
Известны термостабильные препараты протеиназ. Для термостабильного фермента, выделенного из Thermoactinomyces thalpophilus максимальная активность обнаружена при рН 6,0 и сохранялась до 70% при изменении рН от 5,0 до 8,0. Оптимальная температура равна 70o
С, но через 30 минут выдерживания при 70o
С сохраняется лишь 62% активности [32].
Другая термостабильная нейтральная протеиназа – прототерпин имеет оптимум температуры 79o
C, за 60 часов инкубации при 60o
С потеря активности не превышает 15%.
Итак, рН оптимум для нейтральных протеиназ варьирует от 6,0 до 8,0, температурный оптимум 40 – 60o
С, однако термостабильность ферментов может варьировать в широком диапазоне.
1.4 Расщепление коллагенсодержащего сырья и его применение.
Перспективное направление обработки коллагенсодержащего сырья – его ферментация. Авторами обзора [5] показано, что употребляемые для улучшения качества мяса ферментные препараты должны иметь следующие свойства:
- вызывать изменение соединительной ткани;
- слабо действовать на мышечную ткань;
- иметь возможно более высокий температурный оптимум действия, сохраняя способность частично изменять ткани при тепловой обработке;
- действовать в слабокислой или нейтральной среде с максимальной активностью;
- быть безвредным для человека.
Практика применения ферментных препаратов показывает, что не все ферменты, обладающие высокой протеолитической активностью, при обработке мяса дают должный эффект. При этом имеет большое значение оптимум действия ферментов, природа их активаторов и ингибиторов, специфичность к разрыву пептидных связей при гидролизе животных белков.
Известно несколько способов обработки мяса ферментами: инъекции раствора в кровеносную систему животных, шприцевание раствора фермента в шею, поверхностная обработка мяса ферментами, добавление ферментного раствора к мясному фаршу.
Наиболее приемлемым методом для современного производства оказалось шприцевание ферментного раствора в шею. В состав шприцуемого раствора кроме ферментного препарата входит поваренная соль и пищевые добавки.
Характер и глубина изменений внутримышечной соединительной ткани под действием протеолитических ферментов зависит от специфичности протеиназ содержащихся в препаратах. Наиболее глубокие изменения соединительнотканных прослоек происходили под действием фицина, т. к. этот фермент способен гидролизовать нативный эластин при естественном рН мяса. Что касается пищевых ферментных препаратов микробного происхождения, не обладающих коллагеназной и эластазной активностью, то их действие на внутримышечную соединительную ткань ограничивается освобождением коллагеновых волокон от «цементирующего» их основного вещества. Это способствует снижению устойчивости коллагеновых волокон к гидротермическому воздействию и более быстрому размягчению мяса в процессе тепловой обработки.
Проводя биохимическую оценку мяса, все исследователи пришли к единому мнению, что в результате обработки мяса ферментными препаратами перивариваемость его возрастает. Видимо, это связано с наличием в нём белков уже подвергнутых более или менее глубокой деструкции. Особенно это касается коллагена и эластина белков, наиболее трудно расщепляемых пищеварительными ферментами.
Направленное изменение исходных свойств сырья с помощью ферментативной обработки наиболее перспективно в колбасном производстве при сокращении сроков посола и использования сырья с большим содержанием соединительной ткани.
А.Ф. Невельниченко (1989) предложил способ созревания мясного сырья, предварительно обработанного раствором протеолитических ферментов микробного происхождения (протосубтилин, протомезентерин, прототерризин) методом инъецирования. Такая обработка позволила увеличить выход натуральных полуфабрикатов на 11% за счёт использования для этих целей жёстких частей говяжьих туш.
В США для мягчения соединительной ткани предложено тушу после убоя и разделки шприцевать водным раствором ферментов, содержащим коллагеназу, полученную из Cl. histolyticum и эластазу - из свиной поджелудочной железы.
Результаты исследований по изучению возможности ферментации коллагенсодержащего сырья в колбасном производстве позволили установить следующее:
- применение протосубтилина Г20х как самостоятельного фермента, так и в комплексе с ЭПЖ, вызывает очень значительные деструктивные изменения, в первую очередь, мышечной ткани односортной говядины, не оказывая должного влияния на соединительную;
- ферментация односортной говядины ЭПЖ способствует улучшению физико-химических свойств этого сырья;
-обработку коллагенсодержащего сырья целесообразно проводить на стадии посола мяса или при составлении фарша перед шприцеванием его в оболочку.
Повышенная резистентность коллагеновых и эластиновых волокон к термической дезагрегации предопределяет ряд пороков готовых изделий. Для снижения этих негативных проявлений используют жиловку этого сырья.
Обобщение результатов исследований, выполненных Н.Н. Липатовым, В.Г. Боресковым и др. позволило предположить, что альтернативой операции жиловки при производстве мясопродуктов из сырья с высокой массовой долей соединительной ткани является биотехнологическая модификация такого сырья за счёт воздействия на него протеолитическими ферментными препаратами, обладающими коллагеназной и эластазной активностью.
Ферментирование сырья с высокой массовой долей соединительной ткани способствует повышению скорости диффузионно-фильтрационного распределения посолочных ингредиентов при посоле такого сырья. Авторами [5] доказано увеличение равномерности распределения хлорида натрия при обработке сырья протеолитическими ферментами.
Особое внимание разработке специальных ферментных препаратов уделяется в последнее время в связи с проблемой максимального привлечения вторичных белковых ресурсов и отходов мясной промышленности и созданием безотходных технологий. Обеспечение устойчивого подъёма в этом направлении может быть достигнуто за счет разработки эффективных микробных препаратов. Способностью синтезировать специфические ферменты, расщепляющие животные белки, обладают многие микроорганизмы. Среди них выделяются виды, эффективно гидролизующие белки типа коллагена, эластина, кератина. Показана возможность применения для этих целей протеолитических ферментов на основе Bacillus, Pseudomonas, Streptomyces, Aspergillus, Penicillium.
При использовании коллагенофильного препарата ферментов из Penicillium wortmannii ВКМ – 2091 степень гидролиза коллагенов достигает 60 – 65%.
Анализ гидролизатов указывает на богатый набор и высокое содержание свободных аминокислот: пролина, цистина, валина, аланина, изолейцина, лейцина, фенилаланина, лизина, серина, глутаминовой и аспарагиновой кислот. При этом перевариваемость сырья увеличивается в 2,0 – 2,5 раза. Такие гидролизаты являются прекрасной основой для получения пищевых добавок, модифицированных продуктов и кормовых концентратов.
Ряд методов получения ферментативных гидролизатов предложен французскими исследователями, которые использовали ферменты животного (панкреатин, трипсин, химотрипсин), растительного (фицин, бромелаин, папаин) и микробного (B. subtilis Str. fradiae Str. griseus) происхождения.
В Германии получают гидролизаты из малоценных продуктов переработки тушек птицы. В измельчённое сырьё вносят препараты из B. subtilis, A. оryzae, P. latex, A. melleus. Гидролизат сушат и используют для приготовления супов. При этом потери аминокислот, в частности, лизина, минимальны.
Зарубежные авторы разработали способы получения пищевых гидролизатов путём автолиза сырья содержащимися в нём ферментами. Рекомендовано также получать пищевые гидролизаты из костного остатка после механической обвалки тушек птицы. Согласно этому способу для получения гидролизатов используют микробные протеолитические препараты из B. subtilis, P. latex, A. melleus.
Для более эффективного гидролиза белков животного происхождения предлагается ряд комбинированных способов. При этом применяется предварительная кислотная или щелочная обработка, а затем – ферментативный гидролиз.
В последнее время вырос практический интерес к способам рационального использования малоценных коллагенсодержащих продуктов убоя птицы для получения белковых гидролизатов, которые находят применение не только как компонент пищи, но и как диетический продукт для лечебного питания. Отечественными исследователями проведены работы и достигнуты хорошие результаты по получению гидролизатов из голов и ног сухопутной птицы. Для ферментативной обработки с последующим получением белково-жировой эмульсии предлагается использование препаратов ферментов из P. wortmannii ВКМ-2091 и Str. chromogenes graecus 0832, которые соответственно в большей степени обладают коллагеназной и кератинолитической активностями.
Конкретные условия гидролиза, определённые с помощью методов математической статистики, легли в основу нового способа получения белково-жировой добавки – заменителя основного сырья в рецептурах фаршевых мясных изделий. Способ заключается в следующем: промытые свежие ноги и головы сухопутной птицы измельчают, а затем гомогенизируют с добавлением воды. Это необходимо для разрушения тканевых структур и частичной механической деструкции особенно прочных белков – коллагена и кератина. Измельчённое сырьё (гомогенаты) нагревают до 80 – 90о
С для частичной деструкции упроченных белков. Затем сырьё подвергают ферментативной обработке.
Подготовленные гомогенаты сырья охлаждают и вносят специфическую энзимную композицию на основе микробных препаратов. В результате максимально образуются водорастворимые белковые фракции, перивариваемость гидролизата в 2,0 – 2,5 раза выше, чем исходного сырья.
Изготовленные в соответствии с рекомендациями и технологическими инструкциями готовые изделия имеют хороший товарный вид, высокие вкусовые свойства и биологическую ценность при увеличении выхода на 1,5 – 3,0%.
Аспекты применения на пищевые цели специфического коллагенсодержащего сырья – шквары, получаемой в виде отхода при вытопке жиров и содержащей 22 – 44% белков (в основном коллагенов), известны [3].
Гомогенизированная шквара – ценное белковое сырьё. В её составе присутствуют такие незаменимые аминокислоты, как валин, лизин, фенилаланин. Для улучшения функционально-технологических свойств шквары также целесообразно применение ферментов, специфичных к гидролизу фибриллярных белков. В нейтральной зоне рН при умеренных температурах наиболее эффективными оказались протеолитические препараты глубинной культуры микромицета Penicillium wortmannii.
Полученный гидролизат отличается следующими показателями: значительная доля свободных аминокислот и общие изменения во фракционном составе белков.
В результате нарушения белково-липидных комплексов создаются условия для дополнительного получения жира.
Возможности гидролизатов различного коллагенсодержащего сырья имеют огромные перспективы при получении специальных продуктов питания, в том числе профилактических.
Применение ферментных препаратов при обработке кожевенного сырья является одним из перспективных методов совершенствования технологических процессов кожевенного производства.
Присутствие в шкуре растворимых и нерастворимых компонентов различной химической природы, многоступенчатая структурная организация основного белка шкуры – коллагена – определяют сложный характер реакций при ферментативной обработке.
Среди подготовительных процессов кожевенного производства наиболее трудоёмким является обезволашивание. Наиболее перспективным для всех видов сырья показало себя обезволашивание с помощью ферментов. В достижении эффекта обезволашивания установлена целесообразность применения ферментов, действующих на разные классы соединений дермы – белки, углеводы, жировые вещества, ведущее место среди которых принадлежит специальным протеазам. Основной фактор ускорения процесса – изменение структуры дермы, способствующее увеличению её проницаемости и пористости, скорости проникания фермента к волосяной сумке.
Одним из направлений в проведении ферментативных обработок является применение композиций ферментных препаратов.
Благодаря ферментативным обработкам, потери коллагена на 20 – 30% меньше, чем при традиционных методах, при этом из шкуры удаляется основная масса неколлагеновых белков, углеводов, аминосахаров и происходит разделение структурных компонентов коллагена. Это позволяет проводить последующее золение в более мягких условиях, с уменьшением концентрации химических реагентов и длительности процесса.
Важной операцией в получении мягкой кожи с гладкой шелковистой лицевой поверхностью, является процесс мягчения голья. В процессе мягчения под действием ферментов в голье происходит:
- разложение кератозы, удаление её и других продуктов распада белков, гидролиз остатков эпидермиса, гидролиз и удаление межволоконных веществ, эмульгирование и удаление липидов;
- видоизменение эластиновых волокон;
- разделение коллагеновых волокон на отдельные фибриллы.
Одним из направлений совершенствования процесса мягчения является использование ферментных препаратов, действующих в кислой среде, что даёт возможность объединить в один процесс мягчение и пикелевание. Мягчение в кислой среде способствует получению однородного грифа и текучести по всей площади кожи.
Из-за ряда существенных преимуществ, предпочтение отдаётся микробным препаратам. Среди них положительно опробированны препараты, полученные из грибов Aspergillus, бактерий Bacillus, актиномицетов [1,4].
В результате отбора микробных продуцентов авторами [5] предложены Penicillium wortmannii ВКМ – 2091 и Streptomyces chromogenes s.graecus 0832. Установлено, что Str. chromogenes наиболее кератинофилен, однако по уровню коллагеназной активности этот продуцент был ниже промышленного B. subtilis. Высоким уровнем коллагеназной и кератиназной активности при гидролизе пера отличаются протеолитические комплексы ферментов P. wortmannii, включающие две специфические протеиназы с различными физико-химическими свойствами, удовлетворяющие требованиям мясной промышленности [2].
Целенаправленное применение комплекса ферментов открыло перспективы к созданию принципиально нового подхода к обработке кишечного сырья для получения натуральной колбасной оболочки. При этом трудоёмкие процессы механической обработки возможно заменить применением ферментных препаратов.
Известно, что серозный слой, подлежащий удалению, включает жировые и белковые компоненты. Для их разрушения разработан в Московской государственной технологической академии пищевых производств и получен в опытно-промышленных условиях препарат путём высушивания культуральной жидкости Rhizopus oryzae.
Сравнительные гистологические исследования тканей кишечного сырья, обработанного механическим и ферментативным способами, показали полностью идентичную структуру. Однако в случае ферментативной обработки поверхность не деформирована, на ней полностью отсутствуют штрихи, порезы и другие механические дефекты.
Разработанное техническое решение имеет ряд преимуществ: полностью заменяется сложное электромеханическое оборудование по разрыхлению и удалению серозных слоёв (шляма), отсутствуют разрывы кишок, повышается качество сырья, улучшаются условия труда.
Основной задачей получения коллагеновых масс является максимальная очистка исходного сырья и выделение целевого продукта – коллагена – в свободном от примесей виде. В качестве ферментных препаратов используют прототерризин П10х (источник Asp. terricoba) или протосубтилин Г10х (источник Bac. subtilis). Способ характеризуется высокой степенью очистки исходного сырья от балластных компонентов под действием ферментов микробиального происхождения, их низкой себестоимостью, высокой степенью экологичности производства.
Сложность и трудоёмкость приготовления препаратов ферментов, потеря значительной доли коллагена в результате неполной его экстракции и денатурации под влиянием повышенной температуры, действующей длительное время, снижают значение методов обработки коллагена протеолитическими ферментами животного и растительного происхождения. Новые перспективы и реальная возможность внедрения биотехнологических методов в производство возникает при использовании микробных ферментных препаратов, отличающихся высокой стабильностью, возможностью варьировать специфику биохимических свойств. Было проведено изучение эффективности ферментативного гидролиза балластных компонентов различных коллагенсодержащих источников с применением ряда микробных препаратов: протосубтилина, протомегетерина, липоризина, выделенных из соответствующих микроорганизмов (B. subtilis, B. megaterium, R. oryzae).
Таким образом, для мясной промышленности наибольшую перспективу имеют микробные ферментные препараты и клетки, характерные специфической активностью в отношении фибриллярных белков упроченной структуры.
Оценка эффективности биотехнологий переработки коллагенсодержащего сырья предполагает экономию 10 – 20% основного сырья при получении полноценных мясных продуктов и 70 – 100% - в случае выработки искусственных оболочек и плёнок.
Применение специфических ферментных препаратов и клеток позволяет осуществить принципиально новые технологии глубокой и комплексной переработки основного, вторичного сырья и не пищевых отходов с реализацией режимов в естественных диапазонах температуры, рН среды и давления, минимальными энергозатратами, без дополнительных капитальных вложений и нежелательных экологических воздействий.
ГЛАВА 2. МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
2.1 Определение величины рН.
Величину рН определяли потенциометрически на рН-метре ЛПУ-01. Для измерений значений рН растворов в температуре отличной от 20o
С, применяли автоматическую компенсацию.
2.2 Метод определения протеолитической активности.
Протеолитическую активность (ПА) определяли по ГОСТ 20264.2-74 [12]. Субстратом служил 2% раствор казеината натрия, к которому добавляли 2см3
раствора фермента и помещали в ультратермостат при температуре 30o
С. После проведения гидролиза в течение 10 минут в опытную пробирку приливали 4см3
раствора трихлоруксусной кислоты. Выдерживали ещё 20 минут при температуре 30o
С. Затем фильтровали в сухие пробирки. К 1см3
фильтрата добавляли 5см3
0,5М раствора карбоната натрия, перемешивали и добавляли 1см3
рабочего раствора Фолина. Через 30 минут измеряли оптическую плотность раствора на ФЭКе КФК-2 при 670 нм в кюветах с поглощающим свет слоем 10 мм против контроля. За единицу ПА принимают такое количество фермента, которое за 1 минуту при 30o
С катализировало переход в неосаждаемые трихлоруксусной кислотой продукты гидролиза казеината натрия в количестве, соответствующем 1 ммолю тирозина (1ммоль тирозина равен 0,181мг).
2.3 Определение коллагеназной активности.
Коллагеназную активность определяли по содержанию оксипролина в смеси, образовавшегося в результате действия фермента на нативный коллаген. С этой целью готовили реактив для окисления: 28,2 г хлорамина Т растворяли в 40см3
воды для получения 0,05М концентрации, добавляли 60см3
ацитат-цитратного буфера с рН 6,0. К 2см3
анализируемой пробы, содержащей 2 - 20 см3
оксипролина, приливали 1мл реактива для окисления, встряхивали и оставляли на 20 минут при комнатной температуре. Затем в смесь вносили 2 – 1 см3
4М хлорной кислоты, встряхивали и через 5 минут приливали 3см3
10% раствора n-диметиламинобензальдегида в метилцеллосольфе. Пробу нагревали 15 минут в водяной бане при 150о
С и после охлаждения фотометрировали с зелёным светофильтром на ФЭК-56М (555нм).
Гидролиз коллагена вели в следующих условиях: 20 мг нативного коллагена обрабатывали исследуемым ферментным препаратом в присутствии буферной системы с рН 7,0 так, чтобы общий объём составил 25см3
. Смесь инкубировали в течение 1 часа при 37o
С. Контролем служили пробы, инкубированные в тех же условиях, но без фермента, предварительно остановив реакцию внесением 0,5см3
этанола и центрифугированием смеси в течение 15 минут при 6000 ч×мин-1
.
Активность коллагеназы выражали либо в ммолях оксипролина на 1 мг белка за 60 минут, либо в процентах растворения.
2.4 Определение молекулярной массы фермента.
Молекулярную массу определяли с помощью гель-фильтрации на сефадексе У-100. Расчёт проводили по формуле:
LgM=5,941-0,847 (V/V0
),
где V – объём выхода фермента;
V0
– свободный объём колонки.
2.5 Определение содержания аминного азота.
Метод основан на образовании цветного комплекса при взаимодействии аминогрупп аминокислот с гидроксидом меди. В пробирку, содержащую 100 мг сухого медного реактива, вносили 4см3
анализируемой пробы, предварительно нейтрализованной сухим бикарбонатом натрия, выдерживали 15 минут периодически встряхивая. Затем центрифугировали и измеряли оптическую плотность на ФЗКе КФК-2 при 590 нм. В контроле вместо 4см3
пробы присутствовало 4см3
дистилированной воды. Содержание аминного азота рассчитывали по калибровочной кривой, построенной для известных аминокислот.
2.6 Электрофоретические исследования.
2.6.1 Определение гомогенности очищенных препаратов.
Электрофорез проводили по методу Дэвиса на приборе фирмы Reanol (Венгрия) в щелочной буферной системе, рН 8,9. Концентрация акриламина в мелкопористом геле составила 5%. Длина мелкопористого геля в трубочке составила 5,5 см. Растворы для полимеризации готовили обычным способом. Исследуемый образец, содержащий 20 – 30 мкг белка смешивали в соотношении 1 : 1 с 40% раствором сахарозы и наносили на трубочку с гелем. Объём образца не превышал 0,2 см3
. Поверх образца осторожно наслаивали электродный буфер, который содержал в 1 л 0,6 г трис-(гидроксиметил)-амино-метана и 2,88 г глицина.
В верхний резервуар прибора вносили 1 см3
0,001% раствора бромфенолсинего для контроля за движением фронта подвижных ионов. В первые 10 – 15 минут сила тока составила 1мА на трубочку, а затем 2,5мА. После окончания электрофоретического разделения гели вынимали из трубочек и проводили окрашивание. Окрашивание проводили раствором амидочерного с массовой долей 0,5, приготовленного с массовой долей 7 уксусной кислоты. Окрашивание проводили 20 – 30 минут. Краситель отмывали с массовой долей 7 уксусной кислотой с многократной сменой раствора.
2.6.2 Идентификация протеиназ в ПААГ [16].
Для проявления в гелях полос с протеиназой их выдерживали в денатурированном растворе гемоглобина 2% концентрации в течение 15 – 30 минут при температуре 30o
С. Затем промывали несколько раз дистиллированной водой и переносили в раствор амидочерного. Проводили окрашивание в течение 20 – 30 минут. Краситель отмывали 7% уксусной кислотой. Если в гелях присутствовала протеиназа, то появлялись белые полосы.
Все опыты, описанные в работе, проводили 3 –4 раза, аналитические определения для каждой пробы проводили в двух – трёх повторностях. В таблицах и на рисунках показаны данные типичных опытов, причем каждое значение есть среднее из двух или трех определений. Обсуждаются только те результаты, которые были воспроизводимы в каждом опыте.
ГЛАВА 3. ПОЛУЧЕНИЕ ПРЕПАРАТОВ ПРОТЕИНАЗЫ
PENICILLIUM WORTMANNII 2091 И ИССЛЕДОВАНИЕ ИХ
ФИЗИКО-ХИМИЧЕСКИХ СВОЙСТВ.
Известно, что микроорганизмы синтезируют богатые набором ферментов комплексы. Поэтому важным этапом в получении препаратов направленного действия является изучение условий их выделения, очистки от сопутствующих биологически активных и баластных веществ. В связи с малой изученностью представителей грибов Penicillium этот этап представляет особую важность.
3.1 Разработка условий выделения препарата
Penicillium wortmannii BKMF 2091.
Для выделения ферментов из различных сред в лабораторных условиях и в промышленности чаще всего применяют органические растворители и нейтральные соли.
Эффект осаждения белков органическими растворителями, как известно [7], основан на явлении уменьшения сольватации полярных групп фермента. Молекулы воды, расположенные на гидрофобных участках поверхности белка, могут быть замещены на молекулы органического растворителя. При этом растворимость белков падает, происходит агрегирование и осаждение белковых молекул.
В качестве осадителей использовали 96,5% этанол, 98,0% изопропанол, химически чистый ацетон и сульфат аммония. Органические растворители и сульфат аммония добавляли к охлажденной до 0 – 4o
С культуральной жидкости Pen. Wortmannii 2091 при различных значениях рН и постоянном перемешивании. Образовавшийся осадок отделяли центрифугированием, растворяли в небольшом объёме дистиллированной воды и определяли протеолитическую активность.
Результаты исследования влияния рН на полноту осаждения протеолитического комплекса при концентрации растворителей 60% представлены на рис. 1, из которого видно, что оптимальным является значение рН 7,5 при использовании всех видов органических растворителей. Вероятно, изоэлектрическая точка для данного фермента лежит в этой области рН.
В дальнейшем нами проводились исследования по влиянию концентрации органических растворителей на выход фермента при оптимальном значении рН. Наблюдалось монотонное осаждение фермента при последовательном увеличении концентраций осадителей, выход фермента возрастал до определённого предела (табл. 1).
Как видно из табл. 1, концентрация органических растворителей значительно влияет как на выход протеолитического комплекса, так и на степень его очистки. При использовании этанола наиболее эффективной для выхода ПА была концентрация 72,0%. Степень очистки 1,27. Максимальный выход 98,5% по активности.
Оптимальная концентрация ацетона 66,6% (в объёмных соотношениях 1: 2). Степень очистки была более высокой, чем для этанола (1,5 раза) – однако выход по активности всего 62%. Лучшим органическим осадителем для протеиназы Pen. Wortmannii 2091 явился изопропанол. При концентрации его в смеси 50% выход протеиназы составил 90, 5%, степень очистки 2,78 и удельная активность 3,06.
Таким образом, изопропанол избирательно осаждает протеолитические ферменты, что повышает степень их очистки и снижает содержание баластных примесей. Однако на практике вполне можно использовать и этанол.
В дальнейшем проведены исследования по осаждению протеиназы сульфатом аммония. Было установлено, что при оптимальных условиях (степень насыщения 0,8 рН 7,5) выход фермента составил всего 23%. Низкий вы-
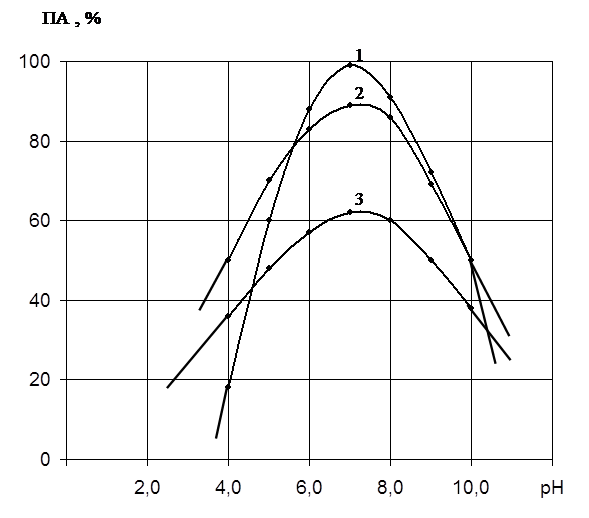 |
Рис. 1. Влияние величины рН на осаждение протеолитического
комплекса различными растворителями:
ось абсцисс – величина рН;
ось ординат – выход по активности в %;
1 – этанол; 2 – изопропанол; 3 – ацетон.
|
|
Таблица 1
Получение препарата протеиназы из культуральной жидкости Penicilliumwortmannii 2091
осаждением органическими растворителями.
| Содержание осадителя |
Общая активность, ед |
Белок, мг/см3
|
Общий белок, мг |
Вес препаратов, мг |
Удельная активность, ед/мг белка |
Выход по активности, % |
Очистка |
| В объёмных отношениях |
В % |
| Ацетон |
| Культуральная жидкость рН 7,5 |
| - |
- |
2,5 |
2,250 |
62,5 |
- |
1,10 |
100,0 |
1,00 |
| 1:1 |
50 |
179,0 |
0,180 |
21,6 |
120 |
0,99 |
17,4 |
0,90 |
| 1:2 |
66,6 |
222,0 |
0,133 |
46,4 |
349 |
1,67 |
62,0 |
1,50 |
| 1:3 |
75,0 |
213,0 |
0,233 |
51,9 |
223 |
0,91 |
38,0 |
0,82 |
| 1:4 |
80,0 |
203,0 |
0,216 |
64,6 |
299 |
0,94 |
49,0 |
0,85 |
| Изопропанол |
| Культуральная жидкость рН 7,5 |
| - |
- |
2,5 |
2,250 |
62,5 |
- |
1,10 |
100,0 |
1,00 |
| 1:1 |
50,0 |
392,0 |
0,128 |
36,9 |
288 |
3,06 |
90,5 |
2,78 |
| 1:2 |
66,6 |
385,4 |
0,232 |
67,4 |
290 |
1,65 |
92,0 |
1,50 |
| 1:3 |
75,0 |
215,0 |
0,282 |
211,5 |
350 |
0,76 |
60,0 |
0,69 |
| 1:4 |
80,0 |
183,0 |
0,132 |
42,2 |
320 |
1,39 |
46,0 |
1,26 |
| Этанол |
| Культуральная жидкость рН 7,5 |
| - |
- |
2,5 |
2,250 |
62,5 |
- |
1,10 |
100,0 |
1,00 |
| 1:1 |
48,0 |
320,3 |
0,396 |
85,1 |
215 |
0,80 |
55,0 |
0,73 |
| 1:2 |
64,0 |
366,7 |
0,340 |
90,1 |
265 |
1,08 |
77,6 |
0,98 |
| 1:3 |
72,0 |
385,4 |
0,276 |
135,2 |
320 |
1,40 |
98,5 |
1,27 |
| 1:4 |
80,0 |
349,6 |
0,250 |
160,0 |
335 |
1,40 |
93,7 |
1,27 |
ход фермента не позволил в дальнейшем использовать эту соль для получения препарата Pen. Wortmannii BKMF 2091.
Из анализа вышеприведённых данных можно сделать вывод, что для осаждения препарата протеиназы целесообразно применение этанола и изопропанола. В зависимости от назначения препарата возможно применение этого или иного растворителя с практически одинаковым эффектом.
3.2 Фракционирование протеолитического комплексного
препарата ферментов.
Полученный осаждением органическими растворителями препарат нами назван „протовортманин Г10х”. В дальнейшем представляло интерес изучить его компонентный состав и идентифицировать протеолитические фракции. Для этого был использован метод дискового электрофореза в ПААГ. Электорофорез вели с учётом „нейтральной’’природы протеолитического комплекса.
Компонентный состав препарата представлен четырьмя фракциями, отличающимися подвижностью в электрическом поле, размерами и интенсивностью окраски белковых полос.
Идентификацию протеолитических фракций проводили двумя способами: насыщением ПААГ денатурированным гемоглобином (pH 7,2) после дискового электрофореза и последующим выявлением прогидролизованных участков; экстракцией белкового спектра из ПААГ дистиллированной водой с определением протеолитической активности в экстрактах.
При гидролизе гемоглобина в ПААГ обнаружены две протеолитические фракции, которые проявились в виде двух светлых полос. Это свидетельствовало о том, что комплекс ферментов, гидролизующий белки в нейтральной области pH сложен и представлен двумя фракциями. Аналогичными были данные при использовании метода экстракции белковых полос из геля.
Таким образом, используя методы дискового электофореза было установлено, что компонентный состав полученного препарата представлен четырьмя фракциями, две из которых протеолитические. Кроме активного протеолитического комплекса препарат „протовортманин Г10х” содержал в своём составе глюкоамилазу (ГЛА 20ед/г) и альфаамилазу (3ед/г), сопутствующие ферменты, а также баластные вещества. Для получения гомогенных протеолитических фракций необходимо ввести более глубокую очистку.
3.3 Влияние температуры и рН на активность фермента.
Нами была поставлена цель определить рН и температурные оптимумы действия выделенных протеиназ Penicillium wortmannii 2091 и дать их сравнительную характеристику.
Нужное значение рН субстрата поддерживали с помощью 0,1М универсального буфера. Гидролиз вели при температуре 30о
С в течение 30 минут. Ферментативную активность определяли стандартным методом [12].
Как видно на рис.2, препарат проявляет определённую активность в широкой зоне рН. Однако максимум активности наблюдается при различных значениях рН. Протеиназа 1 имеет оптимальное значение рН 7,2, в то время как протеиназа 2 – 10,0. Таким образом, протеиназа 1 имеет нейтральную природу, а протеиназа 2 – щелочную.
Температурный оптимум действия ферментов определяли в интервале температур 30 – 80о
С при оптимальных значениях рН 7,2 и 10,0. На рис.3 показано влияние температуры на активность ферментов. Для протеиназы 1 максимальный гидролиз наблюдается при температуре 60о
С, а протеиназы 2 – 40о
С.
Таким образом, протеолитический комплекс Penicillium wortmannii 2091 представлен двумя ферментами, имеющими различные температурные и рН – оптимумы.
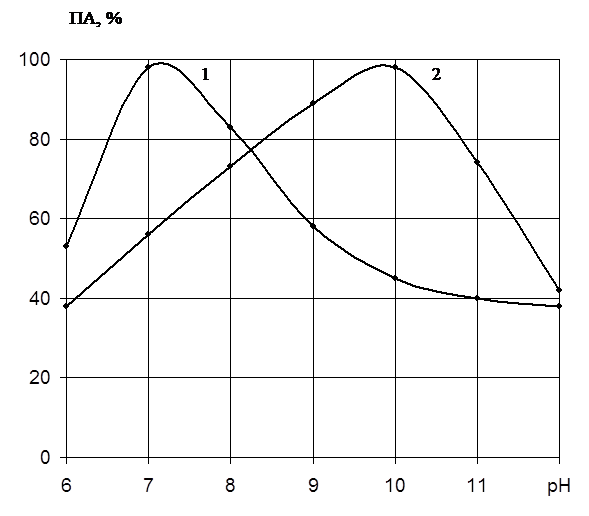 |
Рис. 2. Влияние рН на активность протеолитических фракций
протеиназ Pen. wortmannii BKMF 2091:
Ось абсцисс: величина рН;
Ось ординат: ПА, выход по активности, %;
1 – протеиназа I;
2 – протеиназа II.
|
|
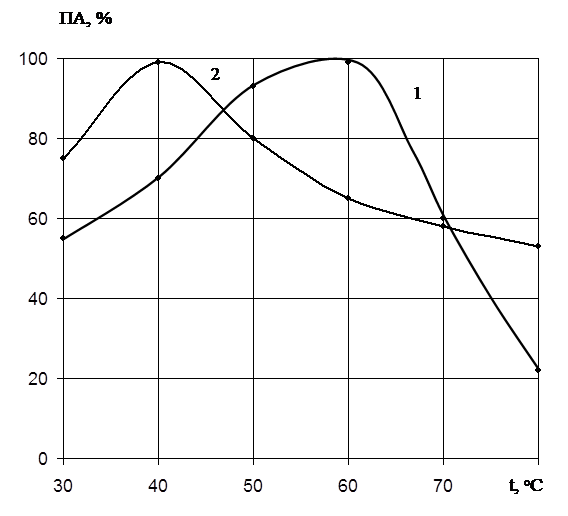 |
Рис. 3. Влияние температуры на активность
протеолитических ферментов Pen.
wortmannii 2091:
1 – протеиназа I;
2 – протеиназа II;
Ось абсцисс: температура о
С;
Ось ординат: ПА, выход по активности, %.
|
|
3.4 Определение молекулярной массы.
Молекулярную массу ферментов Penicillium wortmannii 2091 определяли методом гель-фильтрации на сефадексе У-100 [8].
Установлено, что соотношение объёма элюента, необходимого для выноса исследуемого белка из колонки (V – объём элюента) и объёма элюата, размещающемся в свободном (не занятом гранулами сефадекса) пространстве колонки (V0
– свободный объём), обратно пропорционально величине молекулярной массы белка. Для расчёта использовали формулу:
LgM=5,941-0,847 V/V0
Молекулярная масса протеиназы 1 оказалась равной 34500, протеиназы 2 – 20800, т.е. обе фракции относятся к низкомолекулярным белкам.
3.5 Исследование процессов кислотной и термической инактивации.
Изучение термо- и рН-стабильности ферментов часто несёт прикладной характер.
Исследование этих характеристик проводится остаточной активностью фермента после выдержки его раствора в течение некоторого времени при определённых рН и температуре [11].
Нами были проведены исследования кинетики кислотной и термической инактивации протеиназ Penicillium wortmannii 2091 и рассчитаны кинетические параметры этого процесса.
При изучении термо- и рН –стабильности раствор препарата выдерживали в фосфатном буфере в диапазоне рН от 5,0 до 12,0 и температур от 30 до 60о
С. Периодически отбирали аликвотные доли раствора и определяли остаточную протеолитическую активность.
Полученные результаты по инактивации обоих ферментов показали, что протеиназа 1 сохраняет активность в широком диапазоне рН. При значении рН 7,0 через 200 часов фермент сохраняет около 90% активности (рис.4). При значениях рН 6,0 – 9,0 активность фермента снижается до 70 – 75%, это указывает на то, что фермент в указанном интервале не подвержен автолизу, а, следовательно, его нативная конформация обладает высокой стабильностью. При значениях рН ниже 6,0 и выше 11,0 каталитическая активность фермента быстро снижается.
Во всех случаях ПА/КлА-const, это свидетельствует о том, что мы имеем дело с одним ферментом.
Термическую инактивацию протеиназ изучали в интервале температур 30 – 60о
С. Протеиназа 1 в области высокой рН-стабильности инактивируется почти полностью при температуре 60о
С в течение 60 часов, в то время как протеиназа 2 при этой же температуре инактивируется полностью уже за 3 часа. Данные свидетельствуют о высокой термостабильности протеиназы 1. Инактивация протеиназы 2, происходящая при высокой температуре, по-видимому, определяется процессом разворачивания белковой глобулы.
Протеиназа 1, обладающая коллагенолитическим действием, нас интересует с практической точки зрения, поэтому были рассчитаны некоторые кинетические характеристики для этого фермента.
Если предположить, что в каждом элементарном акте процесса инактивации фермента под действием Н+
- ионов участвует одна его молекула, то кислотную инактивацию можно представить в виде реакции первого порядка. Кинетическое уравнение первого порядка имеет вид:
2,303 lg E0
/E=K,
где Е0
– исходная активность фермента
Е – активность в момент времени
К – константа скорости инактивации, характеризующая потерю активности в течение часа, час-1
.

Остаточную активность выражали в процентах от исходной и затем использовали в расчётах констант инактивации. Величину находили, как среднее из 5 – 6 определений (табл.2).
Таблица 2.
Кислотная инактивация протеиназы 1 при температуре 500
С.
| t, ч |
Значения рН |
| 5,0 |
7,0 |
9,0 |
11,0 |
| Е |
К*103
ч-1
|
Е |
К*103
ч-1
|
Е |
К*103
ч-1
|
Е |
К*103
ч-1
|
| 0 |
100 |
2 |
100 |
2 |
100 |
2 |
100 |
2 |
| 12 |
65,1 |
37,0 |
100 |
2 |
100 |
2 |
63,2 |
38,1 |
| 24 |
45,2 |
33,6 |
92,3 |
2,33 |
92,3 |
2,33 |
42,3 |
36,0 |
| 48 |
16,8 |
37,7 |
88,0 |
2,54 |
87,8 |
2,54 |
18,1 |
36,3 |
| 96 |
7,6 |
36,8 |
81,0 |
2,23 |
81,5 |
2,19 |
7,0 |
37,1 |
| 120 |
6,7 |
35,7 |
66,3 |
2,50 |
68,2 |
2,30 |
6,5 |
37,7 |
| 144 |
6,5 |
33,1 |
62,2 |
2,56 |
60,9 |
2,54 |
6,0 |
34,0 |
Как видно из табл.2, при определённом рН, значения констант достаточно близки друг к другу, максимальное отклонение от средних значений не превышает 10 – 15%, что вполне допустимо в исследованиях кинетики химических реакций. Это свидетельствует о том, что процесс инактивации протеиназы 1 является реакцией первого порядка. Различия в значениях при рН 5,0 и 11,0 и при рН 7,0 – 10,0 на целый порядок ещё раз указывают на лабильность фермента в слабо - кислой и слабо - щелочной зонах.
Исследования термической инактивации протеиназы 1 при различных значениях рН позволили рассчитать константы инактивации для температур 30, 40, 50, 60о
С, а затем найти термодинамические параметры этого процесса.
Термодинамические расчёты были проведены только для вышеуказанных температур (табл.3).
Таблица 3.
Термодинамические характеристики активированного комплекса
протеиназы I.
| t, o
C |
PH |
Еакт
|
DН¹
|
DF¹
|
DS
Дж*К-1
*моль-1
|
| Дж*моль-1
|
| 30-60 |
5,0 |
245,8 |
244,6 |
53,2 |
600,3 |
| 30-40 |
7,0 |
75,6 |
72,0 |
68,1 |
13,6 |
| 40-60 |
7,0 |
300,5 |
298,2 |
60,0 |
734,9 |
| 30-40 |
9,0 |
72,4 |
71,0 |
69,9 |
9,9 |
| 40-60 |
9,0 |
295,9 |
294,1 |
60,0 |
723,9 |
| 30-40 |
11,0 |
255,9 |
253,6 |
54,9 |
624,3 |
Поскольку инактивация протеиназы была необратимой, для определения энтальпии DН¹
, свободной энергии DF¹
и энтропии DS¹
воспользовались теорией абсолютных скоростей Эйринга.
При повышении температуры скорость инактивации возрастает. Это можно объяснить тем, что тепловая энергия разрушает гидрофобные взаимодействия, которые играют важную роль в стабильности белков. В результате происходит развёртывание полипептидной цепи, что подтверждается высокими значениями DS¹
и согласуется с литературными данными.
Таким образом, изменение величины рН вызывает разрушение электростатических сил, и решающую роль в этих условиях в процессе инактивации играют, по-видимому, гидрофобные взаимодействия.
3.6 Влияние ионов металлов и ингибиторов на активный центр фермента.
Главным признаком, используемым при отношении протеолитических ферментов к тому или иному классу, является строение каталитического центра.
Отправной точкой в изучении строения активного центра, механизма катализа является идентификация функциональных групп, что достигается комплексными исследованиями и, в первую очередь, применением специфических ингибиторов. В наших опытах в качестве ингибиторов были использованы ЭДТА, монойодуксусная кислота, n-хлормеркурийбензоат натрия, фенилметилсульфатонилфторид, диизопропилфторфосфат, перманганат калия.
Растворы ферментов, содержащие 5×10-3
М этих соединений, выдерживали при 30о
С в течение одного часа.
Как показали результаты опытов, протеиназа 1 полностью инактивировалась ЭДТА – ингибитором металлоферментов, остальные ферменты не изменяли протеолитическую активность.
Протеиназа 2 инактивировалась монойодуксусной кислотой и n-хлормеркурийбензоатом натрия на 84 и 63% соответственно. Фермент терял активность при воздействии фенилметилсульфатонилфторидом и диизопропилфторфосфатом, это даёт возможность предположить, что протеиназа 2 относится к «сериновым». Не оказывал влияния не на одну из протеиназ перманганат калия, что свидетельствует об отсутствии в активном центре карбоксильной группы.
На основе полученных данных можно предположить, что протеиназа 1 относится к «металлоферментам», а протеиназа 2 – к «сериновым».
В дальнейшем было интересно рассмотреть влияние на протеиназы гистидина. На протеиназу 2 он не оказывал ингибирующего действия, в то время как полностью ингибировал протеолитическую и коллагеназную активности протеиназы 1. Из литературы известно, что гистидин является ингибитором коллагеназ. В связи с чем очевидно, что протеиназа 1 является ферментом, проявляющим свойства протеиназы с коллагеназным действием..
К специфическим реагентам относятся также ионы металлов. Они могут оказывать ингибирующий или активирующий эффект. В наших опытах мы использовали соли двухвалентных металлов в виде хлоридов и концентрации 0,005М. Фермент выдерживали в соли, а затем определяли остаточную активность. Ионы Mn2+
,Ca2+
,Ba2+
практически не оказывали никакого влияния на активность обеих протеиназ; Zn2+
, Co2+
незначительно ингибировали оба фермента,ионы Cd2+
,Cu2+
ингибировали протеиназу 1, а протеиназа 2 ингибировалась ионами Fe2+
,Ni2+
,Cd2+
,Cu2+
. Результаты представлены в таблице 4.
Таблица 4.
Влияние ионов металлов на активность протеиназ Penicillium wortmannii 2091.
| Ион металла С=0,005М |
Ферментная активность, % от исходной. |
| Протеиназа I |
Протеиназа II |
| Mn2+
|
100,0 |
95,39 |
| Ca2+
|
100,0 |
100,0 |
| Ba2+
|
100,0 |
100,0 |
| Zn2+
|
95,2 |
95,2 |
| Co2+
|
93,9 |
95,2 |
| Cu2+
|
34,5 |
19,2 |
| Cd2+
|
20,4 |
20,8 |
| Ni2+
|
98,5 |
67,5 |
| Fe2+
|
97,9 |
44,9 |
3.7 Субстратная специфичность.
В изучении протеолитических ферментов значительное место занимают исследования специфичности их действия. В литературе нет сведений, касающихся вопроса специфичности действия протеиназ грибов рода Penicillium. В связи с этим исследовалась способность протеиназы 1 кгидролизу некоторых пептидных связей.
Исследования проводили на синтетических пептидах и различных белках. Результаты показали, что протеиназа 1 гидролизовала довольно широкий спектр пептидных связей. Она разрывала связи в пептидах: цис – ала, про – ала, гли – лей, гли – мет, ала – гли – гли, ала – гли – фен. Следует отметить, что гидролизу подвергались связи, характерные для белков животного происхождения. В связи с этим мы исследовали специфичность действия протеиназы на животных белках. В качестве субстратов использовались: казеин, гемоглобиин, денатурированный мочевиной, кератин, коллаген, желатина. При одной и той же концентрации фермента наиболее активно расщепляется казеин (78 – 80%) и гемоглобин (60 – 62%), затем слабее желатина и коллаген. Менее всего гидролизу подвергается кератин (22 – 25%) (рис.5).
3.8 Гидролиз коллагенсодержащего сырья: ноги птиц, шквара.
Мясная промышленность располагает значительным количеством шквары, получаемой при перетопке говяжьего и свиного жиросырья. Анализ химического состава шквары свидетельствует о значительном содержании в ней белковых веществ и подтверждает целесообразность её использования как в колбасном, так и ряде других производств. Общее содержание белка в шкваре колеблется в пределах 65 – 80%. В состав белков входят 22 – 44% коллагена и 19 – 30% эластина. Однако использование шквары ограничивалось из-за большого содержания соединительной ткани. В настоящее время соединительную ткань рассматривают не как билластное вещество, а как необходимый компонент питания [10]. В связи с этим возрастает практический интерес к рациональному и полному использованию шквары на пищевые цели, разработке путей повышения её биологической ценности. Это направление явилось основой разрабатываемой нами темы.
Для получения гидролиза шквары целесообразно использование протеиназ, расщепляющих белки в нейтральной зоне рН и действующих на коллаген.

Нами был проведён сравнительный анализ промышленных препаратов, обладающих этими свойствами и полученного препарата (табл. 5).
Таблица 5.
Характеристика протеолитических свойств и степени гидролиза гомогената шквары под действием различных ферментных препаратов.
| Фермент |
Массовая доля, % |
рН |
ПА, ед/см 3
|
Аминный азот, мг на см3
субстрата |
| Протовортманин |
0,1 |
7,2 |
0,838 |
7,616 |
| Протосубтилин |
0,1 |
7,2 |
0,0476 |
5,068 |
| Панкреотин |
0,1 |
7,2 |
0,0570 |
4,868 |
| Пепсин |
0,1 |
7,2 |
- |
- |
| Пигмауесин |
0,3 |
7,2 |
- |
- |
| Контроль |
- |
7,2 |
- |
0,000 |
Контролем служила среда, где вместо фермента была добавлена дистилированная вода в аликвотном количестве.
Согласно полученным результатам,препарат протовортманин наиболее эффективен при получении белкового гидролизата.
В дальнейшем нами были определены условия эффективной работы фермента. Наши исследования ограничивались изучением влияния гидромодуля среды, температуры, продолжительности гидролиза, дозировки препарата, т. е. параметров, играющих решающее значение для разрабатываемой технологии и влияющих на экономику процесса.
Протеолитические ферменты катализируют реакцию расщепления белков с участием воды. В связи с этим важным моментом в подборе условий гидролиза является определение минимального гидромодуля для высокого гидролиза субстрата.
Постановка эксперимента заключалась в следующем: в семь колб объёмом в 100см3
вносили по 10 г гомогената шквары, затем одновременно раствор ферментного препарата и соответствующий объём воды. После внесения фермента и воды колбы закрывали и ставили на 3 часа в ультратермостат при 50о
С. Результаты эксперимента оценивали по степени накопления аминного азота (рис.6). Как видно на рисунке 6 для активного гидролиза белков сырья достаточен гидромодуль гомогенат / вода = 1/1 : 1,5. Дальнейший рост содержания воды в среде увеличения степени гидролиза не даёт.
Решающее значение в ферментативных реакциях имеет температура: при низких температурах фермент может быть практически не активен, а высокие температуры могут привести к инактивации фермента. Поэтому при постановке этого эксперимента особое внимание уделялось поддержанию строгого температурного режима. Эксперимент проводился в трёх поверхностях. В 15 колб по 100см3
вносили 10 г гомогената. Колбы помещали в термостаты при температурах 20, 30, 40, 50, 60о
С. Затем вносили по 3см3
фермента и 12см3
воды (согласно ранее полученным данным), плотно закрывали и вели гидролиз в течение 3 часов. По истечению 3 часов из каждой колбы отбирали по 10см3
субстрата и определяли аминный азот по методике Серенсена. Результаты представлены на рис. 7. Как видно на рис.7 наибольшее накопление аминного азота, а, следовательно, и максимальная степень гидролиза наблюдается при температуре 50о
С. При температурах 20, 30, 40о
С гидролиз, видимо, идёт не до конца, т. е. эти температуры не обеспечивают достаточной катализирующей способности ферментного препарата и требуют увеличения продолжительности процесса гидролиза, что с точки зрения технологического процесса очень невыгодно.
Температура 60о
С приводит, по-видимому, к частичной инактивации фермента. Дальнейшее увеличение температуры приведёт, скорее всего к полной инактивации фермента, поэтому исследование действия ферментного препарата при температурах выше 60о
С не имеет смысла.
Таким образом, оптимальная температура гидролиза субстрата препаратом из Penicillium wortmannii 2091 равна 50о
С.


Дальнейшим этапом нашей работы было определение дозировки препарата. Дозировка препарата в большей степени отражается на экономической стороне процесса, так как ферментные препараты пока ещё имеют достаточно высокую стоимость. Эксперимент проводился по аналогии с предыдущим с учётом оптимальной температуры и внесением различного количества ферментного препарата. Фермент вносили (по ПА) в количестве 2,0, 2,5, 3,0, 4,0, 5,0 ед. (в расчёте на 10 г гомогената). После трёх часов гидролиза определяли аминный азот. Результаты представлены на рис.8.
Исходя из полученных в ходе эксперимента данных можно сделать вывод о целесообразности внесения 4,0 ед. (по ПА) ферментного препарата в расчёте на 10 г белкового сырья.
Время гидролиза, необходимое для течения реакции, отражается на продолжительности всего технологического процесса. Именно с целью определения минимального времени гидролиза с максимальным эффектом накопления аминного азота был поставлен следующий эксперимент: гомогенат в количестве 40 г, с выбранным гидромодулем, помещали в термостат при 50о
С и добавляли раствор фермента в оптимальном количестве. Пробы отбирали каждый час с момента внесения фермента. Эксперимент проводился в трёх повторностях.
Анализируя результаты можно сказать, что первые пять часов идёт накопление аминного азота, следовательно, гидролиз ещё не окончен и целесообразно его продолжать. После 6 – 7 часов гидролиза изменение аминного азота незначительно, т. е. процесс гидролиза, видимо, находится на стадии завершения.
Таким образом, оптимальная продолжительность процесса гидролиза укладывается в 6 часов.
Для того, чтобы судить о ценности полученного гидролиза была проведена оценка полученного продукта в сравнении с исходным сырьём (табл. 6).

Таблица 6.
Характеристика химического состава исследуемых продуктов.
| Показатель |
Гомогенат шквары |
Гидролизат шквары |
| Плотность, кг/м3
|
1,005 |
1,005 |
| рН |
7,75 |
7,40 |
| Сухие вещества, % |
8,4 |
8,4 |
| Жир, % |
2,2 |
2,2 |
| Общий азот, % |
7,25 |
7,25 |
| Белковый азот водорастворимый, % |
2,5 |
0,91 |
| Аминный азот, мг/г |
1,6 |
11,0 |
| Вязкость |
42 |
4,2 |
Анализируя данные таблицы 6 можно сделать следующие выводы: полученный гидролизат значительно отличается по свойствам от исходного продукта. Гидролизат шквары характерен накоплением большого количества свободных аминокислот, о чём свидетельствует резкое увеличение аминокислот азота и снижение рН среды. Как показали наши исследования, заметные изменения произошли во фракционном составе белковых компонентов. В результате гидролиза высота нерастворённого осадка продукта уменьшилась в 4 раза, почти в 4 раза уменьшилось содержание водорастворимых белков. Накопление низкомолекулярных продуктов распада белков, видимо, является причиной потери желирующих свойств водорастворимой фракции и снижения вязкости среды в 10 раз.
Снижение жира практически не изменилось, т. е. фермент не обладает липазной активностью. Анализ свойств гидролизата дал возможность судить о ценности белкового продукта, полученного из шквары и возможности использования его в производстве в качестве заменителя основного сырья.
Мясная промышленность располагает большими резервами увеличения выработки ценных пищевых продуктов. В настоящее время большое внимание уделяется рациональному использованию малоценных продуктов убоя и переработки птицы для получения белковых гидролизатов, которые находят широкое применение не только как компонент пищи, но и как диетический продукт для лечебного питания.
Питательная ценность белковых пищевых гидролизатов зависит от технологии их производства. В мировой практике широко используются процессы кислотного и щелочного гидролиза белков. Однако они имеют ряд недостатков. Так при щелочном гидролизе практически полностью разрушается серин, треонин, аргенин, цистеин. Полученные гидролизаты обладают неприятным вкусом. Кислотный гидролиз протекает быстрее и более специфично. Ферментативный гидролиз лишён этих недостатков, что позволяет значительно повысить питательную ценность получаемых продуктов и имеет ряд преимуществ. При его применении исключается жесткое воздействие на белковые молекулы, распад аминокислот, возможен подбор системы ферментов и условий процесса, что позволяет создать оптимальную технологию переработки разных видов белкового сырья. Путём подбора ферментов можно добиться получения гидролизата без горького привкуса.
ГЛАВА 4. МЕТОДИЧЕСКАЯ ЧАСТЬ.
4.1 Межпредметность – современный принцип обучения.
Совершенствование содержания образования в школе опирается на комплексное использование в обучении межпредметных связей. Это является одним из критериев отбора и координации учебного материала в программах смежных предметов.
Межпредметные связи всесторонне влияют на процесс обучения – от постановки задач до его организации и результатов. Им свойственны методологические, формирующие (образовательные, развивающие, воспитывающие) и конструктивные (системообразующие) функции в предметной системе обучения. Полифункциональность межпредметных связей определяет неоднозначность их понятийной трактовки. Наиболее полная реализация возможностей межпредметных связей, проявление всех их функций в единстве достигаются, когда межпредметные связи функционируют в процессе обучения как самостоятельный принцип построения локальных дидактических систем [21].
Рассмотрение межпредметных связей в русле методологических основ обучения позволяет видеть в них дидактическую форму общенаучного принципа системности. Они вносят системообразующее начало в предметное обучение, обеспечивают целостность процесса обучения, выполняя в нем обобщающие функции (методологическую, формирующую, конструктивную).
Межпредметные связи способствуют повышению теоретического и научного уровня обучения, их осуществление способствует приобщению школьников к системному методу мышления; формируют научное мировоззрение учащихся; обеспечивают систему в организации предметного обучения.
Таким образом, межпредметные связи являются важным фактором совершенствования процесса обучения в целом, на всех его уровнях.
Исходя из общности структуры учебных предметов и структуры процесса обучения, можно выделить три основных типа межпредметных связей: содержательно – информационные, операционно – деятельностные, организационно – методические.
Межпредметные связи на основе содержания знаний можно отнести к типу содержательно – информационных. Виды связей этого типа различаются:
1. по составу научных знаний (фактологические, понятийные, теоретические);
2. по знаниям о познании (философские, историко-научные, семиотические, логические);
3. по знаниям о ценностных ориентациях (диалектико-материалистические, идейно-политические, политико-экономические, эстетические, этические, правовые).
Связи в способах учебно-познавательной деятельности и умений учащихся в обучении разным учебным предметам относят к типу операционно –деятельностных. Виды связей данного типа:
1. практические, которые способствуют выработке у учащихся двигательных, трудовых, конструктивно – технических, вычислительных, экспериментальных, речевых умений;
2. познавательные, которые формируют общенаучные обобщенные умения мыслительной, творческой, учебной, операционно – познавательной, самообразовательной деятельности;
3. ценностно – ориентационные, необходимые для выработки умений оценочной, коммуникативной, художественно-эстетической деятельности, что имеет большое значение в формировании мировоззрения школьника.
Межпредметные связи функционируют в процессе обучения и осуществляются с помощью методов и организационных форм. Это позволяет выделить вторичный, подчиненный первым двум тип организационно-методических связей, имеющих самостоятельное значение. Межпредметные связи этого типа обогащают методы, приемы и формы организации обучения.
Виды связей данного типа различаются:
1. по способам усвоения связей в различных видах знаний (репродуктивные, поисковые, творческие);
2. по широте осуществления (межкурсовые, внутрицикловые, межцикловые);
3. по времени осуществления (преемственные, сопутствующие, перспективные);
4. по способу взаимосвязи предметов (односторонние, двусторонние, многосторонние);
5. по постоянству реализации (эпизодические, постоянные, систематические);
6. по уровню организации учебно-воспитательного процесса (поурочные, тематические и др.);
7. по формам организации работы учащихся и учителей (индивидуальные, групповые, коллективные).
Межпредметные связи реализуются в различных формах организации учебной и внеурочной деятельности [9].
Урок межпредметного характера должен удовлетворять определенным дидактическим требованиям. Урок такого типа должен иметь четко сформулированную учебно-познавательную задачу, для решения которой необходимо привлечение знаний из других предметов; обеспечить высокую активность учащихся по применению знаний из других предметов; содержать выводы мировоззренческого характера, обобщающих и опирающихся на связь, синтез знаний из разных предметов, причинно-следственные связи, сущность изучаемых явлений; вызвать положительное отношение учащихся, возбуждать у них интерес к познанию связей между знаниями из разных курсов; быть нацеленным на обобщение определенных разделов учебного материала смежных учебных предметов [9,19, 22, 25].
Методические приемы осуществления межпредметных связей на уроке [22].
| Обычные методы и приёмы, ориентированные на установление межпредметных связей. |
Специфические для межпредметных связей, обогащающие мотивацию системы методов обучения. |
1. Домашние задания по другим предметам.
2. Включение в изложение учителя межпредметного материала другого предмета.
3. Беседа и воспроизведение знаний другого предмета.
4. Применение наглядных пособий, приборов, фрагментов диа- и кинофильмов.
5. Постановка проблемных вопросов.
6. Решение количественных и качественных задач, кроссвордов межпредметного характера.
7.Сообщения учащимся по материалам другого предмета.
|
1. Работа с учебниками по нескольким предметам на уроке.
2. Использование и изготовление комплексных наглядных пособий, обобщающих учебный материал нескольких предметов.
3. Выполнение письменных самостоятельных работ, которые разрабатываются и оцениваются учителями разных предметов.
4. Комплексные задания, межпредметные тесты, дифференцированные по предметам групповые задания.
5. Введение межпредметных тетрадей (выполнение заданий по разным предметам, направленные на решение общей учебной проблемы).
6. Групповая работа учителей по организации изучения межпредметных проблем.
|
4.2 Межпредметные связи на уроках химии.
Реализация межпредметных связей химии с другими дисциплинами предполагает осуществление комплексного подхода к отбору учебного материала, т.е. привлечение теоретических и эмпирических сведений из смежных дисциплин для многоаспектного освещения основных вопросов школьного курса химии с целью формирования у учащихся целостных и системных знаний по предмету. Механизм формирования таких знаний – межпредметный синтез, результаты которого должны стать средством добывания новых знаний, основой дальнейшего познания и развития личности учащегося.
Наиболее важными и перспективными для формирования научного мировоззрения и мышления школьников, их экологического образования и воспитания, формирования целостного восприятия реальных предметов и явлений являются связи химии с предметами естественно-математического цикла.
Курс химии связан с предметами этого цикла (биологией, географией, физикой, математикой) разными видами межпредметных связей: предшествующие, сопутствующие, перспективные, понятийные, фактические, теоретические и др. [23].
Общими для учебных предметов химии и физики, например, являются: система понятий о веществе и его строении, которая необходима для усвоения фундаментальной физико-химической теории строения вещества; система понятий об энергии. Химию, биологию и физику объединяет система понятий о материи, формах ее движения и уровнях организации. В процессе осуществления межпредметных связей «биология – химия – физика» учащиеся глубже осознают общность и особенности живых и неживых макротел, универсальность многих физико-химических законов и теорий. У них развивается диалектический метод мышления [9, 18, 21].
Комплексный подход к отбору учебного материала для реализации межпредметных связей включает:
1. Анализ учебного материала курса химии с целью выявления вопросов, для многоаспектного освещения которых необходимо привлечь межпредметный материал.
2. Анализ и отбор материала смежных дисциплин, связи с которыми учитель предполагает реализовать в учебном процессе.
3. Дозирование межпредметного материала, включаемого в содержание урока и прогнозирование предполагаемых результатов межпредметного синтеза.
В курсе химии 8 класса преобладают предшествующие и сопутствующие связи, а в курсе химии 9 класса – сопутствующие и перспективные. В связи с этим цели реализации межпредметных связей различны. Если в 8 классе важнейшая цель – формирование у учащихся прочной понятийно-теоретической базы, на основе которой будет строиться дальнейшее изучение курса, то в 9 классе – формирование системных знаний по предмету, многоаспектное освещение изучаемого материала и расширение научного кругозора учащихся.
С учетом этого авторы [23] предлагают следующие принципы отбора межпредметного материала к уроку:
1. соответствие межпредметного материала направленности и специфике общеобразовательного учреждения;
2. соответствие межпредметного материала целям и предметному содержанию обучения;
3. направленность межпредметных связей на решение целесообразных учебных проблем;
4. использование разнообразных видов межпредметных связей при лидирующем значении предшествующих и сопутствующих связей в 8 классе и сопутствующих и перспективных в 9 классе [23].
4.3 Методические рекомендации по реализации принципов межпредметных связей при изучении тем, связанных с понятием «ферментные препараты».
Впервые в курсе химии понятие о ферментах как о веществах, ускоряющих химические реакции, может быть представлено при изучении темы: «Скорость химической реакции. Факторы, влияющие на скорость химической реакции», а более полно при изучении темы «Катализ». (9 класс в школах с углубленным изучением химии).
Тема урока: «КАТАЛИЗ». (9 класс).
Методические рекомендации.
1.В начале урока проводят беседу с учащимися, в ходе которой закрепляются их знания по пройденному материалу:
-Что такое скорость химической реакции? Приведите примеры реакций протекающих мгновенно, медленно, очень замедленно.
-Назовите условия, которые влияют на скорость химической реакции.
-Что такое катализатор? Какие из изученных вами реакций протекали в присутствии катализатора?
2.Учитель демонстрирует опыт окисления оксида серы (IV) в присутствии оксида железа (III). В ходе проведения опыта обсуждают ускоряющую роль катализатора в этой реакции. Учитель разъясняет, в чем состоит сущность течения каталитических реакций, сущность катализатора. Подчеркивают, что катализаторы обладают способностью образовывать с реагирующими веществами очень активные промежуточные соединения с малой продолжительностью существования (использует схему). Далее отмечают, что действие катализаторов строго специфично, при этом важно соблюдать их химическую чистоту.
3.Каталитические процессы широко распространены в жизни животных организмов. Учащиеся отвечают на вопросы:
-Приведите примеры катализаторов в живой природе.
-Как обычно биологи называют эти вещества?
Остановимся на самой главной функции белков – ферментативной. Все ферменты содержат в своем составе белки, поэтому биохимические реакции находятся под контролем белков. Термин «фермент» с латинского языка переводится как «закваска».
Затем следует сравнить ферменты и прочие катализаторы. Обращают внимание на то, что обычные катализаторы – вещества небелковой, а ферменты – вещества белковой природы; один катализатор может изменить скорость нескольких реакций, а фермент ускоряет только одну реакцию; ферменты эффективно работают при температуре человеческого тела, а при высокой температуре и давлении разрушаются; ферменты в клетках располагаются не случайно, а в определенном порядке и их действие контролируют гуморальная и нервная системы.
Учащиеся по группам выполняют лабораторную работу «Действие желудочного сока на белки». Каждая группа исследует одно из условий. Итоги работы обсуждаются и заносятся в таблицу.
Условия действия желудочного сока на белки.
| Условия опыта. |
Наблюдения. |
Выводы. |
Белок и желудочный сок при температуре 400
С.
Крахмал и желудочный сок при температуре 400
С.
Белок и желудочный сок при 00
С.
Белок и кипяченый желудочный сок.
Белок и желудочный сок с добавлением щелочи.
|
Взвесь растворяется.
Взвесь остаётся.
Взвесь остаётся.
Взвесь остаётся.
Взвесь остаётся.
|
Фермент работает при температуре тела.
Фермент действует только на определенный субстрат – белок.
Фермент снижает активность при понижении температуры.
Фермент является белком, а белки при кипячении свертываются.
Фермент работает только при определенной кислотности среды.
|
Затем, из курса анатомии вспоминают, какие ферменты присутствуют в пищеварительных соках организма человека и какие питательные вещества они расщепляют (используют схему) [18].
Тема урока: «БЕЛКИ». (11 класс).
В начале занятия целесообразно поставить вопрос: Почему многие люди отождествляют понятие «белок» с понятием «жизнь»?
Раскрытие содержания урока пойдет в следующем порядке (схема):
1.Строение и состав белков. Внимание учащихся обращается на формулы некоторых белков: пенициллин – C16
H18
O4
N8
, молоко – C1846
H3021
O576
N468
S21
, гемоглобин – C3022
H4816
O872
N780
S8
Fe4
.
Формируется вывод о сложности белков, о важнейшем значении их для жизнедеятельности всего живого на Земле.
Далее учитель рассказывает об аминокислотах, их классификации и значении.
2.Структура белков (уровень организации белковой молекулы): первичная, вторичная, третичная и четвертичная структура.
3.Классификация белков по структуре и функциям:
а) по структуре: - простые и сложные белки
-глобулярные и фибриллярные белки
б) по функциям белков.
Самой главной функцией белков является ферментативная. Учение о ферментах выделяют в самостоятельную науку – энзимологию. Далее учитель дает классификацию ферментов. Затем более подробно останавливается на механизме действия ферментов. Весь процесс действия фермента можно разделить на три стадии:
1) распознавание ферментом(E) субстрата(S) и связывание с ним;
2) образование активного комплекса(ES);
3) отделение продукта(P), образовавшегося в ходе ферментативной реакции.
Схема каталитической реакции:
E+S ® ES ® E+P
4.Физико-химические свойства белка. Рассматриваются свойства денатурации и ренатурации; факторы, способные вызывать денатурацию (физические и химические).
5.Химия питания. Здоровый образ жизни – прежде всего сбалансированное питание. Учитель предлагает ознакомиться с веществами, входящими в состав пищевых продуктов.
Задание: «О чем расскажет упаковка». Ребятам предлагается по желанию отобрать несколько упаковок из-под пищевых продуктов, которые наиболее часто употребляются в пищу и которые являются любимыми лакомствами. Они должны определить:
1)какие основные биохимические компоненты входят в состав продукта и в каком количестве;
2)какие компоненты продукта в нем являются источниками белков, жиров и углеводов.
Основной полезный компонент пищи – белки.
1.Биологическая ценность белка. Задание: Определить биологическую полноценность белка различных пищевых продуктов и лимитирующих аминокислот (используя таблицу об аминокислотном составе некоторых пищевых продуктов). Расчет вести по формуле:
Содержание аминокислоты (мг) в 1 г испытуемого белка
АК= ¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾¾
Содержание аминокислоты (мг) в 1 г белка по аминокислотной шкале
Где АК – аминокислотный скор.
2.Потребность человека в белках и аминокислотах.
3.Основная белковосодержащая пища. Совместимость белкового питания. Учитывая аминокислотный состав (аминокислотный скор) различных продуктов питания, подобрать их комбинацию, наиболее соответствующую потребностям нашего организма в незаменимых аминокислотах (использовать таблицы об аминокислотном составе пищевых продуктов).
Далее ребятам предлагается тест, рассчитанный на два уровня знаний (первый уровень рассчитан на «4» балла, а второй уровень – на «5» баллов) [29].
| Первый уровень. |
Второй уровень. |
1. Какова роль ферментов в организме?
2. Как образованы названия групп ферментов?
3. Какие функциональные группы входят в состав аминокислот, какие свойства они определяют?
4. Что такое первичная структура белка?
5. Что представляет собой вторичная структура белка?
6. Что такое третичная структура белка?
7. Опыт:
- К раствору белка добавьте хлорид натрия.
- Пронаблюдайте и объясните изменения.
- Добавьте воды до растворения белка.
- Сделайте вывод.
8. Известно, что при продолжительности жизни 70 лет, Обновление белков в организме происходит в среднем 200 раз. Предположите, сколько раз произошло обновление белков в вашем организме.
9. Задача: Известно, что для взрослого человека необходимо 1,5 г белка на 1 кг массы тела в день. Зная свою массу, определите суточную норму потребления белка для своего организма.
|
1. Предположите, каковы функции каждой группы ферментов.
2. Приведите примеры известных вам ферментов, назовите их функции.
3. По аналогии с примером на доске, напишите уравнение реакции получения трипептида из дипептида (используйте формулу цистеина или серина). Назовите полученный трипептид.
4. Могут ли измениться свойства белка при нарушении последовательности аминокислотных звеньев в линейной полимерной цепи?
5. Чем отличается первичная структура белка от вторичной?
6. Чем отличается третичная структура от первичной и вторичной?
7. Опыт:
- К раствору белка добавьте концентрированный раствор сульфата меди (II) или другой соли тяжелого металла.
- Пронаблюдайте и объясните изменения.
- Добавьте воды, объясните явление.
8. В чем заключается сущность гидролиза?
9. Предположите, можно ли пищевые белки заменить другими компонентами рациона (например, жирами и углеводами), чтобы обеспечить важнейшие процессы в организме?
|
Подводя итог урока, учитель повторяет, что понятия «жизнь» и «белок» неразрывно связаны. Чтобы ответить на вопрос, что такое жизнь, надо знать, что такое белки. Насколько многообразны белки, настолько сложна и многолика сама жизнь [15, 23,29].
ВЫВОДЫ.
1. Для осаждения препарата протеиназы целесообразно применять этанол или изопропанол.
2. Компонентный состав препарата представлен четырьмя фракциями, две из которых протеолитические.
3. Выяснены температурные оптимумы протеолитических ферментов – для протеиназы I – 60, а для протеиназы II – 400
С.
4. Протеиназа I обладает коллагенолитическим действием.
5. Протеиназа I является достаточно термостабильной, инактивируется при 600
С в течение 60 часов.
6. Протеиназа I обладает специфичностью к белкам животного происхождения.
СПИСОК ЛИТЕРАТУРЫ
1. Антипова Л.В., Глотова И.А., Кочергина Н.И. Микробные ферментные препараты для обработки вторичного сырья мясной промышленности. // Конференция «Биосинтез ферментов микроорганизмами»: Тез. докл., Москва, 26 – 27 октября 1993г – Москва, 1993. – С.33.
2. Антипова Л.В., Глотова И.А., Кочергина Н.И., Чурсин В.И., Макарова Е.Г. Разработка и использование специальных микробных препаратов для обработки кожевенного сырья. // Кожевенно-обувная промышленность. – 1994. - № 5 – 8. – С.25 – 27.
3. Антипова Л.В., Кочергина Н.И. Специальные микробные препараты ферментов в рациональном использовании вторичного мясного сырья. // Всесоюз. науч.-техн. конф. «Совершенствование технологических процессов производства новых видов пищевых продуктов и добавок. Использование вторичного сырья пищевых ресурсов». – Киев, 1991. – Ч.1. – С.222.
4. Антипова Л.В., Насонова Л.В. Исследование возможности получения белкового концентрата из кератинсодержащего сырья методом микробной ферментации. // Тез. докл. 2 науч.-практ. конф. «Разработка и внедрение безотходных технологий, использование вторичных ресурсов», Киров, 30 – 31 мая 1989г. – Киров, 1989. – С.80 – 81.
5. Антипова Л.В., Глотова И.А. Основы рационального использования вторичного коллагенсодержащего сырья мясной промышленности. – Воронеж. – 1997. – С.246.
6. Василевская И.А. Актиномицеты – продуценты биологически активных веществ. – Киев:Высшая школа. – 1979. – С.43.
7. Грачева И.М. Технология ферментных препаратов. – М.: Агропромиздат. – 1987. – С.391.
8. Детерман Г. Гель-хроматография. – М.: Мир. – 1970. – С.352.
9. Зверев И.Д., Максимова В.Н. Межпредметные связи в современной школе. – М.: Педагогика. – 1981. – С.96.
10. Иванов К.А., Шанушкова Л.П.,Нарыжная Т.В. Использование шквары для пищевых целей. // Мясная индустрия СССР. – 1982. - № 11. – С.11 – 15.
11. Извекова Г.И. Протеолитические свойства гриба Em. glabra. // Микробиология. – 1985. – т.54. – С.62 – 65.
12. Каверзиева Е.Д. Стандартный метод определения протеолитической активности для комплексных препаратов протеиназ. // Приклад. биохимия и микробиология. – 1971. – т.7. № 2. – С.225 – 228.
13. Калунянц К.А., Дорохов В.В., Лосякова Л.С., Величко Б.А. Направленный биосинтез ферментов микроорганизмами. // Труды ВНИИсинтезбелок. М.: 1974. – В.2. – С.220.
14. Караваева Н.Н., Садыкходжаева Н.Г. Получение высокоустойчивого препарата протеолитических ферментов гриба Torula thermophila шт.Уз. ПТ при культивировании в ферментере. // Приклад. биохимия и микробиология. – 1985. – Т.XXI. - № 1. – С.24 – 27.
15. Колычева З.И. Химия и питание. // Химия в школе. – 1997. - № 4. – С.86 – 88.
16. Кочетов Г.А. Практическое руководство по энзимологии. – М.: Высшая школа. – 1980. – С.272.
17. Крестьянова И.Н., Васильева Л.И., Бартошевич Ю.Э., Ахпаров В.Л., Нахапетян Л.А. Изоэлектрическое фокусирование препарата протеолитических ферментов из Streptomyces 771. // Приклад. биохимия и микробиология. – 1983. – Т.XIX. - № 2. – С.217 – 225.
18. Крылова Н.В. Интеграция как важная составляющая учебного процесса. // Химия в школе. – 1997. - № 1. – С.21 – 26.
19. Кулагин П.Г. Межпредметные связи в процессе обучения. – М.: Просвещение. – 1981. – С.96.
20. Кавренова Г.И., Руденская Т.Н. Афинная хроматография протеиназ. // Химия протеолитических ферментов. Материалы 2 Всесоюзного симпозиума по химии протеолитических ферментов. – Углич. – 1979. – С.134.
21. Максимова В.Н. Межпредметные связи в учебно-воспитательном процессе в современной школе. – М.: Просвещение. – 1987. – С.160.
22. Межпредметные связи в учебном процессе. – М.: Просвещение. – 1974. – С.
23. Назаренко В.М. Что нужно знать о продуктах, которые мы употребляем в пищу. // Химия в школе. – 1997. - № 5. – С.16 – 25.
24. Насонова Л.В. Биотехнология получения протеиназы актиномицета Streptomyces chromogtnis. // Афтореф. дисс. канд. техн. наук. – Воронеж. – 1988. – С.24.
25. Осуществление межпредметных связей в процессе обучения. – Владимир. – 1984. – С.136.
26. Расулундзатуву М.З. Биосинтез и исследование протеолитического комплекса Streptomyces fulvoviricus ВКМАс – 161. // Автор. дисс. канд. техн. наук. – Воронеж. – 1989. – С.21.
27. Рожанская Т.И., Морголина Н.А., Андреева Т.В. Использование ультрафильтрации в процессах очистки протеолитических ферментов. // Материалы 2 Всесоюзного симпозиума по химии протеолитических ферментов. – Углич. – 1979. – С.134.
28. Фрашель Б., Шишкова Э.А. Свойства протеолитических ферментов, содержащихся в культуральной жидкости Actinomyces rimous. // Приклад. биохимия и микробиология. – 1968. - № 6. – С.627 – 631.
29. Шаталов М.А. Межпредметные связи в формировании системных знаний. // Химия в школе. – 1997. - № 5. – С.26 – 29.
30. Aussein M., Magdel-Din, Abdel-Gawald E.M. Protease and amylase activities of Asp. flawis grown on hudrocarbons and oxygenated hydrocarbous // Biotechnol. And Bioeng. – 1983. – v.25. – Nr.12. – p.3197 – 3199.
31. Knud Aunstrup – Proteinases // Novo Research Institute, Bagsvaerd, Denmark, - 1979. – p.114.
32. Odibo F.I., Obi S.K. Purification and some properties of a thermostable protease of Jherm. Thal // j. Appl. Microbiol. And Biothehnol. – 1988. – v.3. – p.327 –332.
|