Е.Г. Атавин, В.О. Тихоненко, Р.С. Сагитуллин, Омский государственный университет, кафедра органической химии
1. Введение
В последние годы круг соединений, способных к рециклизации, расширился за счет производных пиридиниевых солей с цианидными, карбонильными, сложноэфирными и мостиковыми полиметиленовыми заместителями. Обсуждение полученных результатов и поиск новых синтетических направлений требуют развития методов теоретического описания и прогнозирования рециклизации. Это, в свою очередь, невозможно без знания механизма моделируемой реакции. Ранее на основании эмпирических соображений предлагались различные механизмы изомеризационной рециклизации, включающие значительное число вариантов и большое количество неустойчивых интермедиатов. Однако сделать обоснованный выбор одной из предлагаемых гипотез на основании лишь экспериментальных данных не удалось. В настоящей работе к обсуждению механизма рециклизации иодметилата 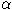 -пиколиния и его дикарбонильного производного привлечены результаты расчетов энтальпий образования интермедиатов методом молекулярной механики. -пиколиния и его дикарбонильного производного привлечены результаты расчетов энтальпий образования интермедиатов методом молекулярной механики.
2. Интермедиаты рециклизации
В ранних работах первая стадия изомеризационной рециклизации представлялась как кислотно-основное равновесие с образованием ангидрооснования (схема 1), что позволило достичь определенных успехов в квантово-химическом описании рециклизации [1].
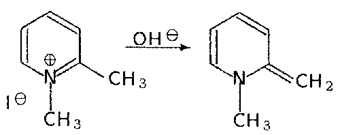
Схема 1. Образование ангидрооснования
В дальнейшем, однако, этот механизм был оставлен по следующим причинам:
Соединения, для которых ангидрооснования легко образуются, оказались вообще неспособными к рециклизации до тех пор, пока образование ангидрооснования не было блокировано [2].
Образование и раскрытие цикла ангидрооснования требует атаки, по крайней мере, двумя гидроксильными группами. Однако в условиях, обеспечивающих точную эквимолярную замену ионов I- на OH- (взаимодействие с влажной окисью серебра, с OH-формой ионообменной смолы, электролиз) не наблюдалось замедления образования раскрытых форм.
В ряде случаев (рециклизация индолизинов, никотерина, раскрытие пиридинового ядра в солях Цинке и т. д.) образование ангидрооснования в принципе невозможно.
Разность энтальпий образования ангидрооснования и псевдооснования составляет 154 ккал/моль, что (даже с учетом энтальпии образования воды) должно привести к практически полному смещению равновесия в сторону последнего.
Реклама

В результате нуклеофильной атаки исходной соли (I) возможно образование двух псевдооснований IIa,b (схема 2):
Схема 2. Образование псевдооснований
К сожалению, количественная оценка возможности протекания этой стадии в рамках метода молекулярной механики невозможна. Отметим, однако, что стерические затруднения, связываемые обычно с формой IIb, по-видимому, преувеличены (см. табл.).
Раскрытие псевдооснований IIa,b может приводить к образованию двадцати двух таутомерных раскрытых форм (см. табл.). Легко видеть, что их энтальпии образования (приведенные для конформера, ближайшего к псевдооснованию), весьма различаются. При условии установления термодинамического равновесия это означает, что относительное содержание всех раскрытых интермедиатов, за исключением кето-аминных форм с неразрывной цепью сопряжения, будет исчезающе малым.
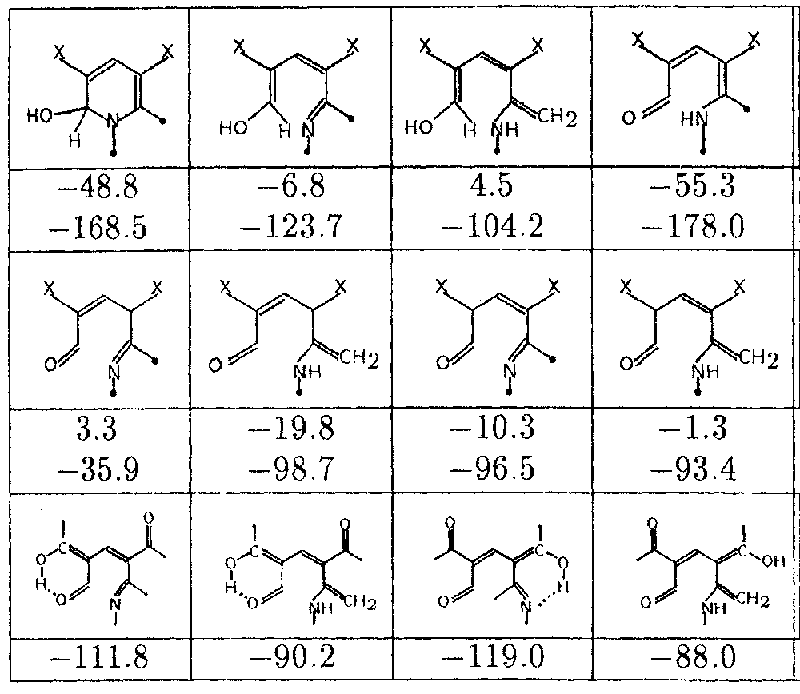
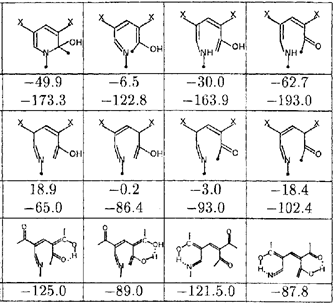
Табл. 1. Раскрытые интермедиаты рециклизации; приведены энтальпии образования (ккал/моль) для X=H и X=COCH3.
Два набора структур таутомерно связаны с двумя псевдооснованиями IIa,b
3. Рециклизация пирилиевых солей
Не останавливаясь на синтетическом значении рециклизации пирилиевых солей [2], отметим, что соответствующие раскрытые формы при использовании в качестве нуклеофильного агента метиламина будут аналогичны интермедиатам рециклизации иодметилата  -пиколиния в щелочной среде. То есть эти две химическиe системы в области превращений раскрытых форм в силу принципа микроскопической обратимости должны иметь одинаковую потенциальную поверхность. И использование пирилиевых солей дает редкую возможность "забросить" пиридиниевую систему в верхнюю часть потенциальной поверхности не термическим путем, а за счет внутренней энергии реагентов. Известно, что рециклизация пирилиевых солей под действием метиламина приводит в мягких условиях к солям -пиколиния в щелочной среде. То есть эти две химическиe системы в области превращений раскрытых форм в силу принципа микроскопической обратимости должны иметь одинаковую потенциальную поверхность. И использование пирилиевых солей дает редкую возможность "забросить" пиридиниевую систему в верхнюю часть потенциальной поверхности не термическим путем, а за счет внутренней энергии реагентов. Известно, что рециклизация пирилиевых солей под действием метиламина приводит в мягких условиях к солям  -пиколиния, а вторичными аминами - к соответствующим анилинам. Отсюда следует, что стадии "псевдооснование-раскрытые формы" и "раскрытые формы-ароматический амин" не могут быть связаны с заметным активационным барьером даже в отсутствии акцепторных заместителей. -пиколиния, а вторичными аминами - к соответствующим анилинам. Отсюда следует, что стадии "псевдооснование-раскрытые формы" и "раскрытые формы-ароматический амин" не могут быть связаны с заметным активационным барьером даже в отсутствии акцепторных заместителей.
4. Раскрытие псевдооснований
Из двух возможных вариантов раскрытия цикла псевдооснования - электроциклического и ионного (схема 3)
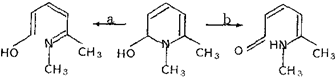
Схема 3. Электроциклическое (a) и ионное (b) раскрытие псевдооснования
следует, по-видимому, предпочесть ионный вариант, поскольку:
Реклама

Образование раскрытых форм никогда не отмечалось для нуклеофилов, не способных к ионному раскрытию цикла (Cl-, Br-, I-, CN- и т. д.)
Образование енольной формы при электроциклическом раскрытии является эндотермическим (табл.1) и несамопроизвольным процессом (в пренебрежении небольшим энтропийным вкладом G0), в то время как образование кетонной формы при ионном раскрытии - экзотермическим и самопроизвольным процессом. В отсутствии заметных активационных барьеров нет оснований говорить о несамопроизвольном электроциклическом раскрытии.
5. Механизмы изомеризационной рециклизации
Перебор всех разумных вариантов взаимных превращений интермедиатов рециклизации позволил нам выделить два пути реакции, наиболее оптимальных с точки зрения величины активационного барьера (схема a,b).
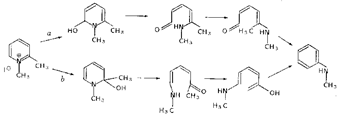
Рис. 4. Механизмы изомеризационной рециклизации
Перебор всех разумных вариантов взаимных превращений интермедиатов рециклизации позволил нам выделить два пути реакции, наиболее оптимальных с точки зрения величины активационного барьера (схема a,b).
Вариант a предполагает вращение вокруг формально двойной связи С=С, однако низкая расчетная величина барьера (15,6 ккал/моль), объясняемая сопряжением с соседней аминогруппой, не препятствует протеканию соответствующего цис-транс превращения даже при комнатной температуре. Введение двух ацетильных групп дополнительно уменьшает это значение до 7,8 ккал/моль, что соответствует увеличению константы скорости соответствующей элементарной стадии реакции примерно в миллион раз. Вариант b характеризуется существенно большей энергией активации (около 30 ккал/моль на пути от псевдооснования IIb до ароматического амина), однако он предполагает электроциклическое замыкание цикла и может представлять интерес в ситуациях, когда альдольно-кротоновая конденсация невозможна.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, код 96-03-33389.
Список литературы
Высоцкий Ю. Б., Земский Б. П., Ступникова Т. В., Сагитуллин Р. С., Кост А. Н., Швайка О. П. Квантовохимическое описание реакций рециклизации четвертичных солей пиридиния // ХГС 1979. 11. С. 1496-1500.
Теренин В. И., Румянцев А. Н., Кабанова Е. В. Перегруппировка Коста-Сагитуллина// Вест. Моск. ун-та. Сер. 2. Химия. 1992. Т. 33. 3. С. 203-220.
Бельский И. Ф., Дорофеенко Г. Н., Простаков Н. С., Шерстюк В. П., Чумаков Ю. И. Гетероциклы в органическом синтезе. Киев: Техника, 1970. С. 108.
|