Е.Г. Атавин, В.О. Тихоненко, Р.С. Сагитуллин, Омский государственный университет, кафедра органической химии
За двадцать лет, прошедших со дня открытия изомеризационной рециклизации пиридиниевых солей [1, 2], накоплен большой экспериментальный материал, изучена рециклизация сотен соединений, делалось несколько попыток обобщений теоретического характера [3, 4]. Но современное состояние теории реакционной способности практически не позволяет для реальных химических объектов детально исследовать поверхность потенциальной энергии и для получения информации о поведении реагирующей системы механизм реакции приходится постулировать на основании эмпирических соображений.
Изомеризационная рециклизация является сложным, многостадийным процессом, для описания которого предлагались механизмы, включающие промежуточное образование псевдооснований, ангидрооснований, комплексов с сульфитом алкиламинов. Перечисленые интермедиаты в некоторых случаях удавалось выделить и идентифицировать. Однако это не может служить аргументом в пользу того или иного механизма, так как интермедиаты, как правило, находятся в состоянии таутомерного равновесия. Поскольку для некоторых соединений, способных к раскрытию цикла или рециклизации, единственно возможными интермедиатами являются псевдооснования, то обычно при интерпретации экспериментальных данных используется следующий механизм, включающий их образование и приводящий к соответствующим ароматическим аминам через промежуточные раскрытые формы по одному из трех вариантов (а, б, в) (схема 1; в качестве примера для простоты взят замещенный 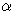 -пиколин). -пиколин).
Рециклизацию в рамках этого механизма удобно разделить на три этапа:
1. Образование псевдооснования II, сопровождающееся разрушением ароматической структуры I, и его изомеризация в раскрытую форму III. При этом происходит значительная перестройка электронной структуры, разрыв и образование химических связей, что делает нецелесообразным использование для теоретического описания этих стадий классических методов типа метода молекулярной механики и требует квантово-химических расчетов. Основные особенности поведения реакции на этом этапе известны: при наличии электроноакцепторных заместителей раскрытие цикла протекает быстро и в мягких условиях, при их отсутствии выход продукта получается низким даже в весьма жестких условиях. То есть на этом этапе реакции решающий фактор, определяющий скорость, а иногда и саму возможность рециклизации, - электронные эффекты заместителей.
Реклама

2. Взаимные таутомерные и конформационные превращения открытых форм III-VIII. Близкое электронное строение этих интермедиатов позволяет оценить их относительную энергию, барьеры вращения, энергию переходного состояния и энергию активации этого этапа реакции методом молекулярной механики. И если энергия активации превысит 20 ккал/моль - значение, обычно принимаемое в качестве верхней границы быстрых конформационных переходов при комнатной температуре, можно утверждать, что реакция будет контролироваться стерическими факторами. Электронные эффекты заместителей на рассматриваемом этапе реакции проявляются косвенно через зависимость барьеров внутреннего вращения от порядков сопряженных связей.
Возможность осуществления стадий, связанных с таутомерным превращением открытых форм (III-IV, III-VI, V-VIII, VII-VIII), нельзя анализировать в рамках метода молекулярной механики но они не могут быть препятствием на пути реакции, поскольку изученные таутомерные превращения аналогичных систем протекают легко и быстро.
3. Внутримолекулярная кротоновая конденсация таутомера VIII с образованием конечного ароматического амина IX. Возможность осуществления этой стадии должна сильно зависеть от межьядерного расстояния между атомами углерода карбонильной и метиленовой компонент, легко получаемым молекулярно-механическим расчетом. Электронные факторы, влияющие на активность карбонильной и метиленовой компонент, также важны для протекания этой фазы рециклизации.
В то время как влиянию электронных эффектов заместителей на протекание изомеризационной рециклизации уделялось достаточно много внимания (например, [1-4]), роль стерических факторов практически не обсуждалась. Вероятно, влияние геометрического размера заместителей на выход продуктов реакции в большинстве иследованних случаев было незначительным либо вообще практически отсутствовало. (Отметим влияние стеpических эффектов на выход в процессах pециклизации с пеpеаминированием [5]).
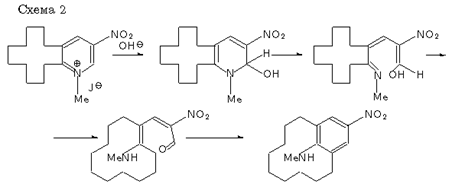
Однако интерес к рециклизации производных пиридина с полиметиленовыми мостиками [6,7] стимулировал изучение круга проблем, связанных с собственным объемом фрагментов рециклизуемых молекул и условиями замыкания циклов. Попытка рециклизации иодметилата метапиридинофана X (11,13-диметил [9](3,5)пиридинофана X) (схема 3) оказалась неудачной, в отличие от рециклизации иодметилата 2,3-циклододеценопиридина XI (отсутствие продукта и выход 6% соответственно).
Реклама

Таблица 1.
| II |
III |
IV |
V |
VI |
VII |
VIII |
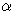 -пиколин -пиколин |
6.76 |
5.83 |
11.95 |
14.01 |
13.10 |
12.55 |
4.49 |
| Х |
32.01 |
28.14 |
42.66 |
39.71 |
34.56 |
36.65 |
26.10 |
Энергии напряжения для интермедиатов II-VIII (ккал/моль)
Таблица 2.
| III |
IV |
VI |
а |
б |
в |
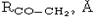 |
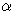 -пиколин -пиколин |
12.12 |
2.40 |
2.12 |
8.52 |
12.12 |
9.39 |
3.02 |
| X |
12.79 |
1.39 |
2.09 |
15.91 |
12.79 |
8.51 |
3.10 |
Барьеры вращения для интермедиатов III, IV, VI, энергии активации для возможных путей реакции (ккал/моль) и расстояние между метиленовым и карбонильным атомами углерода.
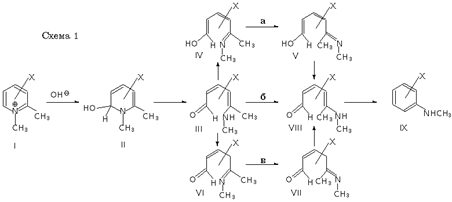
Низкий выход продукта последней реакции ожидался из-за отсутствия электроноакцепторных заместителей. Поэтому работа с веществом XI была продолжена и после введения нитрогруппы успешно завершена получением соответствующего труднодоступного метациклофана XII [7](схема 2). Отсутствие же следов продукта рециклизации X было объяснено стерическими проблемами, связанными с неблагоприятным конформационным строением промежуточных раскрытых форм, и работа с ним была прекращена.
Для проверки этого вывода нами изучено конформационное поведение интермедиатов II-VIII методом молекулярной механики ММР2. Из множества молекулярных параметров, даваемых этим методом, для обсуждения возможности рециклизации были выбраны следующие три группы:
1) энергии напряжения интермедиатов;
2) барьеры вращения вокруг связей;
3) расстояние между атомами углерода карбонильной и метиленовой компонент.
Предлагаемая методика анализа возможности рециклизации показывает отсутствие стерических препятствий для иодметилата 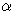 -пиколина. Его неспособность к рециклизации следует связывать с электронными факторами, поскольку нитропиколин, имея практически то же геометрическое строение, рециклизуется легко. -пиколина. Его неспособность к рециклизации следует связывать с электронными факторами, поскольку нитропиколин, имея практически то же геометрическое строение, рециклизуется легко.
Поскольку энергии активации близкого по электронному строению метапиридинофана X также невелики, можно сделать вывод, что рециклизация X станет осуществимой, если удастся ввести в его молекулу электронно-акцепторный заместитель.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований, код 96-03-33389.
Список литературы
Сагитуллин Р.С., Кост А.Н. Новые перегруппировки азотистых гетероароматических соединений // ЖОрХ. 1980. Т. XVI. Вып. 3. С. 658-669.
Теренин В.И., Румянцев А.Н., Кабанова Е.В. Перегруппировка Коста-Сагитуллина // Вестник МГУ. Сер. 2. Химия. 1992. Т. 33. N 3.
Высоцкий Ю.Б., Ступникова Т.В., Земский В.П., Калафат В.Н., Сагитуллин Р.С. Квантовохимическая трактовка реакций рециклизации. Иодид 1,2,5-триметилпиридиния // ХГС. 1982. N 9. С. 1277-1278
Белик А.В., Енваева И.Ю., Сагитуллин Р.С. Квантовохимическое исследование реакции рециклизации иодида 1,2,4,6-тетраметил-3-нитропиридиния // ХГС. 1985. N 10. С. 1386-1388.
Кост А.Н., Яшунский Д.В., Громов С.П., Сагитуллин Р.С. Стерические эффекты при рециклизации солей нитропиридиния в нитроанилины // ХГС. 1980. N 9. С. 1268-1271.
Шкиль Г.П., Сагитуллин Р.С. Неопубликованые результаты.
Shkil G.P., Lusis V., Mucienice D., Sagitullin R.S. A New Route to the Methacyclophane system // Tetrahedron Lett. 1994. N 35. P. 2075-2076.
|