Т. Ф. Черняковская, И. В. Николаева, С. В. Гаврилова
В последние десятилетия одной из наиболее актуальных тем научных исследований в биологии становится изучение биоразнообразия живых организмов, в том числе - прокариот. Бактерии в природе существуют не изолированно, а в составе сообществ, функционирующих как «метаболическая целостность, которая объединяет организмы с разными трофическими уровнями» (Г. А. Заварзин, 2000). В связи с этим большое значение приобретает проблема изучения таксономического состава микробных сообществ и выяснение принципов их функционирования.
В настоящее время достаточно полно изучены таксономический состав и структура микробных сообществ, возникающих при разложении растительного материала в разных типах наземных экосистем [1,3,4,5,6]. Для водных экосистем эти вопросы практически не изучены, это связано со многими причинами, в том числе трудностями методического характера, особенностями воды как среды обитания и т. д. Полностью отсутствуют сведения о составе бактериальных сообществ, формирующихся при деструкции цианобактерий, осуществляющих фотосинтез прокариот, широко распространенных в водных экосистемах и почвах.
Целью настоящего исследования является разработка методики проведения модельного эксперимента для изучения микробиологической деструкции растительного материала в условиях повышенного увлажнения и изучение таксономического состава бактерий гидролитического комплекса при разложении цианобактерий р.Anabaena и Тростника обыкновенного.
Методика исследования
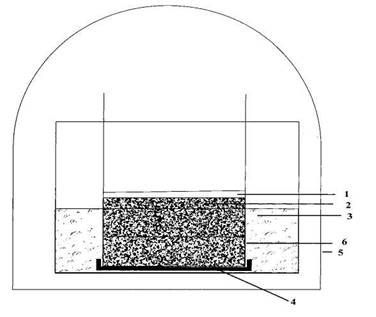
Для моделирования условий разложения растительного материала в водоеме на твердом грунте применяли разработанную нами установку: пластиковый цилиндр из химически инертного материала высотой 10-15 см, на нижний конец которого надета сетка, наполовину заполняли кварцевым песком (промытым и простерилизованным в сушильном шкафу при температуре 105ºС в течение 8 часов). Биомассу исследуемых цианобактерий распределяли по поверхности песка. Цилиндр помещали в кристаллизатор со стерильной водопроводной водой, налитой на несколько миллиметров ниже уровня поверхности песка. Сверху вся установка была закрыта стеклянным колпаком. Схема установки представлена на рис. 1. Эксперимент проводили при температуре 20ºС в течение месяца.
Реклама

Для изучения состава микробных сообществ проводились посевы исследуемого материала, живого и на различных этапах сукцессии, классическим чашечным методом из серийных разведений на широкий спектр сред с полимерами (среда Гаузе 1, среда Гетчинсона с КМЦ, среда с яичным желтком). Определяли общую численность выделенных бактерий и их амилолитическую, леци-тиназную, липазную, протеазную активность. Отдельно проводили учет грамот-рицательных и грамположительных бактерий, в том числе спорообразующих и коринеподобных, на глюкозо-пептонно-дрожжевой среде, а также учет дрожжевых организмов на сусло-агаре.
Для проведения идентификации бактерии выделяли в чистую культуру, микроскопировали и проводили физи-олого-биохимические тесты[2,7].
Достоверность результатов, полученных в модельном эксперименте, проверяли в контрольном опыте по разложению Тростника обыкновенного в естественных условиях (малое эвтрофное озеро в Заволжском районе г. Ярославля).
Результаты исследования
Анализ общей численности и таксономический состав сообществ бактерий на воздушно-сухом материале Тростника обыкновенного и цианобактериях р. Anabena, выделенных непосредственно из естественного местообитания (река Которосль), представлены в табл. 1.
Структура исследуемых бактерий сообществ различается незначительно. Обнаружены эпифитные коринеподоб-ные бактерии р.р. Micrococcus, Curtobacterium, грамотрицательные бак-терии-копиотрофы р. Flavobacterium на цианобактериях и р. р. Methylobacterium, Azospirillum - на тростнике, а также типичные эврибионты - коринеподобные-бактерии р. Rhodococcus. На цианобактериях обнаружены единичные представители бактерий гидролитического комплекса - р. р. Cytophaga, Myxobacterium, Bacillus.Таксономический состав бактериальных сообществ на заключительном этапе сукцессии в условиях модельного эксперимента представлен в табл. 2.
Растительный материал 4. Сетка
Песок 5. Стеклянный колпак
Вода 6. Пластиковый циллиндр
Рис. 1. Схема модельной установки для изучения деструкции растительного материала в условиях
повышенного увлажнения
Таблица 1
Численность и таксономическая структура сообщества бактерий, ассоциированных с цианобактериями р. Anabena и Тростником обыкновенным на глюкозо-пептонно-дрожжевой среде (живой материал)
| Объект исследования |
Численность КОЕ/г |
Таксономический состав сообщества |
| Цианобактерии |
4,81· 106 |
Rhodococcus, Curtobacterium, Micrococcus, Flavobacterium, Cytophaga, Myxobacterium, Bacillus |
| Тростник обыкновенный |
4,0·104 |
Methylobacterium, Azospirillum, Rhodococcus, Micrococcus, Curtobacterium |
Таблица 2
Сравнительный анализ таксономического состава сообществ бактерий на разлагающихся в условиях модельного эксперимента цианобактериях р. Anabena и Тростнике обыкновенном
Реклама

| Цианобактери р. Anabena |
Тростник обыкновенный |
| Aquaspirillum |
| Pseudomonas |
| Aquaspirillum |
Flavobacterium |
| Pseudomonas |
Curtobacterium |
| Curtobacterium |
Azotobacter |
| Cytophaga |
Cytophaga |
| Myxobacterium |
Myxobacterium |
| Bacillus |
Bacillus |
| Streptomyces |
| Rhodotorula, Cryptococcus, Trichosporon |
| Микромицеты |
Примечание: курсивом выделены названия таксонов бактерий гидролитического комплекса.
Из приведенных данных следует, что на высших растениях (тростник обыкновенный) обнаружено бóльшее таксономическое разнообразие бактерий (12 таксонов), чем на цианобактериях (6 таксонов). На обоих типах субстратов доминируют представители гидролитического комплекса (Cytophaga, Myxobacterium, Bacillus). На тростнике обнаружены также актиномицеты р. Streptomyces, которые всегда принимают активное участие в разложении растительного материала на поздних этапах сукцессии, так как осуществляют деструкцию сложных полимерных соединений. Зафиксированы также бактериико-пиотрофы, которые ассоциированы с гидролитиками и используют простые органические соединения (Aquaspirillum, Pseudomonas, Flavobacterium). Кроме то го, на тростнике выявлены бактерии р. Azotobacter, которые всегда являются спутниками целлюлозоразрушающих бактерий. Обнаружены также дрожжи р.р. Rhodotorula, Cryptococcus, Trichosporon и многочисленные представители микромицетов, которых мы не идентифицировали.
Для подтверждения достоверности результатов, полученных в модельном эксперименте, проведен анализ численности и состава бактерий на тростнике в естественных условиях. Результаты эксперимента представлены в табл. 3.
 Таблица 3 Таблица 3
Численность и таксономический состав бактерий гидролитического комплекса и дрожжей при разложении Тростника обыкновенного в водоеме и в модельном эксперименте
| Условия эксперимента |
Численность КОЕ/г бактерий |
Численность КОЕ/г дрожжей |
Выделенные таксоны бактерий |
| водоем |
2,1·108 |
2,25·105 |
Pseudomonas Flavobacterium Azotobacter Cytophaga Myxobacterium Bacillus Streptomyces |
| модельная установка |
1,2·107 |
1,15·105 |
Aquaspirillum Pseudomonas Flavobacterium Curtobacterium Azotobacter |
| Cytophaga Myxobacterium Bacillus Streptomyces |
 Результаты, представленные в таблице, свидетельствуют о том, что модельный эксперимент может быть использован для изучения сукцессии микроорганизмов. Таким образом, в ходе проведенного исследования нами разработана методика постановки модельного эксперимента по разложению растительного материала в условиях повышенного увлажнения. Результаты, представленные в таблице, свидетельствуют о том, что модельный эксперимент может быть использован для изучения сукцессии микроорганизмов. Таким образом, в ходе проведенного исследования нами разработана методика постановки модельного эксперимента по разложению растительного материала в условиях повышенного увлажнения.
Впервые изучен таксономический состав сообществ бактерий гидролитического комплекса при микробиологическом разложении прокариот - цианобак-терий.
Установлено, что деструкцию цианобактерий осуществляет то же «бактериальное ядро», которое составляет основу микробного сообщества при деструкции высших растений. Это бактерии-гидролитики р.р. Myxobacterium и Cytophaga, а также ассоциированные с ними грамотрицательные бактериико-пиотрофы р.р. Aquaspirillium и Pseudo-monas.
Различия в структуре исследуемых бактериальных комплексов проявляются на уровне крупных таксономических групп. Отмечено полное отсутствие в составе бактериального сообщества на циа-нобактериях актиномицетов, дрожжей и грибов. По-видимому, это связано с различиями химического состава клеточной стенки цианобактерий и высших растений.
Вероятно, в ходе эволюции сложились достаточно стабильные сообщества прокариот, адаптированные к выполнению функции - деструкции растительной биомассы. В связи с этим мы предполагаем, что ожидать каких-либо фундаментальных отличий в структуре бактериальных сообществ при разложении растений разных таксономических групп на уровне эубактерий не следует.
Список
литературы
Bysov B. A., Dobrovolskaja Т. С, Chernjakovskaja T. F., Zenova G. M. Bacterial communities assosiated with soil diplopods // Pedobiologia. 40. 1996.I.
Добровольская Т. Г., Скворцова И. Н., Лысак Л. В. Методы выделения и идентификации почвенных бактерий. М.: Изд-во МГУ, 1989.
Звягинцев Д.Г., Добровольская Т. Г., Лысак Л. В. Растения как центры формирования бактериальных сообществ // Общая биология. 1993. Т. 54. №2.
Звягинцев Д. Г., Добровольская Т. Г., Бабьева И. П. и др. Структурно-функциональная организация микробных сообществ наземных экосистем // Экология в России на рубеже ХХI века. М.: Научный мир, 1999. С. 147-180.
Звягинцев Д. Г., Добровольская Т. Г., Лысак Л. В. Вертикальный континуум бактериальных сообществ в наземных биогеоценозах // Журн. общ. биологии. 1991. Т. 52. № 2. С. 162-171.
Звягинцев Д. Г., Добровольская Т. Г., Лысак Л. В. Растения как центры формирования бактериальных сообществ // Журн. общ. биологии. 1993. Т. 54. №2. С. 183-199.
Определитель бактерий Берджи. / Под ред. Дж. Хоулта, Н. Крига, П. Снита, Дж. Стейли, С. Уилльямса. М., Мир, 1997.
|