1. Общие
сведения.
К ЭХП
будем относить
электрохимические
генераторы
(ЭХГ), т.е. батареи
топливных
элементов
(ТЭ) со вспомогательными
устройствами
и химические
аккумуляторные
батареи. Топливным
элементом
называется
прямой преобразователь
химической
энергии в
электрическую,
в котором реакция
электрохимического
окисления
происходит
без расхода
вещества
электродов
и электролита.
Исходными
реагентами
служат горючее
и окислитель,
обладающие
запасом энергии
химических
связей, которая
преобразуется
в энергию
постоянного
электрического
тока (при получении
конечного
химического
продукта
взаимодействия
компонентов
топлива и выделении
некоторого
количества
тепловой энергии).
В обращенном
или регенераторном
режиме работы
ТЭ подведенная
к нему электроэнергия
преобразуется
в химическую
энергию реагентов
топлива.
Аккумуляторным
элементом,
входящим
в состав химической
АБ, называется
накопитель
электрической
энергии при
ее превращении
в химическую
энергию, который
осуществляет
также и обратное
преобразование
химической
энергии в
электроэнергию
при изменении
состава вещества
электродов
и участии
электролита
в токообразующей
реакции.
Характерным
показателем
технического
качества ЭХП
служит удельная
энергия W*
на единицу
массы преобразователя.
Применяемые
в ЭХГ различные
ТЭ принципиально
могут работать
на горючем
органического
или неорганического
состава. В
качестве
окислителя
используются
преимущественно
кислород O2,
а также перекись
водорода H2O2,
азотная кислота
HNO3,
галогены Cl2,
F2.
При выборе рабочих
тел ЭХГ учитывают:
удельную энергию,
конечные продукты
реакции, стоимость,
агрегатное
состояние
веществ и
связанную
с ним относительную
массу тары
(контейнеров,
баллонов) для
хранения реагентов,
возможность
их непрерывного
подвода к электродам,
скорость
электрохимического
взаимодействия
(при наличии
катализаторов
и при заданных
диапазонах
температуры
и давления).
Наиболе широко
для ЭХГ в качестве
горючего применяется
водород H2
и гидразин
N2O2
в связи с их
высокой активностью,
легкостью
подвода и отвода
конечных
продуктов
реакции, достаточно
высокой удельной
энергией. Известны
разработки
ЭХГ с использованием
метана CH4,
пропана C3H8,
а также метанола
CH3OH,
аммиака NH3,
имеющих относительно
низкую стоимость.
Представляют
интерес перспективные
разработки
полутопливных
элементов (с
подводом только
окислителя)
на основе
встроенного
в элемент
твердотельного
горючего (металлов
Zn, Al, Mg, Li и др.). Отдельные
разновидности
компонентов
топлива относятся
к токсичным
веществам,
например, угарный
газ CO, гидразин,
аммиак, галогены
и т.п. Поэтому
предпочтительно
использование
водород-кислородных
ЭХГ, в особенности
для автономных
бортовых объектов.
Конечным
продуктом
реакции данных
ЭХГ служат
пары воды, эти
ЭХГ являются
экологически
чистыми. После
сепарации и
удаления электролита
вода используется
в системах
жизнеобеспечения,
в частности
на КЛА, либо
направляется
для получения
исходных
продуктов реакции
(H2
и O2)
в регенерационных
циклах.
Общим
достоинством
ЭХГ на ТЭ является
высокий КПД.
Применительно
к автономным
объектам
существенное
значение имеет
бесшумность
работы ЭХГ,
отсутствие
механически
перемещающихся
деталей и
изнашивающихся
частей. Ресурс
ЭХГ определяется
имеющимся
запасом топлива
(в открытых
циклах) либо
долговечностью
вспомогательного
оборудования
в циклах с
регенерацией;
ресурс ЭХГ
может превосходить
104
ч.
Энергетический
уровень ЭХГ
при мощности
АЭУ P=10 - 100 кВт
характеризуется
удельной энергией
W*=(1.5
.. 2)*103
кДж/кг на единицу
массы генератора,
заправленного
топливом. (Для
ряда разновидностей
химических
АБ значение
W*
на порядок
меньше.) В перспективе
возможно создание
ЭХГ мощностью
P=103
кВт при КПД h=0.9.
Недостатки
ЭХГ состоят
в сложности
обеспечения
сбалансированных
электрохимических
реакций и в
относительно
малой удельной
мощности P*
на
единицу массы
генератора.
Без учета массы
запаса топлива
параметр P*=0.15
.. 0.2 кВт/кг несколько
ниже, чем в
химической
АБ. Ввиду специфики
электрохимических
реакций из
ЭХГ нельзя
достаточно
быстро вывести
электрическую
энергию. Для
обеспечения
сбалансированной
реакции в ЭХГ
необходимо
с помощью
специальных
подсистем
обеспечить
разделение
и дозированную
подачу компонентов
топлива, а также
непрерывное
удаление конечных
продуктов
токообразующей
реакции. Показатели
ЭХГ достаточно
чувствительны
к чистоте
химреагентов,
примеси существенно
снижают эффективность
ТЭ, их ресурс.
2. Область
применения.
Применение
ЭХГ нашли в
основном для
энергообеспечения
АЭУ, в том числе
подвижных и
стационарных.
Имеется значительный
опыт, накопленный,
в частности,
за рубежом
(США), по использованию
ЭХГ в разработках
для космических
программ "Апполон",
"Джеммини",
"Скайлеб",
"Спейс Шаттл"
и др. Проводятся
многочисленные
разработки
и исследования
по применению
ЭХГ для наземных
транспортных
установок,
например
электромобилей,
а также для
морских судов.
Традиционно
применяемым
во многих
отраслях техники
видом ЭХП являются
химические
АБ. Наиболее
широко распространены
сравнительно
недорогие
свинцово-кислотные
АБ. Они достаточно
долговечны
по числу допустимых
циклов "заряд
- разряд", но имеют
сравнительно
низкую удельную
энергию (W*<120
кДж/кг). Распространены
также щелочные
никель-железные
и никель-кадмиевые
АБ, для которых
W*<150
кДж/кг. Для АЭУ
разработаны
никель-кадмиевые
и серебряно-цинковые
АБ. Они превосходят
свинцово-кислотные
АБ по W*
в 2 и 3 раза соответственно,
но значительно
дороже. Никель-кадмиевые
АБ существенно
долговечнее,
чем свинцово-кислотные.
Серебряно-цинковые
АБ отличаются
небольшим
числом циклов
"заряд - разряд",
но обеспечивают
высокий КПД
h=0.75 при большой
скорости разряда.
В последние
годы разработаны
химические
АБ на основе
аккумуляторных
элементов с
использованием
никеля, серы,
натрия, лития
и др. Никель-цинковые
щелочные АБ
имеют W*>200
кДж/кг, но их
долговечность
мала. Повышение
долговечности
достигается
в газодиффузионных
никель-водородных
АБ, в которых
W*>250
кДж/кг. Еще более
высокий показатель
(W*>500
кДж/кг) имеют
серно-натриевые
АБ, но их ресурс
составляет
100 - 200 циклов "заряд
- разряд". Дальнейшее
повышение W*
теоретически
до значений
103
кДж/кг возможно
в литиевых
АБ, но их недостаток
- малый ресурс
вследствие
высокой корозионной
активности
Li.
Запас
энергии в
химической
АБ принято
характеризовать
зарядной емкостью
(в Ач или Кл),
необходимое
значение
которой зависит
от мощности
и времени работы
потребителей
электроэнергии.
Химические
АБ получили
широкое распространение
на транспорте,
в системах
электростартерного
запуска авиационных
и автомобильных
двигателей,
в судовых
установках,
на электромобилях,
во внутризаводском
электротранспорте,
на электропогрузчиках
и т.д.
В условиях
КЛА всегда
реализуется
параллельная
работа химической
АБ с ФЭП. Последние
производят
подзарядку
АБ в "дневные"
часы. Для автономных
установок,
в том числе
на КЛА, целесообразно
также сочетание
ФЭП с системой
"электролизер
- ЭХГ". Часть
энергии ФЭП
в "дневные"
часы затрачивается
на разложение
воды, а в "ночные"
часы полученные
H2
и O2
обеспечивают
работу ЭХГ.
3. Физико
- химические
процессы в ЭХГ
Как и
в реакции горения
(активируемого,
например, зажиганием),
стадии токообразующей
электрохимической
реакции также
протекают
одновременно,
но локализованы
в различных
областях
внутреннего
пространства
ТЭ. Основные
данные некоторых
применяемых
на практике
ТЭ приведены
в табл. 1. В качестве
типового приметра
рассмотрим
работу водород
- кислородного
ТЭ. Стехиометрическое
уравнение
суммарной
реакции:
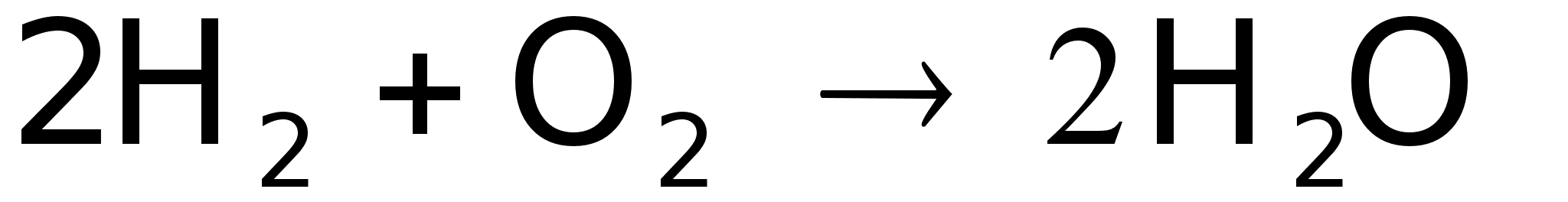
имеет
такой же вид,
как при горении.
Поясним устройство
и принцип действия
ТЭ, в котором
электрохимическая
реакция происходит
на стыках трех
фаз состояния
веществ: газообразной
(восстановителя
H2
и окислителя
O2),
жидкостной
(щелочного
электролита
- раствора KOH) и
твердой (пористых
металлокерамических
электродов).
Схема ТЭ показана
на рис. 1а. Электроды
анод 1 и катод
2 выполнены из
композитного
материала
Таблица
1: Теоретические
значения
удельных показателей
ТЭ для разработанных
ЭХГ.
|
Химические
реагенты
|
Напря-жение
элемента,
В
|
Расход
на единицу
генерируемой
энергии,
г/МДж
|
Энергия
на единицу
массы
топлива,
кДж/кг
|
|
|
горючего
|
окислителя
|
топлива
|
|
|
H2
- O2
|
0.9
|
10.6
|
91.6
|
102.2
|
9750
|
|
C3H8
- O2
|
0.8
|
27
|
91.6
|
118.6
|
8460
|
|
NH3
- O2
|
0.7
|
83.4
|
116.6
|
200
|
5000
|
|
N2H4
- O2
|
0.9
|
91.6
|
91.6
|
183.2
|
5450
|
|
N2H4-H2O2
|
0.9
|
91.6
|
197.4
|
289
|
3470
|
Примечание:
С
учетом влияния
необратимых
электрохимических
процессов в
реальных ТЭ
удельный
расход топлива
возрастает
в 1.5 - 2 раза, а его
удельная энергия
снижается
в 1.5 - 2 раза по сравнению
с соответствующими
теоретическими
показателями,
приведенными
в таблице.
(например,
из графитовой
керамики с
платиновым
катализатором).
Электроды 1 и
2 отделены слоем
электролита
- раствора щелочи
KOH, который не
пропускает
нейтральные
молекулы или
атомы газов
водорода и
кислорода.
Ионизированные
газы, например,
ионы H+,
могут дрейфовать
сквозь электролит.
Корпус ТЭ
выполняется
из титанового
сплава 4, химически
не взаимодействующего
с KOH. Внешняя цепь
ТЭ замкнута
сопротивлением
Rн
нагрузки, которое
подключено
к металлическим
наплавкам на
электродах.
Газообразные
компоненты
химического
топлива - отдающий
свои электроны
восстановитель
H2
и присоединяющий
электроны
окислитель
O2
- - непрерывно
подводятся
под избыточным
давлением к
порам анода
и катода (рис.
1а) из резервуаров
с запасом
реагентов.
1. На
поверхностях
анода, смоченных
р-ром KOH, в электролите
растворяется
газообразный
водород и абсорбируется
на стенках
пор электрода.
В растворе
гидроксид калия
находится в
диссоциированном
состоянии:
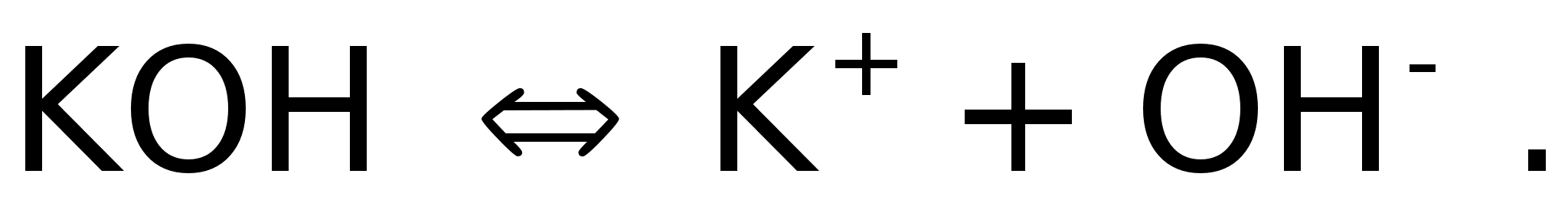
Водород
в присутствии
ионов OH-
он легко отдает
электроны
(окисляется),
образуя воду:


а)
б)
Рис
. 1. Схемы
водородно-кислородных
топливных
элементов:
а - с жидким
электролитом
(раствором
КОН); б - с ионообменной
мембраной
2. На поверхности
катода аналогичные
явления приводят
к реакции
восстановления
кислорода,
который в присутствии
воды отбирает
у этого электрода
образовавшиеся
свободные
электроны:
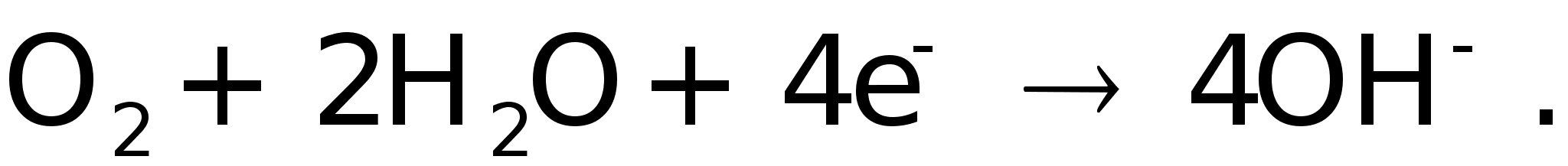
В итоге
этих первой
и второй стадий
"холодного
горения" на
аноде образуется
избыток электронов,
а в примыкающем
растворе - недостаток
ионов гидроксила
OH-.
На катоде же
имеется недостаток
электронов,
а в окружающем
его электролите
- избыток ионов
H+.
Вследствие
этого протекают
следующие две
стадии реакции.
3. По внешнему
участку цепи
от анода к катоду
через сопротивление
Rн
проходят электроны
4e-,
совершая полезную
электрическую
работу (направление
тока I противоположно
перемещению
электронов).
4. В электролите
происходит
диффузия ионов
4OH-
с катода на
анод и посредством
ионного тока
замыкается
электрическая
цепь (согласно
уравнению
непрерывности
полного тока
div J = 0).
Если
сложить реакции
для первой и
второй стадии,
получится
результирующее
уравнение
реакции
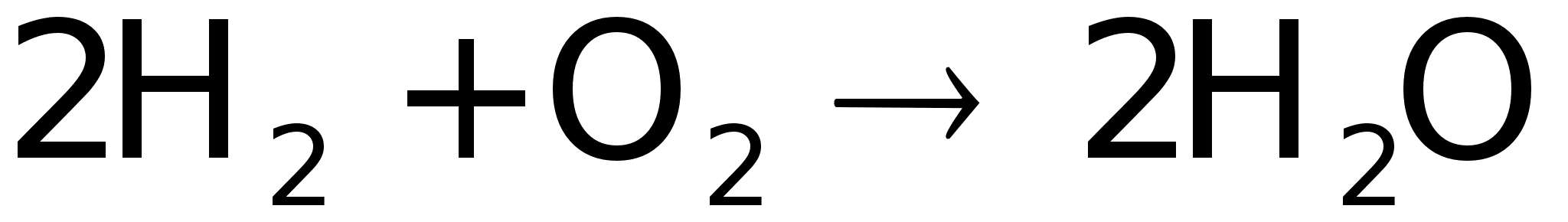 ,
конечным
продуктом
которой является
вода. Избыточное
количество
паров воды 2H2O
удаляют из
ТЭ, например,
с помощью продувки
с последующей
сепарацией
или выпариванием.
Очищенная
от паров электролита,
вода может
направляться
для дальнейшей
утилизации
(рис. 1а). ,
конечным
продуктом
которой является
вода. Избыточное
количество
паров воды 2H2O
удаляют из
ТЭ, например,
с помощью продувки
с последующей
сепарацией
или выпариванием.
Очищенная
от паров электролита,
вода может
направляться
для дальнейшей
утилизации
(рис. 1а).
Сбалансированный
ход реакций
на указанных
стадиях у
поверхностей
электродов
определяется
равновесием
давлений газовой
и жидкостной
фаз: pr
= pэ +
pк
;
здесь
pr
- внешнее давление
газообразных
реагентов (
водорода или
кислорода ); pэ
- гидростатическое
давление
электролита;
pк
=(
cos)/d
-
его
капиллярное
давление в
порах электродов;
- поверхностное
натяжение
(H/м);
- угол смачиваемости;
d - диаметр поры.
В изготовляемых
двухслойными
электродах
ЭХГ поры выполняются
с различными
значениями
d.Слой, который
обращен к газовой
среде(Н2
или
О2)
и содержит
измельченный
катализатор
( например, Pt), имеет
толщину
мми поры с
мкм. В обращенном
к KOH слое с мм
поры имеют d
мкм. Давление
pз
меньше на
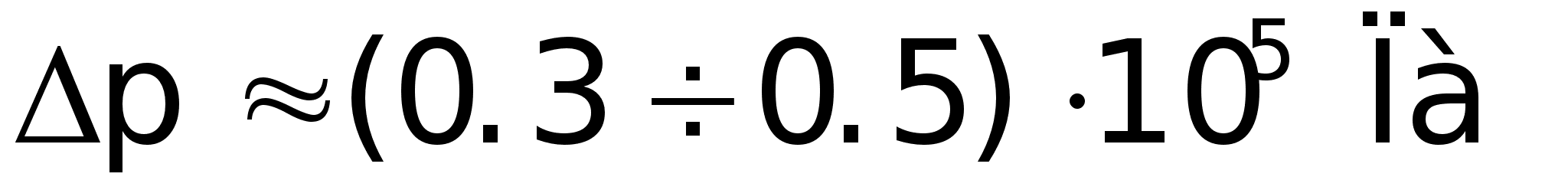
чем давление
 которое препятствует
вытеканию
электролита.
Нейтральные
молекулы или
атомы газообразных
компонентов
при этом значении
pr
также не могут
проникнуть
в электролит,
преодолев капилярные
силы. На поверхности
электродов
обеспечивается
равновесие
фаз, поэтому
через KOH возможно
только ионов,
образовавшихся
в результате
реакций.
которое препятствует
вытеканию
электролита.
Нейтральные
молекулы или
атомы газообразных
компонентов
при этом значении
pr
также не могут
проникнуть
в электролит,
преодолев капилярные
силы. На поверхности
электродов
обеспечивается
равновесие
фаз, поэтому
через KOH возможно
только ионов,
образовавшихся
в результате
реакций.
Наряду
с KOH в ТЭ возможно
использование
кислотного
электролита
- раствора H2SO4.
Требующееся
испарение
воды из элементов
с жидкостным
электролитом,
работающих
при давлении
5Ч105
Па и более,
определяет
эксплуатацию
ТЭ на среднетемпературном
( 373 - 523 К ) или высокотемпературном
( боле 523 К ) уровне,
что обусловливает
необходимость
наличия в составе
ЭХГ ряда технически
сложных вспомогательных
устройств.
Для преодоления
таких затруднений
применительно
к АЭУ разработаны
водород - кислородные
ТЭ с ионообменными
мембранами
(ИОМ) в виде
квазитвердых
веществ (гелей),
разделяющих
разнополярные
электроды в
ТЭ. Изготовляют
ИОМ из фтороуглеродистого
аналога тефлона.
На полимерной
сетке - матрице
закреплены
ионы, они могут
обмениваться
на другие ионы,
присутствующие
в межэлектронной
среде. На практике
для ТЭ применяют
ИОМ с сульфатными
катионами,
например,
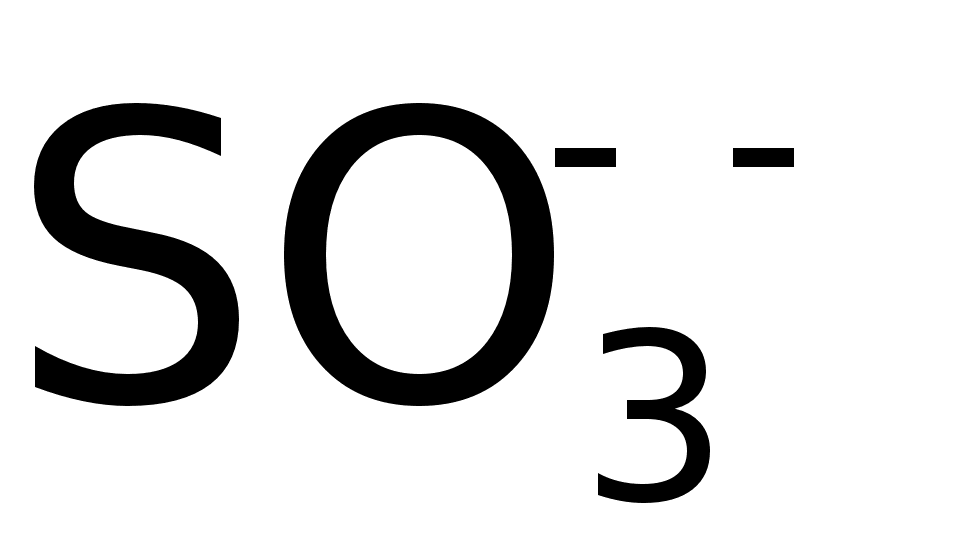 По
своим функциям
ИОМ подобна
электролиту,
она способна
противостоять
воздеймтвию
нейтральных
молекул и атомов
H2
и O2.
Схема ТЭ с ИОМ
приведена на
рис. 1б. Пористые
керамические
электроды 1 и
2 прижаты к мембране
3. Контактирующие
с ИОМ поверхности
анода и катода
покрыты каталитическими
слоями металла.
Принцип работы
ТЭ с ИОМ состоит
в следующем. По
своим функциям
ИОМ подобна
электролиту,
она способна
противостоять
воздеймтвию
нейтральных
молекул и атомов
H2
и O2.
Схема ТЭ с ИОМ
приведена на
рис. 1б. Пористые
керамические
электроды 1 и
2 прижаты к мембране
3. Контактирующие
с ИОМ поверхности
анода и катода
покрыты каталитическими
слоями металла.
Принцип работы
ТЭ с ИОМ состоит
в следующем.
На аноде
подводимый
газообразный
водород ионизируется
по реакции:
 . .
Ионы
водорода под
влиянием градиента
их концентрации
и соответствующего
электрического
поля перемещаются
сквозь ИОМ к
катоду, на
котором протекает
реакция:
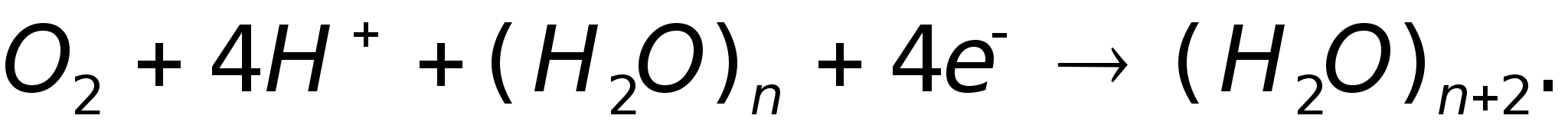
Электроны
4e-
через Rн
поступают к
катоду. Полученная
вода (H2O)n
под действием
градиента ее
концентрации
возвращается
к аноду. Две
молекулы воды
(2H2O),
образующиеся
в элементарном
акте реакции,
необходимо
отводить из
зоны реакции,
например, дренажным
устройством.
При работе ТЭ
гель в ИОМ набухает
и находится,
как указывалось,
в квазитвердом
состоянии.
Кроме
ИОМ в ТЭ применяются
также капилярные
мембраны типа
волокнистых
материалов,
пропитанных
щелочным
электролитом
(например, асбест).
Принцип действия
ТЭ с капилярными
мембранами
такой же, как
ТЭ с жидкостным
электролитом.
В отдельных
установках
возможно
использование
ЭХГ с ТЭ, работающими
на других
компонентах
топлива, кроме
H2
- O2.
Итоговая
электрохимическая
реакция окисления
восстановителя
Red и восстановителя
Ox имеет в общем
случае вид
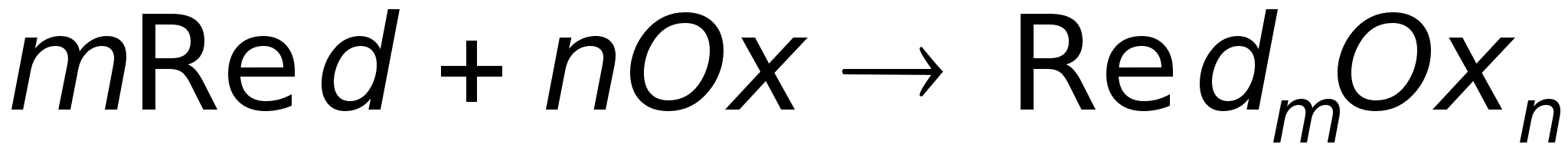
В ТЭ
имеет место
встречное
движение
разнополярных
ионов внутри
электролита
и переход электронов
от анода к катоду
по сопротивлению
Rн,
замыкающему
внешнюю цепь.
При этом осуществляется
прямое преобразование
энергии химических
связей Red и Ox в
электрическую
энергию. Конкретизацию
общей формы
записи токообразующих
реакций рассмотрим
примере окисления
гидразина
N2H4.
Реакция окисления
гидразина
имеет место
в ЭХГ малой
мощности.
Анодное
окисление
гидразина:
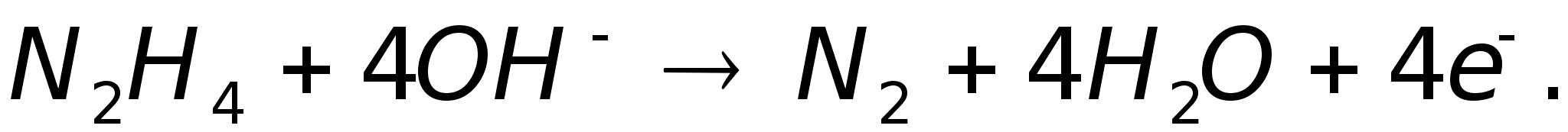
Катодное
восстановление
кислорода:
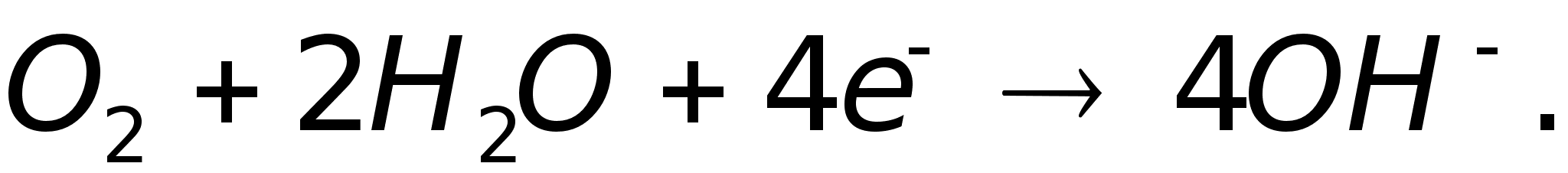
Суммарное
стехиометрическое
уравнение
реакции:

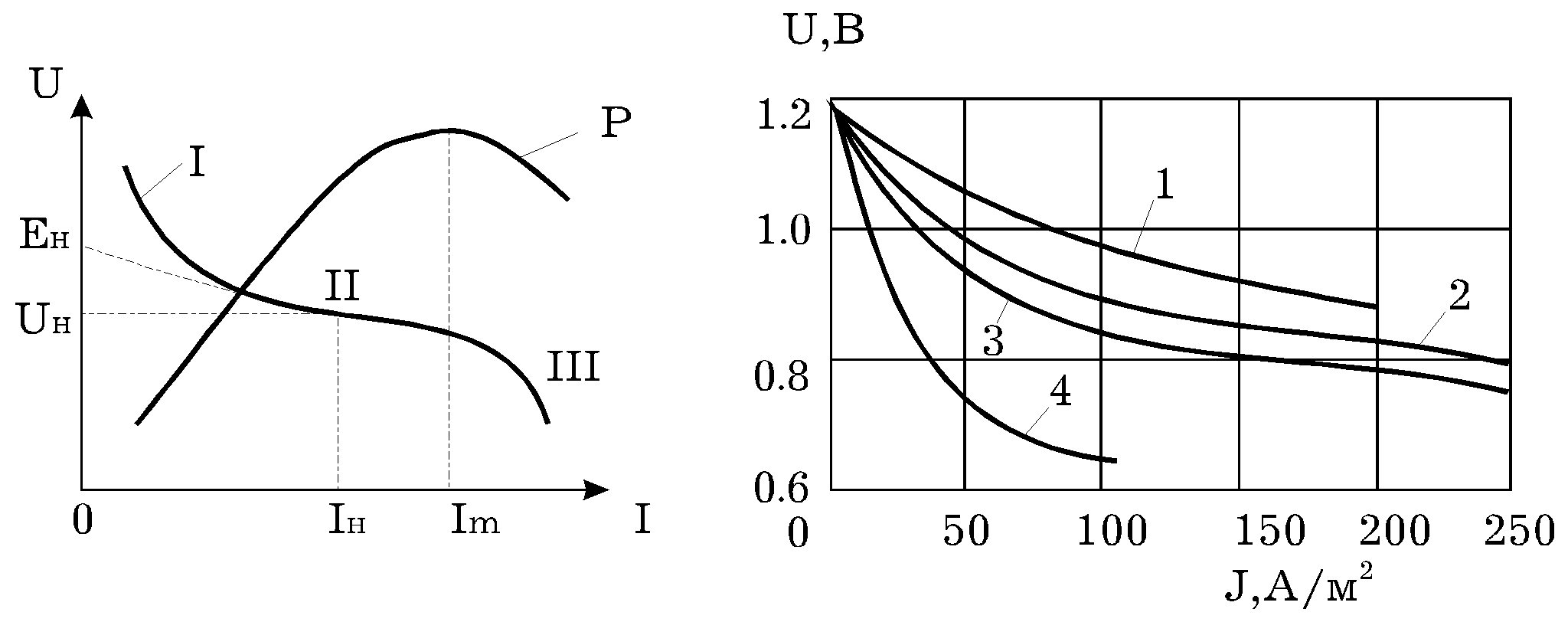
График
зависимости
U от I
а)
б)
Рис.
2:
Характеристики
водородно -
кислородного
ЭХГ:
а
- общая форма
характеристикии
и зависимость
полезной мощности
от тока;
б
- аналоги внешней
характеристики
- зависимости
напряжения
от плотности
тока для ТЭ
различного
исполнения
(1-с раствором
электролита;
2-с капилярной
мембраной;
3-с ИОМ при Т=355
К; 4-с ИОМ при Т=313
К).
Внешняя
характеристика
U=f(I).
Отклонение
от состояния
равновесия
при работе ТЭ
практически
приводит к
уменьшению
напряжения
и снижению
КПД по сравнению
с их термодинамическими
значениями
вследствие
изменения
потенциала
катода и анода
при прохождении
тока в цепи
ТЭ. Совокупность
этих явлений
называют
поляризацией.
При совершении
работы выхода
(активации)
из металла
электрода в
раствор электролита
электрон преодолевает
потенциальный
барьер, образованный
двойным слоем
разноименных
зарядов. На
границе "электрод
- электролит"
наблюдается
различие
концентраций
ионизированных
реагентов.
Электролит
и электроды
имеют собственное
внутреннее
сопротивление.
Упрощенно,
совместное
влияние перечисленных
эффектов можно
учесть с помощью
падения напряжения
на нелинейном
внутреннем
сопротивлении
ТЭ Rвн.
При этом уравнение
внешней характеристики
приближенно
записывается
в виде
U = Eн
- IRвн.
где Eн
- ЭДС при нагрузке,
учитывающая
активационную
и концентрационную
поляризацию;
сопротивление
электролита
Rэл
практически
равно Rвн
и учитывает
"омическую"
поляризацию.
Общая
форма внешней
характеристики
ЭХГ показана
на рис. 2а. Большая
крутизна | dU /
dI | при малых и
повышенных
значениях
тока обусловлена
соответственно
поляризацией
активации
электродов
(участок 1) и
приграничной
поляризацией
концентрации
(участок 3). Линейный
участок 2 с
относительно
малой крутизной
| dU / dI | отражает
влияние в основном
"омической"
поляризации.
На рис. 2б. приведены
аналоги внешних
характеристик
U = U(J) для конкретных

Рис.
3: Схемы
ЭХГ:
а
- последовательно-параллельное
соединение
топливных
элементов;
б
- упрощенная
электрическая
схема замещения.
ТЭ. Геометрическая
плотность тока
J (на единицу
кажущейся
поверхности
электрода) может
при кратковременных
режимах достигать
0.1 - 0.2 А/см2.
Электрическая
схема ЭХГ,
построенная
по матричному
принципу, дана
на рис. 3а;
(Iэ,
Uэ
- ток и напряжение
ТЭ). Упрощенная
схема замещения
ТЭ представленна
на рис. 3б. сли
при T = const рассматривать
ТЭ как линейный
элемент с
постоянными
эквивалентными
параметрами

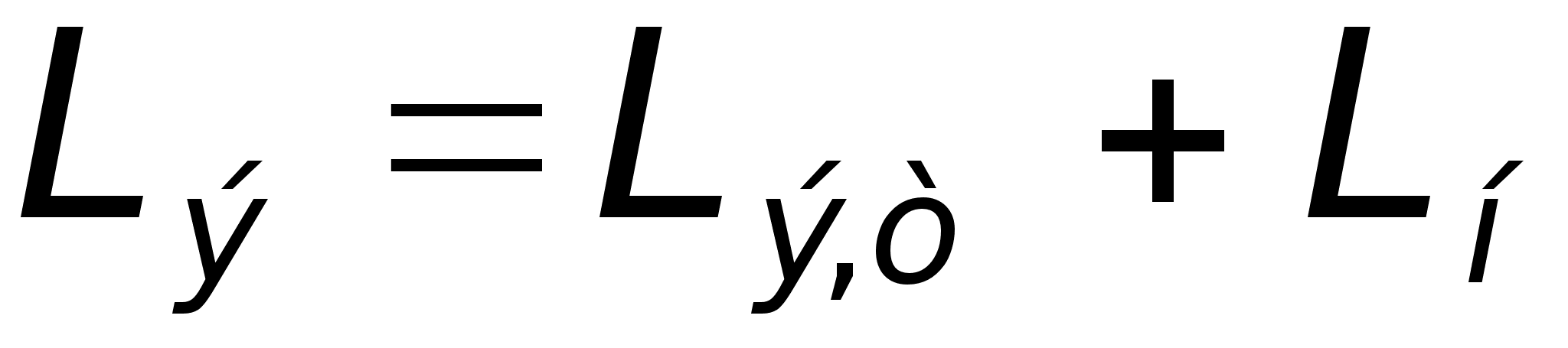
где Rн,
Lн
- сопротивление
и индуктивность
нагрузки; Lэ,т
- индуктивность
электродови
токоотводов,
то процесс
разряда ТЭ
описывается
уравнением:
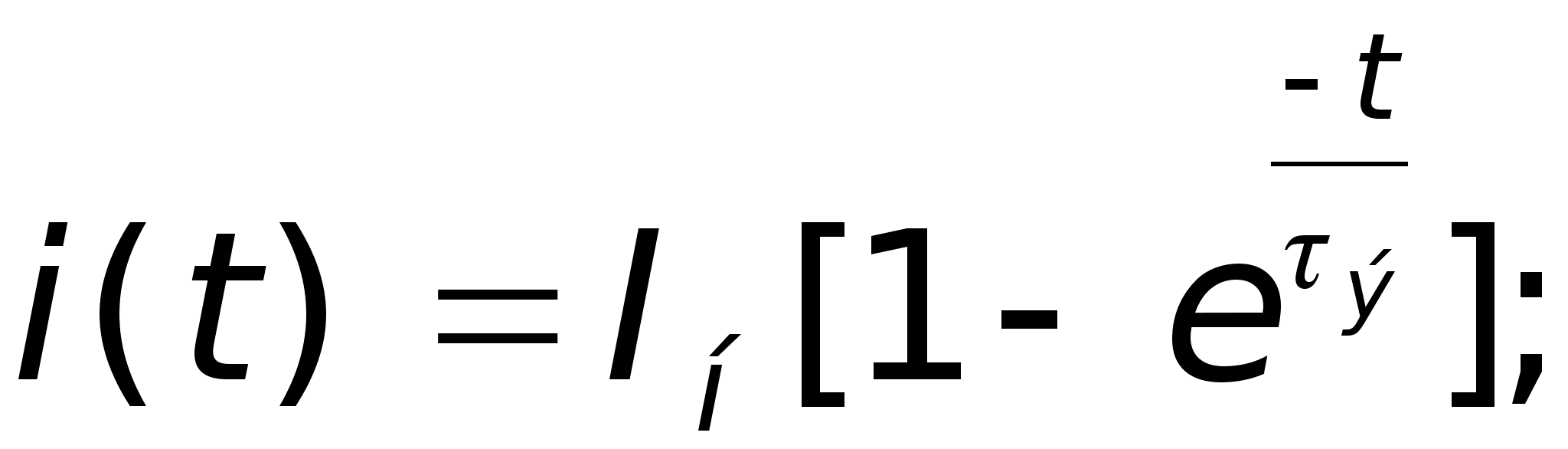
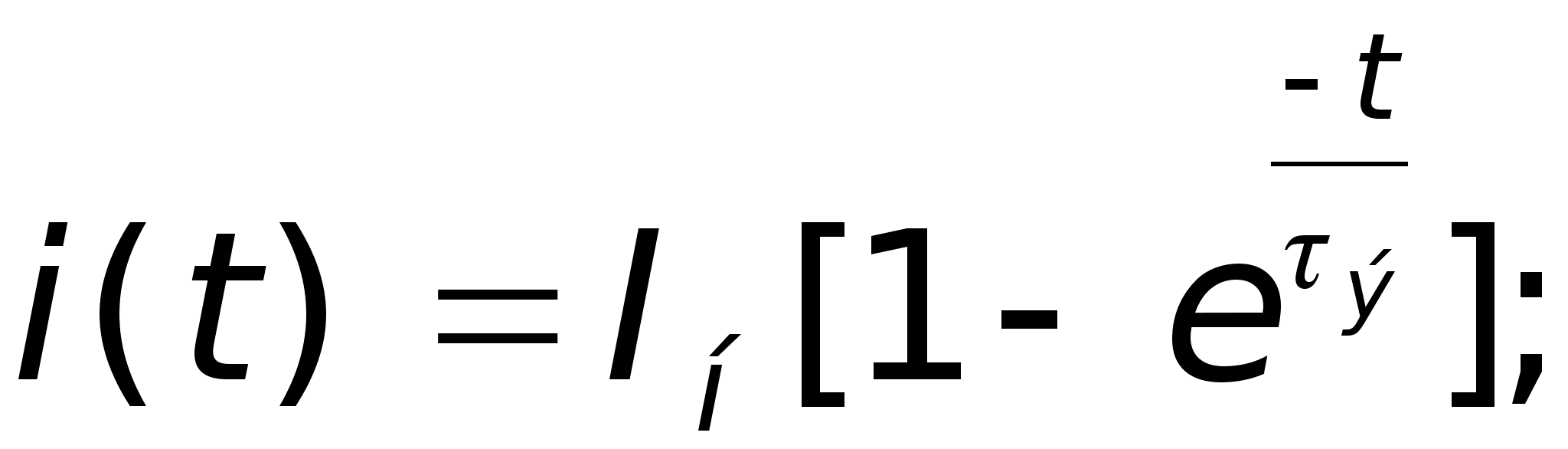
Здесь
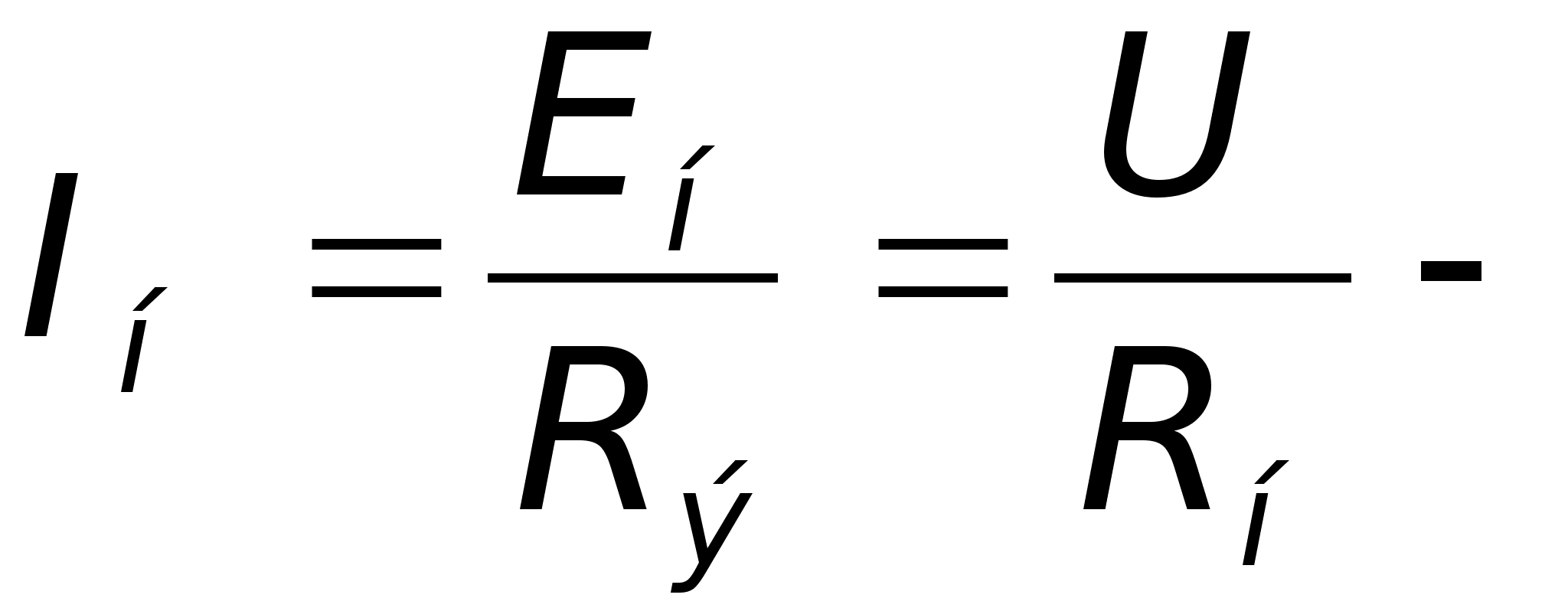 установившийся
ток нагрузки;
установившийся
ток нагрузки;
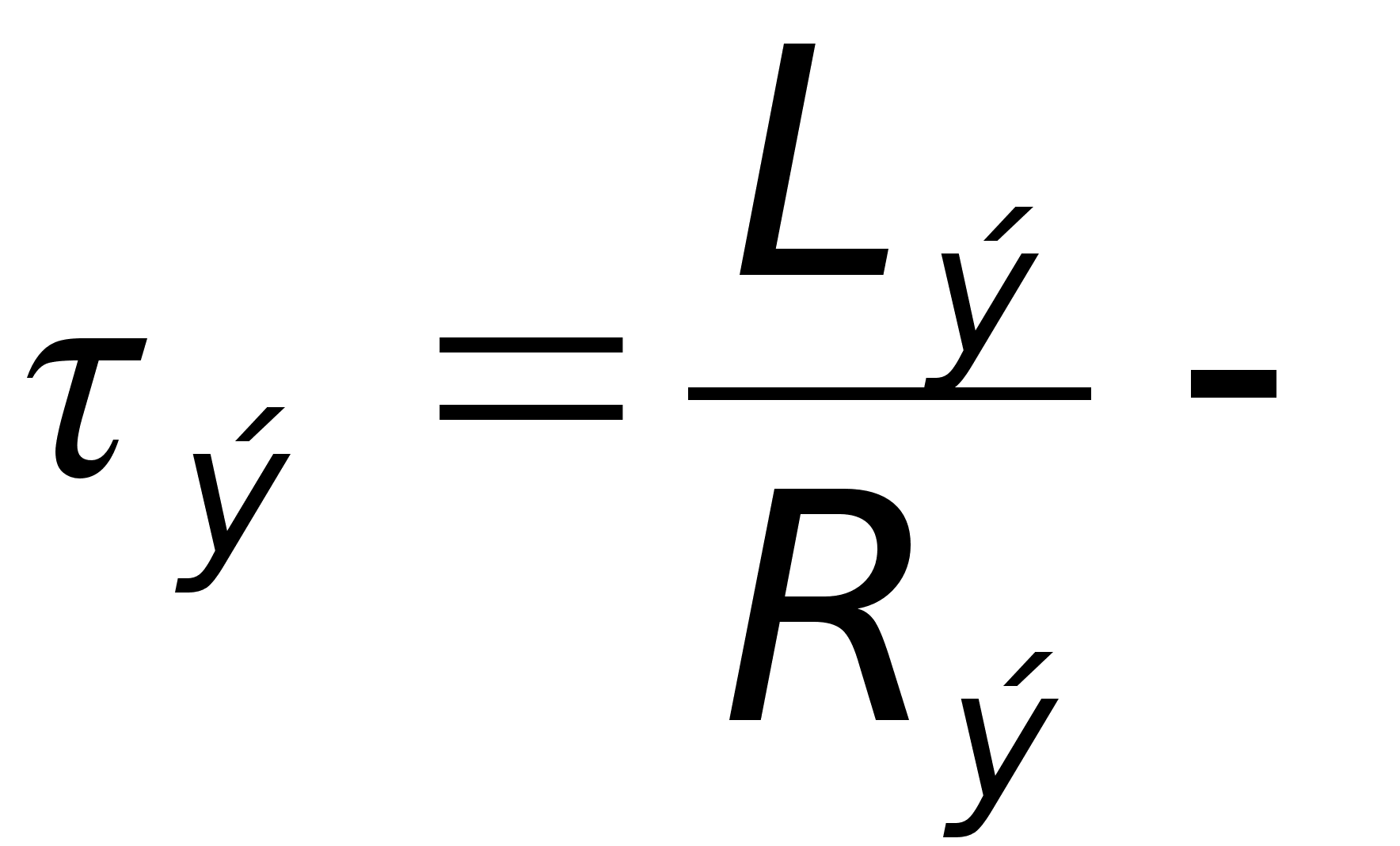 эквивалентная
постоянная
времени.
эквивалентная
постоянная
времени.
Электроэнергетические
установки
на базе электрохимических
генераторов.
ЭХГ в
целом кроме
батареи ТЭ
и вспомогательного
оборудования
включает ряд
блоков, снабженных
взаимными
прямыми и обратными
связями для
обеспечения
функционирования
в заданном
режиме. Можно
классифицировать
ЭХГ как техническую
систему, состоящую
из соответствующих
подсистем.
Укрупненная
схема ЭХГ
(рис. 4.) в качестве
главной подсистемы
содержит батарею
топливных
элементов
БТЭ, а также
подсистемы:
хранения горючего
ПХГ и окислителя
ПХО; обработки
горючего ПОГ
и окислителя
ПОО; подачи
горючего ППГ
и окислителя
ППО. Наряду с
ними имеются
подсистемы
отводов продуктов
реакции ПОПР,
теплоотвода
ПТО и подсистема
контроля и
автоматики
ПКА, которая
соединена
двусторонними
связями с
подсистемами
подачи и отвода.
К подсистеме
потребления
и регулирования
электроэнергии
ППРЭ подключена
БТЭ.
Применительно
к водород - кислородному
ЭХГ в ПХГ, ПХО
осуществляется
криогенное
хранение сжиженных
компонентов
топлива, в ПОГ,
ПОО производится
нагрев H2
и O2
, которые в
газообразном
состоянии
подводятся к
ППГ, ППО. Эти
подсистемы
производят
дозированную
подачу реагентов
при заданных
параметрах
(давлении,
температуре)
в БТЭ, где происходит
реакция электрохимического
окисления.
Удаление паров
воды в ЭХГ
выполняет ПОПР.
Для ЭХГ, применяемых
на КЛА, важное
значение имеет
ПТО, содержащая
холодильник
- излучатель,
к которому
тепло доставляется
с помощью
циркуляционных
устройств с
жидкостным
теплоносителем.
Для КЛА
многоразового
использования
"Спейс Шаттл"
фирма "Дженерал
Электрик" (США)
выполнила ЭХГ
с водород - кислородными
ТЭ, имеющими
позолоченные
электроды с
платиновыми
катализаторами.
Электроды
разделены ИОМ,
во избежание
высушивания
которых организован
отвод тепла
от анода, что
создает движущий
градиент
концентрации
для возвращения
H2O
к аноду. Отвод
воды - продукта
реакции - реализован
с помощью
автоматически
действующей
схемы с микропористым
сепаратором
и волокнистыми
фитилями,
выступающими
из сборки ТЭ.
На рис. 5. дана
упрощенная
функциональная
схема подобного
ЭХГ, в составе
которого находится
батарея топливных
элементов
БТЭ из 76 ТЭ с
ИОМ.

Рис.
4. Функциональная
схема ЭХГ с ТЭ
на ИОМ ( 1 - теплообменник;
2 - сепаратор
воды; 3 - блок
увлажнения
реагентов и
регулирования
давления воды;
4 - компенсатор
давления электролита;
5, 6 насосы; 7 - излучатель
тепла; 8 - тракт
продувки кислорода;
9 - тракт отвода
Н2О
в сборный бак)
Две секции
БТЭ, имеющие
по 38 ТЭ, соединены
параллельно
и генерируют
электрическую
мощность 5 кВт.
Батарея размещена
в цилиндрическом
контейнере
диаметром
0,33 м и габаритной
длиной 0,94 м. Удельная
масса БТЭ без
заправки равна
11 кг/кВт. Эксперименты
показали, что
сборка ТЭ
способна работать
более 5000 ч без
деградации
ИОМ при температуре
до 455 К.
На КЛА
многоразового
использования
"Буран" установлены
четыре ЭХГ
мощностью
по 10 кВт ( суммарная
мощность 40 кВт
) серии "Фотон"
на водород -
кислородном
топливе H2
- О2.
Напряжение
одного генератора,
состоящего
из 128 топливных
элементов,
составляет
29,2 В ( схема генератора
содержитчетыре
параллельные
ветви, в каждой
из которых
включено
последовательно
по 32 элемента).
Масса ЭХГ
составляет
145 кг, масса его
блока автоматики
- 15 кг ( удельная
масса 14,5 кг/кВт,
а с учетом
блока автоматики
- 16 кг/кВт ). Ресурс
ЭХГ равен 2000 ч,
его КПД 62%
Для длительной
эксплуатации
в АЭУ перспективны
установки,
в которых ЭХГ
работает совместно
с регенератором
компонентов
топлива, разлагающим
воду на водород
и кислород.
Электролиз
воды требует
подведения
извне энергии
для разрыва
валентной
химической
связи
Н - О - Н.
При мощностях
менее 1 кВт
целесообразно
интегральное
исполнение
ЭХГ и электролизера
воды (ЭВ). При
более высоких
электрических
мощностях
ЭХГ и электролизер
воды в раздельном
исполнении
имеют лучшие
технико-экономические
показатели,
чем у интегрального
устройства.
В зависимости
от вида подводимой
к регенератору
Р энергии
принципиально
возможны различные
способы разложения
воды. Высоким
КПД отличается
электролиз
при пропускании
через Н2О
электрического
тока: отношение
теплоты сгорания
полученного
топлива к
энергозатратам
на выделение
Н2
и О2
достигает
70 - 80%. В особенности
электролиз
эффективен
для АЭУ на КЛА
при использовании
Солнца в качестве
источника
первичной
энергии с
последующим
ее преобразованием
в ФЭП.
Разложение
воды на Н2
и О2
можно реализовать
непосредственно
в ТЭ при пропускании
тока в обратном
направлении
по отношению
к току генераторного
режима, используя
принцип обратимости
ТЭ, который
выполняет роль
электролизной
ячейки. При
таком способе
регенерации
компонентов
топлива ресурс
регенеративного
ТЭ ограничен
объемом резервуаров
для хранения
Н2
и О2.
Известны
регенеративные
ТЭ, в которых
полученные
газы Н2
и О2
хранятся в
пористых или
губчатых
устройствах
внутри ТЭ. Данный
тип ТЭ по принципу
дествия формально
аналогичегн
химической
АБ, причем
электрическая
емкость регенеративного
ТЭ определяется
количеством
адсорбированных
газов. Как и
ТЭ, возможно
выполнение
электролизной
ячейки с электролитом,
ИОМ или капиллярной
мембраной.
Прикладываемое
к электролизной
ячейке при
электролизе
напряжение
на 30 - 80% должно
превосходить
напряжение,
генерируемое
ТЭ, поскольку
поляризационные
эффекты в
электролизной
ячейке проявляются
сильнее, чем
в ТЭ.
Регенеративная
электроэнергетическая
установка
(РЭУ) космической
долговременной
технологической
базы включает
восемь идентичных
модулей данного
типа, средняя
энергетическая
мощность каждого
из которых
составляет
12,5 кВт. Газовые
баллоны рассчитаны
на запас реагентов
кг, рабочее
давление в
баллонах
поддерживается
в диапазоне
Па. За один цикл
разрядного
режима расходуется
3.03 кг реагентов
(условная степень
разрядки 33%). Регулятор
постоянного
тока, компенсирующий
падение напряжения
на выходе ЭХГ,
позволяет вдвое
повысить ресурс
ТЭ, который
может доходить
до 10 лет.
Список
сокращений:
ЭХП
- электрохимический
преобразователь;
ЭХГ
- электрохимический
генератор;
ТЭ
- топливный
элемент;
КЛА
- космический
летательный
аппарат;
АБ
- аккумуляторная
батарея;
АЭУ
- автономная
энергетическая
установка;
ФЭП
- фотоэлектрические
преобразователи;
ИОМ
- ионообменная
мембрана;
БТЭ
- батарея
топливных
элементов;
ПХГ
- подсистема
хранения горючего;
ПХО
- ==||==
==||== окислителя;
ПОГ
- ==||==
обработки
Г.;
ПОО
- ==||== ==||==
O.;
ППГ
- ==||==
подачи Г.;
ППО
- ==||==
==||== О.;
ПОПР
- ==||== отвода
продуктов
реакции;
ПТО
- ==||==
теплоотвода;
ПКА
- ==||==
контроля и
автоматики;
ППРЭ
- ==||==
потребления
и регулирования
электроэнергии;
РЭУ
- регенеративная
электроэнергетическая
установка.
Литература:
Алиевский
Б.Л. Специальные
электрические
машины.
М.:Энергоатомиздат,
1993.
Список
основных
сокращений:
АБ
- аккумуляторная
батарея;
АЭУ
- автономная
энергетическая
установка;
БТЭ
- батарея
топливных
элементов;
ИОМ
- ионообменная
мембрана;
ПКА
- подсистема
контроля и
автоматики;
КЛА
- космический
летательный
аппарат;
ПОГ
- подсистема
обработки
горючего;
ПОО
- подсистема
обработки
окислителя;
ПОПР
- подсистема
отвода продуктов
реакции;
ППГ
- подсистема
подачи горючего;
КПД
- коэффицент
полезного
дейсвия;
ППО
- подсистема
подачи окислителя;
ППРЭ
- подсистема
потребления
и регулирования
электроэнергии;
ПХГ
- подсистема
хранения горючего;
ПХО
- подсистема
хранения
окислителя;
ПТО
- подсистема
теплоотвода;
РЭУ
- регенеративная
электроэнергетическая
установка;
ТЭ
- топливный
элемент;
ФЭП
- фотоэлектрические
преобразователи;
ЭХП
- электрохимический
преобразователь;
ЭХГ
-
электрохимический
генератор.
|