Московская Государственная Академия
Тонкой Химической Технологии
Имени М.В. Ломоносова
Курсовая Работа
По дисциплине: Основы Химической Технологии
На тему:
Производство серной кислоты из серы.
Преподаватель:
Игумнов Михаил Степанович
Студент
: Троян Наталья Сергеевна
Группа М-32
Москва.1999
Содержание
Введение........................................................................................ 3
Исходное сырье......................................................................... 7
Характеристика целевого продукта.................................. 8
Химическая схема процесса.............................................. 10
1.Сжигание серы.
......................................................................... 10
2. Контактное окисление SO2
в SO3
............................................ 11
3.Абсорбция триоксида серы.
..................................................... 12
Задание для расчета.............................................................. 14
Выполнение расчета.............................................................. 15
1.Составляем блок-схему производства.
.................................. 15
2. Составление уравнений по каждому узлу.
............................. 16
3.Материальный баланс.
............................................................. 19
Список литературы................................................................. 20
Серная кислота – наиболее сильная и самая дешевая кислота. Среди минеральных кислот, производимых химической промышленностью, серная кислота по объему производства и потребления занимает первое место. Серная кислота не дымит, в концентрированном виде не разрушает черные металлы, в то же время является одной из самых сильных кислот, в широком диапазоне температур (от –40…-20 до 260 – 336,5*С) находится в жидком состоянии. Она широко используется в производстве минеральных удобрений, различных солей и кислот, всевозможных органических продуктов, красителей, дымообразующих и взрывчатых веществ и т.д. Серная кислота находит разнообразное применение в нефтяной, металлургической, металлообрабатывающей, текстильной, кожевенной и других отраслях промышленности, используется в качестве водоотталкивающего и осушающего средства, применяется в процессах нейтрализации, травления и т.д. Наиболее важные области применения серной кислоты отражены на схеме.
Реклама

Еще в XIII веке серную кислоту получали в незначительных количествах термическим разложением железного купороса FeSO4
, поэтому и сейчас один из сортов серной кислоты называется купоросным маслом, хотя уже давно серная кислота не производится из купороса.
В настоящее время серная кислота производится двумя способами: нитрозным, существующим более 200 лет, и контактным, освоенным в промышленности в конце ХIХ и начале ХХ века. Контактный способ вытесняет нитрозный (башенный). Первой стадией сернокислотного производства по любому методу является получение диоксида серы при сжигании сернистого сырья. После очистки диоксида серы (особенно в контактном методе) ее окисляют до триоксида серы, который соединяют с водой с получением серной кислоты. Окисление SO2
в SO3
в обычных условиях протекает крайне медленно. Для ускорения процесса применяют катализаторы.
В настоящее время контактным методом получают концентрированную серную кислоту, олеум и 100% серный ангидрид.
Одновременно с увеличением объема производства серной кислоты расширяется ассортимент продукции сернокислотных заводов, организуется выпуск особо чистой кислоты, 100% SO2
, высококачественного олеума и кислоты, а также увеличивается производство новых продуктов на основе SO2
. Кроме олеума, концентрированной серной кислоты и аккумуляторной кислоты, отечественные заводы выпускают также более чистую контактную кислоту улучшенного качества (для производства искусственного волокна, титановых белил и др.), чистый олеум, химически чистую и реактивную серную кислоту.
За последние годы в процессе производства серной кислоты внесены существенные улучшения. Широко применяется обжиг колчедана в кипящем слое и сжигание серы в циклонной печи, значительно увеличивается использование тепла, выделяющегося приобжиге сырья, и на других стадиях производства серной кислоты. Непрерывно повышается производительность башенных сернокислотных систем в результате поддержания оптимального технологического режима, разработанного на основе исследований; интенсивность башенных систем достигает 250 кг/м3
в сутки. Освоен контактно-башенный процесс производства серной кислоты, при котором расход HNO3
составляет 6 – 7 кг на 1 тонну H2
SO4
.
В контактном
методе производства серной кислоты окисление диоксида серы в триоксид осуществляется на твердых контактных массах. Благодаря усовершенствованию контактного способа производства, себестоимость более чистой и высококонцентрированной контактной серной кислоты лишь незначительно выше, чем башенной. В настоящее время свыше 90% всей кислоты производится контактным способом.
Реклама

В качестве катализаторов контактного процесса теперь применяется термически стойкая ванадиевая контактная масса (в виде гранул и колец) с пониженной температурой зажигания. Проведены работы по освоению процесса окисления SO2
в кипящем слое катализатора. Важным усовершенствованием является двойное контактирование, при котором обеспечивается высокая степень окисления SO2
на катализаторе (до 99,8%) и потому исключается необходимость в дополнительной санитарной очистке отходящих газов.
Внедряется процесс конденсации H2
SO4
, заменяющий абсорбцию серного ангидрида.
Также для производства серной кислоты используют ангидрид или безводный сульфат кальция CaSO4
, гипс или двуводную соль CaSO4
*2H2
O и фосфогипс, представляющий собой отход производства концентрированных фосфорных удобрений (смесь гипса, соединений фтора, окислов фосфора, SO2
и других примесей).
В нитрозном
способе катализатором служат оксиды азота. Окисление SO2
происходит в основном в жидкой фазе и осуществляется в башнях с насадкой. Поэтому нитрозный способ по аппаратурному признаку называют башенным
. Сущность нитрозного метода состоит в том, что обжиговый газ обрабатывается серной кислотой, в которой растворены окислы азота. Сернистый ангидрид обжигового газа поглощается нитрозой, и затем окисляется окислами азота по реакции: SO2
+ N2
O3
+ H2
O = H2
SO4
+ 2NO. Образующийся NO плохо растворим в нитрозе и выделяется, а затем частично окисляется кислородом до NO2
. Смесь NO и NO2
вновь поглощается H2
SO4
.
Промышленность выпускает три вида товарной серной кислоты:
Башенная кислота: С=75%, tкрист
= -29,5*С
Контактная кислота: С=92,5%, tкрист
= -22,0*С
Олеум: С=20% своб. SO3
, tкрист
= +2*С
Схема применения серной кислоты

Традиционно основными источниками сырья являются сера и железный (серный) колчедан. Около половины серной кислоты в СССР получали из серы, треть – из колчедана. Значительное место в сырьевом балансе занимают отходящие газы цветной металлургии, содержащие диоксид серы.
В целях защиты окружающей среды во всем мире принимаются меры по использованию отходов промышленности, содержащих серу. В атмосферу с отходящими газами тепловых электростанций и металлургических заводов выбрасывается диоксида серы значительно больше, чем употребляется для производства серной кислоты. Из-за низкой концентрации SO2
в таких отходящих газах их переработка пока еще не всегда осуществима.
В то же время отходящие газы – наиболее дешевое сырье, низки оптовые цены и на колчедан, наиболее же дорогостоящим сырьем является сера. Следовательно, для того чтобы производство серной кислоты из серы было экономически целесообразно, должна быть разработана схема, в которой стоимость ее переработки будет существенно ниже стоимости переработки колчедана или отходящих газов.
Серная кислота может существовать как самостоятельное химическое соединение H2
SO4
, а также в виде соединений с водой H2
SO4
*2H2
O, H2
SO4
*H2
O, H2
SO4
*4H2
O и с триоксидом серы H2
SO4
*SO3
, H2
SO4
*2SO3
.
В технике серной кислотой называют и безводную H2
SO4
и ее водные растворы (по сути дела, это смесь H2
O, SO2
и соединений H2
SO4
*nH2
O) и растворы триоксида серы в безводной H2
SO4
– олеум (смесь H2
SO4
и соединенийH2
SO4
*nSO3
).
Безводная серная кислота – тяжелая маслянистая бесцветная жидкость, смешивающаяся с водой и триоксидом серы в любом соотношении. Физические свойства серной кислоты, такие, как плотность, температура кристаллизации, температура кипения, зависят от ее состава.
Безводная 100%-ная кислота имеет сравнительно высокую температуру кристаллизации 10,7 *С. Чтобы уменьшить возможность замерзания товарного продукта при перевозке и хранении, концентрацию технической серной кислоты выбирают такой, чтобы она имела достаточно низкую температуру кристаллизации. Промышленность выпускает три вида товарной серной кислоты.
| Концентрация
|
Температура кристаллизации, *С
|
| Башенная кислота |
75% |
-29*C |
| Контактная кислота |
92,5% |
-22*C |
| Олеум |
20% своб.SO3
|
+2*C |
Серная кислота и вода образуют азеотропную смесь состава 98,3% H2
SO4
и 1,7% H2
O с максимальной температурой кипения (336,5*С). Состав находящихся в равновесии жидкой и паровой фаз для кислоты азеотропной концентрации одинаков; у более разбавленных растворов кислоты в паровой фазе преобладают пары воды, в паровой фазе над олеумом высока равновесная концентрация SO3
.
Серная кислота весьма активна. Она растворяет оксиды металлов и большинство чистых металлов, вытесняет при повышенной температуре все другие кислоты из солей. Особенно жадно серная кислота соединяется с водой благодаря способности давать гидраты. Она отнимает воду у других кислот, от кристаллогидратов солей и даже кислородных производных углеводородов, которые содержат не воду как таковую, а водород и кислород в сочетании Н:О=2. Дерево и другие растительные и животные ткани, содержащие целлюлозу (С6
Н10
О5
), крахмал и сахар, разрушаются в концентрированной серной кислоте; вода связывается с кислотой и от ткани остается лишь мелкодисперсный углерод. В разбавленной кислоте целлюлоза и крахмал распадаются с образованием сахаров. При попадании на кожу человека концентрированная серная кислота вызывает ожоги.
При получении обжигового газа путем сжигания серы отпадает необходимость очистки от примесей. Стадия подготовки будет включать лишь осушку газа и утилизацию кислоты. При сжигании серы протекает необратимая экзотермическая реакция:
S + O2
= SO2
(1)
с выделением очень большого количества теплоты: изменение Н= -362,4 кДж/моль, или в пересчете на единицу массы 362,4/32=11,325 кДж/т = 11325 кДж/кг S.
Расплавленная жидкая сера, подаваемая на сжигание, испаряется (кипит) при температуре 444,6 *С; теплота испарения составляет 288 кДж/кг. Как видно из приведенных данных, теплоты реакции горения серы вполне достаточно для испарения исходного сырья, поэтому взаимодействие серы и кислорода происходит в газовой фазе (гомогенная реакция).
Сжигание серы в промышленности проводят следующим образом. Серу предварительно расплавляют (для этого можно использовать водяной пар, полученный при утилизации теплоты основной реакции горения серы). Так как температура плавления серы сравнительно низка, то путем отстаивания и последующей фильтрации от серы легко отделить механические примеси, не перешедшие в жидкую фазу, и получить исходное сырье достаточной степени чистоты. Для сжигания расплавленной серы используют два типа печей – форсуночные и циклонные.
В них необходимо предусмотреть распыление жидкой серы для ее быстрого испарения и обеспечения надежного контакта с воздухом во всех частях аппарата.
Из печи обжиговый газ поступает в котел-утилизатор и далее в последующие аппараты.
Концентрация диоксида серы в обжиговом газе зависит от соотношения серы и воздуха, подаваемых на сжигание. Если воздух берут в стехиометрическом количестве, т.е. на каждый моль серы 1 моль кислорода, то при полном сгорании серы концентрация будет равна объемной доле кислорода в воздухе Сso2.max
=21%. Однако обычно воздух берут в избытке, так как в противном случае в печи будет слишком высокая температура.
При адиабатическом сжигании серы температура обжига для реакционной смеси стехиометрического состава составит ~ 1500*С. В практических условиях возможности повышения температуры в печи ограничены тем, что выше 1300*С быстро разрушается футеровка печи и газоходов. Обычно при сжигании серы получают обжиговый газ, содержащий 13 – 14% SO2
.
Контактное окисление диоксида серы является типичным примером гетерогенного окислительного экзотермического катализа.
Это один из наиболее изученных каталитических синтезов. В СССР наиболее основательные работы по изучению окисления SO2
в SO3
и разработке катализаторов были проведены Г.К. Боресковым.Реакция окисления диоксида серы
SO2
+ 0,5 O2
= SO3
(2)
характеризуется очень высоким значением энергии активации и поэтому практическое ее осуществление возможно лишь в присутствии катализатора.
В промышленности основным катализатором окисления SO2
является катализатор на основе оксида ванадия V2
O5
(ванадиевая контактная масса). Кталитическая активность в этой реакции проявляют и другие соединения, прежде всего платина. Однако, платиновые катализаторы чрезвычайно чувствительны даже к следам мышьяка, селена, хлора и других примесей и поэтому постепенно были вытеснены ванадиевым катализатором.
Скорость реакции повышается с ростом концентрации кислорода, поэтому процесс в промышленности проводят при его избытке.
Так как реакция окисления SO2
относится к типу экзотермических, температурный режим ее проведения должен приближаться к линии оптимальных температур. На выбор температурного режима дополнительно накладываются два ограничения, связанные со свойствами катализатора. Нижним температурным пределом является температура зажигания ванадиевых катализаторов, составляющая в зависимости от конкретного вида катализатора и состава газа 400 – 440*С. верхний температурный предел составляет 600 – 650*С и определяется тем, что выше этих температур происходит перестройка структуры катализатора, и он теряет свою активность.
В диапазоне 400 – 600*С процесс стремятся провести так, чтобы по мере увеличения степени превращения температура уменьшалась.
Чаще всего в промышленности используют полочные контактные аппараты с наружным теплообменом. Схема теплообмена предполагает максимальное использование теплоты реакции для подогрева исходного газа и одновременное охлаждение газа между полками.
Одна из важнейших задач, стоящих перед сернокислотной промышленностью, - увеличение степени превращения диоксида серы и снижение его выбросов в атмосферу. Эта задача может быть решена несколькими методами.
Один из наиболее рациональных методов решения этой задачи, повсеместно применяемой в сернокислотной промышленности, - метод двойного контактирования и двойной абсорбции (ДКДА). Для смещения равновесия вправо и увеличения выхода процесса, а также для увеличения скорости процесса процесс проводят по этому методу. Его сущность состоит в том, что реакционную смесь, в которой степень превращения SO2
составляет 90 – 95%, охлаждают и направляют в промежуточный абсорбер для выделения SO3
. В оставшемся реакционном газе соотношение O2
:SO2
существенно повышается, что приводит к смещению равновесия реакции вправо. Вновь нагретый реакционный газ снова подают в контактный аппарат, где на одном-двух слоях катализатора достигают 95% степени превращения оставшегося SO2
.суммарная степень превращения SO2
составляет в таком процессе 99,5% - 99,8 %.
Последней стадией процесса производства серной кислоты контактным способом является абсорбция триоксида серы из газовой смеси и превращение его в серную кислоту.
nSO3
+ H2
O = H2
SO4
+ (n-1)SO3
+Q………(3)
если n>1, то получается олеум (раствор SO3
в H2
SO4
)
если n=1 , то получается моногидрат (98,3% H2
SO4
)
если n<1, то получается разбавленная серная кислота
При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3
из газовой фазы. Для полного извлечения SO3
необходимо, чтобы равновесное парциальное давление SO2
над растворителем было ничтожно малым, так как при этом будет велика движущая сила процесса абсорбции. Однако, в качестве абсорбента нельзя использовать и такие растворы, над поверхностью которых велико равновесное парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3
будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде – азоте, т.е. с образованием сернокислотного тумана:
  SO3(
г)
+ H2
O(г)
H2
SO4(
г)
H2
SO4(
туман)
; Q>0 SO3(
г)
+ H2
O(г)
H2
SO4(
г)
H2
SO4(
туман)
; Q>0
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу, при этом загрязняется окружающая среда и возрастают потери серной кислоты.
Высказанные соображения позволяют решить вопрос о выборе абсорбента. Оптимальным абсорбентом является 98,3%-ная серная кислота (техническое название – моногидрат), соответствующая азеотропному составу. Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3
. Протекающий при этом процесс можно условно описать уравнением реакции:
SO3
+ nH2
SO4
+ H2
O= (n+1) H2
SO4
Использование в качестве поглотителя менее концентрированной серной кислоты может привести к образованию сернокислотного тумана, а над 100%-ной серной кислотой или олеумом в паровой фазе довольно велико равновесное парциальное давление SO3
, поэтому он будет абсорбироваться не полностью. Однако если в качестве одного из продуктов процесса необходимо получить олеум, можно совместить абсорбцию олеумом (1-й абсорбер) и абсорбцию 98,3%-ной кислотой (2-й абсорбер).
В принципе при высоких температурах над 98,3%-ной кислотой может быть значительным парциальное давление паров самой кислоты, что также будет снижать степень абсорбции SO3
. Ниже 100*С равновесное давление паров H2
SO4
очень мало и поэтому может быть достигнута практически 100%-ная степень абсорбции.
Таким образом, для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100*С. Однако в процессе абсорбции SO3
происходит закрепление кислоты (повышение ее концентрации) и в силу экзотермичности реакции увеличивается температура. Для уменьшения тормозящего влияния этих явлений абсорбцию ведут так, чтобы концентрация H2
SO4
при однократном прохождении абсорбера повышалась только на 1-1,5%, закрепившуюся серную кислоту разбавляют в сборнике до концентрации 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая высокую кратность циркуляции.
Вариант №3
Стадии производства серной кислоты:
1.
подготовка сырья
:
очистка и плавление серы; очистка, сушка и дозировка воздуха;
2.
сжигание серы
:
S + O2
= SO2
(1) .Процесс ведут с избытком воздуха;
3.
контактное окисление
SO2
в
SO3
:
SO2
+ 0,5O2
= SO3
(2).Процесс идет на ванадиевом катализаторе при температуре 420-550*С;
4.
абсорбция
SO3
:
SO3
+ H2
O = H2
SO4
(3). Абсорбционная колонна орошается 98,3% H2
SO4
. Перед отправкой на склад кислота разбавляется до ~93% H2
SO4
в соответствии с требованиями ГОСТа.
Исходные данные для расчета
| Показатель
|
Значения
|
Степень превращения
серы в SO2
, %
|
92.0 |
Степень превращения
SO2
в SO3
, %
|
99.0 |
| Степень абсорбции SO3
, % |
99.8 |
| Содержание SO2
в газе, поступающем в контактный аппарат, % (по объему) |
8.0 |
| Содержание H2
SO4
в целевом продукте, % по массе |
92.5 |
| Базис расчета, кг H2
SO4
|
2000 |
03
   011 011
 12 23 302 12 23 302
   012 012
  301 301
011 - Сера жидкая
012 - Воздух
12 - SO2
содерж. газ
23 - SO3
содерж. газ
03 - Вода
301 - Выхлопные газы
302 – Серная кислота
1.Составляем уравнения по первому узлу:
0.92*N011
=N12
SO2
N12
SO2
=N12
*0.08 N011
=X1
0.92*N011
=N12
*0.08 N12
=X3
0.92*X1
=X3
*0.08 (1)
2
. Составляем уравнения по второму узлу:
а) 0,99*N12
SO2
=N23
SO3
0.99*N12
*0.08=N23
SO3
N23
SO3
=X4
0.99*X3
*0.08=X4
(2)
б) N12
*(0.21-0.08)=2N23
SO3
X*(0.21-0.08)=2X4
(3)
3
.Составляем уравнение по третьему узлу:
а) G302
*0.925=2000 базисное уравнение G302
=X7
X7
*0.925=2000 (4)
б) 0.998*N23
SO3
=2000/Mr(H2
SO4
)
0.998*X4
=2000/98 (5)
в) N301
=N301
SO2
+ N301
N2
+ N301
SO3
+ N301
O2
N301
SO2
=N12
SO2
*(1-0.99)=N12
SO2
*0.01=N12
*0.08*0.01
N301
N2
= 0.79*N012
N301
SO3
=N23
SO3
*(1-0.998)=0.002*N23
SO3
N301
O2
=N12
*(0.21-0.08)-1/2*N12
*(0.21-0.08)=N12
*0.13*(1-
1/2)=0.13/2*N12
N301
=N12
*0.08*0.01+0.79*N012
+0.002*N23
SO3
+0.065*N12
N301
=0.0658*N12
+0.79*N012
+0.002*N23
SO3
X6
=0.0658*X3
+0.79*X2
+0.002*X1
(6)
N012
=X2
N301
=X6
Но надо учесть , что N12
=N012
,т.е. X2
=X3
(7)
6 неизвестных и 7 уравнений. Выбрасываем уравнение (3) и получаем систему уравнений:
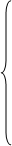 0,92*X1
=0.08*X3 0,92*X1
=0.08*X3
0.99*0.08*X3
=X4
0.925*X7
=2000
0.998*X4
=20.41
X6
=0.0658*X3
+0.79*X2
+0.002*X4
X3
=X2
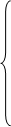 0.92*X1
-0.08*X3
=0 0.92*X1
-0.08*X3
=0
0.0792*X3
-X4
=0
X7
=2162.2
X4
=20.45
0.8558*X3
+0.002*X4
- X6
=0
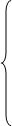 0.92*X1
-0.08*X3
=0 0.92*X1
-0.08*X3
=0
0.0792*X3
-20.45=0
X7
=2162.2
X4
=20.45
0.8558*X3
+0.002*20.45-X6
=0
0.92*X1
-0.08*X3
=0
X3
=257.23
X7
=2162.2
X4
=20.45
0.8558*X3
+0.041-X6
=0
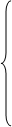 0.92*X1
=0.08*257.23 0.92*X1
=0.08*257.23
X3
=257.23
X7
=2162.2
X4
=20.45
0.8558*257.23+0.041-X6
=0
 X1
=22.37=N011 X1
=22.37=N011
X3
=257.23=X2
=N12
=N012
X7
=2162.2=G301
X4
=20.45=N23
SO3
X6
=220.18=N301
1.Количество целевого продукта:
X7
=G301
=2162.2 кг 92.5% серной кислоты
2. Расход серы:
X1
=N011
=22.37кмоль
ms
=Ns
*MS
=22.37*32=715.84 кг
GS
нач
=715,84/0,92=778,1 кг было введено в систему
3. Расход воздуха:
X2
=X3
=N012
=257.23 кмоль
Gвозд
=Nвозд
*Mвозд
=257,23*29=7459,67 кг
4.Определение расхода кислорода и азота
GO2
=7459,67*0,21=1566,7 кг
GN2
=7459,67*0,79=5893,1 кг
5.
Определяем количество SO2
, содержащегося в газе:
X3
=N12
=257.23 кмоль
N12
SO2
=257.23*0.08=20.58 кмоль
GSO2
=NSO2
*MSO2
=20.58*64=1317 кг
6.
Определение SO3
, содержащегося в газе:
X4
=N23
SO3
=20.45кмоль
GSO3
=NSO3
*MSO3
=20.45*80=1636 кг
7.
Расход воды на абсорбцию:
G03
=G301
*MH2O
/MH2SO4
=2162.2*18/98=397 кг
8.
Выхлопные газы:
X6
=N301
=220.18 кмоль
G301
=G301
SO2
+G301
N2
+G301
SO3
+G301
O2
=1317*0.01+5893.1+
0.002*1636+0.065*7459.67=13.17+5893.1+3.27+484.88=
6394.42 кг
| Введено
|
Получено
|
| Реагенты
|
кг
|
% масс
|
Продукты
|
кг
|
%масс
|
| Сера
|
778,1 |
9 |
Серная кислота:
|
2162,2 |
25 |
| Вода
|
397 |
4,6 |
H2
SO4
|
2000 |
23,2 |
| Воздух:
|
7459,67 |
86,4 |
H2
O
|
162,2 |
1,8 |
| 21% О2
|
1566,7 |
18,1 |
Выхлопные газы:
|
6394,42 |
74,1 |
| 79%
N
2
|
5893,1 |
69,3 |
SO2
|
13,17 |
0,15 |
| N2
|
5893,1 |
68,25 |
| SO3
|
3,27 |
0,06 |
| O2
|
484,88 |
5,64 |
| Невязка
|
78,15 |
0,9 |
| Всего
|
8634,77 |
100 |
Всего
|
8634,77 |
100 |
1. Г.Н. Кононова, В.В. Сафонов, Н.Г. Чабан. Разработка алгоритма и расчет материального баланса химико-технологической системы. Москва. 1995.
2. Учебник для химико-технологических специальностей ВУЗов под редакцией проф. И.П. Мухленова. Общая химическая технология. Часть 2 « Важнейшие химические производства». Москва «Высшая школа»1984.
3. А.М. Кутепов, Т.И. Бондарева, М.Г. Беренгартен. Общая химическая технология. Издание второе исправленное и дополненное. Москва «Высшая школа» 1990.
4. Конспект лекций (лектор: Г.Н. Кононова)
|