Министерство образования Республики Бурятия
Бурятский Государственный Университет
Курсовая работа
по органической химии
«Получение синтетических красителей реакцией азосочетания на примере синтеза 3-окси-4-карбоксиазобензола»
Выполнил(а): Ситникова Н., гр.13111
Руководитель: ст. преподаватель Тоневицкий Ю.В.
Улан-Удэ,
2003 г.
Содержание
1. Введение 3
1.1. Краткая историческая справка 3
1.2. Современные проблемы производства и применения красителей 4
1.3. Актуальность темы и цель работы 5
2. Современная классификация синтетических красителей и их св-ва 6
2.1. Тип классификации 6
2.1.1. Химическая классификация красителей 6
2.1.2. Техническая классификация красителей 10
2.2. Свойства и строение синтетических красителей 12
2.2.1. Номенклатура красителей 12
2.2.2. Связь между строением и цветом вещества 13
2.2.3. Светопрочность красителей 15
2.3. Общие реакции получения красителей 16
2.4. Применение синтетических красителей 16
3. Реакции азосочетания. Азокрасители 17
3.1. Азокрасители. 17
3.2. Реакция диазотирования 18
3.3. Реакция азосочетания 22
3.4. Механизм реакции азосочетания 26
3.5. Продукты для холодного крашения 28
4. Экспериментальная часть 29
4.1. Синтез 3-окси-4-карбоксиазобензола 29
5. Выводы 34
6. Список литературы 35
1. Введение
1.1. Краткая историческая справка.
Радость от восприятия цвета – одно из старейших культурно-эстетических чувств человечества. Уже в древние времена люди заботились о том, чтобы окрасить одежду и предметы домашнего обихода в красивые цвета. При религиозно-культовых обрядах, напротив, использовали устраняющие отталкивающие расцветки. Во все времена окраска имела символическое значение, как это и сейчас выражается в цветах гербов и национальных флагов.
Если проследить развитие искусства крашения на протяжении столетий, то можно отметить два периода. Первый, начиная с зарождения человечества и вплоть до 1859 года – исключительное применение красителей минерального, растительного или животного происхождения. В старинных культурах Европы, Египта, Азии, Центральной и Южной Америки были известны методы крашения хлопка, шерсти и льна. В античные времена из пурпурных улиток, обитающих и сейчас в Средиземном море, добывали ценный пурпур. Он был настолько дорог, что использование окрашиваемых им тканей было привилегией королей. Для крашения применяли красный краситель из корней морены ализарин, экстракты красильной вайды и индигоидных растений – индиго, дающий очень прочную синюю окраску. Шафран применялся греками, кермес – римлянами, в Индии получали индийский жёлтый из мочи коров, которых кормили листьями манго. Эти красители добывали в небольших количествах. Они были очень дороги и не могли удовлетворять потребности развивающейся текстильной промышленности.
Реклама

Открытие Америки принесло ряд ценных продуктов – кошениль, из которого выделяли карминовую кислоты – алый краситель, который до сих пор ещё применяется для губной помады, красное дерево бразилин и синий сандал. Только последние сто лет из этих природных препаратов были выделены собственнокрасящие вещества и установлено их строение. Неорганические пигменты – берлинская лазурь, марганцевый пигменты и другие стали использовать лишь в начале XIX века.
Второй период – применение искусственных синтетических красителей – началось с открытия мовеина, цвет которого напоминал окраску цветка мальвы, его строение удалось установить О. Фишеру лишь в 1890 году. Он оказался одним из многократно замещённых феназинов.
Когда в 50-х годах XIX столетия органическая химия начала своё триумфальное шествие, одной из важнейших проблем стоявших перед нею, являлось получение природных красителей синтетическим путём. Вскоре были открыты новые не существовавшие в природе классы красителей и, наконец, были синтезированы красители обладающие наивысшей прочностью.
После установления формулы бензола Кекуле было получено множество искусственных красителей. При синтезах исходили из ароматических веществ, содержащихся в каменноугольной смоле, поэтому их назвали смоляными красителями. На русском языке принят термин анилиновые красители. Производство анилиновых красителей было первым промышленным производством органических соединений, и послужило исходным пунктом химической индустрии после открытия в 1842 году знаменитым русским химиком Н. Н. Зининым способа получения анилина из нитробензола.
Первый синтетические красители – фуксин, мовеин, анилиновый жёлтый были получены в конце 50-х годов XIX века, а уже в 70-х годах возникает промышленное производство синтетических красителей.
Мировое производство синтетических красителей в настоящее время составляет порядка 1000000 тонн в год.
Реклама

1.2. Современные проблемы производства и применения красителей.
Возникновение и развитие новых отраслей промышленности, создание новых материалов требует создания новых видов красителей для этих материалов. Появляются новые красители для различных видов полимерных материалов, для новых видов синтетических волокон и.т.д.
Разрабатываются новые принципы крашения текстильных материалов, например, путём образования химический связи красителя с волокном. В соответствии с этим в технической классификации появляются новые группы, например, активные красители, красители для анодированного алюминия, оптически отбеливающие вещества и прочие. Активные красители представляют собой новый класс красителей с очень ценными свойствами. В их молекуле содержатся группировки, способные химически связываться с волокном, образуя ковалентную связь. Молекула активного красителя состоит из двух частей – хромофора, обуславливающего окраску и активной группировки, обеспечивающей прочную связь – красителя с волокном. Активные красители очень перспективны, так как они дают прочные окраски и позволяют упростить процесс крашения.
Усилия исследователей направлены на улучшение светопрочности, прочности к стирке и отбеливанию. Фотохимия простых органических соединений, например альдегидов, кетонов, насыщенных и ненасыщенных жирных кислот многократно изучалась. При изучении красителей сложного строения лишь в очень незначительном числе случаев удалось выделить и идентифицировать продукты фотореакции. Трудности заключаются в том, что фотохимические изменения красителей протекают очень медленно. Даже если удаётся выделить продукты разложения, бывает трудно отличить первичные и фотохимические изменения от последующих термических и других реакций, а также сформулировать механизм по которому образуются конечные продукты разложения.
1.3. Актуальность темы по синтетическим красителям и цели работы.
Новые материалы требуют новых красителей, а потому тема по синтезу красителей всегда остаётся актуальной. Цель данной работы – синтез 4-окси-3-карбоксиазобензола, который является представителем большого класса азокрасителей. На примере его получения изучить условия проведения реакций диазотирования 4-окси-3-карбоксиазобензола и реакции.
2. Современная классификация синтетических красителей и их свойства
2.1. Типы классификации
2.1.1. Химическая классификация красителей
В химической классификации красители объединены в группы главным образом по сходству химического строения или методов получения.
Органические красители построены очень сложно, и основой объединения их в группы по сходству химического строения служит сходство хромофорной системы. Например, красители, содержащие нитрозогруппу, объединены в группу нитрозокрасителей, а содержащие азогруппу – в группу азокрасителей. Некоторые красители объединены в группу по способу получения, например сернистые красители. Во многих случаях красители с одинаковыми хромофорными системами получают одинаковыми способами. Например, все азокрасители получают путём диазотирования ароматических аминов и сочетания продуктов диазотирования с фенолами или аминами. Все нитрозокрасители получают нитрозированием фенолов или нафтолов.
Химическая классификация облегчает изучение свойств красителей и способов их получения. По химической классификации органические красители разделяют на следующие группы.
1. Нитрокрасители.
В этих красителях имеются электроноакцепторные заместители нитрогруппы - 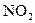 . Представитель этой группы – краситель нафтоловый жёлтый (динатриевая соль 2,4-динитро-1-нафтол-7-сульфокислоты) . Представитель этой группы – краситель нафтоловый жёлтый (динатриевая соль 2,4-динитро-1-нафтол-7-сульфокислоты)
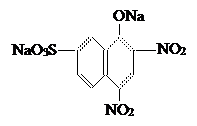 
2. Нитрозокрасители
.
Они содержат нитрозогруппы – NO. Представители этой группы – производные 1-нитрозо-2-нафтола
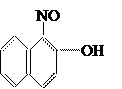 
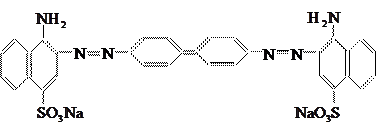
3. Азокрасители
.
В их хромофорную систему входит азогруппа −N ═ N−. Представители этой группы – кислотный синий 2К
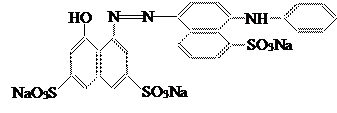 
и конго красный
4. Арилметановые красители
.
Их основу составляют молекулы диарил- или триарилметана (I и II) либо фенилксантена (III). Хромофорную систему образует система сопряжённых связей с электроноакцепторными и электронодонорными заместителями (X ═ O, NH):
 
Представители этой группы – кислотный ярко-голубой З (I) и флюоресцин (II):
 
5. Хинониминовые красители.
В их молекуле имеются хинониминовые группы
 
Представитель этой группы – краситель прямой ярко-голубой светопрочный
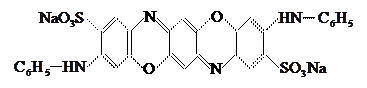 
6. Сернистые красители.
Они объединены по способу получения осернением ароматических амино- и нитросоединений. Химическое строение большинства сернистых красителей не установлено. Представители этой группы – сернистый чёрный, получаемый осернением 2,4-динитрофенола, и сернистый коричневый Ж, получаемый осернением 2,4-динитротолуола.
7. Антрахиноновые красители
. Являются производными антрахинона
 
Представители этой группы – ализарин (I) и кислотный зелёный антрахиноновый (II):
 
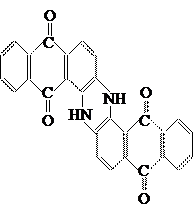
8. Кубовые полициклокетоновые красители.
Молекулы их содержат несколько конденсированных ароматических колец и не менее двух карбонильных групп, атомы углерода обычно также принадлежат ароматическим ядрам. Представитель этой группы – кубовый синий O:
9. Индигоидные красители.
В основе строения этих красителей лежит структура молекулы индиго (I) или тиоиндиго (II):
 
10. Фталоциановые красители.
Являются производными фталоцианина
 
2.1.2. Техническая классификация красителей
Химическая классификация отражает строение и способы получения красителей, но не отражает их технических свойств и назначения. Между тем для тех отраслей промышленности, которые применяют красители, важно знать их технические свойства, т.е. для крашения каких материалов предназначен краситель и в каких условиях его применяют. Поэтому существует вторая классификация красителей – техническая, в которой красители объединены в группы по их техническому назначению.
Крашение – сложный процесс, в котором краситель может взаимодействовать с окрашиваемым материалом химически, а может адсорбироваться поверхностью материала и удерживаться при помощи адсорбционных сил. В зависимости от свойств красителя и окрашиваемого материала крашение ведут в различных условиях, вводя в раствор красителя разные добавки, изменяя температуру ванны, концентрацию красителя и.т.д.
В простейшем случае краситель растворяют в воде и ткань окрашивают, погружая в красильную ванну. Другие красители требуют предварительной обработки ткани специальными веществами – протравами. Третьи нуждаются в последующей обработке для закрепления красителя на волокне. Существуют группы красителей, нерастворимых в воде. Их переводят в раствор восстановлением в форму лейкосоединения, и в таком виде они переходят на волокно. При последующем окислении они переходят в краситель непосредственно на волокне. Некоторые красители синтезируют на самом волокне: ткань пропитывают последовательно растворами промежуточных продуктов, которые реагируют между собой на волокне, образуя краситель.
Ряд нерастворимых в воде красителей растворяется в органических растворителях. К ним относятся жиро-, спирто-, и ацетонорастворимые красители, а также красители, растворимые в полимерах – полиамидах и полиэфирах.
По технической классификации красители подразделяют на следующие важнейшие группы.
1. Кислотные красители
, окрашивающие шерсть и шёлк в кислом или нейтральном растворе.
2. Основные красители
, окрашивающие в нейтральном растворе шерсть, шёлк и кожу непосредственно, а хлопчатобумажные ткани после протравливания таннином.
3. Прямые красители
,
окрашивающие хлопчатобумажные волокна в нейтральном или слабощелочном растворе.
4. Протравные красители
, окрашивающие хлопчатобумажные, шерстяные и шёлковые волокна после их протравливания солями металлов - алюминия, хрома, железа.
5. Активные красители
, окрашивающие целлюлозные волокна в щелочном растворе (сода, бикарбонат, тринатрийфосфат), а шерсть, натуральный шёлк и полиамидные волокна в среде, близкой к нейтральной (pH = 6 – 8).
6. Кубовые красители
,окрашивающие целлюлозные волокна в щелочном растворе лейкосоединения (т.е. продукта восстановления). Окрашиваемый материал выдерживают в этом растворе (так называемом кубе), а затем окисляют на воздухе. При этом лейкосоединение снова переходит в краситель.
7. Сернистые красители
, окрашивающие хлопчатобумажное волокно в водных растворах сернистого натрия.
8. Красители, образующиеся на волокне
.
К этой группе красителей относятся азоидные, окислительные красители и фталогены.
Азоидные (ледяные, или холодные) красители: окрашиваемый материал пропитывают раствором оксисоединения, затем погружают в раствор диазосоединения; на волокне происходит реакция азосочетания и образуется краситель.
Окислительные красители образуются в процессе крашения на волокне при окислении ароматических аминов.
9. Красители для меха
.
10. Красители для кожи и шубной овчины
.
11. Дисперсные красители
, окрашивающие ацетатный шёлк и синтетические волокна. Они практически нерастворимы в воде и окрашивают только тогда, когда содержатся в красильной ванне в тонкодисперсном состоянии (величина частиц 0,2 – 2,0 мкм).
12. Красители жиро- и спирторастворимые
.
13. Пигменты и лаки
.
Применяются для приготовления полиграфических, художественных, строительных и других красок. Пигменты используют для крашения пластических масс, резины, бумаги. Пигментами окрашивают вискозное и ацетатцеллюлозное волокно и синтетические полимерные материалы в растворе или расплаве полимера перед изготовлением из них волокон (крашение в массе).
2.2. Свойства и строение синтетических красителей
2.2.1. Номенклатура красителей
В начальный период развития промышленности названия многим красителям давали произвольно, без какой-либо системы. Эти названия не отражали полностью ни химических, ни технических свойств красителя, а зачастую не указывали даже на его цвет. Несмотря на явное несовершенство таких названий, многие из них сохранились до настоящего времени и прочно укоренились в технике, например, аурамин, эозин, фуксин, родамин, индиго и др. Иногда к таким названиям добавляют указание на цвет красителя, например, конго красный, нафтоловый жёлтый, метиленовый голубой.
В России принята единая номенклатура красителей, в соответствии с которой название красителя строится так, что оно отражает технические свойства красителя и его цвет. Приводим названия ряда красителей, построенные в соответствии с этой номенклатурой: протравной зелёный Бс; основной коричневый 2К; кислотный оранжевый; кислотный зелёный Ж; кислотный алый 2Ж; прямой синий КМ; пигмент жёлтый светопрочный; сернистый чёрный; пигмент голубой фталоциановый; кислотный зелёный антрахиноновый; кубовый синий О; кубовый золотисто-жёлтый КХ. Из этих примеров видно, что название красителя составлено из нескольких прилагательных, первое из которых указывает на принадлежность красителя к той или иной группе по технической классификации, а второе – на цвет красителя.
Часто в названии красителя имеется ещё слово или буква, указывающая на оттенок красителя или на его особые свойства. Например, в названии красителя «кислотный зелёный Ж» буква Ж указывает на желтоватый оттенок этого зелёного красителя. Буква К означает красноватый оттенок, С – синеватый, З – зеленоватый, О – основной оттенок данного тона. Буква Х в названии кубового красителя показывает, что краситель восстанавливается в лейкосоединение и окрашивает волокно на холоду - кубовый золотисто-жёлтый КХ; эта же буква в названии прямого красителя означает, что прочность окраски возрастает при обработке волокна солями хрома - прямой красный Х. Буква М в названии прямого красителя означает, что прочность окраски возрастает после обработки волокна солями меди - прямой синий КМ. Буквы Бс означают, что краситель выпущен в форме бисульфатного соединения, которое легче растворяется в воде, чем исходный краситель - протравной зелёный Бс.
Цифра, стоящая перед буквой, означает степень отклонения оттенка от основного цвета. Например, кислотный синий 2К имеет более сильно выраженный красноватый оттенок, чем кислотный синий К.
Иногда в названии содержится определение какого-либо свойства красителя («светопрочный») или указание на форму, в которой его выпускают («в пасте», «порошок»).
2.2.2. Связь между строением и цветом вещества
Для характеристики красителя важное значение имеет его цвет.
Способность органического соединения поглощать те или иные световые лучи, т.е. способность к избирательному поглощению света, зависит от строения его молекулы.
Ароматические углеводороды – бензол, нафталин, содержащие систему сопряжённых двойных связей, не поглощают видимых световых лучей и кажется нам бесцветными. Удлинение цепочки сопряжённых двойных связей, а также введение в молекулу ароматического соединения заместителей, облегчающих сдвиг подвижных электронов сопряжённых двойных связей, сообщает молекуле способность поглощать видимые световые лучи, т.е. придаёт ему окраску. Таким свойством обладают электроноакцепторные
заместители, оттягивающие электроны от молекулы, и электронодонорные
заместители, которые отдают электроны. К электроноакцепторным заместителям относятся нитрогруппа 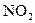 , нитрогруппа –NO, карбонильная группа >C=O; в меньшей степени хинониминная группа >C=NH. В электронодонорных заместителях содержатся атомы, имеющие неподеленные пары электронов. К числу таких заместителей относятся в первую очередь оксигруппа ─ , нитрогруппа –NO, карбонильная группа >C=O; в меньшей степени хинониминная группа >C=NH. В электронодонорных заместителях содержатся атомы, имеющие неподеленные пары электронов. К числу таких заместителей относятся в первую очередь оксигруппа ─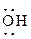 и аминогруппа ─ и аминогруппа ─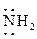 . .
Систему сопряжённых двойных связей с электроноакцепторными и электронодонорными заместителями называют хромофорной
.
В молекуле красителя могут присутствовать и другие заместители, влияющие на его свойства. Например, сульфогруппа ─ SO3
Hи карбоксильная группа ─COOH придают красителю кислотный характер и способность растворяться в воде и в растворах щелочей. В молекуле красителя могут присутствовать атомы хлора, брома, нитрогруппы и другие заместители, влияющие на оттенок красителя и прочность окраски волокна.
Существует несколько тысяч органических красителей различного химического строения, разных цветов и оттенков, с различными химическими свойствами.
По химическому строению и способам получения красители подразделяют на группы, лежащие в основе химической классификации красителей.
2.2.3. Светопрочность красителей
Первые попытки связать химическое строение красителей и их светопрочность были сделаны, по-видимому, Гебгардом. Он нашёл, что окси- и аминогруппы ускоряют выцветание, а алкалирование аминогрупп ускоряет его ещё больше. Атомы хлора , брома, сульфо- и карбоксильная группы замедляют выцветание; последняя особенно сильно. Имеет значение также и положение заместителя. Изучая ализариновые красители, Гебгард нашёл, что светопрочность зависит от числа, природы и положения заместителей; кроме окси- и аминогрупп, тиоловые группы и хинолиновое ядро усиливают выцветание, в то время как нитрогруппа ослабляет его. Из имеющихся в настоящее время многочисленных данных следует, что выцветание красителей представляет собой сложное явление и не может быть вызвано постоянным влиянием определённых групп. Так, в рядах индигоидов и антрахиноновых кубовых красителей галоидирование обычно повышает светопрочность, но в некоторых случаях, как среди этих, так и других классов красителей, галоид может не оказывать влияния или даже снижать светопрочность. Наличие сульфогруппы часто благоприятствует светопрочности, но существенным исключением является более высокая светопрочность окрасок азоидными красителями по сравнению с прямыми красителями для хлопка. По-видимому, нитрокрасители выцветают вследствие восстановления до азокси- и азосоединений и, наконец, до первичных аминов. Светопрочность азокрасителей колеблется в больших пределах, чем светопрочность красителей других групп. Этого и надо было ожидать, так как азокрасители представляют собой очень многочисленный класс, включающий типы, отличающиеся количеством азогрупп, характером циклических систем, объединяемых азогруппами, числом и природой ауксохромов. Наличие в молекуле красителя первичных аминогрупп обусловливает низкую светопрочность, а ацилирование (в особенности хлорированными красителями) повышает светопрочность. Для повышения светопрочности красителя в его молекулу могут быть введены особые группы, например –
SO2
R, ─SO2
NR2
, OSO2
R, CF3
и алкоксильные группы. Среди прямых красителей для хлопка, как правило, жёлтые и оранжевые красители обладают более высокой светопрочностью, чем синие и зелёные. Прямые красители для хлопка бензидинового ряда обычно не прочны к свету. Средняя светопрочность комбинаций нерастворимых азокрасителей, применяемых в промышленности, около 5 баллов, а у многих достигает 6-7 (светопрочность красителей определяется в баллах, наивысший балл составляет 10). У некоторых простых азокрасителей можно установить определённую зависимость между положением заместителя в ядре и их прочностью к свету и стирке.
2.3. Общие реакции получения красителей
Основным сырьём для получения органических красителей являются ароматические углеводороды – бензол, толуол, нафталин, антрацен. Вспомогательное сырьё – органические и неорганические кислоты, основания, соли, альдегиды, кетоны, спирты, галогензамещённые углеводороды и.т.д.
Разнообразные химические превращения, в результате которых исходные ароматические углеводороды превращаются в промежуточные продукты, а затем в красители, можно разделить на три группы: 1) реакции, связанные с введением заместителя в ароматическое ядро; 2) реакции, связанные с превращением введенного заместителя; 3) реакции, связанные с изменением углеродного скелета. Реакции 1 и 2 типов реакций не связанны с разрывом связей углерод-углерод в ароматическом ядре, это, например, получение фталевого ангидрида окисление нафталина, или, напротив, усложнение молекул, например, получение антрахинона реакцией конденсации из фталевого ангидрида и бензола.
2.4. Применение красителей
Сейчас естественные красители полностью вытеснены синтетическими. Преимущество синтетических красителей – дешевизна, удобство в обращении, разнообразие оттенков, возможность создавать широкий ассортимент красителей с нужными свойствами. Последнее особенно важно, так как число материалов, которые окрашивают органическими красителями, непрерывно растёт. Если раньше единственным потребителем органических красителей была текстильная промышленность, где красили почти исключительно хлопчатобумажные, шерстяные и хлопковые волокна, то сегодня органические красители применяют для крашения многих видов синтетических волокон, пластических масс, резины, бумаги, картона, дерева, кожи, меха и других материалов. Синтетические органические красители широко применяют в полиграфической, лакокрасочной, пищевой, фотокинопромышленности, а также медицине и других отраслях промышленности.
Области применения природных красителей всё больше и больше суживались, и в наши дни они ограничены лишь специальными областями, например, окрашивание некоторых продуктов питания.
3. Реакции азосочетания. Азокрасители
3.1. Азокрасители
К этой группе относятся красители, молекула которых содержит в качестве хромофора азогруппу ─N ═ N─.
Азогруппа, как правило, связывает два ароматических ядра с различными заместителями – гидроксильными группами, амино- и сульфогруппами, карбоксильными группами, атомами галогена и др. Иногда место одного из ароматических колец занимает гетероциклический или алифатический остаток. В молекуле красителя может быть более одной азогруппы, поэтому различают моноазокрасители с одной азогруппой в молекуле, бисазокрасители с двумя азогруппами и полиазокрасители с тремя и более азогруппами.
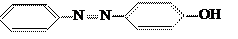  Простейшее азосоединение – азобензол ─ сам по себе не является красителем. Только после введения в молекулу азобензола амино- или гидроксильной группы она приобретает свойства красителя. Простейшими азокрасителями являются оксиазобензол Простейшее азосоединение – азобензол ─ сам по себе не является красителем. Только после введения в молекулу азобензола амино- или гидроксильной группы она приобретает свойства красителя. Простейшими азокрасителями являются оксиазобензол
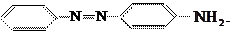 и аминобензол и аминобензол
Практическое значение имеют азокрасители более сложного строения.
Азокрасители получают из ароматических аминов и оксисоединений при помощи сравнительно простых реакций диазотирования и азосочетания которые будут рассмотрены подробно. При этом используют большое количество амино- и оксисоединений бензольного и нафталинового ряда с различными заместителями, простыми и сложными. Это даёт возможность получать красители всех цветов и оттенков – от лимонно-жёлтого до глубоко-чёрного. По технической классификации среди азокрасителей имеются прямые, кислотные, протравные, основные, красители для ацетатного шёлка, компоненты красителей, образующихся на волокне, пигменты и др. Азокрасители широко применяются для крашения растительных, животных и синтетических волокон, резины, кожи, пластических масс, в лакокрасочной, полиграфической и других областях промышленности.
В основе технологии получения азокрасителей лежат две химические реакции: 1) диазотирование ароматического амина, 2) сочетание полученного диазосоединения с амином или фенолом.
3.2. Реакция диазотирования
Диазотированием называют взаимодействие первичного ароматического амина с азотистой кислотой в присутствии избытка минеральной кислоты
.
Как правило, минеральная кислота берётся в некотором избытке (2,5 эквивалента на 1 эквивалент амина). При этом образуется диазосоединение.
Азотистая кислота неустойчива и легко разлагается, поэтому при диазотировании применяют не свободную азотистую кислоту, а её соль – нитрит натрия. Эта соль при действии на неё минеральной кислоты (обычно соляной, реже – серной) образует азотистую кислоту, которая вступает в реакцию с амином. Поэтому часть минеральной кислоты, взятой для реакции, расходуется на разложение нитрита натрия с образованием азотистой кислоты: NaNO2
+ HCl → HNO2
+ NaCl.
Схему реакции диазотирования, в присутствии соляной кислоты, можно представить в общем виде:
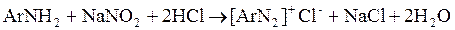
Диазосоединения в этой форме называются соли диазония
. Само диазосоединение является катионом [ArN2
]+
, а остаток кислоты – анионом. Например, при диазотировании анилина получают хлористый фенилдиазоний (I), при диазотировании n-нитроанилина – хлористый n-нитрофенилдиазоний (II) и.т.д.; при диазотировании в присутствии серной кислоты образуются соответствующие сернокислые соли (III, IV):
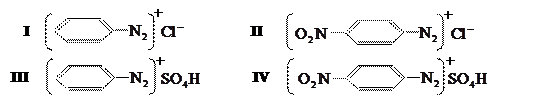 
Большинство ароматических диазосоединений весьма неустойчиво. В твёрдом состоянии они разлагаются при нагревании, при ударе, причём иногда со взрывом. В растворах при низких температурах они сравнительно устойчивы, но при нагревании водных растворов разложение происходит довольно быстро. Поэтому диазотирование ведут при низкой температуре, а растворы диазосоединений, как правило, не хранят, а сразу же пускают в дальнейшую переработку. Особенно неустойчивы диазосоединения, полученные при диазотировании анилина и его гомологов (толуидина, ксилидонов и др.) Поэтому диазотирование их ведут при температуре от 0 до 5˚С. Значительно более устойчивы диазосоединения из изомерных нитроанилинов, хлоранилинов, амино-бензойных кислот, т.е. ароматических аминов, содержащих так называемые отрицательные заместители. Их диазотируют при более высокой температуре (до 20˚С). Амины диазотируются тем легче, чем выше их основность. Когда основность амина сильно понижена вследствие наличия в ядре заместителей II рода, как, например, в п
-нитроанилина, диазотирование следует производить в более концентрированных растворах сильных кислот.
Диазотирование ведут, как было указано, в кислой среде, чаще всего в среде соляной кислоты. В серной кислоте диазотирование идёт медленнее, чем в соляной. Так как солянокислые соли большинства ароматических аминов лучше растворяются в воде, чем сернокислые и, кроме того, отличается каталитическое действие ионов галогена. Добавка бромистого натрия (или другого бромида) значительно ускоряет реакцию.
Диазотирование обычно ведут в присутствии значительного избытка кислоты. Это необходимо, чтобы предотвратить побочные реакции, приводящие к снижению выхода основного продукта. Соли диазония химически очень активны и в ходе реакции диазотирования могут вступать в реакцию с исходным аминосоединением, образуя диазоаминосоединения: [ArN2
]+
Cl-
+ ArNH2
→ Ar─N══N─HN─Ar. В сильнокислой среде эта реакция практически не идёт. Кроме того, в присутствии большого избытка минеральной кислоты повышается стойкость раствора диазосоединения.
Если ароматический амин нерастворим в водном растворе кислоты (как, например, сульфаниловая кислота или n-нитроанилин), то применяют различные приёмы, чтобы перевести его в раствор или в мелкодисперсную форму, удобную для диазотирования. Для этого, например, сульфаниловую кислоту растворяют в растворе аммиака или соды, а затем добавляют в кислоту; при подокислении амин выпадает в осадок в мелкораздробленной форме. Аминосоединения, находящиеся в растворе, обычно диазотируются быстрее, причём скорость диазотирования возрастает с увеличением концентрации в растворе аминосоединения. Аминосоединения, труднорастворимые в кислоте, диазотируются медленнее. При диазотировании таких аминосоединений, находящихся в форме суспензии, скорость диазотирования связана с размером частиц: чем мельче частицы суспензии, тем быстрее диазотируется аминосоединение.
В зависимости от свойств исходного ароматического амина и получаемого диазосоединения диазотирование ведут по-разному.
Анилин и толуидин смешивают с водой, добавляют рассчитанное количество соляной кислоты и образовавшийся раствор солянокислой соли амина охлаждают при размешивании до 0-2˚С. Солянокислые соли анилина и его гомологов хорошо растворимы в воде и при охлаждении не выпадают в осадок. К охлаждённому раствору постепенно приливают раствор нитрита натрия. Температура реакционной массы при диазотировании не должна превышать 5˚С. Диазосоединение образуется в форме соли диазония C6
H5
N2
Cl.
Диамины, т.е. соединения с двумя аминогруппами, по-разному ведут себя в реакции диазотирования. м
-Диамины, например м
-фенилдиамин, легко диазотируются с образованием бисдиазосоединения:
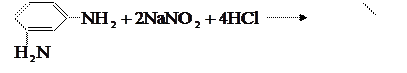  Образовавшееся бисдиазосоединение легко вступает в реакцию сочетания с исходным м
-фенилдиамином; при этом образуется краситель. Диазотирование n
-диаминов осложняется их склонностью к окислению, которое особенно легко протекает в среде концентрированной серной кислоты. Поэтому красители на основе бисдиазотированного n
-
фенилдиамина (т.е. дисазокрасители) получают не из n
-
фенилдиамина, а из n
-
нитроанилина или N-ацетил-n
-фенилдиамина. n
-
Нитроанилин диазотируют, получают краситель на основе этого диазосоединения (моноазокраситель), а затем в полученном красителе восстанавливают нитрогруппу в аминогруппу, диазотируют её и переводят в дисазокраситель.
Бензидин и другие амины, в которых аминогруппы расположены в разных ароматических ядрах, диазотируются обычными приёмами в обеих аминогруппах: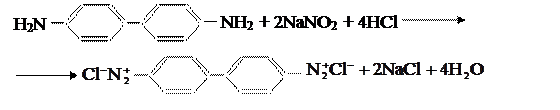 
При диазотировании контролируют температуру, кислотность среды и наличие в реакционной массе азотистой кислоты.
Кислотность контролируют при помощи индикаторной бумаги конго, которая в присутствии соляной или серной кислоты изменяет свой красный цвет на синий. Присутствие значительного избытка кислоты – важнейшее условие проведения реакции диазотирования. При недостатке кислоты снижается условие проведения реакции диазотирования. При недостатке кислоты снижается устойчивость диазосоединения и возникают побочные реакции, приводящие к загрязнению диазосоединения.
Наличие азотистой кислоты определяют при помощи индикаторной йодкрахмальной бумаги. Она представляет собой фильтровальную бумагу, пропитанную раствором йодистого калия и крахмала и высушенную. На йодкрахмальную бумагу наносят каплю реакционной массы. При наличии азотистой кислоты на белой полоске бумаги образуется синее пятно, но только в том случае, если раствор содержит избыток минеральной кислоты. Поэтому сначала следует проверить кислотность среды по бумаге конго, а затем – наличие азотистой кислоты по йодкрахмальной бумаге.
3.3. Реакция азосочетания
Азосочетанием называется взаимодействие диазосоединений с ароматическими аминами и фенолами (нафтолами)
;
оно приводит к образованию азокрасителей.
В реакции азосочетания участвуют два реагента: диазосоединение (обычно в форме соли диазония) и ароматический амин или фенол (нафтол). Амин, из которого получено диазосоединение, называют диазосотавляющей
реакции азосочетания, а второй реагент – азосоставляющей
(не путать с азосоединением!). Например, при получении красителя хризоидина сочетанием диазотированного анилина с м-
фенилдиамином:
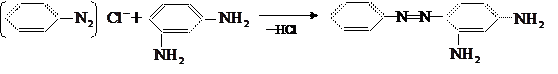 
диазосоставляющей является анилин, а азосоставляющей – м-
фенилдиамин.
В качестве азосоставляющей используют ароматические соединения, содержащие гидроксильную группу OH, аминогруппу NH2
, а также замещённую аминогруппу NHAlk, N(Alk)2
, NHAr.. Активной формой диазосоставляющей является катион диазония [ArN2
]+
.
Реакцию азосочетания можно рассматривать как реакцию замещения водорода в молекуле азосоставляющей остатком диазосоединения, точнее – замещённой азогруппой ArN═N─. При азосочетании замещение идёт, как правило, в п
-положение к амино- или оксигруппе азосоставляющей. Если п
-положение занято, то замещение идёт в о
-положение.
Сочетание с аминосоединениями ведут обычно в слабокислой среде, с оксисоединениями – в слабощелочной среде. Чтобы поддерживать во время реакции сочетания необходимую кислотность или щелочность среды, к раствору азосоставляющей добавляют уксуснокислый натрий для создания слабокислой среды, кальцинированную соду или бикарбонат натрия для создания слабощелочной среды. Уксуснокислый натрий взаимодействует с минеральной кислотой, выделяющейся при реакции азосочетания, и связывает её, превращаясь при этом в уксусную кислоту: HCl+CH3
COONa→CH3
COOH+NaCl. Благодаря этому в реакционной массе поддерживается слабокислая реакция.
При сочетании диазосоединений с анилином и другими первичными аминами бензольного ряда
образуется промежуточное диазоаминосоединение:
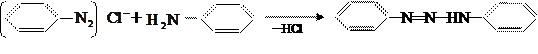 
При нагревании в кислой среде до 35-38˚С оно превращается в азосоединение:
 
Некоторые амины бензольного ряда, например крезидин, сразу образуют азосоединения. Аминосоединения, имеющие в м
-положении к аминогруппе заместитель первого рода, например м-
толуидин или м-
фенилдиамин, являются активными азосоставляющими, легко вступающими в реакцию сочетания. В молекулу м-
фенилендиамина (I) могут вступить две азогруппы: первая вступает в положение 4, вторая – в положение 2 или 6; при этом образуется смесь двух диазокрасителей. В м
-толуилендиамине (II) первая азогруппа вступает в положение 5, вторая - в положение 3:
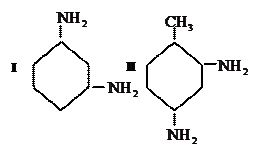 
1–Нафтиламин в кислой среде сочетается преимущественно в положении 4:
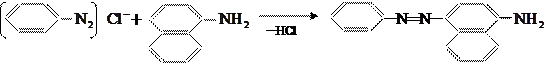 
Таким же образом сочетаются сульфокислоты 1-нафтиламина, например, 1-нафтиламин-6-сульфокислота, 1-нафтиламин-7-сульфокислота, перекислота (1-нафтиламин-8-сульфокислота).
Если положение 4 занято, что сочетание идёт в положение 2:
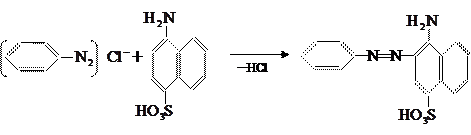 
Легко вступает в реакцию сочетания алкилированные амины, например, диметил- и диэтиланилин:
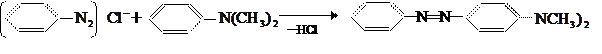 
При сочетании диазосоединений с оксисоединениями нужна слабощелочная среда и температура от 0 до 10˚С. С фенолом сочетание идёт в параположение:
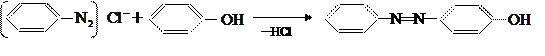 
Если параположение занято, то сочетание идёт в ортоположение.
Труднее, чем фенол, вступает в реакцию сочетания салициловая кислота. Сочетание с салициловой кислотой ведут в щелочной среде; диазогруппа вступает в параположение к оксигруппе:
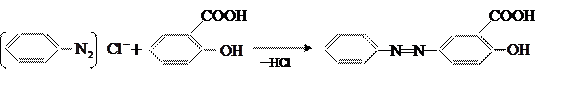 
Легко вступает в реакцию сочетания 2-нафтол; здесь сочетание идёт в положение 1:
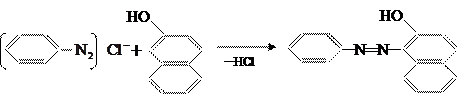 
Большое практическое значение в качестве азосоставляющих имеют нафтолсульфокислоты и аминонафтолсульфокислоты.
При сочетании диазосоединений с нафтолсульфокислотами диазогруппа вступает главным образом в положение, соседнее с гидроксильной группой. Азосоставляющую растворяют в содовом или щелочном растворе. Особое место среди азосоставляющих занимают аминонафтолсульфокислоты, в частности Аш-кислота (I), гамма-кислота (II) и И-кислота (III):
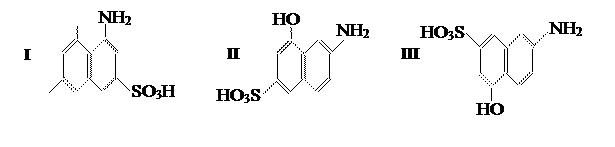  Обычно реакцию азосочетания ведут таким образом, чтобы к её концу в реакционной массе оставался незначительный избыток азосоставляющей и совершенно отсутствовало диазосоединение.
3.4. Механизм реакции азосочетания
Реакция азосочетания является классическим примером электрофильного замещения в ароматических соединениях. Эффектным электрофилом в данном случае является катион арилдиазония:
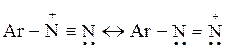
Он образуется в результате взаимодействия анилина с азотистой кислотой:
Однако, катион арилдиазония является более слабым электрофилом по сравнению с такими реагентами, как +NO2
и способен успешно атаковать только очень реакционноспособные ароматические соединения, такие как фенолы и амины.
Катионы диазония существуют только в кислой или слабощелочной среде, в сильнощелочном растворе они превращаются в кислоты. Поэтому реакция азосочетания может проводиться только в указанных условиях. Оптимальное значение pH зависит от свойств атакуемого соединения. В случае фенолов реакция лучше всего протекает в слабощелочной среде, поскольку образующийся фенолят-ион намного лучше атакуется, чем сам фенол из-за значительно более высокой электронной плотности.
Ароматические амины, как правило, атакуется несколько труднее, чем фенолы, поэтому сочетание с ними чаще всего проводят в слабокислом растворе, что обеспечивает высокую концентрацию иона.
Реакция азосочетания в общем виде:
Если X= ─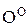 , ─ , ─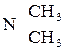 , сильно активирующие группы, азосочетание проходит успешно. Различия в поведении аминов и фенолов вызвано тем обстоятельством, что диазониевый ион эффективно атакует только свободный амин и фенолят-анион. , сильно активирующие группы, азосочетание проходит успешно. Различия в поведении аминов и фенолов вызвано тем обстоятельством, что диазониевый ион эффективно атакует только свободный амин и фенолят-анион.
Аммониевые ионы солей аминов ─NH3
, ─NH2
R, ─NHR2
и свободный фенол практически не атакуются, так как вследствие слабой электрофильности диазониевого иона он может атаковать углерод ароматического кольца лишь при значительном содействии со стороны заместителя. Такое содействие выражено в случае ─O и ─N(CH3
)2
:
Очень медленно реакция идёт в случае фенола:
3.6. Продукты для холодного крашения
Во всех рассмотренных до сих пор примерах реакцию азосочетания вели в растворе, затем выделяли полученный краситель, фильтровали, высушивали и в готовом виде передавали на текстильные фабрики для крашения ткани. Существует и другой способ крашения ткани, при котором реакцию азосочетания проводят непосредственно на волокне. Для этого ткань пропитывают щелочным раствором азосоставляющей (например 2-нафтолом) а затем погружают в подкисленный раствор диазосоставляющей (например диазотированного п-
нитроанилина). При этом краситель образуется непосредственно на волокне и полученная окраска обладает большой прочностью. Так как реакции диазотирования и азосочетания проводят при низких температурах, а в производстве это достигается охлаждением льдом, то способ этот получил название холодного
илиледяного крашения
.
Важнейшими азосоставляющими для холодного крашения являются производные β-оксинафтойной кислоты – азотолы
. Их получают взаимодействием β-оксинафтойной кислоты с ароматическими аминами.
Азотолы легко переходят на волокно из щелочных растворов и прочно удерживаются на нём, что облегчает последующее сочетание их на волокне с диазосоединением.
Диазосоставляющие для холодного крашения выпускают в различных формах. Наиболее простая форма – азоамины –
аминосоединения бензольного и нафталинового ряда. Название азоаминов включает цвет наиболее важного красителя, получаемого, из него в текстильной промышленности. Например азоамин красный Ж (п-
нитроанилин), азоамин жёлтый О (о-
хлоранилин).
В отличие от азотолов азоамины нельзя непосредственно применять для холодного крашения. Их сначала нужно перенести в форму диазосоединения, т.е. продиазотировать, причём обязательно на текстильной фабрике непосредственно перед крашением. Это объясняется неустойчивостью обычных форм диазосоединений и трудностью транспортировки. Поэтому большей частью диазосоединения перерабатывают сразу после диазотирования, не выделяя из раствора. Но специально для холодного крашения некоторые диазосоединения заготавливают в твёрдом виде или в виде паст, переводя их в различные стойкие формы, пригодные для хранения и транспортировки. Стойкие формы азосоединений называются диазолями
.
Одна из таких форм – двойная соль диазосоединения с солями тяжёлых металлов, например хлористым цинком. Её получают добавлением хлористого цинка к раствору соли диазония. При последующем добавлении хлористого натрия двойная соль выпадает в осадок, её отфильтровывают и сушат при низкой температуре. Строение соли отвечает формуле 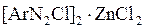 . В некоторых случаях диазотирование ведут в среде серной кислоты; тогда двойная соль имеет строение . В некоторых случаях диазотирование ведут в среде серной кислоты; тогда двойная соль имеет строение 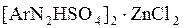 . .
Таким образом, из азоамина жёлтого О получают диазоль жёлтый О:
 
4. Экспериментальная часть
4.1.
Синтез 4-окси-3-кабоксиазобензола
 
Анилин 9,3 г (9,1 мл)
Соляная кислота (
d
=1,18) 22,5 мл
Нитрит натрия 7 г
Карбонат натрия 3 г
|
Салициловая кислота 13,8 г
Раствор едкого натра (36%-ный) 16,5 мл
2 фарфоровых стакана на 250 мл
Мешалка
|
В фарфоровом стакане на 150-200 мл растворяют 9,3 г анилина в смеси 22,5 мл концентрированной соляной кислоты и 22,5 мл воды. Раствор охлаждают до 0˚С и при перемешивании приливают к нему охлаждённый раствор 7 г нитрита натрия в 20 мл воды (при температуре не выше 2˚С). Конец реакции диазотирования контролируют по иодкрахмальной бумаге.
Через 10 мин после конца диазотирования избыток соляной кислоты удаляют осторожным внесением 2 г соды, после чего раствор должен всё же давать слабокислую реакцию на конго.
Раствор диазосоединения при перемешивании постепенно приливают к охлаждённому до 0˚С раствору 13,8 г салициловой кислоты в 16,6 мл 36%-ного едкого натра и 35 мл воды, к которому добавлено ещё 1 г соды (температура должна поддерживаться не выше 5˚С). Через 2 ч выпавший моноазокраситель отделяют фильтрованием.
Характеристика исходных реактивов
| № |
Название |
Формула |
Мол. масса |
ρ, г/см3
|
Т. пл., ˚С |
Т.кип., ˚С |
 |
Растворимость |
| в воде |
в орг. р-лях |
| 1 |
Анилин |
C6
H5
NH2
|
93,13 |
1,02 |
-6 |
184,4 |
1,585 |
3,4 |
сп. э. бз. |
| 2 |
Соляная кислота |
HCl |
36,5 |
1,179 |
- |
- |
- |
- |
- |
| 3 |
Нитрит натрия |
NaNO2
|
69,0 |
2,17 |
79 разл. |
- |
- |
84,5 |
э. метанолабс. сп |
| 4 |
Карбонат натрия |
Na2
CO3
|
105,9 |
2,53 |
851 |
разл. |
- |
21,5 |
- |
| 5 |
Салициловая кислота |
HO-C6
H4
-COOH |
138,1 |
1,443 |
159 |
возг. |
- |
0,18 |
сп. э. ац. хл. |
| 6 |
Едкий натр |
NaOH |
40,0 |
2,13 |
328 |
1388 |
- |
109 |
сп. гл. |
Ход работы и пояснения к синтезу
1. Анилин растворяем в разбавленной соляной кислоте.
2. Проводим реакцию диазотирования. Раствор охлаждаем до 0˚С и при перемешивании к нему добавляем охлаждённый водный раствор нитрита натрия. Для диазотирования применяется азотистая кислота, выделяющаяся из нитрита натрия под действием соляной кислоты. Для проведения реакции необходима низкая температура (не выше 2˚С), т.к. большинство диазосоединений неустойчивы. В процессе диазотирования раствор должен иметь кислую реакцию. Как правило, минеральной кислоты берётся в некотором избытке – 2,5 эквивалента на 1 эквивалент амина, т.к. при более высоких значениях pH равновесие ион аммония ↔ амин смещается в сторону свободного основания. Следует отметить также, что анионы галогенводородных кислот действуют в данной реакции каталитически. При небольших концентрациях водородных ионов образовавшееся диазосоединение может реагировать с исходным анилином, образуя диазоаминосоединение:   что является побочным продуктом. Для контроля кислотности пользуемся реакцией на конго – красный: посинение бумажки от капли раствора указывает на присутствие соляной кислоты. Необходимое для реакции нитрита натрия следует дозировать как можно точнее, т.к., во-первых, диазотирование протекает практически количественно (этой реакцией пользуются при объёмном анализе ароматических аминов) и, во-вторых, избыток азотистой кислоты уменьшает устойчивость диазорастворов. Избыток азотистой кислоты обычно определяют в конце реакции. Для этого пользуются йодкрахмальной бумажкой (фильтровальная бумага, пропитанная раствором крахмала и йодистого калия). Образовавшая из нитрита натрия в кислой среде азотистая кислота, реагирует с йодистым калием, выделяя йод, который с крахмалом даёт синее окрашивание: 2HNO2
+ KI + 2H2
O→ I2
+ 2KCl + 2NO + 2H2
O. При правильно проведённом диазотировании реакция на азотистую кислоту в конце процесса должна быть очень слабой, т.е. йодкрахмальная бумажка должна быть синей в процессе реакции, когда много свободной азотистой кислоты, к концу реакции синее окрашивание исчезает. Таким образом получаем водный раствор соли диазония. Механизм реакции диазотирования приведён подробно в литературной части (стр. 22). что является побочным продуктом. Для контроля кислотности пользуемся реакцией на конго – красный: посинение бумажки от капли раствора указывает на присутствие соляной кислоты. Необходимое для реакции нитрита натрия следует дозировать как можно точнее, т.к., во-первых, диазотирование протекает практически количественно (этой реакцией пользуются при объёмном анализе ароматических аминов) и, во-вторых, избыток азотистой кислоты уменьшает устойчивость диазорастворов. Избыток азотистой кислоты обычно определяют в конце реакции. Для этого пользуются йодкрахмальной бумажкой (фильтровальная бумага, пропитанная раствором крахмала и йодистого калия). Образовавшая из нитрита натрия в кислой среде азотистая кислота, реагирует с йодистым калием, выделяя йод, который с крахмалом даёт синее окрашивание: 2HNO2
+ KI + 2H2
O→ I2
+ 2KCl + 2NO + 2H2
O. При правильно проведённом диазотировании реакция на азотистую кислоту в конце процесса должна быть очень слабой, т.е. йодкрахмальная бумажка должна быть синей в процессе реакции, когда много свободной азотистой кислоты, к концу реакции синее окрашивание исчезает. Таким образом получаем водный раствор соли диазония. Механизм реакции диазотирования приведён подробно в литературной части (стр. 22).
3. Проводим реакцию азосочетания полученной соли диазония с салициловой кислотой. После окончания реакции диазотирования избыток соляной кислоты удаляем осторожным внесением соды, после чего раствор всё же должен давать слабокислую реакцию на конго. Раствор полученного диазосоединения при перемешивании постепенно приливаем к охлаждённому до 0˚С щелочному раствору салициловой кислоты. Температура синтеза не должна превышать 5˚С. Салициловая кислота   является окси-кислотой или фенолокислотой, она имеет две функциональные группы ─OH и ─COOH и потому образует два ряда производных. Как кислота, салициловая кислота по COOH-группе может образовать хлор-ангидрид, соль, эфир. С другой стороны, салициловая кислота может выступать как фенол по OH-группе, образовывать феноляты и участвовать в реакции азосочетания. Салициловая кислота труднее, чем фенол, вступает в реакцию азосочетания. Сочетание с салициловой кислотой идёт в щелочной среде, диазогруппа вступает в п-
положение к оксигруппе: является окси-кислотой или фенолокислотой, она имеет две функциональные группы ─OH и ─COOH и потому образует два ряда производных. Как кислота, салициловая кислота по COOH-группе может образовать хлор-ангидрид, соль, эфир. С другой стороны, салициловая кислота может выступать как фенол по OH-группе, образовывать феноляты и участвовать в реакции азосочетания. Салициловая кислота труднее, чем фенол, вступает в реакцию азосочетания. Сочетание с салициловой кислотой идёт в щелочной среде, диазогруппа вступает в п-
положение к оксигруппе: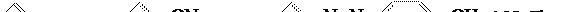  Механизм реакции азосочетания приведён в литературной части (стр. 30). Для поддержания щелочной среды к раствору добавляется ещё 1 г. соды. Через 2 часа выпадает моноазокраситель оранжевого цвета, который отделяют фильтрованием. Механизм реакции азосочетания приведён в литературной части (стр. 30). Для поддержания щелочной среды к раствору добавляется ещё 1 г. соды. Через 2 часа выпадает моноазокраситель оранжевого цвета, который отделяют фильтрованием.
Чтобы легче установить строение полученного азокрасителя, его можно восстановить с помощью гидросульфита натрия до двух простых по строению диаминов:  
Полученные диамины можно охарактеризовать данными элементного анализа, спектроскопии и хроматографии. Данный моноазокраситель можно использовать для получения вышеуказанных аминов, если их труднее получить другим путём. В качестве восстановителя также можно использовать SnCl2
в кислой среде.
Расчёты (по проведённому синтезу):
5.
Выводы
1. Собран и проанализирован литературный материал по красителям, азокрасителям, способам их получения и свойствам.
2. Изучены условия реакции диазотированияи получена соли диазония.
3. Изучены условия реакции азосочетания соли диазония с салициловой кислотой и получен моноазокраситель – 4-окси-3-карбоксиазобензол.
6. Список литературы
1. Гурвич Я. А., Кулик С. Т.. Химия и технология промежуточных продуктов органических красителей и химикатов для полимерных материалов. – М. Высшая школа. 1974. с.126-171
2. Венкатараман К.. Химия синтетических красителей. Т.2 -Л. Хим. литература. 1957. с.1664.
3. Несмеянов А. Н., Несмеянов Н. А.. Начала органической химии. Т.2. –М. Химия. 1970. с.823.
4. Неницеску К. Д.. Органическая химия. Т.1. – М. «ИЛ». 1963. с.863
5. Робертс Дж., Касерио М.. Основы органической химии. Т.2. – М. Мир. 1968. с.550
6. Каррер П.. Курс органической химии. 2-е издание (стереотипное). – Л. 1962. с.358-359,586,588,589,740.
7. Физер Л., Физер М.. Органическая химия. Т.2. – М. Химия. 1969. с.687.
8. Гауптман, Грефе Ю., Ремане Х.. Органическая химия. – М. Химия. 1979. с.740-746.
9. Храмкина М. Н.. Практикум по органическому синтезу. – Л. Химия. 1969. с.328.
10. Гинзбург О. Ф.. Лабораторные работы по органической химии. – М. Высшая школа. 1970. с.295.
11. Аграномов А. Е., Шаборов Ю. С.. Лабораторные работы в органическом практикуме. – М. Химия. 1974. с.375.
12. Сайкс П.. Механизмы реакций в органической химии. – М. Химия. 1977. с.319.
13. Бреслоу Р.. Механизмы органических реакций. – М. Мир. 1968. с.277.
14. Перельман В. И.. Краткий справочник химика. – М. Л. Химия. 1964. с.619.
|