Сургутский Государственный Университет
Кафедра химии
РЕФЕРАТ
по теме:
ЖЕЛЕЗО
Выполнил:
Бондаренко М.А.
596/2 гр.
Проверил:
Щербакова Л.П.
Сургут, 2000
В периодической системе железо находится в четвертом периоде, в побочной подгруппе VIII группы.
Химический знак – Fe (феррум). Порядковый номер – 26, электронная формула 1s2
2s2
2p6
3d6
4s2
.
Электронно-графическая формула
| ¯ |
|
|
|
|
| 3d |
¯ |
4p |
 |
4s |
Валентные электроны у атома железа находятся на последнем электронном слое (4s2
) и предпоследнем (3d6
). В химических реакциях железо может отдавать эти электроны и проявлять степени окисления +2, +3 и, иногда, +6.
Нахождение в природе.
Железо является вторым по распространенности металлом в природе (после алюминия). В свободном состоянии железо встречается только в метеоритах, падающих на землю. Наиболее важные природные соединения:
Fe2
O3
· 3H2
O – бурый железняк;
Fe2
O3
– красный железняк;
Fe3
O4
(FeO · Fe2
O3
) – магнитный железняк;
FeS2
- железный колчедан (пирит).
Соединения железа входят в состав живых организмов.
Получение железа.
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах. Химизм доменного процесса следующий:
C + O2
= CO2
,
CO2
+ C = 2CO.
3Fe2
O3
+ CO = 2Fe3
O4
+ CO2
,
Fe3
O4
+ CO = 3FeO + CO2
,
FeO + CO = Fe + CO2
.
Физические свойства.
Железо – серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами. Плотность железа – 7,87 г/см3
, температура плавления 1539°С.
Химические свойства.
В реакциях железо является восстановителем. Однако при обычной температуре оно не взаимодействует даже с самыми активными окислителями (галогенами, кислородом, серой), но при нагревании становится активным и реагирует с ними:
2Fe + 3Cl2
= 2FeCl3
Хлорид железа (III)
3Fe + 2O2
= Fe3
O4
(FeO · Fe2
O3
) Оксид железа (II,III)
Fe + S = FeS Сульфид железа (II)
При очень высокой температуре железо реагирует с углеродом, кремнием и фосфором:
3Fe + C = Fe3
C Карбид железа (цементит)
3Fe + Si = Fe3
Si Силицид железа
3Fe + 2P = Fe3
P2
Фосфид железа (II)
Железо реагирует со сложными веществами.
Во влажном воздухе железо быстро окисляется (корродирует):
Реклама

4Fe + 3O2
+ 6H2
O = 4Fe(OH)3
,
O
Fe(OH)3
= Fe
O – H + H2
O
Ржавчина
Железо находится в середине электрохимического ряда напряжений металлов, поэтому является металлом средней активности
. Восстановительная способность у железа меньше, чем у щелочных, щелочноземельных металлов и у алюминия. Только при высокой температуре раскаленное железо реагирует с водой:
3Fe + 4H2
O = Fe3
O4
+ 4H2
Железо реагирует с разбавленными серной и соляной кислотами, вытесняя из кислот водород:
Fe + 2HCl = FeCl2
+ H2
Fe + H2
SO4
= FeSO4
+ H2
При обычной температуре железо не взаимодействует с концентрированной серной кислотой, так как пассивируется ею. При нагревании концентрированная H2
SO4
окисляет железо до сульфита железа (III):
2Fe + 6H2
SO4
= Fe2
(SO4
)3
+ 3SO2
+ 6H2
O.
Разбавленная азотная кислота окисляет железо до нитрата железа (III):
Fe + 4HNO3
= Fe(NO3
)3
+ NO + 2H2
O.
Концентрированная азотная кислота пассивирует железо.
Из растворов солей железо вытесняет металлы, которые расположены правее его в электрохимическом ряду напряжений:
Fe + CuSO4
= FeSO4
+ Cu, Fe0
+ Cu2+
= Fe2+
+ Cu0
.
Соединения железа (II)
Оксид железа (II) FeO
– черное кристаллическое вещество, нерастворимое в воде. Оксид железа (II) получают восстановлением оксида железа(II,III) оксидом углерода (II):
Fe3
O4
+ CO = 3FeO + CO2
.
Оксид железа (II) – основной оксид, легко реагирует с кислотами, при этом образуются соли железа(II):
FeO + 2HCl = FeCl2
+ H2
O, FeO + 2H+
= Fe2+
+ H2
O.
Гидроксид железа (II) Fe(OH)2
– порошок белого цвета, не растворяется в воде. Получают его из солей железа (II) при взаимодействии их со щелочами:
FeSO4
+ 2NaOH = Fe(OH)2
¯ + Na2
SO4
,
Fe2+
+ 2OH-
= Fe(OH)2
¯.
Гидроксид железа () Fe(OH)2 проявляет свойства основания, легко реагирует с кислотами:
Fe(OH)2
+ 2HCl = FeCl2
+ 2H2
O,
Fe(OH)2
+ 2H+
= Fe2+
+ 2H2
O.
При нагревании гидроксид железа (II) разлагается:
Fe(OH)2
= FeO + H2
O.
Соединения со степенью окисления железа +2 проявляют восстановительные свойства
, так как Fe2+
легко окисляются до Fe+3
:
Fe+2
– 1e = Fe+3
Так, свежеполученный зеленоватый осадок Fe(OH)2 на воздухе очень быстро изменяет окраску – буреет. Изменение окраски объясняется окислением Fe(OH)2
в Fe(OH)3
кислородом воздуха:
4Fe+2
(OH)2
+ O2
+ 2H2
O = 4Fe+3
(OH)3
.
Восстановительные свойства проявляют и соли двухвалентного железа, особенно при действии окислителей в кислотной среде. Например, сульфат железа (II) восстанавливает перманганат калия в сернокислотной среде до сульфата марганца (II):
Реклама

10Fe+2
SO4
+ 2KMn+7
O4
+ 8H2
SO4
= 5Fe+3
2
(SO4
)3
+ 2Mn+2
SO4
+ K2
SO4
+ 8H2
O.
Качественная реакция на катион железа (II).
Реактивом для определения катиона железа Fe2+ является гексациано (III) феррат калия (красная кровяная соль) K3[Fe(CN)6
]:
3FeSO4
+ 2K3
[Fe(CN)6
] = Fe3
[Fe(CN)6
]2
¯ + 3K2
SO4
.
При взаимодействии ионов [Fe(CN)6
]3
- с катионами железа Fe2+
образуется темно-синий осадок – турнбулева синь:
3Fe2+
+2[Fe(CN)6
]3-
= Fe3
[Fe(CN)6
]2
¯
Соединения железа (III)
Оксид железа (III) Fe2
O3
– порошок бурого цвета, не растворяется в воде. Оксид железа (III) получают:
А) разложением гидроксида железа (III):
2Fe(OH)3
= Fe2
O3
+ 3H2
O
Б) окислением пирита (FeS2
):
4Fe+2
S2
-1
+ 11O2
0
= 2Fe2
+3
O3
+ 8S+4
O2
-2
.
 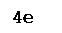 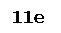 Fe+2
– 1e ® Fe+3 Fe+2
– 1e ® Fe+3
2S-1
– 10e ® 2S+4
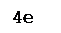
O2
0
+ 4e ® 2O-2
11e
Оксид железа (III) проявляет амфотерные свойства:
А) взаимодействует с твердыми щелочами NaOH и KOH и с карбонатами натрия и калия при высокой температуре:
Fe2
O3
+ 2NaOH = 2NaFeO2 + H2
O,
Fe2
O3
+ 2OH-
= 2FeO2-
+ H2
O,
Fe2
O3
+ Na2
CO3
= 2NaFeO2
+ CO2
.
Феррит натрия
Гидроксид железа (III)
получают из солей железа (III) при взаимодействии их со щелочами:
FeCl3
+ 3NaOH = Fe(OH)3
¯ + 3NaCl,
Fe3+
+ 3OH-
= Fe(OH)3
¯.
Гидроксид железа (III) является более слабым основанием, чем Fe(OH)2
, и проявляет амфотерные свойства (с преобладанием основных). При взаимодействии с разбавленными кислотами Fe(OH)3
легко образует соответствующие соли:
Fe(OH)3
+ 3HCl « FeCl3
+ H2
O
2Fe(OH)3
+ 3H2
SO4
« Fe2
(SO4
)3
+ 6H2
O
Fe(OH)3
+ 3H+
« Fe3+
+ 3H2
O
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании. При этом получаются устойчивые гидрокомплексы с координационным числом 4 или 6:
Fe(OH)3
+ NaOH = Na[Fe(OH)4
],
Fe(OH)3
+ OH-
= [Fe(OH)4]-
,
Fe(OH)3
+ 3NaOH = Na3
[Fe(OH)6
],
Fe(OH)3
+ 3OH-
= [Fe(OH)6
]3-
.
Соединения со степенью окисления железа +3 проявляют окислительные свойства, так как под действием восстановителей Fe+3
превращается в Fe+2
:
Fe+3 + 1e = Fe+2.
Так, например, хлорид железа (III) окисляет йодид калия до свободного йода:
2Fe+3
Cl3
+ 2KI = 2Fe+2
Cl2
+ 2KCl + I2
0
Качественные реакции на катион железа (III)
А) Реактивом для обнаружения катиона Fe3+
является гексациано (II) феррат калия (желтая кровяная соль) K2
[Fe(CN)6
].
При взаимодействии ионов [Fe(CN)6
]4-
с ионами Fe3+
образуется темно-синий осадок – берлинская лазурь
:
4FeCl3
+ 3K4
[Fe(CN)6
] « Fe4
[Fe(CN)6
]3
¯ +12KCl,
4Fe3+
+ 3[Fe(CN)6
]4-
= Fe4
[Fe(CN)6
]3
¯.
Б) Катионы Fe3+
легко обнаруживаются с помощью роданида аммония (NH4
CNS). В результате взаимодействия ионов CNS-1 с катионами железа (III) Fe3+ образуется малодиссоциирующий роданид железа (III) кроваво-красного цвета:
FeCl3
+ 3NH4
CNS « Fe(CNS)3
+ 3NH4
Cl,
Fe3+
+ 3CNS1-
« Fe(CNS)3
.
Применение и биологическая роль железа и его соединений.
Важнейшие сплавы железа – чугуны и стали – являются основными конструкционными материалами практически во всех отраслях современного производства.
Хлорид железа (III) FeCl3
применяется для очистки воды. В органическом синтезе FeCl3
применяется как катализатор. Нитрат железа Fe(NO3
)3
· 9H2
O используют при окраске тканей.
Железо является одним из важнейших микроэлементов в организме человека и животных (в организме взрослого человека содержится в виде соединений около 4 г Fe). Оно входит в состав гемоглобина, миоглобина, различных ферментов и других сложных железобелковых комплексов, которые находятся в печени и селезенке. Железо стимулирует функцию кроветворных органов.
Список использованной литературы:
1. «Химия. Пособие репетитор». Ростов-на-Дону. «Феникс». 1997 год.
2. «Справочник для поступающих в вузы». Москва. «Высшая школа», 1995 год.
3. Э.Т. Оганесян. «Руководство по химии поступающим в вузы». Москва. 1994 год.
|