АНДРЕЕВ В.Г.
ВЛИЯНИЕ ПОВЕРХНОСТНОГО ПОТЕНЦИАЛА ВОДЫ НА РЕОЛОГИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ
Дисперсные системы относятся к гетерогенным системам и состоят из двух и более фаз [1]. Одна из фаз является сплошной и называется дисперсионной средой. Другие фазы раздроблены и распределены в первой; они называются дисперсными фазами. Дисперсные системы, в которых дисперсионной средой является вода, широко распространены в природе и играют важную роль в технике (кровь живых организмов, грязевые потоки, суспензии в производстве керамики и т.д.). Реологические свойства этих дисперсных систем в значительной степени зависят от свойств межфазной границы «вода - дисперсная фаза». Поэтому исследование этих зависимостей весьма актуально при решении ряда задач по регулированию свойств дисперсных систем.
При погружении частиц дисперсной фазы в водную среду происходит специфическая адсорбция всегда присутствующих в воде ионов Н3
О+
и OH-
на поверхность. Величины адсорбции ионов Н3
О+
и OH-
обусловлены особенностям химического состава, кристаллической структуры и состояния поверхности частиц дисперсной фазы. Свойства межфазных границ «вода – дисперсная фаза» зависят также от поверхностного потенциала воды. Известно, что в нейтральной среде поверхность воды имеет отрицательный потенциал -450 мВ, несмотря на то, что концентрация ионов [Н3
О+
] равна концентрации ионов [OH-
][2]. Ионы OH-
по своему строению сильнее отличаются от строения молекул воды, чем ионы Н3
О+
, что и объясняет их повышенную поверхностную активность (рис.1). Поэтому, как правило, поверхность частиц в дисперсных системах заряжается отрицательно, что способствует снижению вязкости дисперсных систем благодаря уменьшению сил межчастичного трения в результате действия кулоновских сил взаимного отталкивания между частицами.

Рис.1. Схема строения иона Н3
О+
, молекулы воды и иона OH-
Соотношение ионов Н3
О+
и OH-
, адсорбирующихся на поверхности воды, и, следовательно, потенциал поверхности воды, зависят от исходного соотношения ионов Н3
О+
и OH-
в воде, т.е. от кислотности (рН) водной среды. Это подтверждается данными, приведенными на рис.2. Потенциал поверхности дистиллированной воды определяли по методике, описанной в работе [2]. Для изменения рН использовались водные растворы HCl и NaOH. Увеличение рН (щелочная среда) вызывает увеличение доли адсорбированных ионов OH-
и, соответственно усиливает отрицательный заряд на поверхности воды. В кислой среде происходит снижение и последующая инверсия поверхностного потенциала. Величину рН, соответствующую нулевому потенциалу поверхности воды (5,4), назовем точкой нулевого заряда (ТНЗ).
Реклама

В технике часто приходится решать задачу получения стабильных концентрированных дисперсных систем (суспензий, шликеров) с низкой вязкостью. Это важно при операциях транспортировки дисперсных систем по трубопроводам, измельчения, сушки, формования и т.д. При этом необходимо предотвратить налипание дисперсных систем на стенки трубопроводов, реакторов и рабочие поверхности технологического оборудования. Похожие задачи встречаются и в медицине, например, снижения вязкости крови при высоком содержании эритроцитов и предотвращения формирования атеросклеротических бляшек на стенках кровеносных сосудов.
Известно, что кровь человека и других живых организмов имеет щелочную реакцию. Отрицательный поверхностный потенциал поверхности воды обеспечивает формирование отрицательного потенциала на стенках кровеносных сосудов и поверхности эритроцитов. В результате снижается вязкость крови и вероятность формирования атеросклеротических бляшек на стенках кровеносных сосудов из-за возрастания кулоновских сил отталкивания между отрицательно заряженными поверхностями. Аналогичные явления наблюдаются и в суспензиях керамических порошков. Как видно из данных, приведенных на рис.3, налипание суспензий Fe2
O3
на поверхности пластин стали и оргстекла происходит в кислой и нейтральной средах. В основной среде налипания не происходит, а имеет место даже “растворение” налипшей массы и очистка пластин. В щелочной среде повышается седиментационная устойчивость суспензии и снижается вязкость.
Концентрация адсорбированных ионов зависит от кривизны поверхности. Вблизи поверхности частицы равновесная концентрация адсорбированных ионов H3
O+
повышена по сравнению с плоской поверхностью на величину [3]:
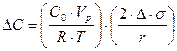 , ,
где С0
- концентрация адсорбированных ионов на плоской поверхности; Vр
– равновесный объем иона; R – универсальная газовая постоянная; T – температура; Ds - понижение поверхностной энергии при адсорбции; r – радиус частиц.
Реклама

Следовательно, потенциал поверхности частиц дисперсной фазы изменяется быстрее потенциала поверхности пластины. Поэтому в кислой среде, как правило, поверхность частиц имеет положительный потенциал, а на поверхности пластины еще сохраняется отрицательный потенциал, что служит причиной значительного возрастания налипания частиц к поверхности пластины.
Известно, что значительную роль в стабилизации свойств крови играют белковые вещества, являющиеся полиэлектролитами (альбумин, гепарин) и другие полиэлектролиты (например, цитрат натрия предотвращает сворачивание крови при хранении на воздухе) [4]. В технике также используются полиэлектролиты для стабилизации и снижения вязкости водных суспензий и шликеров [3]. Эффективность полиэлектролитов объясняется формированием двойного электрического слоя на поверхности частиц дисперсной фазы в результате адсорбции полиионов.
Использование полиэлектролитов для снижения вязкости суспензий может значительно влиять на процессы налипания. В частности, аммонийные соли поликислот (цитрат аммония, полиакрилат аммония и т.д.) неустойчивы и могут разлагаться с выделением аммиака [3]. В результате в суспензиях формируется кислая среда, значительно ускоряющая процессы налипания. Поэтому в керамическом производстве предпочтительнее использование устойчивых солей поликислот (например, триэтаноламиновые соли, натриевые и т.д.). Причем, содержание щелочи должно несколько превышать стехиометрический состав с целью формирования основной среды и уменьшения налипания. В случае использования солей полиоснований (полиэтилениминацетат, поливиниламин хлорид и т.д.) для формирования основной среды количество вводимой кислоты должно быть меньше стехиометрического состава.
В заключении следует отметить важную роль полученных результатов при разработке лекарственных средств для снижения вязкости крови и предотвращения формирования атеросклеротических бляшек. Эффективные препараты можно создать с использованием полиэлектролитов, обеспечивающие стабильность рН крови вблизи 7,36 благодаря большой буферной емкости.
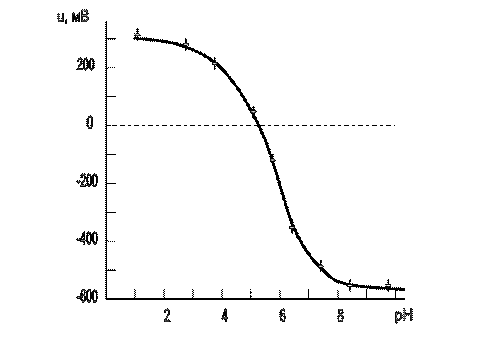
Рис.2. Влияние рН на потенциал поверхности воды

Рис.3. Зависимость массы налипшего слоя на поверхности пластин из стали (1) и оргстекла (2) при их погружении в суспензию частиц оксида железа с содержанием твердой фазы 70% масс. и средним размером часмтиц 1 мкм от рН среды
Литература
- Бибик Е.Е. Реология дисперсных систем. - Л.: Издание Ленинградского университета, 1981. - 172с.
- Colacicco G. Electrical potential of the water surface // Chewm. Scripta. 1988. V.28, N.2. p.141-144.
- Анциферов В.Н., Гончар А.В., Андреев В.Г., Летюк Л.М., Салдугей А.М., Рябов И.Ф. Водорастворимые связующие вещества в технологии порошковых ферритовых материалов.- Пермь: Изд-во ПГТУ, 1996.-189с.
- Маркосян А.А. Нормальная физиология.- М.: Медгиз, 1955. -392 с.
|