.
Аминами называются органические производные аммиака, в котором один, два или все три атома водорода замещены на углеводородные радикалы ( предельные, непредельные, ароматические).
Название аминов производят от названия углеводородного радикала с добавлением окончания –амин
или от названия соответствующего углеводорода с приставкой амино-.
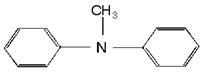 Примеры: Примеры:
CH3
– NH2
CH3
– NH – C2
H5
метиламин метилэтиламин мтилдифениламин
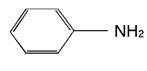
фениламин
(анилин)
В зависимости от числа атомов водорода, замещенных в аммиаке на углеводородные радикалы, различают первичные, вторичные и третичные
амины:
R
R- NH2
R – NH – R’ R – N – R”
первичный амин вторичный амин третичный амин
Где R, R’, R’’ – углеводородные радикалы.
Первичные, вторичные и третичные амины можно получить, проводя алкилирование (введение алкильного радикала) аммиака. При этом происходит постепенное замещение атомов водорода аммиака на радикалы, и образуется смесь аминов:
NH3
+ CH3
I --- CH3
NH2
+ HI
CH3
NH2
+ CH3
I --- (CH3
)2
NH + HI
(CH3
)2
NH + CH3
I --- (CH3
)2
N + HI
Обычно в смеси аминов преобладает один из них в зависимости от соотношения исходных веществ.
Для получения вторичных и третичных аминов можно использовать реакцию аминов с галогеналкилами:
(CH3
)2
NH + C2
H5
Br --- (CH3
)2
NC2
H5
+ HBr
Амины можно получить восстановлением нитросоединений. Обычно нитросоединения подвергают каталитическому гидрированию водородом:
C2
H5
NO2
+ 3H2
--- C2
H5
NH2
+ 2H2
O
Этот метод используется в промышленности для получения ароматических аминов .
Предельные амины. При обычных условиях метил амин CH3
NH2
, диметиламин (CH3
)2
NH, триметиламин (CH3
)3
N и этиламин C2
H5
NH2
– газы с запахом, напоминающим запах аммиака. Эти амины хорошо растворимы в воде. Более сложные амины – жидкости, высшие амины – твердые вещества.
Для аминов характерны реакции присоединения, в результате которых образуются алкиламиновые соли. Например, амины присоединяют галогеноводороды:
(CH3
)2
NH2
+HCl --- [(CH3
)2
NH3
]Cl
хлорид этиламмония
(CH3
)2
NH + HBr --- [(CH3
)2
NH2
]Br
бромид диметиламмония
(CH3
)3
N + HI --- [(CH3
)3
NH]I
Реклама

иодид триметиламмония
Тритичные амины присоединяют галогенопроизводные углеводорода с образованием тетраалкиламмониевых солей, например:
(C2
H5
)3
N + C2
H5
I --- [(C2
H5
)4
N]I
Алкиламониевые соли растворимы в воде и в некоторых органических растворителях. При этом они диссоциируют на ионы:
[(C2
H5
)4
N]I === [(C2
H5
)4
N]+
+ I-
В результате водные и неводные растворы этих солей проводят электрический ток. Химическая связь в алкиламмониевых соединениях ковалентная, образованная по донорно-акцепторному механизму:
Ион метиламмония
Как и аммиак, в водных растворах амины проявляют свойства оснований. В их растворах появляются гидроксид-ионы за счет образования алкиламониевых оснований:
C2
H5
NH2
+ H2
O === [C2
H5
NH3
]+
+ OH-
Щелочную реакцию растворов аминов можно обнаружить при помощи индикаторов.
Амины горят на воздухе с выделением CO2
, азота и воды, например:
4(C2
H5
)2
NH + 27O2
--- 16CO2
+ 2N2
+ 22H2
O
Первичные, вторичные и третичные амины можно различить, используя азотную кислоту HNO2
. при взаимодействии этой кислоты с первичными аминами образуется спирт и выделяется азот:
CH3
– NH2
+ HNO2
--- CH3
– OH + N2
+H2
O
Вторичные амины дают азотистой кислотой нитрозосоединения, которые имеют характерный запах:
CH3
– NH2
– CH3 + HNO2
--- (CH3
)2
– N==NO+H2
O
Третичные амины не реагируют азотистой кислотой.
Анилин
C6
H5
NH2
является важнейшим ароматическим амином. Он представляет собой бесцветную маслянистую жидкость, которая кипит при температуре 184,4 0
С.
Анилин был впервые получен в XIX в. русским химиком-органиком Н. Н. Зининым, который использовал реакцию восстановления нитробензола сульфидом аммония (NH4
)2
S. В промышленности анилин получают каталитическим гидрированием нитробензола с использованием медного катализатора:
C6
H5
– NO2
+ 3H2
-cu
-- C6
H5
– NH2
+ 2H2
O
Старый способ восстановления нитробензола, который потерял промышленное значение, заключается в использовании в качестве восстановителя железа в присутствии кислоты.
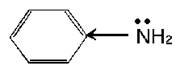 По химическим свойствам анилин во многом аналогичен предельным аминам, однако по сравнению с ними является более слабым основанием, что обусловлено влиянием бензольного кольца. Свободная электронная пора атома азота, с наличием которой связаны основные свойства, частично втягивается в П – электронную систему бензольного кольца: По химическим свойствам анилин во многом аналогичен предельным аминам, однако по сравнению с ними является более слабым основанием, что обусловлено влиянием бензольного кольца. Свободная электронная пора атома азота, с наличием которой связаны основные свойства, частично втягивается в П – электронную систему бензольного кольца:
Уменьшение электронной плотности на атоме азота снижает основные свойства анилина. Анилин образует соли лишь с сильными кислотами. Например, с хлороводородной кислотой он образует хлорид фениламмония:
Реклама

C6
H5
NH2
+ HCl --- [C6
H5
NH3
]Cl
Азотная кислота образует с анилином диазосоединения:
C6
H5
– NH2
+ NaNO2
+2HCl --- [C6
H5
– N+
==N]Cl-
+ NaCl + 2H2
O
Диазосоединения, особенно ароматические. Имеют большое значение в синтезе органических красителей.
Некоторые особые свойства анилина обусловлены наличием в его молекуле ароматического ядра. Так, анилин легко взаимодействует в растворах с хлором и бромом, при этом происходит замещение атомов водорода в бензольном ядре, находящихся в орто
- и пара
-положенияхк аминогруппе:
Анилин сульфируется при нагревании с серной кислотой, при этом образуется сульфаниловая кислота:
Сульфаниловая кислота – важнейший промежуточный продукт при синтезе красителей и лекарственных препаратов.
Гидрированием анилина в присутствии катализаторов можно получить циклогексиламин:
C6
H5
– NH2
+ 3H2
--- C6
H11
– NH2
Анилин используется в химической промышленности для синтеза многих органических соединений, в том числе красителей и лекарств.
|