Kinemaatika pхhimхisted
Nagu
цeldud, fььsika on teadus mis kдsitleb kehade
liikumist. Selleks aga tuleb defineerida liikumist kirjeldavad
suurused ehk parameetrid, mis on: asukoht (koordinaadid), kiirus,
kiirendus.
Asukoht
(koodinaadid).
Keha
asendi ja selle muutuste (liikumise) kvantitatiivseks kirjeldamiseks
kasutatakse ruumikoordinaate. Koordinaadid on arvud, mis mддravad
keha kauguse mingitest kindlaksmддratud kohtaest,
koordinaat-telgedest. Kolmemххtmelises ruumis on asendi
mдaramiseks vajalik kolm arvu (koordinaati), kahemххtmelises
(tasapinnal) kaks ja ьhemххtmelises (joonel)
uksainus arv. Analoogiat edasi arendades saab ette kujutada ka enama
kui kolemххtmelisi ruume, nдiteks vхttes
neljanda mххtmena kasutusele aja, aga kui tarvis, veel
teisi muutuvaid parameetreid. Sejuures on tдhtis, et
juurdetoodavad muutujad ei oleks seoste kaudu tuletatavad
olemasolevatest, vaid oleksid tдiesti sхltumatud,
ortogonaalsed (piltlikult oleksid kхik teljed ьksteisega
risti, kuigi neid vхib olle palju rohkem kui kolm).
Kхige
sagedamini kasutatav koordinaat-teljestik on sirgete ristiolevate
telgedega nn. ristkoordid e. Cartesiuse koordinaadid. Selles
teljestikus mддratakse keha asukoht kolme kauguse kaudu:
esiteks liikudes piki x-telge, siis ristisuunas piki y-telge ja
lхpuks ristisuunas piki z-telge. Kaugused x, y ja z
kokkuleppelisest nullpunktist ongi keha riskoordinaadid.
Riskoordinaadistikku kasutatakse nдiteks USA-s linnade
planeerimisel, kus ‘streedid’ ja ‘avenue’d on
ьksteisega risti ja nummerdatud kasvavas jдrjekorras alates
linna keskpunktist. Positiivsete ja negatiivsete vддrtuste
asemel kasutatakse ‘North’, ‘South’, East’
ja ‘West’ lisandeid.
Cartesiuse
koordinaadid ei ole ainuke viis keha asukoha mддramiseks,
vaid seda saab teha ka mхne testsuguse kolme arvu
kombinatsiooni abil, peaasi, et kolm liikumist, mida need arvud
kirjeldavad, oleksid ikka omavahel ristsuundades. Nдiteks
tsentraalsьmmeetriliste (kerakujuliste ja kerakuju moondumisena
tulenenud liikumiste) kirjeldamiseks on mugavamad nn.
polaarkoordinaadid. Polaarkoordinaate on ka kolm, kuid ainult ьks
neist (raadius r) omab pikkuse (kauguse) dimensiooni, kaks
ьlejддnut on nurgad, mis mддravad selle
liikumise suuna, mida mццda minnes mддratud
punkti jхutakse. Esimene on nurk (teeta),
mis mддrab erinevuse vertikaalsihist ja teine on nurk ,
mis mдarab erinevuse kokkuleppelisest horisontaalsihist.
Polaarkoordinaate kasutatakse geograafias, kus ‘pхhjalaius’
on sisuliselt 90°- ja
idapikkus on Kuna
mддratavad punktid asuvad kхik Maa pinnal, siis
raadius oleks kхigi jaoks umbes 6000 km ja see jдetakse
kirjutamata. Maapinna kohal хhus vхi maa sees olevate
punktide koordinaatidele tuleks aga raadiuse vддrtus juurde
lisada. Polaarkoordinaate allpool nдiteks elektroni orbitaalide
kvantmehaaniliseks kirjeldamiseks vesiniku aatomis.
Liikumine, kiirus
Liikumine
on keha asukoha (koordinaatide) muutumine ajas. Lihtsaim on ьhtlane
sirgjooneline liikumine: konstantsed on kiiruse absoluutvддrtus
ja suund.
Kiirus
(v) on fььsikaline suurus, mida mххdetakse
ajaьhikus lдbitud teepikkusega. Teepikkus s
on kahe asukoha vahekaugus. Kolmemххtmelises ruumis
avaldub teepikkus alg ja lхpp-punkti koordinaatide kaudu
jдrgmiselt
 (1.1) (1.1)
Pikkuse
(teepikkuse) ьhikuks on meeter, m. Meeter on ligilдhedaselt
1/40000000 Maa ьmbermххtu, kuid tдpne ьhik
on kokkuleppeline ja oli pikemat aega defineeritud kui kahe peene
kriipsu vahe plaatina-iriidiumi sulamist siinil, mida hoiti Pariisi
lдhedal, nььd aga on meeter seotud teatud aine
aatomite poolt kiiratava valguse lainepikkusega. Meeter on ьks
kolmest pхhiьhikust ja teda ei saa tuletada teiste
ьhikute kaudu.
Kiirus
 ,
kust ,
kust
 ja
ja
 (1.2) (1.2)
Viimased
valemid seovad omavahel kiiruse, teepikkuse ja aja. Aja ьhikuks
on sekund, s. Sekund on ligilдhedaselt 1/(365.25x24x60x60)
keskmise astronoomilise ццpдeva pikkusest, kuid tema
tдpne vддrtus on praegu seotud teatud aine poolt
kiiratava valguse vхnkeperioodiga. Sekund on ьks kolmest
pхhiьhikust ja teda ei saa tuletada teiste ьhikute
kaudu. Nдiteks kiiruse ьhik on m/s ehk m s-1 ja
see on tuletatud pхhiьhikutest. Suurem osa tuletatud
ьhikuid on seotud pхhiьhikutega andes viimastele
vддrtuse 1.
Nii
teepikkus kui ka kiirus on vektorid, millel on x, y, ja z- suunalised
komponendid. Kahemххtmelisel (tasapinnalisel juhul)
vektori s kaks komponenti on sx=scos;
sy=ssin
Ebaьhtlase
liikumise kiirendus (a) on fььsikaline
suurus, mida mххdetakse kiiruse muutusega ajaьhikus.
Sirgjoonelise liikumise kiirendus on kiiruse muutumise kiirus, seega
teine tuletis teepikkuse muutumisest:
 (1.3) (1.3)
Ka
kiirendus on vektor, s.t., valem (1.3) kehtib sx,
sy ja sz suhtes eraldi.
Kiirenduse ьhik on m s-1 s-1 = m s-2
(loe: meeter sekundis sekundis).
Kiirendusega
liikumise kiirus
 (1.4) (1.4)
kui
alghetkel kiirus ei olnud mitte null vaid v0.
Kiirendusega
liikumisel lдbitud teepikkus, kui aega hakkame lugema nullist
(integraali alumine rada on null ja arvutada tuleb ainult ьlemine
rada):
 (1.5) (1.5)
ja
teepikkuse s lдbimiseks kuluv aeg
 (1.4) (1.4)
Juhul, kui
algkiirus on null, siis
 ,
(1.5) ,
(1.5)
kust
leiame aja, mis kulub teepikkuse s lдbimiseks:
 (1.6) (1.6)
ja kiiruse
v, mis saavutatakse teepikkuse s lдbimisel
 (1.7) (1.7)
Maa
raskuskiirendus on g=9.81 m s-2 ja see
mддrab vabalt langevate kehade liikumise kiirenduse.
Ьlesanded:
Kuidas mддrata torni kхrgust ampermeetri ja stopperi
abil?
Kui suure
algkiirusega peab pumpama vett, et purskkaevu juga kerkiks 30 m
kхrgusele?
Kui
kхrgele ja kui kaugele ulatub sama juga kui see suunata 45
kraadi all kaldu?
Kuidas
peab piloot juhtima lennukit, et kabiinis tekiks kaaluta olek?
Vдhemalt
kui suure algkiirusega peab toimuma kaugushьppaja дratхuge
ja missuguse nurga all tuleb see suunata, et pьstitada uus
maailmarekord (oletame, et praegune maailmarekord on 9 m)?
Ringikujulisel
(elliptilisel) trajektooril liikuvate kehade orbiidi leidmiseks
tutvume kхverjoonelise liikumise kiirendusega, millest
lihtsaim on ringjooneline liikumine.
Kхverjoonelise
(ringjoonelise) liikumise tangentsiaal- (puutujasuunaline) kiirus
 (1.8) (1.8)
kus r
on raadius, on
tiirlemisperiood ja on
tiirlemissagedus. Ristikiirendus
 (1.9) (1.9)
kus on
nurk-kiirus. Nurkkiirust mххdetakse pццrdenurga
suurenemise kiiruse kaudu, ьhik on radiaan sekundis. Tдisring
on 2 radiaani, seega ьks
tiir sekundis tдhendab nurkkiirust 2
radiaani sekundis.
Dьnaamika
pхhimхisted ja seadused: jхud, impulss, tцц,
energia
Newtoni
esimene seadus (ka Galilei seadus, inertsiseadus): Iga keha liigub
ьhtlaselt ja sirgjooneliselt seni kuni teiste kehade mхju
(jхud) ei pхhjusta selle seisundi
(kiiruse) muutumist.
Ьhtlane
ja sirgjooneline liikumine on vхimalik ainult avakosmoses vдga
kaugel taevakehadest. Maa pinnal on kхik kehad
gravitatsioonivдlja mхjusfддris ja neile mхjub
Maa kьlgetхmbejхud. Demonstratsioonkatseks on
mхjudeta liikumisele ligilahedane teraskuuli veeremine
horisontaalsel peegelpinnal, kus raskusjхud on liikumisega
risti ja hххrdumisjхud on minimaalne. Ka
piljardikuulid liiguvad kьllatki ьhtlaselt ja
sirgjooneliselt kuni pхrkumiseni.
Newtoni
teine seadus: Liikumise muutumise kiirus (kiirendus)
on vхrdeline rakendatud jхuga ja toimub jхu
suunas.
 ehk
ehk
 (2.1) (2.1)
kus f
on jхud, m on keha mass ja a on
kiirendus. Vхrdetegur, mis seob kiirenduse jхuga
on pццrdvхrdeline keha massiga, s.t. ьks ja
seesama jхud pхhjustab seda suurema kiirenduse mida
vдiksem on keha mass. Jхud f ja kiirendus a on
vektorid (suunaga suurused), m on skaalar (suunata suurus).
Massi ьhik on kilogramm (kg). Ьks
kilogramm on ligilдhedaselt ьhe dm3 puhta vee
mass, kuid tдpne massi etaloon on plaatina-iriidiumi sulamist
metallkeha, mis on hoiul Pariisi lдhedal. Kilogramm on seega ьks
kolmest pхhiьhikust, mille suurus on kokkuleppeline ja
mida ei saa tuletada teiste ьhikute kaudu. Tuletatud ьhiku
nдiteks on jхu ьhik: ьks njuuton (N) on
jхud, mis annab massile ьks kilogramm kiirenduse ьks
m s-2
Mass: kaal ja inerts
Massil on
kaks omadust: inerts ja gravitatsioon. Huvitaval kombel on need kaks
omadust alati vхrdelised ja massi suurust saab mддrata
nii ьhe kui teise kaudu. Kaalumine on massi mххtmise
viis gravitatsioonijхu kaudu. Mitu N kaalub keha massiga 1 kg?
Kaal on raskusjхud, millega Maa tхmbab keha. Raskusjхud
annab massile 1 kg kiirenduse 9.8 m s-2, sel ajal kui 1 N
annab kiirenduse vaid 1 m s-2. Seega, mass 1 kg kaalub 9.8
N. Sama mass 1 kg kaaluks Kuu peal umbes kuus korda vдhem,
seega umbes 1.6 N. Keha kaal sхltub ka asukohast Maal
(ekvaatoril on Maa pццrlemisest tulenev tsentrifugaaljхud
suurem ja see vдhendab kaalu). Kaalu vдhendab ka хhu
ьleslьke. Seega, ьks kilogramm udusulgi kaalub vдhem
kui 1 kg rauda, kui ei arvestata хhu ьleslьkke
parandit. See parand on seda suurem, mida lдhdasemad on
kaalutava keha ja хhu tihedused, kuni selleni, et vesinikuga
tдidetud хhupall omab negatiivset kaalu. Хige
kaalu mддramine oleks хhu ьleslьket
arvestades, kuid praktikas, kui on tegu tahkete ainete vхi
vedelikega, on selle tдhtsus suhteliselt vдike. Kui kьsite
poest ьhe kg leiba, siis soovite te tхepoolest leiva
massi, mitte selle kaalu. Seega kьsimine kilogrammides ja mitte
njuutonites on fььsikaliselt хige. Kui mььja
kaalub leiva vedrukaaluga, siis saab ta tulemuse njuutonites ja see
sхltub laiuskraadist. Kui aga kasutatakse kangkaalu, siis
vхrreldakse omavahel kaalutavat keha kaalupommide massiga ja
tulemus ei sхltu laiuskraadist.
Newtoni kolmas seadus: Mхju (jхud) on
vхrdne vastumхjuga (vastujхuga)
 .
Kui esimene keha mхjutab teist jхuga f siis
teine keha mхjutab esimest jхuga –f.
Klassikaline nдide: paadist kaldale hьpates tхukate
paati kaldast eemale. Kumb aga liigub kiiremini, teie vхi
paat? .
Kui esimene keha mхjutab teist jхuga f siis
teine keha mхjutab esimest jхuga –f.
Klassikaline nдide: paadist kaldale hьpates tхukate
paati kaldast eemale. Kumb aga liigub kiiremini, teie vхi
paat?
Kahe keha
vastasmхjul saavad mхlemad kiirenduse pццrdvхrdeliselt
nende kehade massiga:
 ehk
ehk
 (2.2) (2.2)
Newtoni
kolmandal seadusel pхhineb rakettmootori tцц. Igal
ajamomendil paiskab reaktiivmootor suhteliselt vдikest kьtuse
massi suure kiirendusega tahapoole, selle tulemusena liigub rakett
kui suurem mass vдiksema kiirendusega vastassuunas. Protsess on
pidev seni kuni mootor tццtab ja kuna kiirendus mхjub
mхlemale, nii raketile kui kьtusele vхrdse aja
jooksul, siis lхppkokkuvхttes suhtuvad ka raketi ja
ruumi vдljapaisatud kьtusemassi kiirused nii nagu valem
(2.2) nдitab kiirenduste kohta. Kui nдiteks raketi ja
kьtuse massid on vхrdsed, siis on lхpuks vхrdsed
ja vastassuunalised ka nende kiirused. Erinevus raketi ja
ruumipaisatud kьtuse vahel on aga selles, et rakett kui tahke
keha omab ьhte kindlat kiirust, kьtuse pхlemisprodukt
aga on gaasiline ja valem (2.2) kehtib selle ruumilise massikeskme
kohta.
Ka lindude lendamine (ja isegi loomade vхi inimese ujumine) on
sisuliselt reaktiivliikumine, sest teist vхimalust kui Newtoni
kolmanda seaduse abil хhust raskemal kehal хhus (veest
raskemal kehal vee peal) pьsimiseks ei ole. Lind lьkkab
tiibadega хhku allapoole, mхjutades хhumassi
jхuga ja andes хhule allapoole liikumise kiirenduse,
samal ajal vastujхud tхukab lindu ьlespoole. Linnu
ьlespoole liikumise kiirendus on niisama suur kui
raskuskiirendus, kuid sellega vastassuunaline, nii et mхlemad
kompenseeruvad ja lind lendab konstantsel kхrgusel.
Matemaatiliselt,
 ,
kus m1 on linnu ja m2 tiibade all
liikuma pandud хhu mass ning a on viimasele antud
kiirendus. ,
kus m1 on linnu ja m2 tiibade all
liikuma pandud хhu mass ning a on viimasele antud
kiirendus.
Ьlesanne: Selgitada, mis ьhist on lennuki
reaktiivmootoril, propellermootoril, lendamisel tiivalehvitamisega ja
planeerimisel.
Ьks
tдhtsamaid kiirendusest tulenevaid jхude on kesktхmbejхud
ja kesktхukejхud ringlikumisel, mis on vхrdsed
javastassuunalised. Keha liigub ringikujulist trajektoori mццda
tдnu jхule, mis tхmbab teda keskpunkti suunas.
Kesktхmbejхud vхib olla gravitatsioon (Maa
tiirlemine ьkber Pдikese), elektromagnetiline (elektroni
tiirlemine ьmber tuuma) vхi mehaaniline (nццr
mis ьhendab lingukivi kдega, tsentrifugaalpumba korpus, mis
suunab vedeliku ringtrajektoorile, aga ega nedes kehadeski esine
lхppkokkuvхttes muud kui elektromagnetilised jхud).
Kesktхukejхud tekib keha inersti tхttu, tema
pььdest likuda sirgjooneliselt puutujat mццda.
Kesktхukejхud ringliikumisel avaldub jдrgmiselt
 . .
kus
on nurkkiirus. Nurkkiirus seostub lineaarkiirusega jдrgmiselt:
 ehk
ehk
 ,
seega ,
seega

Kui suur
on 100 kg-se mehe kaaluvahe poolusel ja ekvaatoril? Maakera raadius
on 6000 km. Nurkkiirus on 2/(24x3600)
= 7.27x10-5 radiaani sekundis. Asendades need vдrtused
valemisse (??) saame f=100x(7.27x10-5)2x6x106
= 100x52.8x10-10x6x106= 3.168 N. Poolusel
kaalub 100 kg 981 N. Suhteline kaalu kahanemine on 3.17/981=0.0032
ehk 0.32%. Meie laiuskraadil ja ekvaatoril on see suhe veel umbes
poole vдiksem.
Tsentrifugaaljхu praktilisi rakendusi: tsentrifugaalpumbad ja
ventilaatorid. Kuidas muutub ventilaatori ja tsentrifugaalpumba
arendatav rхhk mootori pццretest?
Liikumise
hulk ehk impulss.
Kui pььate
vдga massiivset keha, nдiteks autot, liikuma lьkata,
siis tuleb jхudu rakendada kьllalt kaua, enne kui
saavutate vajaliku kiiruse, nдiteks kьllaldase mootori
kдivitamiseks ilma starteri abita. See tдhendab, et keha
poolt saavutatud kiirus sхltub jхu mхjumise
ajast. Kasutame kiiruse arvutamiseks kahte seost:
 ,
kust ,
kust

Suurust mv
nimetatakse liikumise hulgaks ehk impulsiks. Impulsi muutus on
vхrdeline jхuga ja selle mхjumise ajaga ning
toimub jхu suunas.
Impulsi
jддvus liikuvate kehade vastasmхjudes on energia
jддvuse kхrval ьks looduse pхhiseadusi.
Nдiteks kahe piljardikuuli pхrkel vхi kahe
gaasimolekuli pхrkel

Impulsi
muutus kehade vastasmхjul on vхrdne ja vastassuunaline,
sьsteemi summaarne impulss on konstantne. Impulsi mхistet
kasutame allpool gaaside rхhu arvutamisel.
Tцц
ja energia.
Tцц
on fььsikaline suurus, mida mххdetakse jхu
ja jхu suunas lдbitud teepikkuse korrutisega

Tцц
ьhik on Dzhaul (Joule), [J] = [N]x[m]. Dzhaul on tцц,
mida teeb jхud ьks njuuton ьhe meetri pikkusel teel.
Tццd tehakse siis, kui liigutatakse mingit keha avaldades
sellele jхudu. Nдiteks, tхstes 50 kg viljakotti
maast 1m kхrgusele vankrile tehakse tцц mis vхrdub
koti kaal (njuutonites !) korda vankri kхrgus, 50x9.8x1=490 J.
Kui vesi langeb 20 m kхrguses joas kдivitades turbiini,
siis iga kg vett teeb tццd 20x9.8=295 J.
Kui jхud
on teepikkuse (koordinaadi) funktsioon (on muutuv sхltuvalt
asukohast), siis tuleb rakendada integreerimist. Integreerida vхib
liikumise ja jхu kui vektori komponente kolme koordinaadi
suunas eraldi

Tььpiline
muutuva jхu poolt tehtud tцц arvutus on seotud keha
asukoha muutusega teise keha gravitatsiooni- vхi
elektrivдljas. Nдiteks, Newtoni gravitatsiooniseadus
vдidab, et kahe keha vahel mхjub gravitatsioonijхud,
mis on vхrdeline nende kehade masside korrutisega ja
pццrdvхrdeline nedevahelise kauguse ruuduga:

Elementaartцц,
mida tehakse selleks, et suurendada kehade vahelist kaugust dx vхrra
oleks

ja
liikumisel ьle mingi pikema vahemiku tehtud tцц oleks
 
Kui
teepikkus on mддratud, tuleb integraal vхtta radades
liikumise algpunktist lхpp-punkti. Valem ??? nдitab, et
kui kahe keha vaheline jхud kahaneb kauguse suurenedes
pццrdvхrdeliselt kauguse ruuduga, siis tehtud tцц
kasvab kauguse kasvades pццrdvхrdeliselt kaugusega.
Tхmbuvate kehade vahelise kauguse suurendamiseks tuleb teha
vдlist tццd, kui kehad lдhenevad, siis nad teevad
ise tццd. Tхukuvate kehade, nдiteks
samanimeliste laengute vahel, on olukord vastupidine: tхukuvate
kehade lдhendamiseks tuleb teha vдlist tццd, kui
need kehad eemalduvad teineteisest, siis nad teevad ise tццd.
Viimase juhu nдiteks oleks aatomite lдhenemine, kus vдlise
elektronkihi elektronid tхukuvad ьksteise elektrivдljas.
Tahkete kehade kokkupuude ja hххrdumine ongi vдliste
elektronkihtide tхukumine, tegelikku fььsilist
kokkupuudet ei esine kunagi.
Vхimsus
on fььsikaline suurus, mida mххdetakse
ajaьhikus tehtud tцц hulgaga.

Vхimsust
kasutatakse nдit. mootorite ja kьttekehade hindamisel,
teadmaks kui palju tццd need suudavad ajaьhikus teha.
Vхimsuse ьhik on Watt [W] = [J] [s]-1 ьks
Dzhaul sekundis. Elektripirnide tarbitav vхimsus on nдiteks
40 – 100 W, elektripliit 600 – 2000W, automootor 50 –
100 kW. Elektrienergia hulga mххtmiseks kasutatakse
ьhikut kilovatt-tund (kWh), see on tцц, mida teeb
vхimsus 1 kW ьhe tunni = 3600 s jooksul. Ьks kWh =
1000 J s-1 x 3600 s = 3600000 J = 3600 kJ.
Energia
on keha vхime teha tццd.
Energiat
on kahte liiki, liikuva keha kineetiline energia ja jхuvдljas
asuva keha potentsiaalne energia. Energia jддvuse
seadus on looduse pхhiseadus: Energia ei teki ega kao, vaid
muundub ьhest vormist teise. Seega, looduses toimub
kineetilise energia muundumine potentsiaalseks ja potentsiaalse
energia muundumine kineetiliseks.
Liikuva
keha kineetiline energia. Arvutame, kui palju tццd
tuleb teha, et keha (massiga m) kiirust suurendada
paigalseisust kuni vддrtuseni v. See tцц
moodustabki likuva keha kineetilise energia.
Tцц=energia: 
Kui suur
aga on teepikkus s mille lхpuks saavutatakse kiirus v?
Kasutame seost (1.7)
 ,
kust ,
kust

Teades, et
 ,
asendame selle ja saame ,
asendame selle ja saame

Nььd
on selge, et

Kineetiline
energia on vхime teha tццd. Liikuva keha peatumisel
vхib ta enese ees lьkata teist keha mхjudes
sellele jхuga ja tehes tццd. Kui auto sхidab
vastu puud, siis auto kineetiline energia liigutab plekke paigast ja
murrab sхitjate luid. Tдhelepanu, et auto kiiruse
suurenemisel kaks korda suureneb kineetiline energia neli korda!
Niisugustel deformeerivatel pхrgetel muutub kineetiline
energia peamiselt molekulide soojusenergiaks. Kineetiline energia
muutub potentsiaalseks energiaks kui liikuvat keha peatab jхuvдli,
nдiteks kui viskame kivi ьlespoole. Gravitatsioonivдlja
jхud peatab lхpuks kivi liikumise, kuid kivi
kineetiline energia on muundunud tema potentsiaalseks energiaks. Sama
juhtub elektronidega, kui nad saavad lisaks kineetilist energiat
(nдiteks aatomite pхrgetel vхi valguse
neeldumisel): nad liiguvad tuumast kaugemale.
Jхuvдljas
asetseva keha potentsiaalne energia.Vaatleme esialgu
gravitatsioonivдlja maapinna lдhedal. Arvutame, kui palju
tццd tuleb teha keha (massiga m) tхstmiseks
kхrgusele h.

Gravitatsioonivдli
ja elektrivдli on nn. potentsiaalsed vдljad, kus keha
potentsiaalse energia muutus sхltub ainult alg-ja
lхppasukohast, mitte aga vahepealse liikumise trajektoorist.
Tehtud tцц on sama, ьkskхik millist rada mццda
liigutakse samade alg- ja lхpp-punktide vahel. Vabal inertsel
liikumisel jхuvдljas (ilma vдlismхjudeta)
potentsiaalne ja kineetiline energia pidevalt muunduvad teineteiseks,
nii et summaarne energia on kogu aeg sama:

Nдiteks
kхrguselt h kukkuva keha kiiruse leiame teades et
kukkumise lхpuks
 ,
kust ,
kust

Ьlesvisatava
kivi maksimaalkхrguse vхime samuti leida tema
algenergia (algkiiruse) kaudu.
Kineetilise
ja potentsiaalse energia muundumine toimub ka lihastetццs.
Nдiteks vхib teoreetiliselt arvutada, kui kхrgele
saab hьpata kirp, kelle kehas keskmine ATP kontsentratsioon on
0.1 mM, eeldades, et ATP keemiline energia kхik muutub hьppel
kineetiliseks energiaks.
Eelmised
ьlesanded on lihtsad, sest ьlesvisatud keha kхrgus
muutub suhteliselt Maa raadiusega sedavхrd vдhe, et
rakusjхudu saab lugeda konstantseks. Kui aga kaugus muutub
suhteliselt palju, nдiteks nagu kosmoselendudel, vхi nagu
elektroni kaugus muutub tuuma suhtes, siis ei saa ei gravitatsiooni-
ega elektrivдlja jхudu enam konstantseks lugeda vaid tцц
(energia) arvutamisel tuleb arvestada, et jхud muutub koos
kaugusega.
Jхudude
tasakaal, kiirus ja energia ringjoonelisel tiirlemisel.
Looduses
asuvad kхik kehad ьksteise jхuvдljades,
suuremad kehad gravitatsioonivдljas, vдikeste kehade puhul
on oluline elektrivдli. Ometi ei kuku tхmbuvad kehad
ьksteise peale, sest sellisel juhul oleks kogu Universum ammu
kokku kukkunud, elektronid oleksid kukkunud aatomituumadesse ja
planeedid nende Pдikestesse. Loodust stabiliseerib see, et kehad
tiirlevad ьksteise ьmber, nii et kesktхmbejхud
ja kesktхukejхud on vхrdsed ja radiaalsuunalist
kiirendust (jхudu) ei esine. Kasutades fььsikast
teadaolevaid valemeid gravitatsioonilise (elektrilise) kesktхmbejхu
ja inertsiaalse kesktхukejхu kohta saab nende
tasakaalutingimustest tuletada nдiteks kui suur on tiirleva keha
potentsiaalne, kineetiline ja summaarne energia.
Mхlemad,
nii elektrivдlja kui ka gravitatsioonivдlja tugevus (mхjuv
jхud) kirjelduvad ьhe ja sellesama seadusega:
gravitatsioonivдli:
 ja elektrivдli:
ja elektrivдli:

kus m
on keha mass, e on keha laeng (indeksid nдitavad esimese
ja teise keha oma eraldi), r on nendevaheline kaugus ka konstant k
mддrab seose kasutatava ьhikute sьsteemiga. Kui
masse mххdetakse kilogrammides, siis gravitatsioonijхu
saamiseks Njuutonites omab gravitatsioonikonstant kg
vддrtust ????. Kui laenguid mххdetakse
Coulombides (Kulonites, C) siis elektrostaatilise tхmbejхu
saamiseks Njuutonites elektrivдljakonstant ke
omab vддrtust ????.
Muide,
selles, et need konstandid ei oma vддrtust 1, vдljendub
fььsikalise mххtьhikute sьsteemi
ajalooliselt kujunenud ebajдrjekindlus. Sьsteemselt хige
oleks olnud massiьhikuks vхtta niisugune mass, mis teist
samasugust tхmbab ьhe pikkusьhiku kauguselt
ьhikulise jхuga. Seesama ьhikuline jхud aga
peab andma ьhikulisele massile ka ьhikulise kiirenduse. Et
see aga nii tuleks, peaks nii massi, pikkuse kui ajaьhikut
vastavalt muutma. Praegused pхhiьhikud ei ole ьldse
seotud gravitatsiooniseadusega. Samasugune on lugu
elektrilaenguьhikutega. Formaalselt peaks laenguьhik
Coulomb (Kulon) olema defineeritud kui laeng mis tхmbab teist
samasuurt vastasmдrgilist laengut pikkusьhiku kauguselt
ьhikulise jхuga. Tegelikult on aga Coulomb defineeritud
hoopis magnetvдlja kaudu: Coulomb on laeng, mis liikudes ьhe
sekundi jooksul lдbi 1 m pikkuse traadi mхjutab teist
samasugust traati, milles voolab niisama tugev vool, 1 m kauguselt
jхuga 1 N. See definitsioon baseerub magnetvдljal, mis on
liikuvate laengute ьmber ruumis. Elektrivдlja jхud
avaldub nььd aga ьlaltoodud kaliibrimiskonstandi
kaudu.
Leiame
keha (laengu) potentsiaalse energia tsentraalsьmmeetrilises
gravitatsiooni- (elektri-) vдljas. Kuna jхud on tugevasti
kaugusest sхltuv, siis tuleb kindlasti rakendada
integreerimist. Laengu liikumisel elektrivдljas vдga
lьhikesel teepikkusel tehtud tцц on


kus
liikumise teepikkust tдhistame seekod raadiuse (kugus tsentrist)
muutusena dr. Kui laeng liigub raadiuselt r1
raadiusele r2, peame integreerima vastavates
radades:
 
Valem
nдitab, et tsentraalsьmmeetrilises elektrivдljas
liikudes muutub laengu potentsiaalne energia pццrdvхrdeliselt
kaugusega tsentrist. Analoogiline valem kehtib ka gravitatsioonivдlja
kohta, ainult et seal esinevad kahe laengu asemel kaks massi ja
elektrivдlja konstandi asemel gravitatsioonikonstant. Kui laeng
liigub tsentrist eemale, siis r2>r1
ja negatiivne liige on vдiksem kui positiivne,
seega siis potentsiaalne energia kasvab. Vastupidi, potentsiaalne
energia kahaneb, kui laeng liigub tsentrile lдhemale.
Potentsiaalse energia nullnivoo on aga kokkuleppeline. See vхiks
olla ьks ддrmuslikest seisunditest, kas
 vхi vхi
 (lхpmatus). Siiski, raadius ei saa olla null, sest siis
lдheneb energia lхpmatusele, seega jддb
kokkuleppeliseks nulliks nivoo, kus laengud asetsevad teineteisest
lхpmatu kaugel. Lдhenedes aga nende potentsiaalne energia
kahaneb, seega muutub negatiivseks, ja lдheneb miinus
lхpmatusele kui laengud kohtuvad. Niisugune potentsiaalse
energia nullnivoo definitsioon, mis on hea elektronide ja tuumade
vahelise mхju kirjeldamiseks aatomites, on erinev
igapдevakogemusest gravitatsioonilise energiaga, kus nulliks
loeme tavaliselt energia maapinnal ja energia loeme positiivselt
kasvavaks kui keha maapinnast kaugeneb. Kui valemis ???
(lхpmatus). Siiski, raadius ei saa olla null, sest siis
lдheneb energia lхpmatusele, seega jддb
kokkuleppeliseks nulliks nivoo, kus laengud asetsevad teineteisest
lхpmatu kaugel. Lдhenedes aga nende potentsiaalne energia
kahaneb, seega muutub negatiivseks, ja lдheneb miinus
lхpmatusele kui laengud kohtuvad. Niisugune potentsiaalse
energia nullnivoo definitsioon, mis on hea elektronide ja tuumade
vahelise mхju kirjeldamiseks aatomites, on erinev
igapдevakogemusest gravitatsioonilise energiaga, kus nulliks
loeme tavaliselt energia maapinnal ja energia loeme positiivselt
kasvavaks kui keha maapinnast kaugeneb. Kui valemis ???
 ,
st. elektron lдheneb tuumale lхpmatu kaugelt, siis tema
potentsiaalne energia on alguses null ja kahaneb lхpuks
vддrtusele ,
st. elektron lдheneb tuumale lхpmatu kaugelt, siis tema
potentsiaalne energia on alguses null ja kahaneb lхpuks
vддrtusele
 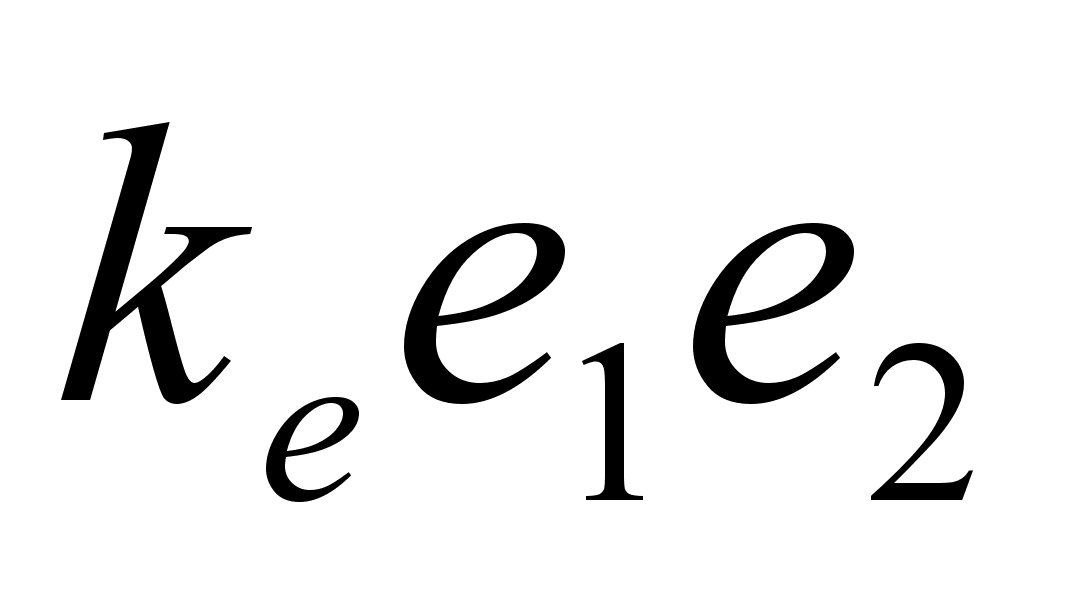
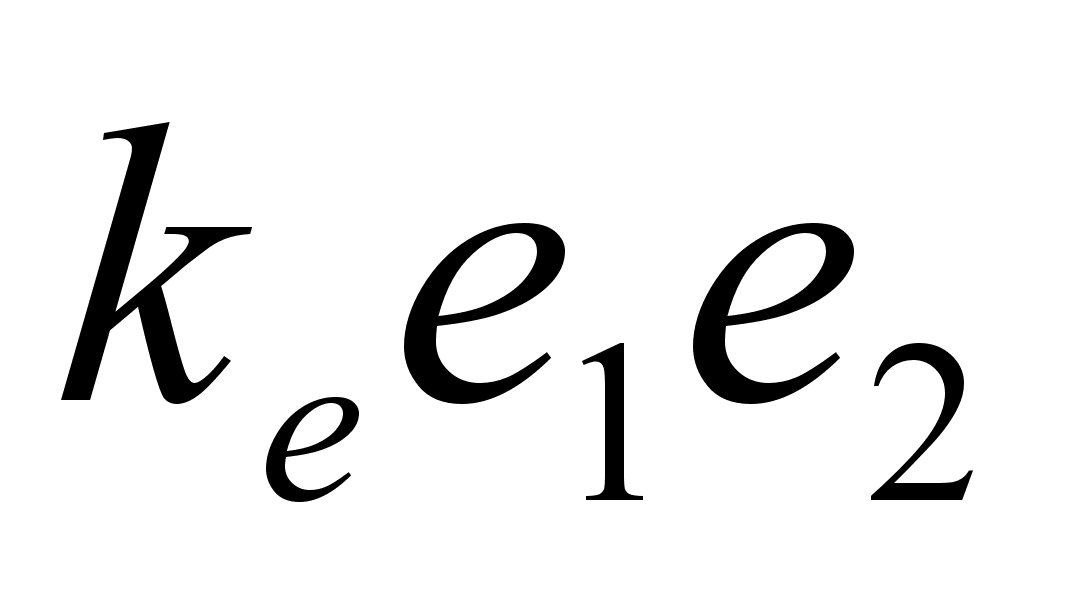
Kuna see
energia kuhugi kaduda ei saa, siis muutub ta elektroni liikumise
kineetiliseks energiaks, st., lдhenedes tuumale elektron liigub
kiirenevalt, nii nagu nдiteks asteroid liigub kiirenevalt
lдhenedes Maa pinnale. Vahe on siiski selles, et elektron ei
lange kunagi tuumale, vaid jддb tiirlema mingil kaugusel
ьmber tuuma. Tiirlemise kaugus (raadius, on mддratud
sellega, millal elektriline tхmbejхud vхrdub
inertsiaalse kesktхukejхuga. Matemaatiliselt avaldub
see tingimus jдrgmiselt:
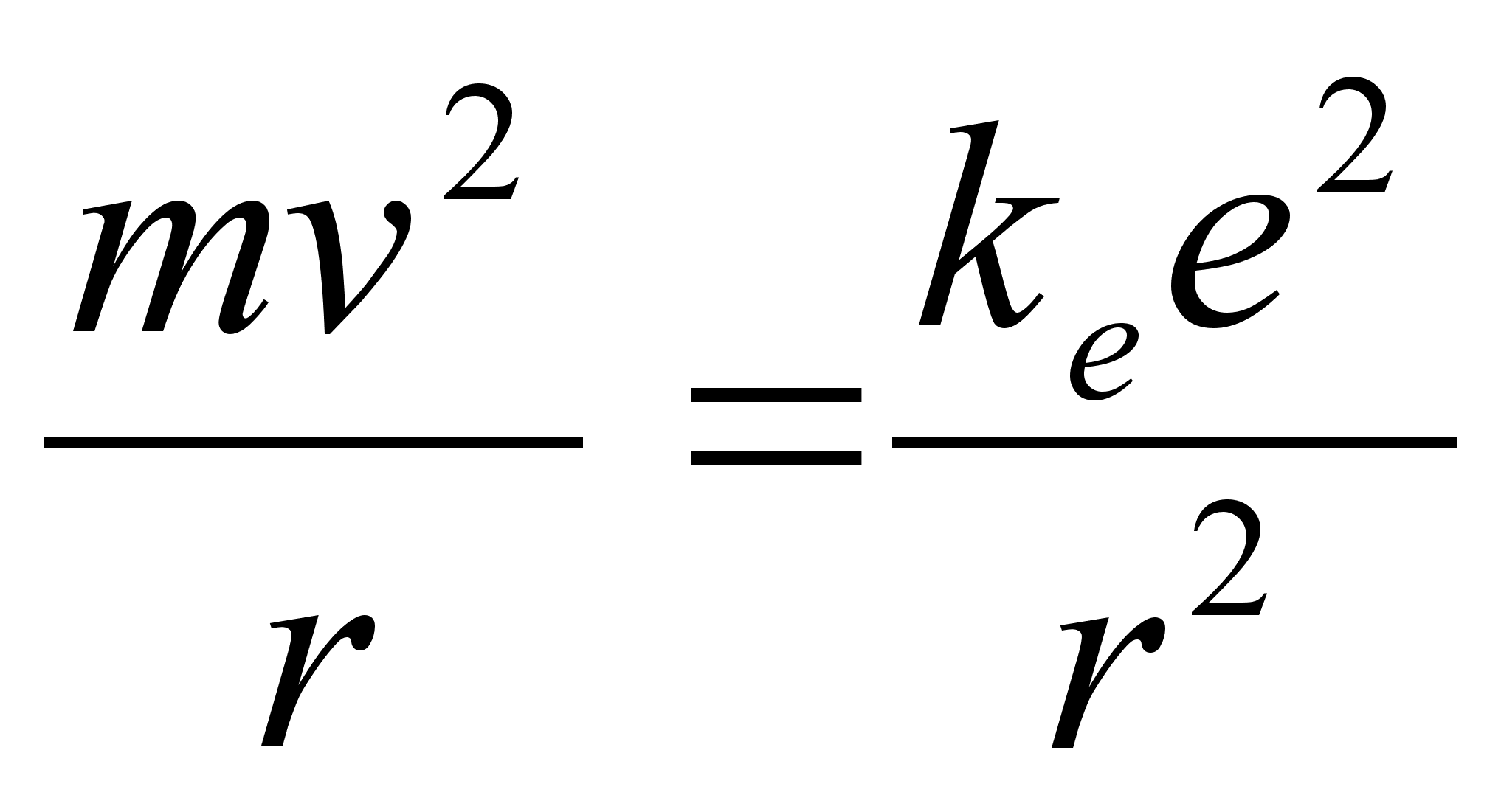
Selle
valemi vasak pool on varasemast tuttav kesktхukejхu
valem keha massiga m ringliikumisel joonkiirusega v
ьmber tsentri kaugusel r. Valemi parem pool on
elektrostaatilise tхmbejхu valem, kuid siin on juba
arvestatud, et aatomis positiivne ja negatiivne laeng on vхrdsed,
mхlemad vддrtusega e.
Eelmisest
valemist saab leida raadiuse, mille saab siduda nii elektroni kiiruse
kui tema kineetilise energiaga:
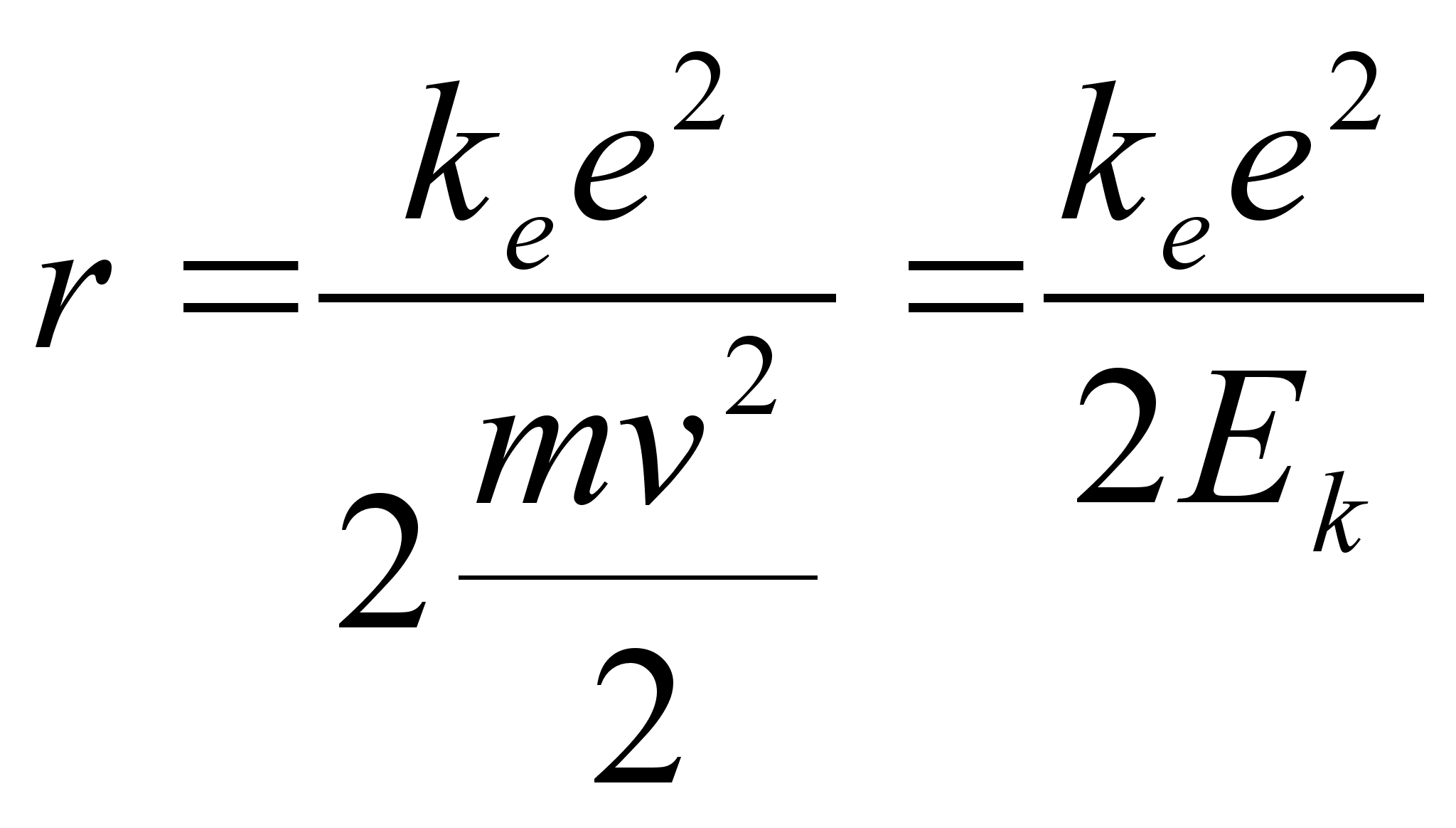
vхi
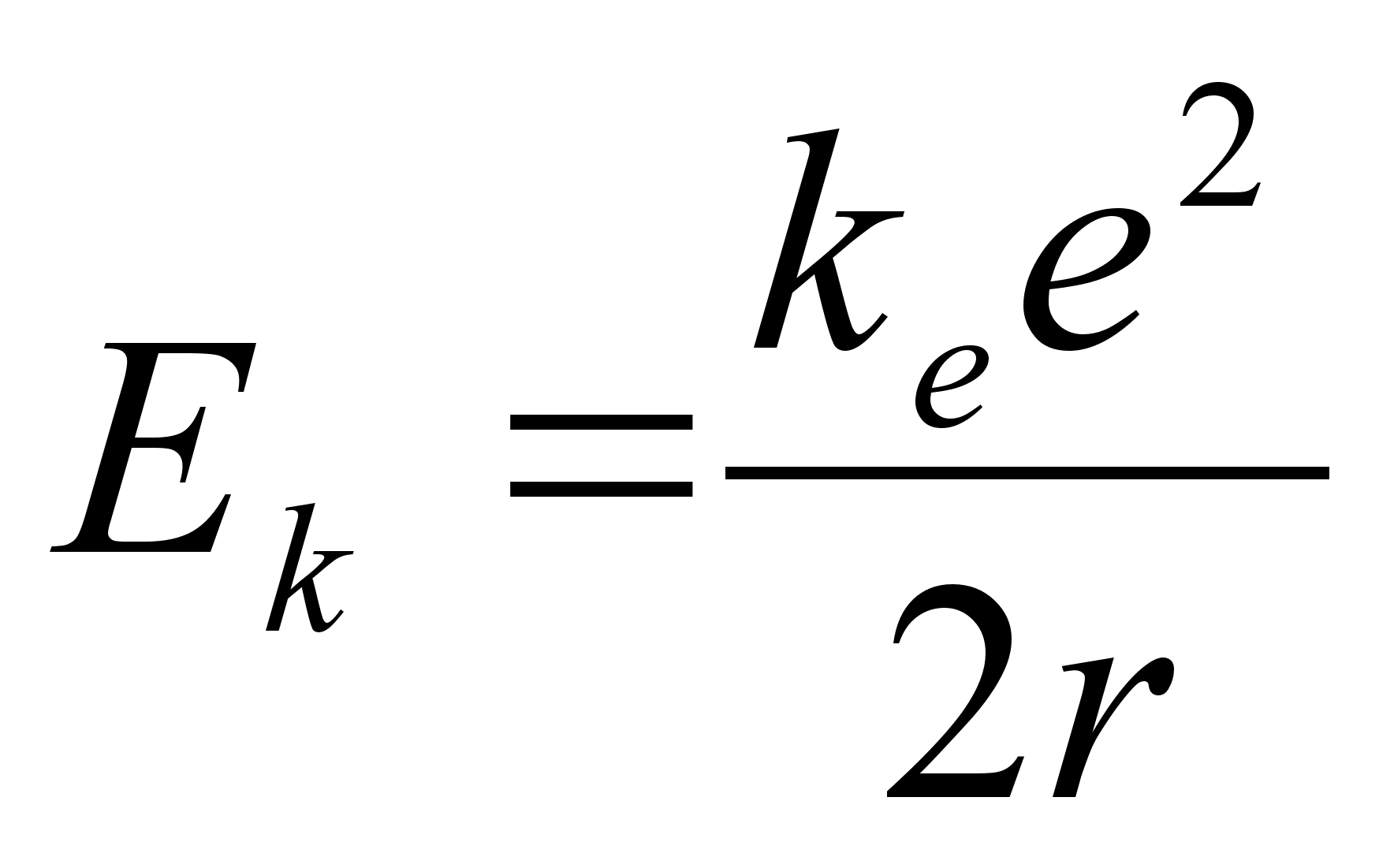
Ьmber tuuma tiirleva elektroni kineetiline energia kasvab kui
elektron lдheneb tuumale (r kahaneb). Tuletame meelde, et
potentsiaalne energia samal ajal kahanes:
 , ,
ja
summaarne energia
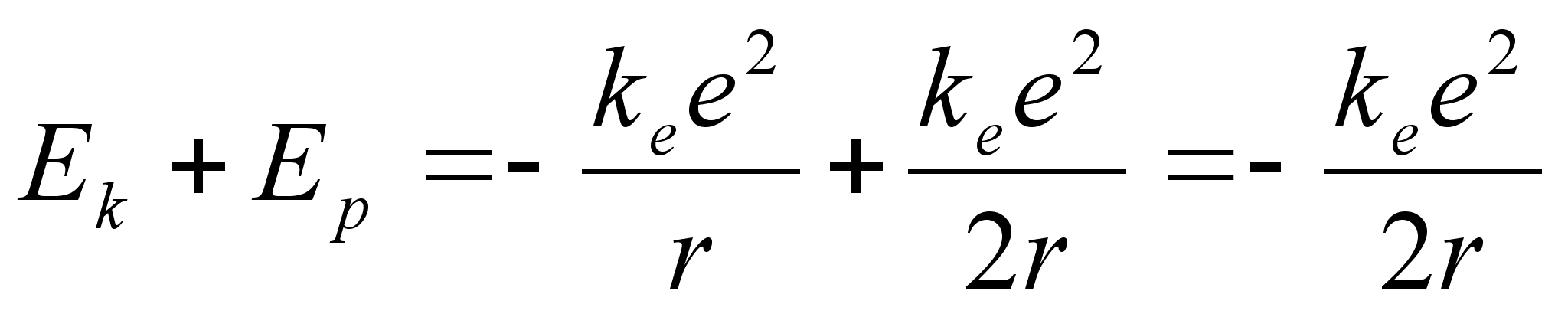
Elektroni
summaarne energia kahaneb kui elektron asub tiirlema orbiidile mis on
tuumale lдhemal. Kuhu see energiavahe siis lдheb,
millisesse vormi muutub (kaduda ju ei saa)?
See energiavahe peab aatomist eralduma ja seda ta ka teeb, kas
valguskvandi kujul, vхi kandub ьle mхnele
naaberaatomile, tхstes selle elektroni vastavalt kхrgemale
energianivoole, vхi eraldub soojusena, s.o. muutub aatomi
translatoorseks (kulgevaks) liikumiseks. Niisugune elektronide ja
tuuma vahelise kauguse muutumine, elektronide tiirlemine erineva
raadiusega orbiitidel, on peamine keemiliste ainete siseenergia,
keemilise energia olemus. Ained, mille molekulides elektronid
tiirlevad tuumadest kaugemal, on energiarikkamad ja vхivad
seda vabastada kui keemilise reaktsiooni tulemusena toimuvad
muutused, mille tulemusena elektronid saavad tuumadele lдhemale
asuda. Bioloogiliste protsesside energeetika on samadel alustel:
fotosьnteesis tхstetakse elektron valguskvandi abil
kхrgemale energianivoole, tuumast kaugemale orbiidile, ja
metabolismi kдigus ta jдrkjдrgult lдheneb
tuumale, vabastades niimoodi kvandi poolt talle antud energia.
Kas aga elektronid saavad tiirelda ьmber tuuma igasugustel
kaugustel? Kui see nii oleks, vхiks ju vabastada vдga
suuri keemilise siseenegia koguseid lubades elektronil asuda tuumale
vдga-vдga lдhedale (lastes raadiuse nulli lдhedale).
Tхepoolest, klassikaline fььsika seda lubaks, kuid
tegelikkuses seda ei juhtu. Siin tulevad sisse kvantmehaanilised
piirangud, mis klassikalise fььsika abil ei seletu.
Jдrgnevas tutvumegi atomaarse kvantteooria pхhialustega.
BOHRI AATOMIMUDEL
Eelmises lхigus tuletasime valemid, mis kirjeldavad ьmber
tuuma tiirleva elektroni kiirust ja energiat. Igale elektroni
kineetilise energia vддrtusele Ek vastaks
kindel raadius r. Klassikalise fььsika seisukohtade
kohaselt tekitab aga tiirlev elektron muutuva elektromagnetilise
vдlja: elektron on perioodiliselt kord tuumast parmal, siis
jдlle vasemal, seega ‘pluss’ ja ‘miinus’
vahelduvad nagu televisiooni saateantenni varrastes, vahe on ainult
mххdus ja tiirlemise sageduses. Muutuva
elektromagnetilise vдlja kaudu peaks elektroni tiirlemisenergia
vдlja kiirguma, elektron peaks tuumale lдhenema ja lхpuks
tuumale kukkuma. Tegelikult seda ei toimu, kхik aatomid
maailmas on stabiilsed ja tavaliselt ei kiirga energiat. Selles on
klassikalise mehhaanika pхhivastuolu tegelikkusega. Seda
vastuolu ei saa eletada, see tuleb lihtsalt teadmiseks vхtta
ja postuleerida, et teatud kindlate energiavддrtuste puhul
on elektronide orbiidid aatomis stabiilsed ja energiat ei kiirgu,
kuigi pхhjus, miks ei kiirgu, ei ole teada. Kui see aga
teadmiseks vхtta, siis saab sellele ьles ehitada uut
sorti mehanika – kvantmehaanika. Esimeseses jдrjekorras
tuleb postuleerida, missugused on need orbiidid, millel elektron saab
stabiilselt tiirelda ilma energiat kiirgamata.
Uurides kuumutatud kehadelt kiirguva valguse spektreid leidis Max
Planck (1900) ka siin vastuolu, mis lahenes, kui eeldati, et valgusel
on kvantiseloom: valgus kiirgub energiaportsjonite e. kvantide kaupa,
millest igaьhe energia
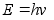 ,
kus on valguslaine
vхnkumise sagedus. ,
kus on valguslaine
vхnkumise sagedus.
Lдhtudes
sellest postuleeris Bohr (1913): elektroni tiirlemisel ьmber
tuuma elektrmagnetilist lainet (=valgust) ei kiirgu, kui elektron
tiirleb orbiitidel millel potentsiaalne on
 . .
Kineetiline
energia oli positiivne ja pool potentsiaalsest energiast:
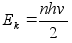 , ,
Nendes
valemites on elektroni
tiirlemise sagedus, n aga mingi tдisarv 1, 2, 3, 4 jne.
Kasutades
seost joonkiiruse ja nurkkiiruse vahel, mille abil sagedus
teisendatakse joonkiiruseks, saame:
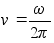 ja
ja
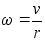
ja vхime
kirjutada
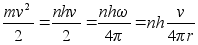
ehk
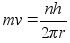
vхi
vхttes mхlemad pooled ruutu saame:
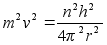 . .
Elektrostaatilise tхmbejхu valemist (???) saame massiga
m lдbi korrutades:
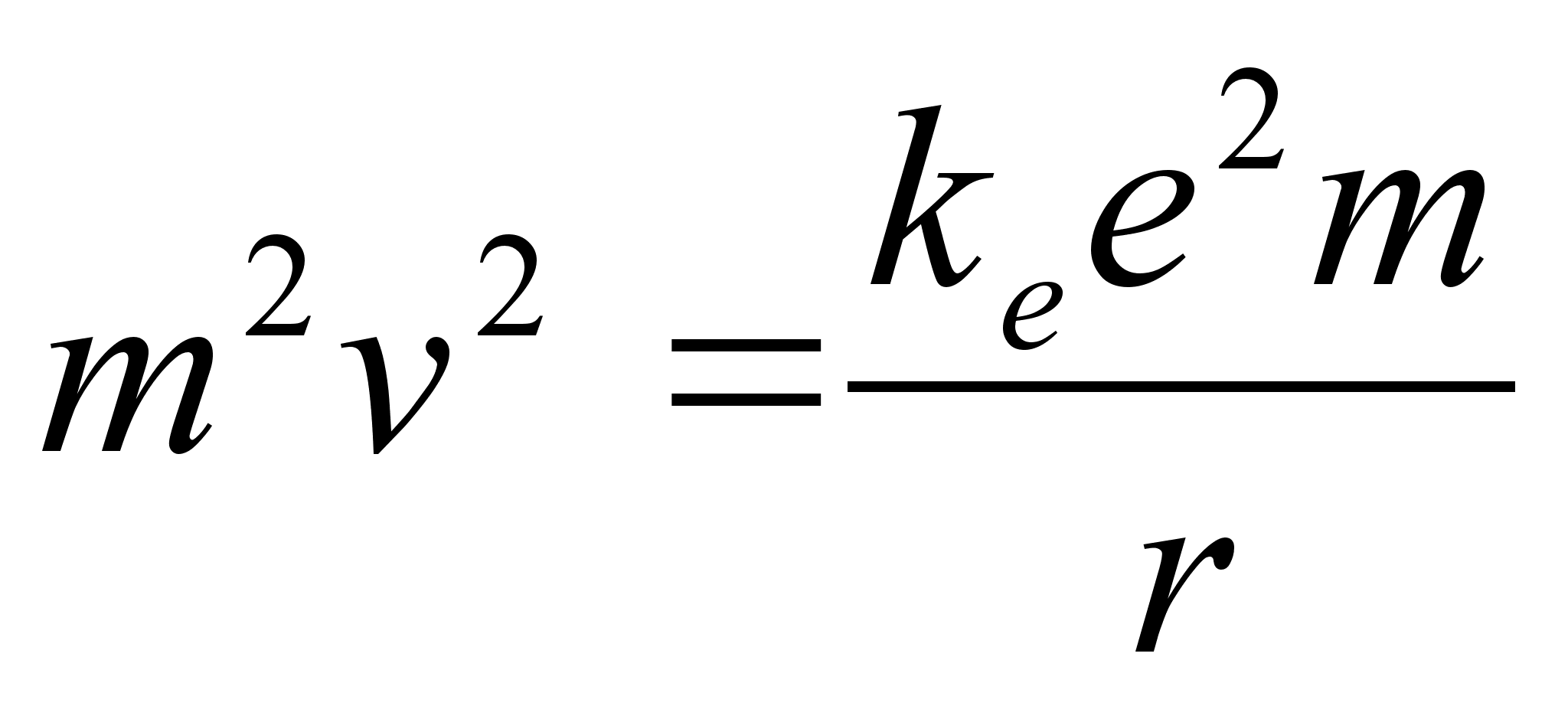
Kahe
viimase valemi vasakud pooled on vхrdsed. Paremate poolte
vхrdsustamisel saame avaldada lubatud raadiuse
 . .
Need nn.
Bohri raadiused ongi vхimalikud raadiused millel elektron saab
asuda stabiilselt ilma energiat kiirgamata.
Avaldame elektroni kineetilise energia tema massi m ja laengu
e kaudu. Selleks asendame r valemisse (???) vхi
(???). Saame
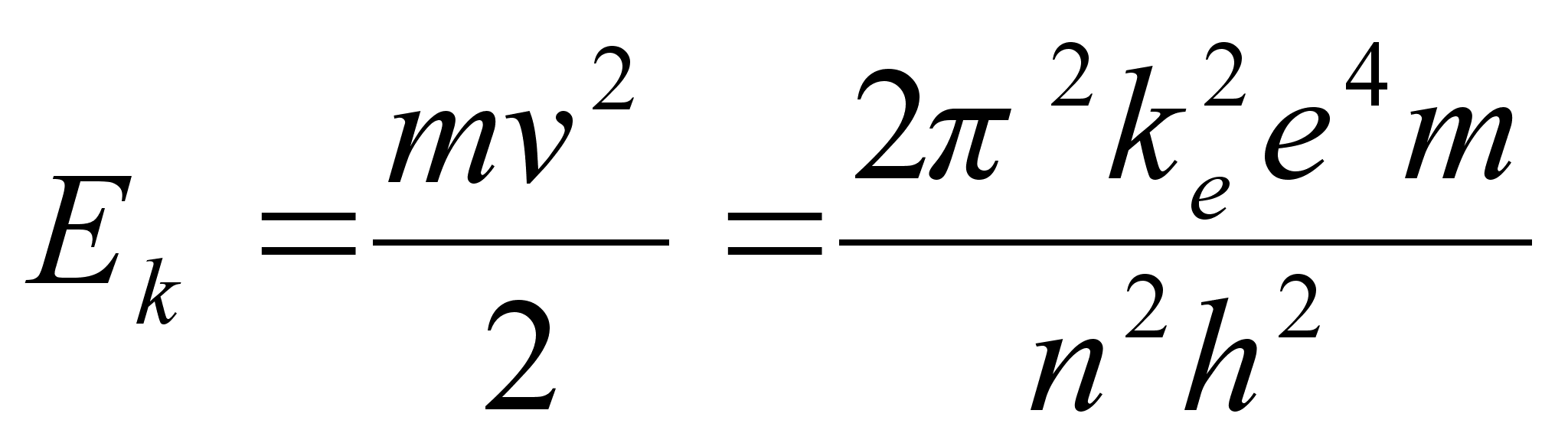
Samale
orbiidile vastav potentsiaalne energia

ja
koguenergia, mis vastab orbiidile, mida iseloomustab tдisarv n
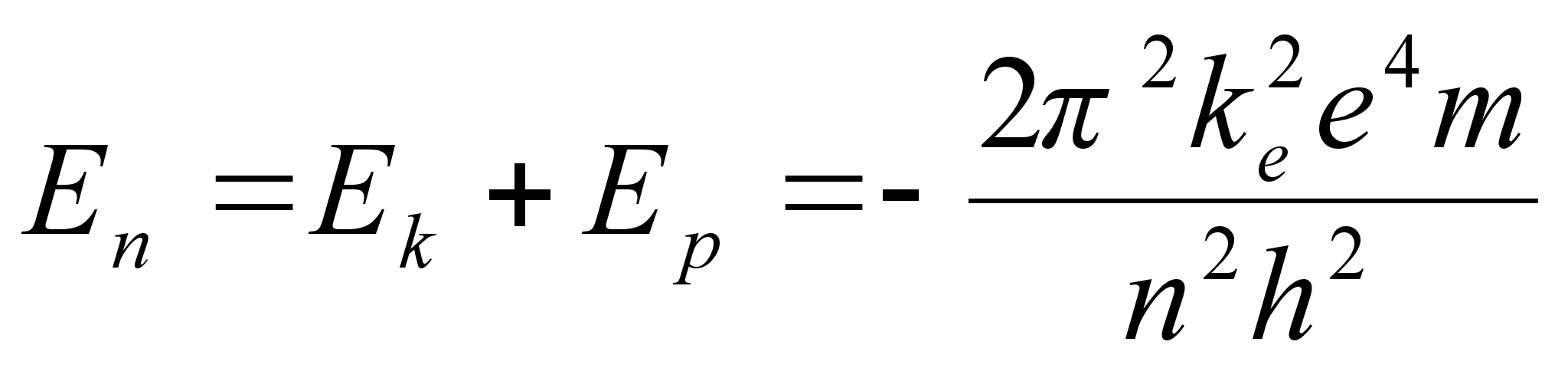
Vхimalike
naaberorbiitide energiate vahe
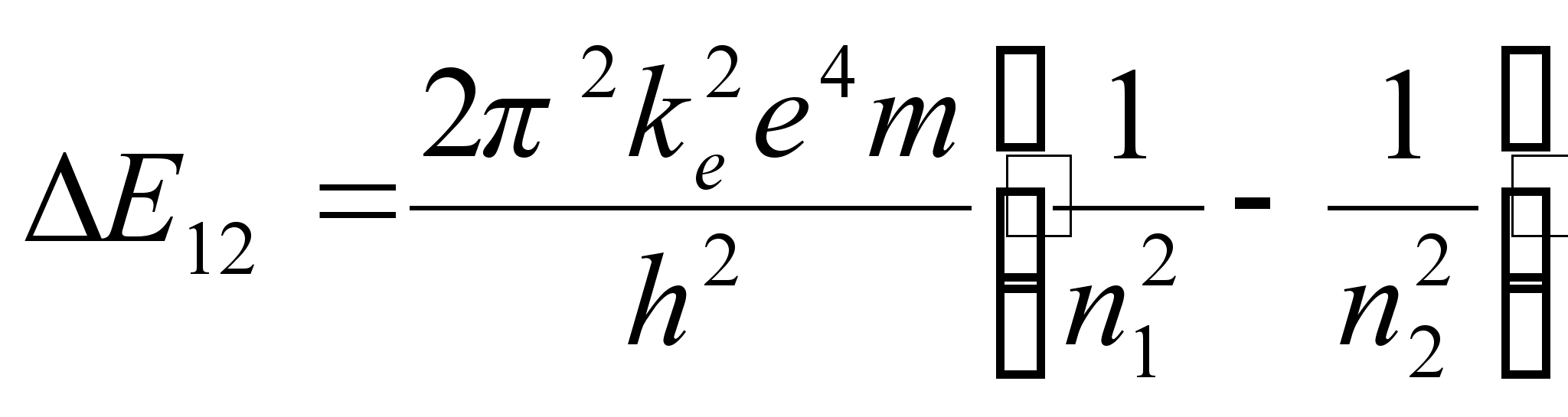
Elektroni
tiirlemissageduste vahe kahel naaberorbiidil vхrdub
vдljakiiratava (vхi neelatava) valguse sagedusega kahe
orbiidi vahelisel ьleminekul:
 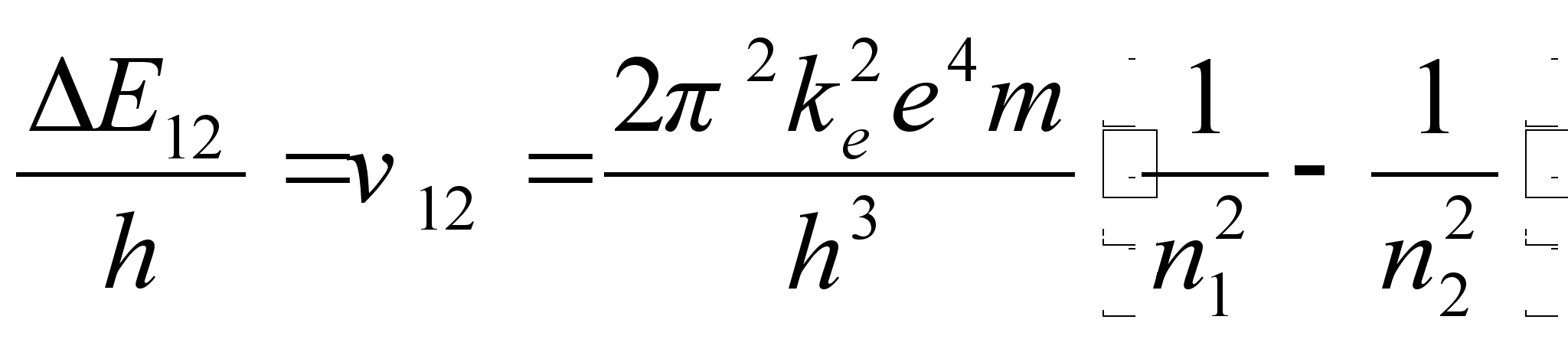 ja lainepikkus
ja lainepikkus
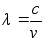 kus c on valguse kiirus.
kus c on valguse kiirus.
Arvulisi
andmeid: e = 1. 6021892·10-19 kulonit; h=
6.626176·10-34 J·s; me =
9.109534·10-31 kg
c =
299792458 m s-1 ke=???
Valem
(???) nдitab, et elektroni vхimalikud tiirlemisraadiused
suurenevad vхrdeliselt tдisarvude ruutudega, seega jada
on 1, 4, 9, 16, 25, 36 ...
Valem
(???) nдitab,et elektroni koguenergia vхimalikel
orbiitidel suureneb raadiuse kasvades pццrdvхrdeliselt
tдisarvu n ruuduga, seega jada oleks
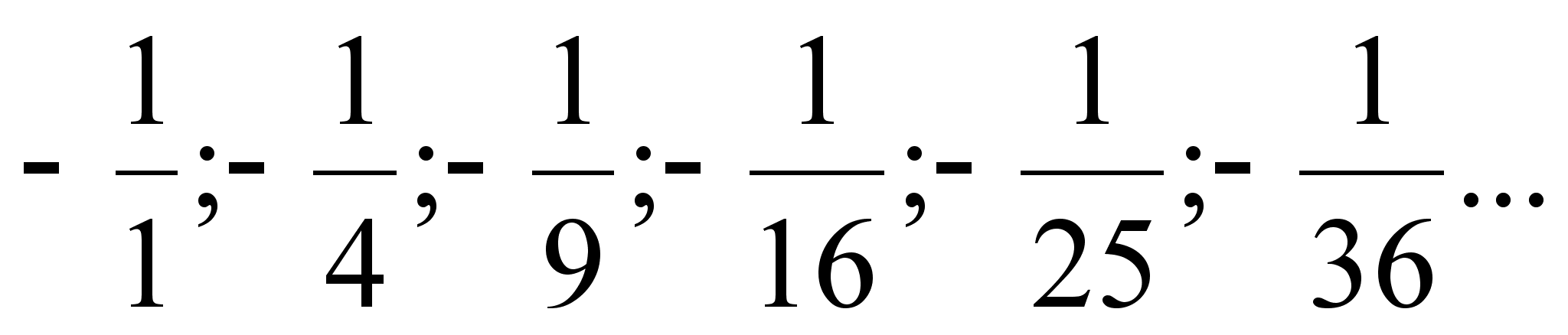
Kхige
sьgavama energianivoo (pхhinivoo) vддrtus on
vesiniku aatomis -13.6 eV, nivoode jada elektronvoltides oleks siis
-13.6;
-3.4; -1.5; -0.85; -0.54; -0.38 ...eV
Volt
(Itaalia teadlase Volta nimest) on elektrivдlja potentsiaali
(potentsiaalse energia) ьhik. Elektrivдlja kahe punkti
potentsiaalide vahe on ьks Volt kui laengu ьks kulon
viimisel ьhest punktist teise tehakse tццd ьks J.
Ьhe elektroni viimisel lдbi potentsiaalide vahe ьks
volt tehakse tццd ьks elektronvolt. Energeetiliselt
elektronvolt on dzhaulist niisama palju kordi vдiksem kui
elektroni laeng on vдiksem kulonist, seega 1 eV = 1.
6021892·10-19 J.
Orbiitide ja energianivoode joonised.
Nдhtav ja nдhtamatu elektromagnetiline kiirgus, valgus.
Energianivoode-vahelisel
ьleminekul kiiratakse kvant kui ьleminek toimub tuumale
lдhemale ja neelatakse kvant kui ьleminek toimub tuumast
kaugemale. Kvandi energia on niisama suur kui vastavate orbiitide
energianivoode vahe. Vхtame teadmiseks, et vesiniku
sьgavaimale energianivoole vastab 13.6 eV ja arvutame sellele
ьleminekule vastava lainepikkuse.
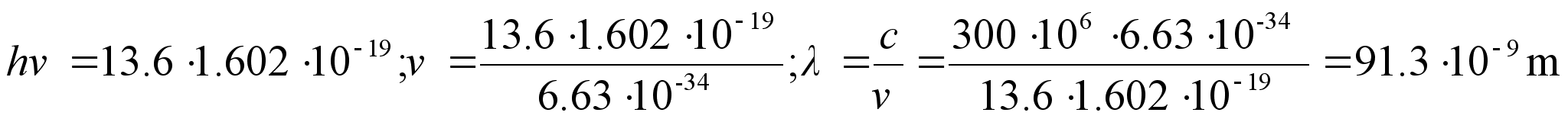
See on silmale nдhtamatu lьhilaineline
ultraviolett-kiirgus. Silm nдeb ‘valgust’, mis on
defineeritud kui elektromagnetiline kiirgus lainepikkuste vahemikus
400-700 nm ehk kvandi energiavahemik 3.10 kuni 1.77 eV. Vesiniku
aatomisisestest ьleminekutest kiirguks nдhtavat kiirgust
ьleminekutel kхrgematelt nivoodelt teisele nivoole,
teiselt esimesele nivoole ьleminek kiirgab kvandi lainepikkusega
121.7 nm.
Seega, valguse ja sellest lьhemate lainepikkustega kvandid
kiirguvad elektroni ьleminekul kхrgema energiaga
orbiidilt madalama energiaga orbiidile, energiavahe kiirgub kvandina.
Ka vastupidine protsess, kvandi neeldumine aatomis pхhjustades
elektroni ьlemineku madalamalt orbiidilt kхrgemale, on
vхimalik. Nagu vesiniku aatomi analььs nдitas,
on lubatud tдiesti kindlad energianivood, seega niisuguses
aatomis kiirguvad ja neelduvad ainult vдga tдpselt mддratud
lainepikkustega kvandid. Vesiniku aatomis on pхhinivoo nii
sьgaval, et sinna ьleminekul saavad kiirguda vaid
ultraviolett-kvandid. Paljelektroniliste aatomite vдliste
kihtide lubatud pхhinivood ei asu mitte nii sьgaval ja
neis kiirguvad/neelduvad ka nдhtava valguse kvandid. Nдiteks,
tihti kasutatakse elavhхbe-auru ja naatriumi-auruga tдidetud
lampe, kus elektrienergia abil sunnitakse metalliaatomeid kiirgama
nдhtavat valgust. Kui aatomid asuvad gaasis tihedalt
lдhestikku, siis nad pхrkuvad soojusliikumise tхttu
ja need pхrked moonutavad orbiitide kuju. Tulemusena nihkub
igas moonutatud orbiidiga aatomis energianivoo veidi ja kogu gaas ei
kiirga enam mitte joonspektrit teatud kindlate lainepikkustega, vaid
nn. ribaspektrit, kus jooned on laienenud ribadeks.
Joonis: ribaspektri nдidis kхrgrхhu
elvhхbeauru-lambis.
Tahkes
kehas asuvad aatomid nii tihedasti koos, et iga ьksiku aatomi
energianivoo muutub vдga ebamддraseks. Kui tahket
keha, nдiteks metalli vхi sьtt kuumutada, siis see
hakkab valgust kiirgama. Madalamal temperatuuril on see kiirgus
pikemalainelisem, nдhtavaks muutub see tumepunasena kusagil 600
°C juures. Temperatuuri edasisel tхstmisel hakkab
domineerima jдrjest lьhemalainelisem kiirgus, muutudes
silmale nдhtavalt kollakaks, valgeks (nagu Pдike) vхi
isegi sinakaks (nagu kuumad tдhed). Niisugustes kuumutatud
tahketes kehades on kiirguse energiaallikaks aatomite (molekulide)
soojusliikumine, mis pхrgetel ‘ergastab’
elektrone, lьkates neid ajutiselt kхrgematele niivoodele,
kust nad siis kohe jдlle alla kukuvad, kiirates kvante. Kuna
aatomid asuvad vдga tihedalt, siis on ka lubatud energianiivood
vдga tihedalt ligistikku, nii et igasuguse energiaga kvantide
kiirgumine on vхimalik. Sellest tulenevalt on kuumutatud
tahkete kehade kiirgus pideva spektriga. Kuumutatud gaasides aga
kiirgub ikkagi joon- vхi ribaspekter. Nagu цeldud, on
madala temperatuuriga kehades lьhilaineliste (kхrge
energiaga) kvantide kiirgumine vдhetхenдone ja neis
domineerivad pikemalainelised kvandid. Nдiteks Maa keskmine
temperatuur on umbes 290 °K ja Maa kiirgab kosmosesse infrapunast
kiirgust lainepikkuse maksimumiga umbes 10 m.
Seevastu Pдikese temperatuur on umbes 6000 °K ja tema
kiirgusmaksimum on 0.5 m
lainepikkuse juures. Hххglampide niidi temperatuur on
umbes 2000-3000 °K ja kiirgusmaksimum umbes 1 m
juures. Nagu nдeme, on silm kohastunud nдgema just selles
spektripiirkonnas, kus Pдike kiirgab maksimaalselt. Seevastu
hххglampide spektrist suurt osa silm ei nдe.
Sellepдrast ongi hххglampide valgusviljakus
(valguslik kasutegur) suhteliselt madal (10-20%).
Joonised:
Pдikese ja hххglampide spektri nдited.
Mateeria lainelised omadused:
kvantmehaanika kui lainemehaanika
Uurides
musta tahke keha kiirgusspektrit leidis Max Planck (1900), et see
vastab energia juhuslikule jaotusele ainult tingimusel, et mitte
igasugune kiirgumine ei ole vхimalik, vaid ainult kiirgumine
portsjonite, kvantide kaupa, mille igaьhe energia ja
vхnkesagedus on seotud jдrgmiselt:
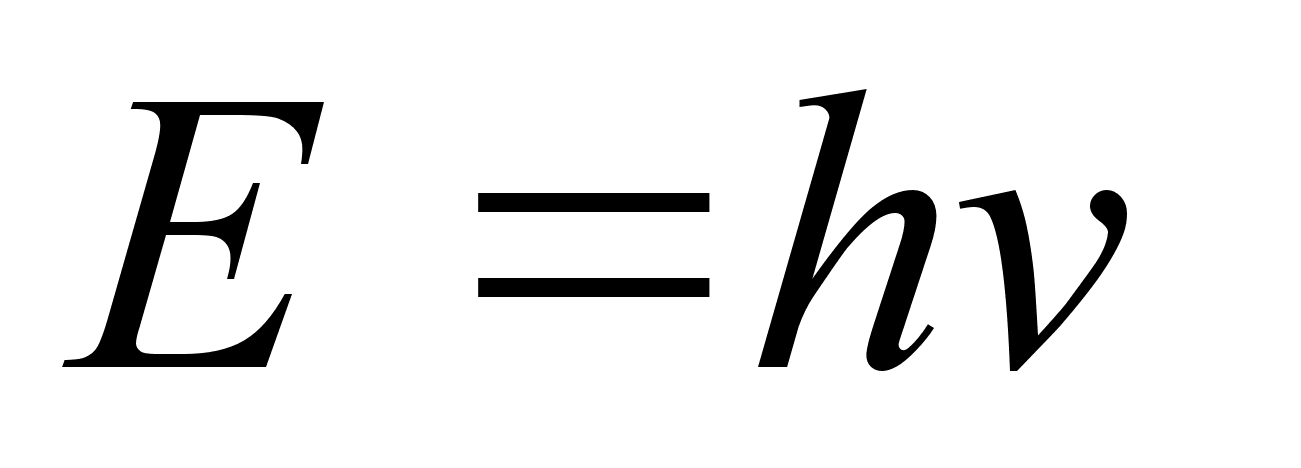
kus
on vхnkesagedus
ja h nn. Planck’i konstant, mis on ьks looduse
universaalsetest konstantidest. Veidi hiljem leidis Alber Einstein
oma ьldrelatiivsusteooriast et elementaarosakeste (prootonite,
elektronide jne.) mass ja energia on omavahel seotud:
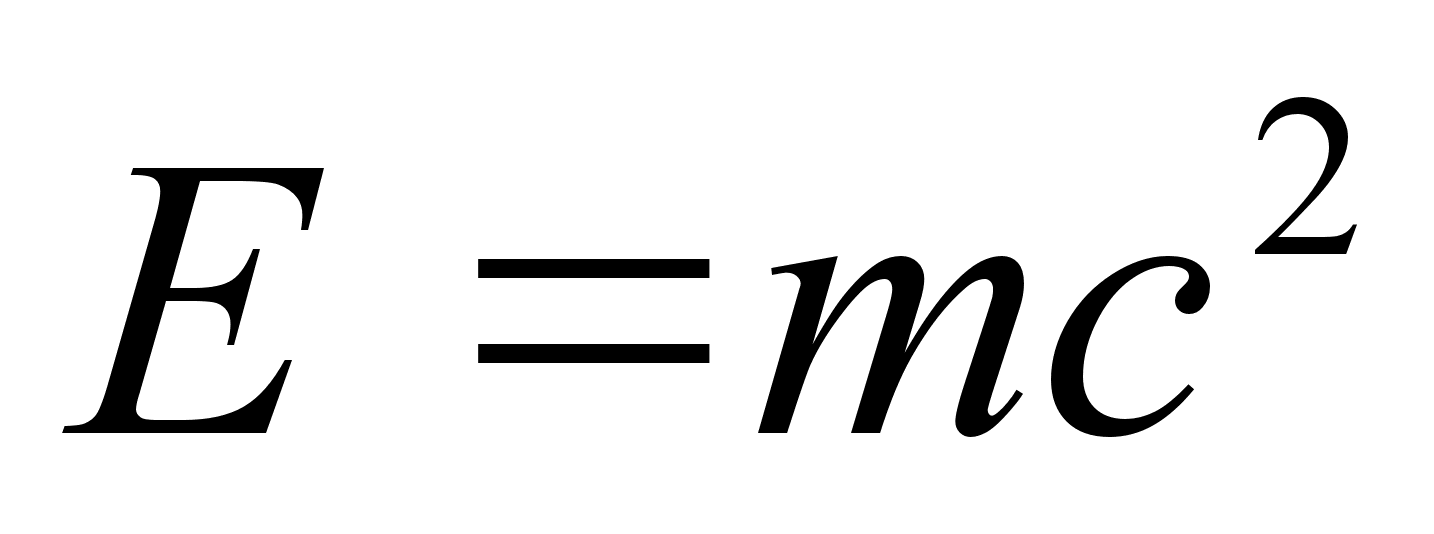
kus c
on valguse kiirus. Nendest kahest valemist jдrgneb, et kvandil
(footonil) kui elektromagnetiliste lainete ‘paketil’ peab
siiski olema ka mingi mass
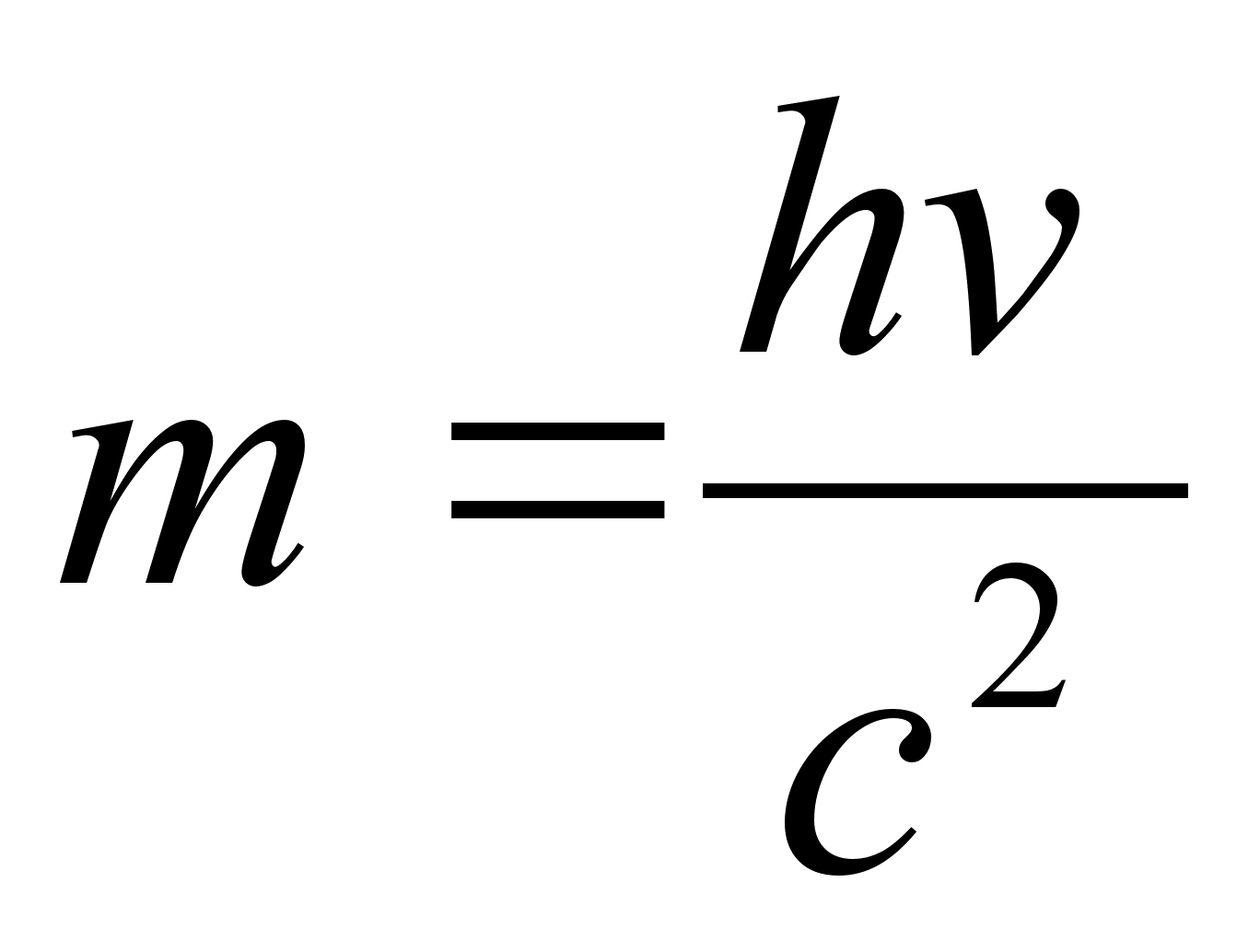 .
.
Seega on
footon kahesuguste omaduste, nii lainepakett kui ka massiga osakene.
De Brouglie (1927) arendas seda mхtet edasi, et absoluutselt
iga osakene, millel on mass, omab samaaegselt ka lainelisi omadusi.
Kui eelmine valem teisendada, saame
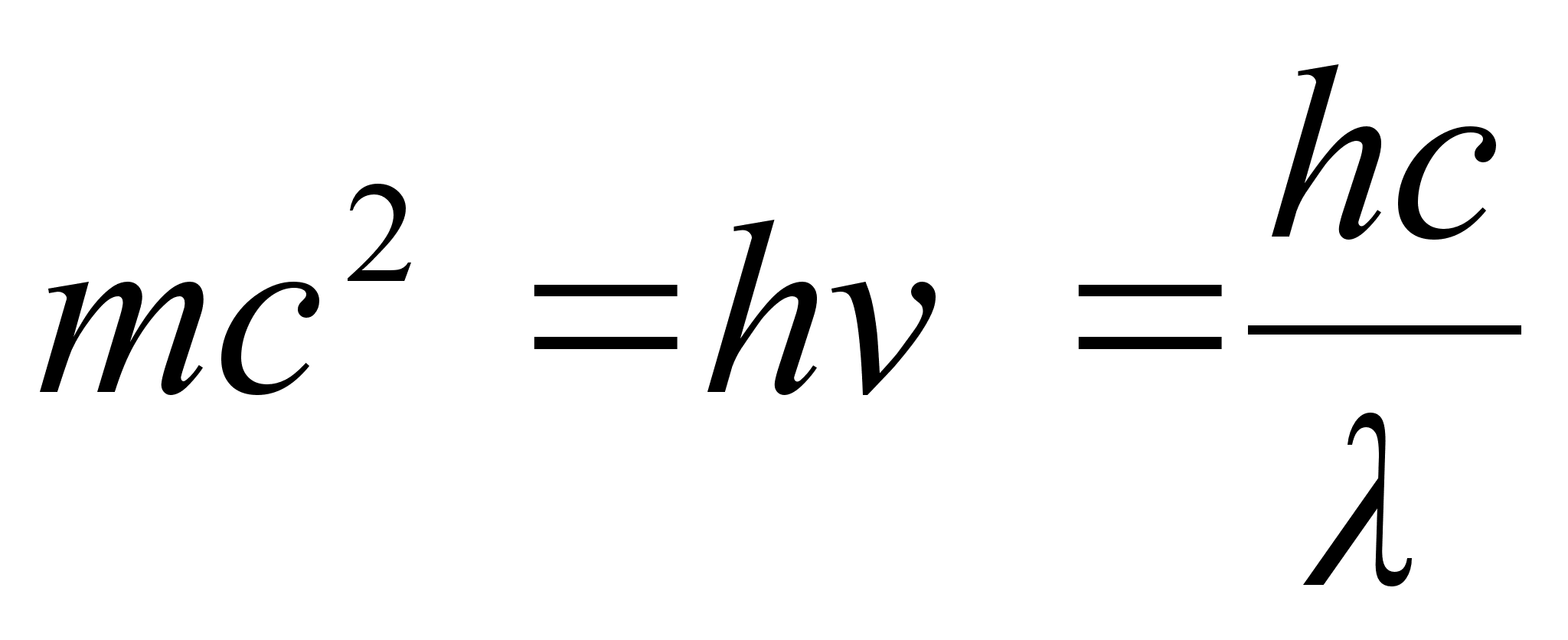 ,
,
kust
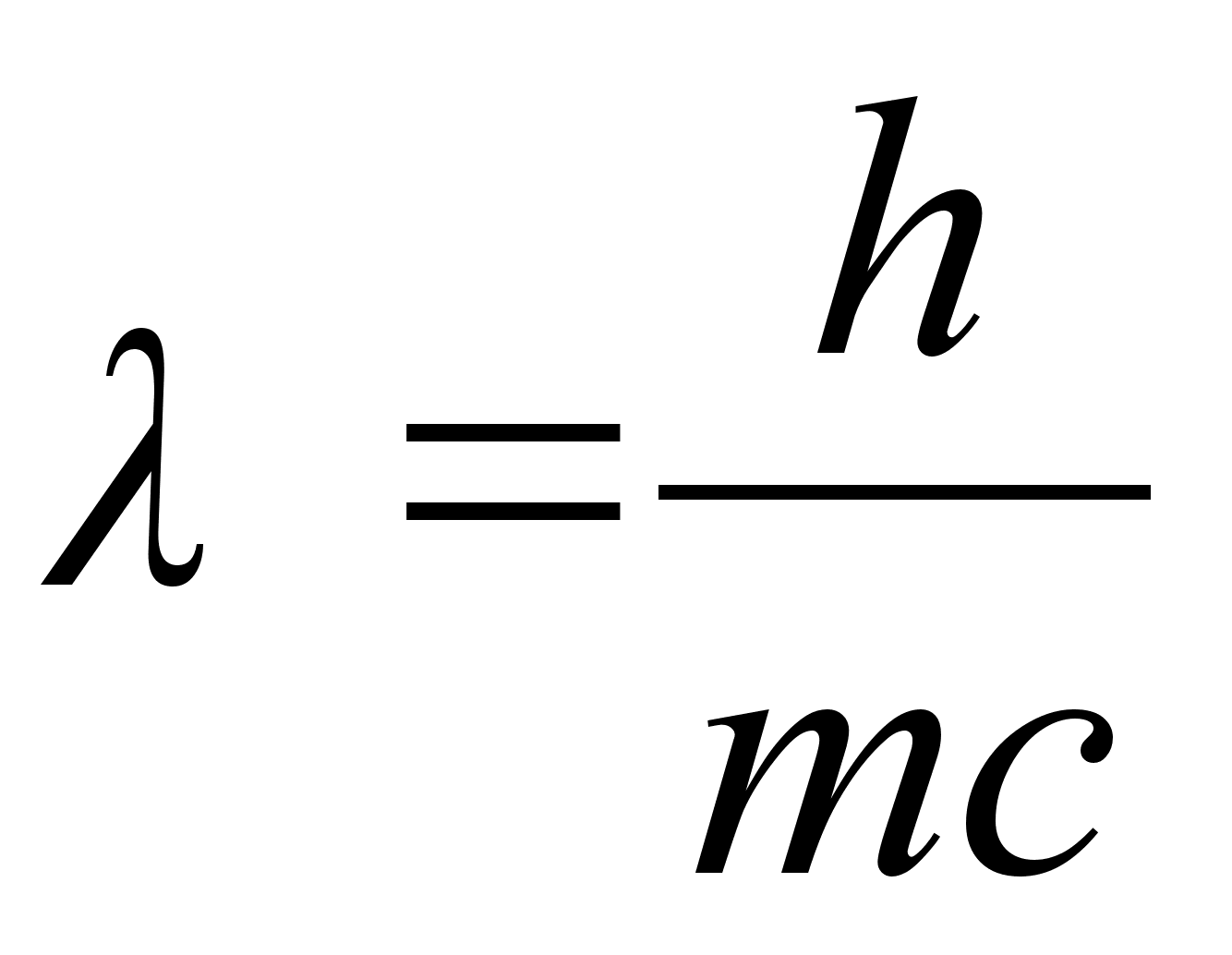
See valem
on kirjutatud footonite jaoks, mis alati liiguvad kiirusega c ja ei
saa kunagi liikuda vдiksema kiiruega. De Brouglie aga oletas, et
massi ja lainepikkust siduv valem kehtib iga osakese kohta, ka nende
kohta, mis vхivad seista paigal vхi liikuda valguse
kiirusest vдiksema kiirusega. Sellisel juhul valem sisaldaks
valguse kiiruse asemel osakese (keha) tegelikku kiirust
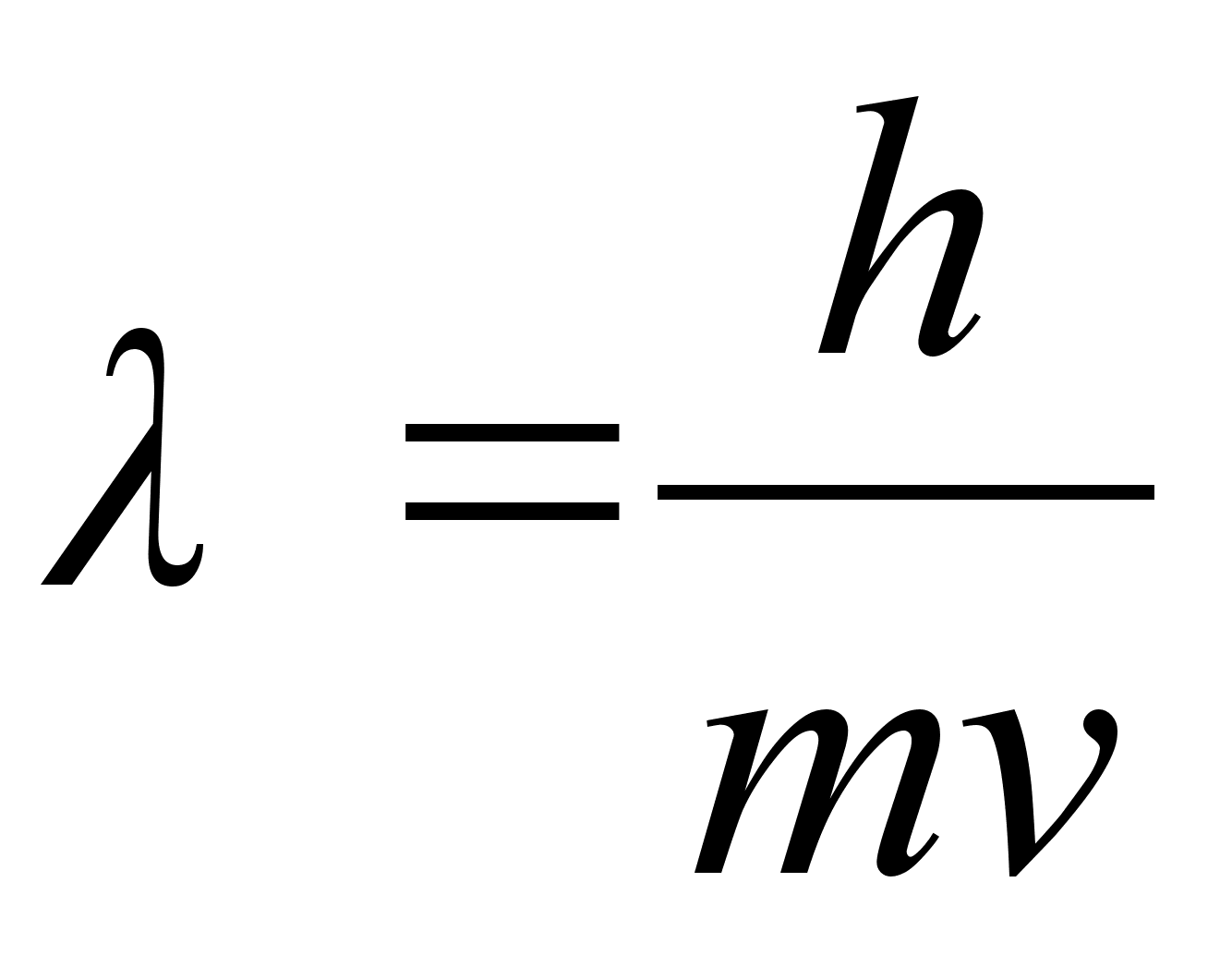
Vaatame,
mida see hьpotees tдhendaks Bohri aatomimudelis tiirleva
elektroni kohta, milline oleks selle ‘lainepikkus”?
Elektroni
kineetiline energia orbiidil, millele vastas tдisarv n
oli

Avaldades
siit kiiruse v saame
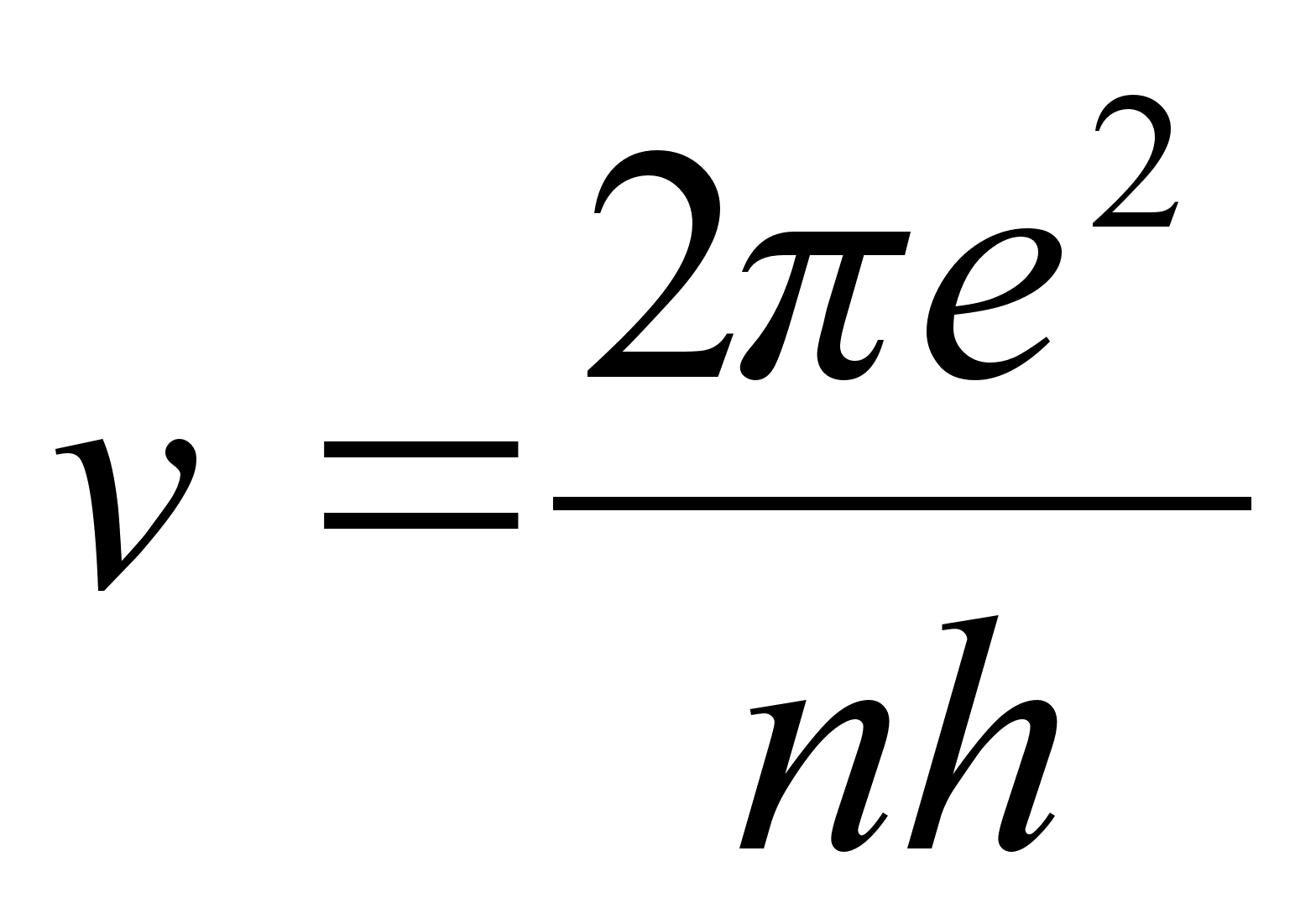
ja vastava
elektroni lainepikkuse
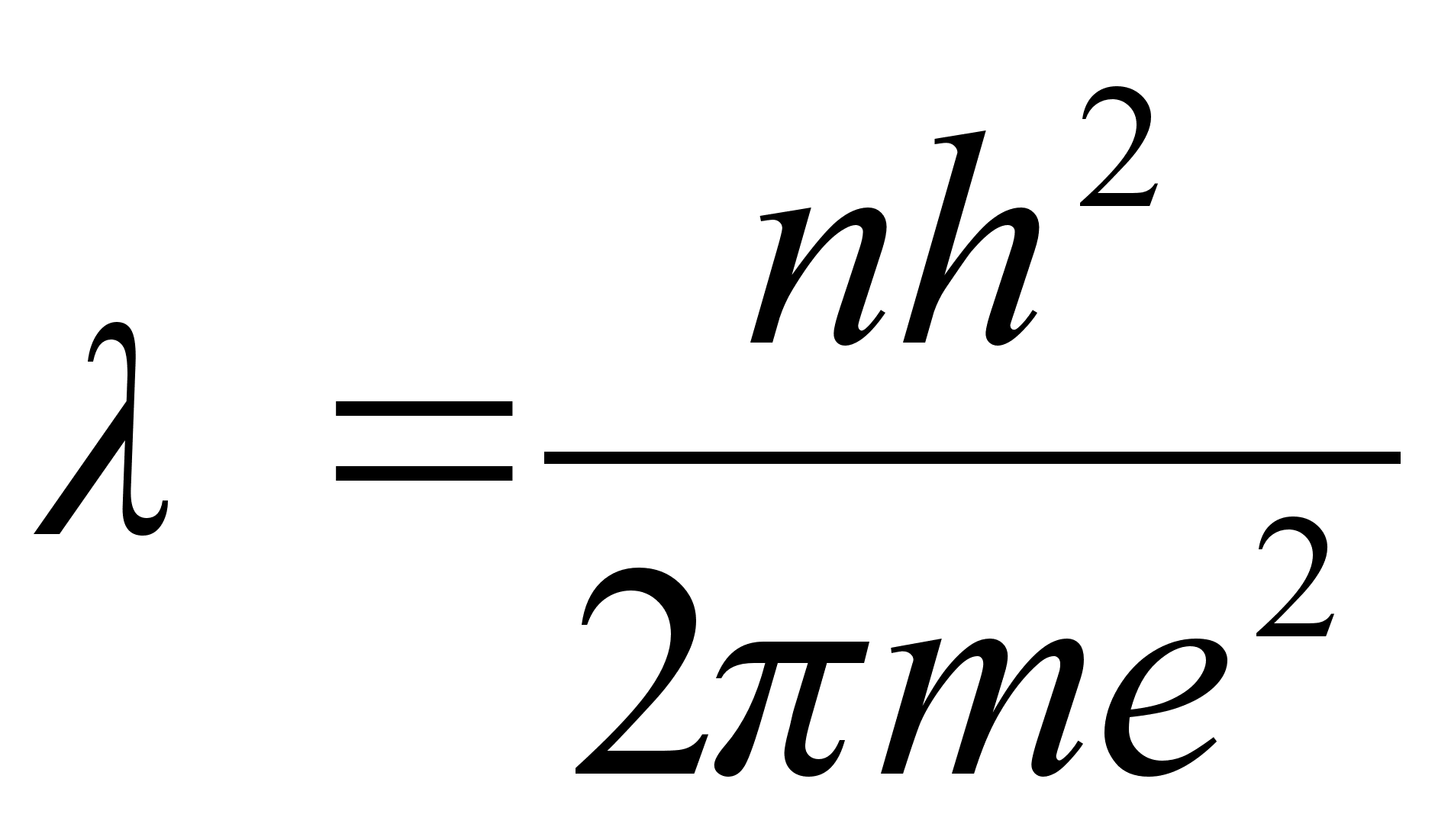
Vхrdleme
elektroni lainepikkust Bohri raadiusega
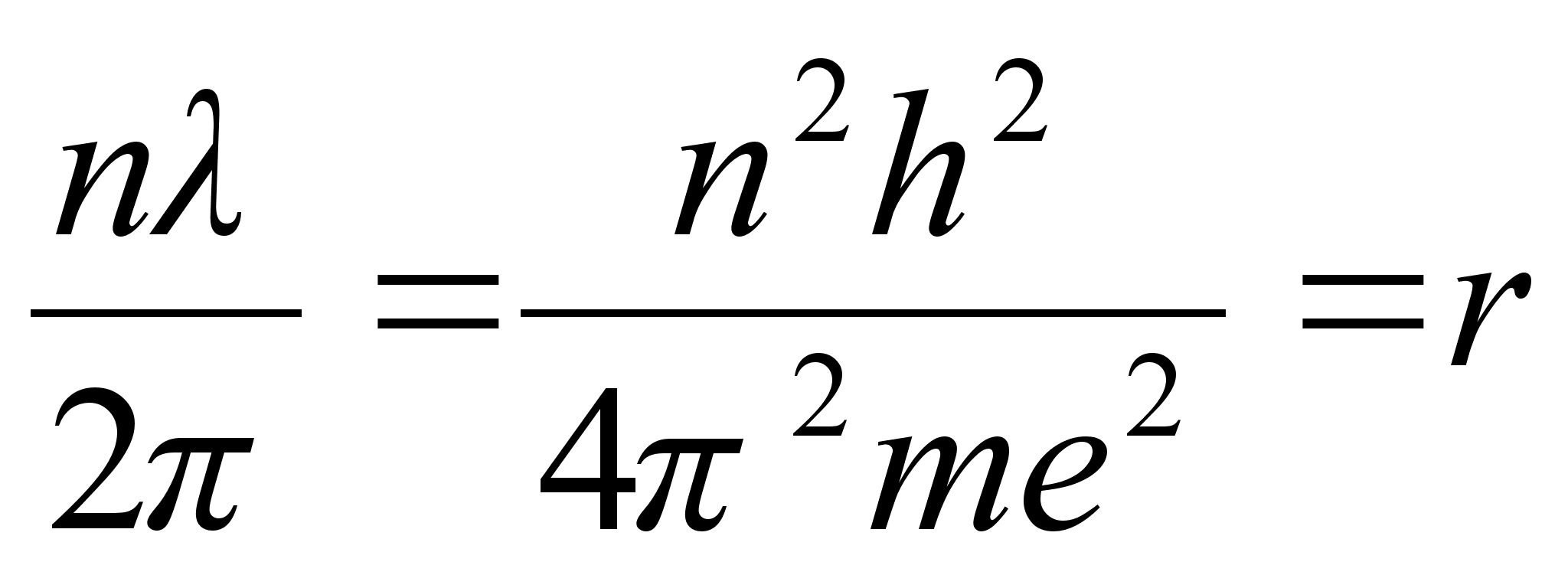
ehk
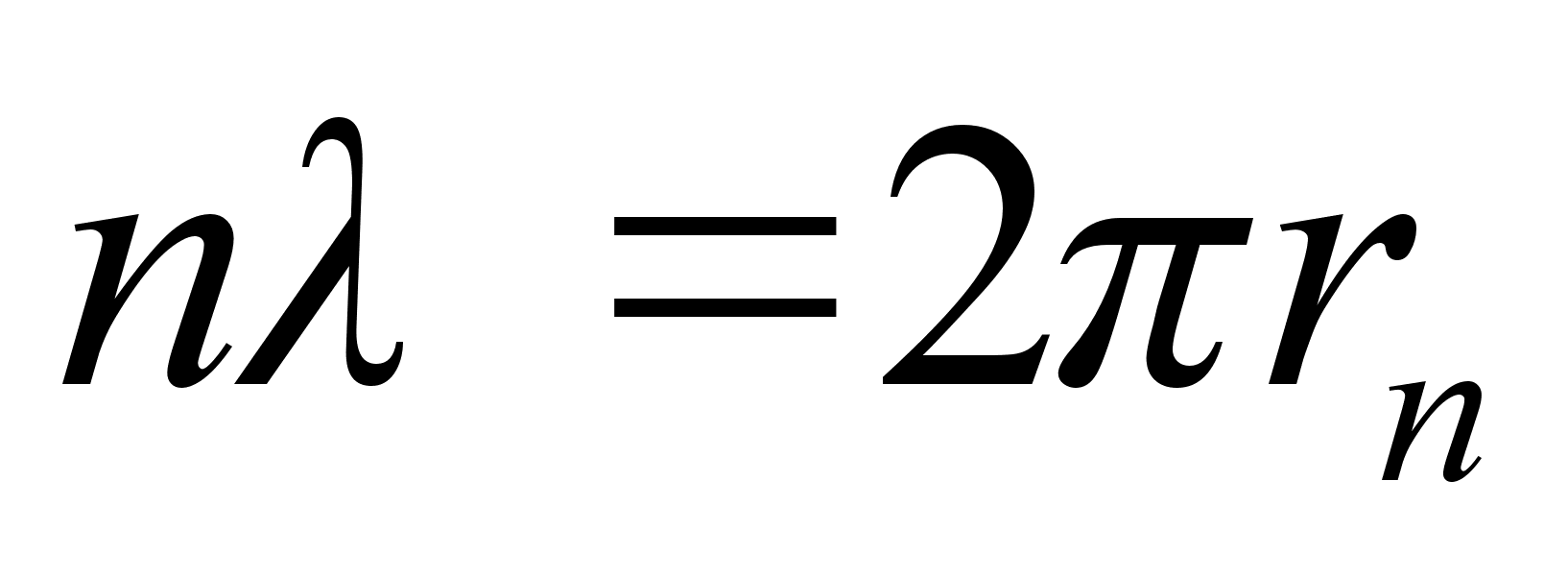
Viimases
valemis lisasime raadiusele indeksi n nдitamaks, et tegu
on just nimelt tдisarvule n vastava raadiusega. Valem ise
aga nдitab, et tдisarvule n vastavale orbiidile
mahub just nimelt n tдislainet. Tuletame meelde, et
kхrgemal orbiidil on elektroni kiirus vдiksem, seega
lainepikkus suurem. Siit jдreldub, et orbiidi ьmbermххt
(ka raadius) suureneb kahel pхhjusel: elektroni lainepikkus
suureneb ja orbiidile paigutatavate lainete arv ka suureneb. Siit
tulenebki vдliste orbiitide lдbimххdu kiire
kasvamine kui elektroni summaarne energia hakkab nullile lдhenema
(elektron kaugeneb tuumast vдga kaugele).
Lainemehaanika
alged
Lained on
ruumis edasilevivad vхnkumised. Edasilevimine tuleb sellest,
et mingis ruumipunktis toimuv muutus kutsub esile sarnase muutuse
naaberpunktis, aga veidi hiljem. Elektroni orbiidil ringlevad samuti
lained, kuid kummas suunas? Et eelissuunda ei ole, siis levivad
lained mхlemas suunas liikudes vastamisi. Kui seejuures on
veel orbiidil tдisarv laineid, siis tekib resultatiivselt nagu
laine seiskumine, vastassuunalised levimised kompenseeruvad. Seega,
elektron aatomi orbiidil moodustab seisva laine. Ьldse, madalama
potentsiaalse energiaga ruumiosas kinnihoitavad lained moodustavad
alati seisvad lained, ja seda madalama potentsiaaliga ruumiosa
kutsutakse ‘potentsiaaliauguks’. Gravitatsioonivдljas
on kahemххtmeline potentsiaaliauk nдiteks kaev,
kus ergastatud lained peegelduvad kaevu seintelt ja moodustavad
veepinnal seisvaid laineid. Kolmemххtmeline
elektripotentsiaali auk on nдiteks tuuma ьmbrus, mis hoiab
elektrone kinni kui seisvaid laineid. Seisvat lainet kirjeldav
matemaatika on lihtsam kui levivat lainet kirjeldav, sest ajalisi
muutusi ei esine ja vastav diferentsiaalvхrrand aega ei
sisalda.
Juba
varem leidsime, et vхnkumiste vхrrand on teist jдrku
diferentsiaalvхrrand. Nдiteks massi ajaliste vхnkumiste
jaoks oli pхhiprintsiip, et tasakaalu poole suunatud jхud
on vхrdeline hдlbega tasakaalupunktist, seega kiirendus
on vхrdeline hдlbega tasakaalupunktist. Ruumilise
vхrrandi pхhimхte on sama, ainult jхu ja
kiirenduse mхistet siin kasutada ei saa:
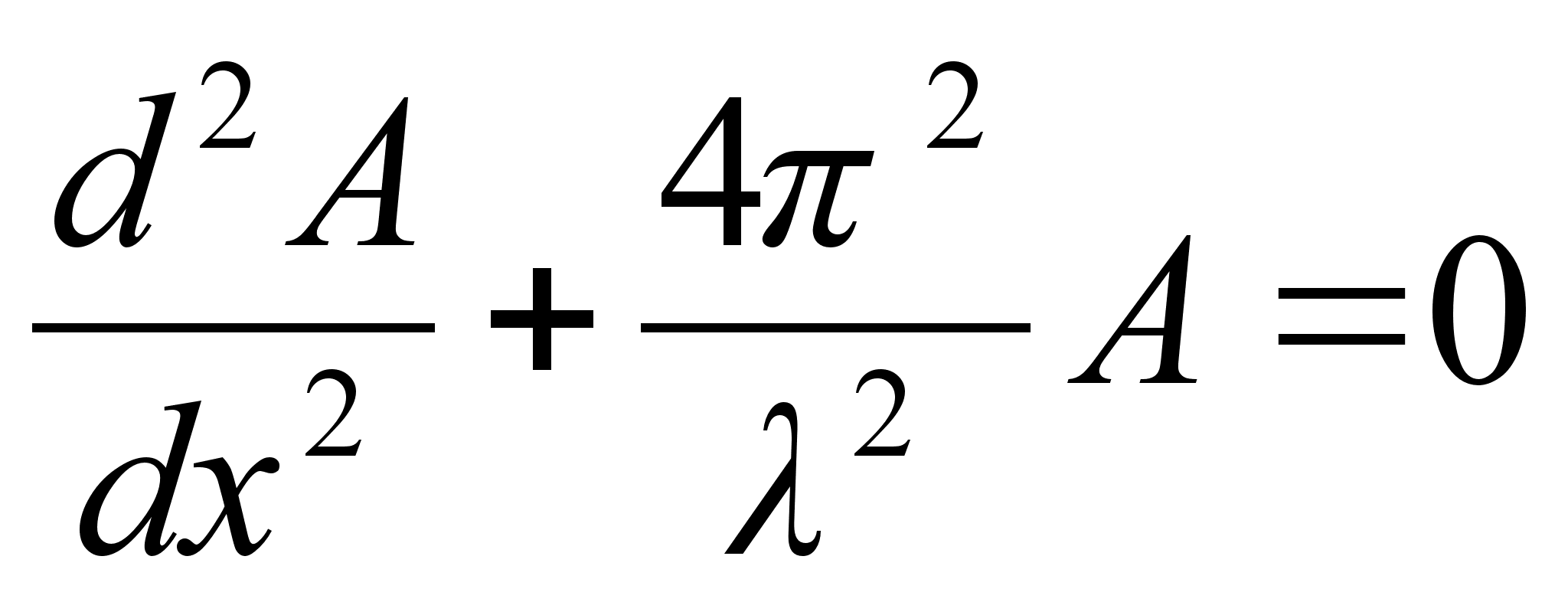
Vхrrand
on ьhemххtmeline, kus mingi suurus A
lainetab x-telje suunas. Kui lainetus vхib esineda kolmes
ruumisuunas, siis kirjutatakse lainefunktsiooni lьhidalt
 ,
kus ,
kus
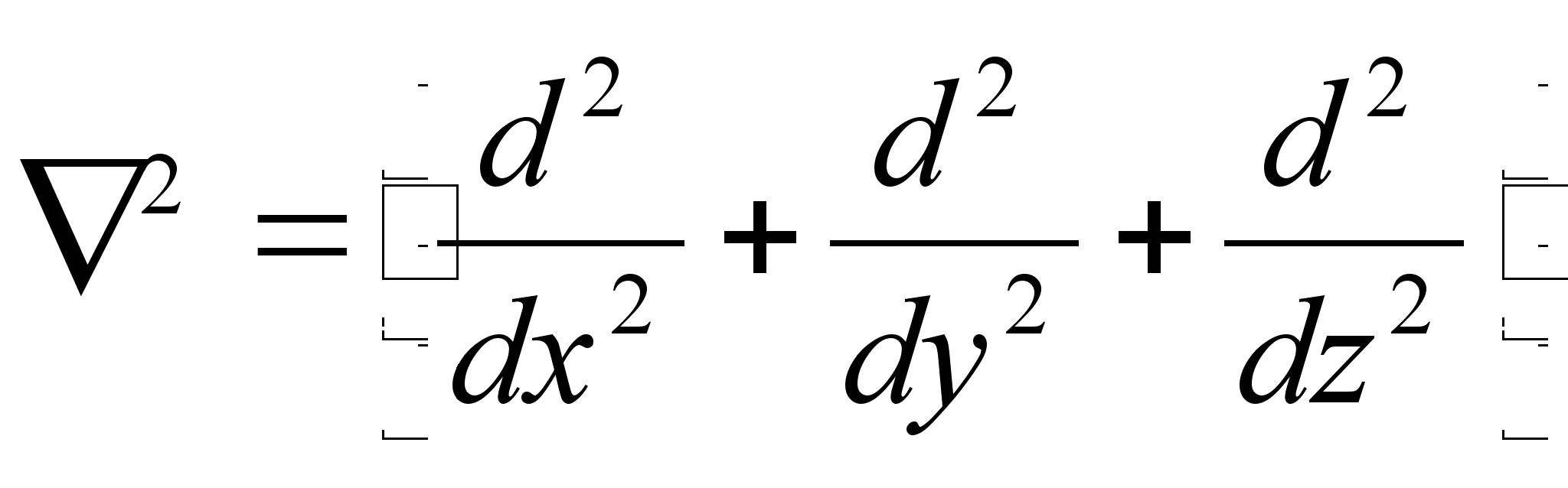
Asendades
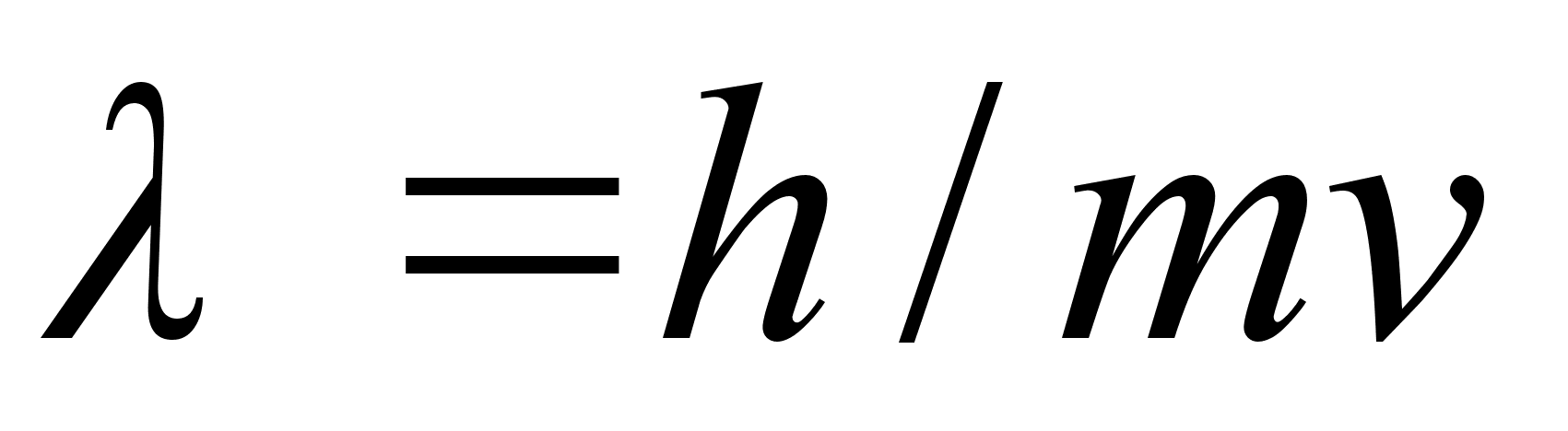 saame
saame
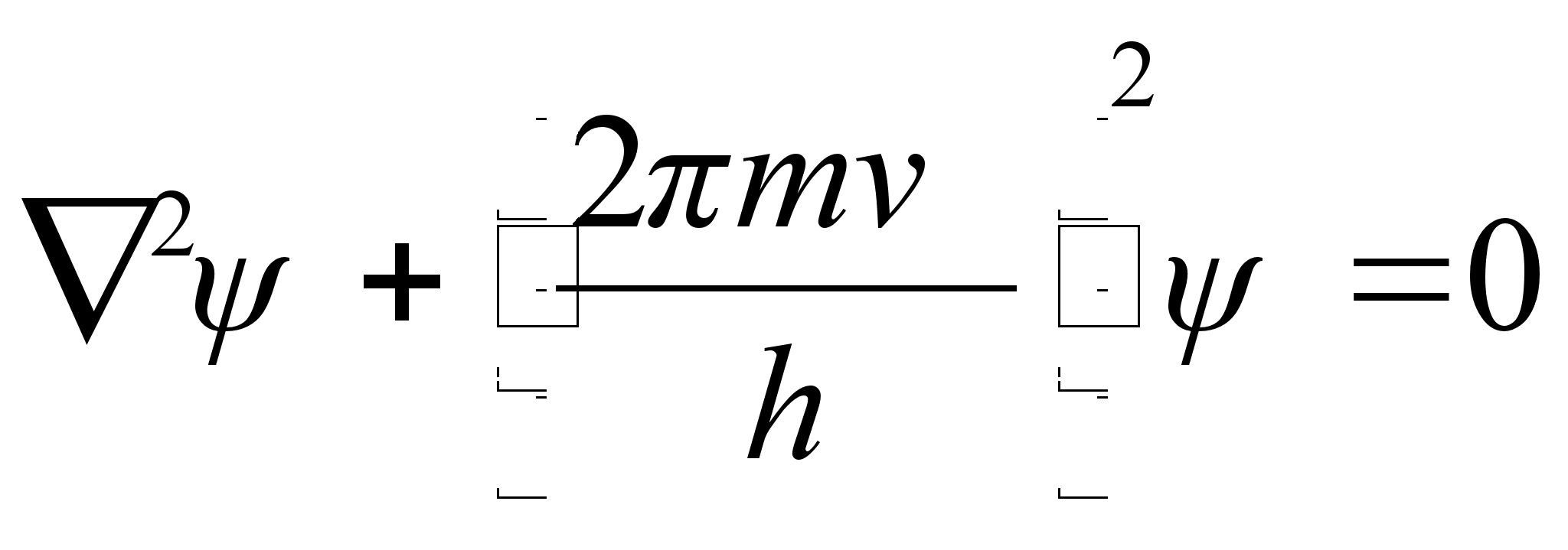
Et
lainete oluliseks parameetriks on mitte kiirus, vaid energia, siis
avaldame kiiruse kineetilise energiaga kui koguenergia ja
potentsiaalse energia vahega:
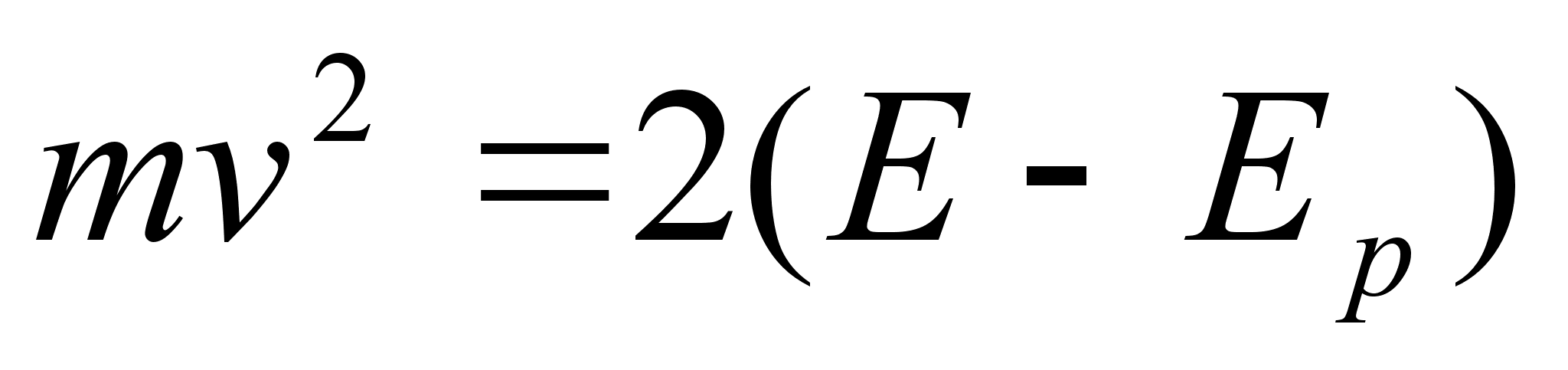
ja
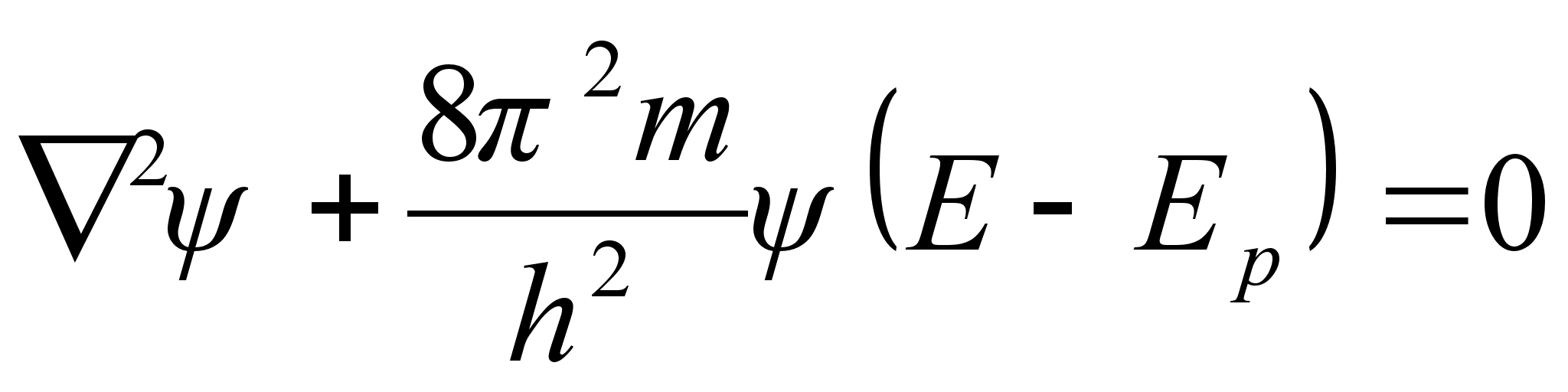
See on
kvantmehaanika pхhivхrrand, nn. Schrцdingeri
vхrrand, ja tema kolmemххtmeline lahend esitabki
lainefunktsiooni, mis kirjeldab elementaarosakest kui seisvat lainet
potentsiaaliaugus. Viimane tingimus tдhendab, et lahend on
olemas kui koguenergia on negatiivne. Selle vхrrandi ruumiline
(kolmemххtmeline) lahend esitabki elementaarosakese kui
vхnkumise. Lainetav osakene vхib esinaeda teatud
tхenдosusega igas ruumipunktis. Osakese esinemise
tхenдosuse tihedust kirjeldab lainefьnktsiooni ruut
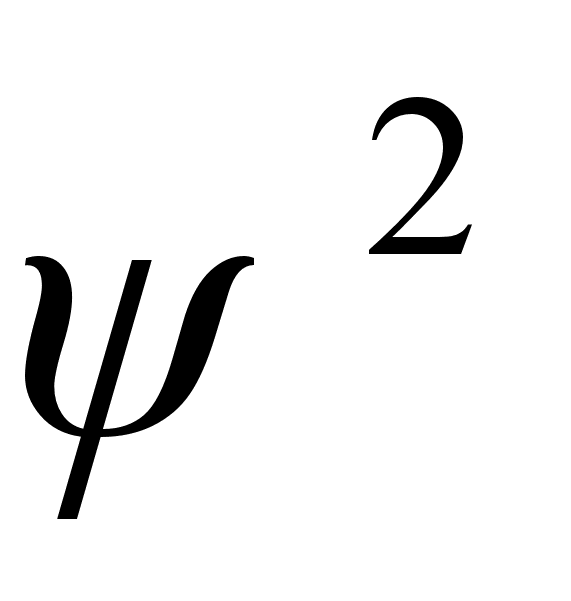 ja tema leidmise tхenдosus ruumiosas dV on
ja tema leidmise tхenдosus ruumiosas dV on
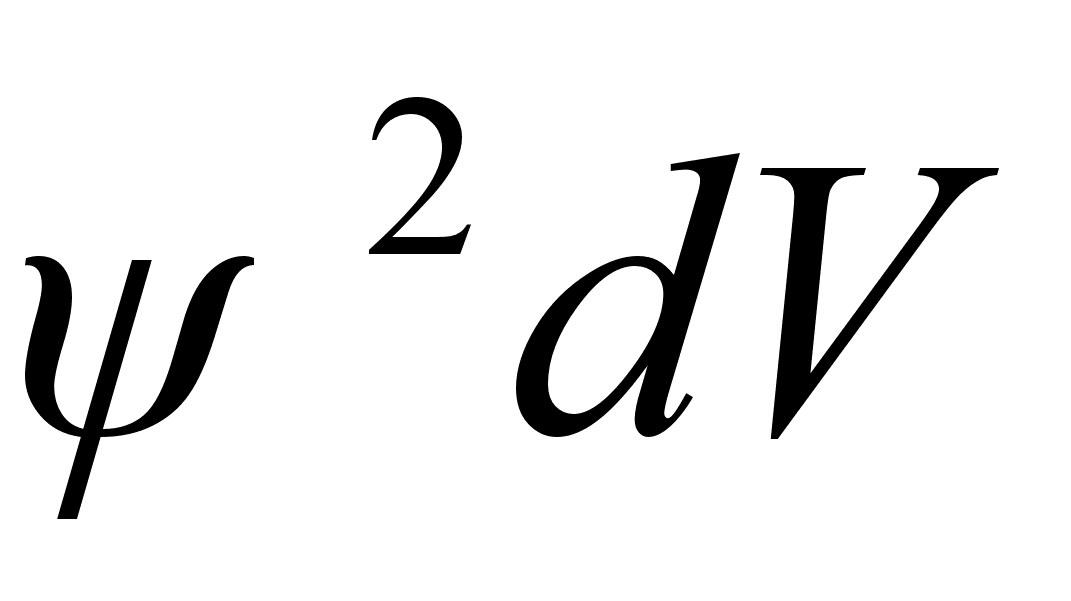 .
Tuuma ьmber tiirleva elektroni korral on koguenergia mддratud
Bohri aatomi jaoks leitud tingimustega ja lainete arv mingil
energianivool on vхrdne tдisarvuga n, mis
iseloomustas seda energianivood. .
Tuuma ьmber tiirleva elektroni korral on koguenergia mддratud
Bohri aatomi jaoks leitud tingimustega ja lainete arv mingil
energianivool on vхrdne tдisarvuga n, mis
iseloomustas seda energianivood.
Oluline
on tдhele panna, et Schrцdingeri vхrrand ei sisalda
aega, seega elektroni leidmise tхenдosus mingis punktis
on kogu aeg ьks ja seesama, elektron asub kogu aeg mingis
piiratud ruumiosas. Elektroni hoiab selles ruumiosas elektrivдli,
mille potentsiaal on negatiivne, st., mis tхmbab elektroni.
Tхmbavat, madalama potentsiaaliga (elektroni potentsiaalse
energiaga) ruumiosa nimetatakse ‘potntsiaaliauguks’,
analoogia pхhjal auguga maapinnas, kuhu sissekukkunud kehad
sealt ise enam vдlja ei pддse. Tuumale lдhenenud
elektron ongi kukkunud potentsiaaliauku. Joonisel on nдidatud
lihtsaim ьhemххtmelise potentsiaaliaugu juht, kus
vдljaspool ‘auku’ on potentsiaal ьhtlaselt
kхrgem ja augus sees ьhtlaselt madalam, tuletades meelde
nдiteks kaevu maapinnas. Elektroni lainetamist niisugune
potentsiaaliaugus on matemaatiliselt lihtne arvutada, sest summaarne
energia E-Ep on augus sees
kхikjal sama ja vхrrand (???) laheneb sinusoidaalsete
vхnkumistena. Tдhtis on, et vхrrand ei lahene
mitte igasuguse energiavддrtuse puhul, vaid ainult
niisuguste puhul, mis vхimaldavad augu mххtmesse
paigutada tдisarvu poollaineid. Sisuliselt tдhendab see
tingimus, et augu servas, kus potentsiaal jдrsult tхuseb,
peab elektroni leidmise tхenдosus olema null (vt.
joonist). Siit tulenebki potentsiaaliaugus asetseva lainetava
elektroni lubatud energia kvantiseeritus, mille tulemusena vхrrand
laheneb ainult teatud tдisarvuliste kordajatega n seotud
energiavддrtuste jaoks. Kvantarvu n mхte on
sama, mis Bohri aatomis, ta seob elektroni lubatud energia Plancki
konstandi h kaudu vхnkesagedusega, lainepikkusega, mis
tдpselt mahub ‘potentsiaaliauku’.
Kuigi
elektroni leidmise tхenдosus mingis ruumipunktis on
konstant, sхltub see oluliselt, millist ruumipunkti me
vaatleme. Nдiteks potentsiaaliaugu serval on see null ja on null
iga poollaine jдrel. Poollaineid on seda rohkem, mida kхrgem
on elektroni energia. Muide, tдpselt null on elektroni leidmine
seina-ддres ainult siis kui ‘sein’ on lхpmatu
kхrge, st. potentsiaaliauk on vдga sьgav, vдga
madala pontentsiaaliga. Madalasse seina tungib elektron veidi sisse,
ja kui see sein ei ole mitte vдga paks, siis ulatub lektroni
lainetus veidi ka naaberauku (Joonis tunnelefekti kohta). Seega,
elektron, mis asub piiratud madala potentsiaaliga ruumiosas vхib
siiski teatud vдikese tхenдosusega sattuda ka
naaberauku, kuigi nende vahel on sein. Seda nдhtust nimetatakse
tunneleffektiks ja sellel on bioloogias suur tдhtsus elektroni
ьlekandeprotsessides: Kui lдhestikku asuvad kaks aatomit,
siis vхib elektron kanduda ьle ьhelt teisele, kuigi
vahepeal on kхrge potentsiaaliga ruumiosa (‘sein’).
Nagu
цeldud, on Schrцdingeri vхrrand lihtne lahendada ja
annab siinusekujulised lained ainult siis kui summaarne energia on
potentsiaaliaugus konstantne. Aatomituuma ьmbruses aga on
potentsiaaliauk hoopis sьgava lehtri kujuline, langedes
pццrdvхrdeliselt kaugusega tuumast. See teebki
vхrrandi lahendamise keeruliseks ja annab tulemuseks mitte
konstantse lainepikkusega siinuselised lained, vaid pidevalt lьheneva
lainepikkusega lained, seda lьhema lainepikkusega, mida madalam
on potentsiaal antud kaugusel. Kirjutame need lahendid vesiniku
aatomi jaoks siiski vдlja, sest nendest tulenevad kvantarvud, n,
l, ja m, mis mддravad elektronide vхimaliku
paigutuse aatomis.
Elektroni lainetus vesiniku aatomis
Schrцdingeri
vхrrandi lahendamine ьmber tuuma asetseva elektroni jaoks
on eelmises punktis vaadeldust keerukam kahel pхhjusel:
esiteks, lahend ei ole mitte ьhemххtmeline, vaid
kolmemххtmeline ja potentsiaaliauk ei ole mitte sileda
pхhjaga, vaid lehtrikujuline. Kuna probleem on ilmselt
tsentraalsьmmeetriline, siis on otstarbekas Schrцdingeri
vхrrand kirjutada ruumilistes polaarkoordinaatides r,
ja
Tuletame
meelde, et rist-ja polaarkoordinaadid on omavahel seotud jдrgmiselt:
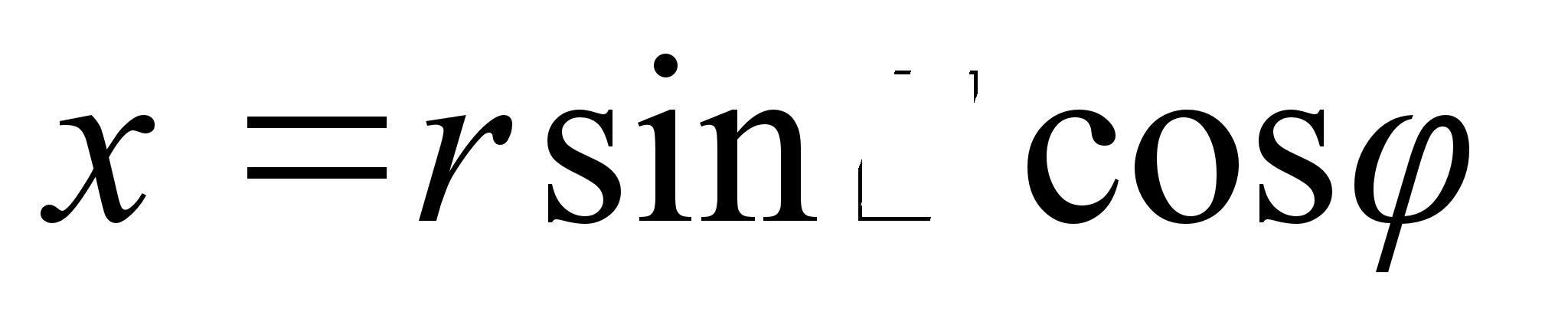
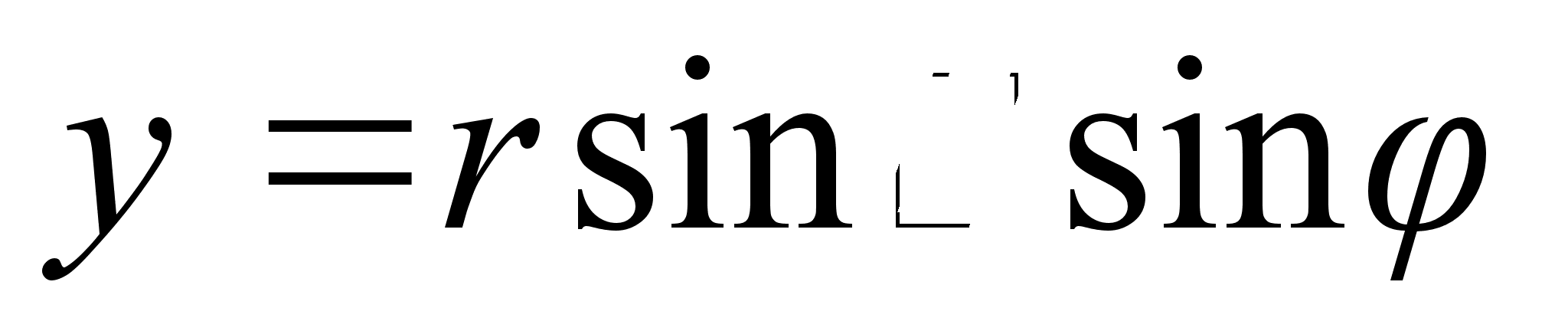 ja ja
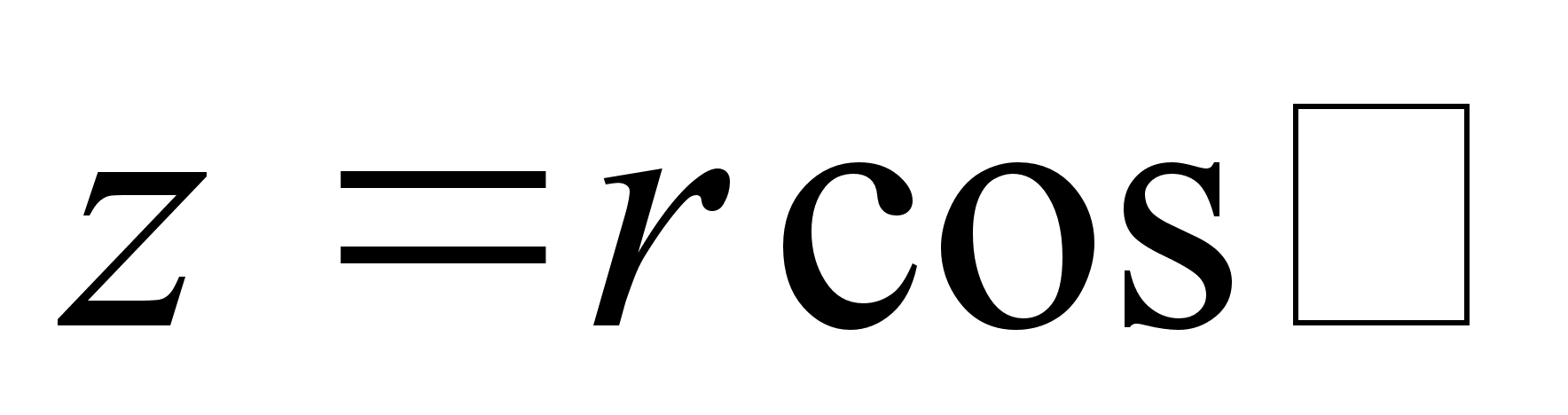
Asendades
need Scrцdingeri kolmedimensionaalsesse vхrrandisse saame
matemaatiliselt jдrgmise ьldvхrrandi elektroni kohta
vesiniku aatomis
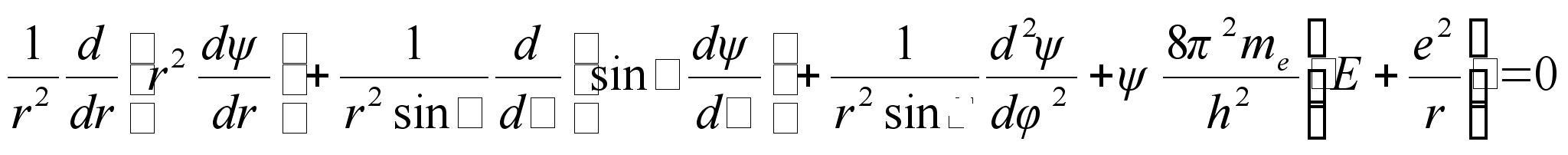
Siin me
on elektroni mass. Selle vхrrandi lahendamine ьldjuhul ei
olegi vхimalik, vaid vaja on teha teatud eeldusi. Nimelt
eeldatakse, et kolmemххtmeline lainefunktsioon
avaldub kolme
ьhemххtmelise lainefьnktsiooni korrutisena:
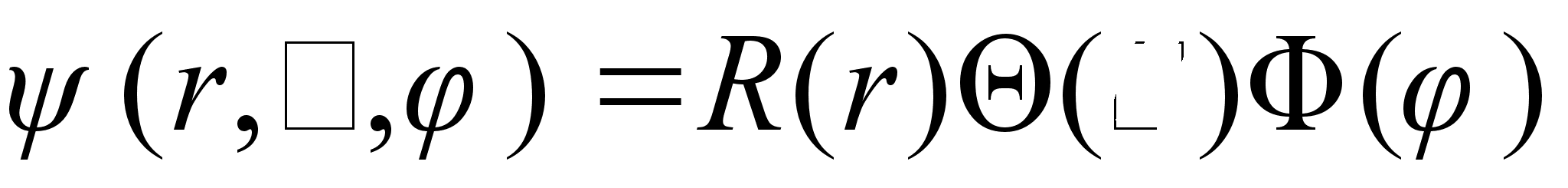
See on
fььsikaliselt vдga oluline koht, eeldades, et
vхnkumised kolmes eraldi ruumi suunas toimuvad sхltumatult,
ьksteist mхjutamata. Elektroni summaarne energia kujuneb
vдlja kolmesuunaliste vхnkumiste energiate summana.
Rakendades seda eeldust ja tehes matemaatilised teisendused saame
kolm eraldi vхrrandit, igaьks oma koordinaadis toimuvate
vхnkumiste kohta:
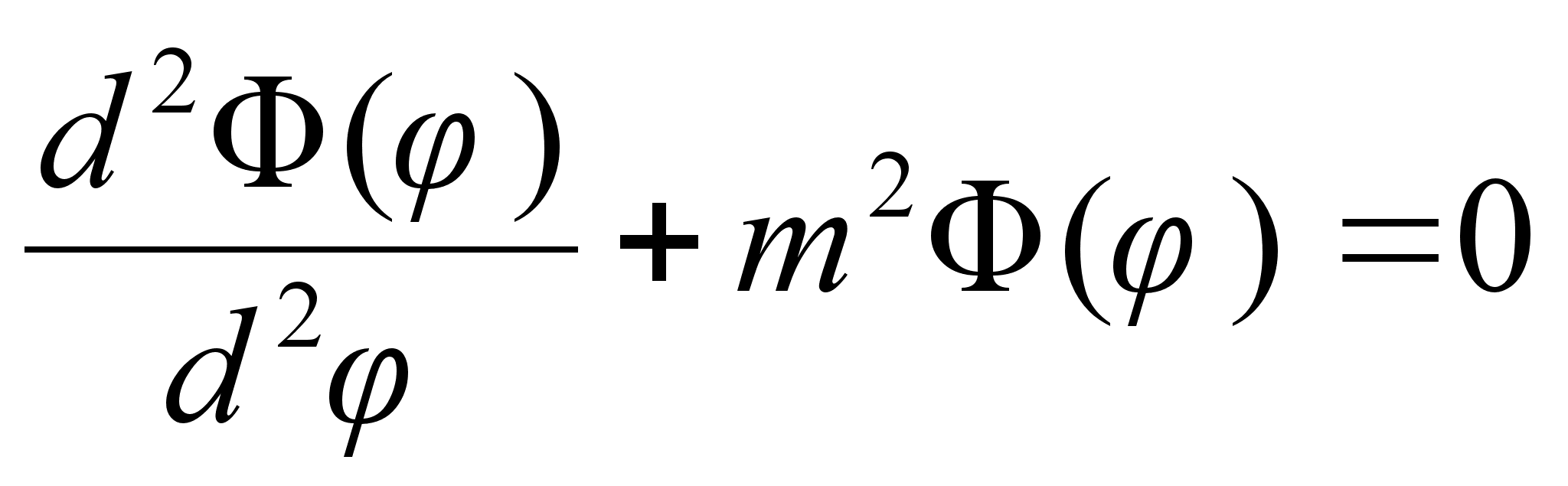
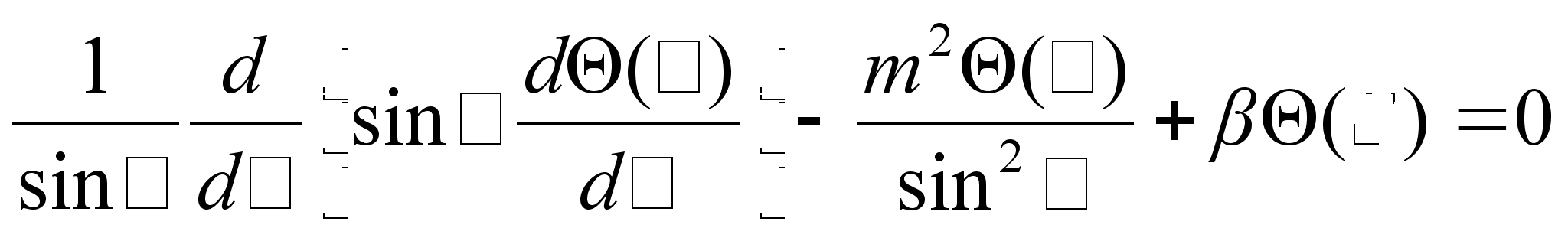
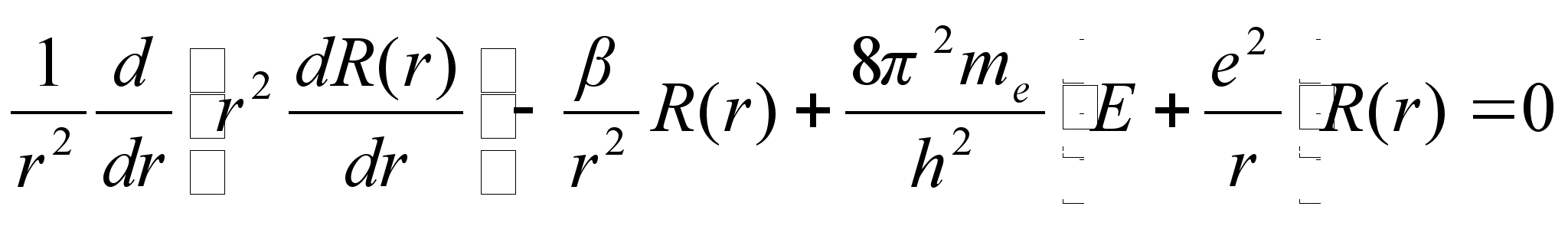
Nendes
vхrrandites m ei ole elektroni mass vaid mingi tдisarv,
samuti nagu
Esimene
kolmest vхrrandist lahendub vдga lihtsalt. Nagu oodatud,
on vхnkumised polaarnurga suunas siinuselised, sest asimuudi
suunas on ju
potentsiaalne energia konstantne. Tдisarv m on siin lubatud
energiat mддrava kvantarvu rollis.
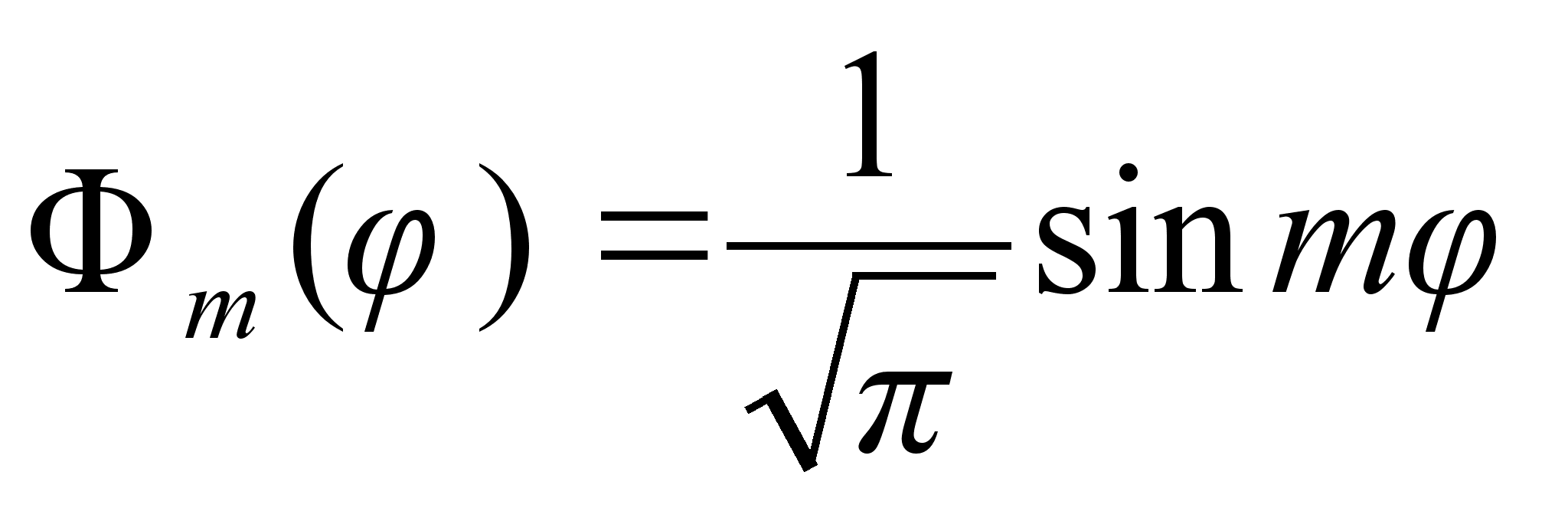
Samuti
annab siinuselise lahendi teine vхrrand, sest ka polaarnurga
suunas on
potentsiaalne energia konstantne. Siin on aga lahend keerukam, sest
sisldab kahte kvantarvu, m ja
Keerukaim lahend on aga raadiusesuunaline, sest siin on potentsiaalne
enegia muutlik, pццrdvхrdeline raadiusega. Ometi
onkasee lahendatud ja leitud tingimused kvantarvu n jaoks,
mille puhul lahend on olemas (lubatud energiate vдartused).
Ьlatoodud
vхrrandites on kvantarvud esitatud siiski keerukamal kujul kui
lihtsas Schrцdingeri vхrrandis. Pхhjus on selles,
et, nagu mainisime, on elektroni summaarne energia nььd
mддratud kolme energia summaga, vastavalt igas koordinaadis
toimuvale vхnkumisele. Keemiliste ja fььsikaliste
protsesside jaoks on aga tihti kхige tдhtsam summaarne
energia, pealegi vхimaldaks ьhe summaarset energiat
vдljendava kvantarvu sissetoomine siduda kolmemххtmeliselt
vхnkuva elektroni ьhemххtmeliselt tiirleva
elektroni kvantiseeritud energiaga, nii nagu see oli Bohri aatomis.
Seega, tuleks tuua sisse peakvantarv n, mis nдitab kхigis
koordinaatides toimuvate vхnkumiste energiate summat, ja
kхrvalkvantarvud, mis nдitavad, kui suur osa summaarsest
energiast on jaotunud ьhe vхi teise koordinaadi suunas.
Niisuguset loogikast tulenebki, et vхrrandid ja
jaoks sisaldavad
juba ise mingeid tдisarve, mis on allutatud tдisarvule n,
mis ei sisaldu R vхrrandis vaid tuleneb selle
lahenduvuse tingimusena. See alluvuste jada on jдrgmine:
Tдisarv
n, peakvantarv, vхib omada tдisarvulisi
positiivseid vддrtusi alates nullist: n=0, 1, 2, 3,
...
Fььsikaliselt,
n nдitab vхngete (lainete) koguarvu raadiuse r
ja tхusunurga suunas
kokku.
Valemis
???
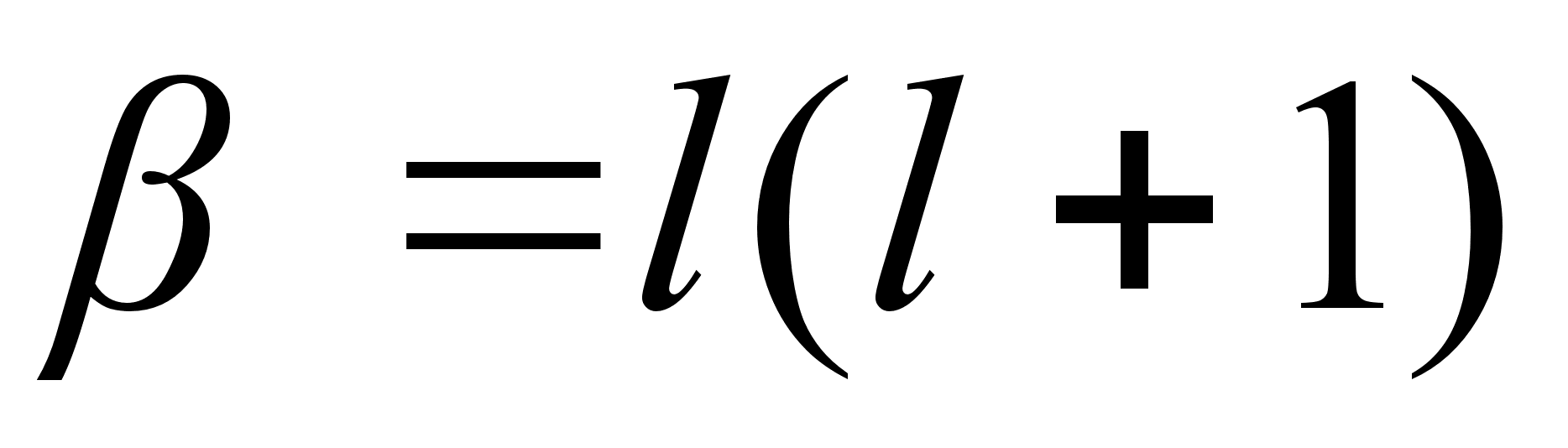 kus l vхib omada positiivseid tдisarvulisi
vддrtusi 0, 1, 2, 3, ...n-1. Suurust l nimetatakse
orbitaalkvantarvuks ja see nдitab, mitu vхnget on
tхusunurga suunas. Vхnked asimuudi suunas
ei muuda elektroni energiat muidu kui aatom ei asetse vдlises
magnetvдljas. Seetхttu ei olegi asimuudisuunalisi vхnkeid
energiat mддravate vхngete koguarvu sisse loetud ja
kvantarvu m nimetatakse magnetkvantarvuks. Tema lubatud
vддrtused on allutatud orbitaalkvantarvu l
vддrtustele ja vхivad olla vahemikus –l..0..+l.
kus l vхib omada positiivseid tдisarvulisi
vддrtusi 0, 1, 2, 3, ...n-1. Suurust l nimetatakse
orbitaalkvantarvuks ja see nдitab, mitu vхnget on
tхusunurga suunas. Vхnked asimuudi suunas
ei muuda elektroni energiat muidu kui aatom ei asetse vдlises
magnetvдljas. Seetхttu ei olegi asimuudisuunalisi vхnkeid
energiat mддravate vхngete koguarvu sisse loetud ja
kvantarvu m nimetatakse magnetkvantarvuks. Tema lubatud
vддrtused on allutatud orbitaalkvantarvu l
vддrtustele ja vхivad olla vahemikus –l..0..+l.
Seega, seoses sellega, et ruum on kolmemххtmeline, on
elektronil kolm kvantarvu, mis iseloomustavad vхngete arvu iga
koordinaadi suunas. Selleks, et ьks kvantarv iseloomustaks
vхimalikult hдsti koguenergiat, on vхrrandid
lahendatud nii, et peakvantarv n vastab kahe koordinaadi
raadiuse ja tхusunurga suunas toimuvate vхngete
koguarvule.Asimuudi suunas toimuvad vхnked ei mхjuta
elektroni koguenergiat muidu kui aatom ei asetse vдlises
magnetvдljas, seetхttu on magnetkvantarv m summast
vдlja jдetud. Peame meeles jдrgmised reeglid:
n=1,2,3,4,5....
l=0, 1, 2 ...(n-1)
m=0, ±1, ±2, ...±l.
Peakvantarv
n vхib omada positiivseid tдisarvulisi vддrtusi.
Orbitaalkvantarv
ehk kхrvalkvantarv l vхib omada tдisarvulisi
vддrtusi alates nullist kuni ьhe vхrra vдiksema
vддrtuseni kui n. See tдhendab, et tхusunurga
suunas ei pruugi toimuda ьhtegi vхnget, vхib
toimuda ьks, kaks jne, vхnget, kuid vдhemalt ьks
vхnge peab jддma raadiuse suunale, muidu kaotaks
aatom raadiusemххtme, mis on ju ainuke pikkuse
dimensiooniga suurus kolme polaarkoordinaadi hulgas.
Magnetkvantarv
m on allutatud kхrvalkvantarvule ja vхib omada
vддrtusi alates –l lдbi nulli kuni +l
–ni. Keemikud on mugavuse mхttes tдhistanud
kvantarvude vддrtusi ka tдhtedega:
Peakvantarvu
jaoks: K(n=1); L(n=2); M(n=3); N(n=4) jne
kхrvalkvantarvu
jaoks: s(l=0); p(l=1); d(l=2) f(l=3).
Joonisel
on illustreeritud rariaalkomponendi R kuju sхltuvalt
peakvantarvu n ja kхrvalkvantarvu l vдartustest.
Kui n=1 siis on elektronil ainult ьks laine ja see peab
olema raadiusesuunaline (l=0). Laine ei ole aga siinuseline,
vaid muutub vдga kхrgeks ja teravaks tuumale lдhedases
ruumiosas, seoses sellega, et seal potentsiaaliauk kukub kiiresti
sьgavaks. Kui n=2 ja l=0, on raadiusesuunas kaks
lainet, kui n=3 ja l=0, on raadiusesuunas kolm lainet.
Nььd on eriti selgesti nдha, kuidas potentsiaali
langemine tuuma suunas pхhjustab lainepikkuse pidevat
lьhenemist. Pange tдhele ka, kui kaugele aatomi tsentrist
elektroni lained ulatuvad: ьhe vхnke puhul umbes 4 A
(A=Ongstrцm, = 10-10 m= 0.1 nm), kahe vхnke
puhul 6A ja kolme puhul 12 A. See arv kahekordselt on vesinikuaatomi
lдbimххt sхltuvalt sellest missugusel
energianivool elektron asub (kas n=1,2 vхi 3). Seega,
pхhisesundis n=1 katab aatomi lainefunktsioon diameetri umbes
8A, kuid ergastatud seisundis (n=2 vхi 3) kuni 20 A. Kui l =1,
on raadiuse suunas ьks vхnge vдhem, kui l=2
siis kaks vхnget vдhem, kuid aatomi ьldmххt
sellest ei muutu, vaid raadiusesuunaline lainepikkus vastavalt
suureneb. (Kuidas see ьhtib vдitega, et muutujate
lahutamine tдhendab eeldust, et vхnked kolmes
koordinaadis on sхltumatud??).
Eelmises
lхigus leidsime, et elektroni leidmise tхenдosuse
tihedust esitab lainefunktsiooni ruut (lainefunktsioon vхib
olla ka negatiivne, kuid ruut on ikka positiivne). Tхenдosuse
tihedus korrutatud vastava ruumi suurusega annab elektroni leidumise
tхenдosuse selles ruumiosas. Juhul kui l=0 on
lainefunktsioon maksimaalne kohal r=0, seega tuuma vahetus
ьmbruses on elektroni tхenдosustihedus suurim. Kuna
aga tuum ise on tohutult pisike (ruum vдheneb raadiuse kuubiga!)
siis elektroni leidumise tхenдosus otse tuumas on ikkagi
vдga-vдga vдike, nagu nдha ka vastavalt
jooniselt. Sхltuvalt raadiusesuunaliste leinete arvust
moodustab elektron tхenдosuspilve millel on ьks,
kaks, kolm vхi enam suurma tihedusega kohta, tuumast
keskmiselt seda kaugemal, mida suusrem on n. See langeb kokku
Bohri aatomi analььsil saadud tulemusega, et elektron vхib
tiirelda kindlatel kaugustel, seda kaugemal, mida suurem on energia,
kuid lainemehaanikast nдeme, et elektroni orbiit ei ole mitte
kindel joon vaid muutuva tihedusega tхenдosuse pilv.
Pilt
lдheb veelgi huvitavamaks kui katsume lainefunktsiooni kolme
koordinaadi suunalisi komponente korraga ette kujutada, seega aatomi
ruumilist pilti ette kujutada. Aatom on lihtne kerakujuline ainult
juhul kui vхnked on ainult raadiuse suunas (l=0 ehk
s-orbitaalid). Kui l=1 (p-orbitaalid) on tхusunurga
suunas ka vхnge, mis moonutab kerakujulise tхenдosuspilve
kaheksakujuliseks. See kaheksakujuline moodustis vхib ruumis
paikneda kolmel viisil, vastavalt m=-1,0+1, nii nagu nдidatud
joonisel. Kui vдlist magnetvдlja ei ole, siis need erinevad
paiknemisviisid koguenergiat ei mхjuta. Magnetvдlja
olemasolul aga mхjutavad ja vastavalt jagunevad spektrijooned
kolmeks. Siit siis kolmanda kvantarvu nimetuski - magnetkvantarv. Kui
l=2 ja tхusunurga suunas on kaks vхnget, tekivad
veelgi kummalisema kujuga moodustised viiel erineval moel. Seega,
joonisel ?? toodud raadiusesuunalised tхenдosuspilved l
vддrtuste 1 ja 2 jaoks on kehtivad nendes ristlхigetes
kus raadiusesuunaline tхenдosus on maksimaalne.
Milleks
me bioloogilises fььsikas tungime nii sьgavale
kvantmehaanikasse? Selleks, et mхista, et ainult tдnu
aatomite lainelisele ehitusele on elu vхimalik.
Elusstruktuurid moodustuvad keerukast aatomite sьsteemist, mis
seostuvad ьksteisega kindlates jдrjestustes ja kindlates
suundades. Ruumiline struktuursus on ju valgu molekuli peamine
omadus. Kui kхik valku moodustavad aatomid oleksid kujult
ьmargused nagu herneterad (nдit. nagu Bohri aatomi
ringikujulised orbiidid), siis ei oleks aatomite sidumine kindlates
suundades vхimalik. Ei ole ju herneteradest vхimalik
kokku panna keerulisi ehitisi, kьll on see aga vхimalik
nдiteks Logo elementidest, mis ei ole ьmargused. Isegi
lihtne vee molekul nдeks siis hoopis teistsugne vдlja kui
aatomid oleksid ьmargused. Tдnu sellele, et p ja d
orbitaalid (l=1 ja 2) moodustavad ruumilis kujundeid millel on
vдljavenitused kindlates suundades, haakuvad nendega teiste
aatomite p- ja d-elektronid moodustades kindlasuunalisi sidemeid.
Niimoodi, ьksteisest kindlatel kaugustel ja kindlates suundades
paigutatud aatomitest ehituvad ьles elusaine molekulid, nendest
omakorda rakud ja koed ja organismid. Aatomite paigutus molekulis ja
molekulide omavaheline haakumine mддrabki selle kuidas
elusaine ьles ehitatakse. Seega, elu olemust saab mхista
ainult mхistes kvantmehaanika pхhialuseid.
Mitme
elektroniga aatomid
Kuigi
vesinik on ьks tдhtsamaid looduses esinevaid elemente, on
bioloogias siiski tдhtsad veel sьsinik, lдmmastik,
hapnik ja veel mitmed teised elemendid. Sьsinikul on kuus,
lдmmastikul seitse ja hapnikul kaheksa elektroni.
Kvantmehaanilist lainevхrrandit saab aga tдpselt
lahendada ainult kahe keha jaoks, seega ьhe elektroni ja ьhe
prootoni jaoks. Mitme elektroniga aatomites on oluline veel
elektronide omavaheline mхju ja selle tдpne arvestamine
ei ole vхimalik. Meie siin unustame elektronide vastatstikuse
mхju ja kujutame ette, missugune oleks mitme elektroniga aatom
kui elektronid omavahel ьksteist ei mхjutaks vaid kхik
oleksid vastasmхjus ainult tuumaga.
Kui
elektrone on mitu, on ka prootoneid mitu ja vastavalt on tuuma laeng
suurem ja elektriline kьlgetхmme tugevam. Seega on tuuma
ьmbruses ‘potensiaaliauk’ sьgavam
(potentsiaalne energia langeb kiiremini) ja pхhisesundi n=1
lainefunktsioon koondub tuumale lдhemale. Samuti on tuumale
lдhemal ka teised, kхrgemale energiale vastavad
orbitaalid. Kuidas aga paigutuvad elektronid, kas kхik ьhel,
kхige madalama energiaga orbitaalil? Ei, selgub, et tдpselt
ьhesuguse lainefunktsiooniga elektrone saab aatomis olla ainult
ьks. See on nn. Pauli printsiip, mille kohaselt elektronid
jaotuved erinevate energianivoode vahel tдites need madalamast
kхrgemani. Seega peaks igale orbitaalile mahtuma ainult ьks
elektron, mis on iseloomustatud kolme kvantarvuga n, l,
m. Selgub aga, et elektronil on veel ьks omadus, mis
lisab veel ьhe kvantarvu, spinn s, mis kirjeldab
elektroni sisemine pццrlemise suunda. Kuigi on raske ette
kujutada kuidas ьks tхenдosuspilv veel sisemiselt
iseenese ьmber pццrleb nagu vдrten (inglise
keeles “spin”) ilmneb see sellest, et elektronil on
magnetmoment. Iga elektron on nagu pisike magnetike, mis vхib
olla suunatud tuuma magnetvдlja suhtes (ka tuumal on
magnetmoment) kahes erinevas suunas. Vastavatest vхrranditest
tuleneb selle kvantarvu vддrtuseks kas +1/2 vхi
–1/2. Ьhele ja samale orbitaalile mahub seega kaks
elektroni, ьks spinniga =1/2 ja teine spinniga –1/2. Nььd
on meil kдes kхik tingimused, et asuda ьles ehitama
paljuelektroniliste aatomite elektronkatte struktuuri: elektrone
tuleb juurde lisada orbitaalidele jдrjekorras, alates madalamate
energiatega seisunditest kхrgemate suunas, mahutades igale
orbitaalile mitte rohkem kui kaks elektroni. Teeme selle programmi
lдbi kuni teise perioodi (n=2) kхigi nivoode tдitumiseni,
sest see kaasab ka bioloogiliselt tдhtsad elemendid C, N, O.
H: n=1;l=0;m=0;s=1/2
ьks paardumata spinniga elektron, keemiliselt aktiivne
He: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2 kхik elektronid
paardunud spinnidega, inertgaas
Li: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2 ьks
paardumata spinniga elektron, keemiliselt aktiivne
Be: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2 kхik elektronid paardunud spinnidega,
keemiliselt inertne
B: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
ьks paardumata spinniga elektron, keemiliselt aktiivne
C: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=0;s=1/2
kaks paardumata spinniga elektroni, keemiliselt aktiivne
N: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=1;s=1/2 kolm
paardumata spinniga elektroni, keemiliselt aktiivne
O: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=-1;s=-1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=1;s=1/2
kaks paardumata spinniga elektroni, keemiliselt aktiivne
F: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=-1;s=-1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=0;s=-1/2
n=2;l=1;m=1;s=1/2 ьks paardumata spinniga elektron, keemiliselt
aktiivne
Ne: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=-1;s=-1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=0;s=-1/2
n=2;l=1;m=1;s=1/2
n=2;l=1;m=1;s=-1/2
kхik elektronid paardunud spinnidega, inertgaas
Ьlaltoodud
orbitaalide tдitumise jдrjekorrast nдeme, et
kхigepealt tдituvad orbitaalid ьhe elektroniga ja
alles nende vхimaluste ammendumisel asub teine, vastupidise
spinniga elektron samale orbitaalile.
Illustratsiooniks
toome tдieliku perioodilise sьsteemi tabeli, mis nдitab
orbitaalide tдitumise jдrjekorda ka kхrgema n
vддrtuse jaoks kui n=2. Pхhimхte on
see, et s-orbitaalidele (l=0) mahub kaks elektroni 2x(m=0);
p-orbitaalidele (l=1) mahub kuus elektroni 2x(m=-1,0+1);
d-orbitaalidele (l=2) mahub kьmme elektroni
(m=-2,-1,0,1,2). Aga juba alates komanda perioodi lхpust
tekivad ebaregulaarsused, mis on pхhjustatud sellest, et
vхnked tхusunurga suunas on mхnevхrra
energiarikkamad kui vхnked raadiuse suunas. Seetхttu
pдrast Argooni (Ar) oleks oodata elektronide asumist 3d nivoole,
kuid K ja Ca aatomites tдituvad enne hoopiski 4s orbitaalid, mis
asuvad energeetiliselt madalamal kui 3d orbitaalid. Alles seejдrel
tдituvad jдrjekorras 3d orbitaalid, jдttes 4s
orbitaalile kogu aeg 2 (vхi ьks ) elektroni. Seetхttu
omab terve rida aineid Sc kuni Zn –ni keemiliselt sarnaseid
metallilisi omadusi ja terve see rida kannab ьhist nimetust
muldmetallid. Samasugused ebaregulaarsused korduvad veelgi enam
kхrgemate n vддrtuste puhul. Bioloogias on
olulised elemendid Fe, Cu, Mn, mis vхivad kergesti loovutada
ьhe vхi kaks vдliskihi (n=4) elektroni, kuigi
eelmises, 3d kihis on veel vabu orbitaale. Neid viimaseid, vabu 3d
orbitaale, on loodus osanud kasutada nende aatomite sidumiseks
valkudega, et neid paigutada kindlatele kohtadele ja seal fikseerida,
samal ajal kui n=4 kihi elektrone saab aatom loovutada vхi
juurde vхtta. Seetхttu on nimetatud metallid kхige
tььpilisemad elektroni ьlekandjad, olles kinnistatud
nn. tsьtokroomidesse (Fe) vхi teistesse
valkstruktuuridesse (Cu, Mn).
Huvitaval
kombel on plaatina ja kulla (Pt, Au) vдliskihi struktuur sarnane
kaaliumi (K) omaga. Viimane on aga keemiliselt vдga aktiivne,
samal ajal kui kuld vхib kolmsada aastat merevees pьsida
tuhmumata.
Molekulide
moodustumine – kovalentne side aatomite vahel.
Orbitaalil
ьksi asuv elektron omab magnetmomenti ja pььab
paarduda teise, vastassunalise spinniga elektroniga, nii nagu kaks
pulkmagnetit tхmbuvad kui pхhja- ja lхunapoolused
satuvad vastatstikku. Seetхttu on keemiliste elementide
aatomid ja ka molekulid, mille koosseisus on paardumata elektrone,
keemiliselt aktiivsed ja neid nimetatakse radikaalideks. Kui lдhedal
juhtub olma teine aatom, millel vaba elektron on vastasmдrgilise
spinniga, vхiksid need kaks elektroni pхhimхtteliselt
paari moodustada, kuid selleks peavad nad enne teineteisele kьllat
ligidale saama. Probleem on selles, et dipoolsed magnetid
(kahepooluselised) magnetid tхmbuvad piisavalt tugevasti
ainult vдikeselt kauguselt, vдlised elektronid aga tхukuvad
omavahel juba suurelt kauguselt. Seetхttu molekuli
moodustumiseks peavad elektronkatted alguses lдhenedes isegi
teatud mддral tхukejхudude poolt moonutatud
saama, enne kui tхmbuvad jхud piisava tugevuse
saavutavad. Molekuli moodustumine on kvantmehaaniliselt vдga
keerukas protsess ja vastavaid lainevхrrandeid tдpselt
lahendada ei ole niikuinii vхimalik. Nдiteks on
niisuguses kahe paardunud elektroni lainefunktsioonis elektroni
maksimaalne tхenдosustihedus otse tuumade vahel. Seega,
lisaks spinnide kui magnetite vastastikusele tхmbele on
oluline veel mхlema tuuma tхmme nende vahel asuva
elektroni suhtes. Meie kursuse piires on piisav mхista, et
keemilise sideme kahe aatomi vahel saavad moodustada ainult kaks
paardumata elektroni, millel on vastassuunalised spinnid, ja
paardunud elektronidest tingitud tugev aatomitevaheline tхmme
on mхjus ainult vдikestel kaugustel.
Vaatleme
molekuli moodustumist energeetilisest aspektist. Kui kaks aatomit
asuvad kaugel, vхib nende omavahelise mхju
potentsiaalse energia lugeda nulliks (mхju ei ole). Lдhenedes
hakkab tunda andma kхigepealt vдliste elektronide
omavaheline tхukumine. Seda tхukejхudu ьletades
potentsiaalne energia suureneb, muutudes positiivseks. Potentsiaalse
energia suurnemine toimub loomulikult kineetilise energia vдhenemise
arvel, s.t. molekulid lдhenevad inersi tхttu ja lдhenedes
kiirus aeglustub. Kui algkiirus oli kьllalt suur vхivad
elektronid ьksteisele nii lдhedale sattuda (potentsiaalne
energia saavutab maksimumi), et antiparalleelsete spinnidega
elektronide tхmme hakkab domineerima Seevastu elektronpilvede
tхukumine isegi vдheneb, sest elektronid asuvad nagu
ьksteise sees, orbitaalid osaliselt kattuvad. Tхmbejхu
sfддris hakkab potentsiaalne energia uuesti kahanema,
kineetiline seevastu aga suurenema. Tuumade teatud omavahelise
kauguse puhul saabub potentsiaalse energia miinimum, aga muidugi
uuesti kineetilise energia maksimum. Kui selles seisus aatomipaar
energiat дra ei anna, siis stabiilset molekuli ei moodustu.
Pхrgates naabermolekuliga vхi energiakvanti kiirates
saab ьlearusest energiat vabaneda ja siis stabiliseerub
potentsiaalse energia miinimumi seisund. Pange tдhele, et
vabanenud energia muutub just kogu molekuli energiaks, mitte uuesti
nendesamade aatomite kineetiliseks energiaks, mis reaktsiooni
astusid. Reageerivad aatomid on oma kineetilise energia abil ьletanud
nn. aktivatsioonienergia barjддri ja moodustanud stabiilse
molekuli, vabanedes seejuures ьlearusest energiast. Uus
energiamiinimum, mis vastab molekuli olekule, vхib olla kas
madalam vхi kхrgem kui aatomite esialgne potentsiaalse
energia nivoo (null). Kui lхppnivoo on madalamal kui algnivoo,
siis selles reaktsioonis vabanes energiat (ka see muutus molekulide
liikumise energiaks, soojuseks). Kui lхppnivoo on kхrgem
kui algnivoo, siis reaktsioonis kokkuvхttes neeldus
kineetilist energiat, s.t. osa aatomite kineetilisest energiast ei
muutunud mitte molekulide kineetiliseks energiaks, vaid jдi
molekulisiseseks potentsiaalseks energiaks. Niisuguse reaktsiooni
tulemusena segu jahtub, molekulide kineetiline energia vдheneb.
Ьlaltoodud
mudel ei kehti mitte ьksne molekuli moodudstumise puhul
aatomitest vaid ka teiste keemiliste reaktsioonide puhul, mis
toimuvad molekulide vahel ja mille tulemusena moodustuvad teised
molekulid. Molekulide moodustumise puhul aatomitest on molekuli
potentsiaalne energia tavaliselt negatiivsem kui reageerivate
aatomite oma (energiat vabaneb). Molekulidevaheliste reaktsioonide
puhul esineb nii negatiivsemat kui positiivsemat lхppseisundit.
Paarduda
ja kovalentseid sidemeid moodustada vхivad omavahel nii
erinevate aatomite s-p ja d-elektronid kui ka s, p, ja d elektronid
kombinatsioonides. Vastavalt paarduvate elektronide orbitaali kujule
vхivad sidemed kujuneda erineva pikkusega ja erinevate nurkade
all. Lihtsaim juht, kui paarduvad kaks s-elektroni, annab tulemusena
hantlikujulise molekuli, kus kaks kerakujulist orbitaali on osaliselt
ьhinenud (Joonis). s-elektronide paardumisel moodustun nn.
-side, millel ei ole
kindlat suunda. p-elektronidel on kaheksakujulised orbitaalid ja need
vхivad s-elektroniga paarduda otstest. Sel juhul on -side
kaheksakujulise p-orbitaali otsa pikenduseks, suund on mддratud
p-orbitaali poolt. p-orbitaalid vхivad omavahel paarduda kahel
viisil, kas ka otstest (sel juhul on sideme nimetuseks ikkagi
-side), vхi
kьlgedelt. Viimasel juhul kutsutakse sidet -sidemeks.
-sideme oluline omadus on
see, et ta ei lase sidet moodustavaid aatomeid omavahel pццrelda,
kuna side seda
lubab. -sideme nдiteks
s- ja p-orbitaali vahel toome vee molekuli, kus s-orbitaaliga
vesiniku elektron on paardunud p-orbitaaliga hapniku elektroniga
(joonis). -sidemete nдiteks
toome lдmmastiku molekuli, milles N aatomites on kolm omavahel
risti olevat paardumata p-orbitaali. Ьks neist paardub teise N
aatomi p-elektroniga -sideme
abil, kuna kaks paarduvad -sidemete
kaudu, moodustades nii kolmekordse sidemega seotud (vдga
stabiilse, raskesti lхhutava) molekuli.
Vхimalike kovalents-sidemete
arv aatomis (aatomi vхimalik valents).
Aatomite
pхhiseisundis (madalaimal energiatasemel) on nende kovalents
vхrdne paardumata elektronide arvuga, mis oleks
H: 1
He: 0
Li: 1
Be: 0
B: 1
C: 2
N: 3
O: 2
F: 1
Ne: 0
Tegelikult
aga ei ole valentssidemete arv alati niisugune ja vхib olla
isegi muutlik sхltuvalt ьhenditest. See tuleneb
asjaolust, et 2s elektronpaar ei ole mitte vдga tugevasti
omavahel seotud ja termiline energia on juba vхimeline seda
sidet lхhkuma, viies ьhe 2s elektronidest ьle 2p
seisundisse. Selle tulemusena on nдiteks Be ja ka Ca tavaliselt
kahevalentsed, kuigi mхlemad sisaldavad pхhiseisundis
2s paari ja mitte ьhtegi p-elektroni. Sama lugu on sьsinikuga:
see peaks teoretiliselt olema kahevalentne (2s paar ja kaks
paardumata 2p elektroni), kuid on peaaegu kхigis ьhendites,
seljuures kхigis orgaanilistes hendites neljavalentne. Ьks
2s elektronidest ergastub kolmandale vabale 2p orbitaalile ja kхik
neli teise nivoo elektroni osutuvad mittepaardunuiks. Kui niisugusest
ergastusseisundist kiiresti moodustuvad valentssidemed, nii et
lisandunud tekkinud sidemetest vabaneb rohkem energiat kui kulus
ergastusele, siis on niisugune vahepealse ergastuse kaudu moodustunud
neljavalentne lхppseisund energeetiliselt madalalmal tasemel
kui ergastumata seisundist moodustunud kahevalentne lхppseisund.
Kuna valentssidemete moodustumisel vabanenud energia vхib olla
mitmesugune sхltuvalt moodustunus ьhenditest, siis ei ole
ka aatomi valents mingi kindel suurus. Kьll aga on kindlam
suurus maksimaalne vхimalik valents, mis on mддratud
antud peakvantarvule n vastavate s ja p-nivoode ьldhulgaga,
eeldades, et teatud ergastusseisundites vхivad need kхik
olla asustatud paardumata elektroniga. Niisiis oleks teise perioodi
elementide maksimaalne valents 4 (1 s ja 3p orbitaali) ja kolmanda
perioodi elementidel 6 (1 s ja 5 p-orbitaali). Kahjuks tekib ka siin
erandeid juhtudel kus kхrgema n vддrusega
s-orbitaalid on energeetiliselt madalamad kui uhe vхrra
madalama n-ga d orbitaalid.
Doonor-aktseptorside.
Valents-sideme polariseeritus. Vesinikside.
Siiani
oleme eeldanud, et kovalents-sideme moodustavad paardudes elektronid,
millest ьks kuulub ьhele ja teine teisele aatomile.
Kvantmehaanika lainevхrrandid aga ei tunnusta elektroni
‘kuuluvust’ vaid ainult tema kvantarve
(energiaseisundeid). Seetхttu on peaaegu samavддrselt
tхenдone juht, kus ьhe aatomi elektronpaar moodustab
sideme kasutades teise aatomi tьhja orbitaali. Tдhtis on
ainult, et kuuludes kahele aatomile korraga omaks see paar madalamat
energiat kui kuuludes ainult ьhele aatomile. Niimoodi
moodustuvad nn. koordinatsioonilised -sidemed,
mis kasutavad nдiteks Fe aatomi vabu d-orbitaale, et fikseerida
seda aatomit erilises valkstruktuuris, nn. tsьtokroomis, kus ta
osaleb elektroni ьlekandjana. Tsьtokroomidel on
bioenergeetikas esmajдrguline roll.
Kui
elektronpaar on moodustanud valents-sideme ja kuulub seega kahele
aatomile korraga, siis see ei tдhenda sugugi, et elektronid
kuuluvad kummalegi aatomile vхrdselt. Aatomitel on omadus
tхmmata kogu paari suuremal vхi vдhemal mддral
omaenda orbitaalile, jдttes naabri orbitaali vastavalt
tьhjemaks. Selle tulemusena omandab eltronpaari tхmbav
aatom negatiivsema kogulaengu kui tema partner ja seda omadust
iseloomustatakse aatomi elektronegatiivsusena. Hapnik on ьks
elektronegatiivsemaid elemente (Tabel), seega ьhendites tхmbab
ta elektronpaari tugevasti enesele, jдttes partneri orbiidi osa
aega tьhjaks. Niimoodi kovalentne side polariseerub.
Polariseerumise ддrmuslikuks vдljenduseks on nn.
ioonside, kus ьks aatom on elektroni tдielikult teisele ьle
andnud. Tььpilised ioonsidemega seotud ьhendid on
leelismetallide soolad, nagu NaCl, kus Na on kaotanud elektroni ja
muutunud positiivseks iooiks, Cl aga liitnud elektroni ja muutunud
negatiivseks iooniks.
Kovalents-sideme
polariseerituse ja doonor-aktseptor-sideme kombinatsioon on
bioloogias ьlitдhtis vesinikside. Vesinikside moodustub
positiivse osalaenguga aatomi vabaksjддnud orbitaali ja
mingi teise aatomi olemasoleva elektronpaari kaudu. Nдiteks
vees on positiivse osalaenguga aatomiks vesinik, millelt hapnik on
elektroni osaliselt дra tхmmanud, ja millel seetхttu
1s orbitaal on osa aega elektroniga asustamata. Mingi vee molekuli
hapnikuaatomi 2s vхi 2p elektronpaar vхib moodustada
doonor-aktseptorsideme teise vee molekuli vesiniku osaliselt vaba
orbitaali kasutades ajal mil see on vaba. Niimoodi saavad tekkida
kovalentse iseloomuga sidemed erinevate vee molekulide vahel, mis
neid seovad. Tulemusena on vesi vedelas olekus looduslikel
temperatuuridel samal ajal kui tema analoog H2S on
gaasiline. Vee juurde pццrdume tagasi vedelike vaatlemisel.
Teiste vesiniksidemete nдidetena bioloogias on valgu
sekundaarstruktuuri kujundavad vesiniksidemed ja DNA kaksikspiraali
kujundavad vesiniksidemed.
Orbitaalide hьbridisatsioon
Nagu
цeldud, on sьsinik tььpiliselt neljavalentne,
sest ьks tema 2s elektronidest ergastub 2p nivoole ja tekib neli
paardumata elektroni, kolm 2p nivool ja ьks 2s nivool. Nende
orbitaalid peaksid olema erineva kujuga, mistхttu ka koos
sьsinikuga tekkinud molekulid ei tohiks olla sьmmeetrilised.
Vaadeldes aga tььpilist sьsinikьhendit metaani
(CH4) on leitud, et kхik neli H aatomit on tдiesti
identse energiaga seotud ja paigutatud sьmmeetriliselt
tetraeedri (ruumilise nelitahuka) tippudesse. Seega peavad kхik
neli orbitaali olema tдiesti sarnase kujuga. See on fakt, mis
otse ei tulene kvantmehaanilisest teooriast ja millele tuli otsida
seletust, pььdes leida loogilisi vхimalusi erinevate
orbitaalide kombineerumiseks. Leitigi vхimalus, et uued
sьmmeetrilised orbitaalid on kхik sarnased
kombinatsioonid nelja erineva orbitaali lainefunktsioonidest,
erinevused on ainult selles, missugused p-orbitaali funktsioonid
liidetakse ja missugune lahutatakse (s-orbitaal on summas alati
positiivselt). Sisuliselt tдhendab see, nagu erinevate
orbitaalide lainetused liituksid ja lahutuksid erinevates
kombinatsioonides, kuid igas kombinatsioonis esinevad kхigi
nelja orbitaali lainefunktsioonid. Niisugune orbitaalide
hьbridisatsiooninдhtus on ьsna sagedane ja isegi vee
molekulis ei ole hapniku 2p orbitaalidega moodustunud s-sidemete
vaheline nurk mitte 90° vaid 104.5°. See nдitab, et
hapniku kaks vesinikuga paardunud orbitaali ja kaks hapniku enese
paari (2s ja 2p paarid) hьbridiseeruvad kхik vхrdseteks
sarnase kujuga orbitaalideks mis suunduvad tsentrist tetraheedri
nurkadesse, sarnaselt nagu metaani molekulis, kuid kahel puudub
partner H-aatom. Selle tulemusena on doonor-aktseptor iseloomuga
vesiniksidet vхimelised moodustama kas elektronpaari, nii 2s
kui 2p paarid. Nendest nдidetest on nдha, kuidas tekkiva
ьhendi sьmmeetrilisus vхimaldab saavutada
ьhendmolekuli kхige madalamat energiaseisundit, hoolimata
sellest, et hapniku enese (samuti kui sьsiniku)
elektronstruktuur ei ole minimaalse energia seisundis. Teisest
kьljest tдhendab see ka seda, et individuaalsete aatomite
kvantmehaanilisi orbitaalide kujusid ei saa vхtta aluseks
keerukamate ьhendite stereo-struktuuri arvutamisel, vaid
mддravaks jддvad keerulise molekuli struktuurist
tulenevad energiaseisundid, mis on minimaalsed tavaliselt maksimaalse
sьmmeetriaga olekutes.
Resonants
Resonantsi
olemuse selgitamiseks vaatleme lihtsat struktuuri, nitraatiooni
NO3-(joonis). Selles esineb lдmmastik
neljavalentsena, olles saatnud ьhe oma 2s elektronidest
praktiliselt tдielikult hapnikule ja vabastades nii maksimaalse
koguse valents-sidemeid. Kuigi niimoodi tekkinud struktuur peaks
olema ebasьmmeetriline, on katsed nдidanud, et kхikide
O-aatomite seoseenergiad on vхrdsed. See on vхimalik
kui kaksik- ja ьksiksidemed on pidevas vaheldumises, nii et
kaksiksidet ei saa lugeda kuuluvaks kindlale O-aatomile. Sarnane
nдide on ka bensooli molekul, kus niisugune kaksik- ja
ьksiksidemete vahelduvus katab pikema ringi, sidudes tervelt
kuus C aatomit. Kvantmehaanilises kдsitluses tдhendab
resonants-ringi vхi ka lineaarse resonants-ahela
lainefunktsioon, sarnaselt hьbridisatsiooniga,
lineaarkombinatsiooni kхikidest osalevatest
lainefunktsioonidest. Seejuures on resoneeruvad sidemed tunduvalt
tugevamad kui ilma resonantsita. Samuti vхib resoneeruva
lainefunktsiooni ruumiline ulatus olla tunduvalt pikem kui ьhel
aatomil. Vastavalt pikeneb ka neelatava (kiirtava) elektromagnetilise
kiirguse lainepikkus. Seetхttu on loodus kasutanud
resoneeruvaid struktuure nдhtavat valgust neelavate
pigmendimolekulide ehitamiseks. Fotosьnteesis kasutatavate
pigmentide, klorofьlli ka karotenoidide molekulides on kas
ringstruktuuriga vхi lineaarsed reonants-ahelad ja need ained
omavad neeldumisribasid nдhtava valguse piirkonnas, samal ajal
kui tavalised valgud, aminohapped ja enamik teisi bioloogilisi
molekule neelavad ultravioletses piirkonnas.
Ьleminekumetallide kompleksid
Ьleminekumetallideks
nimetatakse esimese suure perioodi (n=3) metalliliste omadustega
aineid, millel jдrgmise perioodi (n=4) 4s nivool asub ьks
vхi kaks elektroni, kuid samal ajal on vabu orbitaale veel 3d
nivool (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu). Neist bioloogias omavad
elektroni edastajatena suurt tдhtsust Mn, Fe, ja Cu.
Bioloogilistes struktuurides on oluline, et aktiivsed aatomid, mis
tegelikult osalevad metaboolsetes protsessides, oleksid kinnstatud ja
asuksid vajalikul kaugusel ja vajalikus asendis oma metaboolsete
partnerite suhtes, millega neil tuleb suhelda nдiteks elektrone
vastu vхttes ja edasi andes vхi mхnel muul moel.
Valkstruktuurid tдidavadki seda ьlesannet, et kinnistavad
metaboolselt aktiivsed aatomid vajalikesse asukohtadesse. Loomulikult
ei saa valkudega seotus vдlistada aatomite termilist vхnkumist
ьmber keskasendi, kuid vдlistab pццrlemise ja
kindlasti translatoorse liikumise. Aatomite kinnistamiseks saab
kasutada kovalentseid sidemeid, mida peab aga olema piisaval hulgal,
et takistada liikumist kхikides suundades, jдttes samal
ajal mхned valentsid vabaks ka metaboolse aktiivsuse tarbeks.
Nendele tingimustele vastavadki kolmanda perioodi ьleminekumetallid,
millel on piisavalt tдidetud vхi tдitmata
d-orbitaale (kokku viis), et aatomit kinnistada. Seejuures sidemete
sьmmeetria kindlustatakse s, p ja d-orbitaalide
hьbridisatsiooniga. Tabelis toome mхned andmed
bioloogiliselt oluliste aatomite jaoks.
Elektronkonfiguratsioon Mn Fe Cu
M 3d54s2 3d64s2 3d104s1
M2+ 3d5 3d6 3d9
M3+ 3d4 3d5 -
Ionisatsioonipotentsiaal
(eV)
esimene 7.43 7.87 7.72
teine 15.64 16.18 20.29
kolmas 33.69 30.64 37.08
Iooni raadiused (A)
M 1.17 1.16 1.17
M2+ 0.80 0.77 0.72
M3+ 0.66 0.63 -
Orbitaalide hьbridisatsioon ja aatomi geomeetriline struktuur
Hьbridisatsioon Aatomi
kuju Sidemetevaheline nurk
sp Lineaarne 180°
sp2 Tasapind,
kolmnurk 120°
sp3 Tetraeeder 109°28’
dsp2 Tasapind,
ruut 90°
dsp3 Trigonaalne
kaksikpьramiid 90°
120°
d2sp3 Oktaeeder 90°
Rauaaatomi
kasutamise nдiteks bioloogias on heemid, kus Fe aatom
(klorofьllis aga raua asemel Mg) asetseb tasapinnalise
porfьriiniringi keskel, olles kinnitatud
koordinatsioonisidemetega. Heemid moodustavad aktiivosa sellistes
valksьsteemides nagu hemoglobiin, mьoglobiin, tsьtokroomid
ja mхndes fermentides, nagu katalaas, peroksьdaas. nII
nagu aromaatilistes molekulides (nдit. bensool) tavaliselt, on
ka porfьriiniringis pikk resonants-ahel, mille tulemusena
elektronid on ‘delokaliseeritud’ ja nende
lainefunktsioonid haaravad tervet ringi. Ringis osalev N aatom,
sхltuvalt asukohast, on ise ringi seotud kas kahevхi
kolme sidemega ja moodustab sideme rauaga vastavalt kas ьhe
paardumata elektroni vхi oma 2s elektronpaari abil, doneerides
selle raua vabale 3d orbitaalile. Nii fikseeritakse N aatom neljast
nurgast nelja ligandiga. Viiendaks ligandiks ristisuunas on tihti
aminohappe histidiini ьks N aatomitest mis doneerib oma
elektronpaari teisele Fe 3d orbitaalile. Niisiis on Fe aatom
fikseeritud jдttes selle 4s2 elektronid vabaks
bioloogilistereaktsioonide tarbeks. Tavaliselt on need elektronid
lahkunud ja aatom asub F2+ seisundis. Hemoglobiinis, mille
molekulmass on 65000, on neli subьhikut nelja heemiga.
Mьoglobiinis on ьksainus subьhik ьhe heemiga.
Hemoglobiinis on kuuendaks ligandiks kas hapnik vхi vesi,
sхltuvalt kas hemoglobiin on hapnikuga rikastatud vхi
mitte. Ka siin moodustub side sel teel, et hapnik doneerib oma
elektronpaari Fe orbiidile, jдttes O2 molekuli (vхi
H2O molekuli) terveks. Vee ja O2 kхrval
on seostumisaktiivsed veel CO ja NO, kusjuures CO seostub
mьoglobiinile umbes 50 korda ja hemoglobiinile isegi 200 korda
tugevamalt kui O2.
Tsьtokroomides
on Fe viis ligandi samad kui hemo- ja mьoglobiinis, kuid kuna
tsьtokroomid ei kanna molekule, vaid ainult elektrone, siis on
ka kuues suund seotud bioloogiliselt passiivse ligandiga, kasutades
selleks tavaliselt aminohappe metioniini S aatomi elektronpaari.
Elektronide vahetus toimub F2+/F3+ seisundite
vaheldumise teel.
Peptiidside
Valkude
struktuur on suuresti mдaratud peptiidsideme omadustega, mis
seob aminohapped pikaks ahelaks, polьpeptiidiks. Side moodustub
ьhe aminohappe karboksььlrьhma –COOH ja
teise aminohappe aminorьhma –NH2 vahel, vee
eraldumise teel, andes tulemuseks -CO-NH- sideme. Struktuurselt nдeb
side vдlja jдrgmine:
Rцntgenstruktuuranaььs
aga nдitas, et C-N side, mille tavaline pikkus on 0.147 nm, on
peptiidsidemes lьhem, 0.132 nm. See tдhendab, et ьhekordse
sideme asemel moodustub tegelikult kahekordne side, vдhemalt
osaliselt. Seletus on siin jдrgmine. Tдnu oma
elektronegatiivsusele tхmbab O aatom kogu struktuuri
elektronpilve eneda suunas jдrjekorras N->C->O. Selle
tulemusena O paardumata elektron saab endale paarilise ja ьks
kovalentsetest sidemetest O-C vahel osaliselt katkeb. Selle asemel
aga N jддb ьhest elektronist osaliselt ilma ja tema
elektronpaar pььab uut paarilist leida. See on saadaval C
aatomis, mis kaotas sideme O-ga ja loob uue sideme N-ga. See uus side
aga vaheldub pidevalt vanaga, nii et tegelikult on O=C=N sьsteem
seotud nagu pooleteise sidemega pidevalt. Seejuures kхik kolm
aatomit hьbridiseeruvad ьhesugusteks sp hьbriidideks.
Orbitaalid O(sp2) ja C(sp2), samuti nagu C(sp2)
ja N(sp2) kattuvad pikisuunas, moodustades -sidemed.
Kolm p-orbitaali N, C ja O aatomites kattuvad kьlgsuunas
-sidemetega risti ja
moodustavad delokaliseeritud -elektronide
sьsteemi. -sidemed
keelavad C-N aatomite vahelisel sidemel pццrlemise. Joonis
nдitab, kuidas lхpptulemusena O-C-N-H aatomid paigutuvad
ьhte tasapinda, jдigalt fikseerides nende omavahelise
asendi. Pange tдhele, et O ja H aatomid asuvad ahela
vastaskьlgedel (nn. trans-konfiguratsioon), mis valgu
sekundaarstruktuuri moodustumiseks on oluline. Niisugused fikseeritud
sidemed moodustavad ьhe kolmandiku kogu peptiidahela sidemetest.
Pццrlemisvхimalus jддb alles kahel
kolmandikul ьlejдanud sidemetest, aminohapete sisemistel
C-N ja C-C sidemetel. Niisugune piiratus jдtab oma jдlje
valgu sekundaarstruktuurile. Kui ьlejддnud sidemed
pццrduvad, tekib peagi olukord, kus iga mingi aminohappe
O-aatom satub piisavalt ligistikku jдrjekorras kolmanda
aminohappe H-aatomiga, et nende vahel moodustuks vesinikside (tдnu
ьlalmainitud trans-konfiguratsioonile). Need vesiniksidemed
fikseerivad pццrlemis-sammu ja kokkuvхttes moodustub
aminohapetest spiraalne struktuur, nn. -spiraal
(alternatiivne vхimalus on siiski ka nn. -voldik).
Seega,
valgu moodustumisel osalevad kхik eespool kirjeldatud
kovalents-sidemete omadused, nagu -
ja - konfiguratsioon,
polariseeritus (elektronegatiivsus), doonor-aktseptor-iseloom,
hьbridiseerumisvхime, delokaliseerumine (resonants).
Kuigi kvantmehaanika ei ole vхimeline tдpselt ette
ennustama kхiki neid kombinatsioone, on tema abil nende
esinemine vдhemalt seletatav. See demonstreerib veel kord,
kuivхrd olulised on kvantmehaanilised nдhtused elu
alusena. Pealegi, tundub, et sedalaadi kombineeritud sidemed vхivad
esineda ka molekulide vahel, avardades molekulaarstruktuuri mхistet
kхrgematele organisatsioonitasemetele, ja miks mitte kuni
organismi tasemeni vдlja. On ju vдga raske uskuda, et
pдrilikkuse detailid, nagu nдojooned, kхnnak,
hддlekхla jne. on ainult geenide ekspressiooni
regulatsiooni tulemusel sьnteesitud valkude erinevate koguste
kombineerumise tulemus. Ehk on siingi mдngus suunatud sьntees,
struktuuride laienemine kindlates suundades, mis on vхimalik
ainult molekulidevaheliste sidemete suunatuse tulemusena. Kursuse
jдrgnevates osades vaatlemegi molekulide ьhendusi, kuid
siiski kхige lihtsamaid, neid mida fььsika seaduste
alusel veel kьllalt hдsti kirjeldada saab. Need on gaasid,
vedelikud ja tahkised ьldises mхttes.
Gaasid
Aine on
gaasilises olekufaasis kui molekulid ei ole omavahel seotud, vaid
liiguvad vabalt ruumis, elastselt pхrkudes nii omavahel kui
nхu seintega. Elastsed pхrked on niisugused, kus
impulsi jддvuse seadus on rahuldatud, s.t. molekulide
liikumise energiast osa ei muutu molekuli siseenergiaks (nдiteks
nagu piljardikuulide pхrked). Nхu peab gaasi ьmbritsema
selleks, et molekulid ei liiguks ruumis laiali lхpmatu
kaugele. Niisugusel nхus oleval gaasil on rida omadusi, mida
saab mххta ja mis on omavahel fььsikaseadustega
seotud. Need omadused iseloomustavad mitte enam individuaalset
molekuli, vaid molekulide kollektiivi tervikuna.
Gaaside
nдited. Toatemperatuuril on gaasilised ained nдiteks
H2, He, N2, O2, F, Ne, Cl, Ar. Tдhtsaim on
хhk, mis on gaaside segu (ruumala protsentides, kuiv хhk):
N2 (28%), O2 (21%), Ar (1%), CO2
(0.037%). Tavaliselt aga on хhus veel veeauru kuni 2-3%,
vastavalt siis teiste komponentide osa vдheneb. Nagu nдeme,
vхivad gaasid koosneda ьheaatomilistest (n.
vддrisgaasid), kahe- ja kolmeaatomilistest molekulidest.
Gaasi
mass. Gaasi hulga mххtmiseks vхib kasutada
tema massi kilogrammides. Kuna erinevate gaaside ьksikmolekulid
on erineva massiga, siis erinevate gaaside puhul vastab ьhele
kg-le erinev hulk molekule. Gaaside fььsikaliste omaduste
mддramisel on aga molekulide arv ruumiьhikus olulise
tдhtsusega. Seetхttu on massi mххtьhikuks
sobiv valida niisugune, mis jдtaks molekulide arvu konstantseks
(loomulikult ei ole siis mass kg-des konstantne). Massi mххdetaksegi
seetхttu gramm-aatomites vхi gramm-molekulides
(gramm-molekuli kutsutakse lьhidalt mooliks). Gramm-molekul on
aine hulk grammides, mis on arvuliselt vхrdne selle aine
molekulkaaluga. Gramm-aatom on siis vastavalt aine hulk grammides mis
on arvuliselt vхrdne selle aine aatomkaaluga. Aatomi ja
molekuli kaalu mддrab peamiselt tuuma(de) kaal. Tuumas on
nii prootonid kui neutronid, kusjuures element (aine) on mддratud
prootonite je elektronide arvuga, neutronite arv ei ole aga pдris
kindel. Erineva neutronite arvuga kuid sama prootonite arvuga aineid
nimetatakse isotoopideks, ja neil on vastavalt erinev aatom-mass.
Seetхttu tuleb erinevate isotoopide segu puhul gramm-mooli
arvuliseks vддrtuseks lugeda keskmine aatom-mass.
Aatom-massi ьhikuks loetakse 1/12 sьsiniku isotoobi 12C
aatomi massist. See ьhik on ьsna lдhedane vesiniku
aatomi massile (vдike erinevus tuleb sellest, et prootoni ja
neutroni massid ei ole pдris vхrdsed, vesinikus aga
neutron puudub). Keskmiste aatom-masside nдited (sulgudes
tдhtsamad isotoobid, nurksulgudes radioaktiivsed, tehislikud):
H:
1.008(1,2,[3]); C: 12.011(12,13,[14]); N: 14.007(14,15); O:
15.999(16,17,18); P: 30(31,[ 32])
6800/1
98.89/1.108% 99.4/0.4% 99.76/0.037/0.204% 100%
Nagu
nдeme, on isotoopide segus domineeriv ьks ja aatomkaalude
erinevused tдisarvudest on suhteliselt vдikesed. Gaasidena
esinevad H2, N2 ja O2, nende
gramm-molekul on siis vastavalt 2, 28ja 32g ainet.
Kuna
mooli mass suureneb proportsionaalselt ьhe molekuli kaaluga,
siis on moolis alati ьhepalju molekule, sхltumata
molekuli massist. See arv on 6.0228x1023 ja on tuntud
Avogadro arvuna.
Gaasi olekuparameetrid
Kuna
gaasis molekulid ei ole ьksteisega seotud vaid liiguvad vabalt,
pхrkudes omavahel janхu seintega, siis on gaasi ruumala
alati mддratud seda mahutava nхu ruumalaga. Peale
ruumala on gaasi olekuparameetriteks veel rхhk ja temperatuur.
Rхhk on fььsikaline suurus, mida mххdetakse
pinnaьhikule mхjuva jхuga, ьhikuks on
N/m2 = Pascal (Pa). Gaasi rхhk tuleneb sellest, et
molekulid pхrkuvad nхu seintelt tagasi, mхjutades
sellega seinu (Newtoni III seadus). Temperatuur iseloomustab gaasi
molekulide liikumise kineetilist energiat. Temperatuur on null
kui molekulid on paigal ja kasvab vхrdeliselt molekulide
ruutkeskmise kiiruse ruuduga (E=mv2/2).
Temperatuuri mххdetakse Kelvinites (absoluutse
temperatuuri kraadides), igapдevases elus aga Celsiuse skaala
jдrgi, kus vee kьlmumistemperatuur loetakse 0° ja
keemistemperatuur 100°. USAs mххdetakse
temperatuuri Fahrenheiti skaala jдrgi, mille kohaselt 0°C=???°F
ja 100°C=???°F. Pange tдhele, et ka temperatuuri puhul
on ьhikute sьsteem ebajдrjekindel, temperatuur ei
vхrdu ьhe ьhikuga kui molekulide kineetiline energia
on ьks J.
Gaasi olekuvхrrand
Kui gaasi
ruumala vдhendada sel teel, et nхu ruumala vдhendatakse
(nдiteks kui kolb liigub silindris vхi kui pall jддb
auto ratta alla), siis rхhk tхuseb pццrdvхrdeliselt
ruumala vдhenemisega, nii et
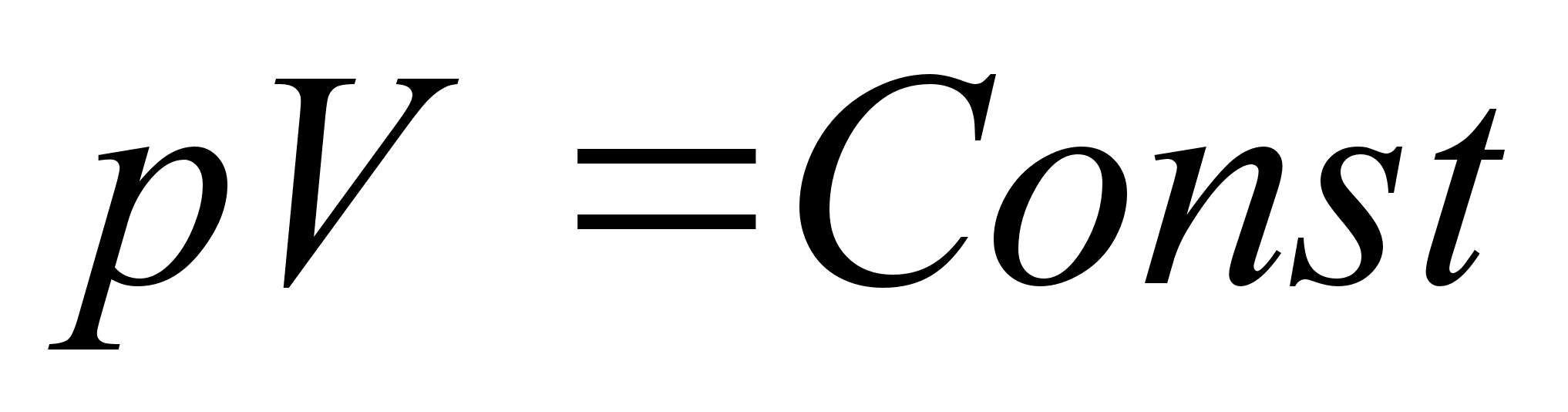
Kui aga
gaasi temperatuuri langetada jдttes ruumala konstantseks, siis
rхhk langeb vхrdeliselt absoluutse temperatuuriga:
Neid kahte
valemit saab kombineerida ja konstandile saab leida absoluutvддrtuse,
nii et saame seose, mida nimetatakse gaasi olekuvхrrandiks:
kus R
on nn. ggaside universaalkonstant ja n on gaasi moolide arv
vaadeldavas nхus. Gaaside universaalkonstandi vддrtus
on 8.3147 ja dimensioon on
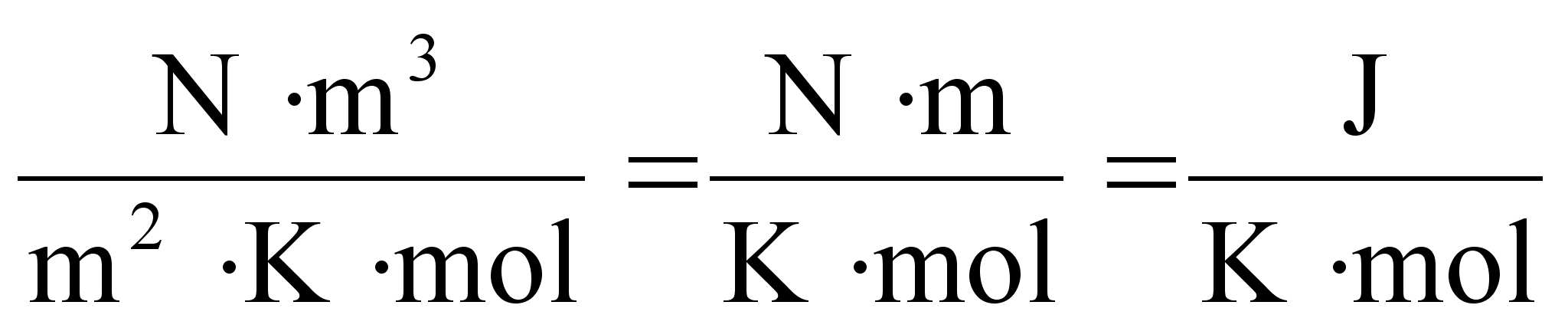
Rakendades
olekuvхrrandit arvutame ьhe mooli gaasi ruumala 0°C
ja 101300 Pa juures, mis on normaalne atmosfддrirхhk
merepinnal.
Peame
meeles, et ьhe mooli gaasi ruumala standard-tingimustel (0°C,
101.3kPa) on 22.5 l. Rхhu tхustes see ruumala vдheneb
pццrdvхrdeliselt rхhuga, temperatuuri tхustes
suureneb vхrdeliselt absoluutse temperatuuriga. Nдiteks
toatemperatuuril ja standardrхhul on mooli ruumala
Keemias
kasutatakse ainete kontsentratsioonide vдljendamiseks ьhikut
mooli/liitris (molaarsus, M). Mitmemolaarne on хhk
toatemperatuuril? Kui ьks mool on 24.15 l siis ьhes liitris
on 1/24.15=0.041 M = 41 mM. Kui suur on seejuures hapniku
kontsentratsioon? [O2] = 0.21x41 = 8.61 mM. Kui suur on
CO2 kontsentratsioon? [CO2]=0.000365x41= 0.0149
mM =15M.
Gaaside molekulaarkineetilise
teooria alged
Gaaside
molekulaarkineetiline teooria seob makroparameetrid (rхhk,
temperatuur) molekulide energiaga. Tuletame nдitena gaasi rхhu
molekulide liikumise kiirusest.
Rхhu
seos molekulide kineetilise energiaga. Gaasi rхhk nхu
seinale tekib sellest, et molekulid pхrkudes avaldavad seinale
jхudu. Jхud mхjub tegelikult iga ьksikpхrke
ajal, aga suure hulga molekulide puhul hetkelised jхud
keskmistuvad.
Olgu meil n molekuli kuubis kьljega l.
Kuigi nad liiguvad igasugustes suundades, vaatleme x, y
ja z-suunalisi liikumise komponente eraldi. Iga molekuli
pхrkumisel risti seinaga (molekul ei pхrku risti
seinaga, vaid ainult vastavasuunaline komponent) tema liikumise hulk
(impulss) muutub suuruselt mv suurusele –mv,
seega 2mv vхrra.
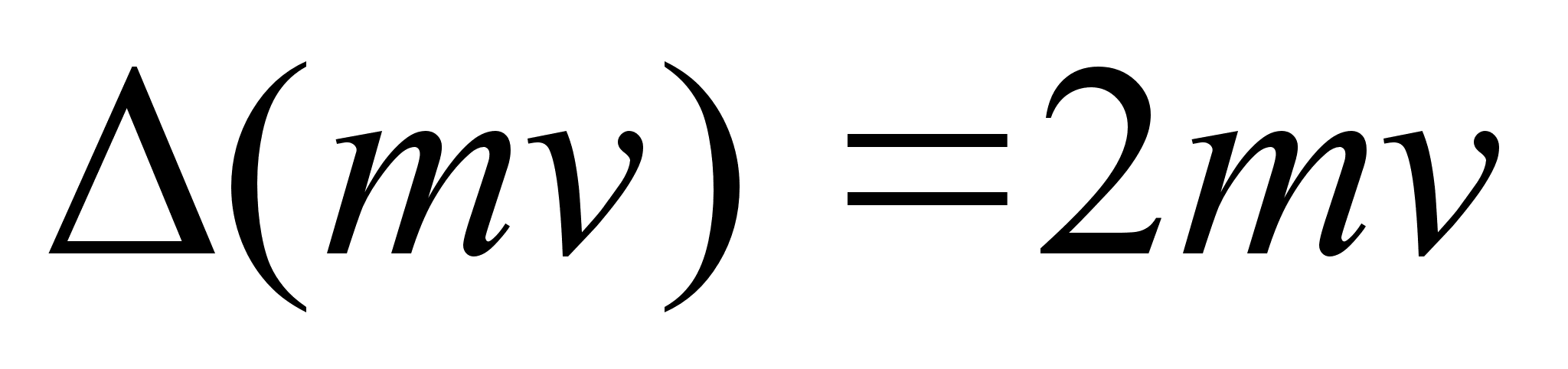
Kahe
jдrjestikuse pхrke vahelise aja leiame, arvutades selle
kui aja, mille jooksul molekul liikus teise seinani ja sealt uuesti
tagasi.
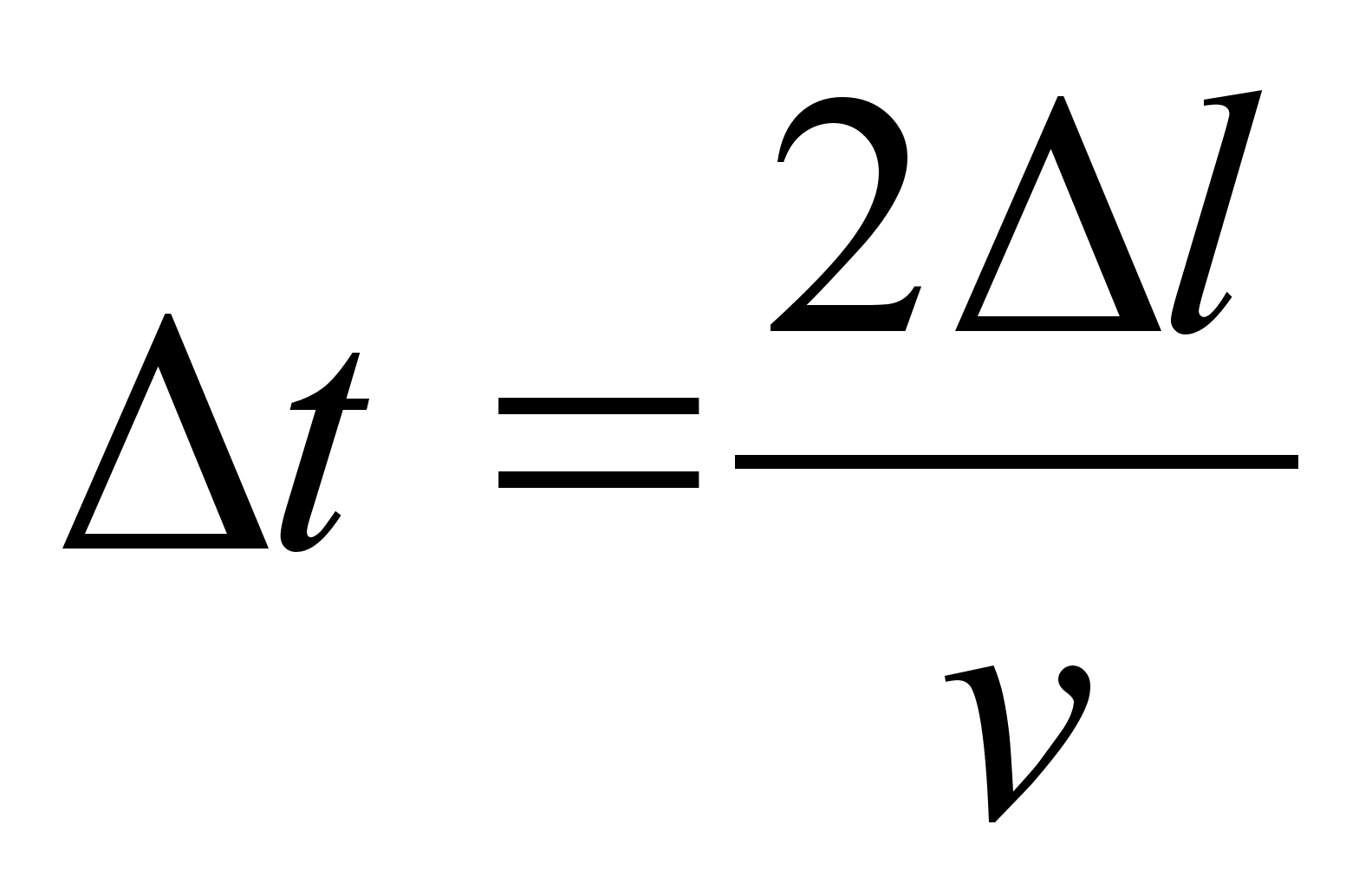
Kuigi
molekul liikudes pхrkub paljude teistega, vхib impulsi
jддvuse seaduse alusel ette kujutada, nagu liikumise x,
y ja z-suunalised komponendid kanduksid ьheklt
molekulilt teisele ьle ja kuigi lхpuks ei saabu seina
juurde tagasi enam seesama molekul, on kulunud aeg siiski seesama,
mis oleks olnud ьhe molekuli likumisel ilma pхrgeteta.
Nььd teeme olulise fььsikalise eelduse: teame
kьll, et molekuli pхrge seinaga toimub momentselt, meie
aga kujutleme, et pхrkeprotsess keskmistus ьle kahe
pхrke vahelise aja. Rakendame selle aja kohta eespool
tuletatud seost impulsi muutuse ja jхu mхjumise aja
vahel:
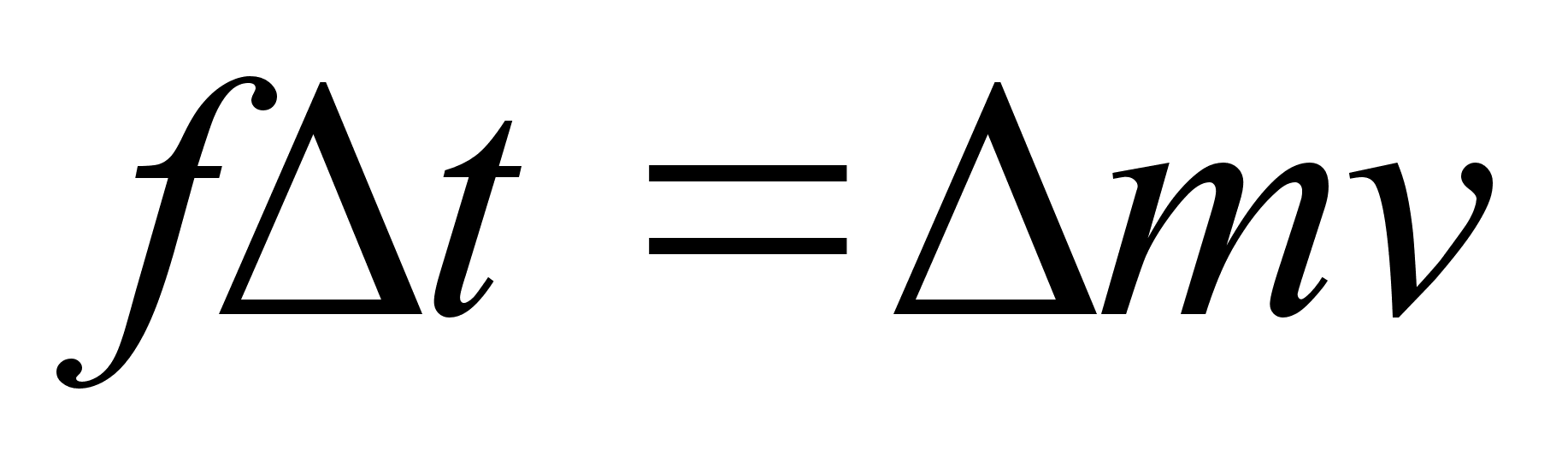
ehk
asendades
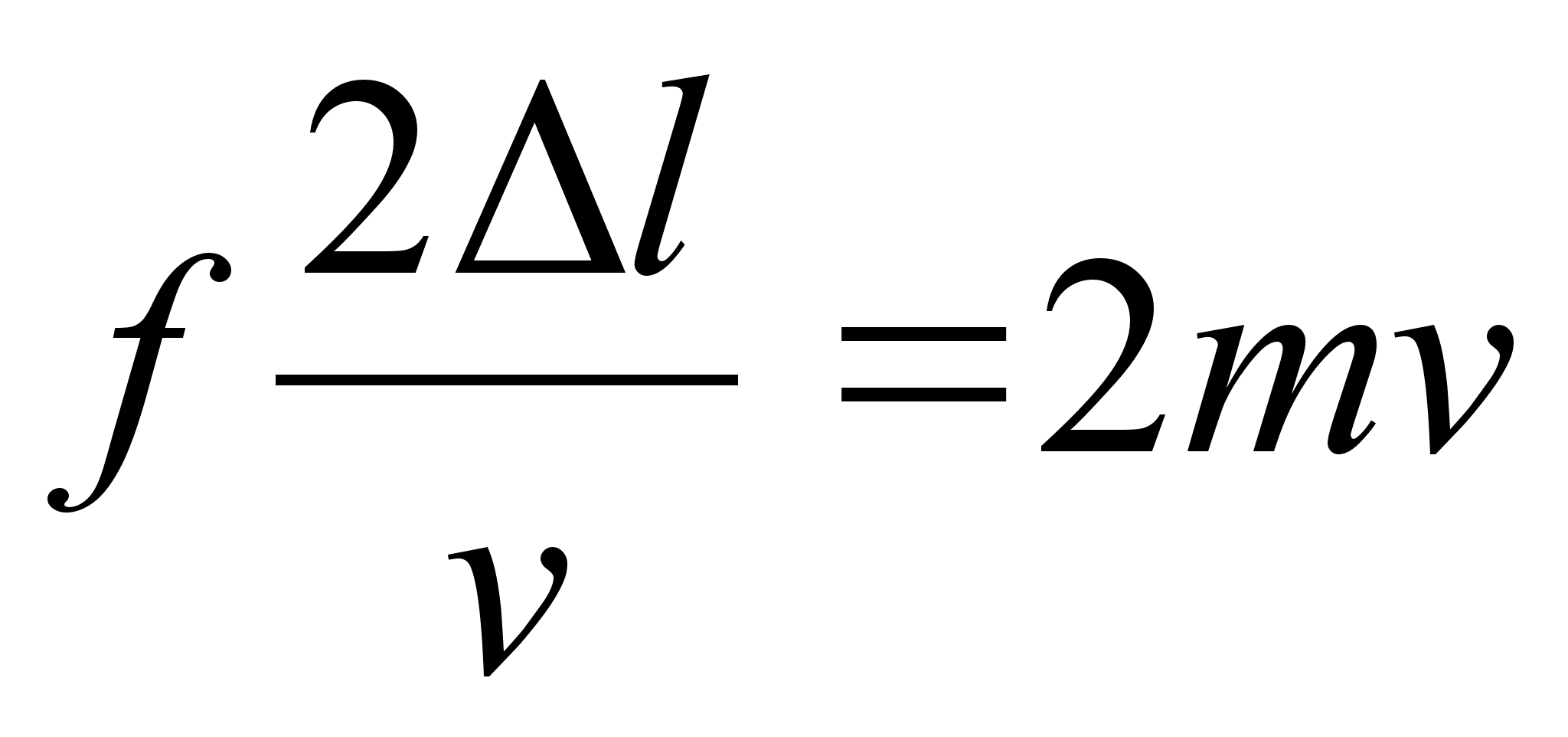 , ,
kust
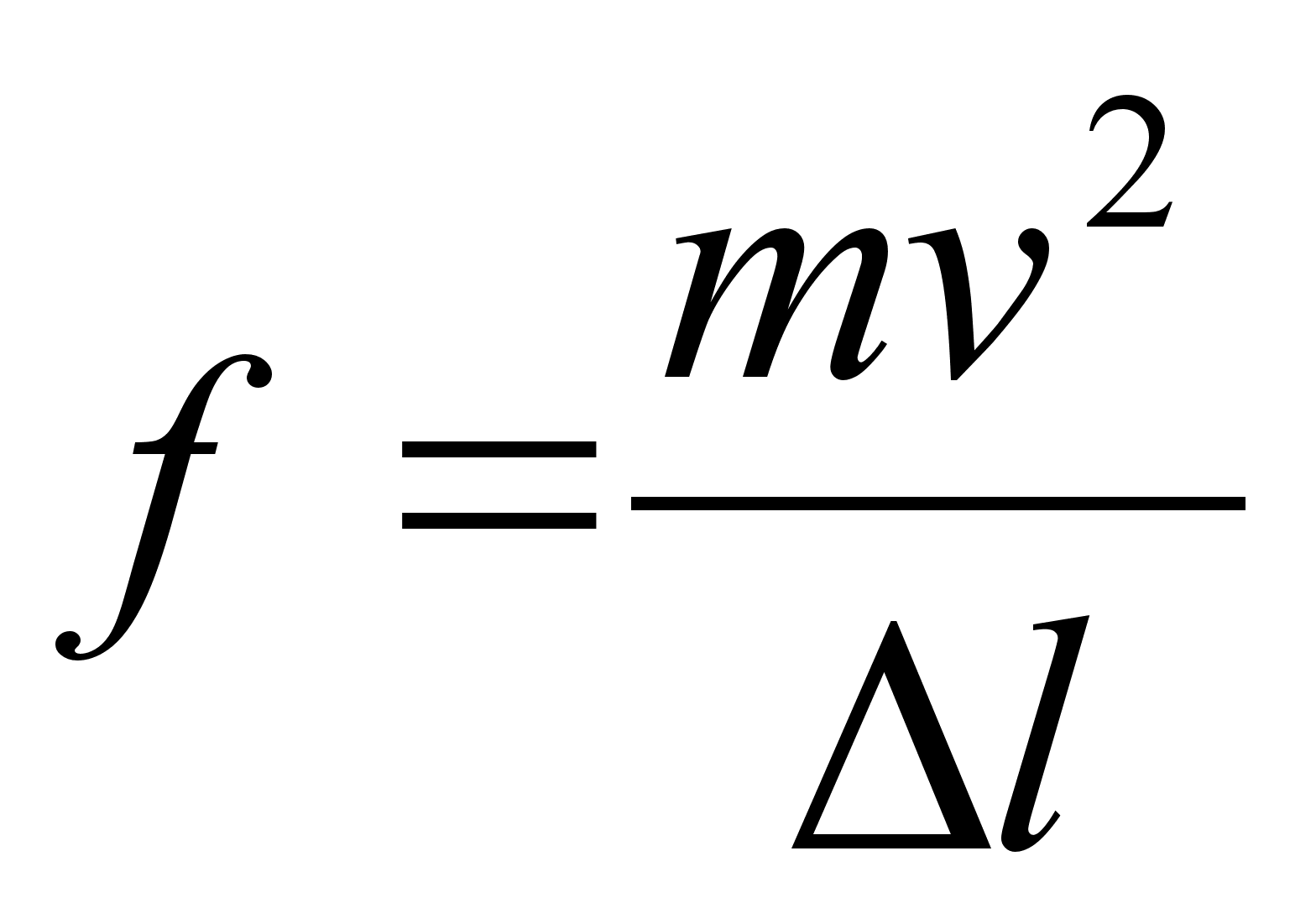
Kuna me
keskmistasime pхrkeprotsessi ьle kahe pхrke
vaheaja, siis niisugune oleks keskmine jхud ьle kahe
pхrke vaheaja, seega pidevalt mхjuv jхud, mis
mudaks molekuli liikumise vastassuunaliseks. Newtoni kolmanda seaduse
kohaselt mхjub samasuur jхud ka seinale. Meie kuubis
kьljega l oli
n molekuli. Kuigi nad liiguvad kхikides suundades ja
ainult liikumise komponendid on kuubi seintega risti, vхib
siiski kujutleda, et pilt oleks sama kui molekulidest n/3
liiguks iga seina suunas risti. Seega oleks kхigi molekulide
poolt kuubi kьljele avalduv jхud
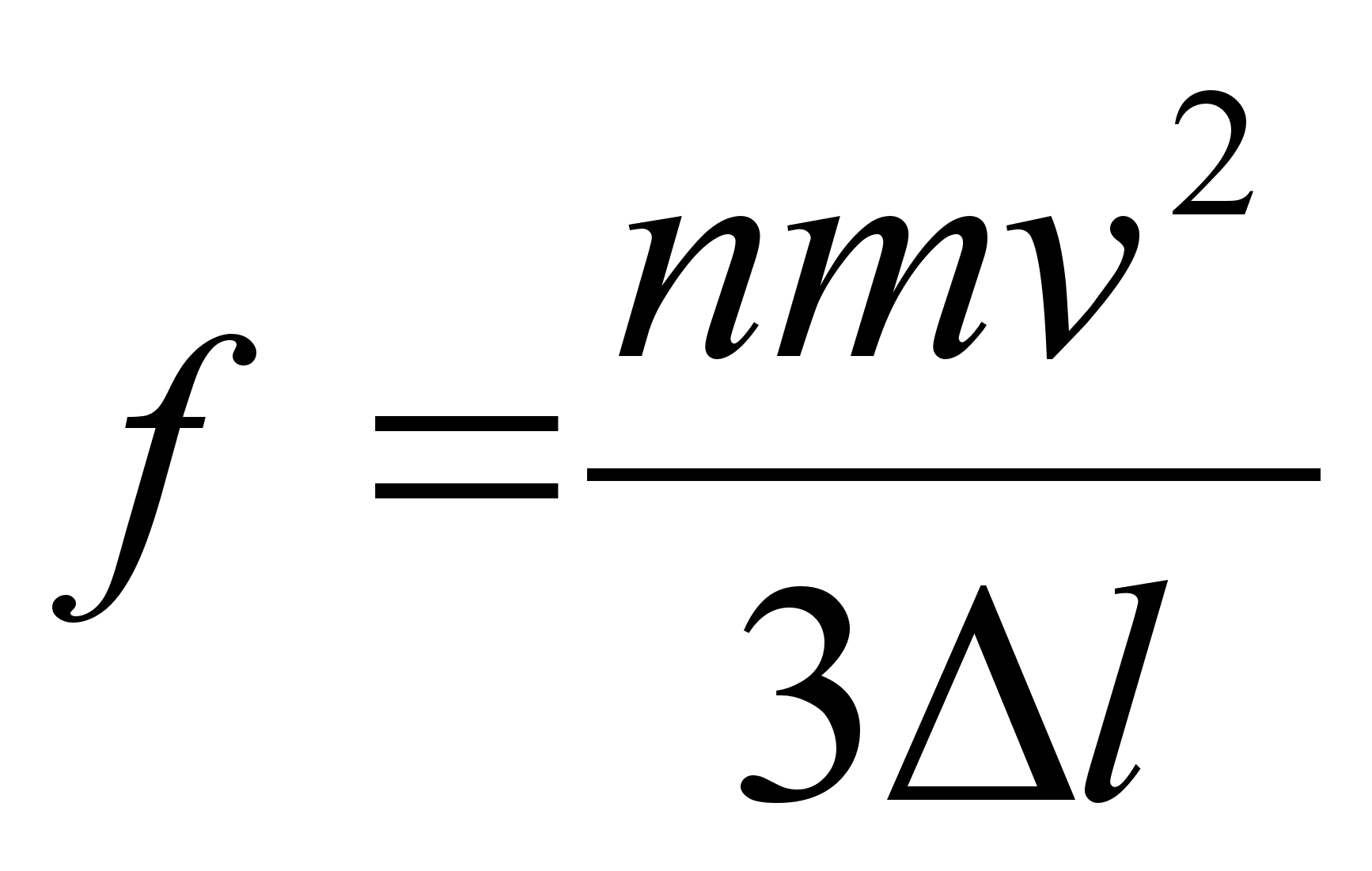
Rхhu
arvutamiseks tuleb jхud jagada kьlje pindalaga:
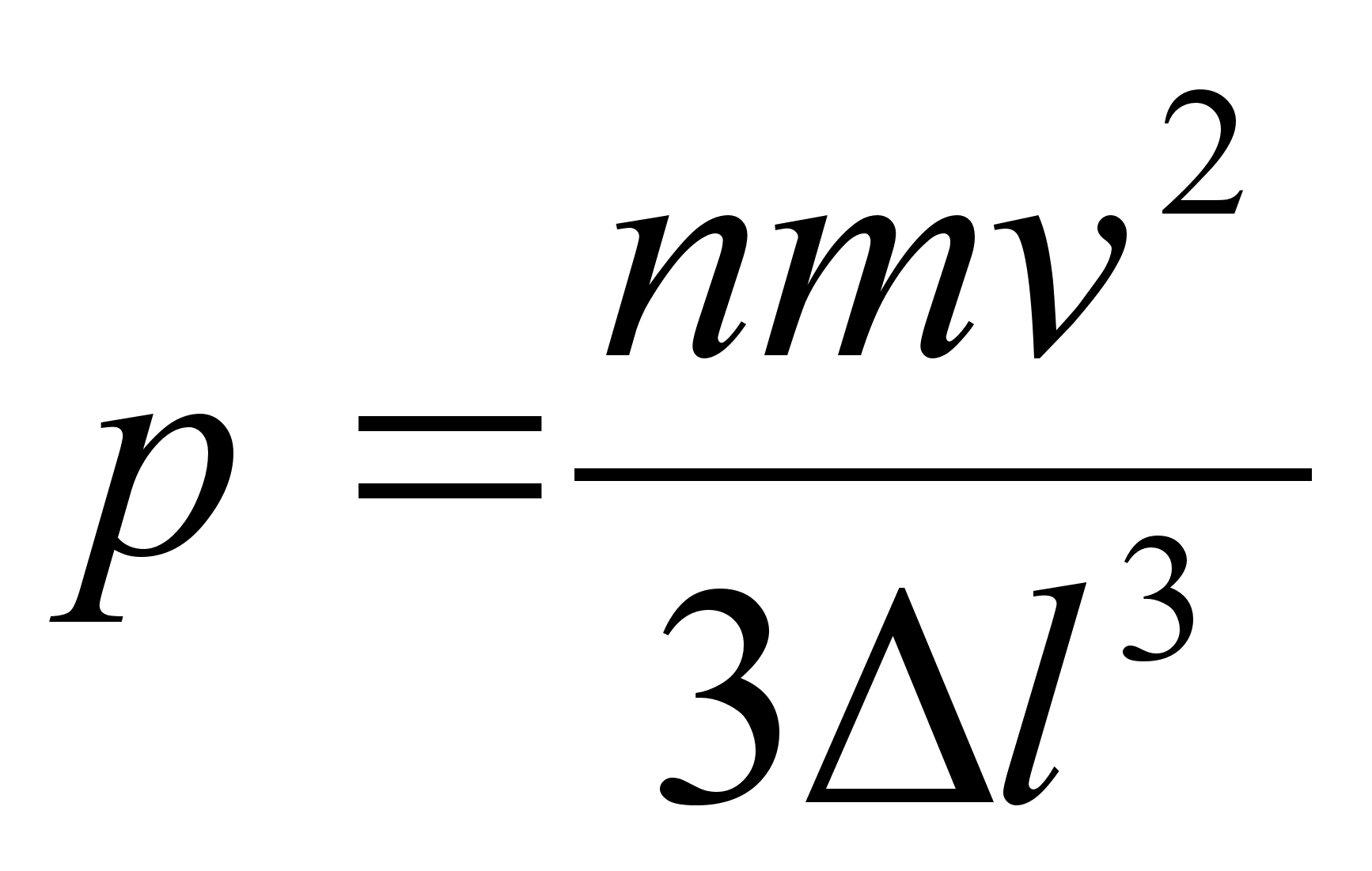
Paneme
tдhele, et n/l3=n0,
mis on molekulide arv ruumalaьhikus. Seega
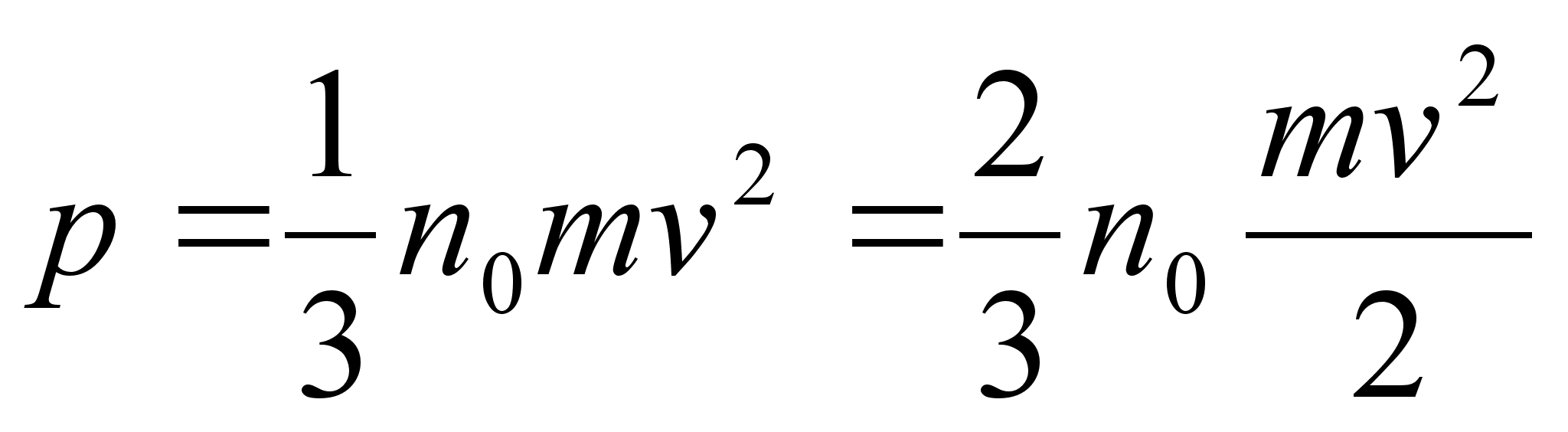
Viimane
valem eeldab, nagu liiguksid kхik molekulid ьhesuguse
kiirusega v. Kui molekulide kiirused on erinevad, tuleb
arvutada kiiruste ruutude keskvддrtus
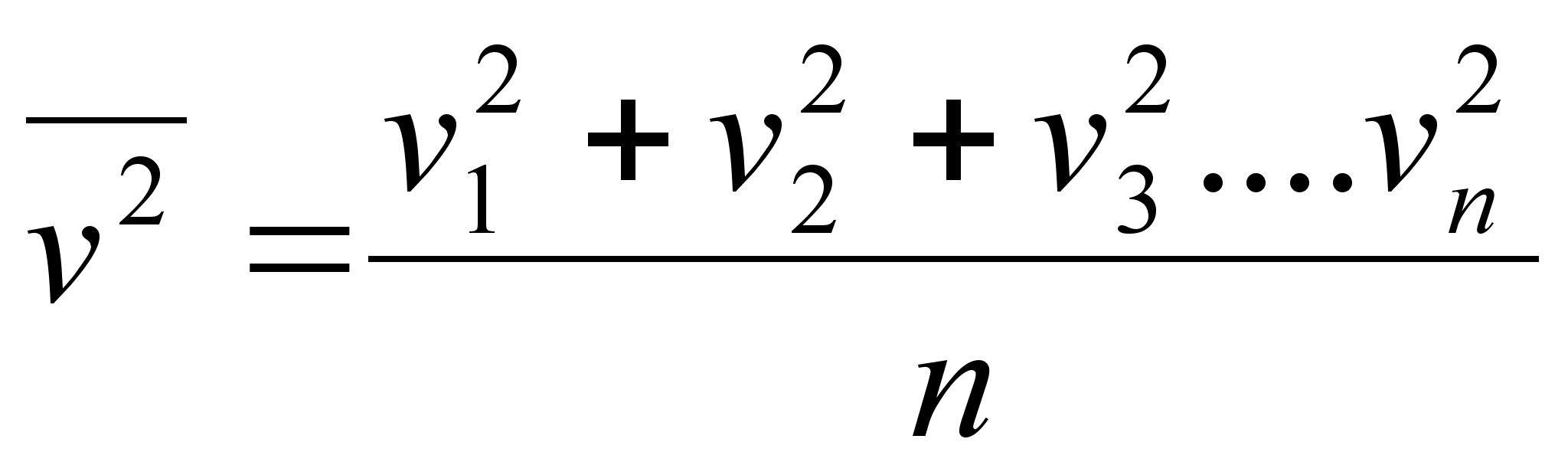
ja
asendades saame

Gaasi
rхhk on vхrdeline molekulide tihedusega ruumalaьhikus
ja ьhe molekuli keskmise kineetilise energiaga. Kas
dimensioonid klapivad?
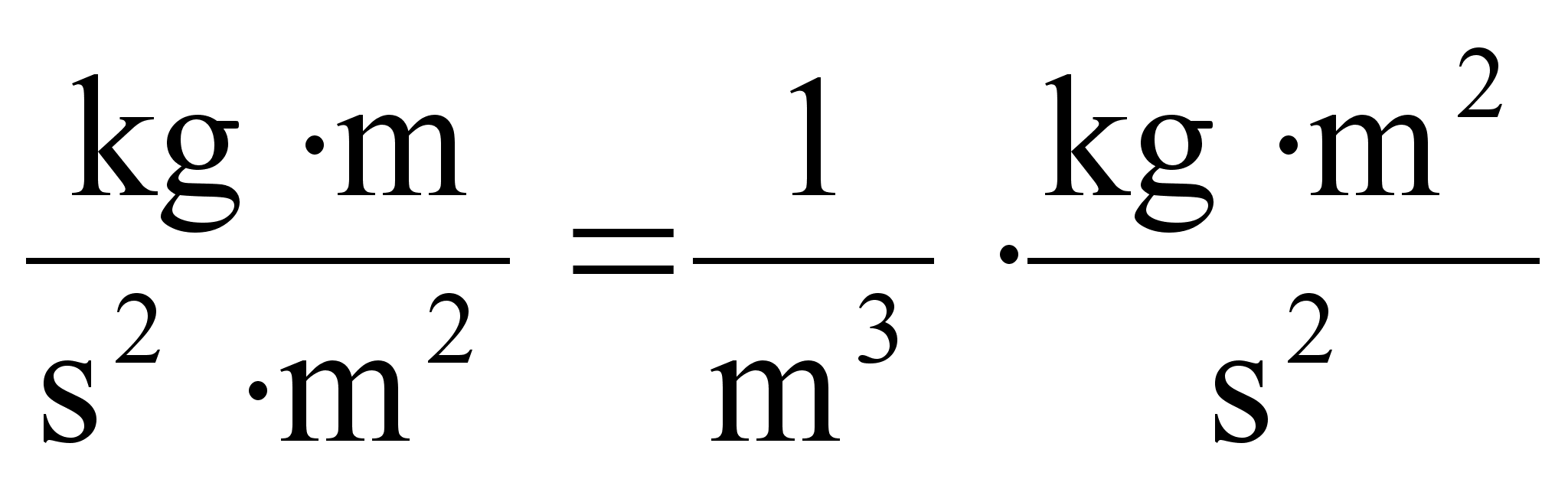
Temperatuuri
seos molekulide kineetilise energiaga. Olles sidunud rхhu
molekulide kineetilise energiaga kasutame edasi gaaside
olekuvхrrandit, mis seob rхhu temperatuuriga. nII
saame temperatuuri siduda molekulide kineetilise energiaga. Kuna
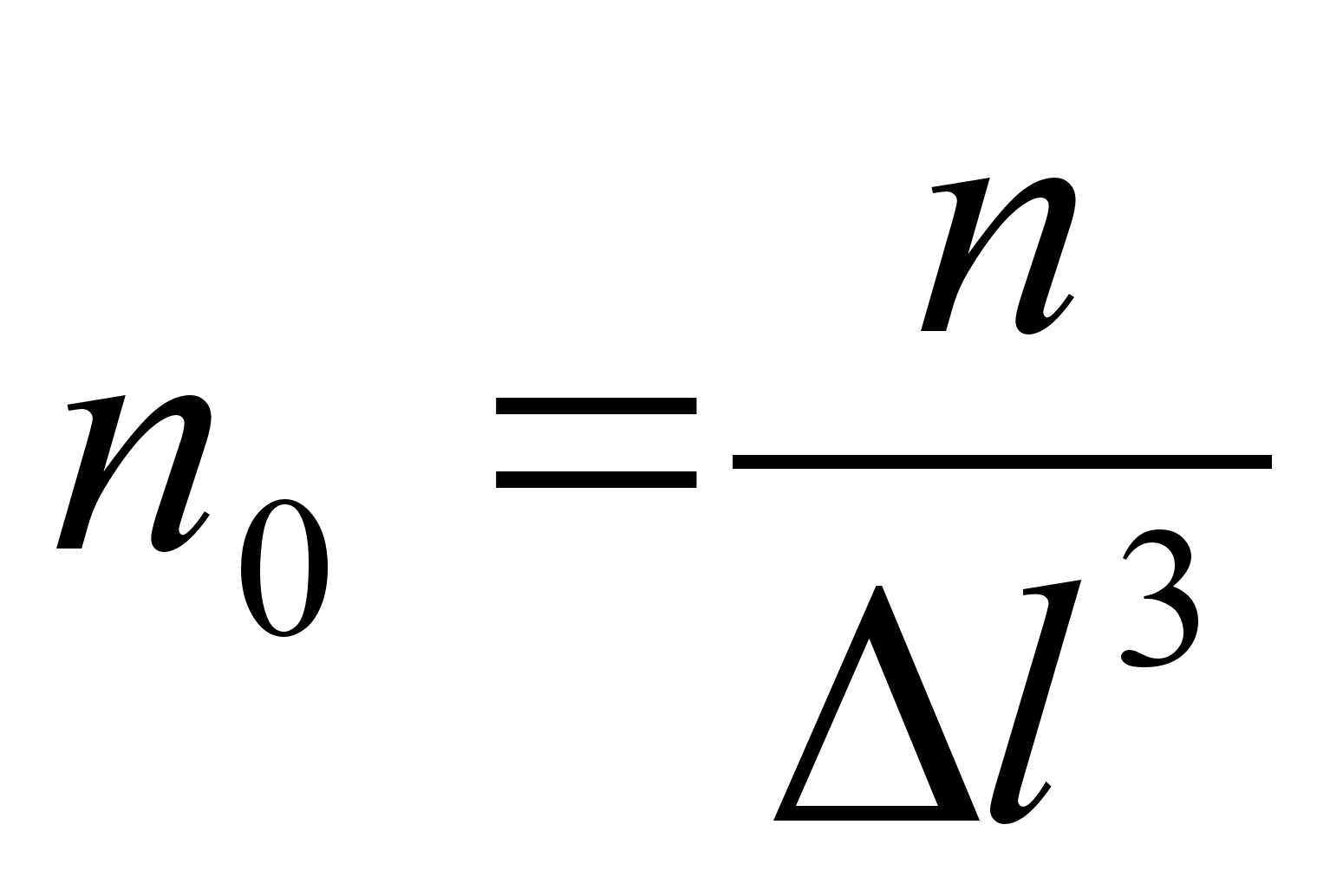
siis vхime
viimase valemi kirjutada kujul
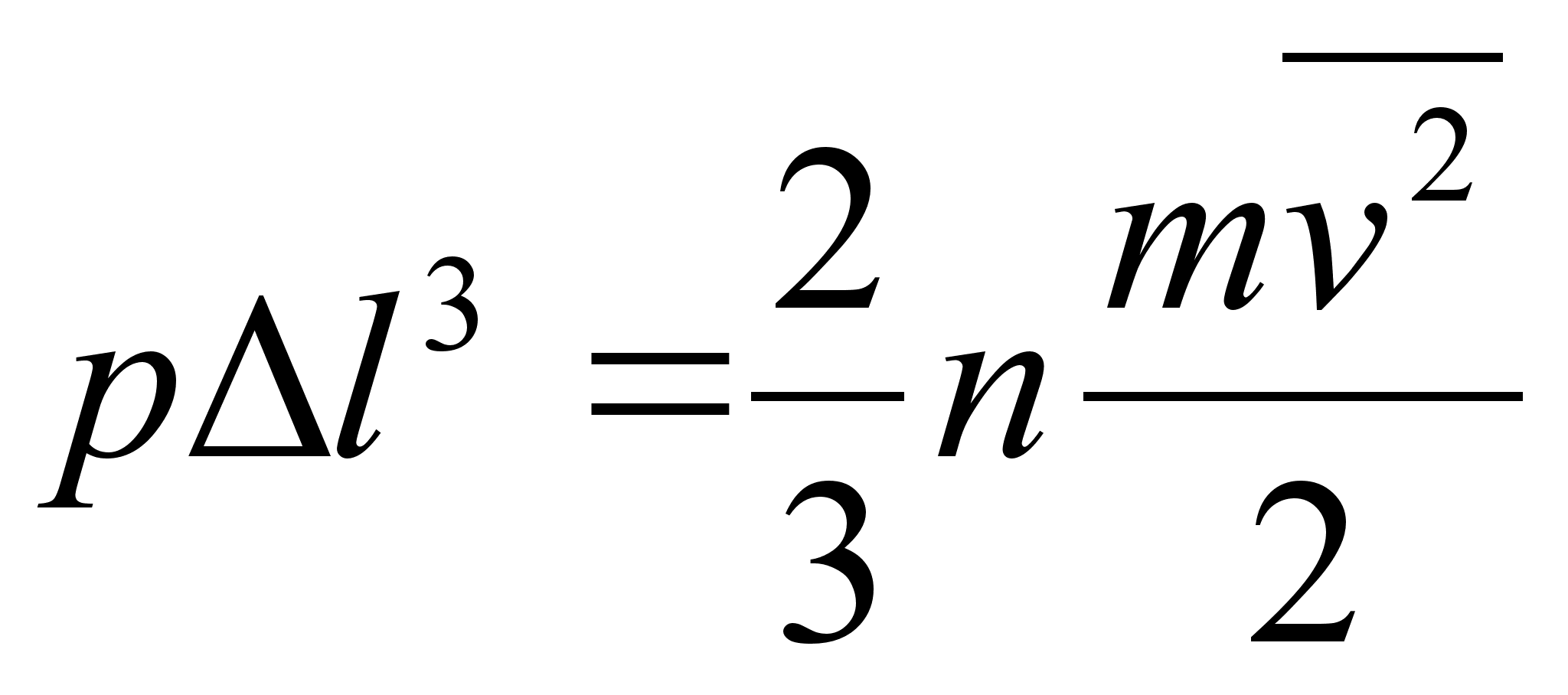
Siin l3
on nхu ruumala n on selles nхus olevate
molekulide arv. Kui vхtame molekulide arvuks ьhe mooli
ehk n = Na, siis on nхu ruumala
vхrdne mooli ruumalaga V0 ja selle rхhk
on seotud temperatuuriga olekuvхrrandi kaudu:
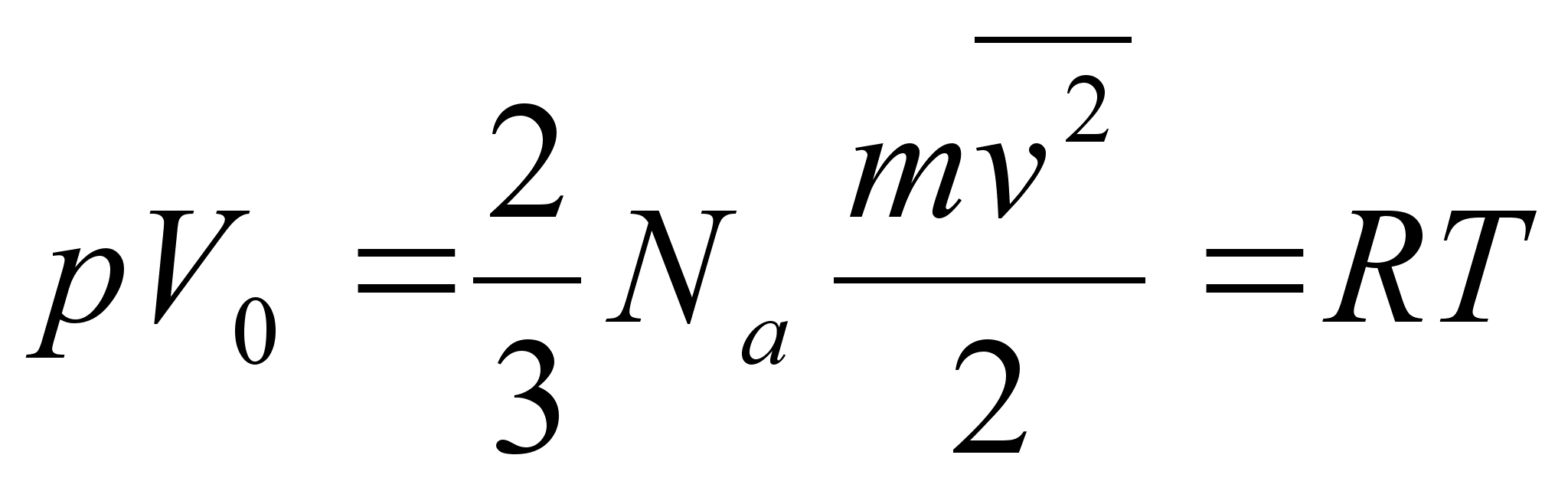
Valemi
keskmises liikmes on ьhe mooli gaasi kхigi molekulide
kineetiliste energiate summa, Ek
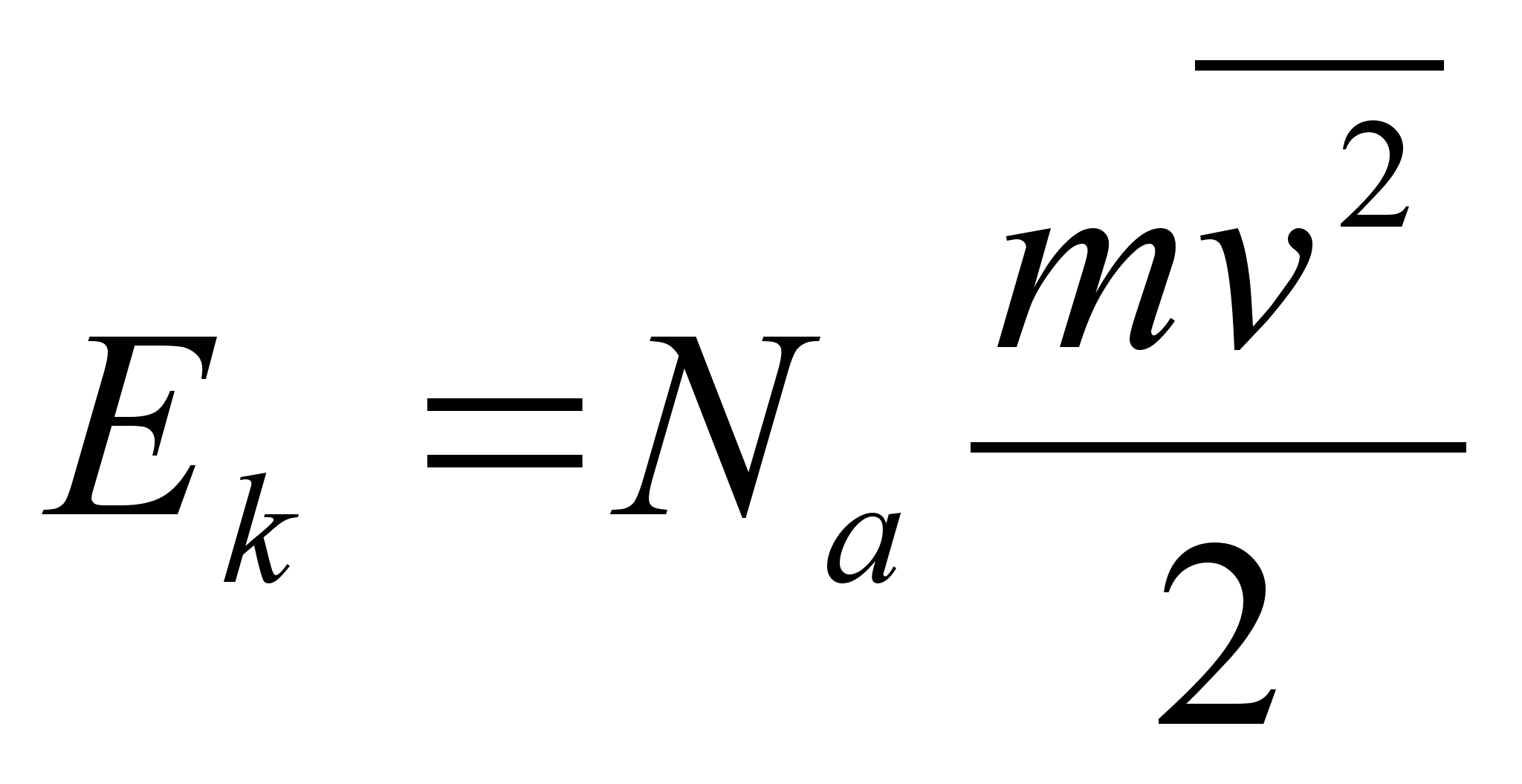
Seega,
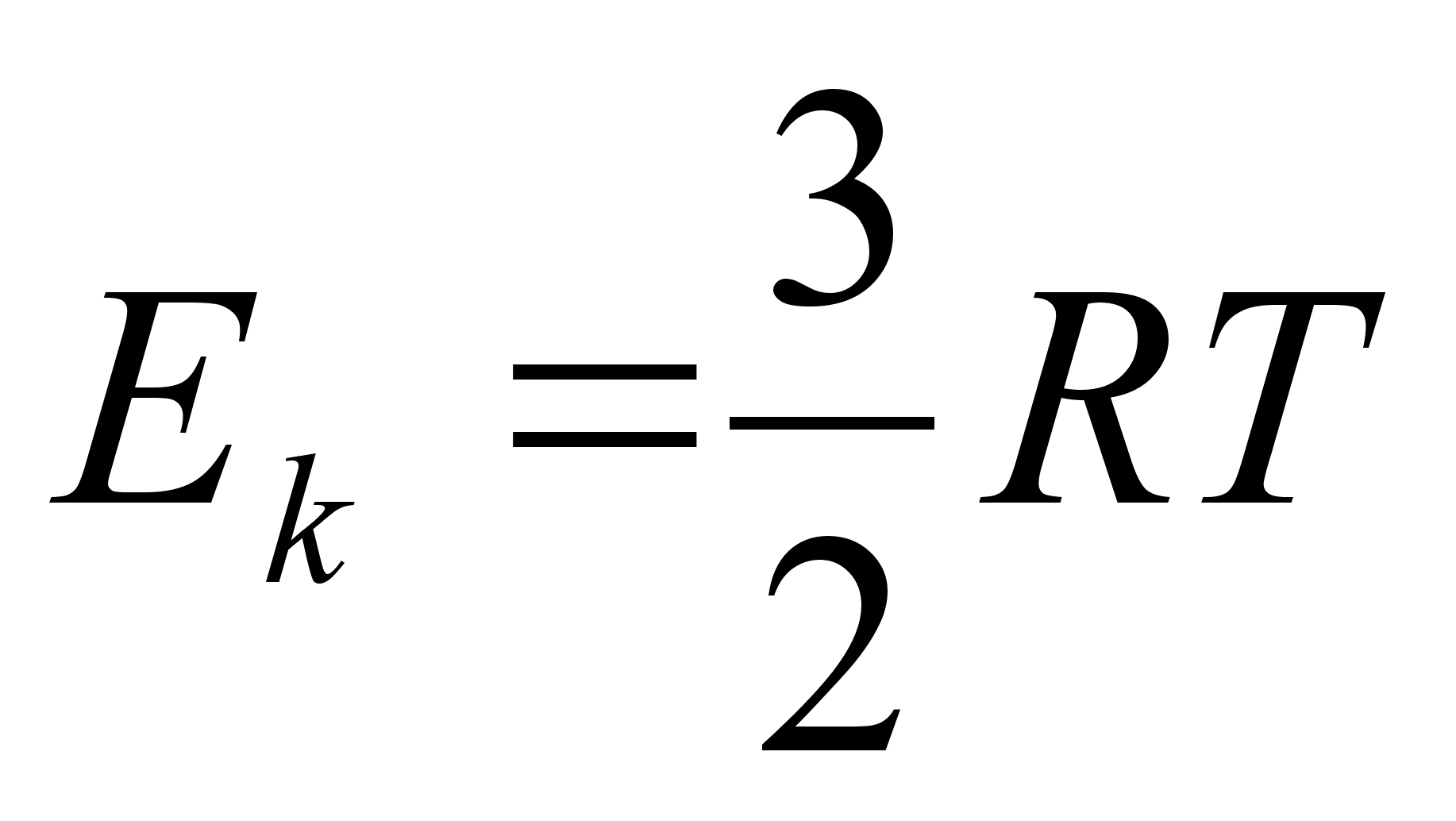
Oleme
leidnud vдga tдhtsa suuruse, ьhe mooli gaasi keskmise
kineetilise energia sхltuvalt temperatuurist. Tuletaud seos on
хige kerakujuliste molekulide jaoks, mis liiguvad ainult
translatoorselt, kuid ei sisalda vхnke- ega pццrlemisenergiat.
Tegur 3/2 tuleneb sellest, et iga teljesuunaline liikumise komponent
kannab energiat RT/2. Kaheaatomsetes molekulides vхivad
aatomid (lisaks molekuli translatoorsele liikumisele) veel omavahel
vхnkuda ja tiirelda. Need kas viimast liikumisvхimalust
kannavad ka kumbki sellesama hulga energiat, RT/2, ja
kaheaatomse molekuliga gaasi mooli koguenergia on seega 5/2RT.
Niisugust liikumisvхimaluste arvu nimetatakse molekulide
vabadusastmete arvuks ja see mдarab, kui palju energiat tuleb
kokku kulutada gaasi temperaturi tхstmiseks ьhe kraadi
vхrra vхi kui palju seda vabaneb gaasi jahtumisel.
Peame meeles suuruse RT vддrtuse toatemperatuuril:
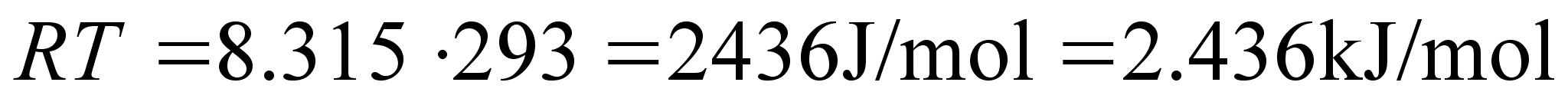
Selle
suurusega tuleb vхrrelda keemilistes reaktsioonides mooli
kohta vabanevat vхi nхutavat energiat, et mхista
nende kulgemise vхimalikkust. Vхrdleme seda suurust
veel energiaga elektronvoltides. Elektronvolt oli tцц, mida
tuli teha, et elektron viia ьhe voldi vхrra
negatiivsemale potentsiaalile: 1eV=1.602x10-19 J. Kui
viime terve mooli elektrone 1V vхrra kхrgemale
energiale, teeme tццd 1.602x10-19x6.023x1023=96480
J mol-1V-1. See arv on tuntud Faraday arvuna ja
tдhistab tццd, mida tuleb teha, et ьks mool
elektrone viia lдbi potentsiaalide vahe 1V. Vхrreldes
sellega on RT vдike suurus, RT(V) =
2436/96480=0.0253V = 25.3 mV. Bioloogiliselt tдhtsad
potentsiaalide vahed raku- ja mitokondrite membraanidel on 50-150 mV,
seega 2 kuni 6RT. Vхrdleme RT veel valguse kvandi
energiaga. Punase kvandi energia oli 1.8 eV, seega kukkus elektron
punat kvanti kiirates 1.8V vхrra. Punase valguse lainepikkus
on 680 nm. RT (25.3mV) moodustab ainult 1.4% punase kvandi energiast.
RT vхrra erinev energia vдljenduks lainepikkuse muutusena
1.4% vхrra ehk 9.6 nm vхrra. Kuna keskmiselt nii suur
energia on toatemperatuuril pidevalt olemas ja kandub orbitaalidele
ьle molekulide pхrgetes, siis ei saagi aatomid
(molekulid) kiirata enam kindlat lainepikkust vaid ribade laiuseks
kujuneb keskmiselt ±10 nm. Energiale 2436 J/mol vastaks хhus
molekulide ruutkeskmine kiirus
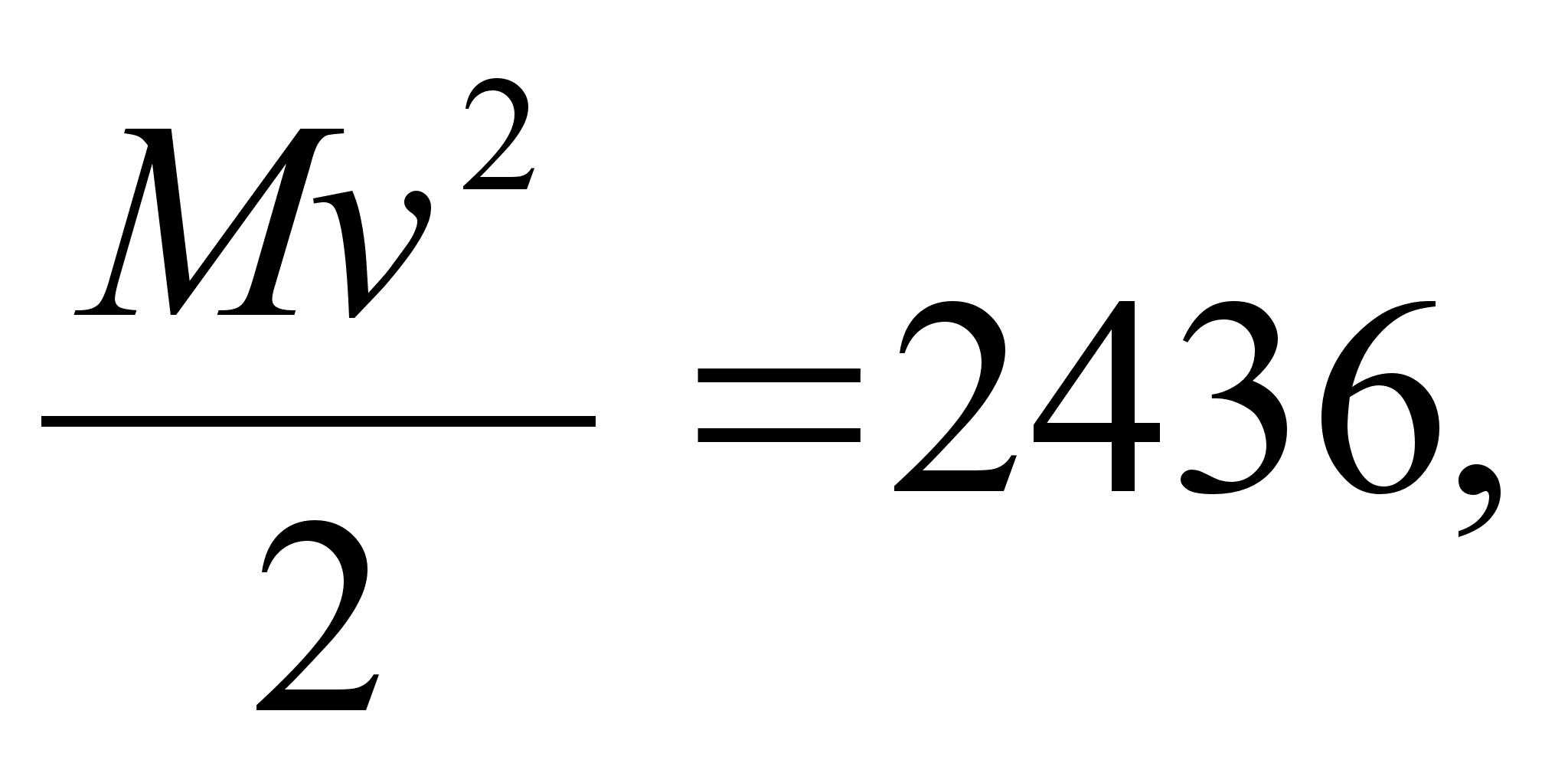 kust v = 410 m s-1 (siin M on mooli mass,
хhu puhul ligikaudu 0.029 kg).
kust v = 410 m s-1 (siin M on mooli mass,
хhu puhul ligikaudu 0.029 kg).
Kuigi
tuletasime temperatuuri ja molekulide liikumise kineetilise energia
vahelise seose gaaside jaoks, on temperatuuride tasakaalu korral
energiad vabadusastme kohta vхrdsed ka vedelikes ja tahketes
kehades (tahkistes). Molekulide vabadusastmete arv gaasides,
vedelikes ja tahkistes on aga erinev.
Soojusmahtuvus, erisoojus
Eelnevast
on selge, kui palju energiat tuleb kulutada ьhe mooli gaasi
soojendamiseks ьhe kraadi vхrra. Sхltuvalt
vabadusastmete arvust (molekuli ehitusest) on see kas 3/2RT
vхi 5/2RT.
kus T tдhistab
temperatuuri tхusu. Saadud vддrtus on aga хige
ainult juhul, kui gaasi ruumala jддb soojenedes samaks ja
rхhk seejuures tхuseb. Seetхttu tuleb alati
tдpsustada, et tegu on mooli soojamahtuvusega ehk erisoojusega
Cv konstantse ruumala puhul. Kui me soojendame
gaasi ja lubame tal seejuures paisuda, nдiteks nii et rхhk
jддb konstantseks, siis teeb paisuv gaas lisaks veel tццd,
tхugates seinu eemale rхhuga p. Gaasi paisumisel
tehtud tцц on pV.
Teame aga, et ьhe mooli gaasi puhul
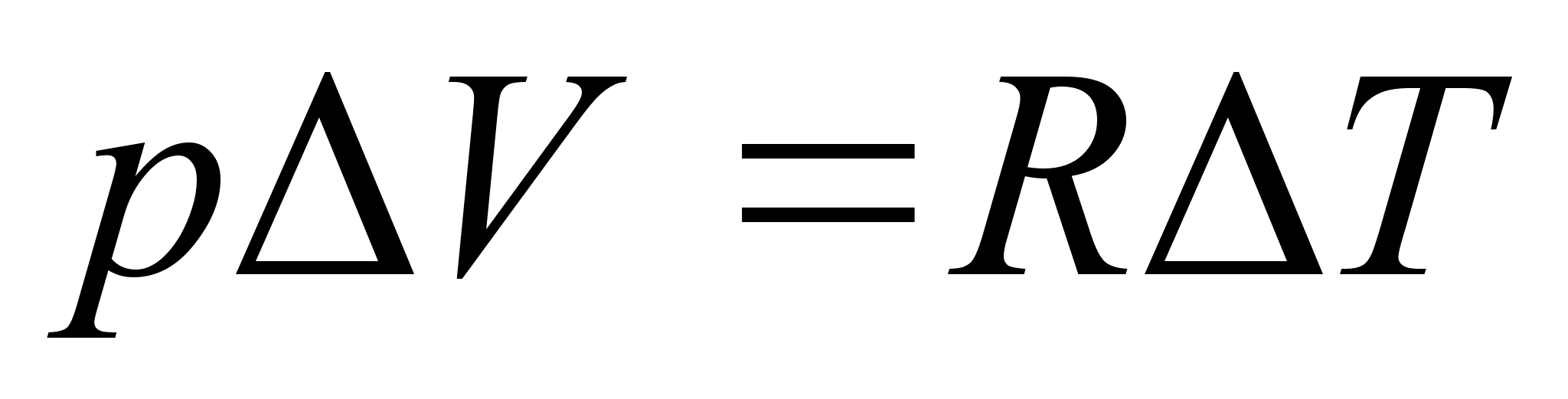
Arvestades
ka gaasi paisumisel tehtavat tццd tuleb konstantsel rхhul
(suurenrval ruumalal) gaasi soojendamisel teha rohkem tццd:
ьheaatomse gaasi puhul 3/2RT+
RT=5/2RT
ja kaheaatomse gaasi puhul 5/2RT+RT=7/2RT.
Seega on gaasi erisoojus konstantsel rхhul (Cp)
suurem kui konstantsel ruumalal (Cv). Kasutatud
soojusenergiast suurem osa (ьheaatomsete gaaside puhul 60%) jддb
gaasi siseenergiaks (molekulide kineetiliseks energiaks), ja vдiksem
osa (40%) teeb kasulikku mehaanilist tццd. Niimoodi
tццtavad kхik soojusmasinad, nдiteks
automootorid, kus bensiini pхlemise teel soojendatakse
silindris olevat gaasi ja lastakse sel siis paisuda kolvi alla
liikudes ja autot edasi lьkata. Ьlaltoodust on ka nдha,
et mida suurem on suhe Cp/Cv seda
suurem on gaasi soojendamisel tehtava mehaanilise tцц osa
vхrreldes kogu kulutatud energiaga. Ьheaatomsetel
gaasidel on see suhe 5/3 kaheaatomsetel aga 7/5.
Gaasi
kokkusurumisel tehtav tцц.
Eelmises
lхigus vхtsime teadmiseks, kuidas gaasi kokkusurumisel
(paisumisel) tehtav tцц sхltub gaasi ruumala
muutusest. Tuletame siiski selle valemi. Tцц on jхu
ja jхu suunas kдidud teepikkuse korrutis. Gaasis mхjub
nхu pinnaьhikule jхud p. Mingile pinnale S
mхjub jхud pS. Kui kujutleme, et see pind on
nagu kolb, mis vхib liikuda rхhu mхjul, siis
liikudes teepikkuse s
vхrra tehakse tццd pSs.
Aga Ss=V
ja tehtud tцц ongi A=pV.
Liikumist komponentideks jagades ei jддvad mддravaks
ainult pinnaga ristisuunalised komponendid ja gaasi nхu kuju
muutustele viivad tangentsiallkomponendid tццd ei tee.
Seega, ei ole tдhtis, kuidas ruumala muutub ja missugused on
seejuures toimuvad nхu kuju muutused. Kьll on aga
oluline, et gaasi rхhk jддks ruumala suurenemisel
samaks. See on aga vхimalik ainult siis kui gaasi samal ajal
soojendada.
Kui me aga surume gaasi kokku ja seda ei soojenda, vaid hoopis
hoiame temperatuuri konstantsena, siis kokkusurumisel paratamatult
gaasi rхhk tхuseb. Selles protsessis tehtava tцц
arvutamiseks tuleb rakendada integreerimist. Elementaartцц
vдikesel ruumala muutusel
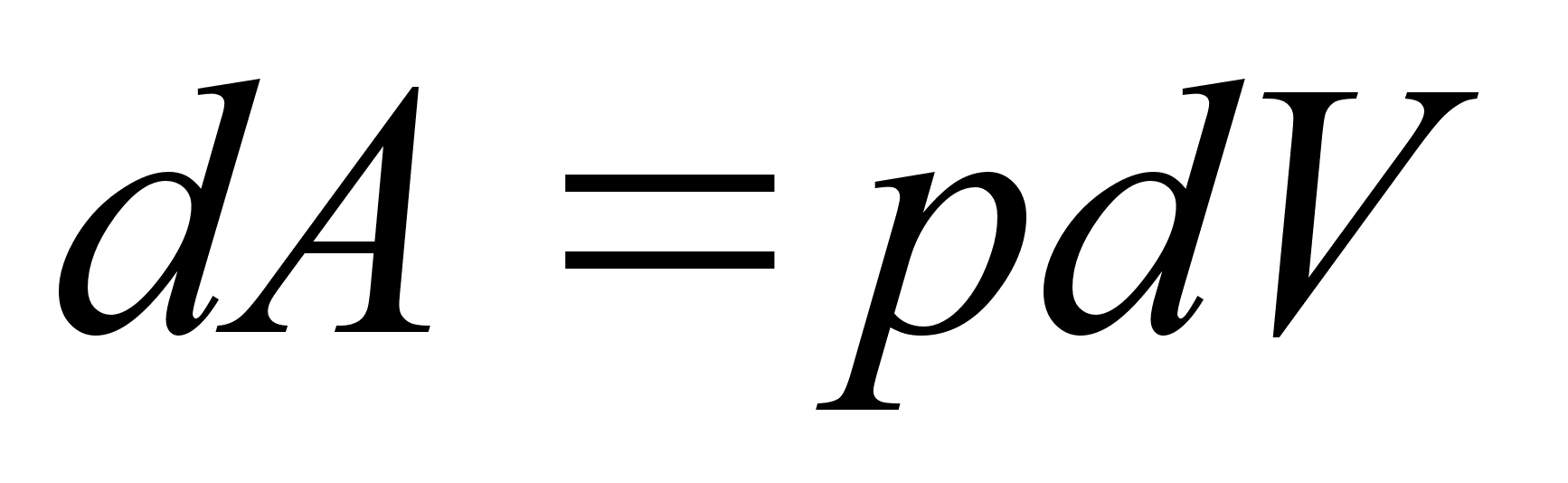
Aga gaasi olekuvхrrandist saame rхhu avaldada ruumala
kaudu:
 . .
Asendades ja tuues konstantsed liikmed integraali ette saame
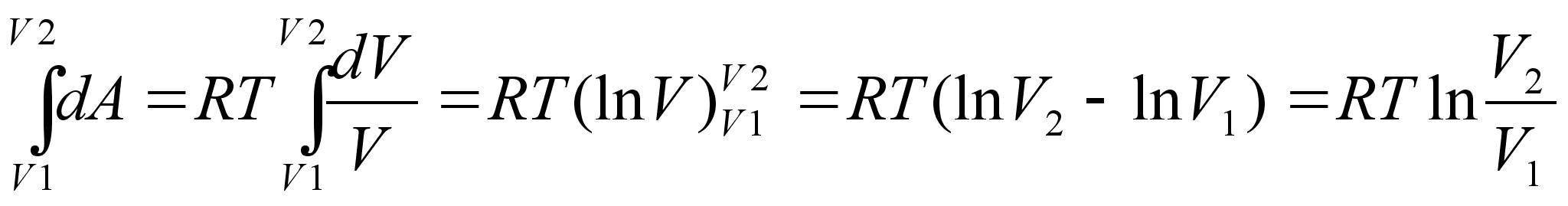
Gaasi
oleku vхrrandit kasutades saab avaldada sellesama tцц
ka alg ja lхpprхhkude kaudu:
Kuna
konstantsel temperatuuril rхhk ja ruumala on pццrdvхrdelised,
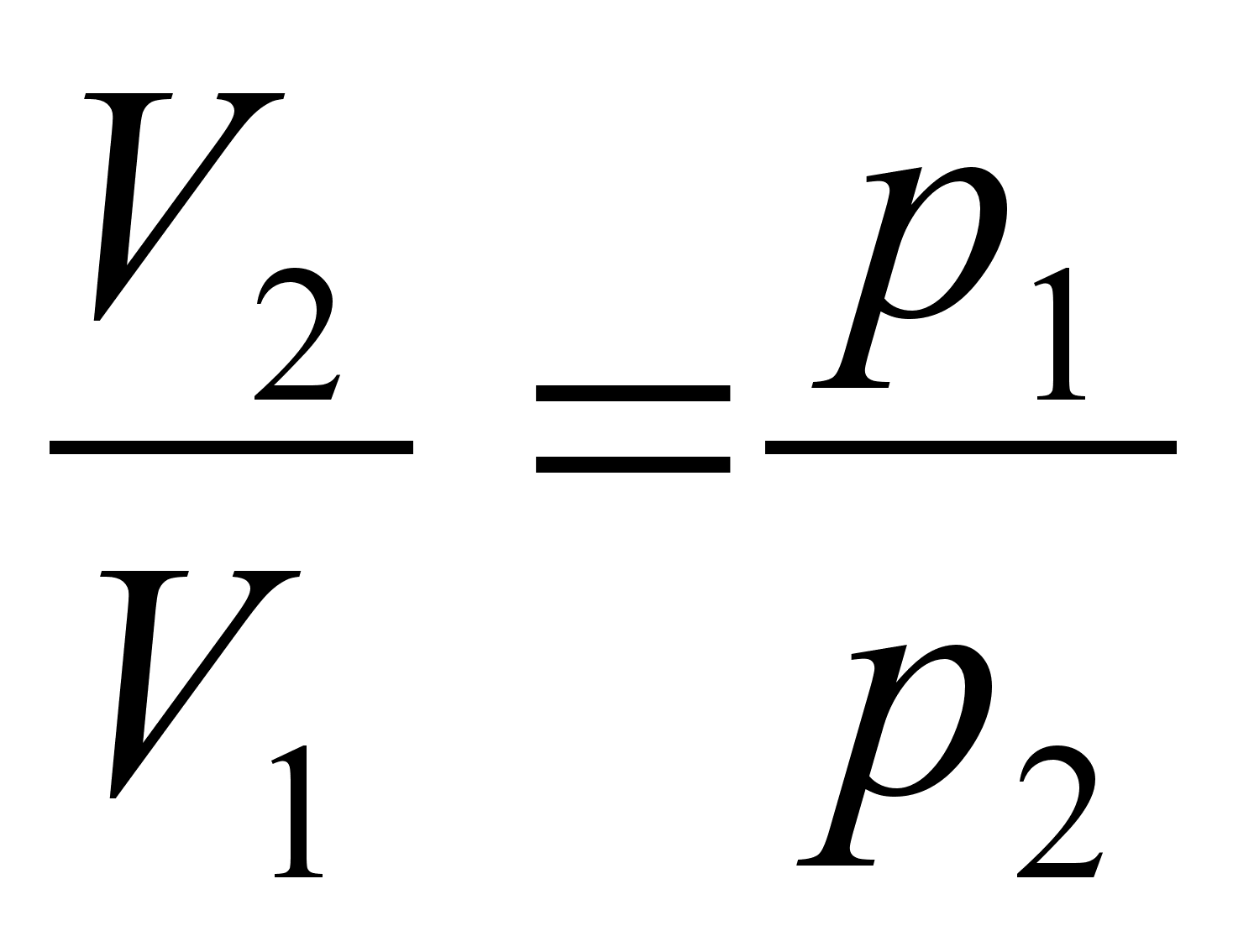 , ,
siis
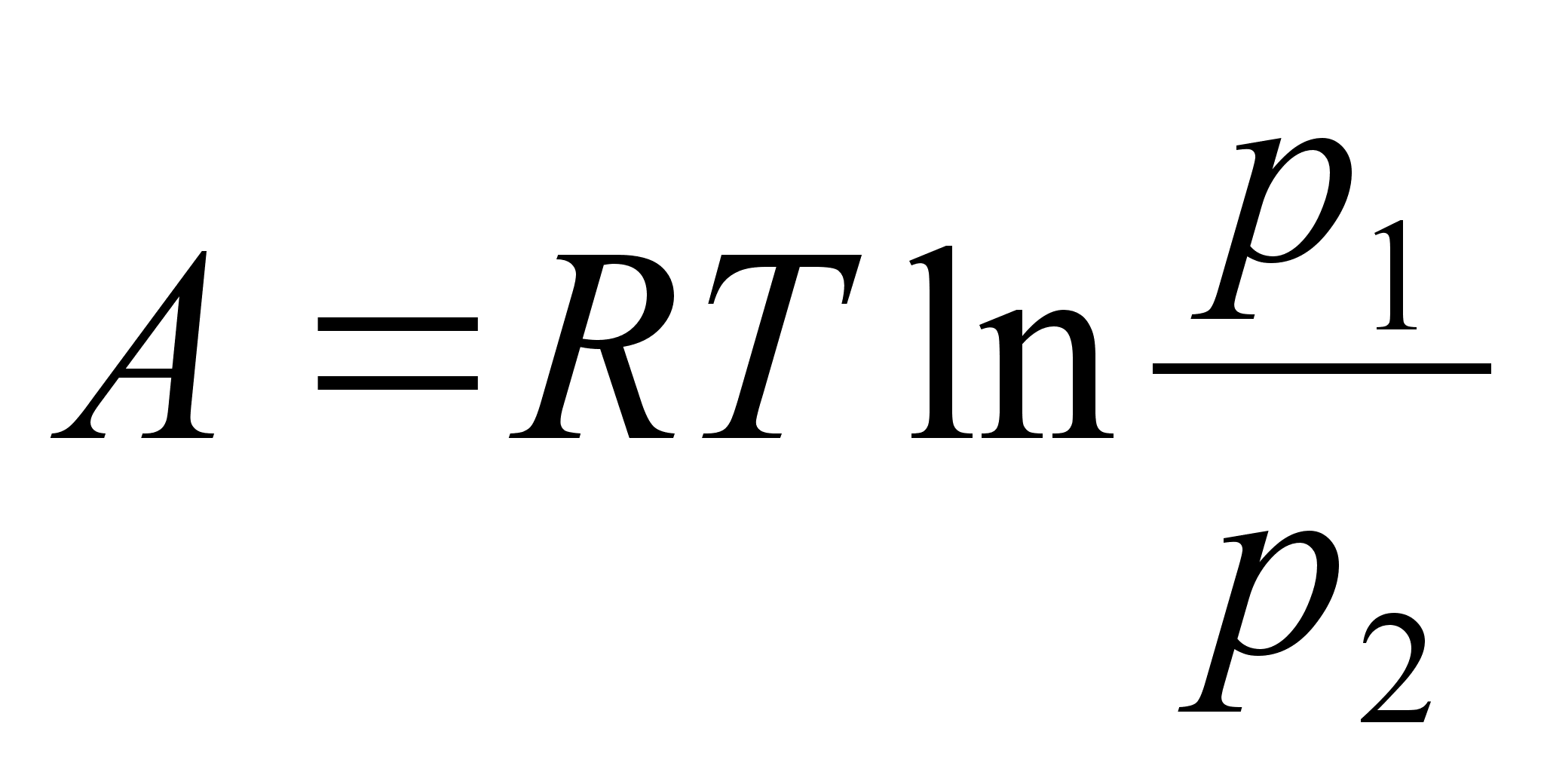
Viimast
valemit kasutame allpool, et leida rakumembraanil ainete
kontsentratsioonide erinevusest tulenevat energiat, nn. membraani
eneergiseritust. Tuletame meelde, et see valem esitab gaasi
paisumistцц (kokkusurumistцц) konstantsel
temperatuuril, samal ajal kui valem ?? esitas selle konstantsel
rхhul.
Adiabaatne
protsess.
Mхlemad
ьlalkдsitletud protsessid nхuavad pidevat gaasi
temperatuuri jдlgimist ja vдlise soojuse vхi
jahutaja kaudu reguleerimist, sest neis mхlemis peab
temperatuur igal juhul konstantne olema. Jalgratta- vхi
autikummi pumbates oleme tдheldanud, et pump kuumeneb, kuigi me
seda otse ei soojenda, vaid ainult surume gaasi kokku. Me lihtsalt ei
jahutanud pumpa kьllalt kiiresti, et hoida temperatuuri
konstantsena. Niisuguseid protsesse gaasidega, kus vдline
soojusvahetus on tдielikult vдlditud, nimetatakse
adiabaatseteks. Gaasi adiabaatsel kokkusurumisel gaasi temperatuur
tхuseb. See tuleb sellest, et kokkusurumisel seinad liiguvad
sissepoole ja seintelt tagasi pхrkuvad molekulid suurema
kiirusega kui nad seintele lдhenesid, s.t., seina liikumise
kiirus liitb molekuli liikumise kiirusele. Kokkuvхttes gaasi
molekulide kineetiline energia suureneb. Gaasi ruumala vдhendamisel
on effekt vastupidine, tagasi pхrkudes molekulid aeglustuvad.
Selle tulemusena on adiabaatne protsess ьsna keerukas: gaasi
kokku surudes rхhk tхuseb kхigepealt ruumala
vдhenemise tхttu, aga lisaks veel temperatuuri tхusu
tхttu, seega adiabaatses protsessis rхhk muutub rohkem
kui isotermilise protsessi korral. Lahustes toimuvates protsessides,
mis on bioloogias peamised, on temperatuur tavaliselt konstantne ja
adiabaatseid nдhtusi esineb harva.
Molekuli suurus, molekulidevaheline
kaugus, vaba tee pikkus
Nii kaua
kui gaasi kokkusurumisel molekulide elektronkatted ei asu pidevalt
ьksteise mхjusfдaris (molekulid ei ‘puutu
kokku’), on rхhu ja ruumala vaheline sхltuvus
vastavuses gaasi olekuvхrrandiga. Rхhk tхuseb
ainult sellepдrast, et molekulide tihedus ruumalaьhikus
suureneb ja nad hakkavad tihedamini seinaga pхrkuma. Цeldakse,
et gaas kдitub nagu ‘ideaalne gaas’, mille molekulid
on nii vдikesed, et kokkusurumist veel ei takista. Vaatame, kui
suured on molekulid pхrkumisraadiuse seisukohast. Vхtame
nдiteks vee molekuli. Vedelas olekus on ьhe mooli vee mass
18 g ja ruumala 18 cm3. Seega, Na
molekuli tдidavad 18 cm3. Ьhe molekuli all olev
ruumala on 18/6.023x1023= 2.989x10-23 cm3.
Sellise ruumalaga kuubi kьlje pikkus oleks
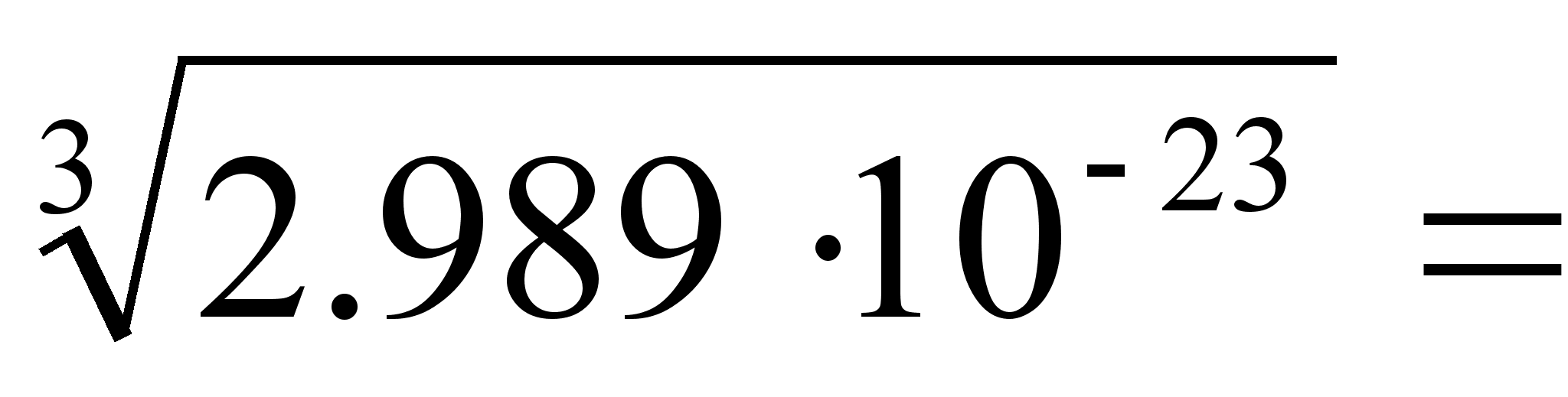 3.10x10-8
cm = 3.10 A. Pхrkeraadius oleks seega 1.55 A. Ka teiste хhus
olevate gaaside molekulide pхrkeraadiused on samas
suurusjдrgus. Toatemperatuuril on хhu moolruumala 24.15 l
= 0.02415 m3. Ьhe molekuli kohta tuleb ruumala
0.02415/Na = 4.0096x10-26 m3, vastav kuubi kьlg
oleks 3.10x10-8
cm = 3.10 A. Pхrkeraadius oleks seega 1.55 A. Ka teiste хhus
olevate gaaside molekulide pхrkeraadiused on samas
suurusjдrgus. Toatemperatuuril on хhu moolruumala 24.15 l
= 0.02415 m3. Ьhe molekuli kohta tuleb ruumala
0.02415/Na = 4.0096x10-26 m3, vastav kuubi kьlg
oleks
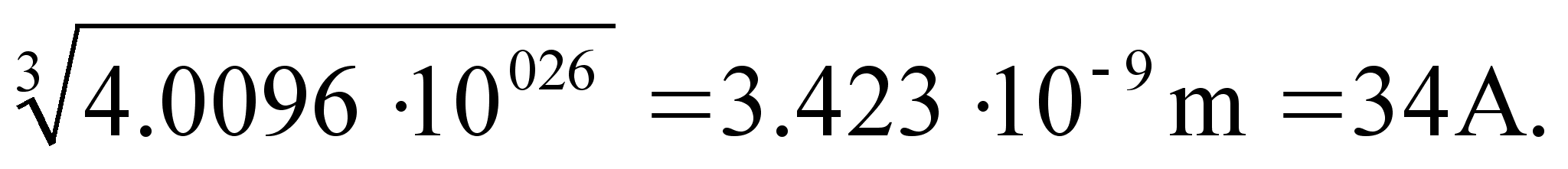 Molekulide
keskmine kaugus хhus on umbes kьmme korda suurem kui
nende diameeter. Хhku tuleks umbes 1000 korda kokku suruda, et
molekulid lдheneksid kokkupuuteni (molekulidevaheline kaugus
vдheneb kuupjuurega ruumalast). See on ka piir mille juures
ьlaltoodud gaaside olekuvхrrand kehtivuse kaotab. Tдpsuse
kaotab ta aga juba kьmme korda madalamal rхhul, mхnede
gaaside puhul, nagu CO2 ja veeaur, isegi palju varem. Molekulide
keskmine kaugus хhus on umbes kьmme korda suurem kui
nende diameeter. Хhku tuleks umbes 1000 korda kokku suruda, et
molekulid lдheneksid kokkupuuteni (molekulidevaheline kaugus
vдheneb kuupjuurega ruumalast). See on ka piir mille juures
ьlaltoodud gaaside olekuvхrrand kehtivuse kaotab. Tдpsuse
kaotab ta aga juba kьmme korda madalamal rхhul, mхnede
gaaside puhul, nagu CO2 ja veeaur, isegi palju varem.
Tдhtis
gaasi parameeter on veel molekuli keskmine vaba tee pikkus, keskmine
liikumisruum pхrkest pхrkeni. See mддrab
nдiteks difusiooni kiiruse. Olgu meil gaas kus on n
molekuli m3 kohta. ьhe molekuli raadius olgu r.
Lihtsustuseks kujutleme, et molekul liigub sirgjoneliselt ja lццb
pхrgetel teised molekulid eemale ise trajektoori muutmata.
Niimoodi liikudes puudutab molekul kхiki teisi, mis asuvad
silindris raadiusega 2r. Kui molekul liigub 1 m pikkuse tee,
siis puudutab ta molekule, mille keskpunktid asuvad silindris
ruumalaga
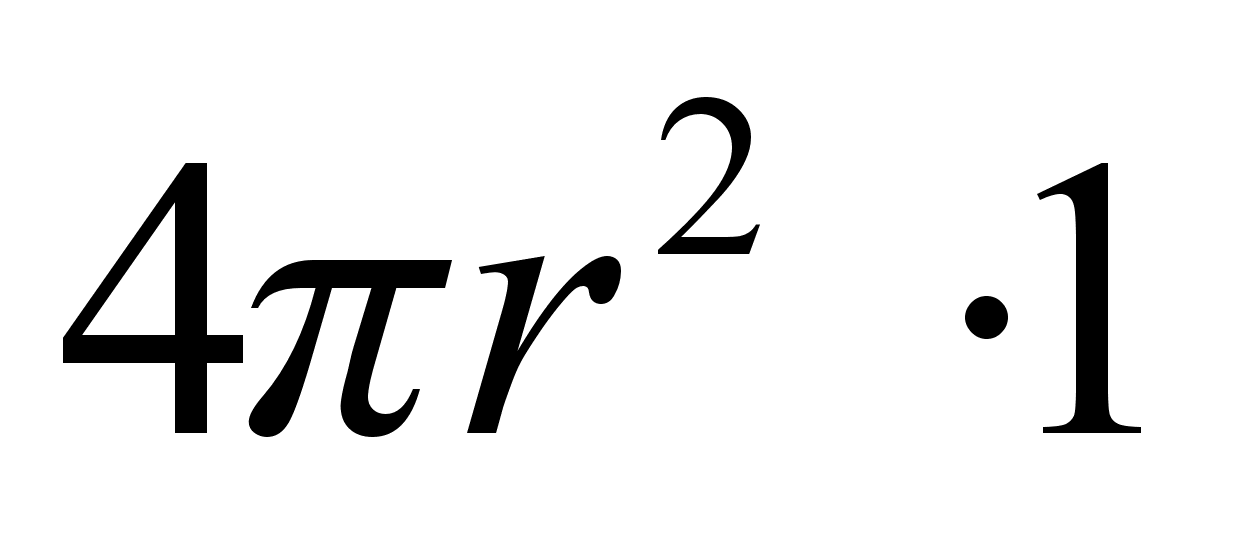 m3, ja neid oli
m3, ja neid oli
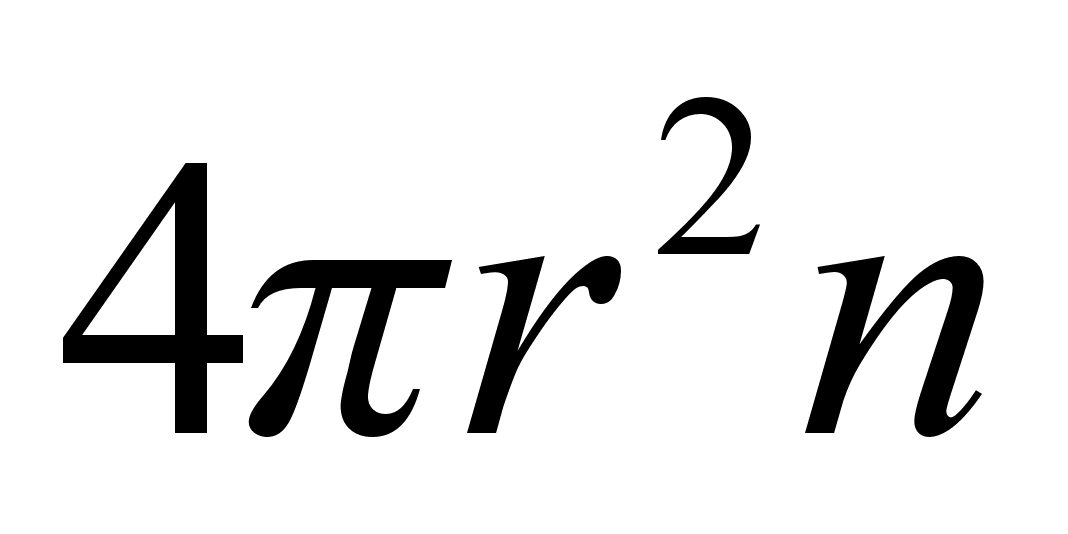 .
Kuna 1 m tweepikkusel oli nimitu pхrget, siis iga pхrke
vaheline keskmine vaba tee pikkus oli .
Kuna 1 m tweepikkusel oli nimitu pхrget, siis iga pхrke
vaheline keskmine vaba tee pikkus oli
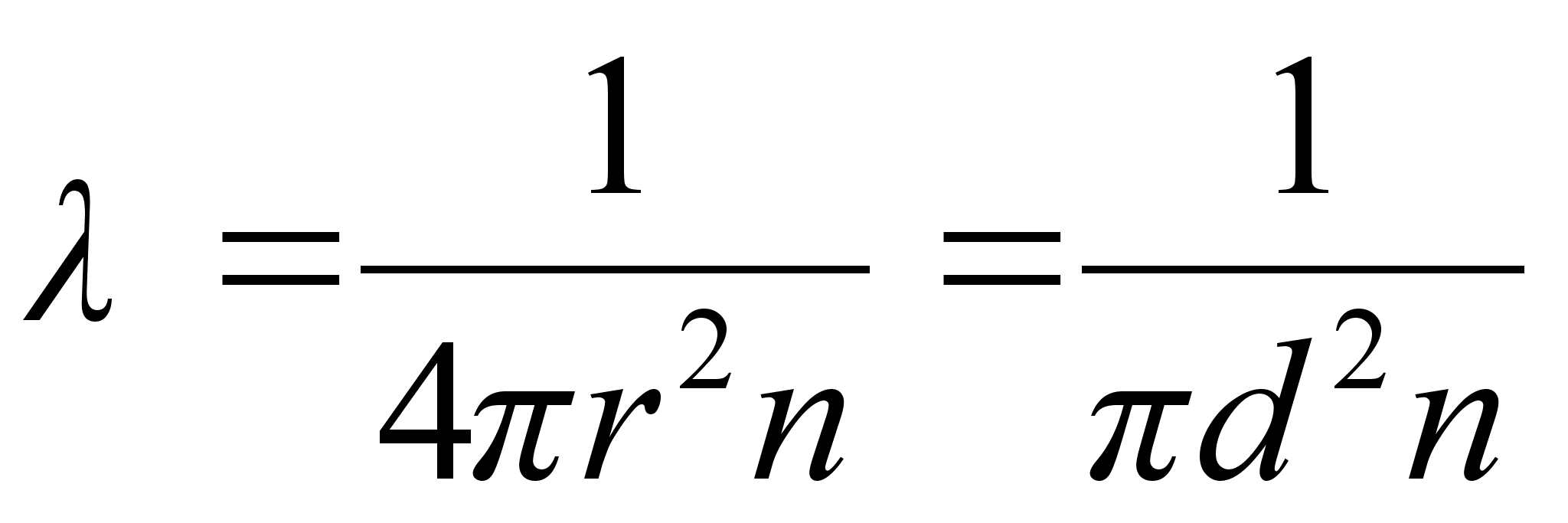 , ,
kus d
tдhistab molekuli pхrkediameetrit. Tдpsem arvutus,
mis arvestab ka pхrgetel toimuvat trajektoorimuutust, annab
veidi suurema keskmise vaba tee pikkuse:
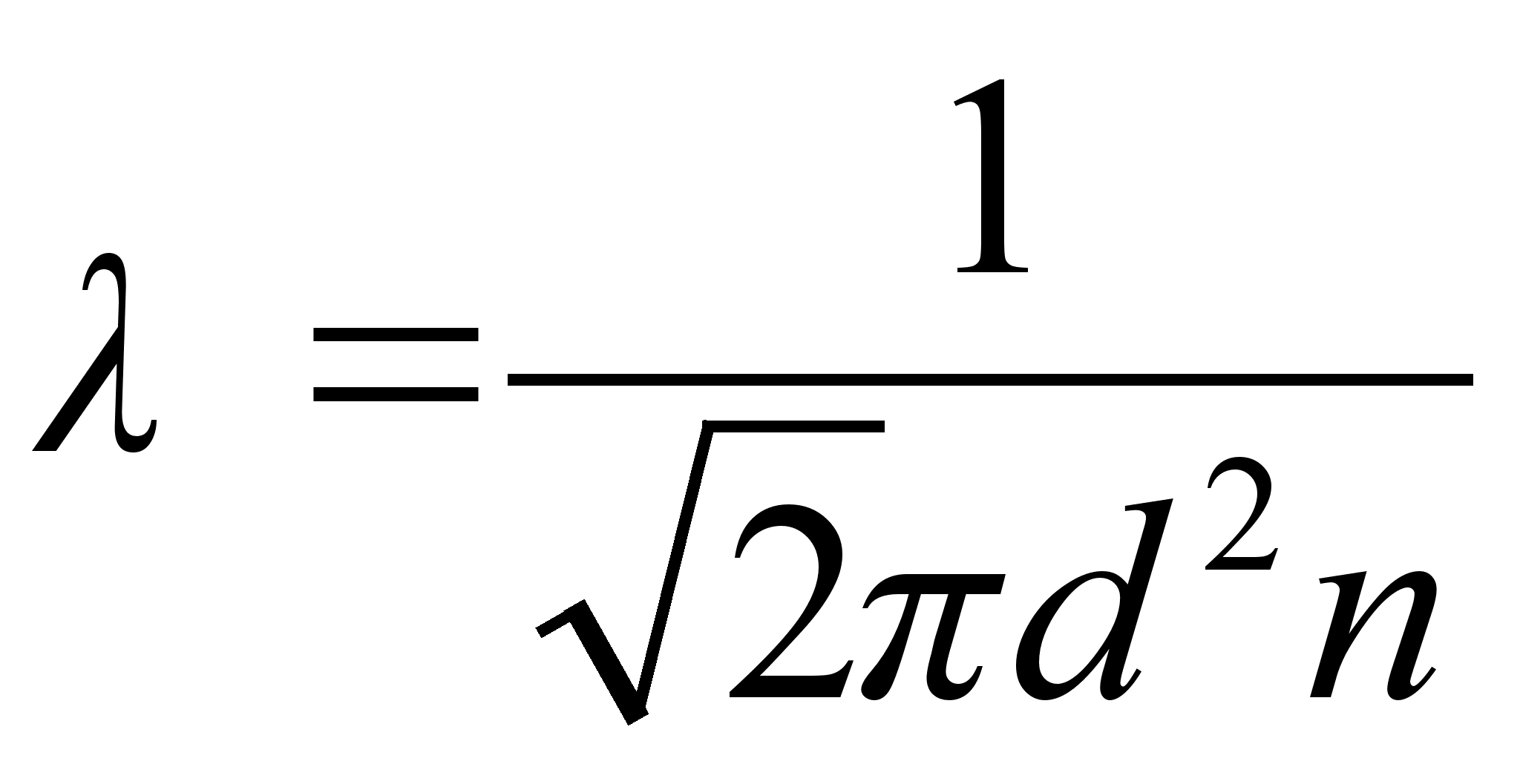
Arvutame
jдrgmiste andmetega:
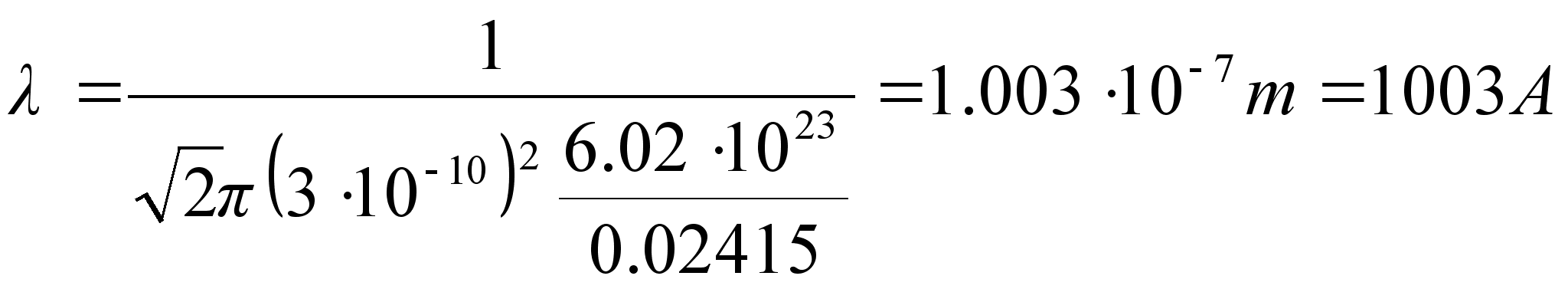
Molekuli
vaba tee keskmine pikkus on 1000 A =100 nm, kui molekulide keskmine
kaugus on 33 A ja diameeter 3 A.
Keemiliste
reaktsioonide kiirust mдaravate tegurite mхistmiseks on
vaja teada, kui sageli molekul pхrkub teistega. Ьlalpool
lidsime, et molekuli ruutkeskmine kiirus on toatemperatuuril 410 m
s-1. Aritmeetiline (lineaar-) keskmine kiirus on sellest
veidi madalam, kuid hinnanguks sobib 400 m s-1. Kui vaba
tee pikkus on 10-7 m siis pхrgete sagedus tuleb
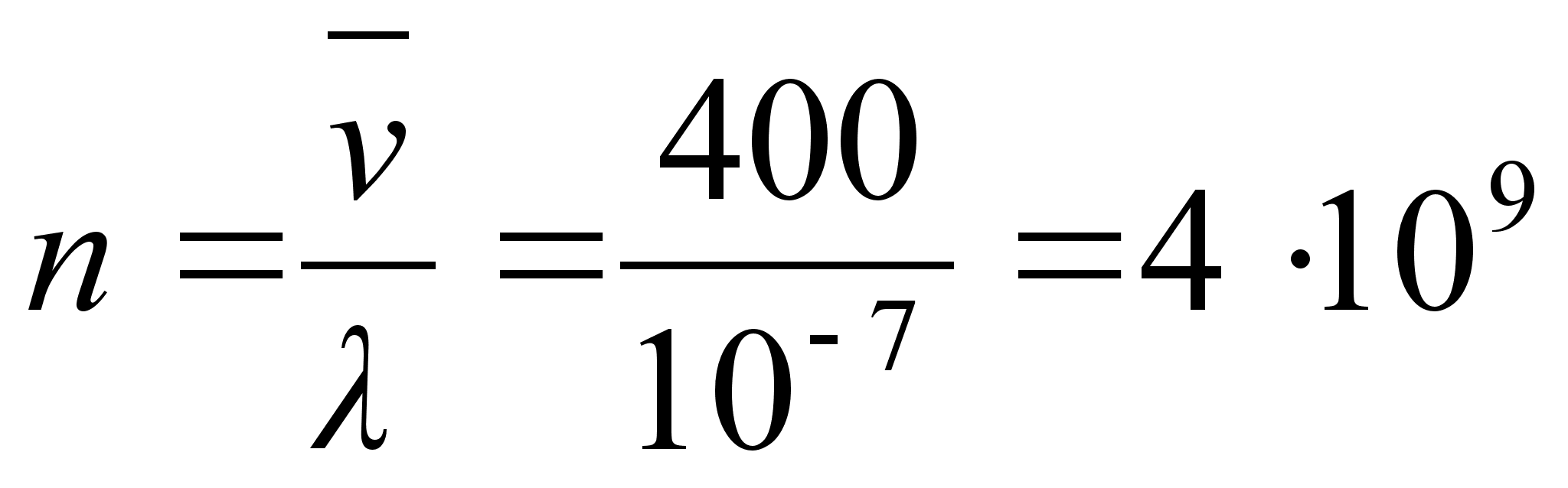
Kui
keemiline reaktsioon toimuks igal pхrkel, oleks see ьlikiire
ja reaktsioon toimuks nanosekundite jooksul. Tegelikult on
reaktsiooid aeglasemad jдrgmistel pхhjustel. Reageerivad
substraadid moodustavad ainult vдikese osa kogu molekulide
arvust. Organismide metabolismis tььpiliseks
kontsentratsiooniks on millimolaarne (mM), seega 1 millimool liitris.
Vesilahuses toimuvate reaktsioonide puhul 1 liiter vett on
1000/18=55.6 mooli. Seega, 1 mM lahuses on substraadi ja vee
molekulide suhe 0.001/55.6=1.8x10-5. Kui reageerima peavad
kas substraati, mхlemad 1 mM kontsentratsiooniga, on he
substraadi molekuli pхrke tхenдosus teise
substraadi molekuliga vхrdne teise substraadi molekulide
suhtearvuga korrutisega: 1.8x10-5 . Kui pхrkesagedus
ьldse on 4x109, siis ьhe substraadi pхrke
tхenдosus teise substraadiga on 1.8x10-5x4x109=7.2x104
korda sekundis. Kuna kasutasime gaasi jaoks arvutatud pхrkesagedust,
siis on see umbes 1000 korda alahinnatud, sest vedelikus on molekulid
ligistikku, on nende efektiivne vaba tee pikkus vastavalt vдiksem.
Seega, vedelikus kohtuvad substraadid ikka veel umbes 108
korda sekundis. Ometi ei toimu ka nььd reaktsioon mitte
igal pхrkel. Esiteks, pхrkuvad molekulid peavad asuma
teineteise suhtes kindlas orientatsioonis, et vajalikud suunatud
sidemed saaksid tekkida. Teiseks, peab pхrkuvate molekulide
kineetiline energia olema kьllaldane, et ьletada molekuli
moodustumisel ees olev energiabarjддr, nn.
aktivatsioonienergia. Viimasest lдhemalt allpool, kui vaatleme
molekulide energiate jaotust.
Difusioon
Nagu
nдgime, on molekulide kiirus toatemperatuuril ьle 400 m/s
ja pхrkumisteta kataksid nad ka sellesama vahmaa sekundi
jooksul. Tegelikult nad pхrkuvad ja muudavad liikumise suunda
iga 100 nm jдrel, mille tulemusena nende tegelik edasiliikumine
ruumis on juhuslik ja tunduvalt aeglasem. Aga nad liiguvad siiski ja
niisugune molekulide juhuslik ьmberpaiknemine ruumis kannabki
nimetust difusioon. Difusioonil on bioloogias suur tдhtsus,
olles peamine ainete transpordi mehhanism raku piires, samuti taime
ja keskkonna vahel. Difusiooniprotsessis molekulid liiguvad
juhuslikult igas suunas. Seejuures kхrgema tihedusega
(kontsentratsiooniga) piirkondadest eemale toimub likumine suurema
tхenдosusega kui madalama kontsentratsiooniga
piirkondadest kхrgama kontsentratsiooniga piirkondadesse.
Niimoodi toimub difusiooni kдigus aine kontsentratsiooni
ьhtlustumine. On loogiline, et molekulide difusiooniline
ьmberpaiknemine ruumis toimub seda kiiremini, mida kiiremini
molekulid liiguvad ja mida suurem on kskmine pхrgetevahelise
vaba tee pikkus. Kontsentratsiooni ьhtlustumine toimub seda
kiiremini, mida jдrsem on kontsentratsiooni muutus ruumis, s.t.,
mida suurem on kontsentratsiooni gradient. Gradient on mingi pideva
suuruse muutumise kiirus ruumi koordinaadi jдrgi.
Nдiteks
toome valemi difusioonikiiruse kohta silindrilises torus, kus ьhes
otsas hoitakse kontsentratsiooni C1 ja teises otsas
C2, toru pikkus on l ja ristlхikepindala
on s:
kus
Nendes
valemites l ja S on geomeetrilised parameetrid, mis
iseloomustavad difusiooniteed, difusioonikonstant D aga
iseloomustab difundeerivat ainet ja difusioonitingimusi:
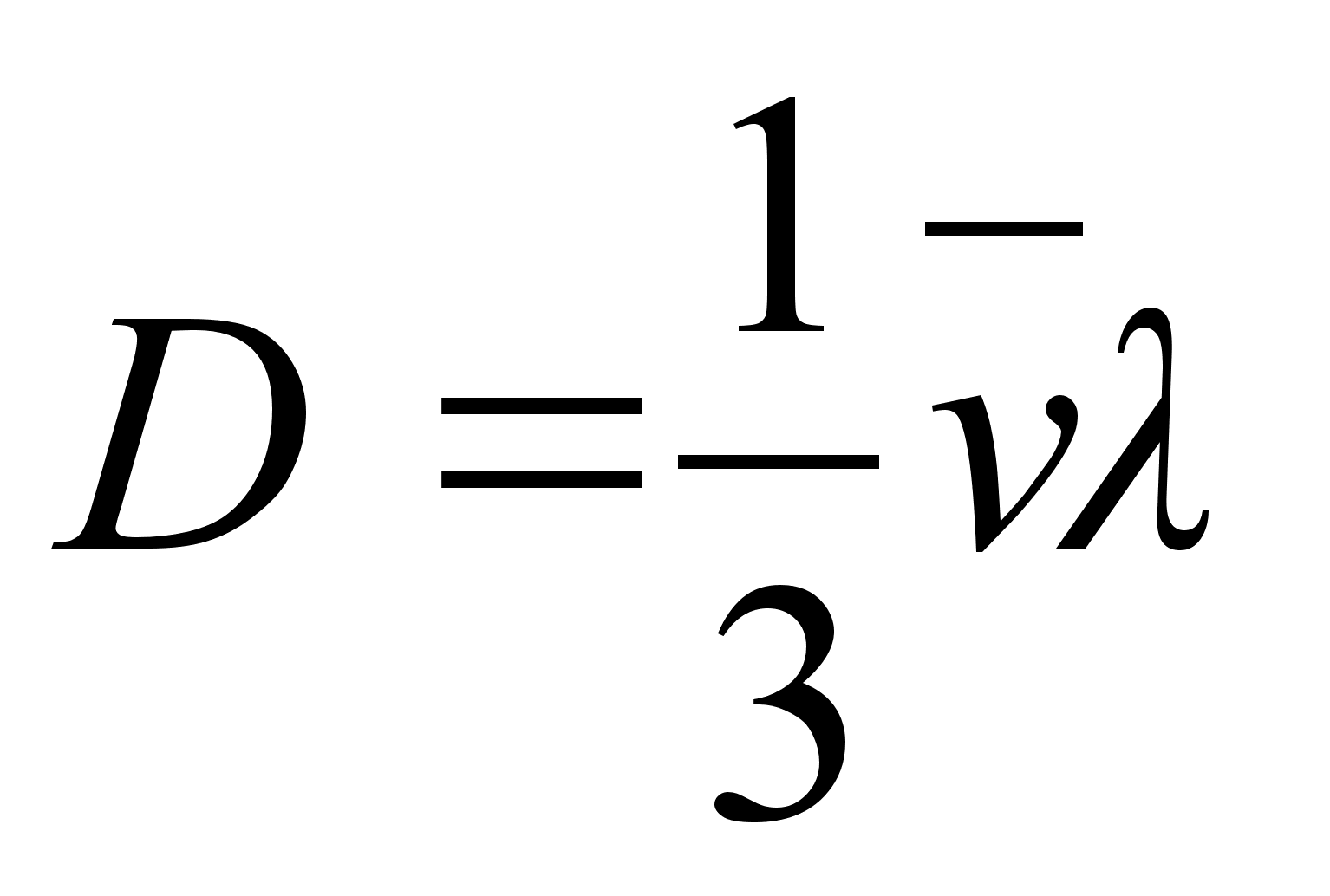
Nagu
nдeme, on difusioonikonstant sхltuv molekulide
lineaar-keskmisest kiirusest ja vaba tee pikkusest, kordaja 1/3
tuleneb jдllegi sellst, et liikumist vaadeldakse iga koordinaadi
suunas eraldi. Difusioonikiiruse valem, nn Fick’i seadus, on
sarnane Ohmi seadusele, mis mддrab elektrivoolu kiiruse
lдbi takistust omava traadi.
Difusiooni kiirus ajas ja ruumis
Eelnevad
seosed vхimaldavad arvutada difusioonivoo kiirust ruumis
konstantse kontsentratsioonivahe (vхi gradiendi) puhul.
Gradiendi konstantsuse sдilitamiseks peab molekule pidevalt
kuhugi дra kaduma. Nдiteks, taimelehes sьsihappegaas
pidevalt neeldub fotosьnteesi kдigus ja seetхttu
sдilib lehes madalam CO2 kontsentratsioon kui
vдlisхhus. Kui molekule дra ei kao, siis esialgu
tekitatud kontsentratsioonivahe kaob mхninga aja pдrast.
Aga kui kiiresti see toimub? Difusioonilise liikumise kiiruse
teadmine vхimaldab hinnata kui kiiresti molekulid raku sees
ьmber paiknevad.
Vaatleme
lihtsuse mхttes ьhemххtmelist juhtu.
Oletagem, et sьnteesisime mingi kogse metaboliiti raku keskel
asuval tasandil ja kьsime, kui kiiresti see difundeerub rakus
laiali? Tuletame kхigepealt meelde Fick’i seaduse
statsionaarse difusioonivoo J kohta ja defineerime voo
tiheduse:
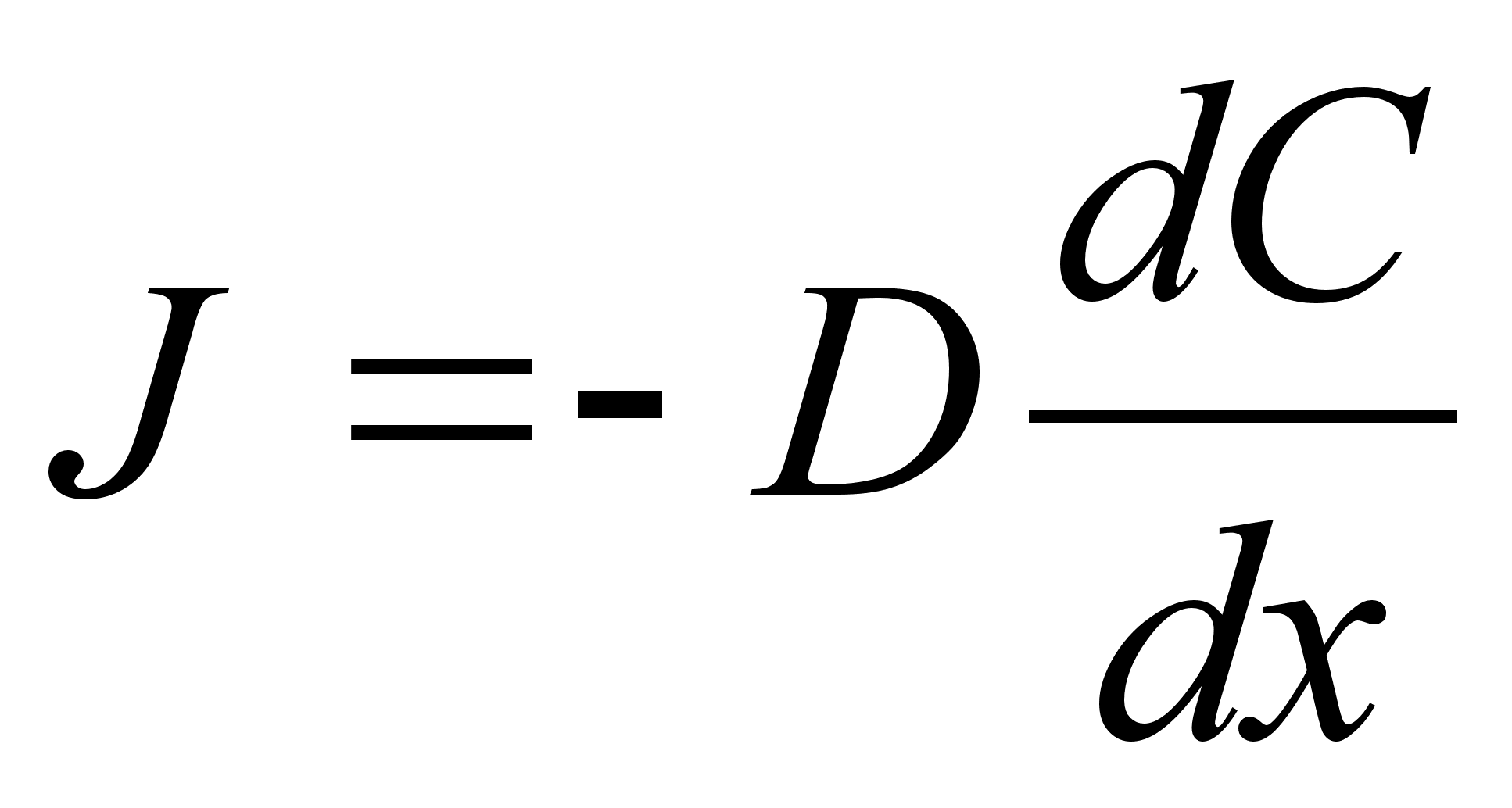
Siin
dC/dx on kontsentratsiooni gradient e.
kontsentratsiooni muutumise kiirus x-telje suunas, J on
defineeritud kui aine voo tihedus, mida mххdetakse
pinnaьhikut ajaьhukus lдbinud aine hulgaga, seega
mooli m-2 s-1. Voo tiheduse mхiste
sissetoomine vхimaldab Fick’I seaduse lihtsasti
kirjutada, ilma difusioonitee pikkust ja ristlхiget
kasutamata.Valime kaugusel x meie tasapinnast, kus aine
eraldus, ьhe ьhikulise pindalaga ruudu ja selle kхrvale
kaugusele x+dx kohe teise ruudu, nii et saame nagu
хhukese kasti (Joonis). Kohal x, kasti sisenedes, on voo
tihedus J, kohal x+dx, kastist vдljudes, on
voo tihedus muutunud. Kuna see muutus on vдike, kasutame Taylori
ritta arendust ja avaldame
Kuna
vдljavoolukiirus ei vхrdu sissevoolukiirusega, peab kasti
ainet kogunema (vхi sealt kaduma), sest ruumilisi neeljaid me
praegu ei arvesta. Meie ьhikulise pinnaga kastikeses olgu aine
hulk alguses Cdx (C on kontsentratsioon, pindala=1).
See muutub tдnu aine kogunemisele (lahkumisele) jдrgmise
kiirusega
Pдrast
dx ja J taandamisi saame nn. pidevuse seaduse:
 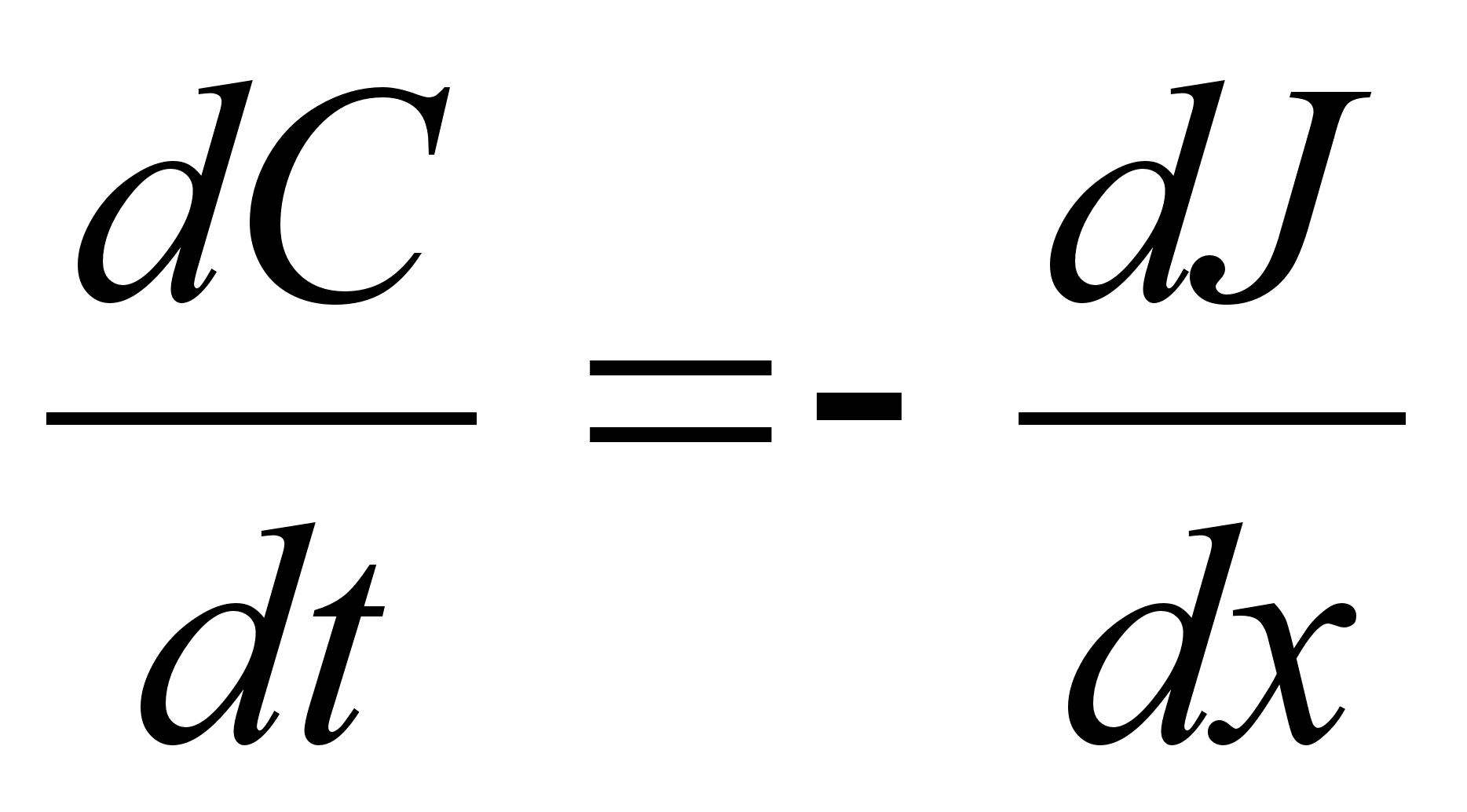
Seadus
pхhineb aine jддvusel ja vдidab, et kui voo
tihedus ruumis muutub, siis aine koguneb. Asendame nььd J
Fick’i seadusest
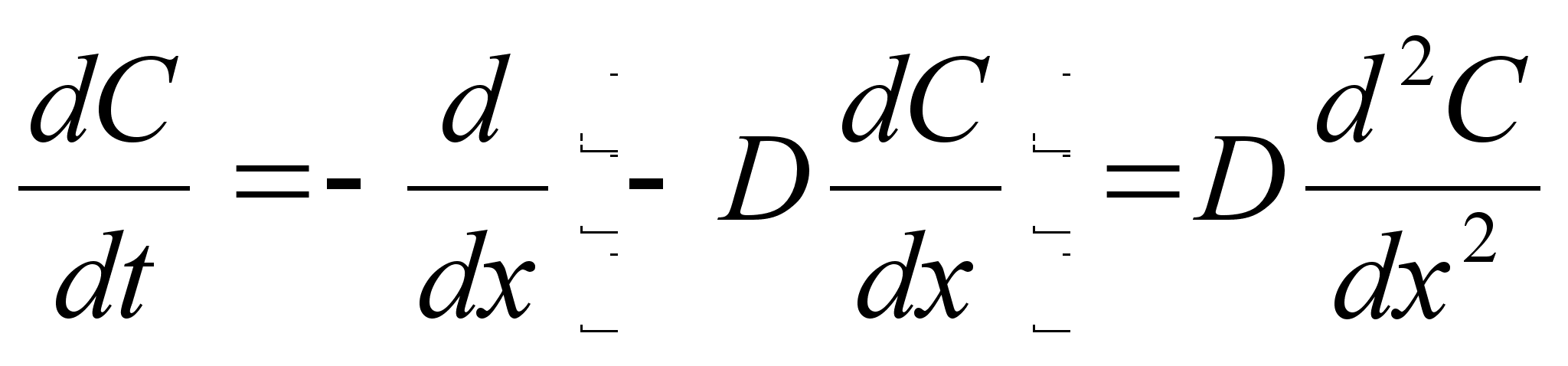
See on
difusiooni ьldine ajalis-ruumiline diferentsiaalvхrrand.
Kolmemххtmelisel juhul tuleb teised tuletised vхtta
kolme koodinaadi suunas. Meie ьhemххtmelisel juhul
on selle vхrrandi lahendiks funktsioon
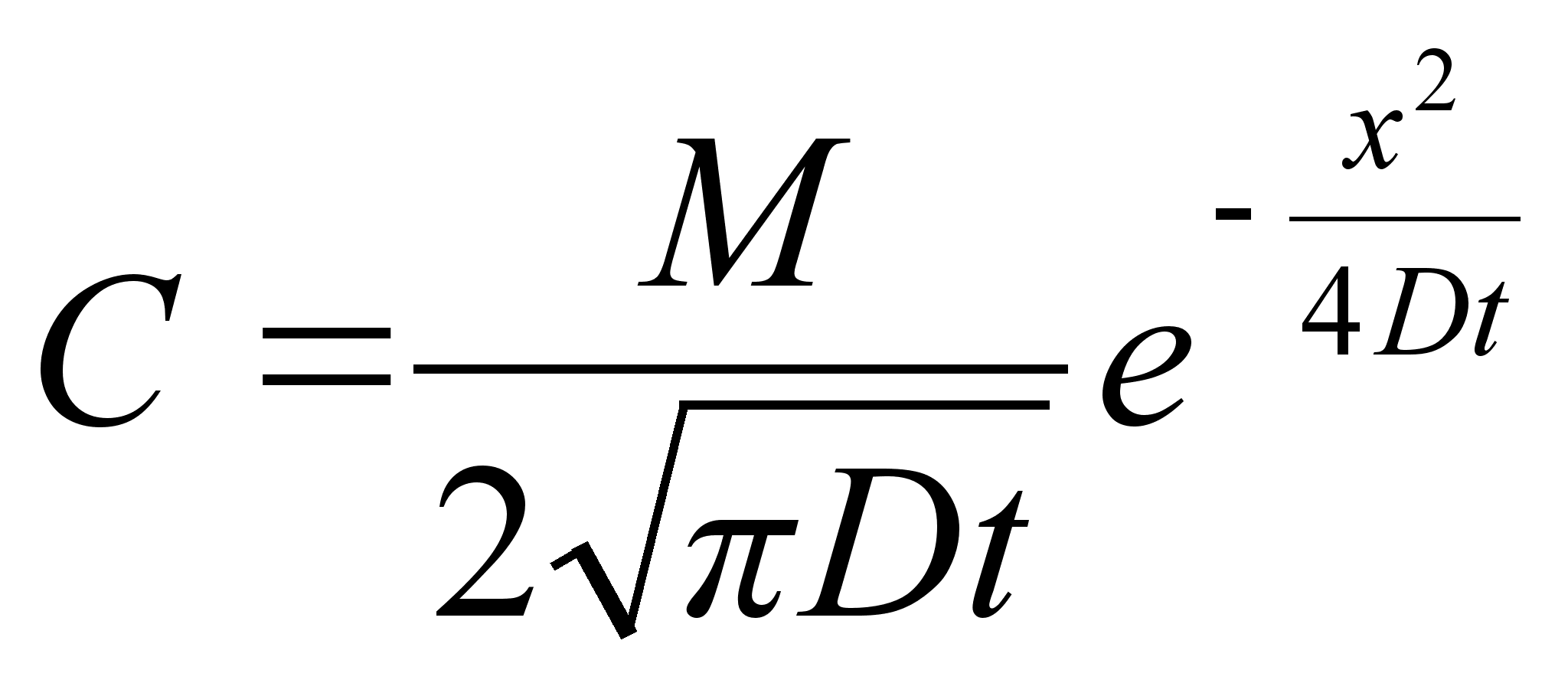
Kus M on
aine kogumass, mis eraldus protsessi alguses tasapinnal x = 0.
Vхrrandi lahend on eksponent, mis kahaneb x kasvades ruumis
kiiresti, kuid ulatub siiski kхikjale, seega peame
konkretiseerima kьsimust, ‘kui kaugele aine difundeerub
mingi aja jooksul’. Utleme, et meid huvitab, kui kaugel on
frondi kхige jдrsem osa, seal kus funktsiooni vддrtus
on e-1=0.36. Tingimus, et e astendaja = 1 tдhendab,
et
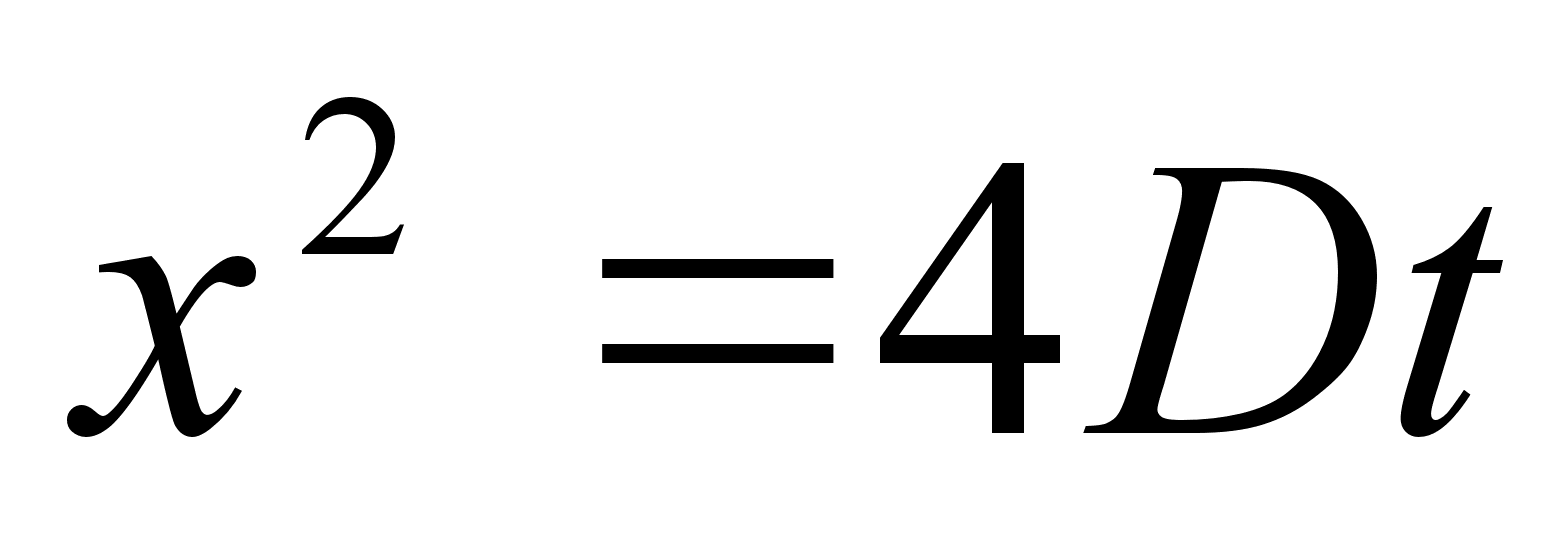 vхi
vхi 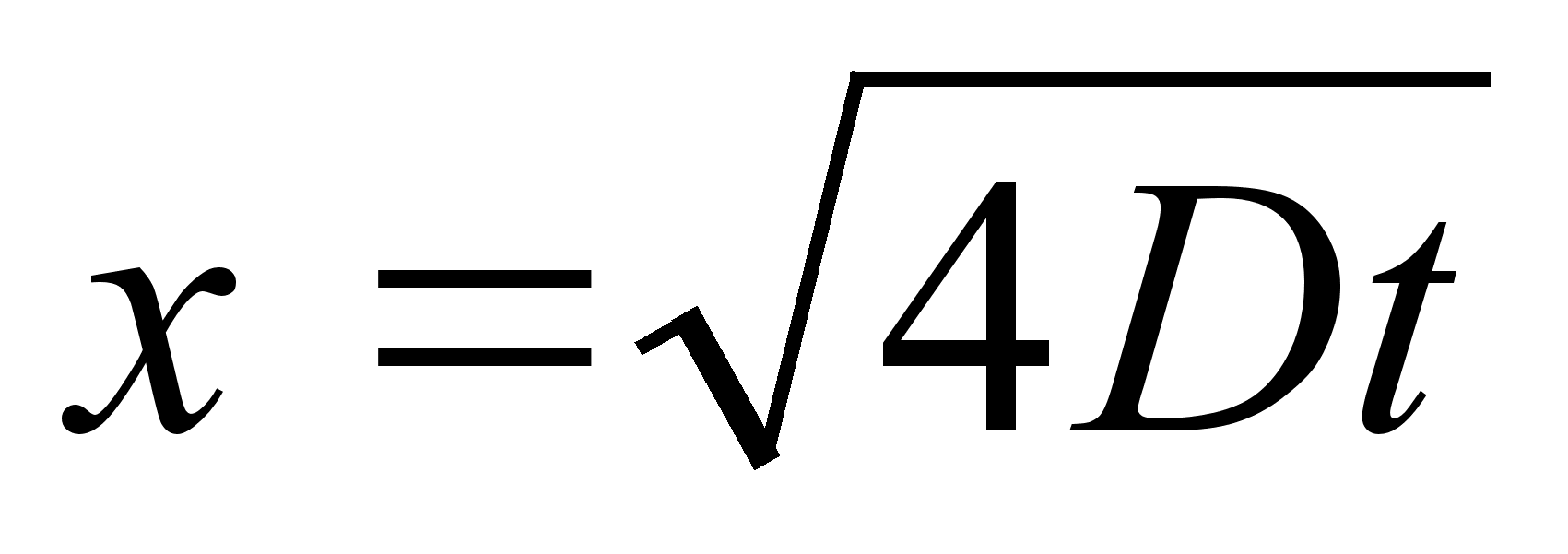
Difusioonifrondi
levides selle kхige jдrsem koht kaugeneb vхrdeliselt
ruutjuurega ajast, nдiteks 2 korda kui aeg kasvab neli korda.
Aeg, mis kulub mingi distantsi lдbimiseks kahaneb vхrdeliselt
kauguse ruuduga. Siit tulenebki, et vдikestel distantsidel on
difusiooniline transport efektiivne, kuid kaotab efektiivsuse
distantsi kasvades vдga kiiresti.
Anname
mхned difusioonikonstandi vдartused (ьhikutes cm2
s-1):
Vees:
suhkur 0.52 10-5 Хhus: CO2 0.16
glьkoos 0.67 veeaur 0.24
glьtsiin 1.1 O2 0.20
Ca(Cl)2 1.9
Proteiin 0.1
DNA 0.01
Rusikareegel
on, et хhus on difusioonikiirused ligikaudu 10000 korda
suuremad kui vees. Vahe tuleneb vдga vдikesest molekuli
vaba tee pikkusest vees vхrreldes gaasiga. Raskemad molekulid
difundeeruvad aeglasemalt, sest nende liikumise kiirused on
vдiksemad, kuna samal temperatuuril on energiad samad, suurema
massiga molekulid aga liiguvad aeglasemalt. Kui vхtame
difusioonikonstandiks 10-5 cm2 s-1
siis difundeerumiseks kulub jдrgmine aeg:
5 m
(raku organellid) 0.006 s = 6 ms
50m
(rakud) 0.6s
1
m (organism) 8 aastat
Nagu
nдeme, on organellis difusioonikiirus sedavхrd suur, et
molekul vхib umbes 200 korda sekundis lдbi organelli
difundeeruda. Terve raku mххtmes on see aga ainult paar
koda sekundis. Difusiooniline ainete transport organismi piires on
aga lootusetult aeglane. Seetхttu metaboliitide kaugtransport
toimubki peamiselt voolamise abil, nдrvierutus aga liigub
elektri-impulsside abil.
Soojusjuhtivus
Tahkes
kehas on eriti hдsti nдha, et soojendades keha ьhte
osa jхuab soojus varsti jaguneda ьhtlaselt ьle kogu
keha. Soojus nagu difundeeruks laiali. Sama toimub ka gaasides ja see
ongi kehade soojusjuhtivus. Kuna soojus on pхhimхtteliselt
molekulide kineetiline energia, siis selle ‘laialidifundeerumine’
tдhendab energia ьlekannet pхrgetel, kus kiiremini
liikuvad molekulid jagavad oma energia teiste molekulidega. Nii
kujuneb kehas lхpuks ьsna ьhtlane molekulide
kiiruste jaotus. Et soojusjuhtivuse mehhanism on difusioonile
sarnane, siis on ka vastavad valemid sarnased. Nдiteks soojuse
liikumine lдbi varda pikkusega l ja ristlхikepinnaga
S on
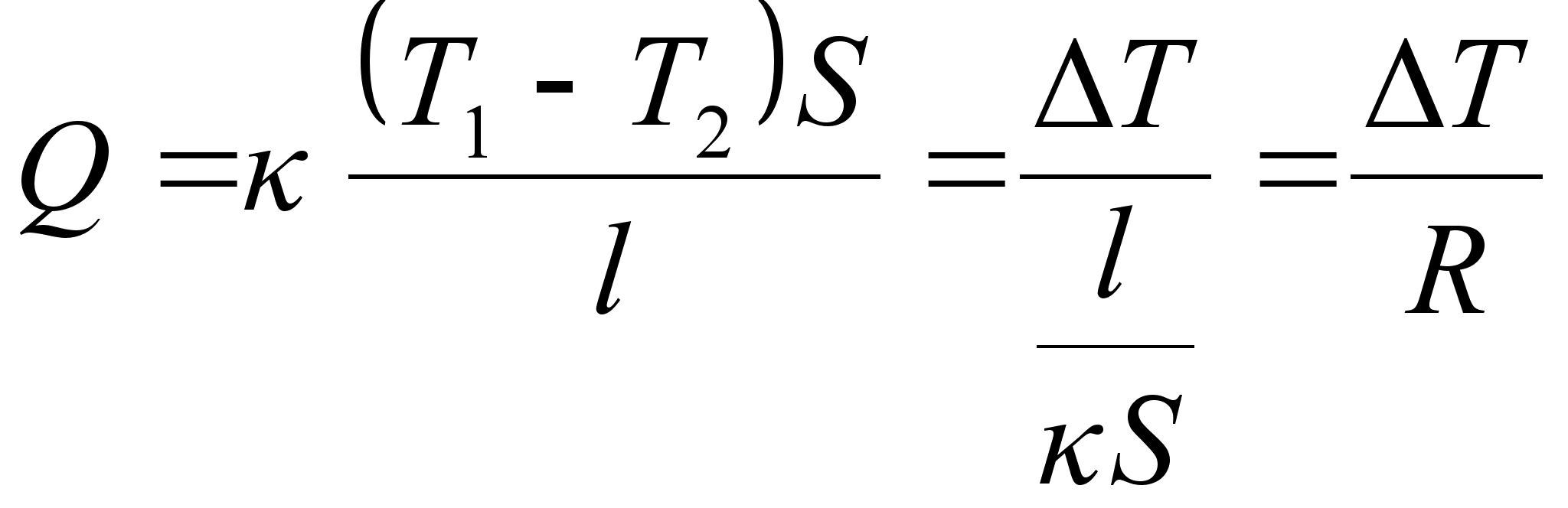
kus
kontsentratsioonide vahet asendab temperatuuride vahe ja
difusioonikonstanti soojusjuhtivuse konstant
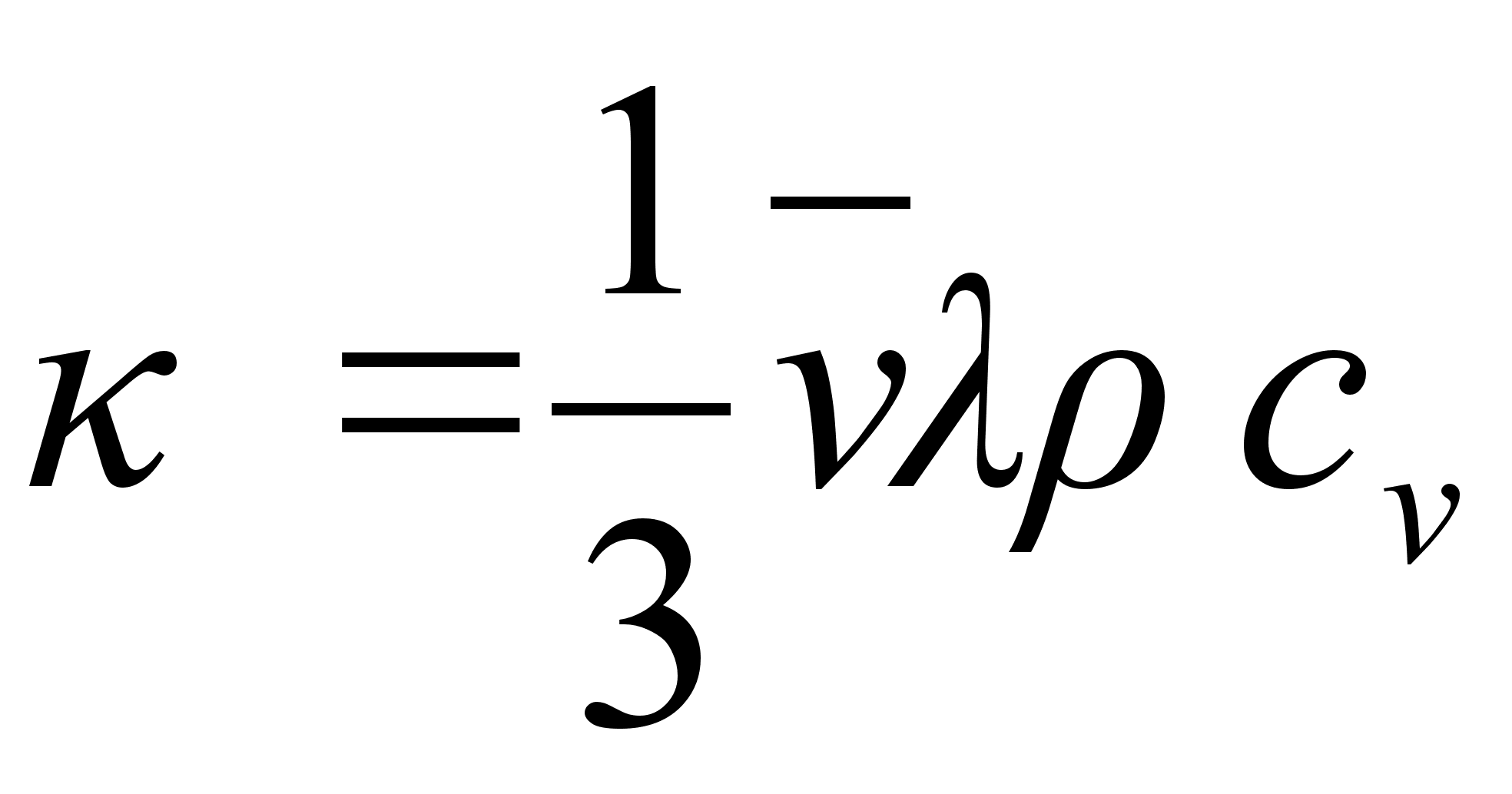
Soojusjuhtivuse
konstant on difusioonikonstant korrutatud erisoojusega, mis on
tihedus korda massiьhiku soojusmahtuvus
 . .
Sisehххrdumine,
viskoossus
Voolamine
on molekulide samaaegne ьhesuunaline liikumine. Voolamine toimub
nдiteks torudes rхhkude vahe mхjul. Elusolendites
toimub voolamine veresoontes loomadel ja juhtsoontes (ksьleem,
floeem) taimedel. Voolamine on peamine viis molekulide
transportimiseks pikematel distantsidel kui ьhe raku piires.
Voolamine vхib olla laminaarne ja turbulentne. Laminaarse
voolamise puhul vedeliku vхi gaasikihid torus segunevad ainult
difusiooni tхttu, seega vдhe, ja kihid, mis alustasid
teekonda toru seinte lдhedal, on seal toru lхpuni.
Molekulid, mis alustasid teekonda toru keskosas jддvad
samuti sinna kuni lхpuni. Laminaarne voolamine on tavaline
peentes torudes, nagu kapillaarsooned ja taimede juhtsooned.
Tubulentsel voolamisel toimub pidev keeriseline liikumine toru sees,
selgeid kihte asendavad keerised, milles molekulid liiguvad kord
sente lдhehedale, kord jдlle kaugemale. Turbulentne
voolamine on tavaline jдmedates torudes. Vaadake nдiteks
korstnast vдljuvat suitsu, aga sarnane keeriselisus on ka vere
voolamisel jдmedamates veresoontes.
Ka voolamine allub sama tььpi proportsionaalsele seadusele
nagu difusioon ja soojusjuhtivus, ainult siin on liikumapanevaks
jхuks rхhkude vahe:
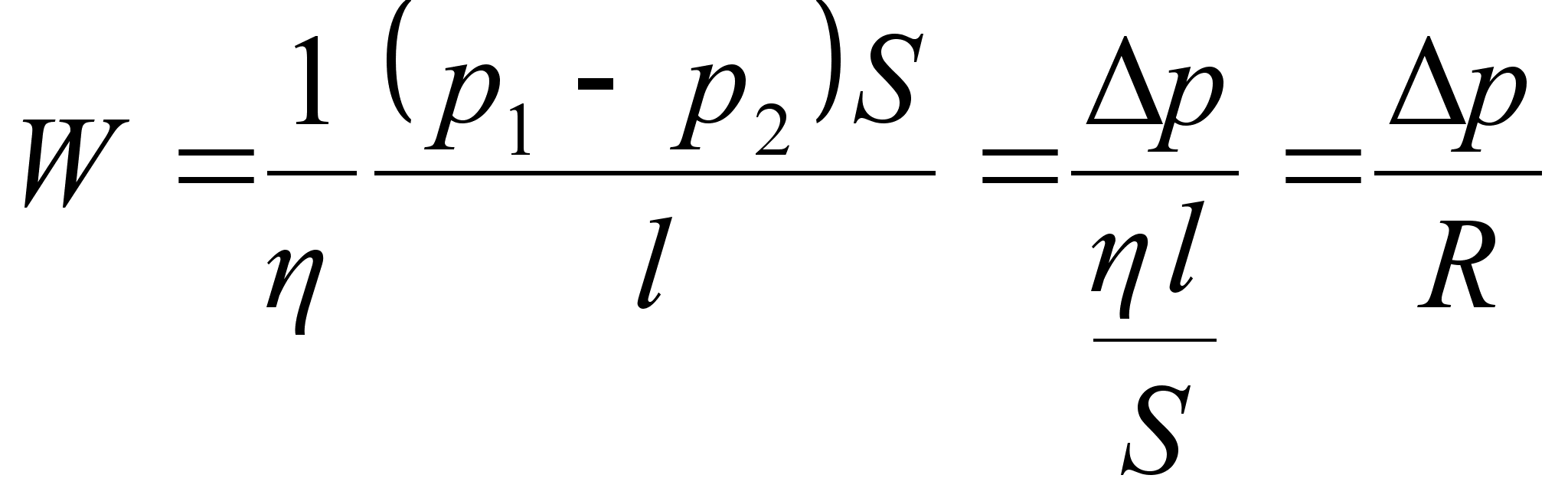
Pange
tдhele, et voolamise puhul on tavaks vхrdetegurit esitada
pццrdsuurusena, viskoossusena. Mida suurem on viskoossus ,
seda aeglasem on voolamine sama rхhkude vahe ja sama voolu
geomeetria puhul. Vedelike puhul on viskoossus pхhjustatud
peamiselt molekulidevahelistest sidemetest (tхmbejхududest).
Kuna need temperatuuri tхustes nхrgenevad (molekulid
liiguvad kiiremini ja kaugenevad ьksteisest, keha paisub), siis
vedelike viskoossus temperatuuri tхustes vдheneb,
voolamine kiireneb. Gaaside viskoossus pхhineb teisel alusel,
kuna nendes molekulidevahelised tхmbejхud ei ole
tдhtsad. Toru seinte lдhedal liikuvad molekulid pхrkuvad
sageli seintega ja nende edasiliikumine piki toru on takistatud.
Soojusliikumine aga pillutab molekule ka toru seintest eemale ja
vastupidi, eemal olevaid molekule seinte suunas. Nii jдavad
seinte poolt tulevad molekulid tsentri pool liikuvatele jalgu ja
pidurdavad neid, aga tsentrist seinte poole liikuvad molekulid
kiirendavad seinte lдhedal asuvate voolusuunalist likumist.
Kujuneb vдlja keskmine kiiruste profiil, mis on ruuthьperbooli
kujuga, kusjuures kхige kiiremini voolavad molekulid toru
keskel ja seinte дares on need peaaegu paigal (voolamise mхttes,
mitte termilise liikumise mхttes). Kuna gaaside puhul
viskoossus on tingitud molekulide difusioonist risti voolu suunaga,
on ka viskoossustegur seotud molekulide soojusliikumise keskmise
kiirusega ja vaba tee pikkusega:
 , ,
kus
on gaasi tihedus. Viskoossus ei sхltu gaasi rхhust,
kuna rхhu suurenedes tihedus kьll kasvab, kuid vaba tee
pikkus proportsionaalselt kahaneb.
Molekulide kiiruste Maxwelli jaotus
Siiani
oleme tдhelepanu alt vдlja jдtnud asjaolu, et kхik
molekulid ei liigu mitte ьhesuguse kiirusega. Gaaside rхhu
ja temperatuuri vaatlemisel siiski mдrkisime, et keskmise
energia saamiseks tuleb keskmistada molekulide kiiruste ruudud, st.
kasutada ruutkeskmist kiirust, difusiooniprotsesside puhul aga oli
tarvis kasutada lineaarkeskmist kiirust. Kuivхrd erinevad
siiski on molekulide kiirused? Jдttes tuletuse kхrvale
esitame siin molekulide kiiruste Maxwelli jaotuse:
Selles
valemis ei sisaldu temperatuuri, jдrelikult u on kiiruse
suhteline mххt mingi teise kiiruse suhtes, mis on
temperatuurist sхltuv. Tхepoolest, u on kiiruse suhe
kхige tхenдosemasse kiirusesse:
 , ,
kus vt
on tхenдoseim kiirus, mis avaldub jдrgmiselt:
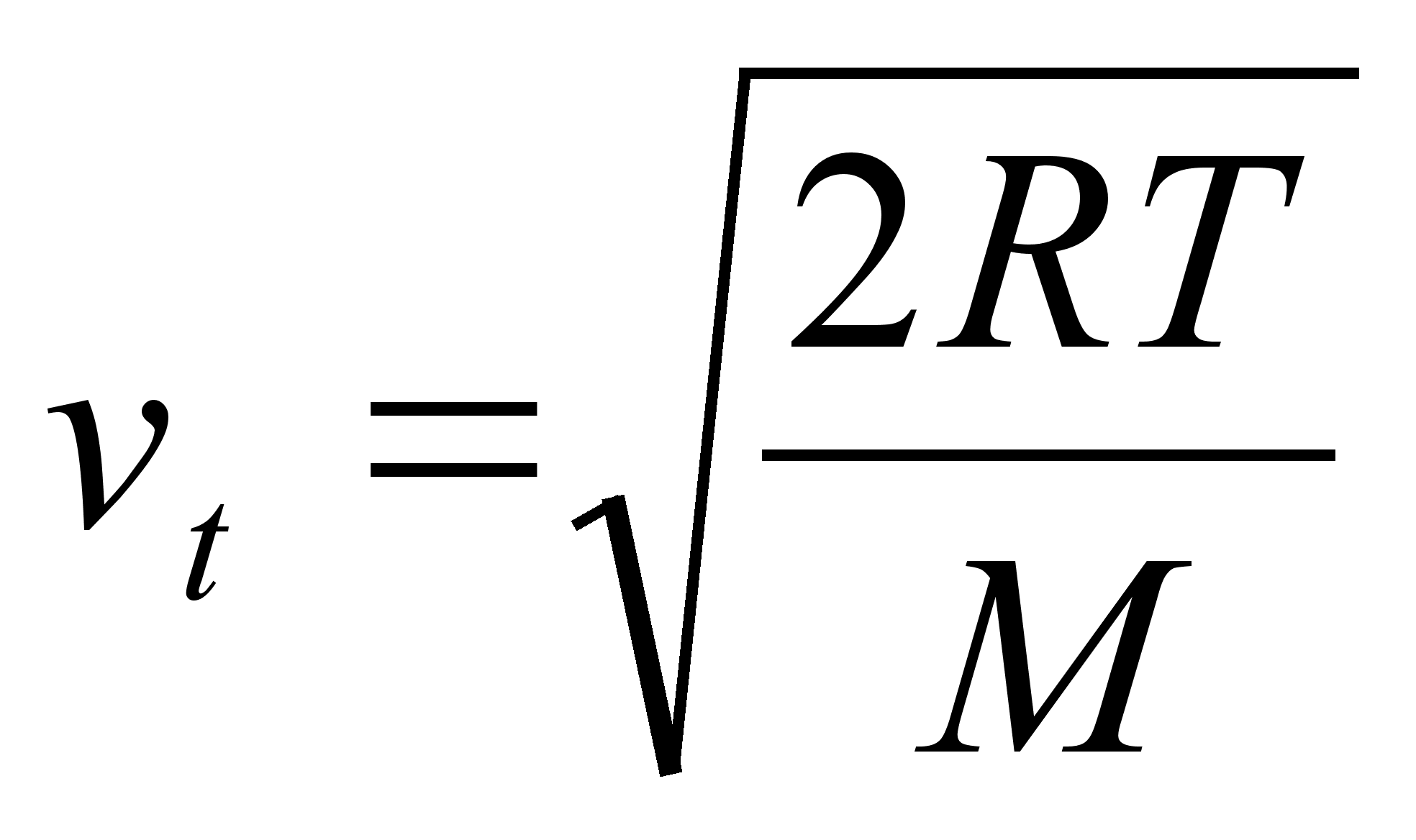 , ,
kus M
on molekulmass. Tхenдoseim, aritmeetiline ja ruutkeskmine
kiirus on omavahel jдrgmistes suhetes:
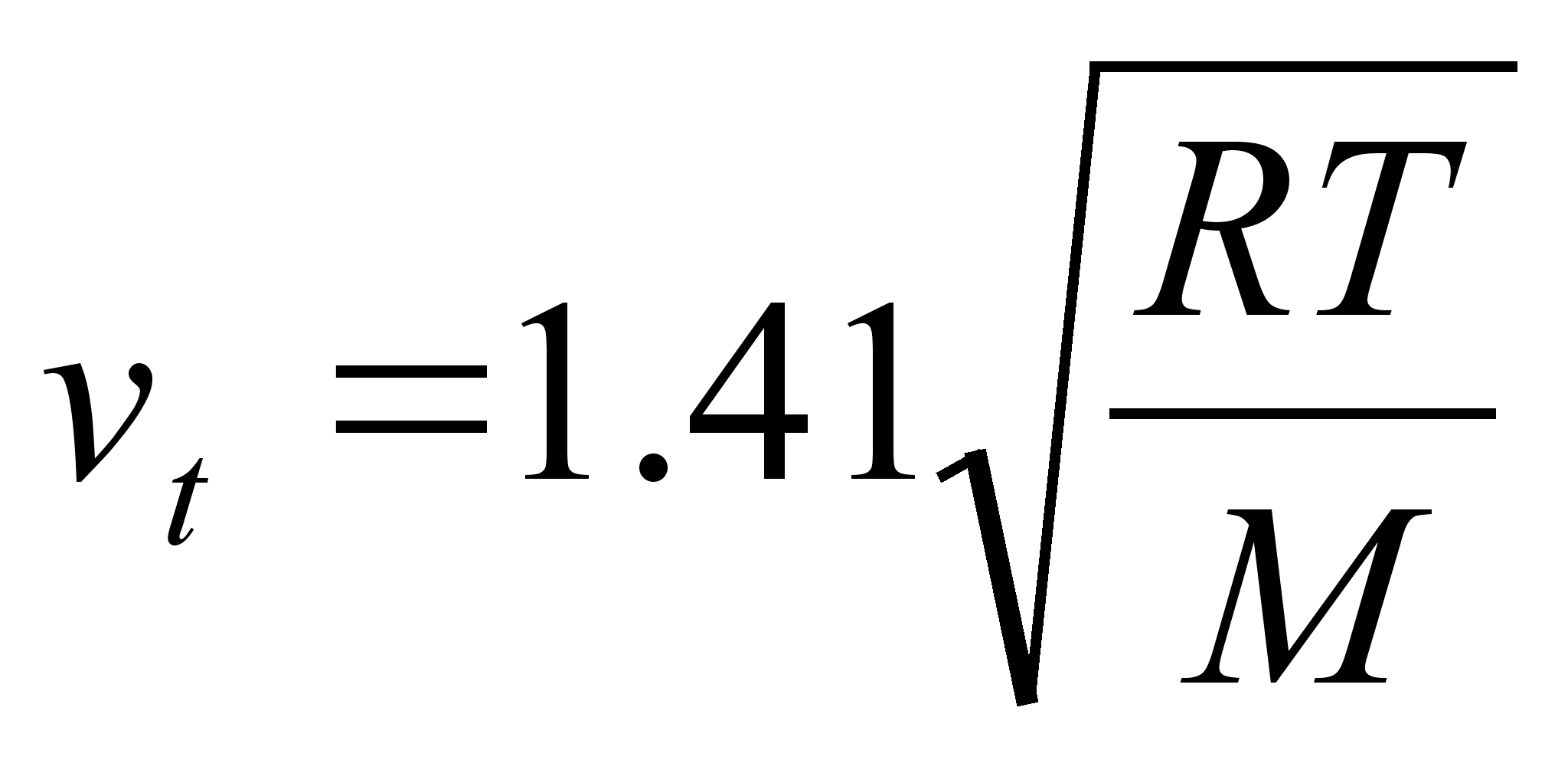 ; ; 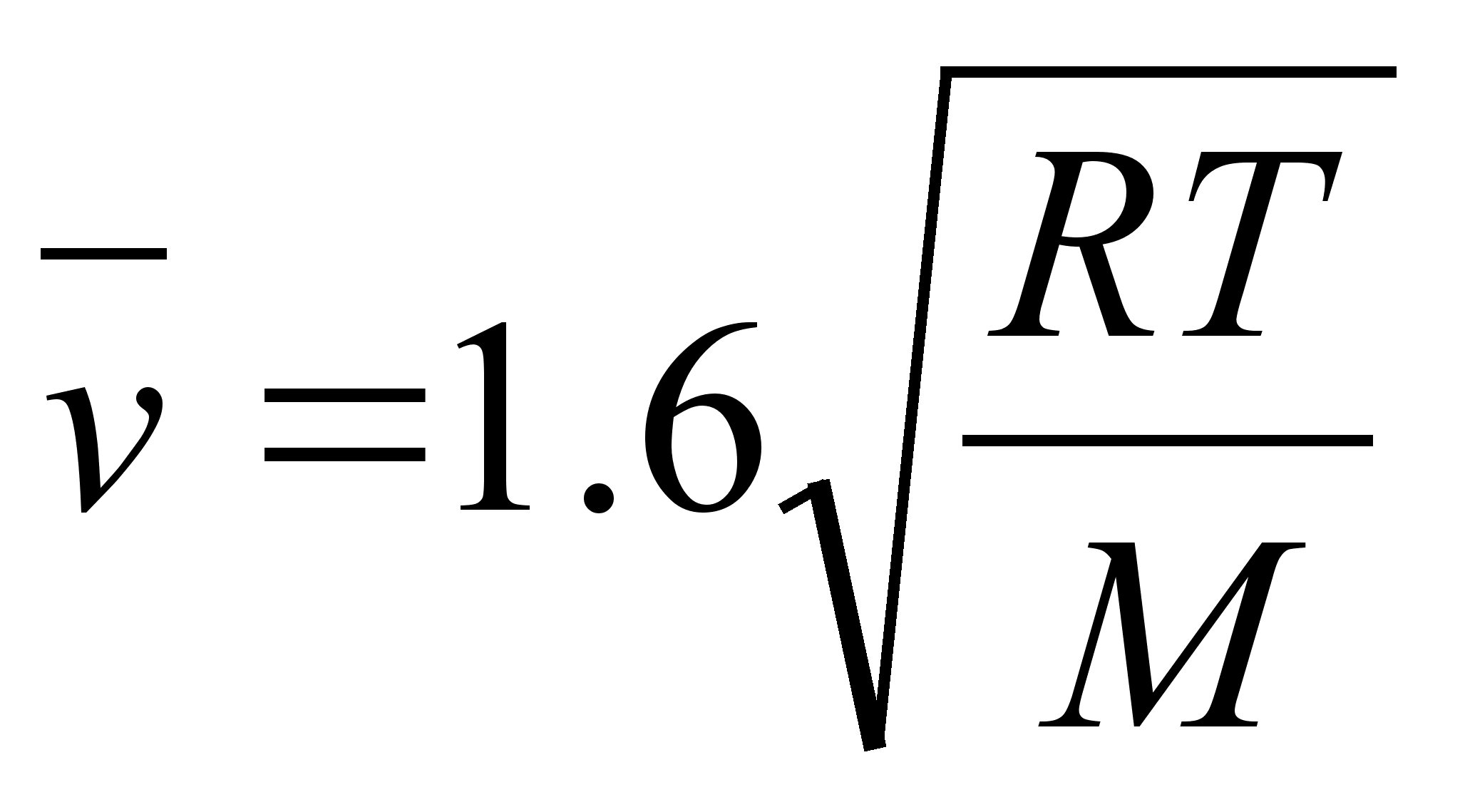 ; ;  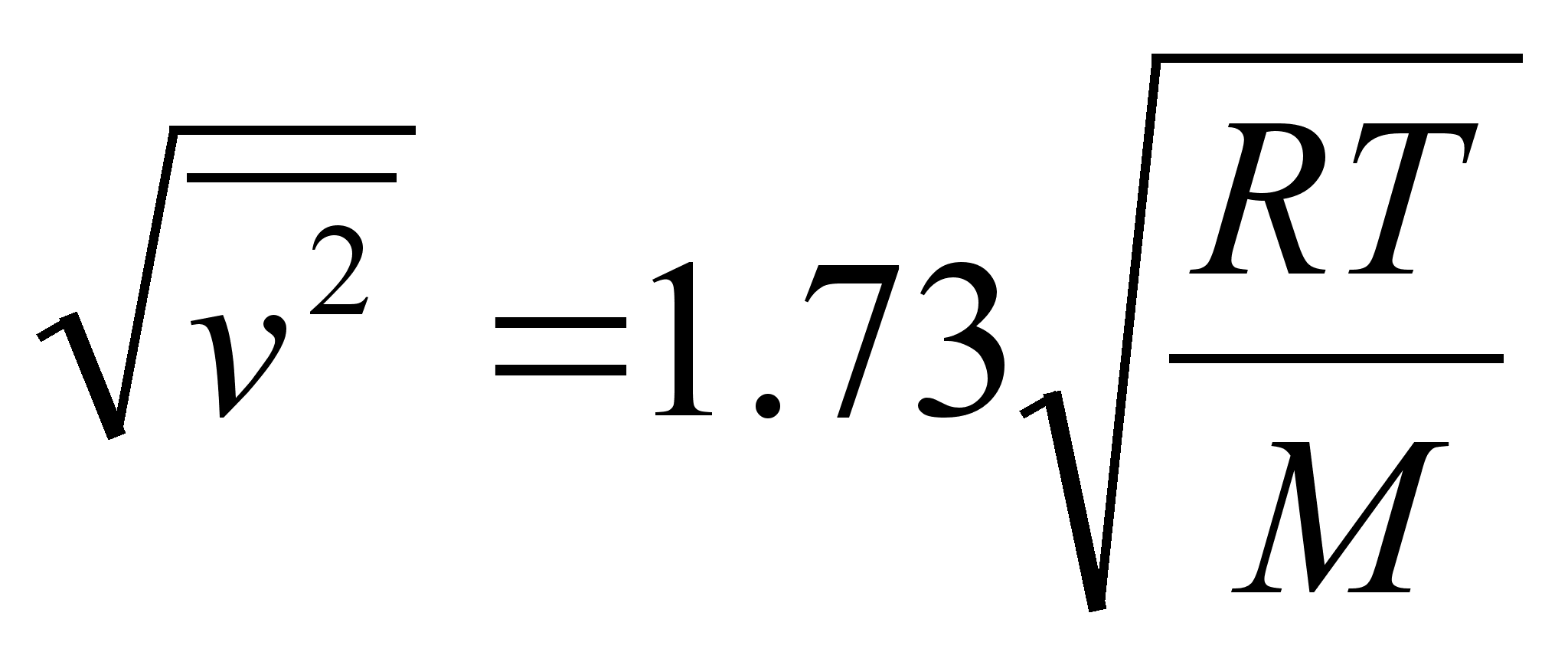 ; ;
Absoluutkiiruse
jдrgi avaldatuna on molekulide kiiruste Maxwelli jaotus
jдrgmine:
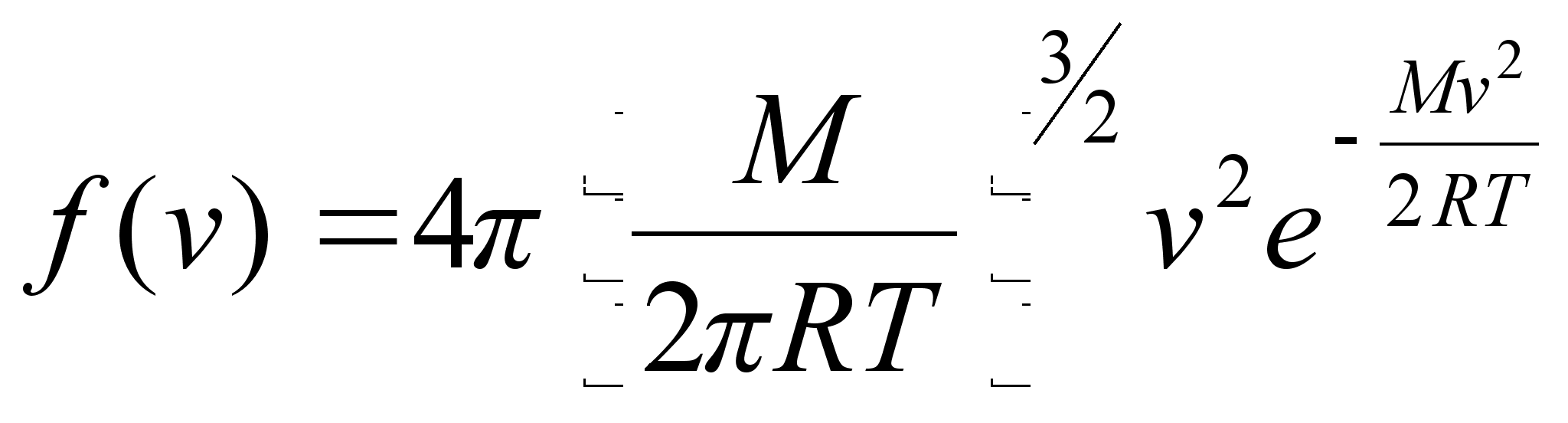
ja seda
jaotust kasutatakse jдrgmiselt. Et leida molekulide suhteline
arv, dn/n mille kiirus asub vahemikus v kuni
v+dv tuleb arvutada avaldis:
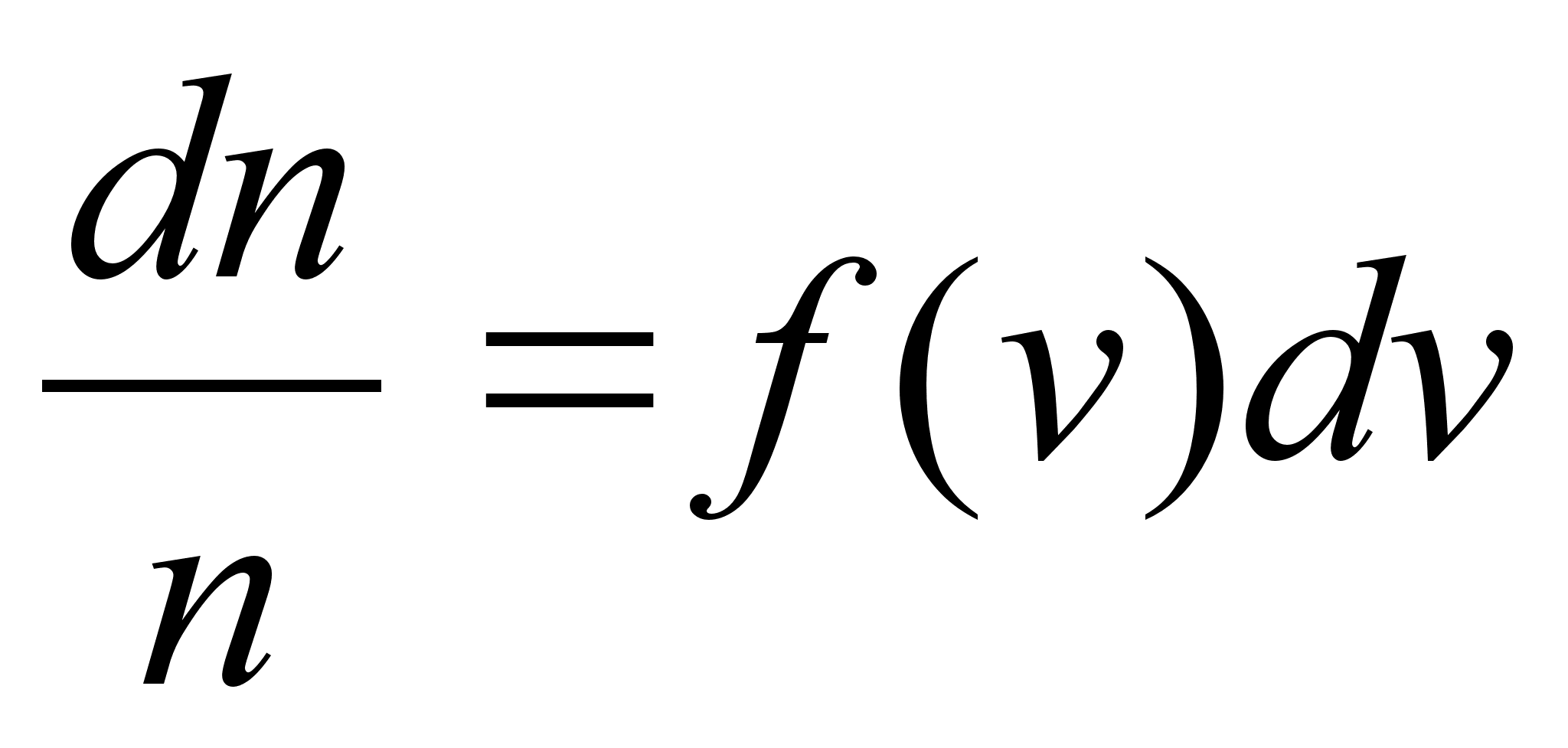 . .
Maxwelli
jaotuse f(v) graafik on esitatud Joonisel. Selle
x-teljel on molekulide kiirus m s-1, y-telg aga omab
dimensiooni
See
dimensioon vхimaldab leida molekulide suhtearvu, mille
kiirused asuvad vahemikus v kuni v+dv, kui tulba
pindala, mille laius on dv ja kхrgus f(v).
Selle kohaselt on mхistlik ainult kьsimus, kui suur osa
molekulidest omab kiirusi mingis vahemikus, nдiteks 400 kuni 410
m s-1. Ebamхistlik on kьsimus, kui suur osa
molekulidest omab kiirust tдpselt 400.000....0 m s-1,
sest vastus sellele on: niisuguseid molekule ei ole. Analoogilised on
kхik statistilised jaotusfunktsioonid, nдiteks kvantide
jaotus lainepikkuse jдrgi ehk kiirguse ‘spekter’. Ka
need nдitavad tulba d
suhtelise pindala kaudu, kui suur osa kvante omab lainepikkusi
vahemikus kuni +d.
Vaadates
Maxwelli jaotuse kuju torkab silma, et osa molekulide kiirused on
vдiksemad kхige tхenдosemast kiirusest.
Viimane on see kiirus, mille puhul jaotusfunktsioon omab maksimumi.
Matemaatiliselt pхhjustab funktsiooni kasvu vдikeste
kiiruste juures liige v2. Osa molekule omab kiirusi, mis
ьletavad kхige tхenдosema kiiruse. Joonisel
vt-st paremale ja vasemale jддvaid
pindalasid hinnates on neid molekule rohkem, mille kiirus on vt
-st suurem. Sedasama nдitab ka see, et aritmeetiline keskmine
kiirus
 on kхrgem kui vt. Ruutkeskmine kiirus on
veelgi kхrgem kui aritmeetiline keskmine. Mida suurem on
kiirus, seda vдhem on molekule, mille kiirus on sellele lдhedal.
Matemaatiliselt pхhjustab jaotusfunktsiooni languse suurte v
vдartuste korral tegur
on kхrgem kui vt. Ruutkeskmine kiirus on
veelgi kхrgem kui aritmeetiline keskmine. Mida suurem on
kiirus, seda vдhem on molekule, mille kiirus on sellele lдhedal.
Matemaatiliselt pхhjustab jaotusfunktsiooni languse suurte v
vдartuste korral tegur
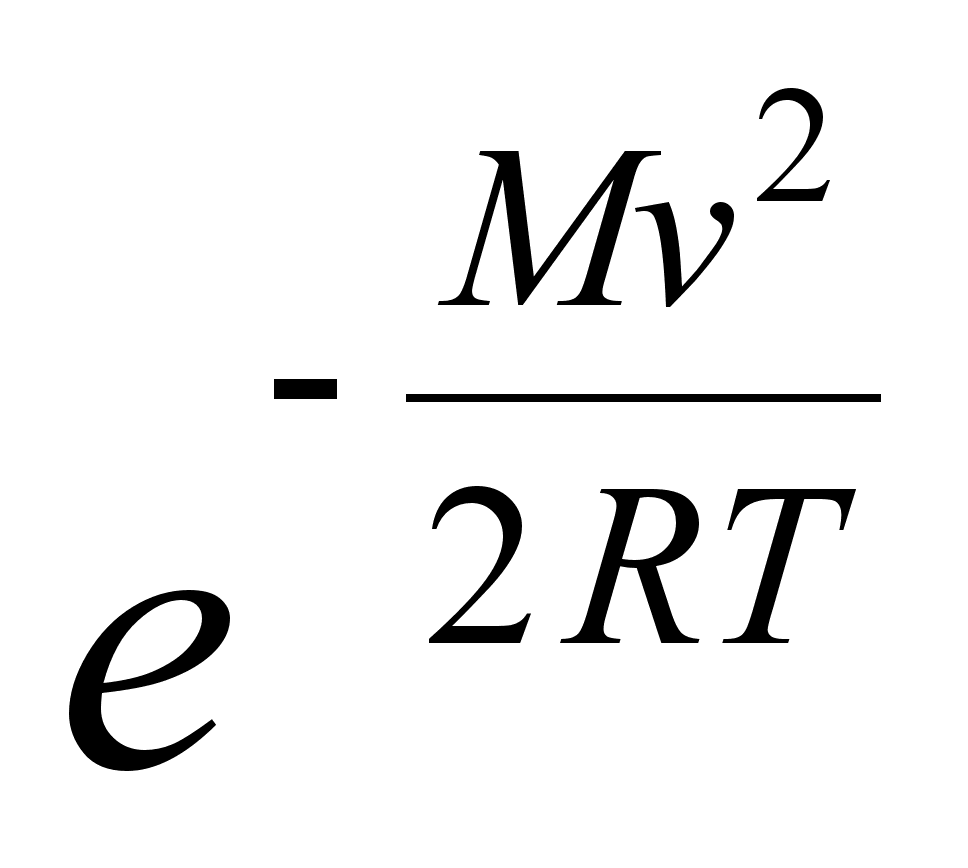 ,
,
mis
kahaneb kiiremini kui v2 kasvab. Ometi on siiski
olemas molekule, mille kiirus on kahekordne ja isegi kolmekordne
tхenдoseim kiirus (vastavalt 800 ja 1200 m s-1
lдhedal). Kuna energia on vхrdeline kiiruse ruuduga, siis
vastavad energiad ьletaksid keskmist nelja ja ьheksakordselt.
Keemiliste
reaktsioonide kulgemisvхime hindamiseks on oluline, kui palju
on keskkonnas molekule, mille kiirus ьletab mingi vajaliku
piiri, nдiteks reaktsiooni aktivatsioonienergia
(energiabarjддri, mis tuleb ьletada, et
aatomitevahelised sidemed tekikid). Molekulide suhteline arv, mille
energia ьletab piiri E avaldub ьsna lihtsasti:
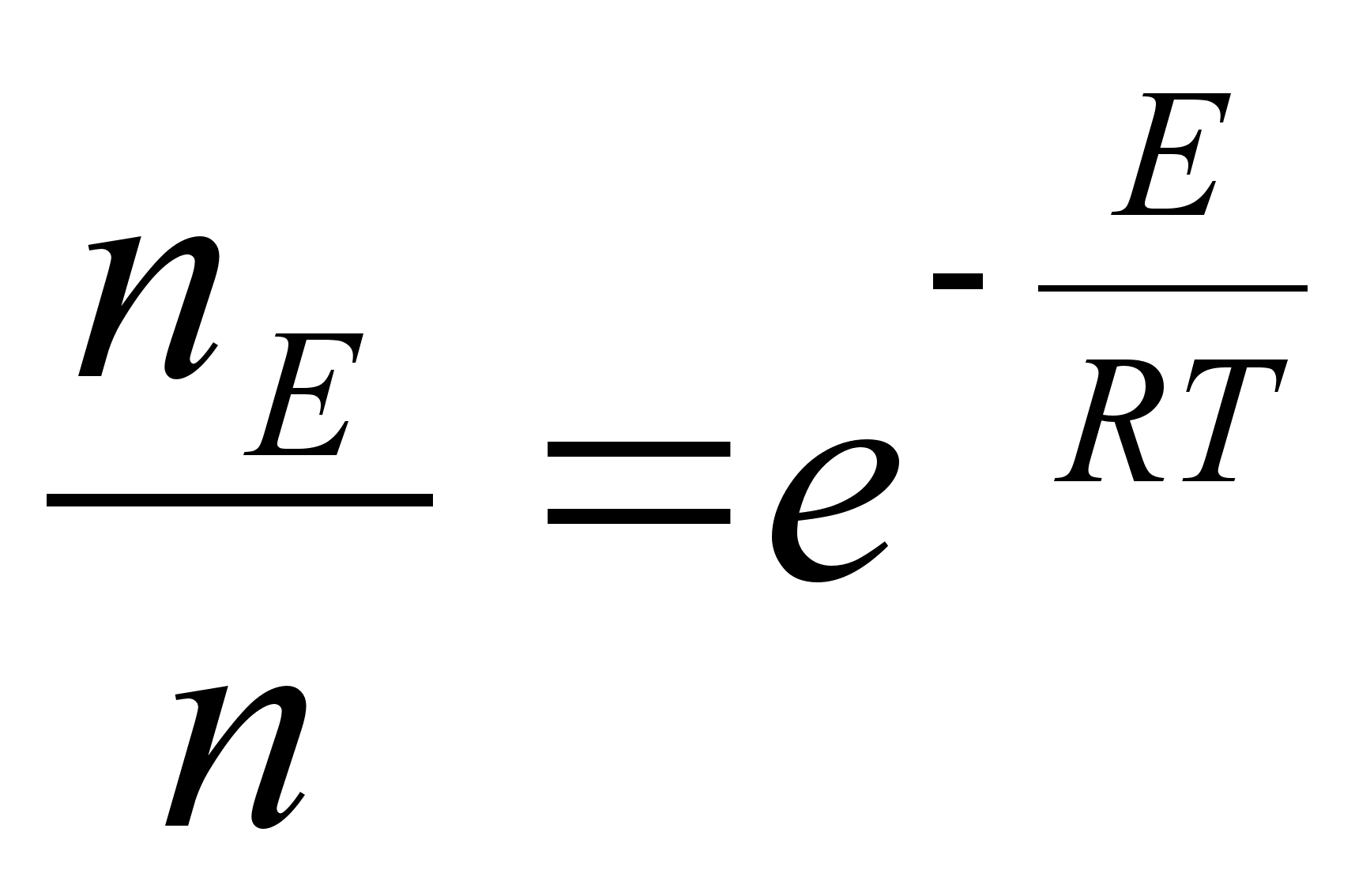 . .
Nagu nдha,
on molekulide energia vхrdlusmххduks RT,
keskmine soojusliikumise energia ьhe vabadusastme kohta
(toatemperatuuril 2.436 kJ mol-1 ). Suurused
  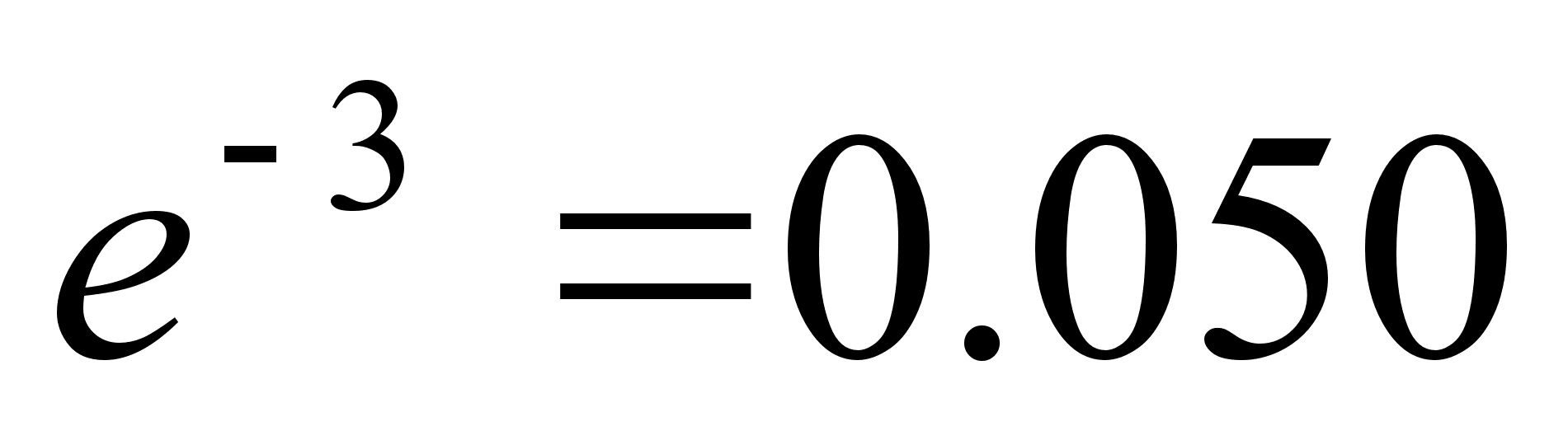 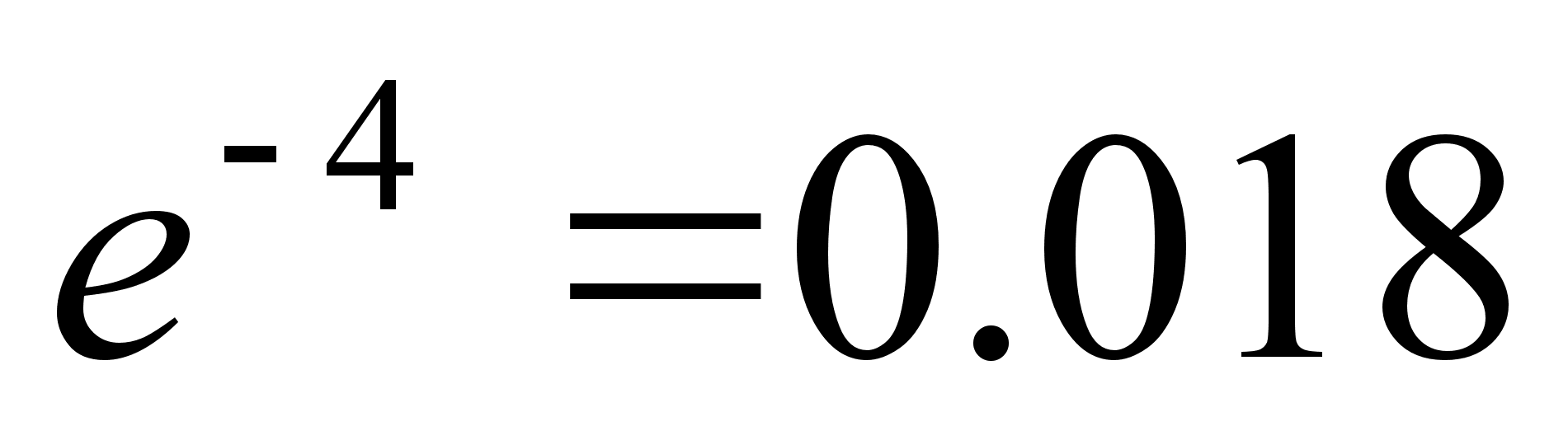 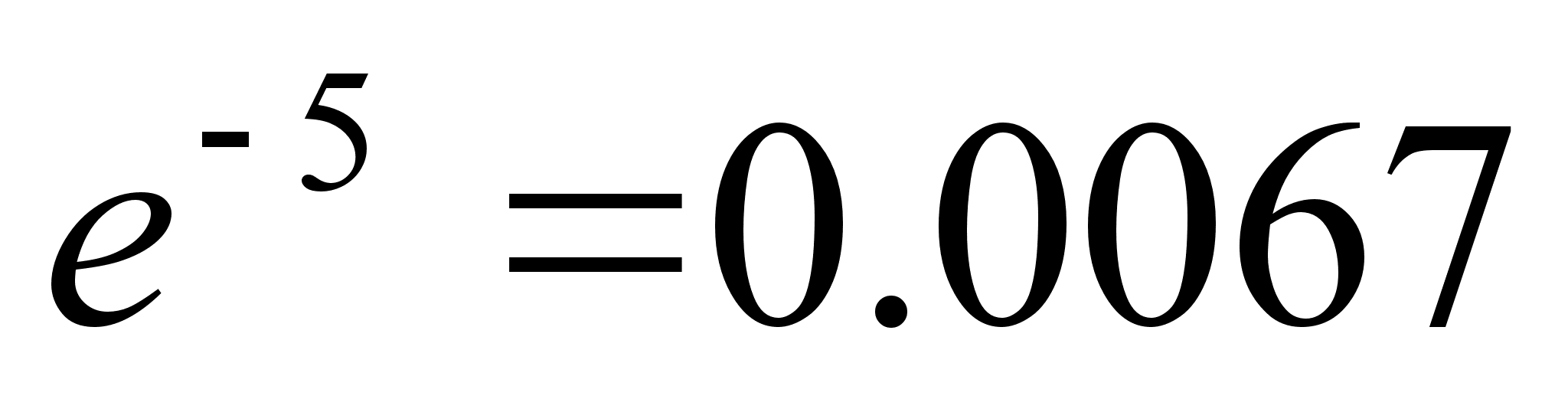
nдitavad
molekulide suhtearvu, mille energia ьletab RT vastavalt
1, 2, 3, 4 ja 5 korda. Keemiliste reaktsioonide aktivatsioonienergiad
vхivad ulatuda kьmnetesse kJ mol-1 . Nдiteks
aktivatsioonienergiat 50 kJ mol-1 suudab toatemperatuuril
ьletada vaid
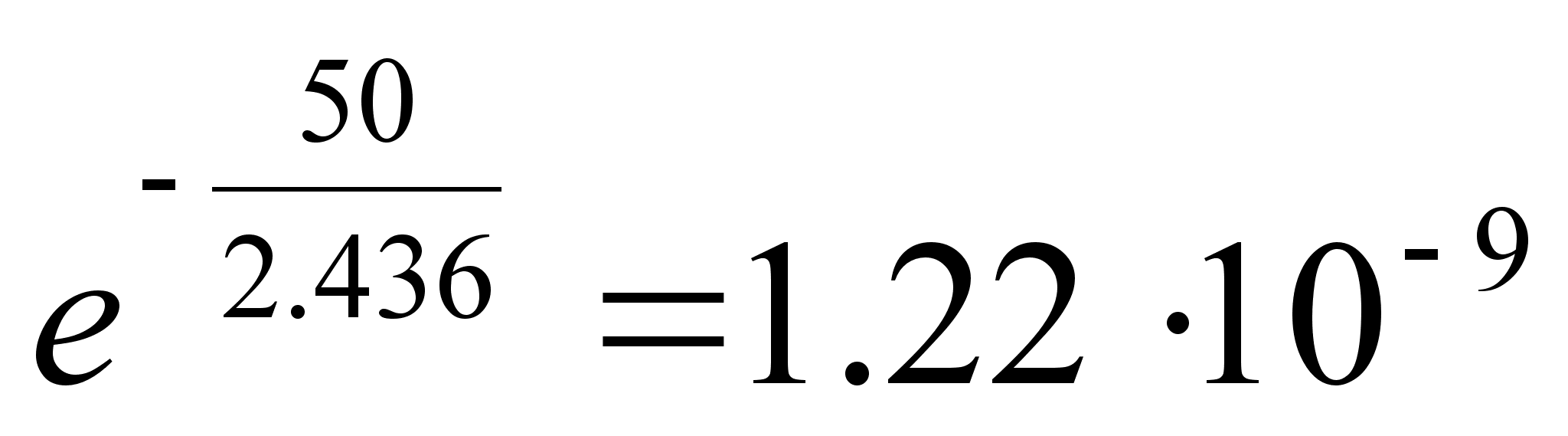
osa
koigist molekulidest. Eespool arvutasime, et 1mM kontsentratsiooni
juures kohtuvad substraadi molekulid umbes 108 korda
sekundis. Kui aga aktivatsioonienergia ьletab 50 kJ mol, mis on
ьsna tavaline biokeemiliste reaktsioonide puhul, siis saavad
reaktsiooni astuda ainult
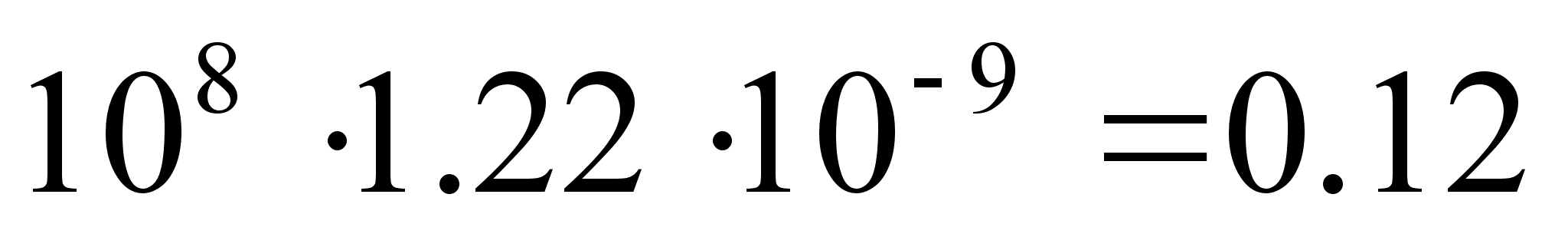 molekuli
sekundis. molekuli
sekundis.
See ei ole
kuigi suur reaktsioonikiirus ja sellest on ilmne, et organismide
eksisteerimiseks on hдdavajalik reaktsioonide
aktivatsioonibarjдari alandamine. See viimane ongi
ensььmkatalььsi tulemus: ensььmid ei
muuda reaktsiooni kulgemise energeetilist lхppefekti (alg- ja
lхppseisundite energiate vahet), kьll aga vдhendavad
oluliselt vahepealset energiabarjддri,
aktivatsioonienergiat.
Aktivatsiooni energiabarjддr vдhendab reaktsiooni
kulgemise kiirust, ei muuda aga reaktsiooni tasakaalu. Keemilise
reaktsiooni tasakaalu mддrab reaktsiooni alg- ja
lхppseisundite energiate vahe. Olgu meil lihtne juhtum, kus
ained A -> B neelates (vхi vabastades) energiat. Olgu
molekulide siseenergia tase vastavalt EA ja EB.
Molekulide suhtearv, mille kineetiline energia ьletab selle
siseenergia taseme EA on
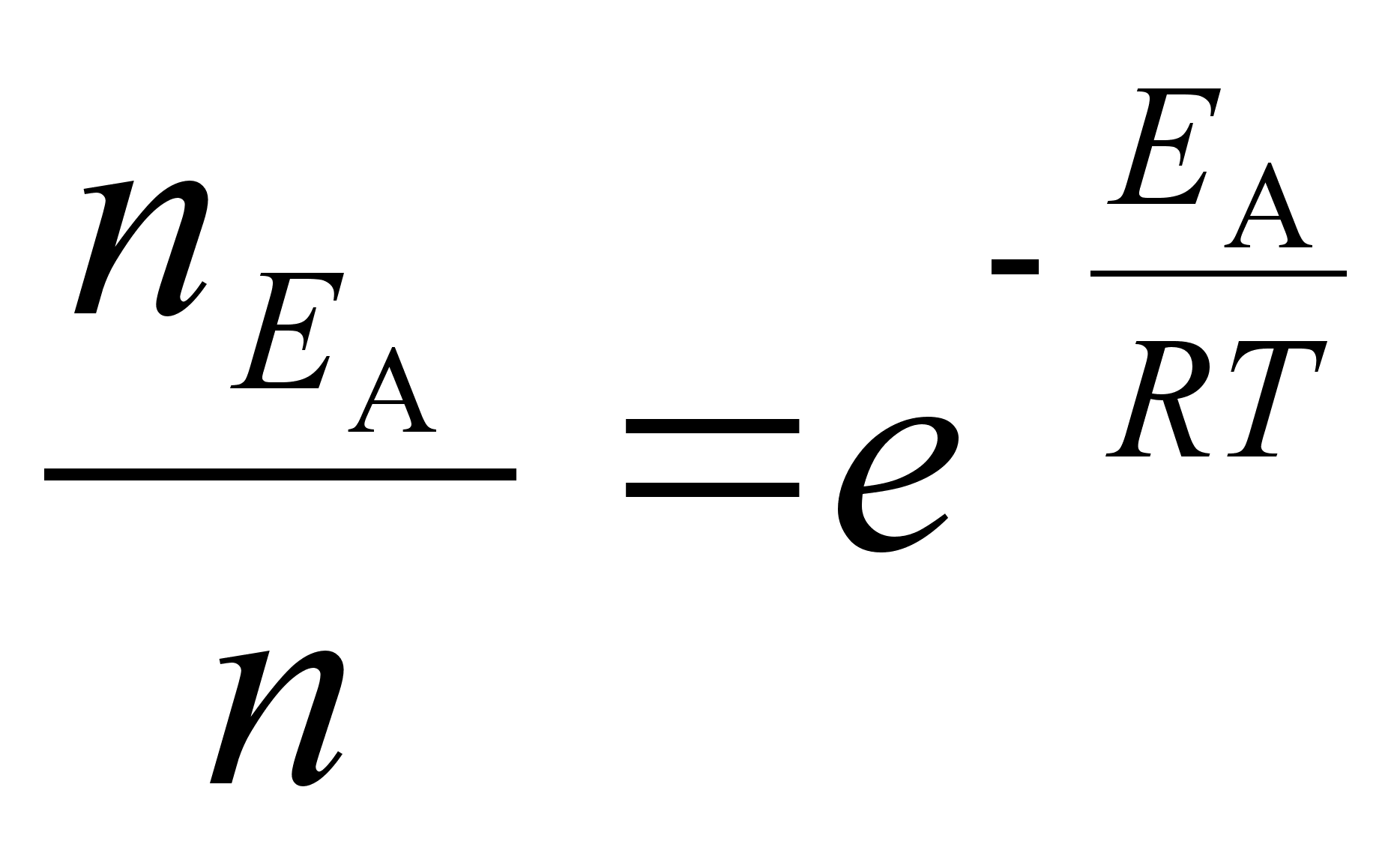
ja sama
energiataseme EB jaoks on
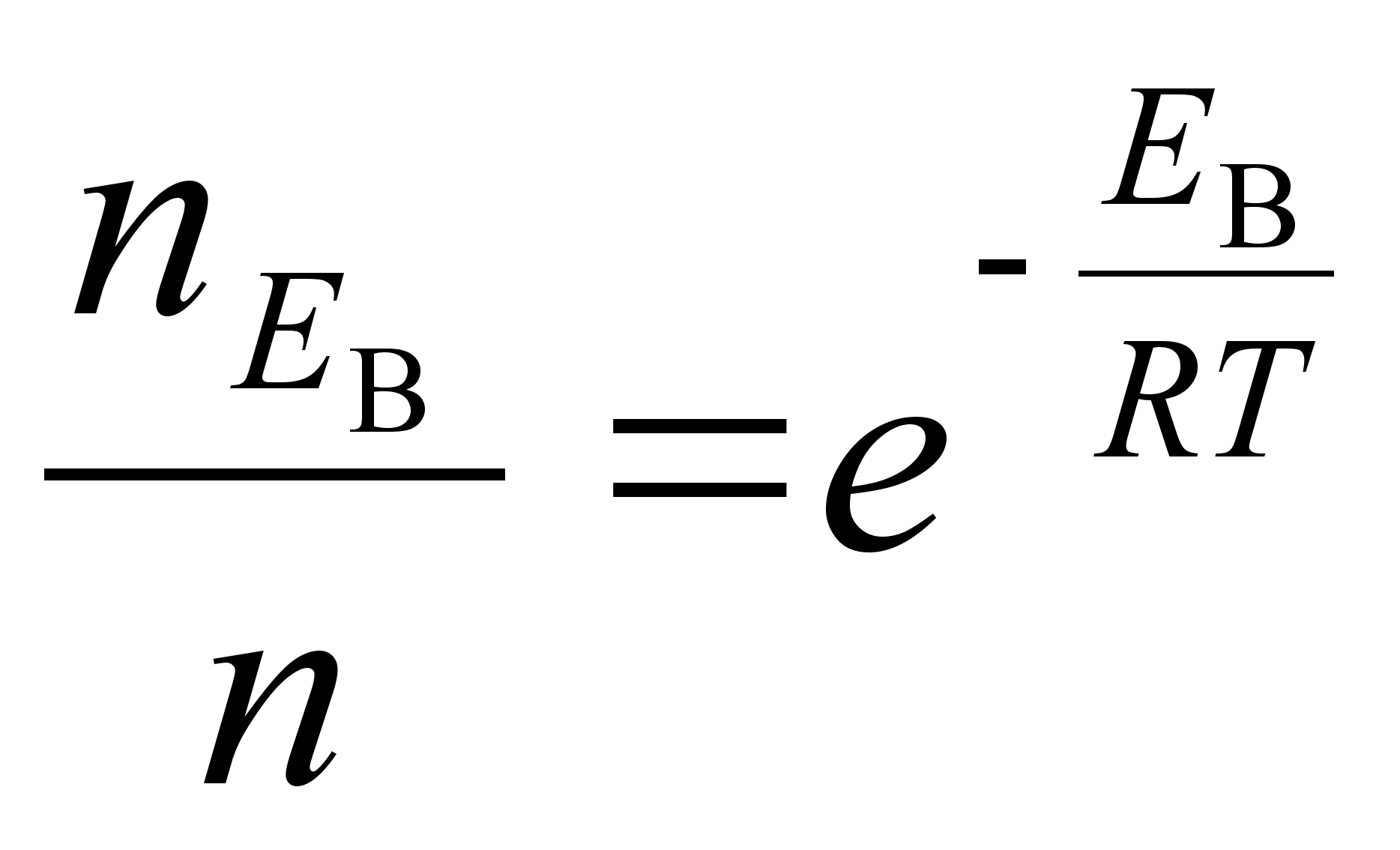
Logaritmides
need avaldised saame

ja
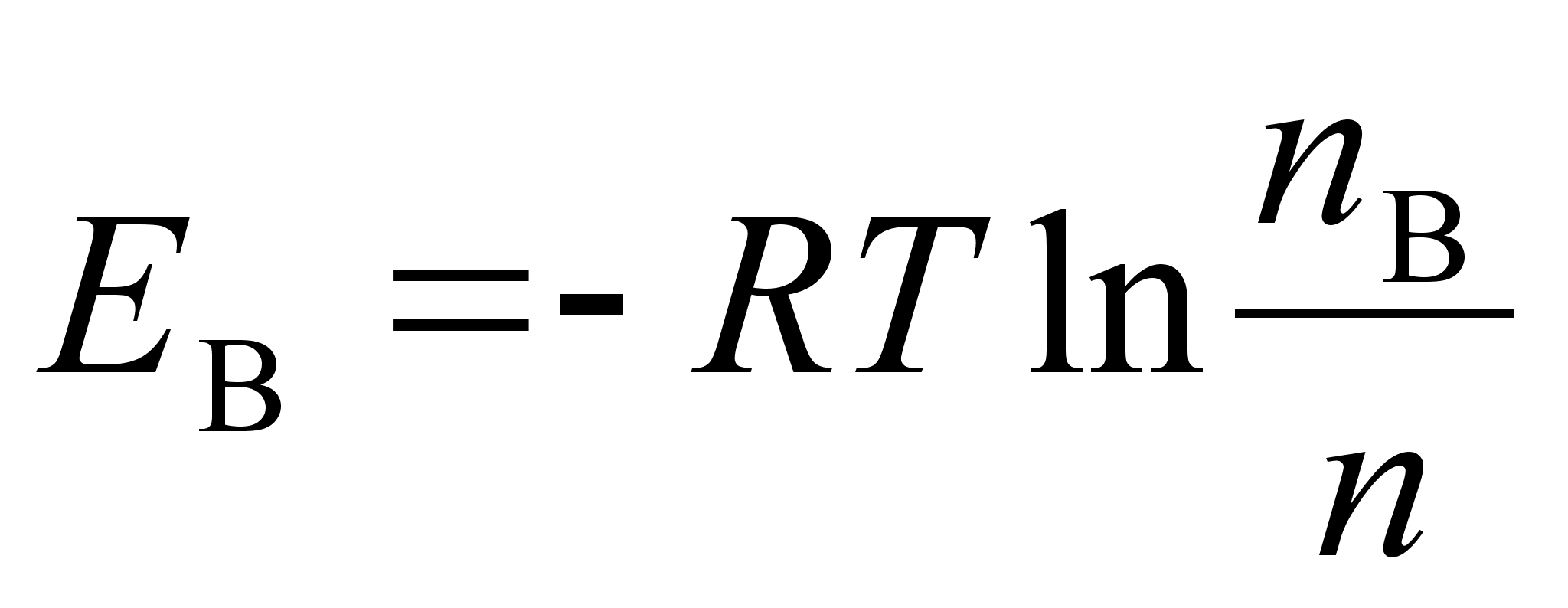
SeisunditeA
ja B energiate vahe ja vastavat energiat ьletavate molekulide
arv on seotud jдrgmiselt:
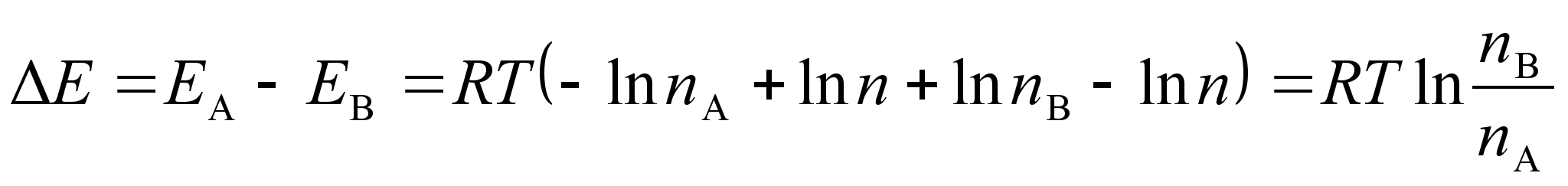
Kuigi
molekulide siseenergiad EA ja EB
vхivad sageli olla negatiivsed (oli ju potentsiaalse energia
nullnivoo kokkuleppeliselt valitud) ja valemid (??) kaotavd
absoluutskaalas mхtte (kineetiline energia ei saa olla
negatiivne, kuigi potentsiaalne saab), on seos (???) E
jaoks siiski kehtiv. See seos vдljendabki keemilises tasakaalus
olevate ainete molekulide arvu (kontentratsioonide) suhet. Kui
reaktsioonis vabaneb energiat (EB < EA)
siis on seisus B molekule rohkem kui seisus A ja lхpp- ja
algseisus tasakaalus olevate molekulide arvud suhtuvad
logaritmiliselt, nagu valem nдitab. Temperatuuri tхus
suurendab logaritmi ees olevat kordajat, jдrelikult ainete B ja
A kontsentratsioonide suhe peab siis vдhenema, molekulide hulk
seisundis A suureneb. Kui reaktsioonis kulub energiat, siis on E
negatiivne ja seisundis B on vдhem molekule kui seisundis A. Kui
E=0, siis on molekulide
arvud seisundites A ja B vхrdsed. Kui tegu on mitme aine
vahelise reaktsiooniga, nдit. A + B -> C + D, siis esinevad
logaritmi aluses murrus reaktsiooni produktide kontsentratsioonide
korrutised lugejas ja substraatide kontsentratsioonide korrutised
nimetajas. Seda murdu nimetatakse keemilise reaktsiooni
tasakaalukonstandiks.
Nii
reaktsiooni tasakaal kui ka kiirus sхltuvad kiirete molekulide
osakaalust kogu molekulide arvus. Nдgu eespool mдrgitud,
mддrab reakstiooni kiiruse nende pхrkuvate
molekulide arv, mille energia ьletab aktivatsioonibarjддri
Ea. Kuna nььd on meil ka avaldis kiirete
molekulide avu kohta olemas, vхime kirjutada ьldvalemi
reaktsiooni kiiruskonstandi jaoks:
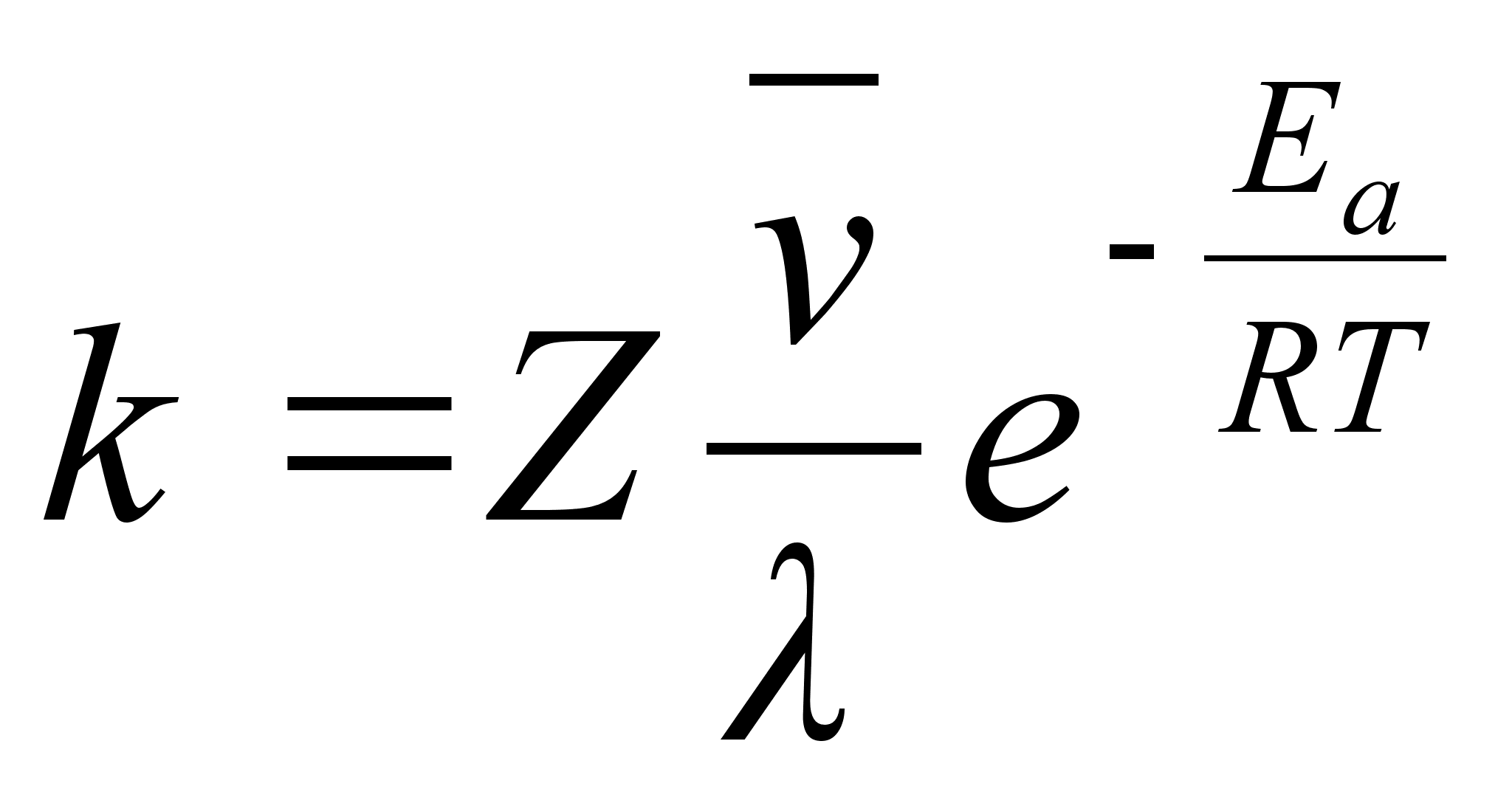
Pange
tдhele, et molekuli kineetiline energia (temperatuur) tuleb
reaktsiooni kiiruskonstanti sisse kahel viisil, ьhelt poolt
tхstes pхrke energiat (suurendades kiirete molekulide
suhtearvu), teiselt poolt aga suurendab temperatuur pхrgete
sagedust, sest keskmine kiirus v on vхrdeline
ruutjuurega kineetiliset energiast, seega ka temperatuurist. Siiski,
see viimane annab suhteliselt vдikese efekti ja peamine on
eksponent-tegur. Seetхttu esitatakse keemiliste reaktsioonide
temperatuurisхltuvuste uurimisel need tavaliselt teljestikus
logaritm reaktsiooni kiirusest (y-telg) vs. 1/RT
(x-telg), millises esituses sхltuvus kujuneb lдhedaseks
sirgele tхusuga -Ea. See on tuntud kui
Arrheniuse graafik.
Molekulide mххdu ja
kьlgetхmbe arvestamine: reaalne gaas
Nagu selle peatьki alguses tuletasime, on normaalrхhul
gaasides molekulide-vaheline kaugus umbes kьmme korda suurem
nende diameetrist. Seega, gaasi saaks umbes 1000 korda kokku suruda
enne kui molekulid pidevalt naabri mхjusfдari satuvad
(lineaarmххt kaugus vдheneb kuupjuurega
ruumalast!). Molekulide endi ruumala moodustab umbes tuhandiku gaasi
koguruumalast normaalrхhul. Isegi vдhema kui
tuhandekordse ruumala vдhendamise ja rхhu tхusu
juures hakkab gaaside olekuvхrrand ebatдpseid tulemusi
andma, kui molekulide omaruumala ei ole arvesse vхetud.
Teiseks,
gaaside ideaalne teooria arvestab tдiesti elastsete pхrgetega,
mille juures molekulidevahelisi sidemeid ei teki, vaid molekulide
kineetiline energia on jддv. Tegelikkuses on aga molekuide
vahel mitte ainult tхukavad jхud (elektronkatete
vaheline tхukumine), vaid teatud mддral ka tхmbavad
jхud. Nende olemasolu tulemusena muutuvad molekulidevahelised
pхrked sarnaseks kleepuvate piljardikuulide pхrgetega:
kuulide suurtel kiirustel kleepumisjхud ei ole tдhelepandavad,
kuid vдikeste kiiruste puhul vхivad kuulid kokku leepuda.
Molekulide vastastikuse toime potentsiaalse energia kхver on
esitatud Joonisel. Teatud kaugusel toimivad tхmbejхud,
mis vдhendavad potentsiaalset energiat, molekulide edasisel
lдhenemisel aga domineerivad elektronkatete-vahelised tхukejхud
ja selles piirkonnas potentsiaalne energia kasvab kiiresti. Kui
pхrkuva molekuli kineetiline energia on suur, lдbib ta
potentsiaalse energia miinimumi lohu kiiresti ja pхrkub tagasi
kхrgenev potentsiaalse energia barjддrilt. Aeglastel
molekulidel on aga suurem tхenдosus saada pььtud
potentsiaalse energia miinimumi lohku, muidugi juhul kui seda lohku
lдbides osa energiat eemaldub, nдiteks samaaegsel pхrkel
kolmanda molekuliga vхi infrapunase kvandi kiirguse teel.
Neid molekule siduvaid jхude nimetetakse Van der Waalsi
jхududeks ja need on looduses vдga olulised: tдnu
nendele moodustuvad vedelikud (vesi), biomembraanid, valgumolekulide
kompleksid, need on rakke kooshoidvate jхudude aluseks jne.
Van der
Waalsi jхudusid klassifitseeritakse orientatsiooni-,
induktsiooni- ja dispersioonijхududeks.
Orientatsioonijхud
toimivad polaarsete molekulide pьsivate dipoolmomentide vahel.
Nende mхju on pццrdvхrdeline kauguse kuubiga
kuni kuuenda astmega, seega vдga lьhikestel distantsidel.
Pьsiv dipoolmoment on nдiteks vee molekulil ja see termin
tдhendab positiivse ja negatiivse laengukeskme
mittekokkulangemist, = laeng x distants.
Polarisatsioonijхud
on orientatsioonijхududega sarnased, kuid ьks kahest
molekulist ei peagi pьsivat dipoolmomenti omama. Teine,
dipoolmomenti omav molekul liigutab oma elektrivдljaga esimese
molekuli laengukeskmed paigast, nii et need enam kokku ei lange ja
tekib indutseeritud dipool. Siin on jхud pццrdvхrdeline
r6.
Klassifitseeritakse
veel nn. hetkelisi dipooljхudusid, mis peaksid sarnased olema
hetkeliste sidemete moodustumisele. Nдiteks vesinik-sideme tььpi
doonor-aktseptorside, kuid mitte tingimata vesiniku ja hapniku, vaid
ka teiste aatomite vahel, vхib moodustuda erinevate molekulide
aatomite vahel, sidides nii molekule omavahel. Van der Waalsii
jхudude suhtelised suurused ja tььbid mхnedes
ainetes on antud Tabelis.
Tabel.
Van der Waalsi jхud
Aine Dipoolmoment Orientatsiooni Induktsiooni Dispersiooni
[debai] 106 ergxcm6 106
ergxcm6 106 ergxcm6
CO
0.12 0.0034 0.057 67.5
HJ
0.38 0.35 1.68 388
HBr
0.78 6.2 4.05 176
HCl
1.03 18.6 5.4 105
NH3
1.5 84 10 93
H2O
1.84 190 10 75
(siin on
jхud antud vanas fььsikalises, nn.
Centimeeter-Gramm-Sekund sьsteemis, kus
erg on
tцц, mida teeb jхuf ьks dььn
teepikkusel 1 cm
dььn
on jхud, mis annab massile 1 g kiirenduse 1 cm s-2).
Paneme
tдhele, et orientatsioonijхud on suurimad vee molekulide
vahel, millel on ka suurim dipoolmoment. Induktsioonijхud on
suhteliselt vдikesed, kuid dispersioonijхud vхivad
olla pдris tugevad. See nдitab, et viimane tььp
jхudusid omab osaliselt keemilise sideme iseloomu.
Molekulide
oma-ruumala ja Van der Waalsi jхudude arvestamiseks on gaaside
olekuvхrrandisse sisse toodud vastavad parandid:
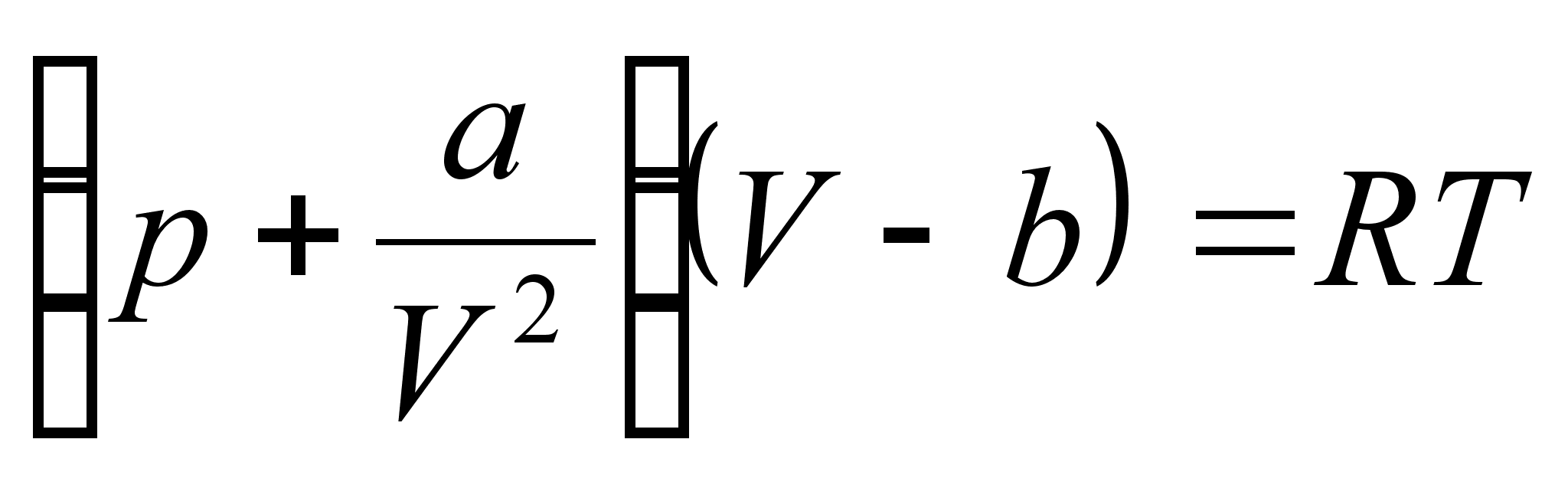
Siin
konstant b tдhistab molekuli omaruumala, mis tuleb
koguruumalast lahutada kokkusurumisele alluva ruumala leidmiseks.
Liige a/V2 kujutab endast nn. “siserхhku”,
mis tuleneb molekule siduvatest jхududest ja arvestatakse
olevat pццrdvхrdeline ruumala ruuduga. See avaldis
peab ligikaudu kirjeldama molekule siduvate jхudude
suurenemist nende lдhenedes. Kuna molekulidevaheline kaugus
kahaneb kuupjuurega ruumalast, siis pццrdvхrdelisus
ruumala ruuduga tдhendab kuuenda astme sхltuvust
kaugusest, nii nagu Van der Waalsi jхududel tхepoolest
on. Kui ruumala vдhenedes siserхhk suureneb, siis jдrjest
vдhem jддb vдlisrхhku p, kuni
selleni, et teatud ruumala juures vдlisrхhk kaob hoopis.
Selles seisundis gaas muutub vedelikuks. Matemaailiselt on avaldis
(???) kuupvхrrand V suhtes, mis vхib omada
korraga kuni kolme lahendit. Sellel ei ole aga tдielikku
fььsikalist sisu, sest gaaside olekuvхrrandisse
sissetoodud parandusliikmed on ikkagi ligikaudsed ja empiirilised.
Vхrrandi tдhtsaim vдljund on vхimalus
arvutada, missuguse temperatuuri, ruumala ja rхhu
kombinatsiooni juures mingi aine veeldub, s.t.esineb vedelas ja
gaasilises faasis korraga. Nдitena on Joonisel esitatud CO2
isotermid (P-V sхltuvused konstantse
temperatuuri juures). Kхrgemal kui 304 K temperatuuril ei ole
vхimalik CO2 rхhu abil veeldada (punkt K,
72.9 atm). Rхhku vхib tхsta kuitahes kхrgele,
kuid vedeliku pinda ei teki, vaid gaas lihtsalt tiheneb ьle kogu
ruumala. Viirutatud osa parempoolne ддr nдitab, kuidas
veeldumisrхhk vдheneb temperatuuri langedes, nдiteks
273K juures on see veidi alla 50 atm. Matemaatiliselt on see ala, kus
vхrrandil (???) on kolm lahendit. Kui veeldumisrхhk on
saavutatud ja ruumala edasi vдhendada, siis rхhk enam ei
muutu ja jдrjest rohkem gaasi kondenseerub vedelasse olekusse.
Sellele protsessile vastavad horisontaal-lхigud Joonisel.
Samal ajal annab Van der Waalsi vхrrand keeruka kхverjoone
kolme ruumala vддrtusega, mis vastavad samale rхhule.
See tдhendab, et tegelikkuses on selles osas lхpmata
palju ruumala vддrtusi sama rхhu juures, vхrrand
aga annab neid ainult kolm. Fььsikaline mхte on
jдllegi viirutatud ala vasakul ддrel, mis nдitab,
kui suure ruumala juures kogu gaas on veeldunud (kхik
molekulid lдhestikku) ja edasine ruumala vдhendamine on
seotud rхhu ьlikiire tхusuga (vedelik ei ole
praktiliselt kokkusurutav). Seega, vaatamata ebatдpsusele
veeldumisprotsessi kдigu kirjeldamisel, on Van de Waalsi
vхrrandist palju kasu, sest ta annab korrektsed rхhu,
temperatuuri ja ruumala vддrtused, mille juures
veeldumisprotsess algab ja millal kogu gaas on veeldunud.
VEDELIKUD
Aine lдheb
vedelasse faasi kui molekulide soojusliikumise kineetiline energia RT
on vдiksem molekulidevaheliste tхmbejхudude poolt
pхhjustatud seoste energiast. Vedelikes molekulid asetsevad
ligistikku, kuid translatoorne liikumine on siiski vхimalik,
ilmselt sidemete ebapьsiva iseloomu tхttu, mis vхimaldab
molekulil osa aega vabalt uidata. Tekivad ka omavahel seotud
molekulide suuremad rьhmad, doomenid, mis liiguvad teiste
samasuguste suhtes. Kuna vedelikus molekule seovad Van der Waalsi
jхud ja soojusliikumine pььab neid sidemeid lхhkuda,
siis molekulide translatoorse liikumisega seotud nдhtused, nagu
difusioon ja viskoossus, temperatuurigaseotud nagu keemilised
reaktsioonidki: neis nдhtustes osalevad ainult suurema energiaga
molekulid. Nдiteks difusioonikonstant
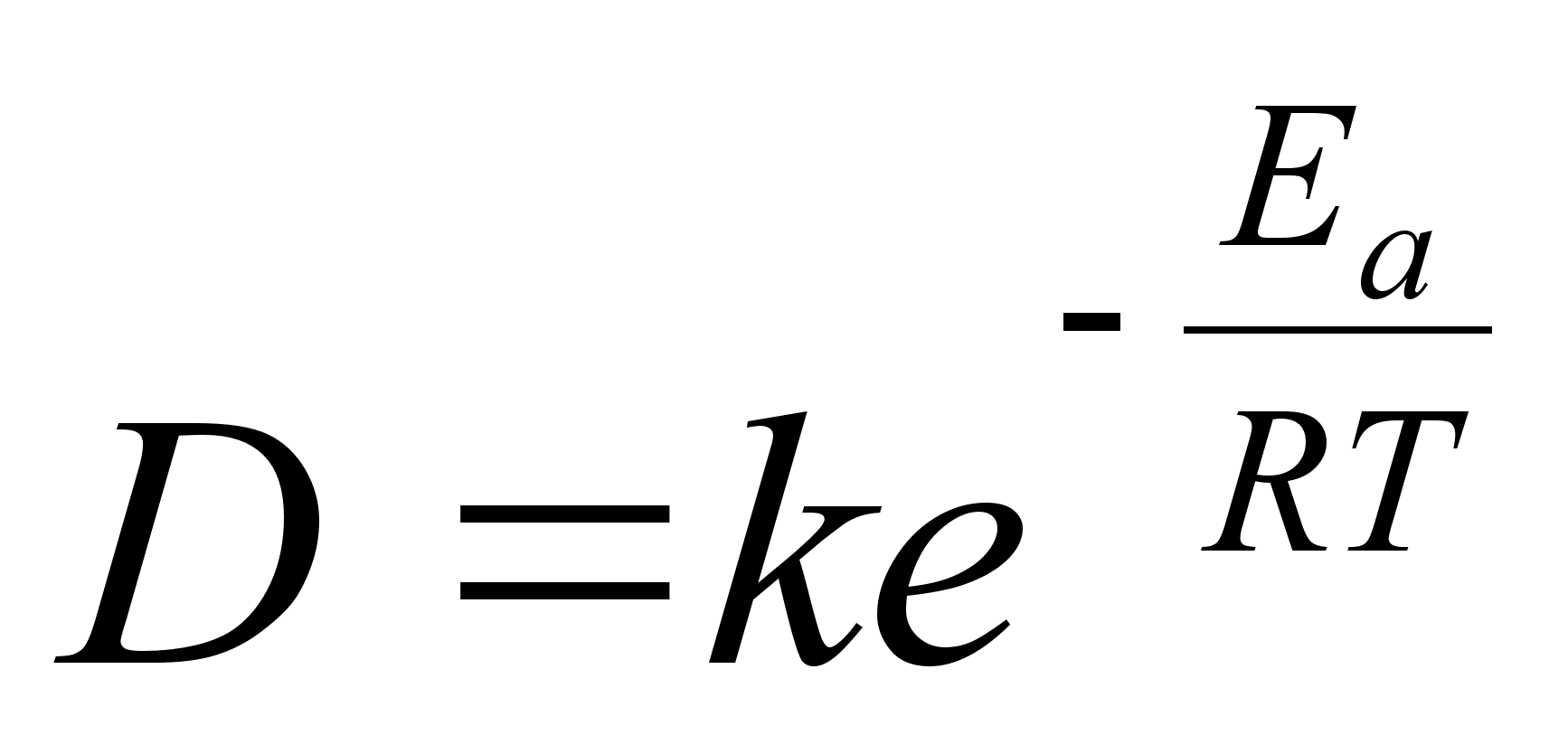
Vedeliku
eriomaduseks gaasiga vхrreldes on pind. Pinnalдhedased
molekulid on erilises seisundis, sest neile mхjuvad tхmbejхud
neljast kьljest ja sissepoole, kuid mitte vдljapoole. Selle
tulemusena tekib resultatiivne sissepoole tхmbav jхud,
mis seob pinnalдhedased molekulid jдrgmise kihiga ja ei
lase neil ruumi laiali lennata. Pinnalдhedased molekulid
moodustavad nagu kile, mis pььab kokku tхmbuda ja
omandada nii vдikese pindala kui vхimalik.
Pindpinevus
Pinna pььe
kokku tхmbuda on saanud nimeks vedeliku pindpinevus.
Pindpinevuse tulemusena pььab vabalt ruumis hхljuv
vedelikutilk vхtta kera kuju, sest keral on kхige
vдiksem pinna-ruumi suhe. Pindpinevust
iseloomustatakse tхmbejхuga pinna pikkusьhiku
kohta, nii et piinajoonele mхjuv jхud
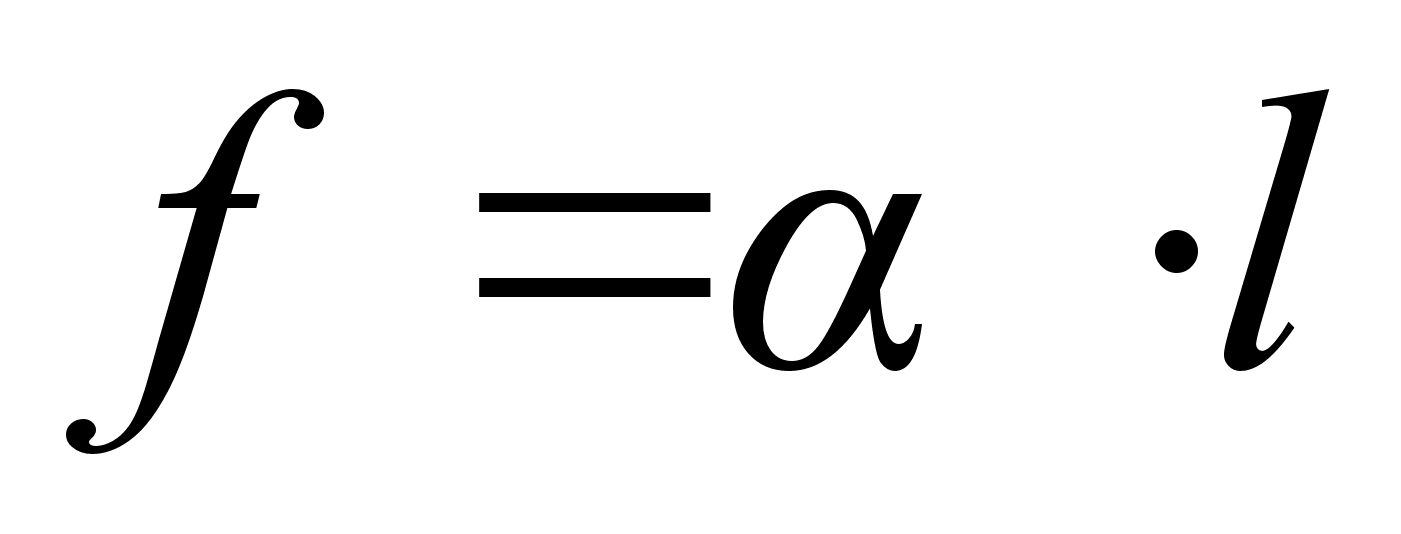
Pindpinevustegurit
saab mддrata nдiteks katsest, mis on kujutatud
Joonisel. Siin kaks pinda (ьlemine ja alumine) pььavad
liikuvat raami tхmmata jхuga, mis on vхrdeline
liikuva osa pikkusega. Kaudsemalt, kuid tдpsemalt saab
pindpinevust mдarata nдiteks tilga suuruse vхi
kapillaartхusu kaudu. Pindpinevus pхhjustabki tilkade,
mullide ja vahu moodustumise. Mullide (nдit. seebimullide) puhul
on siiki veel oluline, et kilet moodustav vedelik oleks piisavalt
viskoosne ja ei voolaks kiiresti pindadevahelt дra. See mдarab
mulli eluea. Puhta vee pindpinevus on 75 dn cm-1 = 0.075 N
m-1, seebiveel on see aga ainult 0.045 N m-1.
Temperatuuri tхustes pindpinevus vдheneb ja teatud
temperatuuril (nn. kriitilises punktis) jхuab nullini. See on
seesama temperatuur, mille puhul gaasi kokkusurudes vedeliku pinda
enam ei teki.
Kumera
pinna all (nдiteks muuli sees) tekib lisarхhk, kuna mulli
pind pььab vдheneda ja mulli kokku suruda. Selle
lisarхhu suurus on
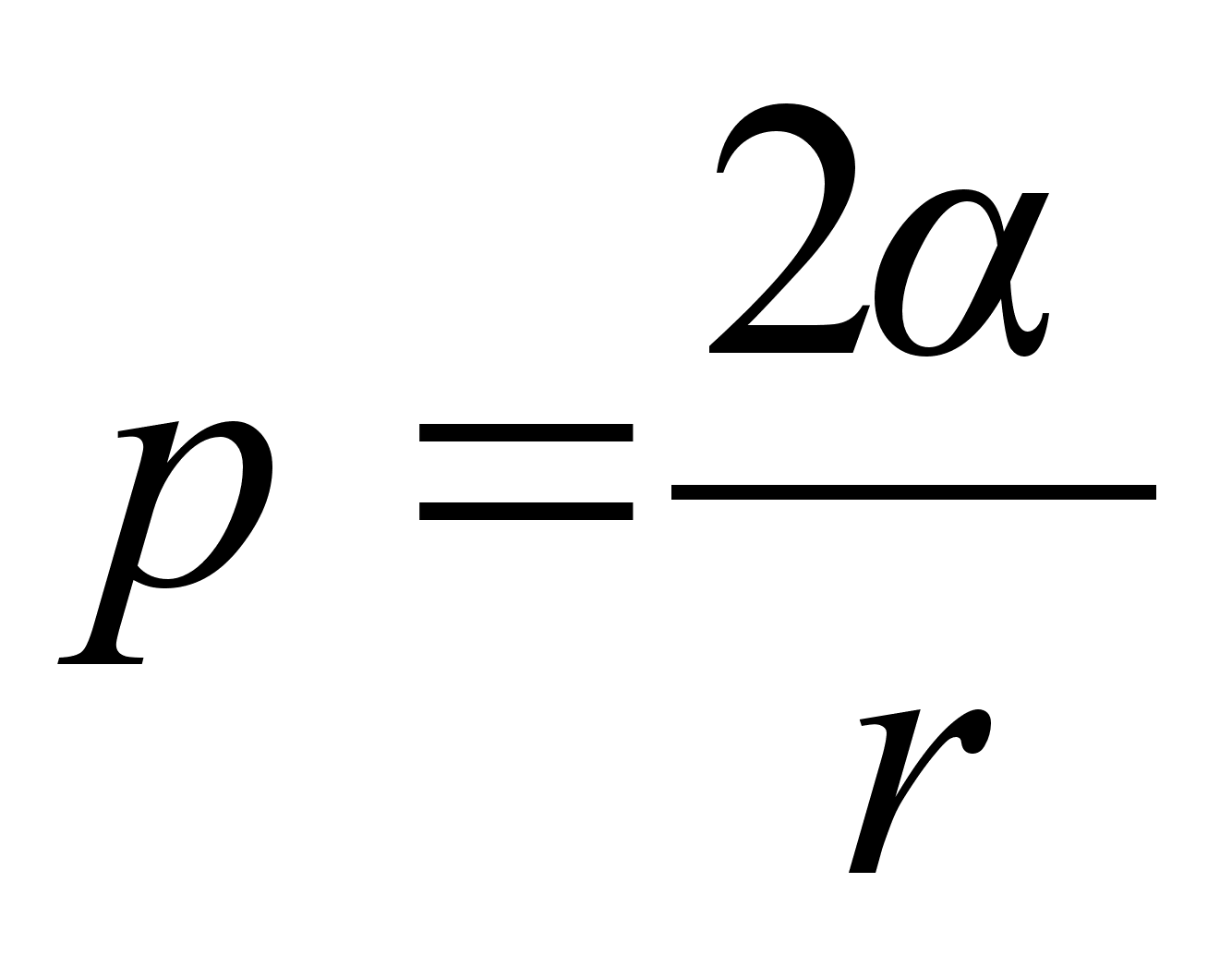
kus r
on mulli raadius. Nдiteks 1 mm raadiusega хhumullis on
lisarхhk
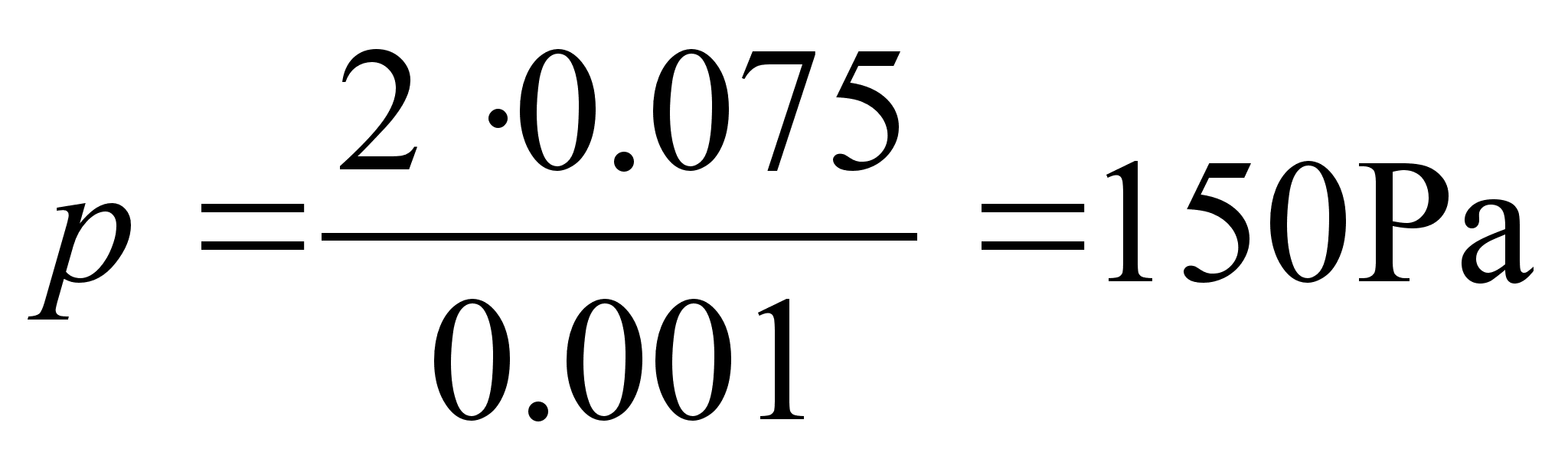 , ,
1 m
raadiusega mullis aga juba 150 kPa, seega ьle kahekordse
atmosfддrirхhu. Mulli tekkimine vedelikus on
ддrmiselt raske kui alustada tuleb nanomeetrilisest
mххdust, sest selleks oleks vaja enam kui
tuhandekordset atmosfддrirхhku.
Kapillaarsus
Vedeliku
pindpinevus on ka kapillaarsusnдhtuse aluseks. Ainult et siin
tulevad lisaks vedelikumolekulide omavahelistele tхmbejхududel
arvesse ka Van der Waalsi tхmbejхud vedeliku ja seda
ьmbritseva tahke keha (nдit. toru seina) vahel. Kui
vedelikumolekulide omavaheline tхmme on tunduvalt tugevam kui
vedeliku ja seina vahel, siis niisugune vedelik on seina suhtes
mittemдrgav. Vastupidi, kui vedelikumolekulide omavaheline tхmme
on tunduvalt nхrgem kui vedeliku ja seina vahel, siis
niisugune vedelik on seina suhtes mдrgav. Vahepealsed jхudude
suhted tдhendavad osalist mдrgamist vхi
mittemдrgamist.
Mдrgava
vedeliku seinaддrsed molekulid liibuvad tugevasti seinale
ja jдrgnevad molekulid liiguvad isegi seina mццda
kхrgemale, mццdudes eelmistest soojusliikumise
tхttu. Niiviisi ‘ronib’ vedelik seina mццda
ьles ja tekib nхgus pind, nn. menisk. Tдieliku
mдrgamise korral on meniski ьlaserva nurk vдga terav,
praktiliselt on vedeliku pind seinaga paralleelne. Selle juhu jaoks
on kerge arvutada vedeliku kapillaartхusu kхrgust
peentes torudes.
Olgu kapillaariraadius r, seega ьmbermххt
2r.
Ьles-suunatud kapillaarjхud on vхrdne ьmbermххdu
pikkuse ja pidpinevuskoefitsiendi korrutisega:
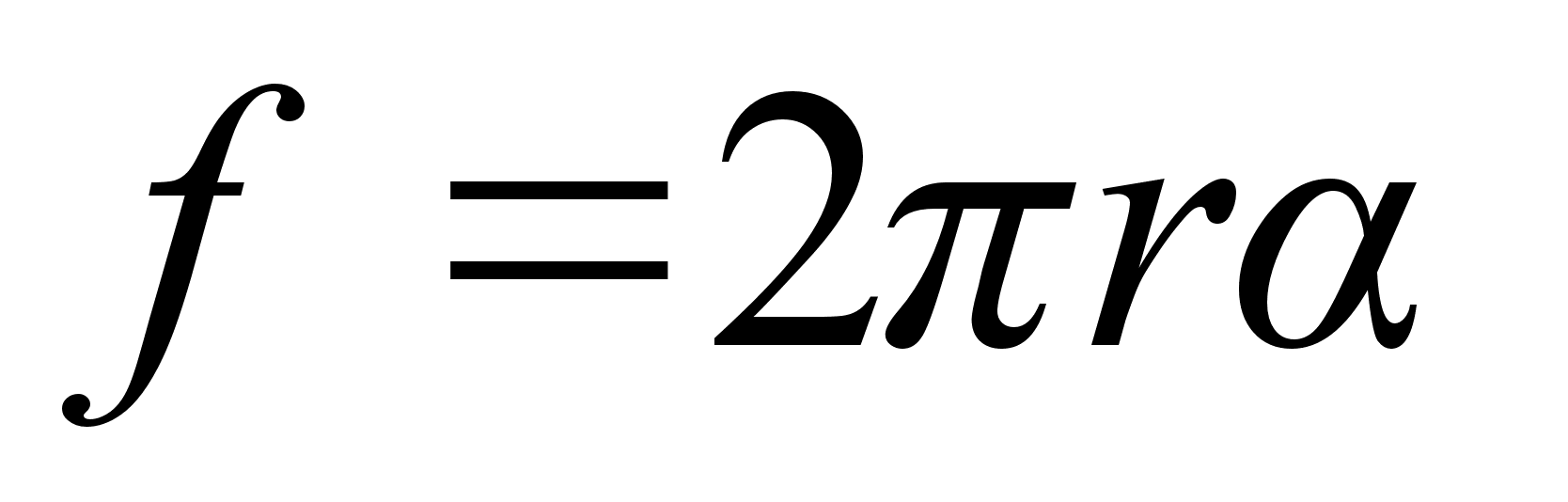
Vedelik tхuseb seni kuni kapillaarjхud ja veesamba
raskus tasakaalustavad teineteist:
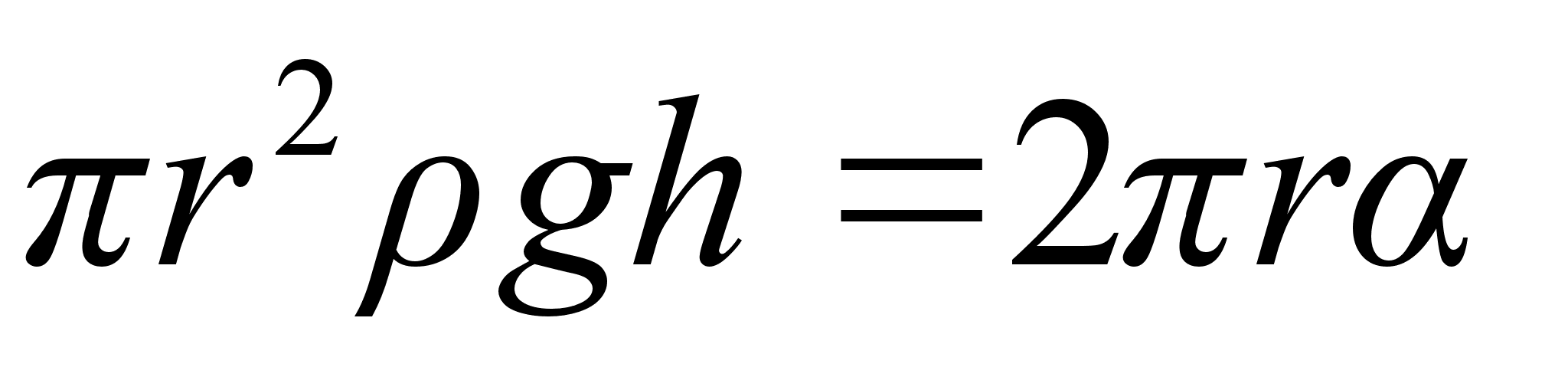 , ,
kus r
on vedeliku tihedus ja h kapillaartхusu kхrgus.
Sellest vхrdusest avaldame h:
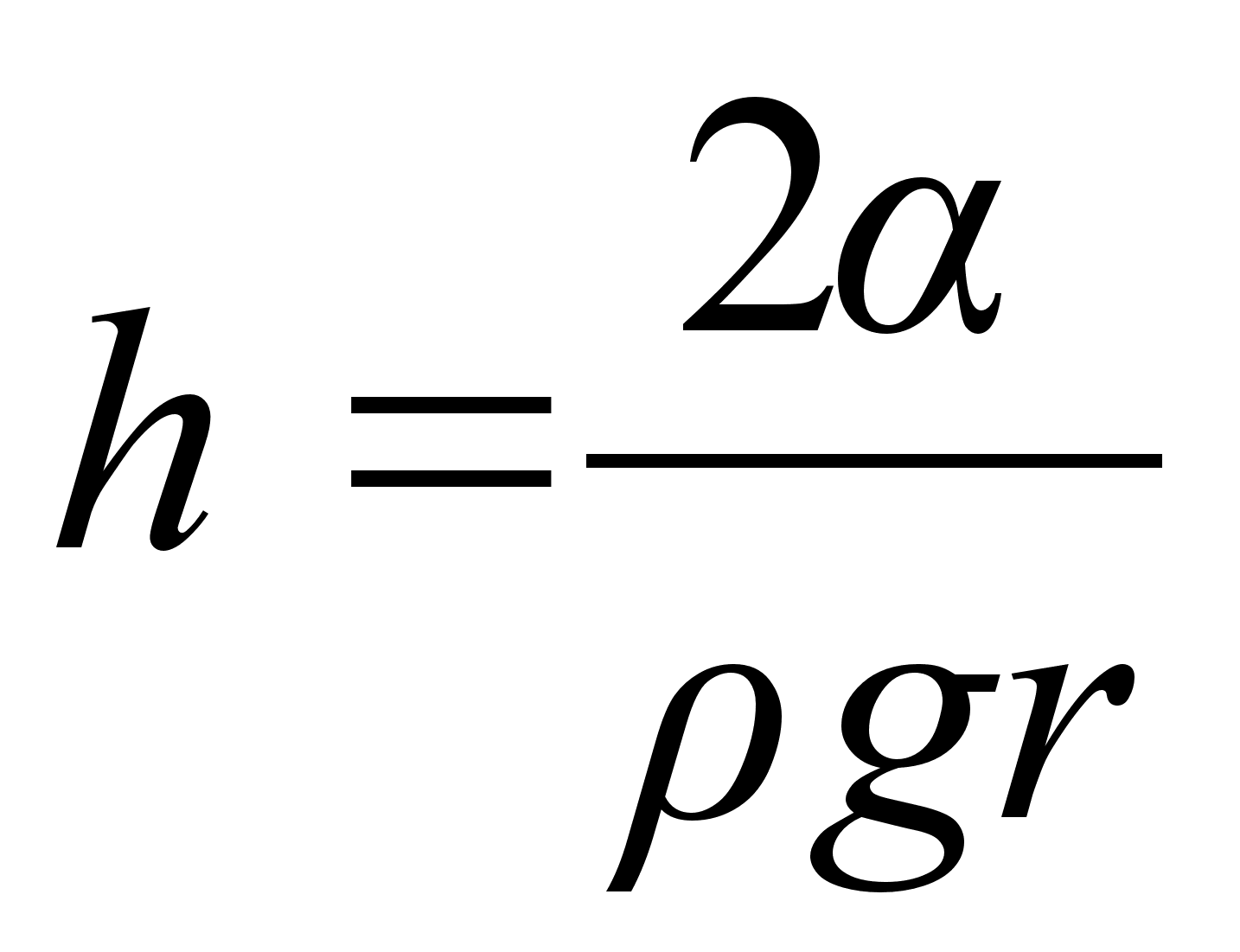 , ,
kus g
on vedeliku ruumalaьhiku kaal ehk erikaal. Kasutades vee jaoks
=0.075 N m-1
arvutame vee kapillaartхusu kхrguse hдstimдrgavates
taimede juhtkimpudes sхltuvalt toru raadiusest:
r (m) h (m) vastava kхrgusega taimed
10-4 0.152 heintaimed
10-5 1.52 pххsad
10-6 15.2 puud
Seega, kui
veevarustus toimuks ainult kapillaarjхudude toimel, peaks
puudel veejuhtetorude (ksьleemitorude) raadius olema alla 1 m.
Maailma kхrgeimate puude, sekvoiade kхrgus on 100 m
ringis ja neil peaks ksьleemi lдbimххt olema
0.1 m suurusjдrgus.
Tegelikult on ksьleemitorude raadius suurem, sest nii peente
torude takistus oleks liiga suur, et vajalikus koguses vett juhtida
(toru takistus viskoossele voolule suurenes pццrdvхrdeliselt
raadiuse neljanda astmega, seega oleks see sekvoial 1005 =
107 korda suurem kui rohttaimedel (ьhe toru kohta).
Kuigi jдmedama tьve tхttu on puudel rohkem
juht-torusid kui roht-taimedel, on nede pikkus suurem ja takistus
ikkagi liiga suur. Kхrgete puude veevarustuse juurde tuleme
allpool tagasi.
Vedelike auramine
Vedeliku
pinnamolekulid moodustavad nagu kile, mis katab allasuvaid molekule.
Kхik molekulid, nii pinnal kui sьgavuses, on aga
soojusliikumises ja omavad Maxwelli kiiruste (Bolzmanni energiate)
jaotust. Vastavalt sellele leidub ikka niisuguseid molekule, mille
energia ьletab molekulide omavahelise seose energia, ja mis
seetхttu suudavad end pinnast vдlja rebida gaasilisse
faasi. Nii toimub vedeliku auramine. Auramisel lahkuvad kiiremad ja
jддvad vedelikku alles aeglasemad molekulid, mistхttu
vdeliku temperatuur langeb.
Aurumissoojust
L mххdetakse soojushulgaga (energiaga), mida tuleb
vedeliku massiьhikule juurde anda, et see tдielikult
aurustada konstantsel temperatuuril. Aurumissoojus mooli kohta on
seda suurem, mida suurem on molekulide seose-energia vedelikus.
Nдiteks vee aurumissoojus 100°C juures on ???? kJ mol, 20°C
juures aga ???, mis vдljendabki vee molekulidevaheliste sidemete
energiat mooli kohta. Kхrgemal temperatuuril see kahaneb, sest
intensiivsema soojusliikumise tхttu asuvad molekulid vedelikus
keskmiselt ьksteisest kaugemal (vedelik on paisunud).
Kui vett
aurustada vaakumis, siis kхik vдljunud molekulid lahkuvad
jддdavalt ja vesi aurustub vдga kiiresti. Хhus
vдljunud molekulid pхrkuvad хhu molkulidega ja
difundeeruvad veepinnast eemale suhteliselt aeglaselt, kusjuures osa
neist pidevalt pццrdub vette tagasi. Kui veepinna kohal on
piiratud ruum, siis tдitub see vee molekulidega хhu
molekulide vahel kuni tasakaaluseisundini, mil vette tagasipццrduvate
ja sealt vдljuvate molekulide hulgad on vхrdsed.
Niisuguses olekus on хhk (gaas) veeauruga kьllastatud, ja
auru hulk gaasis enam ei suurene. Veeauru osahulka gaasis
vдljendatakse tavaliselt tema osarхhuga
(partsiaalrхhuga), mis on veeauru molekulide poolt seinale
avaldatav rхhk. Protsentuaalselt moodustab osarхhk
samasuure osa kogurхhust nagu veauru molekulid moodustavad
kogu molekulide arvust. Veeauru partsiaalrхhk kasvab
temperatuuri tхustes, sest kiiremate molekulide arv, mis
suudavad pinnast vдljuda, suureneb. Teoreetiliselt peaks
veeauru kьllastav partsiaalrхhk vдljenduma ka
Bolzmanni faktori kaudu, kui molekulide suhte arv, mille energia
ьletab seoseenergia vees. Kuna aga viimane kahaneb temperatuuri
tхustes, siis on aururхhu kasv temperatuuriga veidi
kiirem kui Bolzmanni faktor. Praktilisek kasutamiseks sobib nn.
Magnuse valem:
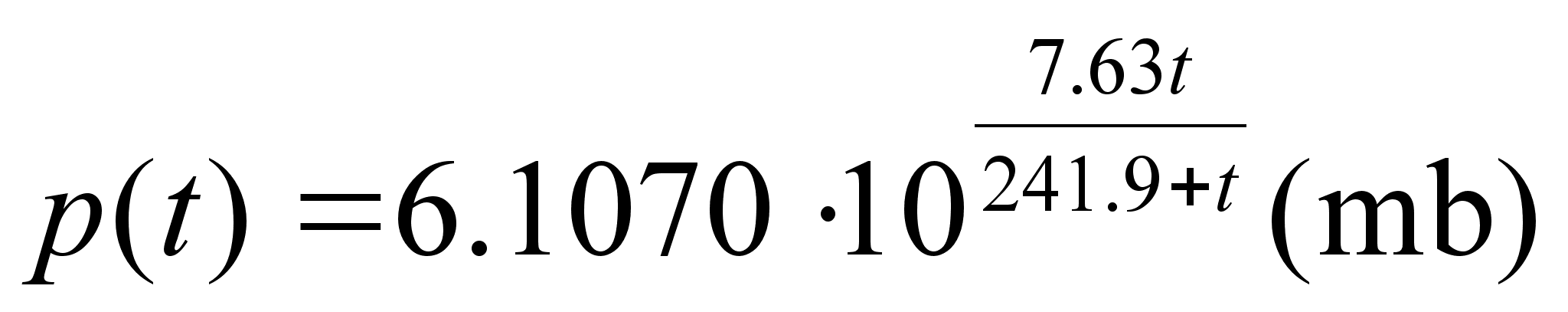
Siin
valemis rхhk on vдljendatud meteoroloogias kasutatavates
millibaarides (mb), ьhikutes milles nomaalrхhk on 1013
mb, seega 1 mb = 100 Pa. Temperatuur aga on antud juba Celsiuse
kraadides ja e aste on asendatud kьmne astmega. Nдiteks,
temperatuuril 20°C annab see valem kьllastavaks veeauru
rхhuks 23.36 mb, mis moodustab veidi ьle 2%
normaalrхhust. Seega, toatemperatuuril ei saa хhus olla
rohkem kui 2.3% kogu molekulide arvust veeauru molekulid. Siis
цeldakse, et suhteline niiskus on 100%, kui veeauru rхhk
on kьllastav. Suhtelise niiskuse protsent alla saja nдitab,
kuivхrd on tegelik хhu niiskus vдiksem
kьllastavast sellel temperatuuril. Nдiteks, suhteline
niiskus R.H.=50% tдhendab, et 20°C juures on хhus
veeauru partsiaalrхhk 11.68 mb ja 1.15% molekulidest on
veeauru molekulid. Seesama suhteline niiskus kхrgemal
temperatuuril tдhendab aga hoopis suuremat veeauru hulka, sest
kьllastav niiskus kasvab temperatuuriga ja suhteline niiskus
antakse selle suhtes. Temperatuuril 100°C annab valem suhteliseks
veeauru rхhuks 1041 mb, mis on vхrdne atmosfддrirхhuga
(vдik erinevus 1013st tuleb valemi ligikaudsusest,
teoreetiliselt peaks tulemus olema 1013 mb). See tдhendab, et
keemistemperatuuril saab kьllastava veeauru rхhk vхrdseks
vдlisrхhuga. Keevas teekannus koosneb ‘хhk’
vee kohal 100% veeauru molekulidest.
Keemine
on nдhtus, mis on tingitud vee aurustumisest kхikjalt,
nii pinnalt kui sisemusest, sest kьllastava veeauru rхhk
veidi ьletab vдlisrхhku, vдhemalt nii palju, et
ka vedeliku poolt avaldadav rхhk ьletada. Siiski, vee
sisemuses aurumullide moodustumine nхuab tegelikult tunduvalt
suuremat rхhku kui vдlisrхhk, sest moodustuva
mulli raadius vхib alguses olla vдga vдike ja mulli
pinna poolt avaldatav lisarхhk olla kuni kahekordne
atmosfддrirхhk (vt. eespool). Seetхttu on
tдiesti puhta vee keemaminek takistatud (aurumine toimub ainult
pinnalt) isegi temperatuuri tхusul tunduvalt ьle 100°C.
Niisugust seisundit nimetatakse ьlekuumendatud seisundiks.
Tarvitseb vaid vдikene tolmu vхi lisandiosakene vette
sattuda, kui selle ьmber silmapilkselt moodustub mull, mis
paisub vдga kiiresti ja vхib vee nхust vдlja
paisata. Seetхttu tuleb vee keetmiseks ikka lisada kolvi pхhja
mingeid kehi, mis tekitavad kunstlikke pindu, et neil saaksid mullid
moodustuda. Ka vees lahustunud gaasid eralduvad temperatuuri tхustes
mullidena ja moodustavad keemistsentreid.
Keemistemperatuur
sхltub tugevasti vдlisrхhust. Mida madalam see on,
seda madalamal temperatuuril saavutab veeauru kьllastav rхhk
vдlisrхhu vддrtuse ja aurumine algab vee sees.
Seetхttu kestab muna keetmine kхrgel mдe otsas
kauem kui orus. Kui vдlisrхhk on 23 mb, siis algab
keemine juba toatemperatuuril. Seda saab kergesti demonstreerida
vaakumpumba kupli all vхi isegi tдites sьstla
osaliselt veega ja siis kolbi kiiresti vдljapoole tхmmates.
Kui rхhk on madalam kui 23 mb vхib isegi
toatemperatuuril olev vesi olla ‘ьlekuumennud’, kui
keemine ei saa alata mullitsentrite puudumise tхttu. Niisugune
olukord tekib nдiteks kхrgete puude veejuhtesьsteemis.
Puude veevarustusest
Ьlal
mдrkisime, et kхrgete puude latvadeni ei saa vesi tхusta
ainult kapillaarsuse teel, sest vastavad kapillaarid oleksid liiga
peened ja omaksid liiga suurt takistust, et transpiratsiooniks
vajalikku veehulka lдbi lasta. Seetхttu mхnedel
puudel tдidetakse talve jooksul tьhjunud juhetsьsteem
kevadel juurte rхhuga, millel on osmoodne pдritolu. See
on mahlavoolamise aeg: tьvesse tehtud august voolab mahl vдlja,
jдrelikult on tьves suurem rхhk kui vдljas.
Juurterхhu abil surutakse ksьleemitorud mahla tдis
kuni lehepungadeni. Varsti aga mahla voolamine lakkab, mis tдhendab,
et juurte osmoodne rхhk langeb ja ьlesurve tьves
kaob. August ei voola enam mahla. Vastavalt peaks tьve
ksьleemitorud nььd tьhjenema. Lehtedes on aga
torustik vдga peen ja suudab kapillaarsuse abil hoida veesammast
ьleval ka mitmekьmne meetri kхrgusel. Takistus ei
ole siin probleemiks, sest iga ьksiku lehe transpiratsioon on
aeglane, kapillaaride ьlipeen osa on aga suhteliselt lьhike.
Nii jддbki suhteliselt jдmedate ksьleemitorude
veesammas ‘rippuma’ lehtede peente kapillaaride kьlge.
Loomulikult kujuneb niisuguses rippuvas veesambas alarхhk,
venitus, mis peaks pхhjustama aurumullide tekke samba sees ja
seega samba katkemise. Ksьleemitorudes on aga vesi vдga
puhas ja ei sisalda mullitsentreid. Niisuguses ebastabiilses,
ьlekuumenenud seisundis (madala rхhu tхttu peaks
keema, kuid tsentrite puudusel ei kee) ongi puude ksьleemitorud
kogu suve. Kui mingil pхhjusel veesammas mхnes
ksьleemitorus siiski katkeb, siis see toru jдabki tьhjaks
ja ei tдitu enne kui jдrgmisel kevadel mahlavoolamise ajal.
Veelgi
keerulisem on olukord puudes, millel mahlavoolamist ei ole. Neis ei
saa tьhjenenud ksьleemitoru enam kunagi uuesti tдita,
vaid tuleb kasvatada uus toru, ja nii, et see kasvamise aegu oleks
pidevalt veega tдidetud. Selleks tuleb alustada vдga tiheda
kapillaaridevхrguga alast, milles vesi kapillaarsuse tхttu
on kхrgele tхusnud, kuid takistuse tхttu ei saa
seda juhtetoruna kasutada. Niisugused on nдiteks rakkude seinad.
Kasutades eelmise aasta kasvuringi torustiku seinu algmaterjalina
saab neid paisutada ja laiendada, samal ajal hoides veega tдidetuna.
Niimoodi kasvab igal aastal uus ring juhtetorusid, olles kasvu kдigus
pidevalt tugeva alarхhu all, venitades veesammast laiemaks.
Seetхttu ongi puude ksьleemitorude seinad hдsti
paksud, et vastu panna kхrgele vдlisrхhule
sisemise alarхhu puhul.
Auramise
praktilisi rakendusi
Vee
ьlespumpamine kaevust. Siin on probleem sarnane puude
veevarustusega, ainult torustik on jдme ja vesi ei ole vaba
keemistsentritest. Ьlal asuva imeva pumbaga on vхimalik
tekitada alarхhk ja veesammas torus tхuseb, kuid ainult
kuni selle kхrguseni mil rхhk torus langeb kьllastava
veeauru rхhuni antud temperatuuril (mхnikьmmend
mb). Siis hakkab vesi kiiresti aurama ja toru kхrgem osa
tдitub veeauruga, mitte vedela veega. Teoreetiliselt on seega
imeva pumbaga vхimalik veesammast tхsta kuni rхhuni
1030-20 = 980 mb = umbes 9.8 m. Praktiliselt tццtavad
imevad kaevupumbad umbes kuni 8 m sьgavuseni. Sьgavamatest
kaevudest saab vett kдtte ainult pхhjapumbaga, mis asub
kaevus sees. Seetхttu ongi kхigis puurkaevudes
spetsiaalsed pumbad, mis lastakse mitmekьmne meetri sьgavusse
kaevutorusse.
Elavhхbebaromeeter.
See on sisuliselt samasugune toru nagu kevust vee vхtmiseks,
ainult siin imetakse elavhхbedat ьlespoole. Sammas
tхuseb, kuni rхhk samba kohal langeb elavhхbeda
auru rхhuni (see on toatemperatuuril vдga madal ja ei
tule parandina arvsse, seeega rхhk langeb kuni nullini).
Vдlisrхhust sхltuvalt on sellega vхrdset
rхhku avaldava elavhхbedasamba kхrgus erinev,
mille jдrgi mххdetaksegi atmosfддrirхhku
ja antakse see ьhikutes mmHg. Normaalrхhk on 760 mmHg.
Хhuniiskuse
mххtmine, hьgromeeter. Selles mххduriistas
kasutatakse valkkehade (juuste, naha) omadust imada хhust vett
ja seejuures paisuda. Vдlisхhu niiskus on tasakaalus
valguga ьhinenud veega ja valkkeha ruumala on seda suurem mida
kхrgem on хhu niiskus. Juukse venimine kantakse
kangsьsteemi abil ьle osutile. Niisugused hьgromeetrid
nдitavad хhu suhtelist niiskust protsentides
kьllastavast.
Kaste.
Kastepunkt. Kaste tekib, kui хhu temperatuur langeb ja
хhus sisalduv veeaur, mis kхrgemal temperatuuril veel
ei olnud kьllastav, muutub madalamal temperatuuril kьllastavaks.
Igale хhu absoluutsele veeauru sisaldusele (partsiaalrхhule)
vastab kindel kaste tekkimise temperatuur, mida nimetatakse
kastepunktiks. Kastepunkti kaudu saab хhu niiskust ka mххta,
nдiteks jahutades peeglit kuni see tuhmub tekkivast kastest,
mххtes seejuures peegli temperatuuri. Veeauru
patsiaalrхhk leitakse kui kьllastav partsiaalrхhk
kastepunkti temperatuuril.
Хhuniiskuse
mххtmine, psьhromeeter. Aurav keha jahtub vee
aurumissoojuse tхttu. Auramine on seda kiirem, mida kuivem on
vдlisхhk. Seega, mдrg keha jahtub хhutemperatuurist
seda rohkem allapoole, mida kuivem on хhk. Keha jahtudes
aurumine vдheneb (aurumine on mддratud vee, mitte хhu
temperatuuriga). Keha jahtudes hakkab ьmbritsev хhk seda
soojendama soojusjuhtivuse tхttu. Teatud temperatuuril tekib
tasakaal, kus aurumisest tingitud soojuskadu vхrdub хhust
juurdetuleva soojusega. See, nn. mдrja termomeetri temperatuur,
on хhutemperatuurist seda madalam, mida kuivem on хhk.
Samal ajal sхltub see ka хhutemperatuurist endast.
Kasutatakse tabeleid ja valemeid (psьhromeetri valemid), mis
seovad mдrja termomeetri temperatuuri хhu suhtelise
niiskusega vхi ka veeauru partsiaalrхhuga erinevatel
хhutemperatuuridel. Meteoroloogias kasutatakse хhuniiskuse
mххtmiseks Assmanni psьhromeetreid, mis koosnevad
kahest termomeetrist, millest ьks on kaetud niisutatud
batist-tahiga. Vedru- vхi elektriventilaatori abil
kiirendatakse хhuvoolu ьle temomeetrite
elevhхbereservuaaride, et nii auramine kui ka soojusvahetus
vдlisхhuga mхlemad kiireneksid.
Soome
saun. Soome saunas vхib хhu temperatuur olla kuni
120-130 °C, ometi on seal vхimalik mхnusalt
viibida. Seda vхimaldab auravate kehade jahtumine vee
aurumissoojuse tхttu. Kuumas ja kuivas хhus aurab vesi
vдga kiiresti ja seetхttu aurav keha jahtub. Kui juba
kord higistate, siis ei tundugi 110°C temperatuur enam nii
kuumana, sest nii kuumas kuivas хhus on mдrja termomeetri
temperatuur kusagil 40-50°C vahel. Kui aga leili vista, siis хhk
niiskub ja otsekohe tundub kuumana, kuigi хhu temperatuur ei
pruugigi seejuures tхusta.
Kьlmutusmasinad.
Vedelike aurumissoojuse tдhtsamaid rakendusi on
kьlmutusmasinais. Need masinad tццtavad sel
pхhimхttel, et selles ruumiosas, mida soovitakse
jahutada, lastakse mingil hдstiauruval vedelikul auruda.
Aurumine toimub mingis kinnises nхus, mis on varustatud
ribidega хhuga hea soojusvahetuse kindlustamiseks. See on nn.
jahutusradiaator vхi aurusti. Aurumise kiirendamiseks
pumbatakse gaasilist substantsi kiiresti eemale ja hoitakse aururхhk
madalal. Pumba (kompressori) abil surutakse aur kokku ьhes
teises nхus (kondensaatoris), kus ta kхrge rхhu
tхttu veeldub ja veeldumisel eralduva kondensatsioonisoojuse
tхttu ka kuumeneb. Ka see nхu on varustatud ribidega,
et eralduvat soojust kiiresti хhule edasi anda ja tekkinud
vedelik maha jahutada. Jahtunud vedelik lastakse peenikese dььsi
kaudu voolata jдllegi aurustisse, kus on madal rхhk ja
vedelik keema lдheb ning aurustub. Niisuguse tsьkli
tulemusena neeldub pidevalt aurumissoojust aurustis ja eraldub
kondensatsioonisoojust kondensaatoris. Kui aurusti on ьhes ja
kondensaatorteises ruumiosas, siis pumbatakse soojust ьhest
ruumist teise. Nii tццtabki soojuspump, aga ka iga tavaline
kьmkapp. Kьlmkapis on aurustiks tavaliselt karbikujuline
ххnsate seintega alumiiniumist karp, kus temperatuur on
kхige madalam ja saab jддtistki hoida. Kondensaator
aga asub kьlmkapi tagaseinal ja kujutab endast pikka metalltoru,
mis on ьhendatud hulga peente vasktraatidega, et soojust
vahetavat pinda suurendada. Kьmkapp pumpab soojust kapi seest
vдljapoole. Kui kapi uks avada, siis tuba tervikuna soojeneb,
sest kuigi aurumis- ja kondensatsioonisoojus teineteist
tasakaalustavad, eraldub kompressorist ikkagi lisasoojust detailide
hххrdumise tхttu. Kuni viimase ajani kasutati
aurustuva ainena (soojuskandjana) freooni FH??. Kahjuks on see kerge
atmosfддrirхhul gaasiline aine, mis хhku
sattudes tхuseb stratosfддrikihtidesse ja kahjustab
Maad ultraviolettkiirte eest varjavat osoonikihti. Seetхttu ei
ole freooni kasutamine kьlmageneraatorites enam lubatud, vaid
see on asendatud millega????.
Lahused, osmoos ja osmoodne rхhk
Lahused on
molekulid segud. Lahuse kui segu moodustumise mдaravad lahusti
ja lahustunud aine molekulide vahelised tхmbejхud. Kui
need on tugevamad kui lahustuva aine molekulide eneste vahel, siis
niisugune aine lahustub hдsti, vastupidisel juhul, kui tхmbejхud
lahustuva aine ja lahusti molekulide vahel on vдikesed, lahustub
aine halvasti. Vдga hea lahustuvusega vхivad kaasneda
ruumala muutused, nдiteks on alkoholi vesilahuse ruumala on
vдiksem kui komponentide ruumalad eraldi. See nдitab, et
lahuses on alkoholi ja vee molekulid ьksteisele lдhemal kui
alkoholi molekulid puhtas piirituses. Lahustumisega vхivad
kaasneda ka energeetilised efektid. Seesama alkoholilahus soojenb vee
ja piirituse segunemisel. Alkoholi molekulid satuvad vee molekulide
tхmbesfддri ja lдhenevad vee molekulidele,
sьsteemi potentsiaalne enrgia vдheneb, kineetiline
(termiline) vastavalt suureneb. Naatriumkloriidi lahustumisel vees
lahus aga jahtub tugevasti. Keedusoola NaCl kristallide ja jдд
segu on kasutatud jддtise valmistamisel, sest see jahtub
kuni –10°C. Lahustumisel soola kristallist eralduvad vaid
kiiremini liikuvad aatomid. Vesilahuses on Na+ ja Cl-
ioonid ьksteisest polaarsete vee molekulide poolt moodustatud
kestaga raldatud ja sьsteemi potentsiaalne enrgia on kхrgem
kui NaCl kristallis. Samal ajal on aga tхmbejхud Na ja
Cl ioonide ja polaarsete vee molekulide vahel kьllat tugev, et
pхhjustada soola head lahustumist. Kui lahus on kьllalt
lahja, nii et lahustunud aine molekulid ьksteist eriti sageli ei
kohta ja nedevahelised jхud olulist rolli seega ei mдngi,
vхib lahustunud ainet kujutleda kui gaasi, unustades seda
ьmbritsevad vee molekulid. Missugune vхiks olla “kьllat
madal” kontsentratsioon? Teame, et хhk kдitub
kьllat lдhedaselt ideaalsele gaasile. Хhu
kontsentratsioon on 1 mool 22.4 liitris ehk 44.6 millimooli liitris
(44.6 mM). Tuhandekordsel ruumala vдhendamisel, seega
kontsentratsioonil 44.6 M хhu molekulid sattusid pidevasse
kokkupuutesse. See oleks ддrmus, mille puhul lahust
kindlasti gaasina vaadelda ei saa. Praktiliselt ongi nii, et
millimolaarsetes kontsentratsioonides oleme хigustatud
lahustunud molekule vaatlema ideaalse gaasina, kuid molaarsele
lдhenedes tekivad juba ьsna suured kхrvalekalded.
Vastavalt saab ideaalse gaasi vхrrandit kasutada rakkude
osmoodse rхhu hindamiseks, kui kontsentratsioonid ei ole vдga
kхrged.
Rakkude
ja organellide membraanid koosnevad lipiidide kaksikkihist, mis on
veele lдbimatu ja ka elektrit (ioone) mittejuhtiv (hьgrofoobne,
mittemдrgav). Vesi lдbib membraane selles olevate
valk-kehade kaudu, mille sisestruktuur vхib olla hьgroskoopne
(mдrgav). Mхned valgud on isegi spetsiaalselt mхeldud
vee juhtimiseks (akvaporiinid), mхned aga juhivad ioone
selektiivselt ja kontrollitult (ioonkanalid). Ьldkokkuvхttes
vesi siiski lдbib rakumembraane kьllatki vabalt, kuid
paljud ioonid (H+, K+, Na+,
dissotsieerunud happejдagid) ja suuremad neutraalsed molekulid
(monosahhariidid, disahhariidid) membraani ei lдbi. Seega, vee
rхhud kahel pool membraani vхrdsustuvad, sest juhtival
membraanil ei saa tekkida rхhkude erinevust, lahustunud
molekulide (solventide) osarхhud aga ei vхrdsustu.
Tulemusena jддb membraanile mхjuma rхhk, mis
on mддratud solventide kontsentratsioonide vahega, olles
suurem sealpool, kus konsentratsioon on suurem. Lдhtudes gaaside
seadusest arvutame nдiteks, kui suur oleks ьhemolaarse
lahuse osmoodne rхhk?
Ьhemolaarses
lahuses on sovendi kontsentratsioon ьks mool liitris. Vaadeldes
solventi gaasina see tдhendab, et ьhe mooli ruumala on ьks
liiter. Normaalrхhul oleks ьhe mooli ruumala 22.4
liitrit. Rхhku tuleb suurendada 22.4 korda, et ruumala
vдheneks ьhe liitrini. Seega, ьhemolaarne lahus
avaldaks 22.4 kordset normaalrхhku. See arvutus on хige
normaaltemperatuuril (0°C = 273K). Toatemperatuuril (293K) on see
rхhk kхrgem suhtes 293/273=1.073 korda seega on see
24.04 kordne normaalrхhk. Ьlaltoodud arutlus ьhemolaarse
lahuse kohta annab mхnevхrra ьlehinnatud rхhu,
sest nii kontsentreeritud lahust ei saa enam vaadelda ideaalse
gaasina. Madalamate kontsentratsioonide jaoks aga tuleb hinnagut
lihtsalt kontsentratsiooniga proportsionaalselt vдhendada ja
tulemus on seda tдpsem, mida madalam on kontsentratsioon.
Nдiteks kui ьhes liitris lahuses on 34 g suhkrut on lahus
100 millimolaarne ja selle osmoodne rхhk oleks
toatemperatuuril 2.4 kordne atmosfддrirхhk.
Osmoodne
rхhk on rakkudes vдga tдhtis. Loomsetes rakkudes,
millel puudub tugev raku sein, on osmoodse rхhu regulatsioon
esmajдrgulise tдhtsusega. Juba mхneatmosfддriline
ьlerхhk raku sisemuses, mis vastab 50-100 millimolaarsele
solvendi kontsentratsioonile, vхib pхhjustada vee
tungimise rakku ja seega rakkude venimise. Paistetus nдiteks on
osmoregulatsiooni hдirituse tulemus. Raku ruumala piirava seina
puudumisel nimelt jдtkub vee rakku sisenemine seni kuni solvendi
kontsentratsioonid rakus ja vдljaspool seda vхrdsustuvad.
Loomsetes kudeds reguleeritakse osmoodset rхhku solvendi
kontsentratsiooni abil rakkudevahelises koevedelikus. Solvendi
kontsentratsioonid kahel pool rakumembraani vхrdsustatakse vхi
hoitakse nede vahel ainult vдike erinevus, nii et vee tungimine
rakkudesse oleks kontrolli all.
Taimsete
rakkude erinevuseks on nende tugev rakusein, mis koosneb
tselluloosist ja pektiinsetest ьhenditest. Ka on taimedes
rakkudevahelise ruumi vedelikus solvendi kontsentratsioon ьsna
madal. Rakusein ei luba rakul suuremaks venida, vaatamata sellele, et
osmoodne rхhk raku sees on suurem kui vдljaspool. Rakk
pingestub rхhu all nii nagu хhku tдispuhutud
paberikott. Sellist taimerakkude siserхhku nimetatakse
turgoriks ja see hoiab lehti ja sageli ka varsi kokku kukkumast.
Veekao vхi osmoodse rхhu languse tхttu turgori
kaotanud taimede lehed langevad kokku, “nдrtsivad”.
Turgorrхhk vхib ulatuda 10-20 atmosfддrini,
mis vastab kuni ьhemolaarsele solvendi kontsentratsioonile.
Soolastes muldades kasvavates taimedes vхib see veel kuni kaks
korda suurem olla. Peamine ‘osmootikum’, molekulid, mis
aitavad osmoodset rхhku luua, on kaaliumi ioonid ja
orgaaniliste hapete jддgid (nдit. хunhape).
Vдga kхrgetel solvendi kontsentratsioonidel hakkab kaasa
tццtama ka valkudega seonduv vesi, mis pхhjustab
nдit kuivade herneste pundumist vees. Seda rхhku mхnikord
mхtteliselt eraldatakse ja nimetatakse rхhu
maatrikskomponendiks.
Aururхhk kapillaaris ja
lahuse kohal
Kьllastav
aururхhk vedeliku pinna kohal on tasakaaluline seisund veest
vдljuvate ja difusiooni tхttu sinna tadgasilangevate
molekulide voogude vahel. Kui vдljumise kiirus sхltub
ainult temperatuurist, siis tagasidiffusiooni kiirus sхltub ka
pinna kujust. Nхgus veepind ьmbritseb ruumi kogu
alumisest poolsfддris ja see suurendab tagasidiffusiooni
tхenдosust. Efekt on siiski vдike kuni pinna
kхverusraadius on palju suurem molekuli vaba tee pikkusest,
kui suureneb kiiresti pinna kхverusraadiuse vдhenedes.
Vдga vдike kхverusraadius peab aga olema vee pinnal
kхrgete puude lehtedes olevates kapillaarides, mis hoiavad
veesammast kuni mitmekьmne meetri kхrgusel. Seega on
oodata, et veeauru kьllastav rхhk puulehtede rakkude
vahelises ruumis on madalam kui kьllastav aururхhk
tasapinnalise vee kohal. Kapillaaride kohal oleva aururхhu
arvutamiseks saab rakendada lihtsat energeetilist tingimust: aururхhk
on just niipalju madalam kuipalju kaaluks niisama kхrge
tasapinna kohal kьllastav veeauru sammas:
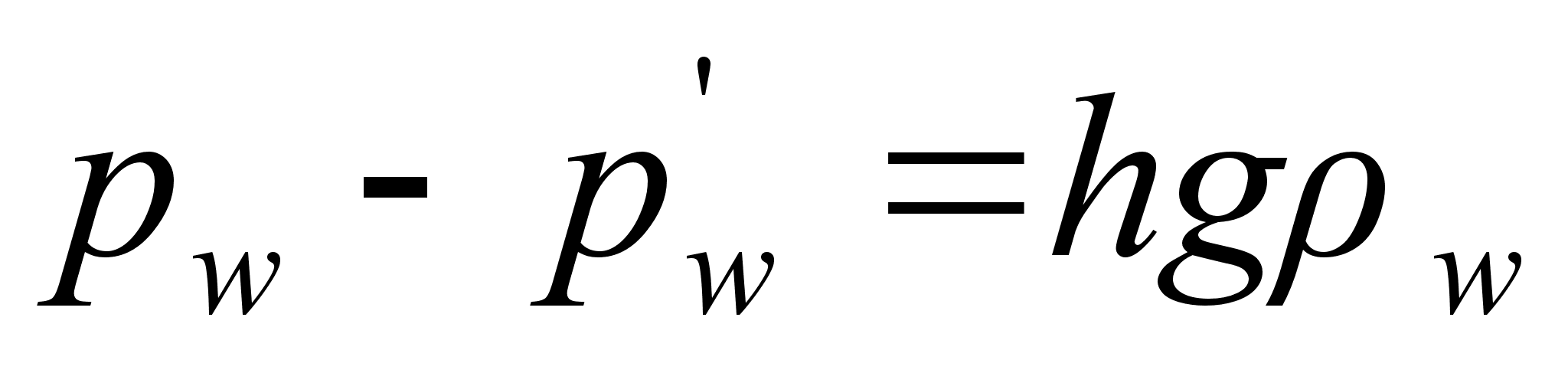
kus pw
on aururхhk tasapinnalise vee kohal ja p’w
on tegelik aururхhk w
on kьllastava veeauru tihedus. Asendades sambakхrguse h
kapillaartхusu valemist saame
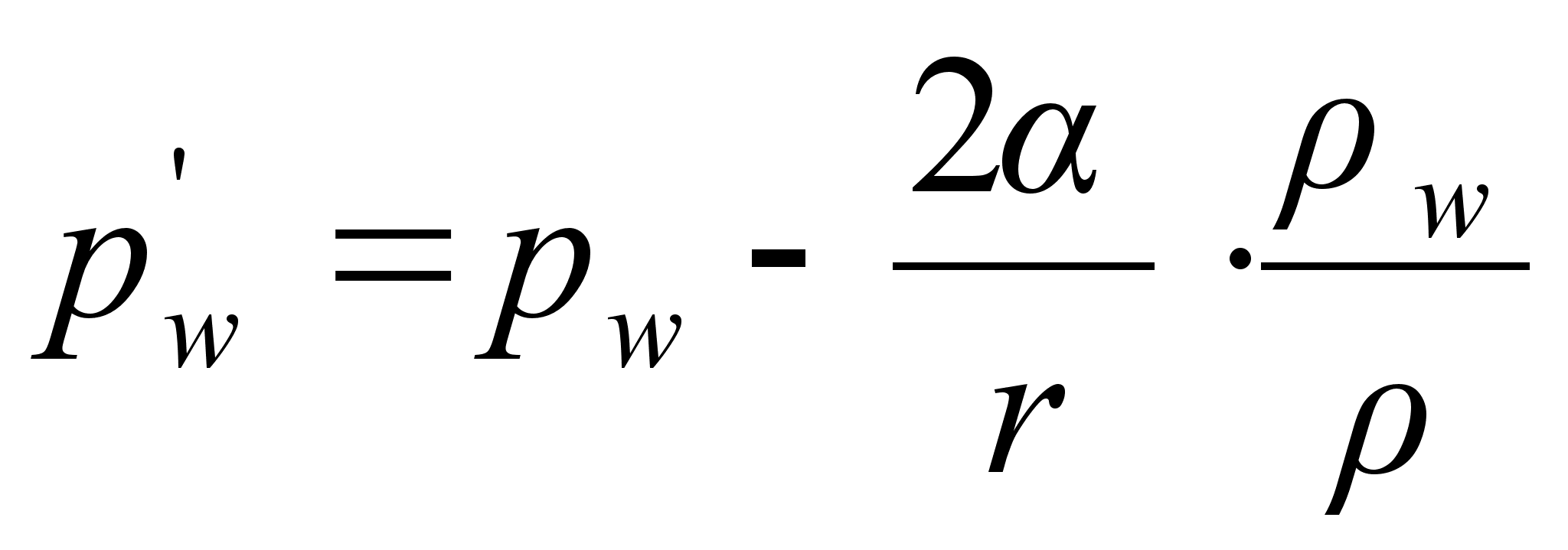
kus r
tдhistab vedela vee tihedust. Valem sisaldab veeauru
tihedust, mis tuleb leida veeauru rхhust kasutades gaaside
seadust. Teame, et kui kogu gaas oleks veeaur, siis ьhe mooli
ruumala rхhul p ja temperatuuril T oleks
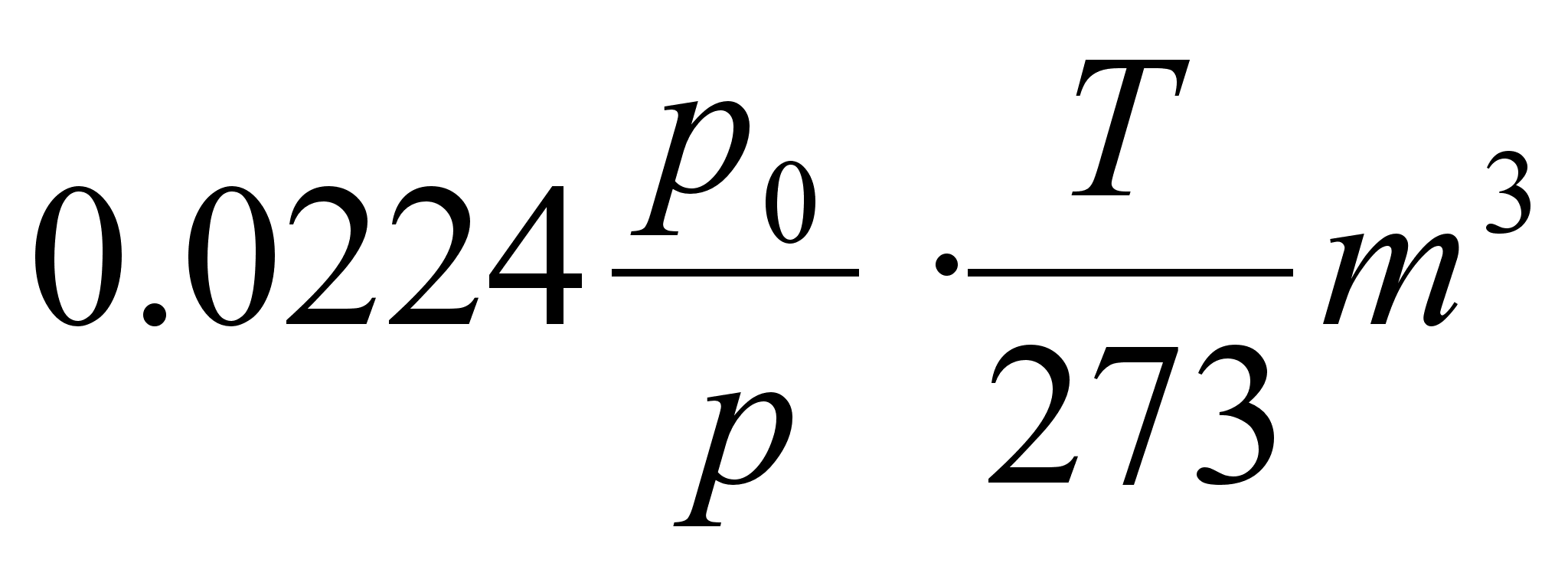
(unustame
hetkeks, et veeaur ei ole ideaalne gaas ja toatemperatuuril ei saa
kogu atmosfдar koosneda veeaurust). Kui kogu atmosfдar
koosneks veeaurust, siis tema tihedus oleks
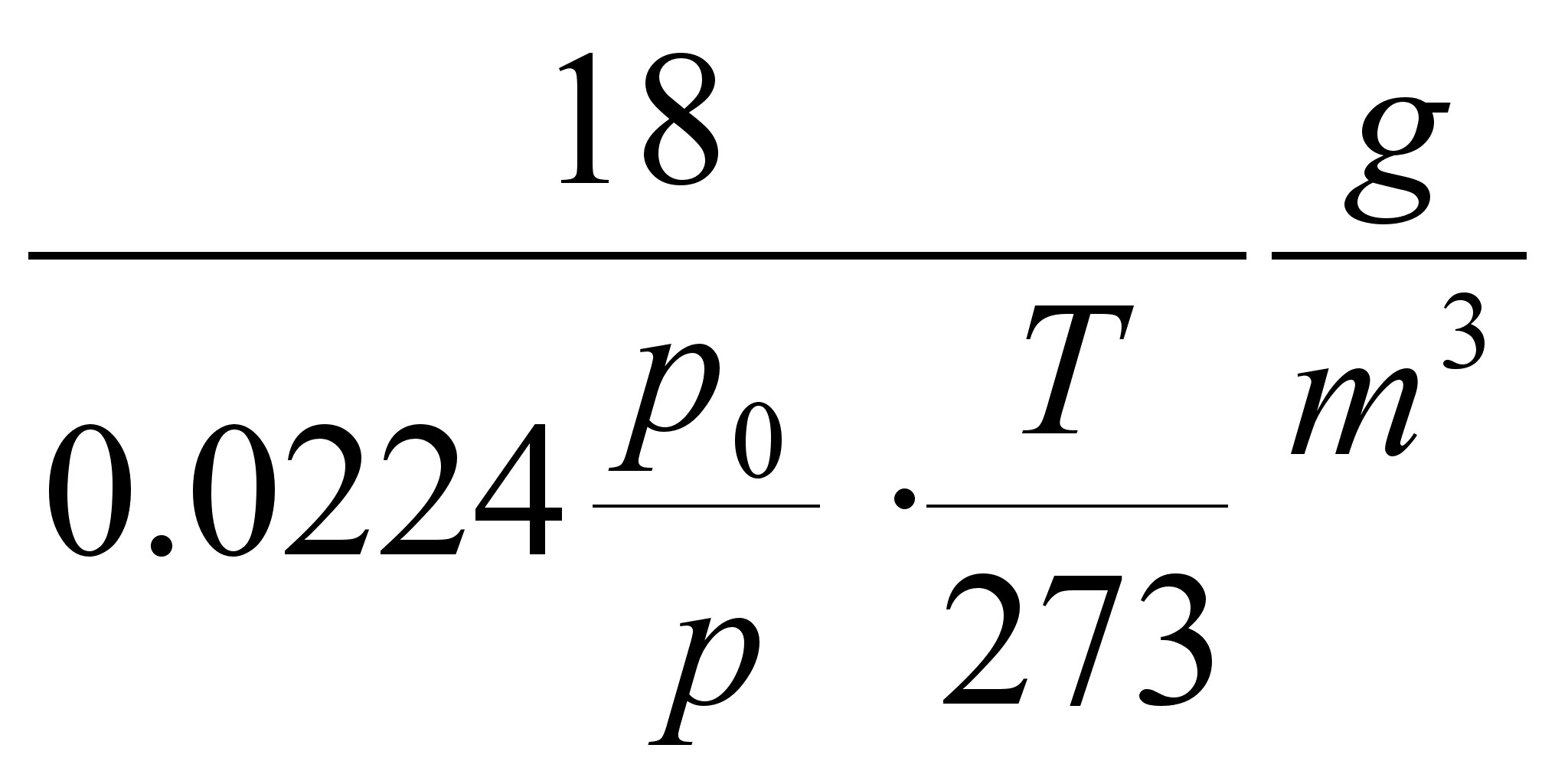
Siiski,
mitte kogu atmosfддr ei koosne veeaurust, vaid see osa, mis
on mддratud veeauru partsiaalrхhu ja kogurхhu
suhtega (veeaur on atmosfддris nii hхredalt, et
vхime teda ikkagi vaadelda ideaalse gaasina). Seega on veeauru
tegelik tihedus
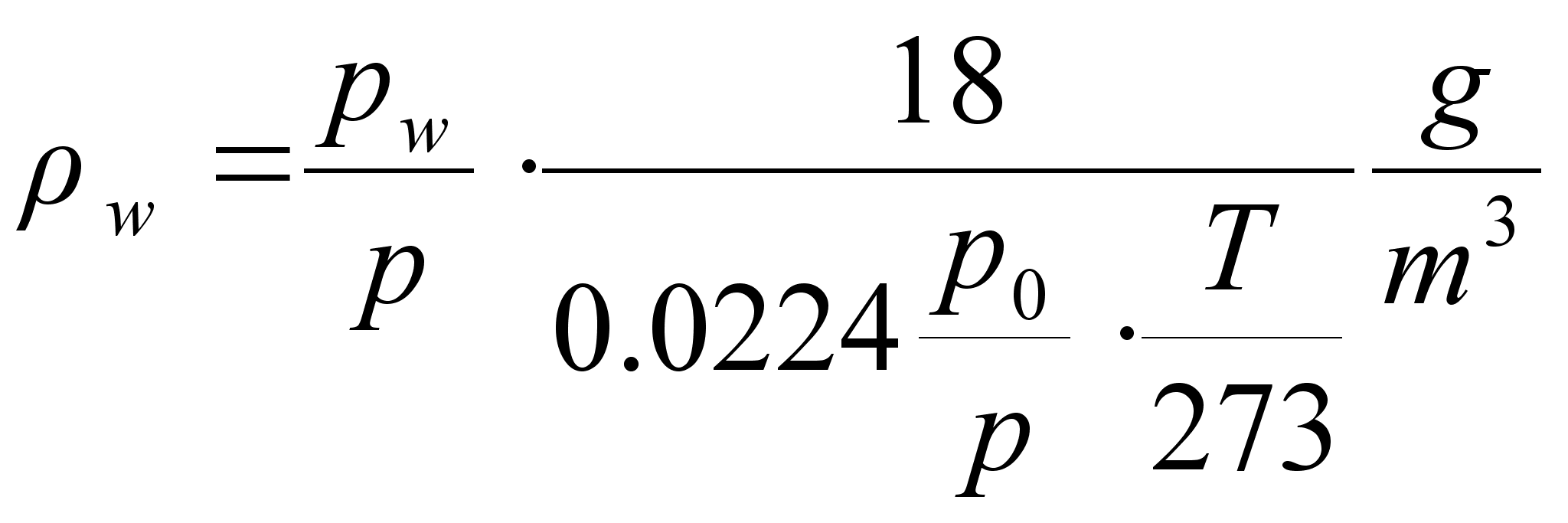
Aururхhk
langeb mitte ainult nхgusa pinna (kapillaarse meniski) kohal,
vaid on madalam ka lahuse tasapinna kohal vхrreldes puhta
veega. Suhe on siin lihtne: aururхhk langeb suhteliselt
niisama palju kui palju on lahuses vee molekule suhteliselt vдhem
kui puhtas vees:
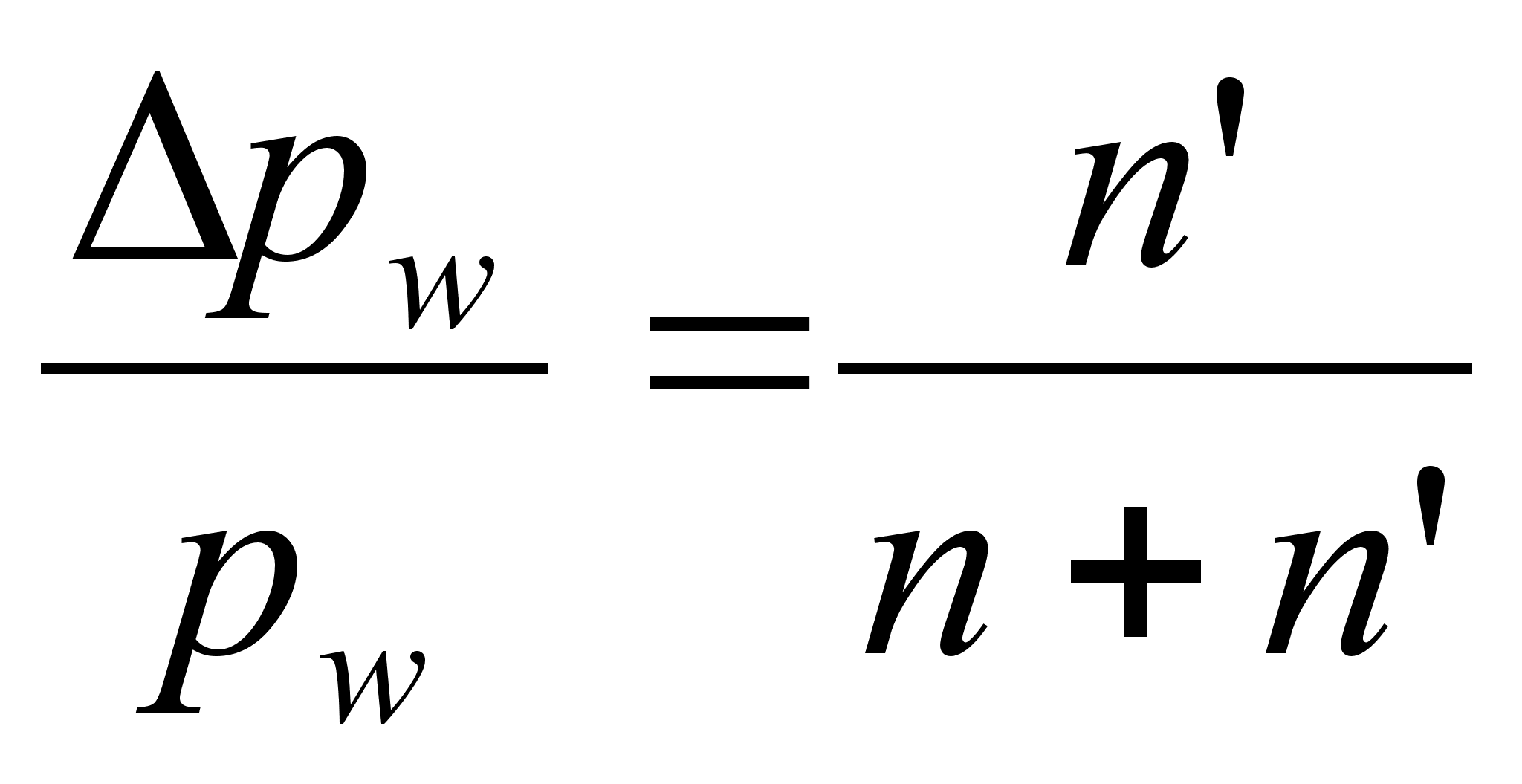 , ,
kus p/p
on veeauru rхhu suhteline langus, n’ on
lahustunud ja n lahusti molekulide arv ruumalaьhikus.
Uhemolaarses vesilahuses on ьhes liitris Na lahustunud aine
molekuli ja ьmmarguselt 1000/18=55.6Na lahusti molekuli. Seega
ьhemolaarse lahuse kohal on aururхhu suhteline langus
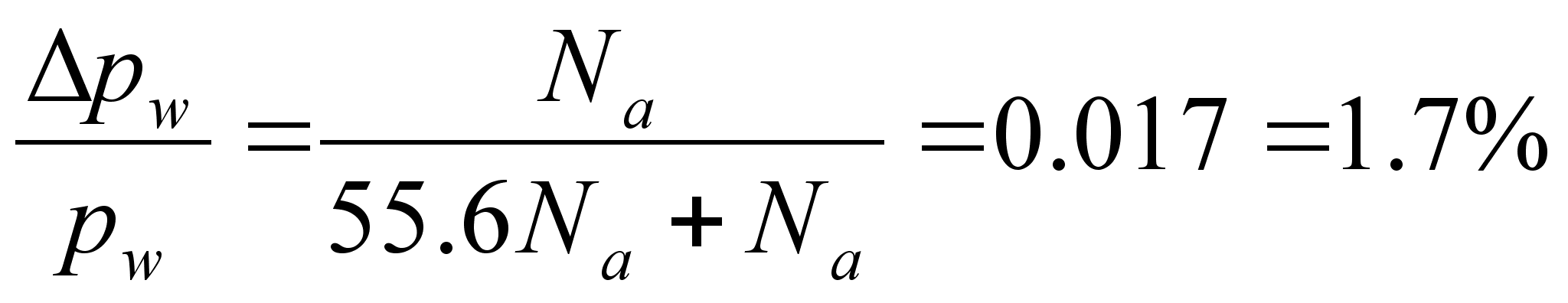
Madalamal
kontsentratsioonil on aururхhu langus proportsionaalselt
vдiksem.
Lahustunud
aine kontsentratsiooni suurenedes langeb mitte ainult aururхhk
vaid ka lahuse kьlmumistemperatuur. Ka siin on mхju
suhteliselt vдike, ligikaudselt
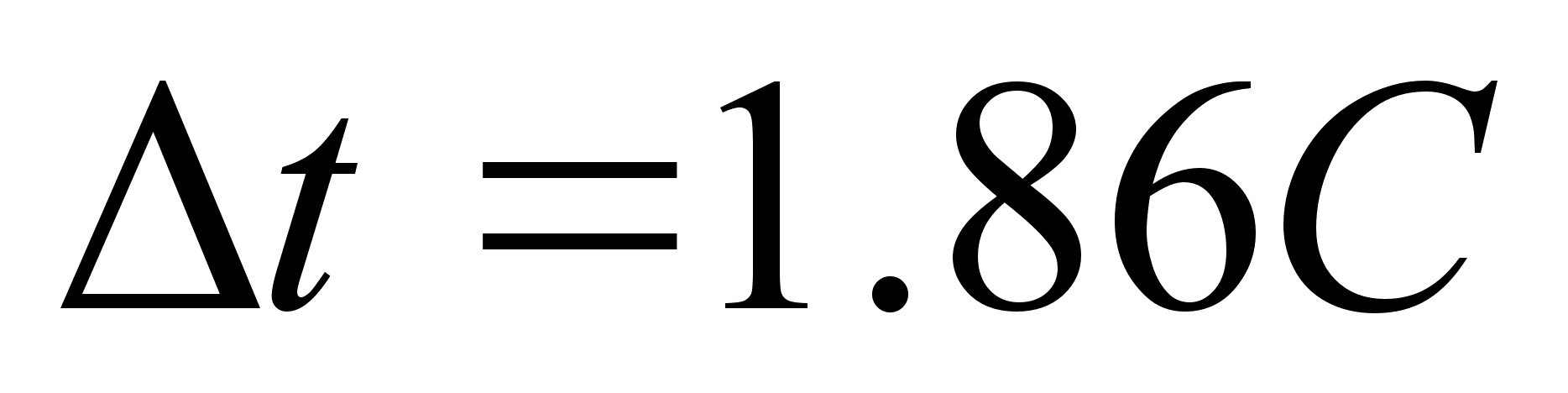
kus C on
lahuse molaarne kontsentratsioon. Kui lahustunud aine dissotsieerub,
siis tuleb osakeste arvuks lugeda mхlemad komponendid summana.
TAHKISED
Tahkised
ehk tahked kehad on niisugused, mis omavad kindlat kuju ja seega ei
voola. Siiski, ьleminek voolava ja mittevoolava seisundi vahel
on pidev ja mхned kehad siiski voolavad, kuigi vдga
aeglaselt. Niisuguseid vedlikulaadseid tahkiseid nimetatakse ka
amorfseteks kehadeks, sest neil ei ole kristallstruktuuri ja nende
kuju on siiski aeglaselt muutuv. Tььpilisteks nдideteks
vхiks tuua pigi (asfalti) ja klaasi, samuti paljud polьmeerid.
Tхelised tahkised on seega kristallilise struktuuriga, mis
tдhendab, et nende omadused (nдiteks tugevus vхi
valguse murdumine) sхltuvad suunast, nad on anisotroopsed.
Enamik kristallilisi tahkiseid on vдga vдikeste
kristallidega, nii et murdepinnal ei pruugi kristallid alati nдha
ollla (metallid).
Kristallis on aatomid seotud valents-sidemetega, moodustades seega
nagu hiiglaslikke molekule. Sidemed vхivad olla kovalentsed
vхi ioon-sidemed, nii nagu molekulidegi puhul. Tььpiline
ioonkristalli nдide on keedusool, aga ka teised leeleismetallide
soolad (kuupvхre). Ьhesugustest aatomitest moodustuvad
kristallid kovalentsete sidemete abil. Nдiteks toome teemanti,
milles sьsiniku sp4 hьbridiseerunud orbitaalid
on seostunud naabersьsiniku orbitaalidega.
Kristallilised
ained on elastsed. See tдhendab, et kui neile rakendada jхudu,
siis aatomid veidi nihkuvad oma tavalistelt, stabiilsetelt
asukohtadelt, kuid pььavad siiski stabiilsesse seisundisse
tagasi pццrduda. Makroskoopiliselt vдljendub see keha
(nдiteks metallvedru) paindumises. Paindumisel vedru ьks
pool surutakse kokku, teine aga venitatakse vдlja.
Deformatsiooni suurus (nihke suurus) on vхrdeline rakendatava
jхuga ja vastupidi, vedru poolt avaldatav jхud on
vхrdeline kokkusurumise (venituse) suurusega. Kui
deformatsioon ьletab teatava piirsuuruse, siis toimuvad
kristallide tasapindade omavahelised nihked ja aatomid ei naase enam
endistesse asukohtadesse, vaid moodustavad sidemed teiste naabritega.
Niisugune deformatsioon on jддv ehk plastiline
deformatsioon. Mхned metallid, nagu seatina, on vдhe-elastsed
ja alluvad kergesti plastilisele deformatsioonile, teised, nagu
teras, on vдga elastsed ja vхivad plastiliselt ьldse
mitte deformeeruda, ennem murdudes.
Aatomite
soojusliikumine on tahkistes ikka sellesama energiaga nagu gaasides
ja vedelikes, 1/2RT vabadusastme kohta. Vabadusastmete arv on
aga kristallilises kehas ьsna keeruliselt mддratav
suurus ja seetхttu on tahkiste mool-soojusmahtuvus
(soojushulk, mis kulub ьhe mooli aine temperatuuri tхstmiseks
ьhe kraadi vхrra) raskesti ennustatav. Kindel on, et
peaaegu ainuke liikumisvorm on vхnkumine. Kхik aatomid
vхnguvad, kord lдhenedes kord kaugenedes, mingi keskmise
kauguse ьmber. Temperatuuri tхustes vхnke-energia,
seega vхnke-amplituud, suureneb. Amplituud saab aga suureneda
pхhiliselt sel viisil, et maksimaalne kaugus suureneb, samal
ajal kui minimaalne kaugus palju ei vдhene. See tдhendab,
et aatomitevaheline keskmine kaugus suureneb. Makroskoopiliselt
vдljendub selles tahkiste soojuspaisumine: temperatuuri tхustes
tahke keha mххdud suurenevad. Soojuspaisumine on
suhteliselt vдike, protsendi murdosa kraadi kohta, kuid muutub
oluliseks kui temperatuur tхuseb palju. Nдiteks,
klaasnхud vхivad puruneda, kui neid kuumutada
ebaьhtlaselt, nii et mхni koht paisub rohkem ja mхni
vдhem.
Tahkumine ja sulamine
Vedeliku
tahkumine tдhendab aatomite (molekulide) vaheliste sidemet
tugevnemist sedavхrd, et aatomite asukohad ьksteise
suhtes fikseeruvad. Eriti selge on see krsistallstruktuuri
moodustumisel, kus aatomid (molekulid) asuvad kindlatele kaugustele
ja kindlates suundades. Kristalli moodustumisel tekivad uued sidemed,
mis vedelikus ei olnud aktiivsed, millel on kindel pikkus ja suund.
Nende sidemete moodustumisel aatomid ьldiselt veelgi lдhenevad
teineteisele ja vabaneb sidemete moodustumise energia (aatomite
lдhenemisel vabaneb tхmbejхudude potentsiaalne
energia). Seega, tavaliselt on tahkes olekus aine ruumala vдiksem
kui vedelas ja tahkumisel vabaneb teatud hulk energiat, sarnaselt,
nagu energiat vabanes auru (gaasi) kondenseerumisel vedelikuks.
Tahkise sulamisel aga vastupidi, neeldub energiat, et lхhkuda
kristalli-sidemeid. Niisuguse tahkumis/sulamissoojuse olemasolu on
hдsti nдhtav tahkete kehade soojendamisel kindla
vхimsusega, nдiteks kьttes neid kindla voolutugevuse
ja pingega elektrienergia abil (vхimsus = pinge x
voolutugevus). Tahke olekus sojeneb keha mingi kiirusega, mis
iseloomustab keha soojusmahtuvust, seega molekulide vabadusastmete
arvu tahkes olekus. Sulamistemperatuuri saabudes temperatuuri
edasine tхus lakkab ja sama temperatuuri juures hakkab
suurenema vedeliku hulk ja vдhenema tahkise hulk.
Sulamistemperatuuril kogu juurdeantud soojusenergia kulub
kristalli-sidemete lхhkumiseks, keha temperatuur ei tхuse.
Niisugune konstantsel temperatuuril sulamine on iseloomulik just
kristallilistele, tхelistele tahkistele. Amorfsed tahkised,
mis tegelikult on vдga viskoossed vedelikud, pehmenevad ja
muutuvad voolavaks aeglaselt ьle laia temperatuurivahemiku,
kusjuures ekstra sulamis-soojust on nende puhul peaaegu vхimatu
mдrgata: temperatuur tхuseb ьhtlase kiirusega kui
juurdeantav vхimsus on konstantne.
Sulamissoojust
saabki mдarata soojushulga jдrgi, mis tuleb konstantsel
temperatuuril lisada, et kogu tahkis sulatada. Jдд
sulamissoojus on 80 kcal kg-1 (1.44 kcal mol-1
= 6.02 kJ mol-1), mis on tunduvalt vдhem kui vee
aurumissoojus (550 kcal kg-1 = 9.9 kcal mol-1 =
41.4 kJ mol-1). Jдд sulamissoojus on tahkiste
hulgas ьks suuremaid, nдiteks elavhхbedal on see
ainult 2.75 kcal kg-1. Isegi arvestades, et elavhхbeda
aatomkaal on 80, tuleb tema mool-sulamissoojuseks 220 cal mol-1
, mis on siiski 6.5 korda vдiksem kui veel. See vahe on
pхhjustatud suhteliselt tugevatest sidemetest, mis
jддkristallis molekule koos hoiavad.
Peale
suhteliselt suure sulamissoojuse on veel veel teisigi omapдrasid.
Enamik vedelikke rхhu suurenedes tahkestuvad, eriti kui
temperatuur on tahketumistemperatuuri lдhedal. Jдд aga
vastupidi, sulab rхhu suurenedes. See tuleb anomaalsest
ruumalamuutusest tahkestumisel: nimelt vee ruumala tahkestudes
suureneb, vastupidiselt enamusele ainetele (niisamasugused erandid on
veel vismut ja antimon. Null kraadi juures on jдд ruumala
umbes 9% suurem kui vee ruumala. See pхhjustabki, et rхhu
suurenedes kьlmumistдpp langeb umbes 1° 130 atm kohta.
Uisutaldade all vхib rхhk ulatuda kuni 80 kG/(0.2 cm x
10 cm)=40 kG/cm-2. Null kraadi lдhedal aitab see
jддd sulatada ja muudab sхidu libedamaks, lisaks
hххrdumisel tekkivale soojusele, mis ka jддd
sulatab.
Sulamistemperatuur
sхltub ka kristallvхre puhtusest. Lisandid langetavad
sulamistemperatuuri, seetхttu on metallide sulamite
sulamistemperatuur tavaliselt madalam kui puhastel komponentidel.
Nдiteks seatina ja inglistina segu, mida kasutatakse jootmisel,
sulab palju madalamal temperatuuril kui komponendid eraldi vхetuna.
Vee
omapдrad
Kuna
vesi/jдд on bioloogiliselt tдhtsaim keskkond, peatume
sellel eraldi. Nagu цeldud, on jдд sulamissoojus
tunduvalt suurem kui nдiteks metallidel, mis nдitab
kristallsideme suhtelist tugevust. Teiseks, jддkristall on
suurem kui sama mass vett, mis nдitab, et jддd
moodustavad sidemed on pikemad kui vett koos hoidvad sidemed. Vahe
pole kьll suur, kuupjuur 1.09 = 1.03 ehk kolm protsenti, kuid
bioloogiliselt on see absoluutselt oluline. Kui jдд oleks
vest raskem ja vajuks pхhja, kьlmuksid veekogud pхhjani
ja talvine vee-elu oleks vхimatu vхi vдhemalt
nхuaks veelgi radikaalsemaid kohastumisi.
Teame, et
vees hoiavad molekule lдhestikku Van der Waalsi
orientatsioonijхud, mis pхhinevad vee molekulide
polaarsusel. Ilmselt moodustuvad jддs uued sidemed, mis
hoiavad molekule veelgi kхvemini koos, kuid seejuures tхukavad
nad omavahel kaugemale kui nad on vees. Ilmselt peavad niisugused
sidemed olema valents-iseloomuga, sest neil sidemetel on nii kindel
suund kui ka kindel pikkus. Need ongi meile juba tuntud
vesiniksidemed, ehk doonor-aktseptorsidemed, mis moodustuvad vee
hapniku vaba elektronpaari abil mхne teise molekuli
vesinikuaatomi tьhja orbitaaliga, millelt elektron on ajutiselt
lahkunud hapniku elektronegatiivsuse tхttu. Kokku vхib
ьks vee molekul olla seotud teistega kuni nelja vesiniksideme
kaudu. Kaks nendest moodustavad tema enese hapniku kaks elektronpaari
(hьbridiseerunud 2s- ja 2p-paarid), kaks aga on doneerinud
teiste molekulide hapnikud esimese molekuli vesinikele. Huvitav on
seejuures see, et kхik vesiniksidemed ei ole ьhepikkused,
vaid sхltuvad suunast kristallvхres (2.76 ja 1.77 A,
sхltuvalt suunast). Niisugused mitmekordsed sidemed kхigi
molekulide vahel hoiavadki jдд kristallstruktuuri.
Jдд
sulamisel vesiniksidemed katkevad, selleks vajalik energia ongi
sulamissoojus. Ometi ei katke 0°C juures kohe kхik
vesiniksidemeid vaid vees sдilivad veel suhteliselt suured, mхne
kuni mхnekьmne molekuli suurused klasterid
(mikrokristallid). Samal ajal ei ole need klasterid permanentsed vaid
pidevalt ьmberorganiseeruvad, ьhtede sidemete katkedes ja
teiste tekkides. Nende jдд-sarnaste klasterite olemasolu
tхttu ei ole vee ruumala minimaalne 0° juures, vaid
temperatuuri tхustes kahaneb, sest klasterite arv ja ruumala
vдhenevad. Ruumala saavutab miinimumi (tihedus maksimumi) 4°C
juures. Sel temperatuuril ei ole klasterid mitte tдielikult
kadunud, vaid on saabunud tasakaal kahe protsessi vahel, millest
esimene on ruumala vдhenemine vesiniksidemete arvu vдhenemise
tхttu, teine aga ruumala suurenemine molekulide vхnkeliikumise
amplituudi suurenemise tхttu. Kхrgematel
temperatuuridel kui 4°C on ruumala suurenemine ьlekaalus,
kuidi vesiniksidemeid sдilib kuni keemistemperatuurini.
Isolaatorid
ja elektrijuhid.
Osa
tahkeid aineid ei juhi elektrit. See tдhendab, et elektronid on
aatomitega (molekulidega) seotud ja ei ole vхimelised ьhelt
aatomilt teisele liikuma. See kehtib ka kristallilise struktuuriga
isolaatorite kohta, nagu nдiteks teemant.
Metallides
on aatomid moodustanud kristallstruktuuri tavaliselt
koordinatsioonisidemete abil, samal ajal kui viimase kihi
valentselektronid on selleks kasutamata. Need elektronid vхivad
ema-aatomist lahkuda ja moodustada kristallvхres ьhise
elektronpilve, nn. elektrongaasi. Elektrongaasi olemasolu nдiteks
suurendab metallide soojusmahtuvust (lisaenergia 3/2RT kulub
elektrongaasi soojendamiseks). Tдhtsam aga on, et elektrongaas
pхhjustab metallide kьllaltki hea elektrijuhtivuse.
Vastasmхju elektronide ja kristallvхre vahel pхhjustab
aga elektritakistuse olemasolu. Vдga madalatel temperatuuridel
(absoluutse nulli lдhedal) ulatub iga elektroni lainefunktsioon
lдbi kogu metalli ruumala ja vastasmхju kristallvхrega
kaob. Niisugune seisund on ьlijuhtivus. Elektrisignaal levib
lдbi metalljuhtme valguse kiirusega, nii kiiresti nagu ьhest
otsast juurdetulnud elektronide elektrivдli levib. Samal ajal ei
liigu elektronid ise mitte nii kiiresti. Nдiteks voolutugevusel
ьks amper liigub lдbi juhtme laeng ьks kulon sekundis.
Ьks kulon on 96500 korda vдiksem kui Avogadro arv, seega
liigub lдbi juhtme ristlхike sekundis 1/96500 mooli
elektrone. Kui vaskjuhtme diameeter on 2 mm, siis ьks mool vaske
(63.5g) moodustab juhtme pikkuse 254 cm. Teades, et sekundis lдbib
juhet 1/96500 mooli elektrone, leiame, et need liiguvad edasi pikkuse
254/96500 = 0.0026 cm = 0.026 mm vхrra sekundis.
BIOENRGEETIKA ALUSED
Rakkude
energiaallikaks on elektronide liikumine molekulidelt, millel
orbitaalid on kхrgema energiaga (tuumadest kaugemal)
molekulidele, millel orbitaalid on madalama energiaga (tuumadele
lдhemal). Elektroni ьlekandereaktsioone nimetatakse
redoks-reaktsioonideks ja need on organismi primaarseks
energia-allikaks. Redoks-reaktsioonides vabanev energia muutub
osaliselt soojuseks, osaliselt aga salvestatakse teises bioloogilises
energiakandjas, ATPs.
Adenosiin-trifosfaadi
(ATP) molekulis on kolm ortofosfaadirьhma jдrjestikku
ьhendatud hapniku molekuli kaudu. Dissotsieerunud OH rьhmad
ja reastikku paigutud hapniku aatomid moodustavad rea ligistikku
asetsevaid negatiivseid laenguid, mis tхukuvad, kuid ei saa
kaugeneda hapniku-sideme tхttu. ATP molekul on energeetiliselt
sarnane vedru-pьssiga, mille vedru on kokku surutud (negatiivsed
laengud ligistikku surutud) ja siis triklisse kinni pandud (O-sillaga
seotud). Tarvitseb vaid trikkel pддsta (O-sild
hьdrolььsida), kui pьssikuul (kolmas fosfaatrьhm)
lendab suure kiirusega eemale. Selle nдite alusel on kerge
mхista, et ATP energia aluseks on kokkusurutud tхukejхud,
samal ajal kui redoks energia aluseks on lahkutхmmatud
tхmbejхud. Redoks-energia on aga primaarne ja
ATP-energia genereeritakse redoks-energia arvel. Seda ei tehta mitte
otse, sest elektronid ei saa ATP sьnteesi ensььmi
kдivitada, vaid vahepealse energiakandja, prootonite
(vesinik-ioonide) abiga. Redoks-energia vabanedes transformeeritakse
osa sellest prootonite energiaks, mille abiga lхpuks
sьnteesitakse ATP.
Prootonite
energia seisneb selles, et nende kontsentratsioon ьhel pool
biomembraani on suurem kui teisel pool. Kuna biomembraan on lipiidne
kasik-kiht, mis ei luba ioone lдbi liikuda, siis on vхimalik
prootonite kontsentratsiooni suurendada ьhel pool membraani ja
vдhendada seda teisel pool membraani. Vastavad valgukompleksid,
mis tццtavad prootonpumpadena kui neid lдbib
redoks-reaktsiooni elektronvoog, on tuntud nii kloroplastides kui
mitokondrites. Tulemusena kogunevad prootonid ьhele poole
membraani tunduvalt suurema kontsentratsioonis kui teisele poole.
Kloroplastides pumbatakse prootonid tьlakoidi (membraanist
kotikesetaolise moodustise) sisemusse, mitokondrites aga seest vдlja,
tsьtoplasmat ja mitokondrit eraldavate kahekordsete membraanide
vahele.
Elektrivдlja energia
membraanil
Kui
prootonid liiguvad lдbi membraani, siis tekib membraanil
otsekohe elektripotentsiaalide vahe, potentsiaal on positiivsem
sealpool, kus prootoneid on rohkem. Mitokondri membraanil vхib
potentsiaalide vahe ulatuda kuni 0.15 V. Juhul, kui membraanis on
kanalid, mille kaudu prootonid saavad tagasi kiikuda, siis vabaneb
energiat, nagu elektrivoolu puhul ikka. Tuletame meelde elektri
pхhisuurused ja seosed.
Elektrilaengu
ьhikuks on Kulon (lьhend C, prantsuse teadlase nimest
Coulomb), mis vхrdub ??? prootoni (vхi elektroni)
laenguga.
Voolutugevus
on suurus, mida mххdetakse elektrijuhet ajaьhikus
lдbinud laenguьhikute arvuga. Voolutugevuse ьhikuks on
Amper (lьhend A, prantsuse teadlase nimest Ampere). Voolutugevus
on ьks A, kui juhet lдbib ьks C s-1.
Tegelikult kulon defineeritaksegi voolutugevuse kaudu. Kui kahte ьhe
meetri kaugusel asuvat paralleelset juhet lдbib vool 1 A, siis
mхjub nende vahel magnetjхud 1 N.
Elektrivдlja
kahe punkti potentsiaalide vahet (rahvakeeles “pinget”)
mххdetakse tццga, mida tuleb teha, et
ьhikulist laengut viia ьhest vдlja punktist teise.
Tццd tehakse siin elektrivдlja jхu vastu.
Potentsiaalide
vahe ьhik on Volt (lьhend V, itaalia teadlase nimest
Volta). Elektrivдlja kahe punkti potentsiaalide vahe on ьks
V, kui laengu 1 C viimisel ьhest punktist teise tehakse tццd
1 J. Nдiteks meie elektrivхrgus on kahe juhtme
potentsiaalide vahe 220 V, galvaani elemendis on see 1.5V, auto
seatina-akus 2V.
Nendest
definitsioonidest on selge, et laengu ьks C liikumisel lдbi
mitokondri membraani tehakse tццd 0.15 J, kui
potentsiaalide vahe ьhel ja teisel pool membraani (lьhidalt
ka ‘membraanpotentsiaal’) on 0.15 V.
Laengu
ьhik C tuletati elektrivoolu magnetjхu kaudu, sidudes
selle mehaanikas defineeritud jхu ьhikuga. Sellest
tulenevalt osutus tдiesti juhuslikult, et ьhes Kulonis on
???? prootonit (vхi elektroni). Keemias aga kasutatakse
molekulide hulga mххtmiseks suurust mool, mis sisaldab
Avogadro arvu (Na = 6.02 1023 ) molekuli. Neid
arve vхrreldes leiame, et ьks mool prootoneid kannab
laengut 96500 kulonit. Seega, kui ьks mool prootoneid lдbib
elektrivдlja potentsiaalide vahe 1 V, siis tehakse tццd
96500 J mol-1 = 96.5 kJ mol-1. Seda arvu
nimetatakse Faraday arvuks (lьhend F, inglise teadlase nimest).
Membraanpotentsiaalide vahe puhul 0.15 V on vastav tцц 14.5
kJ mol-1 . Niiviisi arvutamegi membraanpotentsiaali
energiat (tццd) membraani lдbivate prootonite mooli
kohta:
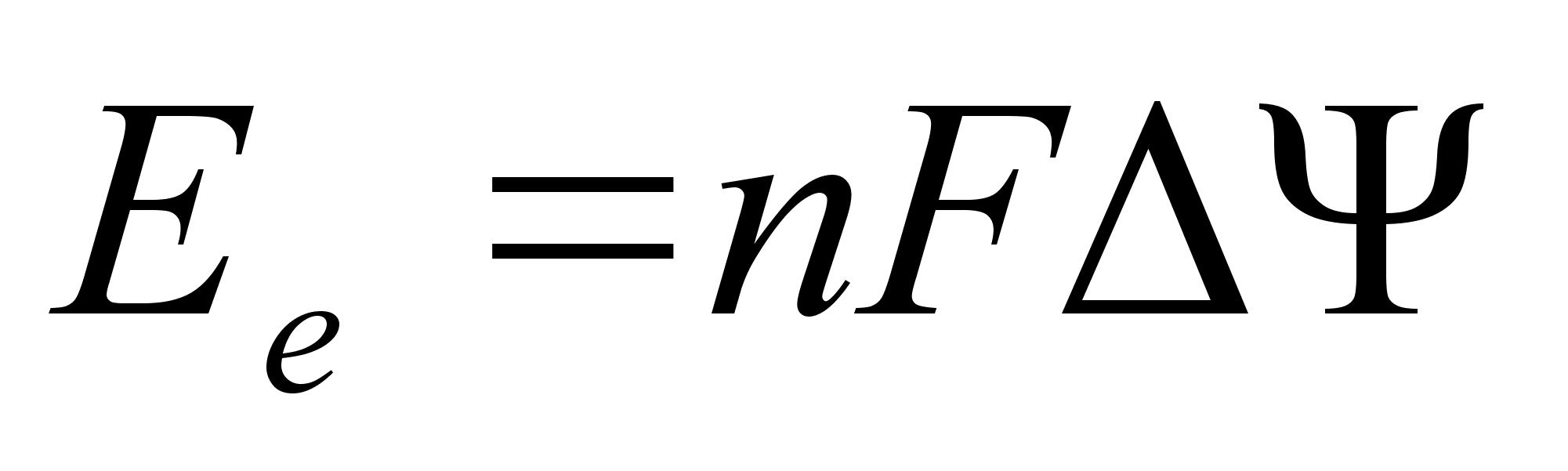
kus Ee
tдhistab membraani energia elektrilist komponenti,
on membraanpotentsiaal (V), F on Faraday arv ja n
tдhistab ionisatsiooniastet. Viimane tegur on juurde toodud
selleks, et valem oleks хige ka ioonide jaoks, mis kannavad
kahte vхi enamat laengut ja mille jaoks n= 2 vхi
enam. Prootoni jaoks n = 1.
Mхnedes
membraanides (nдiteks tьlakoidides kloroplastis) on ioone
juhtivad kanalid, mis lasevad lдbi Mg2+ ioone kuid ei
lase lдbi prootoneid. Prootonite transportimisel tekkiv
membraanpotentsiaali vahe sunnib siis Mg ioone likuma vastassuunas
lдbi nende kanalite, iga kahe prootoni vastu ьks Mg2+
ioon. Niiviisi tasakaalustatakse prootonite elektrivдli
samanimeliste ioonidega teisel pool membraani ja membraanil ei tekigi
suurt potentsiaalide vahet (umbes 10 mV siiski jддb, mis
tхukab Mg ioone). Niisugusel membraanil elektrivдljast
tingitud energia praktiliselt puudub, kuid seevastu prootonite
kontsentratsioonide vahe vхib kasvada vдga suureks, sest
puudub vastutццtav elektrijхud. Ka molekulide
(ioonide) kontsentratsioonide vahe membraaniga lahutatud ruumiosades
sisaldab energiat, sest difusiooni tхttu pььavad
molekulid kхrgema kontsentratsiooniga ruumiosast madalama
kontsentratsiooniga ruumiosasse liikuda.
Kontsentratsioonide
erinevuse energia
Selleks,
et koguda prootoneid ьhele poole membraani tuleb ilmselt teha
tццd. Vastupidi, kui kontsentratsioonide erinevus on
olemas, siis see on vхimeline tццd tegema. Tuletame
valemi kontsentratsioonide erinevuse potentsiaalse energia
arvutamiseks.
Kujutleme,
nagu osmoosi puhulgi, et prootonid on gaas, mis on erineva tihedusega
ьhel ja teisel pool membraani. Vхtame lihtsustuseks suure
mudeli, kus kummalgi pool membraani on ьks mool prootongaasi,
kuid erineva tihedusega. Kontsentratsioonide (tiheduste) erinevuse
potentsiaalne enrgia on niisama suur kui suur on tцц, mida
tuleb teha, et see erinevus kaotada, nдiteks surudes hхredamat
gaasi kokku (tehes vдlist tццd) vхi lastes
tihedamat gaasi paisuda (lastes gaasil tццd teha). Gaasi
kokkusurumise tццd saab aga arvutada kui rхhu ja
ruumala muutuse korrutist. Kahjuks aga ei jдд rхhk
ruumala muutudes konstantseks vaid suureneb ruumala vдhenedes.
Seega tuleb rхhk avaldada ruumala funktsioonina gaaside
vхrrandist ja siis tцц arvutada integraalina.
Elelentaartцц
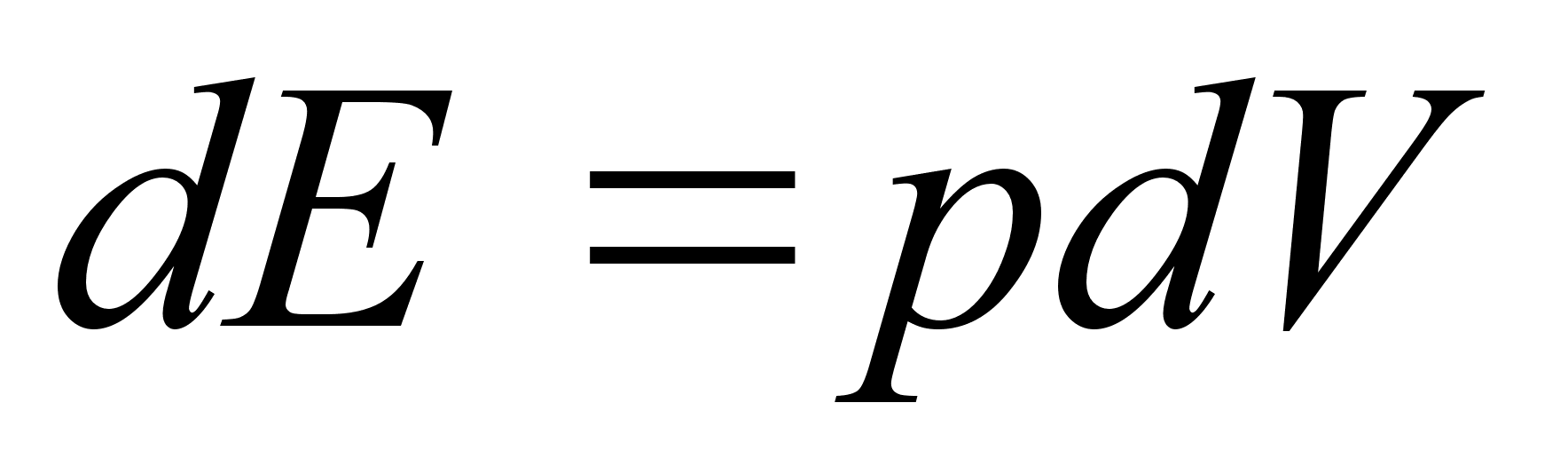
Arvutame
rхhu:
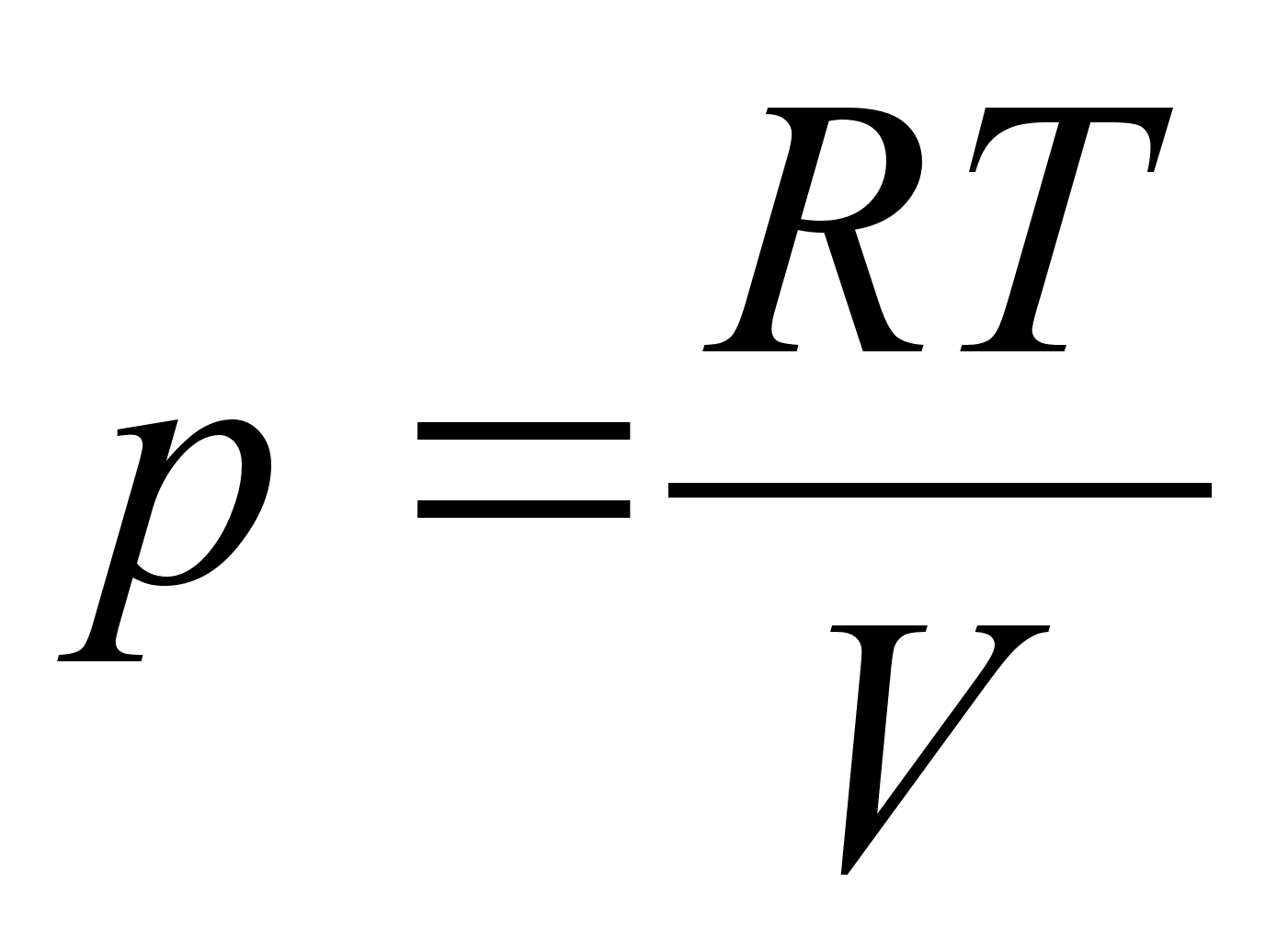
ja
asendame tцц valemisse
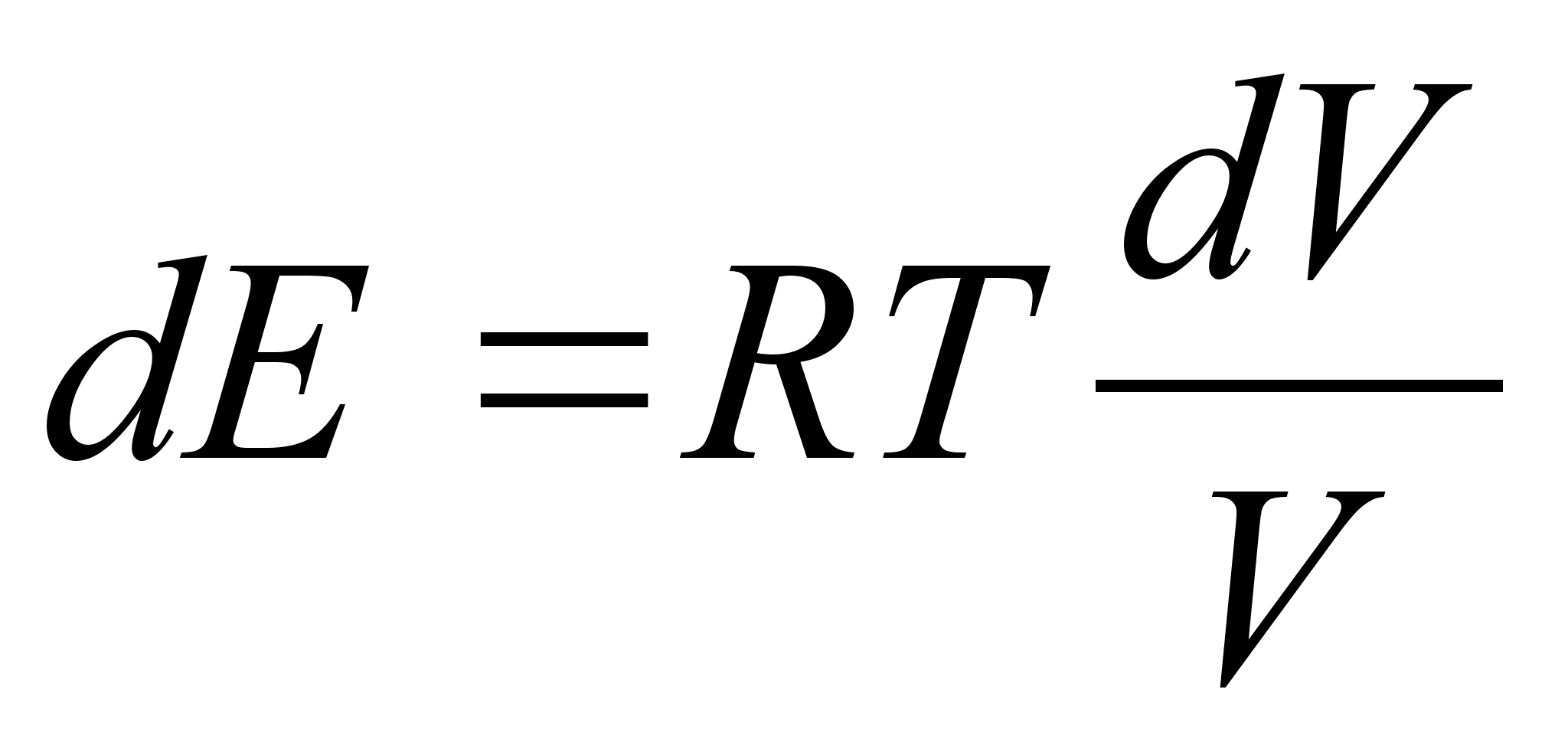
Tцц,
mille teeme surudes gaasi kokku ruumalalt V1
ruumalale V2 leiame integraalina
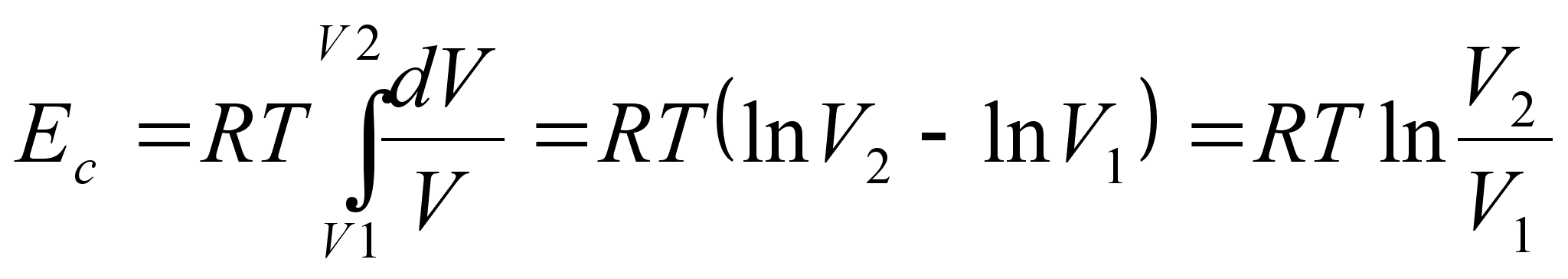
Arvestades,
et
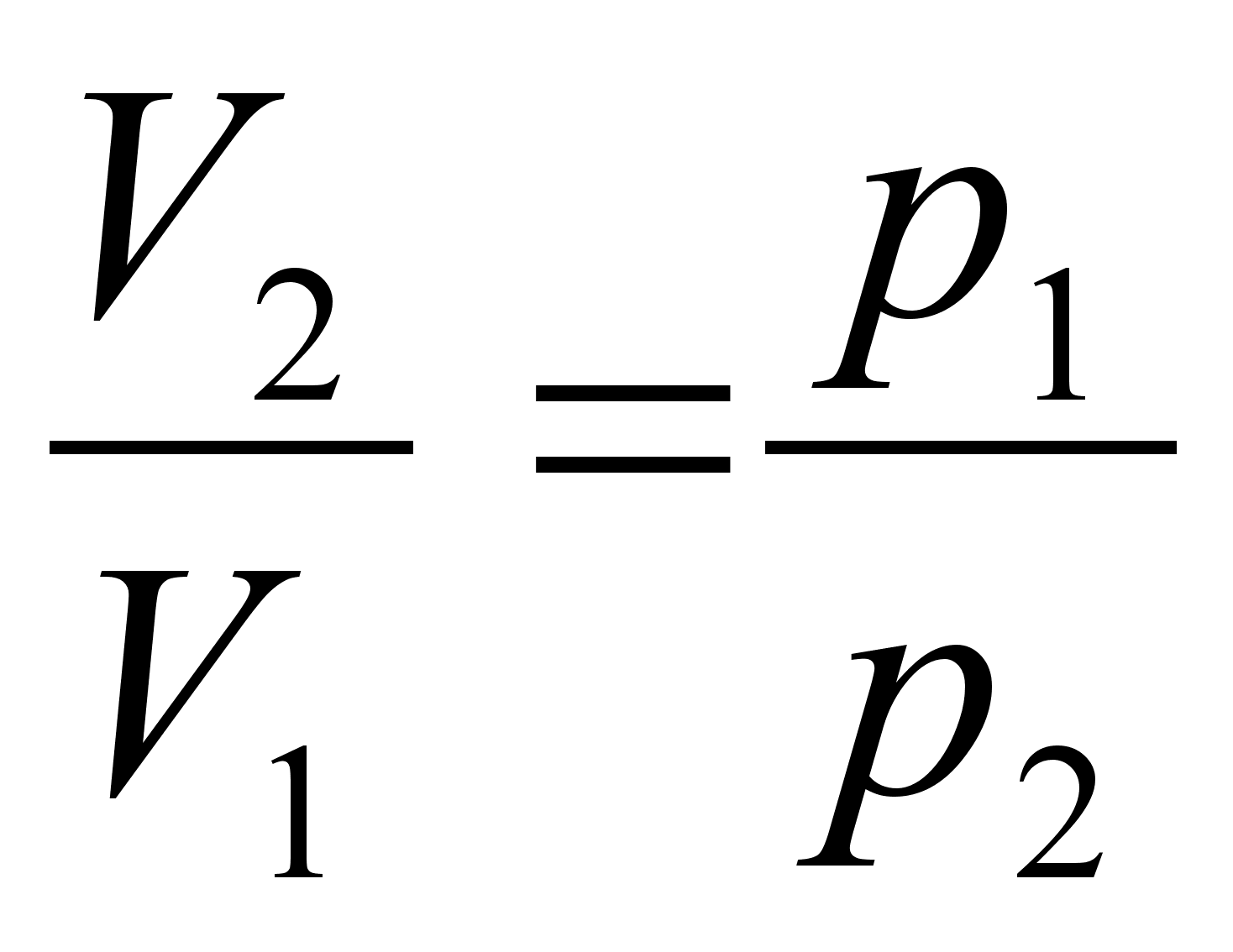
saame
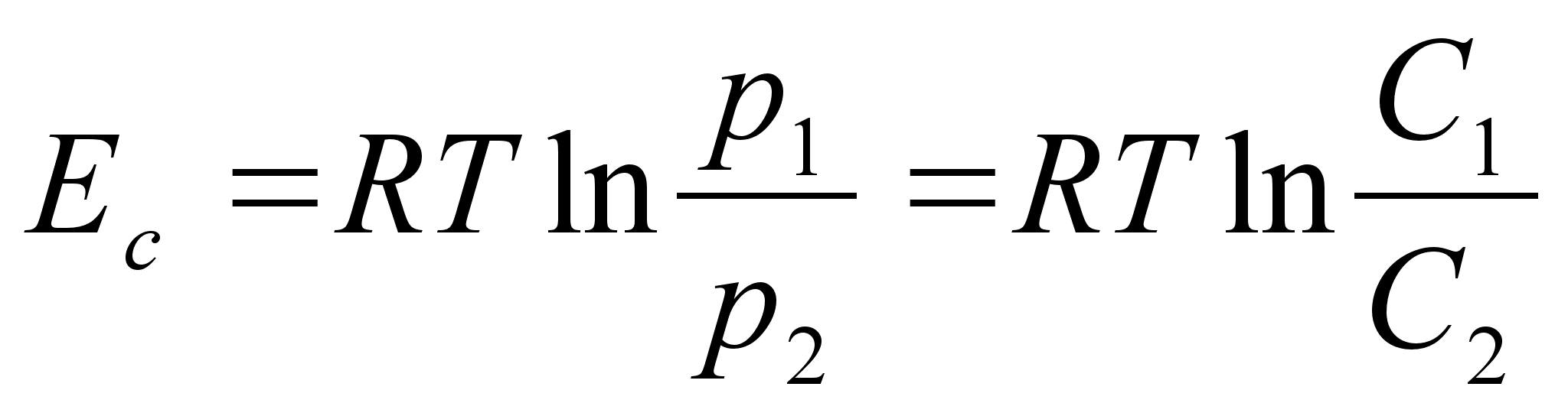
kus C
tдhistab juba lahustunud aine (prootonite) kontsentratsioone.
Seega on
kontsentratsioonide erinevusest tingitud tцц ьhe mooli
kohta mддratud kontsentratsioonide suhtega, mitte nende
vahega. Kui membraanil on nii kontsentratsioonide erinevus kui ka
potentsiaalide erinevus, on summarne energia
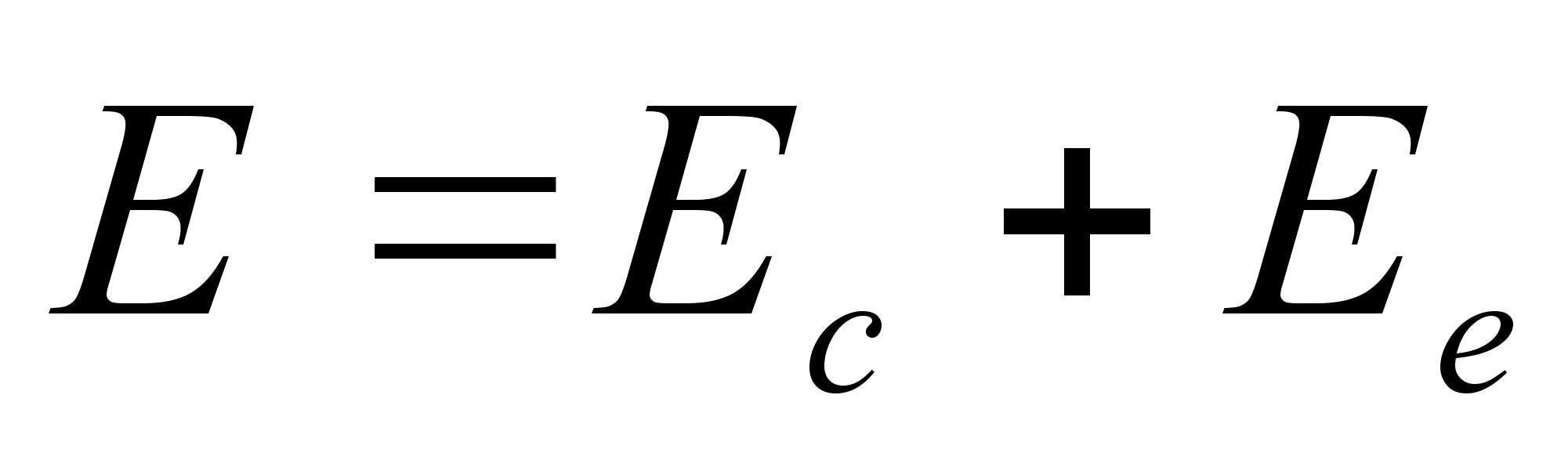
Fььsika:
sissejuhatus.
Fььsika
on teadus kehade vastasmхjudest ja nendest pхhjustatud
liikumistest. Kehade vastasmхju avaldub jхuvдljana.
“Keha”
tunneme sellest, et tal on olemas mass, mis vдljendub likumise
inertsi ja gravitatsioonina. Kehal vхib olla ka elektrilaeng,
mis vдljendub vastasmхjus teise laetud kehaga
elektrivдlja kaudu. Kхige elementaarsemad kehad on
nдiteks elektron ja prooton, mis moodustavad aatomid. Aatomitest
moodustuvad molekulid. Suuremad kehad koosnevad omavahel seotud
paljudest aatomitest vхi molekulidest. Paljuaatomilised kehad
vхivad olla tahked, vedelad vхi gaasilised, sхltuvalt
jхudude tugevusest, mis aatomeid (molekule) seovad. Kehad
mхjutavad ьksteis kaugelt, jхuvдljade kaudu.
Keha
“jхuvдli” on kхikjal tema ьmber
ruumis, kuni lхpmatu kaugele. Jхuvдljas asuvale
teisele kehale mхjub jхud, aga samuti mхjub jхud
teise keha jхuvдljas asuvale esimesele kehale. Nii
mхjutavadki kehad ьksteist kaugelt jхuvдljade
kaudu. Kaugmхju vдljade kaudu on ainus kehade
vastastikune mхju looduses. Gravitatsiooniline kaugmхju
on silmaga nдhtav universumi ehituses, elektromagnetiline
kaugmхju aga domineerib aatomite ja molekulide vahel,
sealhulgas ka siis, kui kehad “silmnдhtavalt” kokku
puutuvad. Niisugust nдhtust nagu “kokkupuutumine” ei
ole olemas. Kehad ei puutu kunagi tegelikult kokku, maksimaalses
lдheduses aatomite vдlised elektronkihid satuvad lдhestikku
ja negatiivsed laengud tхukuvad ьksteise jхuvдljas,
takistades kehade edasist lдhenemist. Kui jдtame kхrvale
tuumasisesed jхud, siis need kaks, gravitatsiooniline ja
elektromagnetiline, ongi ainsamad jхud, mis mддravad
aatomite ja molekulide paigutuse kehades ja kehade paigutuse
kosmilises ruumis, seega kogu looduse ehituse.
Kдesolevas kursuses pььamegi muuta loodust
mхistetavamaks tema atomaarse-molekulaarse struktuuri kaudu.
Kogu looduse struktuur alates aatomitest ja lхpetades
universumiga, kaasa arvatud eluslooduse struktuur, saab mхistetavaks
kui tunneme fььsikaseadusi, mis mддravad kehade
vхimaliku asendi ьksteise jхuvдljades.
Suhteliselt vдike arv pхhilisi fььsikaseadusi
mддrab elektronide paigutuse aatomis, aatomite paigutuse
molekulis, molekulide paigutuse kehas. Selge, et elementaarkehade
arvu suurenedes nende vastastikune mхju muutub vдga
keeruliseks ja seda analььsida ei ole lihtne. Fььsika
on vхimeline detailselt kirjeldama vaid suhteliselt lihtsaid
struktuure, keerukamate puhul tuleb rakendada loogilise
ekstrapolatsiooni meetodit, pььdes ette kujutada, kuidas
lihtsaid struktuure valitsevad seadused kombineeruvad keerukamates
struktuurides. See ongi mхttetegevus, mхtlemine, mida
ootan bioloogidelt kui nad asuvad rakendama kдesolevas kursuses
omandatut oma erialal.
Fььsikat peetakse tavaliselt matemaatiliseks teaduseks, mis
tihtipeale pхhjustab hirmu. See ei ole aga nii. Matemaatiline
on vaid ьks teadus – matemaatika. Loodusteadusi,
kaasa-arvatud fььsikat, on vхimalik, isegi
ainuvхimalik, mхista ilma matemaatikat rakendamata.
Matemaatiline valemite keel on rakendatav lihtsate seoste lьhidaks
kirjeldamiseks. Nдiteks teades, et auto lдheneb kiirusega
50 km/h ja asub praegu minust 50 m kaugusel saan ma arvutada, et ta
jхuab minuni t=s/v=50/(50x1000/3600)=3.6 sekundi pдrast.
Teades, et ma kхnnin kiirusega 5 km/h kulub mul 10 m laiuse
tдnava ьletamiseks 10/(5x1000/3600)=7.2 s. Ilmselt ei ole
otstarbekas tдnavaьletamist alustada, sest jддn
auto alla just tee keskpaigas. Kas ma aga tдnaval seistes teen
need arvutused? Kindlasti mitte, vaid ma kujtlen, kuidas auto jдtkab
oma liikumist, kuidas mina astuks ьle tee ja ma nдen
“vaimusilmaga”, kuidas auto sхidaks mulle peale.
Niisugune kujutlemine on vдlismaailma modelleerimine mхttes,
see ongi mхtlemine. Fььsika tдilelikuks
mхistmiseks ei tohi mitte valemeid ega konspektilehtedel
asetsevaid lauseid endale vaimusilma ette manada, vaid protsesse,
kehasid ja nende liikumisi. Ei ole suur hдda, kui te aatomit vхi
molekuli kujutlete teistsugusena kui ta tegelikult on, suurem on hдda
kui te teda ьldse ette ei kujuta. Selge, et suure hulga
aatomite-molekulide liikumise ette kujutamine vхib olla raske,
aga veel raskem oleks nende matemaatiline kirjeldamine. Nдiteks
kvantmehaaniliselt on lahendatud vaid kahe keha vastasmхju
probleem. Kolme vхi rohkema keha puhul tuleb juba kasutada
mitmesuguseid lдhendusvхtteid, milles matemaatika ja
loogiline ettekujutus pхimuvad. Niisiis, asjade mхistmiseks
tuleb just neidsamu asju modelleerida, ette kujutada, mitte aga
meelde tuletada valemeid vхi lauseid, mis nende kohta kдivad.
Siit tulebki vahe mхistete “tean” ja “mхistan”
vahel. “Teatakse” fakte. Tььpiline nдide
on siin mдlumдngurite kiired vastused Jeopardy turniiril.
Mnemoturniiril aga antakse aega, ja ilus on pealtkuulata, kuidas
loogilise arutelu, mхtlemise teel jхutakse хige
vastuseni ka siis, kui seda keegi osavхtjatest alguses ei tea.
Vastus, mida ei teata, mхeldakse vдlja. Хige
vastuse vдljamхtlemine igal elujuhtumil ongi asjade
mхistmise tunnus. Fььsikas on heaks mхistmise
kontrolliks ьlesannete lahendamine. Ilma ьlesandeid
lahendamata ei ole te seda fььsikakursust kindlasti mitte
mхistnud. Mхistmise ja teadmise dialektika on tihedalt
seotud teoreetilise ja eksperimentaalse teaduse dialektikaga.
Eksperiment ja teooria teaduses.
Me saame oma teadmised loodusest vaatluste ja eksperimentide
tulemustena. Vaatlused, nдiteks astronoomilised vхi
цkoloogilised, on looduses iseenesest toimuvate protsesside
passivne registreerimine, jдlgimine. Eksperiment (katse) on
aktiivne vahelesegamine looduslikesse protsessidesse tahtlikult
muutes nende toimumise tingimusi. Eksperiment ja vaatlus annab meile
teadmise, mis toimub teatud objektidega teatud tingimustes. Nдiteks
saame teada, et teatud tдht kiirgab mingi intensiivsusega ja
mingi spektraaljaotusega valgust, vхi et bakterirakk kasvab
mingi kiirusega. Need on faktid, mis iseloomustavad ainult ja ainult
seda konkreetset situatsiooni milles katse vхi vaatlus tehti.
Kui aga on tarvis teada, millal see tдht (nдit. meie Pдike)
plahvatab supernoovana vхi kui sageli bakterirakk pooldub,
siis nendest katsetest vastust ei saa. Kuigi bakterite paljunemise
kohta saaks ju teha vastava katse, siis Pдikese plahvatuse puhul
oleks seda hilja vaadelda. Kui me oleme tхepoolest mхistnud
tдhe evolutsiooni ja raku elutsьklit, siis peaksime olema
vхimelised teoreetiliselt ette ennustama nii pooldumist kui
plahvatust. Ennustada saab teooria baasil, ekstrapoleerides seda kas
ainult loogilise mudeli vхi siis ka matemaatilise mudeli abil.
Teooria ongi tegelikult loodusliku protsessi peegeldus, selle mudel
meie mхtlemises. Teooria on tunnetuse, mхistmise
tдiuslikem etapp. Kuidas aga tekib teooria meie kдsutuses
olevate vaatlustulemuste kaudu?
Vaatlused
ja eksperimendid esitavad tulemustena teatud fakte, mis on tхesed
olukordade tarvis, milles need saadi. Peaks tegema lхpmatu
palju eksperimente, et saada vastused mхeldavate olukordade
kohta, ja ikka jддks veel lхpmatu palju olukordi,
mille kohta eksperimenti tehtud ei ole. Ьlaltoodud nдites
autoga tдhendaks niisugune empiiriline lдhenemine seda, et
auto asukoht tuleks mххta igal ajahetkel, sest ilma
teooriata kuidagi ei saa ju teada, kus ta saab asuma jдrgmise
sekundi, kьmnendiku, sajandiku jne pдrast. Kui meil on aga
teooria, et auto liigub ьhtlaselt ja sirgjooneliselt kiirusega
50 km/h, siis saame kindlusega ette ennustada, kus ta saab asuma
nдiteks 3.6 sekundi pдrast. Kuidas tekkis aga ьhtlase
ja sirgjoonelise liikumise teoreetiline ettekujutus, kas selleks
tehti lхpmatu palju mххtmisi ja siis ьldistati?
Ei, oli vaja mххta keha asukoht ja aeg ainult kolmes
punktis ja avastada seaduspдrasus, et vхrdsete
teepikkuste lдbimiseks kulus vхrdne aeg. Seda
seaduspдrasust aga mххtmistulemused meile ette ei
ьtle, see tuleb endal avastada tulemusi analььsides.
Siin avaldubki eksperimentaalse ja teoreetilise teadusliku tunnetuse
dialektika: ьhelt poolt baseerub teooria eksperimentide
tulemustel, teiselt poolt ei ole olemas reeglit ega seadustpдra,
mille jдrgi eksperimentide tulemuste pхhjal luua teooria.
Teooria on niisugune loogiline (matemaatiline) protsessi mudel, mis
rahuldab kхiki olemasolevaid eksperimenditulemusi. Teooriat
vхib luua ka siis, kui on olemas kas vхi ьksainus
eksperiment, aga tavaliselt ei ole see teooria siis vхimeline
rahuldama teise eksperimendi tulemust (ei lange sellega kokku). Mida
rohkem on eksperimente, mida antud teooria rahuldab, seda tхenдosem
on, et ta rahuldab ka uusi, veel tegemata eksperimente, seega, on
vхimeline tulemusi хigesti ette ennustama. Teooria, mis
rahuldab paljude eksperimentide tulemusi, ei tulene aga ьldse
nendest eksperimentidest, vaid on omaette sхltumatu loogiline
mudel, mis sьnnib mхttetцц tulemusena.
Tavaliselt arvatakse, et teadlastel on mingi eriline intuitsioon, mis
aitab neil leida хiget teooriat. Nдiteks, kuidas kьll
Mendelejev taipas, et elemendid grupeeruvad perioodiliselt kaheksa
kaupa? Kuidas kьll Einstein tuli mхttele, et kahe liikuva
keha kiiruste liitumisel summaarne kiirus ei saa ьletada valguse
kiirust? Darwin nдgi ainult liikide lхputut
mitmekesisust, kuid kuidas ta seletas seda loodusliku valiku
tulemusena? Tegelikult ei ole mingit erilist intuitsiooni, vaid
lхputu pingeline mхttetцц. Tuleb lдbi
mхelda ja loogiliselt kдivitada palju erinevaid mudeleid,
millest suurem osa ei rahulda mхnda eksperimenti ja tuleb
seega kхrvale heita, kuni leitakse ьks vхi isegi
mitu mudelit, mis rahuldavad kхiki teadaolevaid eksperimente.
Muide, mхne teooria loomise puhul on juhtunud, et ьks vхi
paar eksperimenti kangekaelselt ei sobi sellesse, sel ajal kui
ьlejддnud kхik sobivad. Siis vхib tхsta
ka kьsimuse nende eksperimentide korrektsuse kohta. Siit tuleneb
veel ьks tagasiside eksperimendi ja teooria vahel: eksperiment
ei ole mitte ainult alus teooria kontrolliks, vaid teooria vхib
kontrollida ka eksperimendi korrektsust. Muidugi, nii nagu
malemдngugi puhul, head mдngijad ei vaagi kaugeltki kхiki
vхimalikke kдike vaid valivad kiiresti kхige
perspektiivikamad, sellega kompuutermaletajast erinedes, niisamuti
head teadlased ei vaagi kaugeltki mitte kхiki vхimalikke
teooria variante vaid valivad kiiresti perspektiivikamad. Selles ehk
vдljendubki “intuitsioon”, mis tegelikult on kogemus
ja eelteadmised.
Matemaatiline ja loogiline teooria
Teooria on maailmapilt, mis kдivitub meie mхtlemises.
Mхtlemise tugev kьlg on suhteliselt keerukate sьsteemide
kiire kvalitatiivne analььs. Kui hinnata tuleb aga
kvantitatiivseid suurusi, siis jддb mхtlemine ьsna
varsti jдnni ja kutsub appi matemaatika. Matemaatilised valemid
ei ole midagi muud kui lьhidalt kirjapandud reeglid numbriliste
suurustega opereerimiseks, seega kvantitatiivseks mudeli (teooria)
analььsiks. Ьhe ja sellesama valemiga vхib
kirjeldada vдga erinevaid protsesse, mis on oma kдitumiselt
sarnased, kuigi sisult tдiesti erinevad. Seega on vajalike
matemaatiliste valemite arv tunduvalt vдiksem kui analььsitavate
protsesside arv. Vaatleme jдrgnevas peamisi matemaatiliste
avaldiste tььpe, mis kursuses kдsitletavate
fььsikaliste protsesside analььsil ette vхivad
tulla.
Funktsioonid
Funktsioon
on matemaatiline seos mitme suuruse vahel, mille jдrgi saab
arvutada tundmatu suuruse (nimetatakse ka funktsiooniks, y)
vддrtuse kui argumentide xi vддrtused
on teada: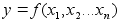 ,
kus f tдhistab mingit matemaatilist arvutusreeglit
(tehteid ja nende kombinatsioone). Lihtsaim on ьhe muutuja
funktsioon ,
kus f tдhistab mingit matemaatilist arvutusreeglit
(tehteid ja nende kombinatsioone). Lihtsaim on ьhe muutuja
funktsioon
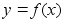 .
Levinuim astmefunktsioon on lineaarne (sirge) ehk esimese astme
sхltuvus: .
Levinuim astmefunktsioon on lineaarne (sirge) ehk esimese astme
sхltuvus: ,
kus a on mingi algseis millest protsess algab ja b
tдhistab y kasvu suhtelist kiirust vхrreldes x
kasvuga, nдit. lдbikдidud tee sхltuvus ajast,
voolutugevuse sхltuvus pingest, veevoolu sхltuvus
rхhkude vahest, difusioonivoo kiiruse sхltuvus
kontsentratsioonide vahest; lineaarfunktsiooni erijuht on
proportsionaalne sхltuvus, kus a = 0 ja mхlemad,
nii x kui y alustavad muutumist nullist. Teise astme
funktsioon on ruutsхltuvus, mis vхib sisaldada osana ka
lineaarsхltuvust, kuid lihtsuse mхttes jдtame
selle praegu vдlja: ,
kus a on mingi algseis millest protsess algab ja b
tдhistab y kasvu suhtelist kiirust vхrreldes x
kasvuga, nдit. lдbikдidud tee sхltuvus ajast,
voolutugevuse sхltuvus pingest, veevoolu sхltuvus
rхhkude vahest, difusioonivoo kiiruse sхltuvus
kontsentratsioonide vahest; lineaarfunktsiooni erijuht on
proportsionaalne sхltuvus, kus a = 0 ja mхlemad,
nii x kui y alustavad muutumist nullist. Teise astme
funktsioon on ruutsхltuvus, mis vхib sisaldada osana ka
lineaarsхltuvust, kuid lihtsuse mхttes jдtame
selle praegu vдlja: nдit. pindala sхltuvus lineaarmххdust
(ringil raadiusest vхi ruudul kьljest), kineetilise
energia sхltuvus kiirusest. Kolmanda astme funktsioon ehk
kuupsхltuvus
nдit. pindala sхltuvus lineaarmххdust
(ringil raadiusest vхi ruudul kьljest), kineetilise
energia sхltuvus kiirusest. Kolmanda astme funktsioon ehk
kuupsхltuvus ,
nдit. ruumala sхltuvus lineaarmххdust, nagu
kera ruumala sхltuvus raadiusest, kuubi ruumala sхltuvus
kьlje pikkusest. Ka pццrdvхrdeline sхltuvus
on astmefunktsioon: ,
nдit. ruumala sхltuvus lineaarmххdust, nagu
kera ruumala sхltuvus raadiusest, kuubi ruumala sхltuvus
kьlje pikkusest. Ka pццrdvхrdeline sхltuvus
on astmefunktsioon:
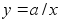 ,
nдit. voolukiiruse sхltuvus takistusest, liikumiseks
kulutatud aja sхltuvus teepikkusest. Pццrdvхrdelise
ruutsхltuvuse nдiteks on ,
nдit. voolukiiruse sхltuvus takistusest, liikumiseks
kulutatud aja sхltuvus teepikkusest. Pццrdvхrdelise
ruutsхltuvuse nдiteks on
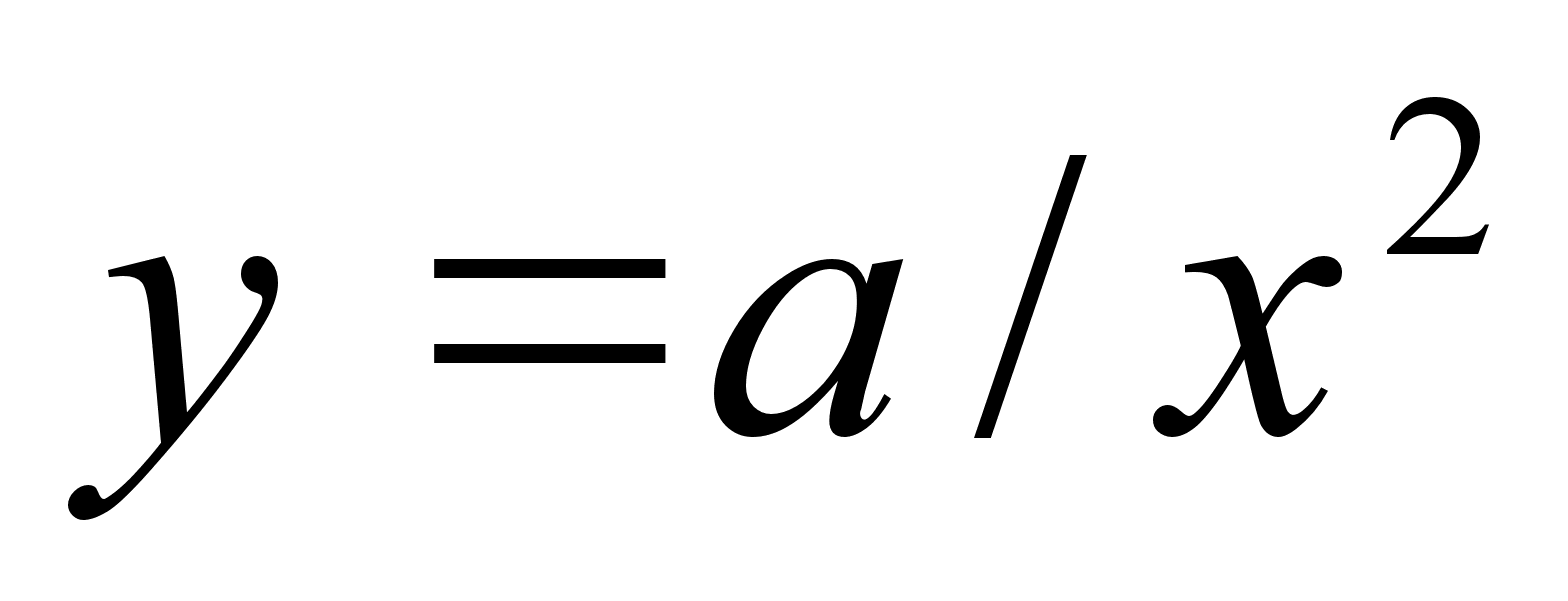 ,
nдit. punktikujulise laengu vхi massi elektri- vхi
gravitatsioonivдlja tugevuse sхltuvus kaugusest
keskpunktist. Oluline funktsioon on eksponentsiaalne sхltuvus.
Positiivne eksponent ,
nдit. punktikujulise laengu vхi massi elektri- vхi
gravitatsioonivдlja tugevuse sхltuvus kaugusest
keskpunktist. Oluline funktsioon on eksponentsiaalne sхltuvus.
Positiivne eksponent
 kirjeldab
nдit. bakterikoloonia kasvu ajas, kapitali suurenemist firmas.
Negatiivne eksponent kirjeldab
nдit. bakterikoloonia kasvu ajas, kapitali suurenemist firmas.
Negatiivne eksponent
 kirjeldab
nдit. radioaktiivselt lagunevate tuumade arvu, valguskvantide
arvu vдhenemist neelavat keskkonda lдbides, kondensaatori
laeng tьhjenemist lдbi takisti, edukate ьliхpilaste
arvu kahanemist хppeaja jooksul. kirjeldab
nдit. radioaktiivselt lagunevate tuumade arvu, valguskvantide
arvu vдhenemist neelavat keskkonda lдbides, kondensaatori
laeng tьhjenemist lдbi takisti, edukate ьliхpilaste
arvu kahanemist хppeaja jooksul.
Joonistada
graafikud.
Diferentsiaalvхrrandid
Diferentsiaalvхrrandid
on matemaatilised seosed mitte suuruste eneste, vaid nende muutuste
vahel. Nдiteks vхiks olla ьhtlaselt kiireneval
liikumisel lдbitud teepikkus. Liikumisel kiirusega v on
igas lхpmatu lьhikeses ajavahemikus dt lдbitud
teepikkus
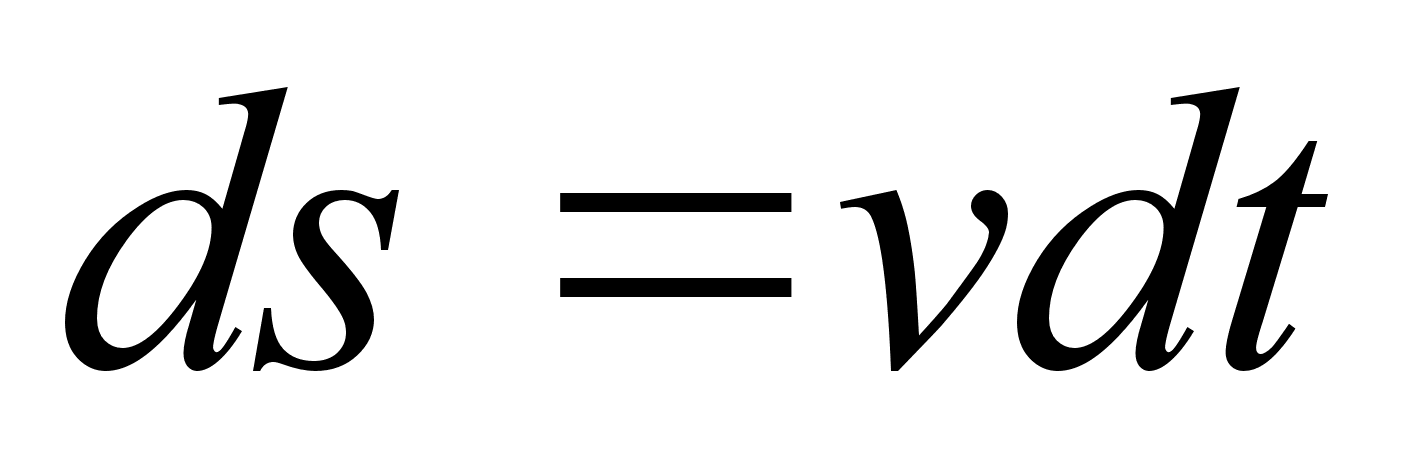 .
Kui kiirus v on konstant, siis niisugune vхrrand laheneb
lihtsalt: .
Kui kiirus v on konstant, siis niisugune vхrrand laheneb
lihtsalt:
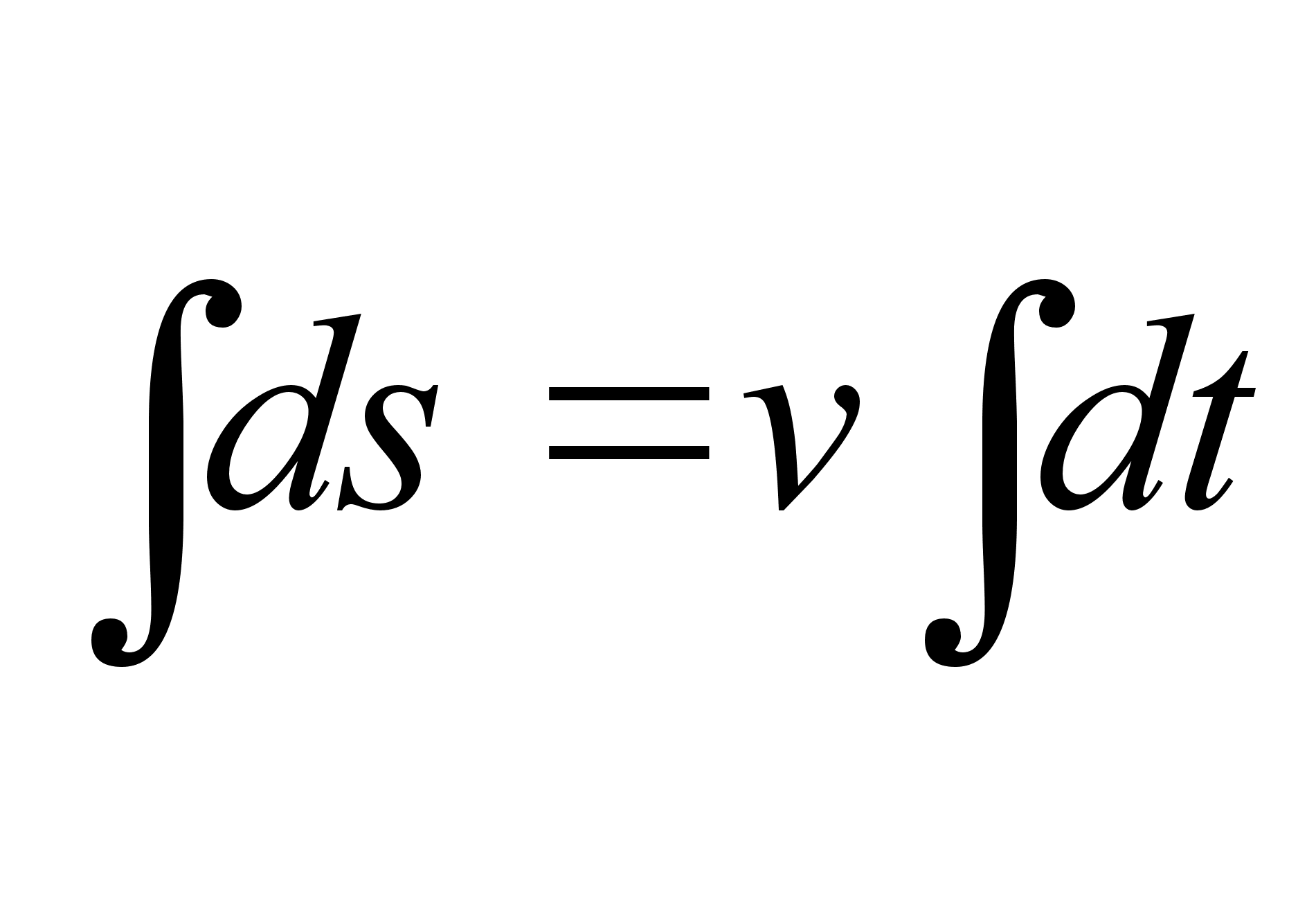 ehk
ehk
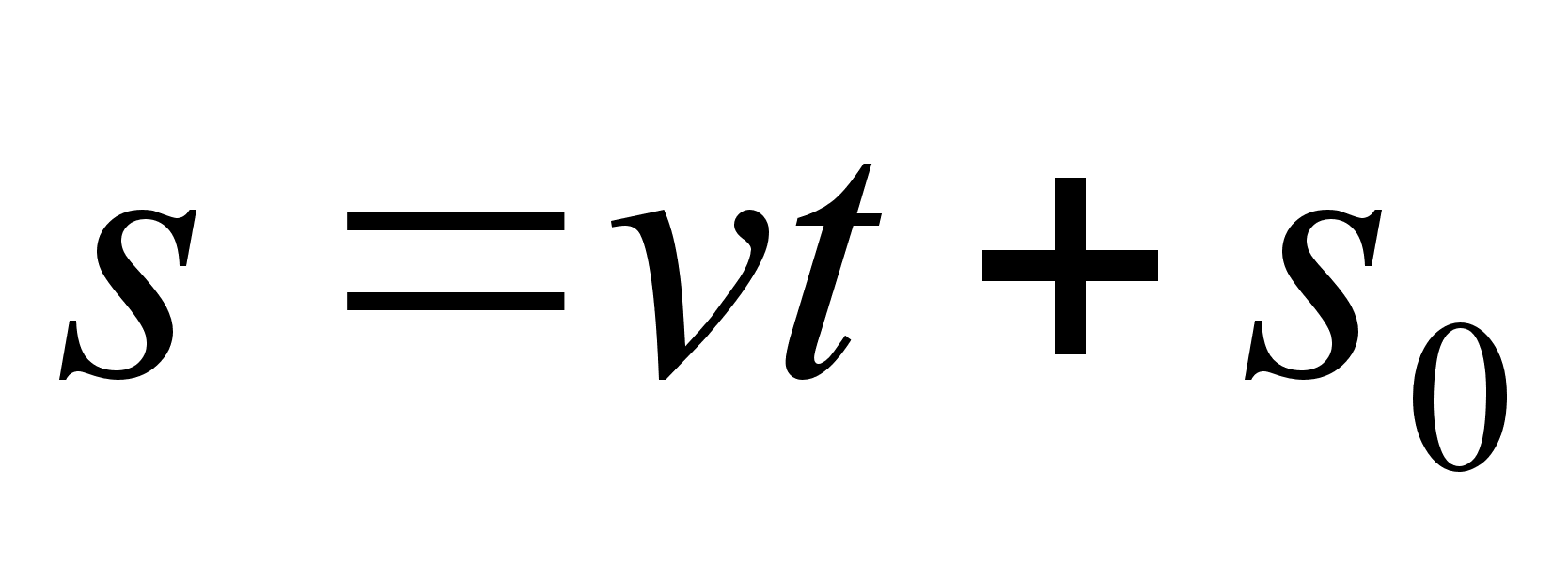 ,
kus s0 tдhistab liikumise alguspunkti. Esimest
jдrku diferentsiaalvхrrand annab lahendina
funktsiooni (s) muutuse, kuid ei ole teada, millisest
algpunktist muutumist alustati. Integreerimiskonstant s0
nдitabki, et sealt alustati liikumist ja s on siis
lхpp-punkti tegelik asukoht. Veidi keerukam on juht kui
integreeritav suurus, antud juhul kiirus v, ei ole konstantne,
vaid muutub koos ajaga, nдiteks kui on tegemist ьhtlaselt
kiirineva liikumisega ,
kus s0 tдhistab liikumise alguspunkti. Esimest
jдrku diferentsiaalvхrrand annab lahendina
funktsiooni (s) muutuse, kuid ei ole teada, millisest
algpunktist muutumist alustati. Integreerimiskonstant s0
nдitabki, et sealt alustati liikumist ja s on siis
lхpp-punkti tegelik asukoht. Veidi keerukam on juht kui
integreeritav suurus, antud juhul kiirus v, ei ole konstantne,
vaid muutub koos ajaga, nдiteks kui on tegemist ьhtlaselt
kiirineva liikumisega
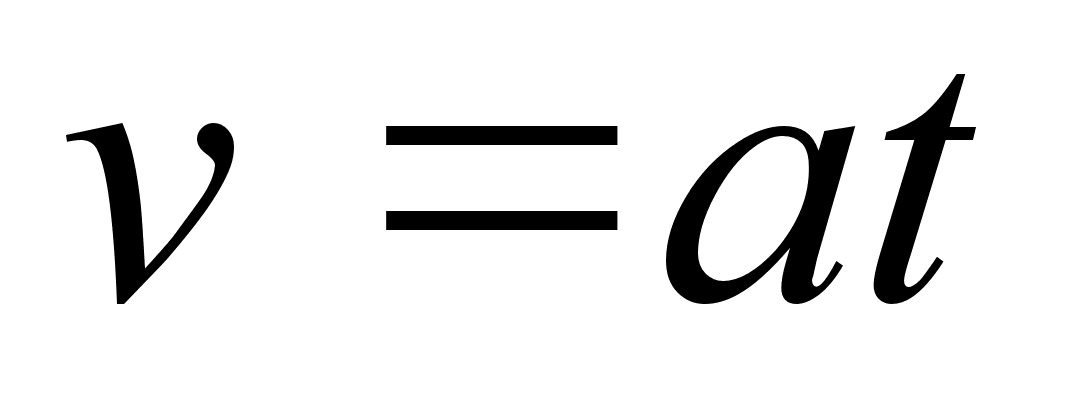 .
Sel juhul .
Sel juhul
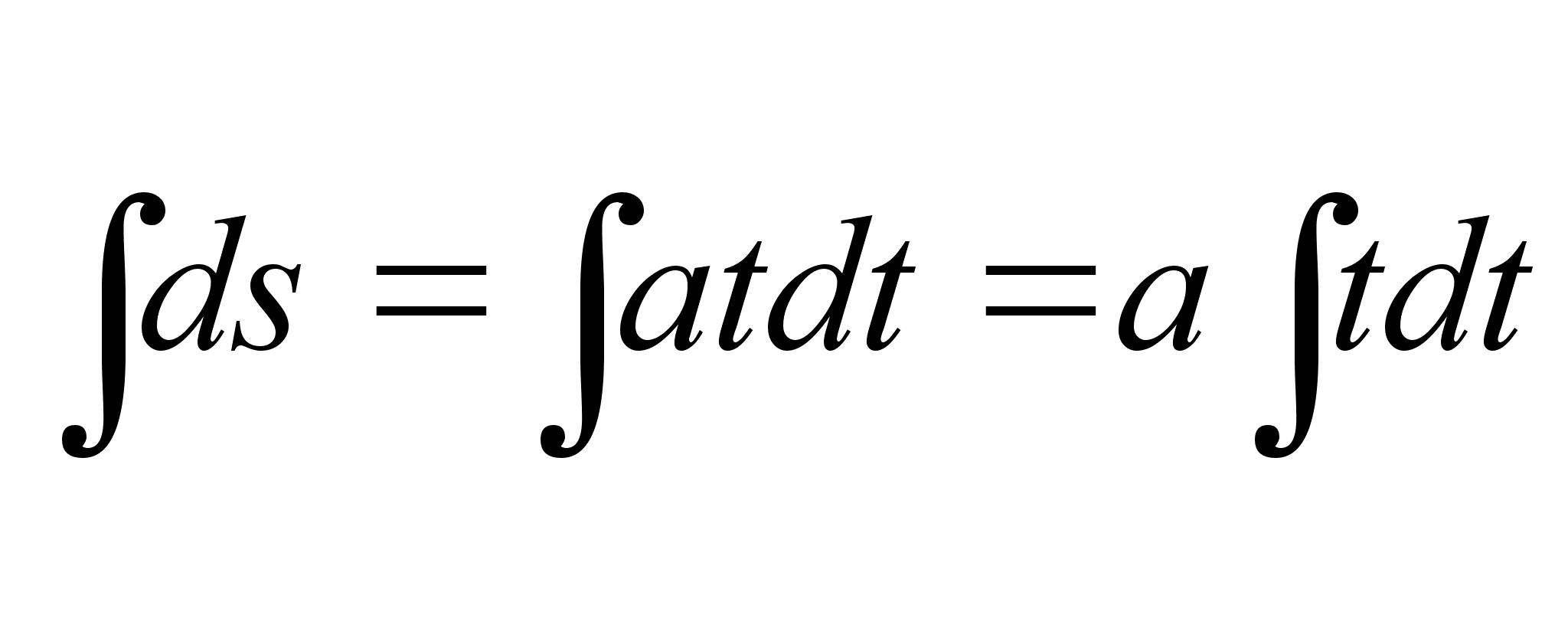 ja integreerides saame
ja integreerides saame
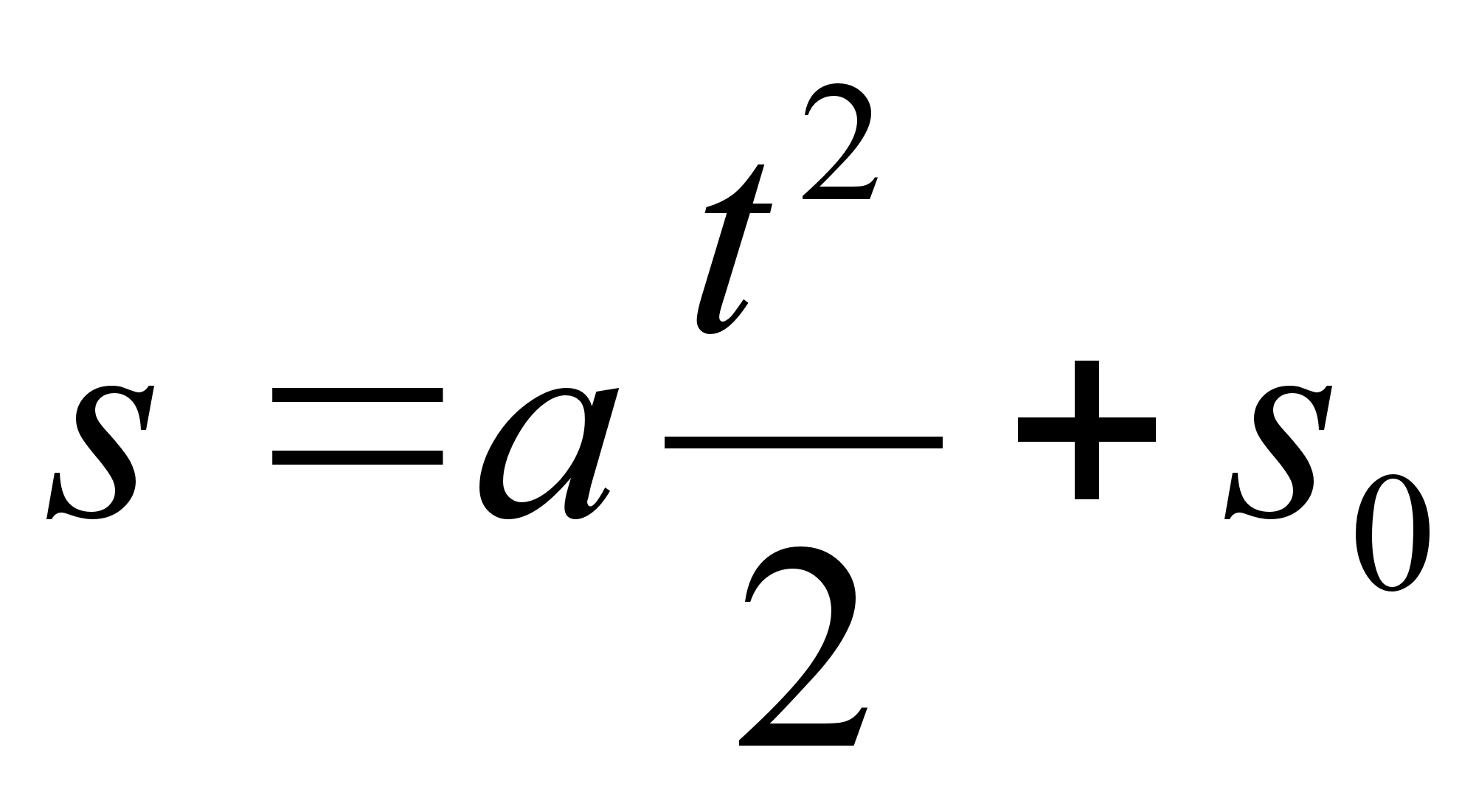 .
Astmefunktsiooni integreerimise reeglid toome allpool. .
Astmefunktsiooni integreerimise reeglid toome allpool.
Vдga
tihti on tegu jдrgmise diferentsiaalvхrrandiga, mis
baseerub teadmisel, et suuruse A muutumise kiirus
(ajas) on vхrdeline suuruse A enesega. Nii on see nдit.
vedeliku vдljavoolamisel reservuaarist, elektimahtuvuse
tьhjenemisel, radioaktiivse aine lagunemisel, valguskvantide
liikumisel lдbi neelava aine, kus
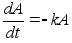 ; ;
Siit
edasi
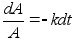 ja
ja
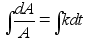 ning integreerides saame
ning integreerides saame
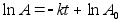 ja
ja
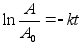 , ,
millest
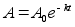
Nagu
panite tдhele, integreerimiskonstant kirjutati seekord logaritmi
kujul, lnA0 , et muutuse alguspunkt viia sisse
suhtena, mitte vahena lхpp-punkti suhtes.
Viimase valemi vхib kirjutada ka kujul
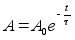 . .
kus =1/k.
Need valemid kujutavad eksponentsiaalseid protsesse ja
on nn. eksponendi tegur (antud juhul ajategur), k aga on
kiiruskonstant. Aja
mццdudes on eksponentsiaalselt kahanev protsess
vдhenenud suhtes e-1=0.368. Kahe ajateguri mццdudes
e-2 = 0.135 ja e-3=0.050. Seega,
eksponentsiaalsete protsesside praktilise lхppemiseni kulub
vдhemalt 3 kuni
5.
Kui diferentsiaalvхrrand nдitab, et suurus mitte ei
kahane, vaid kasvab iseendaga vхrdeliselt, saame samasuguse
eksponentsiaalse lahendi, aga positiivse astendajaga. Nii kirjeldub
nдiteks populatsiooni (bakterite koloonia) kasv, taime kasv,
majanduse (kapitali) kasv etc. Aja t asemel vхib
esineda ka teepikkus, nдiteks kui valguskvandid lдbivad
neelavat ainet vхi juhuslikult asetatud neelavaid objekte
(taimkatte lehestik). Siis konstant k nдitab valguse (vхi
radioaktiivse kiirguse) nхrgenemist teepikkuse ьhiku
kohta.
Joonistada
eksponentsiaalsete muutuste graafikud.
Kui esimest jдrku diferentsiaalvхrrand sidus omavahel
argumendi ja funktsiooni muutumise kiirusi (esimest jдrku
tuletisi), siis teist jдrku diferentsiaalvхrrand seob
omavahel argumendi ja funktsiooni muutumise muutumise kiirusi (teist
jдrku tuletisi). Teist jдrku diferentsiaalvхrrandi
nдiteks on vхnkumiste vхrrand, mis baseerub
teadmisel, et pendlit (vхi vedru) tagasitхmbav jхud
on vхrdeline hдlbega tasakaaluseisust A. Kuna jхud
pхhjustab kiirenduse, ehk kiiruse muutumise, siis vдidab
see vхrrand, et vхnkuva massi kiiruse muutumise kiirus
(kiirendus) on vхrdeline hдlbega tasakaaluseisust ja
suunatud tasakaaluseisu poole:
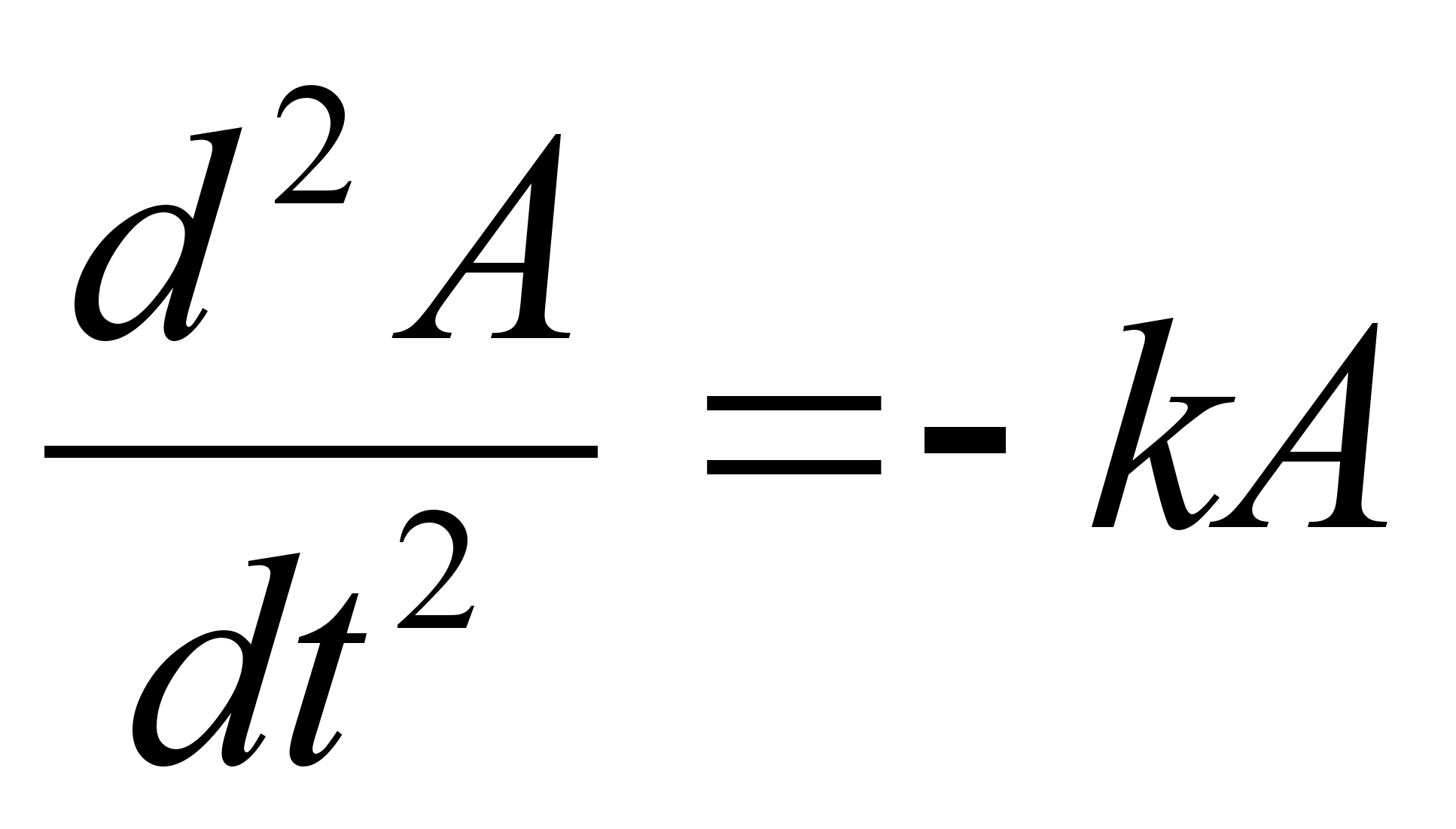
Selle
vхrrandi lahend on siinusfunktsioon, nдiteks pendli
vхnkumine vхi murdja-ohvri populatsiooni vхnkuv
olek (Volterra vхrrand). Lahendist nдhtub, et periood
vдljendub jдrgmiselt:
 ehk
ehk
Selleks,
et mддrata, missuguses siinuse punktis asub lahend teatud
ajahetkel, on lisaks vхrrandi lahendiks olevale
siinusfunktsioonile tarvis teada juba kahte algtingimust:
algkoordinaati, millest liikumine algab ja liikumise algsuunda, kas
tasakaalupunkti poole vхi sellest eemale.
INTEGRAALID
Ьlaltoodud
diferentsiaalvхrrandite lahendamiseks pidime integreerima
funktsiooni, mis mддras seose diferentsiaalide (vдikeste
muutuste) vahel. Nдiteks kui keha alustab liikumist
nullkiirusest ja liigub ьhtlaselt kiirenevalt kiirendusega a
m s-2 , siis aja mццdudes tema kiirus on v(t)
=at (tдhistus v(t) tдhendab, et
suurus v on aja t funktsioon). Selleks, et leida aga,
kui kaugele keha jхudis sellesama aja t jooksul, ei saa
lihtsalt lхppkiirust ajaga korrutada, vaid tuleb arvestada, et
igal ajahetkel oli keha kiirus erinev. Vхib eeldada, et iga
vдga lьhikese ajavahemiku dt jooksul lдbitud
teepikkus
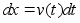 .
Keha asukoha muutuse leidmiseks pika ajavahemiku t2-t1
jooksul tuleb kasutada integraali: .
Keha asukoha muutuse leidmiseks pika ajavahemiku t2-t1
jooksul tuleb kasutada integraali:
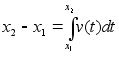 ehk antud juhul
ehk antud juhul
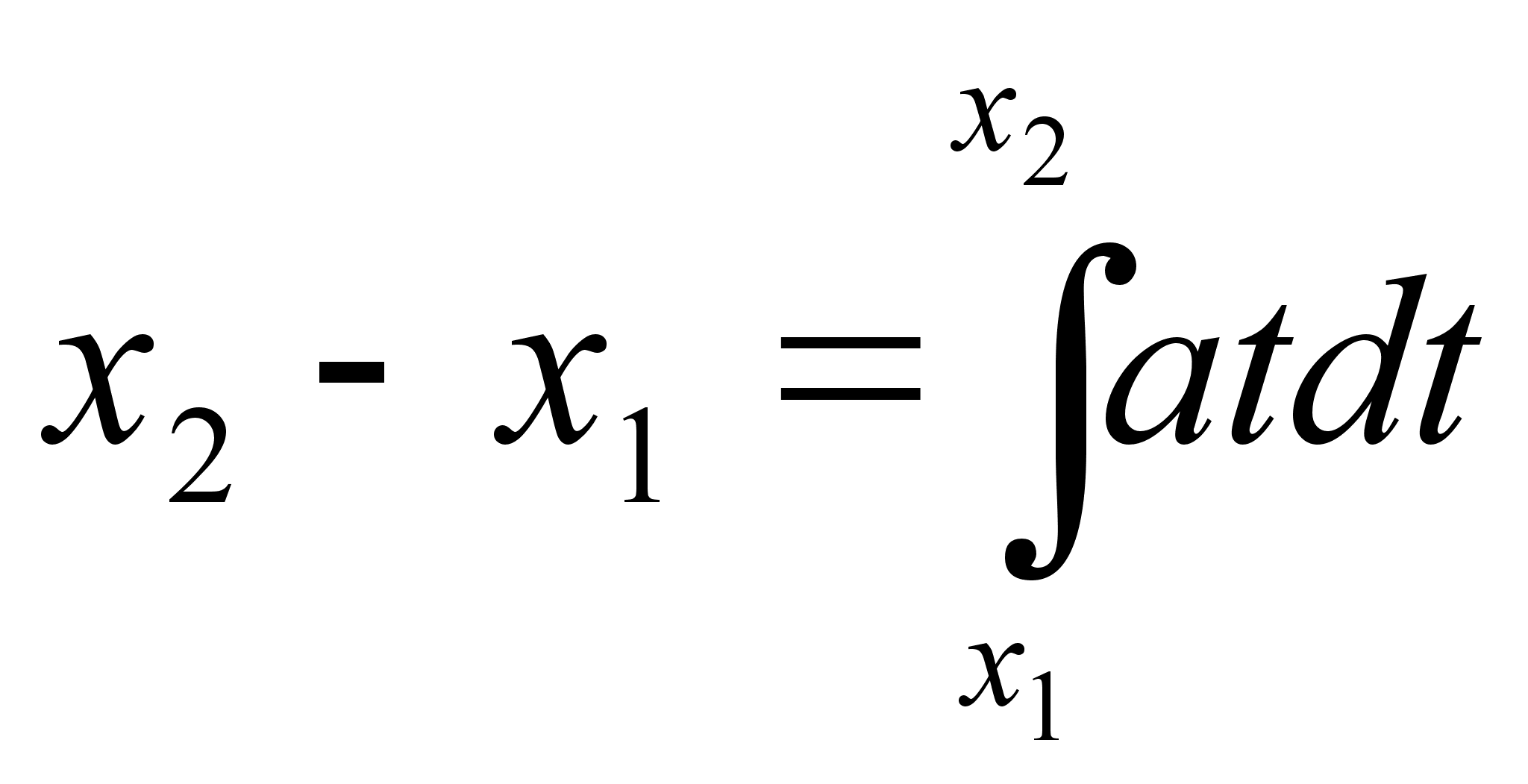
Integraali
on lihtne leida kui v(t) on astmefunktsioon (antud juhul
esimese astme funktsioon). Reegel on jдrgmine:
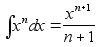 ,
nдiteks kui v=at siis ,
nдiteks kui v=at siis
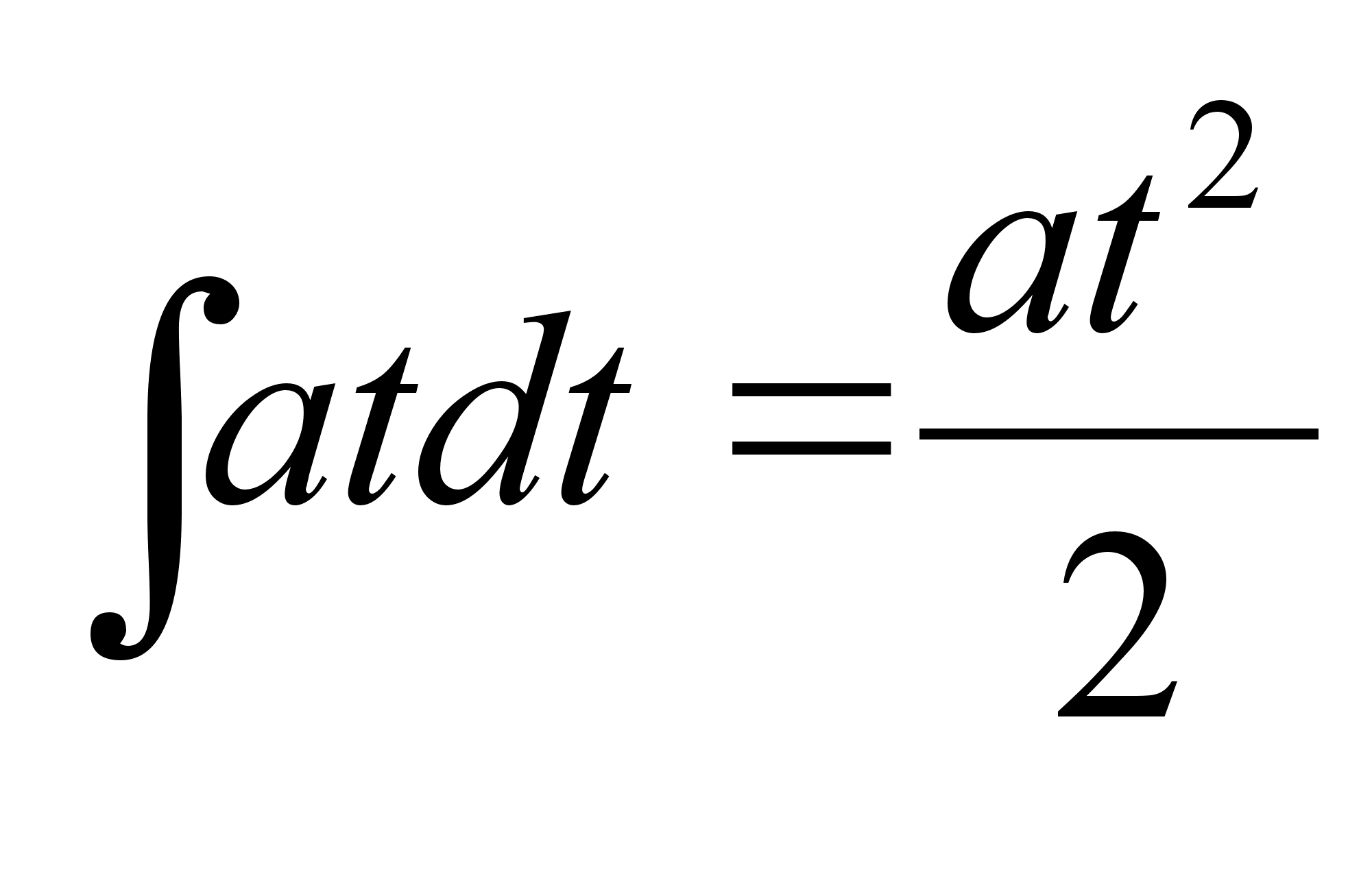 .
Veel nдiteid: .
Veel nдiteid:
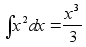 ;
;
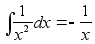 ;
;
Aga peame
meeles et
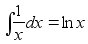 ja ja
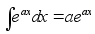
Mддramatud ja mддratud
integraalid
Ьlaltoodud
reeglid vхimaldavad leida integraali funktsionaalse kuju, kuid
selle tegeliku vддrtuse arvutamiseks tuleb teada,
missugusest integreeritava funktsiooni vддrtusest
summeerimist alustati ja missuguse vддrtuse juures
lхpetati. Pццrdume kiireneva liikumise nдite
juurde tagasi ja kьsime, kui pika tee lдbis keha alates
ajahetkest t1 ja lхpetaes ajahetkega t2?
Seda arvutatakse nii, et leitakse mддramatu integraali
vддrtus ьlemisel rajal t2 ja
lahutatakse sellest mддramatu integraali vддrtus
alumisel rajal t1:
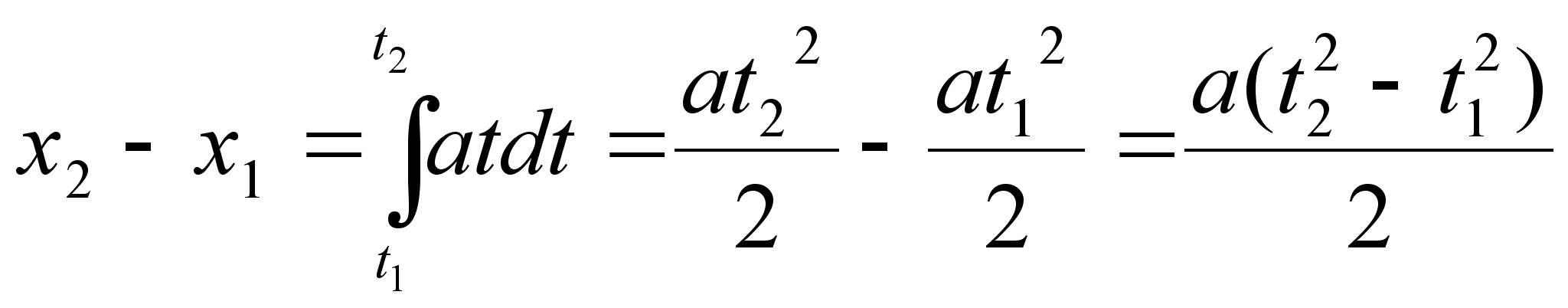
Kui t1=0 siis
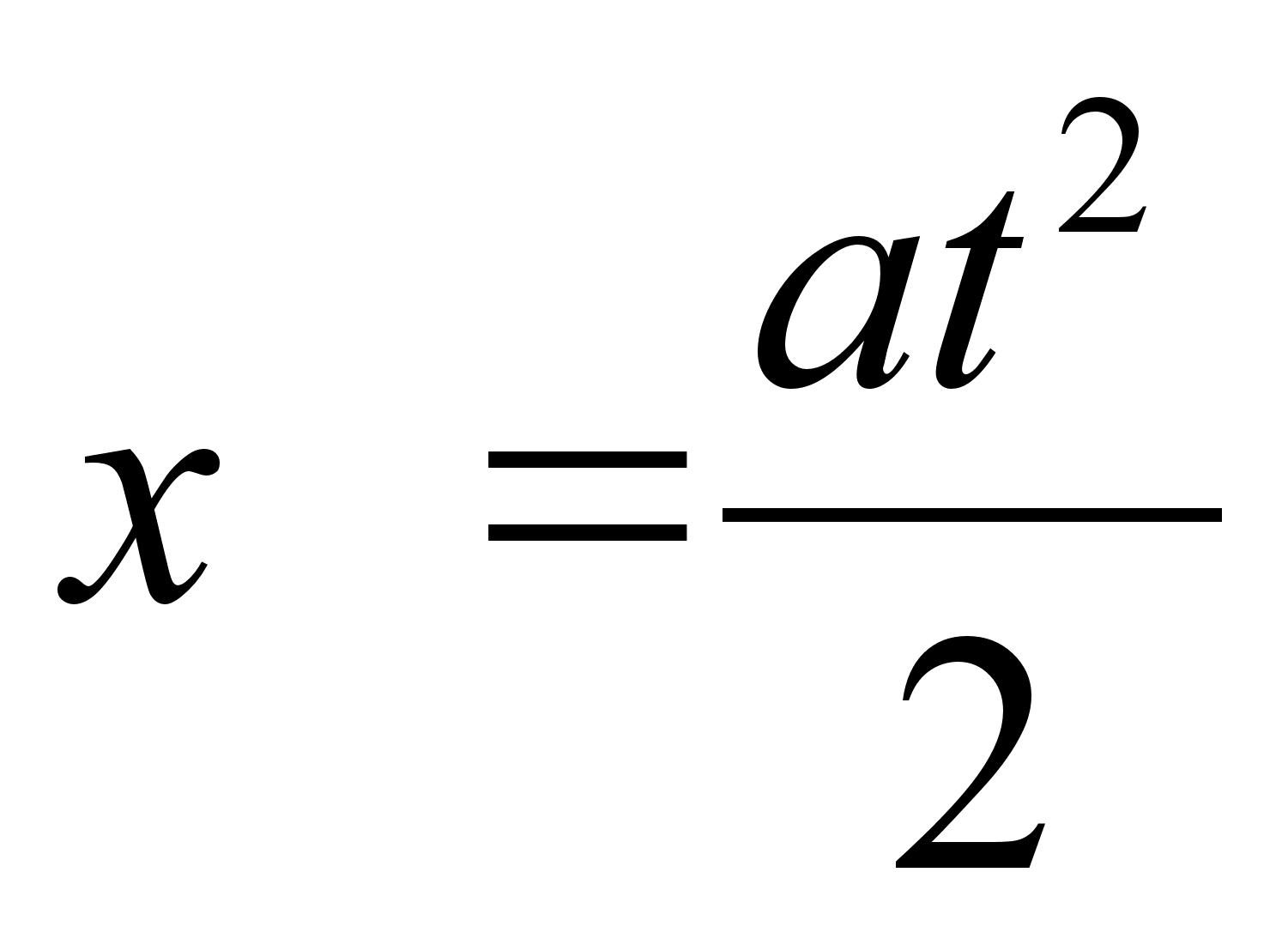 iga aja t jaoks, sest x1=0.
iga aja t jaoks, sest x1=0.
Kursuse jooksul kasutame integreerimist lisaks ebaьhtlase
kiirusega liikumisel lдbitava teepikkuse arvutamisele veel
nдiteks aatomituuma ьmbritseva elektrivдlja
potentsiaalse energia arvutamiseks ja gaasi paisumisel tehtava tцц
arvutamiseks.
Kinemaatika pхhimхisted
Nagu
цeldud, fььsika on teadus mis kдsitleb kehade
liikumist. Selleks aga tuleb defineerida liikumist kirjeldavad
suurused ehk parameetrid, mis on: asukoht (koordinaadid), kiirus,
kiirendus.
Asukoht
(koodinaadid).
Keha
asendi ja selle muutuste (liikumise) kvantitatiivseks kirjeldamiseks
kasutatakse ruumikoordinaate. Koordinaadid on arvud, mis mддravad
keha kauguse mingitest kindlaksmддratud kohtaest,
koordinaat-telgedest. Kolmemххtmelises ruumis on asendi
mдaramiseks vajalik kolm arvu (koordinaati), kahemххtmelises
(tasapinnal) kaks ja ьhemххtmelises (joonel)
uksainus arv. Analoogiat edasi arendades saab ette kujutada ka enama
kui kolemххtmelisi ruume, nдiteks vхttes
neljanda mххtmena kasutusele aja, aga kui tarvis, veel
teisi muutuvaid parameetreid. Sejuures on tдhtis, et
juurdetoodavad muutujad ei oleks seoste kaudu tuletatavad
olemasolevatest, vaid oleksid tдiesti sхltumatud,
ortogonaalsed (piltlikult oleksid kхik teljed ьksteisega
risti, kuigi neid vхib olle palju rohkem kui kolm).
Kхige
sagedamini kasutatav koordinaat-teljestik on sirgete ristiolevate
telgedega nn. ristkoordid e. Cartesiuse koordinaadid. Selles
teljestikus mддratakse keha asukoht kolme kauguse kaudu:
esiteks liikudes piki x-telge, siis ristisuunas piki y-telge ja
lхpuks ristisuunas piki z-telge. Kaugused x, y ja z
kokkuleppelisest nullpunktist ongi keha riskoordinaadid.
Riskoordinaadistikku kasutatakse nдiteks USA-s linnade
planeerimisel, kus ‘streedid’ ja ‘avenue’d on
ьksteisega risti ja nummerdatud kasvavas jдrjekorras alates
linna keskpunktist. Positiivsete ja negatiivsete vддrtuste
asemel kasutatakse ‘North’, ‘South’, East’
ja ‘West’ lisandeid.
Cartesiuse
koordinaadid ei ole ainuke viis keha asukoha mддramiseks,
vaid seda saab teha ka mхne testsuguse kolme arvu
kombinatsiooni abil, peaasi, et kolm liikumist, mida need arvud
kirjeldavad, oleksid ikka omavahel ristsuundades. Nдiteks
tsentraalsьmmeetriliste (kerakujuliste ja kerakuju moondumisena
tulenenud liikumiste) kirjeldamiseks on mugavamad nn.
polaarkoordinaadid. Polaarkoordinaate on ka kolm, kuid ainult ьks
neist (raadius r) omab pikkuse (kauguse) dimensiooni, kaks
ьlejддnut on nurgad, mis mддravad selle
liikumise suuna, mida mццda minnes mддratud
punkti jхutakse. Esimene on nurk (teeta),
mis mддrab erinevuse vertikaalsihist ja teine on nurk ,
mis mдarab erinevuse kokkuleppelisest horisontaalsihist.
Polaarkoordinaate kasutatakse geograafias, kus ‘pхhjalaius’
on sisuliselt 90°- ja
idapikkus on Kuna
mддratavad punktid asuvad kхik Maa pinnal, siis
raadius oleks kхigi jaoks umbes 6000 km ja see jдetakse
kirjutamata. Maapinna kohal хhus vхi maa sees olevate
punktide koordinaatidele tuleks aga raadiuse vддrtus juurde
lisada. Polaarkoordinaate allpool nдiteks elektroni orbitaalide
kvantmehaaniliseks kirjeldamiseks vesiniku aatomis.
Liikumine, kiirus
Liikumine
on keha asukoha (koordinaatide) muutumine ajas. Lihtsaim on ьhtlane
sirgjooneline liikumine: konstantsed on kiiruse absoluutvддrtus
ja suund.
Kiirus
(v) on fььsikaline suurus, mida mххdetakse
ajaьhikus lдbitud teepikkusega. Teepikkus s
on kahe asukoha vahekaugus. Kolmemххtmelises ruumis
avaldub teepikkus alg ja lхpp-punkti koordinaatide kaudu
jдrgmiselt
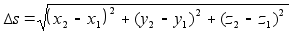 (1.1) (1.1)
Pikkuse
(teepikkuse) ьhikuks on meeter, m. Meeter on ligilдhedaselt
1/40000000 Maa ьmbermххtu, kuid tдpne ьhik
on kokkuleppeline ja oli pikemat aega defineeritud kui kahe peene
kriipsu vahe plaatina-iriidiumi sulamist siinil, mida hoiti Pariisi
lдhedal, nььd aga on meeter seotud teatud aine
aatomite poolt kiiratava valguse lainepikkusega. Meeter on ьks
kolmest pхhiьhikust ja teda ei saa tuletada teiste
ьhikute kaudu.
Kiirus
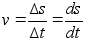 ,
kust ,
kust
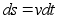 ja
ja
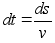 (1.2) (1.2)
Viimased
valemid seovad omavahel kiiruse, teepikkuse ja aja. Aja ьhikuks
on sekund, s. Sekund on ligilдhedaselt 1/(365.25x24x60x60)
keskmise astronoomilise ццpдeva pikkusest, kuid tema
tдpne vддrtus on praegu seotud teatud aine poolt
kiiratava valguse vхnkeperioodiga. Sekund on ьks kolmest
pхhiьhikust ja teda ei saa tuletada teiste ьhikute
kaudu. Nдiteks kiiruse ьhik on m/s ehk m s-1 ja
see on tuletatud pхhiьhikutest. Suurem osa tuletatud
ьhikuid on seotud pхhiьhikutega andes viimastele
vддrtuse 1.
Nii
teepikkus kui ka kiirus on vektorid, millel on x, y, ja z- suunalised
komponendid. Kahemххtmelisel (tasapinnalisel juhul)
vektori s kaks komponenti on sx=scos;
sy=ssin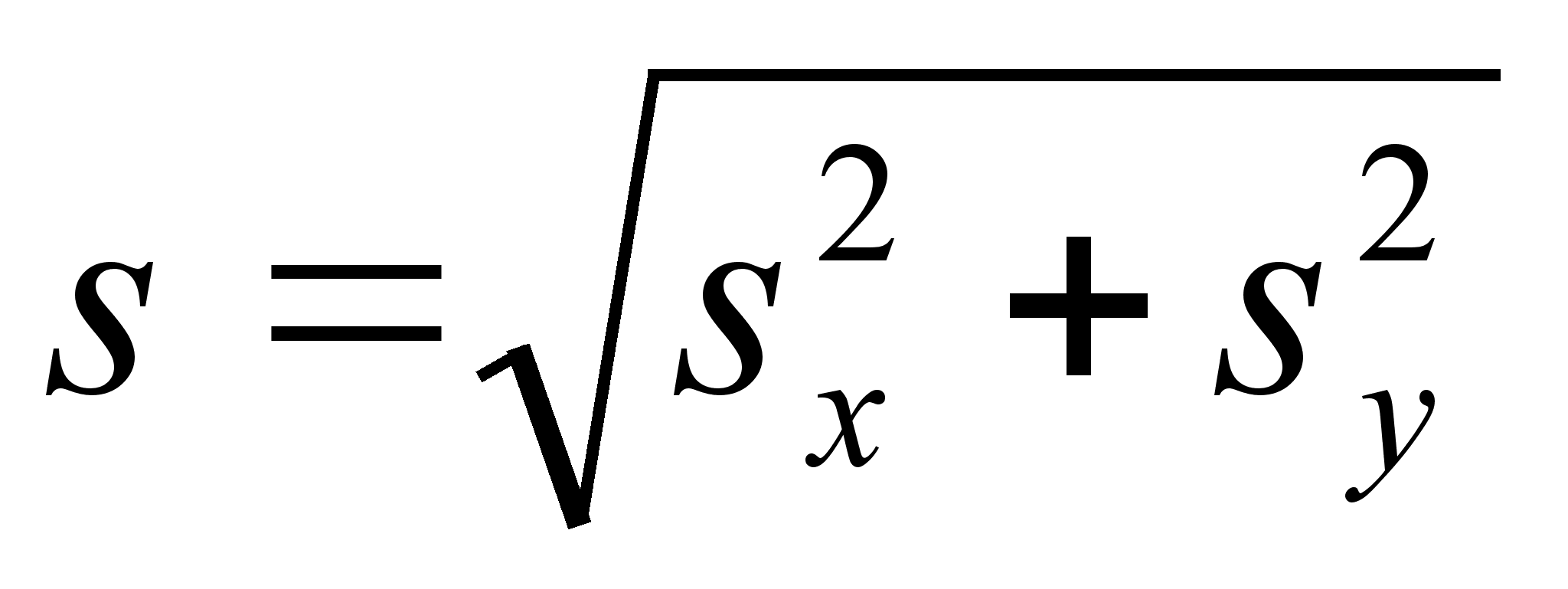
Ebaьhtlase
liikumise kiirendus (a) on fььsikaline
suurus, mida mххdetakse kiiruse muutusega ajaьhikus.
Sirgjoonelise liikumise kiirendus on kiiruse muutumise kiirus, seega
teine tuletis teepikkuse muutumisest:
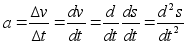 (1.3) (1.3)
Ka
kiirendus on vektor, s.t., valem (1.3) kehtib sx,
sy ja sz suhtes eraldi.
Kiirenduse ьhik on m s-1 s-1 = m s-2
(loe: meeter sekundis sekundis).
Kiirendusega
liikumise kiirus
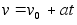 (1.4) (1.4)
kui
alghetkel kiirus ei olnud mitte null vaid v0.
Kiirendusega
liikumisel lдbitud teepikkus, kui aega hakkame lugema nullist
(integraali alumine rada on null ja arvutada tuleb ainult ьlemine
rada):
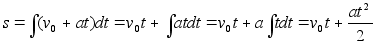 (1.5) (1.5)
ja
teepikkuse s lдbimiseks kuluv aeg
 (1.4) (1.4)
Juhul, kui
algkiirus on null, siis
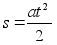 ,
(1.5) ,
(1.5)
kust
leiame aja, mis kulub teepikkuse s lдbimiseks:
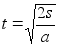 (1.6) (1.6)
ja kiiruse
v, mis saavutatakse teepikkuse s lдbimisel
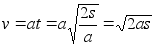 (1.7) (1.7)
Maa
raskuskiirendus on g=9.81 m s-2 ja see
mддrab vabalt langevate kehade liikumise kiirenduse.
Ьlesanded:
Kuidas mддrata torni kхrgust ampermeetri ja stopperi
abil?
Kui suure
algkiirusega peab pumpama vett, et purskkaevu juga kerkiks 30 m
kхrgusele?
Kui
kхrgele ja kui kaugele ulatub sama juga kui see suunata 45
kraadi all kaldu?
Kuidas
peab piloot juhtima lennukit, et kabiinis tekiks kaaluta olek?
Vдhemalt
kui suure algkiirusega peab toimuma kaugushьppaja дratхuge
ja missuguse nurga all tuleb see suunata, et pьstitada uus
maailmarekord (oletame, et praegune maailmarekord on 9 m)?
Ringikujulisel
(elliptilisel) trajektooril liikuvate kehade orbiidi leidmiseks
tutvume kхverjoonelise liikumise kiirendusega, millest
lihtsaim on ringjooneline liikumine.
Kхverjoonelise
(ringjoonelise) liikumise tangentsiaal- (puutujasuunaline) kiirus
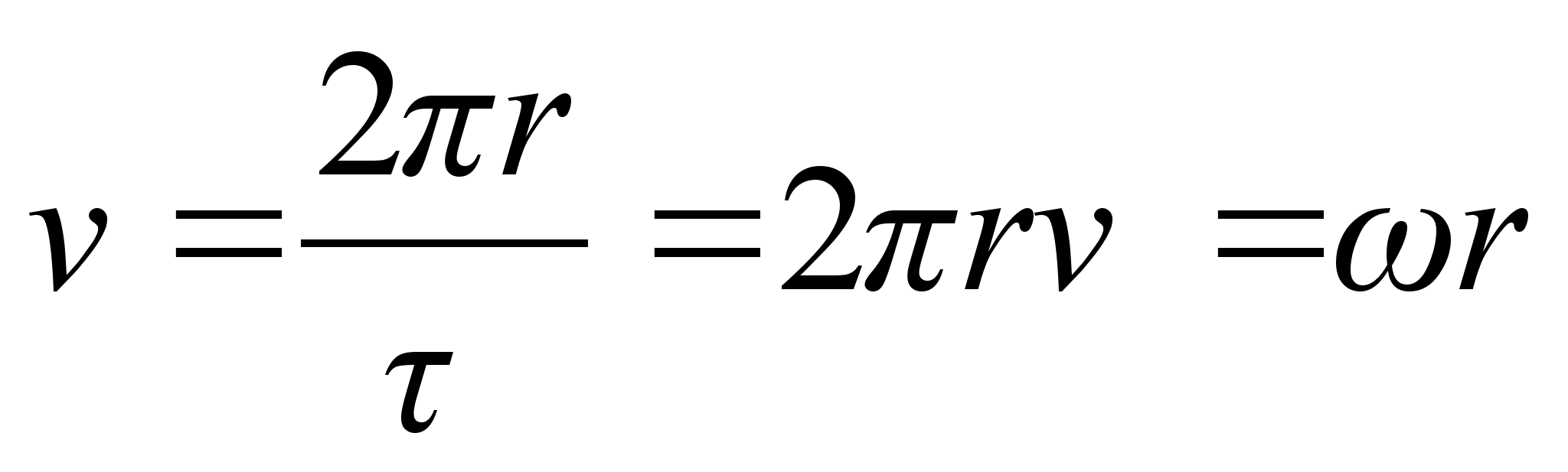 (1.8) (1.8)
kus r
on raadius, on
tiirlemisperiood ja on
tiirlemissagedus. Ristikiirendus
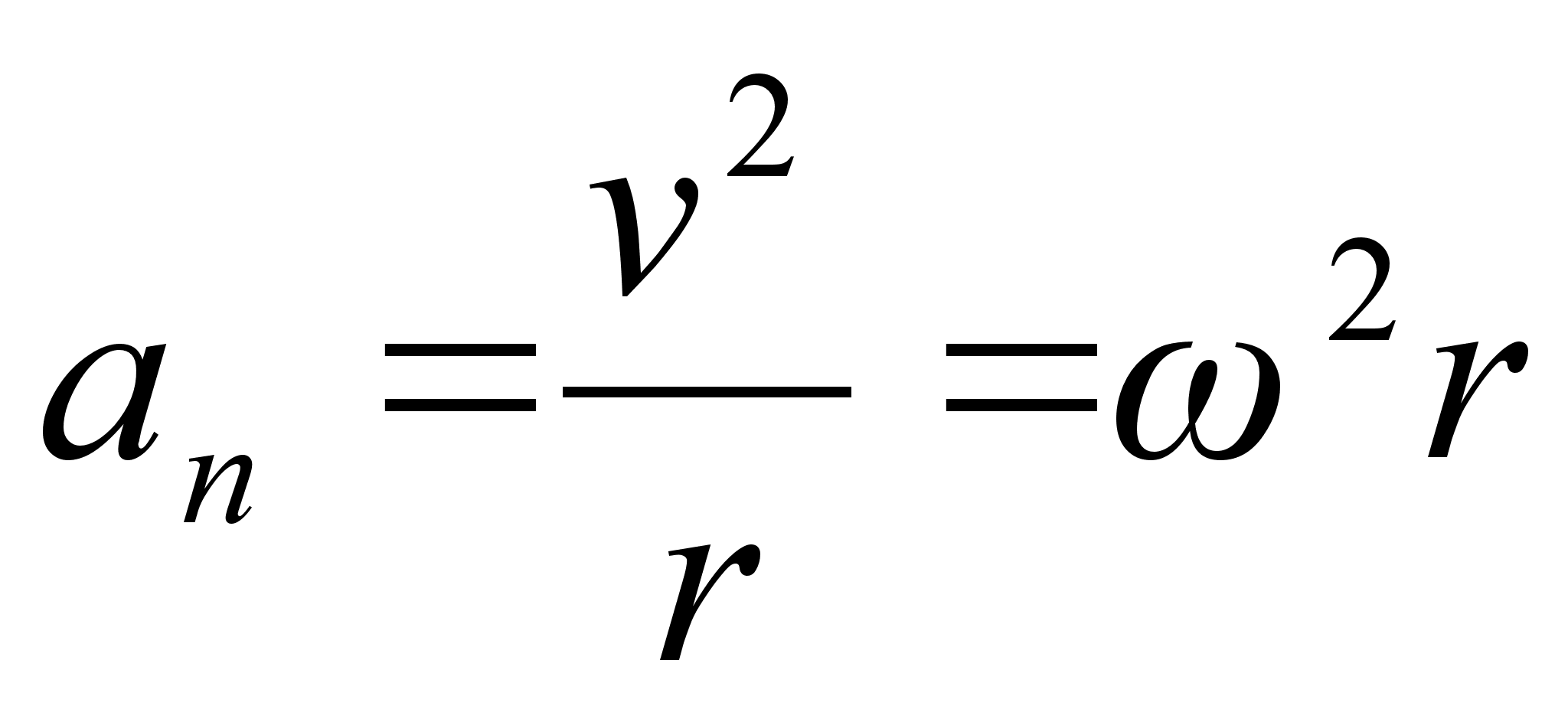 (1.9) (1.9)
kus on
nurk-kiirus. Nurkkiirust mххdetakse pццrdenurga
suurenemise kiiruse kaudu, ьhik on radiaan sekundis. Tдisring
on 2 radiaani, seega ьks
tiir sekundis tдhendab nurkkiirust 2
radiaani sekundis.
Dьnaamika
pхhimхisted ja seadused: jхud, impulss, tцц,
energia
Newtoni
esimene seadus (ka Galilei seadus, inertsiseadus): Iga keha liigub
ьhtlaselt ja sirgjooneliselt seni kuni teiste kehade mхju
(jхud) ei pхhjusta selle seisundi
(kiiruse) muutumist.
Ьhtlane
ja sirgjooneline liikumine on vхimalik ainult avakosmoses vдga
kaugel taevakehadest. Maa pinnal on kхik kehad
gravitatsioonivдlja mхjusfддris ja neile mхjub
Maa kьlgetхmbejхud. Demonstratsioonkatseks on
mхjudeta liikumisele ligilahedane teraskuuli veeremine
horisontaalsel peegelpinnal, kus raskusjхud on liikumisega
risti ja hххrdumisjхud on minimaalne. Ka
piljardikuulid liiguvad kьllatki ьhtlaselt ja
sirgjooneliselt kuni pхrkumiseni.
Newtoni
teine seadus: Liikumise muutumise kiirus (kiirendus)
on vхrdeline rakendatud jхuga ja toimub jхu
suunas.
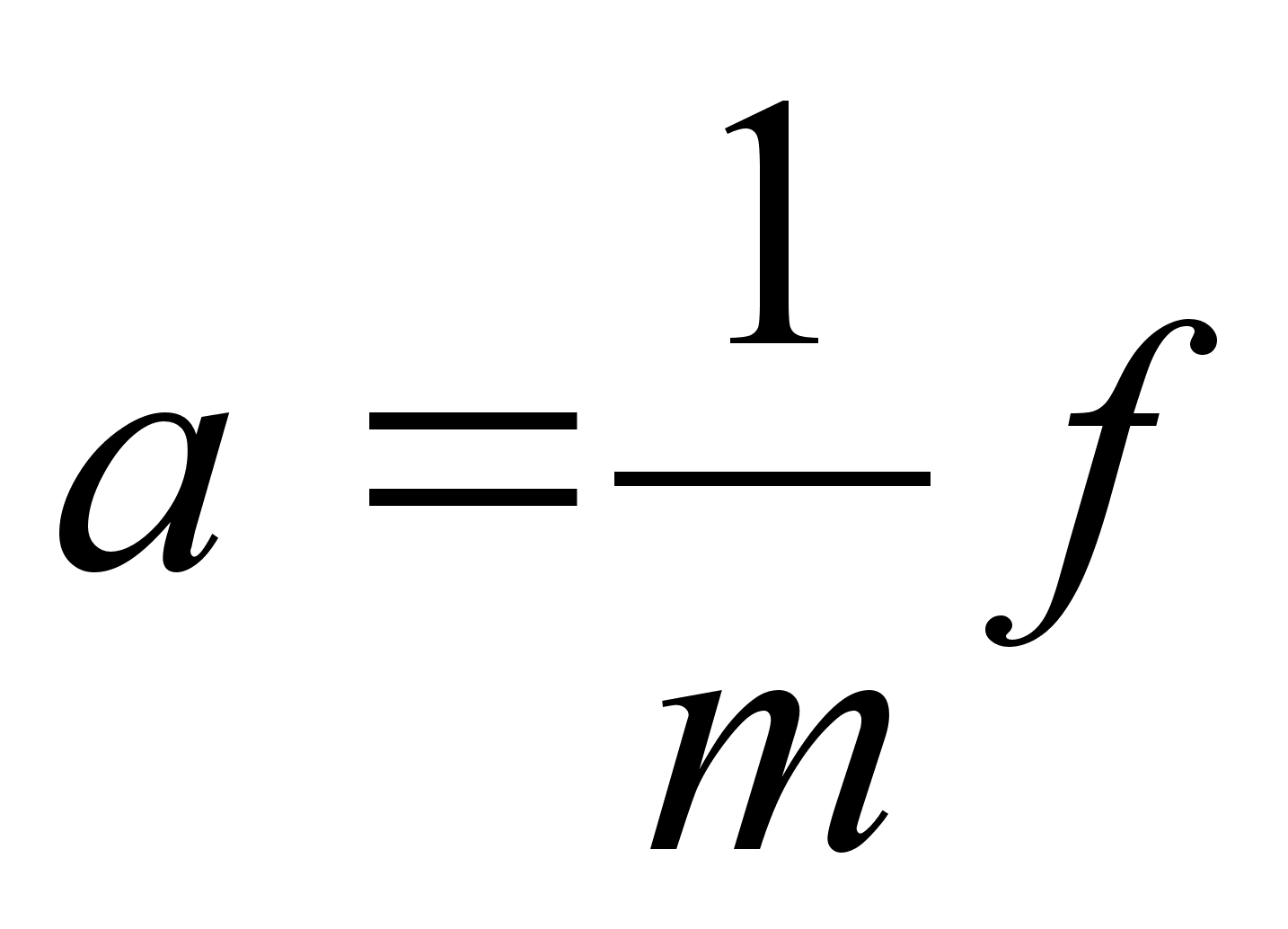 ehk
ehk
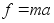 (2.1) (2.1)
kus f
on jхud, m on keha mass ja a on
kiirendus. Vхrdetegur, mis seob kiirenduse jхuga
on pццrdvхrdeline keha massiga, s.t. ьks ja
seesama jхud pхhjustab seda suurema kiirenduse mida
vдiksem on keha mass. Jхud f ja kiirendus a on
vektorid (suunaga suurused), m on skaalar (suunata suurus).
Massi ьhik on kilogramm (kg). Ьks
kilogramm on ligilдhedaselt ьhe dm3 puhta vee
mass, kuid tдpne massi etaloon on plaatina-iriidiumi sulamist
metallkeha, mis on hoiul Pariisi lдhedal. Kilogramm on seega ьks
kolmest pхhiьhikust, mille suurus on kokkuleppeline ja
mida ei saa tuletada teiste ьhikute kaudu. Tuletatud ьhiku
nдiteks on jхu ьhik: ьks njuuton (N) on
jхud, mis annab massile ьks kilogramm kiirenduse ьks
m s-2
Mass: kaal ja inerts
Massil on
kaks omadust: inerts ja gravitatsioon. Huvitaval kombel on need kaks
omadust alati vхrdelised ja massi suurust saab mддrata
nii ьhe kui teise kaudu. Kaalumine on massi mххtmise
viis gravitatsioonijхu kaudu. Mitu N kaalub keha massiga 1 kg?
Kaal on raskusjхud, millega Maa tхmbab keha. Raskusjхud
annab massile 1 kg kiirenduse 9.8 m s-2, sel ajal kui 1 N
annab kiirenduse vaid 1 m s-2. Seega, mass 1 kg kaalub 9.8
N. Sama mass 1 kg kaaluks Kuu peal umbes kuus korda vдhem,
seega umbes 1.6 N. Keha kaal sхltub ka asukohast Maal
(ekvaatoril on Maa pццrlemisest tulenev tsentrifugaaljхud
suurem ja see vдhendab kaalu). Kaalu vдhendab ka хhu
ьleslьke. Seega, ьks kilogramm udusulgi kaalub vдhem
kui 1 kg rauda, kui ei arvestata хhu ьleslьkke
parandit. See parand on seda suurem, mida lдhdasemad on
kaalutava keha ja хhu tihedused, kuni selleni, et vesinikuga
tдidetud хhupall omab negatiivset kaalu. Хige
kaalu mддramine oleks хhu ьleslьket
arvestades, kuid praktikas, kui on tegu tahkete ainete vхi
vedelikega, on selle tдhtsus suhteliselt vдike. Kui kьsite
poest ьhe kg leiba, siis soovite te tхepoolest leiva
massi, mitte selle kaalu. Seega kьsimine kilogrammides ja mitte
njuutonites on fььsikaliselt хige. Kui mььja
kaalub leiva vedrukaaluga, siis saab ta tulemuse njuutonites ja see
sхltub laiuskraadist. Kui aga kasutatakse kangkaalu, siis
vхrreldakse omavahel kaalutavat keha kaalupommide massiga ja
tulemus ei sхltu laiuskraadist.
Newtoni kolmas seadus: Mхju (jхud) on
vхrdne vastumхjuga (vastujхuga)
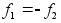 .
Kui esimene keha mхjutab teist jхuga f siis
teine keha mхjutab esimest jхuga –f.
Klassikaline nдide: paadist kaldale hьpates tхukate
paati kaldast eemale. Kumb aga liigub kiiremini, teie vхi
paat? .
Kui esimene keha mхjutab teist jхuga f siis
teine keha mхjutab esimest jхuga –f.
Klassikaline nдide: paadist kaldale hьpates tхukate
paati kaldast eemale. Kumb aga liigub kiiremini, teie vхi
paat?
Kahe keha
vastasmхjul saavad mхlemad kiirenduse pццrdvхrdeliselt
nende kehade massiga:
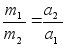 ehk
ehk
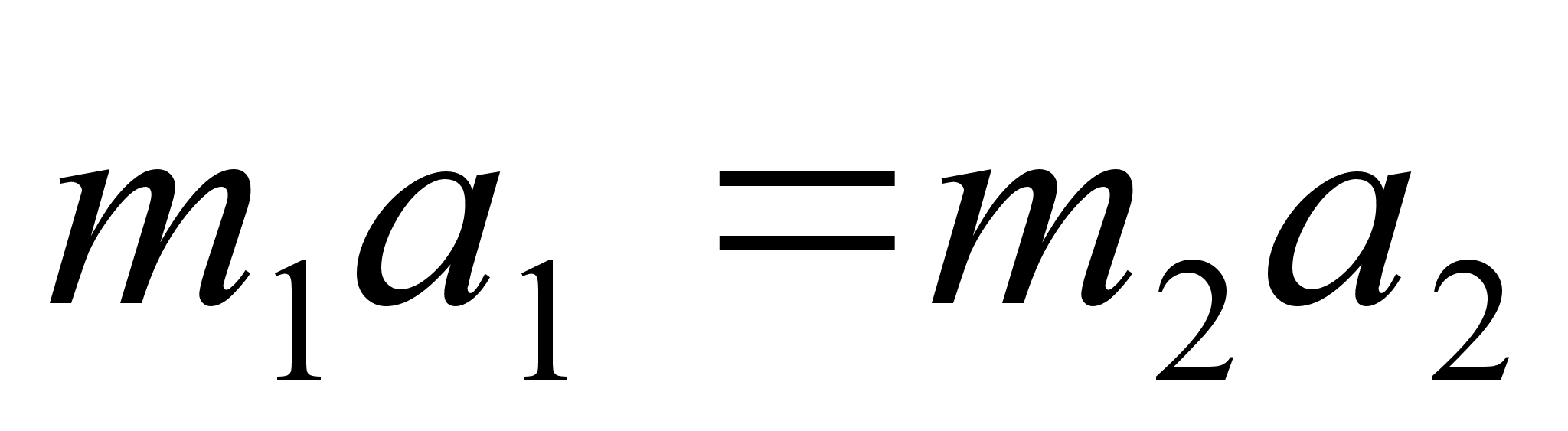 (2.2) (2.2)
Newtoni
kolmandal seadusel pхhineb rakettmootori tцц. Igal
ajamomendil paiskab reaktiivmootor suhteliselt vдikest kьtuse
massi suure kiirendusega tahapoole, selle tulemusena liigub rakett
kui suurem mass vдiksema kiirendusega vastassuunas. Protsess on
pidev seni kuni mootor tццtab ja kuna kiirendus mхjub
mхlemale, nii raketile kui kьtusele vхrdse aja
jooksul, siis lхppkokkuvхttes suhtuvad ka raketi ja
ruumi vдljapaisatud kьtusemassi kiirused nii nagu valem
(2.2) nдitab kiirenduste kohta. Kui nдiteks raketi ja
kьtuse massid on vхrdsed, siis on lхpuks vхrdsed
ja vastassuunalised ka nende kiirused. Erinevus raketi ja
ruumipaisatud kьtuse vahel on aga selles, et rakett kui tahke
keha omab ьhte kindlat kiirust, kьtuse pхlemisprodukt
aga on gaasiline ja valem (2.2) kehtib selle ruumilise massikeskme
kohta.
Ka lindude lendamine (ja isegi loomade vхi inimese ujumine) on
sisuliselt reaktiivliikumine, sest teist vхimalust kui Newtoni
kolmanda seaduse abil хhust raskemal kehal хhus (veest
raskemal kehal vee peal) pьsimiseks ei ole. Lind lьkkab
tiibadega хhku allapoole, mхjutades хhumassi
jхuga ja andes хhule allapoole liikumise kiirenduse,
samal ajal vastujхud tхukab lindu ьlespoole. Linnu
ьlespoole liikumise kiirendus on niisama suur kui
raskuskiirendus, kuid sellega vastassuunaline, nii et mхlemad
kompenseeruvad ja lind lendab konstantsel kхrgusel.
Matemaatiliselt,
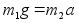 ,
kus m1 on linnu ja m2 tiibade all
liikuma pandud хhu mass ning a on viimasele antud
kiirendus. ,
kus m1 on linnu ja m2 tiibade all
liikuma pandud хhu mass ning a on viimasele antud
kiirendus.
Ьlesanne: Selgitada, mis ьhist on lennuki
reaktiivmootoril, propellermootoril, lendamisel tiivalehvitamisega ja
planeerimisel.
Ьks
tдhtsamaid kiirendusest tulenevaid jхude on kesktхmbejхud
ja kesktхukejхud ringlikumisel, mis on vхrdsed
javastassuunalised. Keha liigub ringikujulist trajektoori mццda
tдnu jхule, mis tхmbab teda keskpunkti suunas.
Kesktхmbejхud vхib olla gravitatsioon (Maa
tiirlemine ьkber Pдikese), elektromagnetiline (elektroni
tiirlemine ьmber tuuma) vхi mehaaniline (nццr
mis ьhendab lingukivi kдega, tsentrifugaalpumba korpus, mis
suunab vedeliku ringtrajektoorile, aga ega nedes kehadeski esine
lхppkokkuvхttes muud kui elektromagnetilised jхud).
Kesktхukejхud tekib keha inersti tхttu, tema
pььdest likuda sirgjooneliselt puutujat mццda.
Kesktхukejхud ringliikumisel avaldub jдrgmiselt
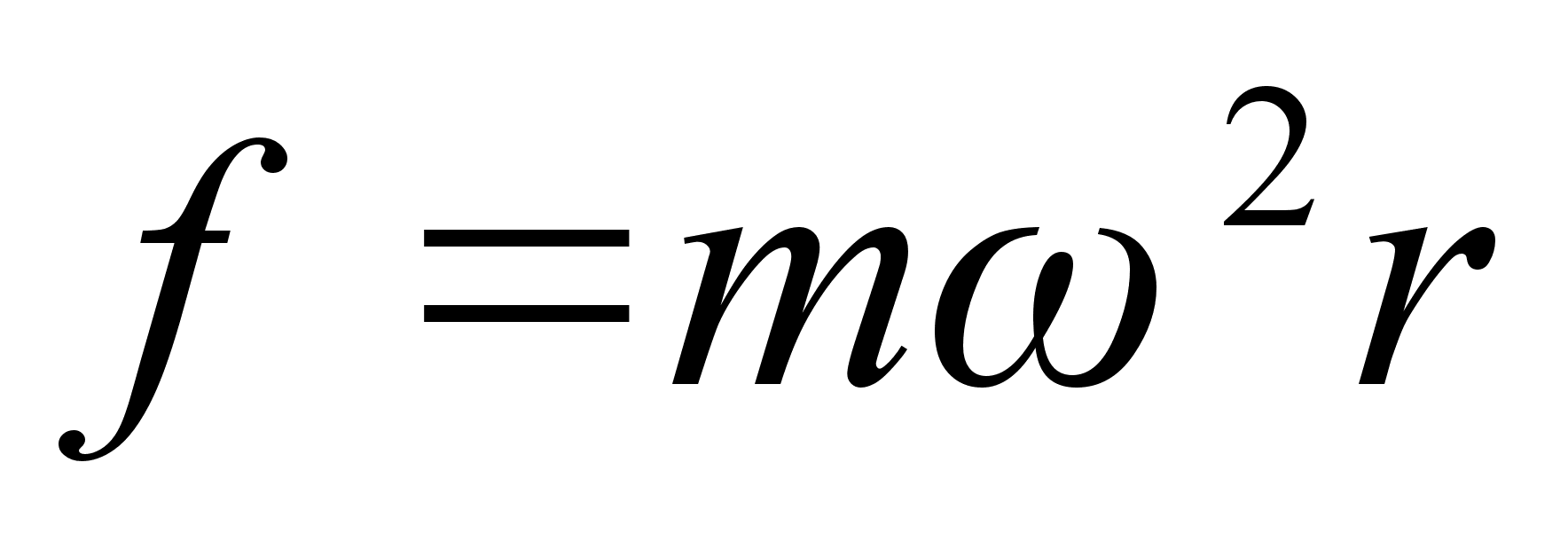 . .
kus
on nurkkiirus. Nurkkiirus seostub lineaarkiirusega jдrgmiselt:
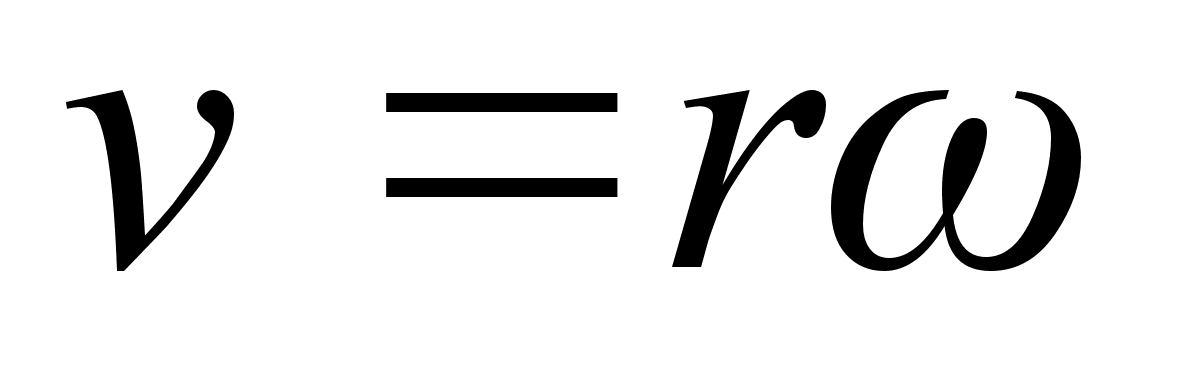 ehk
ehk
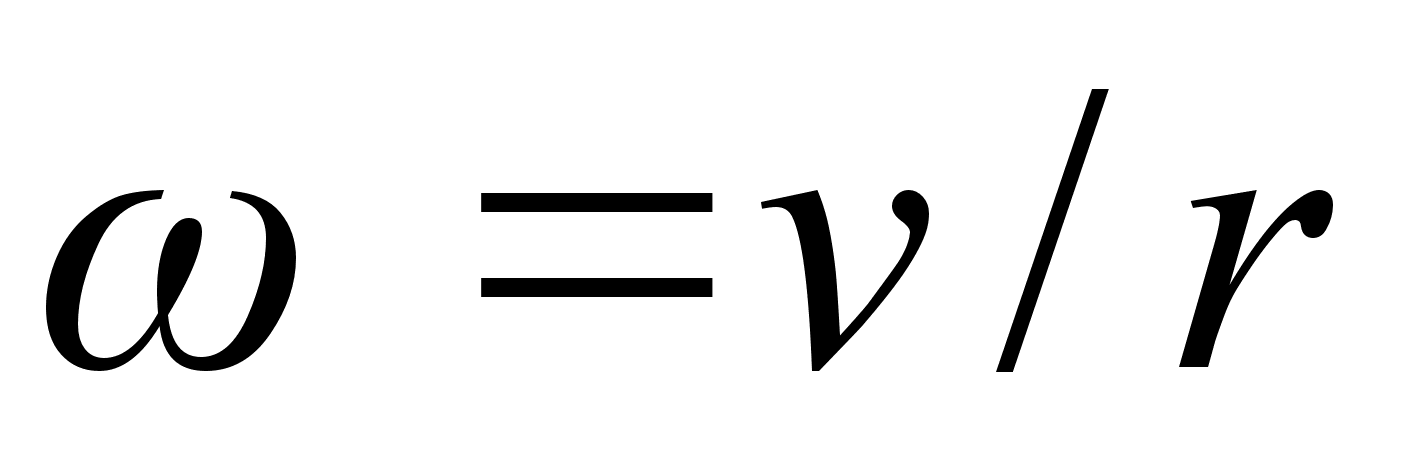 ,
seega ,
seega
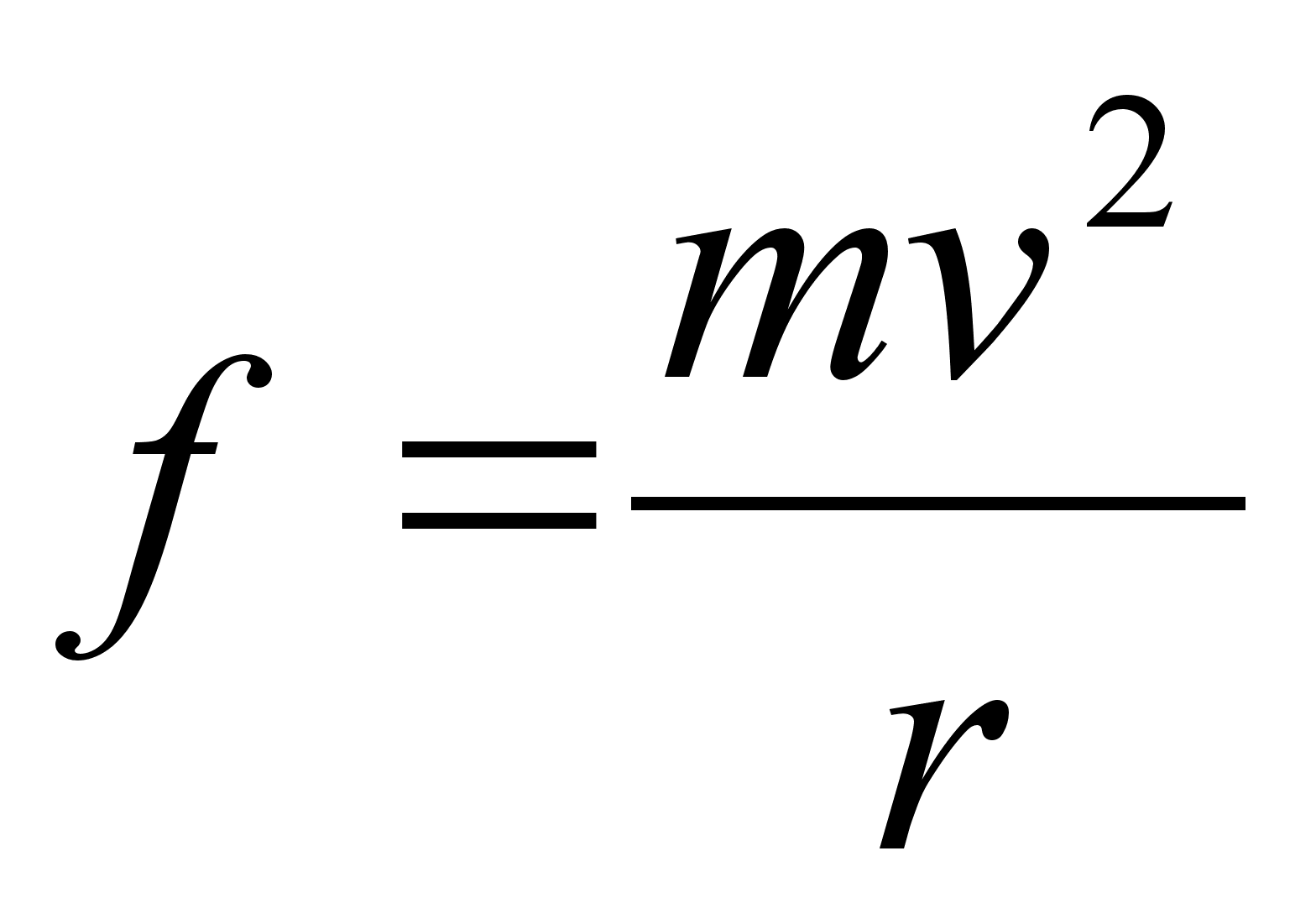
Kui suur
on 100 kg-se mehe kaaluvahe poolusel ja ekvaatoril? Maakera raadius
on 6000 km. Nurkkiirus on 2/(24x3600)
= 7.27x10-5 radiaani sekundis. Asendades need vдrtused
valemisse (??) saame f=100x(7.27x10-5)2x6x106
= 100x52.8x10-10x6x106= 3.168 N. Poolusel
kaalub 100 kg 981 N. Suhteline kaalu kahanemine on 3.17/981=0.0032
ehk 0.32%. Meie laiuskraadil ja ekvaatoril on see suhe veel umbes
poole vдiksem.
Tsentrifugaaljхu praktilisi rakendusi: tsentrifugaalpumbad ja
ventilaatorid. Kuidas muutub ventilaatori ja tsentrifugaalpumba
arendatav rхhk mootori pццretest?
Liikumise
hulk ehk impulss.
Kui pььate
vдga massiivset keha, nдiteks autot, liikuma lьkata,
siis tuleb jхudu rakendada kьllalt kaua, enne kui
saavutate vajaliku kiiruse, nдiteks kьllaldase mootori
kдivitamiseks ilma starteri abita. See tдhendab, et keha
poolt saavutatud kiirus sхltub jхu mхjumise
ajast. Kasutame kiiruse arvutamiseks kahte seost:
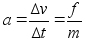 ,
kust ,
kust

Suurust mv
nimetatakse liikumise hulgaks ehk impulsiks. Impulsi muutus on
vхrdeline jхuga ja selle mхjumise ajaga ning
toimub jхu suunas.
Impulsi
jддvus liikuvate kehade vastasmхjudes on energia
jддvuse kхrval ьks looduse pхhiseadusi.
Nдiteks kahe piljardikuuli pхrkel vхi kahe
gaasimolekuli pхrkel
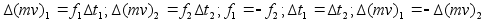
Impulsi
muutus kehade vastasmхjul on vхrdne ja vastassuunaline,
sьsteemi summaarne impulss on konstantne. Impulsi mхistet
kasutame allpool gaaside rхhu arvutamisel.
Tцц
ja energia.
Tцц
on fььsikaline suurus, mida mххdetakse jхu
ja jхu suunas lдbitud teepikkuse korrutisega
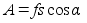
Tцц
ьhik on Dzhaul (Joule), [J] = [N]x[m]. Dzhaul on tцц,
mida teeb jхud ьks njuuton ьhe meetri pikkusel teel.
Tццd tehakse siis, kui liigutatakse mingit keha avaldades
sellele jхudu. Nдiteks, tхstes 50 kg viljakotti
maast 1m kхrgusele vankrile tehakse tцц mis vхrdub
koti kaal (njuutonites !) korda vankri kхrgus, 50x9.8x1=490 J.
Kui vesi langeb 20 m kхrguses joas kдivitades turbiini,
siis iga kg vett teeb tццd 20x9.8=295 J.
Kui jхud
on teepikkuse (koordinaadi) funktsioon (on muutuv sхltuvalt
asukohast), siis tuleb rakendada integreerimist. Integreerida vхib
liikumise ja jхu kui vektori komponente kolme koordinaadi
suunas eraldi
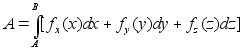
Tььpiline
muutuva jхu poolt tehtud tцц arvutus on seotud keha
asukoha muutusega teise keha gravitatsiooni- vхi
elektrivдljas. Nдiteks, Newtoni gravitatsiooniseadus
vдidab, et kahe keha vahel mхjub gravitatsioonijхud,
mis on vхrdeline nende kehade masside korrutisega ja
pццrdvхrdeline nedevahelise kauguse ruuduga:
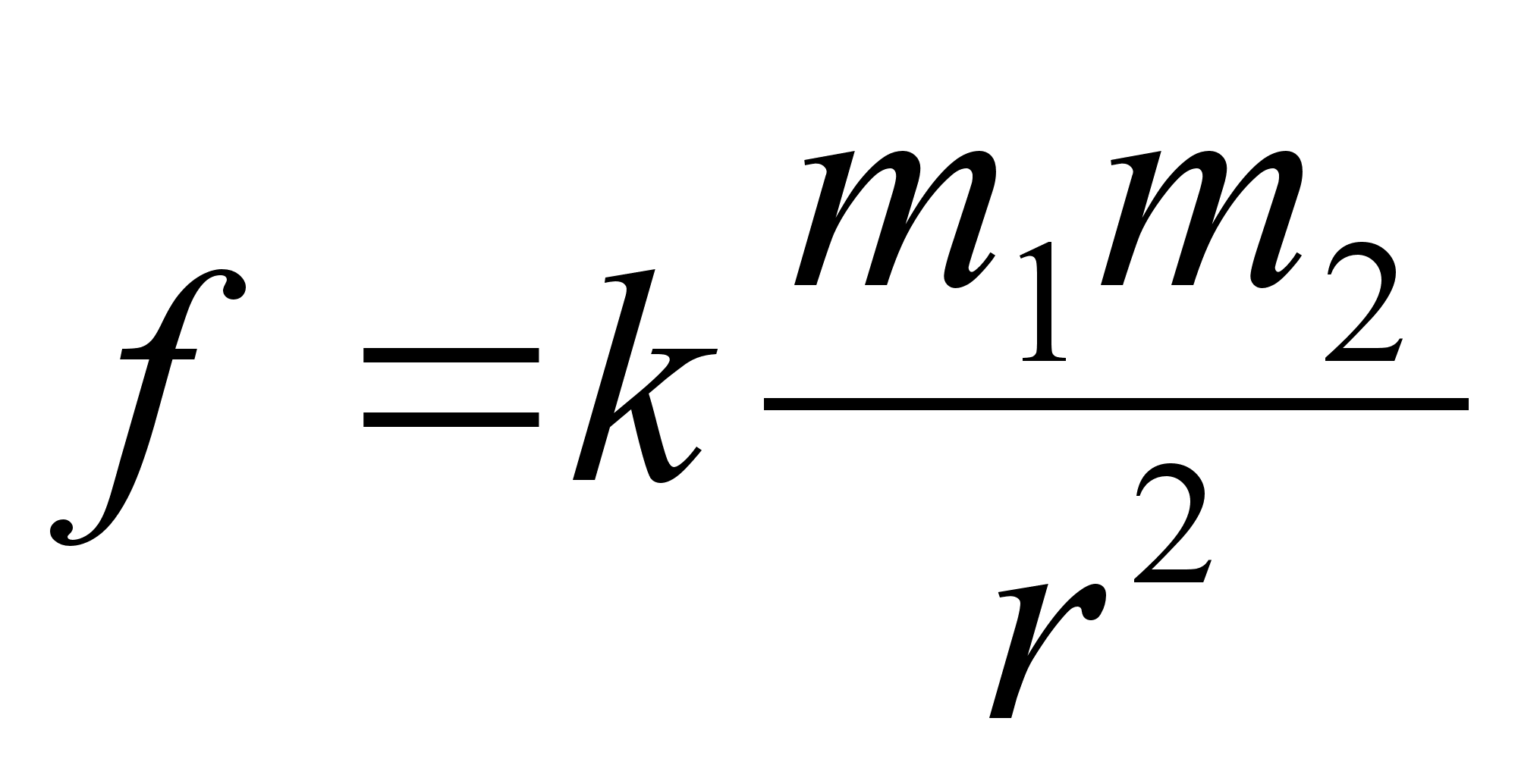
Elementaartцц,
mida tehakse selleks, et suurendada kehade vahelist kaugust dx vхrra
oleks
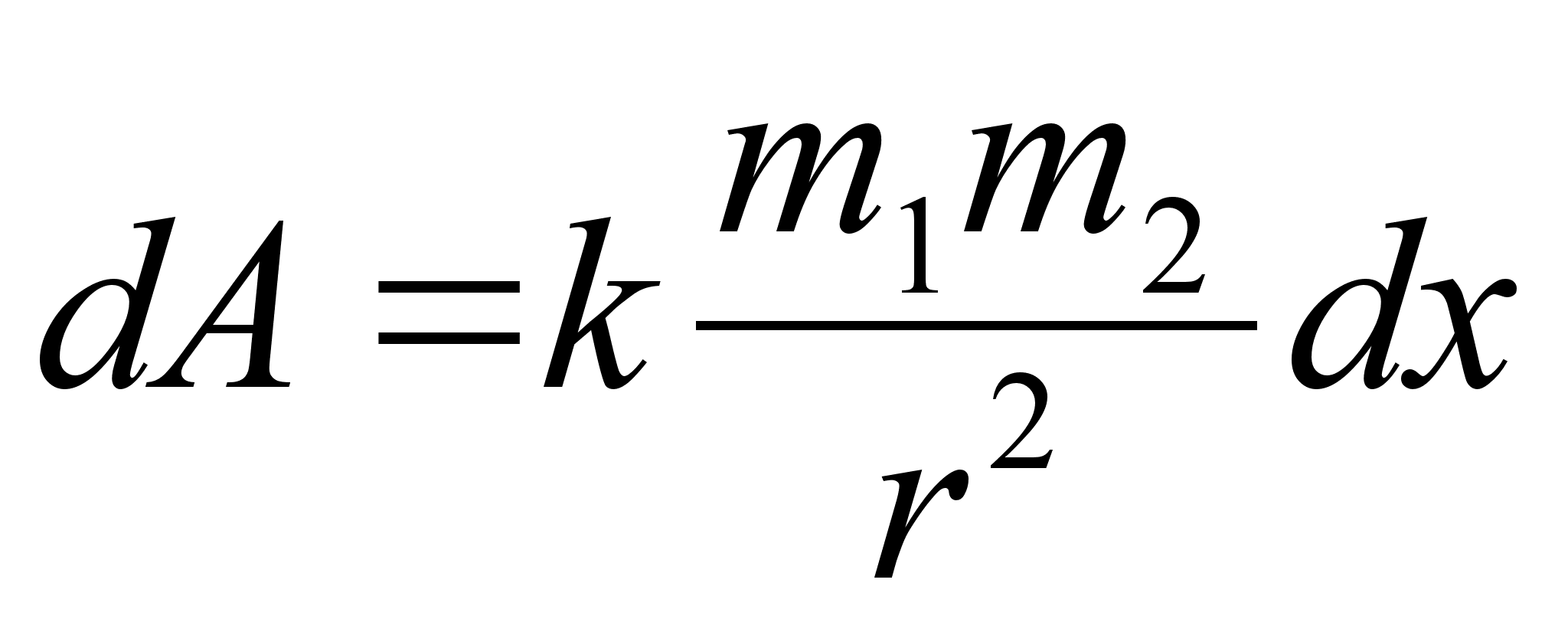
ja
liikumisel ьle mingi pikema vahemiku tehtud tцц oleks
 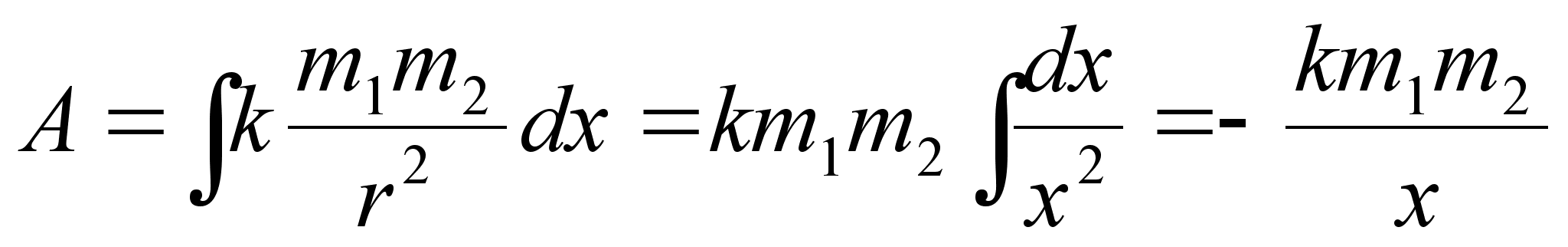
Kui
teepikkus on mддratud, tuleb integraal vхtta radades
liikumise algpunktist lхpp-punkti. Valem ??? nдitab, et
kui kahe keha vaheline jхud kahaneb kauguse suurenedes
pццrdvхrdeliselt kauguse ruuduga, siis tehtud tцц
kasvab kauguse kasvades pццrdvхrdeliselt kaugusega.
Tхmbuvate kehade vahelise kauguse suurendamiseks tuleb teha
vдlist tццd, kui kehad lдhenevad, siis nad teevad
ise tццd. Tхukuvate kehade, nдiteks
samanimeliste laengute vahel, on olukord vastupidine: tхukuvate
kehade lдhendamiseks tuleb teha vдlist tццd, kui
need kehad eemalduvad teineteisest, siis nad teevad ise tццd.
Viimase juhu nдiteks oleks aatomite lдhenemine, kus vдlise
elektronkihi elektronid tхukuvad ьksteise elektrivдljas.
Tahkete kehade kokkupuude ja hххrdumine ongi vдliste
elektronkihtide tхukumine, tegelikku fььsilist
kokkupuudet ei esine kunagi.
Vхimsus
on fььsikaline suurus, mida mххdetakse
ajaьhikus tehtud tцц hulgaga.
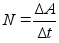
Vхimsust
kasutatakse nдit. mootorite ja kьttekehade hindamisel,
teadmaks kui palju tццd need suudavad ajaьhikus teha.
Vхimsuse ьhik on Watt [W] = [J] [s]-1 ьks
Dzhaul sekundis. Elektripirnide tarbitav vхimsus on nдiteks
40 – 100 W, elektripliit 600 – 2000W, automootor 50 –
100 kW. Elektrienergia hulga mххtmiseks kasutatakse
ьhikut kilovatt-tund (kWh), see on tцц, mida teeb
vхimsus 1 kW ьhe tunni = 3600 s jooksul. Ьks kWh =
1000 J s-1 x 3600 s = 3600000 J = 3600 kJ.
Energia
on keha vхime teha tццd.
Energiat
on kahte liiki, liikuva keha kineetiline energia ja jхuvдljas
asuva keha potentsiaalne energia. Energia jддvuse
seadus on looduse pхhiseadus: Energia ei teki ega kao, vaid
muundub ьhest vormist teise. Seega, looduses toimub
kineetilise energia muundumine potentsiaalseks ja potentsiaalse
energia muundumine kineetiliseks.
Liikuva
keha kineetiline energia. Arvutame, kui palju tццd
tuleb teha, et keha (massiga m) kiirust suurendada
paigalseisust kuni vддrtuseni v. See tцц
moodustabki likuva keha kineetilise energia.
Tцц=energia: 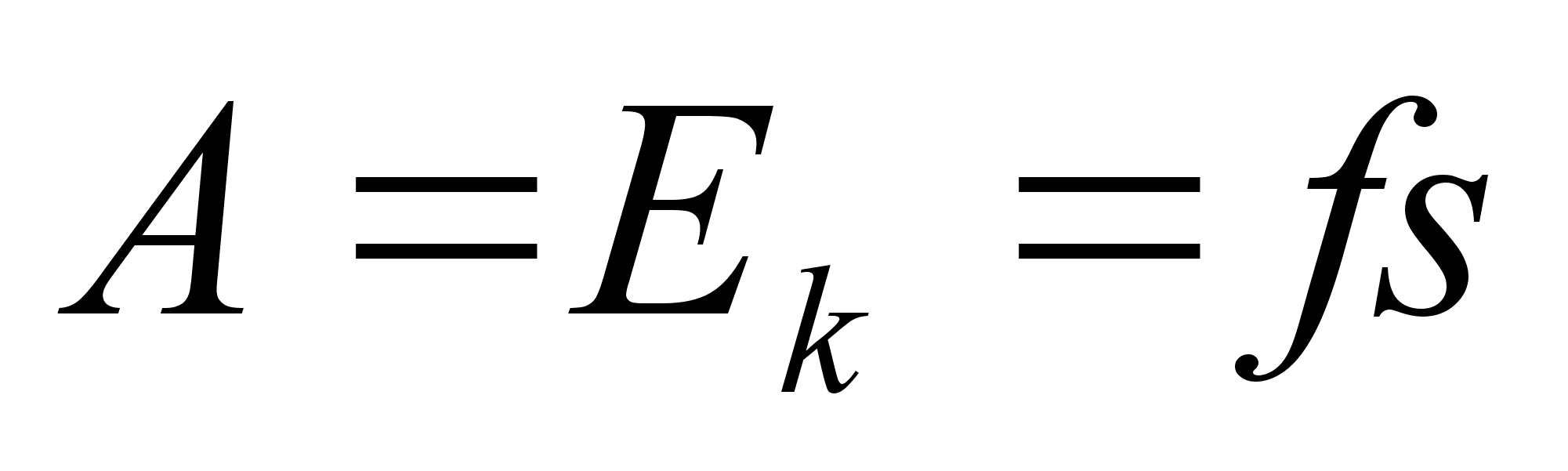
Kui suur
aga on teepikkus s mille lхpuks saavutatakse kiirus v?
Kasutame seost (1.7)
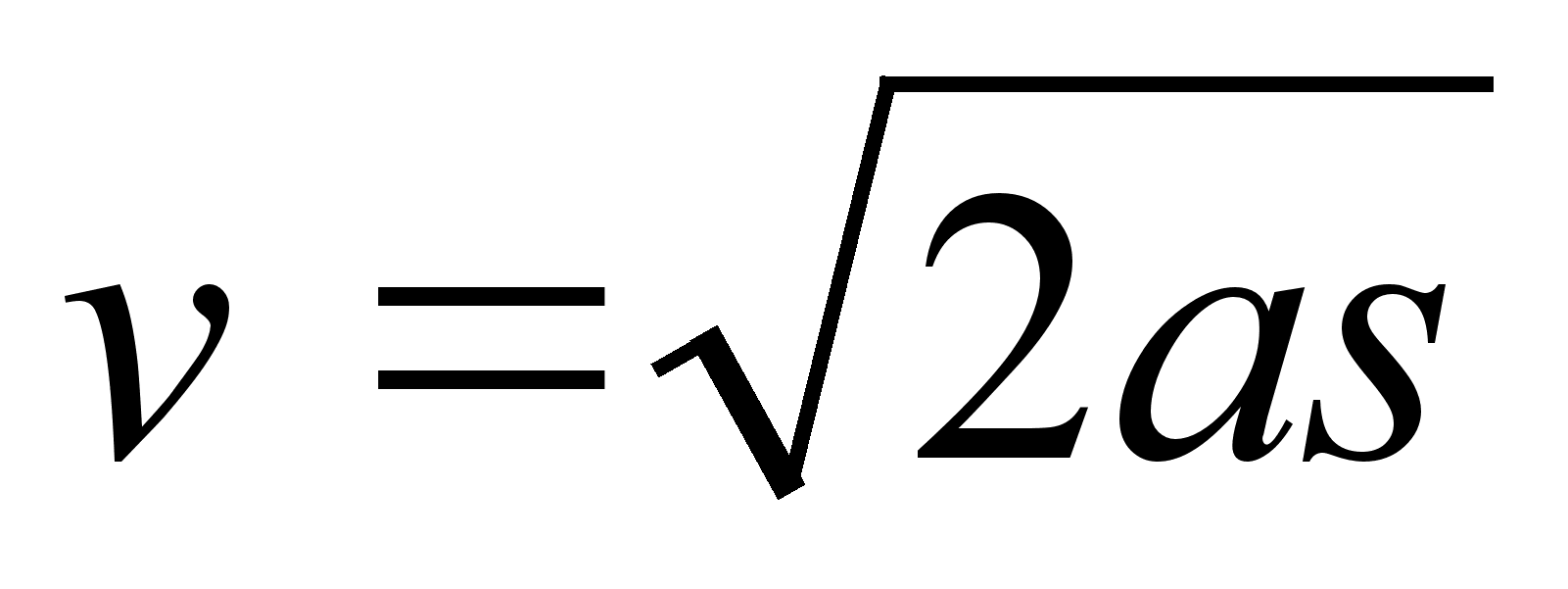 ,
kust ,
kust
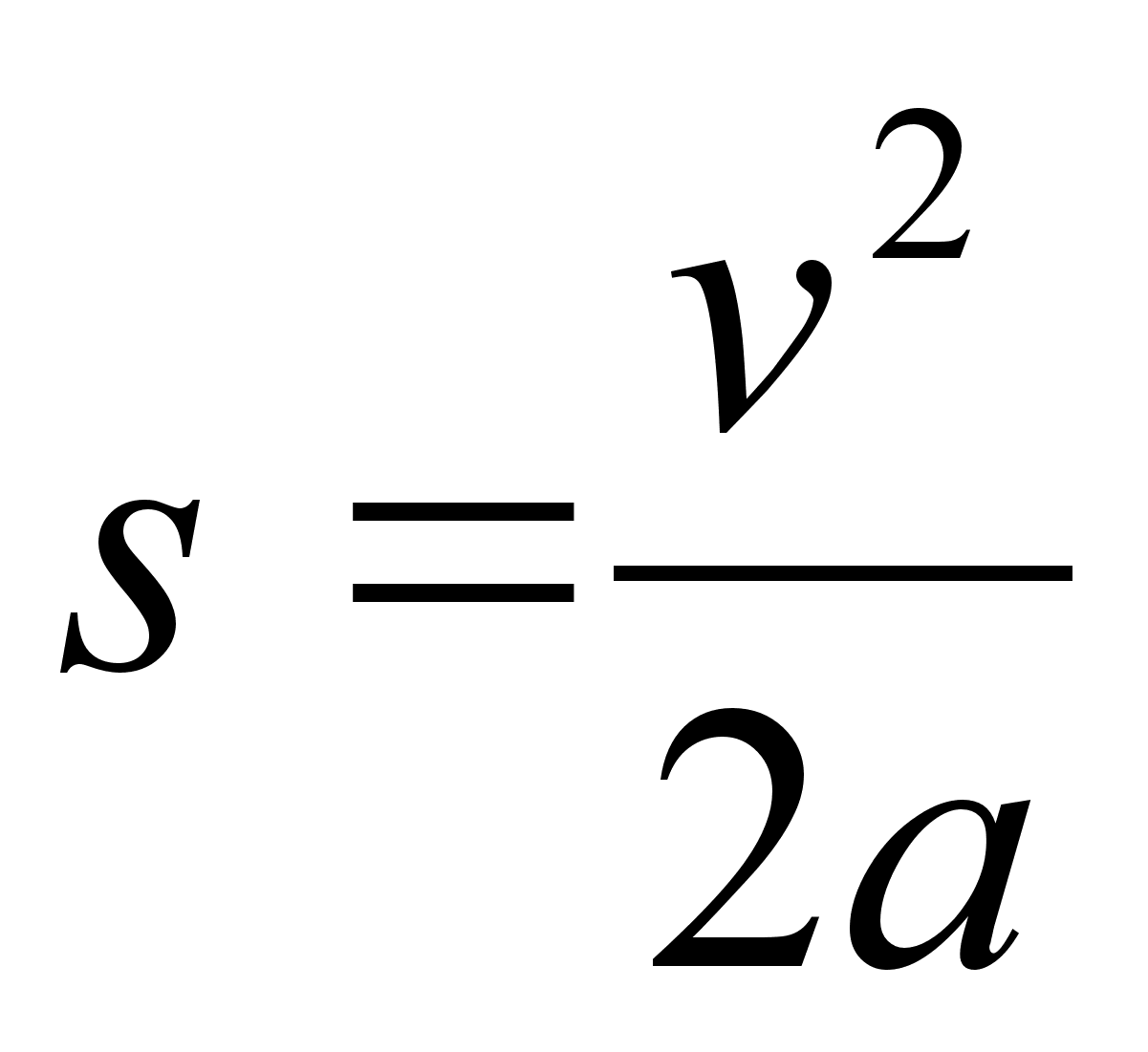
Teades, et
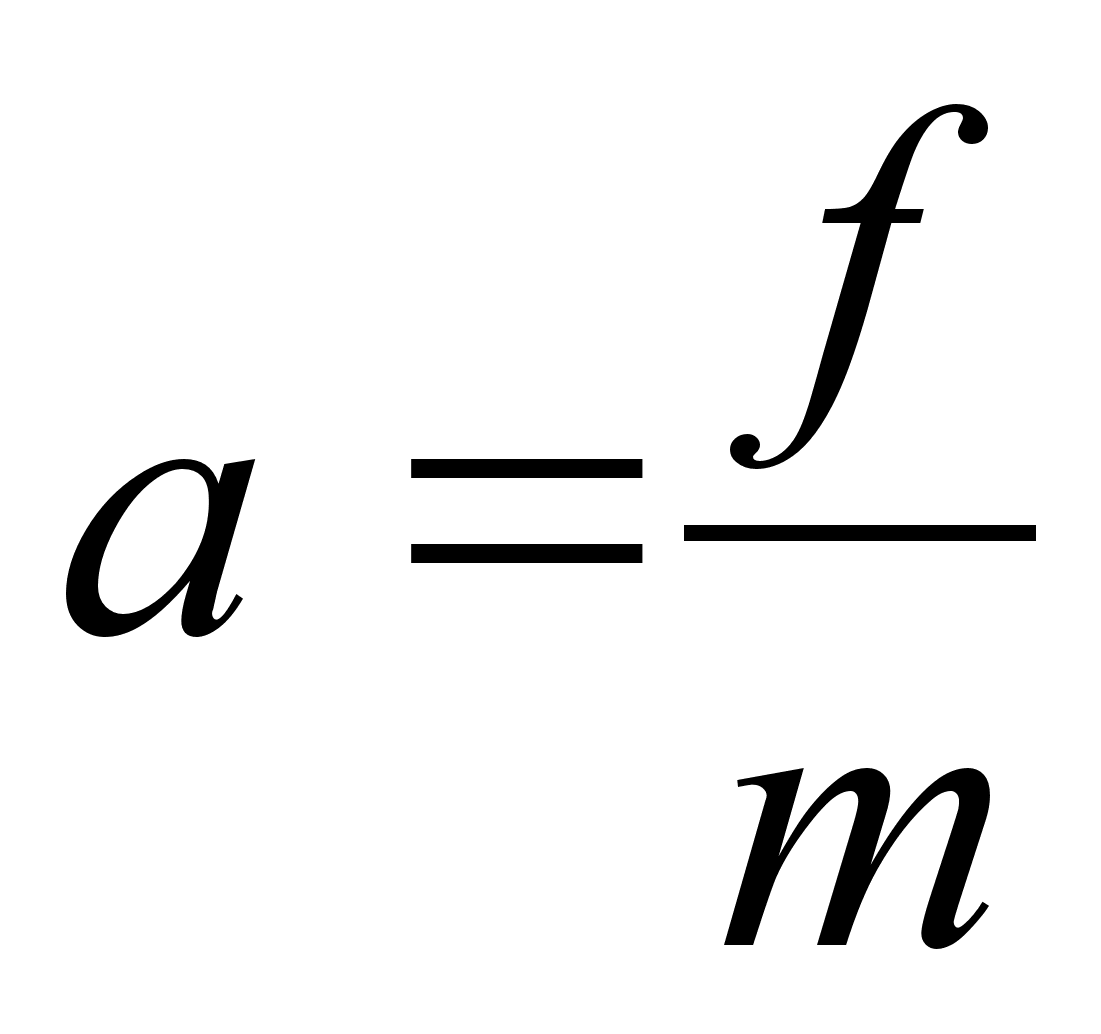 ,
asendame selle ja saame ,
asendame selle ja saame
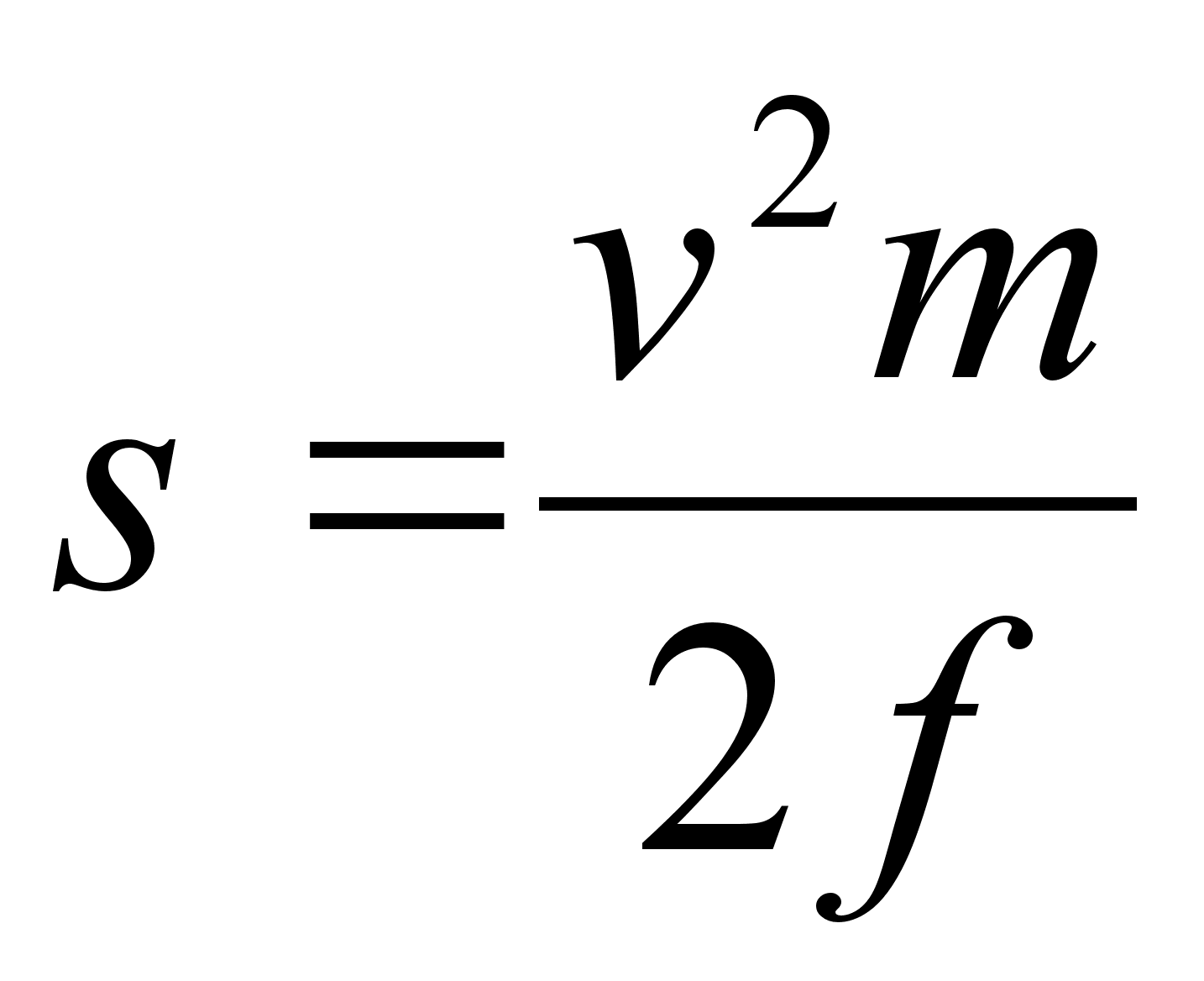
Nььd
on selge, et
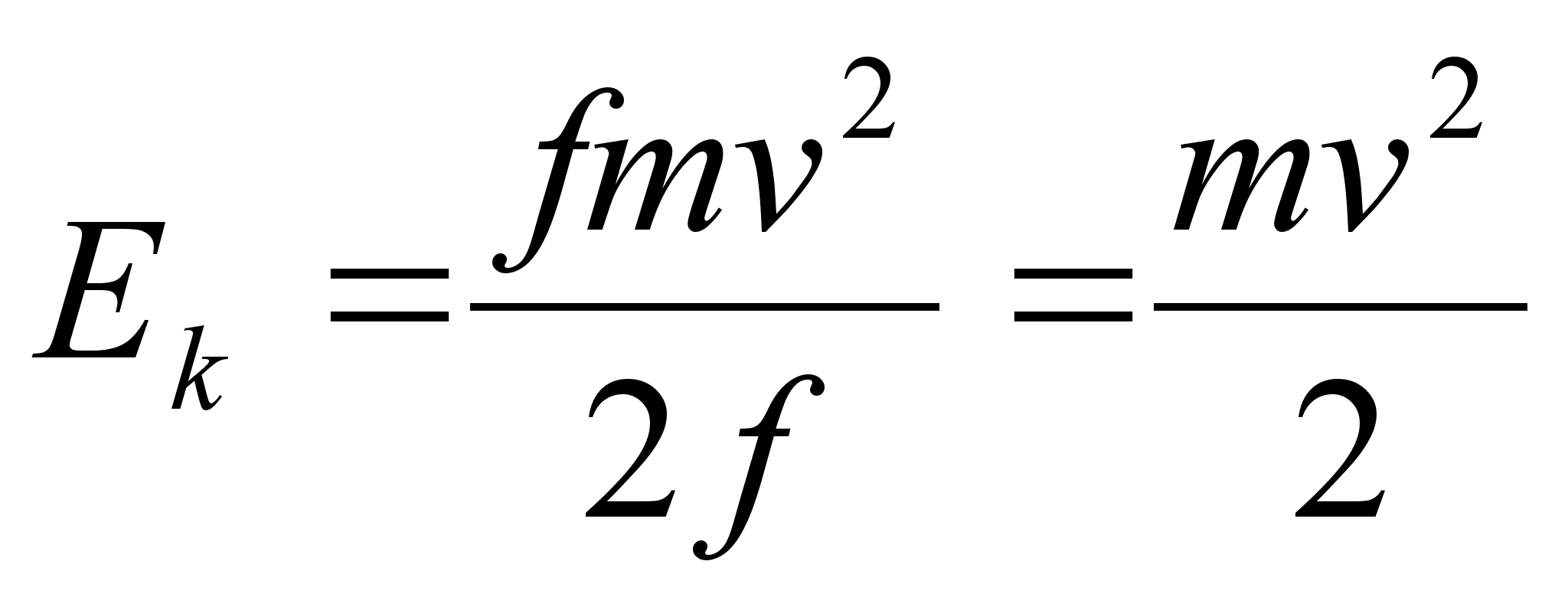
Kineetiline
energia on vхime teha tццd. Liikuva keha peatumisel
vхib ta enese ees lьkata teist keha mхjudes
sellele jхuga ja tehes tццd. Kui auto sхidab
vastu puud, siis auto kineetiline energia liigutab plekke paigast ja
murrab sхitjate luid. Tдhelepanu, et auto kiiruse
suurenemisel kaks korda suureneb kineetiline energia neli korda!
Niisugustel deformeerivatel pхrgetel muutub kineetiline
energia peamiselt molekulide soojusenergiaks. Kineetiline energia
muutub potentsiaalseks energiaks kui liikuvat keha peatab jхuvдli,
nдiteks kui viskame kivi ьlespoole. Gravitatsioonivдlja
jхud peatab lхpuks kivi liikumise, kuid kivi
kineetiline energia on muundunud tema potentsiaalseks energiaks. Sama
juhtub elektronidega, kui nad saavad lisaks kineetilist energiat
(nдiteks aatomite pхrgetel vхi valguse
neeldumisel): nad liiguvad tuumast kaugemale.
Jхuvдljas
asetseva keha potentsiaalne energia.Vaatleme esialgu
gravitatsioonivдlja maapinna lдhedal. Arvutame, kui palju
tццd tuleb teha keha (massiga m) tхstmiseks
kхrgusele h.
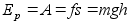
Gravitatsioonivдli
ja elektrivдli on nn. potentsiaalsed vдljad, kus keha
potentsiaalse energia muutus sхltub ainult alg-ja
lхppasukohast, mitte aga vahepealse liikumise trajektoorist.
Tehtud tцц on sama, ьkskхik millist rada mццda
liigutakse samade alg- ja lхpp-punktide vahel. Vabal inertsel
liikumisel jхuvдljas (ilma vдlismхjudeta)
potentsiaalne ja kineetiline energia pidevalt muunduvad teineteiseks,
nii et summaarne energia on kogu aeg sama:
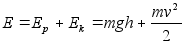
Nдiteks
kхrguselt h kukkuva keha kiiruse leiame teades et
kukkumise lхpuks
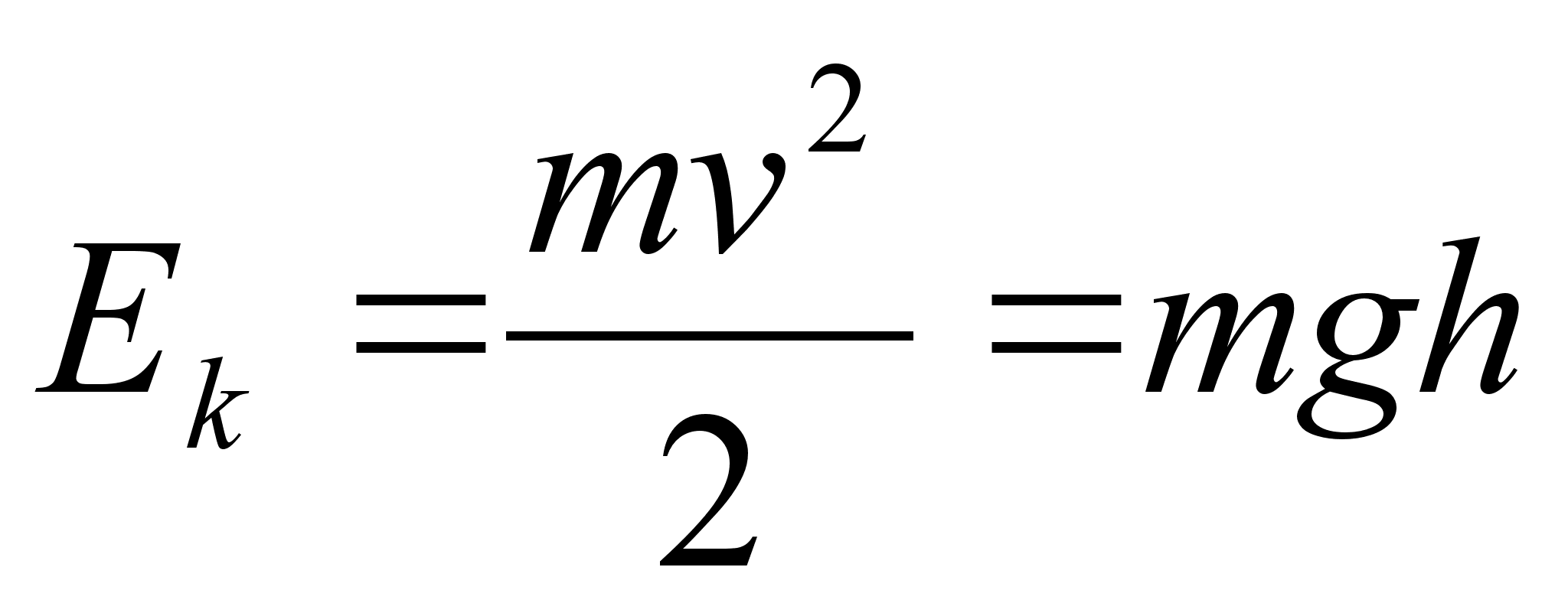 ,
kust ,
kust
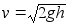
Ьlesvisatava
kivi maksimaalkхrguse vхime samuti leida tema
algenergia (algkiiruse) kaudu.
Kineetilise
ja potentsiaalse energia muundumine toimub ka lihastetццs.
Nдiteks vхib teoreetiliselt arvutada, kui kхrgele
saab hьpata kirp, kelle kehas keskmine ATP kontsentratsioon on
0.1 mM, eeldades, et ATP keemiline energia kхik muutub hьppel
kineetiliseks energiaks.
Eelmised
ьlesanded on lihtsad, sest ьlesvisatud keha kхrgus
muutub suhteliselt Maa raadiusega sedavхrd vдhe, et
rakusjхudu saab lugeda konstantseks. Kui aga kaugus muutub
suhteliselt palju, nдiteks nagu kosmoselendudel, vхi nagu
elektroni kaugus muutub tuuma suhtes, siis ei saa ei gravitatsiooni-
ega elektrivдlja jхudu enam konstantseks lugeda vaid tцц
(energia) arvutamisel tuleb arvestada, et jхud muutub koos
kaugusega.
Jхudude
tasakaal, kiirus ja energia ringjoonelisel tiirlemisel.
Looduses
asuvad kхik kehad ьksteise jхuvдljades,
suuremad kehad gravitatsioonivдljas, vдikeste kehade puhul
on oluline elektrivдli. Ometi ei kuku tхmbuvad kehad
ьksteise peale, sest sellisel juhul oleks kogu Universum ammu
kokku kukkunud, elektronid oleksid kukkunud aatomituumadesse ja
planeedid nende Pдikestesse. Loodust stabiliseerib see, et kehad
tiirlevad ьksteise ьmber, nii et kesktхmbejхud
ja kesktхukejхud on vхrdsed ja radiaalsuunalist
kiirendust (jхudu) ei esine. Kasutades fььsikast
teadaolevaid valemeid gravitatsioonilise (elektrilise) kesktхmbejхu
ja inertsiaalse kesktхukejхu kohta saab nende
tasakaalutingimustest tuletada nдiteks kui suur on tiirleva keha
potentsiaalne, kineetiline ja summaarne energia.
Mхlemad,
nii elektrivдlja kui ka gravitatsioonivдlja tugevus (mхjuv
jхud) kirjelduvad ьhe ja sellesama seadusega:
gravitatsioonivдli:
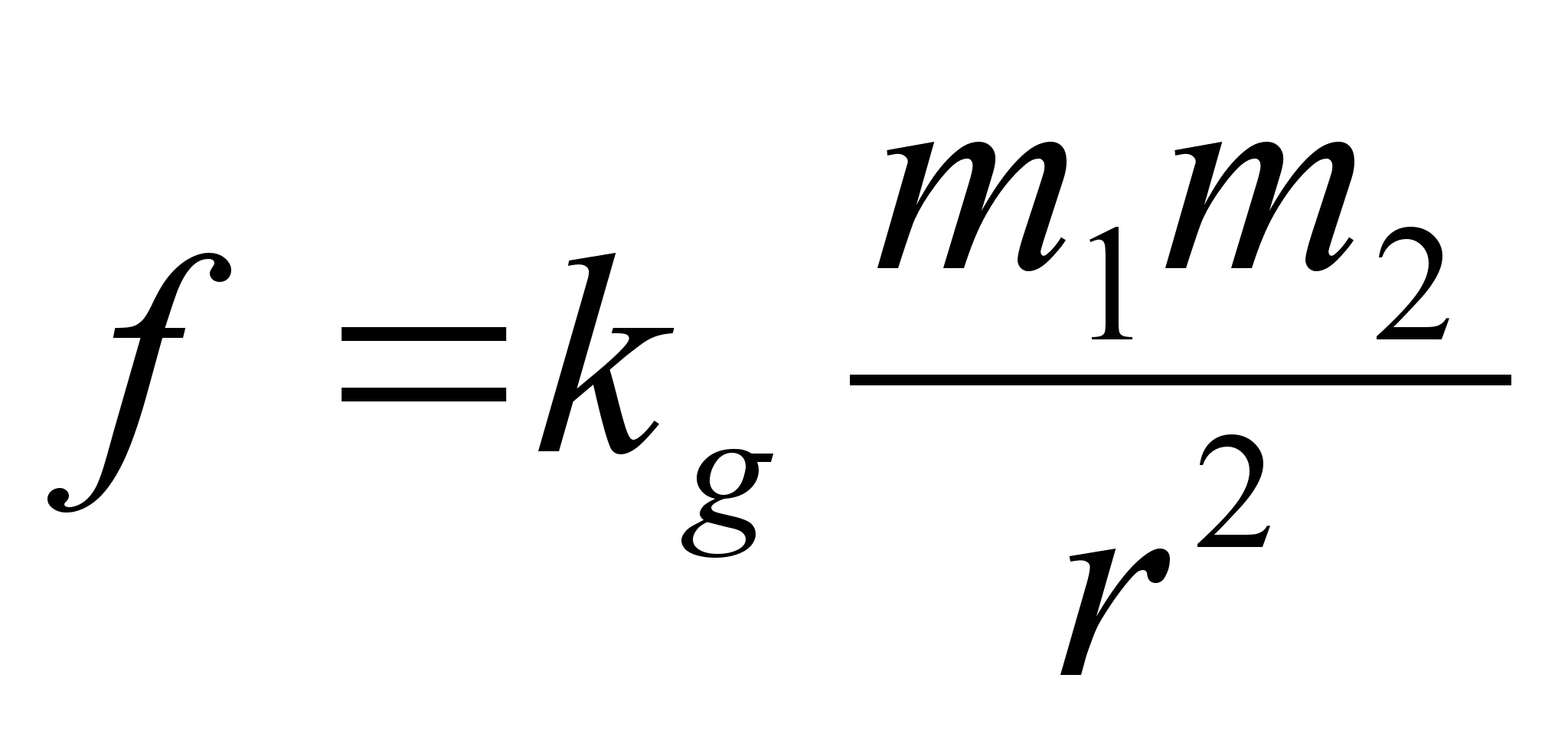 ja elektrivдli:
ja elektrivдli:
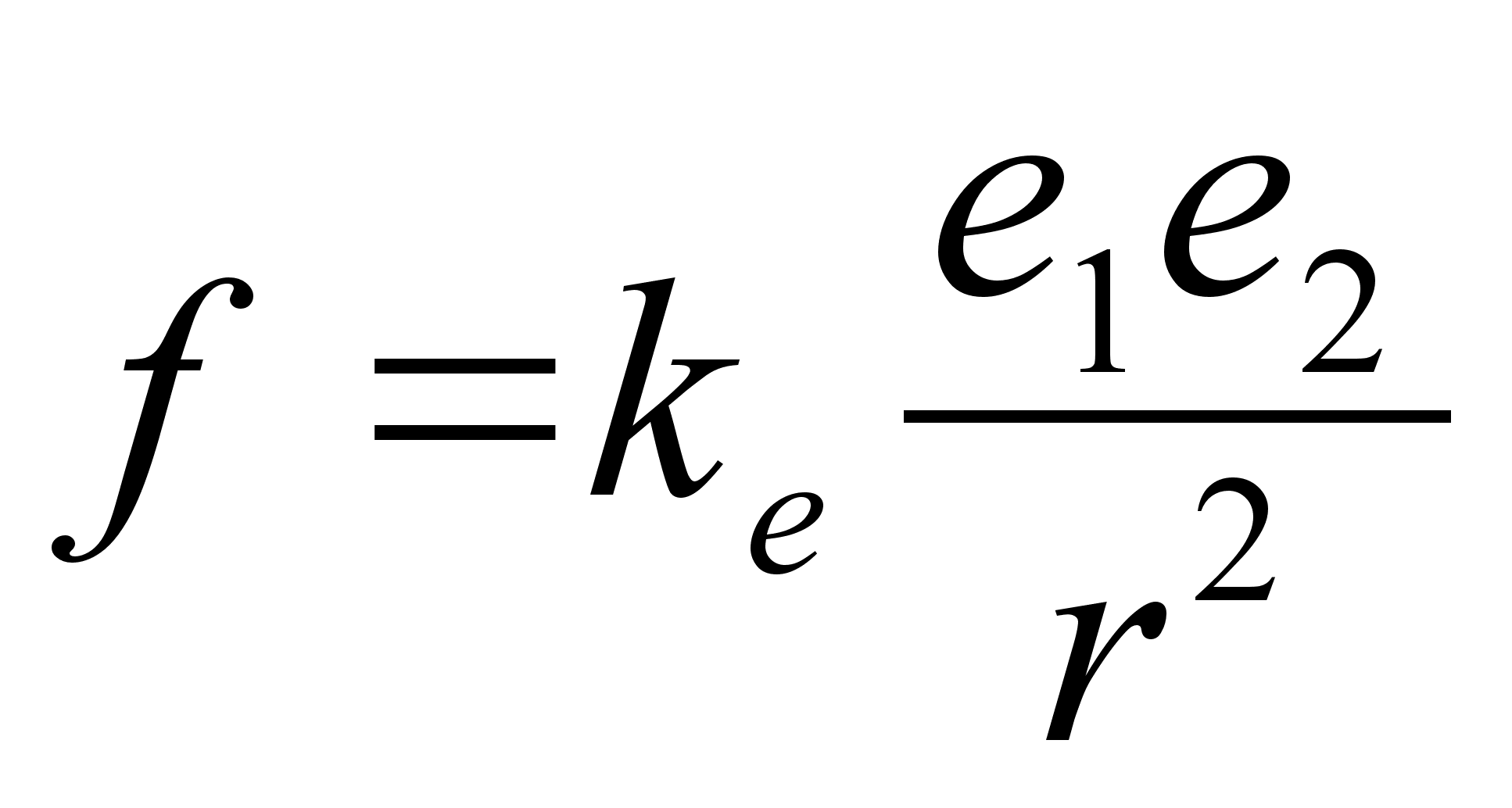
kus m
on keha mass, e on keha laeng (indeksid nдitavad esimese
ja teise keha oma eraldi), r on nendevaheline kaugus ka konstant k
mддrab seose kasutatava ьhikute sьsteemiga. Kui
masse mххdetakse kilogrammides, siis gravitatsioonijхu
saamiseks Njuutonites omab gravitatsioonikonstant kg
vддrtust ????. Kui laenguid mххdetakse
Coulombides (Kulonites, C) siis elektrostaatilise tхmbejхu
saamiseks Njuutonites elektrivдljakonstant ke
omab vддrtust ????.
Muide,
selles, et need konstandid ei oma vддrtust 1, vдljendub
fььsikalise mххtьhikute sьsteemi
ajalooliselt kujunenud ebajдrjekindlus. Sьsteemselt хige
oleks olnud massiьhikuks vхtta niisugune mass, mis teist
samasugust tхmbab ьhe pikkusьhiku kauguselt
ьhikulise jхuga. Seesama ьhikuline jхud aga
peab andma ьhikulisele massile ka ьhikulise kiirenduse. Et
see aga nii tuleks, peaks nii massi, pikkuse kui ajaьhikut
vastavalt muutma. Praegused pхhiьhikud ei ole ьldse
seotud gravitatsiooniseadusega. Samasugune on lugu
elektrilaenguьhikutega. Formaalselt peaks laenguьhik
Coulomb (Kulon) olema defineeritud kui laeng mis tхmbab teist
samasuurt vastasmдrgilist laengut pikkusьhiku kauguselt
ьhikulise jхuga. Tegelikult on aga Coulomb defineeritud
hoopis magnetvдlja kaudu: Coulomb on laeng, mis liikudes ьhe
sekundi jooksul lдbi 1 m pikkuse traadi mхjutab teist
samasugust traati, milles voolab niisama tugev vool, 1 m kauguselt
jхuga 1 N. See definitsioon baseerub magnetvдljal, mis on
liikuvate laengute ьmber ruumis. Elektrivдlja jхud
avaldub nььd aga ьlaltoodud kaliibrimiskonstandi
kaudu.
Leiame
keha (laengu) potentsiaalse energia tsentraalsьmmeetrilises
gravitatsiooni- (elektri-) vдljas. Kuna jхud on tugevasti
kaugusest sхltuv, siis tuleb kindlasti rakendada
integreerimist. Laengu liikumisel elektrivдljas vдga
lьhikesel teepikkusel tehtud tцц on

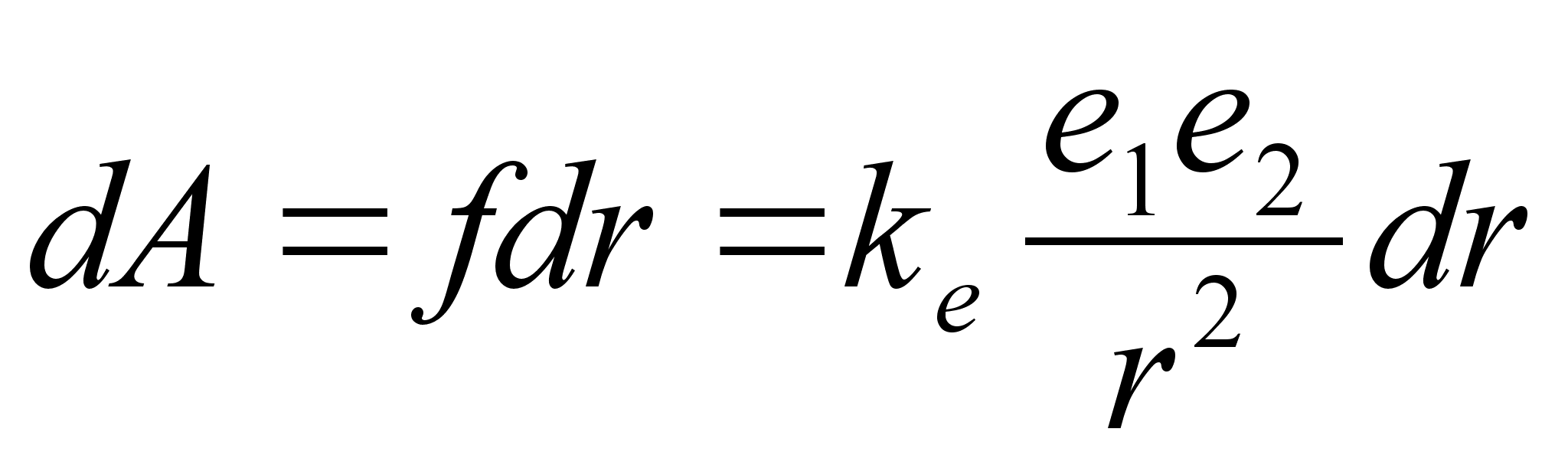
kus
liikumise teepikkust tдhistame seekod raadiuse (kugus tsentrist)
muutusena dr. Kui laeng liigub raadiuselt r1
raadiusele r2, peame integreerima vastavates
radades:
 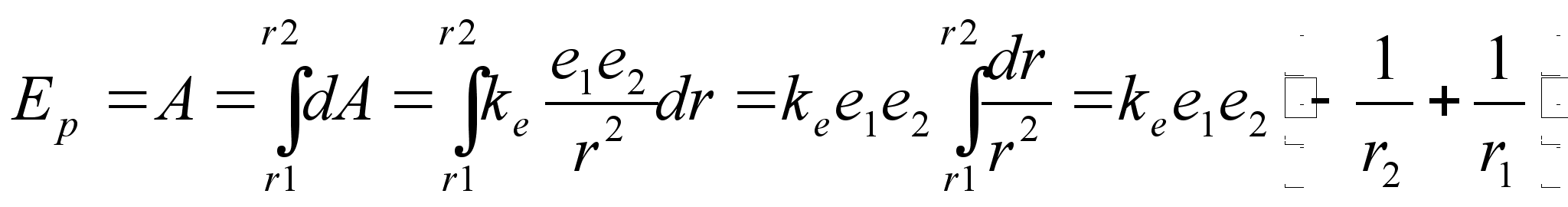
Valem
nдitab, et tsentraalsьmmeetrilises elektrivдljas
liikudes muutub laengu potentsiaalne energia pццrdvхrdeliselt
kaugusega tsentrist. Analoogiline valem kehtib ka gravitatsioonivдlja
kohta, ainult et seal esinevad kahe laengu asemel kaks massi ja
elektrivдlja konstandi asemel gravitatsioonikonstant. Kui laeng
liigub tsentrist eemale, siis r2>r1
ja negatiivne liige on vдiksem kui positiivne,
seega siis potentsiaalne energia kasvab. Vastupidi, potentsiaalne
energia kahaneb, kui laeng liigub tsentrile lдhemale.
Potentsiaalse energia nullnivoo on aga kokkuleppeline. See vхiks
olla ьks ддrmuslikest seisunditest, kas
 vхi vхi
 (lхpmatus). Siiski, raadius ei saa olla null, sest siis
lдheneb energia lхpmatusele, seega jддb
kokkuleppeliseks nulliks nivoo, kus laengud asetsevad teineteisest
lхpmatu kaugel. Lдhenedes aga nende potentsiaalne energia
kahaneb, seega muutub negatiivseks, ja lдheneb miinus
lхpmatusele kui laengud kohtuvad. Niisugune potentsiaalse
energia nullnivoo definitsioon, mis on hea elektronide ja tuumade
vahelise mхju kirjeldamiseks aatomites, on erinev
igapдevakogemusest gravitatsioonilise energiaga, kus nulliks
loeme tavaliselt energia maapinnal ja energia loeme positiivselt
kasvavaks kui keha maapinnast kaugeneb. Kui valemis ???
(lхpmatus). Siiski, raadius ei saa olla null, sest siis
lдheneb energia lхpmatusele, seega jддb
kokkuleppeliseks nulliks nivoo, kus laengud asetsevad teineteisest
lхpmatu kaugel. Lдhenedes aga nende potentsiaalne energia
kahaneb, seega muutub negatiivseks, ja lдheneb miinus
lхpmatusele kui laengud kohtuvad. Niisugune potentsiaalse
energia nullnivoo definitsioon, mis on hea elektronide ja tuumade
vahelise mхju kirjeldamiseks aatomites, on erinev
igapдevakogemusest gravitatsioonilise energiaga, kus nulliks
loeme tavaliselt energia maapinnal ja energia loeme positiivselt
kasvavaks kui keha maapinnast kaugeneb. Kui valemis ???
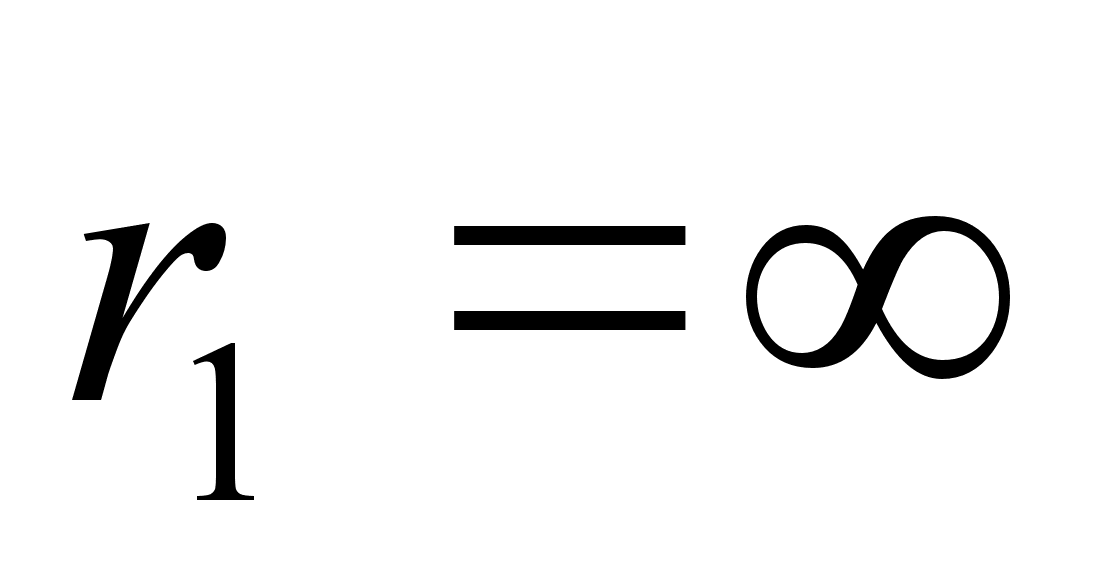 ,
st. elektron lдheneb tuumale lхpmatu kaugelt, siis tema
potentsiaalne energia on alguses null ja kahaneb lхpuks
vддrtusele ,
st. elektron lдheneb tuumale lхpmatu kaugelt, siis tema
potentsiaalne energia on alguses null ja kahaneb lхpuks
vддrtusele
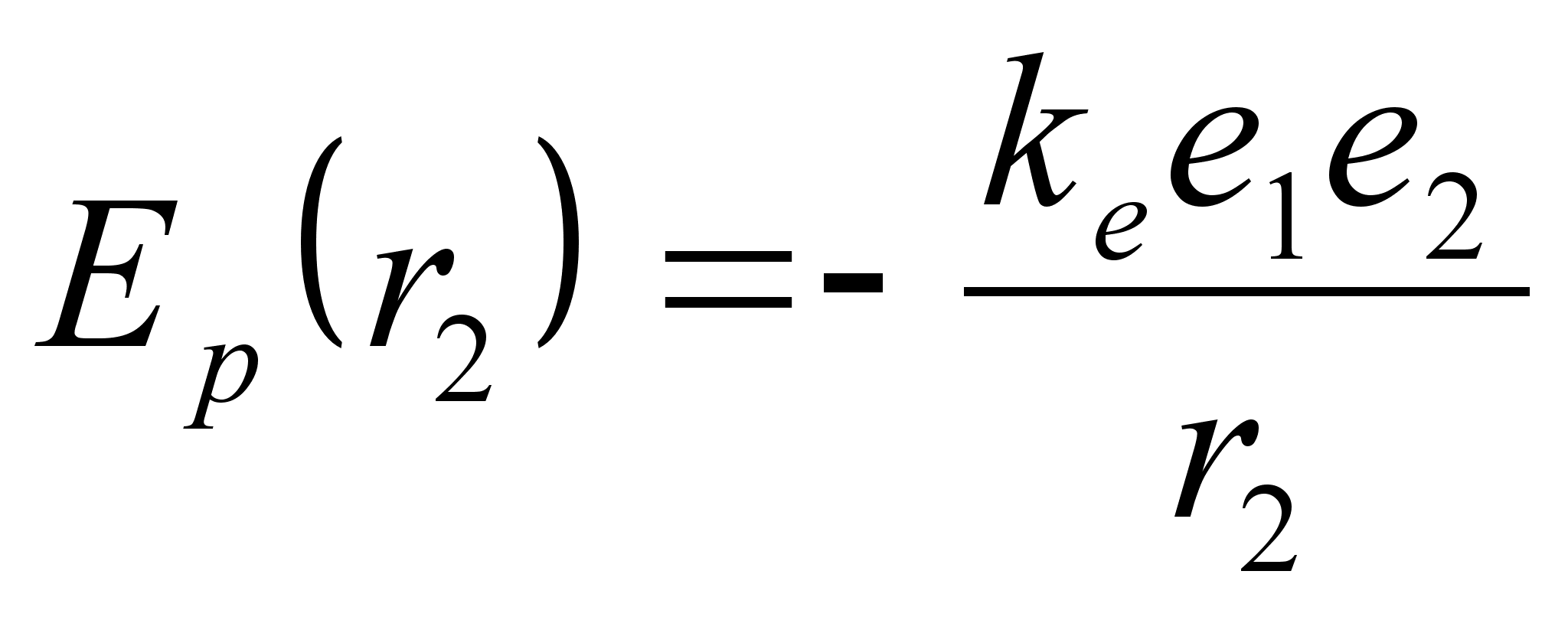 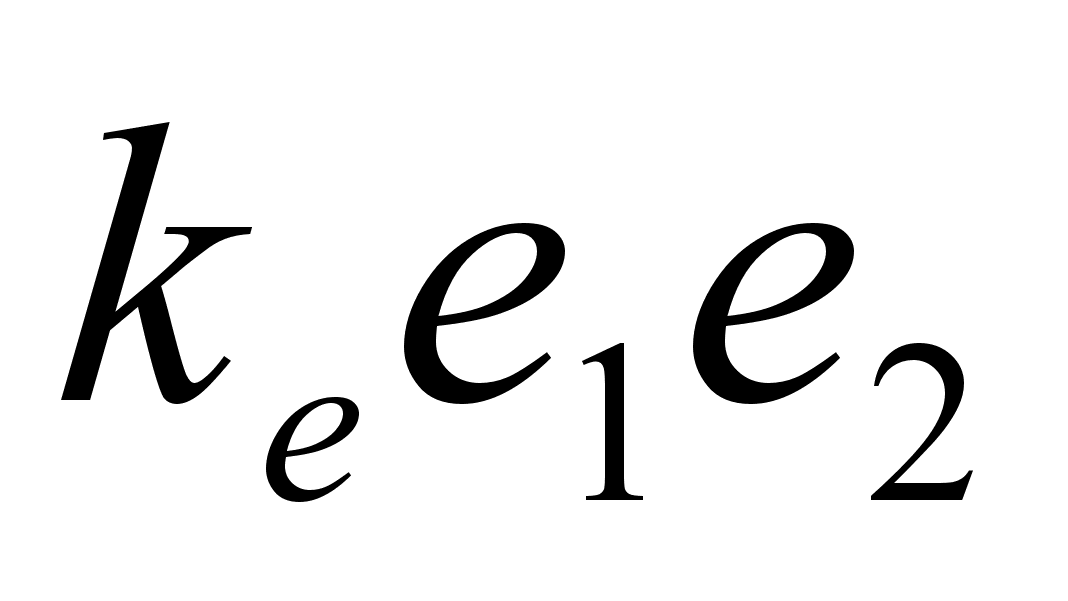
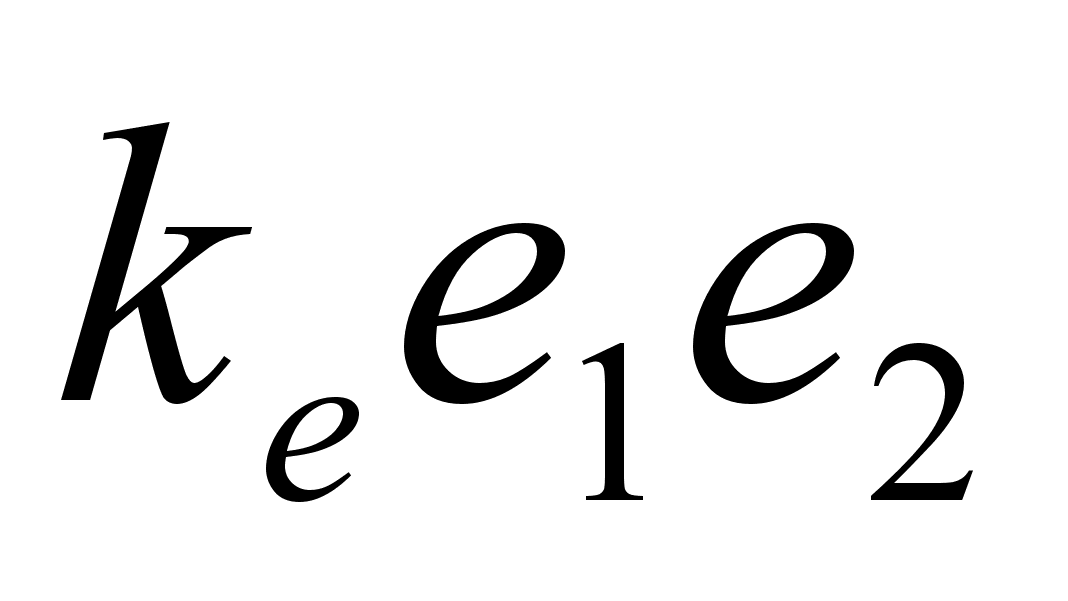
Kuna see
energia kuhugi kaduda ei saa, siis muutub ta elektroni liikumise
kineetiliseks energiaks, st., lдhenedes tuumale elektron liigub
kiirenevalt, nii nagu nдiteks asteroid liigub kiirenevalt
lдhenedes Maa pinnale. Vahe on siiski selles, et elektron ei
lange kunagi tuumale, vaid jддb tiirlema mingil kaugusel
ьmber tuuma. Tiirlemise kaugus (raadius, on mддratud
sellega, millal elektriline tхmbejхud vхrdub
inertsiaalse kesktхukejхuga. Matemaatiliselt avaldub
see tingimus jдrgmiselt:
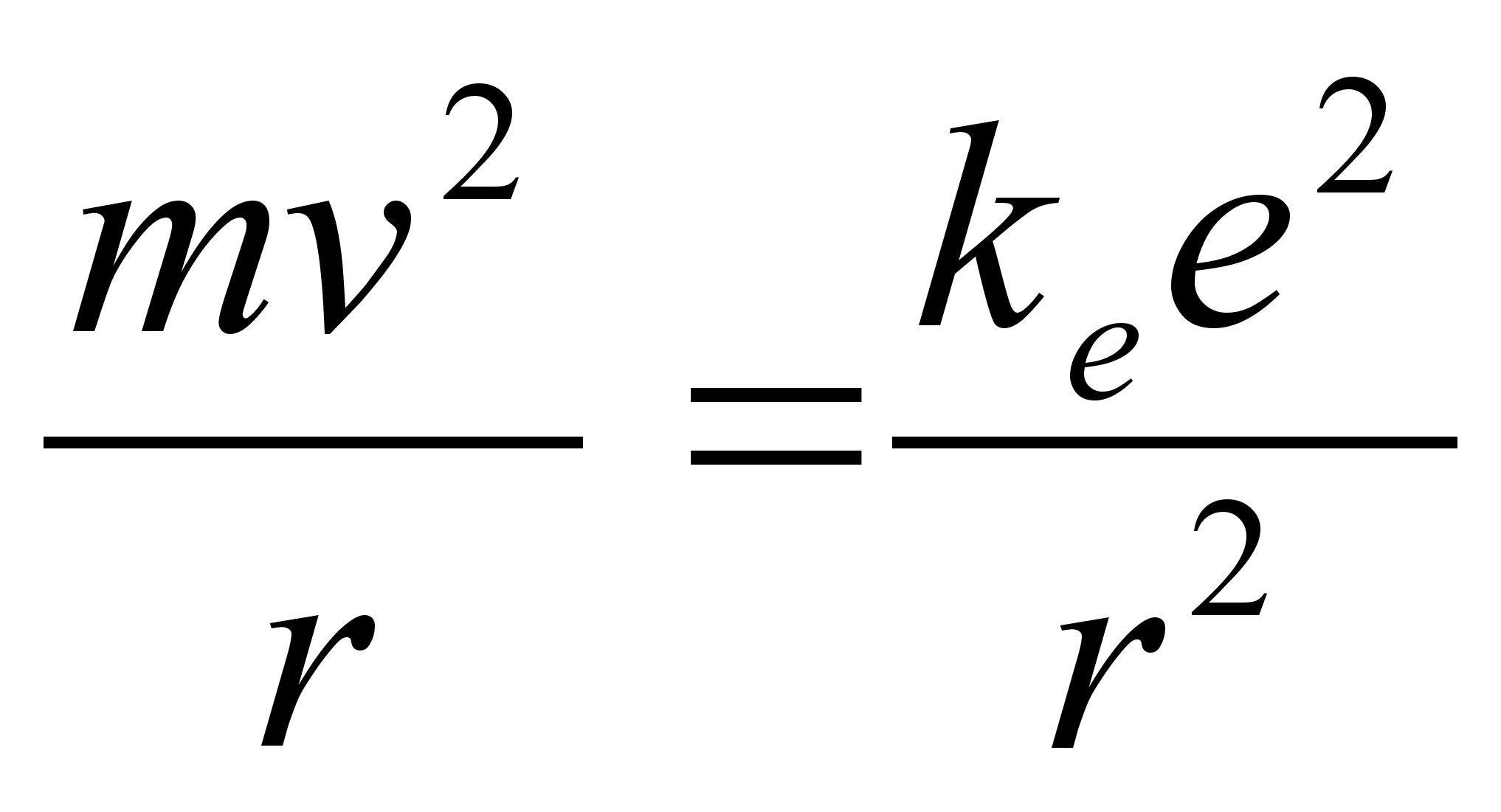
Selle
valemi vasak pool on varasemast tuttav kesktхukejхu
valem keha massiga m ringliikumisel joonkiirusega v
ьmber tsentri kaugusel r. Valemi parem pool on
elektrostaatilise tхmbejхu valem, kuid siin on juba
arvestatud, et aatomis positiivne ja negatiivne laeng on vхrdsed,
mхlemad vддrtusega e.
Eelmisest
valemist saab leida raadiuse, mille saab siduda nii elektroni kiiruse
kui tema kineetilise energiaga:
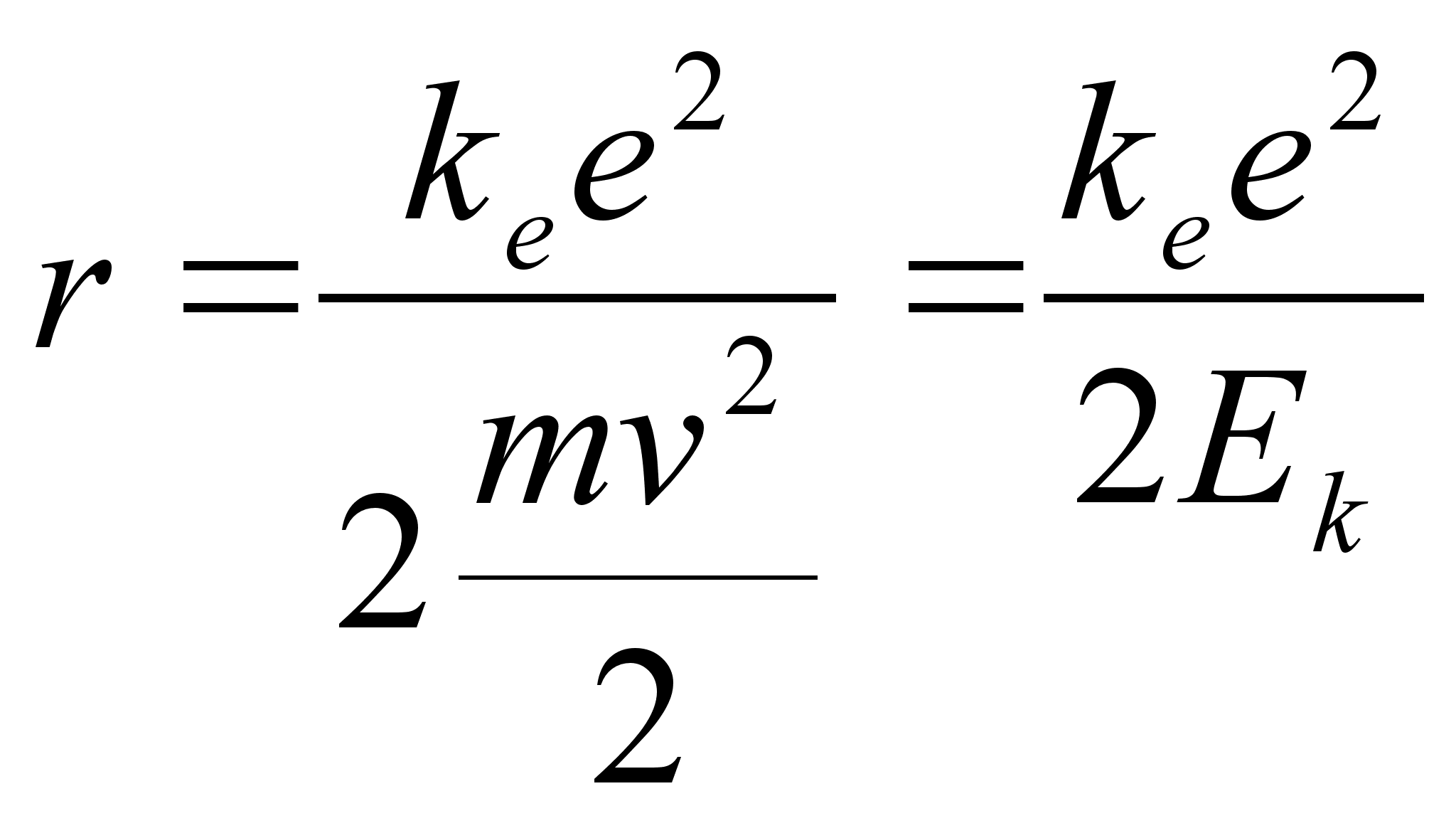
vхi
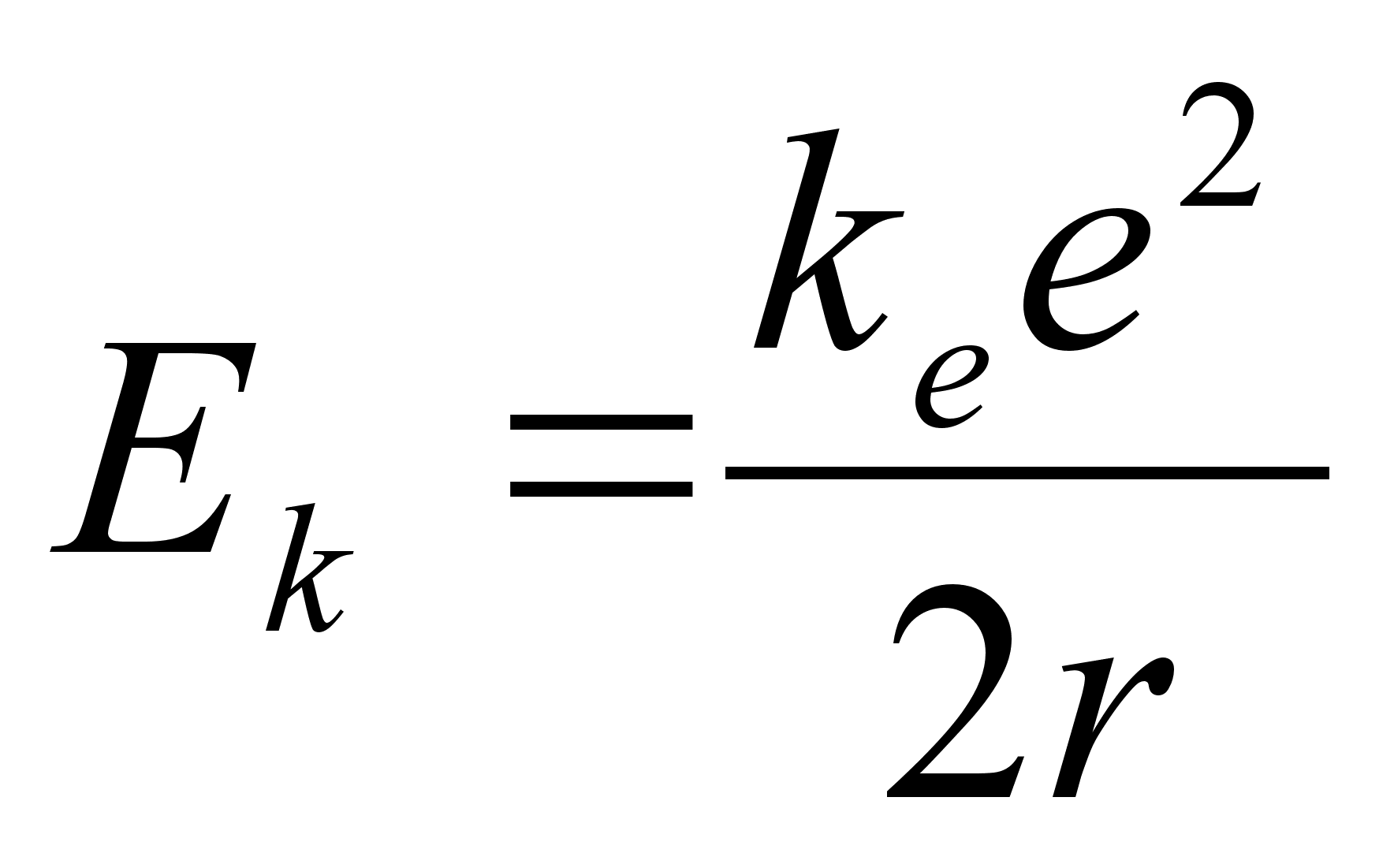
Ьmber tuuma tiirleva elektroni kineetiline energia kasvab kui
elektron lдheneb tuumale (r kahaneb). Tuletame meelde, et
potentsiaalne energia samal ajal kahanes:
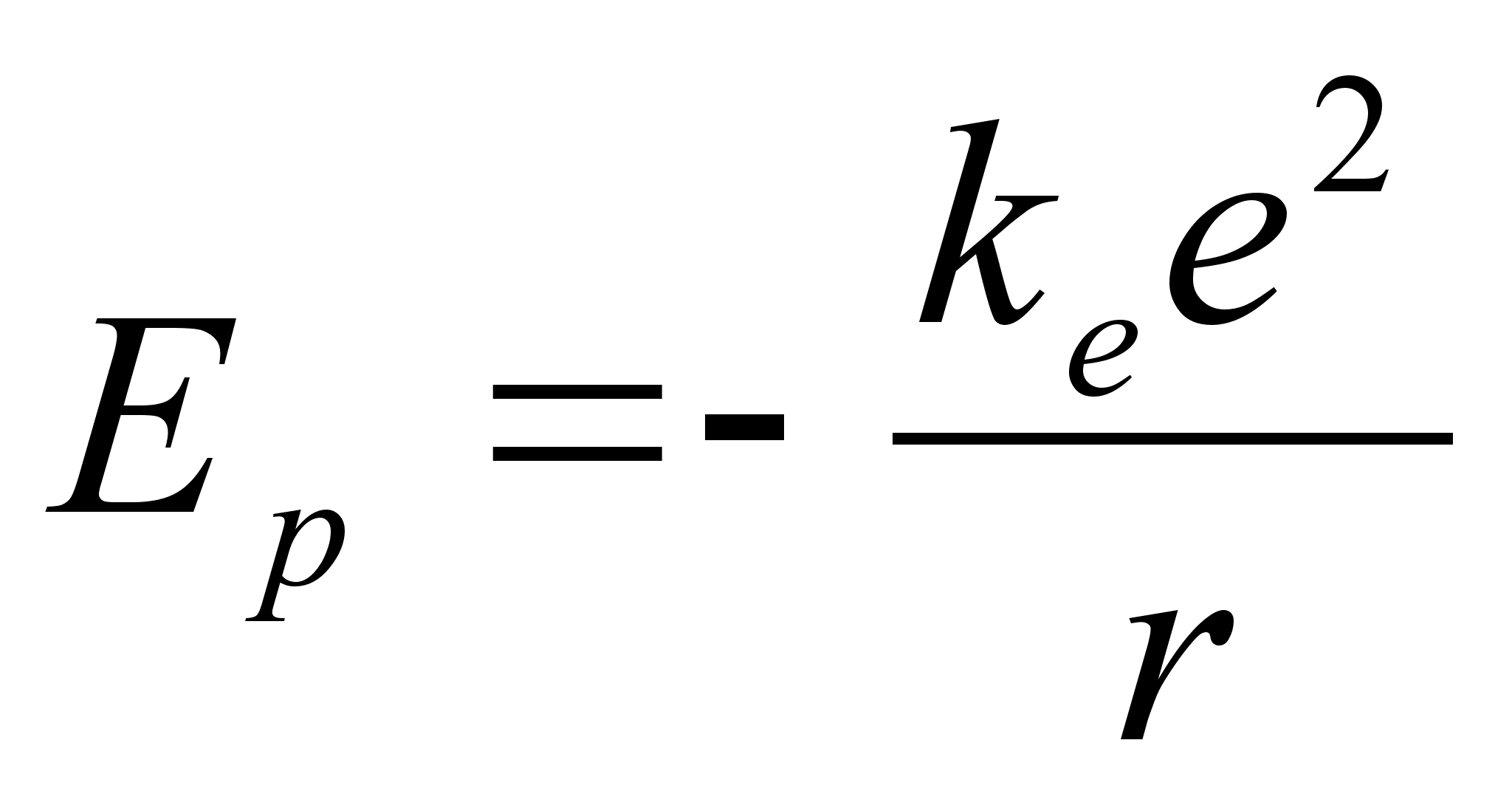 , ,
ja
summaarne energia
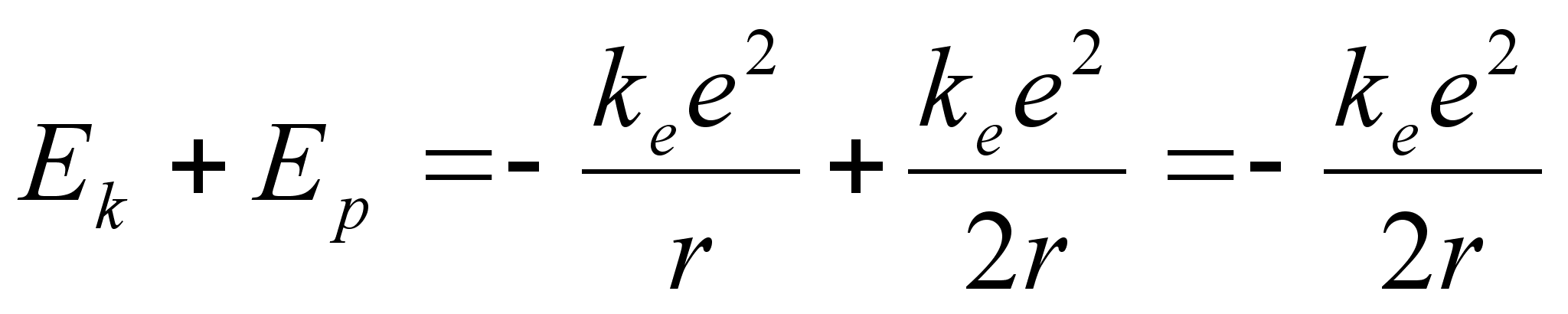
Elektroni
summaarne energia kahaneb kui elektron asub tiirlema orbiidile mis on
tuumale lдhemal. Kuhu see energiavahe siis lдheb,
millisesse vormi muutub (kaduda ju ei saa)?
See energiavahe peab aatomist eralduma ja seda ta ka teeb, kas
valguskvandi kujul, vхi kandub ьle mхnele
naaberaatomile, tхstes selle elektroni vastavalt kхrgemale
energianivoole, vхi eraldub soojusena, s.o. muutub aatomi
translatoorseks (kulgevaks) liikumiseks. Niisugune elektronide ja
tuuma vahelise kauguse muutumine, elektronide tiirlemine erineva
raadiusega orbiitidel, on peamine keemiliste ainete siseenergia,
keemilise energia olemus. Ained, mille molekulides elektronid
tiirlevad tuumadest kaugemal, on energiarikkamad ja vхivad
seda vabastada kui keemilise reaktsiooni tulemusena toimuvad
muutused, mille tulemusena elektronid saavad tuumadele lдhemale
asuda. Bioloogiliste protsesside energeetika on samadel alustel:
fotosьnteesis tхstetakse elektron valguskvandi abil
kхrgemale energianivoole, tuumast kaugemale orbiidile, ja
metabolismi kдigus ta jдrkjдrgult lдheneb
tuumale, vabastades niimoodi kvandi poolt talle antud energia.
Kas aga elektronid saavad tiirelda ьmber tuuma igasugustel
kaugustel? Kui see nii oleks, vхiks ju vabastada vдga
suuri keemilise siseenegia koguseid lubades elektronil asuda tuumale
vдga-vдga lдhedale (lastes raadiuse nulli lдhedale).
Tхepoolest, klassikaline fььsika seda lubaks, kuid
tegelikkuses seda ei juhtu. Siin tulevad sisse kvantmehaanilised
piirangud, mis klassikalise fььsika abil ei seletu.
Jдrgnevas tutvumegi atomaarse kvantteooria pхhialustega.
BOHRI AATOMIMUDEL
Eelmises lхigus tuletasime valemid, mis kirjeldavad ьmber
tuuma tiirleva elektroni kiirust ja energiat. Igale elektroni
kineetilise energia vддrtusele Ek vastaks
kindel raadius r. Klassikalise fььsika seisukohtade
kohaselt tekitab aga tiirlev elektron muutuva elektromagnetilise
vдlja: elektron on perioodiliselt kord tuumast parmal, siis
jдlle vasemal, seega ‘pluss’ ja ‘miinus’
vahelduvad nagu televisiooni saateantenni varrastes, vahe on ainult
mххdus ja tiirlemise sageduses. Muutuva
elektromagnetilise vдlja kaudu peaks elektroni tiirlemisenergia
vдlja kiirguma, elektron peaks tuumale lдhenema ja lхpuks
tuumale kukkuma. Tegelikult seda ei toimu, kхik aatomid
maailmas on stabiilsed ja tavaliselt ei kiirga energiat. Selles on
klassikalise mehhaanika pхhivastuolu tegelikkusega. Seda
vastuolu ei saa eletada, see tuleb lihtsalt teadmiseks vхtta
ja postuleerida, et teatud kindlate energiavддrtuste puhul
on elektronide orbiidid aatomis stabiilsed ja energiat ei kiirgu,
kuigi pхhjus, miks ei kiirgu, ei ole teada. Kui see aga
teadmiseks vхtta, siis saab sellele ьles ehitada uut
sorti mehanika – kvantmehaanika. Esimeseses jдrjekorras
tuleb postuleerida, missugused on need orbiidid, millel elektron saab
stabiilselt tiirelda ilma energiat kiirgamata.
Uurides kuumutatud kehadelt kiirguva valguse spektreid leidis Max
Planck (1900) ka siin vastuolu, mis lahenes, kui eeldati, et valgusel
on kvantiseloom: valgus kiirgub energiaportsjonite e. kvantide kaupa,
millest igaьhe energia
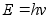 ,
kus on valguslaine
vхnkumise sagedus. ,
kus on valguslaine
vхnkumise sagedus.
Lдhtudes
sellest postuleeris Bohr (1913): elektroni tiirlemisel ьmber
tuuma elektrmagnetilist lainet (=valgust) ei kiirgu, kui elektron
tiirleb orbiitidel millel potentsiaalne on
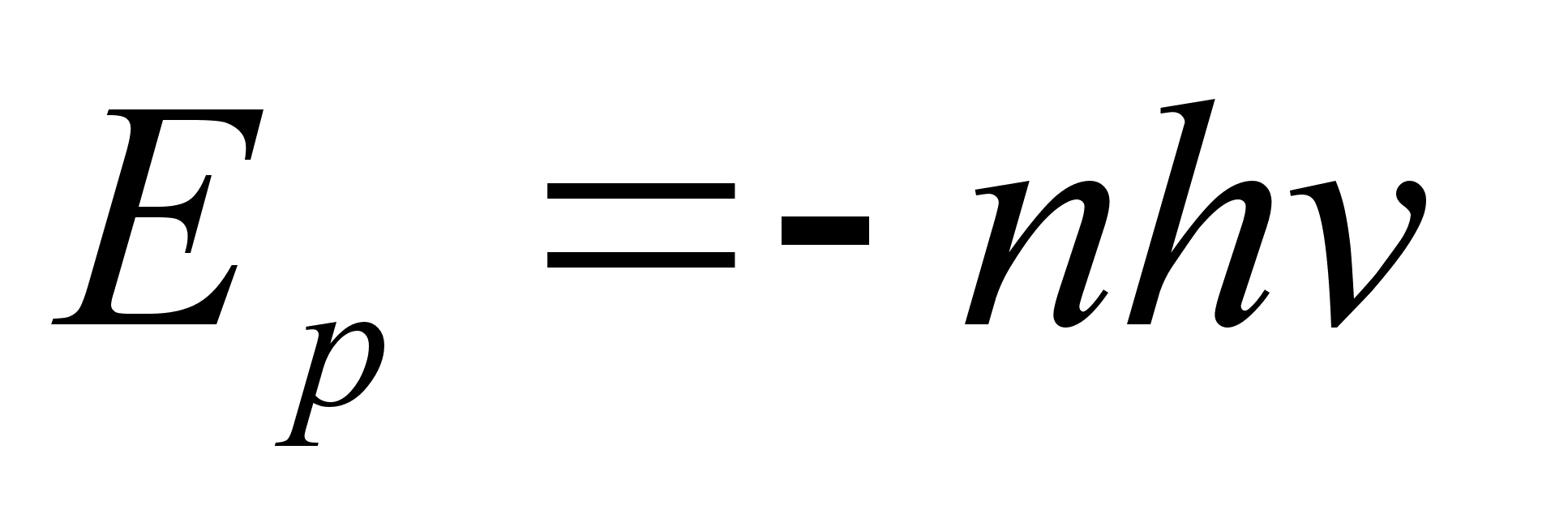 . .
Kineetiline
energia oli positiivne ja pool potentsiaalsest energiast:
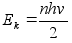 , ,
Nendes
valemites on elektroni
tiirlemise sagedus, n aga mingi tдisarv 1, 2, 3, 4 jne.
Kasutades
seost joonkiiruse ja nurkkiiruse vahel, mille abil sagedus
teisendatakse joonkiiruseks, saame:
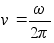 ja
ja
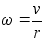
ja vхime
kirjutada
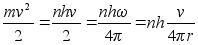
ehk
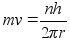
vхi
vхttes mхlemad pooled ruutu saame:
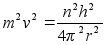 . .
Elektrostaatilise tхmbejхu valemist (???) saame massiga
m lдbi korrutades:
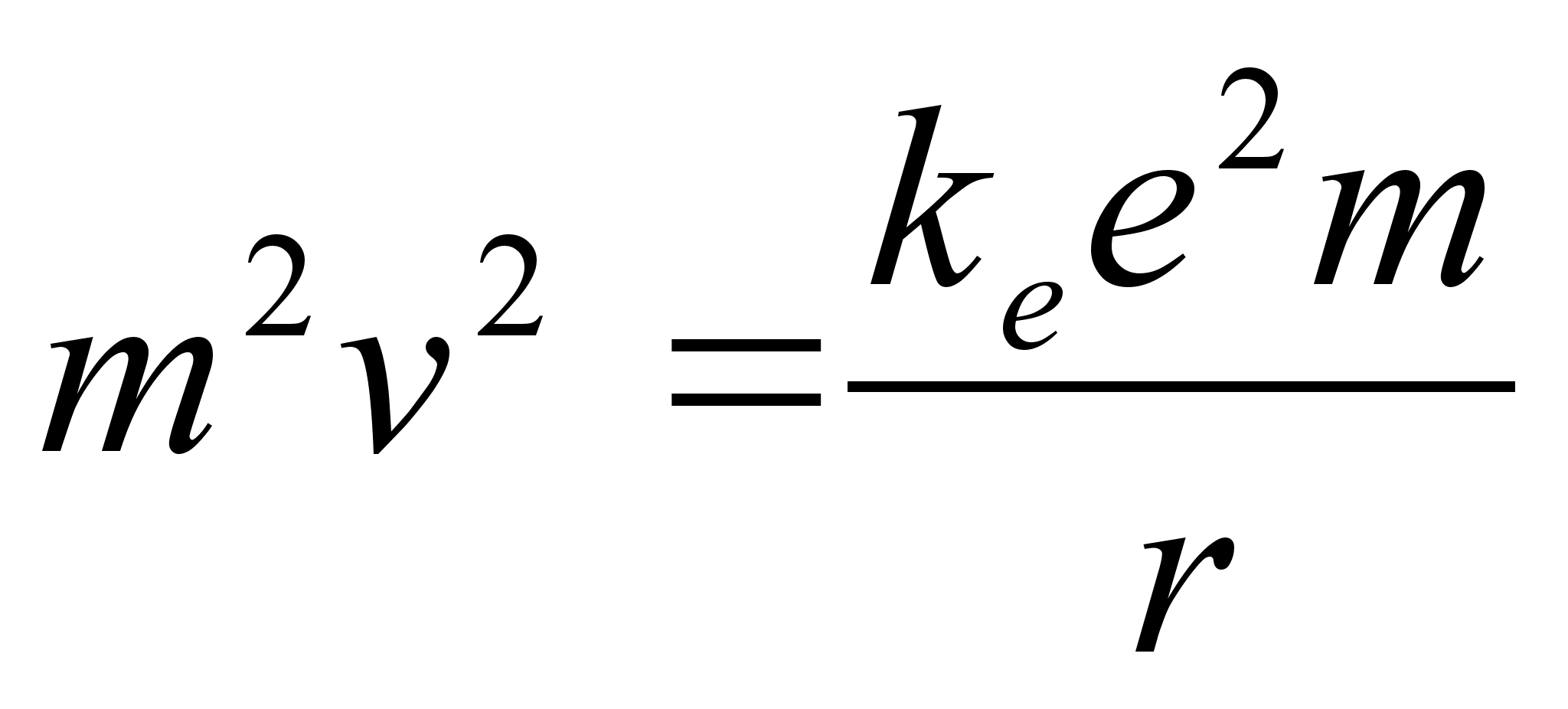
Kahe
viimase valemi vasakud pooled on vхrdsed. Paremate poolte
vхrdsustamisel saame avaldada lubatud raadiuse
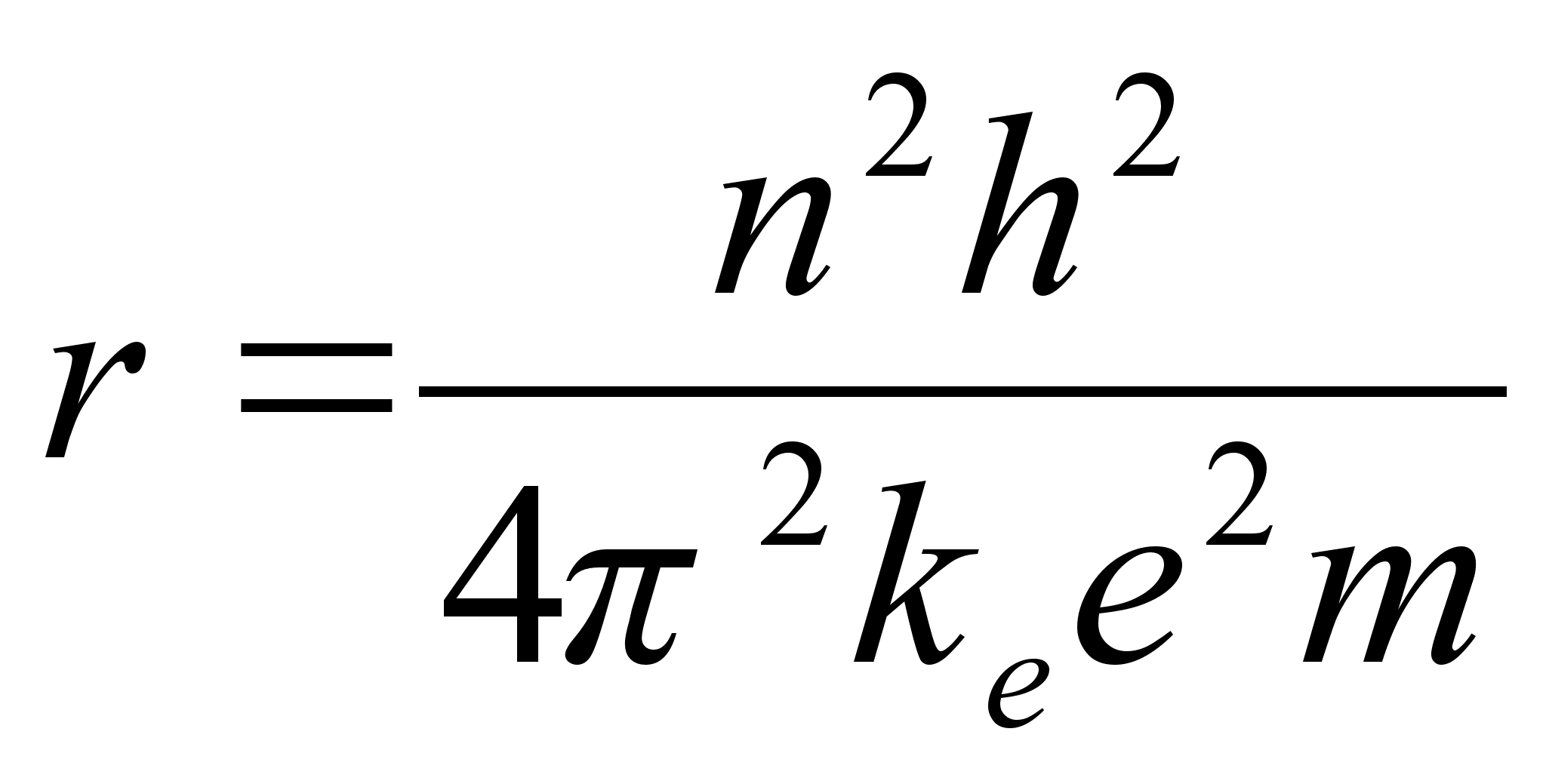 . .
Need nn.
Bohri raadiused ongi vхimalikud raadiused millel elektron saab
asuda stabiilselt ilma energiat kiirgamata.
Avaldame elektroni kineetilise energia tema massi m ja laengu
e kaudu. Selleks asendame r valemisse (???) vхi
(???). Saame
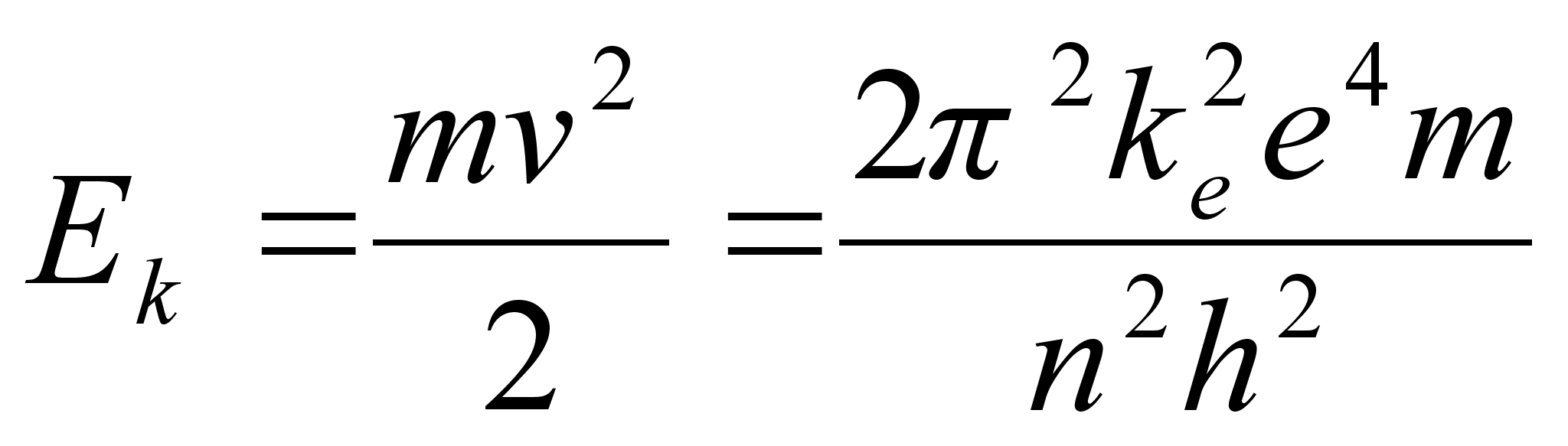
Samale
orbiidile vastav potentsiaalne energia
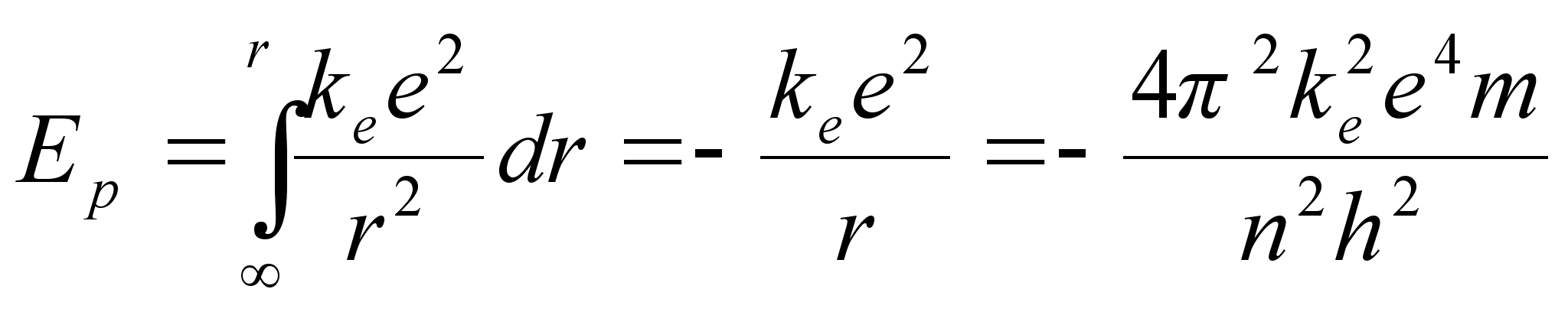
ja
koguenergia, mis vastab orbiidile, mida iseloomustab tдisarv n
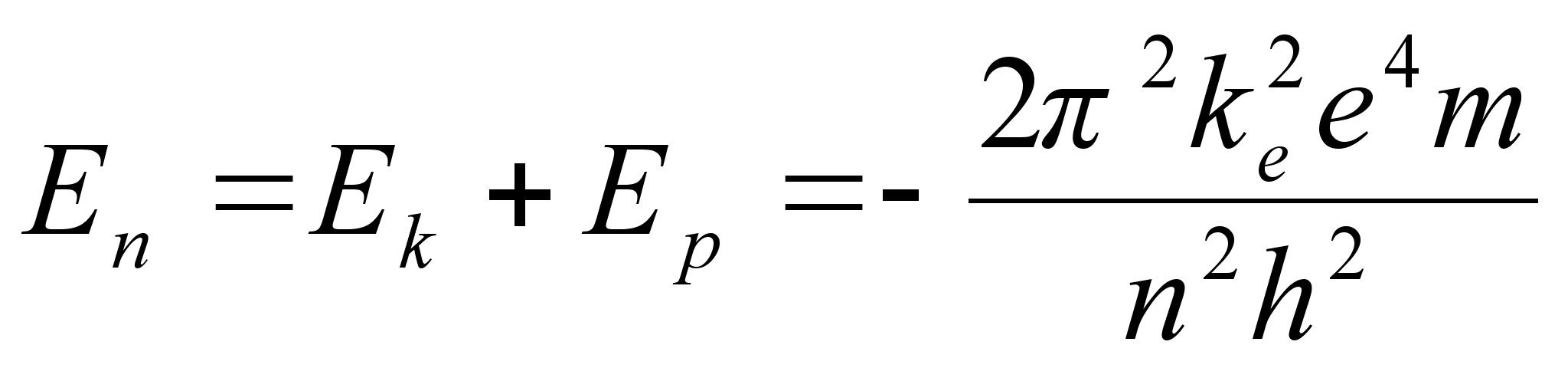
Vхimalike
naaberorbiitide energiate vahe
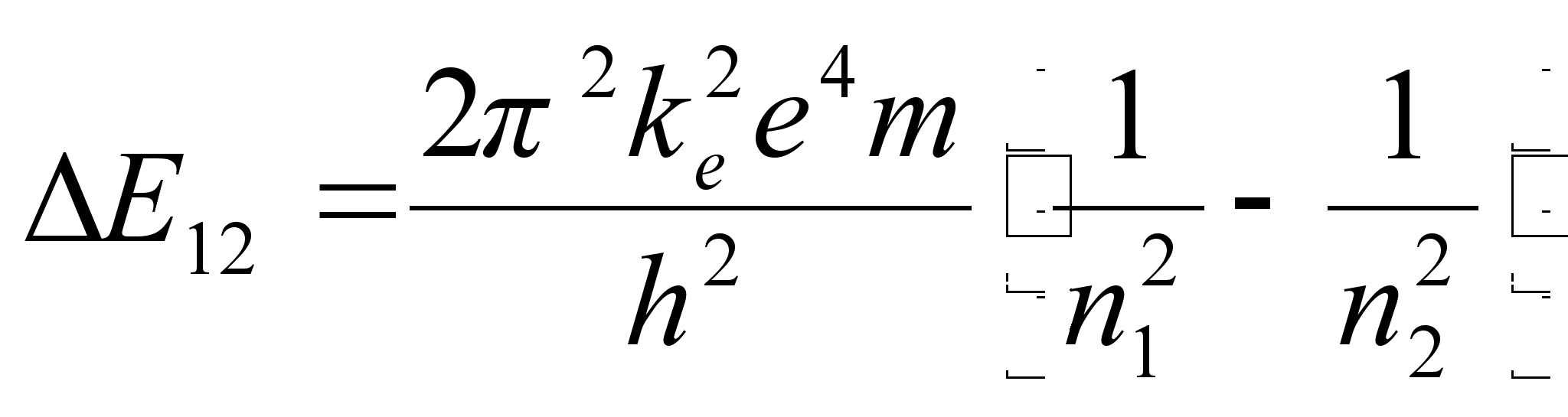
Elektroni
tiirlemissageduste vahe kahel naaberorbiidil vхrdub
vдljakiiratava (vхi neelatava) valguse sagedusega kahe
orbiidi vahelisel ьleminekul:
 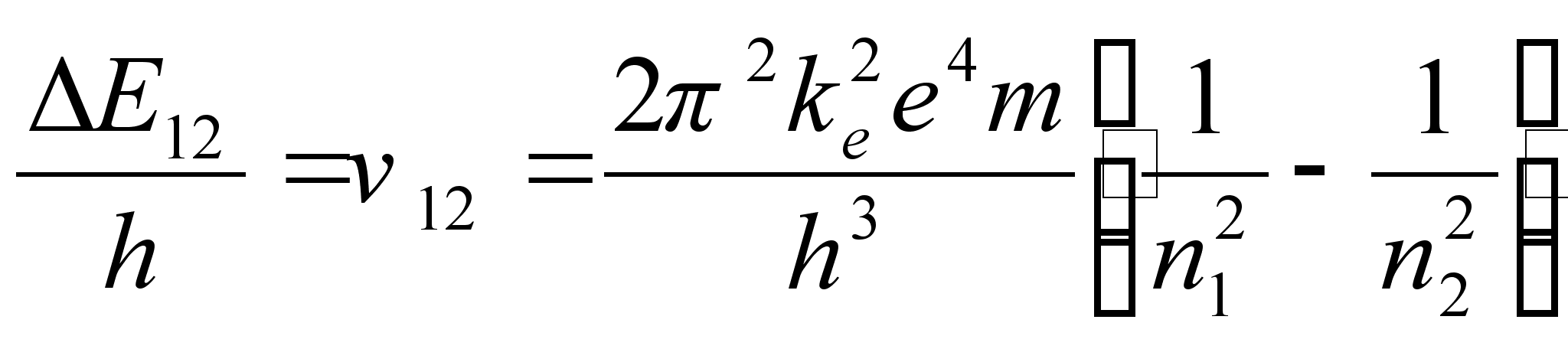 ja lainepikkus
ja lainepikkus
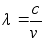 kus c on valguse kiirus.
kus c on valguse kiirus.
Arvulisi
andmeid: e = 1. 6021892·10-19 kulonit; h=
6.626176·10-34 J·s; me =
9.109534·10-31 kg
c =
299792458 m s-1 ke=???
Valem
(???) nдitab, et elektroni vхimalikud tiirlemisraadiused
suurenevad vхrdeliselt tдisarvude ruutudega, seega jada
on 1, 4, 9, 16, 25, 36 ...
Valem
(???) nдitab,et elektroni koguenergia vхimalikel
orbiitidel suureneb raadiuse kasvades pццrdvхrdeliselt
tдisarvu n ruuduga, seega jada oleks
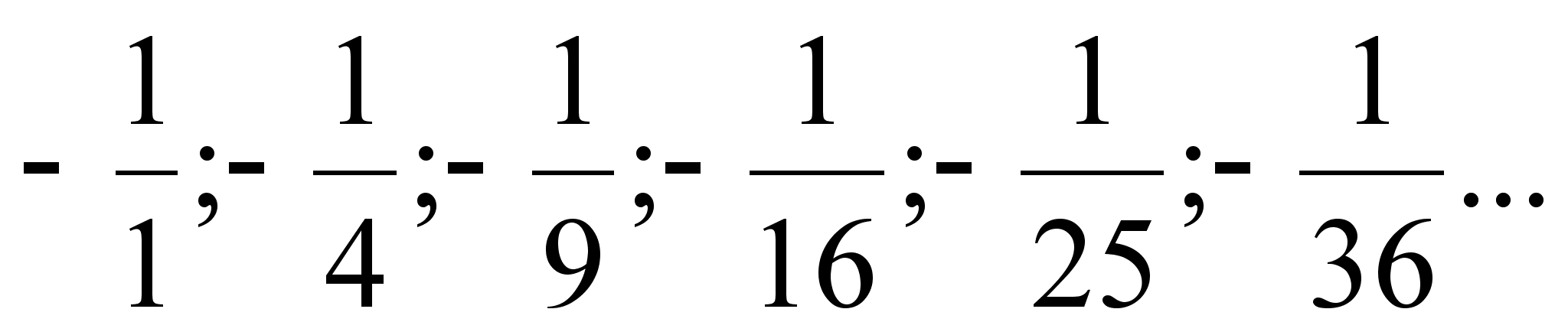
Kхige
sьgavama energianivoo (pхhinivoo) vддrtus on
vesiniku aatomis -13.6 eV, nivoode jada elektronvoltides oleks siis
-13.6;
-3.4; -1.5; -0.85; -0.54; -0.38 ...eV
Volt
(Itaalia teadlase Volta nimest) on elektrivдlja potentsiaali
(potentsiaalse energia) ьhik. Elektrivдlja kahe punkti
potentsiaalide vahe on ьks Volt kui laengu ьks kulon
viimisel ьhest punktist teise tehakse tццd ьks J.
Ьhe elektroni viimisel lдbi potentsiaalide vahe ьks
volt tehakse tццd ьks elektronvolt. Energeetiliselt
elektronvolt on dzhaulist niisama palju kordi vдiksem kui
elektroni laeng on vдiksem kulonist, seega 1 eV = 1.
6021892·10-19 J.
Orbiitide ja energianivoode joonised.
Nдhtav ja nдhtamatu elektromagnetiline kiirgus, valgus.
Energianivoode-vahelisel
ьleminekul kiiratakse kvant kui ьleminek toimub tuumale
lдhemale ja neelatakse kvant kui ьleminek toimub tuumast
kaugemale. Kvandi energia on niisama suur kui vastavate orbiitide
energianivoode vahe. Vхtame teadmiseks, et vesiniku
sьgavaimale energianivoole vastab 13.6 eV ja arvutame sellele
ьleminekule vastava lainepikkuse.
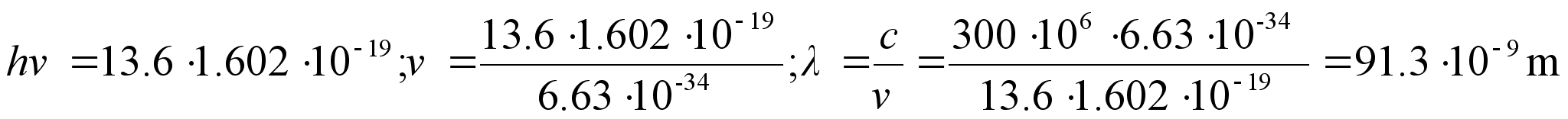
See on silmale nдhtamatu lьhilaineline
ultraviolett-kiirgus. Silm nдeb ‘valgust’, mis on
defineeritud kui elektromagnetiline kiirgus lainepikkuste vahemikus
400-700 nm ehk kvandi energiavahemik 3.10 kuni 1.77 eV. Vesiniku
aatomisisestest ьleminekutest kiirguks nдhtavat kiirgust
ьleminekutel kхrgematelt nivoodelt teisele nivoole,
teiselt esimesele nivoole ьleminek kiirgab kvandi lainepikkusega
121.7 nm.
Seega, valguse ja sellest lьhemate lainepikkustega kvandid
kiirguvad elektroni ьleminekul kхrgema energiaga
orbiidilt madalama energiaga orbiidile, energiavahe kiirgub kvandina.
Ka vastupidine protsess, kvandi neeldumine aatomis pхhjustades
elektroni ьlemineku madalamalt orbiidilt kхrgemale, on
vхimalik. Nagu vesiniku aatomi analььs nдitas,
on lubatud tдiesti kindlad energianivood, seega niisuguses
aatomis kiirguvad ja neelduvad ainult vдga tдpselt mддratud
lainepikkustega kvandid. Vesiniku aatomis on pхhinivoo nii
sьgaval, et sinna ьleminekul saavad kiirguda vaid
ultraviolett-kvandid. Paljelektroniliste aatomite vдliste
kihtide lubatud pхhinivood ei asu mitte nii sьgaval ja
neis kiirguvad/neelduvad ka nдhtava valguse kvandid. Nдiteks,
tihti kasutatakse elavhхbe-auru ja naatriumi-auruga tдidetud
lampe, kus elektrienergia abil sunnitakse metalliaatomeid kiirgama
nдhtavat valgust. Kui aatomid asuvad gaasis tihedalt
lдhestikku, siis nad pхrkuvad soojusliikumise tхttu
ja need pхrked moonutavad orbiitide kuju. Tulemusena nihkub
igas moonutatud orbiidiga aatomis energianivoo veidi ja kogu gaas ei
kiirga enam mitte joonspektrit teatud kindlate lainepikkustega, vaid
nn. ribaspektrit, kus jooned on laienenud ribadeks.
Joonis: ribaspektri nдidis kхrgrхhu
elvhхbeauru-lambis.
Tahkes
kehas asuvad aatomid nii tihedasti koos, et iga ьksiku aatomi
energianivoo muutub vдga ebamддraseks. Kui tahket
keha, nдiteks metalli vхi sьtt kuumutada, siis see
hakkab valgust kiirgama. Madalamal temperatuuril on see kiirgus
pikemalainelisem, nдhtavaks muutub see tumepunasena kusagil 600
°C juures. Temperatuuri edasisel tхstmisel hakkab
domineerima jдrjest lьhemalainelisem kiirgus, muutudes
silmale nдhtavalt kollakaks, valgeks (nagu Pдike) vхi
isegi sinakaks (nagu kuumad tдhed). Niisugustes kuumutatud
tahketes kehades on kiirguse energiaallikaks aatomite (molekulide)
soojusliikumine, mis pхrgetel ‘ergastab’
elektrone, lьkates neid ajutiselt kхrgematele niivoodele,
kust nad siis kohe jдlle alla kukuvad, kiirates kvante. Kuna
aatomid asuvad vдga tihedalt, siis on ka lubatud energianiivood
vдga tihedalt ligistikku, nii et igasuguse energiaga kvantide
kiirgumine on vхimalik. Sellest tulenevalt on kuumutatud
tahkete kehade kiirgus pideva spektriga. Kuumutatud gaasides aga
kiirgub ikkagi joon- vхi ribaspekter. Nagu цeldud, on
madala temperatuuriga kehades lьhilaineliste (kхrge
energiaga) kvantide kiirgumine vдhetхenдone ja neis
domineerivad pikemalainelised kvandid. Nдiteks Maa keskmine
temperatuur on umbes 290 °K ja Maa kiirgab kosmosesse infrapunast
kiirgust lainepikkuse maksimumiga umbes 10 m.
Seevastu Pдikese temperatuur on umbes 6000 °K ja tema
kiirgusmaksimum on 0.5 m
lainepikkuse juures. Hххglampide niidi temperatuur on
umbes 2000-3000 °K ja kiirgusmaksimum umbes 1 m
juures. Nagu nдeme, on silm kohastunud nдgema just selles
spektripiirkonnas, kus Pдike kiirgab maksimaalselt. Seevastu
hххglampide spektrist suurt osa silm ei nдe.
Sellepдrast ongi hххglampide valgusviljakus
(valguslik kasutegur) suhteliselt madal (10-20%).
Joonised:
Pдikese ja hххglampide spektri nдited.
Mateeria lainelised omadused:
kvantmehaanika kui lainemehaanika
Uurides
musta tahke keha kiirgusspektrit leidis Max Planck (1900), et see
vastab energia juhuslikule jaotusele ainult tingimusel, et mitte
igasugune kiirgumine ei ole vхimalik, vaid ainult kiirgumine
portsjonite, kvantide kaupa, mille igaьhe energia ja
vхnkesagedus on seotud jдrgmiselt:
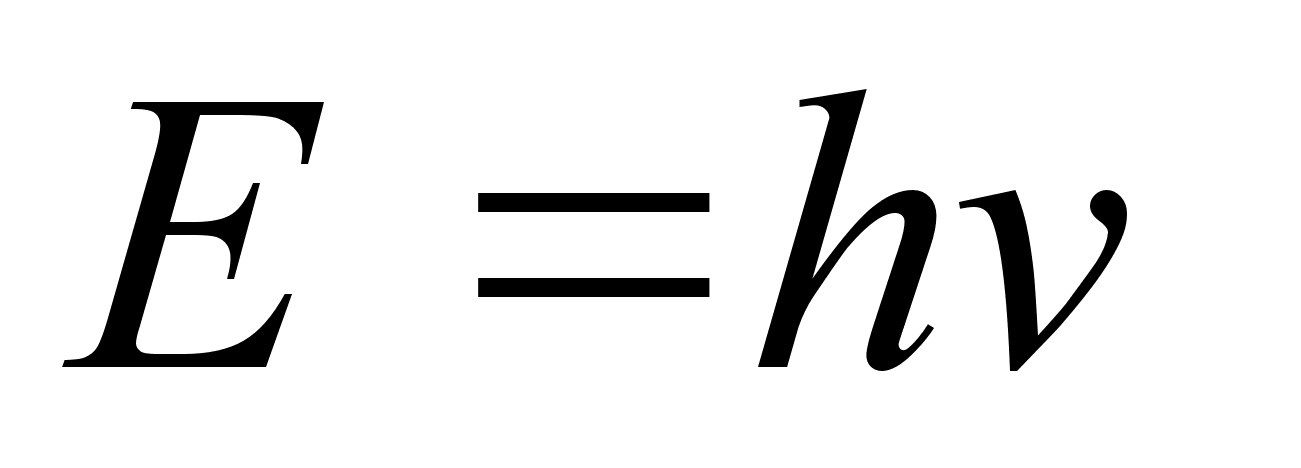
kus
on vхnkesagedus
ja h nn. Planck’i konstant, mis on ьks looduse
universaalsetest konstantidest. Veidi hiljem leidis Alber Einstein
oma ьldrelatiivsusteooriast et elementaarosakeste (prootonite,
elektronide jne.) mass ja energia on omavahel seotud:
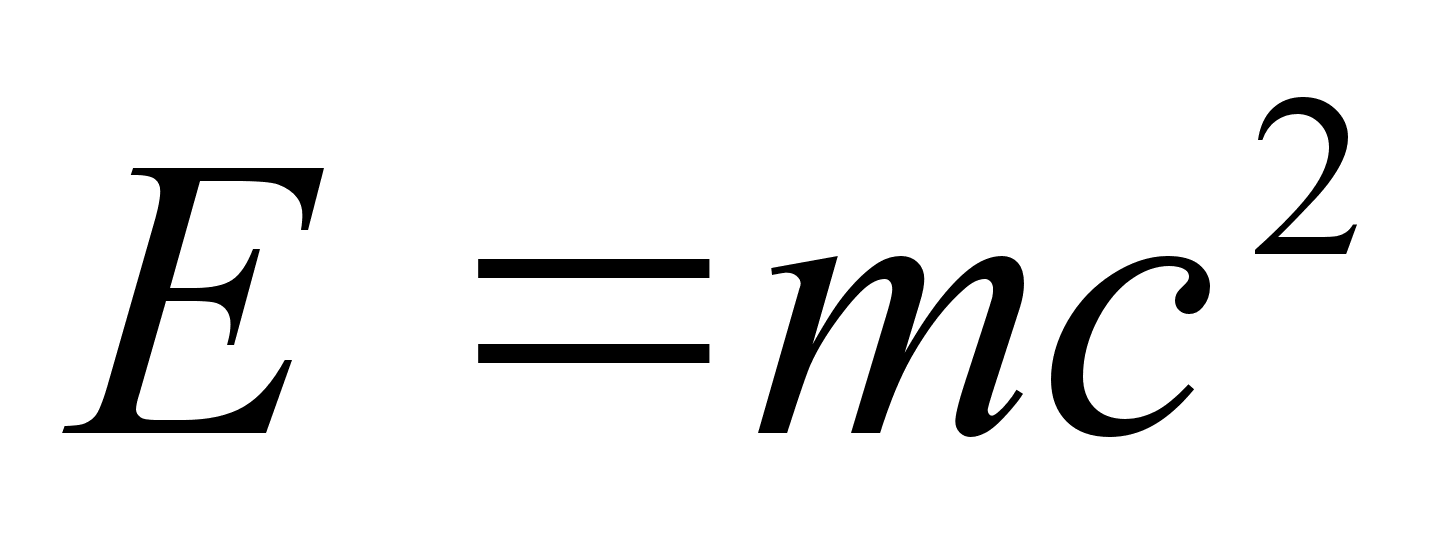
kus c
on valguse kiirus. Nendest kahest valemist jдrgneb, et kvandil
(footonil) kui elektromagnetiliste lainete ‘paketil’ peab
siiski olema ka mingi mass
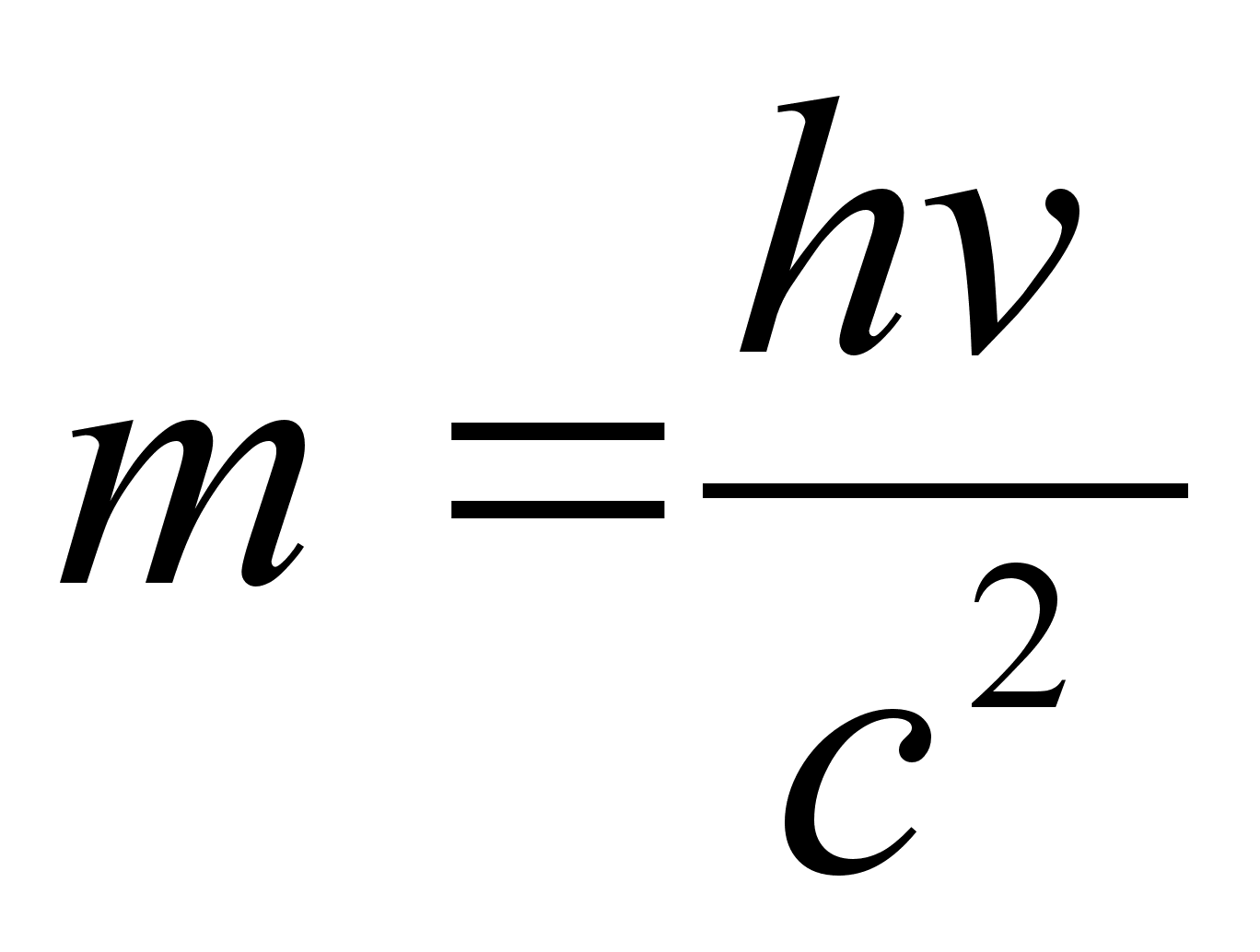 .
.
Seega on
footon kahesuguste omaduste, nii lainepakett kui ka massiga osakene.
De Brouglie (1927) arendas seda mхtet edasi, et absoluutselt
iga osakene, millel on mass, omab samaaegselt ka lainelisi omadusi.
Kui eelmine valem teisendada, saame
 ,
,
kust
See valem
on kirjutatud footonite jaoks, mis alati liiguvad kiirusega c ja ei
saa kunagi liikuda vдiksema kiiruega. De Brouglie aga oletas, et
massi ja lainepikkust siduv valem kehtib iga osakese kohta, ka nende
kohta, mis vхivad seista paigal vхi liikuda valguse
kiirusest vдiksema kiirusega. Sellisel juhul valem sisaldaks
valguse kiiruse asemel osakese (keha) tegelikku kiirust
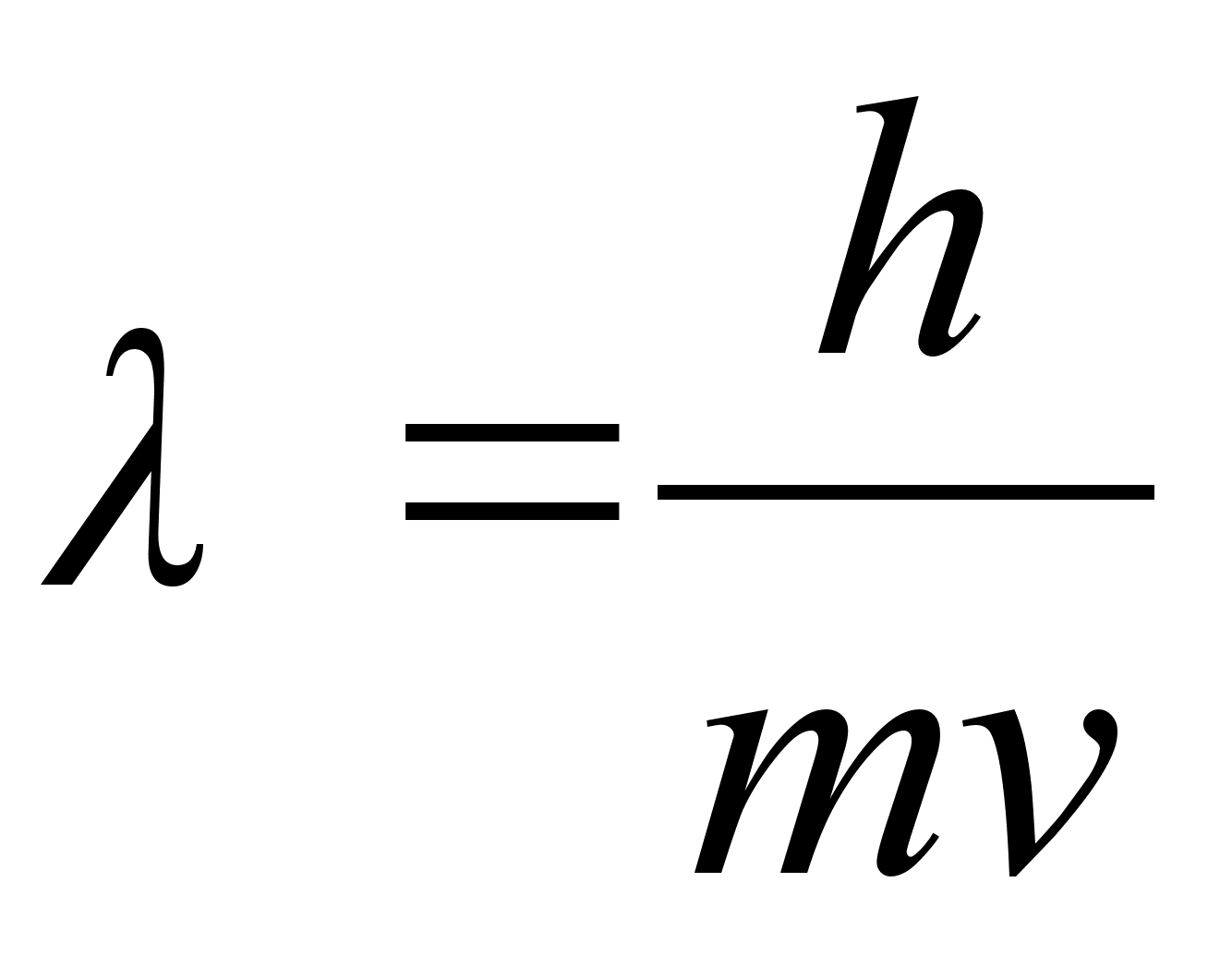
Vaatame,
mida see hьpotees tдhendaks Bohri aatomimudelis tiirleva
elektroni kohta, milline oleks selle ‘lainepikkus”?
Elektroni
kineetiline energia orbiidil, millele vastas tдisarv n
oli
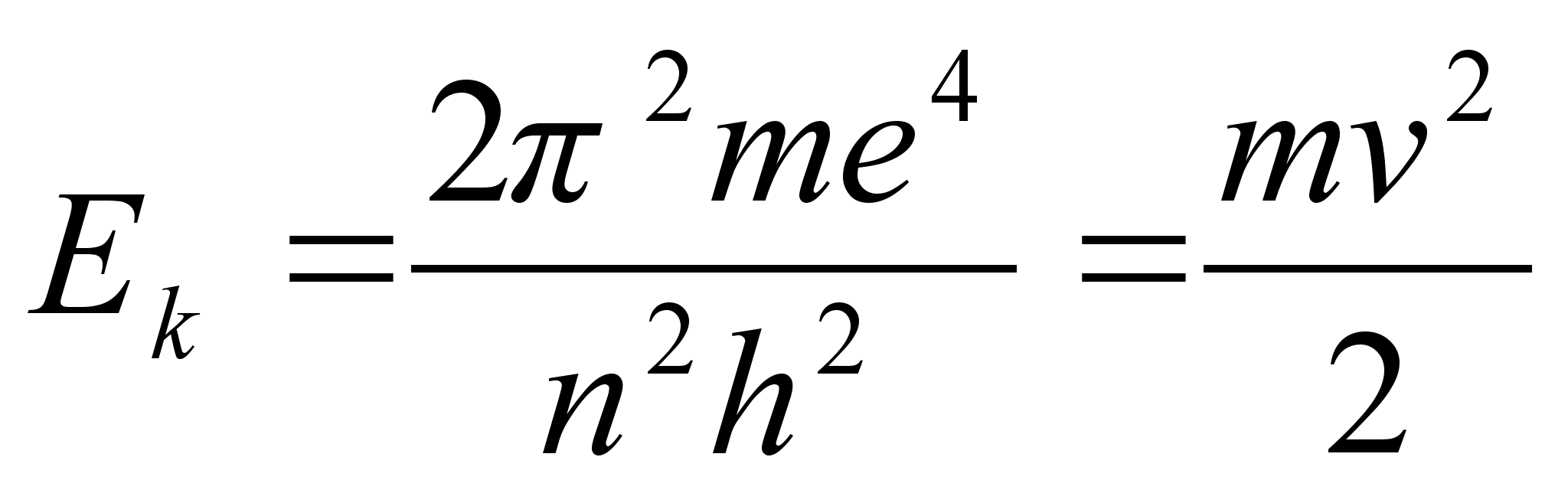
Avaldades
siit kiiruse v saame
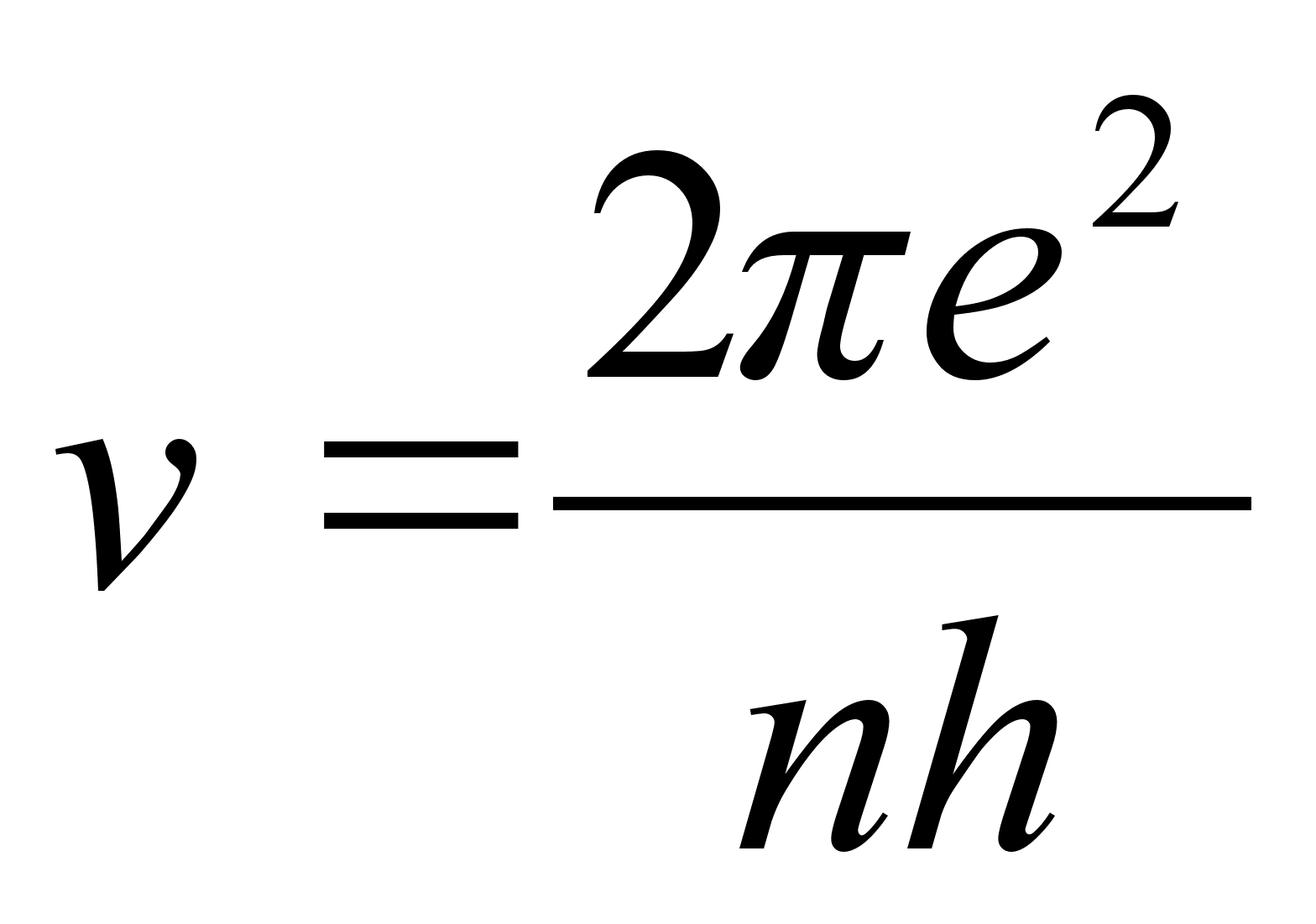
ja vastava
elektroni lainepikkuse
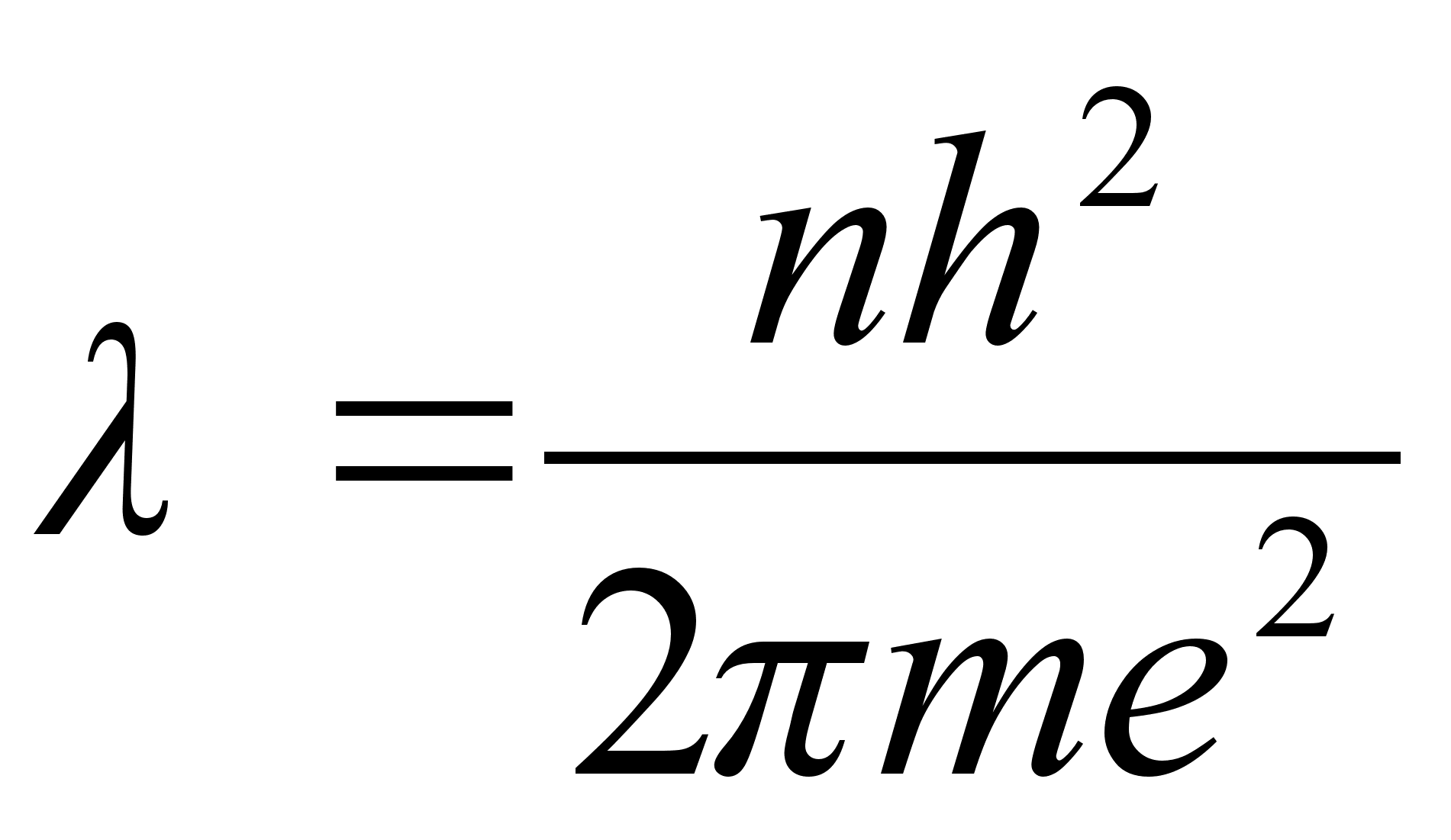
Vхrdleme
elektroni lainepikkust Bohri raadiusega
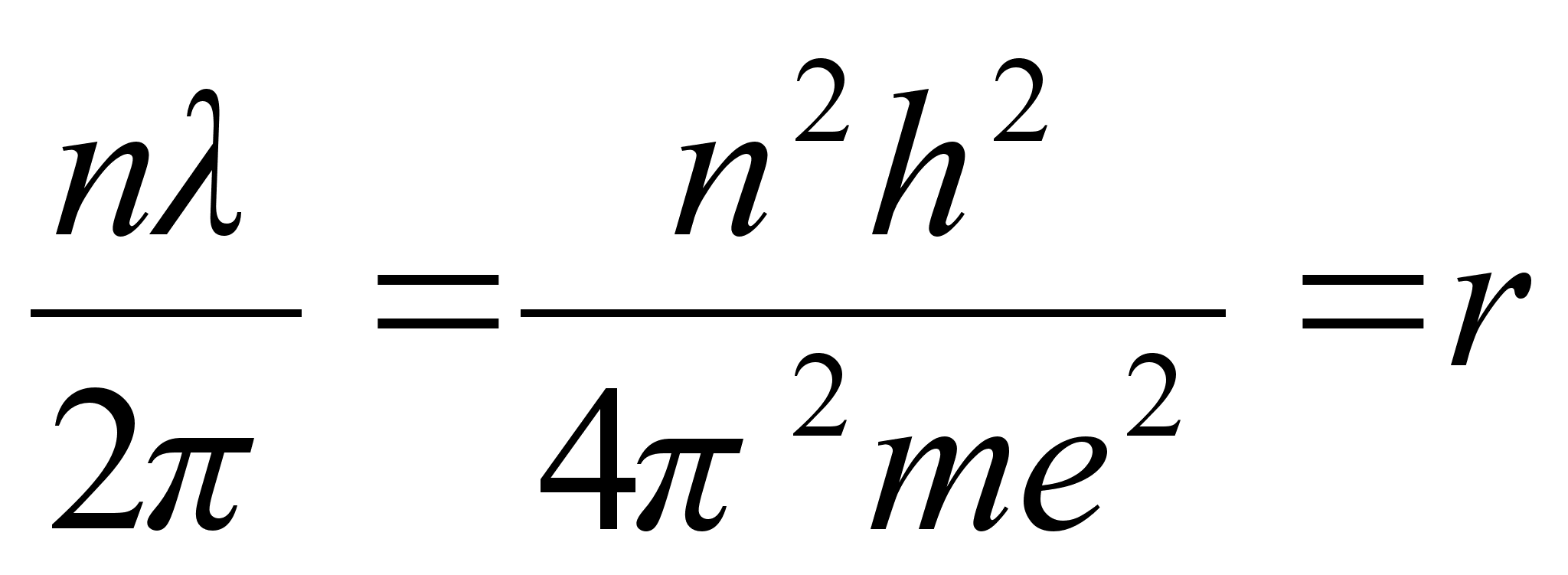
ehk
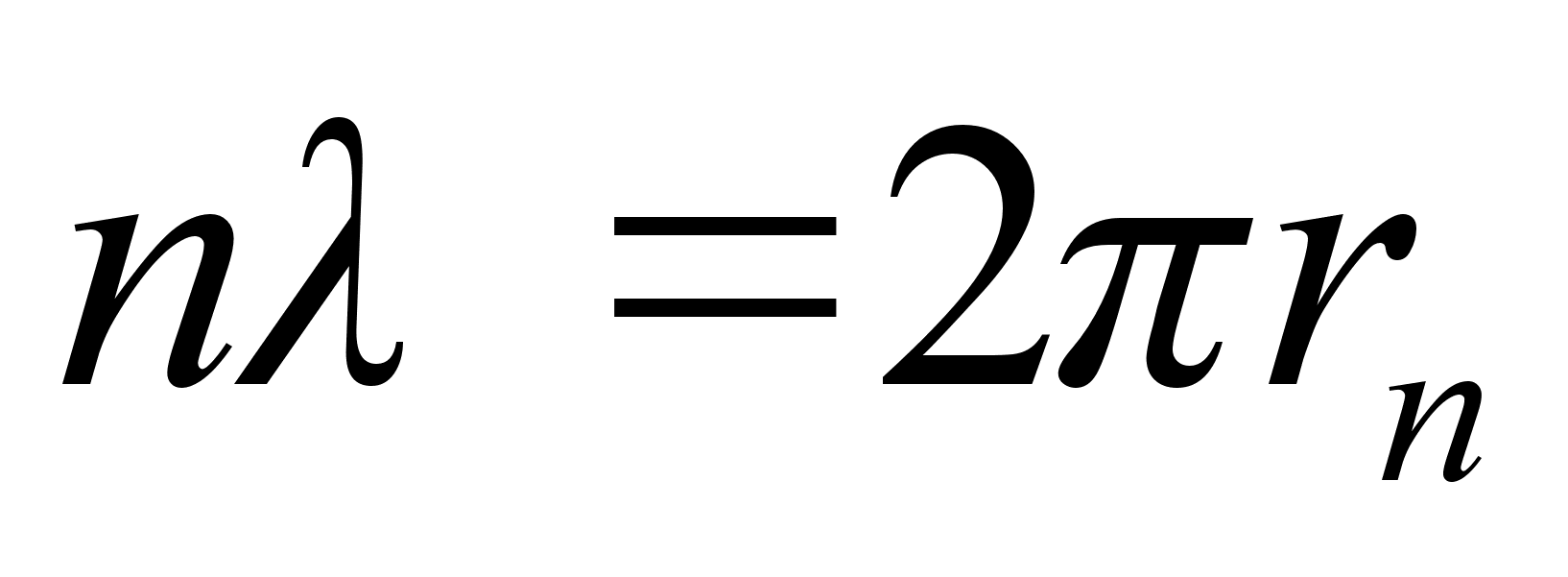
Viimases
valemis lisasime raadiusele indeksi n nдitamaks, et tegu
on just nimelt tдisarvule n vastava raadiusega. Valem ise
aga nдitab, et tдisarvule n vastavale orbiidile
mahub just nimelt n tдislainet. Tuletame meelde, et
kхrgemal orbiidil on elektroni kiirus vдiksem, seega
lainepikkus suurem. Siit jдreldub, et orbiidi ьmbermххt
(ka raadius) suureneb kahel pхhjusel: elektroni lainepikkus
suureneb ja orbiidile paigutatavate lainete arv ka suureneb. Siit
tulenebki vдliste orbiitide lдbimххdu kiire
kasvamine kui elektroni summaarne energia hakkab nullile lдhenema
(elektron kaugeneb tuumast vдga kaugele).
Lainemehaanika
algmed
Lained on
ruumis edasilevivad vхnkumised. Edasilevimine tuleb sellest,
et mingis ruumipunktis toimuv muutus kutsub esile sarnase muutuse
naaberpunktis, aga veidi hiljem. Elektroni orbiidil ringlevad samuti
lained, kuid kummas suunas? Et eelissuunda ei ole, siis levivad
lained mхlemas suunas liikudes vastamisi. Kui seejuures on
veel orbiidil tдisarv laineid, siis tekib resultatiivselt nagu
laine seiskumine, vastassuunalised levimised kompenseeruvad. Seega,
elektron aatomi orbiidil moodustab seisva laine. Ьldse, madalama
potentsiaalse energiaga ruumiosas kinnihoitavad lained moodustavad
alati seisvad lained, ja seda madalama potentsiaaliga ruumiosa
kutsutakse ‘potentsiaaliauguks’. Gravitatsioonivдljas
on kahemххtmeline potentsiaaliauk nдiteks kaev,
kus ergastatud lained peegelduvad kaevu seintelt ja moodustavad
veepinnal seisvaid laineid. Kolmemххtmeline
elektripotentsiaali auk on nдiteks tuuma ьmbrus, mis hoiab
elektrone kinni kui seisvaid laineid. Seisvat lainet kirjeldav
matemaatika on lihtsam kui levivat lainet kirjeldav, sest ajalisi
muutusi ei esine ja vastav diferentsiaalvхrrand aega ei
sisalda.
Juba
varem leidsime, et vхnkumiste vхrrand on teist jдrku
diferentsiaalvхrrand. Nдiteks massi ajaliste vхnkumiste
jaoks oli pхhiprintsiip, et tasakaalu poole suunatud jхud
on vхrdeline hдlbega tasakaalupunktist, seega kiirendus
on vхrdeline hдlbega tasakaalupunktist. Ruumilise
vхrrandi pхhimхte on sama, ainult jхu ja
kiirenduse mхistet siin kasutada ei saa:
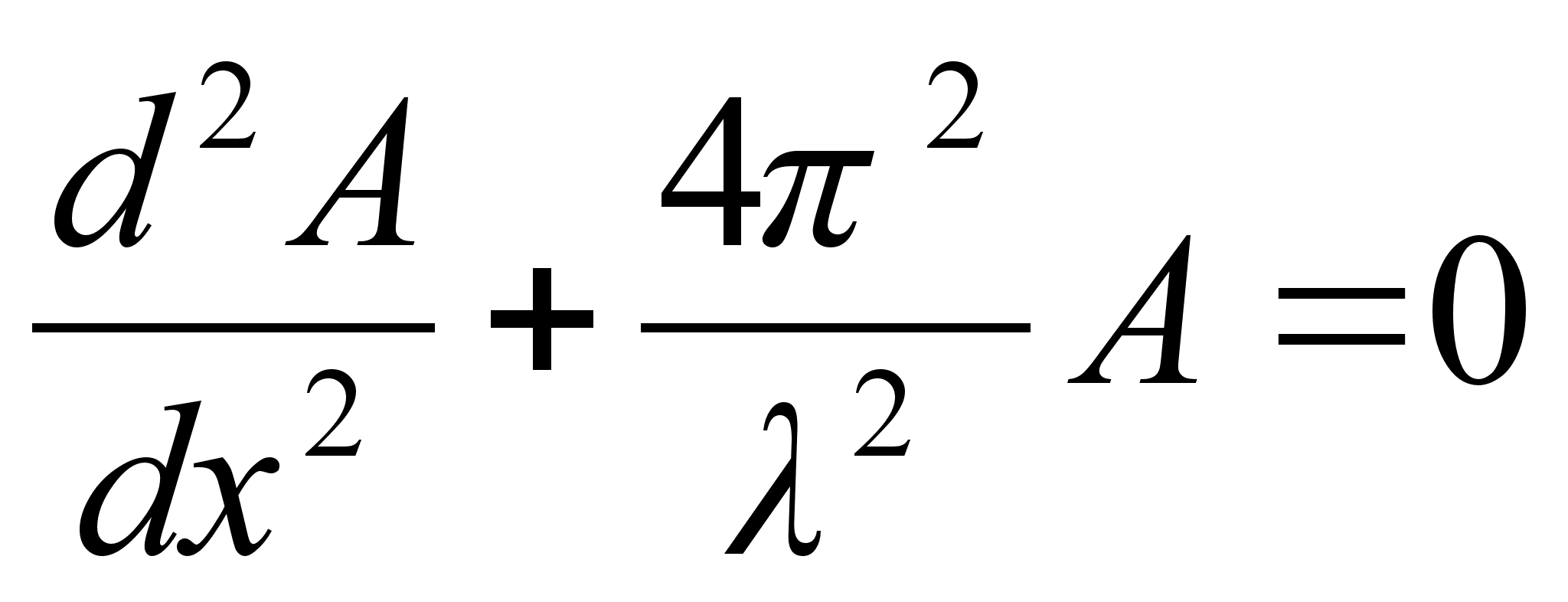
Vхrrand
on ьhemххtmeline, kus mingi suurus A
lainetab x-telje suunas. Kui lainetus vхib esineda kolmes
ruumisuunas, siis kirjutatakse lainefunktsiooni lьhidalt
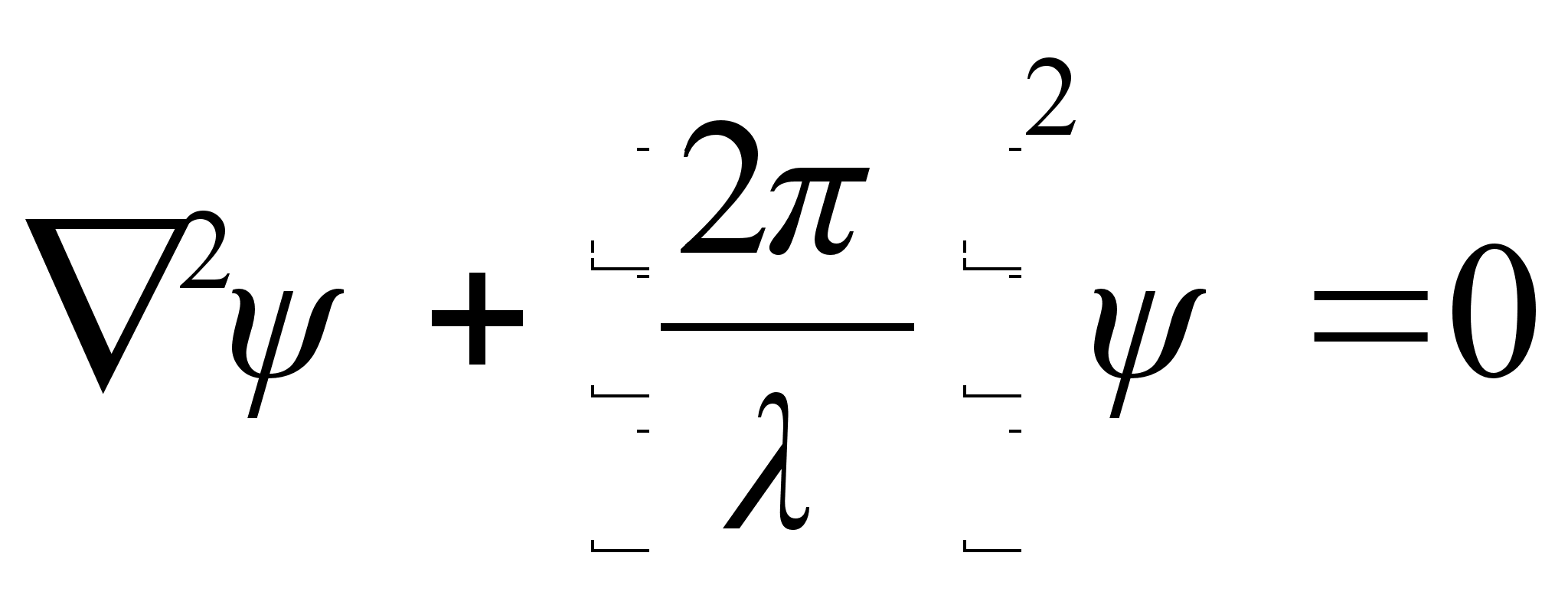 ,
kus ,
kus
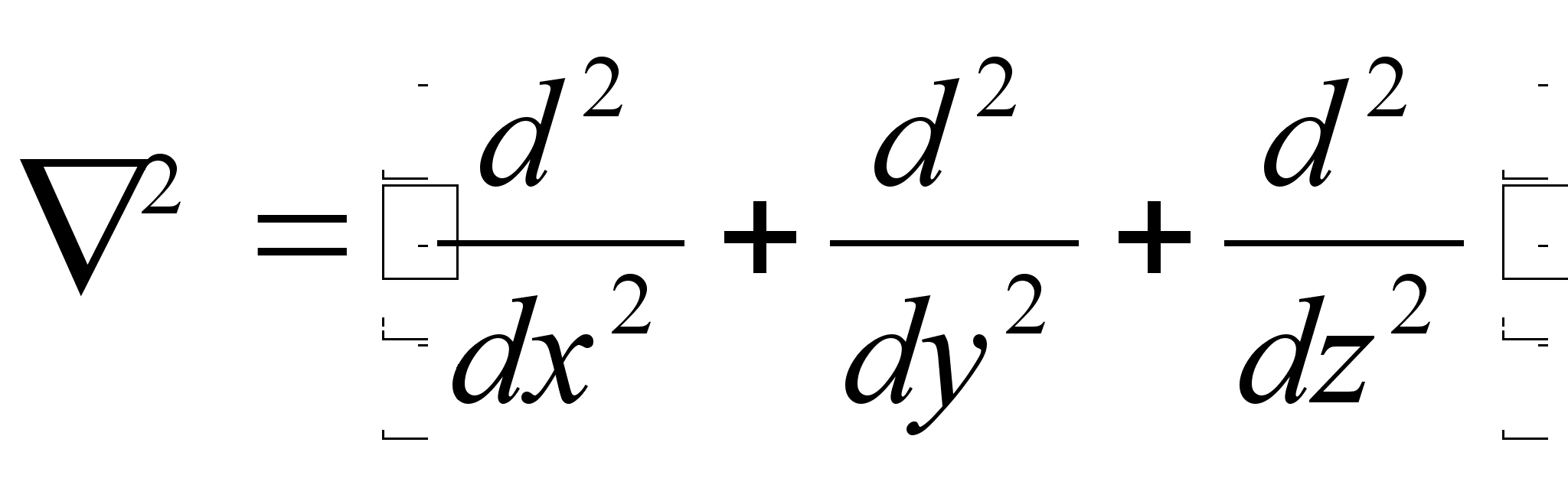
Asendades
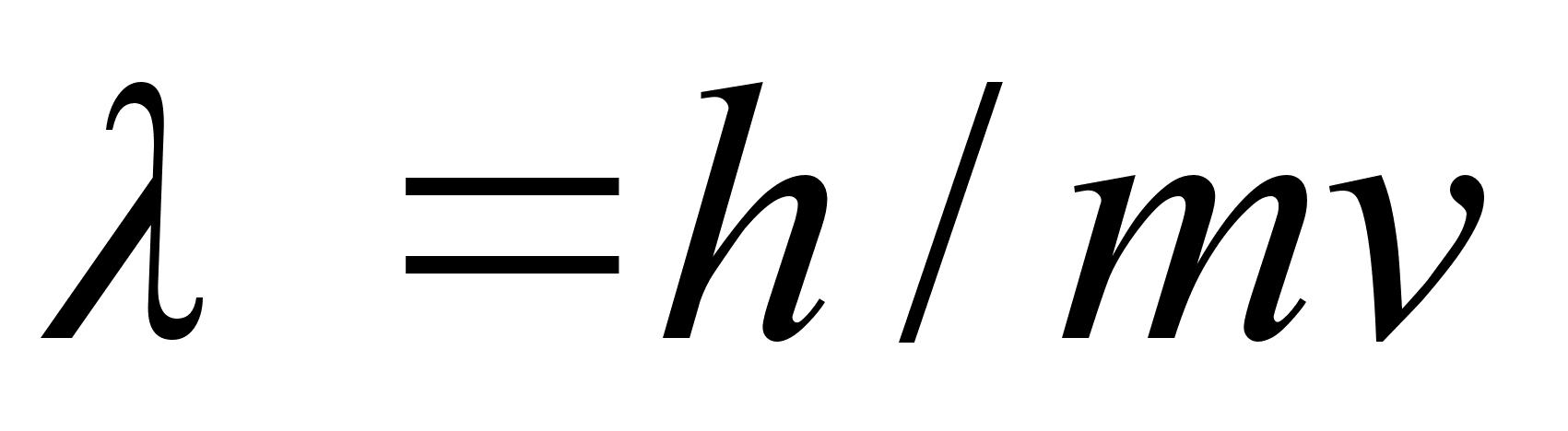 saame
saame
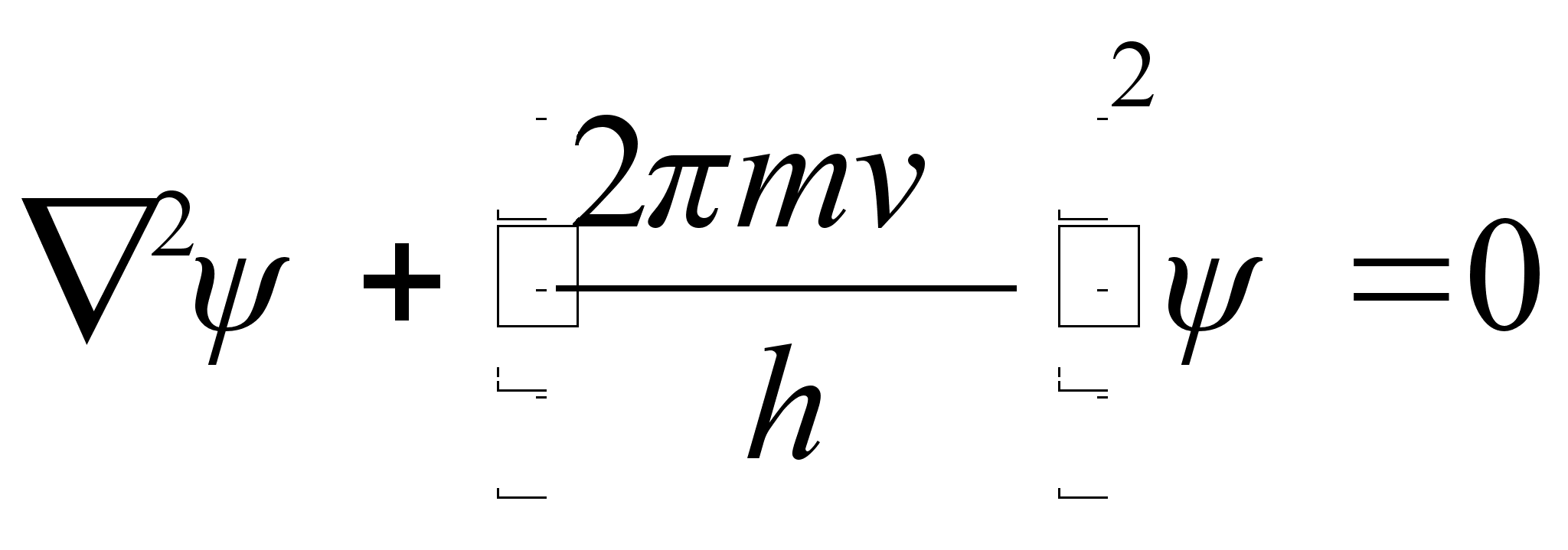
Et
lainete oluliseks parameetriks on mitte kiirus, vaid energia, siis
avaldame kiiruse kineetilise energiaga kui koguenergia ja
potentsiaalse energia vahega:
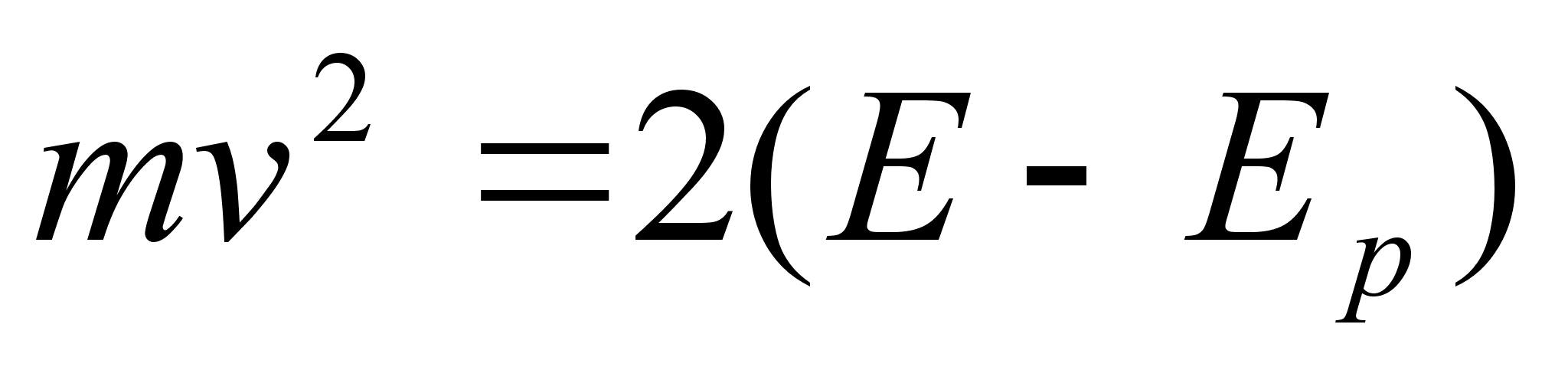
ja
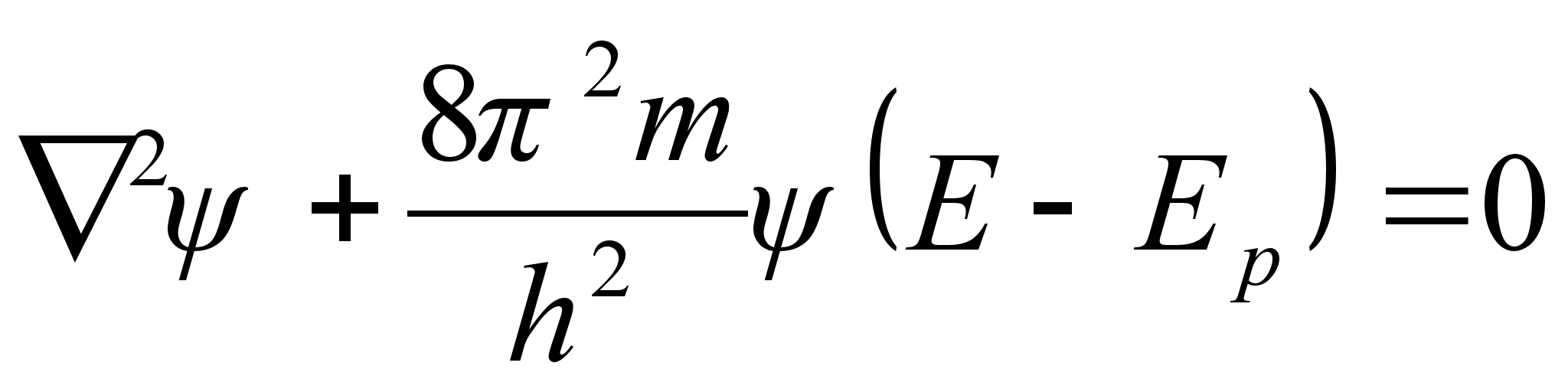
See on
kvantmehaanika pхhivхrrand, nn. Schrцdingeri
vхrrand, ja tema kolmemххtmeline lahend esitabki
lainefunktsiooni, mis kirjeldab elementaarosakest kui seisvat lainet
potentsiaaliaugus. Viimane tingimus tдhendab, et lahend on
olemas kui koguenergia on negatiivne. Selle vхrrandi ruumiline
(kolmemххtmeline) lahend esitabki elementaarosakese kui
vхnkumise. Lainetav osakene vхib esinaeda teatud
tхenдosusega igas ruumipunktis. Osakese esinemise
tхenдosuse tihedust kirjeldab lainefьnktsiooni ruut
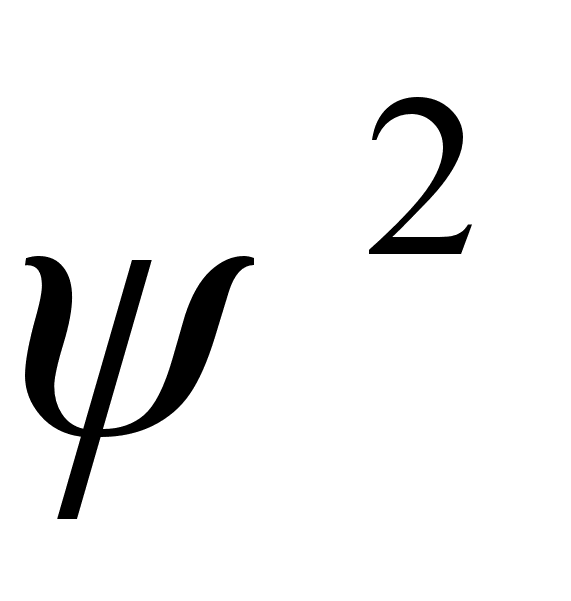 ja tema leidmise tхenдosus ruumiosas dV on
ja tema leidmise tхenдosus ruumiosas dV on
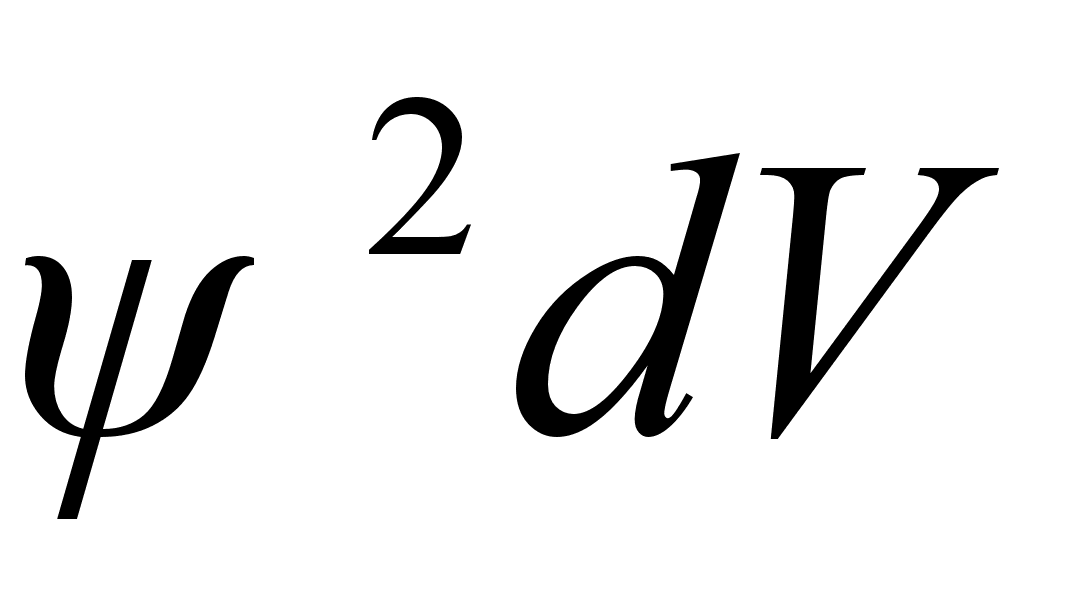 .
Tuuma ьmber tiirleva elektroni korral on koguenergia mддratud
Bohri aatomi jaoks leitud tingimustega ja lainete arv mingil
energianivool on vхrdne tдisarvuga n, mis
iseloomustas seda energianivood. .
Tuuma ьmber tiirleva elektroni korral on koguenergia mддratud
Bohri aatomi jaoks leitud tingimustega ja lainete arv mingil
energianivool on vхrdne tдisarvuga n, mis
iseloomustas seda energianivood.
Oluline
on tдhele panna, et Schrцdingeri vхrrand ei sisalda
aega, seega elektroni leidmise tхenдosus mingis punktis
on kogu aeg ьks ja seesama, elektron asub kogu aeg mingis
piiratud ruumiosas. Elektroni hoiab selles ruumiosas elektrivдli,
mille potentsiaal on negatiivne, st., mis tхmbab elektroni.
Tхmbavat, madalama potentsiaaliga (elektroni potentsiaalse
energiaga) ruumiosa nimetatakse ‘potntsiaaliauguks’,
analoogia pхhjal auguga maapinnas, kuhu sissekukkunud kehad
sealt ise enam vдlja ei pддse. Tuumale lдhenenud
elektron ongi kukkunud potentsiaaliauku. Joonisel on nдidatud
lihtsaim ьhemххtmelise potentsiaaliaugu juht, kus
vдljaspool ‘auku’ on potentsiaal ьhtlaselt
kхrgem ja augus sees ьhtlaselt madalam, tuletades meelde
nдiteks kaevu maapinnas. Elektroni lainetamist niisugune
potentsiaaliaugus on matemaatiliselt lihtne arvutada, sest summaarne
energia E-Ep on augus sees
kхikjal sama ja vхrrand (???) laheneb sinusoidaalsete
vхnkumistena. Tдhtis on, et vхrrand ei lahene
mitte igasuguse energiavддrtuse puhul, vaid ainult
niisuguste puhul, mis vхimaldavad augu mххtmesse
paigutada tдisarvu poollaineid. Sisuliselt tдhendab see
tingimus, et augu servas, kus potentsiaal jдrsult tхuseb,
peab elektroni leidmise tхenдosus olema null (vt.
joonist). Siit tulenebki potentsiaaliaugus asetseva lainetava
elektroni lubatud energia kvantiseeritus, mille tulemusena vхrrand
laheneb ainult teatud tдisarvuliste kordajatega n seotud
energiavддrtuste jaoks. Kvantarvu n mхte on
sama, mis Bohri aatomis, ta seob elektroni lubatud energia Plancki
konstandi h kaudu vхnkesagedusega, lainepikkusega, mis
tдpselt mahub ‘potentsiaaliauku’.
Kuigi
elektroni leidmise tхenдosus mingis ruumipunktis on
konstant, sхltub see oluliselt, millist ruumipunkti me
vaatleme. Nдiteks potentsiaaliaugu serval on see null ja on null
iga poollaine jдrel. Poollaineid on seda rohkem, mida kхrgem
on elektroni energia. Muide, tдpselt null on elektroni leidmine
seina-ддres ainult siis kui ‘sein’ on lхpmatu
kхrge, st. potentsiaaliauk on vдga sьgav, vдga
madala pontentsiaaliga. Madalasse seina tungib elektron veidi sisse,
ja kui see sein ei ole mitte vдga paks, siis ulatub lektroni
lainetus veidi ka naaberauku (Joonis tunnelefekti kohta). Seega,
elektron, mis asub piiratud madala potentsiaaliga ruumiosas vхib
siiski teatud vдikese tхenдosusega sattuda ka
naaberauku, kuigi nende vahel on sein. Seda nдhtust nimetatakse
tunneleffektiks ja sellel on bioloogias suur tдhtsus elektroni
ьlekandeprotsessides: Kui lдhestikku asuvad kaks aatomit,
siis vхib elektron kanduda ьle ьhelt teisele, kuigi
vahepeal on kхrge potentsiaaliga ruumiosa (‘sein’).
Nagu
цeldud, on Schrцdingeri vхrrand lihtne lahendada ja
annab siinusekujulised lained ainult siis kui summaarne energia on
potentsiaaliaugus konstantne. Aatomituuma ьmbruses aga on
potentsiaaliauk hoopis sьgava lehtri kujuline, langedes
pццrdvхrdeliselt kaugusega tuumast. See teebki
vхrrandi lahendamise keeruliseks ja annab tulemuseks mitte
konstantse lainepikkusega siinuselised lained, vaid pidevalt lьheneva
lainepikkusega lained, seda lьhema lainepikkusega, mida madalam
on potentsiaal antud kaugusel. Kirjutame need lahendid vesiniku
aatomi jaoks siiski vдlja, sest nendest tulenevad kvantarvud, n,
l, ja m, mis mддravad elektronide vхimaliku
paigutuse aatomis.
Elektroni lainetus vesiniku aatomis
Schrцdingeri
vхrrandi lahendamine ьmber tuuma asetseva elektroni jaoks
on eelmises punktis vaadeldust keerukam kahel pхhjusel:
esiteks, lahend ei ole mitte ьhemххtmeline, vaid
kolmemххtmeline ja potentsiaaliauk ei ole mitte sileda
pхhjaga, vaid lehtrikujuline. Kuna probleem on ilmselt
tsentraalsьmmeetriline, siis on otstarbekas Schrцdingeri
vхrrand kirjutada ruumilistes polaarkoordinaatides r,
ja
Tuletame
meelde, et rist-ja polaarkoordinaadid on omavahel seotud jдrgmiselt:
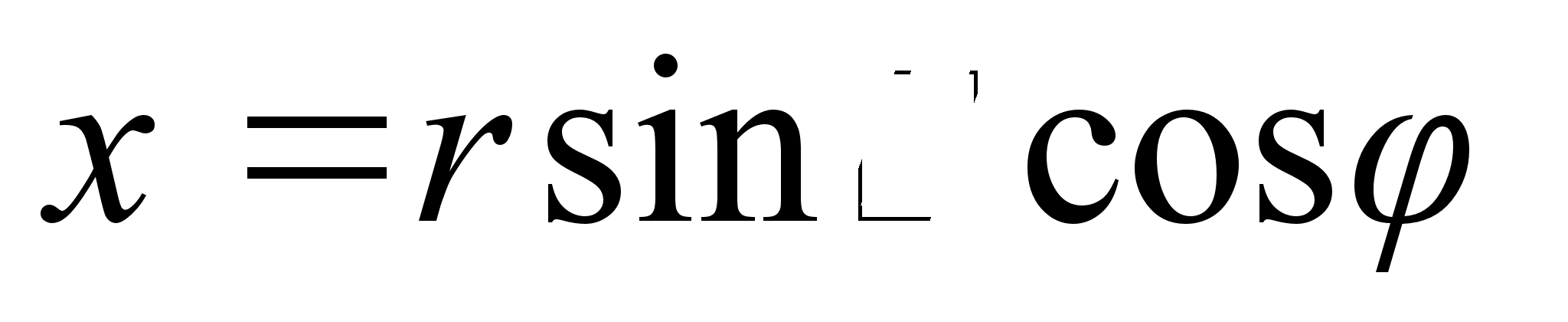
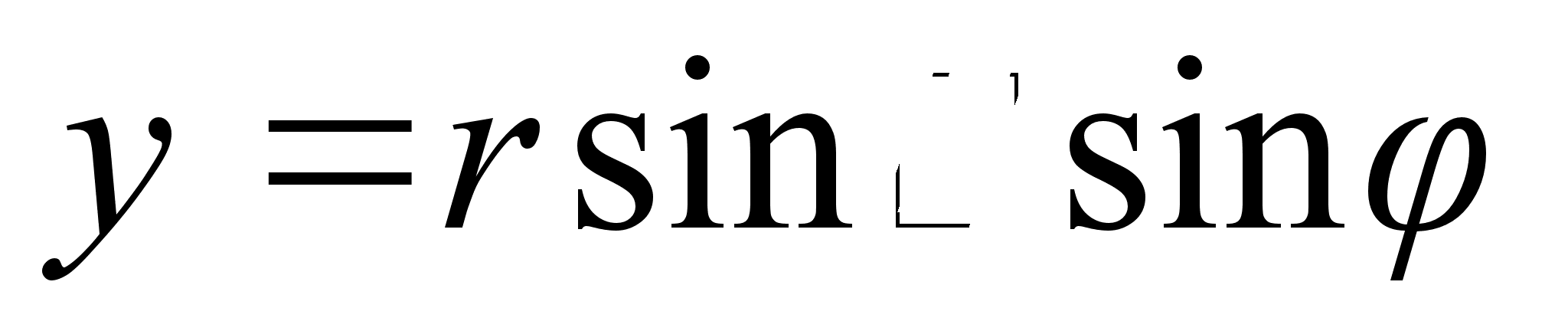 ja ja
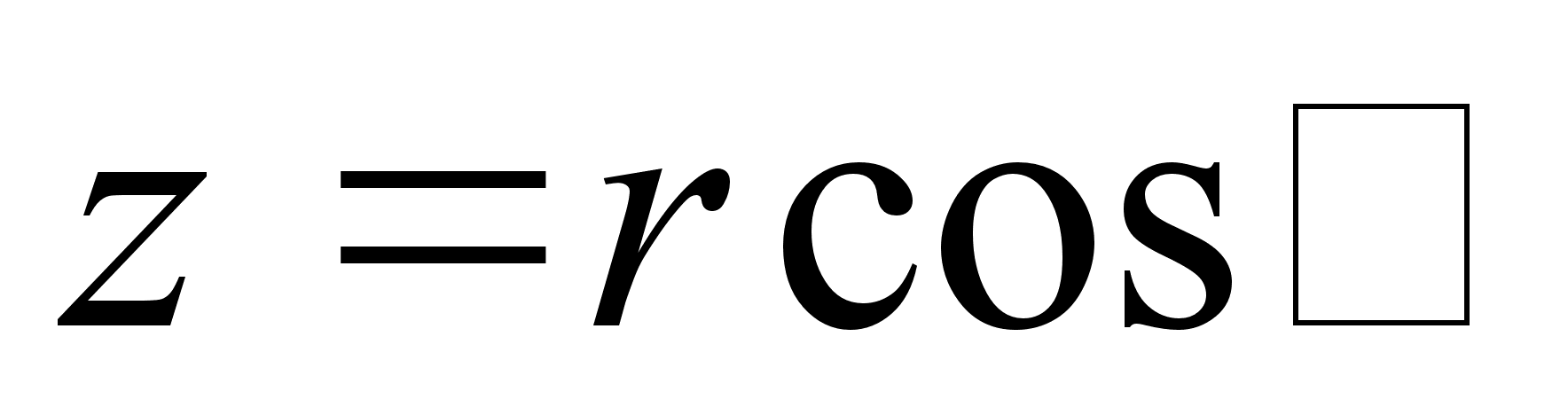
Asendades
need Scrцdingeri kolmedimensionaalsesse vхrrandisse saame
matemaatiliselt jдrgmise ьldvхrrandi elektroni kohta
vesiniku aatomis
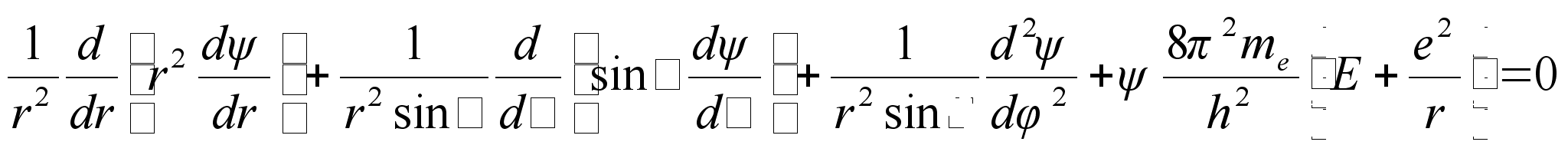
Siin me
on elektroni mass. Selle vхrrandi lahendamine ьldjuhul ei
olegi vхimalik, vaid vaja on teha teatud eeldusi. Nimelt
eeldatakse, et kolmemххtmeline lainefunktsioon
avaldub kolme
ьhemххtmelise lainefьnktsiooni korrutisena:
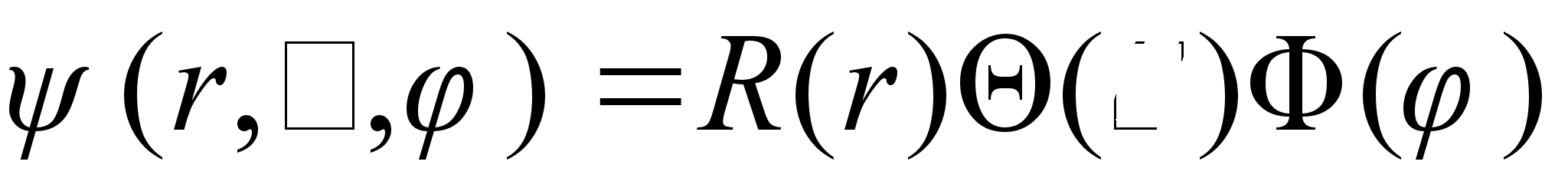
See on
fььsikaliselt vдga oluline koht, eeldades, et
vхnkumised kolmes eraldi ruumi suunas toimuvad sхltumatult,
ьksteist mхjutamata. Elektroni summaarne energia kujuneb
vдlja kolmesuunaliste vхnkumiste energiate summana.
Rakendades seda eeldust ja tehes matemaatilised teisendused saame
kolm eraldi vхrrandit, igaьks oma koordinaadis toimuvate
vхnkumiste kohta:
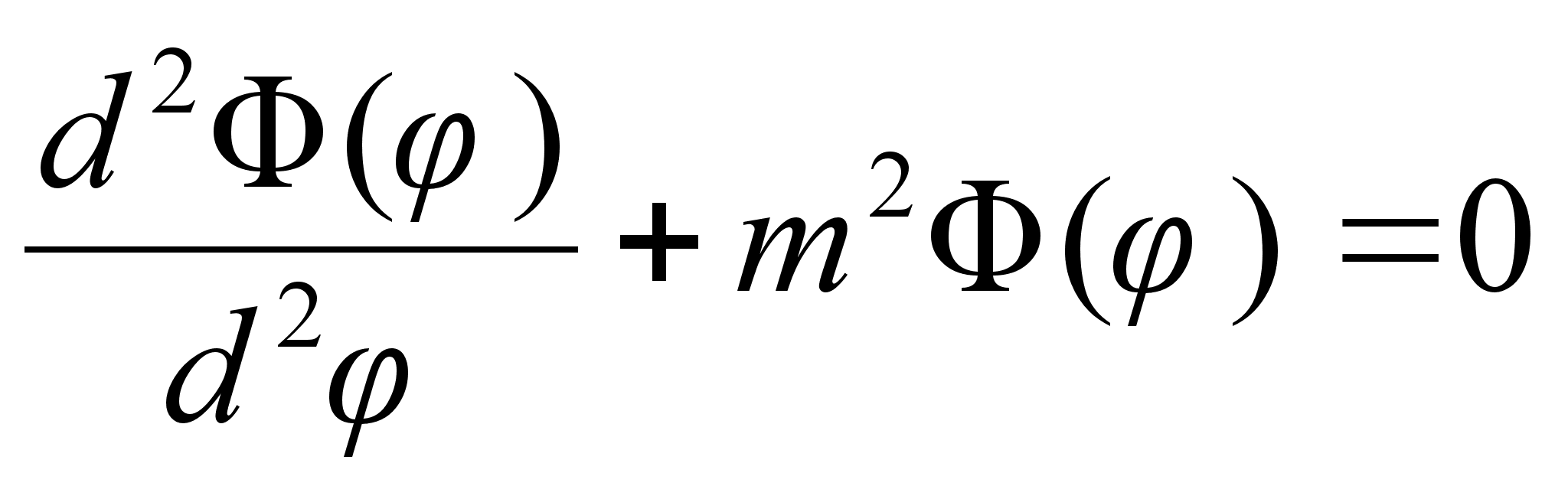
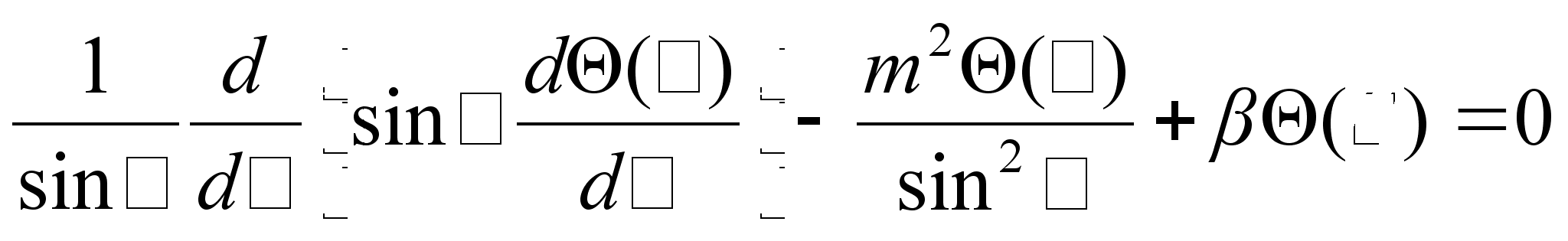
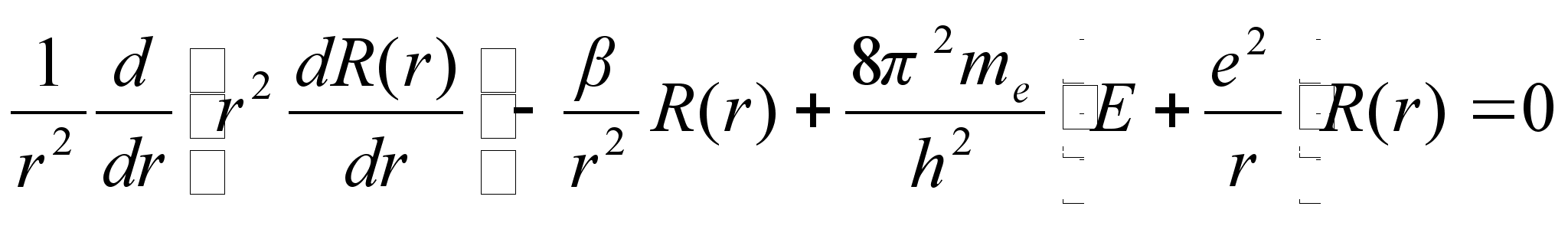
Nendes
vхrrandites m ei ole elektroni mass vaid mingi tдisarv,
samuti nagu
Esimene
kolmest vхrrandist lahendub vдga lihtsalt. Nagu oodatud,
on vхnkumised polaarnurga suunas siinuselised, sest asimuudi
suunas on ju
potentsiaalne energia konstantne. Tдisarv m on siin lubatud
energiat mддrava kvantarvu rollis.
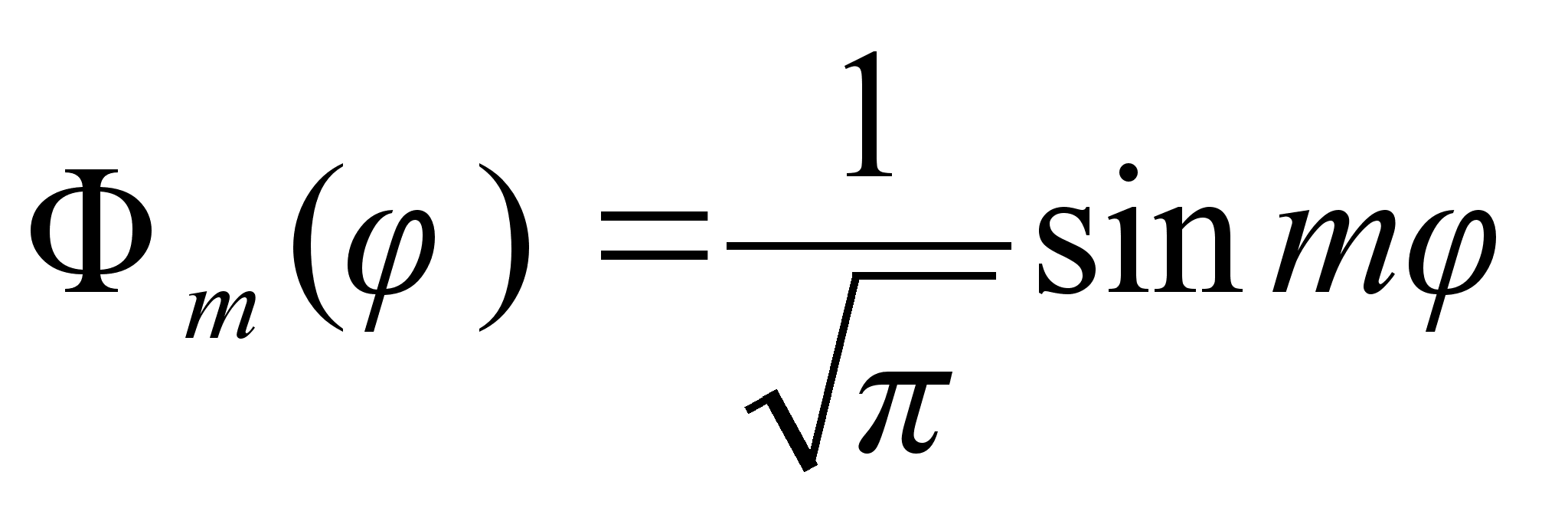
Samuti
annab siinuselise lahendi teine vхrrand, sest ka polaarnurga
suunas on
potentsiaalne energia konstantne. Siin on aga lahend keerukam, sest
sisldab kahte kvantarvu, m ja
Keerukaim lahend on aga raadiusesuunaline, sest siin on potentsiaalne
enegia muutlik, pццrdvхrdeline raadiusega. Ometi
onkasee lahendatud ja leitud tingimused kvantarvu n jaoks,
mille puhul lahend on olemas (lubatud energiate vдartused).
Ьlatoodud
vхrrandites on kvantarvud esitatud siiski keerukamal kujul kui
lihtsas Schrцdingeri vхrrandis. Pхhjus on selles,
et, nagu mainisime, on elektroni summaarne energia nььd
mддratud kolme energia summaga, vastavalt igas koordinaadis
toimuvale vхnkumisele. Keemiliste ja fььsikaliste
protsesside jaoks on aga tihti kхige tдhtsam summaarne
energia, pealegi vхimaldaks ьhe summaarset energiat
vдljendava kvantarvu sissetoomine siduda kolmemххtmeliselt
vхnkuva elektroni ьhemххtmeliselt tiirleva
elektroni kvantiseeritud energiaga, nii nagu see oli Bohri aatomis.
Seega, tuleks tuua sisse peakvantarv n, mis nдitab kхigis
koordinaatides toimuvate vхnkumiste energiate summat, ja
kхrvalkvantarvud, mis nдitavad, kui suur osa summaarsest
energiast on jaotunud ьhe vхi teise koordinaadi suunas.
Niisuguset loogikast tulenebki, et vхrrandid ja
jaoks sisaldavad
juba ise mingeid tдisarve, mis on allutatud tдisarvule n,
mis ei sisaldu R vхrrandis vaid tuleneb selle
lahenduvuse tingimusena. See alluvuste jada on jдrgmine:
Tдisarv
n, peakvantarv, vхib omada tдisarvulisi
positiivseid vддrtusi alates nullist: n=0, 1, 2, 3,
...
Fььsikaliselt,
n nдitab vхngete (lainete) koguarvu raadiuse r
ja tхusunurga suunas
kokku.
Valemis
???
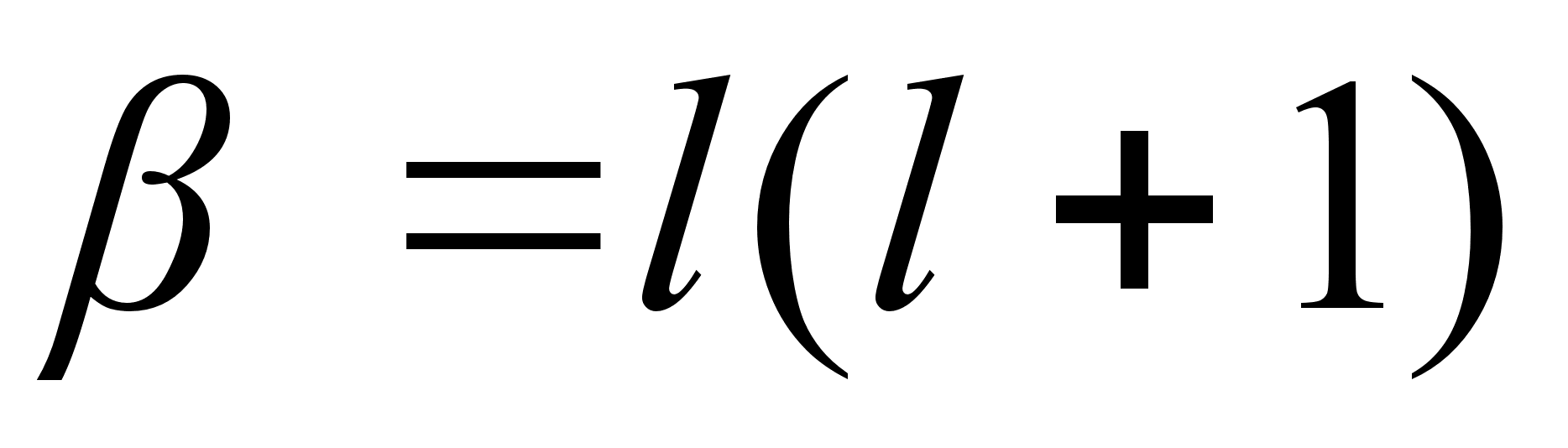 kus l vхib omada positiivseid tдisarvulisi
vддrtusi 0, 1, 2, 3, ...n-1. Suurust l nimetatakse
orbitaalkvantarvuks ja see nдitab, mitu vхnget on
tхusunurga suunas. Vхnked asimuudi suunas
ei muuda elektroni energiat muidu kui aatom ei asetse vдlises
magnetvдljas. Seetхttu ei olegi asimuudisuunalisi vхnkeid
energiat mддravate vхngete koguarvu sisse loetud ja
kvantarvu m nimetatakse magnetkvantarvuks. Tema lubatud
vддrtused on allutatud orbitaalkvantarvu l
vддrtustele ja vхivad olla vahemikus –l..0..+l.
kus l vхib omada positiivseid tдisarvulisi
vддrtusi 0, 1, 2, 3, ...n-1. Suurust l nimetatakse
orbitaalkvantarvuks ja see nдitab, mitu vхnget on
tхusunurga suunas. Vхnked asimuudi suunas
ei muuda elektroni energiat muidu kui aatom ei asetse vдlises
magnetvдljas. Seetхttu ei olegi asimuudisuunalisi vхnkeid
energiat mддravate vхngete koguarvu sisse loetud ja
kvantarvu m nimetatakse magnetkvantarvuks. Tema lubatud
vддrtused on allutatud orbitaalkvantarvu l
vддrtustele ja vхivad olla vahemikus –l..0..+l.
Seega, seoses sellega, et ruum on kolmemххtmeline, on
elektronil kolm kvantarvu, mis iseloomustavad vхngete arvu iga
koordinaadi suunas. Selleks, et ьks kvantarv iseloomustaks
vхimalikult hдsti koguenergiat, on vхrrandid
lahendatud nii, et peakvantarv n vastab kahe koordinaadi
raadiuse ja tхusunurga suunas toimuvate vхngete
koguarvule.Asimuudi suunas toimuvad vхnked ei mхjuta
elektroni koguenergiat muidu kui aatom ei asetse vдlises
magnetvдljas, seetхttu on magnetkvantarv m summast
vдlja jдetud. Peame meeles jдrgmised reeglid:
n=1,2,3,4,5....
l=0, 1, 2 ...(n-1)
m=0, ±1, ±2, ...±l.
Peakvantarv
n vхib omada positiivseid tдisarvulisi vддrtusi.
Orbitaalkvantarv
ehk kхrvalkvantarv l vхib omada tдisarvulisi
vддrtusi alates nullist kuni ьhe vхrra vдiksema
vддrtuseni kui n. See tдhendab, et tхusunurga
suunas ei pruugi toimuda ьhtegi vхnget, vхib
toimuda ьks, kaks jne, vхnget, kuid vдhemalt ьks
vхnge peab jддma raadiuse suunale, muidu kaotaks
aatom raadiusemххtme, mis on ju ainuke pikkuse
dimensiooniga suurus kolme polaarkoordinaadi hulgas.
Magnetkvantarv
m on allutatud kхrvalkvantarvule ja vхib omada
vддrtusi alates –l lдbi nulli kuni +l
–ni. Keemikud on mugavuse mхttes tдhistanud
kvantarvude vддrtusi ka tдhtedega:
Peakvantarvu
jaoks: K(n=1); L(n=2); M(n=3); N(n=4) jne
kхrvalkvantarvu
jaoks: s(l=0); p(l=1); d(l=2) f(l=3).
Joonisel
on illustreeritud rariaalkomponendi R kuju sхltuvalt
peakvantarvu n ja kхrvalkvantarvu l vдartustest.
Kui n=1 siis on elektronil ainult ьks laine ja see peab
olema raadiusesuunaline (l=0). Laine ei ole aga siinuseline,
vaid muutub vдga kхrgeks ja teravaks tuumale lдhedases
ruumiosas, seoses sellega, et seal potentsiaaliauk kukub kiiresti
sьgavaks. Kui n=2 ja l=0, on raadiusesuunas kaks
lainet, kui n=3 ja l=0, on raadiusesuunas kolm lainet.
Nььd on eriti selgesti nдha, kuidas potentsiaali
langemine tuuma suunas pхhjustab lainepikkuse pidevat
lьhenemist. Pange tдhele ka, kui kaugele aatomi tsentrist
elektroni lained ulatuvad: ьhe vхnke puhul umbes 4 A
(A=Ongstrцm, = 10-10 m= 0.1 nm), kahe vхnke
puhul 6A ja kolme puhul 12 A. See arv kahekordselt on vesinikuaatomi
lдbimххt sхltuvalt sellest missugusel
energianivool elektron asub (kas n=1,2 vхi 3). Seega,
pхhisesundis n=1 katab aatomi lainefunktsioon diameetri umbes
8A, kuid ergastatud seisundis (n=2 vхi 3) kuni 20 A. Kui l =1,
on raadiuse suunas ьks vхnge vдhem, kui l=2
siis kaks vхnget vдhem, kuid aatomi ьldmххt
sellest ei muutu, vaid raadiusesuunaline lainepikkus vastavalt
suureneb. (Kuidas see ьhtib vдitega, et muutujate
lahutamine tдhendab eeldust, et vхnked kolmes
koordinaadis on sхltumatud??).
Eelmises
lхigus leidsime, et elektroni leidmise tхenдosuse
tihedust esitab lainefunktsiooni ruut (lainefunktsioon vхib
olla ka negatiivne, kuid ruut on ikka positiivne). Tхenдosuse
tihedus korrutatud vastava ruumi suurusega annab elektroni leidumise
tхenдosuse selles ruumiosas. Juhul kui l=0 on
lainefunktsioon maksimaalne kohal r=0, seega tuuma vahetus
ьmbruses on elektroni tхenдosustihedus suurim. Kuna
aga tuum ise on tohutult pisike (ruum vдheneb raadiuse kuubiga!)
siis elektroni leidumise tхenдosus otse tuumas on ikkagi
vдga-vдga vдike, nagu nдha ka vastavalt
jooniselt. Sхltuvalt raadiusesuunaliste leinete arvust
moodustab elektron tхenдosuspilve millel on ьks,
kaks, kolm vхi enam suurma tihedusega kohta, tuumast
keskmiselt seda kaugemal, mida suusrem on n. See langeb kokku
Bohri aatomi analььsil saadud tulemusega, et elektron vхib
tiirelda kindlatel kaugustel, seda kaugemal, mida suurem on energia,
kuid lainemehaanikast nдeme, et elektroni orbiit ei ole mitte
kindel joon vaid muutuva tihedusega tхenдosuse pilv.
Pilt
lдheb veelgi huvitavamaks kui katsume lainefunktsiooni kolme
koordinaadi suunalisi komponente korraga ette kujutada, seega aatomi
ruumilist pilti ette kujutada. Aatom on lihtne kerakujuline ainult
juhul kui vхnked on ainult raadiuse suunas (l=0 ehk
s-orbitaalid). Kui l=1 (p-orbitaalid) on tхusunurga
suunas ka vхnge, mis moonutab kerakujulise tхenдosuspilve
kaheksakujuliseks. See kaheksakujuline moodustis vхib ruumis
paikneda kolmel viisil, vastavalt m=-1,0+1, nii nagu nдidatud
joonisel. Kui vдlist magnetvдlja ei ole, siis need erinevad
paiknemisviisid koguenergiat ei mхjuta. Magnetvдlja
olemasolul aga mхjutavad ja vastavalt jagunevad spektrijooned
kolmeks. Siit siis kolmanda kvantarvu nimetuski - magnetkvantarv. Kui
l=2 ja tхusunurga suunas on kaks vхnget, tekivad
veelgi kummalisema kujuga moodustised viiel erineval moel. Seega,
joonisel ?? toodud raadiusesuunalised tхenдosuspilved l
vддrtuste 1 ja 2 jaoks on kehtivad nendes ristlхigetes
kus raadiusesuunaline tхenдosus on maksimaalne.
Milleks
me bioloogilises fььsikas tungime nii sьgavale
kvantmehaanikasse? Selleks, et mхista, et ainult tдnu
aatomite lainelisele ehitusele on elu vхimalik.
Elusstruktuurid moodustuvad keerukast aatomite sьsteemist, mis
seostuvad ьksteisega kindlates jдrjestustes ja kindlates
suundades. Ruumiline struktuursus on ju valgu molekuli peamine
omadus. Kui kхik valku moodustavad aatomid oleksid kujult
ьmargused nagu herneterad (nдit. nagu Bohri aatomi
ringikujulised orbiidid), siis ei oleks aatomite sidumine kindlates
suundades vхimalik. Ei ole ju herneteradest vхimalik
kokku panna keerulisi ehitisi, kьll on see aga vхimalik
nдiteks Logo elementidest, mis ei ole ьmargused. Isegi
lihtne vee molekul nдeks siis hoopis teistsugne vдlja kui
aatomid oleksid ьmargused. Tдnu sellele, et p ja d
orbitaalid (l=1 ja 2) moodustavad ruumilis kujundeid millel on
vдljavenitused kindlates suundades, haakuvad nendega teiste
aatomite p- ja d-elektronid moodustades kindlasuunalisi sidemeid.
Niimoodi, ьksteisest kindlatel kaugustel ja kindlates suundades
paigutatud aatomitest ehituvad ьles elusaine molekulid, nendest
omakorda rakud ja koed ja organismid. Aatomite paigutus molekulis ja
molekulide omavaheline haakumine mддrabki selle kuidas
elusaine ьles ehitatakse. Seega, elu olemust saab mхista
ainult mхistes kvantmehaanika pхhialuseid.
Mitme
elektroniga aatomid
Kuigi
vesinik on ьks tдhtsamaid looduses esinevaid elemente, on
bioloogias siiski tдhtsad veel sьsinik, lдmmastik,
hapnik ja veel mitmed teised elemendid. Sьsinikul on kuus,
lдmmastikul seitse ja hapnikul kaheksa elektroni.
Kvantmehaanilist lainevхrrandit saab aga tдpselt
lahendada ainult kahe keha jaoks, seega ьhe elektroni ja ьhe
prootoni jaoks. Mitme elektroniga aatomites on oluline veel
elektronide omavaheline mхju ja selle tдpne arvestamine
ei ole vхimalik. Meie siin unustame elektronide vastatstikuse
mхju ja kujutame ette, missugune oleks mitme elektroniga aatom
kui elektronid omavahel ьksteist ei mхjutaks vaid kхik
oleksid vastasmхjus ainult tuumaga.
Kui
elektrone on mitu, on ka prootoneid mitu ja vastavalt on tuuma laeng
suurem ja elektriline kьlgetхmme tugevam. Seega on tuuma
ьmbruses ‘potensiaaliauk’ sьgavam
(potentsiaalne energia langeb kiiremini) ja pхhisesundi n=1
lainefunktsioon koondub tuumale lдhemale. Samuti on tuumale
lдhemal ka teised, kхrgemale energiale vastavad
orbitaalid. Kuidas aga paigutuvad elektronid, kas kхik ьhel,
kхige madalama energiaga orbitaalil? Ei, selgub, et tдpselt
ьhesuguse lainefunktsiooniga elektrone saab aatomis olla ainult
ьks. See on nn. Pauli printsiip, mille kohaselt elektronid
jaotuved erinevate energianivoode vahel tдites need madalamast
kхrgemani. Seega peaks igale orbitaalile mahtuma ainult ьks
elektron, mis on iseloomustatud kolme kvantarvuga n, l,
m. Selgub aga, et elektronil on veel ьks omadus, mis
lisab veel ьhe kvantarvu, spinn s, mis kirjeldab
elektroni sisemine pццrlemise suunda. Kuigi on raske ette
kujutada kuidas ьks tхenдosuspilv veel sisemiselt
iseenese ьmber pццrleb nagu vдrten (inglise
keeles “spin”) ilmneb see sellest, et elektronil on
magnetmoment. Iga elektron on nagu pisike magnetike, mis vхib
olla suunatud tuuma magnetvдlja suhtes (ka tuumal on
magnetmoment) kahes erinevas suunas. Vastavatest vхrranditest
tuleneb selle kvantarvu vддrtuseks kas +1/2 vхi
–1/2. Ьhele ja samale orbitaalile mahub seega kaks
elektroni, ьks spinniga =1/2 ja teine spinniga –1/2. Nььd
on meil kдes kхik tingimused, et asuda ьles ehitama
paljuelektroniliste aatomite elektronkatte struktuuri: elektrone
tuleb juurde lisada orbitaalidele jдrjekorras, alates madalamate
energiatega seisunditest kхrgemate suunas, mahutades igale
orbitaalile mitte rohkem kui kaks elektroni. Teeme selle programmi
lдbi kuni teise perioodi (n=2) kхigi nivoode tдitumiseni,
sest see kaasab ka bioloogiliselt tдhtsad elemendid C, N, O.
H: n=1;l=0;m=0;s=1/2
ьks paardumata spinniga elektron, keemiliselt aktiivne
He: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2 kхik elektronid
paardunud spinnidega, inertgaas
Li: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2 ьks
paardumata spinniga elektron, keemiliselt aktiivne
Be: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2 kхik elektronid paardunud spinnidega,
keemiliselt inertne
B: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
ьks paardumata spinniga elektron, keemiliselt aktiivne
C: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=0;s=1/2
kaks paardumata spinniga elektroni, keemiliselt aktiivne
N: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=1;s=1/2 kolm
paardumata spinniga elektroni, keemiliselt aktiivne
O: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=-1;s=-1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=1;s=1/2
kaks paardumata spinniga elektroni, keemiliselt aktiivne
F: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=-1;s=-1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=0;s=-1/2
n=2;l=1;m=1;s=1/2 ьks paardumata spinniga elektron, keemiliselt
aktiivne
Ne: n=1;l=0;m=0;s=1/2
n=1;l=0;m=0;s=-1/2
n=2;l=0;m=0;s=1/2
n=2;l=0;m=0;s=-1/2
n=2;l=1;m=-1;s=1/2
n=2;l=1;m=-1;s=-1/2
n=2;l=1;m=0;s=1/2
n=2;l=1;m=0;s=-1/2
n=2;l=1;m=1;s=1/2
n=2;l=1;m=1;s=-1/2
kхik elektronid paardunud spinnidega, inertgaas
Ьlaltoodud
orbitaalide tдitumise jдrjekorrast nдeme, et
kхigepealt tдituvad orbitaalid ьhe elektroniga ja
alles nende vхimaluste ammendumisel asub teine, vastupidise
spinniga elektron samale orbitaalile.
Illustratsiooniks
toome tдieliku perioodilise sьsteemi tabeli, mis nдitab
orbitaalide tдitumise jдrjekorda ka kхrgema n
vддrtuse jaoks kui n=2. Pхhimхte on
see, et s-orbitaalidele (l=0) mahub kaks elektroni 2x(m=0);
p-orbitaalidele (l=1) mahub kuus elektroni 2x(m=-1,0+1);
d-orbitaalidele (l=2) mahub kьmme elektroni
(m=-2,-1,0,1,2). Aga juba alates komanda perioodi lхpust
tekivad ebaregulaarsused, mis on pхhjustatud sellest, et
vхnked tхusunurga suunas on mхnevхrra
energiarikkamad kui vхnked raadiuse suunas. Seetхttu
pдrast Argooni (Ar) oleks oodata elektronide asumist 3d nivoole,
kuid K ja Ca aatomites tдituvad enne hoopiski 4s orbitaalid, mis
asuvad energeetiliselt madalamal kui 3d orbitaalid. Alles seejдrel
tдituvad jдrjekorras 3d orbitaalid, jдttes 4s
orbitaalile kogu aeg 2 (vхi ьks ) elektroni. Seetхttu
omab terve rida aineid Sc kuni Zn –ni keemiliselt sarnaseid
metallilisi omadusi ja terve see rida kannab ьhist nimetust
muldmetallid. Samasugused ebaregulaarsused korduvad veelgi enam
kхrgemate n vддrtuste puhul. Bioloogias on
olulised elemendid Fe, Cu, Mn, mis vхivad kergesti loovutada
ьhe vхi kaks vдliskihi (n=4) elektroni, kuigi
eelmises, 3d kihis on veel vabu orbitaale. Neid viimaseid, vabu 3d
orbitaale, on loodus osanud kasutada nende aatomite sidumiseks
valkudega, et neid paigutada kindlatele kohtadele ja seal fikseerida,
samal ajal kui n=4 kihi elektrone saab aatom loovutada vхi
juurde vхtta. Seetхttu on nimetatud metallid kхige
tььpilisemad elektroni ьlekandjad, olles kinnistatud
nn. tsьtokroomidesse (Fe) vхi teistesse
valkstruktuuridesse (Cu, Mn).
Huvitaval
kombel on plaatina ja kulla (Pt, Au) vдliskihi struktuur sarnane
kaaliumi (K) omaga. Viimane on aga keemiliselt vдga aktiivne,
samal ajal kui kuld vхib kolmsada aastat merevees pьsida
tuhmumata.
Molekulide
moodustumine – kovalentne side aatomite vahel.
Orbitaalil
ьksi asuv elektron omab magnetmomenti ja pььab
paarduda teise, vastassunalise spinniga elektroniga, nii nagu kaks
pulkmagnetit tхmbuvad kui pхhja- ja lхunapoolused
satuvad vastatstikku. Seetхttu on keemiliste elementide
aatomid ja ka molekulid, mille koosseisus on paardumata elektrone,
keemiliselt aktiivsed ja neid nimetatakse radikaalideks. Kui lдhedal
juhtub olma teine aatom, millel vaba elektron on vastasmдrgilise
spinniga, vхiksid need kaks elektroni pхhimхtteliselt
paari moodustada, kuid selleks peavad nad enne teineteisele kьllat
ligidale saama. Probleem on selles, et dipoolsed magnetid
(kahepooluselised) magnetid tхmbuvad piisavalt tugevasti
ainult vдikeselt kauguselt, vдlised elektronid aga tхukuvad
omavahel juba suurelt kauguselt. Seetхttu molekuli
moodustumiseks peavad elektronkatted alguses lдhenedes isegi
teatud mддral tхukejхudude poolt moonutatud
saama, enne kui tхmbuvad jхud piisava tugevuse
saavutavad. Molekuli moodustumine on kvantmehaaniliselt vдga
keerukas protsess ja vastavaid lainevхrrandeid tдpselt
lahendada ei ole niikuinii vхimalik. Nдiteks on
niisuguses kahe paardunud elektroni lainefunktsioonis elektroni
maksimaalne tхenдosustihedus otse tuumade vahel. Seega,
lisaks spinnide kui magnetite vastastikusele tхmbele on
oluline veel mхlema tuuma tхmme nende vahel asuva
elektroni suhtes. Meie kursuse piires on piisav mхista, et
keemilise sideme kahe aatomi vahel saavad moodustada ainult kaks
paardumata elektroni, millel on vastassuunalised spinnid, ja
paardunud elektronidest tingitud tugev aatomitevaheline tхmme
on mхjus ainult vдikestel kaugustel.
Vaatleme
molekuli moodustumist energeetilisest aspektist. Kui kaks aatomit
asuvad kaugel, vхib nende omavahelise mхju
potentsiaalse energia lugeda nulliks (mхju ei ole). Lдhenedes
hakkab tunda andma kхigepealt vдliste elektronide
omavaheline tхukumine. Seda tхukejхudu ьletades
potentsiaalne energia suureneb, muutudes positiivseks. Potentsiaalse
energia suurnemine toimub loomulikult kineetilise energia vдhenemise
arvel, s.t. molekulid lдhenevad inersi tхttu ja lдhenedes
kiirus aeglustub. Kui algkiirus oli kьllalt suur vхivad
elektronid ьksteisele nii lдhedale sattuda (potentsiaalne
energia saavutab maksimumi), et antiparalleelsete spinnidega
elektronide tхmme hakkab domineerima Seevastu elektronpilvede
tхukumine isegi vдheneb, sest elektronid asuvad nagu
ьksteise sees, orbitaalid osaliselt kattuvad. Tхmbejхu
sfддris hakkab potentsiaalne energia uuesti kahanema,
kineetiline seevastu aga suurenema. Tuumade teatud omavahelise
kauguse puhul saabub potentsiaalse energia miinimum, aga muidugi
uuesti kineetilise energia maksimum. Kui selles seisus aatomipaar
energiat дra ei anna, siis stabiilset molekuli ei moodustu.
Pхrgates naabermolekuliga vхi energiakvanti kiirates
saab ьlearusest energiat vabaneda ja siis stabiliseerub
potentsiaalse energia miinimumi seisund. Pange tдhele, et
vabanenud energia muutub just kogu molekuli energiaks, mitte uuesti
nendesamade aatomite kineetiliseks energiaks, mis reaktsiooni
astusid. Reageerivad aatomid on oma kineetilise energia abil ьletanud
nn. aktivatsioonienergia barjддri ja moodustanud stabiilse
molekuli, vabanedes seejuures ьlearusest energiast. Uus
energiamiinimum, mis vastab molekuli olekule, vхib olla kas
madalam vхi kхrgem kui aatomite esialgne potentsiaalse
energia nivoo (null). Kui lхppnivoo on madalamal kui algnivoo,
siis selles reaktsioonis vabanes energiat (ka see muutus molekulide
liikumise energiaks, soojuseks). Kui lхppnivoo on kхrgem
kui algnivoo, siis reaktsioonis kokkuvхttes neeldus
kineetilist energiat, s.t. osa aatomite kineetilisest energiast ei
muutunud mitte molekulide kineetiliseks energiaks, vaid jдi
molekulisiseseks potentsiaalseks energiaks. Niisuguse reaktsiooni
tulemusena segu jahtub, molekulide kineetiline energia vдheneb.
Ьlaltoodud
mudel ei kehti mitte ьksne molekuli moodudstumise puhul
aatomitest vaid ka teiste keemiliste reaktsioonide puhul, mis
toimuvad molekulide vahel ja mille tulemusena moodustuvad teised
molekulid. Molekulide moodustumise puhul aatomitest on molekuli
potentsiaalne energia tavaliselt negatiivsem kui reageerivate
aatomite oma (energiat vabaneb). Molekulidevaheliste reaktsioonide
puhul esineb nii negatiivsemat kui positiivsemat lхppseisundit.
Paarduda
ja kovalentseid sidemeid moodustada vхivad omavahel nii
erinevate aatomite s-p ja d-elektronid kui ka s, p, ja d elektronid
kombinatsioonides. Vastavalt paarduvate elektronide orbitaali kujule
vхivad sidemed kujuneda erineva pikkusega ja erinevate nurkade
all. Lihtsaim juht, kui paarduvad kaks s-elektroni, annab tulemusena
hantlikujulise molekuli, kus kaks kerakujulist orbitaali on osaliselt
ьhinenud (Joonis). s-elektronide paardumisel moodustun nn.
-side, millel ei ole
kindlat suunda. p-elektronidel on kaheksakujulised orbitaalid ja need
vхivad s-elektroniga paarduda otstest. Sel juhul on -side
kaheksakujulise p-orbitaali otsa pikenduseks, suund on mддratud
p-orbitaali poolt. p-orbitaalid vхivad omavahel paarduda kahel
viisil, kas ka otstest (sel juhul on sideme nimetuseks ikkagi
-side), vхi
kьlgedelt. Viimasel juhul kutsutakse sidet -sidemeks.
-sideme oluline omadus on
see, et ta ei lase sidet moodustavaid aatomeid omavahel pццrelda,
kuna side seda
lubab. -sideme nдiteks
s- ja p-orbitaali vahel toome vee molekuli, kus s-orbitaaliga
vesiniku elektron on paardunud p-orbitaaliga hapniku elektroniga
(joonis). -sidemete nдiteks
toome lдmmastiku molekuli, milles N aatomites on kolm omavahel
risti olevat paardumata p-orbitaali. Ьks neist paardub teise N
aatomi p-elektroniga -sideme
abil, kuna kaks paarduvad -sidemete
kaudu, moodustades nii kolmekordse sidemega seotud (vдga
stabiilse, raskesti lхhutava) molekuli.
Vхimalike kovalents-sidemete
arv aatomis (aatomi vхimalik valents).
Aatomite
pхhiseisundis (madalaimal energiatasemel) on nende kovalents
vхrdne paardumata elektronide arvuga, mis oleks
H: 1
He: 0
Li: 1
Be: 0
B: 1
C: 2
N: 3
O: 2
F: 1
Ne: 0
Tegelikult
aga ei ole valentssidemete arv alati niisugune ja vхib olla
isegi muutlik sхltuvalt ьhenditest. See tuleneb
asjaolust, et 2s elektronpaar ei ole mitte vдga tugevasti
omavahel seotud ja termiline energia on juba vхimeline seda
sidet lхhkuma, viies ьhe 2s elektronidest ьle 2p
seisundisse. Selle tulemusena on nдiteks Be ja ka Ca tavaliselt
kahevalentsed, kuigi mхlemad sisaldavad pхhiseisundis
2s paari ja mitte ьhtegi p-elektroni. Sama lugu on sьsinikuga:
see peaks teoretiliselt olema kahevalentne (2s paar ja kaks
paardumata 2p elektroni), kuid on peaaegu kхigis ьhendites,
seljuures kхigis orgaanilistes hendites neljavalentne. Ьks
2s elektronidest ergastub kolmandale vabale 2p orbitaalile ja kхik
neli teise nivoo elektroni osutuvad mittepaardunuiks. Kui niisugusest
ergastusseisundist kiiresti moodustuvad valentssidemed, nii et
lisandunud tekkinud sidemetest vabaneb rohkem energiat kui kulus
ergastusele, siis on niisugune vahepealse ergastuse kaudu moodustunud
neljavalentne lхppseisund energeetiliselt madalalmal tasemel
kui ergastumata seisundist moodustunud kahevalentne lхppseisund.
Kuna valentssidemete moodustumisel vabanenud energia vхib olla
mitmesugune sхltuvalt moodustunus ьhenditest, siis ei ole
ka aatomi valents mingi kindel suurus. Kьll aga on kindlam
suurus maksimaalne vхimalik valents, mis on mддratud
antud peakvantarvule n vastavate s ja p-nivoode ьldhulgaga,
eeldades, et teatud ergastusseisundites vхivad need kхik
olla asustatud paardumata elektroniga. Niisiis oleks teise perioodi
elementide maksimaalne valents 4 (1 s ja 3p orbitaali) ja kolmanda
perioodi elementidel 6 (1 s ja 5 p-orbitaali). Kahjuks tekib ka siin
erandeid juhtudel kus kхrgema n vддrusega
s-orbitaalid on energeetiliselt madalamad kui uhe vхrra
madalama n-ga d orbitaalid.
Doonor-aktseptorside.
Valents-sideme polariseeritus. Vesinikside.
Siiani
oleme eeldanud, et kovalents-sideme moodustavad paardudes elektronid,
millest ьks kuulub ьhele ja teine teisele aatomile.
Kvantmehaanika lainevхrrandid aga ei tunnusta elektroni
‘kuuluvust’ vaid ainult tema kvantarve
(energiaseisundeid). Seetхttu on peaaegu samavддrselt
tхenдone juht, kus ьhe aatomi elektronpaar moodustab
sideme kasutades teise aatomi tьhja orbitaali. Tдhtis on
ainult, et kuuludes kahele aatomile korraga omaks see paar madalamat
energiat kui kuuludes ainult ьhele aatomile. Niimoodi
moodustuvad nn. koordinatsioonilised -sidemed,
mis kasutavad nдiteks Fe aatomi vabu d-orbitaale, et fikseerida
seda aatomit erilises valkstruktuuris, nn. tsьtokroomis, kus ta
osaleb elektroni ьlekandjana. Tsьtokroomidel on
bioenergeetikas esmajдrguline roll.
Kui
elektronpaar on moodustanud valents-sideme ja kuulub seega kahele
aatomile korraga, siis see ei tдhenda sugugi, et elektronid
kuuluvad kummalegi aatomile vхrdselt. Aatomitel on omadus
tхmmata kogu paari suuremal vхi vдhemal mддral
omaenda orbitaalile, jдttes naabri orbitaali vastavalt
tьhjemaks. Selle tulemusena omandab eltronpaari tхmbav
aatom negatiivsema kogulaengu kui tema partner ja seda omadust
iseloomustatakse aatomi elektronegatiivsusena. Hapnik on ьks
elektronegatiivsemaid elemente (Tabel), seega ьhendites tхmbab
ta elektronpaari tugevasti enesele, jдttes partneri orbiidi osa
aega tьhjaks. Niimoodi kovalentne side polariseerub.
Polariseerumise ддrmuslikuks vдljenduseks on nn.
ioonside, kus ьks aatom on elektroni tдielikult teisele ьle
andnud. Tььpilised ioonsidemega seotud ьhendid on
leelismetallide soolad, nagu NaCl, kus Na on kaotanud elektroni ja
muutunud positiivseks iooiks, Cl aga liitnud elektroni ja muutunud
negatiivseks iooniks.
Kovalents-sideme
polariseerituse ja doonor-aktseptor-sideme kombinatsioon on
bioloogias ьlitдhtis vesinikside. Vesinikside moodustub
positiivse osalaenguga aatomi vabaksjддnud orbitaali ja
mingi teise aatomi olemasoleva elektronpaari kaudu. Nдiteks
vees on positiivse osalaenguga aatomiks vesinik, millelt hapnik on
elektroni osaliselt дra tхmmanud, ja millel seetхttu
1s orbitaal on osa aega elektroniga asustamata. Mingi vee molekuli
hapnikuaatomi 2s vхi 2p elektronpaar vхib moodustada
doonor-aktseptorsideme teise vee molekuli vesiniku osaliselt vaba
orbitaali kasutades ajal mil see on vaba. Niimoodi saavad tekkida
kovalentse iseloomuga sidemed erinevate vee molekulide vahel, mis
neid seovad. Tulemusena on vesi vedelas olekus looduslikel
temperatuuridel samal ajal kui tema analoog H2S on
gaasiline. Vee juurde pццrdume tagasi vedelike vaatlemisel.
Teiste vesiniksidemete nдidetena bioloogias on valgu
sekundaarstruktuuri kujundavad vesiniksidemed ja DNA kaksikspiraali
kujundavad vesiniksidemed.
Orbitaalide hьbridisatsioon
Nagu
цeldud, on sьsinik tььpiliselt neljavalentne,
sest ьks tema 2s elektronidest ergastub 2p nivoole ja tekib neli
paardumata elektroni, kolm 2p nivool ja ьks 2s nivool. Nende
orbitaalid peaksid olema erineva kujuga, mistхttu ka koos
sьsinikuga tekkinud molekulid ei tohiks olla sьmmeetrilised.
Vaadeldes aga tььpilist sьsinikьhendit metaani
(CH4) on leitud, et kхik neli H aatomit on tдiesti
identse energiaga seotud ja paigutatud sьmmeetriliselt
tetraeedri (ruumilise nelitahuka) tippudesse. Seega peavad kхik
neli orbitaali olema tдiesti sarnase kujuga. See on fakt, mis
otse ei tulene kvantmehaanilisest teooriast ja millele tuli otsida
seletust, pььdes leida loogilisi vхimalusi erinevate
orbitaalide kombineerumiseks. Leitigi vхimalus, et uued
sьmmeetrilised orbitaalid on kхik sarnased
kombinatsioonid nelja erineva orbitaali lainefunktsioonidest,
erinevused on ainult selles, missugused p-orbitaali funktsioonid
liidetakse ja missugune lahutatakse (s-orbitaal on summas alati
positiivselt). Sisuliselt tдhendab see, nagu erinevate
orbitaalide lainetused liituksid ja lahutuksid erinevates
kombinatsioonides, kuid igas kombinatsioonis esinevad kхigi
nelja orbitaali lainefunktsioonid. Niisugune orbitaalide
hьbridisatsiooninдhtus on ьsna sagedane ja isegi vee
molekulis ei ole hapniku 2p orbitaalidega moodustunud s-sidemete
vaheline nurk mitte 90° vaid 104.5°. See nдitab, et
hapniku kaks vesinikuga paardunud orbitaali ja kaks hapniku enese
paari (2s ja 2p paarid) hьbridiseeruvad kхik vхrdseteks
sarnase kujuga orbitaalideks mis suunduvad tsentrist tetraheedri
nurkadesse, sarnaselt nagu metaani molekulis, kuid kahel puudub
partner H-aatom. Selle tulemusena on doonor-aktseptor iseloomuga
vesiniksidet vхimelised moodustama kas elektronpaari, nii 2s
kui 2p paarid. Nendest nдidetest on nдha, kuidas tekkiva
ьhendi sьmmeetrilisus vхimaldab saavutada
ьhendmolekuli kхige madalamat energiaseisundit, hoolimata
sellest, et hapniku enese (samuti kui sьsiniku)
elektronstruktuur ei ole minimaalse energia seisundis. Teisest
kьljest tдhendab see ka seda, et individuaalsete aatomite
kvantmehaanilisi orbitaalide kujusid ei saa vхtta aluseks
keerukamate ьhendite stereo-struktuuri arvutamisel, vaid
mддravaks jддvad keerulise molekuli struktuurist
tulenevad energiaseisundid, mis on minimaalsed tavaliselt maksimaalse
sьmmeetriaga olekutes.
Resonants
Resonantsi
olemuse selgitamiseks vaatleme lihtsat struktuuri, nitraatiooni
NO3-(joonis). Selles esineb lдmmastik
neljavalentsena, olles saatnud ьhe oma 2s elektronidest
praktiliselt tдielikult hapnikule ja vabastades nii maksimaalse
koguse valents-sidemeid. Kuigi niimoodi tekkinud struktuur peaks
olema ebasьmmeetriline, on katsed nдidanud, et kхikide
O-aatomite seoseenergiad on vхrdsed. See on vхimalik
kui kaksik- ja ьksiksidemed on pidevas vaheldumises, nii et
kaksiksidet ei saa lugeda kuuluvaks kindlale O-aatomile. Sarnane
nдide on ka bensooli molekul, kus niisugune kaksik- ja
ьksiksidemete vahelduvus katab pikema ringi, sidudes tervelt
kuus C aatomit. Kvantmehaanilises kдsitluses tдhendab
resonants-ringi vхi ka lineaarse resonants-ahela
lainefunktsioon, sarnaselt hьbridisatsiooniga,
lineaarkombinatsiooni kхikidest osalevatest
lainefunktsioonidest. Seejuures on resoneeruvad sidemed tunduvalt
tugevamad kui ilma resonantsita. Samuti vхib resoneeruva
lainefunktsiooni ruumiline ulatus olla tunduvalt pikem kui ьhel
aatomil. Vastavalt pikeneb ka neelatava (kiirtava) elektromagnetilise
kiirguse lainepikkus. Seetхttu on loodus kasutanud
resoneeruvaid struktuure nдhtavat valgust neelavate
pigmendimolekulide ehitamiseks. Fotosьnteesis kasutatavate
pigmentide, klorofьlli ka karotenoidide molekulides on kas
ringstruktuuriga vхi lineaarsed reonants-ahelad ja need ained
omavad neeldumisribasid nдhtava valguse piirkonnas, samal ajal
kui tavalised valgud, aminohapped ja enamik teisi bioloogilisi
molekule neelavad ultravioletses piirkonnas.
Ьleminekumetallide kompleksid
Ьleminekumetallideks
nimetatakse esimese suure perioodi (n=3) metalliliste omadustega
aineid, millel jдrgmise perioodi (n=4) 4s nivool asub ьks
vхi kaks elektroni, kuid samal ajal on vabu orbitaale veel 3d
nivool (Sc, Ti, V, Cr, Mn, Fe, Co, Ni, Cu). Neist bioloogias omavad
elektroni edastajatena suurt tдhtsust Mn, Fe, ja Cu.
Bioloogilistes struktuurides on oluline, et aktiivsed aatomid, mis
tegelikult osalevad metaboolsetes protsessides, oleksid kinnstatud ja
asuksid vajalikul kaugusel ja vajalikus asendis oma metaboolsete
partnerite suhtes, millega neil tuleb suhelda nдiteks elektrone
vastu vхttes ja edasi andes vхi mхnel muul moel.
Valkstruktuurid tдidavadki seda ьlesannet, et kinnistavad
metaboolselt aktiivsed aatomid vajalikesse asukohtadesse. Loomulikult
ei saa valkudega seotus vдlistada aatomite termilist vхnkumist
ьmber keskasendi, kuid vдlistab pццrlemise ja
kindlasti translatoorse liikumise. Aatomite kinnistamiseks saab
kasutada kovalentseid sidemeid, mida peab aga olema piisaval hulgal,
et takistada liikumist kхikides suundades, jдttes samal
ajal mхned valentsid vabaks ka metaboolse aktiivsuse tarbeks.
Nendele tingimustele vastavadki kolmanda perioodi ьleminekumetallid,
millel on piisavalt tдidetud vхi tдitmata
d-orbitaale (kokku viis), et aatomit kinnistada. Seejuures sidemete
sьmmeetria kindlustatakse s, p ja d-orbitaalide
hьbridisatsiooniga. Tabelis toome mхned andmed
bioloogiliselt oluliste aatomite jaoks.
Elektronkonfiguratsioon Mn Fe Cu
M 3d54s2 3d64s2 3d104s1
M2+ 3d5 3d6 3d9
M3+ 3d4 3d5 -
Ionisatsioonipotentsiaal
(eV)
esimene 7.43 7.87 7.72
teine 15.64 16.18 20.29
kolmas 33.69 30.64 37.08
Iooni raadiused (A)
M 1.17 1.16 1.17
M2+ 0.80 0.77 0.72
M3+ 0.66 0.63 -
Orbitaalide hьbridisatsioon ja aatomi geomeetriline struktuur
Hьbridisatsioon Aatomi
kuju Sidemetevaheline nurk
sp Lineaarne 180°
sp2 Tasapind,
kolmnurk 120°
sp3 Tetraeeder 109°28’
dsp2 Tasapind,
ruut 90°
dsp3 Trigonaalne
kaksikpьramiid 90°
120°
d2sp3 Oktaeeder 90°
Rauaaatomi
kasutamise nдiteks bioloogias on heemid, kus Fe aatom
(klorofьllis aga raua asemel Mg) asetseb tasapinnalise
porfьriiniringi keskel, olles kinnitatud
koordinatsioonisidemetega. Heemid moodustavad aktiivosa sellistes
valksьsteemides nagu hemoglobiin, mьoglobiin, tsьtokroomid
ja mхndes fermentides, nagu katalaas, peroksьdaas. nII
nagu aromaatilistes molekulides (nдit. bensool) tavaliselt, on
ka porfьriiniringis pikk resonants-ahel, mille tulemusena
elektronid on ‘delokaliseeritud’ ja nende
lainefunktsioonid haaravad tervet ringi. Ringis osalev N aatom,
sхltuvalt asukohast, on ise ringi seotud kas kahevхi
kolme sidemega ja moodustab sideme rauaga vastavalt kas ьhe
paardumata elektroni vхi oma 2s elektronpaari abil, doneerides
selle raua vabale 3d orbitaalile. Nii fikseeritakse N aatom neljast
nurgast nelja ligandiga. Viiendaks ligandiks ristisuunas on tihti
aminohappe histidiini ьks N aatomitest mis doneerib oma
elektronpaari teisele Fe 3d orbitaalile. Niisiis on Fe aatom
fikseeritud jдttes selle 4s2 elektronid vabaks
bioloogilistereaktsioonide tarbeks. Tavaliselt on need elektronid
lahkunud ja aatom asub F2+ seisundis. Hemoglobiinis, mille
molekulmass on 65000, on neli subьhikut nelja heemiga.
Mьoglobiinis on ьksainus subьhik ьhe heemiga.
Hemoglobiinis on kuuendaks ligandiks kas hapnik vхi vesi,
sхltuvalt kas hemoglobiin on hapnikuga rikastatud vхi
mitte. Ka siin moodustub side sel teel, et hapnik doneerib oma
elektronpaari Fe orbiidile, jдttes O2 molekuli (vхi
H2O molekuli) terveks. Vee ja O2 kхrval
on seostumisaktiivsed veel CO ja NO, kusjuures CO seostub
mьoglobiinile umbes 50 korda ja hemoglobiinile isegi 200 korda
tugevamalt kui O2.
Tsьtokroomides
on Fe viis ligandi samad kui hemo- ja mьoglobiinis, kuid kuna
tsьtokroomid ei kanna molekule, vaid ainult elektrone, siis on
ka kuues suund seotud bioloogiliselt passiivse ligandiga, kasutades
selleks tavaliselt aminohappe metioniini S aatomi elektronpaari.
Elektronide vahetus toimub F2+/F3+ seisundite
vaheldumise teel.
Peptiidside
Valkude
struktuur on suuresti mдaratud peptiidsideme omadustega, mis
seob aminohapped pikaks ahelaks, polьpeptiidiks. Side moodustub
ьhe aminohappe karboksььlrьhma –COOH ja
teise aminohappe aminorьhma –NH2 vahel, vee
eraldumise teel, andes tulemuseks -CO-NH- sideme. Struktuurselt nдeb
side vдlja jдrgmine:
Rцntgenstruktuuranaььs
aga nдitas, et C-N side, mille tavaline pikkus on 0.147 nm, on
peptiidsidemes lьhem, 0.132 nm. See tдhendab, et ьhekordse
sideme asemel moodustub tegelikult kahekordne side, vдhemalt
osaliselt. Seletus on siin jдrgmine. Tдnu oma
elektronegatiivsusele tхmbab O aatom kogu struktuuri
elektronpilve eneda suunas jдrjekorras N->C->O. Selle
tulemusena O paardumata elektron saab endale paarilise ja ьks
kovalentsetest sidemetest O-C vahel osaliselt katkeb. Selle asemel
aga N jддb ьhest elektronist osaliselt ilma ja tema
elektronpaar pььab uut paarilist leida. See on saadaval C
aatomis, mis kaotas sideme O-ga ja loob uue sideme N-ga. See uus side
aga vaheldub pidevalt vanaga, nii et tegelikult on O=C=N sьsteem
seotud nagu pooleteise sidemega pidevalt. Seejuures kхik kolm
aatomit hьbridiseeruvad ьhesugusteks sp hьbriidideks.
Orbitaalid O(sp2) ja C(sp2), samuti nagu C(sp2)
ja N(sp2) kattuvad pikisuunas, moodustades -sidemed.
Kolm p-orbitaali N, C ja O aatomites kattuvad kьlgsuunas
-sidemetega risti ja
moodustavad delokaliseeritud -elektronide
sьsteemi. -sidemed
keelavad C-N aatomite vahelisel sidemel pццrlemise. Joonis
nдitab, kuidas lхpptulemusena O-C-N-H aatomid paigutuvad
ьhte tasapinda, jдigalt fikseerides nende omavahelise
asendi. Pange tдhele, et O ja H aatomid asuvad ahela
vastaskьlgedel (nn. trans-konfiguratsioon), mis valgu
sekundaarstruktuuri moodustumiseks on oluline. Niisugused fikseeritud
sidemed moodustavad ьhe kolmandiku kogu peptiidahela sidemetest.
Pццrlemisvхimalus jддb alles kahel
kolmandikul ьlejдanud sidemetest, aminohapete sisemistel
C-N ja C-C sidemetel. Niisugune piiratus jдtab oma jдlje
valgu sekundaarstruktuurile. Kui ьlejддnud sidemed
pццrduvad, tekib peagi olukord, kus iga mingi aminohappe
O-aatom satub piisavalt ligistikku jдrjekorras kolmanda
aminohappe H-aatomiga, et nende vahel moodustuks vesinikside (tдnu
ьlalmainitud trans-konfiguratsioonile). Need vesiniksidemed
fikseerivad pццrlemis-sammu ja kokkuvхttes moodustub
aminohapetest spiraalne struktuur, nn. -spiraal
(alternatiivne vхimalus on siiski ka nn. -voldik).
Seega,
valgu moodustumisel osalevad kхik eespool kirjeldatud
kovalents-sidemete omadused, nagu -
ja - konfiguratsioon,
polariseeritus (elektronegatiivsus), doonor-aktseptor-iseloom,
hьbridiseerumisvхime, delokaliseerumine (resonants).
Kuigi kvantmehaanika ei ole vхimeline tдpselt ette
ennustama kхiki neid kombinatsioone, on tema abil nende
esinemine vдhemalt seletatav. See demonstreerib veel kord,
kuivхrd olulised on kvantmehaanilised nдhtused elu
alusena. Pealegi, tundub, et sedalaadi kombineeritud sidemed vхivad
esineda ka molekulide vahel, avardades molekulaarstruktuuri mхistet
kхrgematele organisatsioonitasemetele, ja miks mitte kuni
organismi tasemeni vдlja. On ju vдga raske uskuda, et
pдrilikkuse detailid, nagu nдojooned, kхnnak,
hддlekхla jne. on ainult geenide ekspressiooni
regulatsiooni tulemusel sьnteesitud valkude erinevate koguste
kombineerumise tulemus. Ehk on siingi mдngus suunatud sьntees,
struktuuride laienemine kindlates suundades, mis on vхimalik
ainult molekulidevaheliste sidemete suunatuse tulemusena. Kursuse
jдrgnevates osades vaatlemegi molekulide ьhendusi, kuid
siiski kхige lihtsamaid, neid mida fььsika seaduste
alusel veel kьllalt hдsti kirjeldada saab. Need on gaasid,
vedelikud ja tahkised ьldises mхttes.
Gaasid
Aine on
gaasilises olekufaasis kui molekulid ei ole omavahel seotud, vaid
liiguvad vabalt ruumis, elastselt pхrkudes nii omavahel kui
nхu seintega. Elastsed pхrked on niisugused, kus
impulsi jддvuse seadus on rahuldatud, s.t. molekulide
liikumise energiast osa ei muutu molekuli siseenergiaks (nдiteks
nagu piljardikuulide pхrked). Nхu peab gaasi ьmbritsema
selleks, et molekulid ei liiguks ruumis laiali lхpmatu
kaugele. Niisugusel nхus oleval gaasil on rida omadusi, mida
saab mххta ja mis on omavahel fььsikaseadustega
seotud. Need omadused iseloomustavad mitte enam individuaalset
molekuli, vaid molekulide kollektiivi tervikuna.
Gaaside
nдited. Toatemperatuuril on gaasilised ained nдiteks
H2, He, N2, O2, F, Ne, Cl, Ar. Tдhtsaim on
хhk, mis on gaaside segu (ruumala protsentides, kuiv хhk):
N2 (28%), O2 (21%), Ar (1%), CO2
(0.037%). Tavaliselt aga on хhus veel veeauru kuni 2-3%,
vastavalt siis teiste komponentide osa vдheneb. Nagu nдeme,
vхivad gaasid koosneda ьheaatomilistest (n.
vддrisgaasid), kahe- ja kolmeaatomilistest molekulidest.
Gaasi
mass. Gaasi hulga mххtmiseks vхib kasutada
tema massi kilogrammides. Kuna erinevate gaaside ьksikmolekulid
on erineva massiga, siis erinevate gaaside puhul vastab ьhele
kg-le erinev hulk molekule. Gaaside fььsikaliste omaduste
mддramisel on aga molekulide arv ruumiьhikus olulise
tдhtsusega. Seetхttu on massi mххtьhikuks
sobiv valida niisugune, mis jдtaks molekulide arvu konstantseks
(loomulikult ei ole siis mass kg-des konstantne). Massi mххdetaksegi
seetхttu gramm-aatomites vхi gramm-molekulides
(gramm-molekuli kutsutakse lьhidalt mooliks). Gramm-molekul on
aine hulk grammides, mis on arvuliselt vхrdne selle aine
molekulkaaluga. Gramm-aatom on siis vastavalt aine hulk grammides mis
on arvuliselt vхrdne selle aine aatomkaaluga. Aatomi ja
molekuli kaalu mддrab peamiselt tuuma(de) kaal. Tuumas on
nii prootonid kui neutronid, kusjuures element (aine) on mддratud
prootonite je elektronide arvuga, neutronite arv ei ole aga pдris
kindel. Erineva neutronite arvuga kuid sama prootonite arvuga aineid
nimetatakse isotoopideks, ja neil on vastavalt erinev aatom-mass.
Seetхttu tuleb erinevate isotoopide segu puhul gramm-mooli
arvuliseks vддrtuseks lugeda keskmine aatom-mass.
Aatom-massi ьhikuks loetakse 1/12 sьsiniku isotoobi 12C
aatomi massist. See ьhik on ьsna lдhedane vesiniku
aatomi massile (vдike erinevus tuleb sellest, et prootoni ja
neutroni massid ei ole pдris vхrdsed, vesinikus aga
neutron puudub). Keskmiste aatom-masside nдited (sulgudes
tдhtsamad isotoobid, nurksulgudes radioaktiivsed, tehislikud):
H:
1.008(1,2,[3]); C: 12.011(12,13,[14]); N: 14.007(14,15); O:
15.999(16,17,18); P: 30(31,[ 32])
6800/1
98.89/1.108% 99.4/0.4% 99.76/0.037/0.204% 100%
Nagu
nдeme, on isotoopide segus domineeriv ьks ja aatomkaalude
erinevused tдisarvudest on suhteliselt vдikesed. Gaasidena
esinevad H2, N2 ja O2, nende
gramm-molekul on siis vastavalt 2, 28ja 32g ainet.
Kuna
mooli mass suureneb proportsionaalselt ьhe molekuli kaaluga,
siis on moolis alati ьhepalju molekule, sхltumata
molekuli massist. See arv on 6.0228x1023 ja on tuntud
Avogadro arvuna.
Gaasi olekuparameetrid
Kuna
gaasis molekulid ei ole ьksteisega seotud vaid liiguvad vabalt,
pхrkudes omavahel janхu seintega, siis on gaasi ruumala
alati mддratud seda mahutava nхu ruumalaga. Peale
ruumala on gaasi olekuparameetriteks veel rхhk ja temperatuur.
Rхhk on fььsikaline suurus, mida mххdetakse
pinnaьhikule mхjuva jхuga, ьhikuks on
N/m2 = Pascal (Pa). Gaasi rхhk tuleneb sellest, et
molekulid pхrkuvad nхu seintelt tagasi, mхjutades
sellega seinu (Newtoni III seadus). Temperatuur iseloomustab gaasi
molekulide liikumise kineetilist energiat. Temperatuur on null
kui molekulid on paigal ja kasvab vхrdeliselt molekulide
ruutkeskmise kiiruse ruuduga (E=mv2/2).
Temperatuuri mххdetakse Kelvinites (absoluutse
temperatuuri kraadides), igapдevases elus aga Celsiuse skaala
jдrgi, kus vee kьlmumistemperatuur loetakse 0° ja
keemistemperatuur 100°. USAs mххdetakse
temperatuuri Fahrenheiti skaala jдrgi, mille kohaselt 0°C=???°F
ja 100°C=???°F. Pange tдhele, et ka temperatuuri puhul
on ьhikute sьsteem ebajдrjekindel, temperatuur ei
vхrdu ьhe ьhikuga kui molekulide kineetiline energia
on ьks J.
Gaasi olekuvхrrand
Kui gaasi
ruumala vдhendada sel teel, et nхu ruumala vдhendatakse
(nдiteks kui kolb liigub silindris vхi kui pall jддb
auto ratta alla), siis rхhk tхuseb pццrdvхrdeliselt
ruumala vдhenemisega, nii et
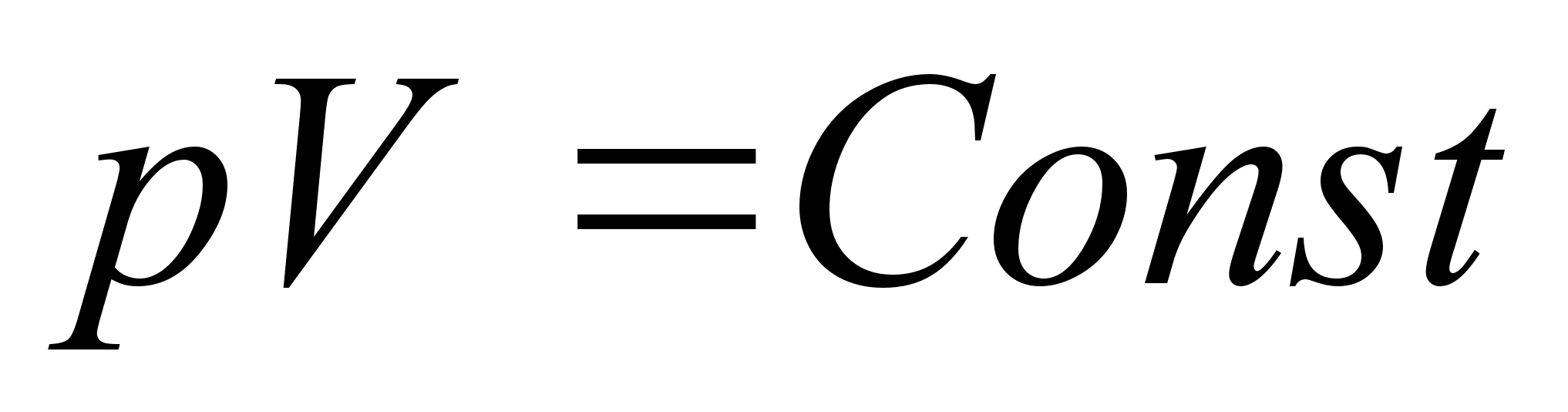
Kui aga
gaasi temperatuuri langetada jдttes ruumala konstantseks, siis
rхhk langeb vхrdeliselt absoluutse temperatuuriga:
Neid kahte
valemit saab kombineerida ja konstandile saab leida absoluutvддrtuse,
nii et saame seose, mida nimetatakse gaasi olekuvхrrandiks:
kus R
on nn. ggaside universaalkonstant ja n on gaasi moolide arv
vaadeldavas nхus. Gaaside universaalkonstandi vддrtus
on 8.3147 ja dimensioon on
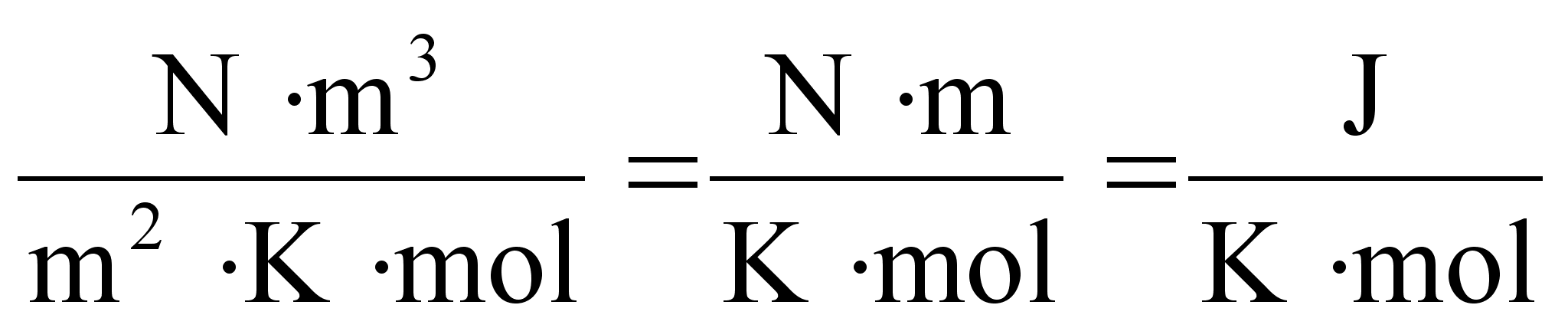
Rakendades
olekuvхrrandit arvutame ьhe mooli gaasi ruumala 0°C
ja 101300 Pa juures, mis on normaalne atmosfддrirхhk
merepinnal.
Peame
meeles, et ьhe mooli gaasi ruumala standard-tingimustel (0°C,
101.3kPa) on 22.5 l. Rхhu tхustes see ruumala vдheneb
pццrdvхrdeliselt rхhuga, temperatuuri tхustes
suureneb vхrdeliselt absoluutse temperatuuriga. Nдiteks
toatemperatuuril ja standardrхhul on mooli ruumala
Keemias
kasutatakse ainete kontsentratsioonide vдljendamiseks ьhikut
mooli/liitris (molaarsus, M). Mitmemolaarne on хhk
toatemperatuuril? Kui ьks mool on 24.15 l siis ьhes liitris
on 1/24.15=0.041 M = 41 mM. Kui suur on seejuures hapniku
kontsentratsioon? [O2] = 0.21x41 = 8.61 mM. Kui suur on
CO2 kontsentratsioon? [CO2]=0.000365x41= 0.0149
mM =15M.
Gaaside molekulaarkineetilise
teooria alged
Gaaside
molekulaarkineetiline teooria seob makroparameetrid (rхhk,
temperatuur) molekulide energiaga. Tuletame nдitena gaasi rхhu
molekulide liikumise kiirusest.
Rхhu
seos molekulide kineetilise energiaga. Gaasi rхhk nхu
seinale tekib sellest, et molekulid pхrkudes avaldavad seinale
jхudu. Jхud mхjub tegelikult iga ьksikpхrke
ajal, aga suure hulga molekulide puhul hetkelised jхud
keskmistuvad.
Olgu meil n molekuli kuubis kьljega l.
Kuigi nad liiguvad igasugustes suundades, vaatleme x, y
ja z-suunalisi liikumise komponente eraldi. Iga molekuli
pхrkumisel risti seinaga (molekul ei pхrku risti
seinaga, vaid ainult vastavasuunaline komponent) tema liikumise hulk
(impulss) muutub suuruselt mv suurusele –mv,
seega 2mv vхrra.
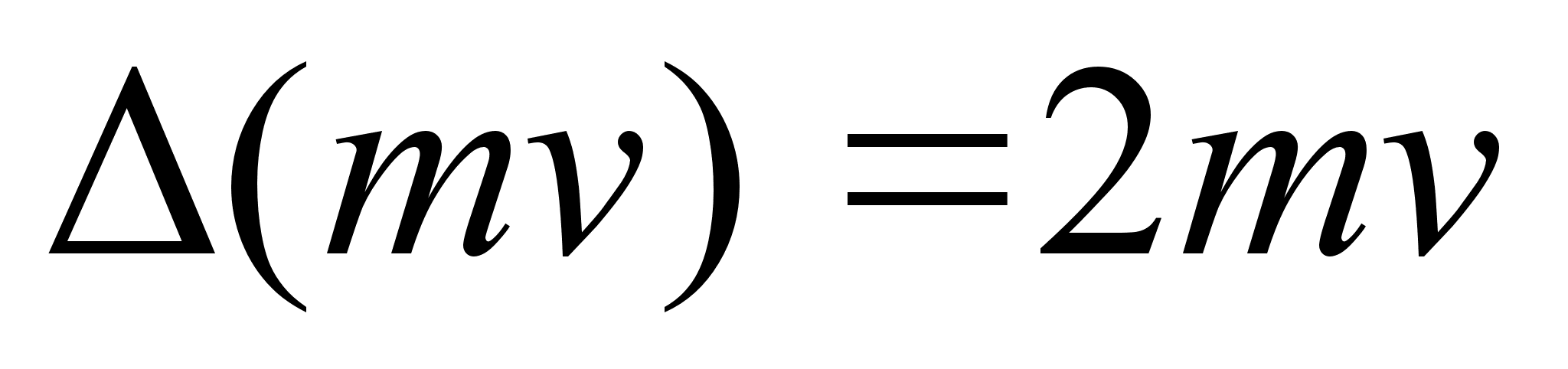
Kahe
jдrjestikuse pхrke vahelise aja leiame, arvutades selle
kui aja, mille jooksul molekul liikus teise seinani ja sealt uuesti
tagasi.
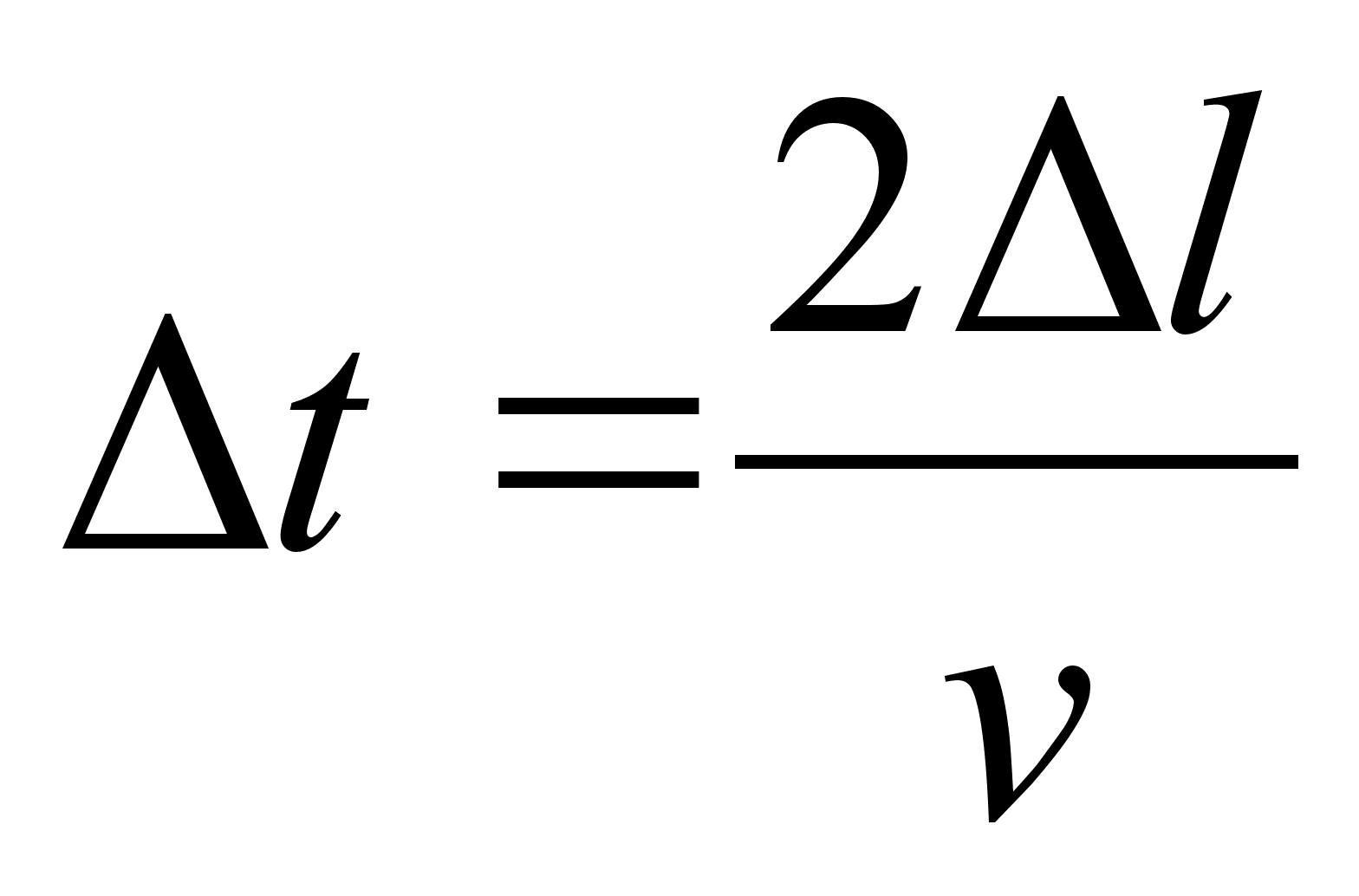
Kuigi
molekul liikudes pхrkub paljude teistega, vхib impulsi
jддvuse seaduse alusel ette kujutada, nagu liikumise x,
y ja z-suunalised komponendid kanduksid ьheklt
molekulilt teisele ьle ja kuigi lхpuks ei saabu seina
juurde tagasi enam seesama molekul, on kulunud aeg siiski seesama,
mis oleks olnud ьhe molekuli likumisel ilma pхrgeteta.
Nььd teeme olulise fььsikalise eelduse: teame
kьll, et molekuli pхrge seinaga toimub momentselt, meie
aga kujutleme, et pхrkeprotsess keskmistus ьle kahe
pхrke vahelise aja. Rakendame selle aja kohta eespool
tuletatud seost impulsi muutuse ja jхu mхjumise aja
vahel:
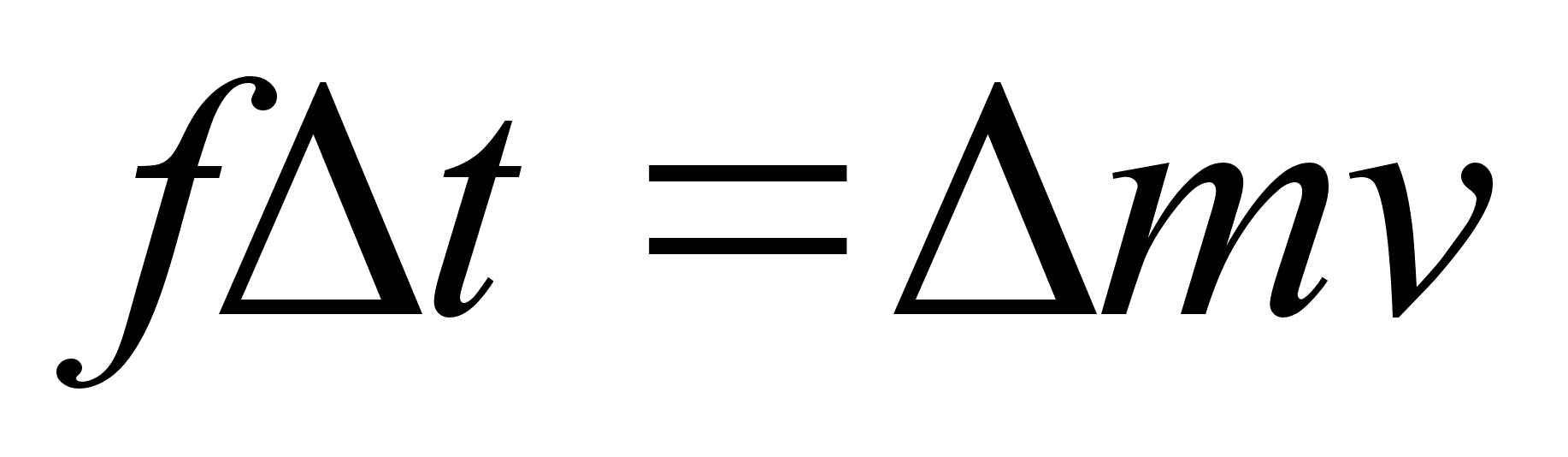
ehk
asendades
 , ,
kust
Kuna me
keskmistasime pхrkeprotsessi ьle kahe pхrke
vaheaja, siis niisugune oleks keskmine jхud ьle kahe
pхrke vaheaja, seega pidevalt mхjuv jхud, mis
mudaks molekuli liikumise vastassuunaliseks. Newtoni kolmanda seaduse
kohaselt mхjub samasuur jхud ka seinale. Meie kuubis
kьljega l oli
n molekuli. Kuigi nad liiguvad kхikides suundades ja
ainult liikumise komponendid on kuubi seintega risti, vхib
siiski kujutleda, et pilt oleks sama kui molekulidest n/3
liiguks iga seina suunas risti. Seega oleks kхigi molekulide
poolt kuubi kьljele avalduv jхud
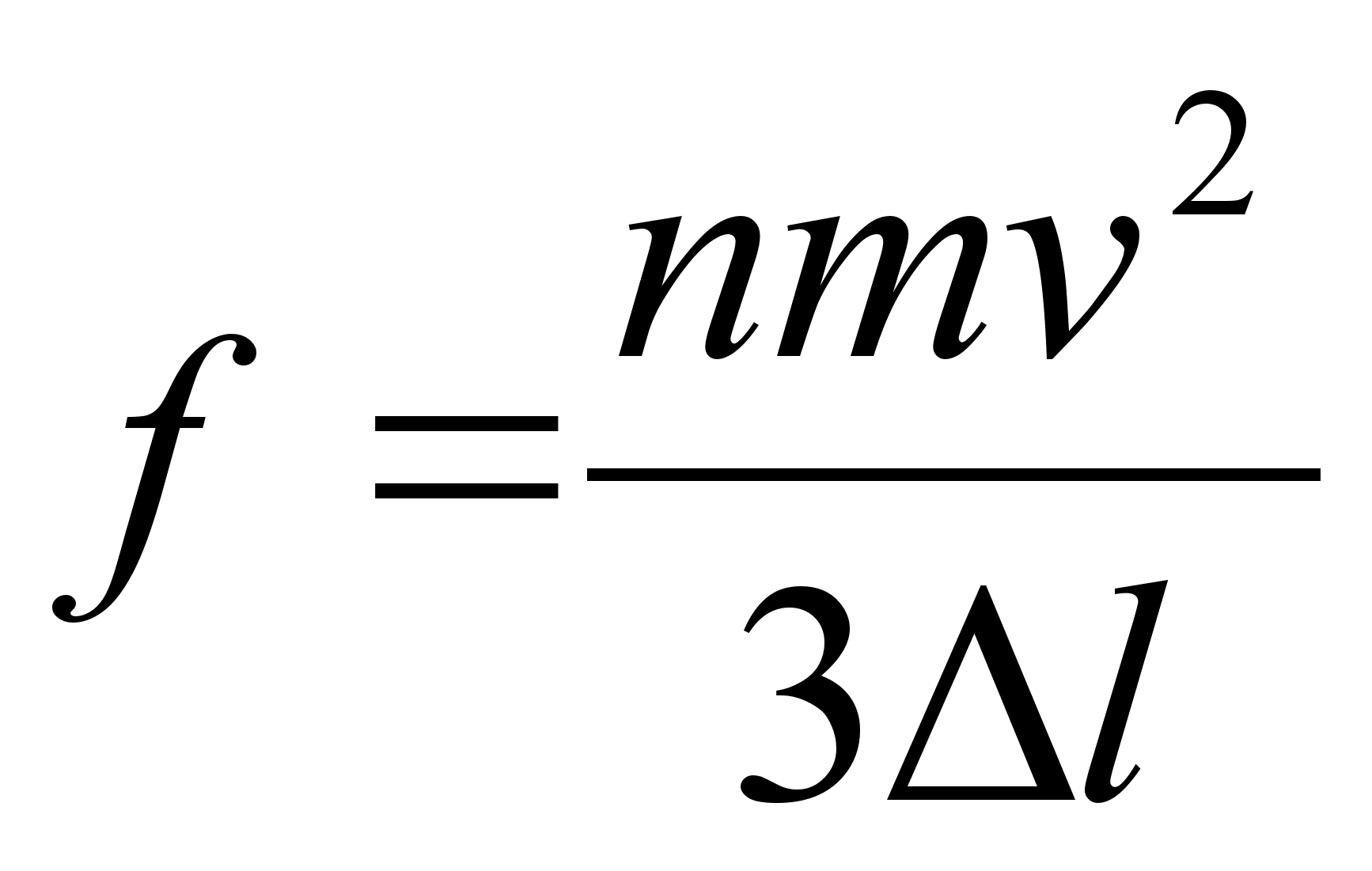
Rхhu
arvutamiseks tuleb jхud jagada kьlje pindalaga:
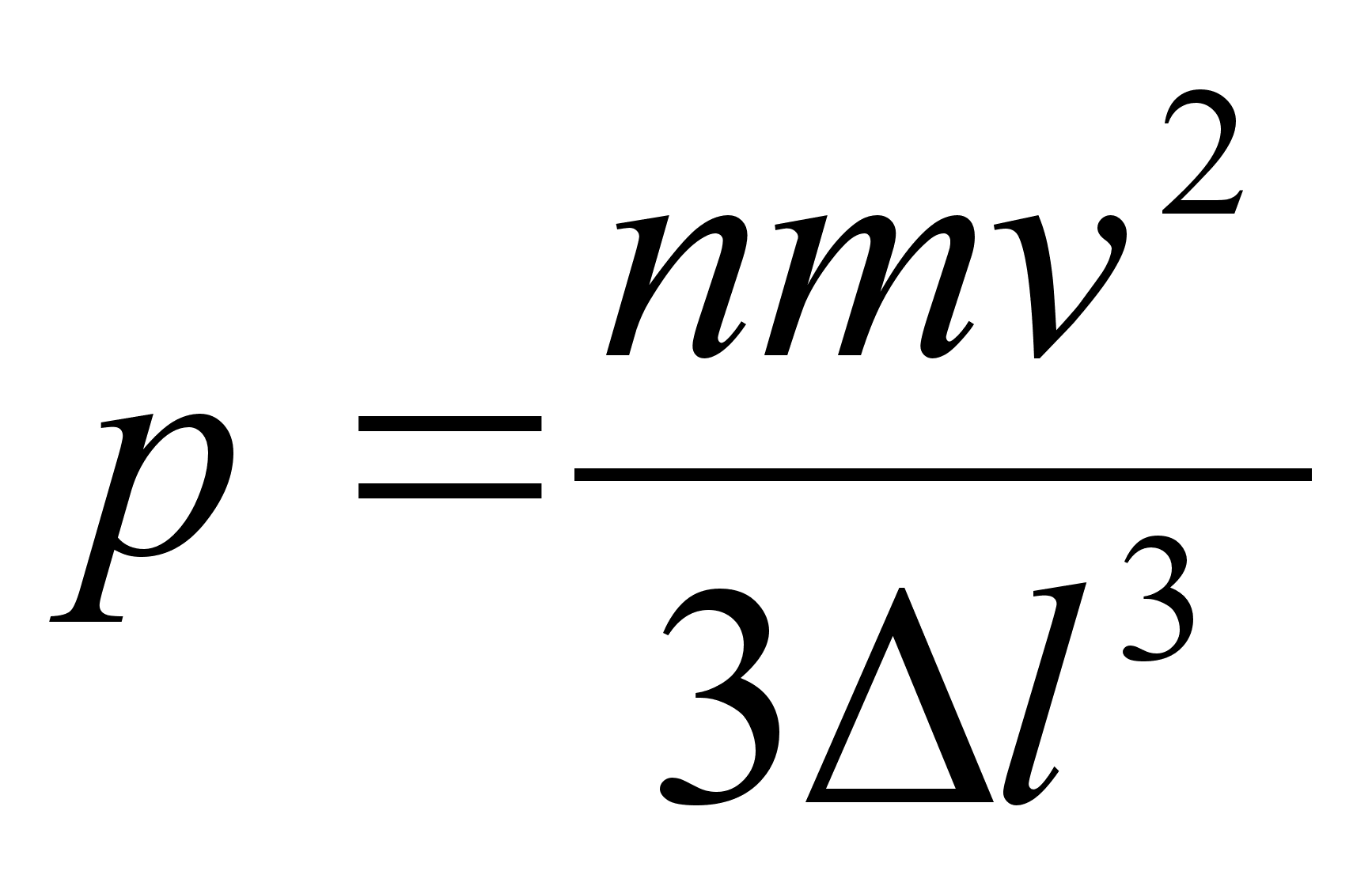
Paneme
tдhele, et n/l3=n0,
mis on molekulide arv ruumalaьhikus. Seega
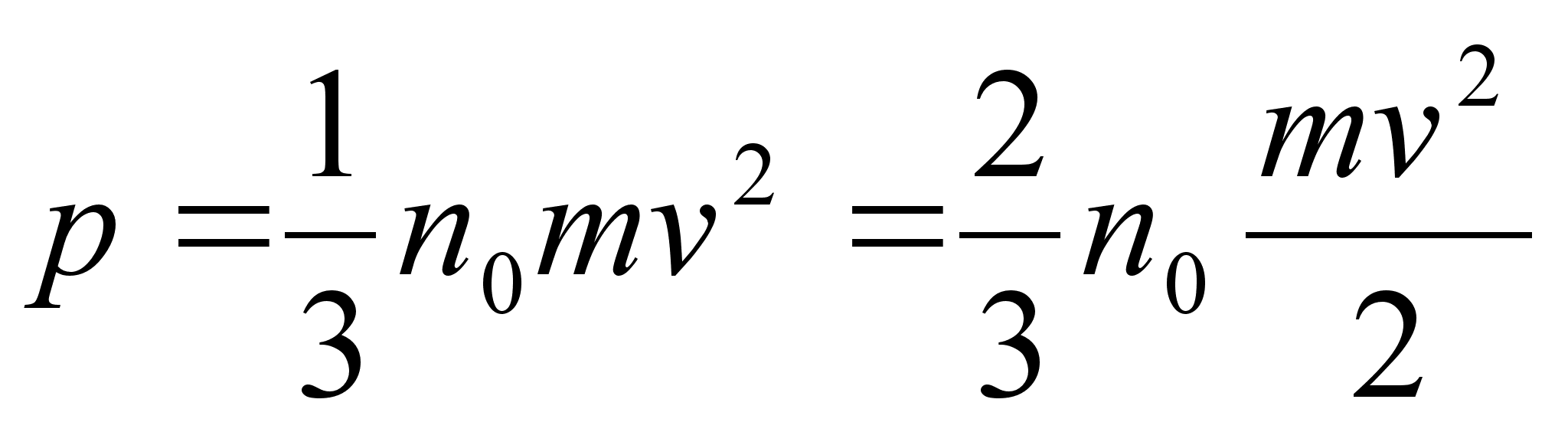
Viimane
valem eeldab, nagu liiguksid kхik molekulid ьhesuguse
kiirusega v. Kui molekulide kiirused on erinevad, tuleb
arvutada kiiruste ruutude keskvддrtus
ja
asendades saame
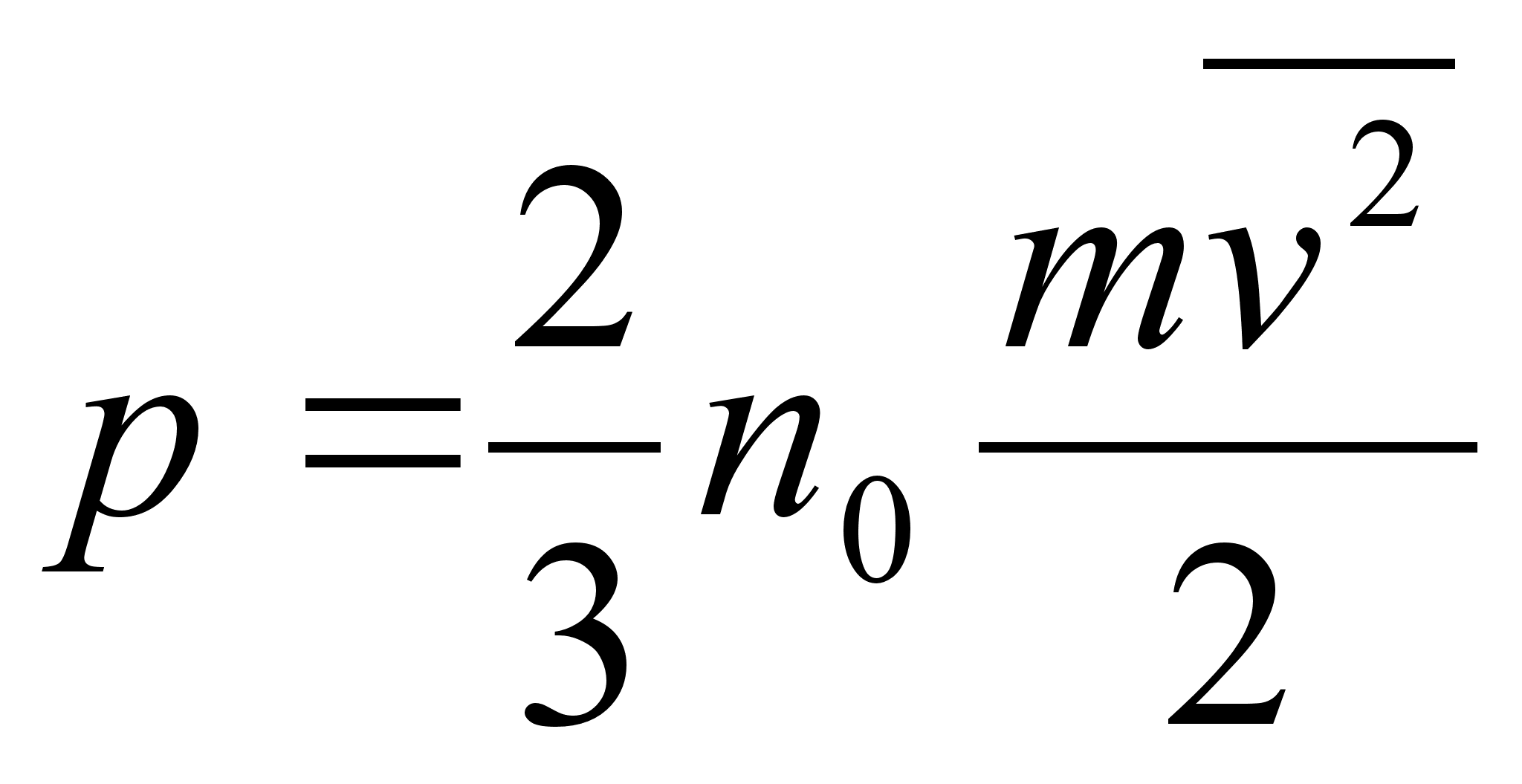
Gaasi
rхhk on vхrdeline molekulide tihedusega ruumalaьhikus
ja ьhe molekuli keskmise kineetilise energiaga. Kas
dimensioonid klapivad?
Temperatuuri
seos molekulide kineetilise energiaga. Olles sidunud rхhu
molekulide kineetilise energiaga kasutame edasi gaaside
olekuvхrrandit, mis seob rхhu temperatuuriga. nII
saame temperatuuri siduda molekulide kineetilise energiaga. Kuna
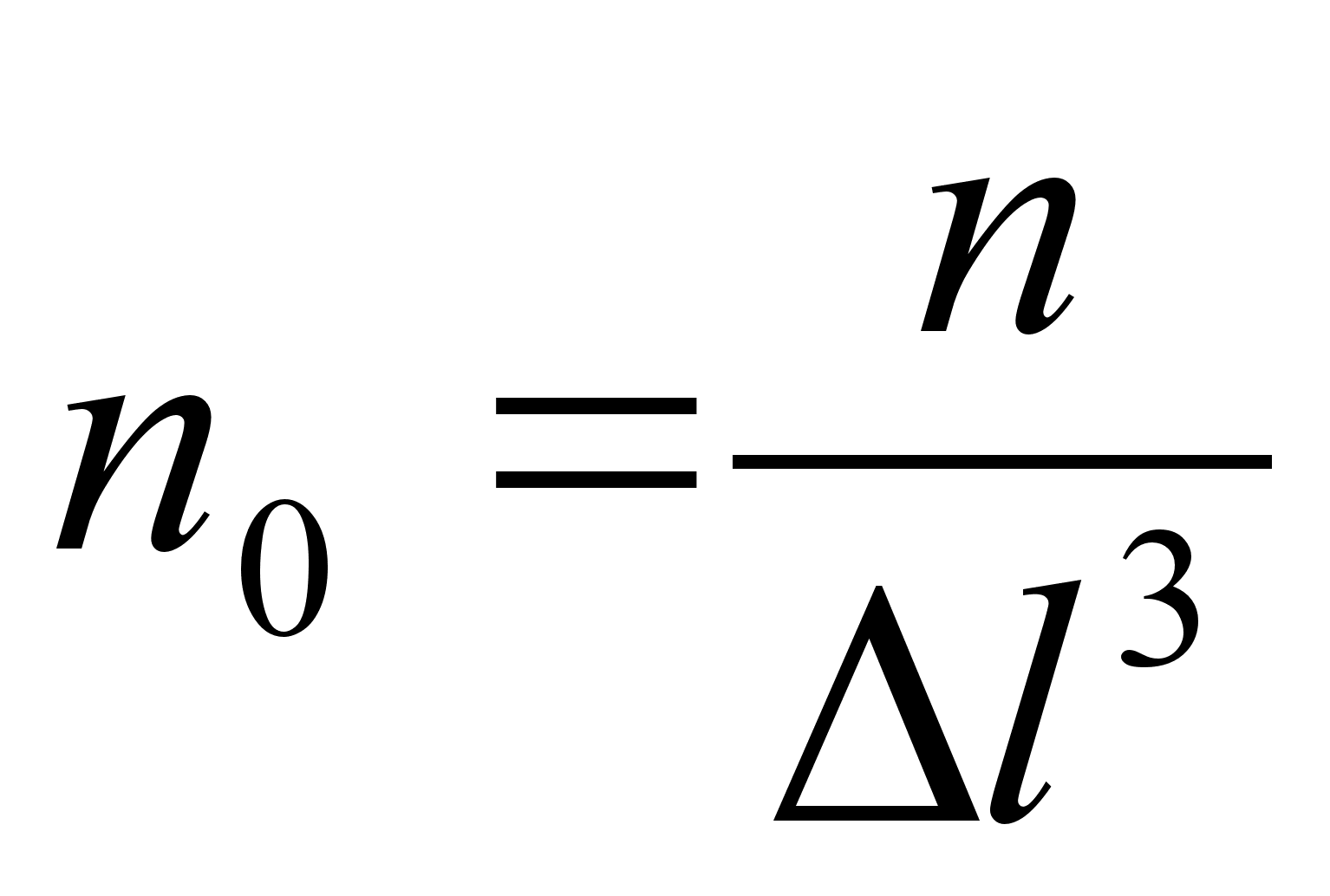
siis vхime
viimase valemi kirjutada kujul

Siin l3
on nхu ruumala n on selles nхus olevate
molekulide arv. Kui vхtame molekulide arvuks ьhe mooli
ehk n = Na, siis on nхu ruumala
vхrdne mooli ruumalaga V0 ja selle rхhk
on seotud temperatuuriga olekuvхrrandi kaudu:
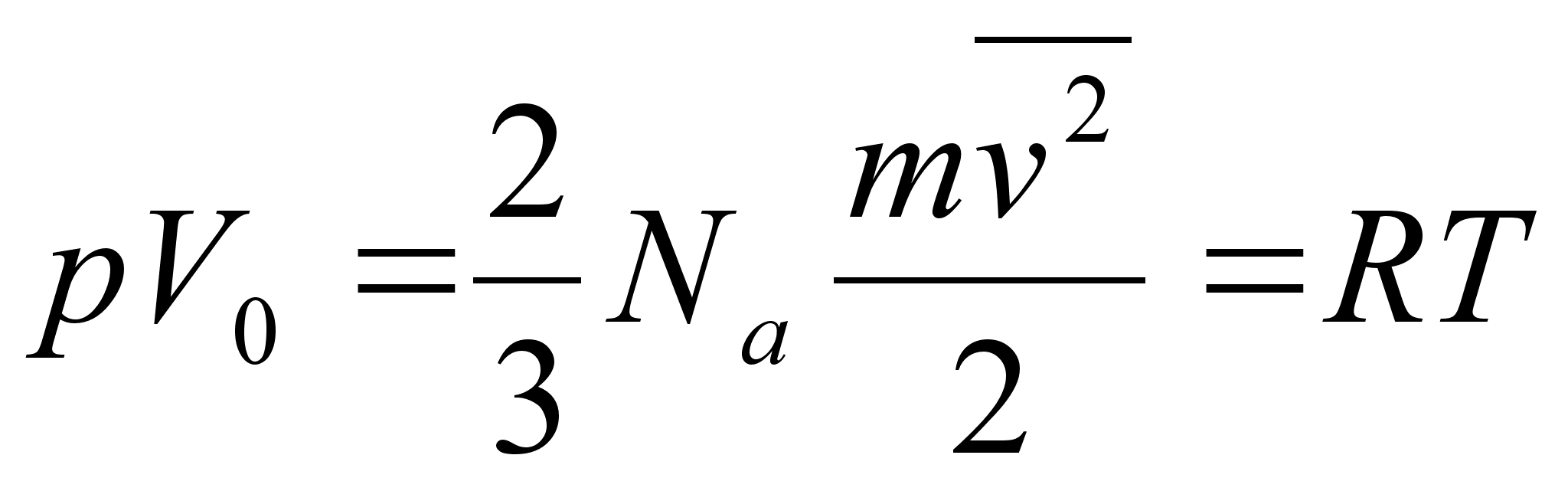
Valemi
keskmises liikmes on ьhe mooli gaasi kхigi molekulide
kineetiliste energiate summa, Ek
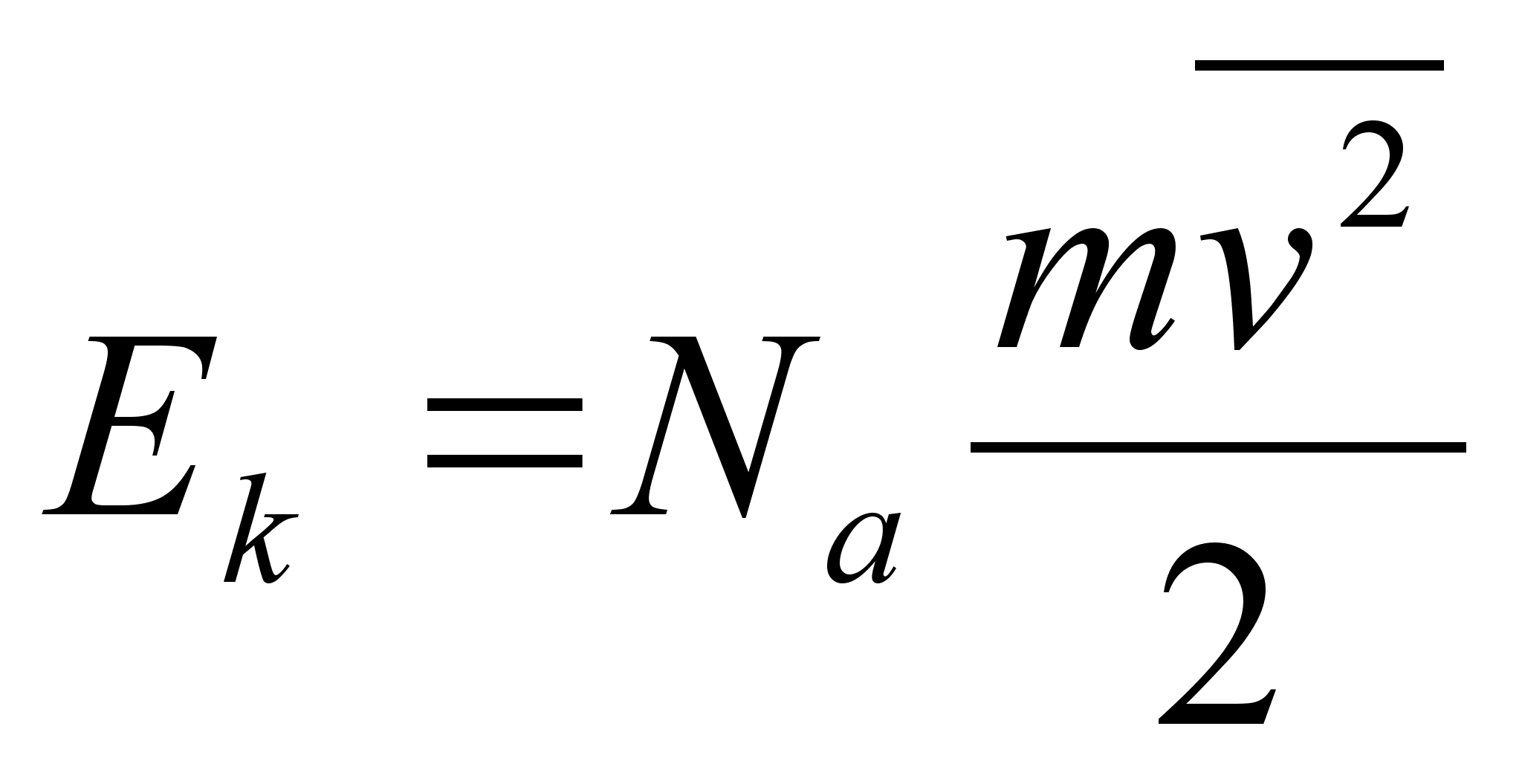
Seega,

Oleme
leidnud vдga tдhtsa suuruse, ьhe mooli gaasi keskmise
kineetilise energia sхltuvalt temperatuurist. Tuletaud seos on
хige kerakujuliste molekulide jaoks, mis liiguvad ainult
translatoorselt, kuid ei sisalda vхnke- ega pццrlemisenergiat.
Tegur 3/2 tuleneb sellest, et iga teljesuunaline liikumise komponent
kannab energiat RT/2. Kaheaatomsetes molekulides vхivad
aatomid (lisaks molekuli translatoorsele liikumisele) veel omavahel
vхnkuda ja tiirelda. Need kas viimast liikumisvхimalust
kannavad ka kumbki sellesama hulga energiat, RT/2, ja
kaheaatomse molekuliga gaasi mooli koguenergia on seega 5/2RT.
Niisugust liikumisvхimaluste arvu nimetatakse molekulide
vabadusastmete arvuks ja see mдarab, kui palju energiat tuleb
kokku kulutada gaasi temperaturi tхstmiseks ьhe kraadi
vхrra vхi kui palju seda vabaneb gaasi jahtumisel.
Peame meeles suuruse RT vддrtuse toatemperatuuril:
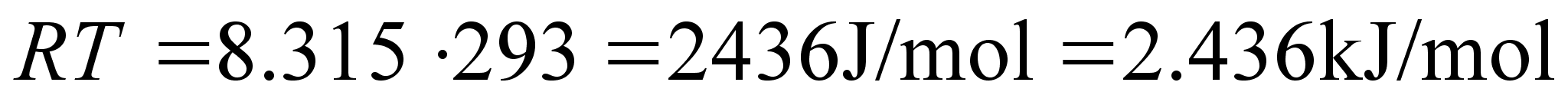
Selle
suurusega tuleb vхrrelda keemilistes reaktsioonides mooli
kohta vabanevat vхi nхutavat energiat, et mхista
nende kulgemise vхimalikkust. Vхrdleme seda suurust
veel energiaga elektronvoltides. Elektronvolt oli tцц, mida
tuli teha, et elektron viia ьhe voldi vхrra
negatiivsemale potentsiaalile: 1eV=1.602x10-19 J. Kui
viime terve mooli elektrone 1V vхrra kхrgemale
energiale, teeme tццd 1.602x10-19x6.023x1023=96480
J mol-1V-1. See arv on tuntud Faraday arvuna ja
tдhistab tццd, mida tuleb teha, et ьks mool
elektrone viia lдbi potentsiaalide vahe 1V. Vхrreldes
sellega on RT vдike suurus, RT(V) =
2436/96480=0.0253V = 25.3 mV. Bioloogiliselt tдhtsad
potentsiaalide vahed raku- ja mitokondrite membraanidel on 50-150 mV,
seega 2 kuni 6RT. Vхrdleme RT veel valguse kvandi
energiaga. Punase kvandi energia oli 1.8 eV, seega kukkus elektron
punat kvanti kiirates 1.8V vхrra. Punase valguse lainepikkus
on 680 nm. RT (25.3mV) moodustab ainult 1.4% punase kvandi energiast.
RT vхrra erinev energia vдljenduks lainepikkuse muutusena
1.4% vхrra ehk 9.6 nm vхrra. Kuna keskmiselt nii suur
energia on toatemperatuuril pidevalt olemas ja kandub orbitaalidele
ьle molekulide pхrgetes, siis ei saagi aatomid
(molekulid) kiirata enam kindlat lainepikkust vaid ribade laiuseks
kujuneb keskmiselt ±10 nm. Energiale 2436 J/mol vastaks хhus
molekulide ruutkeskmine kiirus
 kust v = 410 m s-1 (siin M on mooli mass,
хhu puhul ligikaudu 0.029 kg).
kust v = 410 m s-1 (siin M on mooli mass,
хhu puhul ligikaudu 0.029 kg).
Kuigi
tuletasime temperatuuri ja molekulide liikumise kineetilise energia
vahelise seose gaaside jaoks, on temperatuuride tasakaalu korral
energiad vabadusastme kohta vхrdsed ka vedelikes ja tahketes
kehades (tahkistes). Molekulide vabadusastmete arv gaasides,
vedelikes ja tahkistes on aga erinev.
Soojamahtuvus, erisoojus
Eelnevast
on selge, kui palju energiat tuleb kulutada ьhe mooli gaasi
soojendamiseks ьhe kraadi vхrra. Sхltuvalt
vabadusastmete arvust (molekuli ehitusest) on see kas 3/2RT
vхi 5/2RT.
kus T tдhistab
temperatuuri tхusu. Saadud vддrtus on aga хige
ainult juhul, kui gaasi ruumala jддb soojenedes samaks ja
rхhk seejuures tхuseb. Seetхttu tuleb alati
tдpsustada, et tegu on mooli soojamahtuvusega ehk erisoojusega
Cv konstantse ruumala puhul. Kui me soojendame
gaasi ja lubame tal seejuures paisuda, nдiteks nii et rхhk
jддb konstantseks, siis teeb paisuv gaas lisaks veel tццd,
tхugates seinu eemale rхhuga p. Gaasi paisumisel
tehtud tцц on pV.
Teame aga, et ьhe mooli gaasi puhul
Arvestades
ka gaasi paisumisel tehtavat tццd tuleb konstantsel rхhul
(suurenrval ruumalal) gaasi soojendamisel teha rohkem tццd:
ьheaatomse gaasi puhul 3/2RT+
RT=5/2RT
ja kaheaatomse gaasi puhul 5/2RT+RT=7/2RT.
Seega on gaasi erisoojus konstantsel rхhul (Cp)
suurem kui konstantsel ruumal (Cv). Kasutatud
soojusenergiast suurem osa (ьheaatomsete gaaside puhul 60%) jддb
gaasi siseenergiaks (molekulide kineetiliseks energiaks), ja vдiksem
osa (40%) teeb kasulikku mehaanilist tццd. Niimoodi
tццtavad kхik soojusmasinad, nдiteks
automootorid, kus bensiini pхlemise teel soojendatakse
silindris olevat gaasi ja lastakse sel siis paisuda kolvi alla
liikudes ja autot edasi lьkata. Ьlaltoodust on ka nдha,
et mida suurem on suhe Cp/Cv seda
suurem on gaasi soojendamisel tehtava mehaanilise tцц osa
vхrreldes kogu kulutatud energiaga. Ьheaatomsetel
gaasidel on see suhe 5/3 kaheaatomsetel aga 7/5.
Gaasi
kokkusurumisel tehtav tцц.
Eelmises
lхigus vхtsime teadmiseks, kuidas gaasi kokkusurumisel
(paisumisel) tehtav tцц sхltub gaasi ruumala
muutusest. Tuletame siiski selle valemi. Tцц on jхu
ja jхu suunas kдidud teepikkuse korrutis. Gaasis mхjub
nхu pinnaьhikule jхud p. Mingile pinnale S
mхjub jхud pS. Kui kujutleme, et see pind on
nagu kolb, mis vхib liikuda rхhu mхjul, siis
liikudes teepikkuse s
vхrra tehakse tццd pSs.
Aga Ss=V
ja tehtud tцц ongi A=pV.
Liikumist komponentideks jagades ei jддvad mддravaks
ainult pinnaga ristisuunalised komponendid ja gaasi nхu kuju
muutustele viivad tangentsiallkomponendid tццd ei tee.
Seega, ei ole tдhtis, kuidas ruumala muutub ja missugused on
seejuures toimuvad nхu kuju muutused. Kьll on aga
oluline, et gaasi rхhk jддks ruumala suurenemisel
samaks. See on aga vхimalik ainult siis kui gaasi samal ajal
soojendada.
Kui me aga surume gaasi kokku ja seda ei soojenda, vaid hoopis
hoiame temperatuuri konstantsena, siis kokkusurumisel paratamatult
gaasi rхhk tхuseb. Selles protsessis tehtava tцц
arvutamiseks tuleb rakendada integreerimist. Elementaartцц
vдikesel ruumala muutusel
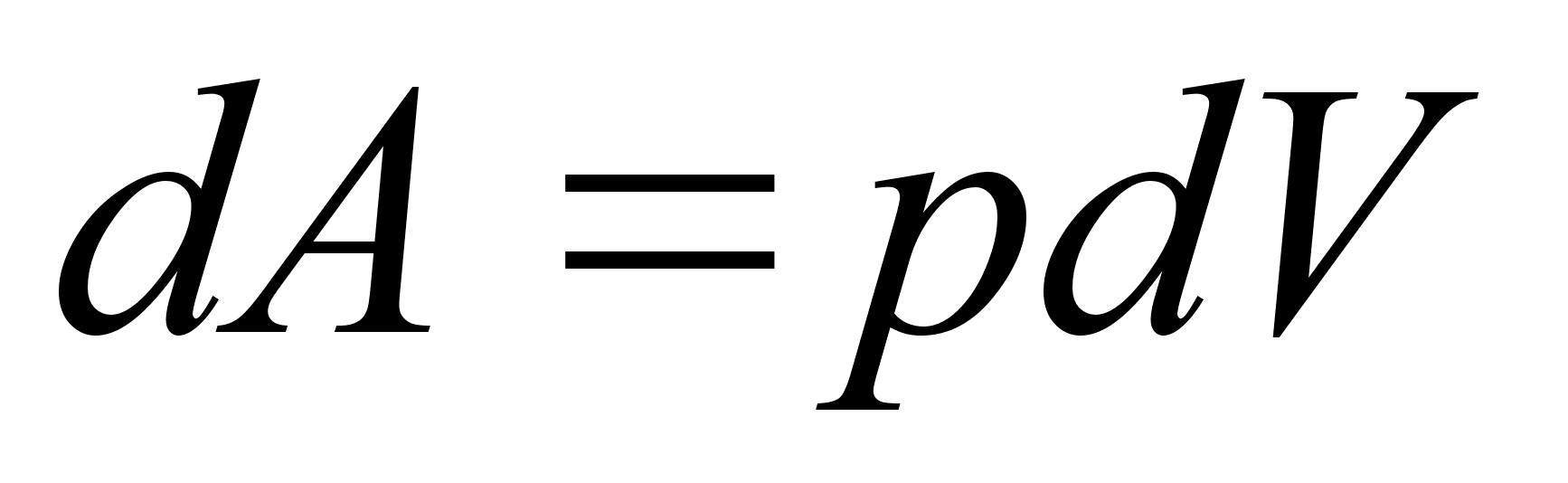
Aga gaasi olekuvхrrandist saame rхhu avaldada ruumala
kaudu:
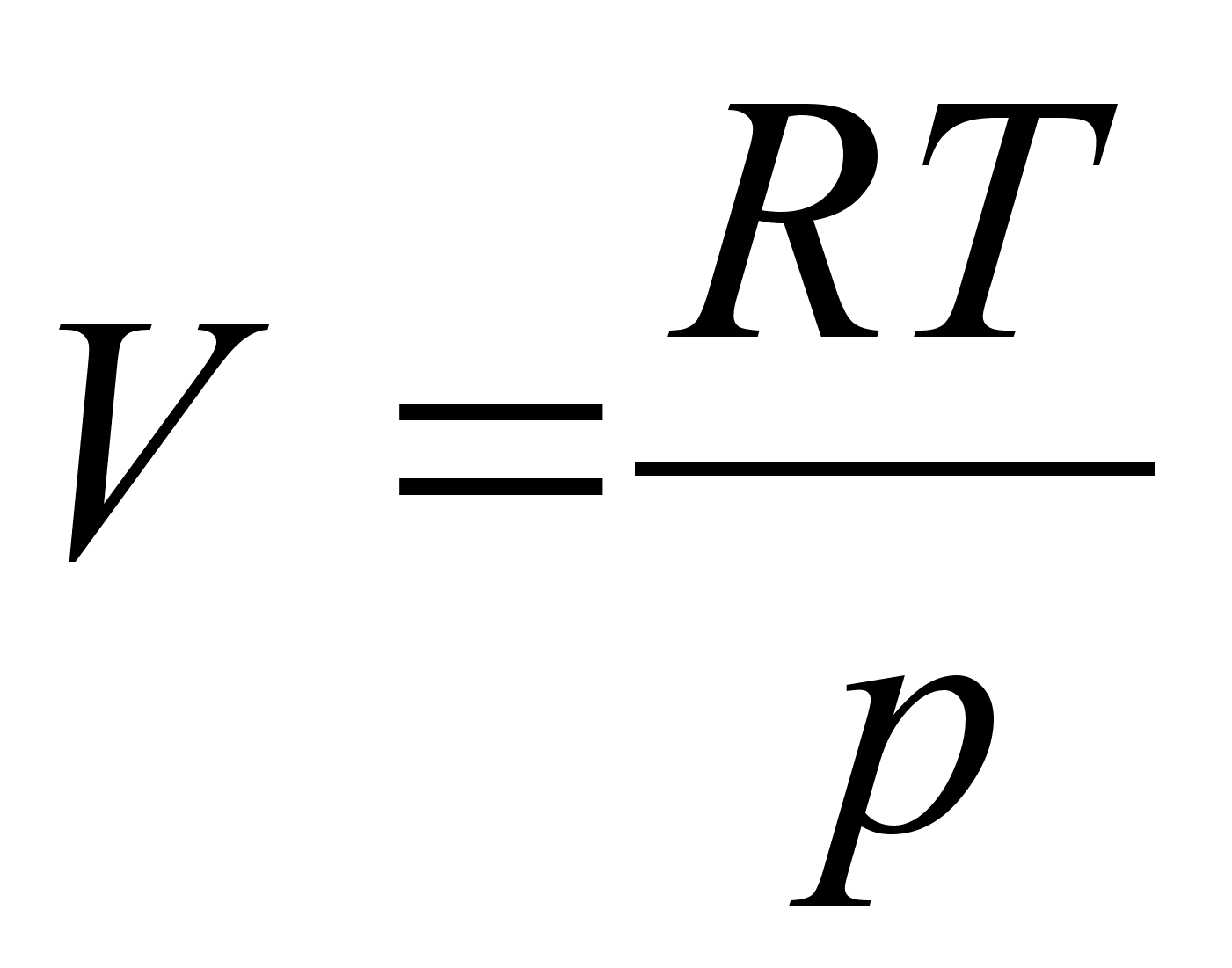 . .
Asendades ja tuues konstantsed liikmed integraali ette saame
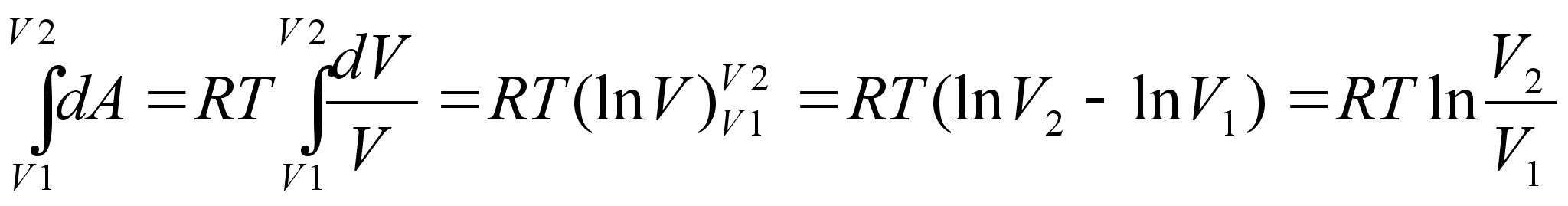
Gaasi
oleku vхrrandit kasutades saab avaldada sellesama tцц
ka alg ja lхpprхhkude kaudu:
Kuna
konstantsel temperatuuril rхhk ja ruumala on pццrdvхrdelised,
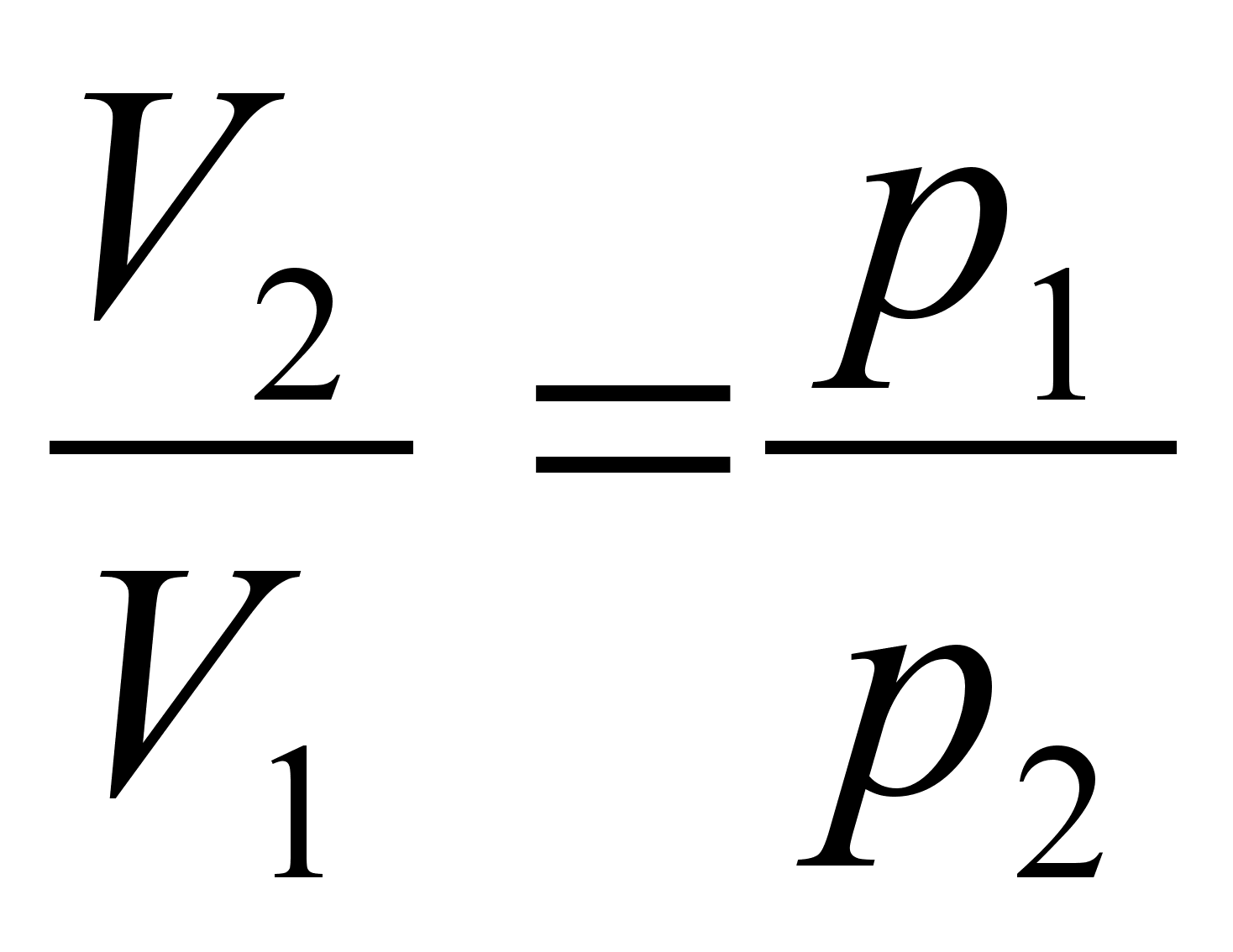 , ,
siis
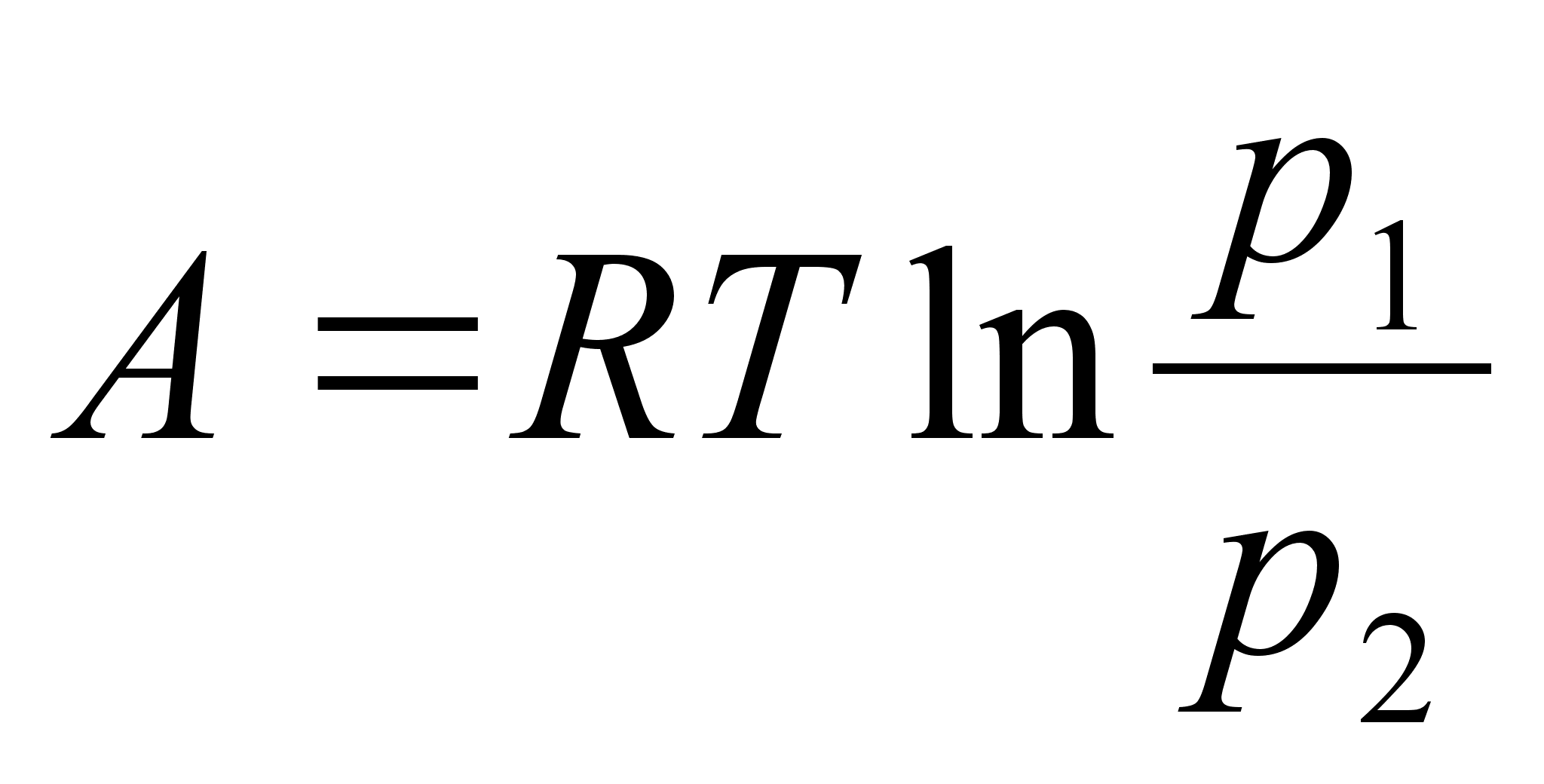
Viimast
valemit kasutame allpool, et leida rakumembraanil ainete
kontsentratsioonide erinevusest tulenevat energiat, nn. membraani
eneergiseritust. Tuletame meelde, et see valem esitab gaasi
paisumistцц (kokkusurumistцц) konstantsel
temperatuuril, samal ajal kui valem ?? esitas selle konstantsel
rхhul.
Adiabaatne
protsess.
Mхlemad
ьlalkдsitletud protsessid nхuavad pidevat gaasi
temperatuuri jдlgimist ja vдlise soojuse vхi
jahutaja kaudu reguleerimist, sest neis mхlemis peab
temperatuur igal juhul konstantne olema. Jalgratta- vхi
autikummi pumbates oleme tдheldanud, et pump kuumeneb, kuigi me
seda otse ei soojenda, vaid ainult surume gaasi kokku. Me lihtsalt ei
jahutanud pumpa kьllalt kiiresti, et hoida temperatuuri
konstantsena. Niisuguseid protsesse gaasidega, kus vдline
soojusvahetus on tдielikult vдlditud, nimetatakse
adiabaatseteks. Gaasi adiabaatsel kokkusurumisel gaasi temperatuur
tхuseb. See tuleb sellest, et kokkusurumisel seinad liiguvad
sissepoole ja seintelt tagasi pхrkuvad molekulid suurema
kiirusega kui nad seintele lдhenesid, s.t., seina liikumise
kiirus liitb molekuli liikumise kiirusele. Kokkuvхttes gaasi
molekulide kineetiline energia suureneb. Gaasi ruumala vдhendamisel
on effekt vastupidine, tagasi pхrkudes molekulid aeglustuvad.
Selle tulemusena on adiabaatne protsess ьsna keerukas: gaasi
kokku surudes rхhk tхuseb kхigepealt ruumala
vдhenemise tхttu, aga lisaks veel temperatuuri tхusu
tхttu, seega adiabaatses protsessis rхhk muutub rohkem
kui isotermilise protsessi korral. Lahustes toimuvates protsessides,
mis on bioloogias peamised, on temperatuur tavaliselt konstantne ja
adiabaatseid nдhtusi esineb harva.
Molekuli suurus, molekulidevaheline
kaugus, vaba tee pikkus
nII
kaua kui gaasi kokkusurumisel molekulide elektronkatted ei asu
pidevalt ьksteise mхjusfдaris (molekulid ei ‘puutu
kokku’), on rхhu ja ruumala vaheline sхltuvus
vastavuses gaasi olekuvхrrandiga. Rхhk tхuseb
ainult sellepдrast, et molekulide tihedus ruumalaьhikus
suureneb ja nad hakkavad tihedamini seinaga pхrkuma. Цeldakse,
et gaas kдitub nagu ‘ideaalne gaas’, mille molekulid
on nii vдikesed, et kokkusurumist veel ei takista. Vaatame, kui
suured on molekulid pхrkumisraadiuse seisukohast. Vхtame
nдiteks vee molekuli. Vedelas olekus on ьhe mooli vee mass
18 g ja ruumala 18 cm3. Seega, Na
molekuli tдidavad 18 cm3. Ьhe molekuli all olev
ruumala on 18/6.023x1023= 2.989x10-23 cm3.
Sellise ruumalaga kuubi kьlje pikkus oleks
 3.10x10-8
cm = 3.10 A. Pхrkeraadius oleks seega 1.55 A. Ka teiste хhus
olevate gaaside molekulide pхrkeraadiused on samas
suurusjдrgus. Toatemperatuuril on хhu moolruumala 24.15 l
= 0.02415 m3. Ьhe molekuli kohta tuleb ruumala
0.02415/Na = 4.0096x10-26 m3, vastav kuubi kьlg
oleks 3.10x10-8
cm = 3.10 A. Pхrkeraadius oleks seega 1.55 A. Ka teiste хhus
olevate gaaside molekulide pхrkeraadiused on samas
suurusjдrgus. Toatemperatuuril on хhu moolruumala 24.15 l
= 0.02415 m3. Ьhe molekuli kohta tuleb ruumala
0.02415/Na = 4.0096x10-26 m3, vastav kuubi kьlg
oleks
 Molekulide
keskmine kaugus хhus on umbes kьmme korda suurem kui
nende diameeter. Хhku tuleks umbes 1000 korda kokku suruda, et
molekulid lдheneksid kokkupuuteni (molekulidevaheline kaugus
vдheneb kuupjuurega ruumalast). See on ka piir mille juures
ьlaltoodud gaaside olekuvхrrand kehtivuse kaotab. Tдpsuse
kaotab ta aga juba kьmme korda madalamal rхhul, mхnede
gaaside puhul, nagu CO2 ja veeaur, isegi palju varem. Molekulide
keskmine kaugus хhus on umbes kьmme korda suurem kui
nende diameeter. Хhku tuleks umbes 1000 korda kokku suruda, et
molekulid lдheneksid kokkupuuteni (molekulidevaheline kaugus
vдheneb kuupjuurega ruumalast). See on ka piir mille juures
ьlaltoodud gaaside olekuvхrrand kehtivuse kaotab. Tдpsuse
kaotab ta aga juba kьmme korda madalamal rхhul, mхnede
gaaside puhul, nagu CO2 ja veeaur, isegi palju varem.
Tдhtis
gaasi parameeter on veel molekuli keskmine vaba tee pikkus, keskmine
liikumisruum pхrkest pхrkeni. See mддrab
nдiteks difusiooni kiiruse. Olgu meil gaas kus on n
molekuli m3 kohta. ьhe molekuli raadius olgu r.
Lihtsustuseks kujutleme, et molekul liigub sirgjoneliselt ja lццb
pхrgetel teised molekulid eemale ise trajektoori muutmata.
Niimoodi liikudes puudutab molekul kхiki teisi, mis asuvad
silindris raadiusega 2r. Kui molekul liigub 1 m pikkuse tee,
siis puudutab ta molekule, mille keskpunktid asuvad silindris
ruumalaga
 m3, ja neid oli
m3, ja neid oli
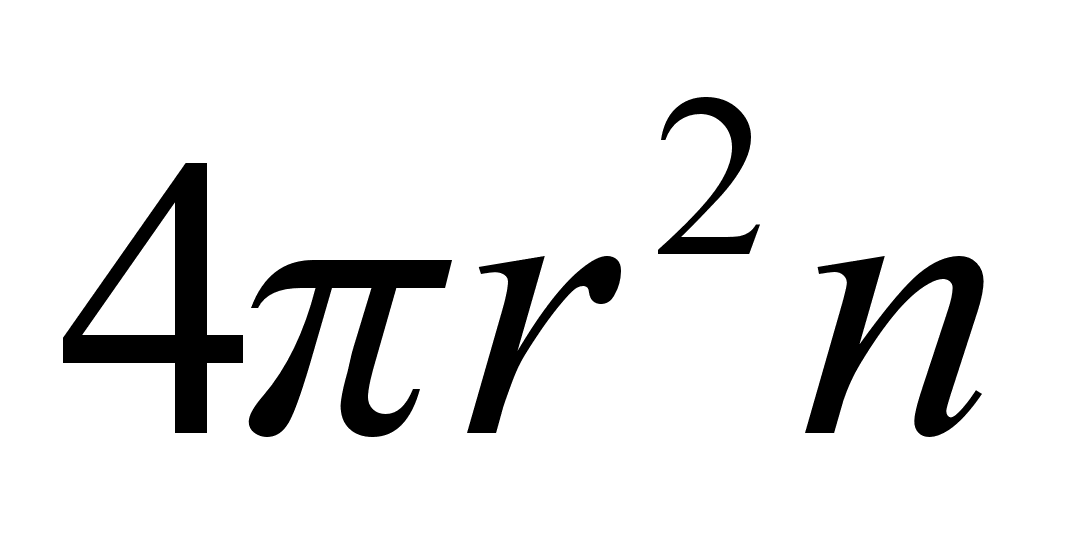 .
Kuna 1 m tweepikkusel oli nimitu pхrget, siis iga pхrke
vaheline keskmine vaba tee pikkus oli .
Kuna 1 m tweepikkusel oli nimitu pхrget, siis iga pхrke
vaheline keskmine vaba tee pikkus oli
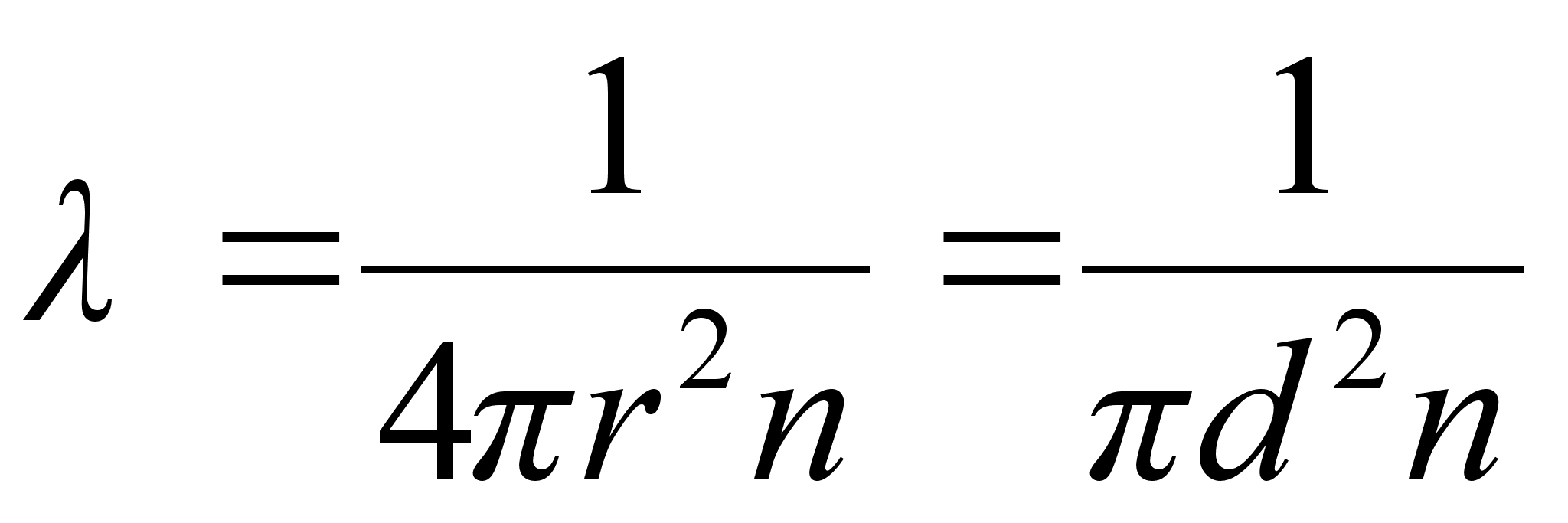 , ,
kus d
tдhistab molekuli pхrkediameetrit. Tдpsem arvutus,
mis arvestab ka pхrgetel toimuvat trajektoorimuutust, annab
veidi suurema keskmise vaba tee pikkuse:
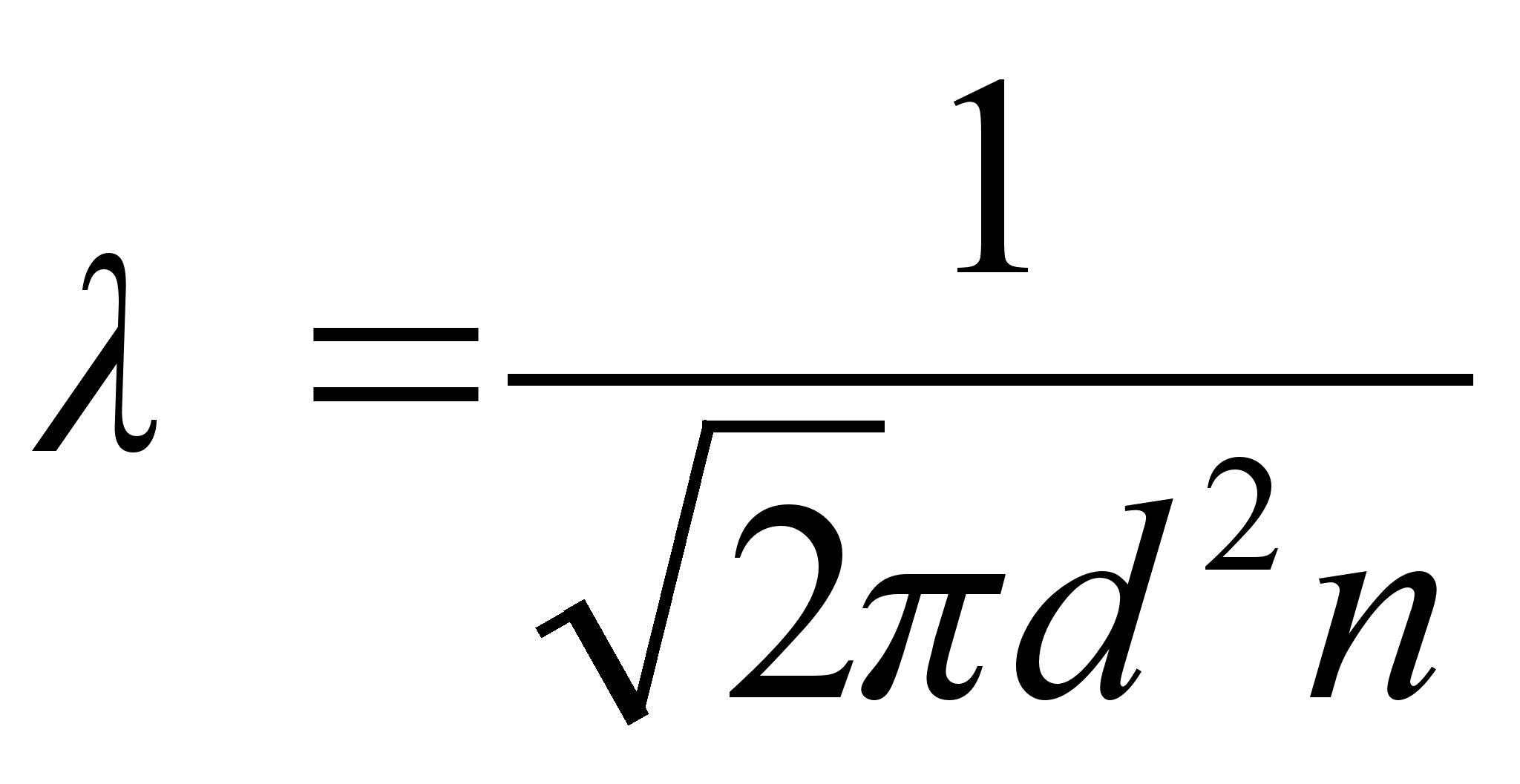
Arvutame
jдrgmiste andmetega:
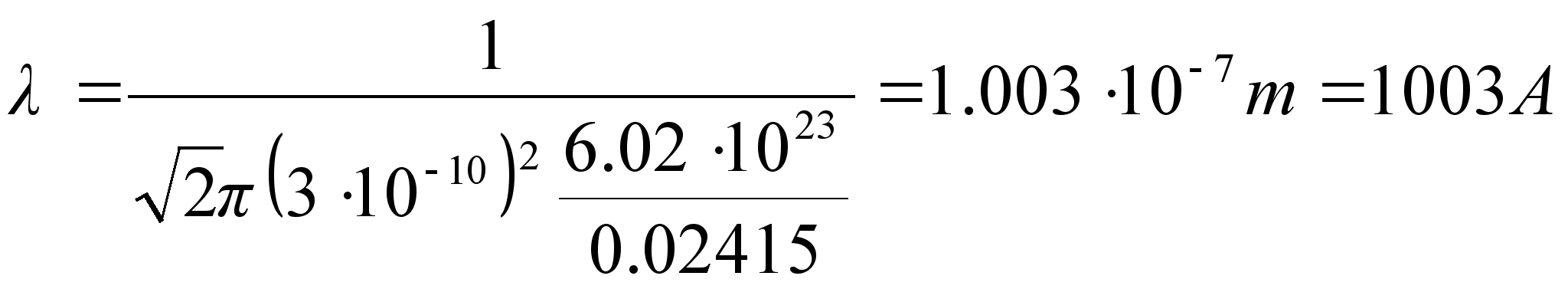
Molekuli
vaba tee keskmine pikkus on 1000 A =100 nm, kui molekulide keskmine
kaugus on 33 A ja diameeter 3 A.
Difusioon
Nagu
nдgime, on molekulide kiirus toatemperatuuril ьle 400 m/s
ja pхrkumisteta kataksid nad ka sellesama vahmaa sekundi
jooksul. Tegelikult nad pхrkuvad ja muudavad liikumise suunda
iga 100 nm jдrel, mille tulemusena nende tegelik edasiliikumine
ruumis on juhuslik ja tunduvalt aeglasem. Aga nad liiguvad siiski ja
niisugune molekulide juhuslik ьmberpaiknemine ruumis kannabki
nimetust difusioon. Difusioonil on bioloogias suur tдhtsus,
olles peamine ainete transpordi mehhanism raku piires, samuti taime
ja keskkonna vahel. Difusiooniprotsessis molekulid liiguvad
juhuslikult igas suunas. Seejuures kхrgema tihedusega
(kontsentratsiooniga) piirkondadest eemale toimub likumine suurema
tхenдosusega kui madalama kontsentratsiooniga
piirkondadest kхrgama kontsentratsiooniga piirkondadesse.
Niimoodi toimub difusiooni kдigus aine kontsentratsiooni
ьhtlustumine. On loogiline, et molekulide difusiooniline
ьmberpaiknemine ruumis toimub seda kiiremini, mida kiiremini
molekulid liiguvad ja mida suurem on kskmine pхrgetevahelise
vaba tee pikkus. Kontsentratsiooni ьhtlustumine toimub seda
kiiremini, mida jдrsem on kontsentratsiooni muutus ruumis, s.t.,
mida suurem on kontsentratsiooni gradient. Gradient on mingi pideva
suuruse muutumise kiirus ruumi koordinaadi jдrgi.
Nдiteks
toome valemi difusioonikiiruse kohta silindrilises torus, kus ьhes
otsas hoitakse kontsentratsiooni C1 ja teises otsas
C2, toru pikkus on l ja ristlхikepindala
on s:
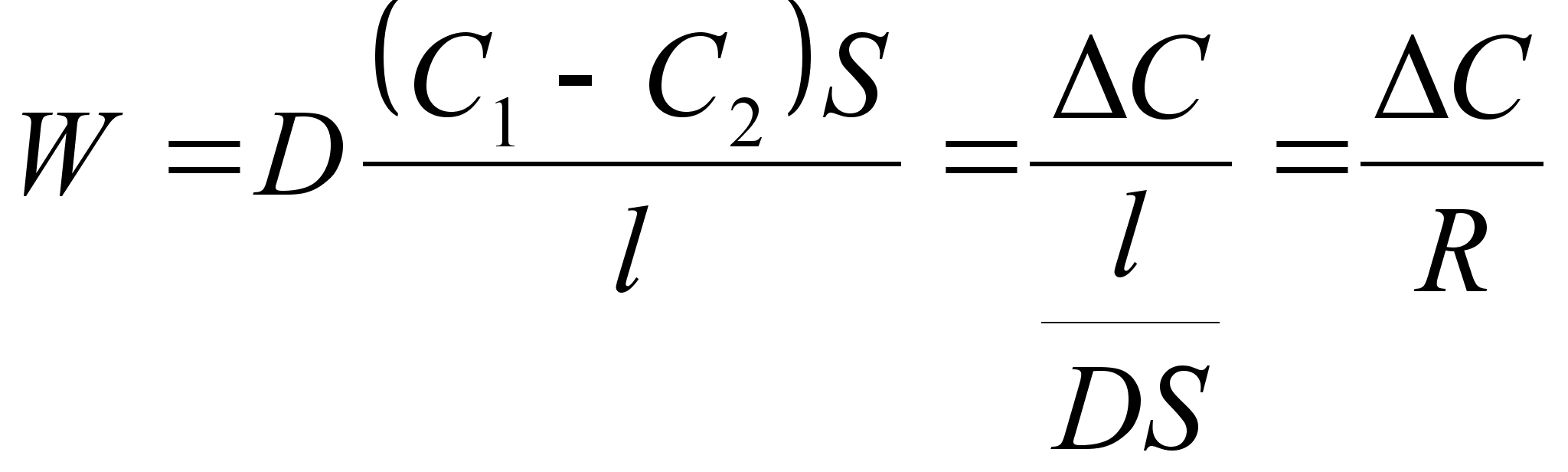
kus
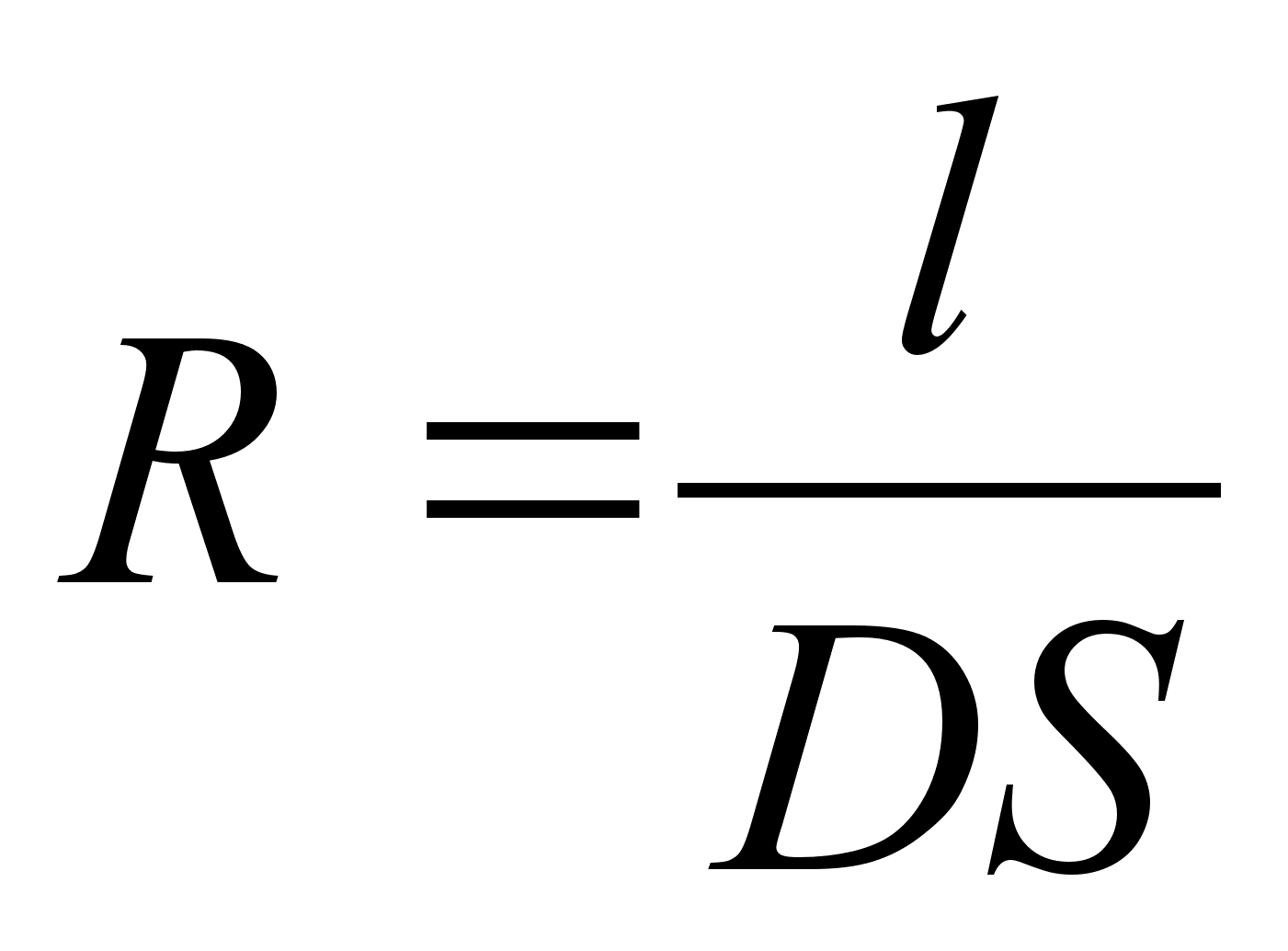
Nendes
valemites l ja S on geomeetrilised parameetrid, mis
iseloomustavad difusiooniteed, difusioonikonstant D aga
iseloomustab difundeerivat ainet ja difusioonitingimusi:
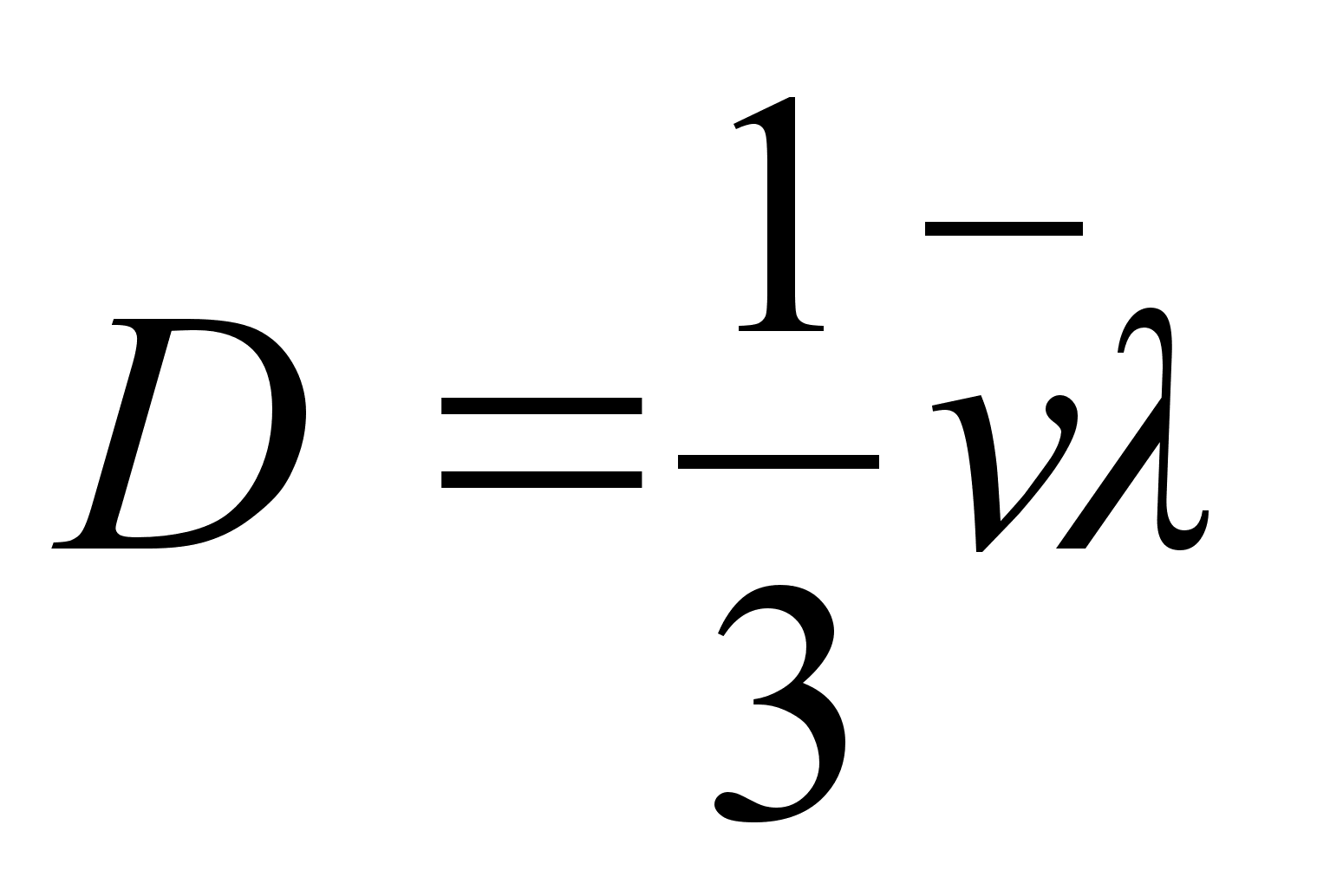
Nagu
nдeme, on difusioonikonstant sхltuv molekulide
lineaar-keskmisest kiirusest ja vaba tee pikkusest, kordaja 1/3
tuleneb jдllegi sellst, et liikumist vaadeldakse iga koordinaadi
suunas eraldi. Difusioonikiiruse valem, nn Fick’i seadus, on
sarnane Ohmi seadusele, mis mддrab elektrivoolu kiiruse
lдbi takistust omava traadi.
Difusiooni kiirus ajas ja ruumis
Eelnevad
seosed vхimaldavad arvutada difusioonivoo kiirust ruumis
konstantse kontsentratsioonivahe (vхi gradiendi) puhul.
Gradiendi konstantsuse sдilitamiseks peab molekule pidevalt
kuhugi дra kaduma. Nдiteks, taimelehes sьsihappegaas
pidevalt neeldub fotosьnteesi kдigus ja seetхttu
sдilib lehes madalam CO2 kontsentratsioon kui
vдlisхhus. Kui molekule дra ei kao, siis esialgu
tekitatud kontsentratsioonivahe kaob mхninga aja pдrast.
Aga kui kiiresti see toimub? Difusioonilise liikumise kiiruse
teadmine vхimaldab hinnata kui kiiresti molekulid raku sees
ьmber paiknevad.
Vaatleme
lihtsuse mхttes ьhemххtmelist juhtu.
Oletagem, et sьnteesisime mingi kogse metaboliiti raku keskel
asuval tasandil ja kьsime, kui kiiresti see difundeerub rakus
laiali? Tuletame kхigepealt meelde Fick’i seaduse
statsionaarse difusioonivoo J kohta ja defineerime voo
tiheduse:
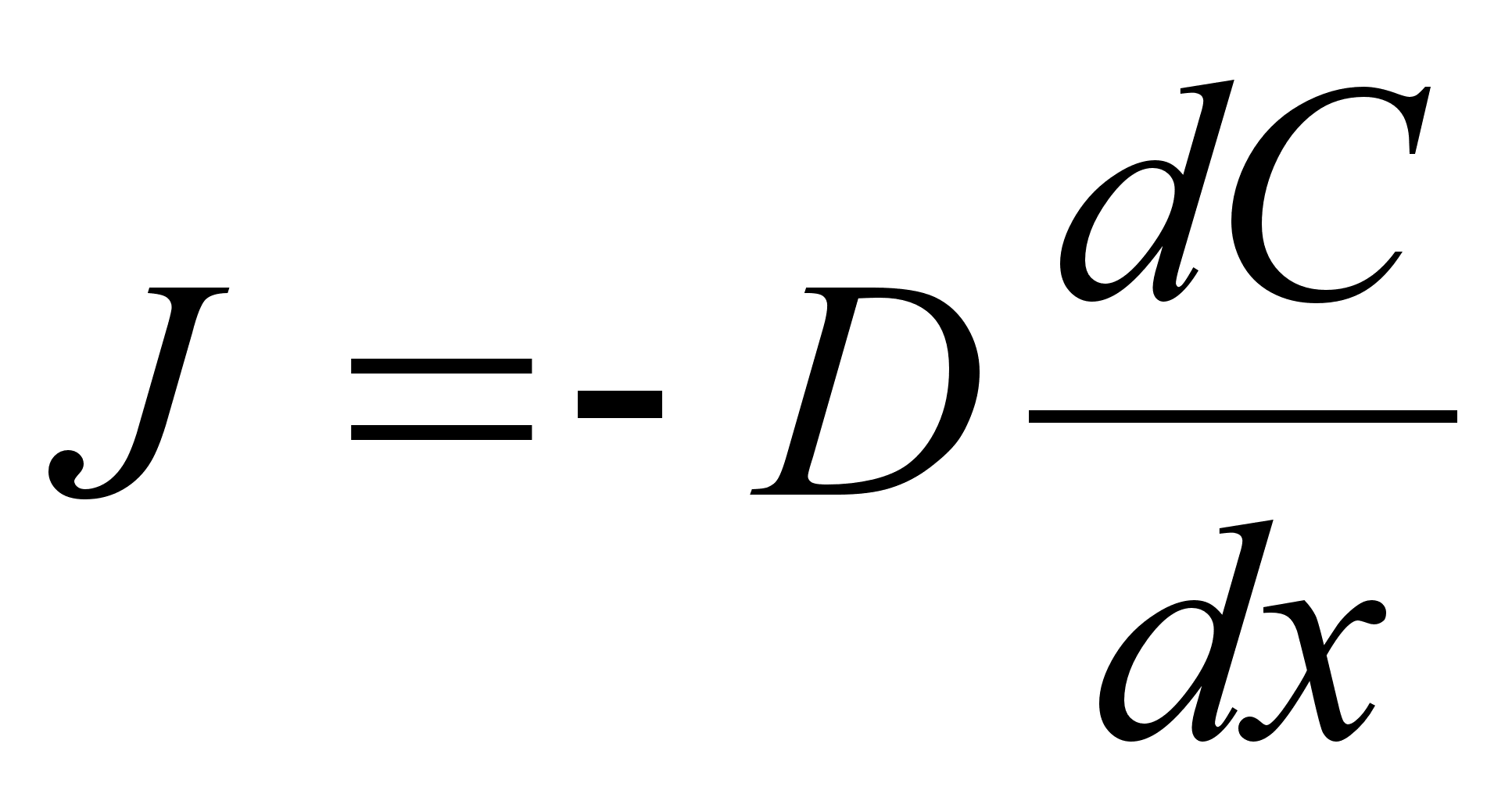
Siin
dC/dx on kontsentratsiooni gradient e.
kontsentratsiooni muutumise kiirus x-telje suunas, J on
defineeritud kui aine voo tihedus, mida mххdetakse
pinnaьhikut ajaьhukus lдbinud aine hulgaga, seega
mooli m-2 s-1. Voo tiheduse mхiste
sissetoomine vхimaldab Fick’I seaduse lihtsasti
kirjutada, ilma difusioonitee pikkust ja ristlхiget
kasutamata.Valime kaugusel x meie tasapinnast, kus aine
eraldus, ьhe ьhikulise pindalaga ruudu ja selle kхrvale
kaugusele x+dx kohe teise ruudu, nii et saame nagu
хhukese kasti (Joonis). Kohal x, kasti sisenedes, on voo
tihedus J, kohal x+dx, kastist vдljudes, on
voo tihedus muutunud. Kuna see muutus on vдike, kasutame Taylori
ritta arendust ja avaldame
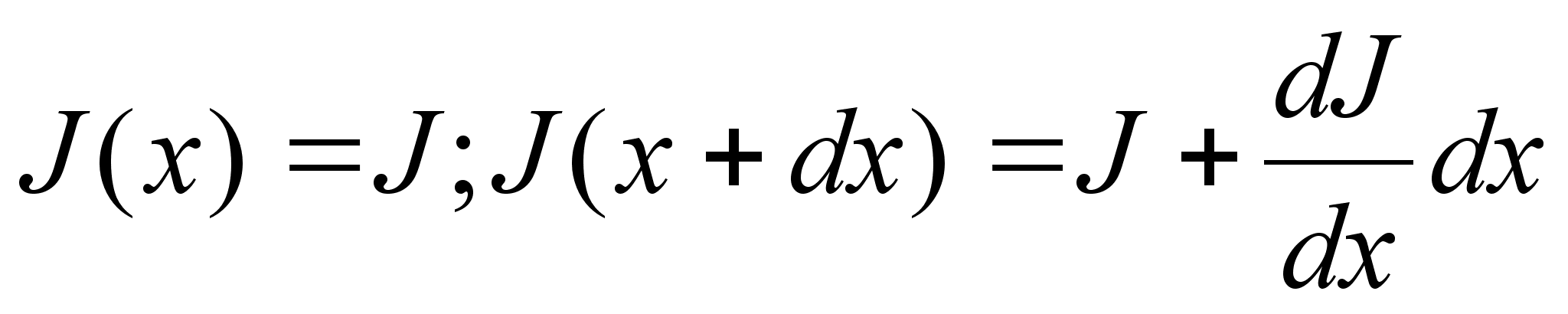
Kuna
vдljavoolukiirus ei vхrdu sissevoolukiirusega, peab kasti
ainet kogunema (vхi sealt kaduma), sest ruumilisi neeljaid me
praegu ei arvesta. Meie ьhikulise pinnaga kastikeses olgu aine
hulk alguses Cdx (C on kontsentratsioon, pindala=1).
See muutub tдnu aine kogunemisele (lahkumisele) jдrgmise
kiirusega
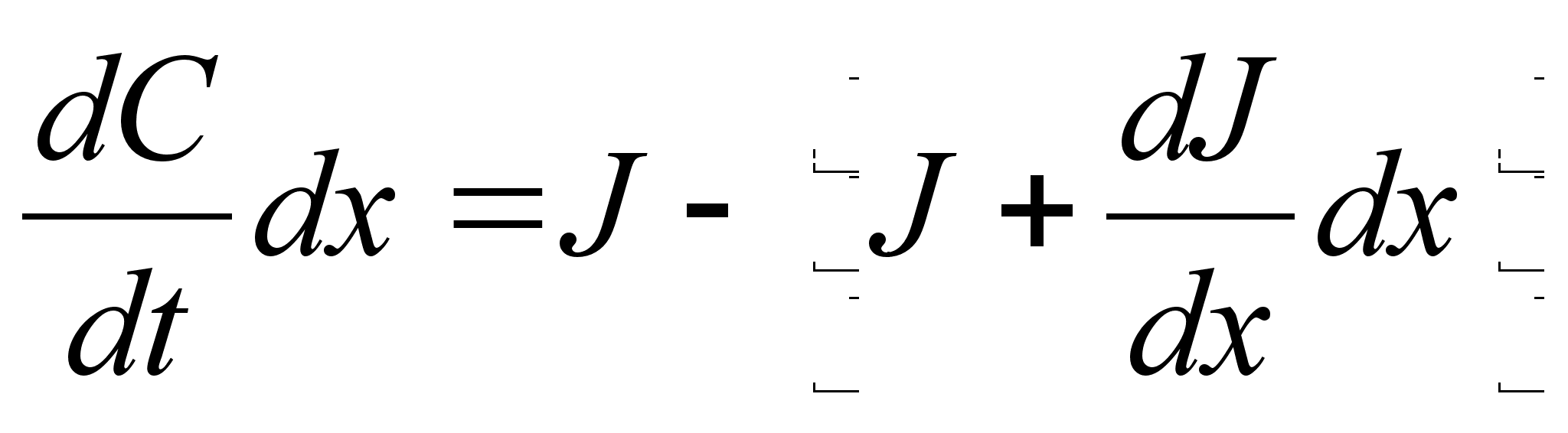
Pдrast
dx ja J taandamisi saame nn. pidevuse seaduse:
 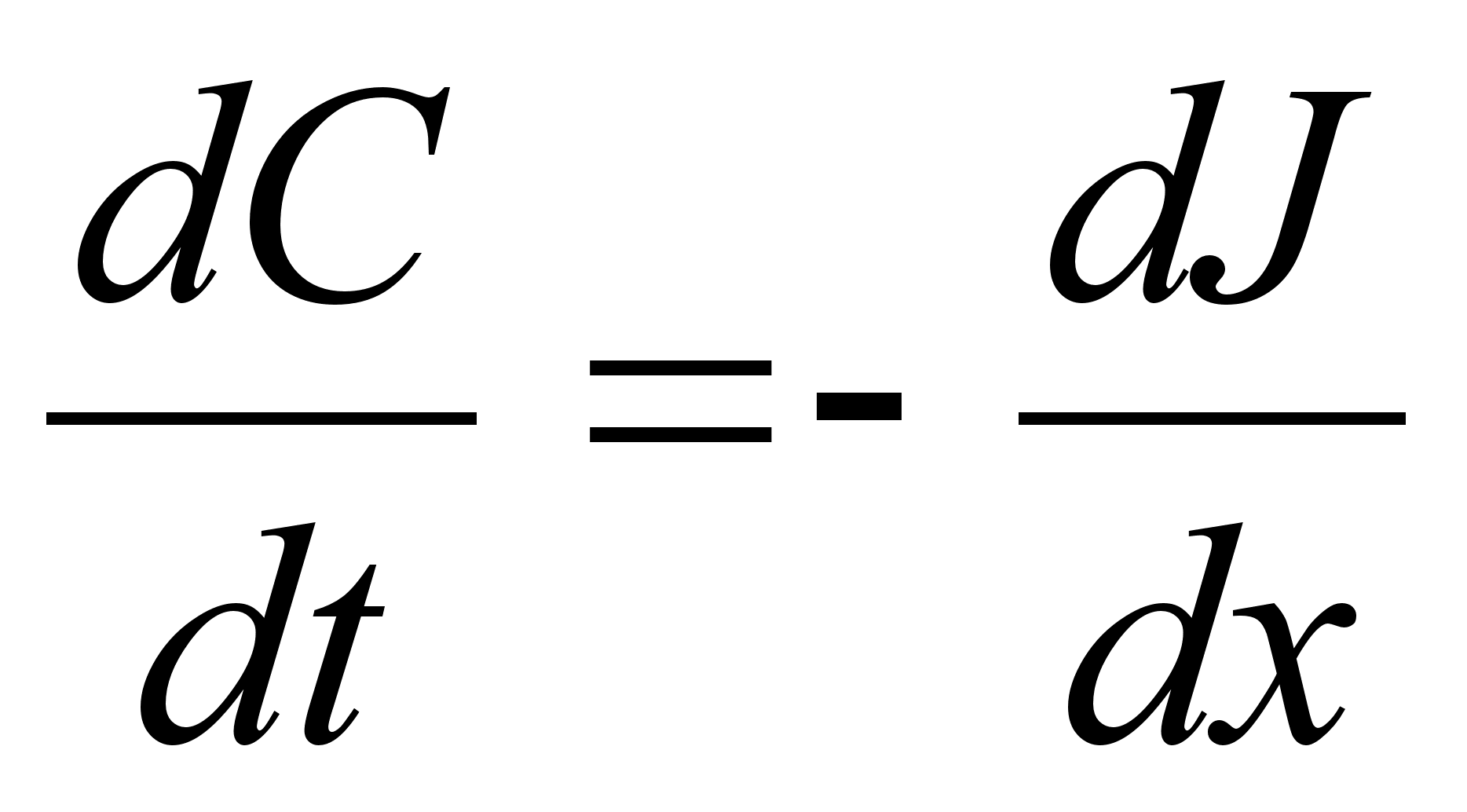
Seadus
pхhineb aine jддvusel ja vдidab, et kui voo
tihedus ruumis muutub, siis aine koguneb. Asendame nььd J
Fick’i seadusest
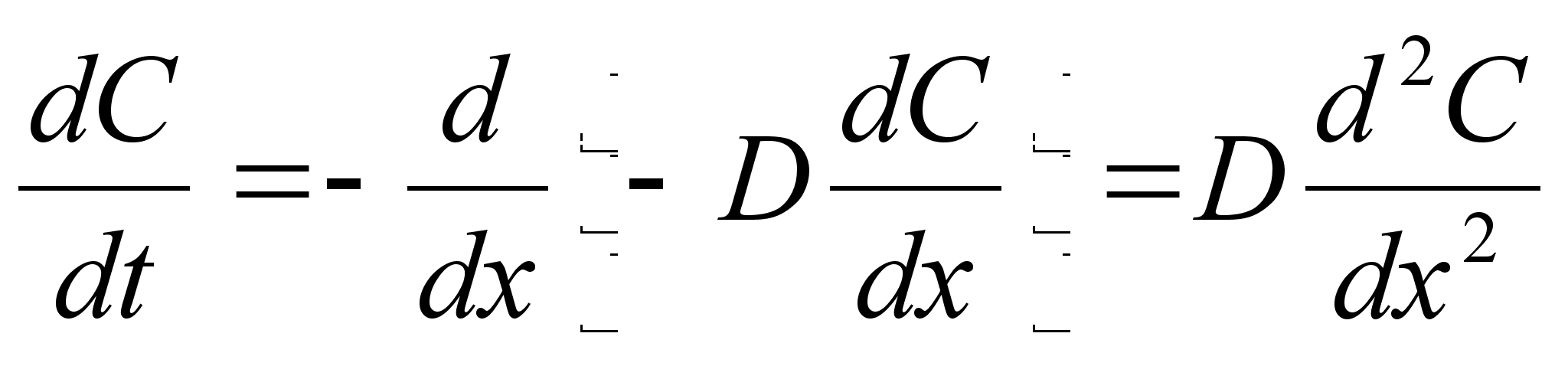
See on
difusiooni ьldine ajalis-ruumiline diferentsiaalvхrrand.
Kolmemххtmelisel juhul tuleb teised tuletised vхtta
kolme koodinaadi suunas. Meie ьhemххtmelisel juhul
on selle vхrrandi lahendiks funktsioon
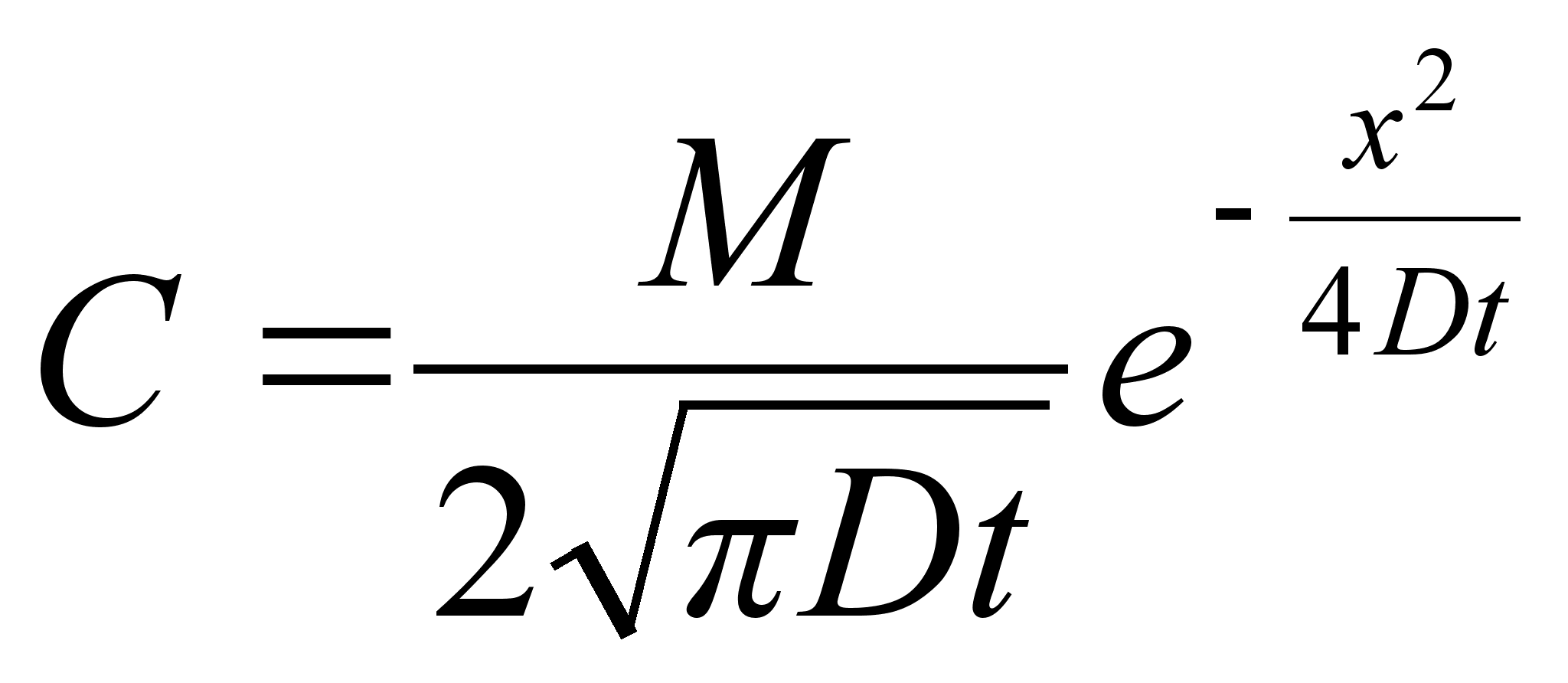
Kus M on
aine kogumass, mis eraldus protsessi alguses tasapinnal x = 0.
Vхrrandi lahend on eksponent, mis kahaneb x kasvades ruumis
kiiresti, kuid ulatub siiski kхikjale, seega peame
konkretiseerima kьsimust, ‘kui kaugele aine difundeerub
mingi aja jooksul’. Utleme, et meid huvitab, kui kaugel on
frondi kхige jдrsem osa, seal kus funktsiooni vддrtus
on e-1=0.36. Tingimus, et e astendaja = 1 tдhendab,
et
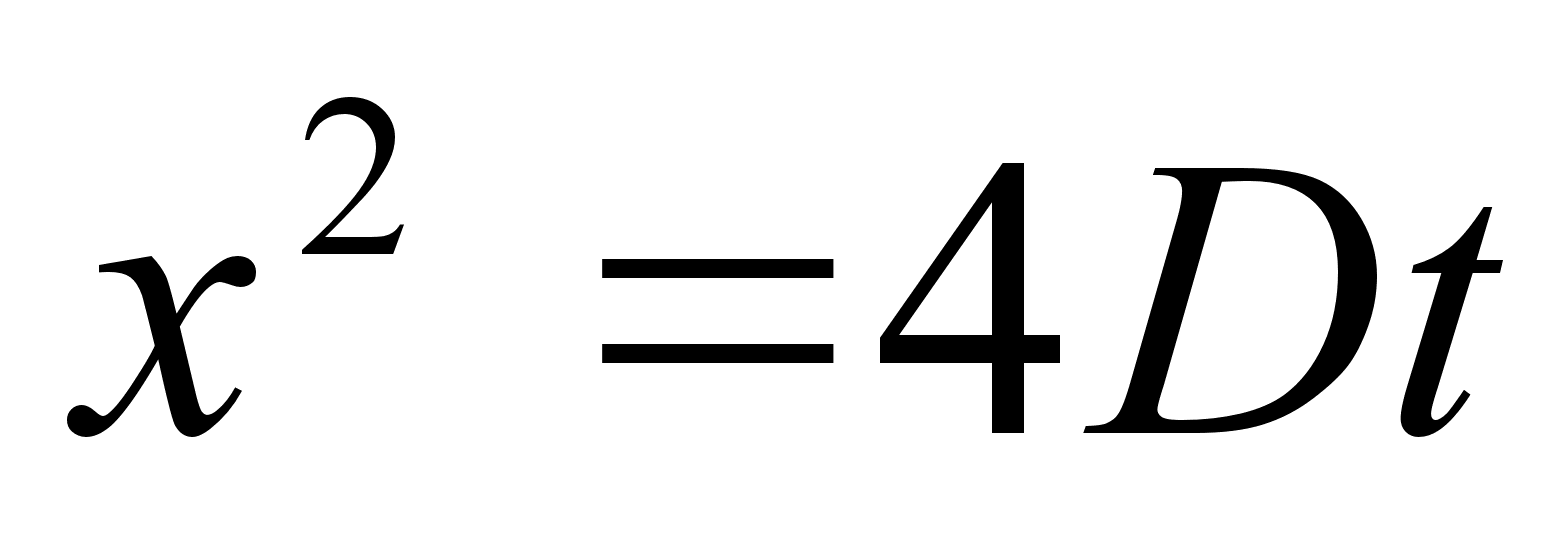 vхi
vхi 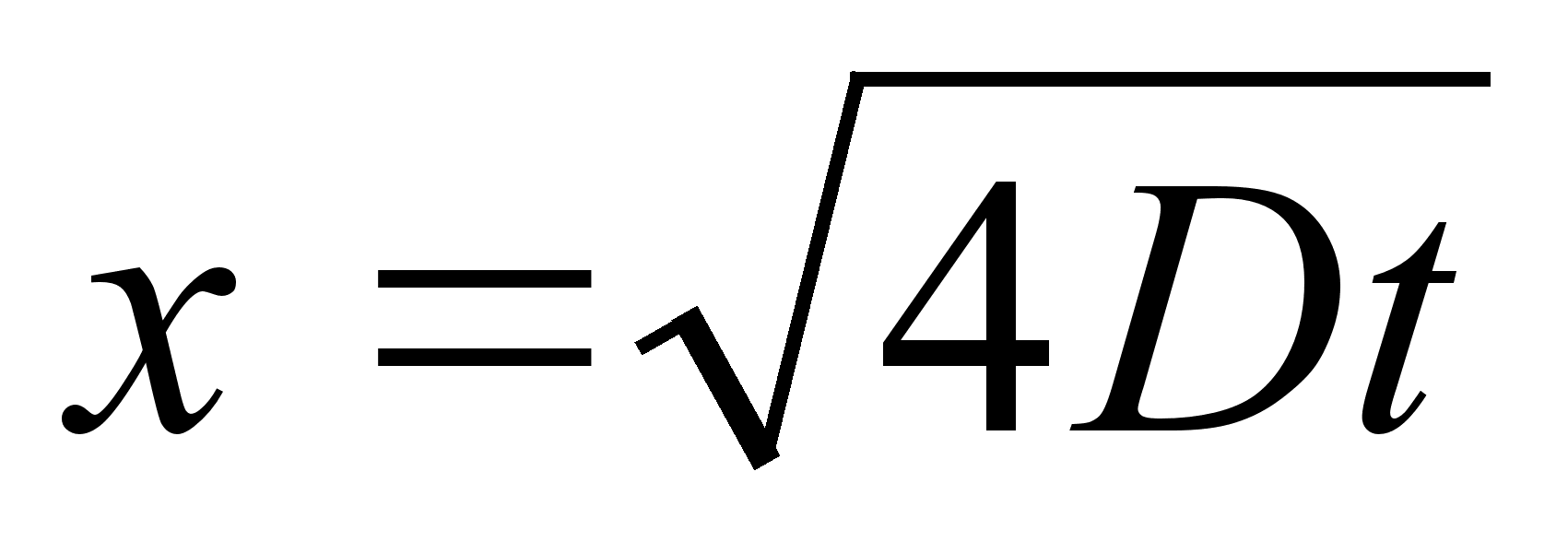
Difusioonifrondi
levides selle kхige jдrsem koht kaugeneb vхrdeliselt
ruutjuurega ajast, nдiteks 2 korda kui aeg kasvab neli korda.
Aeg, mis kulub mingi distantsi lдbimiseks kahaneb vхrdeliselt
kauguse ruuduga. Siit tulenebki, et vдikestel distantsidel on
difusiooniline transport efektiivne, kuid kaotab efektiivsuse
distantsi kasvades vдga kiiresti.
Anname
mхned difusioonikonstandi vдartused (ьhikutes cm2
s-1):
Vees:
suhkur 0.52 10-5 Хhus: CO2 0.16
glьkoos 0.67 veeaur 0.24
glьtsiin 1.1 O2 0.20
Ca(Cl)2 1.9
Proteiin 0.1
DNA 0.01
Rusikareegel
on, et хhus on difusioonikiirused ligikaudu 10000 korda
suuremad kui vees. Vahe tuleneb vдga vдikesest molekuli
vaba tee pikkusest vees vхrreldes gaasiga. Raskemad molekulid
difundeeruvad aeglasemalt, sest nende liikumise kiirused on
vдiksemad, kuna samal temperatuuril on energiad samad, suurema
massiga molekulid aga liiguvad aeglasemalt. Kui vхtame
difusioonikonstandiks 10-5 cm2 s-1
siis difundeerumiseks kulub jдrgmine aeg:
5 m
(raku organellid) 0.006 s = 6 ms
50m
(rakud) 0.6s
1
m (organism) 8 aastat
Nagu
nдeme, on organellis difusioonikiirus sedavхrd suur, et
molekul vхib umbes 200 korda sekundis lдbi organelli
difundeeruda. Terve raku mххtmes on see aga ainult paar
koda sekundis. Difusiooniline ainete transport organismi piires on
aga lootusetult aeglane. Seetхttu metaboliitide kaugtransport
toimubki peamiselt voolamise abil, nдrvierutus aga liigub
elektri-impulsside abil.
Soojusjuhtivus
Tahkes
kehas on eriti hдsti nдha, et soojendades keha ьhte
osa jхuab soojus varsti jaguneda ьhtlaselt ьle kogu
keha. Soojus nagu difundeeruks laiali. Sama toimub ka gaasides ja see
ongi kehade soojusjuhtivus. Kuna soojus on pхhimхtteliselt
molekulide kineetiline energia, siis selle ‘laialidifundeerumine’
tдhendab energia ьlekannet pхrgetel, kus kiiremini
liikuvad molekulid jagavad oma energia teiste molekulidega. Nii
kujuneb kehas lхpuks ьsna ьhtlane molekulide
kiiruste jaotus. Et soojusjuhtivuse mehhanism on difusioonile
sarnane, siis on ka vastavad valemid sarnased. Nдiteks soojuse
liikumine lдbi varda pikkusega l ja ristlхikepinnaga
S on
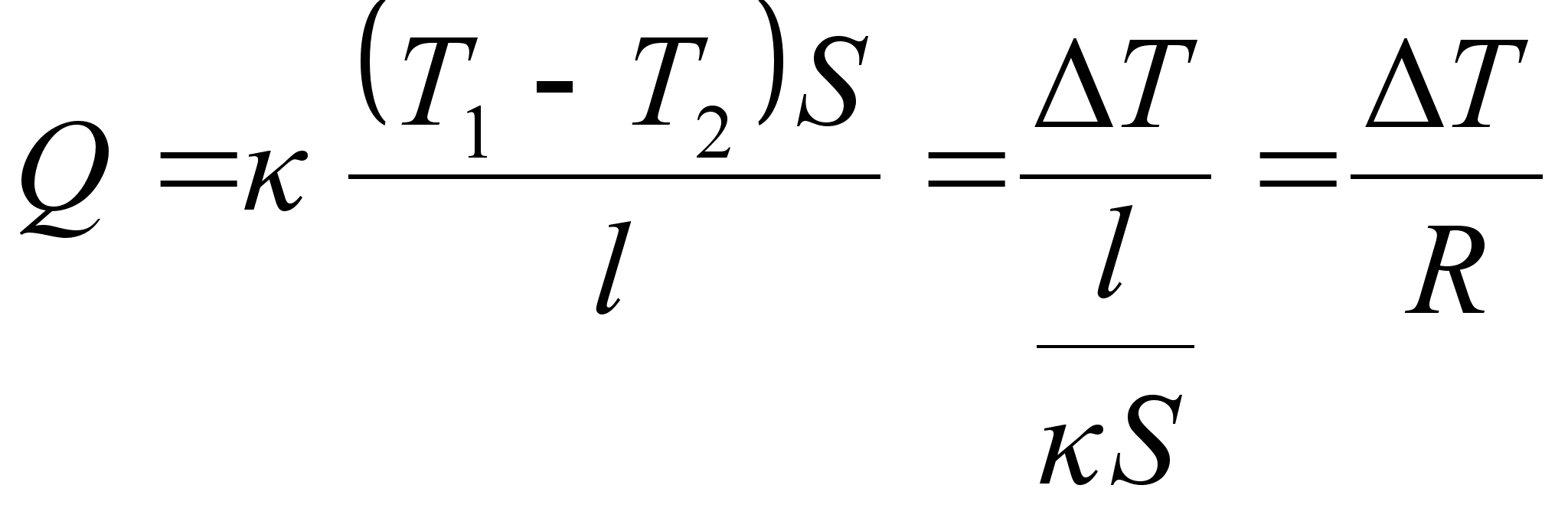
kus
kontsentratsioonide vahet asendab temperatuuride vahe ja
difusioonikonstanti soojusjuhtivuse konstant
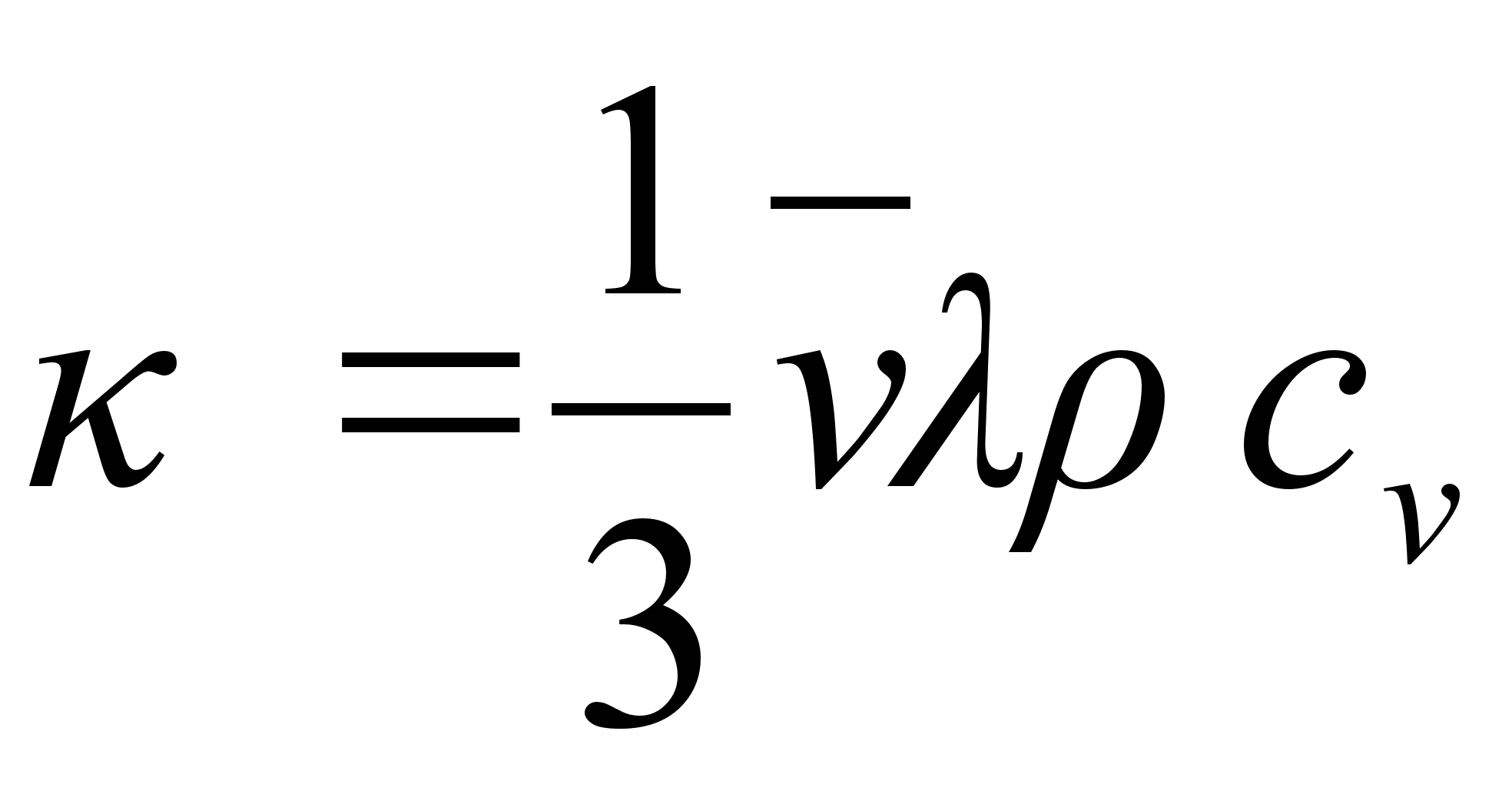
Soojusjuhtivuse
konstant on difusioonikonstant korrutatud erisoojusega, mis on
tihedus korda massiьhiku soojusmahtuvus
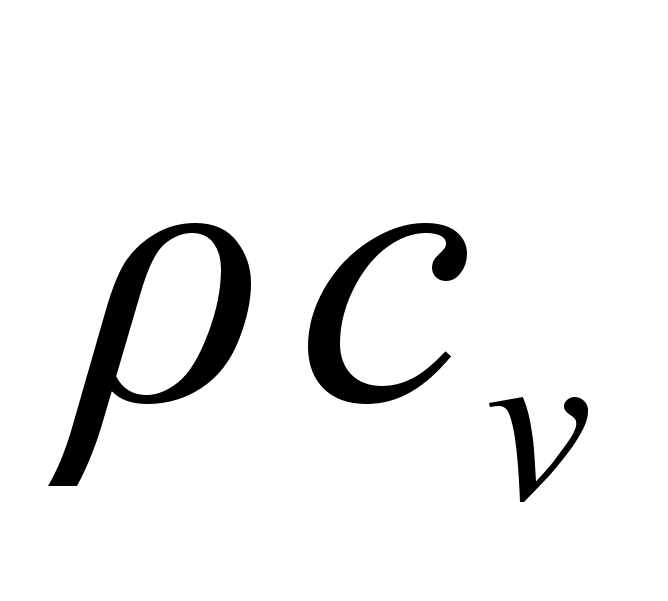 . .
Sisehххrdumine,
viskoossus
Voolamine
on molekulide samaaegne ьhesuunaline liikumine. Voolamine toimub
nдiteks torudes rхhkude vahe mхjul. Elusolendites
toimub voolamine veresoontes loomadel ja juhtsoontes (ksьleem,
floeem) taimedel. Voolamine on peamine viis molekulide
transportimiseks pikematel distantsidel kui ьhe raku piires.
Voolamine vхib olla laminaarne ja turbulentne. Laminaarse
voolamise puhul vedeliku vхi gaasikihid torus segunevad ainult
difusiooni tхttu, seega vдhe, ja kihid, mis alustasid
teekonda toru seinte lдhedal, on seal toru lхpuni.
Molekulid, mis alustasid teekonda toru keskosas jддvad
samuti sinna kuni lхpuni. Laminaarne voolamine on tavaline
peentes torudes, nagu kapillaarsooned ja taimede juhtsooned.
Tubulentsel voolamisel toimub pidev keeriseline liikumine toru sees,
selgeid kihte asendavad keerised, milles molekulid liiguvad kord
sente lдhehedale, kord jдlle kaugemale. Turbulentne
voolamine on tavaline jдmedates torudes. Vaadake nдiteks
korstnast vдljuvat suitsu, aga sarnane keeriselisus on ka vere
voolamisel jдmedamates veresoontes.
Ka voolamine allub sama tььpi proportsionaalsele seadusele
nagu difusioon ja soojusjuhtivus, ainult siin on liikumapanevaks
jхuks rхhkude vahe:
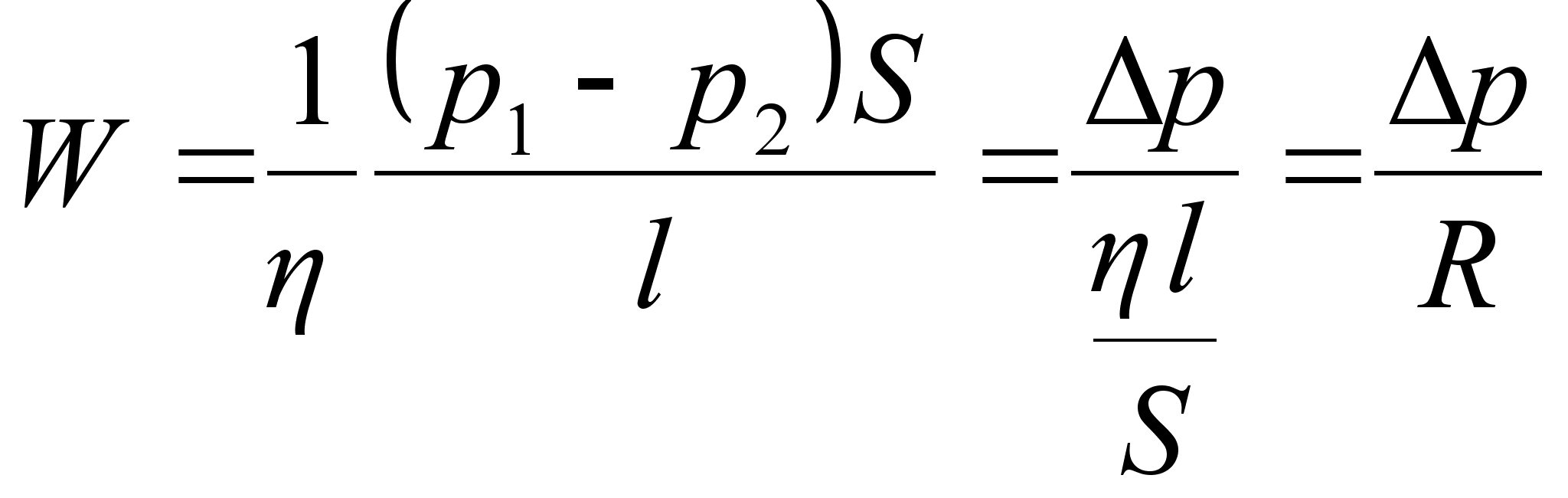
Pange
tдhele, et voolamise puhul on tavaks vхrdetegurit esitada
pццrdsuurusena, viskoossusena. Mida suurem on viskoossus ,
seda aeglasem on voolamine sama rхhkude vahe ja sama voolu
geomeetria puhul. Vedelike puhul on viskoossus pхhjustatud
peamiselt molekulidevahelistest sidemetest (tхmbejхududest).
Kuna need temperatuuri tхustes nхrgenevad (molekulid
liiguvad kiiremini ja kaugenevad ьksteisest, keha paisub), siis
vedelike viskoossus temperatuuri tхustes vдheneb,
voolamine kiireneb. Gaaside viskoossus pхhineb teisel alusel,
kuna nendes molekulidevahelised tхmbejхud ei ole
tдhtsad. Toru seinte lдhedal liikuvad molekulid pхrkuvad
sageli seintega ja nende edasiliikumine piki toru on takistatud.
Soojusliikumine aga pillutab molekule ka toru seintest eemale ja
vastupidi, eemal olevaid molekule seinte suunas. Nii jдavad
seinte poolt tulevad molekulid tsentri pool liikuvatele jalgu ja
pidurdavad neid, aga tsentrist seinte poole liikuvad molekulid
kiirendavad seinte lдhedal asuvate voolusuunalist likumist.
Kujuneb vдlja keskmine kiiruste profiil, mis on ruuthьperbooli
kujuga, kusjuures kхige kiiremini voolavad molekulid toru
keskel ja seinte дares on need peaaegu paigal (voolamise mхttes,
mitte termilise liikumise mхttes). Kuna gaaside puhul
viskoossus on tingitud molekulide difusioonist risti voolu suunaga,
on ka viskoossustegur seotud molekulide soojusliikumise keskmise
kiirusega ja vaba tee pikkusega:
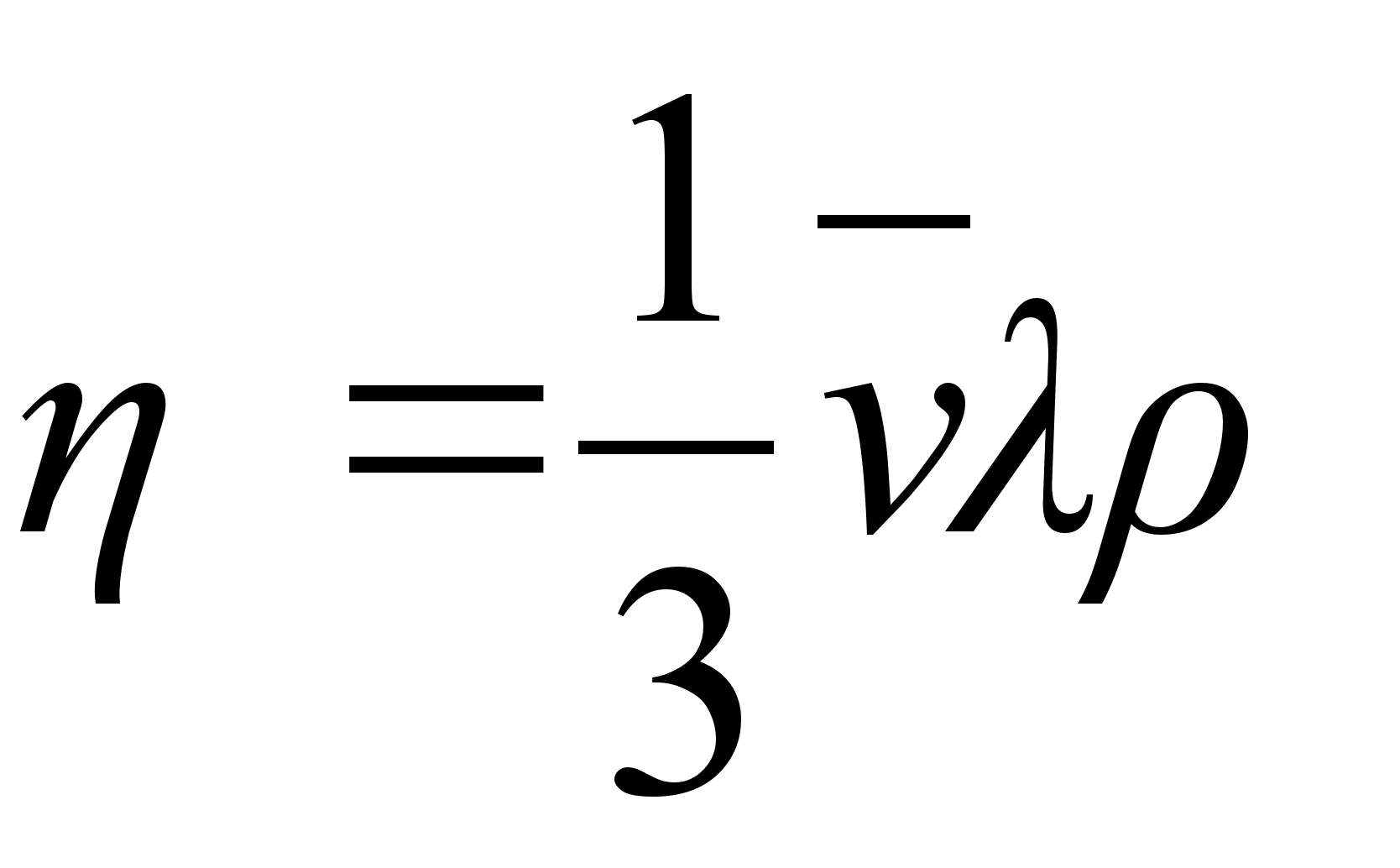 , ,
kus
on gaasi tihedus. Viskoossus ei sхltu gaasi rхhust,
kuna rхhu suurenedes tihedus kьll kasvab, kuid vaba tee
pikkus proportsionaalselt kahaneb. |