| Исследование сорбции тиоцианатных комплексов золота некоторыми анионитами
Д.О.Криницын, О.Н.Кононова, Н.В.Мазняк, А.Г.Холмогоров*
Синтезированы тиоцианатные комплексы золота (I) и исследовано извлечение их из водных растворов высоко- и низкоосновными анионитами АВ-17-8, АН-251 и АМ-2Б. Установлена высокая селективность к ионам тиоцианатных комплексов золота (I). Изучена скорость процесса ионного обмена.
Интерес к изучению сорбции золота из тиоцианатных растворов обусловлен перспективой замены используемого в промышленности цианида как реагента цианидного выщелачивания менее токсичным и более эффективным тиоцианатом [1, 2]. Тиоцианатные растворы золота являются сложными системами, в которых ионному состоянию золота в первую очередь отвечает равновесие Au(III) ↔ Au(I ) , зависящее от концентраций ионов золота и тиоцианат-ионов, pH системы, природы и количества окислителя в растворе [3]. Поэтому в таких растворах, как правило, одновременно в различных количественных отношениях сосуществуют ионы-комплексы [Au(SCN)4]- и [Au(SCN)2]-. Сорбция тиоцианатных комплексов золота (III) и (I) мало изучена и поэтому представляет большой интерес. В данной работе были синтезированы модельные водные растворы тиоцианатных комплексов Au (I), где равновесие Au(III ) ↔ Au(I ) сильно смещено вправо и золото находится в виде комплексного иона [Au(SCN)2]-.
Экспериментальная часть Сорбцию золота исследовали на сильноосновных анионитах стироловой структуры: гелевом АВ-17-8 и на макропористом АМ-2Б, а также на слабоосновном макропористом анионите винилпиридиновой структуры АН-251. Основные характеристики анионитов приведены в табл. 1. Модельные растворы тиоцианатных комплексов золота (I) готовили по методике, основанной на автовосстановлении золота (III) из хлоридного комплекса тиоцианат-ионами по реакции [5, 6]
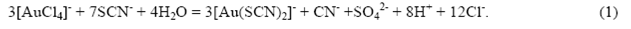
20, 0 мл стандартного раствора HAuCl4 с концентрацией 5 г/л разбавляли дистиллированной водой до объёма 800 мл и доводили pH раствора до значения 2 при помощи концентрированного раствора KOH. Затем медленно по каплям при интенсивном перемешивании добавляли 50, 0 мл 2М раствора KSCN, то есть в гается при малых значениях равновесной концентрации раствора (1 – 2 мг/л) и при значениях процента извлечения 98 - 99 %.
Реклама

Нами была исследована сорбция золота в условиях, когда соотношение статической обменной ёмкости навески анионита по хлорид-ионам к абсолютному содержанию золота в растворе, контактировавшем с этой навеской анионита, (N) было равным 2, 5; 5 и 10. Как видно из рис. 3, обменная ёмкость линейно возрастает с увеличением указанного отношения, то есть с увеличением значения числа N. Такая закономерность свидетельствует о том, что в пределах исследованных отношений селективность к исследуемым комплексам золота не изменяется. Этот факт может указывать также на то, что не изменяется и механизм сорбции.
Для оценки времени наступления равновесия нами было изучено изменение количества сорбированного анионитом золота от времени контакта анионита с раствором. На рис. 4 показаны графики соответствующих зависимостей. Следует отметить, что скорость ионного обмена сравнительно велика и уменьшается лишь с приближением к состоянию равновесия. Так, уже через 1 ч после начала сорбции количество сорбированного золота составляет 47 % для АН-251 и 67 и 65 % для АВ-17-8 и АМ-2Б, соответственно, от равновесного значения. Та же величина через 3 ч составляла 90 – 96 %. Время наступления равновесия для всех анионитов примерно 3 - 6 ч.
Таким образом, из полученных результатов можно заключить:
исследуемые аниониты проявляют высокую селективность к тиоцианатным комплексам золота (I),
извлекая до 98 – 99 % золота из раствора;
в условиях двух-, пяти- и десятикратного избытка ионита над количеством золота в контактирующем растворе селективность анионитов к тиоцианатным комплексам золота (I) не изменяется;
процесс сорбции протекает сравнительно быстро, и количество сорбированного золота уже за 3 ч сорбции близко к равновесному значению, составляя 90 – 96 % от него.
Список литературы
1. Ладейщиков В.В. Технология извлечения золота и серебра из упорных руд / В.В. Ладейщиков. Иркутск: Иргидридмед, 1999. - Том 1. – 340 с. Т. 2. - 452 с.
2. Холмогоров А.Г. Нецианидные растворители для извлечения золота из золотосодержащих продуктов / А.Г. Холмогоров, Г.Л. Пашков, О.Н. Кононова, Ю.С. Кононов, В.П. Плеханов // Химия в интересах устойчивого развития. – 2001. - №9. - С. 293-398.
3. Barbosa O. F. and Manhemius A. J. Thermochemistry of thiocyanate systems for leaching gold and silver ores // The Minerals, Metals and Materials Society. – 1988. – P. 307 – 339.
Реклама

4. Кононова О.Н. Применение хелатных и амфотерных ионитов в анализе и технологии редких элементов/ О.Н. Кононова. – Красноярск: КГУ, 1981. – 44с.
5. Белоносов В.А. Синтез и свойства комплекса золота (I) [(Phen)2H][Au(SCN)2] / В.А. Белоносов, А.К. Молодкин // Ж. неорган. химии. – 1996. – Т. 41, №7. - С. 1150-1151.
6. Bjerrum N., Kirshner A.// Chem. Abstr. 1919. V. 13. P. 1057.
7. Бусев А. И. Аналитическая химия золота / А.И. Бусев, В.М. Иванов. - М.: Наука, 1973. – 263 с.
8. Луковская Н.М. Изучение комплексообразования золота (III) с бромидом и роданидом по ингибированию хемилюминесценции / Н.М. Луковская, Т.А. Богословская // Ж. аналитич. химии. – 1974. - №4. - С. 674-681
|