| Федеральное агентство по образованию
ГОУ ВПО «Уральский государственный технический университет – УПИ»
А.М. Панфилов
Теория металлургических процессов
Учебное электронное текстовое издание
Подготовлено кафедрой «Теория металлургических процессов»
Научный редактор: проф., докт. хим. наук М.А. Спиридонов
Методические указания к лабораторным работам по дисциплинам «Физико-химия металлургических систем и процессов», «Теория металлургических процессов» для студентов всех форм обучения металлургических специальностей.
Регламентированы правила организации работ в практикуме «Теория металлургических процессов» кафедры ТМП (специализированная аудитория
Мт-431 им. О.А. Есина). Описаны методика и порядок выполнения лабораторных работ, приведены требования к содержанию и оформлению отчетов по лабораторным работам согласно действующим ГОСТам и рекомендации по их выполнению.
© ГОУ ВПО УГТУ-УПИ, 2008
Екатеринбург
2008
Содержание
Введение ...................................................................................................................................................... 4
1 Организация работ в лабораторном практикуме по теории металлургических процессов ............. 4
1.1 Подготовка к лабораторной работе ................................................................................................. 5 1.2 Рекомендации по обработке результатов измерений и оформлению отчета .............................. 5
1.3.1 Построение графиков .................................................................................................................. 5
1.3.2 Сглаживание экспериментальных данных ............................................................................... 7
1.3.5 Численное дифференцирование функции, заданной набором дискретных точек ................ 8
1.3.6 Определение методом наименьших квадратов коэффициентов полинома,
аппроксимирующего некоторый набор данных ................................................................................ 9
1.3.7 Представление результатов ...................................................................................................... 10
2 Описание лабораторных работ ............................................................................................................. 11
Реклама

2.1 Изучение кинетики высокотемпературного окисления железа (Работа № 13) ......................... 12
2.1.1 Общие закономерности окисления железа ............................................................................. 12 2.1.2 Описание установки и порядок проведения опытов ............................................................. 14
2.1.3 Обработка и представление результатов измерений ............................................................. 15
Контрольные вопросы ....................................................................................................................... 17
2.2 Изучение температурной зависимости удельной электропроводности оксидных расплавов
(Работа № 14) ......................................................................................................................................... 19
2.2.1 Общие сведения о природе электрической проводимости шлаков ...................................... 19
2.2.2 Описание установки и методики измерений .......................................................................... 21
2.2.3 Порядок выполнения работы ................................................................................................... 23
2.2.4 Обработка и представление результатов измерений ............................................................. 24
Контрольные вопросы ....................................................................................................................... 25
2.3 Исследование кинетики десульфурации металла шлаком на имитационной модели (Работа №
15) ............................................................................................................................................................ 26
2.3.1 Общие сведения о кинетике десульфурации металла шлаком ............................................. 26
2.3.2 Математическая модель процесса ........................................................................................... 29
2.3.3 Порядок проведения работы .................................................................................................... 30
2.3.4 Обработка и представление результатов измерений ............................................................. 31
Контрольные вопросы ....................................................................................................................... 32
2.4 Термографическое изучение процессов диссоциации природных карбонатов (Работа № 16) 33
Реклама

2.4.1 Общие закономерности диссоциации карбонатов ................................................................. 33
2.4.2 Схема установки и методика проведения работы .................................................................. 39
2.4.3 Обработка и представление результатов измерений ............................................................. 39
Контрольные вопросы ....................................................................................................................... 41
2.5 Изучение температурной зависимости вязкости оксидных расплавов (Работа № 17) ............. 42
2.5.1 Природа вязкого сопротивления оксидных расплавов .......................................................... 42
2.5.2 Описание установки и методика измерений вязкости........................................................... 43
2.5.3 Порядок проведения работы .................................................................................................... 45
2.5.4 Обработка и представление результатов измерений ............................................................. 45 Контрольные вопросы ....................................................................................................................... 46
2.6 Восстановление марганца из оксидного расплава в сталь (Работа № 18)
47
2.6.1 Общие закономерности электрохимического взаимодействия металла и шлака ............... 47
2.6.2 Модель процесса ....................................................................................................................... 49
2.6.3 Порядок проведения работы .................................................................................................... 50
Контрольные вопросы ....................................................................................................................... 52 Список литературы ................................................................................................................................... 53
Нормативные ссылки
В методических указаниях использованы ссылки на следующие стандарты:
| СТП УГТУ-УПИ 1-96
|
Стандарт предприятия. Общие требования и правила оформления дипломных и курсовых проектов (работ).
|
| ГОСТ Р 1.5-2002
|
ГСС. Стандарты. Общие требования к построению, изложению, оформлению, содержанию и обозначению.
|
| ГОСТ 2.105-95
|
ЕСКД. Общие требования к текстовым документам.
|
| ГОСТ 2.106-96
|
ЕСКД. Текстовые документы.
|
| ГОСТ 6.30 2003
|
УСД. Унифицированная система организационнораспорядительной документации. Требования к оформлению документов.
|
| ГОСТ 7.32-2001
|
СИБИД. Отчет о научно-исследовательской работе.
|
| ГОСТ 7.54-88
|
СИБИД. Представление численных данных о свойствах веществ и материалов в научно-технических документах.
Общие требования.
|
| ГОСТ 8.417-2002
|
ГСОЕИ. Единицы величин
|
Обозначения и сокращения
| ГОСТ
|
Государственный стандарт бывшего СССР или межгосударственный стандарт (в настоящее время).
|
| ГОСТ Р
|
Стандарт, принятый Государственным комитетом Российской Федерации по стандартизации и метрологии (Госстандарт России) или Государственным комитетом Российской Федерации по жилищной и строительной политике (Госстрой России).
|
| ГСС
|
Государственная система стандартизации.
|
| ГСОЕИ
|
Государственная система обеспечения единства измерений.
|
| ИТ
|
Информационные технологии
|
| МНК
|
Метод наименьших квадратов
|
| ПК, ПЭВМ
|
Персональный компьютер
|
| СТП
|
Стандарт предприятия
|
| ТМП
|
Теория металлургических процессов
|
Введение
Выполнение лабораторных работ по изучению свойств в системе металл-шлак и процессов, происходящих в металлургических агрегатах, позволяет лучше понять возможности физикохимического метода анализа и получить навыки его практического применения. Дополнительно студент знакомится с реализацией некоторых методов экспериментального и модельного исследования отдельных физико-химических свойств и металлургических процессов в целом, приобретает навыки обработки, анализа и представления экспериментальной информации.
1 Организация работ в лабораторном практикуме по теории металлургических процессов
В лабораторном практикуме по теории металлургических процессов основным является компьютерный сбор экспериментальной информации. Этим определяется ряд особенностей организации работы:
 Каждый студент получает индивидуальное задание, выполняет эксперимент целиком или указанную его часть и обрабатывает полученную информацию. Результат работы включает полученные числовые характеристики изучаемого явления и погрешности их определения, графики, иллюстрирующие выявленные особенности, и выводы, полученные по всей совокупности информации. Расхождение количественных результатов работы, приводимых в студенческих отчетах, по сравнению с контрольными оценками не должно превышать 5 %. Каждый студент получает индивидуальное задание, выполняет эксперимент целиком или указанную его часть и обрабатывает полученную информацию. Результат работы включает полученные числовые характеристики изучаемого явления и погрешности их определения, графики, иллюстрирующие выявленные особенности, и выводы, полученные по всей совокупности информации. Расхождение количественных результатов работы, приводимых в студенческих отчетах, по сравнению с контрольными оценками не должно превышать 5 %.
 Основным вариантом оформления результатов является обработка экспериментальных данных, построение графиков и формулирование выводов в электронных таблицах Microsoft.Excel или OpenOffice.Calc. Основным вариантом оформления результатов является обработка экспериментальных данных, построение графиков и формулирование выводов в электронных таблицах Microsoft.Excel или OpenOffice.Calc.
 По разрешению преподавателя временно допускается представление рукописного отчета с необходимыми иллюстрациями и с графиками, выполненными на миллиметровой бумаге. По разрешению преподавателя временно допускается представление рукописного отчета с необходимыми иллюстрациями и с графиками, выполненными на миллиметровой бумаге.
 Отчет по выполненной лабораторной работе передается преподавателю, ведущему лабораторный практикум, не позже, чем в рабочий день, предшествующий очередной лабораторной работе. Порядок передачи (по электронной почте, в перерыв любому преподавателю или лаборанту, ведущим в данный момент занятия) определяет преподаватель. Отчет по выполненной лабораторной работе передается преподавателю, ведущему лабораторный практикум, не позже, чем в рабочий день, предшествующий очередной лабораторной работе. Порядок передачи (по электронной почте, в перерыв любому преподавателю или лаборанту, ведущим в данный момент занятия) определяет преподаватель.
 К очередной лабораторной работе не допускаются студенты, не представившие вовремя отчет по предыдущим работам и не прошедшие коллоквиум (тестирование). К очередной лабораторной работе не допускаются студенты, не представившие вовремя отчет по предыдущим работам и не прошедшие коллоквиум (тестирование).
К выполнению лабораторных работ допускаются только студенты, прошедшие вводный инструктаж по мерам безопасной работы в лабораторном практикуме и расписавшиеся в листке по учету инструктажа.
Работа с нагревательными и измерительными электрическими приборами, с химической посудой и реактивами проводится согласно инструкции по технике безопасности в лаборатории.
После выполнения работы студент приводит в порядок рабочее место и сдает его лаборанту.
1.1 Подготовка к лабораторной работе
Основными источниками при подготовке к занятию является настоящее руководство, учебники и учебные пособия, рекомендованные лектором, конспекты лекций.
Готовясь к лабораторной работе, студент в течение недели, предшествующей занятию, должен прочитать и понять материал, относящийся к изучаемому явлению, разобраться по приведенным в руководстве схемам в конструкции установки и методике измерений и обработке их результатов. При возникновении затруднений необходимо использовать рекомендованную литературу и консультации лектора и преподавателей, ведущих лабораторные занятия.
Готовность студента к выполнению работы контролируется преподавателем путем индивидуального опроса каждого студента, либо проведения компьютерного тестирования. Недостаточно подготовленный студент обязан изучить материал, относящийся к данной работе, в течение занятия, а экспериментальную часть работы выполнить на дополнительном занятии после повторной проверки. Время и порядок проведения повторных занятий регламентируется специальным расписанием.
1.2 Рекомендации по обработке результатов измерений и оформлению отчета
Согласно ГОСТ 7.54-88 экспериментальные численные данные должны быть представлены в виде озаглавленных таблиц. Образцы таблиц предлагаются для каждой лабораторной работы.
При обработке результатов измерений необходимо использовать статистическую обработку: применять сглаживание экспериментальных данных, использовать метод наименьших квадратов при оценке параметров зависимостей и т.п. и обязательно оценивать погрешность полученных значений. Для выполнения такой обработки в электронных таблицах предусмотрены специальные статистические функции. Необходимый набор функций имеется и в калькуляторах, предназначенных для научных (инженерных) расчетов.
1.3.1 Построение графиков
При выполнении экспериментов, как правило, одновременно фиксируют значения нескольких параметров. Анализируя их взаимосвязь, можно сделать заключения о наблюдаемом явлении. Визуальное представление числовых данных чрезвычайно облегчает анализ их взаимосвязи – вот почему построение графиков такой важный этап работы с информацией. Отметим, что среди фиксируемых параметров всегда есть, по крайней мере, одна независимая переменная – величина, значение которой меняется само по себе (время) или которое задает экспериментатор. Остальные параметры определяются значениями независимых переменных. При построении графиков следует руководствоваться некоторыми правилами:
 Значение независимой переменной откладывают по оси абсцисс (горизонтальная ось), а значение функции откладывают по оси ординат (вертикальная ось). Значение независимой переменной откладывают по оси абсцисс (горизонтальная ось), а значение функции откладывают по оси ординат (вертикальная ось).
 Масштабы по осям следует выбирать так, чтобы использовать площадь графика максимально информативно – чтобы было меньше пустых областей, на которых отсутствуют экспериментальные точки и линии функциональных зависимостей. Для выполнения этого требования часто в начале оси координат приходится указывать ненулевое значение. При этом на графике обязательно должны быть представлены все экспериментальные результаты. Масштабы по осям следует выбирать так, чтобы использовать площадь графика максимально информативно – чтобы было меньше пустых областей, на которых отсутствуют экспериментальные точки и линии функциональных зависимостей. Для выполнения этого требования часто в начале оси координат приходится указывать ненулевое значение. При этом на графике обязательно должны быть представлены все экспериментальные результаты.
 Значения по осям должны быть, как правило, кратными некоторому целому числу (1, 2, 4, 5) и располагаться равномерно. Категорически недопустимо указывать на осях результаты конкретных измерений. Выбранные масштабные единицы не должны быть слишком маленькими или слишком большими (не должны содержать несколько ведущих или завершающих нулей). Чтобы обеспечить это требование, следует использовать масштабный множитель вида 10Х
, который выносят в обозначение оси. Значения по осям должны быть, как правило, кратными некоторому целому числу (1, 2, 4, 5) и располагаться равномерно. Категорически недопустимо указывать на осях результаты конкретных измерений. Выбранные масштабные единицы не должны быть слишком маленькими или слишком большими (не должны содержать несколько ведущих или завершающих нулей). Чтобы обеспечить это требование, следует использовать масштабный множитель вида 10Х
, который выносят в обозначение оси.
 Линия функциональной зависимости должна быть или прямой, или плавной кривой. Соединять экспериментальные точки ломаной линией допустимо лишь на этапе предварительного анализа. Линия функциональной зависимости должна быть или прямой, или плавной кривой. Соединять экспериментальные точки ломаной линией допустимо лишь на этапе предварительного анализа.
При построении графиков средствами электронных таблиц соблюдение многих из этих требований будет обеспечено автоматически, но обычно не всех и не в полной мере, поэтому практически всегда приходится корректировать полученное представление.
 В электронных таблицах имеется специальный сервис – Мастер Диаграмм (Главное меню: Вставка Диаграмма). Простейший вариант обращения к нему – предварительно выделить область ячеек, включающую и аргумент и функцию (несколько функций), и активизировать мышью кнопку «Мастер Диаграмм» на стандартной панели. В электронных таблицах имеется специальный сервис – Мастер Диаграмм (Главное меню: Вставка Диаграмма). Простейший вариант обращения к нему – предварительно выделить область ячеек, включающую и аргумент и функцию (несколько функций), и активизировать мышью кнопку «Мастер Диаграмм» на стандартной панели.
Таким образом вы получите заготовку графика, с которой еще надо поработать, поскольку автоматический выбор многих параметров графика, принятых по умолчанию, скорее всего, не позволит обеспечить выполнение всех требований.
Прежде всего, проверьте размер цифр на осях и букв в обозначениях осей и подписях функций в легенде. Желательно, чтобы размер шрифта везде был одинаковым, не менее 10 и не более 14 пунктов, но устанавливать значение придется для каждой надписи отдельно. Для этого следует навести курсор на интересующий объект (ось, подпись, легенду) и нажать правую кнопку мыши. В появившемся контекстном меню выбрать «Формат (элемента)» и в новом меню на листочке с ярлыком «Шрифт» выбрать нужное значение. При форматировании оси следует дополнительно посмотреть и, возможно, изменить значения на листочках с ярлыками «Шкала» и «Число». Если вы не понимаете, к каким изменениям приведет предлагаемый выбор – не бойтесь попробовать какой-либо вариант, ведь вы всегда можете отказаться от внесенных изменений, нажав клавиши Ctrl + Z, или выбрав пункт Главного меню «Правка» – Отменить, или нажав на кнопку «Отменить» на стандартной панели инструментов.
Если точек достаточно много, а разброс невелик и линия выглядит достаточно плавной, то точки можно соединить линиями. Для этого наведите курсор на какую-либо точку на графике и нажмите правую клавишу мыши. В появившемся контекстном меню выберите пункт «Формат рядов данных». В новом окне на листочке с ярлыком «Вид» следует выбрать подходящие цвет и толщину линии, а заодно проверить цвет, размер и форму точек. Именно таким образом строят зависимости, аппроксимирующие экспериментальные данные. Если аппроксимация происходит прямой линией, то достаточно двух точек по краям диапазона изменения аргумента. Использовать встроенную в электронные таблицы опцию «сглаженная кривая» не рекомендуется из-за отсутствия возможности корректировать параметры сглаживания.
1.3.2 Сглаживание экспериментальных данных
Для экспериментальных данных, полученных на высокотемпературных экспериментальных установках, характерна большая величина случайной погрешности измерений. Это определяется, главным образом, электромагнитными помехами от работы мощного нагревательного устройства. Существенно уменьшить случайную погрешность позволяет статистическая обработка результатов. Известно, что для случайной величины, распределенной по нормальному закону, погрешность среднего арифметического, определенного из N
значений, в N
½
раз меньше погрешности единичного измерения. При большом количестве измерений, когда допустимо считать, что случайный разброс данных на небольшом отрезке существенно превышает закономерное изменение величины, эффективным приемом сглаживания является присваивание очередному значению измеряемой величины среднего арифметического, вычисленного по нескольким значениям в симметричном интервале вокруг нее. Математически это передается формулой:
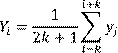 (1.1) (1.1)
и очень легко реализуется в электронных таблицах. Здесь y
i
– результат измерения, а Y
i
– используемое вместо него сглаженное значение.
Для экспериментальных данных, полученных с помощью цифровых систем сбора информации, характерна случайная погрешность, распределение которой существенно отличается от нормального закона. В этом случае более эффективным может быть использование медианы вместо среднего арифметического. При этом измеряемой величине в средине интервала присваивается значение той измеренной величины, которая оказалась наиболее близка к среднему арифметическому. Казалось бы небольшая разница в алгоритме может очень существенно изменить результат. Например, в варианте медианной оценки некоторые экспериментальные результаты могут оказаться вообще неиспользуемыми, скорее всего именно те, которые действительно являются
«выскакивающими» значениями с особенно большой погрешностью.
1.3.5 Численное дифференцирование функции, заданной набором дискретных точек
Необходимость в такой операции при обработке экспериментальных точек возникает достаточно часто. Например, дифференцированием зависимости концентрации от времени находят зависимость скорости процесса от времени и от концентрации реагента, что, в свою очередь, позволяет оценить порядок реакции. Операция численного дифференцирования функции, заданной набором ее значений (y
), отвечающих соответствующему набору значений аргумента (x
), основана на приближенной замене дифференциала функции отношением ее конечного изменения к конечному изменению аргумента:
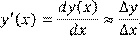 (1.2) (1.2)
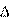 Численное дифференцирование чувствительно к ошибкам, вызванным неточностью исходных данных, отбрасывания членов ряда и т.п., и поэтому должно выполняться с осторожностью. Для повышения точности оценки производной ( Численное дифференцирование чувствительно к ошибкам, вызванным неточностью исходных данных, отбрасывания членов ряда и т.п., и поэтому должно выполняться с осторожностью. Для повышения точности оценки производной (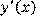 ) стараются сначала сгладить опытные данные, хотя бы на небольшом отрезке, а уже потом выполнить дифференцирование. В результате, в простейшем случае для равноотстоящих узлов (значения аргумента отличаются друг от друга на одинаковую величину x) получаются следующие формулы: для производной в первой (х
1) точке: ) стараются сначала сгладить опытные данные, хотя бы на небольшом отрезке, а уже потом выполнить дифференцирование. В результате, в простейшем случае для равноотстоящих узлов (значения аргумента отличаются друг от друга на одинаковую величину x) получаются следующие формулы: для производной в первой (х
1) точке:
(1.3)
 для производной во всех остальных точках (x
), кроме последней: для производной во всех остальных точках (x
), кроме последней:
(1.4)
для производной в последней (x
) точке:
(1.5)
Если экспериментальных данных достаточно много и допустимо пренебречь несколькими крайними точками, можно использовать формулы более сильного сглаживания, например, по 5-и точкам:
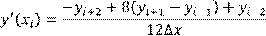 (1.6) (1.6)
или по 7-и точкам:
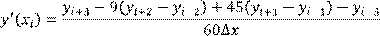 (1.7) (1.7)
Для неравномерного расположения узлов ограничимся тем, что порекомендуем воспользоваться модифицированной формулой (1.3) в виде
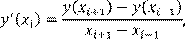 (1.8) (1.8)
а в начальной и конечной точках производную не вычислять.
Таким образом, для реализации численного дифференцирования нужно в ячейках свободного столбца разместить подходящие формулы. Например, неравноотстоящие значения аргумента размещены в столбце «А» в ячейках со 2-й по 25-ю, а значения функции – в столбце «В» в соответствующих ячейках. Значения производной предполагается разместить в столбце «С». Тогда в ячейку «С3» следует ввести формулу (5) в виде:
= (В4 – В2)/(А4 – А2)
и скопировать (растянуть) во все ячейки в диапазоне С4:С24.
1.3.6 Определение методом наименьших квадратов коэффициентов полинома,
аппроксимирующего некоторый набор данных
При графическом представлении числовой информации часто возникает потребность провести по экспериментальным точкам линию, выявляющую особенности полученной зависимости. Это делается для лучшего восприятия информации и облегчения дальнейшего анализа данных, имеющих некоторый разброс за счет погрешности измерений. Часто на основании теоретического анализа исследуемого явления заранее известно, какой вид должна иметь эта линия. Например, известно, что зависимость скорости химического процесса (v
) от температуры должна быть экспоненциальной, причем в показателе экспоненты представлена обратная температура в абсолютной шкале:
(1.9)
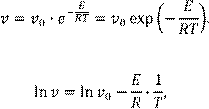 Это означает, что на графике в координатах lnv
– 1/T должна получиться прямая линия, Это означает, что на графике в координатах lnv
– 1/T должна получиться прямая линия,
(1.10)
угловой коэффициент которой характеризует энергию активации (Е
) процесса. Через экспериментальные точки, как правило, можно провести несколько прямых, имеющих разный угловой коэффициент. В определенном смысле наилучшей из них будет прямая с коэффициентами, определенными методом наименьших квадратов.
В общем случае методом наименьших квадратов находят коэффициенты аппроксимирующего зависимость y
(x
1
, x
2
,…xn
) полинома вида
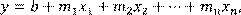 (1.11) (1.11)
где b
и m
1
…mn
– постоянные коэффициенты, а x
1
…xn
– набор независимых аргументов. То есть в общем случае метод применяется для аппроксимации функции нескольких переменных, но он применим и для описания сложной функции одной переменной x
. В этом случае обычно считают, что
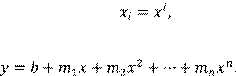 а аппроксимирующий полином имеет вид а аппроксимирующий полином имеет вид
(1.12)
При выборе степени аппроксимирующего полинома n
имейте в виду, что она обязательно должна быть меньше количества измеренных значений x
и y
. Практически во всех случаях она должна быть не больше 4-х, редко 5-и.
Этот метод настолько важен, что в электронных таблицах Excel есть, по крайней мере, четыре варианта получения значений искомых коэффициентов. Рекомендуем использовать функцию ЛИНЕЙН(), если Вы работаете в электронных таблицах Excel в составе Microsoft Office, или функцию LINEST() в электронных таблицах Calc в составе OpenOffice. Они представлены в списке статистических функций, относятся к классу, так называемых, матричных функций и имеют в связи с этим ряд особенностей применения. Во-первых, она вводится не в одну ячейку, а сразу в диапазон (прямоугольную область) ячеек, поскольку функция возвращает несколько значений. Размер области по горизонтали определяется количеством коэффициентов аппроксимирующего полинома (в рассматриваемом примере их два: lnv
0
и E/R), а по вертикали может быть выделено от одной до пяти строк в зависимости от того, какой объем статистической информации необходим для вашего анализа.
1.3.7 Представление результатов
В научно-техническом документе при представлении численных данных должна быть приведена оценка их достоверности и выделены случайная и систематическая погрешности. Приведенные погрешности данных должны быть представлены в соответствии с ГОСТ 8.207–76.
При статистической обработке группы результатов наблюдений следует выполнить следующие операции:  исключить известные систематические погрешности из результатов наблюдений; исключить известные систематические погрешности из результатов наблюдений;
 вычислить среднее арифметическое исправленных результатов наблюдений, принимаемое за результат измерений; вычислить среднее арифметическое исправленных результатов наблюдений, принимаемое за результат измерений;  вычислить оценку среднего квадратичного отклонения результата измерения; вычислить оценку среднего квадратичного отклонения результата измерения;
 вычислить доверительные границы случайной погрешности (случайной составляющей погрешности) результата измерения; вычислить доверительные границы случайной погрешности (случайной составляющей погрешности) результата измерения;
 вычислить границы неисключенной систематической погрешности (неисключенных остатков систематической погрешности) результата измерения; вычислить границы неисключенной систематической погрешности (неисключенных остатков систематической погрешности) результата измерения;  вычислить доверительные границы погрешности результата измерения. вычислить доверительные границы погрешности результата измерения.
Для определения доверительных границ погрешности результата измерения доверительную вероятность Р
принимают равной 0,95. При симметричной доверительной погрешности результаты измерений представляют в форме:
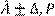
где 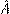 – результат измерения, ∆ – граница погрешности результата измерения, Р
– доверительная вероятность. Числовое значение результата измерения должно оканчиваться цифрой того же разряда, что и значение погрешности ∆. – результат измерения, ∆ – граница погрешности результата измерения, Р
– доверительная вероятность. Числовое значение результата измерения должно оканчиваться цифрой того же разряда, что и значение погрешности ∆.
2 Описание лабораторных работ
В первой части каждого из разделов, посвященных конкретным лабораторным работам, приводятся сведения о составе и строении фаз, механизме процессов, протекающих внутри фазы или на границах ее раздела с соседними фазами, минимально необходимые для понимания существа изучаемого в работе явления. Если приведенной информации оказывается недостаточно, следует обращаться к конспекту лекций и к рекомендуемой литературе. Без понимания первой части раздела невозможно представить, что происходит в изучаемой системе по ходу выполнения работы, сформулировать и осмыслить выводы по полученным результатам.
Следующая часть каждого раздела посвящена аппаратной, либо программной реализации реальной установки, либо компьютерной модели. Здесь приводятся сведения об используемом оборудовании и применяемых алгоритмах. Без понимания этого раздела невозможно оценить источники погрешностей и какие действия следует предпринимать для минимизации их влияния.
В последней части описывается порядок выполнения измерений и обработки их результатов. Все эти вопросы выносятся на коллоквиум, предшествующий работе, или компьютерное тестирование.
2.1 Изучение кинетики высокотемпературного окисления железа (Работа № 13)
2.1.1 Общие закономерности окисления железа
Согласно принципу последовательности превращений А.А. Байкова на поверхности железа при его высокотемпературном окислении кислородом воздуха образуются все термодинамически устойчивые в данных условиях оксиды. При температуре выше 572°С окалина состоит из трех слоев: вюстита FeО, магнетита Fe3
О4
, гематита Fe2
О3
, Ближайший к железу слой вюстит, составляющий приблизительно 95% от толщины всей окалины, обладает р-полупроводниковыми свойствами. Это означает, что в катионной подрешетке FeO имеется значительная концентрация вакансий двухвалентного железа, а электронейтральность обеспечивается за счет появления электронных «дырок», которыми являются частицы трехвалентного железа. Анионная подрешетка вюстита, состоящая из отрицательно заряженных ионов О2–
, практически бездефектна, наличие вакансий в катионной подрешетке существенно увеличивает диффузионную подвижность частиц Fe2+
через вюстит и снижает его защитные свойства.
Промежуточный слой магнетит – оксид стехиометрического состава, имеющий небольшую концентрацию дефектов в кристаллической решетке и обладающий вследствие этого повышенными защитными свойствами. Относительная толщина его составляет в среднем 4 %.
Внешний слой окалины – гематит обладает проводимостью n-типа. Наличие кислородных вакансий в анионной подрешетке облегчает диффузию через него частиц кислорода, по сравнению с катионами железа. Относительная толщина слоя Fe2
О3
не превышает 1%.
При температурах ниже 572°С вюстит термодинамически неустойчив, поэтому окалина состоит из двух слоев: магнетита Fe3
О4
(90 % толщины) и гематита Fe2
О3
(10 %).
Образование сплошной защитной пленки из окалины на поверхности железа приводит к отделению его от атмосферы воздуха. Дальнейшее окисление металла осуществляется за счет диффузии реагентов через оксидную пленку. Рассматриваемый гетерогенный процесс складывается из следующих стадий: подвод кислорода из объема газовой фазы к границе с оксидом путем молекулярной или конвективной диффузии; адсорбция О2 на поверхности оксида; ионизация атомов кислорода с образованием анионов О2–
; диффузия анионов кислорода в оксидной фазе к границе с металлом; ионизация атомов железа и переход их в окалину в виде катионов; диффузия катионов железа в оксиде к границе с газом; кристаллохимический акт образования новых порций оксидной фазы.
Диффузионный режим окисления металла реализуется в том случае, если наиболее заторможенной стадией является транспорт частиц Fe2+
или O2–
через окалину. Подвод молекулярного кислорода из газовой фазы осуществляется сравнительно быстро. В случае кинетического режима лимитирующими являются этапы адсорбции или ионизации частиц, а также акт кристаллохимического превращения.
Вывод кинетического уравнения процесса окисления железа для случая трехслойной окалины достаточно громоздкий. Его можно существенно упростить, не изменив при этом окончательных выводов, если считать окалину однородной по составу и учитывать диффузию через нее только катионов Fe2+
.
Обозначим через D
коэффициент диффузии частиц Fe2+
в окалине, k
– константу скорости окисления железа, C
1
и С
2 равновесные концентрации катионов железа на границе с металлом и воздухом соответственно, h
– толщину оксидной пленки, S
– площадь поверхности образца, 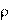 – плотность оксида, М
– его молярную массу. Тогда, в соответствии с законами формальной кинетики, удельная скорость химического акта взаимодействия железа с кислородом на единице поверхности образца (vr
) определяется соотношением: – плотность оксида, М
– его молярную массу. Тогда, в соответствии с законами формальной кинетики, удельная скорость химического акта взаимодействия железа с кислородом на единице поверхности образца (vr
) определяется соотношением:
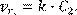 (13.1) (13.1)
В стационарном состоянии она равна плотности диффузионного потока частиц Fe2+
.
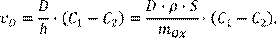 (13.2) (13.2)
Учитывая, что общая скорость гетерогенного процесса окисления пропорциональна скорости роста его массы
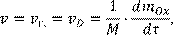 (13.3) (13.3)
можно исключить C
2
из уравнений (13.1) и (13.2) и получить зависимость массы окалины от времени:
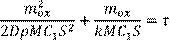 (13.4) (13.4)
Из последнего соотношения видно, что кинетический режим процесса реализуется, как правило, в начальный момент окисления, когда толщина оксидной пленки невелика и ее диффузионным сопротивлением можно пренебречь. Рост слоя окалины замедляет диффузию реагентов, и режим процесса с течением времени меняется на диффузионный.
Более строгий подход, развитый Вагнером в ионно-электронной теории высокотемпературного окисления металлов, позволяет количественно рассчитать постоянную скорости параболического закона роста пленок, используя данные независимых экспериментов по электропроводности оксидов:
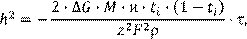 (13.5) (13.5)
где ∆G
– изменение энергии Гиббса для реакции окисления металла, М
– молярная масса оксида, 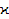 – его удельная электропроводность, ti
– доля ионной проводимости, z
– валентность металла, F
– постоянная Фарадея. – его удельная электропроводность, ti
– доля ионной проводимости, z
– валентность металла, F
– постоянная Фарадея.
При изучении кинетики образования очень тонких (h
< 5·10–9
м) пленок необходимо учитывать также скорость переноса электронов через слой оксида путем туннельного эффекта (теория Хауффе и Ильшнера) и ионов металла под действием электрического поля (теория Мотта и Кабреры). В этом случае окисление металлов сопровождается большим самоторможением во времени при замедленности стадии переноса электронов, чему соответствует логарифмический закон роста пленок h
= K
·ln(a
τ+B
), а также кубический h
3
= K
·τ (оксиды – полупроводники p
-типа) либо обратный логарифмический 1/h
= C
K
·ln(τ) (n-
тип проводимости) при замедленности стадии переноса ионов металла.
2.1.2 Описание установки и порядок проведения опытов
Кинетику окисления железа изучают с помощью гравиметрического метода, позволяющего фиксировать изменение массы образца со временем в течение опыта. Схема установки приведена на рисунке 1.
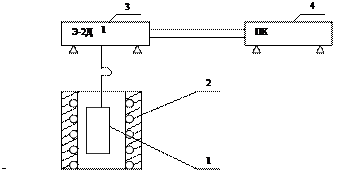
Рисунок 1 – Схема экспериментальной установки:
1 – исследуемый железный образец; 2 – печь электрического сопротивления; 3 – механоэлектрический преобразователь Э 2Д1; 4 – персональный компьютер с платой АЦП.
Образец металла (1), подвешенный на нихромовой цепочке к коромыслу механоэлектричеекого преобразователя Э 2Д1 (3), помещен в вертикальную трубчатую печь электрического сопротивления (2). Выходной сигнал Э 2Д1, пропорциональный изменению массы образца, подается на плату АЦП компьютера в составе установки. Постоянство температуры в печи поддерживается автоматическим регулятором, необходимая температура опыта устанавливается соответствующим задатчиком на приборной панели печи по указанию преподавателя (800 – 900 °С).
По результатам работы определяют константу скорости реакции окисления железа и коэффициент диффузии его ионов в оксидной пленке и, по возможности, энергии активации химической реакции и диффузии. Графически иллюстрируют зависимость изменения массы образца и скорости процесса окисления от времени.
2.1.3 Обработка и представление результатов измерений
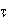 Механоэлектрический преобразователь устроен таким образом, что часть массы объекта измерения компенсируется спиральной пружиной. Величина ее неизвестна, но она должна оставаться постоянной во время измерений. Как следует из описания методики измерений точный момент времени (0
) начала процесса окисления не известен, поскольку неизвестно, когда образец приобретет температуру, достаточную для развития процесса окисления. До того момента времени, когда образец действительно начнет окисляться, его масса равна массе исходного металла (m
0
). То, что мы измеряем не всю массу, а только ее нескомпенсированную часть, существа дела не меняет. Разница между текущей массой образца (m
) и исходной массой металла представляет массу окалины, поэтому формулу (13.4) для реальных условий эксперимента следует представить в виде: Механоэлектрический преобразователь устроен таким образом, что часть массы объекта измерения компенсируется спиральной пружиной. Величина ее неизвестна, но она должна оставаться постоянной во время измерений. Как следует из описания методики измерений точный момент времени (0
) начала процесса окисления не известен, поскольку неизвестно, когда образец приобретет температуру, достаточную для развития процесса окисления. До того момента времени, когда образец действительно начнет окисляться, его масса равна массе исходного металла (m
0
). То, что мы измеряем не всю массу, а только ее нескомпенсированную часть, существа дела не меняет. Разница между текущей массой образца (m
) и исходной массой металла представляет массу окалины, поэтому формулу (13.4) для реальных условий эксперимента следует представить в виде:
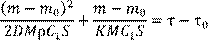 (13.6) (13.6)
в котором m
– измеренное значение оставшейся нескомпенсированной части массы образца, m0
– то же до начала процесса окисления при низкой температуре образца. Из этого соотношения видно, что опытная зависимость массы образца от времени должна описываться уравнением вида:
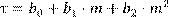 ,
(13.7) ,
(13.7)
коэффициенты которого по полученным результатам измерений могут быть найдены методом наименьших квадратов. Сказанное иллюстрирует типичный график на рис . Точки – результаты измерений, линия получена аппроксимацией данных уравнением 13.7
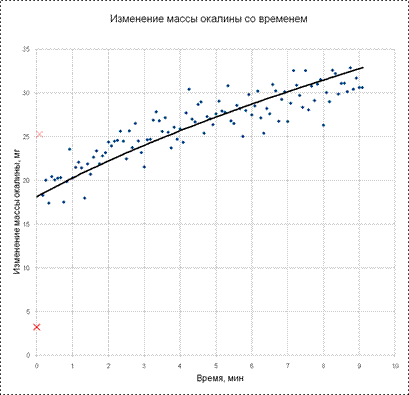
Точки, помеченные крестиками являются выскакивающими значениями и их не следует учитывать при вычислении коэффициентов уравнения 13.7 методом наименьших квадратов.
Сравнивая формулы (13.6) и (13.7) легко связать найденные коэффициенты с определяющими их физико-химическими величинами:
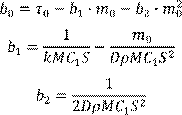 (13.8) (13.8)
(13.9)
(13.10)
 В приведенном примере значение m0 – значение на оси ординат при = 0, оказалось равно 18,1 мг. В приведенном примере значение m0 – значение на оси ординат при = 0, оказалось равно 18,1 мг.
 С использованием этих значений, полученного при подготовке к опыту значения площади образца (S
) и заимствованной из литературных данных плотности вюстита ( = 5,7 г/см3
) можно С использованием этих значений, полученного при подготовке к опыту значения площади образца (S
) и заимствованной из литературных данных плотности вюстита ( = 5,7 г/см3
) можно
оценить и соотношение коэффициента диффузии и константы скорости процесса окисления:
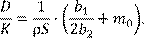 (13.13) (13.13)
Это отношение характеризует толщину пленки окалины, при которой константа скорости диффузии равна константе скорости химической реакции окисления металла, что отвечает определению строго смешанного режима реакции.
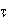 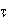 По результатам работы следует определить все значения с использованием формул (13.7, 13.11 – 13.13): b
0
, b
1
, b
2
, m
0
, 0
и D
/K
. Для иллюстрации результатов следует привести график зависимости m
– . Наряду с опытными значениями желательно привести и аппроксимирующую кривую. По результатам работы следует определить все значения с использованием формул (13.7, 13.11 – 13.13): b
0
, b
1
, b
2
, m
0
, 0
и D
/K
. Для иллюстрации результатов следует привести график зависимости m
– . Наряду с опытными значениями желательно привести и аппроксимирующую кривую.
По результатам измерений необходимо заполнить следующую таблицу:
Таблица 1. Результаты исследования процесса окисления железа.
|  , мин , мин
|
m
, мг
(исходн.)
|
m
, мг
(сглаж.)
|
m
2
, мг2
(сглаж.)
|
m
, мг
(апрокс.)
|
В таблице первые два столбца оказываются заполненными после открытия файла данных, а остальные являются вычисляемыми. Сглаживание выполняется по 5-ти точкам. При определении коэффициентов аппроксимирующего полинома одновременно используются первый, третий и четвертый столбцы. В последнем столбце следует привести результаты аппроксимации полиномом (13.7) с использованием найденных методом наименьших квадратов коэффициентов. График строится по первому, третьему и пятому столбцам.
Если работу выполняют несколько студентов, то каждый из них проводит опыт при своей температуре. Совместная обработка результатов оценки толщины слоя окалины в строго смешанном режиме (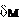 ) позволяет оценить разность энергий активации диффузии и химической реакции. Действительно, здесь справедлива очевидная формула: ) позволяет оценить разность энергий активации диффузии и химической реакции. Действительно, здесь справедлива очевидная формула:
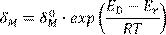 (13.14) (13.14)
Аналогичная обработка коэффициентов b
2
позволяет оценить энергию активации диффузии. Здесь справедлива формула:
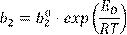 (13.15) (13.15)
Если измерения проводились при двух температурах, то оценки выполняются непосредственно по формулам (13.4) и (13.15), если значений температуры больше двух, следует применить метод наименьших квадратов для функций ln
( ) – 1/T
и ln
(b2
) – 1/T.
Полученные значения приводят в итоговой таблице и обсуждают в выводах. ) – 1/T
и ln
(b2
) – 1/T.
Полученные значения приводят в итоговой таблице и обсуждают в выводах.
Порядок обработки результатов работы
1. Ввести записи результатов измерений в файл электронных таблиц.
2.  Построить на отдельном листе график зависимости m
– , визуально выявить и удалить выскакивающие значения. Построить на отдельном листе график зависимости m
– , визуально выявить и удалить выскакивающие значения.
3. Выполнить сглаживание измеренных значений массы.
4. Вычислить квадраты изменения массы
5. Найти методом наименьших квадратов коэффициенты b
0
, b
1
, b
2
уравнения, аппроксимирующего зависимость изменения массы со временем.
6. Вычислить оценку массы в начале измерений соответствии с аппроксимирующим уравнением
7. Провести анализ результатов аппроксимации с применением сортировки и исключить некорректные значения
8.  Отобразить результаты аппроксимации на графике зависимости m
– . Отобразить результаты аппроксимации на графике зависимости m
– .
9. 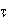 Вычислить характеристики системы и процесса: m
0
, 0
, D
/K
. Вычислить характеристики системы и процесса: m
0
, 0
, D
/K
.
Зачетные результаты:
1. В книге электронных таблиц, представленной на проверку, на первой странице с названием «Результаты» должна быть представлена следующая информация:
a. В ячейке «А1» - площадь поверхности образца, в соседней ячейке «В1» единицы измерения;
b. В ячейке «А2» - масса исходного образца, в ячейке «В2» - единицы измерения;
c. В ячейке «А3» - температура опыта, в ячейке «В3» - единицы измерения;
d. В ячейке «А4» - толщина слоя окалины в строго смешанном режиме, в ячейке «В4» - единицы измерения;
e. Начиная с ячейки «А10» должны быть четко сформулированы выводы по работе.
В ячейках А6-А7 должны быть ссылки на ячейки на других листах книги электронных таблиц, на которых выполнены вычисления с получением представленного результата, а не сами числовые значения! При невыполнении этого требования программа проверки дает сообщение «Ошибка представления информации».
2.  Правильно оформленный график зависимости m
– , полученной экспериментально (точки) и аппроксимированной полиномом (линия), на отдельном листе электронных таблиц со всеми необходимыми подписями и обозначениями. Правильно оформленный график зависимости m
– , полученной экспериментально (точки) и аппроксимированной полиномом (линия), на отдельном листе электронных таблиц со всеми необходимыми подписями и обозначениями.
Контрольные вопросы
1. Какова структура окалины, полученной на железе при его высокотемпературном окислении в атмосфере воздуха?
2. Почему появление вюститной фазы в окалине приводит к резкому увеличению скорости окисления железа?
3. Из каких стадий складывается гетерогенный процесс окисления железа?
4. В чем отличие диффузионного режима окисления железа от кинетического?
5. Каковы порядок и методика проведения работы?
6. Как выявить режим процесса окисления?
2.2 Изучение температурной зависимости удельной электропроводности оксидных расплавов (Работа № 14)
2.2.1 Общие сведения о природе электрической проводимости шлаков
Исследование зависимости удельной электропроводности шлаков от их состава и температуры имеет для металлургии большое значение как в теоретическом, так и в прикладном отношении. Величина удельной электропроводности может оказывать существенное влияние на скорость важнейших реакций между металлом и шлаком в процессах производства стали, на производительность металлургических агрегатов, особенно в электрошлаковых технологиях или дуговых печах для выплавки синтетического шлака, где интенсивность выделения тепла зависит от величины пропускаемого через расплав электрического тока. Кроме того, удельная электропроводность, являясь структурно чувствительным свойством, дает косвенную информацию о строении расплавов, концентрации и виде заряженных частиц.
Согласно представлениям о строении оксидных расплавов, сформулированных, в частности, научной школой профессора О.А.Есина, в них не могут присутствовать незаряженные частицы. В то же время находящиеся в расплаве ионы сильно различаются по размерам и строению. Элементы основных оксидов присутствуют в виде простых ионов, например, Na+
, Ca2+
, Mg2+
, Fe2+
, O2-
. Напротив, элементы с высокой валентностью, которые образуют кислые (кислотные) оксиды, такие как SiO2
, TiO2
, B2
O3
, в виде иона обладают столь высоким электростатическим полем, что не могут находиться в расплаве как простые ионы Si4+
, Ti4+
, B3+
. Они так сильно приближают к себе анионы кислорода, что образуют с ними ковалентные связи и присутствуют в расплаве в виде комплексных анионов, простейшими из которых являются, например, SiO4
4
, TiO4
4-
, BO3
3-
, BO4
5-
. Комплексные анионы обладают способностью усложнять свое строение, объединяясь в двух- и трехмерные структуры. Например, два кремнекислородных тетраэдра (SiO4
4-
) могут соединиться вершинами, образовав простейшую линейную цепочку (Si2
O7
6-
). При этом высвобождается один ион кислорода:
SiO44- + SiO44- = Si2O76- + О2-.
Более подробно эти вопросы можно посмотреть, например, в учебной литературе [3, 4].
Электрическое сопротивление R
обычных линейных проводников можно определить из соотношения
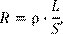 (14.1) (14.1)
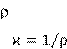 где – удельное сопротивление, L
– длина, S
– площадь поперечного сечения проводника. Величина называется удельной электропроводностью вещества. Из формулы (14.1) следует, где – удельное сопротивление, L
– длина, S
– площадь поперечного сечения проводника. Величина называется удельной электропроводностью вещества. Из формулы (14.1) следует,
что
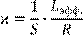 (14.2) (14.2)
Размерность удельной электропроводности выражается в Ом–1
м–1
= См/м (См – сименс). Удельная электропроводность характеризует электропроводность объема расплава, заключенного между двумя параллельными электродами, имеющими площадь по 1 м2
и расположенным на расстоянии 1 м друг от друга.
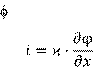 В более общем случае (неоднородное электрическое поле) удельную электропроводность В более общем случае (неоднородное электрическое поле) удельную электропроводность  определяют как коэффициент пропорциональности между плотностью тока i
в проводнике и градиентом электрического потенциала : определяют как коэффициент пропорциональности между плотностью тока i
в проводнике и градиентом электрического потенциала :
(14.3)
Появление электропроводности связано с переносом зарядов в веществе под действием электрического поля. В металлах в переносе электричества участвуют электроны зоны проводимости, концентрация которых практически не зависит от температуры. С ростом температуры происходит уменьшение удельной электропроводности металлов, т.к. концентрация «свободных» электронов остается постоянной, а тормозящее действие на них теплового движения ионов кристаллической решетки возрастает.
В полупроводниках переносчиками электрического заряда являются квазисвободные электроны в зоне проводимости или вакансии в валентной энергетический зоне (электронные дырки), возникающие за счет термически активированных переходов электронов с донорных уровней в зону проводимости полупроводника. С ростом температуры вероятность таких активированных переходов увеличивается, соответственно растет концентрация носителей электрического тока и удельная электропроводность.
В электролитах, к которым относятся и оксидные расплавы, в переносе электричества участвуют, как правило, ионы: Na+
, Ca2+
, Mg2+
, SiO4
4–
, BO2
–
и другие. Каждый из ионов ј
-го сорта может давать свой вклад в общую величину плотности электрического тока в соответствии с известным соотношением
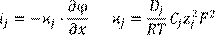 (14.4) (14.4)
где 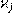 – парциальная удельная электрическая проводимость; Dј
, Cј
, zј
– коэффициент диффузии, концентрация и зарядность иона ј
-го сорта; F
– постоянная Фарадея; Т
– температура; R
– универсальная газовая постоянная. – парциальная удельная электрическая проводимость; Dј
, Cј
, zј
– коэффициент диффузии, концентрация и зарядность иона ј
-го сорта; F
– постоянная Фарадея; Т
– температура; R
– универсальная газовая постоянная.
Очевидно, что сумма величин iј
равна общей плотности тока i
, связанного с движением всех ионов, а удельная электропроводность всего расплава сумме парциальных проводимостей.
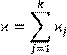 (14.5) (14.5)
Движение ионов в электролитах является активационным процессом. Это означает, что под действием электрического поля перемещаются не все ионы, а только наиболее активные из них, обладающие определенным избытком энергии по сравнению со средним уровнем. Этот избыток энергии, называемый энергией активации электропроводности 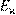 необходим для преодоления сил взаимодействия данного иона с окружением, а также для образования вакансии (полости) в которую он переходит. Количество активных частиц, в соответствии с законом Больцмана, растет с необходим для преодоления сил взаимодействия данного иона с окружением, а также для образования вакансии (полости) в которую он переходит. Количество активных частиц, в соответствии с законом Больцмана, растет с
увеличением температуры по экспоненциальному закону. Поэтому 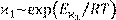 . Следова- . Следова-
тельно, в соответствии с (14.5) температурная зависимость удельной электропроводности должна описываться суммой экспонент. Известно, однако, что с увеличением размеров частиц существенно растет и их энергия активации. Поэтому в соотношении (14.5), как правило, пренебрегают вкладом крупных малоподвижных ионов, а для остальных усредняют парциальные значения 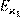 . .
В результате температурная зависимость удельной электропроводности оксидных расплавов принимает следующий вид:
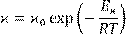 (14.6) (14.6)
что хорошо согласуется с экспериментальными данными.
Типичные значения 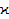 для металлургических шлаков, содержащих оксиды СaO, SiO2
, MgO, Аl2
O3
, находятся в интервале 0.1 – 1.0 См·см–1
вблизи температуры ликвидуса, что значительно меньше электрической проводимости жидких металлов (105
–107
См·см–1
). Энергия активации электропроводности почти не зависит от температуры в основных шлаках, но может несколько снижаться с ростом температуры в кислых расплавах, за счет их деполимеризации. Обычно значение для металлургических шлаков, содержащих оксиды СaO, SiO2
, MgO, Аl2
O3
, находятся в интервале 0.1 – 1.0 См·см–1
вблизи температуры ликвидуса, что значительно меньше электрической проводимости жидких металлов (105
–107
См·см–1
). Энергия активации электропроводности почти не зависит от температуры в основных шлаках, но может несколько снижаться с ростом температуры в кислых расплавах, за счет их деполимеризации. Обычно значение 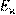 лежит в интервале 40– 200 кДж/моль в зависимости от состава расплава. лежит в интервале 40– 200 кДж/моль в зависимости от состава расплава.
При повышенных содержаниях (свыше 10 %) оксидов железа (FeO, Fe2
O3
) или других оксидов переходных металлов (например, MnО, V2
O3
, Сr2
O3
) характер электропроводности шлаков изменяется, т к. кроме ионной в них появляется существенная доля электронной проводимости. Электронная составляющая проводимости в таких расплавах обусловлена движением электронов или электронных «дырок» по эстафетному механизму от катиона переходного металла с меньшей валентностью к катиону с большей валентностью через р
-орбитали иона кислорода, находящегося между этими частицами.
Очень большая подвижность электронов в сочетаниях Ме2+
– O2–
– Me3+
, несмотря на сравнительно малую их концентрацию, резко увеличивает удельную электропроводность шлаков. Так максимальное значение 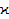 æ для чисто железных расплавов FeO – Fe2
O3
может составлять æ для чисто железных расплавов FeO – Fe2
O3
может составлять
102
См·см–1
, оставаясь, тем не менее, значительно меньше 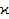 металлов. металлов.
2.2.2 Описание установки и методики измерений
В работе определяется удельная электропроводность расплавленного тетрабората натрия Na2
O·2B2
O3
в интервале температур 700 – 800 °С. Для устранения осложнений, связанных с наличием сопротивления границы металл – электролит, изучение электропроводности необходимо проводить в таких условиях, когда сопротивление границы пренебрежимо мало. Этого можно достичь, используя вместо постоянного переменный ток достаточно высокой частоты (≈ 10 кГц).
Схема электрических цепей установки приведена на рисунке 2.
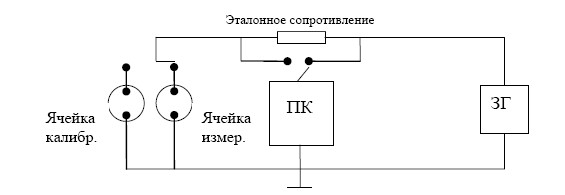
Рисунок 2.Схема электрических цепей установки для измерения электропроводности шлаков:
ЗГ – генератор звуковой частоты; ПК – персональный компьютер со звуковой платой; Ячр-р
и Ячшл
– электрохимическая ячейки, содержащие водный раствор КСl или шлак соответственно; Rэт
– эталонное сопротивление известной величины.
Переменный ток от генератора звуковой частоты подают на ячейку, содержащую шлак, и последовательно включенное с ней эталонное сопротивление известной величины. С помощью звуковой платы ПК измеряют падение напряжения на ячейке и эталонном сопротивлении. Так как ток, протекающий через Rэт
и Яч, одинаков
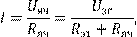 (14.7) (14.7)
Программа обслуживания лабораторной установки вычисляет, выводит на экран монитора и записывает в файл величину отношения (r
) амплитудных значений переменного тока на выходе звукового генератора (U
зг
) и на измерительной ячейке (U
яч
):
(14.8)
 Зная ее, можно определить сопротивление ячейки Зная ее, можно определить сопротивление ячейки
(14.9)
(14.9)
где 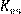 – постоянная ячейки. – постоянная ячейки.
Для определения K
яч
в экспериментальной установке используется вспомогательная ячейка, аналогичная исследуемой по геометрическим параметрам. Обе электрохимические ячейки представляют собой корундовые лодочки с электролитом. В них опущены по два цилиндрических электрода из металла одинакового поперечного сечения и длины, расположенные на одинаковом расстоянии друг от друга, чтобы обеспечить постоянство отношения (L/S)эфф
.
Исследуемая ячейка содержит расплав Na2
O · 2В2
O3
и помешена в нагревательную печь при температуре 700 – 800 °С. Вспомогательная ячейка находится при комнатной температуре и заполнена 0.1 Н водным раствором КСl, электропроводность которого составляет 0,0112 См·см–1
. Зная электропроводность раствора и определив (см. формулу 14.9) электрическое сопротивление
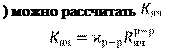 вспомогательной ячейки ( вспомогательной ячейки (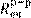
(14.10)
2.2.3 Порядок выполнения работы
А. Работа с использованием измерительной системы в режиме реального времени
Перед началом измерений печь должна быть разогрета до температуры 850 °С. Порядок работы на установке следующий:
1. После выполнения процедуры инициализации в соответствии с указанием на экране монитора следует выключить печь, поставить переключатель «1 – эталонное сопротивление» в положение «1 – Hi» и следить за дальнейшими указаниями.
2. После появления указания «Переключатель 2 – в позицию 'раствор’» следует выполнить его и до появления указания «Переключатель 2 – в позицию ‘РАСПЛАВ’» записывать появляющиеся каждые 5 секунд значения отношения сопротивлений.
3. Выполнить второе указание и следить за изменением температуры. Как только температура станет меньше 800 °С следует командой с клавиатуры «Xs» включить вывод графика и каждые 5 секунд записывать значения температуры и отношения сопротивлений.
4. После охлаждения расплава до температуры менее 650 °С следует инициализировать измерения для второго студента, выполняющего работу на этой установке. Переключатель «1 – эталонное сопротивление» поставить в положение «2 – Lo» и с этого момента второй студент начинает каждые 5 секунд записывать значения температуры и отношения сопротивлений.
5. При охлаждении расплава до температуры 500 °С или достижения значения отношения сопротивлений близкого к 6-ти следует прекратить измерения, подав с клавиатуры команду «Xe». С этого момента второй студент должен перевести переключатель 2 в позицию ‘раствор’ и записать десять значений отношения сопротивлений.
В. Работа с данными, предварительно записанными в файл
После активации программы на экране появляется сообщение о величине эталонного сопротивления и последовательно выводится несколько значений отношения сопротивлений (r
) калибровочной ячейки. После усреднения эти данные позволят найти постоянную установки.
В дальнейшем каждые несколько секунд на экране появляются значения температуры и отноше-ния сопротивлений для измерительной ячейки. Эта информация отображается на графике.
Программа автоматически завершает работу и пересылает все результаты на ПК преподавателя.
2.2.4 Обработка и представление результатов измерений
По результатам измерений следует заполнить таблицу со следующим заголовком:
Таблица 1. Температурная зависимость электропроводности расплава Na2
O · 2B2
O3
| t
, °С
|
r
|
T
, K
|
 , (Ом см)–1 , (Ом см)–1
|
ln(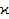 ) )
|
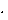 1/Т
103
, K–1 1/Т
103
, K–1
|
В таблице первые два столбца оказываются заполненными после открытия файла данных, а остальные являются вычисляемыми. По ним следует построить график зависимости ln(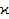 ) – 103
/T и с использованием метода наименьших квадратов (функция LINEST в OpenOffice.Calc) определить значение энергии активации. На графике следует привести аппроксимирующую прямую. Следует также построить график зависимости электропроводности от температуры. Порядок обработки результатов ) – 103
/T и с использованием метода наименьших квадратов (функция LINEST в OpenOffice.Calc) определить значение энергии активации. На графике следует привести аппроксимирующую прямую. Следует также построить график зависимости электропроводности от температуры. Порядок обработки результатов
1. Ввести записи результатов измерений в файл электронных таблиц.
2. Вычислить среднее значение отношения сопротивлений для калибровочной ячейки.
3. Вычислить постоянную установки.
4. Построить график зависимости r
– t
, визуально выявить и удалить выскакивающие значения. При большом их количестве применить сортировку.
5. Вычислить сопротивления измерительной ячейки, электропроводность оксидного расплава при разных температурах, логарифм электропроводности и обратную абсолютную температуру
6. Найти методом наименьших квадратов коэффициенты b
0
, b
1
уравнения, аппроксимирующего зависимость логарифма электропроводности от обратной температуры, и вычислить энергию активации.
7. Построить на отдельном листе график зависимости логарифма электропроводности от обратной температуры и привести аппроксимирующую зависимость Зачетные результаты:
1. В книге электронных таблиц, представленной на проверку, на первой странице с названием «Результаты» должна быть представлена следующая информация:
a. В ячейке «А1» - исходная температура, в ячейке «В1» - единицы измерения;
b. В ячейке «А2» - конечная температура, в ячейке «В2» - единицы измерения;
c. В ячейке «А3» - энергия активации электропроводности, в ячейке «В3» - единицы измерения;
d. В ячейке «А4» - предэкспоненциальный множитель в формуле температурной зависимости электропроводности, в ячейке «В4» - единицы измерения;
e. Начиная с ячейки «А5» должны быть четко сформулированы выводы по работе.
В ячейках А1-А4 должны быть ссылки на ячейки на других листах книги электронных таблиц, на которых выполнены вычисления с получением представленного результата, а не сами числовые значения! При невыполнении этого требования программа проверки дает сообщение «Ошибка представления информации».
2. Правильно оформленный график зависимости логарифма электропроводности от обратной температуры, полученной по экспериментальным данным (точки) и аппроксимированной полиномом (линия), на отдельном листе электронных таблиц со всеми необходимыми подписями и обозначениями.
Контрольные вопросы
1. Что называют удельной электропроводностью?
2. Какие частицы обуславливают электропроводность шлаков?
3. Каков характер температурной зависимости электропроводности металлов и оксидных расплавов?
4. От чего зависит постоянная ячейки и как ее определить?
5. Почему для определения 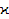 нужно использовать переменный ток? нужно использовать переменный ток?
6. Как зависит от температуры энергия активации электропроводности?
7. Какие датчики и приборы используются в лабораторной установке. Какие физические величины они позволяют регистрировать?
8. Какие графики (в каких координатах) должны быть представлены по результатам работы?
9. Какие физико-химические величины должны быть получены после обработки первичных данных?
10. Определитесь, какие измерения проводятся перед опытом, какие величины регистрируются в ходе опыта, какие данные относятся к первичной информации, какой обработке она подвергается и какая при этом получается информация.
2.3 Исследование кинетики десульфурации металла шлаком на имитационной модели (Работа № 15)
2.3.1 Общие сведения о кинетике десульфурации металла шлаком
Примеси серы в стали, в количествах свыше 0.005 мас. %, существенно снижают ее механические, электротехнические, антикоррозийные и другие свойства, ухудшают свариваемость металла, приводят к появлению красно и хладноломкости. Поэтому процесс десульфурации стали, особенно эффективно протекающий со шлаком, имеет большое значение для качественной металлургии.
Исследование кинетических закономерностей реакции, выявления ее механизма и режима протекания необходимо для эффективного управления скоростью десульфурации, т.к. в реальных условиях металлургических агрегатов равновесное распределение серы между металлом и шлаком обычно не достигается.
В отличие от большинства других примесей в стали переход серы из металла в шлак является процессом восстановительным, а не окислительным 1. [S] +2e = (S2–
).
Это означает, что для непрерывного протекания катодного процесса, приводящего к накоплению положительных зарядов на металле, необходим одновременный переход других частиц, способный отдавать электроны в металлическую фазу. Такими сопутствующими анодными процессами могут быть окисление анионов кислорода шлака или частиц железа, углерода, марганца, кремния и других примесей металла в зависимости от состава стали.
2. (O2–
) = [O] + 2e,
3. [Fe] = (Fe2+
) + 2e,
4. [C] + (O2–
) = CO + 2e, 5. [Mn] = (Mn2+
) +2e.
В совокупности катодный и какой-либо один анодный процесс позволяет записать стехиометрическое уравнение реакции десульфурации в следующем виде, например:
1-2. 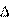 (CaO) + [S] = (CaS) + [O], H = -240 кДж/моль (CaO) + [S] = (CaS) + [O], H = -240 кДж/моль
1-3. 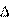 [Fe] + [S] +(CaO)= (FeO) + (CaS). H = -485 кДж/моль [Fe] + [S] +(CaO)= (FeO) + (CaS). H = -485 кДж/моль
Соответствующие выражения для констант равновесия имеют вид
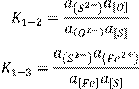 (15.1) (15.1)
(15.2)
Очевидно, выбранные в качестве примера процессы и подобные им могут происходить одновременно. Из соотношения (15.1) следует, что степень десульфурации металла при постоянной температуре, т.е. постоянном значении константы равновесия, увеличивается с ростом концентрации свободного иона кислорода (О2-
) в оксидном расплаве. Действительно, рост сомножителя в знаменателе должен компенсироваться убылью другого сомножителя чтобы соответствовать неизменному значению константы равновесия. Отметим, что содержание свободных ионов кислорода увеличивается при использовании высокоосновных, богатых оксидом кальция шлаков. Анализируя соотношение (15.2) можно заключить, что содержание ионов железа (Fe2+
) в оксидном расплаве должно быть минимальным, т.е. шлаки должны содержать минимальное количество оксидов железа. Присутствие в металле раскислителей (Mn, Si, Al, C) также повышает полноту десульфурации стали за счѐт уменьшения содержания (Fe2+
) и [O].
Реакция 1-2 сопровождается поглощением тепла (∆H>0), поэтому, по мере протекания процесса температура в металлургическом агрегате будет понижаться. Напротив, реакция 1-3 сопровождается выделением тепла (∆H<0) и, если она имеет определяющее значение, температура в агрегате будет повышаться.
При кинетическом описании десульфурации следует рассматривать следующие стадии процесса:
 доставку частиц серы из объема металла к границе со шлаком, реализующуюся сначала за счет конвективной диффузии, а непосредственно вблизи границы раздела металл-шлак – молекулярной диффузии; доставку частиц серы из объема металла к границе со шлаком, реализующуюся сначала за счет конвективной диффузии, а непосредственно вблизи границы раздела металл-шлак – молекулярной диффузии;  электрохимический акт присоединения электронов к атомам серы и образование анионов S2–
; являющийся адсорбционно-химическим актом, электрохимический акт присоединения электронов к атомам серы и образование анионов S2–
; являющийся адсорбционно-химическим актом,  отвод анионов серы в объем шлака, за счет молекулярной, а затем конвективной диффузии. отвод анионов серы в объем шлака, за счет молекулярной, а затем конвективной диффузии.
Аналогичные стадии характерны и для анодных этапов, с участием атомов Fe, Mn, Si или анионов O2–
. Каждая из стадий вносит свой вклад в общее сопротивление процесса десульфурации. Движущей силой потока частиц через ряд указанных сопротивлений является разность их электрохимических потенциалов в неравновесной системе металл – шлак или пропорциональная ей разность фактического и равновесного электродных потенциалов на границе раздела фаз, называемая перенапряжением
.
Скорость процесса, состоящего из ряда последовательных стадий, определяется вкладом этапа с наибольшим сопротивлением – лимитирующего
этапа. В зависимости от механизма протекания лимитирующего этапа говорят о диффузионном или кинетическом режиме реакции. Если этапы с разным механизмом протекания имеют соизмеримые сопротивления, то говорят о смешанном режиме реакции. Сопротивление каждого этапа существенно зависит от природы и свойств системы, концентрации реагентов, интенсивности перемешивания фаз, температуры. Так, например, скорость электрохимического акта восстановления серы определяется величиной тока обмена
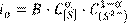 (15.3) (15.3)
где В
– функция температуры, C
[S]
и C
(S
2–
)
– концентрации серы в металле и шлаке, α – коэффициент переноса.
Скорость этапа доставки серы к границе фаз определяется предельным током диффузии этих частиц
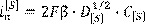 (15.4) (15.4)
где D
[S]
– коэффициент диффузии серы, β – конвективная постоянная, определяемая интенсивностью конвекции в расплаве, она пропорциональна квадратному корню из линейной скорости конвективных потоков в жидкости.
Имеющиеся экспериментальные данные свидетельствуют, что в обычных условиях конвекции расплавов электрохимический акт разряда ионов серы протекает относительно быстро, т.е. десульфурация тормозится в основном диффузией частиц в металле или шлаке. Однако с увеличением концентрации серы в металле диффузионные затруднения уменьшаются и режим процесса может измениться на кинетический. Этому способствуют также добавки углерода в железо, т.к. разряд ионов кислорода на границе углеродистый металл – шлак происходит со значительным кинетическим торможением.
Следует иметь в виду, что электрохимические представления о взаимодействии металлов с электролитами позволяют уточнить механизм процессов, понять в деталях происходящие явления. В то же время простые уравнения формальной кинетики в полной мере сохраняют свою справедливость. В частности, для грубого анализа результатов эксперимента, полученных со значительными погрешностями, уравнение для скорости реакции 1-3 может быть записано в простейшем виде:
 (15.5) (15.5)
где k
f
и k
r
– константы скорости прямой и обратной реакции. Такое соотношение выполняется, если растворы серы в железе и сульфида кальция и вюстита в шлаке допустимо считать бесконечно разбавленными и порядки реакции по этим реагентам близки к единице. Содержания остальных реагентов рассматриваемой реакции столь велики, что все время взаимодействия остаются практически постоянными и их концентрации могут быть включены в константы k
f
и k
r
С другой стороны, если процесс десульфурации далек от состояния равновесия, то скоростью обратной реакции можно пренебречь. Тогда скорость десульфурации должна быть пропорциональна концентрации серы в металле. Такой вариант описания экспериментальных данных можно проверить, исследуя связь логарифма скорости десульфурации и логарифма концентрации серы в металле. Если эта связь линейна, а угловой коэффициент зависимости должен быть близок к единице, то это является аргументом в пользу диффузионного режима процесса.
2.3.2 Математическая модель процесса
Возможность протекания нескольких анодных этапов сильно затрудняет математическое описание процессов десульфурации стали, содержащей много примесей. В связи с этим в модель внесены некоторые упрощения, в частности, пренебрегли кинетическими затруднениями при раз-

Для полуреакций перехода железа и кислорода в связи с принятым ограничением по диффузионному контролю соотношения выглядят существенно проще:
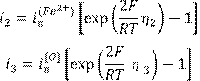 (15.7) (15.7)
(15.8)
В соответствии с условием электронейтральности при отсутствии тока от внешнего источника связь между токами по отдельным электродным полуреакциям выражается простым соотношением:
(15.9)
 Разности электродных перенапряжений ( ) определяются отношениями соответствующих произведений активностей и констант равновесия для реакций 1-2 и 1-3: Разности электродных перенапряжений ( ) определяются отношениями соответствующих произведений активностей и констант равновесия для реакций 1-2 и 1-3:
(15.10)
(15.11)
Производная концентрации серы в металле по времени определяется током первой электродной полуреакции в соответствии с уравнением:
 (15.12) (15.12)
Здесь i
1
, i
2
– плотности токов электродных процессов,η1
, η2
– их поляризации, i
п
– предельные токи диффузии частиц ј
-то сорта, i
о
– ток обмена кинетического этапа, C
[s]
– концентрация серы в металле, α – коэффициент переноса, П, K
p
– произведение активностей и константа равновесия реакции десульфурации, S
– площадь межфазной границы металл шлак, V
Me
– объем металла, Т
– температура, F
– постоянная Фарадея, R
– универсальная газовая постоянная.
В соответствии с законами электрохимической кинетики выражение (15.6) учитывает заторможенность диффузии ионов железа в шлаке, т.к., судя по экспериментальным данным, стадия разряда-ионизации этих частиц не является лимитирующей. Выражение (15.5) – заторможенность диффузии частиц серы в шлаке и металле, а также замедленность ионизации серы на межфазной границе.
Объединяя выражения (15.6 – 15.12), можно численными методами получить зависимость концентрации серы в металле от времени для выбранных условий.
В модели использованы следующие параметры:
3)  Ток обмена ионами серы: Ток обмена ионами серы:
4) Константа равновесия реакции десульфурации (К
Р
):
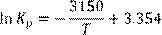
5) Отношение площади межфазной границы к объему металла

7) Конвективная постоянная (β):
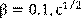
Модель позволяет проанализировать влияние перечисленных факторов на скорость и полноту десульфурации, а также оценить вклад диффузионных и кинетических торможений в общее сопротивление процесса.
2.3.3 Порядок проведения работы
Изображение, генерируемое имитационной программой, представлено на рис. . В верхней части панели приводятся выборочные числовые значения измеряемых величин, на графике отображены все значения, полученные в ходе моделирования процесса. В обозначениях компонентов металлического и шлакового расплавов использованы принятые литервтуре металлургической тематики дополнительные знаки. Квадратные скобки обозначают принадлежность компонента металлическому расплаву, а круглые – шлаковому. Множители при обозначениях компонентов используются только для построения графика, их не следует учитывать при интерпретации значений. Во время работы модели в каждый данный момент отображается только значение одной из измеряемых величин. Через 6 сек оно исчезает и появляется значение следующей величины. За этот промежуток времени надо успеть записать очередное значение. Для экономии времени рекомендуется неизменные цифры не записывать, например, ведущую единицу в значении температуры.
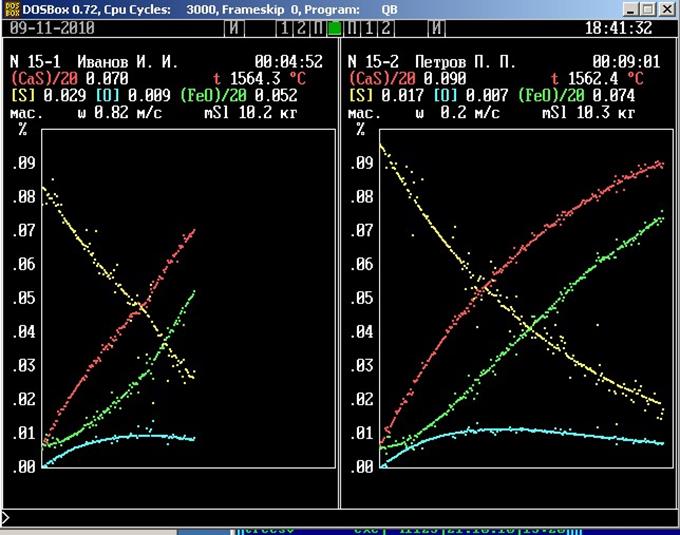
Через пять минут после начала измерений по часам в правом верхнем углу панели установки одновременным нажатием клавиш [Alt] и [№], где № - номер установки, интенсифицируйте скорость перемешивания фаз.
2.3.4 Обработка и представление результатов измерений
Таблицу результатов измерений, сформированную программой имитационного моделирования следует дополнить следующими вычисляемыми столбцами:
Таблица 1. Результаты статистической обработки экспериментальных данных
|  , ,
мин
|
 τ, с τ, с
|
(CaS), мас. %
(сглаж.)
|
(FeO), мас. %
(сглаж.)
|
(CaS)·(FeO),
(мас. %)2
(сглаж.)
|
[S],
мас. %
(сглаж.)
|
 d(CaS)/d , мас. %/мин d(CaS)/d , мас. %/мин
(сглаж.)
|
v
десульф.
, моль/с
|
| 1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
В таблице в первом столбце следует вычислить время с начала процесса в минутах.
Дальнейшая обработка выполняется после графического построения – на первом этапе обработки следует построить график зависимости температуры от времени и оценить диапазон данных, когда переходу серы сопутствует, в основном, переход железа. В этом диапазоне выделяют две области с одинаковыми скоростями перемешивания и методом наименьших квадратов находят коэффициенты аппроксимирующих полиномов вида:
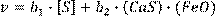 (15.13) (15.13)
который следует из уравнения (15.5) при оговоренных условиях. Сравнивая полученные значения коэффициентов делают выводы о режиме процесса и степени приближения системы к состоянию равновесия. Обратите внимание, что в уравнении (15.13) отсутствует свободный член.
Для иллюстрации результатов эксперимента строят графики зависимостей концентрации серы от времени и скорости десульфурации от концентрации сульфида кальция в шлаке.
Порядок обработки результатов
1. Ввести результаты ручной записи информации в файл электронных таблиц.
2. Вычислить скорость процесса десульфурации по концентраци серы в металле, логарифмы скорости и концентрации серы.
3. Построить на отдельных листах графики зависимостей температуры в агрегате от времени, массы шлака от времени, скорости десульфурации ои времени и логарифма скорости десульфурации от логарифма концентрации серы.
4. Методом наименьших квадратов оценить отдельно для разных скоростей перемешивания кинетические характеристики процесса десульфурации в соответствии с уравнением () и порядок реакции по концентрации серы.
Зачетные результаты:
1. Правильно оформленные графики зависимости скорости процесса десульфурации и логарифма этой величины от времени, на отдельном листе электронных таблиц со всеми необходимыми подписями обозначениями.
2. Значения кинетических характеристик процесса десульфурации во всех вариантах проведения процесса с указанием размерностей (и погрешностей).
3. Выводы по работе.
Контрольные вопросы
1. Какие условия необходимы для наиболее полной десульфурации металла шлаком?
2. Какие анодные процессы могут сопутствовать удалению серы?
3. Из каких этапов складывается процесс перехода серы через межфазную границу?
4. В каких случаях реализуется диффузионный или кинетический режим десульфурации?
5. Каков порядок выполнения работы?
2.4 Термографическое изучение процессов диссоциации природных карбонатов (Работа № 16)
2.4.1 Общие закономерности диссоциации карбонатов
Термограммой называется зависимость температуры образца от времени. Термографический метод изучения процессов термического разложения веществ получил широкое распространение после того, как были обнаружены характерные особенности таких зависимостей: «температурные остановки» и «наклонные температурные площадки».
 1.4 1.4
Рисунок 3. Иллюстрация термограммы:
пунктирная кривая – термограмма гипотетического образца сравнения, в котором не происходит диссоциация; сплошная линия – реальный образец с двухстадийной диссоциацией.
   Это характерные участки зависимости, в пределах которых в течение некоторого времени ( ) температура либо остается постоянной (T = const), либо увеличивается на небольшую величину ( Т) с постоянной скоростью ( Т/ ). Применяя численное или графическое дифференцирование можно с хорошей точностью определить моменты времени и температуры начала и конца температурной остановки. Это характерные участки зависимости, в пределах которых в течение некоторого времени ( ) температура либо остается постоянной (T = const), либо увеличивается на небольшую величину ( Т) с постоянной скоростью ( Т/ ). Применяя численное или графическое дифференцирование можно с хорошей точностью определить моменты времени и температуры начала и конца температурной остановки.
В предлагаемой лабораторной работе такую зависимость получают при непрерывном нагревании природного материала кальцита, основной составляющей которого является карбонат кальция. Горная порода, состоящая, главным образом из кальцита, называется известняк. Известняк в больших количествах используется в металлургии.
В результате обжига (термической обработки) известняка по эндотермической реакции
CaCO3
= CaO + CO2
получают известь (СаО) – необходимый компонент шлакового расплава. Процесс проводят при температурах, ниже температур плавления и известняка и извести. Известно, что карбонаты и образующиеся из них оксиды взаимно практически не растворимы, поэтому продуктом реакции является новая твердая фаза и газ. Выражение для константы равновесия, в общем случае, имеет вид:
(16.1)
Здесь a
– активности твердых реагентов, – парциальное давление газообразного продукта реакции. В металлургии широко используется и другая горная порода, называемая доломит. Она, в основном, состоит из минерала с таким же названием, представляющим из себя двойную соль угольной кислоты CaMg(CO3
)2
.
Кальцит, как и любой природный минерал, наряду с основным компонентом содержит разнообразные примеси, количество и состав которых зависит от месторождения природного ископаемого и, даже, от конкретного участка добычи. Разнообразие примесных соединений так велико, что необходимо их классифицировать по какому-то существенному в том или ином случае признаку. Для термодинамического анализа существенным признаком является способность примесей образовывать растворы с реагентами. Будем считать, что в минерале отсутствуют примеси, которые в изучаемом диапазоне условий (давление и температура) вступают в какие-либо химические реакции между собой или основным компонентом или продуктом его распада. На практике это условие выполняется не вполне строго, поскольку в кальците, например, могут присутствовать карбонаты других металлов, но с точки зрения дальнейшего анализа учет этих реакций не даст новой информации, но неоправданно усложнит анализ.
Все остальные примеси можно разделить на три группы:
1. Примеси, образующие раствор с карбонатом кальция. Такие примеси, безусловно, необходимо учитывать при термодинамическом анализе и, скорее всего, при кинетическом анализе процесса.
2. Примеси, растворяющиеся в продукте реакции – оксиде. Решение вопроса об учете примесей этого типа зависит от того, насколько быстро происходит их растворение в твердом продукте реакции и тесно связанным с ним вопросом дисперсности включений примесей этого типа. Если включения сравнительно велики по размеру, а их растворение происходит медленно, то их не следует учитывать при термодинамическом анализе.
3. Примеси, не растворимые в исходном карбонате и продукте его распада. Эти примеси не следует учитывать при термодинамическом анализе, как если бы их вообще не было. В некоторых случаях они могут оказывать влияние на кинетику процесса.
В простейшем (грубом) варианте анализа допустимо объединить все примеси одного типа и рассматривать их как некоторый обобщенный компонент. На этом основании выделим три компонента: В1, В2 и В3. Следует обсудить и газовую фазу рассматриваемой термодинамической системы. В лабораторной работе процесс диссоциации проводится в открытой установке, сообщающейся с атмосферой помещения. В этом случае общее давление в термодинамической системе постоянно и равняется одной атмосфере, а в газовой фазе присутствует газообразный продукт реакции – углекислый газ (СО2) и компоненты воздушной среды, упрощенно – кислород и азот. Последние не взаимодействуют с остальными компонентами системы, поэтому в рассматриваемом случае кислород и азот не различимы и в дальнейшем их будем называть нейтральный газообразный компонент В.
Температурные остановки и площадки имеют термодинамическое объяснение. При известном составе фаз можно термодинамическими методами предсказать температуру остановки. Можно решать и обратную задачу – по известным температурам определить состав фаз. Она предусмотрена в рамках данного исследования.
Реализоваться температурные остановки и площадки могут только при выполнении определенных требований в отношении кинетики процесса. Естественно ожидать, что это требования практически равновесных составов фаз в месте протекания реакции и пренебрежимо малых градиентов в диффузионных слоях. Соблюдение таких условий оказывается возможным, если скорость процесса контролируется не внутренними факторами (сопротивление диффузии и сопротивление самой химической реакции), а внешними – скоростью подвода тепла к месту реакции. В дополнении к определенным в физической химии основным режимам гетерогенной реакции: кинетическому и диффузионному, такой режим процесса называют тепловым.
Заметим, что тепловой режим твердофазного процесса диссоциации оказывается возможным из-за своеобразия реакции, которая требует подвода большого количества тепла, и при этом в ней отсутствуют этапы подвода исходных веществ к месту реакции (поскольку происходит разложение одного вещества) и отвода твердого продукта реакции от границы раздела фаз (поскольку перемещается эта граница). Остается только два этапа, связанных с диффузией: отвод СО2 через газовую фазу (очевидно, с очень малым сопротивлением) и диффузия СО2 через оксид, которая сильно облегчается растрескиванием оксида, заполняющим объем, ранее занятый улетучившимся оксидом углерода.
Рассмотрим термодинамическую систему при температурах ниже температурной остановки. Сначала допустим, что в карбонате отсутствуют примеси первого и второго вида. Возможное присутствие примеси третьего типа учтем, но только для того, чтобы показать, что этого можно и не делать. Допустим, что навеска исследуемого порошкового кальцита составлена из одинаковых сферических частиц радиусом r
0
. Границу термодинамической системы проведем на некотором расстоянии от поверхности одной из частиц кальцита, небольшом по сравнению с ее радиусом, и таким образом включим в состав системы некоторый объем газовой фазы.
В рассматриваемой системе находятся 5 веществ: СаО, СаСО3, В3, СО2, В и некоторые из них участвуют в одной реакции. Эти вещества распределены по четырем фазам: СаО, СаСО3, В3, газовая фаза, каждая из которых характеризуется присущими только ей значениями различных свойств и отделена от других фаз видимой (хотя бы под микроскопом) границей раздела. То, что фаза В3 представлена, скорее всего, множеством дисперсных частиц не изменит анализа – все частицы практически одинаковы по свойствам и могут рассматриваться как одна фаза. Внешнее давление постоянно, поэтому остается только одна внешняя переменная – температура. Таким образом, все слагаемые для расчета числа степеней свободы (с
) определены: с
= (5 – 1) + 1 – 4 = 1.
Полученная величина означает, что при изменении температуры (одного параметра) система будет переходить от одного равновесного состояния к другому и при этом число и природа фаз меняться не будут. Будут меняться параметры состояния системы: температура и равновесное давление углекислого газа и нейтрального газа В (Т
, РСО2
, РВ
).
Строго говоря, сказанное справедливо не для любых температур ниже температурной остановки, а только для того интервала, когда реакция, первоначально происходящая в кинетическом режиме, перешла в тепловой режим и можно действительно говорить о близости параметров системы к равновесным. При более низких температурах система существенно не равновесна, но на характере зависимости температуры образца от времени это никакими особенностями не отражается.
 С самого начала эксперимента – при комнатной температуре система находится в состоянии равновесия, но только потому, что в ней отсутствуют вещества, которые могли бы взаимодействовать. Имеется в виду оксид кальция, который при этих условиях (парциальное давление углекислого газа в атмосфере примерно 310–4
атм, равновесное давление – 10–23
атм) мог бы карбонизироваться. Согласно уравнению изотермы для реакции, записанному с учетом выражения константы равновесия (16.1) при активностях конденсированных веществ, равных единице: С самого начала эксперимента – при комнатной температуре система находится в состоянии равновесия, но только потому, что в ней отсутствуют вещества, которые могли бы взаимодействовать. Имеется в виду оксид кальция, который при этих условиях (парциальное давление углекислого газа в атмосфере примерно 310–4
атм, равновесное давление – 10–23
атм) мог бы карбонизироваться. Согласно уравнению изотермы для реакции, записанному с учетом выражения константы равновесия (16.1) при активностях конденсированных веществ, равных единице:
(16.2)
изменение энергии Гиббса положительно, что означает, что реакция должна происходить в обратном направлении, но это невозможно, поскольку в системе изначально отсутствует оксид кальция.
При увеличении температуры упругость диссоциации (равновесное давление СО2 над карбонатом) растет, как это следует из уравнения изобары:
(16.3)
поскольку тепловой эффект реакции больше нуля.
Только при температуре примерно 520 С реакция диссоциации станет термодинамически возможной, но начнется она со значительной задержкой по времени (инкубационный период), необходимой для зарождения оксидной фазы. Первоначально реакция будет происходить в кинетическом режиме, но, за счет автокатализа сопротивление кинетического этапа довольно быстро понизится настолько, что реакция перейдет в тепловой режим. Именно с этого момента становится справедливым термодинамический анализ, приведенный выше, а температура образца начнет отставать от температуры гипотетического образца сравнения, в котором не происходит диссоциация (см. рисунок 3).
Рассмотренный термодинамический анализ будет оставаться справедливым до момента, когда упругость диссоциации достигнет значения 1 атм. При этом на поверхности образца непрерывно выделяется углекислый газ под давлением 1 атм. Он оттесняет воздух, а на смену ему из образца поступают новые порции. Давление углекислого газа увеличиться сверх одной атмосферы не может, поскольку газ свободно уходит в окружающую атмосферу.
Система принципиально меняется, поскольку в газовой фазе вокруг образца теперь отсутствует воздух и в системе стало одним компонентом меньше. Число степеней свободы в такой системе с = (4 – 1) + 1 – 4 = 0
оказывается равно нулю, и при сохранении равновесия в ней не могут меняться никакие параметры состояния, в том числе температура.
Заметим теперь, что все выводы (расчет числа степеней свободы и пр.) останутся справедливыми, если не учитывать компонент В3, который на единицу увеличивает и число веществ и число фаз, что взаимно компенсируется.
Наступает температурная остановка, когда все поступающее тепло расходуется только на процесс диссоциации. Система работает как очень хороший регулятор температуры, когда небольшое случайное ее изменение приводит к противоположному изменению скорости диссоциации, что возвращает температуру к прежнему значению. Высокое качество регулирования объясняется тем, что такая система практически безинерционна.
По мере развития процесса диссоциации фронт реакции смещается вглубь образца, при этом уменьшается поверхность взаимодействия и увеличивается толщина твердого продукта реакции, что затрудняет диффузию углекислого газа от места реакции на поверхность образца. Начиная с какого-то момента времени тепловой режим процесса переходит в смешанный, а затем – в диффузионный. Уже в смешанном режиме система станет существенно неравновесной и выводы, полученные при термодинамическом анализе потеряют практический смысл.
Из-за уменьшения скорости процесса диссоциации требуемое количество тепла уменьшится настолько, что часть поступающего теплового потока вновь начнет расходоваться на нагрев системы. С этого момента температурная остановка прекратится, хотя процесс диссоциации еще будет продолжаться до полного разложения карбоната.
Нетрудно догадаться, что для рассматриваемого простейшего случая значение температуры остановки может быть найдено из уравнения
(16.4)
Термодинамический расчет по этому уравнению с использованием базы данных TDHT дает для чистого кальцита температуру 883°С, а для чистого арагонита – 834°С.
Теперь усложним анализ. При диссоциации кальцита, содержащего примеси 1-го и 2-го типа, когда активности карбоната и оксида нельзя считать равными единице, соответствующее условие усложнится:
(16.5)
Если допустить, что содержание примесей невелико и получающиеся растворы можно рассматривать как бесконечно разбавленные, то последнее уравнение можно записать в виде:
(16.6)
где – мольная доля соответствующей примеси.
Если получена наклонная температурная площадка и обе температуры (Т
2 > Т
1) выше температуры остановки для чистого карбоната кальция – КР
(Т
1) > 1 и КР
(Т
2) > 1, то разумно допустить, что примеси второго типа отсутствуют, или не успевают раствориться () и оценить концентрацию примесей 1-го типа в начале
(16.7)
и в конце температурной остановки
(16.8)
Примесь первого типа должна в некоторой мере накапливаться в растворе СаСО3 – В1 по мере перемещения фронта реакции. При этом угловой коэффициент наклона площадки выражается соотношением:
(16.9)
 где 1 – доля компонента В1, возвращающегося в исходную фазу при его выделении в чистом виде; VS
– молярный объем кальцита; vC
– скорость диссоциации карбоната; где 1 – доля компонента В1, возвращающегося в исходную фазу при его выделении в чистом виде; VS
– молярный объем кальцита; vC
– скорость диссоциации карбоната; – тепловой эффект реакции диссоциации при температуре остановки; r
0
– исходный радиус частицы кальцита. – тепловой эффект реакции диссоциации при температуре остановки; r
0
– исходный радиус частицы кальцита.
 Привлекая справочные данные, по этой формуле можно рассчитать vC
- скорость раство- Привлекая справочные данные, по этой формуле можно рассчитать vC
- скорость раство-
рения компонента В1 в кальците.
2.4.2 Схема установки и методика проведения работы
В работе изучают диссоциацию карбоната кальция и доломита различной фракции.
Схема экспериментальной установки приведена на рисунке 4.
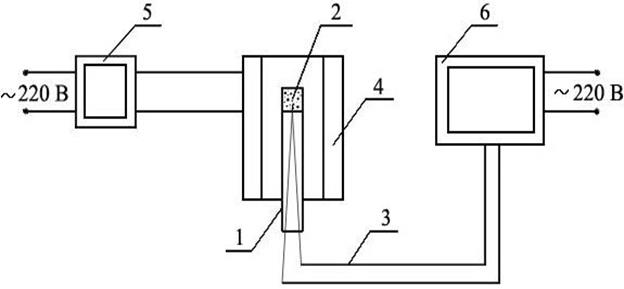
Рисунок 4 – Схема установки для изучения термограмм диссоциации карбонатов:
1 – корундовая трубка, 2 – карбонат, 3 – термопара, 4 – печь,
5 – автотрансформатор, 6 – персональный компьютер с платой АЦП
В предварительно разогретую до 1200 К печь (4) устанавливают корундовую трубку (1) с термопарой (3) и исследуемым образцом карбоната кальция (2). На экране монитора персонального компьютера наблюдают термограмму образца. После прохождения изотермического участка повторяют опыт с другой фракцией карбоната. При исследовании доломита нагрев ведут до выявления двух температурных остановок.
Полученные термограммы представляют на графике «температура – время». Для удобства сопоставления все термограммы необходимо привести на одном графике. По нему определяют температуру интенсивного развития процесса, сравнивают ее с найденной из термодинамического анализа. Делают выводы о влиянии температуры, природы карбоната, степени его дисперсности на характер термограммы.
2.4.3 Обработка и представление результатов измерений
По результатам работы следует заполнить следующую таблицу:
Таблица 1. Результаты исследования процесса диссоциации карбоната кальция (доломита)
| Время, с
|
Температура, °С
|
t, °C (сглаженные знач.)
|
 dt
/d , град./с dt
/d , град./с
|
 Первые два столбца заполняются значениями при открытии файла данных, последние следует вычислить. Сглаживание выполняется по пяти точкам, численное дифференцирование сглаженных данных выполняется с дополнительным сглаживанием тоже по пяти точкам. По результатам работы следует построить две отдельных диаграммы зависимостей: t
– и dt
/d – t
. Первые два столбца заполняются значениями при открытии файла данных, последние следует вычислить. Сглаживание выполняется по пяти точкам, численное дифференцирование сглаженных данных выполняется с дополнительным сглаживанием тоже по пяти точкам. По результатам работы следует построить две отдельных диаграммы зависимостей: t
– и dt
/d – t
.
Полученное значение температурной остановки (Ts
) следует сравнить с характерным значением для чистого кальцита. Если наблюдаемое значение выше, то можно приближенно оценить минимальное содержание примеси первого типа по уравнению (16.7), считая, что примеси второго типа отсутствуют. Если наблюдается обратное соотношение, то можно сделать вывод, что основное влияние оказывают примеси второго типа и оценить их минимальное содержание при условии, что отсутствуют примеси первого типа. Из уравнения (16.6) следует, что в последнем случае
(16.10)
Значение константы равновесия желательно рассчитать с использованием базы данных TDHT по методике, описанной в пособии [8]. В крайнем случае можно воспользоваться уравнением, аппроксимирующим зависимость изменения энергии Гиббса в реакции диссоциации карбоната кальция с температурой:
 G
0
= B
0
+ B
1
·T
+ B
2
·T
2
, G
0
= B
0
+ B
1
·T
+ B
2
·T
2
,
принимая значения коэффициентов равными: B
0
= 177820, Дж/моль; B
1
= -162.61, Дж/(моль·К), B
3
=0.00765, Дж·моль-1
·К-2
.
Примечание
. Если в курсе «Физическая химия» студенты не ознакомлены с базой данных TDHT и не выполняли соответствующие расчеты на практических занятиях, то следует воспользоваться уравнением Шварцмана-Темкина и данными из справочника [9].
Порядок обработки результатов
1. Ввести результаты ручной записи информации в файл электронных таблиц.
2. Выполнить сглаживание значений температуры.
3. Построить на отдельном листе график зависимости температуры от времени.
4. Выполнить дифференцирование значений температуры по времени со сглаживанием по 5-и точкам.
5. Построить на отдельном листе график зависимости производной температуры по времени от температуры, определить характеристики площадок.
Зачетные результаты:
1. В книге электронных таблиц, представленной на проверку, на первой странице с названием «Результаты» должна быть представлена следующая информация:
a. В ячейке «А1» - значение температурной остановки (среднее для наклонной площадки), в ячейке «В1» - единицы измерения;
b. В ячейке «А2» - продолжительность температурной остановки, в ячейке «В2» - единицы измерения;
c. В ячейке «А3» - наклон площадки, в ячейке «В3» - единицы измерения;
d. В ячейке «А4» - тип примеси или «0», если наличие примесей не выявлено;
e. В ячейке «А5» - мольная доля примеси;
f. Начиная с ячейки «А7» должны быть четко сформулированы выводы по работе.
В ячейках А1, А3 и А5 должны быть ссылки на ячейки на других листах книги электронных таблиц, на которых выполнены вычисления с получением представленного результата, а не сами числовые значения! При невыполнении этого требования программа проверки дает сообщение «Ошибка представления информации».
2. Правильно оформленные графики зависимостей температуры от времени, производной температуры по времени от температуры и производной температуры по времени от времени на отдельных листах электронных таблиц со всеми необходимыми подписями и обозначениями.
3. Значения оценок температур остановок и их продолжительности.
4. Выводы по работе.
Контрольные вопросы
1. От чего зависит температура начала диссоциации карбоната на воздухе?
2. Почему с ростом температуры растет упругость диссоциации карбонитов?
3. Чему равно число степеней свобода системы, в которой установилось равновесие между веществами CaO, СО2
, СаСО3
?
4. Как изменится характер термограммы, если продукт диссоциации образует твердые растворы с исходным веществом?
5. Какому режиму гетерогенной реакции диссоциации карбонатов отвечает изотермический участок термограммы?
6. Как изменится вид термограммы при диссоциации полидисперсного карбоната?
7. Чем отличаются термограммы, полученные при общем давлении 101,3 кПа и 50 кПа?
2.5 Изучение температурной зависимости вязкости оксидных расплавов (Работа № 17)
2.5.1 Природа вязкого сопротивления оксидных расплавов
Вязкость – одна из важнейших физико-химических характеристик шлаковых расплавов. Она оказывает существенное влияние на диффузионную подвижность ионов, а значит, и на кинетику взаимодействия металла со шлаком, скорость тепло- и массообменных процессов в металлургических агрегатах. Исследование температурной зависимости вязкости дает косвенную информацию о структурных превращениях в оксидных расплавах, изменениях параметров комплексных анионов. Состав, а значит, и величина вязкости зависят от назначения шлака. Так, например, для интенсификации диффузионных стадий окислительно-восстановительного взаимодействия металла и шлака (десульфурация, дефосфорация и пр.) состав шлака подбирают таким, чтобы его вязкость была небольшой. Напротив, в целях предотвращения переноса водорода или азота в сталь через шлак из газовой фазы наводят шлак с повышенной вязкостью.
Одной из количественных характеристик вязкости может служить коэффициент динамической вязкости (η), который определяется как коэффициент пропорциональности в законе внутреннего трения Ньютона
, (17.1)
где F
– сила внутреннего трения между двумя соседними слоями жидкости, grad υ –
градиент скорости, S
– площадь поверхности соприкосновения слоев. Единица измерения динамической вязкости в СИ: [η] = Н·с/м2
= Па·с.
Известно, что течение жидкости – это серия перескоков частиц в соседнее устойчивое положение. Процесс имеет активационный характер. Для осуществления перескоков частица должна обладать достаточным запасом энергии по сравнению со средним ее значением. Избыточная энергия необходима для разрыва химических связей перемещающейся частицы и образования в объеме расплава вакансии (полости), в которую она переходит. С ростом температуры увеличивается средняя энергия частиц и большее их число может участвовать в течении, что приводит к снижению вязкости. Количество таких «активных» частиц растет с температурой согласно экспоненциальному закону распределения Больцмана. Соответственно зависимость коэффициента вязкости от температуры имеет экспоненциальный вид
(17.2)
где η0
– коэффициент, мало зависящий от температуры, E
η
– энергия активации вязкого течения. Она характеризует минимальный запас кинетической энергии моля активных частиц, способных участвовать в течении.
 Структура оксидных расплавов оказывает существенное влияние на коэффициент вязкости. В отличие от движения ионов под действием электрического поля, при вязком течении все частицы жидкости перемещаются в направлении движения последовательно. Наиболее заторможенным этапом является движение крупных частиц, которые дают наибольший вклад в величину η. Вследствие этого энергия активации вязкого течения, оказывается больше таковой для электропроводности (E
η
> Е
). Структура оксидных расплавов оказывает существенное влияние на коэффициент вязкости. В отличие от движения ионов под действием электрического поля, при вязком течении все частицы жидкости перемещаются в направлении движения последовательно. Наиболее заторможенным этапом является движение крупных частиц, которые дают наибольший вклад в величину η. Вследствие этого энергия активации вязкого течения, оказывается больше таковой для электропроводности (E
η
> Е
).
В кислых шлаках, содержащих оксиды Si, Р, В, велика концентрация крупных комплексных анионов в форме цепочек, колец, тетраэдров и других пространственных структур (например,
 , и т.п.). Наличие крупных частиц увеличивает вязкость расплава, т.к. их перемещение требует больших затрат энергии, по сравнению с мелкими. , и т.п.). Наличие крупных частиц увеличивает вязкость расплава, т.к. их перемещение требует больших затрат энергии, по сравнению с мелкими.
Добавки основных оксидов (СаО, МgО, МnО) приводят к увеличению концентрации простых катионов (Са2+
, Мg2+
, Мn2+
) в расплаве. Вводимые анионы О2–
способствуют деполимеризации расплава, т.е. распаду комплексных анионов, например,
В результате вязкость шлаков уменьшается.
В зависимости от температуры и состава вязкость металлургических шлаков может изменяться в довольно широких пределах (0,01 – 1 Па·с). Эти значения на порядки величины превышают вязкость жидких металлов, что обусловлено наличием в шлаках сравнительно крупных единиц течения.
Приведенная экспоненциальная зависимость η от Т
(17.2) неплохо описывает экспериментальные данные для основных шлаков, содержащих менее 35 мол. % SiО2
. В таких расплавах энергия активации вязкого течения E
η
постоянна и имеет небольшую величину (45 – 80 кДж/моль). При уменьшении температуры η меняется, незначительно и только при затвердевании начиняет интенсивно возрастать.
В кислых шлаках, имеющих высокую концентрацию комплексообразующих компонентов, энергия активации может уменьшаться с ростом температуры: E
η
= Е
0
/ Т
, что вызвано разукрупнением сложных анионов при нагреве. Экспериментальные данные в этом случае линеаризуются в координатах «ln
η – 1/T
2
».
2.5.2 Описание установки и методика измерений вязкости
Для измерения коэффициента вязкости в работе используется ротационный вискозиметр (рисунок 5). Устройство и принцип действия этого прибора заключается в следующем. В тигель (1) цилиндрической формы помещают исследуемую жидкость (2), в которую погружают шпиндель (4), подвешенный на упругой струне (5). Во время опыта вращательный момент от электромотора (9) передается диску (7), от него через струну шпинделю.
О величине вязкости оксидного расплава судят по углу закручивания струны, который определяют по шкале (8). При вращении, шпинделя вязкое сопротивление жидкости создает тормозящий момент сил, закручивающий струну до тех пор, пока момент упругой деформации струны не станет равным моменту сил вязкого сопротивления. При этом скорости вращения диска и шпинделя будут одинаковы. Соответствующий такому состоянию, угол закручивания струны (∆φ) можно измерить, сравнивая положение стрелки (10) относительно шкалы: начальное – до включения электромотора и установившееся – после включения. Очевидно, что угол закручивания струны ∆φ тем больше, чем больше вязкость жидкости η. Если деформации струны не превосходят предельных (соответствующих выполнимости закона Гука), то величина ∆φ пропорциональна η и можно записать:
(17.3)
Коэффициент уравнения k
, получивший название постоянной вискозиметра, зависит от размеров тигля и шпинделя, а также от упругих свойств струны. С уменьшением диаметра струны чувствительность вискозиметра увеличивается.
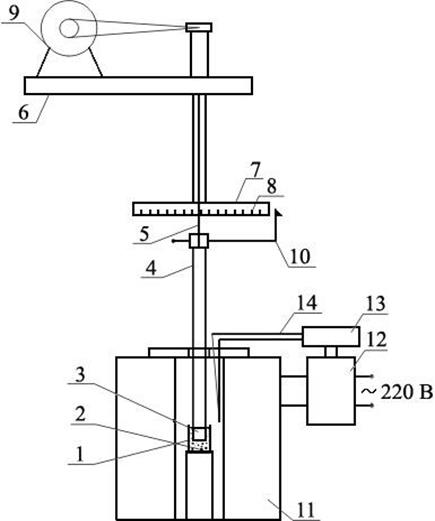
Рисунок 5 – Схема установки для измерения вязкости:
1 – тигель, 2 – исследуемый расплав, 3 – головка шпинделя,
4 – шпиндель, 5 – струна, 6 – верхняя часть установки, 7 – диск,
8 – шкала, 9 – электромотор, 10 – стрелка, 11 – печь, 12 – трансформатор,
13 – устройство регулировки температуры,14 – термопара.
Для определения постоянной вискозиметра k
в тигель помещают жидкость с известной вязкостью – раствор канифоли в трансформаторном масле. В этом случае в опыте при комнатной температуре определяют ∆φ0. Затем, зная вязкость (η0) эталонной жидкости при данной температуре, вычисляют k
по формуле:
(17.4)
Найденное значение k
используют для вычисления коэффициента вязкости оксидного расплава.
2.5.3 Порядок проведения работы
Для знакомства с вязкостными свойствами металлургических шлаков в данной лабораторной работе изучается расплав Na2
O · 2B2
O3
. Измерения проводят в интервале температур 850– 750 о
С. После достижения первоначальной температуры (850 о
С) стрелку вискозиметра устанавливают на нулевой отметке. Затем включают электромотор и фиксируют стационарный угол закручивания струны ∆φт
.
He выключая вискозиметра, повторяют измерение ∆φт
при других температурах. Опыт прекращают, когда угол закручивания струны начнет превышать 720о
.
2.5.4 Обработка и представление результатов измерений
По результатам измерений заполняют следующую таблицу.
Таблица 1. Температурная зависимость вязкости
| t
, °C
|
 , усл.ед. , усл.ед.
|
T
, K
|
 , Па , Па
|
с
|
103
/T, K-1
|
 ln( ) ln( )
|
В таблице первые два столбца заполняют по результатам ручной записи показаний температуры на экране монитора и угла закручивания нити по шкале вискозиметра. Остальные столбцы являются вычисляемыми.
Для проверки выполнимости экспоненциального закона изменения коэффициента вязкости с температурой (17.2) строят график в координатах «Ln(η) – 103
/T
». Энергию активации находят с применением функции LINEST() (OpenOffice.Calc) или ЛИНЕЙН() (MicrosoftOffice.Exel), применяя их к пятому и шестому столбцам таблицы.
В выводах сопоставляют полученные данные η и Eη
с известными для металлургических шлаков, обсуждают характер температурной зависимости вязкости, ее связь со структурными изменениями в расплаве.
Порядок обработки результатов
1. Провести измерения на калибровочной ячейке и вычислить постоянную установки
2. Ввести результаты ручной записи информации в файл электронных таблиц.
3. Вычислить значения вязкости.
4. Построить на отдельном листе график зависимости вязкости от температуры.
5. Вычислить логарифм вязкости и обратную абсолютную температуру для всего набора результатов измерений.
6. Найти методом наименьших квадратов коэффициенты b
0
, b
1
уравнения, аппроксимирующего зависимость логарифма вязкости от обратной температуры, и вычислить энергию активации.
7. Построить на отдельном листе график зависимости логарифма вязкости от обратной температуры и привести аппроксимирующую зависимость Зачетные результаты:
1. В книге электронных таблиц, представленной на проверку, на первой странице с названием «Результаты» должна быть представлена следующая информация:
a. В ячейке «А1» -исходная температура, в ячейке «В1» - единицы измерения;
b. В ячейке «А2» - конечная температура, в ячейке «В2» - единицы измерения;
c. В ячейке «А3» - энергия активации вязкого течения при низких температурах, в ячейке «В3» - единицы измерения;
d. В ячейке «А4» - предэкспоненциальный множитель в формуле температурной зависимости электропроводности при низких температурах, в ячейке «В4» - единицы измерения;
e. В ячейке «А5» - энергия активации вязкого течения при высоких температурах, в ячейке «В5» - единицы измерения;
f. В ячейке «А6» - предэкспоненциальный множитель в формуле температурной зависимости электропроводности при высоких температурах, в ячейке «В6» - единицы измерения;
g. Начиная с ячейки «А7» должны быть четко сформулированы выводы по работе.
В ячейках А1-А6 должны быть ссылки на ячейки на других листах книги электронных таблиц, на которых выполнены вычисления с получением представленного результата, а не сами числовые значения! При невыполнении этого требования программа проверки дает сообщение «Ошибка представления информации».
2. Правильно оформленные графики зависимостей вязкости от температуры и логарифма вязкости от обратной температуры, полученной по экспериментальным данным (точки) и аппроксимированной полиномом (линия), на отдельных листах электронных таблиц со всеми необходимыми подписями обозначениями. Контрольные вопросы
1. В каком виде находятся компоненты оксидного расплава, состоящего из СаО, Na2
O, SiO2
, B2
O3
, Al2
O3
?
2. Что называют коэффициентом вязкости?
3. Как изменится температурная зависимость вязкости шлака при добавлении в него основных оксидов?
4. В каких единицах измеряется вязкость?
5. Как определяют постоянную вискозиметра?
6. Чем определяется энергия активации вязкого течения?
7. Какова причина снижения вязкости с ростом температуры?
8. Как вычисляют энергию активации вязкого течения?
2.6 Восстановление марганца из оксидного расплава в сталь
(Работа № 18)
2.6.1 Общие закономерности электрохимического взаимодействия металла и шлака
Процессы взаимодействия жидкого металла с расплавленным шлаком имеют большое техническое значение и протекают во многих металлургических агрегатах. Производительность этих агрегатов, а также качество готового металла в значительной степени определяются скоростью и полнотой перехода тех или иных элементов через границу фаз.
Одновременное протекание значительного числа физических и химических процессов в различных фазах, высокие температуры, наличие гидродинамических и тепловых потоков затрудняют экспериментальное изучение процессов взаимодействия фаз в производственных и лабораторных условиях. Столь сложные системы исследуются с помощью моделей, которые отражают отдельные, но наиболее существенные стороны рассматриваемого объекта. В настоящей работе математическая модель процессов, протекающих на границе металл – шлак, позволяет проанализировать изменение объемных концентраций компонентов и скорости их перехода через межфазную границу в зависимости от времени.
Восстановление марганца из оксидного расплава происходит по электрохимической полуреакции:
(Mn2+
) + 2e = [Mn]
Сопутствующие процессы должны быть процессами окисления. Очевидно, это может быть процесс окисления железа
[Fe] = (Fe2+) + 2e
или примесей в составе стали, например, кремния. Поскольку четырехзарядный ион кремния не может находиться в шлаке этот процесс сопровождается образованием кремнекислородного тетраэдра в соответствии с электрохимической полуреакцией:
[Si] + 4(O2-
) = (SiO4
4-
) + 4e
Независимое протекание только одной из приведенных электродных полуреакций невозможно, т.к. это приводит к накоплению зарядов в двойном электрическом слое на границе раздела фаз, препятствующему переходу вещества.
Состояние равновесия по каждой из них характеризуется равновесным электродным потенциалом ()
(18.3)
где – стандартный потенциал,  – активности окисленной и восстановленной форм вещества, z
– число электронов, участвующих в электродном процессе, R
– универсальная газовая постоянная, F
– постоянная Фарадея, Т
– температура. – активности окисленной и восстановленной форм вещества, z
– число электронов, участвующих в электродном процессе, R
– универсальная газовая постоянная, F
– постоянная Фарадея, Т
– температура.
Восстановление марганца из шлака в металл реализуется в результате совместного протекания не менее двух электродных полуреакций. Скорости их устанавливаются такими, чтобы не происходило накопления зарядов на межфазной границе. В этом случае потенциал металла принимает стационарное значение, при котором скорости генерации и ассимиляции электронов одинаковы. Разность между фактическим, т.е. стационарным, потенциалом и его равновесным значением, называется поляризацией (перенапряжением) электрода, . Поляризация характеризует степень удаления системы от равновесия и определяет скорость перехода компонентов через границу фаз в соответствии с законами электрохимической кинетики.
С позиций классической термодинамики в системе в том или ином направлении происходят процессы восстановления марганца из шлака растворенным в железе кремнием:
 2(MnO) + [Si] = 2[Mn] + (SiO2
) Н = -590 кДж/моль 2(MnO) + [Si] = 2[Mn] + (SiO2
) Н = -590 кДж/моль
и самим растворителем (окисления марганца оксидом железа в шлаке
 (MnO) + [Fe] = [Mn] + (FeO) =. Н = 128 кДж/моль (MnO) + [Fe] = [Mn] + (FeO) =. Н = 128 кДж/моль
С позиций формальной кинетики скорость первой реакции, определяемой, например, по изменению содержания кремния в металле вдали от равновесия в кинетическом режиме должна зависеть от произведения концентраций оксида марганца в шлаке и кремния в металле в некоторых степенях. В диффузионном режиме скорость реакции должна линейно зависеть от концентрации компонента, диффузия которого затруднена. Аналогичные рассуждения могут быть сделаны и в отношении второй реакции.
Константа равновесия реакции, выраженная через активности
(18.1)
является функцией только температуры.
Отношение равновесных концентраций марганца в шлаке и металле
(18.2)
называют коэффициентом распределения марганца, который, в отличие от , зависит от состава фаз и служит количественной характеристикой распределения этого элемента между шлаком и металлом.
2.6.2 Модель процесса
В имитационной модели рассмотрены три электродные полуреакции, которые могут протекать между оксидным расплавом CaO – MnO – FeO – SiO2
– Al2
O3
и жидким железом, содержащим в качестве примесей Мn и Si. Сделано допущение о диффузионном режиме их протекания. Учтена заторможенность диффузии частиц Fe2+
в шлаке, кремния в металле, марганца в обеих фазах. Общая система уравнений, описывающая модель, имеет вид
 (18.4) (18.4)
(18.5)
(18.6)
(18.7)
(18.8)
где υј
– скорость электродной полуреакции, ηj
– поляризация, ij
– плотность предельного тока диффузии, Dj
– коэффициент диффузии, β – конвективная постоянная, Cj
– концентрация.
Программа имитационной модели позволяет решить систему уравнений (18.4) – (18.8), что дает возможность установить, как изменяется объемная концентрация компонентов и скорости их перехода со временем при взаимодействии металла со шлаком. Результаты расчета выводятся на дисплей. Информация, получаемая с экрана монитора, включает в себя графическое изображение изменения концентраций основных компонентов, их текущие значения, а также значения температуры и константы конвекции (рисунок 8).
Блок-схема программы имитационной модели взаимодействия металла и шлака представлена на рисунке 7. Программа работает в цикле, который прекращается только после истечения заданного времени моделирования (примерно 10 мин).

Рисунок 7 – Блок-схема программы имитационной модели
2.6.3 Порядок проведения работы
Изображение, генерируемое имитационной программой, представлено на рис 8 (правая панель). В верхней части панели приводятся выборочные числовые значения измеряемых величин, на графике отображены все значения, полученные в ходе моделирования процесса. В обозначениях компонентов металлического и шлакового расплавов использованы принятые литервтуре металлургической тематики дополнительные знаки. Квадратные скобки обозначают принадлежность компонента металлическому расплаву, а круглые – шлаковому. Множители при обозначениях компонентов используются только для построения графика, их не следует учитывать при интерпретации значений. Во время работы модели в каждый данный момент отображается только значение одной из измеряемых величин. Через 6 сек оно исчезает и появляется значение следующей величины. За этот промежуток времени надо успеть записать очередное значение. Для экономии времени рекомендуется неизменные цифры не записывать, например, ведущую единицу в значении температуры.
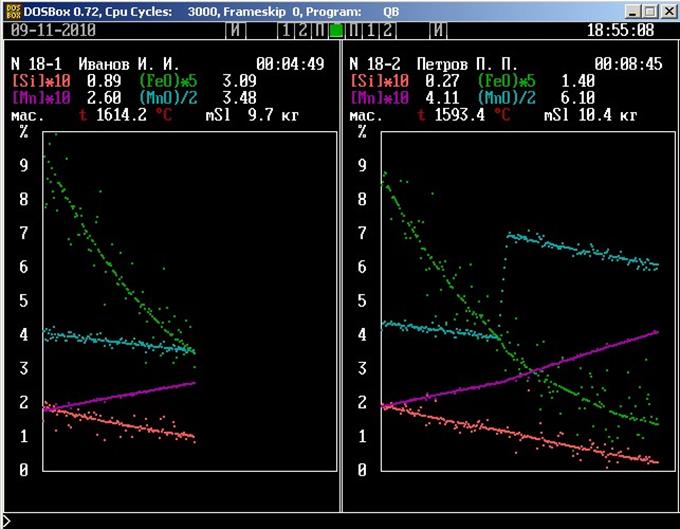
Рис 8. Изображение экрана монитора при выполнении работы № 18 на разных стадиях процессов.
Через четыре – пять минут после начала работы установки произведите добавку предварительно прогретого оксида марганца в шлак, что реализуется при одновременном нажатии клавиши Alt и цифровой клавиши на основной клавиатуре с номером Вашей установки. Порядок обработки результатов:
1. Ввести результаты ручной записи информации в файл электронных таблиц.
2. Вычислить скорости процессов перехода элементов через межфазную границу и логарифмы этих величин до и после добавки оксида марганца в шлак при массе металлического расплава 1400 кг.
3. Построить на отдельных листах графики зависимости температуры от времени, скорости перехода марганца от времени, логарифма скорости перехода кремения от логарифма концентрации кремния в металле.
4. Методом наименьших квадратов оценить кинетические характеристики процесса перехода кремния.
Зачетные результаты:
1. Правильно оформленные графики, перечисленные в предыдущем разделе, на отдельном листе электронных таблиц со всеми необходимыми подписями и обозначениями.
2. Значения порядка реакции окисления кремния до и после введения оксида марганца с указанием погрешностей.
3. Выводы по работе.
Контрольные вопросы
1. Почему возникает необходимость моделирования процессов производства стали?
2. Какова природа взаимодействия металла со шлаком и в чем это проявляется?
3. Какой потенциал называется стационарным?
4. Какой потенциал называется равновесным?
5. Что называется электродной поляризацией (перенапряжением)?
6. Что называется коэффициентом распределения марганца между металлом и шлаком?
7. От чего зависит константа распределения марганца между металлом и шлаком?
8. Какие факторы влияют на скорость перехода марганца из металла в шлак в диффузионном режиме?
Список литературы
1. Линчевский, Б.В. Техника металлургического эксперимента [Текст] / Б.В. Линчевский. – М.: Металлургия, 1992. – 240 с.
2. Арсентьев, П.П. Физико-химические методы исследования металлургических процессов [Текст]: учебник для вузов / П.П. Арсентьев, В.В. Яковлев, М.Г. Крашенинников, Л.А. Пронин и др. – М.: Металлургия, 1988. – 511 с.
3. Попель, С.И. Взаимодействие расплавленного металла с газом и шлаком [Текст]: учебное пособие / С.И. Попель, Ю.П. Никитин, Л.А. Бармин и др. – Свердловск: изд. УПИ им. С.М. Кирова, 1975, – 184 с.
4. Попель, С.И. Теория металлургических процессов [Текст]: учебное пособие / С.И. Попель, А.И. Сотников, В.Н. Бороненков. – М.: Металлургия, 1986. – 463 с.
5. Лепинских, Б.М. Транспортные свойства металлических и шлаковых расплавов [Текст]: Справочник / Б.М. Лепинских, А.А. Белоусов / Под. ред. Ватолина Н.А. – М.: Металлургия, 1995. – 649 с.
6. Белай, Г.Е. Организация металлургического эксперимента [Текст]: учебное пособие / Г.Е. Белай, В.В. Дембовский, О.В. Соценко. – М.: Химия, 1982. – 228 с.
7. Панфилов, А.М. Расчет термодинамических свойств при высоких температурах [Электронный ресурс] : учебно-методическое пособие для студентов металлургического и физикотехнического факультетов всех форм обучения / А.М. Панфилов, Н.С. Семенова – Екатеринбург : УГТУ-УПИ, 2009. – 33 c.
8. Панфилов, А.М. Термодинамические расчеты в электронных таблицах Excel [Электронный ресурс] : методические указания для студентов металлургического и физико-технического факультетов всех форм обучения / А.М.Панфилов, Н.С. Семенова – Екатеринбург : УГТУУПИ, 2009. – 31 с.
9. Краткий справочник физико-химических величин / Под. ред. А.А. Равделя и А.М. Пономарева. Л. : Химия, 1983. – 232 с.
|