| Министерство сельского хозяйства РФ
Федеральное государственное образовательное учреждение высшего профессионального образования
«Мичуринский государственный аграрный университет»
Кафедра химии
______________________________________________________________________
Утверждено методическими комиссиями: экономического факультета Протокол №1
от 12.09.2007 г факультета заочного и дистанционного обучения Протокол №3
от 03.10.2007 г
Методическое руководство к лабораторным занятиям по химии для студентов экономического факультета
по специальности:
080502 – Экономика и управление на предприятии АПК

Мичуринск - 2007
Методическое руководство к лабораторным занятиям по химии составлено к.х.н., доцентом кафедры химии Р.В. Кузнецовой
в соответствии с требованиями Государственного образовательного стандарта по дисциплине «Химия» для специальности 080502
Методическое руководство включает 9 лабораторных работ, относящихся к общетеоретической и специальной частям программы.
Рецензент
:
Н.Н. Быкова
- к.т.н., доцент кафедры химии ТГТУ
Методическое руководство рассмотрено на заседании кафедры химии МичГАУ Протокол № 8 от 21 мая 2007г.
Технический редактор – Т.И. Медведева
Отпечатано в издательско-полиграфическом центре
ФГОУ ВПО МичГАУ
Подписано в печать 3.12.07 г. Формат 60х84 1
/16
,
Бумага офсетная № 1. Усл.печ.л. 4,6 Тираж 110 экз. Ризограф Заказ №
_______________________________________________________________ Издательско-полиграфический центр
Мичуринского государственного аграрного университета
393760, Тамбовская обл., г. Мичуринск, ул. Интернациональная, 101, тел. +7 (47545) 5-55-12
E-mail: vvdem@mgau.ru
©Издательство Мичуринского государственного аграрного университета, 2007
Предисловие
Данная методическая разработка предназначена как руководство к выполнению лабораторных работ по курсу “Химия” для студентов 1-го курса экономического факультета и 2-го курса факультета заочного и дистанционного обучения.
Основой для ее составления являются:
– требования ГОС высшего профессионального образования по общим естественно-научным дисциплинам для направления “Экономика и управление на предприятии АПК ”;
– обязательный минимум образовательной программы по химии по направлению “Экономика и управление на предприятии АПК”;
Реклама

– рабочая программа по химии для направления “Экономика и управление на предприятии АПК ”, утвержденная методическим советом экономического факультета МичГАУ и факультетом заочного и дистанционного обучения.
Разработка включает 9 лабораторных работ по общетеоретической, а также по специальной частям программы, касающихся раздела «Общая и неорганическая химия».
В первом разделе настоящего руководства приведены общие правила выполнения лабораторных работ по химии, правила техники безопасности и меры по оказанию первой помощи в химической лаборатории. Второй раздел включает в себя описание работ по темам. В начале каждой работы дан минимум теоретического материала, помогающего в сознательном выполнении экспериментальных заданий, приведены основные литературные источники и вопросы для самостоятельной подготовки к занятию.
В руководство также включены задания, упражнения и задачи, которые могут быть использованы для быстрой проверки усвоения материала, для индивидуального опроса, контрольных работ и домашних заданий.
Основная цель – помочь студентам самостоятельно оценить степень усвоения на занятиях знаний по химии, лучше подготовиться к экзамену по данной дисциплине, развить у обучаемых способность анализировать, творчески мыслить и использовать фундаментальные знания в процессе решения профессиональных задач.
В конце методического руководства приведен список литературы, используемой студентом при подготовке к занятию.
I. ОБЩИЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКИХ ЛАБОРАТОРИЯХ
Студент может приступить к работе в лаборатории только после предварительной подготовки дома.
Во время работы в лаборатории студенты обязаны соблюдать следующие правила:
1. Студенту в лаборатории отводится постоянное место и он обязан поддерживать его в чистоте и порядке. После окончания работы тщательно убирать рабочее место. Все работы, за небольшим исключением, выполняются студентом индивидуально.
2. Выполнять указания преподавателей и лаборантов.
3. Необходимые для работы реактивы находятся в ящике на лабораторном столе. Студентам не разрешается оставлять реактивы на своих рабочих местах.
4. Сухие реактивы необходимо брать чистым шпателем или специальной ложечкой. При наливании растворов из склянок нужно держать этикеткой вверх во избежание ее загрязнения.
5. Все реакции проводить с такими количествами веществ, которые указаны в описании опыта. Если в руководстве не указано, какое количество необходимо взять, следует брать сухие вещества в небольших количествах, а раствор не более 1-1,5 мл.
Реклама

6. Неизрасходованные реактивы ни в коем случае нельзя высыпать или выливать обратно в склянки, их надо сдавать лаборанту.
7. Остатки дорогостоящих и ядовитых реактивов необходимо сливать в специальные склянки.
Меры предосторожности при работе в лаборатории
1 . Все опыты с ядовитыми, неприятно пахнущими веществами проводить только в вытяжном шкафу.
2. Опыты с легковоспламеняющимися веществами необходимо проводить вдали от огня.
3. Не наклоняться над нагреваемой жидкостью или сплавляемыми веществами во избежание попадания брызг на лицо.
4. Не следует вдыхать пахучие вещества и выделяющиеся газы, близко наклоняясь к сосуду с этими веществами. Струю газа от отверстия сосуда следует направить к себе легким движением руки и осторожно вдохнуть.
5. При работе с твердыми щелочами и металлическим натрием обязательно надевать защитные очки.
6. При разбавлении концентрированных кислот, особенно серной, вливать кислоту в воду, а не наоборот.
7. Пробирку при нагревании растворов в ней всегда следует держать таким образом, чтобы ее отверстие было направлено в сторону от работающего и его соседей по рабочему столу.
8. Необходимо следить за правильной работой газовых горелок и закрывать все газовые краны после окончания работы.
Оказание первой помощи в лаборатории
1 . При попадании на кожу концентрированных кислот и щелочей следует немедленно промыть сильной струей воды обожженное место, после чего наложить повязку из ваты, смоченной спиртовым раствором танина или 3% раствором перманганата калия. При сильных ожогах после оказания первой помощи следует немедленно обратиться к врачу.
2. При попадании брызг кислоты или щелочи в глаза необходимо немедленно промыть поврежденный глаз большим количеством воды комнатной температуры, после чего сейчас же обратиться к врачу.
3. При ожоге кожи горячими предметами наложить сначала повязку из спиртового раствора танина или раствора КМД, а затем жирную повязку (мазь от ожогов).
4. При отравлении хлором, бромом, сероводородом, оксидом углерода (П) необходимо вынести пострадавшего на воздух, а за тем обратиться к врачу.
5. При отравлении соединениями мышьяка, ртути и цианистыми солями необходимо немедленно обратиться к врачу.
II. ЛАБОРАТОРНЫЙ ПРАКТИКУМ.
Лабораторная работа 1.
Тема: ПРИГОТОВЛЕНИЕ РАСТВОРОВ ЗАДАННОЙ
КОНЦЕНТРАЦИИ
Контрольные вопросы:
1. Что называется раствором?
2. От чего зависит растворимость веществ?
3. Что называется коэффициентом растворимости?
4. Что понимается под концентрацией растворов?
5. Каковы способы выражения концентрации растворов?
6. Может ли концентрированный раствор быть ненасыщенным, а насыщенный раствор разбавленным?
7. Что такое плотность растворов?
8. Как рассчитать относительную и абсолютную ошибки?
9. Чему равна плотность воды?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Раствором
называется однородная (гомогенная) система переменного состава, состоящая из растворителя, растворенного вещества и продуктов их взаимодействия.
Растворителем
считают то вещество, которое при данных условиях находится в том же агрегатном состоянии, что и раствор.
Наиболее распространены водные растворы. В них растворителем является вода.
Растворимость вещества
– это способность вещества растворяться в том или ином количестве растворителя при данных условиях.
Растворимость веществ зависит от природы растворенного вещества и растворителя, температуры и давления (для газообразных веществ).
По растворимости все вещества делятся на:
1. растворимые (растворимость > 1 г в 100 г растворителя),
2. малорастворимые (растворимость < 1 г, но > 0,01 г в 100 г растворителя),
3. нерастворимые (растворимость < 0,01 г вещества на 100 г растворителя).
В зависимости от способности вещества растворяться в данном растворе, растворы делятся на:
1. насыщенный -
раствор, в котором данное вещество при данных условиях больше не растворяется.
2. ненасыщенный
- раствор, в котором содержание вещества при данных условиях меньше, чем в насыщенном.
3. пересыщенный
- раствор, в котором содержание вещества при данных условиях больше, чем в насыщенном.
Концентрацией раствора
называется количество растворенного вещества, содержащееся в определенном количестве раствора или растворителя.
Существуют различные способы выражения концентрации раствора:
1. Массовая доля концентрации
(процентная) – определяется числом граммов растворенного вещества, содержащегося в 100г раствора.
Массовую долю выражают обычно в долях единицы или в процентах (0,2 или 20%). Если массовая доля растворенного вещества, например, хлорида натрия равна 0,2 или 20%, то это означает, что в 100г данного раствора содержится 20г хлорида натрия и 80г воды.
2. Молярная концентрация
(молярность) определяется числом молей растворенного вещества, содержащихся в 1 литре раствора
.
Например, молярный раствор едкого калия содержит 56г KOH в литре раствора, а молярный раствор серной кислоты содержит 96г H2
SO4
в литре раствора. Если в литре раствора содержится 2 или 0,1 мольных масс серной кислоты, то концентрация таких растворов соответственно двумолярна -2М или децимолярна – 0,1М. Молярность обозначается буквой М. Размерность молярной концентрации – моль/литр.
3. Эквивалентная концентрация
(нормальность) определяется числом эквивалентов растворенного вещества, содержащихся в 1л
раствора
.
Например, нормальный раствор едкого калия содержит 56г KOH в литре, а нормальный раствор серной кислоты 49г H2
SO4
в литре раствора. Нормальность обозначается буквой N или Н. Если в 1 литре содержится 2 эквивалента серной кислоты, то такой раствор называется двунормальным (2 N или 2Н раствор), если содержится 0,01 эквивалент – сантинормальный раствор (0,01N или 0,01Н раствор). Размерность нормальной концентрации – экв/литр.
Для приготовления нормальных растворов необходимо уметь находить величину эквивалентов растворенного вещества.
4. Моляльная концентрация
(моляльность) раствора определяется количеством молей растворенного вещества, содержащихся в 1 кг растворителя.
Если в 1 кг или в 1000г воды содержится 2 моля серной кислоты, то концентрация такого раствора – двумоляльная. Размерность моляльной концентрации – моль/г. Моляльность обозначается буквой m.
От концентрации зависит плотность растворов.
Плотность (ρ) – показывает массу 1 мл или 1см в граммах.
Например: ρ (Н2
O) =1г/мл, т.е. 1мл имеет массу 1г.
ρ (H2
SO4
) = 1,84г/мл, это значит, что 1 мл H2
SO4
имеет массу 1,84г.
Каждому значению ρ (ро) соответствует массовая доля растворенного вещества, например:
ρ (H2
SO4
)=1,84г/мл соответствует 95,6%-ному раствору H2
SO4
ρ (HCl) = 1,200г/мл соответствует 39,11%-ному раствору HCl плотность в задачах указывается для пересчета от массы (m ) к объему (V) и наоборот:
r
=  m
m =
r *V V = m
m =
r *V V =
 m m
V
r
С повышением концентрации (для большинства веществ) плотность растворов возрастает. С повышением температуры плотность растворов несколько уменьшается.
ЭКСПЕРИМЕТАЛЬНАЯ ЧАСТЬ
Задание 1:
Приготовить раствор с заданной концентрацией из имеющегося в лаборатории раствора с большей концентрацией и воды.
Ход работы:
I. Определение концентрации исходного раствора сульфата
аммония
.
Для этого в мерный цилиндр (250 мл) налить исходный раствор, не доливая до краев 3-4 см, и определить с помощью ареометра его плотность, а затем по таблице 1 или по графику зависимости плотности раствора от его концентрации найти соответствующую ей процентную концентрацию. Для определения плотности в мерный цилиндр с раствором осторожно погрузить ареометр. По шкале ареометра определить деление, совпадающее с уровнем жидкости по нижнему мениску (отсчет ведется сверху по шкале ареометра). Значение этого деления соответствует плотности заданного раствора сульфата аммония. По таблице находим концентрацию этого раствора.
Таблица 1– Зависимость концентрации сульфата аммония от плотности раствора
| ρ,г/см3
|
ω, %
|
ρ,г/см3
|
ω, %
|
ρ,г/см3
|
ω, %
|
ρ,г/см3
|
ω, %
|
| 1,004
|
1
|
1,057
|
10
|
1,115
|
20
|
1,166
|
29
|
| 1,010
|
2
|
1,064
|
11
|
1,121
|
21
|
1,172
|
30
|
| 1,016
|
3
|
1,069
|
12
|
1,127
|
22
|
1,178
|
31
|
| 1,022
|
4
|
1,081
|
14
|
1,133
|
23
|
1,184
|
32
|
| 1,028
|
5
|
1,087
|
15
|
1,138
|
24
|
1,190
|
33
|
| 1,034
|
6
|
1,092
|
16
|
1,144
|
25
|
1,196
|
34
|
| 1,040
|
7
|
1,098
|
17
|
1,150
|
26
|
1,202
|
35
|
| 1,046
|
8
|
1,104
|
18
|
1,156
|
27
|
1,228
|
40
|
| 1,052
|
9
|
1,110
|
19
|
1,160
|
28
|
1,282
|
50
|
II. Расчет количества (NH4
)2
SO4
, необходимого для приготовления
250 мл …. процентного раствора (по заданию преподавателя).
Пользуясь диагональной схемой подсчитать необходимые массовые количества исходного раствора и воды.
Например: необходимо приготовить 250 г 12% раствора из 20% исходного раствора (р == 1,148 г/мл) 20% 12 г (12-0) исходного вещества
\ /
12 %
/ \
О 8г (20-12) Н2
0
Из схемы следует, что при смешении 12 г исходного раствора с 8 г воды получили 20 г 12%-ного раствора. Для приготовления 250 г заданного раствора потребуется исходного раствора значительно больше, а именно по пропорции;
20 г 12%-ного раствора содержит 12 г исходного
250 г Х г
12 .
250
Х = 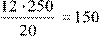 г г
Следовательно, нужно взять 150 г исходного раствора и добавить к нему 100 г воды (250 - 150 = 100 г), смешать и получится 250 г 12 % раствора.
Удобнее брать не массовые, а объемные количества жидкостей. Используя значения плотностей, можно подсчитать соответствующие массам объемы:
V1
=  150
= 132 мл
20%-ного раствора 150
= 132 мл
20%-ного раствора
1,148
V2
= 100
 =100мл
воды =100мл
воды
1
V общ.= V1 + V2
III. Приготовление 250 г заданного раствора.
Рассчитанные объемы исходного раствора и воды отмерить мерным цилиндром, слить и перемещать.
Определить с помощью ареометра плотность приготовленного раствора и по графику определить соответствующую ей процентную концентрацию.
Ошибка не должна быть более ± 2% от задания.
IV. Расчет абсолютной и относительной ошибки опыта.
Абсолютная ошибка измерения определяется как разность теоретического значения и практического значения, полученного в опыте:
∆ абс. = ω (теор.) – ω (практич.)
Разность берется по абсолютной величине, так как ошибка не может быть отрицательной.
Относительной ошибкой измерения называют отношение абсолютной ошибки к теоретическому значению, выражается в процентах:
Δ отн.
=  ∆
абс
.
⋅100% w
(теор
.) ∆
абс
.
⋅100% w
(теор
.)
Задание 2.
Приготовить раствор с заданной концентрацией из растворов с большей и меньшей концентрацией
(используя приготовленные растворы студентов группы по заданию преподавателя)
Ход работы:
1) С помощью ареометра определить плотность исходных растворов, а по графику зависимости плотности раствора от концентрации определить концентрации исходных растворов. Записать результаты, полученные в 1 задании соседним звеном и использовать их при дальнейших расчетах.
2) Пользуясь диагональной схемой определить необходимые массовые количества исходных растворов.
3) Используя значения плотностей исходных растворов подсчитать необходимые объемные количества исходных растворов.
4) Смешать рассчитанные объемы растворов.
5) Проверить правильность выполнения работы, измерив плотность приготовленного раствора и определив по графику соответствующую ей концентрацию.
6) Вычислить ошибки.
Задание 3.
Приготовить раствор с заданной концентрацией из растворителя (воды) и растворяемого вещества (сухого).
Ход работы:
1. Рассчитать необходимую массу растворяемого вещества по формуле:
w
=  m
(в
− ва
) ⋅100% m
(р
− ра
) m
(в
− ва
) ⋅100% m
(р
− ра
)
m (в-ва) = ω .
m (р-ра) .
100%.
2. Рассчитать необходимый объем воды.
Массу воды определяем по формуле: m (Н2
0) = m (р-ра) - m (в-ва).
Т.к. плотность раствора воды равна 1 г/мл, V(H2
О) == m (Н2
0)/1.
3. На технических весах взвесить массу растворяемого вещества, навеску перенести в химический стакан на 500 мл. Мерным цилиндром отмерить нужный объем воды. В химический стакан к растворяемому веществу прилить отмеренный объем воды и перемешать до полного растворения.
4. Определить процентную концентрацию полученного раствора с помощью ареометра и графика зависимости плотности раствора от его концентрации.
Задания:
1. Сколько граммов соли и воды содержится в 800г 12%-ного раствора KCl .
2. К 500г 20%-ного раствора HCl прилили 200г H2
O. Определить концентрацию нового раствора.
3. Из 800г 8%-ного раствора K2
SO4
выпарили 300г воды. Определить концентрацию нового раствора.
4. В сельском хозяйстве для борьбы с вредителями часто используют раствор медного купороса CuSO4
*5H2
O. Сколько кг медного купороса CuSO4
*5H2
O и воды надо взять для приготовления 200кг
5%-ного раствора?
5. Определить молярную, нормальную (эквивалентную) концентрации 47,7%-ного раствора ортофосфорной кислоты H3
PO4
, ρ = 1,315г/мл.
6. Смешали 10мл 10%-ного раствора HNO3
(ρ = 1,056) и 100мл 30%-ного раствора HNO3
(ρ = 1,184). Вычислить концентрацию полученного раствора.
7. Какой объем 10%-ного раствора карбоната натрия
(ρ = 1,105г/см) требуется для приготовления 5л 2%-ного раствора (ρ = 1,02г/см)?
8. На нейтрализацию 31мл 0,16н раствора щелочи требуется 217мл раствора H2
SO4
. Чему равна нормальность раствора H2
SO4
?
9. Какой объем 0,3н раствора кислоты требуется для нейтрализации раствора, содержащего 0,32г NaOH в 40мл?
10. На нейтрализацию 1л раствора, содержащего 1,4г KOH, требуется 50см раствора кислоты. Вычислите нормальность раствора кислоты.
Лабораторная работа № 2.
Тема: ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
ГИДРОЛИЗ СОЛЕЙ.
Контрольные вопросы:
1. Что называется электролитической диссоциацией?
2. Что показывают степень диссоциации и константа диссоциации?
З. Что такое сильные и слабые электролиты? Приведите примеры.
4. Что называется ионным произведением воды?
5. Что такое водородный показатель? И по какой формуле его можно рассчитать?
6. Дайте определение кислотам, солям и основания с точки зрения теории электролитической диссоциации.
7. Что называется гидролизом соли?
8. Какие факторы оказывают влияние на степень гидролиза?
9. Какие соли подвергаются гидролизу? Какова реакция среды при этом?
10. Почему при взаимодействии некоторых солей с водой образуются слабые электролиты, ведь вода является более слабым электролитом, чем образующиеся соли?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Процесс распада электролита на ионы в водных растворах иkb расплавах называется электролитической диссоциацией
.
Для количественной характеристики электролитической диссоциации введено понятие степень диссоциации (
α),
которая равна отношению количества вещества электролита распавшегося на ионы(N), к общему количеству вещества(n) этого электролита, введенного в раствор:
a
=  N
n N
n
Степень диссоциации – безразмерная величена, ее выражают в долях единицы или в процентах. Она зависит от концентрации электролита и температуры: чем меньше концентрация электролита в растворе, тем больше степень диссоциации. С повышением температуры степень диссоциации увеличивается. В зависимости от степени диссоциации различают сильные, средние и слабые электролиты.
Сильные (α >30%): все щелочи (NаОН, КОН, и т.д.), Ва(ОН)2
, Са(ОН)2
, сильные кислоты(H2
S04
, HN03
,НС1, НВr, HJ, НМп04
, НСl0З
, НС104
), почти все растворимые соли.
Средние (3%<α<30%): HF
Слабые (α <3%); почти все органические кислоты , Н2
СО3
, Н2
S ,
НNО2
, НСlО, Н2
SiО3
, Си(ОH)2
, Fе(ОН) 3
, NН4
ОН и др.
С точки зрения теории электролитической диссоциации:
Кислоты
- это электролиты, при диссоциации которых в водных растворах образуются катионы только одного типа - гидратированные ионы водорода.
Число ионов водорода, которое может образоваться при распаде одной молекулы кислоты, определяет основность кислоты.
Например:
НС1 D Н +
+ С1-
; НС1О D Н +
+ С1О-
– одноосновные.
Двух- и многоосновные кислоты диссоциируют ступенчато, постепенно отщепляя ионы водорода.
Например:
Н2
SОЗ
D H+
+ НSОз-
НSОЗ
-
D H+
+ SОЗ
2-
Основания
– электролиты, которые в водных растворах диссоциируют с образованием анионов только одного типа - гидроксид- ионов.
Число гидроксид – ионов, которое образуется при распаде одной молекулы определяет кислотность основания.
Например:
NaOHD Na+
+ OH-
KOH D K +
+ OH-
- одноосновные .
Двух- и трехкислотные основания диссоциируют ступенчато,
т.е. постепенно отщепляют гидроксид - ионы. Например:
Са(ОН)2
D СаОН +
+ ОН-
СаОН-
D Са2-
+ ОН-
Гидроксиды некоторых металлов могут диссоциировать по механизму диссоциации оснований и по механизму диссоциации кислот.
Например, диссоциация гидроксида цинка может протекать так: основной механизм: Zn(ОН)2
D ZnОН+
+ + ОН-
ZnОН-
D Zn2+
+ ОН-
кислотный механизм:
Zn(ОН)2
+2Н2
O D 2Н +
+ [Zn(ОН)4
] 2-
Вещества, которые при диссоциации образуют как ионы водорода, так гидроксид – ионы называются амфотерными соединениями
или амфолитами.
Соли
– это электролиты, при диссоциации которых образуются катионы металлов (аммония NН4
+
или другие комплексные ионы) и анионы кислотных остатков, например:
NaNОЗ
D Na+
+ NO3
-
NН4
С1 D NН4
+
+ Сl-
Средние соли диссоциируют практически полностью. Диссоциация кислых и основных солей протекает ступенчато. Например:
КН2
Р04
D К+
+ Н2
Р04
-
Н2РO4- D Н++НР042- НРO42- D Н++РO43- Са(ОН)С1 D СаОН+
+ С1-
СаОН+
D Са2+
+ ОН-
Теория электролитической диссоциации признаёт, что все реакции в водных растворах электролитов являются реакциями между ионами. Реакции в водных растворах электролитов изображаются в виде ионных уравнений.
При составлении ионных уравнений реакций следует для малодиссоциированных веществ, выпадающих в осадок и газообразных веществ указывать молекулярные формулы. Эти реакции протекают с большой скоростью необратимо.
Пример:
FеС13
+ 3NаОН = Fе(ОН)3
↓ + 3NаС1
Fе3+
+ 3C1-
+ 3Nа+
+ 2OН-
= Fе(ОН)3
↓|+ 3Nа +
+ 3С1-
Fe3+
+ 3OH-
= Fе(ОН) 3
↓
Гидролизом
называется обратимое взаимодействие ионов соли с водой, приводящее к образованию слабого
электролита.
Различают 4 случая гидролиза солей:
1) Соль образована слабой кислотой и сильным основанием
.
Гидролиз происходит по аниону.
Анион связывает протон, образуя слабый электролит. При гидролизе многозарядных ионов получаются кислые соли.
Уравнение гидролиза соли можно написать так:
СНзСООNa D СНЗ
СОО -
+ Nа +
СНЗ
СОО- + НОН D СНЗ
СООН + ОН-
СНЗ
СОО-
+ Nа+
+ НОН DСНЗ
СООН + Nа+
+ОН – СНЗ
СООNа + НОН D СНЗ
СООН + NаОН
В растворе создается избыток ОН - ионов, а потому раствор приобретает щелочную реакцию, рН > 7
2) Соль образована сильной кислотой и слабым основанием
. Гидролиз происходит по катиону
– катион связывает гидроксид – ионы, образуя слабый электролит. При гидролизе многозарядных ионов получаются основные соли.
Уравнение гидролиза соли можно написать так:
СаС12
D Са2+
+ 2С1-
Са2+
+НОН D СаОН+
+ Н+
Са2+
+ 2С1-
+ НОН D СаОН +
+ 2С1-
+ Н+
СаС12
+ НОН D СаОНСl + НС1
В растворе создается избыток Н + - ионов, а потому раствор приобретает кислую реакцию рН < 7
3) Соль образована слабой кислотой и слабым основанием
. Гидролиз происходит по аниону и катиону
. Уравнение гидролиза записывается так:
СНЗ
СООNН4
D СНЗ
СОО-
+ NН4
+
СНЗ
СОО-
+ NH4
+
+ НОН D СНЗ
СООН + NН4
ОН
В этом случае одновременно связываются Н + и ОН - ионы воды. При этом рН водных растворов солей будет больше, равно или меньше 7 т.е. реакция раствора будет определяться константой диссоциации кислоты и основания, которыми образована соль.
4) Соль образована сильной кислотой и сильным основанием.
Соль в этом случае гидролизу не подвергается.
Последовательность действий при составлении уравнений гидролиза солей:
1. Составить уравнение диссоциации соли.
2. Выяснить, по какому иону идет гидролиз.
3. Составить для этого иона уравнение реакции взаимодействия с водой (сокращенное ионное уравнение гидролиза).
4. Составить полное ионное уравнение гидролиза.
5. Записать уравнение гидролиза в молекулярном виде.
Например: Составить уравнение гидролиза хлорида меди:
1. CuCl2
D Cu2+
+ 2Cl-
2. Соль образована слабым основанием, сильной кислотой, значит, гидролиз идет по катиону.
3. Cu 2+
+ H2
O D CuOH+
+ H+
4. Cu2+
+ 2Cl-
+ H2
O D CuOH+
+2Cl-
+ H+
5. CuCl2
+ H2
O D CuOHCl + HCl
С увеличением температуры гидролиз увеличивается, с ростом концентрации соли – уменьшается. Значит, чтобы усилить гидролиз соли необходимо разбавить и нагреть раствор данной соли.
Степенью гидролиза
называют отношение числа гидролизованных ионов (n) к общему числу данных ионов в растворе (N);
a
г
=  n n
N
Константа гидролиза
– отношение произведения концентрации продуктов гидролиза к концентрации иона, который подвергается гидролизу.
С ростом температуры константа гидролиза увеличивается.
Константа гидролиза не зависит
от концентрации веществ, участвующих в гидролизе. Например:
NH4
Cl D NH4
+
+ Cl-
NH4
+
+ H2
O D NH4
OH + H+
NH4
+
+ Cl-
+ H2
O D NH4
OH + HCl
[NH4
OH] .
[H+
]
Kг
= ____________________
[NH4
+
]
Так как концентрация [NH4
OH] = [H+
] можно записать
[H+
]2
= Kг
.
[NH4
+
], отсюда [H+
] = √ Kг
.
[NH4
+
]
Рассчитав концентрацию ионов водорода, можно точно определить рН среды.
Гидролиз солей (по катиону или аниону) происходит потому, что вода, хотя и является слабым электролитом, но в очень малой степени диссоциирует на ионы:
H2
O D H+
+ OH-
Молярные концентрации этих ионов называют – ионным произведением воды
и обозначают так:
[H+
] .
[OH-
] = KH2O
= Кв
и
При t = 25о
С Кв
= [H+
] .
[OH-
] = 1,8 .
10-16
.
55,56 = 10-14
Для чистой воды [H+
] =[OH-
] = √ Кв
= 10-7
моль/л
Чтобы избежать неудобств, связанных с применением чисел с отрицательными показателями степени, концентрацию водородных ионов принято выражать через водородный показатель и обозначать символом рН.
Водородным показателем
рН называют десятичный логарифм концентрации ионов водорода, взятых с обратным знаком:
рН = - ℓg[H+
]
Гидроксильным показателем
рОН называют десятичный логарифм концентрации ионов гидроксила, взятых с обратным знаком:
рОН = - ℓg[OH-
]
рН + рОН = рК H2O
при t = 25о
С рН + рОН = 14
Гидролиз имеет большое значение и широкое практическое применение. В живых организмах протекает гидролиз полисахаридов, белков и других органических соединений. Растущая быстрыми темпами гидролизная промышленность вырабатывает из непищевого сырья (древесины, хлопковой шелухи, соломы) ряд ценных продуктов: этиловый спирт, белковые дрожжи, глюкозу, скипидар, метиловый спирт, лигнин и др.
Гидролиз солей (например, NаЗ
Р04
, К2
СОЗ
) применяют для очистки воды и уменьшения её жёсткости. В результате гидролиза минералов - алюмосиликатов - происходит разрушение горных пород. На процессе гидролиза основаны важные химические производства; гидролиз древесины, осахаривание крахмала, получение мыла и многие другие.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Образование нерастворимого осадка
К раствору хлорида железа (III)прилить немного раствора едкого натра. К раствору нитрата свинца прилить раствор йодида калия, к раствору хлорида бария прилить раствор серной кислоты. Написать молекулярные и ионные уравнения проведённых реакций.
Опыт 2. Образование газообразных малодиссоциирующих
веществ
Налить в пробирку раствор карбоната натрия и добавить немного серной кислоты. Написать молекулярное и ионное уравнение реакции. Какие ионы и почему исчезают из раствора?
Опыт 3. Связывание одного из ионов электролита за счет
образования мало диссоциирующего вещества
Налить в пробирку несколько мл, 0.1 N раствора гидроксида натрия и 3-4 капли фенолфталеина. Наличием каких ионов обусловлено появление малинового окрашивания? Добавить в пробирку кристаллический хлорид аммония и хорошо встряхнуть. Написать в молекулярной и ионной форме уравнения реакции между гидроксидом натрия и хлоридом аммония и объяснить, почему окраска фенолфталеина почти исчезает при добавлении хлорида аммония.
Опыт 4. Гидролиз солей. Реакция среды при гидролизе
Взять в отдельные чистые пробирки немного растворов следующих солей: карбоната натрия, гидрокарбоната натрия, буры, нитрата аммония, сульфата калия, сульфат алюминия. По индикаторной бумажке определить для каждого раствора реакцию среды . Написать соответствующие молекулярные и ионные уравнение реакций гидролиза .
Опыт 5. Влияние температуры на гидролиз
Налить в пробирку немного раствора ацетата натрия и добавить 1-2 капли раствора фенолфталеина. Нагреть смесь почти до кипения и отметить изменение окраски. Охладить пробирку . Чем объясняется постепенное изменение окраски при нагревании и охлаждении? Написать молекулярное и сокращенное ионное уравнение реакции гидролиза соли.
Опыт 6. Полный гидролиз
К раствору сульфата алюминия в пробирке прилить раствор карбоната натрия. Наблюдать выделение углекислого газа и выпадение осадка гидроксида алюминия. Какие условия в данном случае способствовали полноте гидролитического разложения карбоната алюминия.
Проделать аналогичный опыт с раствором сульфата меди (II). Образующийся зелёный осадок принадлежит гидрокоокарбонату меди. Написать молекулярные и ионные уравнения реакции.
Задания:
Напишите ионные (полные и сокращенные) и молекулярные уравнения реакций гидролиза солей. Укажите реакцию среды в растворе соли.
1. Карбонат калия; сульфат алюминия.
2. Цианид натрия; сульфат меди.
3. Сульфид натрия; хлорид магния.
4. Хлорид аммония; нитрат меди.
5. Сульфид калия; хлорид железа (III).
6. Карбонат аммония; нитрат калия.
7. Фосфат калия; хлорид цинка.
8. Фторид натрия; нитрат магния.
9. Силикат калия; сульфат железа (II).
10. Сульфид кальция; сульфат аммония.
11. Карбонат натрия; нитрат хрома (III).
12. Иодид аммония; сульфид бария.
13. Фосфат аммония; сульфат магния.
14. Нитрат алюминия; ацетат натрия.
15. Силикат аммония; сульфат цинка.
Лабораторная работа № 3.
Тема: «КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ»
Контрольные вопросы
1. Какие соединения называются комплексными?
2. Что такое константа нестойкости комплексного иона?
3. Что такое комплексообразователь?
4. Что такое лиганды?
5. Что такое координационное число комплекcообразователя ?
6. На какие ионы диссоциируют следующие комплексные соединения: K2
[PtCl6
], K2
[HgI4
], Na2
[Co(SCN)4
]?
7. Как рассчитать заряд комплексного иона?
8. Какие различают виды изомерии комплексных соединений?
9. Приведите классификацию комплексных ионов.
10. Как дают названия комплексным соединениям?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Комплексными
называются соединения, образующие комплексные ионы, способные существовать как в растворе, так и в кристалле:
[Ag(NH3
)2
]Cl ↔ [Ag(NH3
)2
]+
+ Cl-
Комплексные соединения – это соединения, характеризующиеся наличием хотя бы одной ковалентной связи, возникшей по донорноакцепторному механизму.
В основе классических представлений о строении молекул комплексных соединений лежит координационная теория, созданная А.Вернером.
Суть теории можно свести к следующим положениям:
1) центральное место в комплексном соединении занимает комплексообразователь - обычно положительно заряженный ион (чаще всего металл).
2) вокруг комплексообразователя расположены (координированы) лиганды (старое название аденды), т.е. ионы противоположного знака или нейтральные молекулы.
3) комплексообразователь и лиганды образуют внутреннюю сферу комплексного соединения.
4) ионы, не вошедшие во внутреннюю сферу, составляют внешнюю сферу комплексного соединения.
По общепринятым обозначениям внутренняя сфера отделяется от внешней квадратными скобками. Так комплексное соединение Fе(СN)з *ЗКСN может быть изображено:
┌ СN- ┐
К+ СN- СN-
K+ Fe+
K+ СN- СN-
└ CN- ┘
Число, показывающее, сколько лигандов удерживает комплексообразователь, называют координационным числом. В приведённом примере оно равно 6.
Для написания формулы комплексного соединения надо знать:
1) заряд (степень окисления) комплексообразователя. 2) заряд лигандов.
3) координационное число.
4) ионы внешней сферы.
Типичными комплексообразователями является катионы d - элементов периодической системы Д.И.Менделеева. Это Аg+
, Аи+
, Си2+
, Сd2+
, Zn2+
и др.
Важнейшими лигандами являются:
а) нейтральные молекулы: Н2
0,NНз
, NО,СО и др.
б) анионы СN-
; NО2
-
; и др.
Координационные числа чаще всего имеют значение 6 и 4 , реже
2 и 8 .
Некоторые комплексные соединения не имеют внешней сферы - у них отрицательный заряд ионов, входящих во внутреннюю сферу, равен положительному заряду комплексообразователя. Это
[Рt(NНз)С14
] , [Со(NНз)С13
] и многие другие.
Чтобы написать формулу комплексного иона, Аu3+
(коорд. число 2) и лиганда СN-
надо написать Аи, рядом лиганд (дважды) и затем определить заряд комплексного иона.
В примере заряд иона [Аu(СN)2
] равен (+3) + (-2)= +1. Формула комплексного иона [АuСN)2
]+
Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов.
Первую рациональную номенклатуру комплексных соединений предложил А.Вернер; она с небольшими изменениями применяется и в настоящее время.
Всегда сначала называют анион (в именительном падеже), а затем катион (в родительном падеже).
Если в соединение входит комплексный катион, то в нем сначала называют лиганды - нейтральные молекулы, входящие в комплекс При этом аммиак называют аммин, воду - аква, если лигандов несколько то сначала называют их число на греческом языке : 2 - ди, 3 - три, 4 - тетра, 5 – пента, 6 - гекса. Следующими называют лиганды - ионы входящие в комплекс (обычно остатки кислот), добавляя к ним окончание "о". Например: циано (СN-
), нитро (N02
-
), хлоро (Сl-
), гидроксо (OH-
), тио (S2-
), родано или тиоционато (SСN-
), оксалато (C2
O4
2-
) и т.д. Наконец, следует название комплексообразователя (русское название элемента). В скобках показывают его степень окисления.
Например:
[Аg(NНз)2]С1 - хлорид диамминсеребра (I)
[Р1С1(NНз)5
]С1з - хлорид пентаамминхлорплатины (IV)
[Сu(NНз)4
]S04
- сульфат тетраамминмеди (II)
Если в соединение входит комплексный анион, то также сначала называют лиганды - нейтральные молекулы, затем лиганды - ионы с введением в наименование греческих числительных . После этого называют комплексообразователь, используя латинское название элемента с добавлением слога -ат , в скобках указывают степень его окисления. Наконец называют катион внешней сферы в родительном падеже.
Например:
К[Аg(СN)2
]-дицианоаргентант (I) калия.
NН4
[Сr(SCN)4
(NH3
)2
] - диаммингетратиоцианохромат (III) аммония.
Название нейтральных комплексов составляют из названий лигандов и обычных русских названий центральных атомов в именительном падеже. При этом указание степени окисления опускается.
Например:
[РtС14
(NН3
)2
] – диамминтетрахлорплaтина
[Со(N02
)3
(NН3
)3
]-триамминтринитрокобальт.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Различие в свойствах двойной и комплексной солей
.
Двойные соли – соединения с малоустойчивой внутренней сферой. Константа нестойкости их имеет большую величину.
Двойные соли в отличие от комплексных диссоциируют в водном растворе на простые ионы, например:
КА1(S04
)2
<==> К + Аl3+
+ 2S04
2-
Опыты; б; в; доказывают это.
а) В три чистые пробирки влить по 2-3 мл раствора железоам-
монийных квасцов NН4
Fе(S04
)2
*12Н2
0.
В первую пробирку прилить немного раствора хлорида бария, во вторую – раствора гидроксида натрия и нагреть до появления запаха, в третью – раствора роданида калия КSСN . Обратить внимание на появление белого осадка при добавлении хлорида бария (качественная реакция на сульфат - ион), выделение NН3
(по запаху, качественная реакция на ион аммония) и появление кровавой окраски в третьей пробирке Fе3+
)
Составить ионные уравнения этих качественных реакций и написать уравнение диссоциации исходной двойной соли.
б) В две пробирки влить немного раствора роданида калия - КSСN. В первую пробирку прилить раствор соли хлорида железа (III), во вторую – раствор красной кровяной соли К4
[Fе(СN)6
]. На что указывает появление кровавой окраски в первой пробирке и отсутствие ев во второй?
в) К раствору красной кровяной соли – К3
[Fе(СN)6
] прилить рас-
твор соли сульфата железа (II), а к раствору желтой кровяной соли - К4
[Fе(СН)6
] раствор хлорида железа (III).
Отметить образование и цвет осадков.
Написать уравнения реакции в молекулярном и ионном виде.
Объяснить различие в диссоциации двойных и комплексных солей.
Опыт 2. Получение аммиакатов.
Аммиакаты – комплексные соединения, содержащие в качестве лигандов молекулы аммиака.
К растворам солей серебра и меди в отдельных пробирках добавить (постепенно) раствор аммиака. Обратить внимание на цвет осадков гидроксидов. Полученные осадки растворить в избытке раствора аммиака, при этом образуются комплексные ионы: [Аg(NН3
)2
]+
[Cu(NН3
)4
]2+
Написать уравнения реакции в молекулярном и ионном виде.
К раствору аммиаката серебра добавить азотную кислоту, наблюдать появление осадка и разрушения комплексного соединения.
Опыт 3. Получение гидроксосолей.
Гидроксосоли – комплексные соединения, содержащие в качестве лигандов гидроксогруппу. Они образуются при растворении соответствующих гидроксидов в щелочах.
К растворам солей цинка, алюминия и хрома(III) в отдельных пробирках прилить раствор щёлочи до растворения первоначальных осадков. Образующиеся растворимые комплексные соединения содержат ионы:
(Zn(ОН)4
]2+
; [А1(ОН)4
]+
; [Сr(ОН)6
]3-
Написать уравнения протекающих реакций в молекулярной и ионной форме
Опыт 4. Внутрикомплексные соединения.
(хелаты или клешневидные).
Внутрикомплексные – это соединения в которых центральный атом (комплексoобразователь) образует связи с лигандами одновременно двумя способами - как за счёт неспаренных электронов, так и по донорно - акцепторному механизму.
В пробирку влить раствор хлорида железа (III) и добавить немного раствора гидроксида натрия. Что образуется? Добавить в эту пробирку раствор щавелевой кислоты до растворения осадка т.е. образования внутрикомплексного соединения состава Н3
[Fе(С2
04
)3
] . К полученному раствору добавить раствор роданида калия. На что указывает отсутствие кроваво-красного окрашивания?
Написать уравнение реакции образования этого внутрикомплексного соединения.
Задания:
1. Вычислите заряды следующих комплексных ионов с комплексообразователем хромом (Ш): [Сr (H2
0)4
C12
] , [Cr (NH3
)N03
] . 2. Вычислите заряд комплексообразователей в следующих комплексных ионах: [PtCl3
(N02
)]2-
, [PtCl(NH3
)5
]3+
, [Со(NO2
)4
(NH3
) 2
]-
3. Пользуясь таблицей констант нестойкости определите, в каких случаях произойдет взаимодействие между растворами электролитов. Напишите молекулярные и ионные уравнения. а) [Ag(NH3
)2
]NO3
+ NaNO2
=
б) K2
[HgBr4
] + KCN =
в) K[Ag(NO2
)2
] + NH4
OH =
г) Nа3
[Аg(S2
Оз)2
] + KCN =
4. Напишите координационную формулу комплексного соединения, состав которого CoCl3
-4NH3
, если:
а) при действии AgNO3
осаждается только 1/3 содержащегося в нейхлора;
б) при действии AgNO3
осаждается весь имеющийся хлор.
5. Составить формулы комплексных ионов с обозначением их зарядов:
а) для иона Аg+
, с координационным числом 2 и лигандами: NН3
; СN-
;
б) для иона Аи3+
, c координационным числом 4 и лигандами: С1-
; СN-
; NН3
6. Указать комплексный ион и его заряд в следующих комплексных соединениях:
К[Сu(СN)2
]; [Сu(Н2
О)4
]S04
; К3
[Со(N02
)6
]; [Zп(NН3
)4
]С12
;
[СrNН3
)6]С13
; К4
[Fе(СN)6
].
7. Составить формулы комплексных соединений по исходным данным:
а) комплексообразователь – Со3+
, лиганд N0-
; . координационное число - 6; ионы внешней сферы К+
, 6) комплексообразователь Сг3+
, лиганд - ОH-
, координационное число - 6 , ионы внешней сферы К+
; в) комплексообразовaтель Со3+
; лиганд – SСN-
; координационное число
4 , ионы внешней сферы Na+
8. Дать названия следующим веществам :
К3
[Со(N02
)6]; [Zn(NН3
)4]С12
; [Сr(NH3
)4
С12
]Вr; Fе3
[Fе(СN)6
]2
; [Cu(NН3
)4
)S04
; [Сu(Н2
0)4
]S04
Лабораторная работа № 4.
Тема: «ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ
РЕАКЦИИ»
Контрольные вопросы.
1. Какие реакции называются окислительно-восстановительными и чем они отличаются от других реакций? 2. Что называется окислителем, восстановителем?
3. Какие элементы периодической системы Д.И.Менделеева обладают наиболее сильными окислительными и восстановительными свойствами?
4. Что называется степенью окисления?
5. Как определить степень окисления элемента в молекуле?
6. Является ли степень окисления постоянной величиной?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Химические реакции, протекающие с изменением степеней окисления элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными,
Степень окисления
атомов в молекуле – это условный заряд данного элемента, вычисленный из предположения, что все связи в молекуле кроме связей между атомами одного и того же элемента, являются ионными. Степень окисления может быть положительной, отрицательной или равной нулю:
Н2°, Nа+1, Сl-1, Н+1,Сl-1, O-2.
Для определения степени окисления элемента в молекуле необходимо пользоваться следующими правилами:
1. Степень окисления элемента в атомарном состоянии равна нулю.
2. Степень окисления элементов в молекулах простых веществ равна нулю.
3. Сумма степеней окисления всех атомов в молекуле равна нулю, т.е. молекула всегда электронейтральна. Например: для определения степени окисления хрома в бихромате калия (К2
Сr2
О7
) примем степень окисления хрома за х,(степень окисления калия +1, кислорода
-2), тогда 2 (+1) + 2х + 7 (-2) = 0 , х = +6,
Для некоторых элементов степень окисления постоянная величина (натрий, калий, алюминий цинк и др.), для других – переменная
(азот, сера, фосфор, хром, марганец, железо и др.)
Окисление
– это процесс отдачи электронов атомом, молекулой или ионом. Степень окисления при этом повышается. Zп° - 2е = Zп+2
Сl-
- 1е = Сl° Fе+2
- 1е = Fе+3
Восстановление
– процесс присоединения электронов атомом, молекулой или ионом. Степень окисления при этом понижается.
Аl+3
+ 3е = А1° Мп+7
+ 5е = Мп+2
S+6
+ 8е = S-2
Вещества, которые в ходе химической реакции отдают электроны, называются восстановителями.
Вещества, которые в ходе химической реакции присоединяют электроны, называются окислителями.
Окислитель в процессе реакции восстанавливается, а восстановитель – окисляется.
Элемент в высшей степени окисления прявляет только окислительные свойства (Сr+6
, Мп+7
, S+6
, N+5
и др.).
Элемент в низшей степени окисления проявляет только восстановительные свойства (S-2
, N-3
, С1-1
).
Важнейшими окислителями
являются галогены, кислород, озон, пероксид водорода, оксиды металлов в высоких степенях окисления (СrО3
, Мп2
07
, РЬ02
), кислородсодержащие кислоты (азотная, концентрированная серная, марганцовая, хромовая и дихромовая, хлорноватистая, хлорноватая, хлорная) и их соли.
Важнейшими восстановителями
являются металлы, водород, углерод, оксид углерода (II), безкислородные кислоты (сероводородная, хлороводородная, иодоводородная) и их соли, спирты.
Вещества, содержащие элемент в промежуточной степени окисления, могут проявлять свойства как окислителей, так и восстановителей в зависимости от природы веществ, с которыми они взаимодействуют.
Например: сернистая кислота (Н2
S03
):
восстановитель, если S+4
- 2е = S +6
и окислитель, если S+4
+ 6е = S-2
Для расстановки коэффициентов в уравнении окислительновосстановительной реакции необходимо помнить, что в окислительновосстановительных процессах общее число электронов, отдаваемых восстановителем равно общему числу электронов присоединяемых окислителем.
Применяют два метода
составления уравнений реакций окисления-восстановления: метод электронного баланса и иоиноэлектронный метод.
Разберем расстановку коэффициентов методом электронного баланса
на примере:
Н2
S-2
+ КМп+7
О4
+ Н2
S04
→ S° + К2
S04
+ Мп+2
SO4
+ Н2
О
1) Определяем степени окисления элементов в веществах правой и левой части схемы, отмечаем степень окисления элементов, которые их изменяют (марганец восстанавливается, сера окисляется).
2) Составляем электронные уравнения с учетом изменения степеней окисления и подбираем для них коэффициенты так, чтобы число отданных равнялось числу принятых электронов.
S-2 - 2е = S0 │5 восстановитель ,окисление,
Мп+7
+ 5е = Мп+2 │
2 окислитель, восстановление.
Н2
S - восстановитель
КМп04
- окислитель
Таким образом, основным коэффициентом при восстановителе Н2
S будет 5, а при окислителе КMn04
- 2. Эти коэффициенты называются базовыми.
5Н2
S + 2КМп04
+ Н2S04
→ 5S + 2МпS04
+ К2
S04
+Н2
О
3) Коэффициенты для остальных элементов, не изменяющих степени окисления, устанавливают подбором относительно базовых коэффициентов.
5Н2
S + 2КМп04
+ ЗН2
S04
→ 5C + 2МпS04
+ К2
S04
+ 8Н2
0
Водород и особенно кислород, если они не входят в реакцию в свободном состоянии, уравнивают последними.
4) Проверяя кислород, убеждаемся, что уравнение составлено правильно.
Окислительно-восстановительный процесс зависит от реакции среды, в которой он протекает. Например, перманганат - ион в зависимости от среды восстанавливается согласно схеме: в кислой среда до Мп+2
MnO4
-
→ в нейтральной среде до МпО2
в щелочной среде Мп04
2-
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт1. Восстановительные свойства соединений железа (II).
К раствору перманганата калия прилить немного разбавленной серной кислоты и раствор соли двухзарядного железа. Наблюдать обесцвечивание раствора. Составить уравнение реакции методом электронного баланса.
Опыт 2. Окислительные свойства соединений железа(III)
В пробирку налить намного раствора хлорида железа (III) и прилить к нему раствор иодида калия. Что наблюдаете? Написать уравнение реакции.
Опыт 3. Окислительные свойства соединений хрома(VI).
К раствору дихромата калия прилить немного разбавленной серной кислоты и раствора нитрита натрия, смесь слабо нагреть. Что происходит? Написать уравнение реакции.
Опыт 4. Окислительные свойства перманганата калия
в различиых условиях.
а) В три отдельные пробирки влить немного раствора перманганата калия. В первую пробирку прилить немного разбавленной серной кислоты, во вторую - немного дистиллированной воды, в третью – раствора щелочи. Затем добавить в каждую пробирку раствор сульфита натрия до изменения окраски. Сделать вывод о ходе окислительновосстановительного процесса в различных средах. Составить уравнения реакций.
б) Влить в пробирку немного раствора перманганата калия, добавить раствор сульфата марганца, проверить реакцию среды. Составить уравнение реакции.
Задания:
1. Рассчитайте степень окисления азота в соединениях: N2
, NО, N2
О, NН3
, N2
05
.
2. Указать, какие из приведенных ниже атомов и ионов могут являться: а) только восстановителями, б) только окислителями, в) как восстановителями, так и окислителями:
К, СГ, S-2
, S+6
, S+4
, N+3
, N-3
.
3. Укажите число отданных или принятых электронов при изменении степеней окисления у следующих ионов:
Мп+5
→ Мп+2
Сг+3 → Сг+6
С+4
→ С°
4. Составить уравнения электронного баланса для реакций, идущих по схемам, подберите коэффициенты и укажите окислитель и восстановитель.
а) FеС13
+ Н2
S → FеС12
+S + НС1
б) NаСгО2
+ Вr2
+ NaОН → Nа2
СrO4
+ NаВr + Н2
О
в) Мg + HNO3
→ Мg(NО3
)2
+ NH4
NO3
+ Н2
О
г) Аg + НNО3
+ Н2
О → Н3
Аs04
+ N0 + Н2
SО4
д) Н2
S + КМпО4
+ Н2
SО4
→ S + МnSО4
+ К2
SО4
+ Н2
О
е) FeCl2
+ НС1O3
+ НС1 →FeCl3
+ Н2
0
ж) К2
Сг2
07
+ H2
S04
+ FeS04
→ Cr(SO4
)3
+ Fe2
(S04
)3
+ K2
S04
+ H2
0
з) KMnO4
+ H2
S04
+ H2
02
→ MnSO4
+ K2
S04
+ 02
+ H2
0
и) FeS04
+ KMnO4
+ H2
S04
→ MnS04
+ Fe2
(S04
)3
+ K2
S04
+ H2
0 t
к) KMn04
→ K2
Mn04
+ MnO2
+ O2
t
л) (NH4
)2
Cv2
O7
→ Cv2
O3
+ N2
+ H2
O
5. Написать уравнения реакций и указать, в какой реакции КN02
будет окислителем и в какой восстановителем. а) КI + КNO2
+ Н2
SО4
→
б) КNO2
+ КMnО4
+ Н2
SО4
→
Лабораторная работа № 5.
Тема: «ИЗУЧЕНИЕ СВОЙСТВ ГАЛОГЕНОВ, СЕРЫ И ИХ СОЕДИНЕНИЙ»
Контрольные вопросы.
1. Дать строение атомов фтора, хлора, брома и йода Какие степени окисления характерны для этих элементов?
2. Как получают фтор и хлор в промышленности?
3. Привести химические формулы четырех кислосодержащих кислот, образуемых хлором, назвать их, определить степень окисления хлора в этих соединениях. Как называются соли этих кислот ?
4. Как называется и каким особенностями обладает продукт растворения фтористого водорода в воде?
5. Что такое хлорная вода? Во что она превратится при длительном хранении?
6. Дать строение атома серы. Какие степени окисления характерны для серы? В каком виде сера встречается в природе?
7. Дать формулы оксидов серы и определить степень окисления серы в них.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
К галогенам относятся элементы V11А группы периодической системы Д.И.Менделеева: фтор, хлор, бром, иод, астат. Электронная конфигурация внешнего (валентного) уровня ns2
np5
(n = 2,3,4,5,6 соответственно у фтора, хлора, иода и астата). Такие электронные конфигурации обусловливают типичные окислительные свойства галогенов, высокую электроотрицательность их атомов, причем по мере увеличения радиусов атомов галогенов их электроотрицательность и окислительная активность ослабевают: F > Cl > Br > I > At. У иода и астата появляются металлические признаки.
При обычных условиях галогены существуют в виде простых веществ: F2
и CI2
– газы, Br2
– жидкость, I2
и At2
– твердые вещества.
Фтор – самый электроотрицательный из всех элементов и встречается в соединениях только в степени окисления –1. Для других галогенов наиболее характерной степенью окисления также является –1, однако благодаря наличию свободных d- орбиталей на внешнем электронном уровне они могут проявлять и другие степени окисления от +1 до +7 за счет частичного или полного распаривания валентных электронов.
Галогены вступают в реакции почти со всеми элементами. С типичными металлами, они образуют ионные галогениды – соли, например CaF2
, NaCI, LiI, с типичными неметаллами ковалентные галогениды, например SF6,
PCl3,
CBr4,
BI3,
SiF4,
HCl.
Наибольшей активностью обладает фтор. При облучении фтор реагирует даже с инертными газами: Xe + F2
= XeF2
.
При нагревании фтор окисляет другие галогены с образованием соединений: ClF, BrF, IF, AtF.
С увеличением порядкового номера галогена, уменьшается его химическая активность, поэтому галоген с меньшим порядковым номером всегда вытесняет галоген с большим порядковым номером из безкислородных солей последнего: Сl2
+2KBr = Br2
+2KCl.
Галогены энергично взаимодействуют со многими сложными веществами. В обычных условиях F2,
Cl2,
Br2
реагируют с водой. При этом фтор энергично восстанавливает воду до О2
. Хлор и бром, растворяясь в воде, частично реагируют с ней, образуя равновесную смесь веществ, называемую хлорной водой, бромной водой. Взаимодействуя с водой, они диспропорционируют, одновременно повышая свою степень окисления (до +1) и понижая (до –1). Cl2
+ H2
O = HCl + HClO
Окислительные свойства воды обусловлены нестойкостью хлорноватистой кислоты, которая легко разлагается с выделением атомарного кислорода:
HClO = HCl + O (сильный окислитель)
Хлор и бром могут таким же образом реагировать (диспропорционировать) со щелочами. Например:
Cl2
+ 2КOH = КCl + H2
O + КClO (на холоде) – жавелевая вода
Окислительные свойства жавелевой воды обусловлены гидролизом гипохлорита калия:
KClO + HOH ↔KOH + HClO
3Cl2
+ 6KOH = 5KCl + KClO3
+ 3H2
O (при нагревании) бертолетова соль
Аналогичным способом получают хлорную известь:
Cl2
+ 2Са(OH)2
= СаCl2
+ 2H2
O + Са(ClO)2
Свойства хлорной извести обусловлены гидролизом гипохлорита кальция:
Са(СlO)2
+ 2H2
O ↔ Ca(OH)2
+ 2HClO
HClO = HCl + O
Иод практически нерастворим в воде и не способен ее окислять даже при нагревании.
Водородные соединения галогенов.
Галогеноводороды HF, HCl, HBr, HI – представляют собой бесцветные газы, хорошо растворимые в воде, при этом HF – слабая кислота, а остальные – сильные кислоты в водных растворах.
Т.к. галогены в водородных соединениях находятся в минимальной степени окисления, в окислительно- восстановительных реакциях галогеноводороды, их кислоты и соли являются только восстановителями. Сила ( степень диссоциации) и восстановительная активность галогеноводородных кислот растет по мере уменьшения электроотрицательности галогенов. Это объясняется общим уменьшением прочности связи галоген – водород от фтора к астату.
HBr и HI – более сильные восстановители, поэтому их нельзя получить по обменной реакции в отличие от HF и HCl. Например:
CaF2
(тв.) + H2
SO4
(конц) = CaSO4
+ 2HF
2KBr (тв.) + 2H2
SO4
(конц.) = Br2
+ SO2
+ 2H2
O + K2
SO4
.
При взаимодействии галогеноводородных кислот с металлами окисление металлов может происходить только за счет ионов Н+ кислоты. Поэтому они реагируют только с металлами, стоящими в ряду напряжений металлов левее водорода.
В отличие от других галогеноводородных кислот фтороводородная (плавиковая) кислота взаимодействует с оксидом кремния:
SiO2
+ 4HF = SiF4
+ 2H2
O
Т.к. оксид кремния входит в состав стекла, то плавиковая кислота разъедает стекло, и поэтому в лабораториях ее хранят в сосудах из полиэтилена и тефлона.
Кислородсодержащие соединения галогенов.
Все галогены, кроме фтора, могут образовывать соединения, в которых они обладают положительной степенью окисления. Это соединения хлора, брома, иода с фтором и кислородные соединения – оксиды, кислоты и соли. Непосредственно с кислородом галогены не реагируют, а кислородные соединения их получают косвенным путем. Кислородсодержащие кислоты хлора и названия их солей
| Формула кислоты
|
Название
кислоты
|
Название солей
|
| HClO
|
хлорноватистая
|
гипохлориты
|
| HClO2
|
хлористая
|
хлориты
|
| HClO3
|
хлорноватая
|
хлораты
|
| HClO4
|
хлорная
|
перхлораты
|
В этом ряду (сверху вниз) увеличивается число атомов кислорода, связанных с центральным атомом хлора, при этом все больше оттягивается электронная плотность от связи О-Н, которая за счет этого ослабляется и легче разрывается. Следовательно, с увеличением степени окисления атома хлора увеличивается степень диссоциации кислоты (сила кислоты).
Бром и иод способны аналогично хлору образовывать кислородные кислоты и их соли. Устойчивость, окислительная способность и сила кислородсодержащих соединений брома и иода изменяется также как и в подобных соединениях хлора.
Из числа галогенов наибольшее практическое значение в сельском хозяйстве имеют хлор, фтор и иод, являясь важнейшими микроэлементами. Хлорид-ионы – главные отрицательно заряженные ионы внутриклеточного раствора и межклеточных жидкостей, они образуют тонкие ионные слои по обеим сторонам клеточных мембран и участвуют таким образом в создании электрического мембранного потенциала, который регулирует процессы переноса неорганических и органических веществ сквозь мембраны. Гидратированные хлорид-ионы участвуют в поддержании физиологически требуемой наполненности клетки водой. Хлороводородная кислота – составная часть желудочного сока животных.Хлорноватистая кислота вырабатывается белыми кровяными тельцами – лейкоцитами- для борьбы с проникающими в организм микробами. Фтор необходим для нормального развития организма, при его недостатке развивается анемия. Он содержится в эмали зубов и в костных тканях. Иод участвует в гормональной активности щитовидной железы: входит в состав тирозина- главного гормона этой железы. Поэтому присутствие микроколичеств иода в почве представляется необходимым.
Внесение галогенов в почву в сельском хозяйстве осуществляется в составе удобрений: NH4
Cl, KCl, KCl· NaCl, KCl ·MgCl2
·6H2
O. Использование данных удобрений не приводит к засоленности вследствие высокой подвижности Сl-
.
Экологическую опасность представляет использование различных хлорсодержащих пестицидов, консервантов древесины (NaF, Na2
[SiF6
]), хлор и фторсодержащих пластмасс, необесфторенных фосфорных удобрений, блокирующих метаболические клеточные процессы не только вредных, но и полезных обитателей экосистем.
Сера
– элемент 3-его периода V1А группы Периодической системы Д.И.Менделеева. Электронная формула атома 1S2
2S2
2P6
3S2
3P4
.
Характерные степени окисления серы 0, -2, +4,+6. Состояние S+6
считается устойчивым.
Известно несколько аллотропных модификаций серы – сера ромбическая, моноклинная и пластическая. Наиболее устойчивой модификацией является ромбическая сера, в нее самопроизвольно через некоторое время превращаются все остальные модификации. Сера не растворяется в воде и при обычных условиях не реагируют с ней, хорошо растворима в сероуглероде (CS2
). Сера, особенно порошкообразная, обладает высокой активностью при нагревании.
Сера может отдавать свои электроны при взаимодействии с более сильными окислителями, являясь восстановителем:
S0 + O2 0= S+4O2
S0
+ Cl2
0
= S+4
Cl2
S0 + F20 = S+4F2
S0
+ 2H2
S+6
O4
(конц.) = 3S+4
O2
+ 2H2
O
1 S0
– 4e = S+4
| окисление, восстановитель - S
2 S+6 +2e = S+4 | восстановление, окислитель – H2SO4
S0
+ 6HN+5
O3
(конц.) = H2
S+6
O4
+ 6N+4
O2
+ 2H2
O
При взаимодействии с водородом и металлами сера проявляет окислительные свойства:
H20 + S0 = H2S-2
3S0
+ 2Al0
= Al2
S3
-2
С большинством металлов сера реагирует при нагревании, но в реакции со ртутью взаимодействие происходит уже при комнатной температуре. Это обстоятельство используется для удаления ртути, пары которой сильно ядовиты.
В концентрированных растворах щелочей сера диспропорционирует:
3S + 6KOH(конц.) = 2K2
S + K2
SO3
+ 3H2
O
2 S0
+ 2e = S-2
| восстановление, окислитель - S
1 S0
– 4e = S+4
| окисление, восстановитель - S
Соединения серы:
H2
S – сероводород
, бесцветный ядовитый газ с неприятным запахом, мало растворим в воде.
Раствор сероводорода – очень слабая кислота, которой соответствуют 2 ряда солей: кислые соли – гидросульфиды (NaHS – гидросульфид натрия, NH4
HS – гидросульфид аммония, Ca(HS)2
– гидросульфид кальция), средние соли – сульфиды (Na2
S – сульфид натрия, (NH4
)2
S – сульфид аммония, CaS – сульфид кальция). Большинство сульфидов (за исключением сульфидов щелочных, щелочноземельных металлов и сульфида аммония) плохо растворимы в воде. Т.к. сера в составе сероводорода, сероводородной кислоты и сульфидов находится в минимальной степени окисления (-2), все эти соединения проявляют только восстановительные свойства. S-2
может окисляться до S0
, S+4
, S+6
в зависимости от силы окислителя и условий протекания реакции:
H2
S + Br2
= S + 2HBr
S-2
–2e = S0
| 1 окисление, восстановитель – H2
S
Br2
0
+2e = 2Br-
| 1 восстановление, окислитель – Br2
H2
S + 4 Cl2
+ 4H2
O = H2
SO4
+ HCl
S-2
–8e = S+6
| 1 окисление, восстановитель – H2
S
Cl2
0
+2e = 2Cl-
| 4 восстановление, окислитель – Cl2
Оксид серы IV. Сернистая кислота и ее соли.
Диоксид серы SO2
– бесцветный газ с резким запахом, термически устойчивый и растворимый в воде. Водный раствор оксида серы (1V) называется сернистой кислотой. Основная масса растворенного SO2
находится в растворе в гидратированной форме SO2
× nH2
O. Небольшая часть растворенных молекул взаимодействует с водой по схеме:
SO2
+ H2
O ↔ H2
SO3
↔ H+
+ HSO3
-
↔ 2H+
+ SO3
-2
В сторону образования HSO3
-
и SO3
2-
равновесие смещается легко в присутствии щелочей, при этом образуются соли 2-х типов: кислые – гидросульфиты и средние – сульфиты.
В воде растворяются лишь соли S-элементов 1 группы и гидросульфиты типа Me(HSO3
)2
. Т.к. в SO2
, H2
SO3
и ее солях сера находится в промежуточной степени окисления (+4), в окислительновосстановительных реакциях они могут быть в роли восстановителя, окисляясь до S+6
(серная кислота и ее соли) или окислителя, восста-
навливаясь до S0
и S-2
(сероводород, сульфиды)
Na2
SO3
+ Cl2
+ H2
O = Na2
SO4
+ 2HCl
S+4
–2e = S+6
| 1 окисление, восстановитель - Na2
SO3
Cl2
0
+ 2e = 2Cl-
| 1 восстановление, окислитель – Cl2
Восстановительные свойства S+4
довольно сильные. Поэтому, например, сульфиты в водных растворах постепенно окисляются даже кислородом воздуха 2K2
SO3
+ O2
= 2K2
SO4
Окислительные свойства у S+4
выражены слабо и проявляются только в реакциях с сильными восстановителями.
SO2
+ 2H2
S = 3S + 2H2
O
S+4
+ 4e = S0
| 1 восстановление, окислитель – SO2
S-2
–2e = S0
| 2 окисление, восстановитель – H2
S
Оксид серы (VI), серная кислота и ее соли.
SO3
– серный ангидрид, является продуктом окисления SO2
. Этот процесс медленно протекает даже под действием кислорода воздуха при н.у.
2SO2
+ O2
= 2SO3
. Реакция ускоряется под действием катализаторов (платина, оксиды ванадия). При взаимодействии с водой оксид серы (V1) образует серную кислоту: SO3
+ H2
O = H2
SO4
SO3
хорошо растворяется в 100% серной кислоте. Раствор SO3
в такой кислоте называется олеумом (тяжелая, маслянистая жидкость). При хранении олеума в результате соединения оксида серы (V1) с серной кислотой образуется пиросерная кислота:
H2
SO4
+ SO3
= H2
S2
O7
Ее соли – пиросульфаты (например, K2
S2
O7
– пиросульфат калия) находят применение в лабораторной практике.
Концентрированная серная кислота ионизирует незначительно. В водном растворе серная кислота – сильная, двухосновная. При охлаждении разбавленной серной кислоты выделяются кристаллогидраты H2
SO4
· H2
O,
H2
SO4
·2H2
O, H2
SO4
· 4H2
O.
Гидратация серной кислоты сопровождается выделением большого количества тепла. Поэтому смешивать концентрированную серную кислоту с водой следует очень осторожно, вливая серную кислоту тонкой струйкой в воду, а не наоборот. Концентрированная серная кислота поглощает пары воды и поэтому ее применяют в качестве осушителя. Она отнимает воду и от органических веществ, обугливая их. Например:
С12
Н22
О11
+ H2
SO4
(конц.) = 12C + H2
SO4
· 11H2
O
Поэтому концентрированная серная кислота причиняет сильные ожоги. В случае поражения кожи серной кислотой следует немедленно промыть обожженное место большим количеством воды и раствором NaHCO3
.
Серная кислота обладает всеми общими свойствами кислот (реагирует с основными оксидами и гидроксидами, разлагает соли слабых кислот). Т.к. сера в серной кислоте находится в максимальной степени окисления, она проявляет только окислительные свойства.
Разбавленная серная кислота окислительные свойства проявляет за счет катиона Н+
. Все металлы, стоящие в ряду напряжений до водорода вытесняют его из разбавленной серной кислоты, если только образующаяся соль растворяется в ней.
H2
SO4
(разб.) + 2Al = Al2
(SO4
)3
+ 3H2
Концентрированная серная кислота – более сильный окислитель. Она окисляет почти все металлы (кроме золота и платины) до солей, а сама восстанавливается до соединений серы со степенями окисления –2, 0, +4 в зависимости от активности металла и от условий реакции (например, температуры). Чем горячее серная кислота, тем более сильным окислителем она является. Чем активнее металл, тем сильнее восстанавливается S+6
.
4Са + 5H2
SO4
(конц.)= 4СаSO4
+ H2
S↑ + 4H2
O
3Cd + 4H2
SO4
(конц.) = 3CdSO4
+ 4H2
O +S↓
Cu + 2H2
SO4
(конц.) = CuSO4
+ SO2
↑ + 2H2
O
Металлы Be, Bi, Co, Fe, Mg, Nb, Al пассивируются в концентрированной серной кислоте и не реагируют с ней.
Концентрированная серная кислота окисляет и многие неметаллы:
2H2
SO4конц.
+ S = 3SO2
+ 2H2
O, 2H2
SO4конц.
+ C = CO2
+ 2SO2
+2H2
O а также сложные вещества:
H2
SO4конц.
+ 8HJ = 4J2
+ H2
S +4H2
O
Серная кислота образует соли: кислые (гидросульфаты) и средние (сульфаты).
Качественной реакцией на ион SO4
 2-
является реакция осаждения белого сульфата бария ( осадок не переводится в раствор соляной и азотной кислотами). 2-
является реакция осаждения белого сульфата бария ( осадок не переводится в раствор соляной и азотной кислотами).
Ba+2
+ SO4
-2
= BaSO4
↓
Многие соли серной кислоты содержат кристаллизационную воду и являются кристаллогидратами. Их часто называют купоросами, например:
CuSO4
· 5H2
O – пятиводный сульфат меди (II), медный купорос,
FeSO4
· 7H2
O - семиводный сульфат железа (II), железный купорос,
ZnSO4
· 7H2
O - семиводный сульфат цинка, цинковый купорос.
Серноватистая (тиосерная) кислота и ее соли.
Молекула серноватистой кислоты H2
S2
O3
содержит два атома серы, один из которых имеет степень окисления +6, а другой –2. По силе эта кислота близка к серной, но в свободном состоянии неустойчива и распадается на сернистую кислоту и серу:
Na2
S2
O3
= Na2
SO3
+ S↓
Многие соли серноватистой кислоты устойчивы и благодаря наличию в них иона S-2
обладают восстановительными свойствами.
Наибольшее значение из них имеет тиосульфат натрия Na2
S2
O3
· 5H2
O.
Na2
S2
O3
+ 4Cl2
+ 5H2
O = 2H2
SO4
+ 2NaCl + 6HCl
S-2 – 8e = S+6 │1
Cl2
0
+ 2e = 2Cl-
│4
Сера – элемент питания, необходимый для нормального развития растений. Она является обязательным компонентом белка, входит в состав некоторых растительных масел. Однако следует отметить, что подавляющее большинство почв не нуждается в специальном внесении серосодержащих удобрений, поскольку традиционные минеральные удобрения (суперфосфат, сульфат аммония (NH4
)2
SO4
, каинит KCl · MgSO4
· 3H2
O и т.п.) содержат относительно большие количества серы. Кроме того, оксиды серы, образующиеся в результате переработки серосодержащего сырья и сгорания серосодержащего топлива в атмосфере, постоянно поступают в почву в виде кислотных осадков. В тоже время скопление серы в почвах в составе легкорастворимых солей Na2
SO4
, MgSO4
и сероводорода отрицательно влияет на плодородие почв. Присутствие ионов SO4
2-
в воде обусловливают постоянную или сульфатную жесткость, а наличие сероводорода Н2
S (токсичен) – придает воде неприятный запах и способствует развитию серобактерий.
Тем не менее, внесение в щелочные почвы (солонцы) при вспашке гипса СаSO4
улучшает (мелиорирует) физические свойства почвы. При этом ионы Са2+
замещают ионы Na+
и вымываются в форме Na2
SO4
.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1.Взаимодействие галогенов с водой и щелочью
:
а) К 3-4 каплям раствора органического красителя ( например, фуксина) добавить примерно столько же капель бромной воды и встряхнуть смесь. Записать наблюдавшееся изменение – результат окисляющего действия бромной воды на краситель. Ответить будут ли также окислителями хлорная и йодная вода и какая в наибольшей степени
б) В пробирку внести 3-5 капель бромной воды и добавить при-
мерно такой же объем щелочи (раствор КОН или NаОН) , отметить изменение окраски и запаха, если они наблюдаются. В отдельной пробирке с раствором красителя проверить –сохранилось ли окислительное свойство раствора галогенов после добавления щелочи (брать 1-2 капли щелочного раствора)
Опыт 2 Характерные качественные реакции анионов хлора ,
брома и йода.
а) Действие азотнокислого серебра
. К 3-5 каплям раствора хло-
рида калия добавить примерно столько же раствора нитрата серебра до прекращения образования осадка. Дать осадку осесть , отметить его цвет, слить раствор и добавить к осадку 2-3 капли концентрированного раствора аммиака до полного растворения. Полученный раствор подкислить несколькими каплями азотной кислоты (проверить реакцию жидкости, поместив одну каплю ее на РН-бумажку), отметить выпадение вновь хлористого серебра в виде осадка или мути. Написать уравнение реакции. Повторить этот опыт, взяв вместо хлористого калия сначала раствор бромида калия, затем раствор йодида калия. Отметить различие цвета осадков.
Бромид серебра плохо растворим в аммиаке , а йодид серебра не растворим в нем.
б) Вытеснение и дальнейшее окисление йода и брома хлором в
водной среде.
К 1-2 каплям (не больше) раствора йодида калия добавить 1 каплю раствора серной кислоты и 3-5 капель органического растворителя (бензин, бензол или четыреххлористый углерод).
Затем прилить хлорную воду по каплям при сильном встряхивании. Выделяющийся йод окрашивает слой органического растворителя в красно-фиолетовый цвет. При дальнейшем добавлении хлорной воды окраска постепенно исчезает в результате окисления свободного йода до бесцветного йода- иона. Написать уравнение реакций.
Повторить опыт, взяв вместо йодида раствора бромида калия. В этом случае свободный бром окрашивает органический растворитель в красно-бурый цвет. При избытке хлора окраска желтеет, а затем исчезает вследствие образования бесцветного бромат-иона. Написать уравнение реакций.
Опыт 3. Восстановительные свойства серы
(делается под тя-
гой)
К 0,5-1 мл концентрированной азотной кислоты прибавляется немного порошка серы и нагреть смесь до кипения, наблюдая окраску выделяющегося газа. К остывшей смеси пилить 1-2 мл воды, встряхнуть, дать отстояться, слить прозрачный раствор и добавить к нему несколько капель хлорида бария. В отдельной пробирке испытать действие этого же реактива на смесь 2-3 азотной кислоты с водой. Какой ион обнаружен после кипячения азотной кислоты с серой?
Опыт 4. Действие окислителей на раствор сернистой кислоты
.
В 2 пробирки налить по 3-5 капель раствора оксида серы(1У) В одну пробирку добавить 2-3 капли раствора перманганата калия, в другую бромной воды. Написать уравнение реакции, указывая переход электронов, окислитель и восстановитель.
Опыт 5. Свойства серной кислоты.
В пробирку положить 1-2 кусочка цинка и добавить немного концентрированной серной кислоты, осторожно нагреть. Какой газ выделяется? продолжать нагревать и следить за изменениями в пробирке. На что указывает появление мути? Какой газ теперь выделяется? Написать три уравнения реакции, имея в виду, что во всех случаях получается сернокислый цинк. Какие свойства проявляет концентрированная серная кислота и чем отличается ее действие на металлы от действия разбавленной кислоты?
Опыт 6. Восстановительные свойства триосульфата натрия.
а) К 3-5 каплям раствора триосульфата натрия добавить несколько капель хлорной воды. Наблюдать исчезновение запаха и обнаружить появление иона SO4(каким реактивом)
б) К 3-5 каплям раствора тиосульфата натрия прилить 2-3 капли йодной воды. Что происходит? Объяснить наблюдаемое явление и написать уравнение реакций
Задания:
1.Составить уравнение реакций взаимодействия хлора с гидроксидом калия на холоде и при нагревании. Назвать полученные продукты 2. Составить уравнение реакции термического разложения бертолетовой соли в присутствии катализатора и без.
3. Составить уравнение реакции получения хлора из соляной кислоты действием: а) двуокиси марганца, б) перманганата калия.
4. Составить уравнение реакции получения хлора из соляной кислоты действием: а) двуокиси марганца, б) перманганата калия.
6. Составить уравнение реакций получения хлористого водорода:
а) синтезом из водорода и хлора, б) взаимодействием хлорида натрия с серной кислотой.
5. Составить уравнение реакции взаимодействия фторида кальция с серной кислотой.
6. Что происходит с фтором, хлорид, бромом и йодом при взаимодействии с водой? Составить уравнения соответствующих обратимых реакций, назвать продукты реакции.
7. Кислородосодержащие кислоты и соли галогенов являются сильными окислителями. Составить уравнение реакции взаимодействия хлорноватистой кислоты и сернистой кислоты.
8. Составить уравнение реакций образования сернистого газа из следующих соединений: сера, пирит (железный колчедан), сульфид цинка, сульфит натрия, концентрированная серная кислота. Какие из этих реакций являются окислительно-восстановительными?
9. Составить уравнение реакции получения сероводорода из сульфида железа (11). Какими свойствами обладает сероводород в реакции окисления-восстановления. Составить уравнение реакции взаимодействия сероводорода с перманганатом калия (в сернокислой среде) 10. Составить структурную формулу тиосульфата натрия в реакциях окисления-восстановления.
Лабораторная работа № 6.
Тема: «ИЗУЕНИЕ СВОЙСТВ АЗОТА И ФОСФОРА И ИХ СОЕДИНЕНИЙ»
Контрольные вопросы.
1. Распространение фосфора в природе, его получение и применение.
2. Укажите аллотропные модификации фосфора и различия в их свойствах.
3. Какие соединения образует фосфор с водородом? Укажите способы их получения. Сравните их свойства со свойствами аналогичных соединений азота.
4. Какие соединения образует фосфор с галогенами? Укажите способы их получения.
5. Охарактеризуйте отношение оксида фосфора (III) к воде.
6. Какими свойствами обладает фосфористая кислота? Какие соли она образует?
7. Укажите названия и формулы аммонийных солей ортофосфорной кислоты.
8. Укажите способы получения двойного и простого суперфосфатов. 9. Какими свойствами обладает азотная кислота? Какие соли она образует?
10. Какими свойствами обладает азотистая кислота? Какие соли она образует?
11. Чем объясняется небольшая химическая активность молекулярного азота?
12. Укажите сходные и отличительные химические свойства азота и фосфора.
13. Каковы свойства азота?
14. Как получают азот в промышленности и в лаборатории?
15. Как получают аммиак в промышленности и лаборатории?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Фосфор
– элемент 3-го периода пятой А группы Периодической системы. Электронная формула атома 1s² 2s²2p6 3s²3p3. Характерные степени окисления фосфора 0, -3, +3,+5.
Фосфор образует несколько аллотропных модификаций: белый, красный, черный. Наиболее устойчивая модификация – черный фосфор, а наиболее активен белый фосфор. Фосфор может реагировать со многими неметаллами: кислородом, галогенами, серой. В зависимости от того, находится фосфор в избытке или недостатке, образуются соединения фосфора (III) и (V), например:
2P + 3Br2
=2PBr3
или 2P + 5Br2
=2PBr5
2 | Pº - 3e =P³+ 2 | Pº - 5e =P5+
3 | Br2
º +2e =2Brˉ 5 | Br2
º +2e =2Brˉ
Атом фосфора отдает электроны при взаимодействии с более сильными окислителями, являясь восстановителем.
При взаимодействии с металлами фосфор проявляет окислительные свойства, образуя фосфиды:
3Mg +2P = Mg3
P2
Mgº - 2e = Mg²+
| 3 восстановитель
Рº + 3е = Р³ˉ | 2 окислитель
При нагревании белого фосфора в растворе щелочи он диспропорционирует:
P4
º+ 3NaOH + 3H2
O = Pˉ³H3
+ 3NaH2
P+O2
Pº +3e =Pˉ³ | 1 окислитель
Pº - e = P+
| 3 восстановитель
С водородом фосфор не реагирует, фосфин PH3
получают косвенным путем.
Кислородные соединения фосфора
При окислении фосфора в недостатке кислорода образуется оксид фосфора (III) – белое кристаллическое вещество. Ядовит. В воде растворяется с образованием фосфористой кислоты:
Р2
О3
+ 3Н2
О = 2Н3
РО3
Фосфористая кислота и ее соли – фосфиты – являются сильными восстановителями.
При горении в избытке кислорода фосфор образует оксид Р2
О5
, иногда формулу записывают Р4
О10
.
Р2
О5
– белое кристаллическое вещество, энергично взаимодействует с водой, образуя различные кислоты, например, метафосфорную НРО3
и ортофосфорную Н3
РО4
. Также возможно получение дифосфорной (пирофосфорной) кислоты Н4
Р2
О7
.
Ортофосфорная кислота – наиболее распространенная из всех кислот фосфора, обычно ее называют просто фосфорной.
Средние соли фосфорной кислоты называются ортофосфатами или фосфатами. Как трехосновная кислота Н3
РО4
образует два типа кислых солей: К2
НРО4
- гидрофосфат калия и КН2
РО4
– дигидрофосфат калия.
Фосфор, также как и азот, является важным элементом для обеспечения роста и жизнедеятельности растений. Растения извлекают фосфор из почвы, поэтому его запасы необходимо восполнять, периодически добавляя фосфорные удобрения.
Простейшее фосфорное удобрение – фосфоритная мука – представляет собой перемолотый фосфорит Cа3
(РО4
)2
, применяют главным образом на сильно кислых почвах. В нейтральные и слабокислые почвы вносят суперфосфаты Са(Н2
РО4
)2
– двойной, Са(Н2
РО4
)2
+ 2СаSО4
– простой и преципитат СаНРО4
*2Н2
О. Вместе с азотом фосфор входит в состав других удобрений, например, аммофоса NH4
Н2
РО4
и диаммофоса (NH4
)2
НРО4
.
Азот
разлагается в V A – подгруппе, во втором периоде. Газ без цвета, без запаха. Плотность азота равна 1,25. t кип. = -1960, в твёрдом виде существует в двух модификациях: кубической и гексагональной. Плохо растворим в воде, меньше чем кислород. В 1л воды при t=00
С растворяется 23,2 мл азота.
Наиболее распространён азот 14 N. Состав ядра – 14 нуклонов,
7 протонов, 7 нейтронов. Вокруг ядра – 7 электронов. Электронная конфигурация: 1s2
2s2
2p3
валентный слой 2 возможные степени окисления N0
.
N0
+ 3e- → N- 3
(NH3
) N0
–e-
→ N + 3
(N2
O3
) N0
–5e-
→ N +5
(N2
O5
) Кроме того, азот образует соединения со степенью окисления: +1, +2, +4. Максимальная валентность азота равна 4. За счёт образования дополнительной ковалентной связи по донорно-акцепторному механизму, в которой участвует не поделённая пара электронов 2s2
. Кроме того, можно оторвать один электрон от атома и атом переходит в однозарядный положительный и четырёхвалентный ион.
В молекуле азота (N2
) связь кратная, состоит из одной сигма и двух π- связей.
Связь очень прочная, её энергия достигает 941 кДж. Молекула имеет симметричное распределение электронной плотности и не обладает полярностью.
Азот при обыкновенных условиях без нагревания реагирует только с литием:
6 Li + N2
= 2Li3
N литийнитрид
Нитриды очень активных металлов имеют ионный характер связи, способной гидролизироваться:
Са3
N2
+ 6H2
O = 3Ca (OH)2
+ 3NH3
Взаимодействует с водородом:
N2
+3H2
= 2NH3
∆ H = -92,4 кДж
Температура не ниже 400-5000
С. Давление (Р) 30 м ПА (300 атм.) Постоянно увеличивается [ H2
] и [N2
]. Катализатор -Рt, выведение из сферы реакции NH3
. В приведённых реакциях азот является окислителем, восстановительные свойства проявляются при взаимодействии с кислородом:
1500о
C
N2
+ O2
→ 2NО
Применение: для получения аммиака. Используют как газ, создающий инертную атмосферу чувствительных к воздуху и влаге веществ (нефтепродуктов), наиболее ценных картин и книг. Наполняют электролампочки, используют при получении полиамидных волокон.
Аммиак, Соли аммония.
С водородом азот образует несколько соединений. Аммиак NH3
, гидразин N2
H4
, азотистоводородная кислота NH3
. Наиболее важным является соединение NH3
. Молекула образуется за счёт 3-х непарных р- электронов атома и 3-х атомов водорода.
N 1s2
2s2
2p3
H 1s1
Газ, без цвета, с резким запахом, t плав. = -77,80 С, t кип. =
33,4о
С. Легче воздуха , сжигается при температуре 20о
С и давлении 8,5 атм. Смесь с воздухом в интервале 1,5-27,5% взрывоопасна. Образование водородных связей между молекулами NH3
и H2
O приводит к неорганической растворимости жидкого аммиака в воде (в IV H2
O до 700 V NH3
). Молекула аммиака имеет большой электрический дипольный момент. Поэтому аммиак – сильный ионизирующий растворитель. В нём хорошо растворяются многие соли. Содержание аммиака в воздухе (0,5% по объёму) приводит к раздражению слизистой оболочки. Вдыхание NH3
в больших концентрациях вызывает жгучую боль слизистых оболочек гортани, трахеи и может привести к слепоте. Первая помощь – свежий воздух, обильное промывание глаз водой, вдыхание водяного пара.
Аммиак в химических реакциях выступает в роли энергичного восстановителя. На воздухе не горит, но сгорает в чистом кислороде: 4NH3
+ 3O2
= 6H2
O + 2N2
Возможно окисление и кислородом воздуха в присутствии катализатора:
4NH3
+ 5O2
= 4NO + 6H2
O 8NH3
+3Cl2
= N2
+ 6NH4
Cl
Восстановительное свойство проявляется со сложными веществами: Восстанавливает металлы из оксидов: t
3СuO +2NH3
= 3Cu + N2
+ 3H2
O
Водород в аммиаке способен замещаться на металлы и за счёт этого выступает в роли окислителя: t0
2Al +2NH3
= 2AlN +3H2
↑
нитрид
t
Ca + NH3
= CaNH + Н2
t
2Na + 2NH3
= H2
↑ + 2NaNH2
амид
Аммиак способен вступать в реакции присоединения, которые протекают в обычных условиях, образуются соединения по донорно- акцепторному механизму:
NH3
+H2
O ↔ NH4
OH ↔ NH4
+
+OH-
нашатырный спирт
При взаимодействии с кислотами образует соли аммония: NH3
+ HCl = NH4
Cl
NH3
+ H2
SO4
= NH4
HSO4
2NH3
+ H2
SO4
= (NH4
)2
SO4
Молекулы аммиака входят в состав комплексных соединений:
AgCl +2NH4
OH ↔ [Ag(NH3
)2
] Cl +2H2
O
Аммиак обнаруживается с помощью красной лакмусовой бумаги(влажной), при попадании NH3
наблюдается посинение, образование дыма. При поднесении палочки смоченной концентрированной кислотой HCl к отверстию, HN3
образует белый дым – NH4
Cl. Coли аммония
– твёрдые кристаллические вещества, хорошо растворимые в воде. При нагревании разлагаются, характер разложения зависит от аниона кислоты. Если соль аммония образована летучей кислотой, то при нагревании выделяется аммиак и кислота, способные при охлаждении вновь образовывать соль:
t охлаждение
NH4
Cl ↔ NH3
+ HCl NH4
Cl
При разложении солей нелетучих кислот выделяется аммиак и кислота или её кислая соль:
t
(NH4
)2
SO4
= NH3
+ H2
SO
t
(NH4
)3
PO4
= 2NH3
+ NH4
H2
PO4
Разложение солей аммония, образованных кислотами – окислителями, приводит к окислению иона аммония:
t
(NH4
)2
Cr2
O7
= N2
+Cr2
O3
+ H2
O
t
NH4
NO3
= N2
O +2H2
O
t
NH4
NO2
= N2
+ H2
O
Качественная реакция на соли аммония: NH3
t
NH4
Cl + NaOH = NaCl +NH4
OH
H2
О
Синеет лакмус. бумага
Аммиак – важнейшее сырьё для производства азотной кислоты, солей аммония, взрывчатых веществ, красителей, карбонат аминов, амидов, соды. Аммиак используют как хладореагент в холодильных машинах. Жидкий аммиак – неводный растворитель. Широкое применение находят и соли аммония. NH4
Cl - используют в паяльном деле, для удаления оксидной плёнки металла:
2NH4
Cl + CuO = CuCl2
+2NH3
+ H2
O
(NH4
)2
SO4
, NH4
NO3
, NH4
H2
PO4
– аммофос,
(NH4
)2HPO4
– диаммофос, (NH4
)2
KPO4
– удобрения.
(NH4
)NO3
используют при производстве взрывчатых веществ. NH4
HCO3
– разрыхлитель теста. t NH4
HCO3
= NH3
↑ + H2
O + CO2
↑
(NH4
)2
S, (NH4
)2
CO3
– используют в аналитической химии.
Оксиды азота
Азот образует с кислородом ряд соединений, в которых степень окисления азота изменяется от +1 до +5.
N2
O – диазот оксид, NO – азот монооксид, N2
O3
– диазот триок-
сид, NO2
– азот диоксид, N2
O5
– диазот пентаксид. Все оксиды при н.у. газообразные вещества (кроме оксида азота V) и ядовиты ( кроме оксида (I). N2
O – веселящий газ (диазот оксид).
N2
O
– бесцветный газ со сладковатым вкусом, характерным запахом. Хорошо растворим в воде, с ней не взаимодействует. Безразличный оксид. Легко разлагается:
7000
C
2N2
O↔ 2N2
+ O2
Является энергичным окислителем: N2
O + H2
= N2
+ H2
O
Обладает активным физиологическим воздействием. Вдыхание малых доз этого газа оказывает опьяняющее действие, при больших дозах происходит потеря чувствительности. Обладает анестезирующим действием.
NO
– бесцветный газ, трудно сжигаемый. Плохо растворим в воде. Безразличный оксид, обладает как окислителем, так и восстановительными свойствами: 2NO + O2
= 2NO2
Восстановитель: 2NO + O2
= 2NO2
Окислитель: NO + H2
= N2
+ H2
O Применяется для производства азотной кислоты.
N2
O3
- Легко сжигается газ (t кип. = 3,50
С), разлагающийся на NO и NO2
. Обладает кислотными свойствами, ему соответствует азотистая кислота.
N2
O3
+ H2
O =2HNO2
NO2
– бурый газ, токсичен. При переходе в жидкость бледнеет, а при замерзании образует бесцветные кристаллы. Это объясняется дименирализацией:
2NO2
↔ N2
O4
∆ Н = - 57 кДж
N2
O4
– сложный кислотный оксид, при взаимодействии с Н2
О образует две кислоты. N2
O4
+ H2
O = HN+5
O3
+ HN+3
O3
азотная азотистая
То же самое относится и к NO2
: 2NO2
+ H2
O = HNO3
+ HNO2
2NO2
+ 2NaOH = NaNO3
+ NaNO2
+ H2
O
NO2
– энергичный окислитель и умеренный восстановитель. На энергичных окислительных свойствах основано применение NO2
при нитрозном способе получения серной кислоты NO2
+ O2
= NO +O3
Энергичным восстановителем NO2
может быть превращён в NH3
.
Используется для получения азотной и серной кислот, в органической химии как нитрогирующий агент.
N2
O5
– бесцветное кристаллическое вещество (t плав. = -450
С).
Соединение неустойчивое, легко разлагается: 2N2
O5
= 4NO2
+ O2
Обладает кислотными свойствами, взаимодействует с основаниями и водой:
N2
O5
+ 2 NaOH = 2NaNO3
+ H2
O
(N2
O5
+ 2OH-
= 2NO-
+ H2
O)
N2
O5
+ H2
O = 2HNO3
Проявляет сильные окислительные свойства:
2N+5
2
O5
+ C = C+4
+4N+4
O2
Азотная кислота
– это бесцветная жидкость, при t = 420
С переходит в кристаллическое состояние. На воздухе она дымит, т.к. пары с влагой воздуха образуют мелкие капли. С водой смешивается в любых соотношениях. При хранении на свету приобретает бурый цвет, вследствие разложения с образованием высших оксидов (NO2
)
4HNO3
= 4NO2
+ O2
+2H2
O
Обычно поступает в продажу ώ = 40, с водой образует неустойчивые гидраты.
Обладает всеми свойствами кислот:
1. реакция нейтрализации: HNO3
+ NaOH = NaNO3
+ H2
O;
H+
+ OH-
= H2
O
2. с оксида 2HNO3
+ CaO = Ca(NO3
)2
+ H2
O;
2H+
+ CaO = Ca2+
+ H2
O
Азотная кислота является энергичным окислителем. Взаимодействие с металлами зависит от трёх факторов – концентрация, активность. Ме ., внешних условий:
Al, Cr, Fe, N, Pb пассивир холод
HNO3
очень акт. Ме-
нитрат +NO2
Активные Ме-
нитрат + NO2
oстальные Ме- нитрат + NO2
очень активные металлы нитрат + NH3
HNO3
активные металлы нитрат + N2
O разб.
Остальные металлы нитрат + NO2
HNO3
с большинством металлов нитрат + NH4
NO3
сильно разб.
Влияние внешнего фактора.
t
Zп нитрат + NO2
HNO3
пласт. t
Zп нитрат + N2
изм. кип.
Zп нитрат +NH3
пор.
Влияние на ход реакции активности металла и концентрации кислот.
4HNO3
+Cu = Cu(NO3
)2
+ 2NO2
+ H2
O
2HNO3
+ Ni = Ni(NO3
)2
+ NO + H2
O
9HNO3
+ 4Ca = 4Ca(NO3
)2
+NH3
+ 3H2
O
10HNO3
+ 4Ca = 4Ca (NO3
)2
+ NH4
NO3
+ 3H2
O
8HNO3
+Ni = 4Ni (NO3
)2
+ NO2
+ 5H2
O
10H+5
NO3
+ 4Ca0
= 4Ca+2
(NO3
)2
+ N2
+2
O + 5H2
O
Зависимость взаимодействия от внешних условий.
10HNO3
+ 4Zп = 4Zп(NO3
)2
+ NO2
+ 5H2
O
разб.
12HNO3
+ 5Zп = 5Zп(NO3
)2
+ N2
+ 6H2
O разб. изм.
9HNO3
+ 4Zп (NO3
)2
+ NH3
+ 3H2
O разб. пор.
Действие сильно разбавленной кислоты на большинство металлов.
8Fe +3OHNO3
= 8Fe (NO3
)3
+3NH4
NO3
+ 9H2
O
При нагревании азотной кислоты с неметаллами, азотная кислота восстанавливается до NO2
или NO, а неметаллы окисляются до соответствующих кислородсодержащих кислот.
NO2 S – H2SO4
P – H3
PO4
HNO3
As – H3
AsO4
 NO I2
– HIO3
t NO I2
– HIO3
t
S0 + 6HN+5O3 = H2S+6O4 + 6 N+4O2 + 2H2O
P0
+ 5H+5
NO3
= H3
P O4
+ 5N+4
O2
+ H2
O
Благородные металлы в азотной кислоте не растворяются но растворяются в «царской водке», (смесь из I объема HNO3
и 3 объемов HCl):
HNO3
+ 3HCl = NO + 3Cl + H2
O Аи + HNO3
+ 3HCl = АиСl3
+ NO + 2H2
O
Аи + Cl = АиСl3
Азотная кислота окисляет сульфиды, ход реакции зависит от концентрации кислоты ω HNO3
до 20%, окисляет S –2
до S0
, ω HNO3
= 30% до S+6
, сама при этом восстанавливается до азота монооксида:
3СuS + 8HNO3
= 3Cu (NO3
)2
+3S +2NO + 4H2
O
Азотистая кислота является реактивом на белок (жёлтое окрашивание при контакте с белком – обнаружение азотной кислоты). Действие дифениламина с NO3
–
характерное синее окрашивание. При соприкосновении ионов NO3
-
и Fe2+
на поверхности концентрированной серной кислоты образуется бурое кольцо комплексного иона:
[ Fe (NO) (H2
O5
)] +2
пента акванитрозолий железа П.
Cоли азотной кислоты
нитраты.
Все они хорошо растворимы в воде, при нагревании разлагаются. Разложение по схеме: металл в ряду напряжений:
MgNO2
+ O2
Mg
Cu - Mg MeO + NO2
+O2
 МеNO3
Cu МеNO3
Cu
Me + NO2
+ O2
t
Например: 2KNO3
= 2KNO2
+ O2
t
2Cu (NO3
)2
= 2CuO + 4NO2
t
2AgNO3
= 2Ag + 2NO2
+ O2
Применение:
NaNO3
, KNO3
– удобрения.
KNO3
- используют в кулинарии, при производстве мясных продуктов, в пиротехнике для изготовления пороха.
AgNO3 (ляпис) – вяжущее, противовоспалительное средство. Используют при лечении язв, трещен, трахомы. Кроме того, используется в гальванотехнике, производстве зеркал, фотографии, аналитической химии.
Азотная кислота на 75% используется для производства удобрений, а 15% – для производства взрывчатых веществ. Остальное для получения солей, приготовления “ царской водки “, нитрирования толуола, бензола, фенола, эретификации глицерина, целлюлозы, окисления органических веществ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Опыт 1. Гидролиз солей ортофосфорной кислоты.
В три пробирки налить раствор средней и кислых солей ортофосфорной кислоты. В каждую пробирку добавить по 2-3 капли фенолфталеина. Почему окраска индикатора неодинакова? Какая соль гидролизуется в большей степени? Написать молекулярные и ионные уравнения гидролиза этих солей. Укажите реакцию среды растворов этих солей.
Опыт 2. Качественная реакция на фосфат-ион.
Налить в пробирку 2-3 мл молибденовой жидкости (раствор молибдата аммония (NH4)2МоО4 в концентрированной азотной кислоте) и добавить 2-3 мл раствора соли фосфорной кислоты. Нагреть пробирку и обратить внимание на цвет появляющегося осадка. Осадок имеет состав (NH4)3H4[P(Mo2O7)6].
Написать уравнение реакции.
3. Получение суперфосфата из фосфоритной муки.
а) Перемешать в пробирке с водой небольшое количество фос-
форитной муки Cа3(РО4)2, профильтровать, испытать фильтрат на содержание фосфат-ионов молибденовой жидкостью (опыт 2). Сделать вывод о растворимости фосфоритной муки.
б) Отвесить на технических весах в фарфоровой чашечке 2г
фосфоритной муки, содержащей 45% чистого фосфата кальция, рассчитать, сколько миллилитров 32%-ной серной кислоты (плотностью 1,23г/мл) потребуется для превращения всего фосфата в дигидрофосфат.
в) Обработать этим количеством серной кислоты, взятой из бю-
ретки, навеску фосфоритной муки при постоянном перемешивании кашицы стеклянной палочкой в течение 5-10 минут.
г) Прилить в фарфоровую чашечку 10-15 мл воды, хорошо размешать, профильтровать, испытать фильтрат на содержание фосфатионов (сравнить результат с опытом а). Сделать вывод о растворимости суперфосфата.
Опыт 4. Получение азота
(демонстрационный опыт)
.
В лабораторных условиях азот получают разложением
нитрита аммония t
NH4
NO2
→ N2
+ 2Н2
О.
Нитрит аммония можно получить по реакции
NaNO2
+ NH4
C1 → NH4
NO2
+ NaCl
Возьмите в прибивку немного кристаллического нитрита натрия и прилейте к нему 2-3 мл насыщенного раствор хлорида аммония. Закройте пробирку пробкой с газоотводной трубкой. Укрепите реакционную пробирку в штативе, осторожно нагрейте её, образующийся азот соберите в пробирку, наполненную водой и опущенную в кристаллизатор (рис.1).
Внесите горящую лучинку в про-
 бирку с азотом. Что наблюдаете? Напишите уравнения реакций. бирку с азотом. Что наблюдаете? Напишите уравнения реакций.
Рис 1. Получение азота
5. Термическое разложение хлорида аммония
(тяга).
Возьмите в сухую пробирку несколько кристаллов хлорида аммония. Нагрейте и обратите внимание как на холодных стенках пробирки осаждается белое вещество. Объясните это явление.
Опыт 6.
Качественная реакция на ион аммония и основные
свойства раствора аммиака
(
опыт делать под тягой).
1. В пробирку налейте 2-3 мл раствора соли аммония, прилейте 1-2 мл щелочи и нагрейте до кипения. В выделяющиеся пары внести лакмусовую бумажку. Определите по запаху и изменению цвета лакмусовой бумажки природу выделяющегося газа. Напишите соответствующее уравнение реакции.
2. В пробирку налейте по 2-3 мл раствора хлорида железа (III), и прилейте несколько капель раствора аммиака. Укажите цвета образующегося осадка. Напишите соответствующие уравнения реакций. Сделайте вывод о кислотно-основных свойствах раствора аммиака.
Опыт 7. Окислительные свойства азотной кислоты
(опыт делать под тягой).
1. В три пробирки положите кусочки металлов: в первую - цинка, во вторую – меди, в третью – олова. Добавьте в каждую пробирку по 1-2 мл концентрированной азотной кислоты. (Если реакция не идет – слегка нагрейте). Что происходит? Какой газ выделяется? Напишите уравнения реакций, учитывая, что при взаимодействии с оловом образуется метаоловянная кислота.
2. Повторите опыт с участием разбавленной (10%) азотной кислоты. Что наблюдаете? Составьте уравнения наблюдаемых окислительно-восстановительных реакций.
Опыт 8. Окислительные и восстановительные свойства
азотистой кислоты.
Возьмите две пробирки. В одну налейте 1 мл иодида калия, а в другую I мл перманганата калия. В каждую пробирку добавьте по 1-2 мл раствора H2
S04
2 Н и 1-2 мл насыщенного раствора (или немного сухой соли) нитрита натрия. Что наблюдаете? Напишите уравнения реакций и объясните, какие свойства проявляет нитрит натрия в каждой из реакций.
9. Качественная реакция на ион
NO3
ˉ.
1. В фарфоровую чашечку поместите рядом каплю раствора дифениламина в концентрированной серной кислоте и каплю раствора азотной кислоты.
2. Стеклянной палочкой соедините обе капли. Отметьте наблюдения. Интенсивное синее окрашивание указывает на присутствие аниона NO3- (
или NO2-
)
Задания
1. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) NH4
NO2
N2
Mg3
N2
NH3
NH4
Cl Cu
б) N2
NH3
NO NO2
NaNO2
(NH4
)2
SO4
NH4
HSO4
(NH4
)2
SO4
2. Напишите уравнения реакций, характерные для аммиака: присоединения, замещения, окисления, комплексообразования.
3. Напишите уравнение гидролиза хлорида аммония и карбоната аммония.
4. Допишите уравнения реакций и укажите, при каких условиях они протекают:
а) (NH4
)2
CO3
CO2
б) MgNH4
PO4
MgP2
O7
в) (NH4
)2
Cr2
O7
Cr2
O3
+
г) (NH4
)2
SO4
+ NaOH
д) NH3
+ Na
5 Какова массовая доля (%) аммиака в растворе, полученного растворением 5,6 л аммиака в 50,44 мл аммиака с q=0,95 г\см3
и w=12%. 6.Для обжига 500 кг железного колчедана, с массовой долей примесей 4%, израсходовано 2500 м3
воздуха. Определить объемный состав образовавшейся газовой смеси.
7. Для обжига 500 г синтеза аммиака применяется смесь азота с водородом которая имеет состав: 25% азота, 75% водорода (по объему).
Определить состав этой смеси:
а) в % по массе, б) в молях на литр при н.у.
8. Какой объем, приведенный к н.у. будет занимать аммиак, полученный из смеси 50 г хлорида аммония с 70 г гашенной извести?
9. Какой объем соляной кислоты CHCl
=2 моль/л, потребуется для нейтрализации 20 мл аммиака ρ=0,967 г\см3
и ω=8%.
10. В одном объеме воды при 00
С растворяется 1200 объемов аммиака. Каково содержание аммиака в образующемся при этом растворе (в %) по массе.
11. Напишите уравнения реакций взаимодействия:
а) концентрированной азотной кислоты с серебром и фосфором;
б) разбавленной азотной кислоты с магнием и медью.
12. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
а) NH3
NO NO2
HNO3
NO2
NaNO3
O2
б) NH3
N2
NO NO2
HNO3
NH3
(NH4
)2
SO4
BaSO4
13.Напишите уравнения реакций термического разложения нитратов натрия, меди и ртути.
14.Закончить уравнения окислительно-восстановительных реакций:
а) KNO2
+ K2
Cr2
O7
+ HNO3
= Cr(NO3
)3
+ KNO3
+ H2
O
б) Zn + HNO3
N2
O + …
в) PbS + HNO3
PbSO4
+ …
г) Al + HNO3
+ KOH K3
AlO3
+ NH3
15.Плотность оксида азота NO2
(IУ) по водороду при 700
С равна 27,8. Каково соотношение между числом молекул NO2
и N2
O4
в газе при этой температуре?
16.Сколько мл раствора серной кислоты ρ=1,84 г\см3
и ω=96% потребуется для взаимодействия с 10 г нитрата натрия при слабом нагревании, если 4% её разлагается во время реакции.
17. Сколько литров раствора CNaNO3
=2 моль\л можно приготовить из 500 мл 68%-ного раствора нитрата калия, ρ=1,41 г\мл?
18.Сколько аммиачной селитры получится при нейтрализации 60 г 40% раствора азотной кислоты аммиаком?
19.Напишите реакции термического разложения нитрата свинца, нитрата ртути и нитрата натрия.
20.Сколько требуется фосфорита, содержащего 90% Саз
(РО4
)2
и HaSO4
для получения 1 т суперфосфата?
Лабораторная работа № 7.
Тема: «УГЛЕВОДОРОДЫ ПРЕДЕЛЬНЫЕ И НЕПРЕДЕЛЬНЫЕ»
Контрольные вопросы:
1. Какие углеводороды называются предельными?
2. Какие углеводороды называются непредельными?
3. Приведите общие формулы предельных и непредельных углеводородов.
4. Дайте определение, что такое σ- и π-связи?
5. Какие типы связей характеризуют электронное строение этилена?
6. Какие вы знаете типы гибридизации орбиталей атома углерода и соответствующие им углы между атомами углерода?
7. Каков тип связей имеется в этане?
8. Какое из двух указанных соединений Н3
С – СН = СН - СН3
и СН3
- СН2
- СН2
- СН3
окисляется раствором перманганата калия?
Углеводороды наиболее простые по составу органические соединения состоящие из атомов только углерода и водорода. По строению углеродного скелета они делятся на ациклические (содержат открытые разветвления или линейные углерод-углеродные цепи), и циклические (эпициклические, ароматические) углеводороды.
По характеру связей между атомами углерода различают предельные и непредельные углеводороды.
Предельные содержат только простые или одинарные связи между атомами углерода, непредельные содержат так же и кратные связи - двойные или тройные.
Общая формула предельных углеводородов (алканов, парафинов) Сn
Н2n+2.
Они образуют гомологический ряд, который часто называют рядом метана. Он является основой, из которой выводятся все остальные классы органических соединений. Изомерия предельных углеводородов зависит от структуры углеродного скелета (изомерия цепи или изомерия скелета).
Для наименования углеводородов с разветвленной цепью пользуются двумя номенклатурами.
Одна условно называется рациональной, за основу принимается простейший углеводород-метан: называют в порядке усложнения радикалы расположенные около атома углерода, принятого за остаток метана, затем добавляют слово метан.
Более новой и совершенной является вторая номенклатура, разработанная международной организацией химиков, и называется международной или номенклатурой ИЮПАК. По этой номенклатуре за основу принимают название алкана, соответствующего самой длинной, присутствующей в молекуле цепи углеродных атомов (не считая ответвлений). Цепь нумеруется с того конца, к которому ближе расположено разветвление: указывают числами положение радикалов, затем их название и заканчивают названием углеродорода, взятого за основу
1 2 3 4 5
СН3
– СН – СН – СН2
– СН3
│ │
СН3
СН2
│
СН3
Диэтилизопропил-метан(рн) или 2-метил-З -этилпентан(МН)
Углеродороды с двойной связью называются этиленовыми углеводородами (олефинами, алкенами). Они имеют общую формулу Сn
Н2n
. По рациональной номенклатуре их названия происходят от простейшего члена гомологического ряда-этилена, рассматривая более сложные углеводороды, как происходящие от этилена путем замены водородов на радикалы. Называют радикалы, затем добавляют слово этилен.
По международной номенклатуре выбирают самую длинную цепь углеродных атомов, содержащую двойную связь, и окончание ан алканов заменяется на -ен. Счет углеродных атомов начинают с конца ближнего к двойной связи. Называют ответвления, указывая цифрами их расположение, затем основную цепь с окончанием -ен и указывают цифрой место, где начинается двойная связь:
СН3
│
1 2 3 4 5
СН3
– СН = СН – СН – СН3
Метилизопропилэтилен (рн)
4 - метилпентен - 2 (МН)
Если в молекуле имеется две двойные связи, перед окончанием -ен прибавляют частицу ди-.
1 2 3 4 5
СН2
= СН – СН = СН – СН3
Пентадиент - 1,3 (МН)
Углеводороды с тройной связью, называемые ацетиленовыми углеводородами или алкинами, имеют общую формулу Сn
Н2n-2.
. Названия составляются так же, как и у этиленовых, но по рациональной номенклатуре за основу берется ацетилен, по международной номенклатуре окончание предельных углеводородов - ан заменяется на ин:
СН ≡ С – СН – СН2
– СН3
│
СН3
Фтор - бутилацетилен (рн) 3- метилпентин- 1(МН)
У всех непредельных углеводородов имеются два вида изомерии: изомерия цепи и изомерия положения кратной связи. Кроме того этиленовые углеводороды, имеющие различные (по меньшей мере два) радикала у углеродов связанных двойной связью, могут существовать в виде пространственных изомеров в зависимости от расположения замещающих групп по отношению к двойной связи. Этот зид изомерии называется цис-транс-изомерией или геометрической.
СН3
Н
\ /
С
││
С
/ \
Н3
С Н
Цис-бутен-2
СН3
Н
\ / С
││
С
/ \ Н СН3
транс-бутен-2
Для предельных углеводородов характерна устойчивость к различным реагентам, типичны для них реакции замещения особенно радикального. Непредельные углеводороды значительно более реакционноспособные, для них характерны реакции присоединения, глазным образом электрофильного, реакции окисления и полимеризации, а для ацетиленовых, кроме того, реакции замещения водорода при тройной связи за металл.
Главным природным источником углеводородов является нефть. Углеводороды являются основной составной частью бензинов (моторных топлив).
Причем парафины нормального (линейного) строения сгорают с большей детонацией чем углеводороды с разветвленной цепью.
За стандарт моторного топлива принят изомер эктана-2,2,4-триметил-пентан, обычно называемый изооктаном, для которого октановое число принято 100, а для октана нормального строения 0.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ.
Опыт 1. Бромирование углеводородов
1. В две сухие пробирки поместите по 1 мл исследуемого углеводорода (предельного и непредельного) и добавьте по каплям при легком встряхивании равный объем раствора брома. Если желтая окраска не исчезает, то смесь слегка нагрейте. Отметьте изменение цвета в одной из пробирок.
2. Установите, сопровождается ли исчезновение окраски, обусловленной присутствием свободного брома, образованием бромистого водорода с помощью синей лакмусовой бумажки и стеклянной палочки смоченной в аммиаке.
3. Составьте уравнения происходящих реакций бромирования на примере бутана, бутена-2 и бутина-1.
4. Сделайте вывод о реакционной способности предельных и непредельных углеводородов и возможности использования данной реакции для качественного и количественного анализа непредельных веществ, а также степени непредельности чистых индивидуальных соединений.
Примечание: НВr – газ, имеющий резкий запах, дымящий на воздухе, особенно при внесении в пробирку палочки, смоченной в аммиаке и окрашивающий влажную синюю бумажку в красный цвет.
Характерное для непредельных углеводородов присоединение брома по кратным (двойным, тройным) связям, сопровождающееся обесцвечиванием раствора, обычно протекает быстро. Во многих случаях бром может замещать атомы водорода (особенно при третичных атомах углерода) в углеводородах различных типов. Этот процесс замещения также ведет к обесцвечиванию раствора, но протекает обычно гораздо медленнее, чем присоединение, требует нагревания, освещения или присутствия катализатора и сопровождается вы делением бромистого водорода.
Реакции бромирования представителей алканов и алкенов идут по следующим схемам:
СН3
СН3
СН3
СН3
I I | I
СН3
- С = СН -СН -СН3
+ Вг2
—►СН3
– СВг – СНВг –СН – СН3
2,4-диметилпентен-2
2,3-дибром-2,4-диметилпентан
СН3
СН3
СН3
СН3
I I I I
СН3
- СН - СН2
- СН - СН3
+ Вг2
—►СН3
- СВг-СН2
– СН - СН3
+НВг ↑
2,4-диметилпентан
2-бром-2,4-диметшпентан
Одновременно, конечно, могут получаться продукты дальнейшего бромирования и другие изомерные бромзамещенные алканы.
Для реакций бромирования особенно удобно применять растворы брома в органических растворителях, так как с углеводородами они дают гомогенную смесь. Поэтому реакции протекают быстрее, а выделение нерастворимого в этой среде бромистого водорода обнаруживается с полной определенностью, что ясно указывает на протекание реакции замещения. Применение бромной воды при работе с жидкими веществами в большинстве случаев менее удобно, так как бромирование идет медленнее, требует энергичного взбалтывания, а образование бромистого водорода, хорошо растворимого в воде, качественно обнаружить не удается. Наконец, бромная вода в ряде случаев является не только бромирующим реагентом, но и окислителем, что затрудняет истолкование причин исчезновения окраски реакционной смеси.
Если точно учитывать количество брома, добавляемого до прекращения его связывания, то реакцию бромирования можно применять к углеводородам и другим органическим веществам не только для количественного анализа непредельных веществ, но и как метод определения степени нenpeдельности (числа кратных связей) чистых индивидуальных соединений. Однако, необходимо учесть, что, например, амины, фенолы ,большинство вторичных и третичных спиртов, альдегидов кетонов, даже если они не содержат кратных связей, также быстро обесцвечивают раствор брома, причем амины часто реагируют без выделения НВr.
Опыт 2. Окисление углеводородов перманганатом калия.
(реакция Вагнера)
1. В две пробирки поместите по 1 мл исследуемых углеводородов (предельных и непредельных), добавьте сначала равный объем раствора карбоната натрия (соды) и затем постепенно по каплям при сильном взбалтывании раствор перманганата калия до прекращения изменения внешнего вида смеси.
2. Составьте уравнения возможных реакций окисления на примере бутана, бутена-2 и бутина-1.
3. Сделайте вывод о возможности и степени окисления предельных и непредельных углеводородов.
Примечание:
Наличие непредельных соединений обнаруживается по исчезновению первоначальной окраски раствора КМпО4
.
Как и в случае бромирования, даже очень малое количество ненасыщенных соединений в смеси уже вызывает изменение окраски первых капель реактива. Изучаемые твердые и жидкие органические вещества можно исследовать этим методом также и в растворах или суспензиях
— в воде, ацетоне и т. п.
В результате накопления в смеси оксида марганца(1У) тогда маскируется изменение окраски. В этом случае опускают в смесь полоску фильтровальной бумаги, которая всасывает лишь раствор, но не осадок, и окраска раствора наблюдается вполне отчетливо.
Окисление непредельных соединений перманганатом калия сопровождается образованием гликоля и щелочи:
ЗН2
С = СН2
+ 2КМпО4
+ 4Н2
О→ ЗСН2
-СН2
+ 2МпО2
+ 2 КОН
│ │
ОН ОН
этандиол-1,2
Часто окисление не останавливается на образовании гликоля и проходит дальше: получаются альдегиды, кетоны и, главным образом, кислоты, причем молекула исходного соединения расщепляется по месту кратной связи. Оксид марганца (IV) каталитически ускоряет окисление органических соединений в описанных условиях, поэтому окисление щелочным раствором КМпО4
веществ, содержащих двойные или тройные связи между атомами углерода, сначала идет медленно, а затем, с накоплением МпО2
, обычно протекает быстро. Некоторые соединения, не содержащие кратных связей (например, муравьиная, щавелевая, лимонная кислоты, альдегиды, фенолы, многие кетоны, глицерин и т.п.), также быстро окисляются этим реактивом. Однако, большинство насыщенных соединений, в том числе предельные углеводороды, не реагируют с щелочным раствором КМпО4
или взаимодействуют с ним лишь очень медленно. Имеются редкие случаи устойчивости к действию перманганата калия и ненасыщенных соединений.
Опыт 3. Взаимодействие углеводородов с концентрированной серной кислотой
1. В 2 пробирки налейте по 1 мл углеводородов (насыщенных и ненасыщенных) и добавьте в каждую по 1 мл концентрированной серной кислоты.
2. Осторожно взболтайте пробирки, охлаждая их в воде.
3. Отметьте различное отношение насыщенных и ненасыщенных углеводородов к серной кислоте. Сделайте вывод.
Примечание:
Предельные и ароматические углеводороды, а так же их галогенпроизводные устойчивы к действию серной кислоты при низкой температуре. Непредельные углеводороды, спирты, фенолы, эфиры довольно легко растворяются в холодной концентрированной серной кислоте с образованием алкилсерных кислот общей формулой ROSO2
OH (присоединение к непредельным углеводородам осуществляется по месту разрыва двойной связи). Атом водорода серной кислоты присоединяется к наиболее гидрогенизированному атому углерода из связанных двойной связью, а кислотный остаток (в данном случае -OSO2
OH) - к соседнему с ним (правило Марковникова). При повышении температуры алкилсерная кислота может присоединяться по двойной связи новой молекулы олефина, а последующее отщепление H2
SO4
дает димер исходного углеводорода, снова содержащий двойную связь. Дальнейшее повторение аналогичного процесса ведет к образованию все более сложных полимеров.
Опыт 4. Получение и свойства ацетилена
1. Приготовьте три пробирки: одну - с 2 мл бромной воды, вторую - с 2мл подкисленного раствора КМпО4
, третью - с 2мл аммиачного раствора оксида серебра.
2. В пробирку с отверстием в дне на небольшой слой стекловаты поместите 3-4 кусочка карбида кальция, Пробирку закройте пробкой со вставленной в неё газоотводной трубкой и закрепите вертикально в штативе. Подведите под пробирку стакан с водой так, чтобы уровень воды был значительно выше слоя карбида в пробирке. Через отверстие в дне вода поступает в пробирку и взаимодействует с карбидом кальция. Образующийся при этом ацетилен выделяется через газоотводную трубку.
3. Выделяющийся ацетилен пропустите последовательно через подготовленные (п.1) растворы брома, перманганата калия и аммиачного раствора оксида серебра. Отметьте наблюдения. Объясните происходящие явления.
4. Поднимите газоотводную трубку вверх и подожгите ацетилен. Каким пламенем горит ацетилен?
5. Составьте уравнения реакций получения ацетилена, его горения и взаимодействия с бромом, водным раствором перманганата калия и аммиачным раствором оксида серебра.
6. На основании наблюдений сделайте вывод о физических и химических свойствах ацетилена.
Примечание - Реакция получения ацетилена экзотермична :
СаС2
+ 2Н2
О
= Са(ОН)2
+ НС
≡ CH + 139ккал
При получении больших количеств ацетилена реакция может пойти слишком энергично. Чтобы ацетилен выделялся более спокойно и равномерно, вводят в реакцию с карбидом кальция не чистую воду, а смесь ее со спиртом (1:1,) либо насыщенный раствор поваренной соли.
При присоединении брома к ацетилену сначала образуется 1,2дибромэтилен СНВr=СНВr и далее 1,1,2,2-тетрабромэтан СНВr2
— СНВr2
. При окислении ацетилена перманганатом калия в кислой и нейтральной среде образуются главным образом СО2
и муравьиная кислота, а в щелочной среде
- сначала гликолевып альдегид СН2
ОНСНО, затем щавелевая кислота
НООС—СООН,
При пропускании ацетилена через аммиачный раствор оксида серебра или хлорида меди (I) выпадают в осадок ацетилениды серебра и меди (I). Реакции идут по типу электрофильного замещения и служат для обнаружения алкинов с тройной связью на конце цепи:
НС =
СН + 2[Ag(NH3
)2
]OH → Ag – С ≡ С - Ag +4NH3
+2H2
O,
R – С =
СН + [Cu(NH3
)2
]Cl → R-C ≡ C-Cu+ NH4
C1 + NH3
Ацетилениды серебра и меди как соли очень слабых кислот легко разлагаются при действии хлороводородной кислоты с выделением исходного алкина :
R – С ≡ С - Сu + НС1→ R - С = СН + СuС1
Таким образом, используя реакции образования и разложения ацетиленидов, можно выделять алкины из смесей с другими углеводородами. При взрыве ацетиленидов образуются свободный углерод и металл в раздробленном состоянии.
Задания.
1. Напишите уравнения реакции получения ацетилена из карбида кальция.
2. Напишите уравнения реакции присоединения брома к ацетилену.
3. Напишите уравнения реакции окисления ацетилена перманганатом калия.
4. Напишите уравнения реакции Вюрца с двумя молекулами 2хлорбутана. Назовите полученное соединение. 5. Напишите формулы следующих углеводородов:
2,5 – диметилгексан
2- метилгексен-3
3,4-диметилпентин-1
3-метил-3-этилпентан
Метилацетилен
3,3-диэтилгексан
5-метилгексин-2
2,5-диметилгексин-3
3-этилдекан
Гексадиен-2,4
Пентин-2
Гексадиен-1,2
Гексин-3
Диметилацетилен
5-метилгексен-1
Лабораторная работа № 8.
Тема: ХИМИЧЕСКАЯ КИНЕТИКА. СКОРОСТЬ
ХИМИЧЕСКОЙ РЕАКЦИИ.
Контрольные вопросы.
1. Что называется скоростью химической реакции?
2. От каких факторов зависит скорость химической реакции?
3. Что такое константа скорости химической реакции?
4. Как влияет температура на скорость химической реакции?
5. Влияет ли концентрация реагирующих веществ на скорость реакции?
6. Что такое порядок реакции и как его определить?
7. В чем сущность катализа? Какой бывает катализ?
8. Почему катализатор влияет на скорость химической реакции?
9. Что такое энергия активации?
10. Что такое период полураспада и зависит ли он от концентрации вещества?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ.
Скоростью химической реакции
называется изменение концентрации реагирующих веществ или продуктов реакции в единицу времени. Она зависит от природы самих веществ, от их концентрации, от температуры и других условий, в которых протекает реакция.
Уравнение химической реакции может быть изображено в виде А+В=С+Д или мА+пВ=рС+gД, где А,В,С,Д - вступающие в реакцию и образующиеся вещества, а м,п,р,g - коэффициенты, показывающие, в каких молярных количествах они вступают во взаимодействие или образуются.
Зависимость скорости химической реакции от концентрации реагирующих веществ называется законом действия масс и выражается уравнением v = К(А)(В) или v = К(Д)(В), где v- скорость реакции, К-коэффициент пропорциональности (константа скорости).
Константа скорости
К зависит от природы самих веществ и от температуры и не зависит от концентрации веществ, вступающих в реакцию.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Зависимость скорости реакции от концентрации реагирующих веществ. Опыт проводится с серной кислотой Н2
SO4
и раствором тиосульфата Na2
S2
O3
Опыт 1. Предварительный качественный опыт
. Смешав в пробирке по 1-2 мл обоих растворов, произвести наблюдение, записать опыт, написать уравнения происшедших реакций.
Опыт 2. Зависимость скорости реакции от концентрации.
а) Отмерить в три пробирки по 5 мл раствора тиосульфата, а в три стаканчика (колбочки) большие пробирки, серную кислоту и воду. В первый стаканчик отмерить 15 мл серной кислоты; во второй-10 мл воды. Воду брать дистиллированную.
б) Смешать попарно пробирки с раствором тиосульфата с растворами в стаканчиках, быстро перемешать и точно отметить время от момента смешивания до появления мути для каждой смеси и записать его в заранее подготовленную таблицу 1. Опыт ведется при комнатной температуре, ее надо отметить.
в) на основании этих опытов установить:
какова зависимость между скоростью реакции и концентрацией веществ, вступивших в реакцию? Выразить её в виде кривой откладывая по оси абсцисс время в минутах, а по оси ординат число мл серной кислоты:
Скорость какой из двух протекающих реакций наблюдается в данном случае?
Таблица 1
| Объем серной кислоты
|
Объем дистил.
воды
|
Объем тиосульфата
|
Время, сек.
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
Опыт 3. Зависимость скорости реакции от температуры
а) отмерить в одну пробирку 10 мл раствора тиосульфата, а в другую10 мл серной кислоты и поместить обе пробирки в тающий снег. Когда они охладятся до 0о
С , слить оба раствора и отметить по часам промежуток времени от сливания растворов до появления мути.
б) повторить опыт с другой пары пробирок с такими же растворами, охладив их в воде до температуры + 10 о
С. Смешав растворы, опять отметить точно время по часам.
в) еще одну пару пробирок с растворами серной кислоты тиосульфата нагреть до +20о
С в воде. Время надо отмечать точно по часам.
Для успеха опыта необходимо каждый раз дождаться, чтобы пробирки с растворами приняли температуру воды, и только после этого сливать растворы вместе и отмечать время начала реакции а затем - появление мути.
г) результаты наблюдения занести в таблицу 2 и сравнить между собой. Во сколько раз возрастает скорость реакции в данных опытах при повышении температуры на 10о
С.
Таблица 2
| Температура, о
С
|
Объем серной кислоты
|
Объем тиосульфата
|
Время, сек.
|
| |
|
|
|
| |
|
|
|
| |
|
|
|
Задания.
1. Приведите примеры гомогенного и гетерогенного катализа.
2. Напишите выражение закона действия масс для реакций
2NO(г)+Cl2(г) →2NOCl (г)
CaCO3(тв)
→ CaO(тв)
+ CO2 (г)
3. Как изменится скорость реакции 2NO(г)
+ О2 (г)
→ 2NO2 (г)
, если уменьшить объем газовой смеси в 3 раза?
4. Температурный коэффициент скорости реакции равен 2,8. Во сколько раз возрастает скорость реакции при повышении температуры от 20° до 75°С?
5. Для химического процесса Fe2
O3(тв)
+3CO(г)
↔2Fe(тв)
+3CO2(г)
укажите, во сколько раз увеличится скорость прямой реакции при увеличении концентрации оксида углерода (II) в 2 раза?
6. Во сколько раз возрастет скорость химической реакции при повышении температуры на 40ºС, если температурный коэффициент равен 2?
7. Во сколько раз возрастет скорость химической реакции при повышении температуры на 40ºС, если температурный коэффициент равен 2?
8. Химической реакции в растворе отвечает уравнение А + В = С. Как изменится ее скорость, если концентрацию вещества В увеличить в 2 раза, оставив концентрацию вещества А прежней?
9. Во сколько раз надо увеличить давление, чтобы скорость образования NO2
по реакции 2NO + O2
= 2NO2
возросла в 1000 раз?
10. В системе, где происходит реакция H2
+Cl2
↔2HCl увеличили давление в 3 раза. Во сколько раз при этом возросла скорость синтеза
HCl?
11. Как изменится скорость химической реакции при понижении температуры на 30º, если температурный коэффициент скорости равен 2?
12. На сколько градусов нужно повысить температуру, чтобы скорость реакции увеличилась в 16 раз, если температурный коэффициент скорости равен 2?
Лабораторная работа № 9.
Тема: «КОЛОРИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ СОЕДИНЕНИЙ
МЕДИ(II) В РАСТВОРАХ»
Контрольные вопросы:
1. В чём сущность метода колориметрии? Каковы её преимущества и область её применения?
2. Перечислить методы колориметрии.
3. Какие растворы в калориметрии называют стандартными?
4. На чём основана фотоколориметрия? В чём состоит отличие её от визуальной колориметрии?
5. В чём сущность фотоколориметрии?
6. Описать принципиальную схему устройства фотоколориметра.
7. Какова должна быть окраска светофильтра, если окраска раствора зелёная, пурпурная?
8. Что значит градуирование (калибрование) прибора (фотоколориметра в частности)? Для чего это нужно?
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Колориметрические методы относятся к физико-химическим методам анализа. Они основаны на сравнении или измерении поглощения света окрашенными растворами.
В сельскохозяйственных анализах широко применяются два
способа колориметрии:
Визуальный
(субъективный) – проводимый сравнением на глаз окраски исследуемого раствора с окраской стандартных растворов, в которых концентрация определяемых веществ известна. В данной лабораторной работе изучается способ визуального определения pH неизвестного раствора.
Фотоколориметрический
(объективный) – в нём роль глаза наблюдателя выполняют фотоэлементы. Этот способ широко применяют для определения содержания макро- и микроэлементов в почве, в биологических материалах, содержание хлорофилла в растениях и т.д. Работа по этому способу проводится с помощью специальных приборов – фотоколориметров. Для этого метода в данной лабораторной работе проводится фотоколориметрическое определение содержания меди в растворе.
Колориметрическое определение pH раствора визуальным
методом сравнения.
Для визуального колориметрирования изготовляют серию буферных растворов с возрастающими значениями pH, например – 2, 4, 6, 8, 10, 12 (для лабораторного занятия их готовят заранее лаборанты).
Затем берут соответствующее этой серии растворов количество совершенно одинаковых по диаметру и прозрачности пробирок. Помещают их в штатив и наливают тщательно в каждую пробирку одинаковое количество (по 5 мл) буферного раствора с постепенно увеличивающимся значением pH. Прибавляют в каждую пробирку по 2 капли кислотно-основного индикатора (какие индикаторы применять - указывает преподаватель) и перемешивают.
В зависимости от значения pH индикатор по-разному окрашивает раствор в пробирках. Таким образом, получают две калориметрические шкалы с различными интервалами перехода окраски.
Задача
: Для определения pH неизвестного раствора берут 2 такие же пробирки, как и для приготовленных шкал, наливают в них такое же количество анализируемого раствора (5 мл), добавляют по 2 капли тех же индикаторов и перемешивают.
Вывод о значении pH исследуемого раствора делается из сравнения окраски этих пробирок с окраской пробирок обоих колориметрических шкал.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Фотоколориметрическое определение меди в растворе.
Работа проводится на фотоэлектроколориметрах ФЭК-56 или ФЭК-56М.
Это двухлучевые фотоколориметры. Их принципиальная оптическая схема приведена на рис.1.
1 Источник излучения (лампа накаливания или ртутно-кварцевая лампа).
2. Зеркала.
3. Светофильтры.
4. Кюветы (левая кювета с чистым растворителем, правая – или также с чистым растворителем, или с исследуемым раствором).
5. Диафрагмы.
6. Фотоэлементы.
7.Микроамперметр.
8.Электропровода.

Рис.1
1. Принцип работы
(см. схему рис.1).
При попадании световых лучей на фотоэлементы в них возникает электрический ток. Если световые потоки (освещённость фотоэлементов) одинаковы, то и электрические токи на фотоэлементах тоже одинаковые. Микроамперметр, соединённый с обоими фотоэлементами, при этом даёт нулевые показания.
Если в левую кювету налить бесцветный растворитель, а в правую – окрашенный раствор, то световые потоки будут уже неодинаковы, так как раствор поглощает больше световых лучей, чем бесцветный растворитель. Теперь, чтобы добиться нулевого показания микроамперметра, нужно уменьшить световой поток через левую кювету с помощью барабана левой диафрагмы.
Затем кювета с окрашенным раствором в правом луче заменяется кюветой с бесцветным растворителем из того же кюветодержателя. При этом стрелка микроамперметра снова смещается с «0», так как интенсивность светового потока, падающего на правый фотоэлемент, увеличивается.
Вращением барабана правой диафрагмы уменьшают интенсивность правого светового потока до интенсивности светопотока, получившегося перед этим от первоначального луча после прохождения его через окрашенный раствор. Этим добиваются, чтобы стрелка микроамперметра опять была на «0».
Получающийся теперь на шкале правого барабана отсчёт (цифра) и есть искомая величина, то есть коэффициент светопропускания исследуемого раствора в процентах.
Коэффициент светопропускания (Д) – это есть отношение интенсивности светового потока, прошедшего через растворитель (Ф), умноженное на 100%:
Д
=  Ф
1
⋅100% Ф
2 Ф
1
⋅100% Ф
2
Поскольку максимальный световой поток (Ф) в ФЭКе по шкале барабанов соответствует цифре 100 (шкала регулирования отверстия диафрагмы откалибрована от 1 до 100), то получаемый по шкале отсчёт (Д) будет соответствовать световому потоку Ф1
:
 Ф Ф
Д
 Ф
1 Ф
1
При измерении предлагаемым способом отсчёты коэффициентов светопропускания растворами проводятся только на шкале правого барабана. Левый барабан и связанные с ним фрагмы и фотоэлемент играют компенсационную роль.
Подготовка фотоколориметра к работе.
Убедившись, что ручка регулирования чувствительности (7) до конца повёрнута по часовой стрелке (находится в положении «0»), подключить прибор к сети. Для этого нужно вилку стабилизатора (этот блок питания находится рядом с прибором) вставить в розетку, соединённую с заземлённой шиной.
Включить тумблером на стабилизаторе осветительную лампу РН8-35, а другой тумблер на стабилизаторе поставить на позицию «ВКЛ», т.е. подать на прибор сетевое напряжение.
С помощью ручки (9) установить красный светофильтр - № 9 (выбор светофильтра зависит от цвета исследуемого раствора).
Оставить прибор на 30 мин включённым без прогрева.
Установить «электрический нуль». Для этого с помощью ручки
(6) перекрывают шторкой оба световых потока и корректором (ручка 8) устанавливают стрелку миллиамперметра на «0», после чего шторку открывают. «Электрический нуль» проверяется время от времени и в период работы на приборе.
Установить чувствительность прибора поворотом ручки (7) так, чтобы при раскрытии правой измерительной диафрагмы (правый барабан (2)) на 1% стрелка микроамперметра отклонилась на 1-3 деления.
Рис. 2 ФЭК 56М
1 Переключатель правых кювет.
2 Барабан правой диафрагмы.
3 Барабан левой диафрагмы.
4 Микроамперметр.
5 Крышка кюветной камеры.
6 Ручка шторки (открывает и закрывает световое окно).
7 Ручка регулировки чувствительности.
8 Ручка установления «электрического нуля».
9 Ручка смены светофильтров.
10 Осветитель.
11 Юстировочные винты осветителя.
Работа на приборе (проведение измерений)
.
Последовательность операций на ФЭК-56 и ФЭК-56М одна и та же.
В левый кюветодержатель под луч света на всё время измерений устанавливается кювета с растворителем (здесь дистиллированная вода).
В правый кюветодержатель помещаются две кюветы. Одна также с растворителем, как и в левом, а другая – с исследуемым веществом.
Под правый луч света сначала помещается кювета с исследуемым раствором. Индекс шкалы правого барабана устанавливается на отсчёт (Д=100%). Вращением левого измерительного барабана добиваются установки стрелки микроамперметра на «0».
Примечание: Если левый измерительный барабан установить на «0» не удаётся, то под правый луч устанавливается ещё нейтральный (серый) светофильтр (как добавочный поглотитель) и на микроамперметре добиваются «0» вращением левого измерительного барабана.
Затем, с помощью переключателя (1), в правом луче кювета с раствором заменяется кюветой с растворителем. При этом происходит смещение стрелки микроамперметра от «0».
Вращением правого измерительного барабана добиваются первоначального положения стрелки и отсчитывают по шкале правого барабана величину коэффициента пропускания (Д %) световых лучей.
Измерение рекомендуется повторить.
После окончания измерений поворотом тумблера сетевого напряжения (на стабилизаторе) на позицию «ВЫКЛ» выключается прибор.
Построение градуировочной кривой.
Перед работой прибор нужно откалибровать по тому веществу, концентрацию которого в исследуемом растворе нужно определить.
В данной лабораторной работе калибруем прибор (строим градуировочный график) по медьсодержащему водному раствору.
Для этого используется приготовленный заранее (лаборантами) стандартный раствор CuSO4
* 5H2
O, содержащий в 1 мл 1 мг иона
Cu2+
.
Из этого раствора готовится шесть растворов с известной концентрацией иона Cu2+
, например – 0,5; 0,4; 0,3; 0,2; 0,1 и 0,06 мг в 1 мл. Для приготовления таких растворов в шесть мерных колб ёмкостью по 50 мл нужно отмерить пипетками соответственно 25, 20, 15, 10, 5 и 3 мл стандартного раствора меди. В каждую из колб прибавить по 10% раствора аммиака и довести объёмы жидкостей в колбах дистиллированной водой до метки и перемешать.
Далее нужно провести измерение оптической плотности (Д %) каждого из этих растворов. Начать измерение лучше с раствора с наибольшей концентрацией меди.
Для измерений используются кюветы с рабочей длиной 1 см. Перед измерением в две кюветы налить дистиллированной воды и поставить одну в левый кюветодержатель, а другую – в одно гнездо правого кюветодержателя. В третью кювету налить измеряемый раствор. Поставить её во второе гнездо правого кюветодержателя и провести измерение, как описано в пункте «Работа на приборе».
Примечание. При заполнении и установке кювет нужно следить, чтобы рабочие поверхности кювет не были захватаны пальцами.
Эти поверхности нужно протирать мягкой и чистой тканью.
После измерения кювету с измеряемым раствором вынуть, раствор вылить, промыть кювету следующим измеряемым раствором, потом заполнить её, снова поставить в правый кюветодержатель и провести измерение и т.д.
Данные по оптической плотности внести в таблицу:
| Cu, мг/мл
|
Коэффициент пропускного измерения, Д %
|
| 1
|
2
|
среднее
|
| 0,5
|
|
|
|
| 0,4
|
|
|
|
| 0,3
|
|
|
|
| 0,2
|
|
|
|
| 0,1
|
|
|
|
| 0,06
|
|
|
|
По данным из таблицы строится градуировочная кривая (на миллиметровой бумаге), Рис.3.
Определение меди в исследуемом растворе.
Выданный преподавателем раствор с медьсодержащим веществом количественно перенести в мерную колбу на 50 мл.
Прилить 10 мл аммиака и довести объём жидкости в колбе водой до метки. Раствор тщательно перемешать, наполнить им кювету (1см) и измерить оптическую плотность, как было описано.
Значение плотности записать в тетрадь и по её величине на градуировочном графике находим соответствующую концентрацию иона Cu в мг/мл.
Умножив её на объём мерной колбы (50 мл), вычислите общее количество меди, а затем и количество той или иной соли меди, указанной преподавателем.
Задания.
1. Сколько химически чистого CuSO4
*5H2
O нужно взять для приготовления 800 мл стандартного раствора, содержащего 2 мг Cu(2+) в 1 мл?
2. Концентрация одного из сравниваемых в колориметре растворов равна 0,02мг/мл, а высота слоя – 10 мм. При какой высоте слоя другого раствора того же окрашенного вещества, содержащего 0,015 мг/мл его, окраска будет казаться такой же, как у первого раствора? Ответ: 13,3 мм.
3. Из 2,0 г вещества с неизвестным содержанием Fe2
O3
приготовили 100 мл раствора, окрашенного в красный цвет. При фотоколориметрировании его окраска совпала с окраской раствора, содержащего 0,1 мл Fe2
O3
в 1 мл. Вычислить кислородное содержание Fe2
O3
в веществе. Ответ: 0,5%.
ПРИЛОЖЕНИЕ
Таблица 1 – Константы диссоциации некоторых слабых электролитов в водных растворах при 25°С
| Электролит
|
К
|
Электролит
|
К
|
| NH4
OH
НСООН
СН3
СООН
H2
S K1
K2
H2
CO3
K1
K2
|
1,8·10-3
1,8·10-4
1,8·10-5
6·10-8
1·10-14
4,5·10-7
4,7·10-11
|
H3
PO4
K1
K2
K3
HF
HCN
H2
SO3
K1
K2
|
7,5·10-3
6,3·10-8
1,3·10-12
6,6·10-4
7,9·10-10
1,6·10-2
6,3·10-8
|
Таблица 2 – Произведения растворимости некоторых малорастворимых электролитов при 25°С.
| Электролит
|
ПР
|
Электролит
|
ПР
|
| AgBr
AgCl
AgI А1(ОН)3
ВаСО3
BaSO4
|
5,3·10-13
1,8·10-10 8,3·10-17
1,9·10-33 5,1·10-9
1,1·10-10
|
СаСОз
СаСО4
CuS
CdS
ZnS
MnS
|
4,8·10-9
6,1·10-5
6,3·10-36
7,9·10-27
1,6·10-24
2,5·10-10
|
Таблица 3 – Константы нестойкости комплексных ионов
| Схема диссоциации комплексного иона
|
К нестойкости
|
| [Ag(NH3
)2
]+
↔Ag+
+2NH3
[Ag(NO2
)2
]-
↔Ag+
+2NO2
-
[Ag(S2
O3
)2
]3-
↔ Ag+
+ 2S2
O3
2-
[HgBr4
]2-
↔Hg2+
+4Br-
[Cu(NH3
)4
]2+
↔Cu2+
+4NH3
[Ag(CN)2
]-
↔Ag+
+2CN-
[Hg(CN)4
]2-
↔Hg2+
+4CN-
|
5,7·10-8
1,3·10-3
2,5·10-14
1,0·10-21
2,1·10-13
1,4·10-20 4·10-42
|
ЛИТЕРАТУРА:
а) основная
1. Ахметов Н. С. Общая и неорганическая химия, – М.: Высшая школа, 2003.
2. Саргаев Г.М. . Неорганическая химия. – М.: Колос, 2005.
3. Васильев В.П. Аналитическая химия, – Книга 1,2 - М.: Дрофа, 2003.
4. Некрасов Б.В. Основы общей химии. В 2-х томах. – СПб.: Лань, 2003.
5. Васильев В.П. Лабораторный практикум по аналитической химии, - М.: Дрофа, 2004.
б) дополнительная
6. Хомченко Г. П., Цитович И. К. Неорганическая химия. — М.: Высшая школа, 1987.
7. Цитович И. К.
Курс аналитической химии, — М.: Высшая школа, 1985.
8. Глинка Н. Л.
Общая химия. - М.: Химия, 1985 и другие более поздние издания.
9. Коровин Н.В. Общая химия: Учеб. для вузов. – М.: ВШ, 2000.
10. Угай А.Я. Общая и неорганическая химия: Учеб. для вузов. – М.: ВШ, 2000.
11. Князев Д.А., Смарыгин С.Н. Неорганическая химия. - М.: ВШ, 1990.
12. Некрасов В.В. - Руководство к малому практикуму по органической Химии, М., "Химия", 1975.
13. Грандберг И.И. - Органическая химия, М., "Высшая школа", 1987
14. Галинкер И.С., Медведев П.И. Физическая и коллоидная химия. М:Высшая школа,1972.
СОДЕРЖАНИЕ:
Предисловие 3
I . ОБЩИЕ ПРАВИЛА РАБОТЫ В ХИМИЧЕСКИХ
ЛАБОРАТОРИЯХ 4
II. ЛАБОРАТОРНЫЙ ПРАКТИКУМ 6
Лабораторная работа № 1 ПРИГОТОВЛЕНИЕ
РАСТВОРОВ ЗАДАННОЙ КОНЦЕНТРАЦИИ 6
Лабораторная работа № 2 ЭЛЕКТРОЛИТИЧЕСКАЯ
ДИССОЦИАЦИЯ. ГИДРОЛИЗ СОЛЕЙ. 13
Лабораторная работа № 3 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ. 20
Лабораторная работа № 4 ОКИСЛИТЕЛЬНО-
ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ. 26
Лабораторная работа № 5 ИЗУЧЕНИЕ СВОЙСТВ ГАЛОГЕНОВ,
СЕРЫ И ИХ СОЕДИНЕНИЙ 30
Лабораторная работа № 6 ИЗУЕНИЕ СВОЙСТВ АЗОТА И ФОСФОРА
И ИХ СОЕДИНЕНИЙ 42
Лабораторная работа № 7 УГЛЕВОДОРОДЫ ПРЕДЕЛЬНЫЕ И
НЕПРЕДЕЛЬНЫЕ. 57
Лабораторная работа № 8 ХИМИЧЕСКАЯ КИНЕТИКА. СКОРОСТЬ
ХИМИЧЕСКОЙ РЕАКЦИИ 66
Лабораторная работа № 9 КОЛОРИМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ
СОЕДИНЕНИЙ МЕДИ(II) В РАСТВОРАХ 69
Приложение 77
Литература 78
|