| 
Единый государственный экзамен по ХИМИИ
Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2012 года по химии
подготовлен Федеральным государственным научным учреждением
«ФЕДЕРАЛЬНЫЙ ИНСТИТУТ ПЕДАГОГИЧЕСКИХ ИЗМЕРЕНИЙ»
(2012 - 2 / 20)
Единый государственный экзамен по ХИМИИ
Пояснения к демонстрационному варианту контрольных измерительных материалов единого государственного экзамена 2012 года по ХИМИИ
При ознакомлении с демонстрационным вариантом контрольных измерительных материалов ЕГЭ 2012 г. следует иметь в виду, что задания, в него включённые, не отражают всех вопросов содержания, которые будут проверяться с помощью вариантов КИМ в 2012 г. Полный перечень вопросов, которые могут контролироваться на едином государственном экзамене 2012 года, приведён в кодификаторе элементов содержания и требований к уровню подготовки выпускников общеобразовательных учреждений для единого государственного экзамена 2012 г. по химии.
Назначение демонстрационного варианта заключается в том, чтобы дать возможность любому участнику ЕГЭ и широкой общественности составить представление о структуре будущих КИМ, количестве заданий, об их форме, уровне сложности: базовом, повышенном и высоком. Приведённые критерии оценки выполнения заданий с развёрнутым ответом, включённые в этот вариант, дают представление о требованиях к полноте и правильности записи развёрнутого ответа.
Эти сведения позволят выпускникам выработать стратегию подготовки к ЕГЭ.
(2012 - 3 / 20)
Демонстрационный вариант контрольных измерительных материалов для проведения в 2012 году единого государственного экзамена по ХИМИИ
Инструкция по выполнению работы
На выполнение экзаменационной работы по химии отводится 3 часа (180 минут). Работа состоит из 3 частей и включает 43 задания.
Часть 1 включает 28 заданий (А1–А28). К каждому заданию даётся 4 варианта ответа, из которых только один правильный. Внимательно прочитайте каждое задание и проанализируйте все варианты предложенных ответов.
Часть 2 состоит из 10 заданий (В1–В10), на которые надо дать краткий ответ в виде числа или последовательности цифр.
Часть 3 содержит 5 наиболее сложных заданий по общей, неорганической и органической химии. Задания C1–C5 требуют полного (развёрнутого) ответа.
Все бланки ЕГЭ заполняются яркими чёрными чернилами.
Допускается использование гелевой, капиллярной или перьевой ручек.
Реклама

При выполнении заданий Вы можете пользоваться черновиком. Обращаем Ваше внимание, что записи в черновике не будут учитываться при оценке работы.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
При выполнении работы Вы можете пользоваться периодической системой химических элементов Д.И. Менделеева; таблицей растворимости солей, кислот и оснований в воде; электрохимическим рядом напряжений металлов (они прилагаются к тексту работы), а также непрограммируемым калькулятором, который выдается на экзамене.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
(2012 - 4 / 20)
Часть 1
При выполнении заданий этой части в бланке ответов № 1 под номером выполняемого вами задания (A1–A28) поставьте знак «
×» в клеточке, номер которой соответствует номеру выбранного вами ответа.
| Одинаковое число электронов содержат частицы
|
| 1) Al3+
и N3–
2) Ca2+
и Cl+5
3) S0
и Cl–
|
4) N3– и Р3–
|
В ряду элементов
 Na Mg Al Si Na Mg Al Si
1) уменьшаются радиусы атомов
2) уменьшается число протонов в ядрах атомов
3) увеличивается число электронных слоёв в атомах
4) уменьшается высшая степень окисления атомов
Верны ли следующие суждения о соединениях металлов?
А. Степень окисления бериллия в высшем оксиде равна +2.
Б. Оснóвные свойства оксида магния выражены сильнее, чем у оксида алюминия.
1) верно только А
2) верно только Б
3) верны оба суждения
4) оба суждения неверны
Химическая связь в молекулах метана и хлорида кальция соответственно
1) ковалентная полярная и металлическая
2) ионная и ковалентная полярная
3) ковалентная неполярная и ионная
4) ковалентная полярная и ионная
Степень окисления хлора равна +7 в соединении
1) Ca(ClO 2
)2
2) HClO 3
3) NH 4
Cl 4) HClO 4
Молекулярное строение имеет
1) оксид кремния(IV)
2) нитрат бария
3) хлорид натрия
4) оксид углерода(II)
(2012 - 5 / 20)
| Среди перечисленных веществ:
А) NaHCO3
Б) HCOOK
В) (NH4
)2
SO4
Г) KHSO3
Д) Na2
HPO4
Е) Na3
PO4
кислыми солями являются
1) АГД
2) АВЕ
3) БДE
4) BДЕ
Цинк взаимодействует с раствором
|
| 1) CuSO 4
2) MgCl 2
|
3) Na 2
SO4
|
4) CaCl 2
|
|
|
|
|
|
|
Какой оксид реагирует с раствором НСl, но не реагирует
с раствором NaOH?
Реклама

1) CO 2) SO 3
3) P 2
O5
4) MgO
Гидроксид алюминия реагирует с каждым из двух веществ:
1) KOH и Na2
SO4
2) HCl и NaOH
3) CuO и KNO3
4) Fe 2
O3
и HNO3
Карбонат бария реагирует с раствором каждого из двух веществ:
1) H 2
SO4
и NaOH
2) NaCl и CuSO4
3) HCl и CH3
COOH
4) NaHCO 3
и HNO3
В схеме превращений
Fe ⎯X
⎯→ FeCl3
⎯Y
⎯→ Fe(OH)3
веществами «X» и «Y» являются соответственно
1) Cl 2
и Cu(OH)2
2) CuCl 2
(р-р) и NaOH
3) Cl 2
и NaOH
4) HCl и H2
O
(2012 - 6 / 20)
Бутен-1 является структурным изомером
1) бутана
2) циклобутана
3) бутина
4) бутадиена
В отличие от пропана, циклопропан вступает в реакцию
1) дегидрирования
2) гидрирования
3) горения в кислороде
4) этерификации
Свежеосаждённый гидроксид меди(II) реагирует с
1) пропанолом
2) глицерином
3) этиловым спиртом
4) диэтиловым эфиром
Формальдегид не реагирует
с
1) Ag 2
O(NH3
р-р)
2) O 2
3) H 2
4) СН 3
ОСН3
Бутанол-1 образуется в результате взаимодействия
1) бутаналя с водой
2) бутена-1 с водным раствором щёлочи
3) 1-хлорбутана с водным раствором щёлочи
4) 1,2-дихлорбутана с водой
В схеме превращений
HC ≡ CH → X → CH COOH3
веществом «Х» является
1) CH CHO3
2) CH3
− CO − CH3
3) CH3
−CH OH2
4) CH3
−CH3
(2012 - 7 / 20) (2012 - 8 / 20)
Взаимодействие оксида углерода(IV) с водой относится к реакциям Одинаковую реакцию среды имеют растворы хлорида меди(II) и
1) соединения , необратимым 1) хлорида кальция
2) обмена , обратимым 2) нитрата натрия
3) соединения, обратимым 3) сульфата алюминия
4) обмена , необратимым 4) ацетата натрия
Скорость реакции азота с водородом понизится при Окислительные свойства серная кислота проявляет в реакции, схема которой:
1) уменьшении температуры 1) H 2
SO4
+ NH3
→ NH4
HSO4
2) увеличении концентрации азота 2) H 2
SO4
+ KOH → K2
SO4
+ H2
O
3) использовании катализатора 3) H 2
SO4
+ P → H3
PO4
+ SO2
4) увеличении давления 4) H 2
SO4
+ P2
O5
→ HPO3
+ SO3
Химическое равновесие в системе Верны ли следующие суждения о правилах обращения с веществами?
2HBr (г)
←⎯
⎯⎯⎯
→ H2 (г)
+ Br2 (г)
– Q
А. Вещества в лаборатории запрещается пробовать на вкус.
Б. С солями ртути следует обращаться особо осторожно ввиду их ядовитости. сместится в сторону продуктов реакции при
1) верно только А
1) повышении давления
2) верно только Б
2) повышении температуры
3) верны оба суждения 3) понижении давления
4) оба суждения неверны
4) использовании катализатора
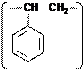 Полимер, имеющий формулу Полимер, имеющий формулу
Наибольшее количество сульфат-ионов образуется в растворе при диссоциации 1 моль
1) сульфата натрия
2) сульфата меди(II) n
3) сульфата алюминия получают из
4) сульфата кальция
1) толуола
2) фенола
Сокращённому ионному уравнению
Н+ + ОН– = Н2О 3) пропилбензола
соответствует взаимодействие 4) стирола
1) H 2
SO4
с NaOH
2) Cu(OH )2 с HCl Согласно термохимическому уравнению реакции
3) H
2
SiO3
с KOH
СаО(тв) + Н2О(ж) = Са(ОН)2(тв) + 70 кДж для получения 15 кДж теплоты потребуется оксид кальция массой
4) HCl с HNO3
1) 3 г 2) 6 г 3) 12 г 4) 56 г
(2012 - 9 / 20)
Часть 2
Ответом к заданиям этой части (В1–В10) является последовательность цифр или число, которые следует записать в бланк ответов № 1 справа от номера соответствующего задания, начиная с первой клеточки. Каждую цифру и запятую в записи десятичной дроби пишите в отдельной клеточке в соответствии с приведёнными в бланке образцами.
В заданиях B1–B5 к каждому элементу первого столбца подберите соответствующий элемент второго и запишите в таблицу выбранные цифры под соответствующими буквами, а затем получившуюся последовательность цифр перенесите в бланк ответов № 1 без пробелов, запятых и других дополнительных символов. (Цифры в ответе могут повторяться.)
Установите соответствие между названием соединения и общей формулой гомологического ряда, к которому оно принадлежит.
НАЗВАНИЕ СОЕДИНЕНИЯ ОБЩАЯ ФОРМУЛА
| А) бутин
Б) циклогексан
В) пропан
Г ) бутадиен
|
1) C nH2n+2
2) C nH2n
3) C nH2n–2
4) C nH2n–4
5) C nH2n–6
|
Ответ:
Установите соответствие между уравнением реакции и свойством азота,
| которое он проявляет в этой реакции.
|
| УРАВНЕНИЕ РЕАКЦИИ
|
СВОЙСТВО АЗОТА
|
| А) NH 4
HCO3
= NH3
+ H2
O + CO2
Б) 3СuO + 2NH3
= N2
+ 3Cu + 3H2
O
В) 4NH 3
+ 5O2
= 4NО + 6H2
O
Г ) 6Li + N 2
= 2Li3
N
|
1) окислитель
2) восстановитель
3) и окислитель, и восстановитель
4) ни окислитель, ни восста новитель
|
Ответ:
(2012 - 10 / 20)
| Установите соответствие между формулой соли и продуктом, образующимся на катоде при электролизе её водного раствора.
|
| |
| ФОРМУЛА СОЛИ
|
ПРОДУКТ НА КАТОДЕ
|
| А) CuCl 2
Б) AgNO 3
В) K 2
S
Г ) NaBr
|
1) водород
2) кислород
3) металл
4) галоген
5) сера
6) азот
|
Ответ:
| Установите соответствие между к гидролизу.
|
названием соли и её отношением
|
| НАЗВАНИЕ СОЛИ
|
ОТНОШЕНИЕ
К ГИДРОЛИЗУ
|
| А) хлорид аммония
Б) сульфат калия
В) карбонат натрия
Г ) сульфид алюминия
|
1) гидролизуется по катиону
2) гидролизуется по аниону
3) гидролиз не происходит
4) необратимый гидролиз
|
Ответ:
Установите соответствие между названием оксида и формулами веществ,
| с которыми он может взаимодействовать.
|
| НАЗВАНИЕ ОКСИДА
|
ФОРМУЛЫ ВЕЩЕСТВ
|
| А) оксид калия
Б) оксид углерода(II)
В) оксид хрома(III)
Г ) оксид фосфора(V)
|
1) H2
O, MgO, LiOH
2) Fe3
O4
, H2
O, Si
3) H2
, Fe3
O4
, O2
4) H2
O, N2
O5
, H3
PO4
5) HCl, NaOH, Al
6) Al, N2
O5
, H2
O
|
Ответ:
(2012 - 11 / 20)
Ответом к заданиям B6–B8 является последовательность из трёх цифр, которые соответствуют номерам правильных ответов. Запишите эти цифры в порядке возрастания сначала в текст работы, а затем перенесите их в бланк ответов № 1 без пробелов, запятых и других дополнительных символов.
Взаимодействие 2-метилпропана и брома при комнатной температуре на свету
1) относится к реакциям замещения
2) протекает по радикальному механизму
3) приводит к преимущественному образованию 1-бром-2-метилпропана
4) приводит к преимущественному образованию 2-бром-2-метилпропана
5) протекает с разрывом связи C – C
6) является каталитическим процессом
Ответ:___________________________
Фенол реагирует с
1) кислородом
2) бензолом
3) гидроксидом натрия
4) хлороводородом
5) натрием
6) оксидом углерода(IV)
Ответ:___________________________
Метиламин может взаимодействовать с
1) пропаном
2) хлорметаном
3) кислородом
4) гидроксидом натрия
5) хлоридом калия
6) серной кислотой
Ответ:___________________________
(2012 - 12 / 20)
Ответом к заданиям B9–B10 является число. Запишите это число в текст работы, а затем перенесите его в бланк ответов № 1 без указания единиц измерения.
Определите массу воды, которую надо добавить к 20 г раствора уксусной кислоты с массовой долей 70% для получения раствора уксусной кислоты с массовой долей 5%. (Запишите число с точностью до целых.) Ответ: ___________ г.
Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2
, равна __________ г.
(Запишите число с точностью до целых.)
Не забудьте перенести все ответы в бланк ответов № 1.
(2012 - 13 / 20)
Часть 3
Для записи ответов к заданиям этой части (С1–С5) используйте бланк ответов № 2. Запишите сначала номер задания (С1, С2 и т. д.), а затем его полное решение. Ответы записывайте чётко и разборчиво.
Используя метод электронного баланса, составьте уравнение реакции Na2
SO3
+ … + KOH →
K2
MnO4
+ … + H2
O Определите окислитель и восстановитель.
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH3 −CH2−CH2−OH⎯⎯⎯⎯H SO1802 °C4→ ⎯⎯⎯X1 HCl→ ⎯⎯⎯⎯⎯X2 NaOH, H O2 → →X3
→ X1
⎯⎯⎯⎯⎯⎯⎯KMnO , H O, 0 C4 2
D
→X4
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного раствора серной кислоты. Для нейтрализации получившегося раствора потребовалось 143 г кристаллической соды Na CO2 3
⋅10H O2
. Рассчитайте массу и массовую долю гидроксида натрия в исходном растворе.
При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. Определите молекулярную формулу кислоты.
(2012 - 14 / 20)
(2012 - 15 / 20)
Система оценивания экзаменационной работы по химии
ЧАСТЬ 1
За правильный ответ на каждое задание части 1 ставится 1 балл.
Если указаны два и более ответов (в их числе правильный), неверный ответ или ответ отсутствует – 0 баллов.
| № задания
|
Ответ
|
|
№ задания
|
Ответ
|
| А1
|
1
|
А11
|
3
|
| А2
|
1
|
А12
|
3
|
| А3
|
3
|
А13
|
2
|
| А4
|
4
|
А14
|
2
|
| А5
|
4
|
А15
|
2
|
| А6
|
4
|
А16
|
4
|
| А7
|
1
|
А17
|
3
|
| А8
|
1
|
А18
|
1
|
| А9
|
4
|
А19
|
3
|
| А10
|
2
|
А20
|
1
|
|
| № задания
|
Ответ
|
| А21
|
2
|
| А22
|
3
|
| А23
|
1
|
| А24
|
3
|
| А25
|
3
|
| А26
|
3
|
| А27
|
4
|
| А28
|
3
|
|
|
ЧАСТЬ 2
Задание с кратким свободным ответом считается выполненным верно, если правильно указана последовательность цифр (число).
За полный правильный ответ в заданиях В1–В8 ставится 2 балла, если допущена одна ошибка – 1 балл, за неверный ответ (более одной ошибки) или его отсутствие – 0 баллов.
За правильный ответ в заданиях В9 и В10 ставится 1 балл, за неверный ответ или его отсутствие – 0 баллов.
| №
|
Ответ
|
| В1
|
3213
|
| В2
|
4221
|
| В3
|
3311
|
| В4
|
1324
|
| В5
|
4351
|
| В6
|
124
|
| В7
|
135
|
| В8
|
236
|
| В9
|
260
|
| В10
|
144
|
(2012 - 16 / 20)
ЧАСТЬ 3
КРИТЕРИИ ПРОВЕРКИ И ОЦЕНКИ ВЫПОЛНЕНИЯ ЗАДАНИЙ С РАЗВЁРНУТЫМ ОТВЕТОМ
За выполнение заданий ставится: С1, С5 – от 0 до 3 баллов; С2, С4 – от 0 до 4 баллов; С3 – от 0 до 5 баллов.
Используя метод электронного баланса, составьте уравнение реакции Na2
SO3
+ … + KOH →
K2
MnO4
+ … + H2
O Определите окислитель и восстановитель.
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
1) определены недостающие в схеме реакции вещества и составлен электронный баланс:
 2 Mn+7
+ ē → Mn+6 2 Mn+7
+ ē → Mn+6
1S+4
– 2ē → S+6
2) указано, что сера в степени окисления +4 является восстановителем, а марганец в степени окисления +7 (или перманганат калия за счёт марганца в степени окисления +7) – окислителем;
3) составлено уравнение реакции:
Na2
SO3
+ 2KMnO4
+ 2KOH = Na2
SO4
+ 2K2
MnO4
+ H2
O
|
| Ответ правильный и полный, включает все названные выше элементы
|
3
|
| В ответе допущена ошибка только в одном из элементов
|
2
|
| В ответе допущены ошибки в двух элементах
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
3
|
(2012 - 17 / 20)
Соль, полученную при растворении железа в горячей концентрированной серной кислоте, обработали избытком раствора гидроксида натрия. Выпавший бурый осадок отфильтровали и прокалили. Полученное вещество сплавили с железом.
Напишите уравнения описанных реакций.
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
Написаны четыре уравнения описанных реакций:
1) 2Fe + 6H2
SO4
⎯t°
⎯→ Fe2
(SO4
)3
+ 3SO2
+ 6H2
O
2) Fe2
(SO4
)3
+ 6NaOH = 2Fe(OH)3
+ 3Na2
SO4
3) 2Fe(OH)3
⎯t°
⎯→ Fe2
O3
+ 3H2
O
4) Fe2
O3
+ Fe = 3FeO
|
| Правильно записаны 4 уравнения реакций
|
4
|
| Правильно записаны 3 уравнения реакций
|
3
|
| Правильно записаны 2 уравнения реакций
|
2
|
| Правильно записано 1 уравнение реакции
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
4
|
(2012 - 18 / 20)
Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения:
CH CH CH OH3 − 2− 2− ⎯⎯⎯⎯H SO1802 °C4→ ⎯⎯⎯X1 HCl→ ⎯⎯⎯⎯⎯X2 NaOH, H O2 → →X3
→ ⎯⎯⎯⎯⎯⎯⎯X1
KMnO , H O, 0 C4 2
D
→X4
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа: приведены уравнения реакций, соответствующие превращений:
1) H C H C CH3 − 2 − 2 −OH⎯⎯⎯⎯H SO1802 4°C →H C HC CH3 − = 2 +H O2
2) H C3
− HC = CH2
+ HCl → H C3
−CH −CH3

Cl
3) H C3
− CH − CH3
+ NaOH ⎯⎯⎯H O2
→H C3
−CH −CH3
+ NaCl

 Cl OH Cl OH
CH3
4) H C3 − CH − OH ⎯⎯⎯⎯⎯⎯H SO ,180 C2 4 ° →CH3 − CH = CH2 + H O2
5)3CH3
−CH CH= 2
+2KMnO4
+4H O2
⎯⎯⎯0
D
C
→2MnO2
+
+ 2KOH + 3CH3
−CH −CH2

OH OH
|
схеме
|
| Ответ правильный и полный, включает все названные выше элементы
|
5
|
| Правильно записаны 4 уравнения реакций
|
4
|
| Правильно записаны 3 уравнения реакций
|
3
|
| Правильно записаны 2 уравнения реакций
|
2
|
| Правильно записано одно уравнение реакции
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
5
|
(2012 - 19 / 20) (2012 - 20 / 20)
| C4
|
К раствору гидроксида натрия массой 1200 г прибавили 490 г 40%-ного
|
C5
|
При взаимодействии 25,5 г предельной однооснóвной карбоновой кислоты раствора серной кислоты. Для нейтрализации получившегося раствора с избытком раствора гидрокарбоната натрия выделилось 5,6 л (н.у.) газа. потребовалось 143 г кристаллической соды Na CO2 3
⋅10H O2
. Рассчитайте Определите молекулярную формулу кислоты.
массу и массовую долю гидроксида натрия в исходном растворе.
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа.
1) Cоставлено уравнение реакции в общем виде, и вычислено количество вещества газа:
Сn
H2n+1
COOH + NaHCO3
= Сn
H2n+1
COONa + H2
O + CO2
n(CO2
) =5,6 : 22,4 = 0,25 моль
2) Рассчитана молярная масса кислоты: n(CO2
) = n(Сn
H2n+1
COOH) = 0,25 моль
М(Сn
H2n+1
COOH) = 25,5/0,25 = 102 г/моль
3) Установлена молекулярная формула кислоты: М(Сn
H2n+1
COOH) = 12n + 2n + 1 + 45 = 102
14n + 46 = 102 14n = 56
n = 4
Молекулярная формула – C4
H9
COOH
|
| Ответ правильный и полный, включает все названные выше элементы
|
3
|
| Правильно записаны первый и второй элементы ответа
|
2
|
| Правильно записан первый или второй элементы ответа
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
3
|
| Содержание верного ответа и указания по оцениванию
(допускаются иные формулировки ответа, не искажающие его смысла)
|
Баллы
|
| Элементы ответа:
1) составлены уравнения реакций:
2NaOH H SO+ 2 4
=Na SO2 4
+2H O2
H SO2 4
+ Na CO2 3
= Na SO2 4
+ CO2
+ H O2
Возможен также расчёт на основании уравнений реакций образования NaHSO 4
и последующего его взаимодействия с Na CO2 3
. Конечный ответ не изменится;
2) рассчитано общее количество серной кислоты, а также количество серной кислоты, прореагировавшей с содой:
n(общ)
(H SO2 4
) = 490 0,4⋅ /98 = 2 моль n H SO( 2 4
) = n Na CO( 2 3
⋅10H O2
) =143/286 = 0,5 моль
3) рассчитано количество серной кислоты, вступившей в реакцию с гидроксидом натрия и масса гидроксида натрия в исходном растворе:
n H SO( 2 4
) = 2 − 0,5 =1,5 моль
n NaOH( )=2n H SO( 2 4
)=3моль m NaOH( ) = 3 40⋅ =120 г
4) рассчитана массовая доля гидроксида натрия в исходном растворе:
ω(NaOH) =120 /1200 = 0,1(10%)
|
| Ответ правильный и полный, включает все названные выше элементы
|
4
|
| В ответе допущена ошибка в одном из названных выше элементов
|
3
|
| В ответе допущены ошибки в двух из названных выше элементов
|
2
|
| В ответе допущены ошибки в трёх из названных выше элементов
|
1
|
| Все элементы ответа записаны неверно
|
0
|
| Максимальный балл
|
4
|
* Примечание.
В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
* Примечание.
В случае, когда в ответе содержится ошибка в вычислениях в одном из элементов (втором, третьем или четвёртом), которая привела к неверному ответу, оценка за выполнение задания снижается только на 1 балл.
|