| Муниципальное общеобразовательное учреждение
Вечерняя (сменная) общеобразовательная школа
П. Кавалерово Приморского края
РЕФЕРАТ
По физике
Тема: «Изопроцессы в газах».
За курс средней (полной) школы
Выполнил
Лукашкин
Павел Дмитриевич
Проверил
Пилеко Ричард
Валерьевич
П. Кавалерово
2003 – 2004 учебный год
План:
1. Вступление
2. Изотермический процесс
3. Изобарный процесс
4. Изохорный процесс
Вступление
С помощью уравнения состояния идеального газа можно исследовать процессы, в которых масса газа и один из трех параметров — давление, объем или температура — остаются неизменными. Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами.
Процессы, протекающие при неизменном значении одного из параметров, называют изопроцессами (от греч. «изос» - равный). Правда, в действительности ни один процесс не может протекать при строго фиксированном значении какого-либо параметра. Всегда имеются те или иные воздействия, нарушающие постоянство температуры, давления или объема. Лишь в лабораторных условиях удается поддерживать постоянство того или иного параметра с хорошей точностью, но в действующих технических устройствах и в природе это практически неосуществимо. Изопроцесс - это идеализированная модель реального процесса, которая только приближенно отражает действительность.
Изотермический процесс
Процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре называют изотермическим.
Для поддержания температуры газа постоянной необходимо, чтобы он мог обмениваться теплотой с большой системой – термостатом. Иначе при сжатии или расширении температура газа будет меняться. Термостатом может служить атмосферный воздух, если температура его заметно не меняется на протяжении всего процесса.
Согласно уравнению состояния идеального газа (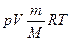 ) в любом состоянии с неизменной температурой произведение давления газа на его объём остаётся постоянным: pV=const при T=const. ) в любом состоянии с неизменной температурой произведение давления газа на его объём остаётся постоянным: pV=const при T=const.
Для газа данной массы произведение давления газа на его объём постоянно, если температура газа не меняется.
Этот закон экспериментально был открыт английским учёным Р. Бойлером (1627 – 1691) и несколько позже французским учёным Э Мариоттом (1620 – 1684). Поэтому он носит название закона Бойля – Мариотта
.
Реклама

Закон Бойля – Мариотта справедлив для любых газов, а так же и их смесей, например для воздуха. Лишь при давлениях, в несколько сотен раз больше атмосферного, отклонение от этого закона становится существенным.
Зависимость давления газа от объёма при постоянной температуре графически изображается кривой, которая называется изотермой.
Изотерма газа изображает обратно пропорциональную зависимость между давлением и объёмом. Кривую такого рода в математике называют гиперболой.
Разным постоянным температурам соответствуют различные изотермы. При повышении температуры давление согласно уравнению состояния увеличивается, если V=const. Поэтому изотерма соответствующая более высокой температуре Т2
, лежит выше изотермы, соответствующей более низкой температуре Т1
.
Изотермическим процессом приближенно можно считать процесс медленного сжатия воздуха при расширении газа под поршнем насоса при откачке его из сосуда. Правда, температура газа при этом меняется, но в первом приближении этим изменением можно пренебречь.
Изобарный процесс
Процесс изменения состояния термодинамической системы при постоянном давлении называют изобарным (от греч. «барос» - вес, тяжесть).
Согласно уравнению 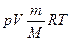 в любом состоянии газа с неизменным давлением отношение объёма газа к его температуре остаётся постоянным: в любом состоянии газа с неизменным давлением отношение объёма газа к его температуре остаётся постоянным: 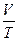 =const при p=const. =const при p=const.
Для газа данной массы отношение объёма к температуре постоянно, если давление газа не меняется.
Этот закон был установлен экспериментально в 1802 году французским учёным Ж. Гей-Люссаком (1778 – 1850) и носит название закона Гей-Люссака.
Согласно уравнению объём газа линейно зависит от температуры при постоянном давлении: V=const T.
Эта зависимость графически изображается прямой, которая называется изобарой.
Различным давлениям соответствуют разные изобары. С ростом давления объём газа при постоянной температуре согласно закону Бойля-Мариотта уменьшается. Поэтому изобара, соответствующая более высокому давлению p2,
лежит ниже изобары, соответствующей более низкому давлению p1
.
В области низких температур все изобары идеального газа сходятся в точке T=0. Но это не означает, что объём реального газа действительно обращается в нуль. Все газы при сильном охлаждении превращаются в жидкость, а к жидкостям уравнения состояния неприменимо.
Изобарным можно считать расширение газа при нагревании его в цилиндре с подвижным поршнем. Постоянство давления в цилиндре обеспечивается атмосферным давлением на внешнюю поверхность поршня.
Реклама

Изохорный процесс
Процесс изменения состояния термодинамической системы при постоянном объёме называют изохорным
(от греч. «хорема» - вместимость).
Из уравнения состояния 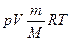 вытекает, что в любом состоянии газа с неизменным объёмом отношение давления газа к его температуре остаётся неизменным: вытекает, что в любом состоянии газа с неизменным объёмом отношение давления газа к его температуре остаётся неизменным: 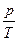 =const при V=const. =const при V=const.
Для газа данной массы отношение давления к температуре постоянно, если объём не меняется.
Этот газовый закон был установлен в 1787 году французским физиком Ж. Шарлем (1746 – 1823) и носит название закона Шарля.
Согласно уравнению 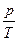 =const при V=const давления газа линейно зависит от температуры при постоянном объёме: p=const T. =const при V=const давления газа линейно зависит от температуры при постоянном объёме: p=const T.
Эта зависимость изображается прямой, называемой изохорой.
Разным объёмам соответствуют разные изохоры. С ростом объёма газа при постоянной температуре давление его согласно закону Бойля-Мариотта падает. Поэтому изохора, соответствующая большему объёму V2
, лежит ниже изохоры, соответствующей меньшему объёму V1
.
В соответствии с уравнением все изохоры начинаются в точке T=0. Значит, давление идеального газа при абсолютном нуле равно нулю.
Увеличение давления газа в любой ёмкости или в электрической лампочке при нагревании является изохорным процессом. Изохорный процесс используется в газовых термостатах постоянного объёма.
|