| Безумные металлы
ЛИТИЙ
(Lithium) Li, химический элемент 1-й (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 3, относительная атомная масса 6,941. Состоит из двух стабильных изотопов 6
Li (7,52%) и 7
Li (92,48%). Искусственным путем получены еще два изотопа лития: у 8
Li период полураспада равен 0,841 с, а у 9
Li 0,168 с.
Степень окисления +1.
Литий был открыт в 1817 шведским химиком и минералогом Августом Арфведсоном (Arfvedson August) (1792–1841), когда он работал в качестве ассистента в лаборатории Йёнса Якоба Берцелиуса. На основании химического анализа петалита (LiAlSi4
O10
) Арфведсон предположил, что в этом слоистом силикатном минерале есть некий щелочной элемент. Он отметил, что его соединения похожи на соединения натрия и калия, однако карбонат и гидроксид менее растворимы в воде. Арфведсон предложил для нового элемента название литий (от греческого liqoz – камень), указывающее на его происхождение. Он показал также, что этот элемент содержится в сподумене (силикатный пироксен) LiAlSi2
O6
и в лепидолите (слюда), который имеет примерный состав K2
Li3
Al4
Si7
O21
(OH,F)3
.
В 1818 английский химик и физик Гемфри Дэви выделил металлический литий электролизом расплавленного гидроксида лития.
НАТРИЙ
– (Natrium) Na, химический элемент 1-й (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 11, относительная атомная масса 22,98977. В природе имеется один стабильный изотоп 23
Na. Известны шесть радиоактивных изотопов этого элемента, причем два из них представляют интерес для науки и медицины. Натрий-22 с периодом полураспада 2,58 года используют в качестве источника позитронов. Натрий-24 (его период полураспада около 15 часов) применяют в медицине для диагностики и для лечения некоторых форм лейкемии.
Степень окисления +1.
Соединения натрия известны с древних времен. Хлорид натрия – необходимейший компонент человеческой пищи. Cчитается, что человек начал употреблять его в неолите, т.е. около 5–7 тыс. лет назад.
В Ветхом завете упоминается некое вещество «нетер». Это вещество использовалось как моющее средство. Скорее всего, нетер – это сода, карбонат натрия, который образовывался в соленых египетских озерах с известковыми берегами. Об этом же веществе, но под названием «нитрон» писали позже греческие авторы Аристотель и Диоскорид, а древнеримский историк Плиний Старший, упоминая это же вещество, называл его уже «нитрум».
Реклама

В 18 в. химикам было известно уже очень много различных соединений натрия. Соли натрия широко применялись в медицине, при выделке кож, при крашении тканей.
Металлический натрий получил впервые английский химик и физик Гемфри Дэви электролизом расплавленного гидроксида натрия (с использованием вольтова столба из 250 пар медных и цинковых пластин). Название «sodium», выбранное Дэви для этого элемента, отражает его происхождение из соды Na2
CO3
. Латинское и русское названия элемента произведены от арабского «натрун» (природная сода).
КАЛИЙ
(Kalium) K, химический элемент 1 (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 19, атомная масса 39,0983. Состоит из двух стабильных изотопов 39
K (93,259%) и 41
K (6,729%), а также радиоактивного изотопа 40
K с периодом полураспада ~109
лет. Этот изотоп играет в природе особую роль. Его доля в смеси изотопов составляет всего 0,01%, однако именно он является источником практически всего содержащегося в земной атмосфере аргона 40
Ar, который образуется при радиоактивном распаде 40
K. Кроме того, 40
K присутствует во всех живых организмах, что, возможно, оказывает определенное влияние на их развитие.
Изотоп 40
K служит для определения возраста горных пород калий-аргоновым методом. Искусственный изотоп 42
K с периодом полураспада 15,52 года используется в качестве радиоактивного индикатора в медицине и биологии.
Степень окисления +1.
Соединения калия известны с древних времен. Поташ – карбонат калия K2
CO3
– издавна выделяли из древесной золы.
Металлический калий был получен электролизом расплавленного едкого кали (KOH) в 1807 английским химиком и физиком Гемфри Дэви. Название «potassium», выбранное Дэви, отражает происхождение этого элемента из поташа. Латинское название элемента образовано от арабского названия поташа – «аль-кали». В русскую химическую номенклатуру слово «калий» введено в 1831 петербургским академиком Германом Гессом (1802–1850).
РУБИДИЙ
– (Rubidium) Rb, химический элемент 1-й (Ia) группы Периодической системы. Щелочной элемент. Атомный номер 37, относительная атомная масса 85,4678. В природе встречается в виде смеси стабильного изотопа 85
Rb (72,15%) и радиоактивного изотопа 87
Rb (27,86%) с периодом полураспада 4,8.
1010
лет. Искусственно получено еще 26 радиоактивных изотопов рубидия с массовыми числами от 75 до 102 и периодами полураспада от 37 мс (рубидий-102) до 86 дней (рубидий-83).
Реклама

Степень окисления +1.
Рубидий был открыт в 1861 немецкими учеными Робертом Бунзеном и Густавом Кирхгоффом и стал одним из первых элементов, открытых методом спектроскопии, который был изобретен Бунзеном и Кирхгоффом в 1859. Название элемента отражает цвет наиболее яркой линии в его спектре (от латинского rubidus – глубокий красный).
Изучая с помощью спектроскопа различные минералы, Бунзен и Кирхгофф заметили, что один из образцов лепидолита, присланный из Розены (Саксония), дает линии в красной области спектра. (Лепидолит – минерал калия и лития, который имеет примерный состав K2
Li3
Al4
Si7
O21
(OH,F)3
.) Эти линии не встречались в спектрах ни одного из известных веществ. Вскоре аналогичные темно-красные линии были обнаружены в спектре осадка, полученного после испарения воды из образцов, взятых из минеральных источников Шварцвальда. Однако содержание нового элемента в опробованных образцах было ничтожным, и чтобы извлечь мало-мальски ощутимые количества, Бунзену пришлось выпаривать свыше 40 м3
минеральных вод. Из упаренного раствора он осадил смесь хлороплатинатов калия, рубидия и цезия. Для отделения рубидия от его ближайших родственников (и особенно от большого избытка калия) Бунзен подверг осадок многократной фракционированной кристаллизации и получил хлориды рубидия и цезия из наименее растворимой фракции и затем перевел их в карбонаты и тартраты (соли винной кислоты), что позволило еще лучше очистить рубидий и освободить его от основной массы цезия. Бунзену удалось получить не только отдельные соли рубидия, но и сам металл. Металлический рубидий был впервые получен при восстановлении сажей кислой соли – гидротартрата рубидия.
Спустя четверть века русский химик Николай Николаевич Бекетов предложил другой способ получения металлического рубидия – восстановлением его из гидроксида алюминиевым порошком. Он проводил этот процесс в железном цилиндре с газоотводной трубкой, которая соединялась со стеклянным резервуаром-холодильником. Цилиндр подогревался на газовой горелке, и в нем начиналась бурная реакция, сопровождавшаяся выделением водорода и возгонкой рубидия в холодильник. Как писал сам Бекетов, «рубидий гонится постепенно, стекая, как ртуть, и сохраняя даже свой металлический блеск вследствие того, что снаряд во время операции наполнен водородом».
Распространение рубидия в природе и его промышленное извлечение. Содержание рубидия в земной коре составляет 7,8·10–3
%. Это примерно столько же, как для никеля, меди и цинка. По распространенности в земной коре рубидий находится примерно на 20-м месте, однако в природе он находится в рассеянном состоянии, рубидий – типичный рассеянный элемент. Собственные минералы рубидия неизвестны. Рубидий встречается вместе с другими щелочными элементами, он всегда сопутствует калию. Обнаружен в очень многих горных породах и минералах, найденных, в частности, в Северной Америке, Южной Африке и России, но его концентрация там крайне низка. Только лепидолиты содержат несколько больше рубидия, иногда 0,2%, а изредка и до 1–3% (в пересчете на Rb2
О).
Соли рубидия растворены в воде морей, океанов и озер. Концентрация их и здесь очень невелика, в среднем порядка 100 мкг/л. В отдельных случаях содержание рубидия в воде выше: в Одесских лиманах оно оказалось равным 670 мкг/л, а в Каспийском море – 5700 мкг/л. Повышенное содержание рубидия обнаружено и в некоторых минеральных источниках Бразилии.
Из морской воды рубидий перешел в калийные соляные отложения, главным образом, в карналлиты. В страссфуртских и соликамских карналлитах содержание рубидия колеблется в пределах от 0,037 до 0,15%. Минерал карналлит – сложное химическое соединение, образованное хлоридами калия и магния с водой; его формула KCl·MgCl2
·6H2
O. Рубидий дает соль аналогичного состава RbCl·MgCl2
·6H2
O, причем обе соли – калиевая и рубидиевая – имеют одинаковое строение и образуют непрерывный ряд твердых растворов, кристаллизуясь совместно. Карналлит хорошо растворим в воде, потому вскрытие минерала не составляет большого труда. Сейчас разработаны и описаны в литературе рациональные и экономичные методы извлечения рубидия из карналлита, попутно с другими элементами.
Тем не менее, большую часть добываемого рубидия получают как побочный продукт при производстве лития из лепидолита. После выделения лития в виде карбоната или гидроксида рубидий осаждают из маточных растворов в виде смеси алюморубидиевых, алюмокалиевых и алюмоцезиевых квасцов MAl(SO4
)2
·12H2
O (M = Rb, K, Cs). Смесь разделяют многократной перекристаллизацией. Рубидий выделяют и из отработанного электролита, получающегося при получении магния из карналлита. Из него рубидий выделяют сорбцией на осадках ферроцианидов железа или никеля. Затем ферроцианиды прокаливают и получают карбонат рубидия с примесями калия и цезия. При получении цезия из поллуцита рубидий извлекают из маточных растворов после осаждения Cs3
[Sb2
Cl9
]. Можно извлекать рубидий и из технологических растворов, образующихся при получении глинозема из нефелина.
Для извлечения рубидия используют методы экстракции и ионообменной хроматографии. Соединения рубидия высокой чистоты получают с использованием полигалогенидов.
Значительную часть производимого рубидия выделяют в ходе получения лития, поэтому появление большого интереса к литию для использования его в термоядерных процессах в 1950-х привело к уведичению добычи лития, а, следовательно, и рубидия и поэтому соединения рубидия стали более доступными.
Рубидий – один из немногих химических элементов, ресурсы и возможности добычи которого больше, чем нынешние потребности в нем. Официальная статистика по производству и использованию рубидия и его соединений отсутствует. Считают, что годовое производство рубидия составляет около 5 т.
Рынок рубидия очень мал. Активная торговля металлом не ведется, и рыночной цены на него нет. Цены, установленные компаниями, торгующими рубидием и его соединениями, различаются в десятки раз.
Характеристика простого вещества, промышленное получение и применение металлического рубидия. Рубидий – мягкий серебристо-белый металл. При обычной температуре он имеет почти пастообразную консистенцию. Плавится рубидий при 39,32° С, кипит при 687,2° С. Пары рубидия окрашены в зеленовато-синий цвет.
ЦЕЗИЙ
(Cesium) Cs, химический элемент 1-й (Ia) группы Периодической системы. Щелочной элемент. Атомный номер 55, относительная атомная масса 132,9054.
В природном цезии не удалось обнаружить какие-либо иные изотопы, кроме стабильного 133
Cs. Известно 33 радиоактивных изотопа цезия с массовыми числами от 114 до 148. В большинстве случаев они недолговечны: периоды полураспада измеряются секундами и минутами, реже – несколькими часами или днями. Однако три из них распадаются не так быстро – это 134
Cs, 137
Cs и 135
Cs с периодами полураспада 2 года, 30 лет и 3·106
лет. Все три изотопа образуются при распаде урана, тория и плутония в атомных реакторах или в ходе испытаний ядерного оружия.
Степень окисления +1.
В 1846 в пегматитах о.Эльба в Тирренском море был открыт силикат цезия – поллуцит. При изучении этого минерала неизвестный в то время цезий был принят за калий. Содержания калия вычислялось по массе соединения платины, с помощью которого элемент переводили в нерастворимое состояние. Так как калий легче цезия, то подсчет результатов химического анализа показывал нехватку около 7%. Эта загадка была разрешена только после открытия спектрального метода анализа немецкими учеными Робертом Бунзеном и Густавом Кирхгоффом в 1859. Бунзен и Кирхгофф открыли цезий в 1861. Первоначально он был найден в минеральных водах целебных источников Шварцвальда. Цезий стал первым из элементов, открытых методом спектроскопии. Его название отражает цвет наиболее ярких линий в спектре (от латинского caesius – небесно-голубой).
Первооткрывателям цезия не удалось выделить этот элемент в свободном состоянии. Металлический цезий был впервые получен только через 20 лет, в 1882, шведским химиком К.Сеттербергом (Setterberg C.) при электролизе расплавленной смеси цианидов цезия и бария, взятых в отношении 4:1. Цианид бария добавлялся для снижения температуры плавления, однако работать с цианидами было трудно ввиду их высокой токсичности, а барий загрязнял конечный продукт, да и выход цезия был весьма мал. Более рациональный способ был найден в 1890 известным русским химиком Н.Н.Бекетовым, предложившим восстанавливать гидроксид цезия металлическим магнием в потоке водорода при повышенной температуре. Водород заполнял прибор и препятствовал окислению цезия, который отгонялся в специальный приемник, однако и в этом случае выход цезия не превышал 50% от теоретического.
ФРАНЦИЙ (
Francium) Fr, радиоактивный химический элемент I группы периодической системы Менделеева, относится к щелочным металлам; атомный номер 87. Стабильных изотопов не имеет. Известно более 20 изотопов Ф. с массовыми числами от 203 до 229; все они очень неустойчивы; наиболее долгоживущий b-радиоактивный 223
Fr (T
1/2
= 21,8 мин
) встречается в природе. среди элементов, стоящих в конце периодической системы Д.И. Менделеева, есть такие, о которых многое слышали и знают неспециалисты, но есть и такие, о которых мало что сможет рассказать даже химик. К числу первых относятся, например, радон (№86) и радий (№88). К числу вторых – их сосед по периодической системе элемент №87 – франций. Франций интересен по двум причинам: во-первых, это самый тяжелый и самый активный щелочной металл; во-вторых, франций можно считать самым неустойчивым из первых ста элементов периодической системы. У самого долгоживущего изотопа франция – 223
Fr – период полураспада составляет всего 22 минуты. Такое редкое сочетание в одном элементе высокой химической активности с низкой ядерной устойчивостью определило трудности в открытии и изучении этого элемента.
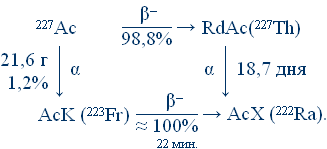
|