| МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
САМАРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
КАФЕДРА ФИЗИОЛОГИИ ЧЕЛОВЕКА И ЖИВОТНЫХ
ВЛИЯНИЕ ЦИАНО- И ТЕТРАЗОЛЬНЫХ ПРОИЗВОДНЫХ ЦИТОЗИНА И ТИМИНА НА РЕЗИСТЕНТНОСТЬ ЭРИТРОЦИТОВ
Дипломная работа
Специальность 011600 – «Биология»
специализация – «Физиология человека и животных»
| Выполнила студентка
5 курса, 552 группы
Комогорова Елена Игоревна
_________________________
Научный руководитель –
к.б.н., доцент
Сергеева Людмила Иосифовна
__________________________
Дипломная работа защищена
«___»________2002 г.
оценка:________________
Председатель ГАК
__________________________
|
|
| «ДОПУСТИТЬ К ЗАЩИТЕ»
Зав.каф. физиологии человека и животных
д.б.н.,профессор
___________А.Н. Инюшкин__
«___»________2002 г.
|
|
САМАРА 2002
Содержание
Введение.......................................................................................................... 3
1. Обзор литературы...................................................................................... 5
1.1. Строение и функции эритроцитарной мембраны............................... 5
1.2. Понятие резистентности и разрушение эритроцитов......................... 8
1.3 Реакции красной крови на воздействие химических факторов......... 11
2. Экспериментальная часть......................................................................... 15
2.1. Материалы и методика исследования............................................... 15
2.2. Результаты исследования................................................................... 17
2.2.1. Влияние цитозина на резистентность эритроцитов.................... 17
2.2.2. Влияние цианоцитозина на резистентность эритроцитов.......... 22
2.2.3. Влияние цитозинтетразола на резистентность эритроцитов..... 28
2.2.4. Влияние тиминтетразола на резистентность эритроцитов........ 33
2.3. Обсуждение результатов.................................................................... 39
Выводы.......................................................................................................... 42
Список использованных источников............................................................ 43
П Р И Л О Ж Е Н И Е............................................................................ 51
Реклама

Введение
При изучении биологической активности химических веществ особое значение приобретают сведения о влиянии их на систему крови, которая является важной составной частью внутренней среды организма. Благодаря своей реактивности ,она играет основополагающую роль в резистентности и развитии адаптации при действии на организм как различных внешних раздражителей, так и при нарушениях внутренней среды организма [23, 35, 86, 87].
Кровь отвечает количественным и качественными изменениями своего состава на любые экзогенные и эндогенные воздействия в целях поддержания гомеостазиса [6, 38].
Изучение количественных характеристик периферической крови несомненно дает представление о влиянии исследуемых факторов на систему красной крови, но без оценки качественных изменений не позволяет в полной мере охарактеризовать реакцию последней. Тем более, что отдельные химические вещества при действиях в субтоксических дозах могут не вызывать резких изменений в количестве и морфологии эритроцитов.
Согласно утвердившемуся мнению цитоплазматическая мембрана играет главную роль в адаптации клетки к действию различных факторов [8, 44, 63]. А это означает, что влияние химических веществ на физико-химическое состояние мембран может существенным образом изменять их устойчивость к неблагоприятным воздействиям. Между тем известно, что клетки, являясь конечным пунктом сложных адаптационных реакций, не только отражают общий уровень сопротивляемости организма, но и обеспечивают его [5, 57, 58, 70, 80].
Настоящая работа выполнена в рамках совместных исследований, проводимых кафедрой физиологии человека и животных и кафедрой органической химии Самарского государственного университета, целью которых является синтез и анализ физиологической активности различных органических соединений, в т.ч. азолов и пиримидинов. Интерес к этим группам веществ обусловлен той значительной ролью, которую они играют в процессах жизнедеятельности, участвуя в важнейших метаболических процессах, взаимодействуя с огромным числом ключевых ферментных систем, внося решающий вклад в функционирование центральной нервной системы [9, 28, 33, 45, 53, 87].Сегодня многие производные азолов и пиримидинов – это разнообразные высокоэффективные лекарственные средства. [1, 2,10, 17, 36, 41, 43, 53, 62, 84, 85, 93, 95].
Задачей нашего исследования явилось изучение влияния на физико-химические свойства эритроцитов цитозина, цианоцитозина и тетразольных производных цитозина и тимина.
Реклама

1. Обзор литературы
1.1. Строение и функции эритроцитарной мембраны
Эритроцит обладает развитым мембранным комплексом и совершенным рецепторным аппаратом [12, 18, 20, 42, 61, 92, 89, 99-101]. Мембрана служит барьером проницаемости с повышенной степенью избирательности, обеспечивая таким образом поддержание клеточного гомеостазиса в условиях больших различий химического состава цитоплазмы клеток и среды [42, 88, 99-101]. Перенос веществ через мембрану совершается в зависимости от их химических свойств различными способами: диффузией, путем проникновения через липидные участки, либо взаимодействуя с встроенными в мембрану белками переносчиками [40, 59, 72, 92].
Мембрана эритроцитов отражает особенности биохимического строения мембран различных тканей, а именно представляет пластичную молекулярную мозаику, состоящую из белков, липо- и гликопротеинов и, возможно, чисто липидных участков [88, 91]. В липидном бислое содержатся холестерин, фосфотидилсерин, фосфотидилэтаноламин, фосфотидилхолин, сфингомиелин, цереброзиды и другие липиды [12]. Липиды в мембране эритроцита находятся исключительно в виде бислоя. В эритроците человека таких липидов не менее 97%. Существует как трансмембранная, так и планарная гетерогенность их распределения. Трансмембранная гетерогенность обуславливается тем, что аминофосфолипиды расположены в цитоплазматической половине бислоя, а остальные фосфолипиды в наружном. Планарная гетерогенность выражается в том, что в биологических мембранах присутствуют белки, с которыми липиды могут устанавливать более сильные нековалентные взаимодействия [12, 40].
Преобладающий по весовым параметрам холестерол своими гидроксильными группами примыкает к полярным головкам фосфолипидных молекул и является фактором, определяющим текучесть мембран и механическую прочность бислоя [59, 98].
Белки в эритроцитарной мембране расположены неравномерно. Основная часть мембранных белков располагается на внутренней (цитоплазматической) стороне мембраны и образует сеть филаментов, которая служит для поддержания двояковогнутой формы эритроцита. К таким белкам относятся: спектрин, гликофорин (рецепторный белок), каталитический белок - "band 3-гликопротеин", являющийся и интегральным белком мембраны, участвующим в транспорте ионов. Поверхностный цитоскелет (строма) эритроцита включает такие белки, как синдеин, анкирин, "band-3", "band-4.1", "band-2.1" [34, 40].Кроме того, гликофорин и белок полосы III являются трансмембранными белками. Последний формирует ионные каналы [12, 15, 69, 70].
Углеводная составляющая эритроцитарных мембран представлена в виде олигосахаридных цепей, ковалентно присоединенных к белкам (гликопротеины) и в меньшей степени к липидам (гликолипиды) и располагающихся на стороне мембраны, контактирующей с цитоплазмой. Функция их заключается в стабилизации пространственной структуры гликопротеина [60, 81].
Фактор стабильности липидного бислоя определяется липидными порами. Эти поры образуются в местах дефектов жидкокристаллической структуры липидного бислоя. Если липидная пора не превышает некоторый критический размер, то структура сохраняется. Минимальные размеры липидных пор могут стать сравнимыми с размерами избирательных белковых каналов, регулирующих в норме ионную проницаемость клеточных мембран [3, 59, 60, 96].
Фактор целостности мембраны определяется биохимическими процессами. При рассмотрении энзимов основного энергетического процесса в эритроците - гликолиза - в первую очередь, выделяют каталазу и глюкозо-6 фосфатдегидрогеназу. Защитная роль каталазы заключается в предотвращении окисления гемоглобина до метгемоглобина, а также предохранении гемоглабина от расщепления под действием перекиси водорода. Сходным эффектом обладает глутатионпероксидаза. Эритроциты, лишенные этих ферментов, становятся весьма чувствительными к действию радиации [56, 59, 94, 97]. Глюкоза-6-фосфатдегидрогеназа катализирует реакцию образования НАДФ(Н); последний в свою очередь способствует функционированию глутатионредуктазы, которая регулирует уровень восстановленного глутатиона. Глутатион необходим для нормального протекания реакций гликолиза. Система глутатина рассматривается как буферная, защищающая эритроциты от деструктивного действия окислителей. Нарушение синтеза глутатиона, увеличение его распада, а также нарушение систем регулирования его уровня приводит к гемолизу [39].
1.2. Понятие резистентности и разрушение эритроцитов
Морфофункциональные характеристики, обеспечивающие целостность эритроцитов, могут изменяться при воздействии ряда внешних и внутренних факторов. Нормальный эритроцит способен до определенного предела противостоять действию осмотических, механических, химических, температурных влияний. Это характеризуется понятием резистентности. Эта способность крови зависит от возраста форменных элементов и уменьшается по мере их старения [13, 50, 78].
При уменьшении резистетности эритроцитов до минимума начинается процесс гемолиза. Гемолизом называется процесс разрушения мембран эритроцитов, сопровождающийся выходом гемоглобина в плазму крови. Плазма при этом окрашивается в красный цвет ("лаковая кровь"). Гемолиз может проходить in vivo и in vitro.
В зависимости от природы разрушающего агента различают осмотический гемолиз (разрушение эритроцитов в гипотонических растворах), механический (разрушение вне организма по воздействием сильных механических воздействий), химический (разрушение эритроцитов под влиянием химических соединений: кислот, щелочей, солей и т.д.), температурный (под влиянием температур, отклоняющихся от оптимального диапазона). Гемолиз может быть вызван действием ультрафиолетового, ионизирующего, рентгеновского излучения [27]. К этиологическим факторам, вызывающим развитие гемолитического процесса, относятся некоторые медикаментозные средства (хинин, хинидин, фенацетин, сульфаниламидные препараты и др.), бактериальные токсины.Отдельные растения (альпийская фиалка, лютик, пыльца бобовых, горошек, дрок и др.), как и большинство медикаментозных препаратов могут обусловить развитие гемолитического синдрома токсико-аллергической природы.Не исключена роль и наследственного фактора при развитии некоторых видов гемолитических анемий [68].
Независимо от типа гемолиза можно наблюдать, что распаду эритроцитов предшествует их сферуляция и разбухание до определенного предела, допустимого оболочкой клетки. Исходя из этого специалисты утверждают, что результатом процесса гемолиза является превышение внутриклеточной осмотической концентрации над наружной и разрыв оболочки внутренним осмотическим давлением [56, 73].
По данным И.А.Терского и И.И.Гительзона [21], при гемолизе эритроцит проходит ряд этапов:
1. прегемолитическая стадия;
2. стадия осмотического гемоглобинолиза;
3. стадия химического гемоглобинолиза;
4. стадия полного разрушения клеточных структур, которая включает в себя 2 фазы – фазу стромопороза и стромотолиза.
В прегемолитической стадии происходит выход ионов калия из клетки в окружающую среду а также сферуляция эритроцитов.
В стадии осмотического гемоглобинолиза эритроцит набухает за пределы критического объема, что приводит к повреждению поверхности и выходу большей части гемоглобина в плазму. Химический состав эритроцита на данном этапе не претерпевает заметных изменений, а электрохимические и коллоидно-осмотические свойства стромы почти не отличаются от свойств неповрежденных эритроцитов [66].
Третья стадия – стадия химического гемоглобинолиза – характеризуется полным отщеплением гемоглобина и переходом части стеринов (около 30-40%) в окружающую среду. Несмотря на то, что на данном этапе гемолиза нарушение морфологической целостности не происходит, изменяется химический состав клетки, что приводит к изменению. электрохимических и коллоидно-осмотических свойств эритроцитов.
В следующей стадии наблюдается разрушение клеточных структур эритроцитов. В ней различают две фазы:
¨ 1 фаза стромопороза, в которой морфологическая целостность форменных элементов еще сохраняется, хотя клетки уже свободно пропускают электрический ток;
¨ 2 фаза строматолиза, когда происходит полный распад стромы эритроцитов.
Специалистами было показано, что при химическом гемолизе сферуляции и разбуханию эритроцитов предшествует этап проникновения гемолитика в клетку[21,71,76]. Возможны два варианта этого процесса: мембрана может быть проницаема и непроницаема для гемолитика. В первом случае гемолитик свободно проникает внутрь клетки, нарушает упорядочение протоплазматических структур и переводит большую часть молекул в растворенное состояние. Распадается также упорядоченная упаковка гемоглобина. Переход в раствор молекул гемоглобина повышает осмотическую активность внутриклеточного содержимого, мелкие освобожденные молекулы и ионы выходят наружу. Крупные липоидные и белковые молекулы остаются в клетке, так как оболочка для них непроницаема. В результате этих процессов осмотическое давление внутри клетки увеличивается. Далее гемолиз развивается по осмотическому пути.
Если же оболочка клетки непроницаема для действующего агента, к процессу гемолиза добавляется еще один этап. Проникновение гемолитика в клетку предшествует повреждение оболочки. В результате этого мембрана эритроцитов утрачивает непроницаемость для молекул лизина, после чего процесс развивается по ранее описанному пути [21, 77].
1.3 Реакции красной крови на воздействие химических факторов
Известно, что любые воздействия на организм находят свое отражение в изменениях системы крови, которая включает в себя как кроветворные органы, так и периферическую кровь. Реакция на воздействие различных агентов может колебаться в различных пределах от резко выраженного токсического до стимулирующего эффекта, а исследуемые характеристики могут как существенно отклоняться от нормы, так и не выходить за ее пределы.
Независимо от химической природы первым патогенным звеном воздействия химических факторов является мембраноповреждающий эффект, сопровождающийся нарушением функции каскада митохондриальных и микросомальных ферментов – оксигеназ, гидролаз, участвующих в детоксикации и элиминации патогенного начала [30, 90]. Многие агенты воздействуют на белки мембран, способствуя их окислению, денатурации и, как следствие, образование пор в ней. Например, этанол способствует денатурации белков мембраны, гемин вызывает как быстрый, так и медленный гемолиз, окисляя мембранные белки [3, 59]. Ртуть и ее органические соединения вызывают повреждение мембраны за счет блокады сульфогидрильных групп белковых молекул, входящих в состав биомембран [22].Подавляющее большинство гемолитических агентов вызывает повреждение мембраны, нарушая расположение молекул липидов в ней. Так олеиновокислый Na и желчные кислоты повреждают оболочку эритроцита, растворяя в ней лецитин, при этом повреждаются более глубокие части мембраны [59]. Активные формы O2
, H2
O2
, органические перекиси взаимодействуют с липидами мембран, образуют перекиси липидов, что приводит к структурным нарушениям и изменению проницаемости [2]. Ретиноиды индуцируют переход эритроцитарных липидов из бислойной фазы в гексагональную. Следовательно, стойкость эритроцитов нарушается [52]. При карбомилировании мембран эритроцитов цианат связывается с фосфотидилхолином и фосфотидилсерином, таким образом размер пор и их количество возрастает. Адреналин вызывает процесс перекисного окисления липидов [14]. Структурные и функциональные изменения мембраны эритроцитов были обнаружены при действии толуола и выражались в ослаблении связей между липидными и белковыми компонентами [37].
И.И.Гительзон и И.А.Терсков [21] показали, что катионы Mg2+
и в меньшей степени Ca2+
увеличивают стоикость эритроцитов, а Na+
и K+
практически не изменяют ее. Из анионов SO4
2-
очень резко увеличивают сстойкость эритроцитов, а PO4
3-
снижают ее. Исследованиями А.К.Гулевского [26] показано, что при предварительном низкотемпературном воздействии наблюдается следующий эффект: Na+
, Ca2+
, Mg2+
сорбируясь на мембране, меняют ее проницаемость для воды и ионов, а также механические свойства. Ионы K+
и Ca2+
снижают устойчивость мембраны.
Антигемолитическим действиям обладают 2-гидроксиламониевые соли арил-, тио- и арилсульфонилуксусной кислот [59]. Л.Гринбер и А.М. Аллахвердиев обнаружили повышение резистентности эритроцитов после добавления формиата Na и обработки промахином.
Лекарственные препараты также были исследованы на гемолитическое действие. Н.М.Митрохин с сотрудниками [4] исследовали вещества, применяемые в медицинской практики. Они установили, что более 70% исследованных препаратов вызывают деформацию эритроцитов. Катионы вызывают преимущественно стоматолиз клеток. Таким механизмом действия обладают димедрол, аминазин, промедола гидрохлорид и некоторые другие препараты. Анионы вызывают эхиноцитоз эритроцитов. Такое влияние характерно для всех барбитуратов, карцеина, мединала.
В последние годы специалисты уделяют большое внимание разработке средств, модулирующих иммунные реакции организма. Стало очевидным, что положительное действие разных лекарственных веществ можно объяснить их способностью повышать общую сопротивляемость организма или его неспецифический иммунитет, а также влиять на специфические иммунные реакции [65].Отражением неспецифической резистентности является система крови. Последняя играет роль эффектора и участвует благодаря особой реактивности в реализации адаптационно-трофических влияний для сохранения постоянства внутренней среды организма [21, 23-25, 51, 74, 86].
Повышение общей сопротивляемости организма отмечено под влиянием ряда стимулирующих препаратов. К веществам, проявляющим данную способность, относят производные пиримидиновых оснований [41, 49] В литературе имеются сведения о том, что соединения данного класса способствуют синтезу нуклеиновых кислот, белков, увеличивают активность иммунной системы.
Производные пиримидинов являются антиоксидантами. Механизм их антиоксидантного эффекта связан с подавлением перекисного окисления жирных кислот, а также с нарушением образования супероксидных радикалов. Данные препараты обладают защитным эффектом на цитоплазматическом и субклеточном уровне по отношению к свободным радикалам, продуцируемые активированными клетками (макрофагами, нейтрофилами). Лечебными препаратами этой группы являются пентаксил, метилурацил, оротовая кислота, сафинор и др. [77, 90].
Рядом исследователей была изучена также способность азолов стимулировать иммунологические процессы и повышать общую сопротивляемость организма. В практике нашли применение в этой связи дибазол, левамизол и др. [7, 41, 49]. Однако отмечается дозозависимость эффекта, так как при повышении доз возможно не иммунно-стимулирующее а иммунно-депрессивное действие [16].
Наряду с положительным влиянием азольных соединений нельзя не обратить вынимание на наличие побочных эффектов от их применения. Среди последних выделяют гематологические – анемия и биохимические – гипонатриемия и гиперлипидиемия [17].
Таким образом, при воздействии различных химических веществ на живой организм возникает выраженная ответная реакция со стороны красной крови, причем, характер и сила их влияний весьма многообразны.
2. Экспериментальная часть
2.1. Материалы и методика исследования
Влияние производных пиримидиновых оснований на устойчивость эритроцитов к дезинтегрирующему фактору изучали методом кислотных эритрограмм.
Исследовали свойства соединений, имеющие следующее химическое строение:
Наблюдения проводили in vivo. Было поставлено две серии экспериментов, в которых использовали 36 нелинейных крыс весом 200-250г. В каждой серии были сформированы две опытные и одна контрольная группа.
В первой серии опытов крысам одной опытной группы пятикратно внутрибрюшинно с интервалом в 48 часов вводили по 1 мл раствора цитозина в разовой дозе 1 мг/100 г массы животного, другой группы раствор цианоцитозина в той же дозе таким образом, что суммарная доза вводимого вещества в обеих группах составила 5 мг на 100 г массы животного. Во второй серии опытов в аналогичных условиях особями одной опытной группы инъецировали цитозинтетразол, другой – тиминтетразол.Крысам обеих контрольных групп вводили физиологический раствор в равном объеме.
Кровь для анализа брали в утренние часы перед кормлением животных из кончика хвоста до начала введения растворов исследуемых веществ – исходные значения, через 2,5 и 24 часа после каждого введения, а затем на 3, 5, 7 и 14 сутки после окончания инъекций. Для проведения исследования 20 мкл крови смешивали с 20 мл физиологического раствора, получая таким образом взвесь эритроцитов в разведении 1:1000.
Все исследования проводились при комнатной температуре.
Измерения оптической плотности взвеси эритроцитов производили на фотоэлектроколориметре КФК-2 УХЛ 42 при красном светофильтре. В кювету рабочей ширины 10 мм вливали 2 мл взвеси эритроцитов из отдельной пробы и добавляли к ней в качестве гемолитика 2 мл 0,004 н HCl. После этого кювету помещали в кюветодержатель прибора. С момента введения во взвесь эритроцитов гемолитика величина светопропускания исследуемого раствора начинала изменятся в связи с разрушением клеток крови. Каждые 30 секунд отмечали показания прибора по шкале экстинкции (Ео
). Измерение вели до получения двух совпадающих показаний, т.е. до завершения гемолиза (Еn
). В результате получали ряд убывающих экстинкций, каждая из которых соответствовала степени гемолиза к моменту отсчета. По значениям оптической плотности вычисляли процент разрушенных эритроцитов за каждые 30 секунд, принимая разность Ео
-Еn
за 100%.
Уровень значимости различий определяли по таблице стандартных значений критерия Стьюдента.
2.2. Результаты исследования
Результаты проведенных исследований показали, что цитозин при многократных введениях животным не оказал существенного влияния на исходные качественные характеристики эритроцитов. Об этом позволяют судить данные таблиц 1 и 2 (Приложение), в которых представлены усредненные показатели оптической плотности взвесей разрушающихся в ходе гемолиза эритроцитов особей опытной и контрольной группы. Как видно из таблиц, в отдельные сроки в течение длительного периода наблюдений имели место колебания функционального состояния эритроцитов по сравнению с исходным уровнем у животных обеих групп. Обращает на себя внимание идентичный характер и незначительные пределы сдвигов показателей у контрольных и подопытных особей.
О физико-химическом состоянии эритроцитов, подвергшихся воздействию гемолитика, до и на фоне введения животным цитозина позволяют судить кислотные эритрограммы (рис. 2.1, 2.2).
Первоначальное распределение по степеням стойкости к гемолитику эритроцитов интактных крыс отражает исходная эритрограмма. Согласно графику, процесс разрушения эритроцитов начинается через 1,5 минуты после добавления к их взвеси гемолитика, наибольшей интенсивности достигает к 3,5 минутам и заканчивается через 7,5 минут.
Как известно, состав эритроцитарной популяции неоднороден. В соответствии с хронологическим возрастом эритроцитов положение начальной части кривой определяется содержанием в периферической крови старых малостойких клеточных форм, средней части – основной массы среднеустойчивых клеток, и ее конечной части – наличием устойчивых молодых форменных элементов [20, 38].
Рис. 2.1. Кислотные эритрограммы крови крыс на фоне пятикратного введения цитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная гистограмма исходная гистограмма
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
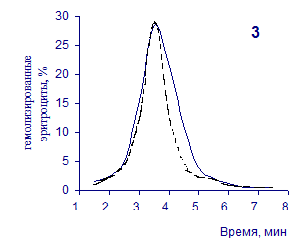
Рис. 2.2 Кислотные эритрограммы крови крыс в отставленные сроки наблюдения после пятикратного введения цитозина
1-4 – на 3, 5, 7 и 14 сутки соответственно
 исходная гистограмма исходная гистограмма
 опытная кривая опытная кривая
Рис. 2.3 Кинетика гемолиза крови крыс на фоне пятикратного введения цитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная гистограмма исходная гистограмма
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
Рис. 2.4. Кинетика гемолиза эритроцитов крыс на фоне пятикратного введения цитозина в разовой дозе 1 мг/100 г массы
1-4 – на 3, 5, 7 и 14 сутки соответственно
 исходная гистограмма исходная гистограмма
 после окончания введений веществ после окончания введений веществ
Анализ эритрограмм на фоне пятикратного введения животным цитозина не выявил заметного перераспределения эритроцитов по степени их устойчивости к дезинтегрирующему агенту. Во все сроки наблюдения интенсивность их разрушения под действием соляной кислоты и общая продолжительность лизиса мало различались с их исходными показателями и почти полностью совпадали с таковыми у контрольной группы.
Отсутствие выраженного эффекта действия цитозина на резистентность эритроцитов отражают также кривые кинетики гемолиза, которые характеризуют динамику разрушения клеток крови под влиянием гемолитика (рис.2.3, 2.4). Кривая процесса гемолиза у интактных крыс характеризуется S-образной формой. Она медленно нарастает в своей начальной части, затем круто поднимается вверх в интервале от 2,5 до 5,5 минут, после чего переходит в плато и заканчивается на 7,5 минуте.
Как видно из приведенных графических материалов, на фоне пятикратного введения растворов пиримидина и в течении двух недель после прекращения инъекций форма кривой практически не отличается от исходных характеристик.
В серии опытов с многократным введением животным цианоцитозина выявлена способность последнего определенным образом изменять базовые свойства эритроцитов. Усредненные данные по динамике показателей оптической плотности взвесей разрушающихся эритроцитов у животных этой группы представлены в таблице 3 (Приложение). Сравнительный анализ исследований крови опытных и контрольных особей показали, что циановое производное пиримидинового основания оказало заметное влияние на функциональное состояние эритроцитов. При относительно слабых колебаниях устойчивости к гемолитику форменных элементов крови контрольных крыс, которым длительное время инъекцировали физиологичес-
Рис. 2.5. Кислотные эритрограммы крови крыс на фоне пятикратного введения цианоцитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная гистограмма исходная гистограмма
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
Рис.2.6. Кислотные эритрограммы крови крыс в отставленные сроки наблюдения после пятикратного введения цианоцитозина
1-4 – на 3, 5, 7 и 14 сутки
 исходная кривая исходная кривая
 опытная кривая опытная кривая
кий раствор, отмечены достаточно выраженное и закономерное усиление резистентности эритроцитов, обусловленное влияние цианоцитозина. Динамику качественных изменений клеток крови под влиянием исследуемого вещества позволяют проследить кислотные эритрограммы на рис.2.5, 2.6.
Как видно из эритрограмм, смена их положений относительно первоначального указывает на тенденцию к усилению устойчивости эритроцитов к гемолитику. Это находит отражение в сдвиге эритрограмм в сторону больших временных значений. Уже на фоне первых трех инъекций растворов цианоцитозина вершина кривой смещается с 3,5 до 4,0-х минут, а при последующих введениях до 5,0 минут (p<0,05), а конец эритрограммы с 7,5 до 8,0 минут. Это означает, что скорость распада клеток крови под влиянием соляной кислоты несколько замедляется, и время от начала до полного завершения химического гемолиза удлииняется. Эффект оказывается достаточно стойким и сохраняется в течение недели послеокончания введений вещества. Лишь к концу второй недели резистентность эритроцитов приближается, однако не возвращается полностью к исходному уровню.
Кривые кинетики гемолиза показательны в плане описания скорости процесса лизиса гемолитиком эритроцитов подопытных животных (рис.2.7, 2.8). На фоне первого и всех последующих инъекций растворов исследуемого вещества форма кривой относительно исходной существенным образом изменяется: становится более пологой и вся кривая смещается вправо. После четвертого и пятого введений с высокой степенью достоверности наблюдается отклонение кривых по всем характеристикам в область больших временных значений, что свидетельствует об увеличении времени контакта эритроцитов до момента их разрушения соляной кислотой.
Рис. 2.7. Кинетика гемолиза крови крыс на фоне пятикратного введения цианоцитозина в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная кривая исходная кривая
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
Рис. 2.8. Кинетика гемолиза эритроцитов крыс на фоне пятикратного введения цианоцитозина в разовой дозе 1 мг/100 г массы
1-4 – на 3, 5, 7 и 14 сутки соответственно
 исходная гистограмма исходная гистограмма
 после окончания введений веществ после окончания введений веществ
В отставленные сроки тенденция к усилению сопротивляемости клеток к действию гемолитика сохраняется, однако выраженность эффекта уменьшается.
При исследовании крови животных, которым пятикратно вводили раствор цитозинтетразола было отмечено качественно иное изменение базовых физико-химических свойств эритроцитов. Усредненные данные по изменению показателей оптической плотности взвесей разрушающихся клеток крови соляной кислотой представлены в таблице 4 (Приложение). Изменение резистентности форменных элементов также иллюстрируют кислотные эритрограммы и кривые кинетики гемолиза (рис.2.9-2.12).
Согласно представленным материалам, под влиянием цитозинтетразола устойчивость эритроцитов существенным образом ослабилась. Тенденция к снижению способности клеток красной крови противостоять действию гемолитика обнаружилась уже на фоне первой инъекции тетразольного производного. Эффект нарастал с кратностью введений вещества (рис.2.9). После третьей инъекции ускорение процесса разрушения эритроцитов под действием соляной кислоты выразилось в сдвиге вершины кривой с 5.5 на 4,5 минуты (p<0,05) и смещение всей площади эритрограммы влево. Обращает на себя внимание некоторе расширение основания кривой, что означает удлинение общего времени гемолиза. После третьего и последующих введений оно увеличилось по сравнению с первоначальным на одну минуту, о чем свидетельствует смещение конца эритрограммы с 7 до 8 минут. Выраженность эффекта сохраняется не только до последнего введения вещества, но и в отставленные сроки наблюдений.
Способность цитозинтетразола понижать резистентность эритроцитов отражают также кривые кинетики гемолиза (рис.2.11, 2.12). Относительно исходного положения последующие кривые процесса гемолиза имеют более
Рис. 2.9. Кислотные эритрограммы крови крыс на фоне пятикратного введения цитозинтетразола в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная гистограмма исходная гистограмма
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
Рис.2.10. Кислотные эритрограммы крови крыс в отставленные сроки наблюдения после пятикратного введения цитозинтетразола.
1-4 – на 3, 5, 7 и 14 сутки
 исходная кривая исходная кривая
 опытная кривая опытная кривая
Рис. 2.11. Кинетика гемолиза крови крыс на фоне пятикратного введения цитозинтетразола в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
Рис. 2.12. Кинетика гемолиза крови крыс на фоне пятикратного введения цитозинтетразола в разовой дозе 1 мг/100 г массы
1-4 – на 3, 5, 7 и 14 сутки соответственно
 исходная кривая исходная кривая
 после окончания введений веществ после окончания введений веществ
крутую форму и сдвигаются влево. Как видно из графиков, начальный участок, соответствующий наличию в популяции эритроцитов малостойких клеточных форм, у интактных крыс находился в интервале от 1,5 до 4.5 минут, а уже после третьего введения сдвигался до 3.5 минут. Как этот факт, так и более быстрое разрушение остаточной части эритроцитов в пробе, свидетельствуют о повышении в периферической крови количества мало- и среднестойких форменных элементов. Так до начала введений подопытным животным цитозинтетразола под влиянием соляной кислоты в пробе разрушились через 4.0 минуты 9%, а через 5.5 минут 66% эритроцитов. В пробах крови крыс сразу после третьего введения химического агента гемолитика вызывали разрушение на те же сроки уже 27 и 92% соответственно.
После прекращения инъекций цитозинтетразола функциональное состояние эритроцитов не восстанавливалось до конца проводимого исследования.
В серии опытов с многократным введением животным тиминтетразола был получен аналогично рассмотренному у цитозинтетразола эффект ослабления резистентности (таблица 5, рис.2.13, 2.14).
Как иллюстрируют гистограммы, уже через 2.5 часа после первого введения исследуемого соединения наблюдалось смещение площади кривой в область меньших временных значений.
При последующих введений растворов вещества эффект усиливается вследствие перераспределения эритроцитов по степени стойкости к гемолитику. Максимум эритрограммы смещается с 5,5 на 4.5 минут.
Кривые гемолиза подтверждают полученный эффект снижения устойчивости эритроцитов после инъекций тиминтетразола (рис.2.15, 2.16). На протяжении всего периода введений вещества, а также в отставленные
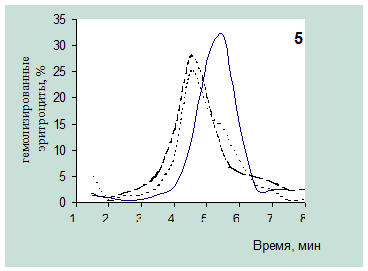
Рис. 2.13. Кислотные эритрограммы крови крыс на фоне пятикратного введения тиминтетразола в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная гистограмма исходная гистограмма
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
Рис.2.14. Кислотные эритрограммы крови крыс в отставленные сроки наблюдения после пятикратного введения тиминтетразола.
1-4 – на 3, 5, 7 и 14 сутки
 исходная кривая исходная кривая
 опытная кривая опытная кривая
Рис. 2.15. Кинетика гемолиза эритроцитов крыс на фоне пятикратного введения тиминтетразола в разовой дозе 1 мг/100 г массы
1-5 – последовательность введения
 исходная гистограмма исходная гистограмма
 через 2,5 часа через 2,5 часа
 через 24 часа через 24 часа
Рис. 2.16. Кинетика гемолиза эритроцитов крыс на фоне пятикратного введения тиминтетразола в разовой дозе 1 мг/100 г массы
1-4 – на 3, 5, 7 и 14 сутки соответственно
 исходная гистограмма исходная гистограмма
 после окончания введений веществ после окончания введений веществ
сроки наблюдений от ослаблении резистентности клеток крови свидетельствует смещение кривых процесса гемолиза влево по сравнению с фоновым положением. Анализ как эритрограмм, так и кривых кинетики гемолиза указывает на то, что время контакта эритроцитов с соляной кислотой до начала их разрушения заметно сокращалось. На усиление интенсивности лизиса эритроцитов указывает также тот факт, что к 4.5 минутам у интактных крыс под влиянием гемолитика разрушалось лишь 17%, тогда как уже после первого введения исследуемого соединения этот показатель возрос до 33% (таблица 5).
Однако следует обратить внимание на то, что в этих условиях , при снижении резистентности эритроцитов, общее время лизиса могло несколько удлиниться с 7,5 до 8 минут, что по-видимому, означало появление в периферическом русле некоторого количества более стойких клеток. Такое явление может быть результатом компенсаторного усиления активности костного мозга, обусловленое влиянием продуктов лизиса эритроцитов [83].
2.3. Обсуждение результатов
Результаты проведенных исследований показали, что изучаемые производные пиримидиновых оснований оказали существенное влияние на функциональное состояние клеточных элементов крови крыс. Анализ кривых кинетики кислотного гемолиза и эритрограмм позволил определить влияние пиримидиновых соединений на характер распределения эритроциов по степени их устойчивости, а также на начало, интенсивность и завершение процесса их разрушения под действием повреждающего агента. Сравнительный анализ результатов исследования показал, что цитозин, цианоцитозин, а также тетразольные производные цитозина и тимина способны различным образом модулировать матричные свойства эритроцитов крови.
По схеме эксперимента мы остановились на дробном введении исследуемых веществ. Это обусловлено стремлением приблизить действие данных соединений к условиям длительного воздействия химических веществ на организм, как в промышленном производстве, так и при применении многих лекарственных препаратов.
Исследование цитозина не обнаружило заметного влияния на исходную способность эритроцитов противостоять действию гемолитика. Во все сроки наблюдения интенсивность разрушения красных клеток крови под действием соляной кислоты и общая продолжительность лизиса мало различались с первоначальными характеристиками и почти полностью совпадали с таковыми у контрольной группы животных. Включение в молекулу пиримидинового основания цианогруппы значительно увеличило его активность, выразившуюся в достаточно закономерном усилении резистентности эритроцитов. Следует заметить, что аналогичные данные были получены в отношении тимина, у которого при слабой собственной активности было отмечено повышение протекторных свойств в случае присоединения к молекуле цианового радикала [76].
Совершенно иную способность изменять функциональное состояние эритроцитов обнаружили пиримидиновые соединения с включением в их структуры тетразольного радикала. Во всех случаях цитозинтетразол и тиминтетразол ослабляли исходную базовую устойчивость эритроцитов к повреждающим воздействиям.
Поскольку вещества с общими носителями и разными радикалами в структуре молекулы различаются по своим свойствам, правомерно считать, что ответственными за изменение последних являются заместители. Полученные в настоящей работе данные подтверждают сложившееся у специалистов представление о зависимости эффекта действия вещества от особенностей его химической структуры.
Таким образом, сопоставление результатов обработки данных, полученных по производным гетероциклических соединений обнаружило способность одних (цитозин, цианоцитозин) усиливать, а других (цитозинтетразол, тиминтетразол) ослаблять исходную кислотную резистентность эритроцитов.
При обсуждении возможных механизмов влияния веществ необходимо учитывать ряд моментов. Как известно, природные пиримидиновые основания присутствуют во всех живых клетках в составе ДНК и РНК, являются структурными компонентами нуклеиновых коферментов, что определяет их участие во многих важных биохимических механизмах [7, 51, 55]. Это позволяет допускать, что биологически активные соединения, получаемые на основе их синтетических аналогов, способны влиять на клеточный метаболизм, стимулируя или угнетая течение биологических процессов [41, 49, 53, 90]. Согласно имеющимся сведениям костно-мозговая ткань характеризуется лабильностью и способностью изменять свою активность при различного рода воздействиях [19, 26, 66, 79]. В этой связи отмеченное в работе усиление или ослабление исходной сопротивляемости эритроцитов может быть обусловлено влиянием изучаемых пиримидиновых оснований на кроветворные органы и, вследствие позитивного и негативного воздействия на эритропоэз, выходом в периферическое русло клеток с измененными свойствами [48, 74, 75, 82]. Однако, по мнению специалистов, химические агенты, а производные азолов и пиримидинов в этом не исключение, в первую очередь действуют на уровне циркулирующих клеток крови, регулируя их устойчивость [54, 57, 70]. В условиях непосредственного контакта в периферическом русле химические вещества могут оказывать различное влияние на биохимические системы, ответственные за сохранение целостности мембран эритроцитов, при этом усиливая или ослабляя их генетически детерминированную резистентность. Такое различие эффектов может определяться влиянием на характер связей между белковыми и липидными компонентами мембраны, уровень активности ферментных систем клетки, уровень отрицательного заряда поверхности мембран и другими причинами [4, 11, 27, 29, 39].
Оценивая степень клеточной резистентности, необходимо учитывать, что клетки, являясь конечным пунктом сложных адаптационных реакций, не только отражают общий уровень сопротивляемости организма, но и обеспечивают его [57, 70]. В этой связи, модуляция производными пиримидиновых оснований клеточной резистентности может служить показателем возможного эффекта их действия на уровне целого организма.
Установленные в работе факты и ранее полученные данные [47, 67, 76], свидетельствующие о способности производных пиримидиновых оснований оказывать стабилизирующее или дестабилизирующее влияние на мембраны эритроцитов в зависимости от природы радикала в их структуре, указывают на перспективность дальнейшего поиска в ряду соединений данного ряда веществ с выраженными протекторными свойствами.
Выводы
1.Цитозин, цианоцитозин и тетразольные производные пиримидиновых оснований (цитозинтетразол и тиминтетразол) при пятикратных внутрибрюшинных введениях в разовой дозе 1 мг на 100 г массы животного обнаружили выраженную биологическую активность, проявившуюся в способности регулировать исходную сопротивляемость эритроцитов к повреждающему агенту (0,004 н HCl). Выявлена зависимость эффекта воздействия на эритроциты от химической структуры производных гетероциклических соединений.
2. Цитозин при пятикратных введениях не оказал заметного влияния на исходное функциональное состояние эритроцитов. Производное пиримидина, в котором в качестве заместителя была использована цианогруппа, преобрело способность повышать резистентность эритроцитов.
3. Тетразольные производные цитозина и тимина проявили способность регулировать базовую резистентность клеток красной крови в сторону ее уменьшения.
Список использованных источников
1. Азеев Ю.А., Мудрецова И.И., Голенева А.Ф. Синтез и некоторые свойства гидразинпроизводных 1,2-диметил-5-нитрозоурацила .//Хим.-фарм. журн. 1987. № 12. С.1446-1450.
2. Аничков С.В. Фармакология. Л.1969. 557 с.
3. Антонов В.Ф.Структура биомембран. Липидные поры.// Соровский образов. журн. 1998. № 10 (35). 13 с.
4. Бадалян Л.О., Дунаевская Г.Н., Ситников В.Ф. Лечение больных прогрессирующей мышечной дистрофией.// Журн. невропат. и психиатр. 1975. № 9. С.1317-1319.
5. Барбашова З.И. – В кн.: Всесоюзное физиол. об-во им.Павлова, 13-й съезд: труды. Л.1979.Т.1. С.210-211.
6. Баренбойм Т.М., Маленков А.Г. Биологически активные вещества. Новые принципы поиска. М. Наука. 1986. 363 с.
7. Белозерский А.Н. Биохимия нуклеиновых кислот и нуклеотидов. М. Наука. 1976. 372 с.
8. Белоусова О.И., Горизонтов Т.Д., Федотова М.И. Радиация и система крови. М. 1979. 112 с.
9. Белякова Н.А. Реакция 1-цианазолов и 1-цианопроизводных оснований со спиртами и аминами алифатического и ароматических рядов: Автореф. дисс….канд. хим. наук. Самара. 2001. 23 с.
10. Бесядецкая Е.И., Семенюк Т.Н. Фосфорилированные этиленамидные производные урацилов, получение и биологическая активность // Хим.-фарм. журн. 1982. № 10. С.1185-1191.
11. Билич Г.Л., Новикова Б.М. Влияние оротовой кислоты на процесс регенерации после резекции желудка. // Вест.хир.. 1978. № 3, С.29-32.
12. Большая медицинская энциклопедия./ Под ред. Б.В.Петровского М.Советская энциклопедия. 1977. 712 с.
13. Бондарев Л.С., Зайцев И.А.,Жидких В.Н. Влияние некоторых воздействий на осмотическую стойкость эритроцитов.// Лаб. дело. 1990 .№ 7 . С . 29-31
14. Бойтлер Э.В. Нарушение метаболизма эритроцитов и гемолитическая анемия. М. Медицина. 1981. 255 с.
15. Вильев П.С., Петрова М.П. Роль белково-липидных комплексов и осмотического равновесия в сохранности физико-химической структуры эритроцитов. / Вопросы биофизики, биохимии и патологии эритроцитов. Красноярск. 1960. Вып.1. С.302-309.
16. Виноградова Ю.Е., Рогозина И.В., Иванина Е.К., Лебедев И.А. Клинический эффект левамизола и возможность лабораторного прогнозирования его действия. // Тер. арх. 1980. № 9. С.30-34.
17. Вокин А.И., Шулунова А.М. Лопырев В.А. и др. Сольватохромия гетероароматических соединений. Особенности взаимодействия 4-нитротирозина с амфипротонными растворителями. // ЖОРХ. 1998. Т.34. вып.11. С.1741-1747.
18. Воробьев А.М., Лор Ю.И. Руководство по гематологии. М. Медицина. 1979. 438 с.
19. Ганжара Н.С., Новиков А.А. Учебное пособие по клинической токсикологии. М. Медицина. 1972. 158 с.
20. Германов В.А., Писканов О.Н. Эритроциты, тромбоциты, лейкоциты. Куйбышев. 1966. 164 с.
21. Гительзон И.И., Тересков И.А. Закономерности распределения эритроцитов по стойкости к различным гемолитикам. / Вопросы биофизики, биохимии и патологии эритроцитов. Красноярск. 1961.
С.30-59.
22. Голиков С.Н., Розенгарт В.И. Холинэстераза и ацетилхолинэстеразные вещества. Л.Медицина. 1964. 378 с.
23. Горизонтов П.Д. Система крови как основа резистентности и адаптации организма.// Патологическая физиология и экспериментальная терапия. Г.М.Медицина. 1981. № 2. С.323-325.
24. Горизонтов П.Д. В кн.:Гомеостаз. М.1976.С 35-38.
25. Горизонтов П.Д. В кн.:Стресс и адаптация. Кишенев. 1978. С.19-20.
26. Грибова А.Н., Гусейнов И.А., Павлюсенко И.А. Морфофункциональные изменения эритроцитов при воздействии токсических факторов. // Гигиена и санитария. 1980. № 6. С.74-76.
27. Гулевский А.К. Влияние низкотемпературного воздействия на проницаемость мембран эритроцитов, реконструированных в средах разного ионного состава. // Бюллетень экспериментальной биологии и медицины. 1981. Т.91. № 5. С.551-552.
28. Гурова Л.И., Барбина С.С. О токсическом действии и гигиеническом формировании диметилцианамида в воздухе рабочей зоны. // Гигиена труда и проф. заболеваний. 1981. № 5. С.43-45.
29. Дергачев В.В. и др. Лечение оротовой и фолиевой кислотами и витамином В12
детей с нарушением памяти.// Сов.мед.1970. № 7. С.78-82.
30. Ершов Ю.А., Плетнева Т.В. Механизмы токсического действия неорганических соединений. М. Медицина. 1989. 272 с.
31. Жаров Е.М. Применение кофакторов синтеза и предшественников нуклеиновых кислот у больных инфарктом миокарда.// Кардиология. 1971. № 11. С.15-25.
32. Заводнин И.Б, Пилецкая Г.П. Кинетика этанолиндуцированного лизиса эритроцитов человека. // Биофизика. 1994. № 6. С.1033-1039.
33. Зенгер В.В. Принципы структурной организации нуклеиновых кислот. М. Мир. 1987. 209 с.
34. Ивенс И., Скейтлак Р. Механика и термодинамика биологических мембран. М. Мир. 1982. 257 с.
35. Итоги науки и техники. Сер.: Иммунология./ Под ред. Р.В. Пеперова. М. 1978. Т.7. 150 с. 1979. Т.8. 172 с.
36. Калдрикян М.А., Гебоян В.А., Степанян Г.М. Производные пиримидина. Синтез и изучение биологических свойств N-замещенных дигидроурацилов и дигидротиоурацилов. // Хим.-фарм. журн. 1983. № 10. С.1203-1207.
37. Кальман П.А., Волчкова Ш. Взаимодействие систем транспорта Ca2+
и адренорецепции перекисной резистентности эритроцитов и активности ферментов антиоксидазной защиты. // Р.ж. 1994. № 8. 8 с.
38. Кассирский И.А., Алексеев Г.А. Клиническая гематология. М. Медицина. 1970. 796 с.
39. Клиорин А.И., Тиунов Л.А. Функциональная неравнозначность эритроцитов. Л. Наука. 1974. 148 с.
40. Козлов М.М., Маркин В.С. Мембранный скелет эритроцита. Теоретическая модель.// Биологические мембраны. 1986. Т.3. № 4. 110 с.
41. Комаров Ф.И., Даниляк И.Г., Гуляев Ф.Е. и др. О неспецифической противоспалительной фармакотерапии больных инфекционно-воспалительными заболеваниями органов дыхания. // Тер. арх. 1979. № 10. С.104-108.
42. Конев С.В. Структурная лабильность топологических мембран и регуляторные процессы. Минск. Наука и техника. 1987. 240 с.
43. Краузе А.А., Витолини Р.О., Зариныш Г.В. Синтез и кардиоваскулярная активность замещенных 3-циано-3,4-дигидропиримидин-2-тионов. //Хим.-фарм. журн. 1985. Т.19. № 5. С.540-545.
44. Крепс Е.М. Липиды клеточных мембран. Адаптационная функция липидов. Л. 1981. 339 с.
45. Круглова В.А., Анненков В.В., Москвитина Л.Т. и др. Синтез и исследование влияния на процесс гемокоагуляции поли-5-изопропенилтетразола. // Хим.-фарм. журн. 1989. Т.23. № 2. С.195-198.
46. Кузнецов П.П., Шустов В.Я. Гематологические показатели при воздействии акрилонитрила. // Гигиена труда и проф.заболеваний. 1986. № 7. С.41-43.
47. Кузьмина В.Е., Сергеева Л.И., Пурыгин П.П., Белякова Н.А. Характер влияния 1-цианобензимидазола на картину белой крови. // Вестник СамГУ. 1966. № 2(12). С.133-139.
48. Курляндский К.Д. Изучение влияния химических соединений на систему крови. // Проблемы токсикологии. 1972. № 5. С.8-32.
49. Левин А.И. и др. О лечебном действии пиримидиновых производных (пентоксила и 4-метилурацила) при язвенной болезни.// Сов.мед. 1969. № 11. С.81-84.
50. Левтов В.А., Регирер С.А., Шадрина Н.К. Реология крови. М.: Медицина. 1982. 272 с.
51. Льюин Б. Гены. М.Мир. 1987. 544 с.
52. Любарев А.Е., Курганов Б.И. Влияние ретиноидов на осмотическую стойкость эритроцитов. // Хим.-фарм. журн. 1987. Т.21. № 8. С.919-923.
53. Машковский М.Д. Лекарственные средства. М. Медицина. 1984. ч.2. С.138-169.
54. Микашинович З.И. Действие различных факторов на кровь. //Бюл.экспер.биол. 1980. № 10.С.418-420.
55. Микельсон А. Химия нуклеозидов и нуклеотидов. М. Мир. 1966. 688 с.
56. Михайлов В.Ф., Потемкин Л.А. Оценка радиационного повреждения мембраны эритроцита по изменению седиментационных свойств. // Радиобиология. 1985. Т.25. вып.6. С.784-786.
57. Меерсон Ф.З. Успехи физиологических наук. 1991. Т.22. С.82-89.
58. Меерсон Ф.З. Адаптация, стресс и профилактика. М. 1981. 54 с.
59. Молекулярная биология клетки. / Б.Альбертс, Д.Брей, Дж.Льюис и др. М. Мир. 1994. 517 с.
60. Моисеева О.И. Транспорт кислорода кровью. // Физиол. журн. СССР им И.М.Сеченова. 1986. Т.72. № 1. С.93-103.
61. Морозова В.Т. Лабораторная диагностика эритроцитов. // Лаб. дело. 1988. № 3. С.77-79.
62. Новиков В.С., Озеров А.А., Брель А.К. Синтез и противовирусная активность о-аллил-производных 2,3-дигидроксил-пропилурацила и тимина. // Хим.-фарм. журн. 1991. № 12. С.35-37
63. Ольшанская А.Я., Одинокова В.А., Квитко Н.Н. Эритроциты в тканевом и имунном гомеостазе. // Сов. медицина. 1984. № 11. С.43-48.
64. Охнянская А.Г. Критерии оценки пределов адаптации человека при длительном воздействии производственных веществ. В кн.: Проблемы токсикологии. Адаптация и компенсация при химических воздействиях. ВИНИТИ. Итоги науки и техники. Т.5. 1973. С.49-64.
65. Петров Р.В. Иммунология. М. Медицина. 1982. 368 с.
66. Петрова М.П. Изучение последовательных стадий разрушения эритроцитов при действии гемолитиков. / Современные проблемы гематологии и переливания крови. М. 1956. С.52-57.
67. Пурыгин П.П., Кузьмина В.Е., Сергеева Л.И. и др. Синтез 1-цианобензимедазола и оценка его биологической активности по реакциям белой крови. // Хим.-фарм. журн. 2000. Т.34. № 2. С.11-13.
68. Рашевская А.М., Зорина Л.А. Профессиональные заболевания системы крови химической этиологии. М. Медицина. 1968. 300 с.
69. Рецепторы клеточных мембран для лекарств и гормонов. / Под ред. Д.Ральфа У., Штрауба, Д.Лианы Болис. М. Медицина. 1983. 220 с.
70. Розин М.А. Клетка и неспецифическая сопротивляемость организма. Цитологический анализ действия бензимедазола. Наука. Ленинград. 1976. С.148.
71. Рубенштейн Д.А., Рутберг Р.А. Коллоидно-осмотические основы химического гемолиза. / Биохимия. 1950. Т.15. вып.3. С.207-211.
72. Рыбальченко В.Н., Коганов М.М. Структура и функции мембран. Практикум. Киев. 1988. С.9-18.
73. Рябов С.И., Шостка Т.Д. Молекулярно-генетические аспекты эритропоэза. Л.: Медицина. 1973. 267 с.
74. Сааков С.И., Шепотинский В.И.// Пат. физиол. 1980. № 6. С.74-78.
75. Саноцкий И.В., Уланова И.П. Критерии вредности в гигиене и токсикологии при оценке опасности химических соединений. Медицина. 1975. С. 27.
76. Сергеева Л.И., Гетманенко Н.А., Абрамова Н.Т. Влияние урацила, тимина и их циановых производных на эритроцитарную систему крыс. // Физиология организмов в нормальном и экстремальном состоянии. 2001. Томск. С. 162-164.
77. Смирнов В.С. О применении метилурацила как фотозащитного средства. //Вест. дерматол. 1973. № 9. с. 68-71.
78. Соловьев Г.М., Радзивил Г.Г. Кровопотеря и регуляция кровообращения в хирургии. М. Медицина. 1973. 335 с.
79. Страйер Л. Биохимия. М. Мир. Т.1. 1984. С.211-215.
80. Судаков К.В. В кн.: Вопросы физиологии и вопросы кровообращения. Ставрополь. 1977. С.5-13.
81. Терехова М.В., Олейникова А.И. В кн.: Некоторые вопросы анатомии и физиологии. Алма-Ата. 1980. С.6-13.
82. Трахтенберг И.М., Сова Р.Е. Шефтель В.О. Проблемы и нормы в токсикологии. М. Медицина. 1991. 208 с.
83. Ужанский Л.Г. Проблемы гематологии и переливания крови. М. Медицина. Т.18. 1973. 13 с.
84. Фарбер Н.А. Клиническое применение левамизола – перспективы и предостережения.// Тер.арх. 1980. № 1 с.95.С.95-100.
85. Фармакология и токсикология синтетических соединений. Минск. 1959. 380 с.
86. Федотова М.И., Зимин Ю.А.// Бюл. экспер. биологии. 1975. № 6. С.32-34.
87. Фетисов В.И., Устинов В.Н., Ежов В.В., Сокольский Г.А. Анализ признакового пространства для классификации 1,5-дизамещенных тетразолов. // Хим.-фарм. журн. 1982. Т.16. № 10. С.74-79.
88. Физиология человека. / Под ред. Р. Шмидта, Г.Тевса. Т.3. М. Мир.1986. 673 с.
89. Фомин Н.А. Физиология человека. М. Просвещение. 1995. 19 с.
90. Хаитов Р.М.,Пинегин Б.В., Истамов Х.И. Экологическая иммунология. М. Изд-во. ВНИРО. 1995. 219 С.
91. Чернецкий Г.А., Воробей А.В. Структура и функции эритроцитарных мембран. Минск. 1981. С. 15-30.
92. Чижевская А.Л. Структурный анализ движущейся крови. М. Изд-во АН СССР. 1959. 474 с.
93. Чупахин О.Н. Разработка новых лекарственных средств для регионов с повышенным уровнем техногенного воздействия. Уральский гос.университет. www.yandex.ru
94. Янушка А.Л., Свиридов Б.Е. и др. Радиобиология./ Институт цитологии. АН СССР. Л. 1975. С.256-258.
95. Яфарова Н.Б., Лазарев Д.Н., Абдрашитов Р.Ф. Влияние метилурацила на иммунологические показатели./ / Казанс.мед. журн. 1974. № 3. С.72-73.
96. Cjrbucci G.C., Montanary G. Acta anaesthial, 1980. № 3. р.997-1006.
97. Moor К. Blaine, Shriver Stephaneiek. // Biochem and Biophys. Res. commun. 1997. 232. № 2. P.294-297.
98. Sheetr M., Sasely J. 2-3 DPG and ATP dissociate erythrocytes membrane. // J.Bios. Chem. 1980. V.225. № 26. P.9925-9960.
99. Welsh C.F., Zhu D. and Bourпuignon L. (1995). J. Cell Physiol. 164. 605-612.
100. Cowin R., Burke B. (1996). Corr. apinior Cess. Bios, 6, 56-65.
101.Yortch M., Homer D., Mashotza JD., Chang S., Frankel J. Jeffons G. and Durbeui L. R. (1998) J.Cell Bios. 142. 251-261.
Таблица 1
Усредненные величины оптической плотности взвеси эритроцитов, разрушенных гемолитиком на фоне пятикратного введения животным физиологического раствора (контроль)
| Время,
мин
|
До вве-
дения
|
После 1 Введения
|
После 2 Введения
|
| 2,5 час
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,303±0,003
|
0,333±0,007
|
0,308±0,003
|
0,305±0,004
|
0,312±0,008
|
| 1
|
0,303±0,003
|
0,333±0,007
|
0,08±0,003
|
0,305±0,004
|
0,312±0,008
|
| 1,5
|
0,293±0,005
|
0,332±0,007
|
0,305±0,003
|
0,299±0,003
|
0,304±0,005
|
| 2
|
0,292±0,005
|
0,330±0,005
|
0,301±0,004
|
0,298±0,004
|
0,302±0,005
|
| 2,5
|
0,291±0,006
|
0,327±0,005
|
0,298±0,004
|
0,297±0,003
|
0,299±0,004
|
| 3
|
0,287±0,006
|
0,325±0,008
|
0,292±0,007
|
0,295±0,004
|
0,296±0,005
|
| 3,5
|
0,281±0,006
|
0,318±0,005
|
0,284±0,006
|
0,285±0,009
|
0,287±0,005
|
| 4
|
0,265±0,006
|
0,302±0,012
|
0,265±0,012
|
0,250±0,013
|
0,261±0,010
|
| 4,5
|
0,225±0,010
|
0,258±0,013
|
0,220±0,022
|
0,173±0,026
|
0,197±0,027
|
| 5
|
0,148±0,016
|
0,205±0,031
|
0,135±0,025
|
0,080±0,028
|
0,132±0,033
|
| 5,5
|
0,072±0,012
|
0,095±0,023
|
0,070±0,023
|
0,042±0,024
|
0,075±0,030
|
| 6
|
0,045±0,007
|
0,070±0,014
|
0,044±0,022
|
0,031±0,023
|
0,041±0,023
|
| 6,5
|
0,022±0,004
|
0,066±0,005
|
0,036±0,013
|
0,028±0,010
|
0,025±0,011
|
| 7
|
0,017±0,004
|
0,031±0,008
|
0,016±0,010
|
0,019±0,004
|
| 7,5
|
0,015±0,004
|
0,026±0,008
|
0,008±0,004
|
| 8
|
Таблица 1 (продолжение)
| Время,
мин
|
После 3 Введения
|
После 4 Введения
|
После 5 Введения
|
| 2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,300±0,006
|
0,308±0,007
|
0,331±0,007
|
0,316±0,004
|
0,333±0,004
|
0,328±0,004
|
| 1
|
0,300±0,006
|
0,308±0,007
|
0,331±0,007
|
0,316±0,004
|
0,333±0,004
|
0,328±0,004
|
| 1,5
|
0,290±0,009
|
0,302±0,005
|
0,325±0,007
|
0,308±0,005
|
0,330±0,004
|
0,325±0,003
|
| 2
|
0,289±0,006
|
0,300±0,005
|
0,324±0,007
|
0,306±0,004
|
0,323±0,003
|
0,322±0,003
|
| 2,5
|
0,287±0,005
|
0,296±0,005
|
0,232±0,007
|
0,305±0,004
|
0,314±0,003
|
0,315±0,003
|
| 3
|
0,283±0,005
|
0,288±0,005
|
0,319±0,007
|
0,299±0,003
|
0,307±0,003
|
0,309±0,003
|
| 3,5
|
0,269±0,006
|
0,269±0,004
|
0,313±0,006
|
0,294±0,002
|
0,300±0,002
|
0,300±0,002
|
| 4
|
0,236±0,013
|
0,241±0,007
|
0,288±0,008
|
0,274±0,005
|
0,290±0,004
|
0,295±0,005
|
| 4,5
|
0,178±0,027
|
0,144±0,016
|
0,236±0,025
|
0,226±0,020
|
0,256±0,016
|
0,280±0,016
|
| 5
|
0,117±0,036
|
0,084±0,022
|
0,168±0,036
|
0,157±0,020
|
0,185±0,020
|
0,239±0,020
|
| 5,5
|
0,068±0,031
|
0,056±0,024
|
0,111±0,033
|
0,095±0,020
|
0,098±0,023
|
0,177±0,024
|
| 6
|
0,042±0,026
|
0,037±0,021
|
0,074±0,023
|
0,054±0,020
|
0,055±0,022
|
0,098±0,014
|
| 6,5
|
0,033±0,015
|
0,033±0,014
|
0,052±0,014
|
0,041±0,014
|
0,040±0,015
|
0,058±0,012
|
| 7
|
0,027±0,008
|
0,011±0,014
|
0,044±0,005
|
0,030±0,006
|
0,037±0,007
|
0,043±0,007
|
| 7,5
|
0,021±0,008
|
0,037±0,005
|
0,029±0,005
|
0,034±0,005
|
0,032±0,005
|
| 8
|
0,026±0,005
|
0,026±0,005
|
0,028±0,005
|
Таблица 1 (продолжение)
| Время,
мин
|
После окончания
|
| 3 сутки
|
5 сутки
|
7 сутки
|
14 сутки
|
| 0,5
|
0,311±0,004
|
0,328±0,003
|
0,339±0,004
|
0,340±0,005
|
| 1
|
0,311±0,004
|
0,328±0,003
|
0,339±0,004
|
0,340±0,005
|
| 1,5
|
0,305±0,004
|
0,323±0,004
|
0,334±0,003
|
0,328±0,004
|
| 2
|
0,293±0,002
|
0,322±0,004
|
0,333±0,003
|
0,325±0,004
|
| 2,5
|
0,278±0,003
|
0,319±0,004
|
0,330±0,006
|
0,324±0,006
|
| 3
|
0,264±0,003
|
0,312±0,004
|
0,325±0,003
|
0,322±0,004
|
| 3,5
|
0,238±0,002
|
0,294±0,003
|
0,318±0,002
|
0,315±0,002
|
| 4
|
0,178±0,017
|
0,256±0,006
|
0,297±0,005
|
0,295±0,004
|
| 4,5
|
0,138±0,021
|
0,197±0,023
|
0,268±0,017
|
0,265±0,016
|
| 5
|
0,082±0,025
|
0,130±0,012
|
0,174±0,019
|
0,170±0,020
|
| 5,5
|
0,048±0,023
|
0,074±0,025
|
0,090±0,025
|
0,082±0,022
|
| 6
|
0,037±0,016
|
0,053±0,027
|
0,051±0,015
|
0,050±0,014
|
| 6,5
|
0,033±0,016
|
0,044±0,014
|
0,040±0,008
|
0,038±0,005
|
| 7
|
0,030±0,010
|
0,038±0,007
|
0,030±0,005
|
0,027±0,004
|
| 7,5
|
0,025±0,010
|
0,031±0,007
|
0,028±0,005
|
0,025±0,004
|
| 8
|
Таблица 2
Усредненные величины оптической плотности взвеси эритроцитов, разрушенных гемолитиком на фоне пятикратного введения животным цитозина
| Время,
мин
|
До вве-
дения
|
После 1 Введения
|
После 2 Введения
|
| 2,5 час
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,330±0,005
|
0,330±0,007
|
0,325±0,006
|
0,330±0,008
|
0,333±0,008
|
| 1
|
0,330±0,005
|
0,330±0,007
|
0,325±0,006
|
0,330±0,008
|
0,333±0,008
|
| 1,5
|
0,321±0,006
|
0,320±0,008
|
0,310±0,008
|
0,318±0,010
|
0,330±0,009
|
| 2
|
0,300±0,007
|
0,318±0,009
|
0,285±0,009
|
0,288±0,010
|
0,323±0,010
|
| 2,5
|
0,265±0,007
|
0,305±0,015
|
0,255±0,006
|
0,253±0,016
|
0,284±0,010
|
| 3
|
0,200±0,012
|
0,260±0,017
|
0,210±0,007
|
0,213±0,010
|
0,210±0,010
|
| 3,5
|
0,128±0,011
|
0,144±0,017
|
0,125±0,007
|
0,144±0,011
|
0,123±0,012
|
| 4
|
0,078±0,02
|
0,050±0,008
|
0,045±0,008
|
0,075±0,006
|
0,070±0,007
|
| 4,5
|
0,056±0,015
|
0,041±0,006
|
0,031±0,008
|
0,061±0,009
|
0,052±0,007
|
| 5
|
0,042±0,010
|
0,038±0,005
|
0,027±0,007
|
0,058±0,007
|
0,043±0,006
|
| 5,5
|
0,025±0,005
|
0,025±0,004
|
0,017±0,007
|
0,051±0,007
|
0,040±0,005
|
| 6
|
0,016±0,004
|
0,020±0,003
|
0,011±0,004
|
0,049±0,008
|
0,037±0,004
|
| 6,5
|
0,010±0,003
|
0,015±0,003
|
0,010±0,003
|
0,043±0,010
|
0,034±0,004
|
| 7
|
0,008±0,003
|
0,010±0,003
|
0,003±0,003
|
0,035±0,010
|
0,033±0,004
|
Таблица 2 (продолжение)
| Время,
мин
|
После 3 Введения
|
После 4 Введения
|
После 5 Введения
|
| 2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,340±0,007
|
0,333±0,006
|
0,310±0,006
|
0,324±0,008
|
0,334±0,007
|
0,320±0,005
|
| 1
|
0,340±0,007
|
0,333±0,006
|
0,310±0,006
|
0,324±0,008
|
0,334±0,007
|
0,320±0,005
|
| 1,5
|
0,335±0,006
|
0,330±0,007
|
0,305±0,007
|
0,318±0,008
|
0,325±0,008
|
0,311±0,006
|
| 2
|
0,326±0,006
|
0,323±0,007
|
0,299±0,007
|
0,308±0,009
|
0,316±0,008
|
0,302±0,007
|
| 2,5
|
0,280±0,007
|
0,269±0,007
|
0,278±0,007
|
0,285±0,009
|
0,290±0,009
|
0,283±0,012
|
| 3
|
0,219±0,010
|
0,215±0,008
|
0,227±0,008
|
0,241±0,009
|
0,250±0,009
|
0,237±0,012
|
| 3,5
|
0,117±0,015
|
0,154±0,009
|
0,132±0,008
|
0,164±0,010
|
0,143±0,011
|
0,160±0,012
|
| 4
|
0,076±0,006
|
0,090±0,007
|
0,057±0,007
|
0,089±0,010
|
0,070±0,015
|
0,090±0,015
|
| 4,5
|
0,060±0,006
|
0,065±0,007
|
0,044±0,006
|
0,052±0,010
|
0,050±0,008
|
0,056±0,010
|
| 5
|
0,059±0,006
|
0,055±0,006
|
0,038±0,005
|
0,040±0,010
|
0,044±0,008
|
0,046±0,005
|
| 5,5
|
0,043±0,005
|
0,047±0,004
|
0,032±0,004
|
0,036±0,009
|
0,040±0,005
|
0,042±0,004
|
| 6
|
0,036±0,004
|
0,041±0,004
|
0,028±0,004
|
0,032±0,007
|
0,036±0,005
|
0,035±0,003
|
| 6,5
|
0,034±0,004
|
0,034±0,004
|
0,024±0,004
|
0,029±0,004
|
0,033±0,005
|
0,033±0,003
|
| 7
|
0,023±0,004
|
0,024±0,004
|
0,032±0,005
|
0,029±0,003
|
Таблица 2 (продолжение)
| Время,
мин
|
После окончания
|
| 3 сутки
|
5 сутки
|
7 сутки
|
14 сутки
|
| 1
|
13
|
14
|
15
|
16
|
| 0,5
|
0,338±0,006
|
0,326±0,007
|
0,330±0,006
|
0,330±0,006
|
| 1
|
0,338±0,006
|
0,326±0,007
|
0,330±0,006
|
0,330±0,006
|
| 1,5
|
0,325±0,008
|
0,321±0,008
|
0,320±0,007
|
0,320±0,007
|
| 2
|
0,314±0,009
|
0,313±0,008
|
0,310±0,007
|
0,310±0,008
|
| 2,5
|
0,286±0,009
|
0,300±0,010
|
0,300±0,008
|
0,295±0,008
|
| 3
|
0,245±0,010
|
0,272±0,015
|
0,270±0,010
|
0,272±0,009
|
| 3,5
|
0,176±0,012
|
0,206±0,010
|
0,200±0,015
|
0,200±0,010
|
| 4
|
0,112±0,015
|
0,138±0,009
|
0,130±0,017
|
0,125±0,011
|
| 4,5
|
0,067±0,010
|
0,078±0,007
|
0,070±0,015
|
0,075±0,012
|
| 5
|
0,041±0,006
|
0,056±0,005
|
0,050±0,010
|
0,055±0,010
|
| 5,5
|
0,030±0,005
|
0,042±0,005
|
0,040±0,008
|
0,045±0,009
|
| 6
|
0,027±0,005
|
0,039±0,004
|
0,035±0,007
|
0,037±0,007
|
| 6,5
|
0,022±0,004
|
0,032±0,004
|
0,030±0,006
|
0,036±0,005
|
| 7
|
0,020±0,004
|
0,024±0,004
|
0,020±0,006
|
0,020±0,005
|
Таблица 3
Усредненные величины оптической плотности взвеси эритроцитов, разрушенных гемолитиком на фоне пятикратного введения животным цианоцитозина
| Время,
мин
|
До вве-
дения
|
После 1 Введения
|
После 2 Введения
|
| 2,5 час
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,330±0,005
|
0,330±0,007
|
0,335±0,006
|
0,335±0,008
|
0,335±0,008
|
| 1
|
0,330±0,005
|
0,330±0,007
|
0,335±0,006
|
0,335±0,008
|
0,335±0,008
|
| 1,5
|
0,321±0,006
|
0,329±0,008
|
0,333±0,008
|
0,330±0,010
|
0,330±0,009
|
| 2
|
0,301±0,007
|
0,323±0,009
|
0,320±0,009
|
0,328±0,010
|
0,324±0,010
|
| 2,5
|
0,267±0,007
|
0,307±0,015
|
0,300±0,006
|
0,303±0,010
|
0,312±0,010
|
| 3
|
0,208±0,012
|
0,242±0,017
|
0,250±0,007
|
0,253±0,010
|
0,255±0,010
|
| 3,5
|
0,128±0,011
|
0,144±0,014
|
0,180±0,007
|
0,144±0,011
|
0,194±0,009
|
| 4
|
0,074±0,012
|
0,092±0,008
|
0,098±0,008
|
0,095±0,006
|
0,095±0,009
|
| 4,5
|
0,056±0,015
|
0,081±0,006
|
0,081±0,008
|
0,091±0,009
|
0,090±0,006
|
| 5
|
0,042±0,010
|
0,058±0,005
|
0,057±0,007
|
0,058±0,007
|
0,053±0,007
|
| 5,5
|
0,028±0,005
|
0,046±0,004
|
0,047±0,007
|
0,051±0,007
|
0,050±0,007
|
| 6
|
0,016±0,004
|
0,040±0,003
|
0,041±0,004
|
0,049±0,008
|
0,038±0,005
|
| 6,5
|
0,010±0,003
|
0,035±0,003
|
0,038±0,003
|
0,043±0,010
|
0,033±0,005
|
| 7
|
0,008±0,003
|
0,010±0,003
|
0,010±0,003
|
0,040±0,010
|
0,011±0,001
|
| 7,5
|
Таблица 3 (продолжение)
| Время,
мин
|
После 3 Введения
|
После 4 Введения
|
После 5 Введения
|
| 2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,330±0,007
|
0,335±0,007
|
0,333±0,008
|
0,335±0,008
|
0,335±0,006
|
0,338±0,010
|
| 1
|
0,330±0,007
|
0,335±0,007
|
0,333±0,008
|
0,335±0,008
|
0,335±0,006
|
0,338±0,010
|
| 1,5
|
0,325±0,006
|
0,330±0,007
|
0,333±0,008
|
0,335±0,007
|
0,331±0,007
|
0,332±0,008
|
| 2
|
0,320±0,007
|
0,319±0,010
|
0,317±0,009
|
0,320±0,003
|
0,325±0,008
|
0,327±0,007
|
| 2,5
|
0,306±0,007
|
0,305±0,007
|
0,305±0,010
|
0,310±0,009
|
0,320±0,008
|
0,321±0,004*
|
| 3
|
0,256±0,006*
|
0,285±0,006*
|
0,298±0,010*
|
0,297±0,010*
|
0,305±0,010*
|
0,311±0,008*
|
| 3,5
|
0,195±0,008*
|
0,193±0,004*
|
0,233±0,008*
|
0,243±0,015*
|
0,243±0,009*
|
0,248±0,009*
|
| 4
|
0,122±0,010*
|
0,128±0,004*
|
0,164±0,007**
|
0,170±0,008**
|
0,178±0,006**
|
0,179±0,007**
|
| 4,5
|
0,092±0,013
|
0,094±0,004
|
0,157±0,007**
|
0,165±0,008**
|
0,166±0,005**
|
0,169±0,006**
|
| 5
|
0,058±0,012
|
0,057±0,004
|
0,151±0,006**
|
0,156±0,009**
|
0,156±0,008**
|
0,159±0,006**
|
| 5,5
|
0,053±0,006
|
0,049±0,007
|
0,096±0,008*
|
0,097±0,009*
|
0,100±0,010*
|
0,113±0,005*
|
| 6
|
0,049±0,005
|
0,048±0,009
|
0,076±0,008*
|
0,075±0,009*
|
0,078±0,010*
|
0,079±0,006*
|
| 6,5
|
0,037±0,006
|
0,041±0,010
|
0,052±0,006*
|
0,058±0,010*
|
0,057±0,014*
|
0,058±0,008*
|
| 7
|
0,036±0,006
|
0,040±0,010
|
0,040±0,006*
|
0,045±0,006*
|
0,045±0,015*
|
0,047±0,008*
|
| 7,5
|
0,028±0,006
|
0,030±0,006
|
0,035±0,015
|
0,035±0,008
|
* р<0.05, ** p<0.01 по сравнению с исходными значениями Таблица 3 (продолжение)
| Время,
мин
|
После окончания
|
| 3 сутки
|
5 сутки
|
7 сутки
|
14 сутки
|
| 0,5
|
0,330±0,006
|
0,330±0,005
|
0,334±0,006
|
0,330±0,004
|
| 1
|
0,330±0,006
|
0,330±0,005
|
0,329±0,006
|
0,330±0,004
|
| 1,5
|
0,328±0,004
|
0,320±0,004
|
0,320±0,005
|
0,320±0,004
|
| 2
|
0,320±0,007
|
0,315±0,004
|
0,300±0,004
|
0,300±0,003
|
| 2,5
|
0,304±0,006
|
0,300±0,005
|
0,263±0,003
|
0,270±0,005
|
| 3
|
0,298±0,005
|
0,283±0,008
|
0,323±0,003
|
0,215±0,005
|
| 3,5
|
0,244±0,009*
|
0,208±0,008*
|
0,130±0,003
|
0,130±0,006
|
| 4
|
0,175±0,012*
|
0,153±0,010*
|
0,086±0,004
|
0,075±0,006
|
| 4,5
|
0,165±0,008*
|
0,144±0,008*
|
0,071±0,008
|
0,068±0,005
|
| 5
|
0,140±0,007*
|
0,114±0,007
|
0,068±0,009
|
0,060±0,007
|
| 5,5
|
0,105±0,006
|
0,097±0,006
|
0,049±0,008
|
0,055±0,007
|
| 6
|
0,078±0,006
|
0,050±0,007
|
0,040±0,007
|
0,045±0,008
|
| 6,5
|
0,055±0,005
|
0,048±0,006
|
0,032±0,007
|
0,040±0,010
|
| 7
|
0,040±0,005
|
0,035±0,006
|
0,030±0,007
|
0,030±0,010
|
| 7,5
|
0,027±0,005
|
0,024±0,006
|
0,020±0,005
|
0,022±0,005
|
* р<0.05 по сравнению с исходными значениями
Таблица 4
Усредненные величины оптической плотности взвеси эритроцитов, разрушенных гемолитиком на фоне пятикратного введения животным цитозинтетразола
| Время,
мин
|
До вве-
дения
|
После 1 Введения
|
После 2 Введения
|
| 2,5 час
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,309±0,012
|
0,315±0,012
|
0,312±0,003
|
0,314±0,005
|
0,303±0,003
|
| 1
|
0,309±0,012
|
0,315±0,012
|
0,312±0,003
|
0,314±0,005
|
0,303±0,003
|
| 1,5
|
0,301±0,011
|
0,0314±0,010
|
0,308±0,004
|
0,312±0,005
|
0,293±0,005
|
| 2
|
0,300±0,015
|
0,310±0,011
|
0,307±0,003
|
0,311±0,005
|
0,292±0,005
|
| 2,5
|
0,296±0,017
|
0,299±0,017
|
0,304±0,004
|
0,310±0,005
|
0,291±0,006
|
| 3
|
0,293±0,020
|
0,285±0,017
|
0,302±0,005
|
0,306±0,004
|
0,287±0,006
|
| 3,5
|
0,290±0,020
|
0,273±0,036
|
0,290±0,005
|
0,294±0,007
|
0,281±0,006
|
| 4
|
0,280±0,021
|
0,254±0,021
|
0,256±0,012
|
0,277±0,010
|
0,265±0,006
|
| 4,5
|
0,258±0,025
|
0,213±0,021
|
0,208±0,013
|
0,208±0,023
|
0,225±0,010
|
| 5
|
0,200±0,020
|
0,150±0,021
|
0,120±0,010
|
0,139±0,022
|
0,148±0,016
|
| 5,5
|
0,097±0,013
|
0,086±0,013
|
0,061±0,007
|
0,070±0,018
|
0,072±0,012
|
| 6
|
0,015±0,010
|
0,046±0,010
|
0,045±0,005
|
0,040±0,007
|
0,045±0,007
|
| 6,5
|
0,012±0,010
|
0,024±0,007
|
0,035±0,005
|
0,022±0,004
|
| 7
|
| 7,5
|
Таблица 4 (продолжение)
| Время,
мин
|
После 3 Введения
|
После 4 Введения
|
После 5 Введения
|
| 2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,303±0,003
|
0,316±0,006
|
0,313±0,006
|
0,316±0,005
|
0,303±0,007
|
0,300±0,003
|
| 1
|
0,303±0,003
|
0,316±0,006
|
0,313±0,006
|
0,316±0,005
|
0,303±0,007
|
0,300±0,007
|
| 1,5
|
0,298±0,003
|
0,311±0,007
|
0,308±0,007
|
0,306±0,004
|
0,297±0,008
|
0,296±0,008
|
| 2
|
0,296±0,003
|
0,308±0,007
|
0,306±0,007
|
0,303±0,003
|
0,288±0,006
|
0,288±0,007
|
| 2,5
|
0,293±0,002
|
0,304±0,006
|
0,303±0,007
|
0,299±0,004
|
0,283±0,006
|
0,281±0,006
|
| 3
|
0,288±0,004
|
0,300±0,006
|
0,300±0,007
|
0,292±0,003
|
0,279±0,006
|
0,270±0,006
|
| 3,5
|
0,272±0,005
|
0,292±0,006
|
0,297±0,008
|
0,272±0,005
|
0,269±0,006
|
0,243±0,007
|
| 4
|
0,227±0,011
|
0,267±0,009
|
0,283±0,009
|
0,218±0,008
|
0,218±0,006
|
0,193±0,013
|
| 4,5
|
0,154±0,012
|
0,210±0,011
|
0,227±0,007
|
0,149±0,010
|
0,150±0,010
|
0,120±0,008
|
| 5
|
0,083±0,013
|
0,133±0,010
|
0,143±0,008
|
0,091±0,010
|
0,091±0,008
|
0,068±0,009
|
| 5,5
|
0,045±0,009
|
0,086±0,010
|
0,071±0,009
|
0,052±0,012
|
0,081±0,008
|
0,047±0,011
|
| 6
|
0,029±0,006
|
0,063±0,011
|
0,046±0,006
|
0,036±0,005
|
0,061±0,003
|
0,037±0,007
|
| 6,5
|
0,027±0,005
|
0,051±0,011
|
0,030±0,005
|
0,030±0,003
|
0,055±0,006
|
0,032±0,006
|
| 7
|
0,043±0,011
|
0,027±0,004
|
0,027±0,003
|
0,043±0,004
|
0,030±0,004
|
| 7,5
|
0,040±0,010
|
0,021±0,004
|
0,020±0,003
|
0,035±0,003
|
0,025±0,004
|
Таблица 4 (продолжение)
| Время,
мин
|
После окончания
|
| 3 сутки
|
5 сутки
|
7 сутки
|
14 сутки
|
| 0,5
|
0,309±0,006
|
0,309±0,006
|
0,315±0,005
|
0,333±0,007
|
| 1
|
0,309±0,006
|
0,309±0,006
|
0,315±0,005
|
0,333±0,007
|
| 1,5
|
0,295±0,006
|
0,304±0,007
|
0,303±0,007
|
0,330±0,008
|
| 2
|
0,292±0,006
|
0,296±0,006
|
0,301±0,007
|
0,327±0,010
|
| 2,5
|
0,286±0,006
|
0,286±0,007
|
0,291±0,007
|
0,324±0,011
|
| 3
|
0,269±0,005
|
0,256±0,006
|
0,281±0,007
|
0,320±0,011
|
| 3,5
|
0,252±0,004
|
0,222±0,007
|
0,253±0,008
|
0,293±0,010
|
| 4
|
0,197±0,007
|
0,190±0,010
|
0,201±0,008
|
0,228±0,012
|
| 4,5
|
0,151±0,007
|
0,138±0,010
|
0,115±0,008
|
0,121±0,014
|
| 5
|
0,078±0,011
|
0,079±0,011
|
0,046±0,011
|
0,056±0,011
|
| 5,5
|
0,060±0,011
|
0,060±0,011
|
0,019±0,011
|
0,029±0,010
|
| 6
|
0,048±0,004
|
0,048±0,005
|
0,013±0,005
|
0,019±0,006
|
| 6,5
|
0,036±0,004
|
0,037±0,004
|
0,010±0,003
|
0,013±0,006
|
| 7
|
0,030±0,004
|
0,032±0,004
|
0,009±0,003
|
0,008±0,004
|
| 7,5
|
0,025±0,004
|
0,026±0,004
|
0,007±0,003
|
0,005±0,004
|
Таблица 5
Усредненные величины оптической плотности взвеси эритроцитов, разрушенных гемолитиком на фоне пятикратного введения животным тиминтетразола
| Время,
мин
|
До вве-
дения
|
После 1 Введения
|
После 2 Введения
|
| 2,5 час
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,318±0,005
|
0,320±0,007
|
0,318±0,008
|
0,305±0,008
|
0,308±0,007
|
| 1
|
0,318±0,005
|
0,320±0,007
|
0,318±0,008
|
0,305±0,008
|
0,308±0,007
|
| 1,5
|
0,314±0,006
|
0,313±0,003
|
0,311±0,010
|
0,301±0,009
|
0,300±0,007
|
| 2
|
0,311±0,006
|
0,309±0,005
|
0,305±0,010
|
0,300±0,008
|
0,298±0,010
|
| 2,5
|
0,310±0,007
|
0,305±0,005
|
0,302±0,010
|
0,297±0,008
|
0,295±0,007
|
| 3
|
0,308±0,007
|
0,302±0,005
|
0,296±0,010
|
0,295±0,008
|
0,282±0,006
|
| 3,5
|
0,303±0,010
|
0,296±0,005
|
0,283±0,011
|
0,285±0,008
|
0,245±0,004
|
| 4
|
0,293±0,011
|
0,275±0,008
|
0,250±0,006
|
0,248±0,014
|
0,173±0,007
|
| 4,5
|
0,360±0,012
|
0,219±0,012
|
0,149±0,009
|
0,175±0,015
|
0,094±0,012
|
| 5
|
0,177±0,015
|
0,140±0,006
|
0,055±0,007
|
0,095±0,012
|
0,061±0,011
|
| 5,5
|
0,064±0,009
|
0,073±0,009
|
0,030±0,005
|
0,054±0,004
|
0,052±0,010
|
| 6
|
0,019±0,005
|
0,047±0,004
|
0,023±0,002
|
0,044±0,007
|
0,043±0,007
|
| 6,5
|
0,012±0,004
|
0,032±0,004
|
0,035±0,007
|
| 7
|
0,011±0,002
|
| 7,5
|
Таблица 5 (продолжение)
| Время,
мин
|
После 3 Введения
|
После 4 Введения
|
После 5 Введения
|
| 2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
2,5 ч
|
24 ч
|
| 0,5
|
0,318±0,011
|
0,302±0,007
|
0,310±0,009
|
0,315±0,008
|
0,325±0,008
|
0,320±0,007
|
| 1
|
0,318±0,011
|
0,302±0,007
|
0,310±0,009
|
0,315±0,008
|
0,325±0,008
|
0,320±0,007
|
| 1,5
|
0,312±0,012
|
0,292±0,006
|
0,308±0,010
|
0,306±0,010
|
0,318±0,008
|
0,305±0,005
|
| 2
|
0,310±0,012
|
0,288±0,007
|
0,305±0,010
|
0,302±0,009
|
0,315±0,003
|
0,303±0,006
|
| 2,5
|
0,305±0,012
|
0,286±0,007
|
0,300±0,009
|
0,293±0,010
|
0,312±0,007
|
0,299±0,008
|
| 3
|
0,293±0,008
|
0,274±0,006
|
0,297±0,009
|
0,282±0,009
|
0,302±0,008
|
0,294±0,009
|
| 3,5
|
0,256±0,011
|
0,272±0,008
|
0,288±0,009
|
0,245±0,013
|
0,282±0,006
|
0,284±0,007
|
| 4
|
0,166±0,010
|
0,229±0,010
|
0,249±0,011
|
0,172±0,013
|
0,235±0,010
|
0,256±0,008
|
| 4,5
|
0,062±0,010
|
0,111±0,013
|
0,171±0,012
|
0,099±0,011
|
0,143±0,008
|
0,200±0,009
|
| 5
|
0,042±0,008
|
0,098±0,012
|
0,082±0,009
|
0,053±0,010
|
0,054±0,008
|
0,122±0,008
|
| 5,5
|
0,029±0,004
|
0,058±0,003
|
0,037±0,004
|
0,026±0,006
|
0,023±0,006
|
0,063±0,004
|
| 6
|
0,024±0,004
|
0,040±0,005
|
0,026±0,002
|
0,018±0,005
|
0,020±0,002
|
0,030±0,003
|
| 6,5
|
0,020±0,005
|
0,035±0,005
|
0,020±0,002
|
0,015±0,005
|
0,015±0,002
|
0,025±0,003
|
| 7
|
0,021±0,004
|
0,015±0,002
|
0,012±0,005
|
0,012±0,002
|
0,020±0,003
|
| 7,5
|
0,015±0,003
|
0,011±0,002
|
0,011±0,005
|
0,010±0,002
|
0,012±0,003
|
Таблица 5 (продолжение)
| Время,
мин
|
После окончания
|
| 3 сутки
|
5 сутки
|
7 сутки
|
14 сутки
|
| 0,5
|
0,320±0,010
|
0,313±0,009
|
0,335±0,029
|
0,330±0,020
|
| 1
|
0,320±0,010
|
0,313±0,009
|
0,335±0,029
|
0,330±0,020
|
| 1,5
|
0,305±0,011
|
0,303±0,010
|
0,330±0,015
|
0,329±0,022
|
| 2
|
0,265±0,041
|
0,293±0,009
|
0,325±0,021
|
0,325±0,021
|
| 2,5
|
0,257±0,010
|
0,288±0,006
|
0,313±0,016
|
0,320±0,016
|
| 3
|
0,240±0,007
|
0,283±0,006
|
0,300±0,013
|
0,306±0,015
|
| 3,5
|
0,211±0,008
|
0,243±0,010
|
0,262±0,013
|
0,287±0,12
|
| 4
|
0,154±0,010
|
0,183±0,011
|
0,201±0,014
|
0,198±0,010
|
| 4,5
|
0,105±0,012
|
0,133±0,012
|
0,118±0,012
|
0,129±0,008
|
| 5
|
0,043±0,024
|
0,048±0,010
|
0,063±0,008
|
0,098±0,033
|
| 5,5
|
0,026±0,005
|
0,039±0,005
|
0,043±0,021
|
0,068±0,042
|
| 6
|
0,016±0,004
|
0,027±0,004
|
0,031±0,020
|
0,058±0,030
|
| 6,5
|
0,015±0,005
|
0,018±0,003
|
0,025±0,020
|
0,052±0,020
|
| 7
|
0,012±0,005
|
0,016±0,003
|
0,021±0,010
|
0,048±0,010
|
| 7,5
|
0,010±0,004
|
0,014±0,003
|
0,014±0,010
|
0,045±0,010
|
|