|
Характеристика молекулярных зондов
Молекулярные зонды - это короткие фрагменты ДНК, подходящие определённому организму (бактериям Nitrospira в данном случае), которые посредством определенных лабораторных методов могут использоваться, чтобы указать не только присутствие или отсутствие этого организма, но также и его относительные количества. Этим способом можно сравнить количество на одном биофильтре или субстрате с количеством на другом.
Актуальность темы определяется важностью разработки методов: исследования структуры жидкостей с помощью метода молекулярного зонда. Использование молекулярных зондов имеет большое распространение в спектральных методах (сольватохромные индикаторы) и при исследовании структуры материалов. Вместе с тем, актуальной является задача разработки теоретических основ метода молекулярного зондирования на базе исследования энергетических - энтальпийных характеристик сольватации. В качестве молекулярных зондов, как правило, используются молекулы, обладающие высокой симметрией и химической инертностью; альтернативно, могут использоваться образцовые молекулы – доноры или акцепторы электронов – для разработки шкал полярности растворителей или сравнения реакционной способности веществ.
Показано, что свойства молекулярного зонда являются важными при изучении энергетики взаимодействия в растворах в связи с возможными специфическими взаимодействиями.
МОЛЕКУЛЯРНЫЕ МЕТОДЫ (ГИБРИДИЗАЦИЯ С ДНК-ЗОНДАМИ) ДЛЯ УСКОРЕННОГО СКРИНИНГА ПАЦИЕНТОВ С ПОВЫШЕННЫМ РИСКОМ РАЗВИТИЯ МУЛЬТИРЕЗИСТЕНТНОГО ТУБЕРКУЛЕЗА
Основные предпосылки
Туберкулез с множественной лекарственной устойчивостью (МЛУ ТБ) представляет собой серьезную проблему для здравоохранения в связи со сложностью его диагностики и лечения. Согласно оценкам ВОЗ, заболеваемость МЛУ ТБ составляет около 490 000 случае в год по всему миру, что составляет около 5% всех случаев туберкулеза. Проблема, однако, состоит в том, что вследствие различных проблем в лабораторной диагностике, в настоящее время, диагностируются лишь менее 5% случаев МЛУ ТБ. Значительный рост распространенности МЛУ ТБ и возникновение сверх устойчивых штаммов микобактерий (XDR TB), риск распространения устойчивых штаммов среди пациентов лечебных учреждений, а также очень высокие уровни смертности среди пациентов, инфицированных одновременно ВИЧ и МЛУ ТБ (либо XDR-TB) привели к необходимости скорейшей разработки и внедрения методов ускоренного скрининга лекарственной устойчивости (ЛУ).
Реклама

Существуют тесты на лекарственную чувствительность (ТЛЧ), основанные на применении бактериологических методов, включают в себя процедуры выделения культур микобактерий из клинического материала, их идентификации с последующей диагностикой лекарственной чувствительности in vitro, что является весьма сложным и длительным процессом. Длительность лабораторных исследований ведет к назначению неадекватной терапии и, как следствие, развитию лекарственной устойчивости и продолжению распространения ЛУ штаммов микобактерий. В настоящее время идет активная разработка новых ускоренных молекулярно-генетических методов диагностики ЛУ. Среди последних, наиболее эффективными признаны методы, основанные на гибридизации с ДНК-зондами (MLPA).
Технология MLPA включает следующие этапы:
- ВыделениеДНК из культур M.tuberculosis либо непосредственно клинического материала;
- Полимеразная цепная реакция (ПЦР) с применением праймеров, меченых биотином, для амплификации фрагментов генов, ассоциированных с лекарственной устойчивостью;
- Гибридизация биотин-меченых ПЦР-продуктов с ДНК-зондами, иммобилизированными на мембранах (полосках, изголовленных их нейлона либо аналогичных материалов).
- визуализация результатов гибридизации, при этом детектируется наличие микобактерий комплекса M.tuberculosis, а также наличие либо отсутствия мутаций в исследуемых генах. Учет результатов производится по наличие либо отсутствию цветных полосок на мембранах, соответствующих зондам дикого типа либо мутантным.
В состав ДНК-зондов включены зонды «дикого типа» (без мутаций), а также зонды для детекции наиболее часто встречающихся мутаций. Если в исследуемых фрагментах генов присутствует мутация, то «мутантный» ПЦР-продукт не свяжется с зондом «дикого типа», присутствующим на мембране. Таким образом, детекция мутаций производится по отсутствию сигнала одного или нескольких зондов дикого типа, а также, дополнительно, по присутствию сигнала от одного или нескольких «мутантных» зондов.
Приоритетные направления дальнейших исследований
Среди приоритетных направлений научно-исследовательской работы по изучению эффективности MLPA тест-систем можно выделить нижеследующие. При этом следует отметить, что дальнейшие исследования необходимо проводить одновременно со скорейшим внедрением указанных систем.
Реклама

- оценка эффективности использования тест-систем в скрининговых и даигнотстических программах в регионах с различными эпидемиологическими показателями;
- оценка экономической эффективности и экономии средств при внедрении систем MLPA в различных программах по борьбе с ТБ;
- эффективность применения систем MLPA в сочетании с бактериологическими методами при проведении даигностики у больных с отрицательным мазком;
- влияние процедур инактивации и дезинфекции мокроты на чувствительность тест-систем MLPA;
- разработка и оптимизация методов выделения ДНК, особенно при исследовании образцов мокроты с низкой концентрацией кислотоустойчивых бактерий;
Молекулярный зонд и спектроскопия позволяют более детально отследить изменения химических связей в белковых молекулах
| 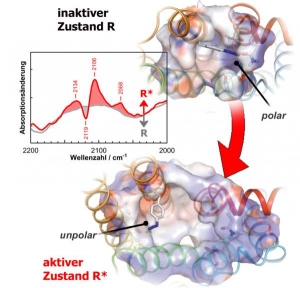
Спектр «азидозонда» (выделен на рисунке синим цветом) позволяет биофизикам детально проанализировать изменения, протекающие во время отдельных стадий активации рецепторов. (кликните картинку для увеличения)
|
|
Белки – это молекулярные машины, которые жизненно необходимы клеткам нашего организма. Для того, чтобы понять, как эти молекулярные машины функционируют, необходимо отслеживать изменения, которые они обеспечивают. Это можно осуществить с помощью инфракрасной спектроскопии, в частности с помощью спектроскопии Фурье. Её использование позволяет измерить колебания отдельных химических связей белковой молекулы и изменения, которые могут происходить с ними во время работы данной молекулы. Однако инфракрасный Фурье-спектр обычного белка включает в себя несколько тысяч колебаний, которые оказывают влияние друг на друга. Поэтому с помощью Фурье-спектроскопии очень сложно выявить колебания, которые имеют непосредственное отношение к изменениям, происходящим в молекулах белков во время их работы.
Международной группе учёных, в состав которой вошли Райнер Вогель и Екатерина Зайцева (Reiner Vogel & Ekaterina Zaitseva, биофизики института молекулярной медицины и клеточной биологии при университете Фрайбурга), Шиксинь Йе и Томас Сакмар (Shixin Ye and Thomas P. Sakmar, биофизики из Нью-Йорка) и Ксавье Дюпи (Xavier Deupi, биофизик из Барселоны), удалось ввести молекулярный зонд в белковую молекулу. С помощью спектроскопии и данного зонда исследователи смогли отследить изменения, которые произошли с данной молекулой. Поскольку белки нашего организма по своей химической природе - это совокупности аминокислот, то группа учёных решила использовать в качестве зонда п-азидо-фенилаланин. Учёные проверили эффективность работы зонда, использовав родопсин (мембранный белок светочувствительных клеток сетчатки глаза).
После того, как родопсин поглощает квант света, он проходит серию превращений, образуя промежуточные формы, так называемые интермедиаты (продукты превращения родопсина, вызванные поглощением кванта света). По окончании серии превращений родопсина происходит активация последующих элементов цепи передачи сигнала, вызванного поглощением кванта света. Использование п-азидо-фенилаланина позволило учёным более детально (чем когда-либо ранее) изучить интермедиаты, образующиеся в ходе ряда превращений молекулы родопсина. По мнению авторов исследований, полученные ими результаты способны внести серьёзный вклад в изучение процессов активации различных рецепторов.
|