Міністерство освіти та науки України
Запорізька Державна Інженерна Академія
Сокольник В.I.
Романець О.В.
Водовідводні системи промислових підприємств
Методичні вказівки до лабораторних робіт для студентів ЗДІА спеціальності 7.092601 “Водопостачання і водовідведення” денного та заочного відділення
Запоріжжя, ЗДІА
2004
Міністерство освіти та науки України
Запорізька Державна Інженерна Академія
Водовідводні системи промислових підприємств
Методичні вказівки до лабораторних робіт для студентів ЗДІА спеціальності 7.092601 “Водопостачання і водовідведення” денного та заочного відділення
Рекомендовано до видання на засіданні кафедри ВВ,
протокол №__ від ________2004р
Запоріжжя, ЗДІА
2004
Водоводні системи промислових підприємств. Методичні вказівки до лабораторних робіт для студентів спеціальності 7.092601 “Водопостачання і водовідведення” денного та заочного відділення / Укладачі Сокольник В.І., Романець О.В. – Запоріжжя, ЗДІА, 2004. – с.
Укладачі – В.І. Сокольник, к. т. н., доцент
О.В. Романець, асистент
Відповідальний за випуск – В.І. Сокольник, к.т. н., доцент,
зав. каф. ВВ.
Зміст
Вступ
1. Лабораторна робота №1. Очищення стічних вод від катіонів важких металів переводом їх в важкорозчинні сполуки
2. Лабораторна робота №2. Електрохімічне очищення промислових стічних вод від йонів міді
3. Лабораторна робота №3. Визначення оптимальної дози коагулянту при очищенні промислових стічних вод
4. Лабораторна робота №4. Вибір розчинника для рідинної екстракції із води
5. Лабораторна робота №5. Визначення сорбційної ємності катіонітів при очищення стічних вод йонообмінним методом
Література
ВСТУП
Трасування, будівництво та експлуатацію систем водовідведення промислових об’єктів повинні очолювати висококваліфіковані спеціалісти. В інженерній підготовці студентів по спеціальності „Водопостачання і водовідведення” курс „Водовідводні системи промислових підприємств” має дуже важливе значення. Ефективність засвоєння цієї учбової дисципліни в значній мірі залежить від змісту і постановки лабораторного практикуму.
Лабораторія, обладнана діючими експериментальними установками (моделями) та комплексною приладоаналітичною базою, допомагає студентам практично вивчити зміст технологічних процесів, а також визначити чинники, які впливають на ці процеси.
Лабораторна робота №1
Очищення стічних вод від катіонів важких металів переводом їх в важкорозчинні сполуки
1.1 Мета роботи
Ознайомитися з методом очищення стічних вод від йонів важких металів переводом їх в важкорозчинні сполуки.
1.2 Загальні положення
В промислових стічних водах можуть знаходитись йони металів. В залежності від того, які йони і яка їх концентрація, стоки можна розглядати як забруднену воду або як джерело цінних речовин.
Реклама

Для видалення таких речовин використовують реакції осадження, в результаті яких розчинна речовина перетворюється в нерозчинну або малорозчинну. Осад, який утворюється, легко видаляється.
В якості реагентів-осаджувачів використовують різноманітні речовини. Але зміст методу завжди залишається постійним і заключається в тому, що в результаті хімічної реакції утворюється осад. Про розчинність осаду судять по значенню добутку розчинності. На величину добутку розчинності впливають такі чинники, як: рН-середовища та концентрація іонів осаджувача.
В лабораторних умовах найбільш зручним методом, для встановлення необхідної дози реагента-осаджувача, є пробне осадження [2]. При такому осадженні, процес переходу катіонів металу в малорозчинну сполуку проходить в відповідності з потенціометричною криво. (рис. 1.1)

Рисунок 1.1 - S-подібна потенціометрична крива осадження катіонів металів із стічних вод
Згідно з рис. 1.1. зона А відповідає процесу нейтралізації вільної кислоти або лугу при введенні іонів реагента-осаджувача до початку реакції осадження.
Зона В (рис. 1.1.) відповідає процесу переходу йонів металу в малорозчинну сполуку;
а-b – кількість реагенту витраченого на реакцію осадження.
Зона С (рис. 1.1.) відповідає надлишку реагента-осаджувача, а відрізок b-c – надлишок реагента-осаджувача.
Методи осадження застосовують в основному для очищення промислових стоків, які забруднені катіонами металів (Ni2+
, Cu2+
, Co3+
, Fe3+
, Hg2+
і т.д.), рідше аніонами (поширена лише обробка фосфатів).
Недоліком методу осадження, як і всіх хімічних методів, є поява в розчинах великої кількості йонів Na+
, K+
, Ca2+
.
Оптимальну дозу хімічного реагенту, необхідного для повного осадження йонів-забруднювачів визначають експериментально: пробним коагулюванням або методом потенціометричного титрування.
1.3. Реактиви, посуд та прилади
1. 0,1н розчин NaOH.
2. Розчин Na2
CO3
.
3. Розчин, який імітує стічну воду і містить іони Cu2+
(або Ni2+
).
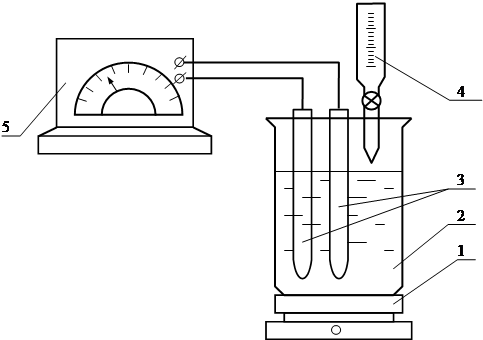
Рисунок 1.2 - Схема лабораторної установки для визначення оптимальної дози реагента-осаджувача
4. Хімічні стакани – 2 шт.
5. Лабораторна установка (рис. 1.2)
1 – магнітна мішалка;
2 – стакан;
3 – електроди потенціометра;
4 – бюретка;
5 – потенціометр (рН-метр).
1.4 Методика експерименту та обробка даних
В скляний стакан ємністю 100мл наливають 50 мл стічної води, яка містить йони міді (або йони нікелю).
В бюретку №1 до нульової позначки наливають розчин реактива-осаджувача – 0,1н розчин NaOH.
Реклама

Визначають рН вихідної стічної води. Потім в стічну воду добавляють 1-2 мл титрувального розчину. Записують значення потенціометра. Для побудови кривої осадження необхідно виконати: подальші титрування і заміри на потенціометрі (від 10 до 20). Результати експерименту заносять до табл. 1.1.
Таблиця 1.1 - Титрування 0,1н розчином NaOH
| Номер точки |
1 |
2 |
3 |
4 |
.... |
17 |
18 |
19 |
20 |
| Об’єм розчину, який витрачено на титрування, мл |
| Значення потенціометра, мВ |
Аналогічно проводять експеримент з реактивом-осаджувачем – розчином Na2
CO3
.
Результати експерименту заносять до табл.1.2, яка за структурою аналогічна табл.1.1.
По даним табл.1.1 та 1.2 будують графіки на міліметровій бумазі, які аналогічні графіку зображеному на рис.1.1. Визначають оптимальні дози реагентів-осаджувачів (NaOH та Na2
CO3
), виконують аналіз по ефективності того чи іншого осаджувача. Записують висновок.
1.5 Зміст звіту
В звіті зазначаються: назва та мета лабораторної роботи; схема лабораторної установки, описується методика експерименту та наводяться результати у вигляді таблиць та графіків. В кінці роботи пишеться висновок.
1.6 Контрольні запитання
1. Зміст методу хімічного осадження (з наведенням хімічних реакцій).
2. Чинники, які впливають на процес осадження йонів важких металів із стічних вод.
3. Обґрунтуйте S-подібну криву потенціометричного титрування, яку отримали при хімічному осадженні.
4. Яким реактивом-осаджувачем краще осаджуються йони міді.
5. Переваги та недоліки методу хімічного осадження.
Лабораторна робота №2
Електрохімічне очищення промислових стічних водвід іонів міді
2.1 Мета роботи
Ознайомитися з електрохімічним методом очищення стічних вод від йонів важких металів.
2.2 Загальні положення
При проходженні струму через межу електрод-електроліт виникає перехід від електронної проникності (металевий провідник) до йонної (електроліти). В зв’язку з цим на межі електрод-електроліт проходить електрохімічна реакція.
Існує зв’язок між кількістю пропущеної через систему електроенергії та кількістю речовини, яка зазнала хімічних перетворень в міжфазовому просторі. Такий зв’язок був знайдений та описаний Фарадеєм у вигляді двох законів.
Перший закон Фарадея: кількість проредагованої на електродах речовини пропорційна силі струму (І), яка пройшла через систему, та часу проходження (Т).
Другий закон Фарадея: при електрохімічному розщепленні різних електролітів однією тією ж кількістю електрики, кількість отриманих на електродах продуктів пропорційна їх хімічним еквівалентом, тобто:
 , (2.1) , (2.1)
де qТ
– теоретична кількість виділеного на катоді металу, г;
І – сила струму, А;
Z – хімічний еквівалент металу (атомна вага поділена на валентність йонів даного металу, Z=A/n);
F – число Фарадея, F=96500 Кл.
Кількість речовини (в грамах), яку отримали при проходженні одиниці електрики, називають електрохімічним еквівалентом. На практиці електрохімічний еквівалент відносять не до сталої Фарадея, а до 1А·год. Оскільки F=96500 Кл =26,8 А·год, то електрохімічний еквівалент (m) зв’язаний з хімічним наступним співвідношенням:
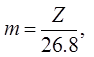 (2.2) (2.2)
Електрохімічний еквівалент міді m=1,185.
Кількість металу, яка виділилась на катоді, згідно за законом Фарадея, визначається за формулою:
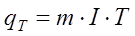 . (2.3) . (2.3)
При електролізі розчину міді:
на катоді в електролізері проходять слідуючи процеси:
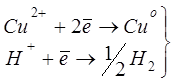 процес проходить з виділенням водню; процес проходить з виділенням водню;
інколи 2Н+
+SO4
2-
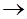 H2
SO4
– проведення процесу без виділення водню; H2
SO4
– проведення процесу без виділення водню;
на аноді: 4OH- ‑ 4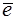 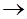 O2 O2 +H2
O +H2
O
В реальних умовах при електролізі проходять побічні електрохімічні та другорядні хімічні реакції, які зменшують вихід за струмом (Вт). Величина Вт вказує наскільки правильно організовано процес електролізу і розраховується за формулою (%):
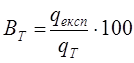 , (2.4) , (2.4)
де qексп
– кількість грамів металу, яка виділилась на катоді при проведенні досліду, г;
qТ
– кількість грамів металу, яка повинна була виділитися на катоді згідно з законом Фарадея, г.
2.3 Реактиви, посуд та прилади
1. Стічна вода, яка містить 250 г/л CuSO4
·5H2
O та 64г/л H2
SO4
.
2. Стічна вода, яка містить 100 г/л CuSO4
·5H2
O та 64 г/л H2
SO4
.
3. Аналітичні терези.
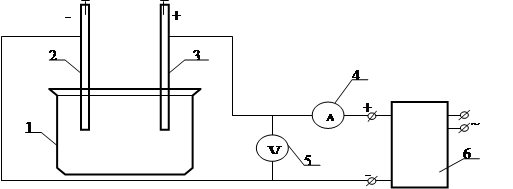
Рисунок 2.1 – Схема лабораторної установки для катодного осадження металу
4. Лабораторна установка (рис. 2.1)
1 – електролізер;
2 – мідний катод;
3 – свинцевий анод;
4 – амперметр;
5 – вольтметр;
6 – джерело струму.
2.4 Методика експерименту та обробка даних
Катод перед початком експерименту зачищають наждачним папером, знежирюють в содовому розчині та промивають водою. Потім висушують і зважують на аналітичних терезах.
Величину струму розраховують виходячи з прийнятої густини струму та розмірів катода за формулою:
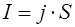 , (2.5) , (2.5)
де j – густина струму, приймається j=5 А/дм2
;
S – площа катода, дм2
.
Перевіривши правильність зібраної схеми лабораторної установки, електроди занурюють в електроліт і пропускають через систему електричний струм. На протязі всього експерименту (приблизно 1год) струм підтримують постійним і визначають напругу в електролізері.
По закінченню електролізу катод обережно промивають водою, залишки води видаляють за допомогою фільтрувального паперу. Катод висушують і зважують на аналітичних терезах.
Потім розраховують вихід за струмом (формула 2.4).
Витрату електроенергії на одиницю видаленого металу (Wпит
) визначають за формулою:
Wпит
= U·105
/(m·Вт), кВт·год/т, (2.6)
де U – напруга на клемах електролізера, В.
Експерименти проводять із стічними водами, які містять: в першому випадку 250 г/л CuSO4
·5H2
O та 64г/л H2
SO4
; в другому випадку 100г/л CuSO4
·5H2
O та 64г/л H2
SO4
.
Результати експериментів заносять до таблиці 2.1.
Таблиця 2.1 - Результати експериментів при катодному осадженню міді
| Хімічний склад електроліту |
Концентра-ція компо-нентів Co, г/л |
Площа катода S, дм2
|
Густина струму j, А/дм2
|
Величина сили струму J, А |
Напруга U, В |
Вага катода |
Вихід за струмомВт, % |
Витрата електро-енергії Wпит
, кВт·год/m |
| початкова, г |
кінцева, г |
CuSO4
·5H2
O
H2
SO4
|
250
64
|
CuSO4
·5H2
O
H2
SO4
|
250
64
|
2.5 Зміст звіту
В звіті зазначаються: назва та мета лабораторної роботи; наводиться схема лабораторної установки; описується методика експерименту та наводяться результати розрахунків у вигляді табл. 2.1.
В кінці роботи пишеться висновок.
2.6 Контрольні запитання
1. Сформулювати закони Фарадея. Фізичний зміст сталої Фарадея.
2. Хімічний та електрохімічний потенціали металів.
3. Які основні хімічні процеси проходять на катоді та аноді в електролізері.
4. Як визначається вихід за струмом.
Лабораторна робота №3
Визначення оптимальної дози коагуляНту при очищенні промислових стічних вод
3.1. Мета роботи
Вивчити методику пробної коагуляції та визначити оптимальні дози коагулянту без підлужування та за підлужуванням води.
3.2 Загальні положення
Для очищення промислових стічних вод, які містять забруднення у вигляді тонкодисперсних домішок та колоїдів, застосовують метод коагуляції. В якості коагулянтів використовують: сульфат алюмінію Al2
(SO4
)3
, оксохлорид алюмінію Aln
(OH)m
Cl, хлорид заліза FeCl3
, сульфат двохвалентного заліза FeSO4
, сульфат трьохвалентного заліза Fe2
(SO4
)3
. Особливістю цих солей є здатність утворювати в результаті гідролізу малорозчинні сполуки:
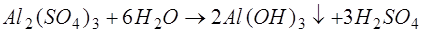 ; ;
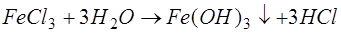 ; ;
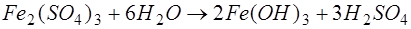 ; ;
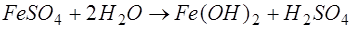 . .
Гідроокис двовалентного заліза має значну розчинність, тому його переводять в тривалентну форму, використовуючи окислювачі, наприклад кисень повітря, хлор, озон та інші:
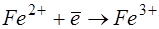 ; ;
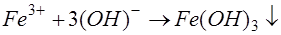
В процесі гідролізу утворюються сірчана або соляна кислоти, які треба нейтралізувати вапном або іншими лугами. Нейтралізація кислот може проходити за рахунок лужного резерву стічної води:
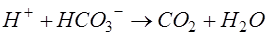 . .
На ефективність дії коагулянтів впливає багато чинників (факторів), таких як: склад та якість забрудненої стічної води, температура, рН води, умови введення та перемішування реагуючих речовин, доза та склад коагулянту.
Для максимального видалення забруднень процес коагуляції необхідно здійснювати в діапазоні оптимальних величин рН. При відсутності цих даних можна приймати, що найбільший ефект очищення стічних вод при використанні в якості коагулянту сульфату алюмінію досягається в інтервалі значень рН середовища від 6.5 до 8; при використанні хлориду заліза – в інтервалі значень від 7 до 8,5; при використанні сульфату двовалентного заліза від 9 до 9,5.
Оптимальну дозу коагулянту визначають експериментально, пробним коагулюванням для кожного конкретного складу стічних вод при суворо визначених умовах проведення експерименту.
3.3 Реактиви, посуд та прилади
1. рН-метр.
2. Циліндри по 500 мл – 5 штук.
3. Бюретка, колби по 250 мл для титрування, хімічні стакани.
4. 0,1н разчин НСl.
5. Метилоранж – індикатор.
6. Гідроокис кальцію, 0,1%-й розчин: 1г попередньо прокаленого окису кальцію СаО при 900о
С на протязі 5 годин розтирають в ступці і змивають киплячою дистильованою водою в мірну колбу ємністю 1000мл. Після того як рідина охолола розчин доводять до 1л дистильованою водою.
7. Сульфат алюмінію, 1%-й розчин: навіс 19,5г Al2
(SO4
)3
·18H2
O, що відповідає 10г безводного сульфату алюмінію Al2
(SO4
)3
, насипають в мірну колбу, розчиняють при нагріванні в 300-500 мл дистильованої води, охолоджують і доводять до 1л дистильованою водою.
8. Сульфат заліза, 1%-й розчин: навіс 18,6г FeSO4
·7H2
O, що відповідає 10г безводному сульфату заліза FeSO4
, насипають в мірну колбу ємністю 1000мл, розчиняють в 300-500 мл дистильованої воді; якщо розчин мутний, то добавляють до нього (краплинами) соляну кислоту (концентровану) до отримання прозорого розчину, потім розчин доводять до 1л дистильованою водою.
9. Хлорид заліза, 1%-й розчин: навіс 16,7г FeCl3
·6H2
O, що відповідає 10г безводного хлориду заліза FeCl3
, насипають в мірну колбу ємністю 1000мл і розчиняють дистильованою водою так, як сульфат заліза.
3.4 Методика експерименту та обробка даних
Дослідження складаються з двох частин: першої – визначення оптимальної дози коагулянту без підлужування, та другої – визначення оптимальної дози коагулянту з підлужуванням.
3.4.1 Визначення оптимальної дози коагулянту без підлужування
В досліджуваній воді визначають концентрацію завислих речовин (гравіметричним або електрометричним методами); рН; лужність. В п’ять циліндрів ємністю 500 мл відбирають досліджувану стічну воду. В кожний циліндр піпеткою добавляють 1% розчин Al2
(SO4)3
в кількостях указаних в таблиці 3.1.
Таблиця 3.1
| Показник |
Номер циліндра |
| 1 |
2 |
3 |
4 |
5 |
| Доза коагулянту, мг/л |
140 |
160 |
180 |
200 |
240 |
| Кількість 1% розчину коагулянту, який додають в циліндри, мг |
7 |
8 |
9 |
10 |
12 |
Вмістиме всіх циліндрів перемішують скляною паличкою від 20 до 30 с, потім повільніше 1-2 хвилини. Після цього циліндри залишають в спокої на 30-40 хв і спостерігають за утворенням та осіданням пластівців. Відмічають час початку утворення пластівців, початку осідання і час кінця осідання. Після закінчення осідання пластівців заміряють висоту утвореного осаду в 5-х циліндрах (за допомогою звичайної лінійки). Відбирають проби по 100 мл за усіх 5-ти циліндрів з освітленою водою і визначають лужність, рН. А в 3-х останніх циліндрах визначають кількість завислих речовин (гравіметричним методом або на ФЕК).
Результати дослідів заносять до табл. 3.2.
3.4.2 Визначення оптимальної дози коагулянту з підлужуванням
В циліндри зі стічною водою вводять дози коагулянту, що і в попередньому випадку та 20, 30, 40, 50, 60 мл 0,1% розчину окису кальцію, що відповідає дозам СаО рівним 40, 60, 80, 100, 120 мг/л. Подальше проведення роботи і обробка даних аналогічні проведенню роботи без підлужування (п.3.4.1). Результати експерименту заносяться до табл. 3.2
Таблиця 3.2 - Результати визначення показників якості очищення дослідної води
| Номер циліндру |
Показник якості вихідної води |
Доза коагулянту Дк
, мг/л |
Доза вапна, Дв
мг/л |
Висота осаду в циліндрах, мм |
Час, хв. |
Показники якості води після експерименту |
Оптимальна доза коагулянта До
, мг/л |
| Кількість завислих речовин, мг/л |
Лужність, мг-екв/л |
рН |
Введення коагулянту, Т1
|
Повного осідання Т2
|
Кількість завислих речовин |
Лужність, мг-екв/л |
рН |
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
| Без підлужування |
1
2
3
4
5
|
| З підлужуванням |
1
2
3
4
5
|
3.4.3 Хід визначення лужності води
В конічну колбу ємністю 250 мл відбираються 100 мл досліджуваної води, додають 2-3 краплі розчину метилоранжу (досліджувана вода забарвиться в жовто-оранжевий колір). Далі цю воду титрують 0,1н розчином НСl. Титрування продовжують до зміни забарвлення із жовто оранжевого кольору на рожевий. Записують об’єм 0,1н розчину НСl витраченого на титрування.
Лужність води розраховують за формулою:
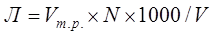 , мг-екв/л; (3.1) , мг-екв/л; (3.1)
де Vm.p.
– загальний об’єм розчину соляної кислоти, витрачений на титрування 100 мл води, яку досліджують, мл;
V – об’єм води, яку досліджують, V=100 мл;
N – нормальність розчину соляної кислоти (N=0,1).
3.5 Зміст звіту
В звіті зазначаються: назва та мета лабораторної роботи; схема лабораторної установки, описується методика експерименту та наводяться результати у вигляді таблиць та графіків. В кінці роботи пишеться висновок.
3.6. Контрольні запитання.
1. Зміст методу пробної коагуляції.
2. Які чинники впливають на ефективність дії коагулянтів.
3. Написати реакції гідролізу найпоширеніших коагулянтів.
4. Назвати інтервали рН середовища при яких спостерігається найбільший ефект очищення стічних вод.
Лабораторна робота №4
Вибір розчинника для рідинної екстракції із води
4.1 Мета роботи
Ознайомитися з методикою та критеріями вибору екстрагенту для видалення органічних забруднень із стічних вод методом екстракції.
4.2 Загальні положення
Органічні речовини, розчинені та завислі в стічних водах, розчиняються в деяких органічних розчинниках набагато краще, ніж у воді. Це дає змогу видалити їх з води методом рідинної екстаракції. Процес екстракції заключається в зміщуванні стічної води з екстрагентом і наступним їх розділенням. При цьому органічні речовини розподіляються між екстрагентом і водою , досягається динамічна рівновага їх концентрацій в цих фазах. Ці фази характеризуються коефіцієнтом розподілу:
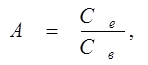 (4.1) (4.1)
де Сe
- рівноважна концентрація речовини в органічній фазі (екстракті);
Св
- рівноважна концентрація цієї ж речовини в водній фазі (рафінаті).
Коефіцієнт розподілу А - це величина, по якій можна судити про екстрагуючу здатність розчинника для екстракції враховують його вартість, токсикологічні характеристики, повноту і швидкість розподілу фаз та інші чинники.
4.3 Реактиви, посуд та прилади
1. Бензол.
2. Н-бутилат.
3. Диізопропіловий ефір.
4. Стічна вода, з концентрацією фенола ~ 3 г/л.
5. Лабораторна установка (рис.4.1)
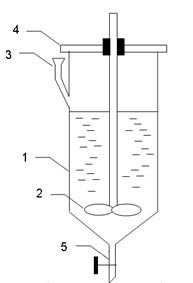
Рисунок 4.1 - Схема лабораторної установки для екстракції.
1 - екстрактор;
2 - перемішувач;
3 - лійка;
4 - кришка;
5 - зливний патрубок.
4.4 Методика експерименту та обробка даних
Коефіцієнт розподілу визначається для трьох розчинників: бензолу, Н-бутилацетату та диізопропілового ефіру. Досліди проводяться з кожним з цих розчинників в нижченаведеній послідовності.
В екстрактор, приблизно на третину його об'єму, заливають стічну воду, яка містить ~3 г/л фенолу (визначається аналізом). Потім в екстрактор заливають такий же об'єм розчинника. Вмикають перемішувач і розчинник активно перемішується з водою на протязі 10 хвилин. Після закінчення перемішування суміш відстоюється на протязі 30 хвилин. За це й час вона розшаровується потім зливають 2/3 водного розчину в чисту колбу. З цієї колби відбирають проби, в яких визначають рівноважну концентрацію фенолу бромметричним методом [2, стор. 256].
Концентрація фенолу в органічній фазі розраховується за формулою:
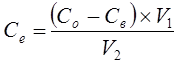 ; (4.2.) ; (4.2.)
де V1
– об’єм стічної води, л
V2
– об’єм екстрагенту, який завантажують в екстрактор, л;
Со
– вихідна концентрація фенолу у стічній воді, г/л;
Св
– рівноважна концентрація фенолу у воді, г/л.
Коефіцієнти розподілу розраховуються за формулою 4.1.
Результати експерименту та розрахункові дані заносять до табл. 4.1.
Таблиця 4.1 - Результати визначення коефіцієнту розподілу
| Розчинник |
Коефіцієнт розчинення |
Температура,
0
С
|
Концентрація фенолу в органічній фазі, г/л |
Концентрація фенолу у воді, г/л |
4.5 Зміст звіту
В звіті зазначаються: назва та мета лабораторної роботи, схема лабораторної установки, описується методика експерименту та наводяться результати експерименту і розрахунків у вигляді таблиці 4.1.
В кінці роботи пишеться висновок.
4.6 Контрольні запитання
1. Критерії вибору екстрагенту для екстракції органічних речовин з промислових стічних вод.
2. Методика визначення і розрахунку коефіцієнта розподілу.
3. Що таке екстракція і які є види екстракції.
Лабораторна робота №5
Визначення сорбційної ємності катіонітів при очищенні стічних вод Йонообмінним методом
5.1 Мета роботи
Ознайомитись з основними закономірностями сорбційної йонообмінної технології очищення промислових стічних вод.
5.2 Загальні положення
Умовно йоніт можна розділити на три складові частини: матриця, фіксовані йони та протийони.
За природою матриці йоніти поділяють на неорганічні та (мінеральні) і органічні, природні і штучні (синтетичні). До неорганічних природних йонітів належать: природні цеоліти, глинисті мінерали (алюмосилікати), в тому числі бентонітові глини, глауконіт, вермикуліт, польові шпати, фельдшпатоїди, слюди, оксиди, фосфати і силікати металів (титану, кальцію, цирконію та ін.), рудні мінерали змінного складу.
До неорганічних штучних відносять: синтетичні цеоліти, важкорозчинні солі гетерополікислот із загальною формулою:
Ме3
XY12
O40
´ n H2
O (де Х – P, As, Sb, Si; Y – Mo, W; Me – метал), фероціаніди, фосфати, гідроксиди, сульфіди металів (цирконію, алюмінію, феруму, титану, нікелю та ін.).
До органічних природних йонообмінних матеріалів належать: кам’яне і буре вугілля, торф, целюлоза тощо.
Синтетичні органічні йоніти є високомолекулярними органічними сполуками, які спрямовано синтезовані, мають сталий склад і властивості, що відтворюються в результаті різних технологічних операцій. Для них характерна висока здатність і механічна міцність.
Оскільки процеси йонного обміну – це різновидність сорбцій них процесів, то необхідно розрізняти слідуючи види сорбції: адсорбція – поглинання речовини поверхнею поглинача; абсорбція – поглинання рідини усім об’ємом поглинача; капілярна конденсація – конденсація речовини в порах поглинача.
Поглинач називається сорбентом, речовина, що поглинається сорбатом.
В залежності від взаємодії виділяють слідуючи види сорбції: фізична – обумовлена силами міжмолекулярної взаємодії; хімічна (хемосорбція) – обумовлена утворенням нових хімічних сполук.
Процеси йонного обміну практичного повністю обумовлені хемосорбцією.
Усі тверді і практично не розчинені у воді речовини, і які здатні до йонного обміну в розчинах електролітів, є йонітами.
Йоніти, які містять кислотні активовані групи і здатні обмінюватися з розчином електроліту рухомими катіонами називаються катіонітами.
Йоніти, які містять основні активовані групи і здатні обмінюватися з розчином електроліту рухомими аніонами називаються аніонітами.
Йоніти, які містять кислотні та основні групи, називаються амфолітами.
Катіоніти залежно від тиску протийонів можуть перебувати у водневій (Н – формі), сольовій (натрієвій, кальцієвій) і змішаній формах. Аніоніти можуть бути в гідроксид ній (ОН – формі), сольовій (хлорид ній, сульфатній тощо) і змішаній формах. Амфоліти бувають у воднево-гідроксильній, воднево-сольовій, гідроксильно-сольовій і сольовій формах.
Сорбційна ємність йонітів залежить від рН розчину, з яким йоніт знаходиться у стані рівноваги. Для кожного йоніту існує оптимальний діапазон робочої величини рН.
Чинники, які впливають на величину обмінної ємності:
а) властивості йоніту: розмір зерен, здатність до утворення комплексів; ступінь поперечного зв’язку, рН – активних груп;
б) властивості електроліту: розміри протийонів, тип розчинника, здатність до гідратації протийонів;
в) температура розчину.
При виборі того чи іншого йоніту велику увагу приділяють вивченню залежності величини хемосорбції від концентрації розчиненої речовини.
Процес хемосорбції на йонітах може бути описаний за допомогою ізотерми (рис. 5.1.), яка характеризує залежність кількості речовини, що сорбувалася після встановлення рівноваги, від рівноважної концентрації розчину при постійній температурі.

Рисунок 5.1 - Ізотерма сорбції
При збільшенні концентрації речовини в розчині, збільшується кількість адсорбованої речовини. Але на різних ділянках сорбційної ізотерми це не однаково.
В області низьких концентрацій кількість сорбованої речовини прямопропорційна концентрації йоніту (ділянка І рис. 5.1.)
При подальшому збільшенні концентрації кількість сорбованої речовини збільшується, але в меншій кількості (ділянка ІІ рис. 5.1.), і далі крива переходить в пряму, яка паралельна осі абсцис (ділянка ІІІ рис. 5.1.), що свідчить про поступове насичення поверхні йоніту.
В будь-якій точці побудованої ізотерми сорбції можна знайти величину питомої сорбції. Статичний метод визначення величини питомої сорбції заключається в знаходженні концентрації вихідного розчину (С0
), потім струшують катіоніт масою m з розчином відомої концентрації на протязі деякого протягу часу, необхідного для встановлення сорбційної рівноваги. Визначають концентрацію речовини (С), яка залишилася не адсорбованою.
Питому сорбцію визначають за формулою:
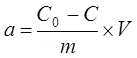 , (5.1) , (5.1)
де V – об’єм розчину, л.
Для розрахунків існує декілька рівнянь, які описують ізотерму сорбції. Найбільш просте – рівняння Ленгмюра:
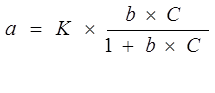  , (5.2) , (5.2)
де К, b – величини, які постійні для даної ізотерми;
С – концентрація речовини при досягненні рівноваги, моль/л.
Часто рівняння Ленгмюра не відповідає експериментально знайденим ізотермам сорбції, так як дуже спрощене.
Найбільш точно крива ізотерми сорбції (рис.5.1) описується рівнянням Фрейндліха:
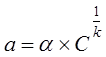 , (5.3) , (5.3)
де α, k– сорбційні константи, які залежать від типу сорбента, концентрації сорбованої речовини, температури середовища, тривалості процесу і визначається експериментально у кожному конкретному випадку.
Визначивши вигляд ізотерми хемосорбції і відповідні коефіцієнти, можна розрахувати значення питомої сорбції речовини при будь-якій заданій рівноважній концентрації розчину та необхідну дозу іоніту для досягнення заданого ефекту видалення речовин з електролітів.
5.3 Реактиви, посуд та прилади
1. Смола КУ–2–8 в (Н+
- формі).
2. Смола КУ–1 (в Н+
- формі).
3. Розчин сульфату міді Cu SO4
, з концентрацією 1 г/л (V = 100 мл).
4. Колби ємністю 250 мл – 10шт.
5. Дистильована вода (1л).
6. Піпетки, стакани.
7. Аналітичні терези.
8. Шпатель.
5.4 Методика експерименту та обробка результатів
В п’ять чистих колб ємністю 250 мл наливають по 100 мл розчину:
в першу – розчин з концентрацією Сu2+
1, 0мг/л;
в другу – 5,0 мг/л;
в третю – 20 мг /л;
в четверту – 100мг/л;
в п’яту – 500мг/л.
Потім в кожну із колб висипають катіоніт КУ–2–8 масою 1г. Вмістиме колб перемішують на протязі 30 хвилин. По закінченню перемішування із розчинів відбирають проби і визначають концентрацію іонів Сu2+
в розчин (за методикою, описаною в [2] ).
Паралельно проводять аналогічний експеримент з використанням в якості катіоніта КУ–1 в Н+ формі.
формі.
Результати експериментів заносять до табл. 5.1.
Таблиця 5.1 - Результати сорбції Сu2+
катіонітами КУ–2–8 та КУ- 1.
| Марка катіоніта |
Номер колби |
Вихідна концентрація Сu2+
, С0
, мг/л |
Рівноважна концентрація Сu2+
, С, мг/л |
Вага катіоніта
m, г
|
| КУ-2-8 |
1 |
| 2 |
| 3 |
| 4 |
| 5 |
| КУ-1 |
1 |
| 2 |
| 3 |
| 4 |
| 5 |
По даним табл. 5.1 розраховують кількість іонів Сu2+
в міліграмах, що сорбувалася на 1 г катіоні та за формулою (5.1)
На основі розрахункових даних будується ізотерма сорбції а = f (С). Перевіряється можливість описання ізотерми сорбції рівнянням Ленгмюра, для чого будують графік в координатах 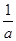 - - 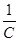 (рис. 5.2) (рис. 5.2)
1. Якщо точки попадають на пряму, то рівняння Ленгмюра можна застосувати.
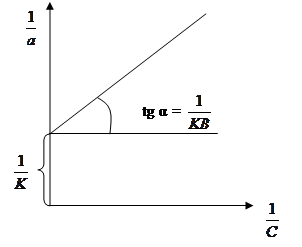
Рисунок 5.2 - Ізотерма сорбції для рівняння Ленгмюра
2. Якщо точки на пряму не попадають, то ізотерма сорбції описується рівнянням Фрейндліха (5.2)
Прологарифмувавши рівняння (5.2), одержимо рівняння прямої в координатах lg a lg С(рис. 5.3)
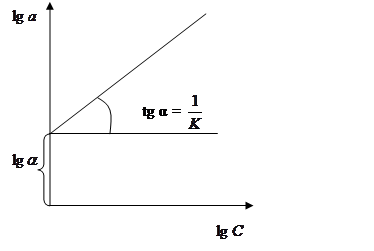
Рисунок 5.3 – Ізотерма сорбції за рівнянням Фрейндліха
5.5 Зміст звіту
В звіті зазначаються: назва та мета лабораторної роботи; схема лабораторної установки, описується методика експерименту та наводяться результати у вигляді таблиць та графіків. В кінці роботи пишеться висновок.
5.6 Контрольні запитання
1. Зміст методу йонного обміну.
2. Чинники, що впливають на процес йонного обміну.
3. Обґрунтуйте існування межі сорбції при збільшенні концентрації.
4. Класифікація йонітів за природою матриці. Навести приклади.
5. Види сорбції.
6. Катіоніти, аніоніти та амфоліти. Їх види. Навести приклади.
7. Рівняння Ленгмюра та ізотерма сорбції.
8. Рівняння Фрейндліха та ізотерма сорбції.
9.Як визначається рівноважна концентрація йонів міді у розчині.
ЛІТЕРАТУРА
1. СНиП 2.04.03-85. Строительные нормы и правила. Канализация. Наружные сети и сооружения. – М.: ЦИТП, 1986-72с.
2. Лурье Ю. Ю. Аналитическая химия промышленных сточных вод. – М.: Химия, 1984. – 448с.
3. Яковлев С. В., Карелин Я. А., Ласков Ю. Н., Воронов Ю. В. Водоотводящие системы промышленных предприятий. – М.: Стройиздат, 1990 ‑ 512с.
4. Калицун В. И., Ласков Ю. М., Воронов Ю. В., Алексеев Е. В. Лабораторный практикум по водоотведению и очистке сточных вод. – М.: Стройиздат, 2000 – 262с.
|