| Міністерство освіти і науки України
Прикарпатський університет імені Василя Стефаника
КРИСТАЛОКВАЗІХІМІЯ ДЕФЕКТІВ ФІЗИКО-ХІМІЧНІ ВЛАСТИВОСТІ ЛЕГОВАНИХ КРИСТАЛІВ ТЕЛУРИДУ КАДМІЮ
дипломна робота
м. Івано-Франківськ
2008
ЗМІСТ
Вступ 3
1. Моделі структур в халькогенідах кадмію і цинку 5
2. Характеристика областей існування структур сфалериту і в’юрциту
3.
4. Кристалічна структура і антиструктура в телуриді кадмію 15
4.1. Кристалоквазіхімічний аналіз 17
4.2. Процеси легування 17
5. Утворення твердих розчинів 20
6. Обговорення результатів 21
Висновки 23
Література 24
Вступ
Актуальність вивчення поведінки домішок у телуриді кадмію обумовлена широким його використанням в оптоелектроніці, при створені модулів сонячних елементів, детекторів іонізуючого випромінювання, які працюють при кімнатній температурі [13-15].
Ширина області гомогенності в CdTe збагачена як Cd, так і Te, складає ~ 10-1
ат.%, при цьому на кожен заряджений дефект припадає 100 електрично неактивних дефектів. Переважаючими видами дефектів в телуриді кадмію, збагаченому Сd є електрично неактивні вакансії телуру, а з сторони Те – вакансії кадмію, що дає можливість припустити наявність в CdTe поряд з дефектами Френкеля дефектів Шоткі. Введення в основну матрицю телуриду кадмію як стехіометричного складу так і при нестехіометрії домішок дозволяє одержати матеріал з різною дефектною підсистемою, яка визначає тип провідності і концентрацію носіїв струму матеріалу. Так, надлишкові відносно стехіометричного складу атоми кадмію вкорінюються в міжвузля решітки і є донорами. При надлишку телуру утворюються вакансії кадмію, які є акцепторами з рівнем 0,15 еВ над валентною зоною [16].
Ряд елементів (Ga, In, Al) III групи в CdTe проявляють донорні властивості, тобто дають можливість одержати матеріал n-типу провідності [17]. Елементи VII групи, а саме хлор, утворює в телуриді кадмію малі донорні рівні і займає в кристалічній решітці позицію атомів телуру. Однак також відомо, що хлор поводить себе як акцептор, утворюючи з вакансіями кадмію комплекси (VCd-Cl
) [15].
В роботі на основі кристалоквазіхімічних підходів [18] запропоновані кристалоквазіхімічні моделі процесів нестехіометрії та легування телуриду кадмію хлором і утворення твердих розчинів Cd1-x
Mnx
Te, Cd1-x
Znx
Te.
Реклама

1. Моделі структур в халькогенідах кадмію і цинку
Кристалографія сполук А2
В6
, утворених із елементів II i VI груп періодичної системи, дещо ускладнена внаслідок того, що вони здатні кристалізуватися в різних поліморфних модифікаціях.
Цинкова обманка ZnS (сфалерит) – кубічна структура, в’юрцит – гексагональна, характеризуються тетраедричним розміщенням атомів. Крім того, вони утворюють ряд близьких за структурою політипів, які характеризуються також тетраедричним розміщенням атомів. Тип зв’язку в цих кристалах може змінюватися від чисто іонного характеру до ковалентного і змішаного [2].
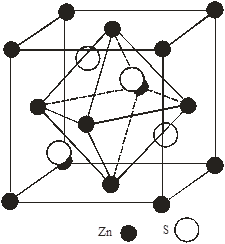
Моделі структур сфалериту і в’юрциту показані на рис.1(а,б), параметри гратки в таблицях 1,2. Всі халькогеніди цинку і кадмію і в частковості CdTe, ZnTe і ZnSe кристалізуються в структурі цинкової обманки типу (В3). Структура сфалериту характеризується щільною трьохшаровою кубічною упаковкою шарів, в’юрциту - двохшаровою гексагональною. В структурі в’юрциту (В4) кристалізуються майже всі халькогеніди цинку і кадмію[2].
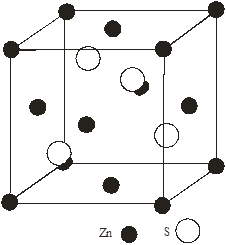 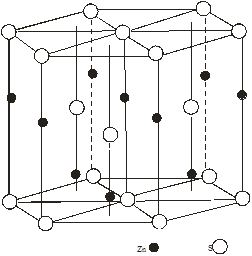
а) б)
Рис.1. Моделі структур: а – сфалериту, б – в’юрциту
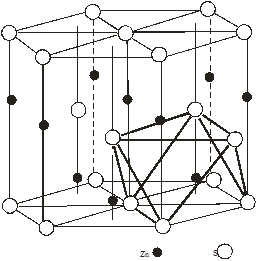
Слід відмітити, що атомами будь-яких ідеальних щільних упаковок простір заповнюється на 74.05%. Т. чином ¼ всього простору упаковки належить пустотам [3]. Розрізняють два види пустот: пустоти оточені чотирма атомами – тетраедричні , оточені шістьма атомами – октаедричні. Щільноупакованні аніонні решітки мають одну октаедричну і дві тетраедричні порожнини. На рис.2(а,б) і 3(а,б) графічно показано розміщення цих порожнин (дефектів) в елементарній комірці сфалериту і в’юрциту. Із яких видно, що октаедричні пустоти в них не заповнені, а тетраедричні на половину. На основі розрахованої кількості розміщення атомів в елементарній комірці розрахували, що на одну комірку сфалериту припадає 4 октаедричні і 8 тетраедричних порожнин, в’юрциту – 12 тетраедричних, 6 октаедричних. Так як тетраедричні порожнини в цих структурах заповнені наполовино металом, а октаедричні не заповнені, то дефектна підсистема буде утворена тетраедричними і октаедричними кристалічними вакансіями і між вузловими атомами металу в тетраедричних порожнинах.
 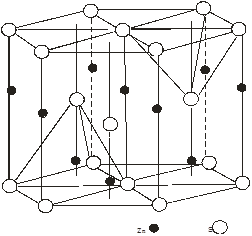
а) б)
Рис 2. Графічне розміщення тетраедричних порожнин (ТП) для структур: а – сфалериту, б – в’юрциту
а) б)
Рис 3. Графічне розміщення октаедричних порожнин (ОП) для структур: а – сфалериту, б – в’юрциту
Реклама

Повернемося до відомої теорії структур щільної упоковки, яка дозволяє в рамках цього підходу визначити всі необхідні геометричні характеристики кристалічних структур напівпровідників А2
В6
. В цій теорії під кристалічною будовою розуміють послідовну шарову упаковку твердих сфер з утворенням тетра- і октапорожнин [12].
Якщо вважати структури сфалериту і в’юрциту щільноупаковані по аніону тоді необхідне виконання наступних двох умов:
1) топологія аніонної підрешітки співпадає з топологією кількості щільноупакованих сфер, причому катіони розміщуються тільки в тетраедричних і октаедричних міжвузлях цієї підрешітки;
2) потенціали міжатомної взаємодії Uмх
, Uхх
i Uмм
, відповідають нерівності (1)
Uмх
>Uхх
>Uмм
, (1)
де М – метал, Х – неметал
Із простих геометричних уявлень можна одержати сукупність величин, які характеризують тетраедр, октаедр і елементарну комірку г.ц.к. решітки. Ці величини, однозначно зв’язані з радіусом сфер будови, тобто радіусами атомів кристалічної решітки, а відповідно і з параметром решітки (а,с) для сфалериту і в’юрциту показані в таблиці 5.
Таблиця 5
Зв’язок величин, які характеризують тетраедр і октаедр в г.ц.к. решітці з радіусом атома і періодом решітки для сфалериту і в’юрциту
| Параметр
|
Позначення
|
f (R)
|
| Сфалерит
|
| 1. Радіус атома
|
R
|
| 2. Період кристалічної решітки
|
a
|
a = 2RÖ2
|
| 3. Ребро тетраедра
|
a1
|
a1
= 2R = 0,71a
|
| 4. Висота тетраедра
|
h
|
h = 2RÖ2/3 = 0,578a
|
| 5. Відстань від центра тетраедра до його основи
|
z
|
z = R/Ö6 = 0,41R= 0,145 a
|
| 6. Відстань центра тетраедра від вершини
|
yt
|
yt
=h-z = (3/Ö6)R = 0,433 a
|
| 7. Відстань центра октаедра від вершини
|
yo
|
yo
= RÖ2
|
| 8. Мінімальний радіус сфери, вписаної в тетрапорожнину
|
rt
min
|
rt
min
= yt
-R = 0,225 R
|
| 9. Мінімальний радіус сфери, вписаної в октапорожнину
|
ro
min
|
ro
min
= yo
- R = 0,414 R
|
| 10. Максимальний радіус сфери, вписаної в тетрапорожнину
|
rt
max
|
rt
max
= 0,5 R
|
| 11. максимальний радіус сфер, вписаних в октапорожнину
|
ro
max
|
ro
max
= 0,732 R
|
| В’юрцит
|
| 1. Період кристалічної решітки
|
a, c
|
a =1/2 √2 а(куб.)
c = 2/3 √3 а(куб.)
|
| 2. Ребро тетраедра
|
a1
|
a1 =
[1/3a2
+ 1/4c2
]1/2
|
| 3. Висота тетраедра
|
h
|
h = c/2
|
| 4. Відстань центра тетраедра від вершини
|
yt
|
yt
= 2/3 h = c/3
|
| 5. Відстань центра октаедра від вершини
|
yo
|
yo
= [1/4a2
+ 3/16c2
]1/2
|
| 6. Мінімальний радіус сфери, вписаної в тетрапорожнину
|
rt
min
|
rt
min
= yt
– R
|
| 7. Мінімальний радіус сфери, вписаної в октапорожнину
|
ro
min
|
ro
min
= yo
- R
|
| 8. Максимальний радіус сфери, вписаної в тетрапорожнину
|
rt
max
|
rt
max
= rt
min √3/2
|
| 9. Максимальний радіус сфери, вписаної в октапорожнину
|
ro
max
|
ro
max
= ro
min √3/2
|
Елементарний тетраедр і октаедр, утворені з щільної упаковки шарів халькогену або металу показані на рис. 4. Для сфалериту і в’юрциту кристалічна решітка складається з двох підрешіток утворених із атомів II i VI груп періодичної системи. В такій решітці виникають вже два типи тетрапорожнин (t1,
t2
) і два типи октапорожнин (o1,
o2
), які відрізняються оточенням, тому розраховували радіуси ТП і ОП в оточені телуру і металу.
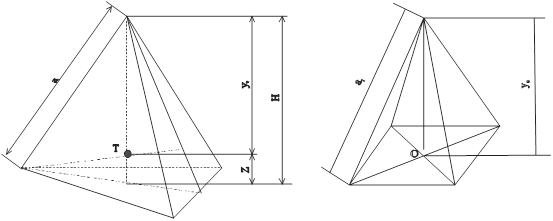
Рис. 4. Елементарний тетраедр (а), октаедр (б), утворені аніонною і катіонною упаковкою шарів: Т – центр тетраедра, О – центр октаедра, а1
– ребро тетраедра, h – висота тетраедра.
Геометричні характеристики тетра- і октапорожнин дозволяють визначити радіуси сфер (атомів) rt
min
, ro
min
(табл. 5), які в них можуть бути вписані. Існує обмеження на rt
, ro
, тобто радіуси вписаних сфер не можуть приймати значення, яке перевищує rt
max
, ro
max
. Їх можна визначити із порушення щільної упаковки сфер, коли вони не дотикаються одна до одної. Тоді проходить ніби збільшення ефективних розмірів сфер основної будови настільки, що, висота утвореного ними нового тетраедра h1
буде рівна або перевищить 2R. Так як h¢
= 2r¢
Ö2/3, тоді прирівнюючи h¢
= 2R, одержимо r¢
= rÖ3/2. Звідси можна знайти гранично допустиме значення радіусів сфер вписаних в порожнини rt
max
і ro
max
.[12].
2. Характеристика областей існування структур сфалериту і в’юрциту
Cтруктура в’юрциту для ZnS – стійка при високих температурах. Фазовий перехід із гексагональної модифікації ZnS в кубічну проходить при температурах 1020 і 1150 0
С [2]. В [4] показані поліморфні пари, зв’язані переходом під тиском, які зачіпають зміну першої координації для ZnO тиск переходу 100 кбар: низькотемпературна форма – в’юрцит, перша координація 4:4; високотемпературна форма – NaCl, перша координація 6:6. Для СdS тиск переходу 20 кбар: низькотемпературна форма – сфалерит,перша координація 4:4; високотемпературна форма – NaCl, перша координація 6:6. Зміна другої координації для CdS проходить при тиску 160-200 кбар, при низькому тиску структурний тип сфалерит; привисокому тиску в’юрцит. Для CdS структурна зміна при збільшені тиску обернена тій, яка викликається пониженням температури.
Перехід із тетраедричної до октаедричної координації супроводжується зменшенням об’єму приблизно на 20 %. Незалежно від того чи має вихідний матеріал структуру в’юрциту чи цинкової обманки, при зворотньому переході до атмосферного тиску зберігається структура цинкової обманки [2].
Можливість зв’язати тип стабільної структури А2
В6
з співвідношенням іонності і ковалентності хімічного зв’язку розроблено авторами [5] (табл. 3).
Таблиця 3
Зв’язок стабільні структури А2
В6
з коефіцієнтом іонності
| А2
В6
|
l,%
|
Стабільна структура
|
D(с/а)
|
А2
В6
|
l,%
|
Стабільна структура
|
D(с/а)
|
| ZnO
|
82
|
W
|
-293
|
ZnSe
|
33
|
S
|
+65
|
| CdS
|
45
|
W
|
-103
|
CdTe
|
21
|
S
|
+68
|
| CdSe
|
40
|
W
|
-24
|
ZnTe
|
16
|
S
|
+81
|
| ZnS
|
40
|
S
|
+33
|
Як відомо, різниця в енергіях двох поліморфних модифікацій – в’юрцита і сфалериту, яка б мала вона не була, буде обумовлена різним вкладом іонності, про що свідчить порівняння їх констант Маделунга. Вони є мірою електростатичної взаємодії між іонами решітки, для структурного типу в’юрциту і сфалериту і рівні 1,641;1,638, яка є більшою для решітки в’юрциту [6]. Звідси можна зробити два висновки. По-перше, якщо сполуки А2
В6
можуть кристалізуватися в двох модифікаціях, одна з яких метастабільна, то тоді характер зв’язку в гексагональній модифікації повинен бути більш іонним, чим у кубічній. Більший іонний характер структури в’юрциту експериментально доказаний вимірюванням ширини забороненої зони, яка для деяких сполук А2
В6
виявилася дещо більшою, ніж ширина забороненої зони тих же сполук, які мають структуру сфалериту [7-9]. По-друге, в ряді сполук А2
В6
з збільшенням долі іонності зв’язку (l) повинен спостерігатися перехід від стабільної структури сфалериту S до стабільної структури в’юрциту W (табл. 3).
Коли необхідно підкреслити зв’язок атомів в сполуках використовують для одного і того ж атома різні радіуси: ковалентні, іонні, тетраедричн і октаедричні ковалентні радіуси атомів в сполуках. Для атомів халькогенідного ряду цинку і кадмію вони приведені в таблиці 4.
Таблиця 4
Радіуси елементів в халькогенідах цинку і кадмію
| Елементи, r, Å
|
Zn
|
Cd
|
S
|
Se
|
Te
|
Література
|
| Атомний, ra
|
1,53
|
1,71
|
1,09
|
1,22
|
1,42
|
| Ковалентний, rk
|
1,25
|
1,48
|
1,02
|
1,16
|
1,36
|
| Іонний, ri
|
0,83
|
0,99
|
1,82
|
1,93
|
2,11
|
| Тетраедричний, rt
|
1,31
|
1,48
|
1,04
|
1,14
|
1,32
|
[2]
|
| Октаедричний, ro
|
1,20
|
1,38
|
1,35
|
1,45
|
1,64
|
[10]
|
3. Домішково-дефектна підсистема сфалеритної структури у легованих хлором кристалах телуриду кадмію
3.1. Домішка хлору у телуриді кадмію
Одним із найбільш перспективних матеріалів для виготовлення високочутливих неохолоджуючих детекторів іонізуючого випромінювання є компенсований хлором телурид кадмію [1].
CdTe відноситься до широкозонних напівпровідників АII
ВVI
для яких характерне явище самокомпенсації. Суть явища самокомпенсації полягає у нейтралізації дії введених домішок донорного чи акцепторного типу утворенням власних дефектів з протилежною дією. Це є енергетично вигідним процесом для кристала. Крім того, власні дефекти, взаємодіючи з домішками, за певних умов, можуть утворювати різного типу електрично активні і неактивні комплекси [2, 3].
Вирощений методом напрямленої кристалізації і компенсований хлором СdТе (NCl
~ 1018
см-3
) звичайно має р-тип провідності з питомим опором ρ > 107
Ом см, концентрацією дірок р ~ 108
см-3
та холлівською рухливістю дірок µh
~ 50см2
-В-1
с-1
. Після відпалу в атмосфері насиченої пари кадмію при температурах 500 — 900 °С протягом кількох годин кристал стає низькоомним з n-типом провідності. У цьому випадку компенсація
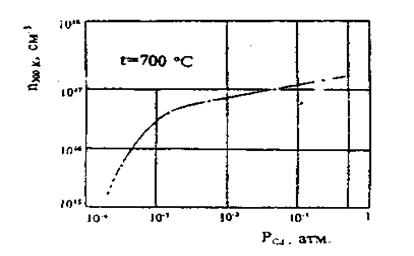
Рис. 1. Залежність n(pCd
) у разі відпалу напівізолюючих зразків CdTe у парі кадмію при температурі 700 °С на протязі 3 год.
практично зникає, і концентрація вільних електронів може досягати п~ 2 І017|
см-3
. Згідно з фундаментальними роботами [9, 10] такий відпал приводить не тільки до збільшення п, але і до зменшення концентрації вакансій кадмію. В результаті порушуються умови компенсації. На рис. 1 наведено залежність значення n від тиску пари кадмію рСd
, при якому проводився відпал [11]. На основі проведених в роботі [11] досліджень зразків
n-CdTe отримано значення 
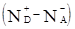 ~ 9,6·1016
см-3
, яке добре узгоджується з величиною п. У цьому випадку атом хлору, замішуючи атом телуру, поводить себе як точковий дефект, донорного типу. На рис. 2 наведено залежність п від концентрації введеного хлору [СІ], характер якої, як вказано в [12], практично не змінюється для різних значень рСd ~ 9,6·1016
см-3
, яке добре узгоджується з величиною п. У цьому випадку атом хлору, замішуючи атом телуру, поводить себе як точковий дефект, донорного типу. На рис. 2 наведено залежність п від концентрації введеного хлору [СІ], характер якої, як вказано в [12], практично не змінюється для різних значень рСd
Це означає, що за концентрацію електронів в зоні провідності відповідає домішка хлору, а не власні дефекти у гратці кадмію. Аналогічні результати отримано і для СdTe:Iп [13] (атом індію замішує атом кадмію). Слід вимітити, що енергія Іонізації ЕD
, залежить від концентрації введеної донорної домішки та ступеня компенсації (ЕD
= ЕD
(N, К = NA
/ ND
)) і зв'язана з енергією іонізації ізольованих донорів E0
емпіричним співвідношенням [14].
ЕD
= Е0
– α( )1/3
, (1) )1/3
, (1)
α = 2,5·10-8
eВ·см. (Співвідношення (1) уточнене врахуванням крупномасштабних флуктуацій потенціалу для низьких і високих температур порівняно з шириною домішкової зони [15]). Знайдене з (1) значення Е0
становить 0,014 еВ [І3] і є близьким до значення, отриманого на основі воднеподібної моделі.
| 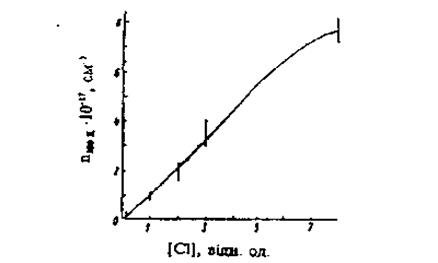
Рис. 2. Залежність n([Cl])
|
Встановлено також наявність у компенсованих монокристалах СdТе:СІ
мілких акцепторних рівнів. У роботі [16] досліджували спектри поглинання (рис. 3) та фотопровідності (рис. 4) таких зразків. Різке зростання коефіцієнта поглинання α в області Е > 1,55 еВ (рис. З, криві 2 і 3) пов'язується з іонізацією акцепторів, розташованих па рівнях Ev
+ 0,04 eВ. У цій же області енергій спостерігалась інтенсивна смуга в спектрі фотопровідності (рис. 4).
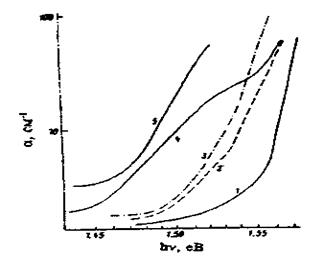
Рис. 3. Спектри поглинання при 77 К: 1 – нелегований зразок; 2 – легований зразок хлором, NCl
~ 1018
cm-3
; 3 – NCl
~ 1019
cm-3
; 4 – зразок, легований хлором після термообробки у вакуумі при 500 °С; 5 – при 700°С
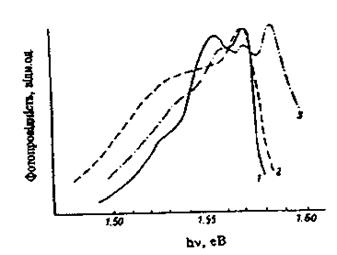
Рис. 4. Спектри фотопровідності: 1 – зразок, легований хлором, NCl
~ 1018
cm-3
, Т = 77 К; 2 – той самий зразок після термообробки у вакуумі при 500 С; 3 – зразок легований хлором, Т = 4,2 К
Високотемпературний відпал кристалів у вакуумі протягом 24 год приводить до суттєвих змін у спектрах поглинання і фотопровідності, а саме мас місце інтенсивне поглинання в області 1,46 — 1,47 еВ з максимумом близько 1,53 eВ (рис. З, крива 4), що відповідас переходам електронів з рівнів Ev
+ 0,06 еВ та Ev
+ 0,12 сВ у зону провідності. Концентрація цих акцепторних центрів становить приблизно 2 1015
– 2 І016
см-3
, а їх природа однозначно не з’ясована, хоча певні міркування про їх походження висловлювались в літературі |І6|.
Аналогічні висновки про енергетичне положення рівнів, що належать даним акцепторним центрам, зробили автори роботи [17], досліджуючи крайову люмінесценцію (рис. 5) нелегованих (крива 1), легованих високоомних (крива 2) та легованих низькоомних (крива 3) кристалів. Для легованих зразків спостерігається люмінесценція в області 1,55 ев.
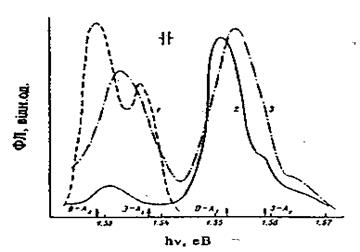
Рис. 5. Спектри крайової люмінесценції кристалів CdTe при 4,2 К: 1 – нелегований зразок, n = 1015
cм-3
; 2, 3 – зразки, леговані хлором (2 – р = 108
см-3
, 3 – р = 1013
см-3
)
Характер зміни положень максимумів кривих 2 і 3 із збільшенням температури відповідає переходам всередині донорно-акцепторної пари, а при Т = 25 ÷ З0 К домінує смуга, що відповідає переходам зона — акцептор (Е~ 1,56 ев). Енергетичне положення цього акцепторного рівня Ev
+ 0,047 узгоджується з даними, отриманими в результаті аналізу спектрів поглинання та фотопровідності. У спектрах спеціально нелегованих та легованих хлором кристалів спостерігається смуга люмінесценції з максимумом 1,53 еВ, яку пов'язують з рівнем Ev
+ 0,069 ев, що належить першому зарядовому стану вакансій кадмію.
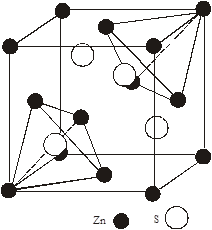
3.2. Кристалічна модель дефектів CdTe:Cl
Кристалічна гратка для сфалериту показана на рис. 1. В’юрцитну модифікацію CdTe у чистому вигляді не одержали [3]. Сфалеритна структура характеризується міжвузловими порожнини з тетраедричним і октаедричним оточенням, центри яких позначаються Т і О. Гратка кристалів телуриду кадмію складається із двох підграток утворених атомами металу і халькогену (на рис.1 вони показані відповідно чорними і світлими кружечками). В такій гратці виникає вже два види тетраедричних Т1
і Т2
і два види октаедричних порожнин О1
і О2
, які відрізняються типом оточуючих атомів. При чому октапорожнини незаповнені, а тетра – наполовину заповнені. На рис. 2 показано можливе розміщення точкових дефектів у кристалічній гратці телуриду кадмію при легуванні його хлором з наступним відпалом в парах кадмію і телуру. Дефектна підсистема в
кінцевому результаті може буде утворена: донорним дефектом заміщення 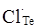 ; вакансіями у катіонній і аніонній підгратках ; вакансіями у катіонній і аніонній підгратках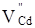 , , 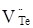 відповідно; міжвузловим атомом кадмію відповідно; міжвузловим атомом кадмію 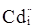 в октаедричних порожнинах аніонної підгратки; акцепторним комплексом в октаедричних порожнинах аніонної підгратки; акцепторним комплексом 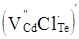 ; міжвузловим атомом телуру ; міжвузловим атомом телуру 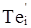 у тетрапорожнинах підгратки металу, який займає вакансії кадмію з утворенням антиструктурного дефекту у тетрапорожнинах підгратки металу, який займає вакансії кадмію з утворенням антиструктурного дефекту 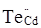 . .
 Користуючись даними радіусів атомів і порожнин наведених у таблиці, проаналізуємо можливість геометричного розміщення вказаних дефектів у кристалічній гратці сфалеритної структури телуриду кадмію. Можливе розміщення кадмію в октапорожнинах аніонної підгратки (рис. 2 – дефект D) підтверджується співставленням його іоного радіусу (rі
= 0,99 Å) з граничними розміроми октаєдричних порожнини підгратки телуру (ro
i(min) –
ro
i(max) =
0,874 –1,544 Å). Кадмій також може входити і у тетраедричні порожнини підгратки телуру, що узгоджується з їх радіусами тетраедричних порожнин (rт
i(min) –
rт
i(max) =
0,475 –1,055 Å). Користуючись даними радіусів атомів і порожнин наведених у таблиці, проаналізуємо можливість геометричного розміщення вказаних дефектів у кристалічній гратці сфалеритної структури телуриду кадмію. Можливе розміщення кадмію в октапорожнинах аніонної підгратки (рис. 2 – дефект D) підтверджується співставленням його іоного радіусу (rі
= 0,99 Å) з граничними розміроми октаєдричних порожнини підгратки телуру (ro
i(min) –
ro
i(max) =
0,874 –1,544 Å). Кадмій також може входити і у тетраедричні порожнини підгратки телуру, що узгоджується з їх радіусами тетраедричних порожнин (rт
i(min) –
rт
i(max) =
0,475 –1,055 Å).
Міжвузловий телур у будь-якому стані (нейтральний атом, іон) не може бути розміщений ні в тетраедричних, ні в октаедричних порожнинах підгратки металу із-за значного перевищення власних розмірів над розмірами відповідних порожнин. Більш імовірним є заміщення телуром кадмію з утворенням анти структурного дефекту 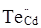 , так як їх тетраедричні ковалентні радіуси спів розмірні (rCd
к(т)
= 1,48 Å,
rTe
к(т)
= 1,34 Å). Геометричні співвідношення також сприяють хлору (rCl
к(т)
= 1,06 Å) зайняти тетравузли телуру. Можливим є і утворення комплексу , так як їх тетраедричні ковалентні радіуси спів розмірні (rCd
к(т)
= 1,48 Å,
rTe
к(т)
= 1,34 Å). Геометричні співвідношення також сприяють хлору (rCl
к(т)
= 1,06 Å) зайняти тетравузли телуру. Можливим є і утворення комплексу 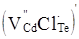 так як відстані між центрами вакансій кадмію і заміщеним телуру хлором у тетрапозиції кристалічної гратки складають всього 2,80 Å [3]. так як відстані між центрами вакансій кадмію і заміщеним телуру хлором у тетрапозиції кристалічної гратки складають всього 2,80 Å [3].
3.3. Кристалоквазіхімічні рівняння утворення дефектів
Незважаючи на проведені фундаментальні дослідження монокристалів CdTe:Cl [2, 4-6], квазіхімічного моделювання дефектної підсистеми при їх відпалі у парах кадмію і телуру, залишається невирішеною проблема визначення розміщення дефектів у кристалічній гратці. Кристалоквазіхімія, як новий науковий напрям, дає більш розширену характеристику утворення дефектів. У квазіхімії немає необхідності знати кристалічну природу дефектів [6-10]. Кристалоквазіхімія розглядає дефекти у відповідності з кристалічною будовою речовини і дає нову інформацію про їх властивості, яка відсутня в окремо взятих кристалохімії і квазіхімії [10].
В основу методу покладено суперпозицію кристалоквазіхімічної формули досліджуваної матриці 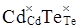 із кристалоквазіхімічним складом (кластером). Кристалоквазіхімічний склад формується шляхом накладання антиструктури телуриду кадмію із кристалоквазіхімічним складом (кластером). Кристалоквазіхімічний склад формується шляхом накладання антиструктури телуриду кадмію 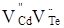 , яку утворюють двократно іонізовані негативні та позитивні вакансії кадмію і телуру з кристалохімічним складом доданої речовини. Заряди дефектів у кристалоквазіхімії позначають таким чином: х – нейтральні, × – позитивні, ¢ – негативні, кількість цих знаків відповідає кратності іонізації, e' – концентрація електронів, h·
– концентрація дірок. , яку утворюють двократно іонізовані негативні та позитивні вакансії кадмію і телуру з кристалохімічним складом доданої речовини. Заряди дефектів у кристалоквазіхімії позначають таким чином: х – нейтральні, × – позитивні, ¢ – негативні, кількість цих знаків відповідає кратності іонізації, e' – концентрація електронів, h·
– концентрація дірок.
Згідно уявлень кристалоквазіхімії [5] нестехіометричний телурид кадмію з надлишком кадмію описується такими рівняннями:
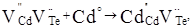
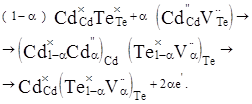 (1) (1)
При надлишку халькогену відповідно:
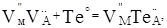
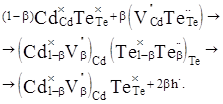 (2) (2)
Де, 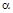 і і 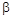 – відхилення від стехіометрії. При аналізі рівнянь (1), (2) видно, що електронний тип провідності телуриду кадмію пов’язаний із вакансіями телуру – відхилення від стехіометрії. При аналізі рівнянь (1), (2) видно, що електронний тип провідності телуриду кадмію пов’язаний із вакансіями телуру 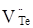 , які утворюються за рахунок надстехіометричного кадмію, а дірковий – із вакансіями кадмію , які утворюються за рахунок надстехіометричного кадмію, а дірковий – із вакансіями кадмію 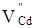 , при надлишку телуру. , при надлишку телуру.
Тепер розглянемо кристалоквазіхімічний кластер легуючої домішки CdCl2
. Згідно попереднього представлення він запишеться як:
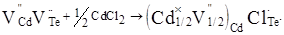 (3) (3)
При суперпозиції матриці CdTe n-типу (1) з кластером (3) одержимо:
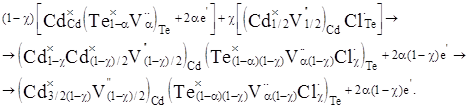 (4) (4)
Утворений матеріал (4) характеризується переважаючою електронною провідністю, яка обумовлена вакансіями 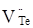 у підгратці халькогену. у підгратці халькогену.
Суперпозиція матеріалу CdTe р-типу (2) з (3) приводить до:
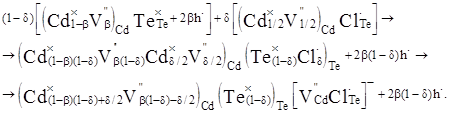 (5) (5)
Дірковий тип провідності матеріалу (5) зберігається за рахунок центрації вакансій 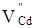 у підгратці металу. у підгратці металу.
При відпалі CdTe:Cl у парі кадмію надлишковий, відносно стехіометричного складу, кадмій може утворювати вакансії телуру 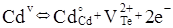 , або вкорінюватися у міжвузля гратки , або вкорінюватися у міжвузля гратки 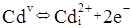 [4]. Тому вплив надлишкового кадмію на матеріал (5) проводили за механізмом заміщення і вкорінення. [4]. Тому вплив надлишкового кадмію на матеріал (5) проводили за механізмом заміщення і вкорінення.
Для механізму входження кадмію у свої ж вакансії одержуємо кластер:
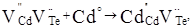 (6) (6)
У випадку CdTe р-типу провідності накладання матриці (5) на кластер (6) приводить до утворення матеріалу з переважаючою електронною провідністю згідно одержаного матеріалу (7).
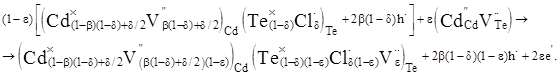 (7) (7)
При вкорінені кадмію у міжвузля кластер запишеться:
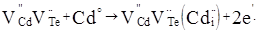 (8) (8)
Суперпозиція матриці (5) з кластером (8) дає наступний результат (9) :
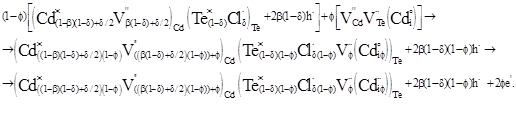 (9) (9)
При аналізі одержаних рівнянь (7) і (9) видно, що вони характеризуються переважаючою електронною провідністю, яка обумовлена появою вакансій телуру для (7) та міжвузловим кадмієм в аніонній підгратці для матриці (9).
Використанні позначення грецькими буквами: 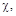 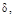 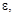 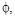 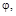 у методі кристалоквазіхімії означають відхилення від стехіометрії або мольні частки тієї речовини, яку додають у процесі дослідження. у методі кристалоквазіхімії означають відхилення від стехіометрії або мольні частки тієї речовини, яку додають у процесі дослідження.
При відпалі р-CdTe:Cl при низьких тисках пари кадмію, а саме у парі телуру, одержують матеріал з високою концентрацією електронів за рахунок утворення антиструктурного дефекту 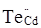 за рівнянням: за рівнянням: 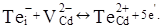 Кристалоквазіхімічне рівняння дефектоутворення для такого процесу приведено нижче: Кристалоквазіхімічне рівняння дефектоутворення для такого процесу приведено нижче:
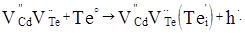 (10) (10)
Суперпозиція матриці (5) з кластером (10) дає:
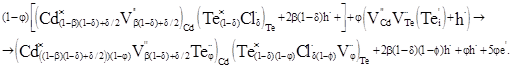 (11) (11)
3.4 Аналіз результатів дослідження
Експериментальні результати [4-6], які визначають залежність типу провідності легованих CdCl2
кристалів телуриду кадмію від значення парціальних тисків компонентів, із врахуванням кристалохімічної (рис. 1, 2) і кристалоквазіхімічної (1) – (11) моделей можна пояснити наступними чином.
Початково синтезовані кристали CdTe, які мають р-тип ровідності [4], характеризуються згідно (2) переважанням вакансій кадмію – тетраедричні порожнини в оточенні телуру (рис. 2 –дефект типу А). При легуванні цього матеріалу CdCl2
акцепторний тип кристалів зберігається за рахунок утворення додаткових вакансій у катіонній підгратці згідно (5): 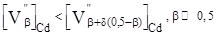 (рис. 2 – дефект типу А). (рис. 2 – дефект типу А).
Відпал кристалів у парах телуру (область низьких значень парціального тиску кадмію) згідно (11) веде до утворення антиструктурних дефектів 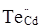 (рис. 2 – дефект M). Це пов’язано із тим, що при високих концентраціях телуру, займаючи тетраедричне міжвузля у кристалічній гратці, він має високу зовнішню релаксацію і буде притягуватися до областей, де напруги можуть бути усунені. Ці області локалізовані у місцях значної концентрації вакансій кадмію (рис. 2 – дефект M). Це пов’язано із тим, що при високих концентраціях телуру, займаючи тетраедричне міжвузля у кристалічній гратці, він має високу зовнішню релаксацію і буде притягуватися до областей, де напруги можуть бути усунені. Ці області локалізовані у місцях значної концентрації вакансій кадмію  , у яких відбувається релаксація і зсув сусідніх атомів. Із-за утворення при цьому значної кількості електронів , у яких відбувається релаксація і зсув сусідніх атомів. Із-за утворення при цьому значної кількості електронів  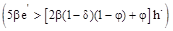 (11), відпалений CdTe:Сl у парах телуру має значну ефективну електронну провідність. (11), відпалений CdTe:Сl у парах телуру має значну ефективну електронну провідність.
Відпал легованих хлором кристалів CdTe при високих парціальних тисках парів кадмію знову ж таки приведе до синтезу кристалів із переважаючою електронною провідністю. Але механізм донорної дії тут буде зовсім інший ніж у попередньому випадку. Так, при механізмі заміщення (7) надлишкові електрони у кристалічній гратці CdTe появляються за рахунок „заліковування” вакансій кадмію: 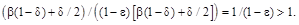 При механізмі вкорінення (9) ці ж електрони провідності утворюються вже у прцесі іонізації міжвузлових атомів кадмію (рис. 2 –дефект D). При механізмі вкорінення (9) ці ж електрони провідності утворюються вже у прцесі іонізації міжвузлових атомів кадмію (рис. 2 –дефект D).
Для області середніх парціальних тисків пари кадмію переважаючими дефектами є вакансії у катіонній підгратці згідно (2) (рис. 2 – дефект А), що і обумовлює р-тип провідності матеріалу.
Окремим цікавим питанням є утворення комплексів (асоціатів) за рахунок взаємодії між собою різнойменно заряджених власних атомних дефектів із домішковими дефектами. У нашому випадку згідно кристалоквазіхімічних рівнянь (4), (5), (7), (9) і (11) може утворюватися заряджений центр типу 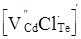 (рис. 2 – дефект К). Він окремо виділений у (5). Крім того, в останній час [2], пропонується ідеї про утворення нейтральних центрів типу (рис. 2 – дефект К). Він окремо виділений у (5). Крім того, в останній час [2], пропонується ідеї про утворення нейтральних центрів типу 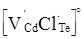 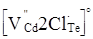 . В усіх випадках утворення центрів, як заряджених, так і нейтральних, має місце зв’язування електронів у кристалічній гратці. . В усіх випадках утворення центрів, як заряджених, так і нейтральних, має місце зв’язування електронів у кристалічній гратці.
Висновки
Згідно одержаних кристалоквазіхімічних механізмів процесів не стехіометрії, легування, утворення твердих розчинів в телуриді кадмію встановлено:
1. При процесах нестехіометрії на боці кадмію одержуємо матеріал n-типу провідності, на боці телуру – р-типу.
2. Адсорбція кисню на поверхні CdTe приводить до заміщення вакансій телуру киснем з утворенням матеріалу р-типу.
3. Легування CdTe хлором і індієм проходить за двома механізмами заміщення і вкорінення, що дає можливість одержати матеріал р-типу при легуванні хлором та n-типу при легуванні індієм, як за механізмом заміщення так і вкорінення.
4. При утворені твердих розчинів CdTe-ZnTe, CdTe-K2
Te одержують матеріал р-типу з ізовалентним заміщенням і n-типу з гетеровалентним заміщенням.
Література
1. А. Верма, П. Кришка. Полиморфизм и политипизм в кристаллах. «Мир». М., 1969.
2. Физика и химия соединений АII
BVI
. «Мир». М., 1970.
3. Г.М. Попов., И.И. Шафрановский. Кристаллография. М., «Высшая школа», 1972.
4. М.Дж. Бюргер. Фазовые переходы // Кристаллография.Том 16, в.6, 1971, с.1084.
5. К.В. Шалимова, В.А. Дмитриев. Изменение типа стабильной структуры в ряду соединений АII
BVI
// Кристаллография, Том 17, в.3, 1972, с.541.
6. Л. Паулинг. Природа химической связи. М. – Л., 1947.
7. J.S. Park, F.I. Chan, J.Appl. Phys, 36, 800,1965.
8. G.F. Neumark. Phus. Rev., 125.838,1962.
9. O. Brafman, G. Schachar, I.T. Steinberger. J.Appl. Phys. 36.668,1965.
10. C.А. Семилетова. Тетраедрические и октаедрические ковалентные радиусы // Кристаллография. Том 21, в.4, 1976, с.752-754.
11. Д.М. Фреїк, В.В. Прокопів, У.М. Писклинець, І.М. Ліщинський. Вплив технологічних факторів і легуючої домішки індію на дефектну систему і тип провідності у телуриді кадмію // Фізика і хімія твердого тіла Т.3. №1 (2002) с. 526-530.
12. В.Й. Фистуль. Примеси переходных металлов в полупроводниках – М.: Металлургия, 1983, с.192.
13. F.V. Wald. Application of CdTe. A Review // Rev Phys. Appl. 12 (12). P.277-290 (1977).
14. G.C. Morris, S.K. Das, P.G. Tanner. Some Factors Aftecting Efficiencies of n-CdS/p-CdTe Thin Film Solar Cells // j. Cryst. Growth. 117. P.929-934 (1992).
15. S. Seto, A. Tanaka, Y. Mosa, M. Kawashima. Clorine – Related Photoluminescence Lines in High-Resistivitg Cl-Doped CdTe // j. Cryst. Growth. 117. P.271-275 (1992).
16. С.А. Медведев, С.Н. Максимовский, К.В. Киселева, Ю.В. Клевков, Н.Н. Сентгорина. О природе точечных дефектов в нелегированом СdTe // Изв. АН СССР. Неорганические материалы, IX (3), сс. 356-360 (1973).
17. О.Э. Панчук, П.И. Фейчук, Л.П. Щербак, П.М. Фочук, Р.Ф. Бойчук. Распределение Ga в CdTe // Изв. АН СССР. Неорганические материалы, 21 (7), сс.1118-1120 (1985).
18. С.С. Лисняк. Кристаллоквазихимическая модель исследований в химии твердого тела // Изв. АН СССР. Неорганические материалы, 29 (9), сс.1913-1917 (1992).
19. В.Г. Яковлева. Структура и свойства соединений АII
ВVI
. - В сб.: Современное состояние аналитической химии полупроводниковых соединений типа АII
ВVI
(Тр. Моск. ин-та стали и сплавов). М.: Изд. МИСиС, с. 151 (1983).
20. Н.Х. Абрикосов, В.Ф. Банкина, Л.В Порецкая, Е. В. Скуднова, С.Н. Чижевская. Полупроводниковые халькогениды и сплавы на их основе. М., Наука, с.220 (1975).
21. В.В. Матлак, М.И. Илащук, О.А. Парфенюк, П.А. Павлин, А.В. Савицкий. Електропроводность полуизолирующего СdTe // Физика и техника полупроводников, 16 (10), сс.89-92 (1982).
22. К. Руманс. Структурные исследования некоторых окислов и других халькогенидов при нормальных и высоких давлениях. М.: Мир, (1969).
23. Д.В. Корбутяк, С.В. Мельничук, П.М. Ткачук. Домішково-дефектна структура CdTe:Cl – матеріалу для детекторів іонізуючого випромінювання // Укр. Фіз. Журн., 44 (6), сс.730-737 (1999).
|