| Введение
Несмотря на достижения современной анестезии, продолжаются поиски менее опасных средств для наркоза, разработка различных вариантов многокомпонентного избирательного наркоза, позволяющего значительно уменьшить их токсичность и побочные отрицательные влияния.
Создание новых лекарственных веществ включает 6 стадий:
1. Создание лекарственного вещества с помощью компьютерного моделирования.
2. Лабораторный синтез.
3. Биоскрининг и доклинические испытания.
4. Клинические испытания.
5. Промышленное производство.
6. Продажа.
В последнее время компьютерное моделирование все более уверенно входит в практику технологии создания новых синтетических лекарственных веществ [1]. Предварительно проведенный компьютерный скрининг экономит время, материалы и силы при аналоговом поиске лекарственных препаратов. В качестве объекта исследования выбран местноанестезирующий препарат дикаин, который имеет более высокий уровень токсичности в ряду своих аналогов, но при этом не заменим в глазной и оториноларингологической практике. Для снижения и сохранения или усиления местноанестезирующего эффекта разрабатываются композиционные составы, дополнительно содержащие противогистаминные средства, содержащих аминоблокаторы, адреналин.
Дикаин относится к классу сложных эфиров п
-аминобензойной кислоты (β-диметиламиноэтиловый эфир п
-бутиламинобензойной кислоты гидрохлорид) [2]. Расстояние C-N в 2-аминоэтанольной группе определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие.
В основу модифицирования молекулы дикаина для создания новых анестетиков нами положен принцип введения химических группировок и фрагментов в существующий анестезиофор, которые усиливают взаимодействие вещества с биорецептором, снижают токсичность и дают метаболиты с положительным фармакодействием.
Исходя из этого нами предложены следующие варианты новых молекулярных структур:
1. В бензельное кольцо введена “облагораживающая” карбоксильная группа, диметиламиногруппа замещена на более фармакоактивную диэтиламиногруппу.
2. Алифатический н
-бутильный радикал замещен на адреналиновый фрагмент.
Реклама

3. Ароматическая основа п
-аминобензойной кислоты замещена на никотиновую кислоту.
4. Бензольное кольцо замещено на пиперидиновое, характерное для эффективного анестетика промедол.
В работе выполнено компьютерное моделирование всех указанных структур с применением программы HyperChem. На последующих этапах компьютерного конструирования исследована биологическая активность новых анестетиков с применением программы PASS.
1. Обзор литературы
1.1 Лекарственные средства
Несмотря на огромный арсенал имеющихся лекарств, проблема изыскания новых высокоэффективных лекарственных средств остается актуальной. Это обусловлено отсутствием или недостаточной эффективностью лекарств для лечения некоторых заболеваний; наличие побочного действия некоторых лекарственных препаратов; ограничениями срока годности лекарственных препаратов; огромными сроками годности лекарственных препаратов или их лекарственных форм.
Создание каждого нового оригинального лекарственного вещества является результатом развития фундаментальных знаний и достижений медицинских, биологических, химических и других наук, проведения напряженных экспериментальных исследований, вложения крупных материальных затрат. Успехи современной фармакотерапии явились следствием глубоких теоретических исследований первичных механизмов гомеостаза, молекулярных основ патологических процессов, открытия и изучения физиологически активных соединений (гормоны, медиаторы, простагландины и др.) [3]. Получению новых химиотерапевтических средств способствовали достижения в изучении первичных механизмов инфекционных процессов и биохимии микроорганизмов.
Лекарственное средство – однокомпонентный или комплексный состав, обладающий профилактической и лечебной эффективностью. Лекарственное вещество – индивидуальное химическое соединение, используемое в качестве лекарственного средства [4].
Лекарственная форма – физическое состояние лекарственного средства, удобное для применения [4].
Лекарственный препарат – дозированное лекарственное средство в адекватной для индивидуального применения лекарственной форме и оптимальным оформлением с приложением аннотации о его свойствах и использовании [4].
В настоящее время каждое потенциальное лекарственное вещество проходит 3 стадии изучения: фармацевтическую, фармакокинетическую и фармакодинамическую.
На фармацевтической стадии устанавливают наличие полезного действия лекарственного вещества, после чего оно подвергается доклиническому изучению других показателей. Прежде всего определяется острая токсичность, т.е. смертельная доза для 50% опытных животных. Затем выясняется субхроническая токсичность в условиях длительного (несколько месяцев) введения лекарственного вещества в терапевтических дозах. При этом наблюдают возможные побочные эффекты и патологические изменения всех систем организма: тератогенность, влияние на репродуктивность и иммунную систему, эмбриотоксичность, мутагенность, канцерогенность, аллергенность и другие вредные побочные действия. После этого этапа лекарственное средство может быть допущено к клиническим испытаниям.
Реклама

На второй стадии - фармакокинетической - изучают судьбу лекарственного вещества в организме: пути его введения и всасывания, распределение в биожидкостях, проникновение через защитные барьеры, доступ к органу-мишени, пути и скорость биотрансформации пути выведения из организма (с мочой, калом, потом и дыханием).
На третьей - фармакодинамической - стадии изучаются проблемы распознавания лекарственного вещества (или его метаболитов) мишенями и их последующего взаимодействия. Мишенями могут служить органы, ткани, клетки, клеточные мембраны, ферменты, нуклеиновые кислоты, регуляторные молекулы (гормоны, витамины, нейромедиаторы и т.д.), а также биорецепторы. Рассматриваются вопросы структурной и стереоспецифичной комплементарности взаимодействующих структур, функционального и химического соответствия лекарственного вещества или метаболита его рецептору. Взаимодействие между лекарственным веществом и рецептором или акцептором, приводящее к активации (стимулированию) или дезактивации (ингибированию) биомишени и сопровождающееся ответом организма в целом, в основном обеспечивается за счет слабых связей – водородных, электростатических, ван-дер-ваальсовых, гидрофобных [5].
1.2 Создание и исследование новых лекарственных средств. Основное направление поиска
Создание новых лекарственных веществ оказалось возможным на основе достижений в области органической и фармацевтической химии, использования физико-химических методов, проведения технологических, биотехнологических и других исследований синтетических и природных соединений.
Общепринятым фундаментом создания теории целенаправленных поисков тех или иных групп лекарственных препаратов является установление связей между фармакологическим действием и физическими особенностями [3].
В настоящее время поиск новых лекарственных средств ведется по следующим основным направлениям.
1. Эмпирическое изучение того или иного вида фармакологической активности различных веществ, полученных химическим путем. В основе этого изучения лежит метод «проб и ошибок», при котором фармакологи берут существующие вещества и определяют с помощью набора фармакологических методик их принадлежность к той или иной фармакологической группе. Затем среди них отбирают наиболее активные вещества и устанавливают степень их фармакологической активности и токсичности по сравнению с существующими лекарственными средствами, которые используются в качестве стандарта.
2. Второе направление состоит в отборе соединений с одним определенным видом фармакологической активности. Это направление получило название направленного изыскания лекарственных средств.
Преимущество этой системы состоит в более быстром отборе фармакологически активных веществ, а недостатком является отсутствие выявления других, может быть весьма ценных видов фармакологической активности.
3. Следующее направление поиска – модификация структур существующих лекарственных средств. Этот путь поиска новых лекарственных средств является теперь весьма распространенным. Химики-синтетики заменяют в существующем соединении один радикал другим, вводят в состав исходной молекулы другие химические элементы или производят иные модификации. Этот путь позволяет увеличить активность лекарственного препарата, сделать его действие более избирательным, а также уменьшить нежелательные стороны действия и его токсичность [4].
Целенаправленный синтез лекарственных веществ означает поиск веществ с заранее заданными фармакологическими свойствами. Синтез новых структур с предполагаемой активностью чаще всего проводится в том классе химических соединений, где уже найдены вещества, обладающие определенной направленностью действия на данный орган или ткань.
Для основного скелета искомого вещества могут быть выбраны также те классы химических соединений, к которым относятся естественные вещества, участвующие в осуществлении функций организма. Целенаправленный синтез фармакологических веществ труднее вести в новых химических классах соединений ввиду отсутствия необходимых первоначальных сведений о связи фармакологической активности со структурой вещества. В этом случае необходимы данные о пользе вещества или элемента.
Далее к избранному основному скелету вещества добавляют различные радикалы, которые будут способствовать растворению вещества в липидах и воде. Синтезируемую структуру целесообразно сделать растворимой одновременно и в воде, и в жирах с той целью, чтобы она могла всосаться в кровь, перейти из нее через гематотканевые барьеры в ткани и клетки и затем вступить в связь с клеточными мембранами или проникнуть через них внутрь клетки и соединиться с молекулами ядра и цитозоля [6].
Целенаправленный синтез лекарственных веществ становится удачным, когда удается найти такую структуру, которая по размеру, форме, пространственному положению, электронно-протонным свойствам и ряду других физико-химических показателей будет соответствовать живой структуре, подлежащей регулированию.
Целенаправленный синтез веществ преследует не только практическую цель - получение новых лекарственных веществ с нужными фармакологическими и биологическими свойствами, но и является одним из методов познания общих и частных закономерностей жизненных процессов. Для построения теоретических обобщений необходимо дальнейшее изучение всех физико-химических характеристик молекулы и выяснение решающих изменений в ее структуре, обусловливающих переход одного вида активности в другой.
Составление комбинированных препаратов является одним из наиболее эффективных путей поиска новых лекарственных средств. Принципы, на основе которых восставляются многокомпонентные лекарственные препараты могут быть различными и изменяются вместе с методологией фармакологии [7]. Разработаны основные принципы и правила составления комбинированных средств.
Чаще всего в комбинированные средства включаются лекарственные вещества, которые оказывают действие на этиологию заболевания и основные звенья патогенеза болезни. В комбинированное средство обычно включаются лекарственные вещества в малых или средних дозах, если между ними существуют явления взаимного усиления действия (потенцирование или суммирование).
Комбинированные средства, составленные с учетом указанных рациональных принципов, отличаются тем, что они вызывают значительный лечебный эффект при отсутствии или минимуме отрицательных явлений. Последнее их свойство обусловлено введением малых доз отдельных ингредиентов. Существенное преимущество малых доз состоит и в том что они не нарушают естественных защитных или компенсаторных механизмов организма.
Комбинированные препараты составляются также и по принципу включения в них таких дополнительных ингредиентов, которые устраняют отрицательное действие основного вещества.
Комбинированные препараты составляются с включением различных корригирующих средств, устраняющих нежелательные свойства основных лекарственных веществ (запах, вкус, раздражение) или регулирующих скорость освобождения лекарственного вещества из лекарственной формы или скорость всасывания его в кровь.
Рациональное составление комбинированных средств позволяет целенаправленно увеличить фармакотерапевтический эффект и устранить или уменьшить возможные отрицательные стороны действия лекарственных средств на организм.
При комбинировании лекарственных средств отдельные компоненты должны быть совместимы между собой в физико-химическом, фармакодинамическом и фармакокинетическом отношениях [8].
1.3 Роль компьютера при создании новых лекарственных средств
Ежегодно химики синтезируют, выделяют и характеризуют от 100 до 200 тысяч новых веществ. Многие из этих веществ проходят первичные испытания на выявление той или иной биологической активности. Этот этап поиска лекарственного вещества называют скринингом. Скрининг проводят в биологических лабораториях на живых клетках, микроорганизмах или кусочках живых тканей, на здоровых или специально задержанных животных: на мышах, крысах, морских свинках, собаках.
При этом из сотен веществ отбираются несколько наиболее активных препаратов, которые затем передаются на углубление испытания. Если высокая активность вещества подтверждается, то его всесторонне изучают для определения токсичности и побочных эффектов, при отсутствии или незначительности которых проводят кинетические испытания на людях.
Считается необходимым, чтобы все новые синтезируемые вещества были подвергнуты первичным испытаниям. Очевидно, что возможность испытать все новые соединения на все новые соединения на все нужные виды активности пока остается малореальной. В настоящее время существует возможность определения потенциала их биоактивности путем компьютерного анализа [1]. Достаточно лишь ввести в компьютер сведения о строении вещества. По окончании компьютерного анализа оператор получает рекомендации о целесообразности или нецелесообразности испытаний данного вещества на тот или иной вид активности. Скрининг экономит время, материалы и силы при аналоговом поиске лекарственных веществ.
В настоящее время также пользуются методом химического модифицирования структуры известных синтетических и природных лекарственных веществ. Этот метод является интуитивным, умозрительным. С его помощью исходя из аналогии двух структур биоактивность известного вещества как бы переносят на новое соединение.
Метод молекулярного моделирования в сочетании с рентгеноструктурным анализом позволяет установить стехереохимические особенности молекулы лекарственного вещества и биорецептора, конфигурацию их хиральных центров, измерить расстояние между отдельными атомами, группами атомов или между зарядами в случае цвиттер-ионных структур лекарства и биорецепторного участка его захвата. Получаемые таким образом данные позволяют более целенаправленно проводить синтезы биоактивных молекул с заданными на молекулярном уровне параметрами. Этот метод был успешно использован в синтезе высокоэффективных анальгетиков – аналогов морфина, а также для получения ряда лекарственных веществ, действующих на центральную нервную систему подобно природному нейромедиатору γ – аминомасляной кислоты. Широкое развитее получил метод комбинаторной химии.
Метод комбинаторной химии возник и стал быстро развиваться в 1990-х годах, как часть общей стратегии открытия новых лекарственных веществ.
Стратегия комбинаторной химии основана на недавней разработке нескольких революционных химических и биологических методов параллельного синтеза и испытания большого числа соединений. Была создана техника, позволяющая синтезировать в растворе или на твердых подложках от сотен до нескольких тысяч новых соединений в день и быстро их тестировать в виде смесей или после выделения индивидуальных веществ. В совокупности с автоматизацией синтез целых семейств вещества требует значительно меньше затрат реагентов при огромном росте производительности [9].
1.4 Молекулярное моделирование с помощью программы
HyperChem
Молекулярное моделирование – сложная сеть различных наук, находящее применение в нанотехнологии, в молекулярной биологии, квантовой химии и биотехнологии.
Молекулярное моделирование молодая, востребованная и бурно развивающаяся наука.
На сегодняшний день методы квантовой химии и молекулярной динамики получили широкое распространение в численном моделировании электронной и атомной структур сложных систем молекулярных, кристаллических и переходных размеров. Это связано с технологическим развитием соответствующего математического обеспечения. Сейчас в мире функционирует достаточно много современных вычислительных комплексов, реализующих методы квантовой химии и молекулярной динамики. Использование многих из этих методов обеспечивается программой Hyper Chem для молекулярного моделирования.
HyperChem - комплексный программный продукт, предназначенный для задач молекулярного моделирования. Он включает в себя программы, реализующие методы молекулярной механики, квантовой химии и молекулярной динамики. Силовые поля, которые могут использоваться в HyperChem - это ММ+ (на базе ММ2), Amber, OPLS и BIO+ (на базе CHARMM). Реализованы полуэмпирические методы: расширенный метод Хюккеля, CNDO, INDO, MINDO/3, MNDO, AM1, PM3, ZINDO/1, ZINDO/S, а также возможности проведения неэмпирических расчетов и по теории возмущений Меллера-Плессета второго порядка.
HyperChem обладает развитыми средствами визуализации, которые могут использоваться как при подготовке входной информации (структуры молекулы), так и при анализе результатов, например, рассчитанных характеристик ИК- и УФ- спектров.
Расчётные методы оказывают неоценимую помощь в создании лекарственных средств. Молекулярное моделирование входит во все области знаний и находит себе применение, порой играя одну из главных ролей. Некоторые области химии немыслимы без молекулярного моделирования. В развитых странах моделирование является современным методом изучения микроструктур.
В настоящее время для изучения реакционной способности молекул используются приближения CNDO/2, MNDO, AM1, PM3.
Метод CNDO основан на приближении нулевого дифференциального перекрывания и поэтому является одним из простейших полуэмпирических методов. Из этого факта следуют ограничения применимости метода, который из-за обедненной расчетной схемы недостаточно корректно воспроизводит многие эффекты. С появлением более совершенных версий полуэмпирических методов МО приближение CNDO все реже применяется на практике. Так, в версии 7 программного продукта МОРАС данный метод не представлен. Тем не менее, во многих случаях для быстрой оценки электронных параметров полезно использовать схему CNDO, так как вследствие резкого уменьшения количества рассчитываемых интегралов с помощью этого метода можно исследовать более сложные объекты. В целом CNDO/2 дает надежные результаты при расчете электронных распределений и свойств, зависящих от них.
Основным калибровочным параметром в CNDO является резонансный интеграл. Он подбирается так, чтобы относительный порядок энергетических уровней занятых МО и коэффициенты разложения МО в ЛKAO наилучшим образом совпали с расчетами ab initio соединений обучающей выборки.
Общим достоинством всех перечисленных версий является прежде всего сравнительно малое время расчетов и меньшие размеры занимаемой оперативной памяти по сравнению с более точными приближениями. Это дает возможность как для быстрой оценки исследуемых объектов, так и для изучения более сложных молекул, требующих длительного времени расчета и больших объемов оперативной памяти. В целом приближение CNDO хорошо описывает электростатические эффекты и полярность связи. CNDO/2 может применяться для расчета дипольных моментов и зарядов по схеме Малликена и оценки равновесной геометрии.
Недостатки приближения CNDO являются следствием усечения расчетной схемы, которая не учитывает взаимодействия между перекрываниями орбитальных зарядов. В результате многие эффекты не воспроизводятся.
Метод MNDO был разработан на основе более строгого и сложного приближения NDDO. Это позволило существенно улучшить результаты расчетов при решении многих задач. Длительное время метод рассматривался в качестве основного полуэмпирического метода квантовой химии. Его возможности позволили с достаточной степенью надежности рассчитывать физико-химические свойства, электронные структуры и реакционную способность множества молекулярных систем.
Преимущество заключается в быстродействии (по сравнению с неэмпирическими методами) программ, в которых реализована схема MNDO. Это позволяет применять ее для исследования все более сложных объектов. Недостатки связаны с тем, что точность метода не может превышать точность тех экспериментальных данных, по которым проводилась параметризация.
В схеме MNDO используются 3 вида параметров.
Во-первых, варьируемые параметры, значения которых определяют с помощью оптимизационной процедуры.
Во-вторых, одноцентровые двухэлектронные интегралы, оценивающиеся из спектроскопических данных.
В-третьих, ряд зависимых параметров, необходимых для расчета двухцентровых двухэлектронных интегралов, оценивающиеся с помощью эмпирических схем.
В настоящее время область применения метода MNDO достаточно изучена. Зная особенности расчетной схемы MNDO, его преимущества и недостатки можно с успехом применять метод для решения многих задач.
Хотя в целом метод MNDO имеет существенные преимущества перед СNDO, в некоторых случаях метод дает серьезные сбои. Это в первую очередь касается расчетов молекул с водородными связями, барьеров внутреннего вращения в p-сопряженных системах и расчетов четырехчленных циклов. Поэтому в рамках метода MNDO были разработаны модифицированные варианты.
Для расчета характеристик систем с водородными связями были разработаны методы MNDO/Н и MNDO/М, которые лучше воспроизводят экспериментальные значения энергии водородных связей в комплексах.
Удовлетворительное описание водородных связей позволило широко использовать модифицированные варианты для исследования биологических объектов.
Таким образом, полуэмпирические квантовохимические методы можно использовать с большим практическим выходом для изучения реакционной способности различных химических соединений.
| Достоинства метода MNDO
|
Недостатки метода MNDO
|
| 1.Быстродействующий метод, позволяющий изучать строение и свойства сложных молекул.
2.Учитывается ориентация р-орбиталей и правильно описывается отталкивание неподеленных электронных пар.
3.Значительное расширение круга доступных для расчета соединений.
4.Более корректное описание последовательности верхних молекулярных уровней.
5.Может использоваться для интерпретации фотоэлектронных спектров.
6.Преимущества проявляются в большей степени в расчетах более полярных молекул.
7.Удовлетворительно описывается строение радикалов, дает разумные результаты для катионов органических соединений.
8.Более точно рассчитываются валентные углы.
9.Более надежный расчет частот колебаний, протонных эффектов и электронного сродства.
10.При изучении химических реакций правильно описывается ППЭ и ПС.
|
1.Точность метода не может превышать точности экспериментальных данных.
2.Электронная корреляция учитывается дважды. Правильнее было бы внесение корреляционных поправок.
3.Недооцениваются эффекты взаимодействия через пространство.
4.Ограничения возможности расчета соединений третьего и более высоких периодов (в частности с SO и SO2-группами) вследствии пренебрежения d-орбиталями.
5.Некорректное описание водородных связей.
6.Неверен расчет барьеров внутреннего вращения в сопряженных молекулах.
7.Недооценивается энергия трехцентровых связей.
8.Неудовлетворительная оценка спиновых плотностей и констант сверхтонкого расщепления электронного парамагнитного резонанса.
9.Завышается стабильность радикалов.
10.Потенциалы ионизации атомов III периода с сильно выраженным S-характером завышены вследствие применения приближения замороженного остова.
11.Плохо воспроизводится спиновая плотность в радикалах.
12.Энтальпия одноатомных ионов может значительно отличаться от экспериментальных данных.
13.Ограниченная воспроизводимость свойств неорганических молекул. Ошибка расчета составляет для энтальпии - 10 ккал/моль, потенциала ионизации - 1 эВ, длин связей - 0,07A
|
1.5 Определение спектра биологической активности с помощью программы
PASS
C
&
T
(
Prediction
of
Activity
Spectra
for
Substances
:
Complex
&
Training
)
Современная версия компьютерной системы предсказания спектра биологической активности PASS C&T
(P
rediction of A
ctivity S
pectra for S
ubstances: C
omplex & T
raining) реализована в 1998 году. Она включает в себя обучающую выборку, содержащую более 45000 биологически активных веществ с известной биологической активностью, и охватывает более 400 фармакологических эффектов, механизмов действия, а также мутагенность, канцерогенность, тератогенность и эмбриотоксичность.
Работа PASS основана на анализе зависимостей «структура-активность» для веществ из обучающей выборки, содержащей более 45000 разнообразных биологически активных веществ (субстанции известных лекарственных препаратов и фармакологически активные соединения). Обучающая выборка постоянно пополняется новой информацией о биологически активных веществах, отбираемой как из публикаций в научно-технической литературе, так и из многочисленных баз данных. Химическая структура представлена в PASS в виде оригинальных MNA дескрипторов (Mulilevel Neighbourhoods of Atoms). MNA дескрипторы имеют универсальный характер и с достаточно хорошей точностью описывают разнообразные зависимости «структура-свойство». Используемый в PASS математический алгоритм был отобран путем целенаправленного анализа и сравнения эффективности для решения подобных задач большого числа различных методов. Показано, что данный алгоритм обеспечивает получение устойчивых в статистическом смысле зависимостей “структура-активность” и, соответственно, результатов прогноза. Это очень важно, поскольку включенные в обучающую выборку данные всегда обладают определенной неполнотой как в отношении охвата всех химических классов веществ, имеющих конкретный вид активности, так и в отношении изученности каждого отдельного вещества на все возможные виды активности. Средняя точность прогноза при скользящем контроле составляет свыше 85%. Скользящий контроль проводится следующим образом: из обучающей выборки поочередно удаляется одно вещество и для него делается прогноз на основе анализа оставшейся части обучающей выборки, результат сравнивается с известными экспериментальными данными. Процедура повторяется итеракивно для каждого из веществ и рассчитывается средняя точность прогноза. Точность прогноза в 85% достаточна для практического применения системы PASS с целью прогноза спектра биологической активности новых веществ, поскольку ожидаемая вероятность случайного угадывания одного из 780 видов активности составляет около 0.1% [10].
Результаты прогноза выдаются пользователю в виде списка названий вероятных видов активности с расчетными оценками вероятностей наличия (Pa) и отсутствия каждого вида активности (Pi), которые имеют значения от 0 до 1. Эти вероятности рассчитываются независимо по подвыборкам активных и неактивных соединений, и поэтому их сумма не равна единице. Pa и Pi интерпретируются как оценки меры принадлежности вещества к классам активных и неактивных соединений соответственно, либо как оценки ошибок первого и второго рода. Чем больше для конкретной активности величина Pa и чем меньше величина Pi, тем больше шанс обнаружить данную активность в эксперименте. Если при анализе прогнозируемого списка активностей для исследования выбираются те виды активности, для которых Pa>90%, то мы рискуем пропустить около 90% действительно активных соединений, но вероятность ложноположительных прогнозов при этом ничтожно мала; для Pa>80% - пропустим уже только 80% активных соединений, но и вероятность ложноположительных прогнозов будет выше, наконец, для Pa>Pi вероятности ошибок первого и второго рода равны [1, 9, 10].
На практике, однако, при отборе для исследования наиболее перспективных веществ руководствуются и другими критериями, например, критерием новизны. При этом исходят из того, что чем ближе значение Pa к единице, тем более вероятно, что вещество является близким аналогом известного препарата. Поэтому, если целью исследователя является выявление соединений с достаточно высоким уровнем новизны (New Chemical Entity, NCE), то надо выбирать вещества, для которых величина прогнозируемой вероятности Pa для требуемого вида активности несколько ниже, например, 0,5<PA< NCE.
Базируясь на данных компьютерного прогноза, исследователь может:
· определить, какие тесты наиболее адекватны для изучения биологической активности конкретного химического соединения.
· обнаружить новые эффекты и механизмы действия для ранее изученных веществ;
· отобрать наиболее вероятные базовые структуры новых лекарств с требуемым биологическим действием среди доступных для скрининга химических соединений.
Система PASS позволяет получить прогноз спектра биологической активности 1000 веществ на обычном персональном компьютере менее чем за одну минуту. Поскольку прогноз выполняется по структурной формуле вещества, он может быть выполнен уже на стадии планирования синтеза [11].
Применимость PASS для решения практических задач продемонстрирована в многочисленных экспериментах. Прогнозируемые виды активности подтверждены для веществ различных химических классов, проявляющих разнообразные эффекты: противобактериальный, антиаритмический, противоопухолевый, гепатопротекторный, антиамнестический, противоспалительный, антиоксидантный и др.
С применением PASS при поддержке гранта CRDF (RC1-2064) был выполнен прогноз спектра биологической активности для 250000 химических соединений.
Кроме того, если, наряду с основным действием, известен перечень нежелательных побочных эффектов, то при отборе перспективных для исследований соединений можно руководствоваться комбинированным критерием:
· наличие в прогнозируемом спектре требуемых эффектов/механизмов;
· отсутствие нежелательных эффектов/механизмов.
Естественно, что при рассмотрении всего списка, включающего свыше 400 прогнозируемых PASS C&T
видов активности, можно составить большое количество комбинаций из требуемых и нежелательных эффектов.
Для их анализа сотрудник Лаборатории структурно-функционального конструирования лекарств НИИ Биомедхимии РАМН А. А. Лагунин разработал специальную компьютерную систему интерпретации спектров биологической активности веществ IBIAC
, основанную на знаниях об известных взаимосвязях между фармакологическими эффектами и механизмом действия биологически активных веществ (более 2000 терминов, описывающих биологическую активность).
С использованием системы IBIAC
генерация перечня эффектов, соответствующих определенному механизму действия и, наоборот, списка вероятных механизмов, ответственных за проявление определенного эффекта, осуществляется автоматически [12].
Поскольку прогноз спектра биологической активности осуществляется на основе структурной формулы химического соединения, он может быть выполнен уже на этапе планирования синтеза.
В итоге будут синтезированы лишь некоторые из теоретически возможных производных, в наибольшей степени удовлетворяющие критериям задачи.
Необходимо отметить, что прогноз спектра биологической активности возможен для низкомолекулярных органических (drug-like) соединений, структура которых не отличается принципиально от веществ обучающей выборки. Не имеет смысла прогноз для синтетических и биополимеров, для неорганических веществ и т.п [13, 14, 15, 16].
1.6 Местноанестезирующие средства
Несмотря на достижения современной анестезии, продолжаются поиски менее опасных средств для наркоза, разработка различных вариантов многокомпонентного избирательного наркоза, позволяющего значительно снизить дозы используемых средств, уменьшить их токсичность и побочные отрицательные влияния. Известно, что местноанестезирующие средства понижают чувствительность окончаний афферентных нервных волокон, и угнетают проведения возбуждения по нервным волокнам. Вызывают местную потерю чувствительности. И в первую очередь они устраняют чувство боли, в связи с чем их используют главным образом для местного обезболивания (анестезии) [17].
К анестезирующим средствам предъявляют определенные требования. Прежде всего они должны иметь высокую избирательность действия, не оказывая отрицательного влияния ни на нервные элементы, ни на окружающие ткани. Короткий латентный период, высокая эффективность при разных видах местной анестезии, определенная продолжительность действия. Желательно, чтобы они сужали кровеносные сосуды. Это существенный момент, так как сужение сосудов усиливает анестезию, понижает кровотечение из тканей, а так же уменьшает возможность токсических эффектов задерживая всасывание анестетика. Так же к числу важных характеристик относятся низкая токсичность и минимальные побочные эффекты.
В настоящее время в медицинской практике используется множество местноанестезирующих веществ с различной степенью активности и разной продолжительностью действия.
По применения в клинической практике местные анестетики подразделяются на:
1) средства, применяемые только для поверхностной анестезии: кокаин, дикаин (тетракаин), бензокаин (анестезин), бупивакаин (пиромекаин);
2) средства, применяемые для инфильтрационной и проводниковой анестезии: новокаин (прокаин), тримекаин, бутивокаин, изокаин, ультракаин.
3) средства, применяемые для всех видов анестезии: лидокаин (кскаин).
По химическому строению местноанестезирующие вещества можно разделить на две группы:
1) сложные эфиры: кокаин, дикаин, бензокаин, прокаин;
2) замещенные амиды кислот: лидокаин, тримекаин, бупивакаин, булекаин.
Дикаин применяется для поверхностной анестезии. Под влиянием местных анестетиков в окончании нерва и в самом нерве прекращается электрохимический процесс, осуществляющий передвижение ионов через мембрану и распространение нервных импульсов. Область окончания чувствительных нервов находится под регулирующим влиянием системы медиаторных рецепторов, синергентное взаимодействие, которых обеспечивает более эффективное развитее торможения.
Так же известно, что в присутствии противогистаминных средств (димедрол), м
– холиноблокаторов (атропин) и адренанила усиливается местноанестезирующий эффект [18].
Дикаин представляет собой 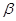 - диметиламиноэтиловй эфир п – бутиламинобензойной кислоты гидрохлорид). - диметиламиноэтиловй эфир п – бутиламинобензойной кислоты гидрохлорид).
Работая над компьютерным дизайном местноанестезирующего препарата дикаин, был проведен информационный анализ данного препарата по сравнению с другими средствами, такими как бензокаин (анестезин), бумекаин. В ходе анализа было установлено, что дикаин является эффективным местноанестезирующим средством, значительно превосходящим по активности кокаин (примерно в 10 раз), он также превосходит кокаин по токсичности (в 2-5 раз).
Применяют дикаин в глазной практике в виде 0,1 % раствора при измерении внутриглазного давления, в виде 0,25-1% или 2% раствора при удалении инородных тел. Дикаин в отличие от кокаина не влияет на внутриглазное давление, не расширяет зрачки. При необходимости длительной анестезии используют глазные пленки с дикаином (0,75 см) изготовленные на основе биорастворимого полимера.
Анестезиофорной группой является диалкиламиноацетанилид. Расстояние между 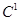 и и 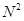 атомами определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие. В структуру молекулы дикаина входит фрагмент биогенного вещества коламина, производные которого оказывают противогистаминный эффект. Дикаин активнее анестезина и новокаина, но токсичнее их в несколько раз. В проведении дальнейшего анализа были предложены варианты новых структур для компьютерного анализа. атомами определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие. В структуру молекулы дикаина входит фрагмент биогенного вещества коламина, производные которого оказывают противогистаминный эффект. Дикаин активнее анестезина и новокаина, но токсичнее их в несколько раз. В проведении дальнейшего анализа были предложены варианты новых структур для компьютерного анализа.
2. Методическая часть
2.1 Характеристика объекта исследования
Температура плавления 147-150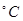 . Соединение представляет белый кристаллический порошок без запаха. Легко растворим в воде и спирте. Дикаин сильное местноанестезирующее средство, обладающее высокой токсичностью. Применяют в глазной и оториноларингологической практике при некоторых оперативных вмешательствах, а также для анестезии. . Соединение представляет белый кристаллический порошок без запаха. Легко растворим в воде и спирте. Дикаин сильное местноанестезирующее средство, обладающее высокой токсичностью. Применяют в глазной и оториноларингологической практике при некоторых оперативных вмешательствах, а также для анестезии.
2.1.
1
Характеристика приборов
Методы исследования проводили с помощью программы Hyper Chem.
2.1.
2
Методика выполнения
Построить молекулы при помощи программы HyperChem.
Последовательность действия:
1. Запуск программы Hyper Chem.
2. Создание молекулы:
- мышь устанавливают на пункт меню “Build”, щелчком по левой кнопке разворачивают меню и выбирают “Default atoms”;
- устанавливают указатель курсора в режиме построения молекулярных моделей; для этого в верхней строчке выбирают необходимый вид курсора и щелкают левой кнопкой мышки;
- в развёрнутой на экране периодической таблице выбирают интересующий атом;
- связь между атомами обозначают, нажимая левую кнопку мыши в положение одного из атомов, и, удерживая ее, передвигают курсор к другому атому; затем кнопку отпускают, типы связей задают. Полуторные связи ароматического кольца обозначаются пунктирной линией. Их можно нарисовать при помощи двойного L-щелчка вблизи одной из внутренних сторон кольца;
- построенную модель автоматически дополняют атомами водорода; для этого мышь устанавливают на пункт меню “Build”, щелчком по левой кнопке разворачивают меню и выбирают “Add Hydrogens”.
- для устранения неточностей выполненного рисунка мышь устанавливают на пункт меню “Build”, щелчком по левой кнопке разворачивают меню и выбирают “Model build”; данная команда корректирует межатомные расстояния и углы.
С помощью программы Нурег Chem:
- курсор мыши устанавливают на пункт меню "Setup", выбирают метод молекулярной механики), устанавливают "ММ";
- запускают процесс оптимизации геометрии путем выбора пункта меню "Compute", далее выбирают "Geometry Optimize";
Определение геометрических характеристик (длин связей и валентных углов):
- выбирают курсор в виде двух концентрических окружностей, ставят этот курсор на один из интересующих атомов, нажимают левую кнопку мыши и, не отпуская ее, подводят курсор к следующему атому (для измерения длины связи) или к атому, находящемуся через один от исходного (для измерения величины валентного угла); затем кнопку отпускают.
В нижней строке экрана появится значение длины связи (Е) или валентного угла (град.).
- в пункте меню "File, выбирают "Start Log" (создание файла отчета); файлу дают название и устанавливают "Quantum print level" = 9;
- в пункте меню "Setup", выбирают "Semiempirical methods"; в раскрывшемся окошечке устанавливают "MNDO";
- устанавливают соответствующий заряд и мультиплетность в соответствующих полях;
- запускают процесс расчета с оптимизацией геометрии путем выбора пункта меню "Compute", выбирают "Geometry Optimize";
- расчет заканчивается, когда в нижней строке окна появляется надпись Conv=YES"- закрывают файл отчета (.log file) путем выбора пункта меню "File", выбирают "Stop Log".
Графическое изображение ВЗМО и НВМО.
- для получения графического изображения молекулярной орбитали выбирают пункт меню "Compute", выбирают "Orbitals";
- выбирают номер нужной молекулярной орбитали, и устанавливают "3D";
- полученную картинку можно скопировать, используя пункт меню "Edit" и далее "Copy image".
- выбирают пункт меню "Compute", затем "Plot molecular properties";
- выбирают "electrostatic potencial" и устанавливают "3D". Положительный знак электростатического потенциала отображается зеленым цветом. В области неподеленных пар на атомах азота, кислорода и др. электростатический потенциал отрицательный, что отображается красным цветом.
- выделить в нарисованной молекуле связь;
- в меню Comput и выбрать пункт Potencial;
- задать начальную(Initial Bond Angle), конечную(Final Bond Angl) длины связи и шаг (Step) с которым будут автоматически производиться расчеты.
-после расчетов машина построит на экране график изменения потенциальной энергии выбранной связи от величины растяжения.
2.2 Определение биологической активности молекул с помощью программы
PASS
2.2.
1
Методика выполнения
Построить молекулы при помощи программы Isis Draw.
Последовательность действия:
1. Запуск программы Isis Draw.
2. Создание молекулы:
- мышь устанавливают на клавишу “Single Bound” для того, что бы изобразить фрагмент связи;
- устанавливают указатель курсора на клавишу “Atom” для того, что бы выбирать интересующий атом;
- построенную модель сохраняют, устанавливая курсор на пункт меню “File”, затем “Export”, устанавливают на “Molfile” и сохраняют в директорию Isis Draw.
Последовательность действия:
1. Запуск программы PASS.
2. Исследование биологической активности:
- мышь устанавливают на пункт меню “File”, затем “Open Base” выбираем “passdemo.SAR” и нажимаем “Открыть”;
- устанавливают указатель курсора на клавишу “Predict and Save Prediction as Text files”, тип файлов выбираем “mol”, нажимаем “Открыть”, затем сохраняем как “txt”, открываем сохраненный файл и изучаем биологическую активность.
3. Результаты эксперимента и их обсуждение
3.1 Разработка новых молекулярных структур на основе дикаина
Несмотря на достижения современной анестезии, продолжаются поиски менее опасных средств для наркоза, разработка различных вариантов многокомпонентного избирательного наркоза, позволяющего значительно снизить дозы используемых средств, уменьшить их токсичность и побочные отрицательные влияния [19]. В последнее время методы компьютерного моделирования все более входят в практику технологии создания новых синтетических лекарственных веществ [9]. Этот подход позволяет установить стехиометрические особенности молекулы лекарственного соединения, измерить расстояние между отдельными атомами, определить потенциал биоактивности, комплементарность взаимодействия с биорецепторным участком. Получаемые таким образом данные позволяют более целенаправленно проводить синтезы биоактивных молекул с заданными на молекулярном уровне параметрами, что значительно экономит время, материалы и силы при аналоговом поиске лекарственных веществ.
Дикаин применяется для поверхностной анестезии. Под влиянием местных анестетиков в окончании нерва и в самом нерве прекращается электрохимический процесс, осуществляющий передвижение ионов через мембрану и распространение нервных импульсов. Область окончания чувствительных нервов находится под регулирующим влиянием системы медиаторных рецепторов, синергентное взаимодействие, которых обеспечивает более эффективное развитие торможения. Известно, что в присутствии противогистаминных средств (димедрол), м-
холиноблокаторов (атропин) и адреналина усиливается местноанестезирующий эффект [20].
Дикаин относится к классу сложных эфиров п
-аминобензойной кислоты (β-диметиламиноэтиловый эфир п
-бутиламинобеизойной кислоты гидрохлорид) [8].
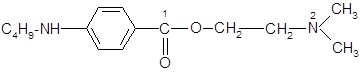
Анестезиофорной группой является диалкиламиноацетанилид. Расстояние между 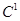 и и 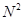 атомами определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие. В структуру молекулы дикаина входит фрагмент биогенного вещества коламина (2-аминоэтанола), производные которого оказывают противогистаминный эффект. Дикаин активнее своих аналогов (анестезина и новокаина), но и токсичнее их в несколько раз. Его используют главным образом в глазной и оториноларингологической практике. атомами определяет двухточечный контакт молекулы дикаина с рецептором через диполь-дипольное и ионное взаимодействие. В структуру молекулы дикаина входит фрагмент биогенного вещества коламина (2-аминоэтанола), производные которого оказывают противогистаминный эффект. Дикаин активнее своих аналогов (анестезина и новокаина), но и токсичнее их в несколько раз. Его используют главным образом в глазной и оториноларингологической практике.
Нами предложены варианты новых структур для компьютерного дизайна молекулы дикаина с целью снижения его токсичности с сохранением или даже усилением анестезирующих свойств.
Введение в бензольное кольцо «облагораживающей» карбоксильной группы и замена диметиламиногруппы на более фармакоактивную диэтиланиногруппу позволит снизить токсичность соединения, облегчить гидролиз сложноэфирной связи с высвобождением антигистаминного фрагмента - диэтиламиноэтанола.
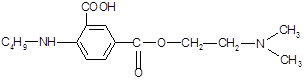
Алифатический радикал н
-бутил в структуре дикаина усиливает фармакологический эффект. При замене его на адреналиновый фрагмент ожидается получить более яркое анестезирующее действие.
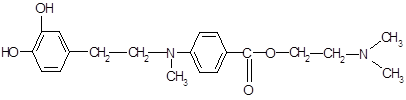
К настоящему времени известно, что биологические системы не делают различия между плоскими кольцами, поэтому при замене ароматической основы н
-аминобензойной кислоты на никотиновую (или изоникотиновую) кислоту изменяется полярность молекулы, облегчается задача введения различных заместителей в ароматическое кольцо. К тому же, аминопроизводные никотиновой кислоты (кордиамин) являются стимуляторами центральной нервной системы.
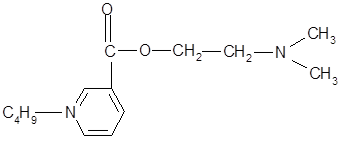
Один из наиболее эффективных анестетиков, промедол, содержит в структуре вместо ароматического пиридинового кольца пиперидиновое, что является предпосылкой для модификации молекулы дикаина.
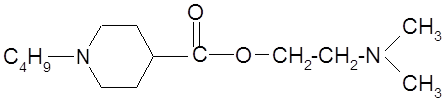
3.2 Результаты исследований с помощью программы
HyperChem
Таблица 1
| Длина связи или валентный угол
|
Данные ММ расчёта
|
Данные MNDO расчёта
|
Справочные величины
|
| С1-С2
С2-С3
С3-С4
С4-N5
N5-C6
C6-C7
C7-C9
C9-C11
C10-C11
C8-C10
C6-C8
C11-C12
C12-O13
C12-O14
O14-C15
C15-C16
C16-N17
N17-C19
N17-C18
C1-C2-C3
С2-С3-С4
C3-C4-N5
N5-C6-C8
N5-C6-C7
C6-C7-C9
C7-C9-C11
C9-C11-C10
C11-C10-C8
C10-C8-C6
C8-C6-C7
C9-C11-C12
C10-C11-C12
C12-O14-C15
O14-C15-C16
C15-C16-N17
C16-N17-C18
C16-N17-C19
C18-N17-C19
|
1,53442
1,53705
1,53626
1,44712
1,35045
1,34373
1,34335
1,34525
1,3446
1,34261
1,34354
1,36294
1,21202
1,35065
1,40995
1.53635
1,45672
1,45174
1,45291
111,792
113,518
109,67
118,219
123,605
120,397
120,124
119,658
119,913
120,666
119,242
119,948
122,115
118,556
107,759
113,916
111,47
113,282
111,148
|
1,53158
1,54128
1,54862
1,46777
1,41076
1,41935
1,40351
1,41482
1,41571
1,40009
1,42528
1,49637
1,22988
1,36302
1,41167
1,56222
1,47112
1,46359
1,46386
114,547
113,518
111,073
118,219
123,605
120,589
121,461
117,898
121,164
120,879
117,974
119,948
122,115
124,819
107,759
109,436
116,806
117,015
116,056
|
1,534
1,536
1,539
1,456
1,411
1,393
1,355
1,381
1,392
1,356
1,352
1,383
1,218
1,386
1,382
1,559
1,493
1,432
1,451
113,125
113,529
110,053
118,953
123,983
120,159
120,956
118,241
120,971
120,264
118,325
119,948
122,233
121,179
107,563
110,563
115,963
115,912
116,023
|
Сравнивая полученные результаты, оба метода имеют небольшие отклонения по сравнению со стандартными данными.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи C16-N17.
Исследуемая связь между атомами C16-N17. Задаём начальные величины начальная длина связи 0,971; конечная длина связи 2,971; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи C16-N17 от величины растяжения.
Изменение потенциальной энергии углового напряжения C3-C4-C5.
Исследуем угол между атомами C3-C4-C5. Задаём начальные величины начальный угол 80; конечный 140; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Таблица 2
| Длина связи или валентный угол
|
Данные ММ расчёта
|
Данные MNDO расчёта
|
Справочные величины
|
| C1-C2
C2-C3
C3-C4
C4-N5
N5-C6
C6-C7
C7-C9
C9-C10
C10-C11
C11-C8
C6-C8
C7-C12
C12-O13
C12-O14
C10-C15
C15-O16
C15-O17
O17-C18
C18-C19
C19-N20
N20-C23
C23-C24
N20-C21
C21-C22
C1-C2-C3
C2-C3-C4
C3-C4-N5
C4-N5-C6
N5-C6-C7
N5-C6-C8
C6-C7-C12
C7-C12-O13
C7-C12-O14
C6-C7-C9
C7-C9-C10
C9-C10-C11
C10-C11-C8
C6-C8-C11
C8-C6-C7
C11-C10-C15
C9-C10-C15
C10-C15-O16
C10-C15-O17
O16-C15-O17
C15-O17-C18
O17-C18-C19
C18-C19-N20
C19-N20-C21
C19-N20-C23
N20-C23-C24
N20-C21-C22
|
1,53446
1,53687
1,53769
1,46773
1,35455
1,34989
1,34842
1,3461
1,34288
1,34136
1,34515
1,36573
1,20944
1,33807
1,36377
1,21204
1,35143
1,41104
1,53791
1,46268
1,45983
1,53447
1,46076
1,53704
111,785
112,138
110,841
116,92
124,692
115,847
123,329
123,901
121,905
119,209
120,947
119,665
119,499
121,203
119,456
119,282
121,051
119,494
121,218
119,22
118,218
108,252
114,762
111,29
111,699
116,769
113,058
|
1,53154
1,54091
1,5495
1,47515
1,43364
1,423
1,41348
1,41233
1,41258
1,40248
1,41671
1,50204
1,22891
1,35818
1,50134
1,22774
1,35955
1,41312
1,5631
1,47233
1,47481
1,53447
1,47478
1,53801
111,785
113,622
110,841
119,144
118,391
122,522
121,784
126,174
144,416
119,516
121,22
118,829
120,542
120,848
118,99
121,044
120,117
125,793
113,418
120,418
125,334
107,378
110,057
116,349
116,243
112,593
112,593
|
1,532
1,539
1,544
1,483
1,423
1,312
1,342
1,401
1,362
1,341
1,395
1,502
1,211
1,348
1,551
1,221
1,355
1,413
1,531
1,452
1,453
1,534
1,460
1,538
111,785
112,953
110,841
117,526
117,318
117,286
122,463
123,901
144,411
119,291
121,231
118,973
119,513
121,203
119,361
120,964
121,051
120,169
119,432
120,111
119,213
107,314
112,953
113,561
114,246
111,548
112,987
|
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи C6-С11.
Исследуемая связь между атомами C6-С11. Задаём начальные величины начальная длина связи 1,037; конечная длина связи 3,037; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи C6-C11 от величины растяжения.
Изменение потенциальной энергии углового напряжения C6-C11-O14.
Исследуем угол между атомами C6-C11-O14. Задаём начальные величины начальный угол 90; конечный 150; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Объектом является химическое соединение.
Таблица 3
| Длина связи или валентный угол
|
Данные ММ расчёта
|
Данные MNDO расчёта
|
Справочные величины
|
| O1-C2
C2-C3
C3-C4
C4-C5
C5-C7
C6-C7
C2-C6
C3-O8
C5-C9
C9-C10
C10-N11
N11-C12
N11-C13
C13-C14
C14-C15
C15-C16
C16-C18
C17-C18
C13-C17
C16-C19
C19-C20
C19-O21
O21-C22
C22-C23
C23-N24
N24-C25
N24-C26
O1-C2-C6
O2-C2-C3
C2-C3-C4
C3-C4-C5
C4-C5-C7
C5-C7-C6
C2-C6-C7
C3-C2-C6
O8-C3-C2
O8-C3-C4
C4-C5-C9
C7-C5-C9
C5-C9-C10
C9-C10-N11
C10-N11-C12
C13-N11-C12
C14-C13-N11
C17-C13-N11
C13-C14-C15
C14-C15-C19
C15-C16-C18
C16-C18-C17
C13-C17-C18
C17-C13-C14
C19-C16-C18
C19-C16-C15
O20-C19-C16
O21-C19-C16
O20-C19-O21
C19-O21-C22
O21-C22-C23
C22-C23-N24
C23-N24-C25
C23-N24-C26
C25-N24-C26
|
1,36051
1,34612
1,34441
1,3441
1,34399
1,34099
1,34297
1,36079
1,51602
1,54091
1,46417
1,45765
1,35257
1,3425
1,34235
1,34536
1,34524
1,34278
1,34206
1,36228
1,21202
1,35004
1,4099
1,53786
1,45675
1,45323
1,45163
120,802
120,483
119,222
122,579
117,432
120,669
121,368
118,714
120,184
120,594
121,181
121,385
115,402
114,762
123,704
116,621
120,198
119,72
120,071
119,877
120,004
119,927
120,013
120,082
119,383
120,612
119,581
120,826
119,469
119,174
110,679
113,688
111,433
113,311
111,143
|
1,35748
1,43712
1,4148
1,41582
1,41064
1,4048
1,41425
1,35924
1,51423
1,55179
1,47428
1,47004
1,43737
1,41646
1,40524
1,41186
1,41199
1,4048
1,41809
1,501
1,22707
1,36061
1,41166
1,5624
1,47048
1,46449
1,46417
123,264
118,062
119,488
121,583
118,032
121,572
120,637
118,674
117,63
122,882
121
120,916
117,262
113,931
116,04
114,642
123,731
117,39
120,376
120,696
118,949
120,676
120,373
118,878
120,928
120,123
126,438
112,643
120,919
125,616
107,249
109,754
116,591
116,835
115,996
|
1,359
1,381
1,368
1,388
1,347
1,358
1,413
1,362
1,514
1,551
1,469
1,462
1,395
1,561
1,395
1,354
1,456
1,400
1,346
1,447
1,210
1,369
1,469
1,537
1,475
1,462
1,495
122,645
119,472
119,265
121,583
117,463
120,873
121,145
118,714
118,139
121,246
121,012
121,213
114,786
113,746
122,612
115,621
120,198
118,365
120,376
120,519
119,789
120,581
120,373
120,566
120,491
120,573
122,469
117,721
120,651
123,125
108,452
110,956
117,854
114,651
113,786
|
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи N11-С13.
Исследуемая связь между атомами N11-С13. Задаём начальные величины начальная длина связи 2,36; конечная длина связи 5,666; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи N11-С13 от величины растяжения.
Изменение потенциальной энергии углового напряжения C19-О21-С22.
Исследуем угол между атомами C19-О21-С22. Задаём начальные величины начальный угол 70; конечный 130; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Оптимизация геометрии и расчёт параметров молекулы методом молекулярной механики (ММ+ и MNDO метод).
Таблица 4
| Длина связи или валентный угол
|
Данные ММ расчёта
|
Данные MNDO расчёта
|
Справочные величины
|
| С1-С2
С2-С3
С3-С4
С4-N5
N5-C6
C6-C7
C7-C8
C41-C8
C9-C41
C5-C9
C7-C10
C10-O11
C10-O12
O12-C13
C13-C14
C14-N15
N15-C16
N15-C17
C1-C1-C3
C2-C3-C4
C3-C4-N5
C4-N5-C6
C4-N5-C9
N5-C6-C7
C6-C7-C8
C7-C8-C41
C8-C41-C9
C41-C9-N5
C9-N5-C6
C6-C7-C10
C8-C7-C10
C7-C10-C11
C7-C10-O12
C10-O12-O13
O12-C13-C14
C13-C14-N15
C14-N15-C16
C14-N15-C17
C16-N15-C17
|
1,53455
1,53762
1,5369
1,468
1,45685
1,5104
1,34294
1,34042
1,33896
1,35217
1,36168
1,21147
1,34976
1,41025
1,53651
1,45706
1,45297
1,4518
111,892
111,685
111,781
122,06
119,167
114,299
120,314
120,526
122,338
123,23
118,447
121,465
118,218
117,423
122,29
118,494
107,986
113,797
111,518
113,334
111,185
|
1,53153
1,54118
1,55042
1,47213
1,4767
1,51705
1,36463
1,44632
1,36782
1,39475
1,49687
1,22888
1,36285
1,41128
1,56218
1,47138
1,46379
1,46434
114,534
113,462
113,494
118,349
119,969
113,836
121,488
120,452
120,512
121,692
121,63
116,046
122,464
126,415
113,517
125,248
107,536
109,6
116,738
116,78
115,933
|
1,532
1,538
1,542
1,468
1,463
1,517
1,352
1,395
1,338
1,394
1,419
1,226
1,339
1,411
1,541
1,468
1,462
1,468
113,589
113,452
113,642
119,486
119,165
113,863
121,488
120,526
121,514
122,945
119,449
120,064
118,218
126,435
122,651
125,984
107,892
110,674
115,465
115,639
113,746
|
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи С4–N5.
Исследуемая связь между атомами С4–N5. Задаём начальные величины начальная длина связи 0,972; конечная длина связи 2,972; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи С4–N5 от величины растяжения.
Изменение потенциальной энергии углового напряжения C2-C3-С4.
Исследуем угол между атомами C2-C3-С4. Задаём начальные величины начальный угол 50; конечный 140; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
Оптимизация геометрии и расчёт параметров молекулы методом молекулярной механики (ММ+ и MNDO метод).
- Проведение оптимизации молекулы.
ММ+ метод.
Таблица 5
| Длина связи или валентный угол
|
Данные ММ расчёта
|
Данные MNDO расчёта
|
Справочные величины
|
| С1-С2
С2-С3
С3-С4
С4-N5
N5-C6
C6-C8
C8-C10
C9-C10
C7-C9
N5-C7
C10-C11
C11-O12
C11-O13
O13-C14
C14-C15
C15-N16
N16-C17
N16-C18
C1-C2-C3
C2-C3-C4
C3-C4-N5
C4-N5-C7
C4-N5-C6
N5-C7-C9
C7-C9-C10
C9-C10-C8
C6-C8-C10
C8-C6-N5
C6-N5-C7
C10-C11-O12
C9-C10-C11
C8-C10-C11
C10-C11-O13
O12-C11-O13
C11-O13-C14
C13-C14-C15
C14-C15-N16
C15-N16-C17
C15-N16-C18
|
1,53461
1,53838
1,53856
1,45536
1,45232
1,53586
1,53611
1,53558
1,536
1,4525
1,52029
1,20871
1,34376
1,40919
1,53584
1,45663
1,45283
1,45193
111,827
111,685
116,445
113,912
113,888
111,468
110,753
108,473
112,918
111,794
116,304
127,3
110,877
112,884
112,782
119,917
125,512
107,339
109,614
116,591
116,809
|
1,53147
1,54129
1,55152
1,47019
1,46727
1,54676
1,54834
1,54919
1,5454
1,46687
1,54228
1,22757
1,36181
1,41133
1,56262
1,47096
1,46422
1,4643
114,597
113,519
116,865
117,555
117,81
111,826
113,034
111,009
112,918
111,794
116,304
127,3
110,877
112,884
112,782
119,917
125,512
107,339
109,614
116,591
116,809
|
1,533
1,539
1,542
1,467
1,467
1,539
1,539
1,542
1,542
1,468
1,534
1,213
1,352
1,412
1,556
1,472
1,468
1,464
113,654
113,512
116,865
116,526
116,956
111,429
111,485
111,006
112,918
111,783
116,304
127,3
110,563
112,853
112,782
119,456
125,654
107,339
110,369
115,654
116,809
|
Сравнивая полученные результаты, оба метода имеют небольшие отклонения.
Расположение молекулы немного изменяется в зависимости от применяемого метода.
Положительный знак электростатического потенциала отображается зелёным цветом. В области неподелённых пар на атомах азота, кислорода электрический потенциал отрицательный, что отображается красным цветом.
Изменение потенциальной энергии связи С4–N5.
Исследуемая связь между атомами С4–N5. Задаём начальные величины начальная длина связи 0,97; конечная длина связи 2,97; шаг 0,1. Проведя расчёты, изобразим график изменения потенциальной энергии связи С4–N5 от величины растяжения.
Изменение потенциальной энергии углового напряжения C2-C3-С4.
Исследуем угол между атомами C2-C3-С4. Задаём начальные величины начальный угол 50; конечный 140; шаг 10. Проведя расчёты, изобразим график изменения энергии углового напряжения при изменении величины угла.
3.3 Исследование биологической активности с помощью программы
PASS
В работе выполнено исследование биологической активности всех молекулярных структур с помощью программы PASS согласно методике п.2.2.
Дикаин
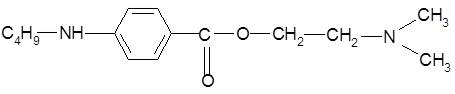
Если величина Pa
близка к единице, то вещество может оказаться близким аналогом известных препаратов. Базовые структуры лекарств, обладающие существенной новизной, целесообразно отбирать из массива доступных веществ соединения с Pa
<0.7. Риск получения отрицательного результата в эксперименте тем больше, чем меньше величина Pa
, однако и новизна такой структуры (при подтверждении прогноза в эксперименте) будет более высокой [12]. Pa Pi:
0.603 0.023 спазмолитик,
0.511 0.048 сосудорасширяющее средство,
0.405 0.015 антагонист кальциевых каналов,
0.350 0.107 антигипертензивный,
0.323 0.166 токсичный,
0.114 0.098 агонист β – адренорецепторов,
0.219 0.214 тератоген,
0.092 0.091 антагонист β – адренорецепторов.
1. Структура 1 (карбоксиструктура).
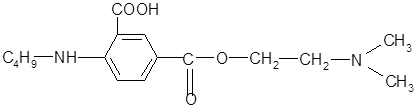 Pa Pi: Pa Pi:
0.591 0.025 спазмолитик,
0.367 0.095 сосудорасширяющее средство,
0.264 0.051 антагонист кальциевых каналов,
0.331 0.160 токсичный,
0.301 0.142 антигипертензивный,
0.211 0.144 диуретик,
0.233 0.195 тератоген,
0.113 0.101 агонист β – адренорецепторов,
0.092 0.090 антагонист β – адренорецепторов.
2. Структура 2 (адреноструктура).
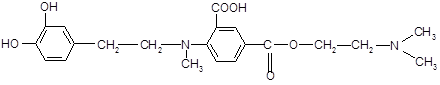 Pa Pi: Pa Pi:
0.620 0.021 спазмолитик,
0.472 0.059 сосудорасширяющее средство,
0.362 0.020 антагонист кальциевых каналов,
0.218 0.041 агонист дофамина,
0.128 0.020 агонист Д2 дофамина,
0.291 0.188 токсичный,
0.144 0.041 агонист β1 – адренорецепторов,
0.139 0.043 агонист β – адренорецепторов,
0.243 0.182 тератоген,
0.237 0.211 антигипертензивный,
0.133 0.119 агонист α – адренорецепторов.
3. Структура 3 (никотиноструктура).
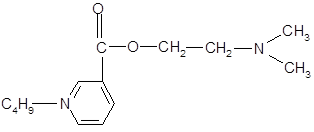
Pa Pi:
0.683 0.017 сосудорасширяющее средство,
0.548 0.031 спазмолитик,
0.326 0.026 антагонист кальциевых каналов,
0.364 0.098 антигипертензивный,
0.171 0.066 агонист дофамина.
4. Структура 4 (пиперидиноструктура).
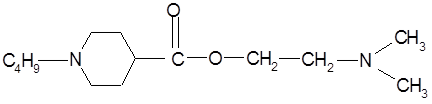
Pa Pi:
0.680 0.015 спазмолитик,
0.537 0.042 сосудорасширяющее средство,
0.411 0.014 антагонист кальциевых каналов,
0.402 0.078 антигипертензивный,
0.233 0.051 антагонист α1 – адренорецепторов,
0.253 0.075 агонист α – адренорецепторов
0.216 0.081 антагонист адреналина.
После исследования биологической активности ряда веществ можно сделать вывод, что все структуры обладают новизной. Есть большая вероятность, что они будут обладать спазмолитической, сосудорасширяющей активностью и являются антагонистами кальциевых каналов.
Суммарно характеристики биологической активности всех молекулярных структур предложены в таблице 6.
Таблица 6
| Характерис-тика фармако-логической активности
|
Основ-ная струк-тура
|
Модифицированные структуры
|
| |
Дикаин  
|
Структура 1
Карбокси-структура  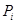
|
Структура 2
Адрено-структура 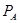 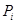
|
Структура 3
Никотино-структура 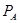 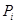
|
Структура 4
Пиперидиноструктура 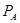 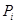
|
| 1. Спазмолитик
|
0,603 0,023
|
0,591 0,025
|
0,620 0,021
|
0,683 0,017
|
0,680 0,015
|
| 2. Сосудорасши-ряющее средство
|
0,511 0,048
|
0,367 0,095
|
0,472 0,059
|
0,548 0,031
|
0,537 0,042
|
| 3. Антагонист кальциевых каналов
|
0,405 0,015
|
0,264 0,051
|
0,362 0,020
|
0,326 0,026
|
0,411 0,014
|
| 4. Антигипер-тензивный
|
0,350 0,107
|
0,301 0,142
|
0,237 0,211
|
0,364 0,098
|
0,402 0,078
|
| 5. Агонист β-адренорецепторов
|
0,114 0,098
|
0,113 0,101
|
0,139 0,043
|
|
|
| 6. Токсичный
|
0,323 0,166
|
0,331 0,160
|
0,291 0,188
|
|
|
| 7. Тератоген
|
0,219 0,214
|
0,233 0,195
|
0,243 0,182
|
|
|
| 8. Антагонист β-адрено-рецепторов
|
0,092 0,091
|
0,092 0,09
|
|
|
|
| 9. Диуретик
|
|
0,211 0,144
|
|
|
|
| 10. агонист 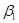 -адрено-рецепторов -адрено-рецепторов
|
|
|
0,144 0,041
|
|
|
| 11. Агонист α-адрено-рецепторов
|
|
|
0,133 0,119
|
|
0,253 0,075
|
| 12. Антагонист 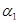 -адрено-рецепторов -адрено-рецепторов
|
|
|
|
|
0,233 0,051
|
Краткое описание позиций проявленной фармакологической активности.
1. Спазмолитик.
Лекарственное средство, понижающее тонус и двигательную активность гладких мышц; применяют для предупреждения или устранения спазмов гладкомышечных органов.
По механизму действия спазмолитические средства делят на миотропные и нейротропные. Миотропные спазмолитические средства снижают тонус гладкомышечных органов путем прямого влияния на биохимические процессы в гладкомышечных клетках. Нейротропные спазмолитические средства оказывают спазмолитический эффект путем нарушения передачи нервных импульсов в вегетативных ганглиях или в области окончаний вегетативных нервов, стимулирующих гладкие мышцы [19].
2. Сосудорасширяющее средство (α- и β-адреноблокаторы).
Лекарственное средство, вызывающее расширение кровеносных сосудов.
По принципу действия различают нейротропные, миотропные сосудорасширяющие средства, антагонисты кальция и сосудорасширяющие средства, влияющие на гуморальную регуляцию сосудистого тонуса.
К нейротропным сосудорасширяющим средствам относят препараты, влияющие на эффективную иннервацию сосудов [18].
3. Антагонист кальциевых каналов.
Механизм сосудорасширяющего действия препаратов группы антагонистов кальция связывают с блокадой кальциевых каналов, что приводит к затруднению проникновения ионов кальция внутрь клетки и расслаблению гладкой мускулатуры. Из числа антагонистов кальция в медицинской практике широко используется верапамил и нифедипин, которые применяют в основном как антиангинальные средства [18, 20].
4. Антигипертензивный.
Антигипертензивный – свойство вещества, препятствующего повышению гидростатического давления в полости организма, полых органах и сосудах.
Антигипертензивные вещества препятствуют развитию гипертензивного синдрома – симптомокомплекса, обусловленного стабильным или прогрессирующим поведением внутричерепного давления [8].
5. Токсичный.
Токсичность – свойство вещества синтетического и природного происхождения при поступлении в организм в количестве, превышающем меру их фармакологической активности, что выражается в возникновении токсических эффектов разной направленности, интенсивности и продолжительности вплоть до развития отравления [20].
6. Агонист β-адренорецепторов.
Агонист β-адренорецепторов – лекарственное вещество, которое прикрепляясь к β-адренорецептору, индуцирует эффективное конформационное изменение [3].
7. Тератоген.
Тератоген – фактор, вызывающий развитие врожденных пороков [5].
8. Антагонист β–адренорецепторов.
Антагонист β-адренорецепторов – лекарственное вещество, которое прикрепляется к β-адренорецептору, не индуцирует эффективного конфигурационного изменения.
β-адренолитики блокируют β-адренорецепторы, осуществляющие симпатическую иннервацию сердца (возбуждение) и торможение гладких мышц бронхов, желудка, некоторых сосудов, ресничной мышцы, поперечнополосатых мышц, а также регуляцию гликогенолиза и липолиза [7].
9. Диуретик.
Диуретики (мочегонные средства) – лекарственные средства, увеличивающие выделение почками ионов натрия и воды и вызывающие в связи с этим уменьшение содержания жидкости в тканях и серозных полостях организма.
Основным и практически важным эффектом мочегонного средства является увеличение выделения ионов натрия.
Одновременно с выделением натрия мочегонные средства способствуют выделению других ионов [19].
10. Агонист 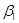 -адренорецепторов. -адренорецепторов.
Агонист 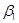 -адренорецепторов – вещество, которое посредством прикрепления к рецептору индуцирует эффективное конформационное изменение. -адренорецепторов – вещество, которое посредством прикрепления к рецептору индуцирует эффективное конформационное изменение.
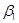 -адренорецепторы опосредуют влияние катехоламинов на сердце, гладкие мышцы желудочно-кишечного тракта и, возможно, липолитический эффект КА [7]. -адренорецепторы опосредуют влияние катехоламинов на сердце, гладкие мышцы желудочно-кишечного тракта и, возможно, липолитический эффект КА [7].
11. Агонист α-адренорецепторов.
Агонист α-адренорецепторов – вещество, которое посредством прикрепления к α-адренорецептору индуцируют эффективное конформационное изменение.
α-адренорецепторы осуществляют возбуждение гладких мышц сосудов, гладких образований кожи, слизистых оболочек, органов брюшной полости, селезенки, сфинктеров желудочно-кишечного тракта и мочевого пузыря, мышцы, расширяющей зрачок и др. Сильное α-адренолитическое действие оказывают производные β-галоидоалкиламина, которые вызывают необратимую блокаду адренореактивных систем [7].
12. Агонист α-адренорецепторов.
Агонист α-адренорецепторов – вещество, которое посредством прикрепления к α-адренорецептору индуцируют эффективное конформационное изменение.
α-адренорецепторы осуществляют возбуждение гладких мышц сосудов, гладких образований кожи, слизистых оболочек, органов брюшной полости, селезенки, сфинктеров желудочно-кишечного тракта и мочевого пузыря, мышцы, расширяющей зрачок и др. Сильное α-адренолитическое действие оказывают производные β-галоидоалкиламина, которые вызывают необратимую блокаду адренореактивных систем [7].
Из таблицы 6 видно, что порог ингибирования 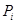 практически для всех видов биологической активности незначителен, поэтому в дальнейшем сравнительный анализ фармакоактивности будем проводить по порогу активности практически для всех видов биологической активности незначителен, поэтому в дальнейшем сравнительный анализ фармакоактивности будем проводить по порогу активности 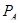 . Одновременно приведем значения . Одновременно приведем значения 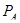 программы PASS в условные проценты относительно базовой структуры – дикаина, принемая его характеристики за 100 %. программы PASS в условные проценты относительно базовой структуры – дикаина, принемая его характеристики за 100 %.
Таблица 7
| |
Дикаин
|
Карбокси-структура
|
Адрено-структура
|
Никотино-структура
|
Пиперидно-структура
|
| 1. Спазмолитик
|
100 (0,603)
|
98,00 (0,591)
|
102,82 (0,620)
|
113,27 (0,693)
|
112,77 (0,680)
|
| 2. Сосудорасширя-ющее
|
100 (0,511)
|
71,82 (0,367)
|
92,37 (0,472)
|
107,24 (0,548)
|
105,09 (0,537)
|
| 3. Антагонист Ca каналов
|
100 (0,405)
|
65,19 (0,264)
|
89,38 (0,362)
|
80,49 (0,326)
|
101,48 (0,411)
|
| 4. Антигипертен-зивный
|
100 (0,350)
|
86,00 (0,301)
|
67,71 (0,237)
|
104,00 (0,364)
|
114,8 (0,402)
|
| 5. Агонист β-адренорецеп-торов
|
100 (0,114)
|
99,12 (0,113)
|
119,30 (0,139)
|
|
|
| 6. Токсичность
|
100 (0,323)
|
102,48 (0,331)
|
90,09 (0,291)
|
|
|
| 7. Тератоген
|
100 (0,219)
|
106,39 (0,233)
|
110,96 (0,243)
|
|
|
| 8. Антагонист β-адренорецеп-торов
|
100 (0,092)
|
100 (0,092)
|
|
|
|
| 9. Диуретик
|
|
(0,211)
|
|
|
|
| 10. Агонист 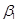 -адренорецеп-торов -адренорецеп-торов
|
|
|
(0,144)
|
|
|
| 11 Агонист α-адренорецеп-торов
|
|
|
(0,133)
|
|
(0,253)
|
| Антагонист 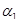 -адренорецеп-торов -адренорецеп-торов
|
|
|
|
|
(0,233)
|
Сравнивая характеристики фармакологических структур и их соотношение, можно сделать следующие выводы.
1. Чем больше показатель спазмолитических свойств, тем больше анестезирующий эффект.
2. Чем меньше показатель сосудорасширяющего свойства, тем больше анестезирующий эффект.
3. Чем больше показатель антагонист кальциевых каналов, тем больше анестезирующий эффект.
4. Чем больше антигипертензивный показатель, тем меньше токсичность.
5. Чем больше показатель сосудорасширяющего средства, тем меньше токсичность.
6. Появление диуретических свойств снижает токсичность.
7. Появление α, β-антагонистов адренорецепторов уменьшает токсичность.
В нашей работе для комплексной оценки анестезирующих и токсических свойств предлагается использовать интегральные показатели.
Расчет интегральных показателей проводили по формуле 1.
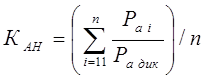 ; ;
где  -интегральный коэффициент анестезирующей активности. -интегральный коэффициент анестезирующей активности.  -порог активности каждого i – вида фармакологического действия, влияющего на анестезирующий эффект. -порог активности каждого i – вида фармакологического действия, влияющего на анестезирующий эффект. 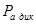 -порог активности дикаина по соответствующему виду. n
-
число видов фармакологического действия, влияющего на анестезирующий эффект. -порог активности дикаина по соответствующему виду. n
-
число видов фармакологического действия, влияющего на анестезирующий эффект.
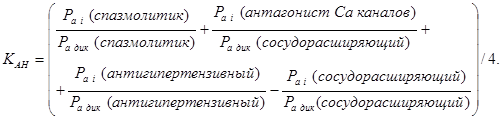
Для суммарной оценки токсических свойств предложен интегральный показатель токсичности.
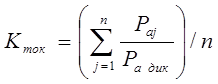 ; ;
где 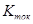 -интегральный коэффициент токсичности. -интегральный коэффициент токсичности. 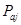 -порог активности каждого j-вида фармакологического действия, влияющего на токсичность. -порог активности каждого j-вида фармакологического действия, влияющего на токсичность. 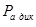 -порог активности дикаина по соответствующему фармакологического действия. n
-число видов фармакологического действия, влияющего на токсичность. -порог активности дикаина по соответствующему фармакологического действия. n
-число видов фармакологического действия, влияющего на токсичность.
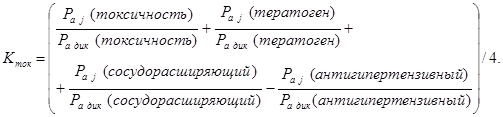
Таблица 8
| Интегральные коэфф-ы
|
Дикаин
|
Структура1
Карбокси-структура
|
Структура 2
Адрено-структура
|
Структура 3
Никотино-структура
|
Структура 4
Пиперидино-структура
|
| Коэффициент анестези-рующей активности
|
0,5
|
0,443
|
0,419
|
0,543
|
0,560
|
| Коэффициент токсичности
|
0,5
|
0,486
|
0,564
|
-
|
-
|
Из таблицы видно, что по анестезирующему эффекту исследуемые структуры можно ранжировать в следующий ряд:
Пиперидиноструктура>никотиноструктура>дикаин>
>карбоксиструктура>адреноструктура
Наглядно эффект анестезирующей активности представлен на диаграмме 1.
По токсичности исследуемые структуры располагаются в следующий ряд:
Таким образом, результаты компьютерного дизайна молекулы дикаина с целью снижения токсичности и усиления местноанестезирующего эффекта позволяют исследуемые структуры расположить в следующий ряд:
Никотиноструктура>пиперидиноструктура>адреноструктура>>дикаин>карбоксиструктура
4. Экономическая часть
4.1 Цель и база сравнения
Несмотря на достижения современной анестезии, продолжаются поиски менее опасных средств для наркоза, разработка различных вариантов многокомпонентного избирательного наркоза, позволяющего значительно снизить дозы используемых средств, уменьшить их токсичность и побочные отрицательные влияния.
В последнее время методы компьютерного моделирования все более входят в практику технологии создания новых синтетических лекарственных веществ. Полученные таким образом данные позволяют более целенаправленно проводить синтезы биоактивных молекул с заданными на молекулярном уровне параметрами, что значительно экономит время, материалы и силы при аналоговом поиске лекарственных веществ.
4.2 Проведение работы связано с определенными видами затрат
Затраты на проведение работы включают в себя:
1) Расчет заработной платы работнику, выполняющему данную работу с окладом 3500 р/мес.
2) Затраты на электроэнергию с ценой 1 кВт-1,6 р.
3) Затраты на покупку компьютера и приобретение программы HyperChem.
4.3 Заработная плата рассчитывается на 1 человека
Оклад составляет 3500 р/мес. Работа проводилась 4 месяца. Заработная плата за 4 месяца составляет 3500.
4=14000 р.
Отчисления на социальные нужды:
1) Пенсионный фонд  . .
2) Фонд социального страхования 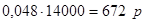 . .
3) Фонд медицинского страхования 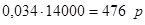 . .
4) Фонд страхования от несчастных случаев 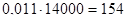 р. р.
Итого: 5222 р.
Основные производственные фонды
Стоимость компьютера 20000 р.
Стоимость компьютера Hyper Chem 30000 р.
Итого: 50000 р.
Амортизация
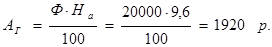
4.4 Затраты на электроэнергию
Цена за 1 кВт – 1,6 р.
Затраты на энергоресурсы составили 0,1 кВт/ ч.
Работа на компьютере составили 528 ч.
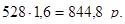
Смета затрат
| Статьи затрат
|
Стоимость, руб
|
| Информационная программа HyperChem
|
30000
|
| Заработная плата
|
19222
|
| Амортизация
|
1920
|
| Затраты на электроэнергию
|
844,8
|
| ИТОГО
|
51986
|
Список литературы
1. Поройков В.В. Компьютерное предсказание биологической активности веществ: пределы возможного. Химия в России, 1999, № 2, 8-12.
2. Кнунянц И. Л. Химическая энциклопедия. Издательство “Советская энциклопедия” Москва, 1988.
3. Кукес В. Г., Стародубцева А. К. Фармакология и фармакотерапия. - М.: ГЭОТАР – МЕД, 2004.
4. Беликов В. Г. Фармацевтическая химия. – М.: Высшая школа, 1985
5. Харкевич Д. А. Фармакология, четвертое издание, Москва, 1993.
6. Солдотенков А. Т., Колядина Н. М., Шендрик И. В. Основы органической химии лекарственных веществ. – М.: МИН, 2003.
7. Аляутдин Р. Н. Фармакология. – учебник для вузов, Москва, 2004.
8. Ланса Л., Лейси Ч., Голдман. М. Фармакологический справочник, Москва, 2000 г.
9. Поройков В.В., Филимонов Д.А. Компьютерный прогноз биологической активности химических соединений как основа для поиска и оптимизации базовых структур новых лекарств. В сб.: Азотистые гетероциклы и алкалоиды. Москва: Иридиум-пресс, 2001, т.1, с.123-129.
10. Poroikov V.V., Filimonov D.A., Borodina Yu.V., Lagunin A.A., Kos A. Robustness of biological activity spectra predicting by computer program PASS for non-congeneric sets of chemical compounds. J. Chem. Inform. Comput. Sci., 2000, 40 (6), 1349-1355.
11. Anzali S., Barnickel G., Cezanne B., Krug M., Filimonov D., Poroikov V. Discriminating between drugs and nondrugs by Prediction of Activity Spectra for Substances (PASS). J. Med. Chem., 2001, 4 (15), 2432-2437.
12. Лагунин А.А., Филимонов Д.А., Поройков В.В. Компьютерный поиск потенциальных антигипертензивных соединений комбинированного действия. Хим.-фарм. журн., 2001, 35 (7), 28-34.
13. Filimonov D., Poroikov V., Borodina Yu., Gloriozova T. Chemical similarity assessment through multilevel neighborhoods of atoms: definition and comparison with the other descriptors. J. Chem. Inf. Comput. Sci., 1999, 39 (4), 666-670.
14. Lagunin A., Stepanchikova A., Filimonov D., Poroikov V. PASS: prediction of activity spectra for biologically active substances. Bioinformatics, 2000, 16 (8), 747-748.
15. Poroikov V., Akimov D., Shabelnikova E., Filimonov D. Top 200 medicines: can new actions be discovered through computer-aided prediction? SAR and QSAR in Environmental Research, 2001, 12 (4), 327-344.
16. Poroikov V., Filimonov D. Computer-aided prediction of biological activity spectra. Application for finding and optimization of new leads. Rational Approaches to Drug Design, Eds. H.-D. Holtje, W.Sippl, Prous Science, Barcelona, 2001, p.403-407.
17. Кудрин А. Н. Фармакология, Москва “Медицина”, 1991.
18. Лоуренс Д. Р., Беннетт П. Н. Браун М. Дж. Фармакология. Издание второе. Москва, 2002.
19. Кудрин А. Н. Фармакология. – М.: Медицина, 2001.
20. Лоуренс Д. Р., Беннетт П. Н. Фармакология Том 1. Москва, 1993.
|