| Лабораторна робота №
1.
„Визначення теплоти розчинення і гідратації солі”
Мета роботи:
1. Познайомитись з калориметричним методом вимірювання теплових ефектів.
2. Визначити теплоти розчинення безводного купрум (II) сульфату і мідного купоросу.
3. Визначити теплоту утворення кристалогідрату СuSО4
•5Н2
О з безводної солі.
На занятті необхідно:
1. Виконати роботу у відповідності до вимог даної методичної розробки.
2. Навчитись користуватись калориметром та визначати його теплоємність.
3. Розрахувати теплоту розчинення солі та теплоту гідратації.
4. Оформити звіт про виконану роботу і здати його викладачу.
Перелік обладнання та реактивів:
1. Калориметр;
2. термометр;
3. технохімічні ваги;
4. пробірки (3 шт.);
5. секундомір;
6. порцелянова ступка;
7. KNO3
8. СuSО4
, СuSО4
•5Н2
О
Порядок виконання роботи:
Дослід 1. Визначення сталої калориметра
1. Суху пробірку попередньо зважити на технохімічних терезах.
2. Ретельно розтерти калій нітрат в порцеляновій ступці і засипати його у зважену пробірку приблизно на ¼ її висоти.
3. Зважити на технохімічних терезах пробірку з сіллю (з точністю до 0,01г). За різницею зважувань знайти масу солі, що повинна знаходитись в межах 4 -7 г. Отримані дані занести в таблицю 1.
4. У стакан калориметра налити 250 мл води, закрити калориметр кришкою і встановити в менший її отвір термометр, а в більший– пробірку з сіллю. (Для того щоб пробірка не провалювалась в калориметр на неї потрібно надіти гумове кільце!
).
5. Вимірювання провести в три етапи (періоди): попередній, головний і заключний.
6. Ввімкнути калориметр в мережу змінного струму, потім ввімкнути тумблером мішалку, а через 1-2 хвилини– секундомір.
7. Попередній етап:
вимірювання температури провести з точністю до 0,5°С через кожні 30 сек. протягом 5 хв.
8. Головний етап:
не виключаючи секундоміра
роз бити пробірку з сіллю так, щоб вся сіль висипалась у воду. Якщо температура змінюється дуже швидко, реєструвати її з меншою точністю.
9. Заключний етап:
іще провести вимірювання температури через кожні 30 сек. протягом 5 хв. до встановлення рівномірного ходу температури (теж з точністю до 0,5°С).
10.Дані всіх вимірювань занести в таблицю 2.
11.Для розрахунку точної зміни температури на міліметровому папері побудувати графік, відкладаючи по вісі абсцис час, а по вісі ординат– зміну температури (масштаб на абсцисі- 1хв: 1см, а на ординаті– 1°К: 5см). З’єднані точки дадуть дві нахилені прямі для попереднього та заключного періодів. Їх продовжити вправо та вліво відповідно і через середину головного періоду провести пряму, паралельну до вісі ординат, до перетину її з продовженнями попередніх прямих. Відстань між точками перетину відповідає зміні температури при розчиненні солі.
Реклама

12.Визначивши з графіка Δt1
, розрахувати сталу калориметра (К):
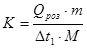
де Qроз
- теплота розчинення солі ( -35,62 кДж/моль для KNO3
);
m - маса нітрату калію;
М - молярна маса KNO3
(101,1 г/моль );
Δt1
- зміна температури при розчиненні солі.
Дослід 2. Визначення теплоти розчинення кристалогідрату (
С
uS
О4
•5Н2
О
)
1. Аналогічно до попереднього досліду зважують близько 5-7 г подрібненого мідного купоросу та вміщують його в пробірку, дані зважування заносять до таблиці 1.
2. Проводять вимірювання у відповідності до п.п. 6-10 попереднього досліду. Результати заносять в таблицю 2; будують графік, за яким визначають зміну температури при розчиненні солі (Δt2
)
3. Визначають теплоту розчинення (Q
1
) солі за формулою:
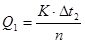 , ,
де n - кількість речовини СuSО4
•5Н2
О.
Дослід 3. Визначення теплоти розчинення безводної солі
(
С
uS
О4
)
1. Беруть наважку безводного сульфату міді масою 4-5г і проводять дослід аналогічно до попереднього. Дані заносять в таблицю 2. Будують відповідний графік і знаходять зміну температури при розчиненні безводної солі (Δt3
).
2. Визначають теплоту розчинення (Q
2
) солі за формулою:
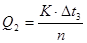 , ,
де n - кількість речовини СuSО4
.
3. Визначають теплоту утворення кристалогідрату (Q3
) з безводної солі:
Q
3
=
Q
2
–
Q
1
4. Розрахувати відносну похибку експерименту, якщо інтегральна теплота розчинення безводної солі +39,04кДж/моль
, а кристалогідрату - рівна -11,72кДж/моль
.
5. Результати всіх дослідів занести в таблиці 1 та 2.
6. Зробити відповідні висновки.
Результати роботи:
Дослід 1. Визначення сталої калориметра
1. Розрахунок маси наважки солі KNO3
:
Таблиця 1.1
| Пробірка з сіллю, г
|
22,33
|
| Пуста пробірка, г
|
17,50
|
| Сіль, г
|
4,83
|
2. Температурні показники для розчину солі KNO3
:
Таблиця 1.2
| Температура
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
| до розчинення
|
24,10
|
24,10
|
24,10
|
24,10
|
24,10
|
24,10
|
24,10
|
24,10
|
24,10
|
24,10
|
| після розчинення
|
22,25
|
22,25
|
22,25
Реклама

|
22,25
|
22,26
|
22,26
|
22,26
|
22,28
|
22,28
|
22,29
|
3. Розрахунок сталої калориметра:
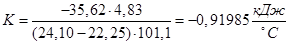
Дослід 2. Визначення теплоти розчинення кристалогідрату (
С
uS
О4
•5Н2
О
)
1. Розрахунок маси наважки солі СuSО4
•5Н2
О:
Таблиця 2.1
| Пробірка з сіллю, г
|
23,50
|
| Пуста пробірка, г
|
17,50
|
| Сіль, г
|
6,00
|
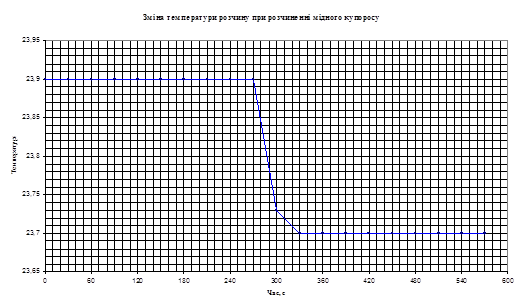
2. Температурні показники для розчину солі СuSО4
•5Н2
О:
Таблиця 2.2
| Температура
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
| до розчинення
|
23,90
|
23,90
|
23,90
|
23,90
|
23,90
|
23,90
|
23,90
|
23,90
|
23,90
|
23,90
|
| після розчинення
|
23,73
|
23,70
|
23,70
|
23,70
|
23,70
|
23,70
|
23,70
|
23,70
|
23,70
|
23,70
|
3. Розрахунок теплоти гідратації солі СuSО4
•5Н2
О:
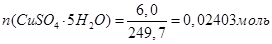 ; ;
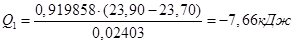
Дослід 3. Визначення теплоти розчинення безводної солі (
С
uS
О4
)
1. Розрахунок маси наважки солі СuSО4
:
Таблиця 3.1
| Пробірка з сіллю, г
|
22,00
|
| Пуста пробірка, г
|
17,50
|
| Сіль, г
|
4,50
|
2. Температурні показники для розчину солі СuSО4
:
Таблиця 3.2
| Температура
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
8
|
9
|
10
|
| до розчинення
|
23,98
|
23,98
|
23,98
|
23,98
|
23,98
|
23,98
|
23,98
|
23,98
|
23,98
|
23,98
|
| після розчинення
|
24,68
|
24,70
|
24,70
|
24,70
|
24,70
|
24,70
|
24,65
|
24,65
|
24,65
|
24,65
|
3. Розрахунок теплоти гідратації солі СuSО4
:
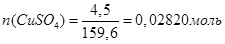 ; ;
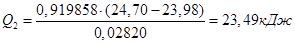
4. Визначення теплоти утворення кристалогідрату з безводної солі:
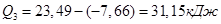
5. Розрахунок відносної похибки досліду:
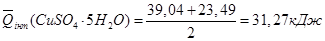
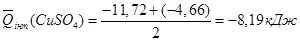
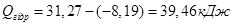
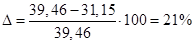
Висновок:
В процесі виконання роботи ми познайомились з калориметричним методом вимірювання теплових ефектів, визначили теплоти розчинення безводного купрум (II) сульфату і мідного купоросу, визначили теплоту утворення кристалогідрату СuSО4
•5Н2
О з безводної солі.


|