| Însămânţările artificiale la animalele domestice
Însămânţările artificiale reprezintă o biotehnică modernă a reproducerii animalelor, care asigură progresul genetic al efectivelor şi implicit sporirea productivităţii acestora.
Însămânţarea artificială înlătură controlul sexual dintre mascul şi femelă, sperma fiind recoltată de la un reproducător mascul şi depusă în organele genitale ale unei femele aflate în călduri, cu ajutorul unui instrumentar adecvat.
Deşi în literatura de specialitate nu există date precise despre începutul aplicării însămânţărilor artificiale, se consideră, totuşi că prima încercare a fost făcută de către arabi, în secolul XIV, obţinând un produs de la un armăsar valoros, prin prelevarea spermei cu un smoc de păr introdus în vaginul unei iepe şi extras după monta acesteia, şi apoi introdus imediat în vaginul altei iepe în călduri.
Date sigure au stabilit că însămânţările artificiale au fost aplicate încă în secolul XVIII. Astfel se cunoaşte faptul că fiziologul italian Lazzaro Spallanzani în anul 1778, inoculând unei căţele sperma recoltată, prin masturbaţie, de la un câine a obţinut trei produşi. Experienţe asemănătoare, cu rezultate bune au fost efectuate în secolul al XIX-lea de către Everett, Millais, Albrecht.
Studii aprofundate, bazate pe cercetări experimentale, au fost efectuate pentru prima dată de fiziologul rus Ilia Ivanov (1860-1932), considerat pe drept cuvânt, fondator al însămânţărilor artificiale. Punând bazele teoretice şi practice ale însămânţărilor artificiale, Ivanov a aplicat, în perioada 1889-1932, această metodă la diferite specii (cabaline, bovine, ovine, porcine), mai întâi ca mijloc profilactic pentru prevenirea bolilor infecţioase şi parazitare transmisibile prin montă, şi apoi ca metodă de ameliorare a raselor de animale. La şcoala creată de Ivanov s-au format specialişti de prestigiu care au elaborat valorase studii despre tehnologia însămânţărilor artificiale, biochimia spermei, perfecţionarea aparaturii şi instrumentarului.
Реклама

Însămânţările artificiale au înregistrat o largă răspândire într-o perioada de timp relativ scurtă datorită avantajelor mari pe care le prezintă în ameliorarea animalelor. Astfel, Danemarca, Japonia şi Israelul utilizează, practic, numai însămânţarea artificială la taurinele pentru lapte şi la suine. Metoda are extindere mare în SUA, ţările din Europa şi Asia. Importanţa însămânţărilor artificiale se manifestă sub diferite aspecte: zootehnic, economic, sanitar-veterinar şi ştiinţific.
Graţie creşterii substanţiale a eficienţei utilizării materialului seminal, prin aplicarea însămânţărilor artificiale este posibilă folosirea celor mai valoroşi reproducători masculi, testaţi după descendenţă şi cu însuşiri morfo-productive deosebite, care intensifică progresul genetic-ameliorativ al efectivelor într-un timp scurt. Astfel, un taur testat poate avea pe durata vieţii între 100.000 şi 200.000 produşi, vierul – peste 1000 într-un an, iar un armăsar – peste 100 mânji pe sezon.
La speciile cu un interval mare între generaţii, asocierea biotehnicii însămânţărilor artificiale cu conservarea prin congelare a spermei permite crearea unor bănci de material seminal, care este unilizat după finalizarea la taurii de 6 sau 7 ani a testului de performare după prima lactaţie normală a fiicelor. În plus, peste 90% din caracterele morfoproductive care au un determinism genetic pot fi ameliorate prin folosirea însămânţărilor artificiale.
Prin folosirea unui număr redus de reproducători în centre specializate de reproducţie, cu sperma cărora pot să fie însămânţate un număr mare de femele se realizează economii însemnate de forţă de muncă, de furaje, de adăposturi, putând fi întreţinuţi în condiţii foarte bune reproducătorii de mare valoare genetică.
Реклама

Întreţinerea masculilor reproducători în ferme specializate permite menţinerea lor în condiţii optime de sănătate şi întreţinere, cu o producţie seminală de calitate şi indemnă de boli cu transmitere veneriană (bruceloză, tricomonoză, vibrioză). Garantarea indemnităţii spermei faţă de principalele boli infecto-contagioase face posibil schimbul internaţional de gene prin importul exportul de material seminal congelat, fără suportarea inconvenientelor prilejuite de carantină.
Derularea diferitelor etape ale însămânţărilor artificiale majorează substanţial aportul factorului uman la procesul reproducerii, fapt care face necesară întocmirea şi păstrarea unor evidenţe complete reducând prin aceasta pericolul transmiterii prin moştenire a unor boli genetice.
Alte avantaje ale însămânţărilor artificiale se referă la reproducerea artificială a unor specii monogame (vulpile) şi obţinerea de hibrizi între specii, care în mod natural nu se împerechează (între măgar şi iapă, între vacă şi Iac, între bizonul european şi bizonul american etc.).
Însămânţarea artificială comportă şi unele dezavantaje. Ele rezidă în următoarele:
· folosirea reproducătorilor necorespunzători din punct de vedere genetic are acţiune negativă asupra ameliorării. De aceea, este absolut necesar să se folosească masculi de origine cunoscută, testaţi după descendentă;
· posibilitatea comiterii unor erori în etapele prelucrării, conservării, transportului, depistării căldurilor şi însămânţarea femelelor de către persoanele antrenate în procesul de muncă.
· Prin neglijarea profilaxiei bolilor genetice, însămânţările artificiale pot favoriza diseminarea unor boli, cum ar fi: boala chistică ovariană, sindromul spastic, criptorhidia şi defecte de conformaţie.
· Toate aceste neajunsuri pot fi înlăturate în cazul existenţei în reţeaua însămânţărilor artificiale a unui personal calificat, care să posede cunoştinţe de biologia şi patologia reproducţiei, precum şi de ameliorare.
Teoria şi practica însămânţărilor artificiale la animalele domestice cuprinde următoarele compartimente:
- studiul spermei;
- metodele de recoltare a spermei;
- controlul şi diluarea spermei;
- metodele de conservare a spermei;
- inocularea spermei sau însămânţarea propriu-zisă.
Sperma
Sperma reprezintă un produs complex al aparatului genital mascul constituit din spermatozoizi şi plasmă seminală.
Plasma seminală este alcătuită din fluidul testicular secretat de canaliculele testiculare, la care se adaugă, succesiv, secreţia epididimului şi a canalelor deferente, Cantitatea cea mai mare de lichid seminal cu rol biologic foarte important este secretată de glandele anexe ale aparatului genital: glandele seminale, prostata şi glandele bulbo-uretrale.
Sperma eliminată de un mascul în timpul unui act coital poartă denumirea de ejaculat.
Particularităţile de structură ale organelor genitale şi dinamismul actului coital determină variaţii atât în volumul ejaculatului, cât şi în compoziţia lui la masculii de diferite specii. Astfel, volumul ejaculatului la armăsar este de 60-80ml, maximum 200ml, la vier – respectiv 200-500 şi 1000ml, la berbec – 1-2 şi 3,5ml, la taur – 4-5ml şi 15 ml, la câine – 8-10 şi 25ml, la cocoş – 0,3 şi 2ml, la curcan – 0,25-0,4 şi la gâscan 0,1-1,3ml.
În funcţie de specie este diferită şi concentraţia spermei. La animalele de tip vaginal de însămânţare naturală concentraţia spermiilor este de 5-10 ori mai mare în comparaţie cu cea la animalele de tip uterin de însămânţare. Aşa, într-un mililitru de spermă se găsesc în mediu: la berbec – 2,5-3,5miliarde, la taur – 0,8-1,25miliarde, la vier – 0,15-0,21miliarde, la armăsar – 0,1-0,15miliarde, la cocoş – 2-4miliarde, la curcan – 2-4miliarde şi la gânsac – 0,3-1miliard de spermi.
Raportul dintre spermi şi plasma seminală este diferit, în dependenţă de specie şi este în corelaţie cu volumul ejaculatului şi mai ales cu dezvoltarea glandelor anexe. În spermă, spermii reprezintă 36% - la berbec, 14% - la taur, 7% - la vier şi numai 1,75% - la armăsar.
Compoziţia chimică a spermei
Din punct de vedere al compoziţiei chimice, sperma face parte din cele mai complicate lichide ale organismului. Apa constituie circa 90-98% din masa spermei, iar 2-10% revine substanţei uscate, dintre care 60% sunt proteine. Constituenţii principali ai spermei sunt proteinele şi lipidele. În compoziţia proteinelor spermei sunt proteinele şi lipidele. În compoziţia proteinelor intră aminoacizi care conţin sulf. Din lipidele spermatice, într-o cantitate mai mare se conţine lecitina, bogată în fosfor. În 100ml spermă de berbec se conţin până la 355mg de fosfor, la taur – 82mg, la vier – 66mg şi la armăsar – 19mg. El are un rol important în procesele biochimice ce se produc în spermi.
În spermă se conţin elemente minerale. În formă combinată sau ca electroliţi, dintre care e de menţionat: Sodiul, potasiul, calciul, magneziul, fosforul, zincul, clorurile, fosfaţii etc. Zincul joacă un rol important în procesul fecundaţiei, stimulând în acelaşi timp acţiunea hormonilor androgeni.
Constituenţii organici
din spermă au rol deosebit în biologia spermilor, concretizat prin: asigurarea substratului energetic necesar metabolismului spermilor; acţiune protectoare asupra gameţilor, prin neutralizarea efectului dăunător al unor constituenţi anorganici din spermă; prevenirea aglutinării spermilor etc. Dintre substanţele organice, o mare importanţă prezintă: fructoza, acidul citric, inozitolul, fosforil-colina şi fosforil-gliceril-colina.
Fructoza
este principalul glucid din spermă. Ea a fost depistată pentru dată în sperma de taur; ulterior s-a descoperit şi în sperma altor specii. Conţinutul de fructoză a spermei este, la 100ml, în medie de 540mg la taur, 247mg la berbec, 15mg la armăsar, 12mg la vier. Secretatq yn cea mai mare parte de glandele seminale, fructoza constituie sursa principală de energie pentru spermi. Secreţia fructozei este favorizată de testosteron, iar sinteza ei este condiţionată de declanşarea unor mecanisme hormonale. Există o corelaţie semnificativă între cantitatea de fructoză din spermă şi procentul de fecunditate obţinut. Determinarea indicelui de fructoliză constituie o metodă eficace pentru aprecierea calităţii spermei. Dintre alte substanţe de natură glucidică, în spermă se găsesc: glucoza, galactoza, arabinoza, riboza şi ribuloza.
În afară de fructoză şi de celelalte monozaharide sperma conţine cantităţi însemnate de sorbitol, secretat de glandele seminale. Sorbitolul serveşte, de asemenea, ca sursă energetică pentru spermi, găsindu-se în cantităţi care variază în limite foarte mari în sperma diferitelor specii: la berbec – 26-120mg/100ml, la taur – 10-136mg/100ml, la vier – 6-18mg/100ml, la armăsar – 20-60mg/100ml spermă.
Acidul citric
este unul din constituenţii caracteristici ai spermei, care îndeplineşte multiple roluri, cum sunt: activator al fosfatazei alcaline, absolut necesară în anumite faze ale glicolizei anaerobe; împreună cu sodiul şi potasiul, acidul citric contribuie la realizarea presiunii osmotice a lichidului spermatic. Ca şi fructoza, este secretat în deosebi de glandele seminale, sub influenţa testosteronului. Sărurile acidului citric (citraţii) sunt elemente ale sistemului-tampon
al spermei, de aceea adausul de citrat de sodiu
în materialul seminal prelungeşte termenul de viabilitate a spermilor. Sperma diferitelor specii conţine, în medie, următoarele cantităţi de acid citric la 100ml sperma: la taur – 720mg, la vier – 130mg, la berbec – 120mg, la armăsar – 26mg. Starea de întreţinere a animalului influenţează conţinutul de acid citric din spermă influenţează conţinutul de acid citric din spermă, ca şi de celelalte substanţe reducătoare.
Inozitolul
s-a descoperit iniţial în sperma de vier, fiind secretat de glandele seminale, având o asemănare de structură cu glucoza şi fructoza, face să se presupună că ar juca rolul de intermediar chimic între glucide şi hormonii androgeni. Conţinutul de inozitol, la 100 ml spermă este: la vier 605-702mg, la taur 63,4mg, la berbec 40mg, la armăsar 37,5mg.
Fosforil-colina
şi gliceril-fosforil-colina
constituie conţinutul total al fosforului existent în plasma seminală. Gliceril-fosforil-colina este secretată, în principal, de epididim şi se găseşte în cantitate destul de mare în sperma tuturor speciilor. În spermă, gliceril-fosforil-colina se găseşte ca atare, dar ea este descompusă în elemente mai simple (colină, fosfoglicerol, glicerol liber) sub acţiunea enzimelor secretate de aparatul genital femel; din aceste considerente, gliceril-fosforil-colina constituie o sursă de energie pentru spermi după depunerea lor în organele genitale femele.
Prin determinări chimice, s-a constatat prezenţa în spermă a vitaminelor A,C,D, a vitaminelor din complexul B, a vitaminei PP. Dintre acestea vitamina C este indispensabilă viabilităţii spermilor, lipsa ei determinând creşterea procentului de infecunditate. Cantitatea de acid ascorbic în spermă este cu mult mai mare decât în sânge (4-14mg% în spermă faţă de 0,2-0,4mg% în sânge). În 100g testicul se găsesc următoarele cantităţi de vitamina C: la taur – 29,39mg, la armăsar 46mg, la iepure 14mg.
Sperma conţine hormoni steroizi
elaboraţi de testicul. În sperma tuturor masculilor se găsesc hormoni androgeni, şi în cantitate mai mică – hormoni estrogeni, cu excepţia spermei de armăsar, unde estrogenii sunt în cantitate mai mare.
Lichidul seminal conţine şi Prostaglandină F2
alfa
în concentraţii care nu depăşesc 100mg/ml şi care, prin acţiunea ocitocică asupra miometrului, favorizează transportul spermilor în căile genitale femele.
Atât lichidul spermatic, cât şi spermii conţin numeroase enzime cu importanţă deosebită, mai ales pentru activităţile vitale ale celulelor seminale. Din acestea fac parte: catalaza, fosfatazele, mucinaza, tripsina, hialuronidaza etc.
Fosfatazele
sunt enzime cu rol important în metabolismul glucidelor. Activitatea fosfatazică este mai intensă la masculii care beneficiază de un regim raţional de hrănire, îngrijire şi exploatare, în timp ce la animalele subalimentate, extenuate etc. activitatea fosfatazelor este mai redusă, deşi concentraţia spermei variază în limite normale. Fosfataza acidă este secretată în cea mai mare parte de glanda prostată, fiind ca şi fructoza, un indiciu al activităţii androgene. Fosfataza alcalină, secretată îndeosebi de glandele seminale, intervine în procesul de hidroliză a fructozei.
Mucinaza
este o enzimă secretată de glandele anexe ale aparatului genital, cu rol de a lichefia mucusul cervical care, în ultimele ore ale căldurilor, este mai vâscos, constituind un mediu nefavorabil pentru înaintarea spermilor depuşi în conductul genital.
Tripsina
este o enzimă secretată de glandele anexe, cu acţiune mucolitică asupra gelului periovocitar. Se căseşte în sperma păsărilor domestice (cu excepţia gânsacului), iar la animalele domestice este prezentă numai în sperma de câine. Activitatea tripsinei este asemănătoare hialurinidazei.
Hialuronidaza
se formează în epiteliul seminifer al testiculului la animalul adult şi se găseşte în spermi, lipsind în plasmă. Cercetările efectuate au confirmat ipoteza că această enzimă se află mai ales în capul spermatozoidului. Hialuronidaza facilitează procesul pătrunderii spermatozoidului în ovul prin dislocarea celulelor foliculare care formează coroana radiată; pentru denudarea ovulului de celulele foliculare este necesar un număr foarte mare de spermi care să elibereze o cantitate crescută de hialuronidază.
Cunoaşterea compoziţiei chimice a spermei contribuie mult la pregătirea diluanţilor care permit menţinerea şi prelungirea viabilităţii spermilor în produsul conservat.
Morfologia spermului
Spre deosebire de celelalte celule din organismul animal, spermii sunt celule flagelate, având atât potenalitate eriditară paternă, cât şi proprietatea de a se mişca.
Pentru prima dată spermii au fost observaţi în anul 1677 de către studentul Hamm din Leida, în sperma de om, iar doi ani mai târziu gameţii au fost observaţi în sperma animalelor, de către Leuwenhoech.
Celula spermatică la animalele se deosebeşte de ovul ca mărime, formă şi mobilitate. Lungimea spermului este de aproximativ de două ori mai mică decât diametrul ovulului, iar volumul gametului mascul este de circa 60000 ori mai mic decât cel al gametului femel. Mărimea spermilor variază în limita de 50-80microni. Astfel, la taur şi berbec lungimea spermului este de 75-80microni, la ţap – 60-65microni, la armăsar 50-60microni şi la vier – 50-55microni.
Studiul morfologic al spermilor a fost posibil datorită coloraţiilor vitale, tehnicilor biochimice şi, îndeosebi microscopiei electronice.
Sub aspect morfologic spermul este format din: cap
, gât
, piesa intermediară
, piesa principală
şi piesa terminală
. Cele trei piese (intermediară, principală şi terminală) alcătuiesc la un loc flagelul sau coada spermului.
Capul spermului
la mamifere este ovoid, alungit, aplatizat şi uşor convex, cu grosimea maximă la bază şi îngustat la vârf, având lungimea şi lăţimea de 8-10 microni şi respectiv – 4-4,5microni la taur, berbec şi vier, 5-7 şi respectiv 2,7-4 microni la armăsar, câine şi cotoi; grosimea spermilor la toate speciile este de 0,1-0,15 microni.
Din punct de vedere al structurilor chimice, capul spermului este format, în special, din nucleoproteide şi cantităţi mici de proteine libere, lipide şi săruri. Nucleoproteidele conţin acid dezoxiribonucleic (AND) şi o proteină simplă, care, în cazul mamiferelor este o histonă, iar în cazul păsărilor – o protamină. Histonele sunt reprezentate de circa 18 aminoacizi, dintre care arginina constituie aproximativ 25%. AND-ul reprezintă circa 55% din substanţa uscată a capului spermului, iar împreună cu histonele – 80-83%. În afară de nucleoproteide capul spermului conţine şi lipoproteine (17-20%), care sunt concentrate în special, în acrozom.
În componenţa capului intră mai multe formaţiuni: nucleul, acrozomul, perforatorul, capişonul sau furoul postnuclear, protuberanţele bazale, fosa de implantaţie şi membrana celulară.
Nucleul constituie partea principală a capului spermului. Cromatina nucleară conţine acidul dezoxiribonucleic (43%), care reprezintă depozitul codificat al caracterelor ereditare, printre care figurează şi cele de sex.
Partea anterioară a membranei nucleare constituie membrana internă a acrozomului şi formează corpul acrozomului.
Aproximativ 60% din suprafaţa nucleului anterior este acoperit de capişonul acrozomului, care are un perete dublu de 0,1 micorni grosime şi încorporează substanţa acrozomală, corpusculii, corpul şi vacuolele acrozomale. Restul de 40% din nucleu şi membrana nucleară, de la zona ecuatorială spre baza capului este învelit de furoul nuclear. Prin forma sa, acrozomul constituie la conturarea profilului caracteristic al extremităţii anterioare a capului spermului, pentru fiecare specie în parte.
Perforatorul este o formaţiune densă situată între membrana nucleară şi acrozom. I se atribuie rol în perforarea membranei ovulare în timpul fecundaţiei.
Protuberanţele bazale sunt nişte formaţiuni semicirculare sau sferice aşezate în zona posterioară a capului, în jurul fosei de implantaţie, respectiv în jurul inserţiei gâtului spermului.
Fosa de implantaţie este o înfundare hemisferică a părţii posterioare a nucleului, în care se găseşte implantată extremitatea apicală a filamentului axial al cozii spermului.
Membrana multistrat celulară acoperă complet capul, corpul şi coada spermului, membrana externă a acrozomului putându-se detaşa spontan în coada epididimului la masculi cu absenţă sexuală îndelungată; prin ruperea membranei celulare şi a membranei externe a învelişului acrozomului în zona ecuatorială se eliberează hialuronidaza necesară penetrării ovulei.
Gâtul reprezintă piesa de legătură dintre capul şi coada spermului. Este o formaţiune dintre capul şi coada spermului. este o formaţiune foarte scurtă dispusă între centriolul proximal şi jumătatea anterioară a centriolului distal. Teaca mitocondrială de 0,1 microni îşi află originea în granulele bazale ale capului, care generează o structură mitocondrială dublu spiralată în sensul acelor de ceasornic, care se continuă în piesa intermediară până la inelul terminal Jensen.
În structura piesei intermediare, cu lungimea de 10-15 microni, intră fibrele filamentului axial care sunt dispuse astfel: 2 fibrile centrale, 9 fibrile subţiri care constituie cercul intern şi 9 fibrile groase formând cercul extern. Filamentul axial este îmbrăcat de o cămaşă mitocondrială, dispusă sub forma unui filament spiralat dublu. La exterior se găseşte o membrană bogată în lipide. Aceasta provine din protoplasma celulară, în special din resturile aparatului Golgi, grupate iniţial la nivelul gâtului. Treptat protoplasma se distribuie de-a lungul piesei intermediare; acest proces are loc în timpul tranzitului epididimar şi constituie unul din fenomenele importante ale maturării spermului. În cazul când nu se produce acestă disperare protoplasma grupată la nivelul gâtului sau piesei intermediare, constituie picătura protoplasmatică. Prezenţa picăturii protoplasmatice este un indiciu al imaturităţii spermului. Piesa intermediară este constituită în cea mai mare parte din substanţe lipoproteice. În ea se găsesc grupate majoritatea enzimelor spermului. Piesa intermediară furnizează energia necesară proceselor metabolice din spirala mitocondrială.
Piesa principală sau coada propriu-zisă (lungă de 35-45 microni şi groasă de 0,4-0,8 microni) este delimitată de inelul lui Jensen, situat la jumătatea externă a centriolului distal, şi distal de piesa terminală.
Fibrele din coada spermului, repartizate tot după formula 2+9+9 sunt acoperite de un înveliş fibrilar spiralat alcătuit dintr-o pereche helicoidală cu mai mult de 400 de înfăşurări.
Piesa terminală are 3-4 microni lungime şi este constituită din porţiunea terminală a fibrelor acoperite cu membrana celulară şi din care lipseşte învelişul spiralat fibrilar al cozii spermului.
Coada spermului conţine lipoproteine, proteine simple şi lipide (circa 23%). În compoziţia lipidelor intră fosfolipide (73,3%), colesterin (14,5%), gliceride (9,6%) şi ceară (2,6%). Dintre substanţele minerale cele mai importante sunt fosforul, care ocupă 2,7% din substanţa uscată a spermului, sodiul, potasiul, calciul, magneziul şi sulful.
Mişcarea, fenomenul fiziologic caracteristic spermului, este rezultatul contractilităţii fibrelor din filamentul axial. Rolul cel mai important îl au fibrele din cercul extern. Se susţine, că punctul de plecare al contractilităţii se află în granulele bazale de la nivelul gâtului. Energia este furnizată de moleculele mici, care se distrug în procesul de contractilitate şi sunt refăcute de mitocondriile filamentului axial.
Proprietăţile biologice ale spermei
Reuşita însămânţărilor artificiale este legată de viabilitatea şi capacitatea fecundantă a spermei, care, la rândul său, este asigurată de proprietăţile biologice ale materialului seminal. Principalele caracteristici biologice ale spermei sunt: mobilitatea aglutinarea şi metabolismul spermilor.
Mobilitatea reprezintă una din caracteristicile principale ale spermilor, prin care aceştia se deosebesc de celelalte celule ale organismului. Mobilitatea reprezintă un factor indispensabil viabilităţii spermilor.
Mobilitatea şi viabilitatea spermilor necesită utilizarea energiei chimice şi transformarea ei în energie biologică. Mişcarea spermului în baza energiei biologice, se datorează porţiunii sale terminale, care are o structură similară ciliatelor şi flagelatelor. Mişcarea gameţilor este determinată de contracţiile cozii (flagelului) şi de rotirea spermului în jurul axei sale longitudinale. Prin contracţiile cozii se asigură mişcarea de avansare, iar capul, prin forma sa uşor exavată (convexă) determină rotirea în jurul axei sale longitudinale. În felul acesta, spermul execută mişcarea de «sfredelire şi înaintare».
Spermii pot realiza trei feluri de mişcări:
· de înaintare sau rectiline
· circulară sau «în manej»
· de pendulare sau vibratoare
Pentru mamifere şi păsări mişcarea de înaintare este considerată normală, pe când mişcările circulară şi vibratoare sunt anormale.
La aprecierea spermei se ţine seama îndeosebi de mobilitatea spermilor determinată de viteza cu care aceştia înaintează în câmpul microscopic, precum şi de procentul de spermi capabili să execute această mişcare.
Viteza de înaintare a spermiilor variază în funcţie de specie, de intervalul de timp când se examinează sperma după recoltare, de pH-ul spermei de temperatura mediului ambiant etc. pe specii, viteza medie de înaintare pe minut este următoarea: la armăsar – 5,22 mm, la taur – 4,02 mm, la berbec – 3 mm, la câine – 2,08 mm. Aceste date sunt posibile la un pH al spermei caracteristic spermei şi la temperatura obişnuită a organismului animal (37-38°C).
Aglutinarea spermilor constă în alipirea sau încleierea acestora, sub formă de rozetă sau dezordonată ca urmare a diminuării sau pierderii totale a sarcinii electrice negative. Aglutinarea este reversibilă, în cazul când spermii se reunesc în formă de rozetă, alipindu-se numai de capul, iar mobilitatea cozii este păstrată şi ireversibilă, când gameţii se alipesc de toată suprafaţa celulară şi rămân imobilizaţi (aglutinare dezordonată sau totală).
Scăderea sau absenţa sarcinii electrice negative are loc la apariţia în spermă a particulelor încărcate cu sarcină electrică pozitivă. Aglutinarea spermilor se produce mai ales la creşterea concentraţiei ionilor de hidrogen ca urmare a acumulării în mediu a acidului lactic. Astfel, într-un mediu cu aciditate scăzută (pH 5-6,4) spermii se adună sub formă de rozetă, iar când aciditatea este mai mare se produce aglutinarea dezordonată (totală) a spermilor şi aceştea nu mai fac mişcări. Aglutinarea spermilor apare uşor în prezenţa ionilor metalelor polivalente, precum şi sub acţiunea aglutininelor spermatice, prezente în materialul seminal şi în vaginul femelei. Formarea aglutininelor spermatice este reacţia organismului femel la pătrunderea parenterală a proteinelor spermatice. Prin urmare, la femelele tinere, nulipare aglutininele lipsesc sau sunt într-o cantitate mică, pe când la femelele însămânţate şi mai ales la cele multipare aglutininele sunt în cantităţi mari. Posibilitatea aglutinării spermilor trebuie luată în considerare şi la utilizarea diluanţilor lapte-ou sau la adăugarea în diluanţi a plasmei sanguine.
Aglutinarea spermilor poate fi prevenită prin reacţia de antiaglutinare. În condiţii naturale, în conductul genital femel aglutinarea spermilor este prevenită de antiaglutininele, care se conţin în lichidul folicular al ovarului şi în sperma masculului (în secreţia prostatică). Datorită acestor particularităţi aglutinarea spermilor la animalele sănătoase se înregistrează rar.
Metabolismul
Reprezintă procesul biologic fundamental prin care se asigură energia necesară mobilităţii şi viabilităţii spermilor. Substanţele energetice se găsesc în spermi sau în plasma seminală, ceea ce demonstrează existenţa a două surse energetice. Astfel, s-a demonstrat că produsele metabolice se produc atât la nivelul spermilor, cât şi în plasma seminală. Spermii pot utiliza energia chimică necesară mobilităţii şi viabilităţii în mediul anaerob, dar şi în cel aerob.
Metabolismul în mediul aerob. La baza metabolismului aerob stă mecanismul glicolitic. El se caracterizează prin activitate respiratorie intensă însoţită de diminuarea progresivă a fructozei şi apariţia în spermă a acidului lactic. În mediul aerob spermii folosesc ca substrat energetic glucidele şi în primul rând, fructoza. Ca rezultat al metabolismului apare acidul lactic. O parte din fructoză este oxidată până la stadiul de CO2
şi H2
O. Rezultă că în condiţii de aerobioză spermii manifestă şi activitate respiratorie (consum de oxigen), a cărei intensitate depinde în mare măsură de concentraţia spermei. Astfel, volumul de oxigen (mm3
) consumat în decurs de o oră la temperatura de 20°C de către 100 milioane de spermi variază în funcţie de specie:
La taur – 3,4
La berbec – 8,4
La armăsar – 4,3
La vier – 7,2
Coborârea temperaturii spermei până la 10°C reduce intensitatea activităţii respiratorii de 2 ori. La temperatura de 0°C activitatea respiratorie a spermilor se manifestă foarte slab. Creşterea acidităţii mediului inhibă respiraţia, iar alcalinizarea mediului o intensifică.
Spermii uşor oxidează şi sorbitolul, secretat de glandele seminale. Acesta serveşte, de asemenea, ca sursă energetică pentru spermi. În anumite cantităţi sorbitolul în spermi se formează din fructoză şi glucoză. Deoarece fructoza se conţine în cantităţi mai mari în sperma rumegătoarelor şi cantitatea de sorbitol este mai mare în sperma acestor reproducători: la taur – 10-136 mg%, la berbec – 26-120 mg%, la vier – 6-18 mg% şi la armăsar 20-60 mg%.
Activitatea respiratorie la spermi se produce datorită enzimelor în special sub influenţa citocromoxidazei. În prezent în spermă a fost descoperit întregul complex de fermenţi oxidanţi. Cantitatea enzimelor din spermă variază în funcţie de specie: cantitatea enzimelor din sperma de armăsar şi vier este de câteva ori mai mare decât din sperma rumegătoarelor.
De obicei, în procesul de metabolism, spermii folosesc substanţele energetice (zahărurile) care se găsesc în plasma seminală; în cazul epuizării rezervelor din spermă, gameţii folosesc fosfolipidele care constituie principala sursă de energie intracelulară. Mai mult se utilizează fosfolipidele din sperma berbecului, probabil de aceea că în sperma acestuia rezervele de zahăr se epuizează în 3-6 ore.
Etapele mecanismului fosfolipidic decurg după următoarea schemă generală:
- degradarea hidrolitică a fosfolipidelor;
- oxidarea acizilor graşi.
Acest tip de metabolism în care se folosesc numai substanţe energetice intracelulare, denumit şi metabolism endogen, nu este însoţit de formarea acidului lactic.
Spermii sunt celule care fac parte din anaerobii facultativi, adică gameţii se pot mişca atât în condiţii de aerobioză, cât şi în condiţii de anaerobioză.
În sperma masculilor de tip vaginal de însămânţare naturală (taur, berbec) se conţin cantităţi importante de zaharuri (până la 1500 mg%), pe când în sperma reproducătorilor de tip uterin de montă naturală se evidenţiază numai urme de zahăr, de aceea spermii la aceste specii nu sunt capabili, sau manifestă o capacitate slabă de glicoliză.
Metabolismul în mediul anaerob. În condiţii de anaerobioză, substratul energetic al spermilor este preluat numai din mediul ambiant, adică din plasma seminală. Ca şi în mediul aerob, spermii folosesc ca substrat energetic monozaharidele: fructoza, glucoza şi manoza, rolul cel mai important avându-l fructoza. Între glicoliza aerobă şi anaerobă există următoarea deosebire esenţială: în glicoliza aerobă o parte din acidul lactic rezultat prin descompunerea monozaharidului este oxidată mai departe până la obţinerea de H2
O şi CO2
, constituind prin aceasta o sursă de energie suplimentară, care duce la scăderea consumului de monozaharide; în glicoliza anaerobă acidul lactic, care constituie produsul final al glicolizei, nu mai suferă în continuare procesul de oxidare.
În sperma animalelor domestice, eliberarea de energie se face pe baza proceselor oxidative şi glicolitice. La taur, berbec şi ţap, fiindcă sperma este bogată în glucide şi săracă în electroliţi, au loc ambele procese (de intensitate egală). La armăsar, vier şi câine, specii la care sperma este săracă în glucide şi bogată în electroliţi, predomină procesele oxidative.
Intensitatea mecanismului glucolitic este mai mare la un pH de 7,6; în cazul acidulării mediului până la pH 6,4 sau la alcalinizarea acestuia procesul de glicoliză slăbeşte.
Principalul glucid din spermă este fructoza. Secretată în cea mai mare parte de glandele seminale ea constituie sursa principală de energie pentru spermi. De aceea, în spermii, care se găsesc în canalele şi epididimul testicular procesul de fructoliză nu are loc.
La adăugarea în spermă a glucozei coeficientul de respiraţie creşte, ceea ce denotă intensificarea utilizării zahărului de către spermi. Spermul este o celulă cu permeabilitate ridicată şi permite trecerea din plasmă a zahărului, de aceea includerea în compoziţia mediilor de diluţie a zahărurilor prelungeşte viabilitatea gameţilor, prevenind totodată epuizarea rezervelor energetice proprii. Prin membrana celulară a spermului uşor trece glucoza sau fructoza, mai greu trec dizaharidele şi este impermebilă pentru zaharuri fosforilate.
Din problemele complicate ale metabolismului spermilor, pentru aplicarea practică a însămânţărilor artificiale este important că gameţii mamiferelor în mediul ambiant sunt capabili să consume oxigen şi glucoză, iar în cazul prezenţei zahărului aceştea pot trăi şi se mişca şi fără oxigen. Astfel, în condiţii de anaerobioză spermii trăiesc mai mult decât în prezenţa oxigenului. Pe această capacitate a spermilor se bazează metoda de păstrare a spermei sub un strat de ulei de vazelină, care limitează aeraţia, iar prin urmare şi procesele de oxidare.
Odată cu acumularea acidului lactic spermii trec într-o stare de anabioză; la alcalinizarea mediului şi ridicarea temperaturii mobilitatea gameţilor se restabileşte. Anabioza acidă poate fi folosită la conservarea spermei. Trecerea spermilor în stări de anabioză permite mărirea termenului de păstrare a spermei în afara organismului până la câteva zile.
Prin încălzire sau alcalinizarea mediului spermii se scot din starea de anabioză.
După cum am menţionat mai sus, una din caracteristicile principale ale spermilor este mobilitatea, adică capacitatea de a se mişca activ pe baza energiei provenită din mecanismul glicolitic şi activitatea respiratorie. Pentru a se mişca, spermii necesită acid adenozin-trifosforic (ATP). Sperma taurilor fertili conţine 7-11 mg% de ATP. Scăderea nivelului de ATP până la 3 mg% reduce fecunditatea spermilor. Prin procesele de fructoliză are loc transformarea fructozei ce duce la apariţia unei importante cantităţi de energie chimică. Aceasta se acumulează sub formă de ATP, care ulterior, prin desfacerea legăturilor macroergice, furnizează energie pentru contractarea cozii spermului. În coada spermului a fost pusă în evidenţă spermozina, analog al actomiozinei din muşchi. Sub acţiunea spermozinei, care are proprietăţi enzimatice se desfac legăturile macroergice ale ATP, din care apar acidul adenozin-difosforic şi acidul fosforic; în rezultatul acestui proces spermii sunt asiguraţi cu energie. Activitatea enzimatică a spermozinei este optimă la nivelul pH-ului de 8,3, de aceea, alcalinizarea spermei intensifică mobilitatea spermilor. Adaosul de ATP în spermă nu modifică mobilitatea spermilor deoarece membrana celulei spermatice nu lasă să treacă acidul adenozin-trifosforic. Glucoza, adăugată la spermă, ameliorează procesul de glicoliză, iar prin urmare, şi activitatea respiratorie a spermilor, menţinându-se astfel mobilitatea lor.
Raportul dintre intensitatea proceselor de glicoliză şi activitatea respiratorie a spermilor la animalele domestice determină două tipuri de spermă:
- Spermă care conţine cantităţi mai mari de zaharuri şi slab asigurată cu enzime cito-respiratorii. Spermii sunt capabili de glicoliză şi activitate respiratorie în măsuri egale. Aşa tip de spermi este caracteristic pentru tauri, berbeci şi ţapi;
- Spermă care conţine doar urme de zahăr, în schimb este bine asigurată cu fermenţi cito-respiratori. Predomină procesele de activitate respiratorie; datorită conţinutului redus de zaharuri se cheltuie în scopuri energetice, cu preponderenţă lipidele. Este caracteristică armăsarilor, vierului şi câinelui.
Acţiunea asupra spermilor a factorilor de mediu
Deoarece o mare varietate de factori fizico-chimici şi biologici afectează grav viabilitatea spermilor, la prelevare şi prelucrarea materialului seminal trebuie să se cunoască acţiunea asupra gameţilor a diferitor factori de mediu, cum ar fi: temperatura, lumina, presiunea osmotică, reacţia mediului, flora bacteriană etc.
Temperatura. Viabilitatea şi mobilitatea optimă a spermiilor se menţine o anumită perioadă de timp la temperatura fiziologică, de 37-38°C. Ridicarea temperaturii până la 40°C asigură activizarea mobilităţii gameţilor, însă brusc se reduce termenul de viabilitate al spermilor. La temperatura de 45°C gameţii mor datorită coagulării proteinelor spermatice.
Coborârea treptată a temperaturii reduce activitatea cinetică a celulelor spermatice, deoarece are loc inhibarea (diminuarea) proceselor de respiraţie şi glicoliză. La temperatura de 15°C mişcarea spermiilor devine vibratorie, iar după răcirea până la +5°C mişcarea gameţilor încetează – apare anabioza termică a spermiilor. Există o relaţie invers proporţională între temperatura şi termenul de păstrare a viabilităţii spermiilor. Răcirea spermei într-un interval de timp scurt, precum şi trecerea bruscă de la temperaturi ridicate la temperaturi coborâte provoacă la spermi şocul termic (frigorific), exprimat prin pierderea capacităţii fecundative de către gameţi, apariţia formelor teratologice de spermi şi chiar moartea acestora.
Există mai multe teorii şi ipoteze referitoare la producerea şocului termic, însă nici una nu elucidează complet mecanismul apariţiei acestuia. Se consideră că un rol important în acest sens îl au procesele de osmoză şi difuzie din spermă. Cu cât aceste procese decurg mai lent, cu atât manifestările şocului sunt mai atenuate.
Şocul termic se manifestă deja la temperatura de +25-20°C, însă spermii sunt mai sensibili faţă de acest fenoment la răcirea spermei proaspăt recoltată mai jos de +18°C. De aceea, în sala de recoltări şi în laboratorul unde se lucrează cu sperma, temperatura nu trebuie să fie sub limita de +18°C.
Posibilitatea apariţiei şocului termic trebuie luată în seamă mai ales la prelucrarea spermei de taur şi berbec, care datorită volumului mic al ejaculatului, se răceşte mai repede.
În practica însămânţărilor artificiale, pentru atenuarea şocului termic se foloseşte gălbenuşul de ou de găină. Lecitina, conţinută în gălbenuş, se absoarbe la suprafaţa gameţilor şi formează o peliculă, care protejează membrana celulară a spermiului şi îl face să reziste la acţiunea şocantă a frigului. Altă metodă de prevenire a şocului termic este coborârea treptată a temperaturii până la +4-2°C, care face posibilă adaptarea spermiilor la regimul de temperatură dat.
Punerea spermiilor în condiţii de anabioză, prin crearea unor temperaturi scăzute, stă la baza conservării materialului seminal prin refrigerare sau congelare. După reanimare, prin ridicarea temperaturii, gameţii îşi restabilesc mobilitatea şi capacitatea fecundantă.
Lumina. Razele solare directe omoară spermii în timp de 20-40 minute. Lumina difuză nu influenţează viabilitatea gameţilor. Prin urmare, la prelevarea şi procesarea materialului seminal se evită acţiunea asupra ejaculatelor, a razelor solare directe.
Reacţia mediului. Este proprietatea fizico-chimică a spermei care reprezintă gradul de aciditate sau concentraţia ei în ioni de hidrogen. Între pH-ul spermei, concentraţie şi metabolism există o strânsă corelaţie. Astfel în sperma deasă de berbec şi taur pH-ul are tendinţă de aciditate (6,6-6,9), ca rezultat al metabolismului cumulat în acid lactic al spermiilor, în timp ce la sperma rară de armăsar şi vier pH-ul este uşor alcalin (7,0-7,9), din cauza numărului redus de gameţi care eliberează mai puţin acid lactic.
Glucoza este considerată ca sursă principală de energie a spermiilor atât în mediul aerob cât şi în cel anaerob; la sperma cu o concentraţie ridicată în fructoză se constată diminuarea într-un timp foarte scurt al pH-ului dat de acumularea acidului lactic: la valoarea pH-ului de 6,3-6,4 apare anabioza acidă a spermiilor. Acest principiu este pus la baza conservării spermiilor. Acest principiu este pus la baza conservării spermei la temperatura camerei (+16-18°C) şi în medii uşor acide (prin barbotarea mediilor cu CO2
).
Creşterea în continuare a acidităţii (pH<6,2) datorită acumulării ionilor de hidrogen determină moartea spermiilor prin distrugerea tegumetnului lipoproteic, dispariţia sarcinii electrice negative şi aglutinarea acestora.
Deplasarea pH-ului în sensul alcalinizării, iniţial activizează mobilitatea gameţilor, iar mai târziu aceştea mor.
Carbonaţii, fosfaţii şi citraţii sunt elementele care formează sistemul tampon al spermei, datorită căruia gameţii sunt capabili să reziste o anumită perioadă de timp la modificările pH-ului.
Presiunea osmotică. Presiunea osmotică a spermei este constantă şi se apropie de cea a sângelui. Plasma seminală este izotonică cu aceea a spermiului, întrucât presiunea osmotică a ei este egală cu presiunea osmotică din interiorul gametului.
Spermii sunt foarte sensibili faţă de modificările presiunii osmotice, adică faţă de concentraţiile substanţelor din lichidul în care se găsesc. De aceea, este necesar să se ţină seama la stabilirea mediilor de diluţie, întrucât modificarea acestora spre hipotonie sau spre hipertonie, faţă de presiunea osmotică a plasmei seminale, duce la micşorarea viabilităţii şi la moartea spermiilor.
Indiferent de situaţie, se impune ca diluanţii pentru conservarea spermei să fie izotonici cu spermii şi ca acestea să nu vină în contact cu apa.
Pentru spermă sunt izotonice soluţiile de clorură de sodiu de 1%, bicarbonat de sodiu de 1%, citratul de sodiu de 3%, glucoza de 6,4% etc.
Flora microbiană. Există o corelaţie directă între gradul de contaminare a spermei cu microbi şi fungi, calitatea materialului seminal şi fecunditatea (rata concepţiei) la animale. În condiţii naturale, la reproducătorii sănătoşi, în tubii seminiferi, canalul epididimar, canalul deferent şi porţiunea incipientă a uretrei microorganismele lipsesc. Însă, datorită contactului pe care sperma o are, în timpul ejaculării cu diferite segmente ale aparatului urogenital sau cu diferite aparate şi instrumente în timpul examinării şi prelucrării, la care se poate adăuga influenţa atmosferei sălilor de recoltare, este imposibil de a se obţine un material seminal steril.
Stabilirea celor mai importante locuri la nivelul cărora sperma poate fi poluată microbian creează posibilităţi reale pentru limitarea infectării materialului seminal cu germeni patogeni sau condiţionat patogeni. Această acţiune, la care se adaugă şi aseptizarea realizată prin diferite antibiotice şi sulfamide ce se introduc în diluanţii pentru spermă, are repercusiuni directe asupra păstrării viabilităţii spermiilor în condiţiile conservării îndelungate.
În general, sursele de contaminare ale spermei pot fi externe şi interne.
Mediul înconjurător, în care se efectuează recoltarea şi prelucrarea spermei, reprezintă una din cele mai importante surse de contaminare. Cele mai frecvente surse externe sunt: atmosfera din adăposturile reproducătorilor, sălile de recoltare şi laboratoarele, precum şi instrumentele cu care se recoltează şi se efectuează examinarea şi prelucrarea spermei.
Numărul de germeni din adăposturile pentru reproducători variază mult, în funcţie de o serie de factori: curenţi de aer, mişcarea animalelor, umiditate, felul aşternului. În general, numărul de microorganisme din adăposturile de taurine este între 120 şi 2500/m3
de arer. În condiţii de igienă necorespunzătoare numărul microbilor atinge 1,6milioane/m3
.
Sursele interne de contaminare a materialului seminal îşi au originea mai ales la nivelul organelor aparatului genital. Astfel, flora bacteriană nepatogenă şi patogenă, specifică şi nespecifică din spermă reflectă gradul de contaminare a aparatului genital.
Căile de contaminare a organelor genitale şi deci a spermei pot fi:
· calea hematogenă – principala în contaminarea cu leptospire sau cu Brucella;
· calea canaliculară – principala cale de contaminare a glandelor anexe, a epididimului şi uneori chiar a testiculelor.
Furoul poate fi sursă importantă de infecţie ascendentă, mai ales la vier, datorită particularităţilor anatomice ale acestuia.
Dintre germenii nepatogeni în spermă se identifică Streptococi, diplococi, stafilococi etc. Dacă rezistenţa animalului scade, germenii pot deveni patogeni.
Germenii patogeni nespecifici din spermă sunt E. coli, Corynebacterium piogenes, Pseudomonas, Stafilococus piogenes, germenii din genul Proteus. Germenii din genul Proteus, E. coli şi Pseudomonas, în asociaţie cu stafilococul piogen, determină o proporţie ridicată de anomalii morfologice şi scăderea capacităţii fecundante a spermei; pe lângă importante modificări enzimatice, aceştea pot infecta şi femelele, prin însămânţări artificiale.
Germenii din flora bacteriană specifică prezintă un tropism particular pentru aparatul genital mascul, în această grupă fiind încadraţi Brucella abortus, Vibrio foetus, Trichomonas foetus, Listeria monocytogenes, uneori şi Mycobacterium tuberculosis. Însămânţarea femelelor cu astfel de spermă contaminată conduce la apariţia infecţiilor genitale.
Deseori în spermă sunt descoperiţi fungi patogeni (Candida albicans, Aspergillus, Apsidia, Mucor etc.) care favorizează apariţia endometritelor, iar în cazul instalării gestaţiei pot provoca moartea produşilor concepţionali.
Acţiunea substanţelor chimice. Majoritatea substanţelor chimice sunt toxice pentru spermi. Dintre substanţele neorganice mai toxice sunt sărurile şi oxizii metalelor grele (mercur, plumb) care blochează sistemele enzimatice ale gameţilor. Sunt periculoşi pentru spermi de asemenea şi oxizii zincului, aluminiului, ferului, cuprului etc., de aceea în practica însămânţărilor artificiale se folosesc instrumente nichelate sau confecţionate din sticlă şi material plastic, iar sticlăria – din sticlă neutră.
Vaporii de creolină, lizol, terebentină, eter, xeroform, iodoform ş. a. au o acţiune nocivă asupra spermiilor chiar de la distanţă. Trebuie de luat în seamă, de asemenea, acţiunea nefavorabilă asupra spermiilor a fumului de tutun, a parfumului, precum şi a mirosului de ceapă şi usturoi.
O acţiune foarte toxică asupra gameţilor exercită detergenţii, acizii neorganici, un şir de acizi organici şi oxidanţii.
Mai puţin toxice pentru spermi sunt nitrofuranele. Sulfamidele şi antibioticele au o acţiune relativ inofensivă asupra spermiilor, de aceea în cantităţi admisibile se adaugă în mediile de diluţie pentru spermă.
Necătând că în practica însămânţărilor artificiale este contraindicată aplicarea remediilor dezinfectante, totuşi pentru dezinfecţia instrumentelor se folosesc substanţe de acest fel. Mai bine venit în acest sens s-a dovedit a fi alcoolul etilic. Spre deosebire de alte substanţe dezinfectante, acesta repede se evaporă şi se dizolvă bine în apă. Cu alcool de 70% se dezinfectează utilajul, dispozitivele pentru recoltarea spermei, precum şi instrumentarul pentru însămânţarea artificială.
Rămăşiţele de alcool rămase pe instrumentar după dezinfecţie se înlătură cu un tampon de vată îmbibat în soluţie de clorură de sodiu de 1%.
Bazele ştiinţifice ale recoltării spermei de la masculi
Activitatea de reproducere la masculi este generată de reflexele sexuale: de apropiere, erecţie, salt şi îmbrăţişare, intromisiune şi ejaculare. Modul de manifestare a reflexelor sexuale are un rol important în desfăşurarea proceselor de reproducere.
Evoluţia normală a reflexelor sexuale are ca urmare eliminarea unei sperme în cantitate normală şi de calitate superioară. Dereglarea sau excluderea unuia din reflexele sexuale are drept consecinţă imposibilitatea manifestării celorlalte reflexe sau elaborarea unei sperme calitativ inferioare şi în cantitate mai mică.
Reflexele sexuale, după cum se ştie, fac parte din grupa reflexelor înnăscute sau necondiţionate. Desfăşurarea lor, deci actul sexual în totalitate, se produce sub influenţa sistemului neuroendocrin. O contribuţie importantă în reglarea normală a proceselor reproductive o au hormonii sexuali, care menţin reactivitatea sistemului nervos şi stabilesc un anumit grad de excitabilitate.
În timpul vieţii animalului, peste reflexele necondiţionate se suprapun reflexele condiţionate sau dobândite. Ele se formează sub influenţa condiţiilor de viaţă ale reproducătorului (alimentaţie, întreţinere, exploatare), le întăresc pe cele necondiţionate şi asigură labilitatea comportamentului sexual al masculului, adică adaptarea celui din urmă la noile condiţii de reproducţie.
În centrele de însămânţare artificială, la o activitate sexuală desfăşurată în condiţii favorabile are loc formarea şi consolidarea reflexelor sexuale pozitive, pe când nerespectarea sistematică a condiţiilor în timpul prelevării spermei (existenţa de zgomote, prezenţa unor persoane străine, schimbarea tehnicianului recoltator şi a locului unde se face recoltarea) determină suprapunerea reflexelor condiţionate negative, care fac dificilă recoltarea materialului seminal.
La masculii animalelor agricole şi mai ales la tauri şi vieri uşor se formează şi se întăresc reflexe sexuale condiţionate prin prezenţa unor femele care nu sunt în călduri, unor masculi şi chiar unor manechine care nu se aseamănă neapărat cu femelele din specia respectivă.
Diferenţierea neînsemnată în comportamentul sexual al masculilor şi în special nespecificitatea reflexului de salt şi îmbrăţişare precum şi crearea unor condiţii similare cu cele din timpul intromisiunii fac posibilă recoltarea spermei de la reproducători; prin urmare la baza prelevării spermei de la masculi stă formarea şi întărirea reflexelor condiţionate pozitive.
Principii şi metode de recoltare a spermei
Prelevarea spermei constă în provocarea artificială a ejaculării, fără a avea loc actul sexual între mascul şi femelă. Fiind o operaţiune foarte importantă, mulţi cercetători au căutat să amelioreze metodele de colectare a spermei, fără să prejudicieze sănătatea masculului. În afară de aceasta, metodele de recoltare a spermei trebuie să asigure colectarea ejaculatului fără pierderi, fără afectarea spermilor, precum şi asigurarea unei calităţi sanitare înalte a materialului seminal.
Metodele existente de recoltare a spermei de la reproducători se împart în:
· metode uretrale, ce permit obţinerea spermei nemijlocit din uretra masculului;
· metode vaginale, care ţin de colectarea spermei din vaginul femelei după actul montei.
Metodele uretrale de recoltare a spermei
Recoltarea spermei cu vaginul artificial
În prezent este cea mai răspândită formă pentru recoltarea spermei de la reproducătorii animalelor agricole. Vaginul artificial pentru prima dată a fost inventat de cercetătorul italian Giuseppe Amantea (1914), iar ulterior a suferit modificări şi îmbunătăţiri în vederea adaptării lui pentru recoltarea spermei la toate speciile (Walton, Ivanov, Milovanov, Comisarov, Lipatov, Rodin).
Principiul recoltării spermei cu vaginul artificial constă în asigurarea condiţiilor existente în vaginul natural al femelei în călduri: temperatură, presiune, lubrifiere.
Vaginul artificial este alcătuit din următoarele părţi:
· un tub cilindric rigid sau semirigid confecţionat din cauciuc (taur, vier), ebonită (berbec) sau tablă (armăsar);
· o cămaşă subţire de cauciuc;
· un pahar colector.
Tubul vaginal pe lungimea lui prezintă un orificiu astupat cu un dop sau un robinet de ebonită şi un mâner pentru fixarea vaginului în timpul recoltării (la armăsar).
În vaginul artificial pentru tauri se folosesc pahare colectoare din sticlă cu pereţii dubli sau colectoare de o singură întrebuinţare, confecţionate din polietilenă, în formă de con.
În vaginul artificial pentru berbeci se folosesc pahare colectoare din sticlă cu pereţii dubli sau simpli. Paharele colectoare cu pereţii dubli, la un capăt au o depresiune în formă de con, pentru spermă, iar la capătul opus au o adâncitură în formă de pâlnie, cu un orificiu pentru a turna apă caldă în spaţiul dintre pereţi: 50ml în paharul colector pentru vaginul berbecului şi 100ml pentru vaginul taurului. Temperatura apei turnate trebuie să fie de 35-40°C, iar în paharul colector, în momentul recoltării spermei, după încălzirea pereţilor lui, de 30-35°C. După umplerea paharului colector cu apă. Orificiul se astupă cu un dop de cauciuc.
Paharele colectoare cu pereţii dubli protejează sperma de răcirea bruscă şi sunt folosite când temperatura este mai joasă de +18°C.
În calitate de pahar colector în vaginul artificial pentru vieri se foloseşte un borcan de sticlă de 500-1000ml. În borcan se montează un filtru de masă plastică pentru filtrarea secretului glandelor bulbo-uretrale.
Paharul colector pentru vaginul artificial al armăsarilor este confecţionat din cauciuc.
Pregătirea vaginului artificial
Asamblarea vaginului se face prin introducerea cămăşii vaginale în lumenul tubului vaginal şi răsfrângerea ei peste capetele acestuia. Între cele două componente se creează astfel un spaţiu care este umplut cu apă caldă şi aer (la unele specii). Pentru fixarea cămăşii se folosesc inele de cauciuc la ambele capete.
Cămaşa vaginului trebuie moderat intensă în aşa fel, încât să se creeze cute longitudinale. Cutele helicoidale împiedică intromisiunea şi desfăşurarea corectă a reflexelor sexuale.
Spălarea şi dezinfectarea vaginului se face cu ajutorul unor perii cu coadă lungă, cu apă călduţă, în care se poate adăuga o cantitate mică de bicarbonat de sodiu (2-3%), se clătesc cu apă curgătoare. Sterilizarea vaginului se face, apoi prin autoclavare. În centrele de reproducţie fiecare reproducător are două vagine artificiale, care după sterilizare se păstrează în dulapuri-termostate la temperatura de 42°C, urmând să se pregătească înainte de recoltare.
Prin orificiul din peretele tubului vaginal se introduce apă caldă în aşa fel, încât în timpul recoltării temperatura interioară în vaginul artificial să fie de 40-42°C.
Cantitatea de apă turnată în vagin şi temperatura ei la diferite specii de reproducători
| Reproducătorul
|
Modelul vaginului
|
Cantitatea de apă, ml
|
Temperatura apei, °C
|
| Taur
|
Scurt, de cauciuc
|
300
|
60-65
|
| Berbec
|
De ebonită
|
150-180
|
50-55
|
| Vier
|
De cauciuc
|
300-400
|
60-65
|
| Armăsar
|
De tablă
|
1500-1800
|
50-60
|
Presiunea este creată de apa caldă şi de aerul care se introduce printr-un dispozitiv din ebonită, de forma unui robinet ataşat la dopul vaginului.
Lubrifierea cămăşii vaginale, prin care se imită mucusul estral, se realizează prin ungerea acesteia cu diluant steril pentru spermă. La unul din capetele vaginului artificial se ataşează paharul colector, care la taur se fixează cu un inel de siguranţă, pentru a nu fi azvârlit în timpul recoltării.
Este strict necesar ca recoltarea spermei cu vaginul artificial să se facă în condiţii igienice, pentru a se evita contaminarea materialului seminal cu diferiţi agenţi infecţioşi şi parazitari.
Recoltarea spermei cu vaginul artificial se face fie pe femele în călduri, fie pe femele care nu sunt în călduri, pe alţi masculi fie pe manechine. Operaţia de prelevare se efectuează în sala de recoltare.
Recoltarea spermei prin masajul ampulelor canalelor deferente. La tauri, înainte de recoltarea spermei, perii de pe furou se tund. Fără contactul prealabil al taurului cu vaca, recoltarea spermei este imposibilă. De aceea taurul este contactat cu femela pentru excitaţia sexuală, sub acţiunea căreia sperma din epididimul testicular se deplasează în ampulele canalelor deferente. Ulterior, mâna lubrefiată se introduce în intestinul rect, se pipăie gâtul vezicii urinare şi ampulele canalelor deferente, amplasate anterior de glandele seminale. În urma mişcărilor de netezire a dilatărilor ampulare şi a glandelor anexe are lor ejacularea.
Recoltarea spermei prin fistula uretrală prezintă interes teoretic şi practic. Metoda este practicată mai mult la armăsari şi permite recoltarea unei sperme absolut sterile cu un potenţial înalt de fecunditate. Reproducătorii cu fistule uretrale pot fi utilizaţi în reproducţie timp îndelungat.
Pentru recoltarea spermei prin fistulă se execută uretrostomia perineală. Operaţia se face în aşa fel, încât capătul interior al fistulei să se situeze la nivelul planşeului bazinului, între tuberozităţile sciatice. La câteva zile după operaţie armăsarii se adaptează la condiţiile noi; pentru actul micţiunii ei acceptă poza caracteristică iepelor, în aşa fel încât nu-şi udă membrele cu urină. La trei-patru săptămâni după operaţie reproducătorul poate fi folosit pentru recoltarea spermei.
Înainte de recoltarea spermei baza cozii se înfăşoară cu o bandă de tifon, iar marginile fistulei se prelucrează cu un tampon îmbibat cu o soluţie de acid boric, ser fiziologic de clorură de sodiu sau cu alcool de 50-60%. În momentul saltului armăsarului pe iapa în călduri, coada masculului se dă într-o parte, iar la fistulă se ataşează un vas steril. În urma ejaculării sperma se acumulează în vasul alăturat.
Recoltarea spermei prin masturbaţie a fost aplicată pentru prima dată de către Spallanzani, la câine. Ejacularea se produce în urma presiunii mecanice asupra penisului. Prin acest procedeu se poate recolta sperma de la câine şi vier. Se execută cu degetele, prin traversul furoului, masaje, mai ales la extremitatea penisului, unde se găsesc mai multe terminaţii nervoase. Penisul intră în erecţie, şi după 10-12 min. masculul ejaculează.
Recoltarea spermei prin masaj abdominal dă rezultate bune la cocoşi. Pentru reuşita operaţiei, cocoşul este contenţionat de un ajutor, într-o poziţie convenabilă. Se efectuează cu degetul mare şi cel arătător de la mâna dreaptă un masaj sub forma unor compresiuni, în sens cranio-caudal de la stern până la regiunea ischio-pubiană. Cu degetele corespunzătoare de la mâna stângă operatorul apasă din când în când pe pereţii cloacei.
Recoltarea spermei cu aparatul electro-ejaculator. Metoda se bazează pe excitaţiile produse de curentul electric asupra centrului ejaculator din măduva lombară, în urma căreia se produc contracţii ale musculaturii netede din pereţii căilor spermatice şi are loc ejacularea. Electro-ejacularea se poate aplica la berbec, taur şi păsări.
Metodele vaginale de recoltare a spermei
Recoltarea spermei cu ajutorul buretului. Metoda era folosită în primii ani de stabilire a însămânţărilor artificiale, la recoltarea spermei de la tauri, berbeci şi armăsari. Esenţa metodei constă în folosirea unui burete, care, după o prelucrare respectivă, se introduce în vaginul unei femele în călduri, după ce se admite actul montei. După ejaculare buretele se extrage din vagin şi se scurge sub o presă specială. Metoda folosirii buretelui la recoltarea spermei are următoarele neajunsuri:
· buretele, ca corp străin, poate să deregleze dinamica ejaculării, determinând inhibiţia reflexelor sexuale şi, în cele din urmă, diminuarea volumului ejaculatului;
· tehnica pregătirii buretelui este complicată; pentru aceste scopuri este necesară o prelucrare specială;
· în urma presării buretelui, mulţi spermi se traumează;
· buretele introdus în vagin absoarbe cantităţi considerabile de mucus vaginal care influenţează negativ viabilitatea spermilor.
Metoda recoltării spermei cu speculumul vaginal
Sperma se aspiră din vaginul femelei după actul montei cu ajutorul speculumului vaginal şi seringii. Această metodă se aplică la vaci, oi şi iepe; la cabaline colectarea spermei este posibilă numai când canalul cervical este închis.
Metoda vaginală de recoltare a spermei este simplă, însă nu şi lipsită de neajunsuri:
· o parte din spermă se pierde printre pliurile mucoasei vaginale;
· ejaculatul se amestecă cu mucus vaginal, care reduce calitatea materialului seminal.
Multe din metodele de recoltare a spermei descrise mai sus, cum sunt prelevarea cu ajutorul buretelui, cu speculumul vaginal, prin fistulă etc. au astăzi mai mult o valoare istorică şi se folosesc în mod excepţional în cazul în care procedeele curente de recoltare nu dau rezultate.
În prezent, la majoritatea speciilor de animale, recoltarea spermei se realizează cu ajutorul vaginului artificial. În afară de această metodă se mai folosesc: electroejacularea (la berbec, taur, câine, păsări); masajul abdominal (la păsări); masajul ampulelor canalelor deferente şi al glandelor seminale (la taur); masturbaţia (la vier şi câine).
Particularităţi de recoltare, pe specii
Recoltarea spermei la taur
Pentru recoltarea spermei la taur se pot folosi trei metode:
· vaginul artificial;
· electroejacularea;
· masajul ampulelor canalelor deferente şi alveziculelor seminale.
Metoda vaginului artificial
Această tehnică de recoltare permite obţinerea unui ejaculat concentrat, nepoluat, cu însuşiri asemănătoare celui natural şi fără a necesita un personal de calificare înaltă sau precauţie deosebită în manipularea taurilor.
Prelevarea spermei se efectuează în sala de recoltare, special amenajată, după două ore de la hrănire şi adăpare. Vaginul pentru recoltarea spermei la taur este adaptat în funcţie de mărimea penisului şi este individual pentru fiecare reproducător.
În ultimul timp se utilizează dispozitive cu dimensiuni mai reduse, de 30 cm lungime pentru masculii adulţi şi de 26 cm pentru taurii tineri. Ejacularea se realizează în paharul colector de o singură întrebuinţare de formă tronconică, din polietilenă, protejat termic.
La taurine, declanşarea reflexului ejaculării depinde în principal de asigurarea factorului temperatură.
Stimularea sexuală a taurilor înainte de recoltare se realizează prin plimbarea acestora «în cerc» în apropierea sălii de recoltare, reţinerea masculilor câteva momente înaintea saltului, efectuarea unui sau a două salturi în gol pentru donatorii mai puţin pregătiţi, sau schimbarea taurilor manechini. În absenţa libidoului se indică palparea transrectală a aparatului genital sau prezenţa unei femele în călduri; saltul acesteia pe mascul reprezintă pentru el un stimul sexual foarte puternic.
Electroejacularea se aplică la taurii tineri, la care recoltarea se face cu uşurinţă, la masculii cu un libidou scăzut sau la cei cu impotenţă de copulaţie, uneori chiar la cei destinaţi montei naturale pentru aprecierea calităţii spermei.
Metoda utilizează dispozitive anale, cu lungimea de 30-35 cm şi diametrul cuprins între 6 şi 9 cm, izolate electric pe toată lungimea, cu excepţia extremităţii interne, care are trei electrozi, orientaţi longitudinal şi poziţionaţi ventral.
Se mai utilizează un electrod de formă inelară, care se introduce pe degetul arătător, protejat de mănuşa de cauciuc. Operatorul fixează acest dispozitiv la baza ampulelor canalelor deferente sau deasupra prostatei.
În pregătirea taurului donator sunt necesare următoarele:
· contenţia fermă într-un travaliu care împiedică alunecarea, căderea din timpul aplicării curentului electric;
· vidanjarea de fecale a ampulei rectale şi curăţirea electrozilor, ambele în scopul realizării unui bun contact electric al dispozitivului cu peretele rectului;
· tunderea perilor prepuţiali, perierea şi spălarea zonei învecinate, apoi uscarea acesteia;
· obţinerea unui ejaculat complet, de bună calitate, este condiţionată de excitarea sexuală a donatorilor sau de masarea transrectală a glandelor anexe ale aparatului genital înainte de recoltare.
Perioadele de stimulare electrică nu trebuie să depăşească 2-3 secunde atunci când animalul se află în apnee, acestea alternează cu pauze de 1 secundă. În mod obişnuit sunt necesare 4-19 reprize de stimulare pentru realizarea erecţiei şi exteriorizarea penisului şi 18-35 pentru ejaculare completă; se foloseşte o sursă de curent electric cu frecvenţa de 30-40 cicluri şi o tensiune de 15-20 volţi. După realizarea erecţiei, mărirea tensiunii curentului electric aplicat grăbeşte ejacularea.
În timpul electroejaculării taurul este agitat, manifestă contracţii tetaniforme şi cifoze.
Erorile în aplicarea electroejaculării şi modalitatea de corectare se referă la:
- absenţa erecţiei – se modifică poziţia dispozitivului anal sau se împinge înainte flexura sigmoidală a penisului, acţionând înapoia pungilor testiculare;
- o stimulare prea frecventă a taurului în faza incipientă a electroejaculării se soldează cu obţinerea de lichid seminal;
- aplicarea unor stimuli electrici cu parametrii prea mari va determina o preerecţie şi pierderea ejaculatului în prepuţiu.
- Izolarea electrică defectuoasă a dispozitivului anal, poziţionarea sa laterală, pot induce contractura musculaturii membrului posterior ipsilateral prin excitarea nervului ischiatic. Unii tauri se înclină pe o parte şi fac extensie pe membrul posterior.
Masajul ampulelor canalelor deferente şi al veziculelor seminale
Această tehnică are aceleaşi indicaţii ca şi electroejacularea. Pregătirea reproducătorului este identică cu cea a electroejaculării; contenţia taurului, tunderea perilor prepuţiali, toaleta furoului.
Se vidanjează ampula rectală şi se trece apoi la identificarea veziculelor seminale şi ampulelor canalelor deferente. Masajul se efectuează în sens cranio-caudal pe o distanţă de aproximativ 30 cm, timp de 3-5 minute, după care, de obicei, se produce ejacularea. În timpul eliminării spermei, testiculele sunt uşor retrase spre inelul inghinal, iar glandul iese parţial din furou, fără ca penisul să intre în erecţie.
Metoda este practică şi avantajoasă, nu necesită condiţii speciale de recoltare, dar ea poate fi aplicată numai de specialişti cu cunoştinţe bune în topografia organelor aparatului genital mascul.
Factorii care limitează extinderea ţin de următoarele:
· Unii tauri nu răspund pozitiv la această metodă. În cazul când nu se obţine eliminarea spermei în 8-10 minute, se recomandă să se renunţe la masaj şi operaţiunea să fie repetată în ziua următoare;
· Contactul materialului seminal cu mucoasa prepuţială poate determina contaminarea cu microbi a materialului seminal;
· Masajul intrapelvian al diferitelor segmente ale aparatului genital poate provoca urinarea şi compromiterea astfel a ejaculatului.
Recoltarea spermei la armăsar
Recoltarea spermei de la armăsar impune prezenţa unei femele în călduri naturale sau provocate prin injectarea a 10-20 mg estradiol, cu 24-48 ore înainte de recoltare, deoarece se cunoaşte că recoltarea spermei prin metode solitare este imposibilă la această specie.
Prelevarea artificială a materialului seminal la armăsar urmăreşte să facă posibilă examinarea calităţii de reproducători a masculilor aflaţi în depozite şi mai rar, în scopul efectuării însămânţărilor artificiale.
Factorii limitativi pentru extinderea metodei sunt:
· aspectul neomogen al ejaculatului care se datorează componentei spermatice cu vâscozitate înaltă (secreţie a veziculelor seminale, care trebuie îndepărtată înaintea prelucrării);
· spermii cabalinelor prezintă o sensibilitate «in vitro» deosebită, fapt care afectează posibilitatea conservării spermei pe termen mediu sau lung;
· recoltarea spermei prezintă un grad ridicat de risc pentru personalul recoltator;
· poluarea frecventă a ejaculatului cu secreţiile prepuţiale, care sunt foarte abundente.
Materialul seminal de la armăsar se obţine prin utilizarea vaginului artificial sau prin metoda fistulei uretrale (descrisă anterior).
Metoda vaginului artificial
Vaginul artificial pentru armăsar se deosebeşte de cel utilizat la alte specii prin dimendsiunile mai mari. Tubul vaginal este confecţionat din tablă zincată, aluminiu sau mase plastice, având lungimea de 55 cm, diametrul interior la un capăt de 16 cm, iar la celălalt de 13 cm. Corpul vaginului este prevăzut cu un mâner ce serveşte la manipularea dispozitivului.
Pregătirea pentru recoltare constă în spălarea şi dezinfectarea riguroasă a penisului şi furoului.
Pregătirea partenerei pentru recoltare constă în contenţionarea acesteia cu ajutorul platlogelor şi iavaşalei; baza cozii se înfăşoară cu o bandă de tifon. Armăsarul este introdus în sala de recoltare de doi îngrijitori cu ajutorul a două pene de căpăstru. Tehnicianul ce recoltează sperma, se aşează în partea dreaptă a iepei şi ţine cu mâna dreaptă vaginul artificial sprijinit de grupa acesteia sub un unghi de 35-40°C. Când armăsarul face saltul, operatorul cu mâna stângă prinde penisul de la bază şi îl dirijează în lumenul vaginului. După ejaculare vaginul artificial împreună cu penisul se dirijează cu paharul colector în jos, pentru ca sperma să se scurgă pe pereţii ei. În aşa poziţie vaginul artificial se ţine până se termină eliminarea spermei. Eliminarea spermei la armăsar este însoţită de încetarea mişcărilor de copulaţie şi a contracţiei ritmice a muşchilor bazei cozii. Ejacularea la armăsar durează 10-20 secunde, iar volumul ejaculatului constituie 50-100 ml.
După recoltare sperma se filtrează printr-un tifon steril, pentru îndepărtarea smegmei şi masei gelatinoase existente în ejaculat (secreţia veziculelor seminale).
Recoltarea spermei la vier
La vier sperma poate fi recoltată cu vaginul artificial şi prin masturbaţi (metoda manuală). Spre deosebire de alte specii, la suine se realizează uşor recoltarea solitară, pe manechin.
Recoltarea spermei cu vaginul artificial
Vaginul artificial pentru vier, spre deosebire de vaginul altor specii, prezintă unele particularităţi, cu toate că principalele părţi componente sunt aceleaşi: tubul vaginal, cămaşa vaginală, tubul prelungitor de cele mai multe ori se foloseşte o bucată de cămaşă vaginală din vaginul artificial pentru tauri. De obicei tubul vaginal, confecţionat din cauciuc, are lungimea de 30 cm, diametrul de 8-10 cm. Cămaşa vaginală are lungimea de 40-45 cm, iar tubul prelungitor de 20-25 cm. Recipientul colector cu capacitatea de 500-1000 ml este confecţionat din sticlă (un borcan obişnuit) sau material plastic cu pereţii dubli, între care se toarnă apă caldă. Pentru îndepărtarea fracţiunii gelatinoase din spermă (secretul glandelor bulbo-uretrale), la gura recipientului colector se ataşează un filtru de material plastic sau o bucată de tifon, care se fixează cu un inel de cauciuc.
Recoltarea spermei la vier se face pe un manechin de porc, confecţionat din scândură şi acoperit cu muşama. În interiorul manechinului este prevăzut un dispozitiv special, unde se aşează vaginul pregătit. Dispozitivul pentru vaginul artificial se încălzeşte cu lămpi electrice.
Pe pereţii laterali ai manechinului se montează două cuie de lemn pentru sprijinirea membrelor anterioare ale vierului în timpul saltului. Pentru deprinderea vierului să îndeplinească salturi pe manechin la început se admit câteva monte cu scroafe aflate în călduri, ulterior scroafa se înlocuieşte cu un manechin acoperit cu o piele scoasă de pe o scroafă sănătoasă sacrificată. Reflexele sexuale se întăresc după 1-3 salturi pe manechin, însoţite de reflexul ejaculării. Unii masculi reproducători repede manifestă reflexele sexuale pe manechin dacă în prezenţa lor se recoltează spermă de la vierii deja deprinşi să efectueze saltul pe manechin. Reproducătorii de asemenea bine manifestă reflexele sexuale pe manechin, dacă cel din urmă este stropit cu spermă de vier sau secreţia din vaginul unei scroafe în călduri. Manechinul, după fiecare recoltare, se spală cu apă caldă şi săpun, se şterge cu un prosop, apoi se dezinfectează cu o soluţie de 2% de cloramină sau 3% de peroxid de hidrogen.
Metoda manuală de recoltare a spermei
Este o metodă simplă şi nu necesită o aparatură complicată, permiţând obţinerea de ejaculate de bună calitate. Ea se efectuează tot pe manechin.
Imediat după saltul şi îmbrăţişarea manechinului vierul execută câteva mişcări de încercare a intromisiunii. În acest moment operatorul fixează extremitatea spiralată a penisului cu mâna acoperită cu o mănuşă din cauciuc. Fixarea manuală a organului copulator desăvârşeşte erecţia, completa sa exteriorizare fiind facilitată de tracţionarea moderată a penisului, care este dirijat anterolateral şi ventral.
Ejacularea la vier începe aproape imediat după contactul penisului cu mâna recoltatorului, durează în medie 4-6 minute, timp în care vierul donator este liniştit şi îmbrăţişează cu putere manechinul.
Ejaculatul va fi recoltat într-un pahar colector la 38-40°C, avându-se grijă ca paharul să fie acoperit cu un tifon, care reţine partea gelatinoasă (secreţia bulbo-uretrală). De asemenea, primele fracţiuni ale ejaculatului (fracţiunea prespermatică, lipsită de spermi şi cu conţinut ridicat de microorganisme) se vor înlătura colectând numai, odată cu apariţia primelor jeturi «lăptoase», sperma bogată în spermi.
Recoltarea spermei de la berbec
Recoltarea spermei de la berbec, în mod obişnuit, se execută cu ajutorul vaginului artificial şi numai în cazuri excepţionale, mai ales în scop experimental, se realizează prin electrocutare.
Recoltarea spermei cu vaginul artificial
Vaginul artificial pentru prelevarea spermei la berbeci are lungimea de 20 cm şi diametrul de 5 cm. Pentru provocarea ejaculării este necesară asigurarea unei temperaturi de 41-44°C şi a unei presiuni de 40-60 mm coloană de mercur; din punct de vedere concepţional acest dispozitiv este identic cu cel utilizat la taurine.
Recoltarea spermei la berbec se face în camera de recoltare amenajată, unde este adusă o oaie în călduri sau un castrat, care trebuie contenţionat într-un travaliu. Tehnicianul se aşează în partea dreaptă a berbecului, stând pe genunchiul drept, iar cu mâna dreaptă ţine vaginul artificial apropiat de crupa animalului, sub un unghi de 35°. În acest timp mâna stângă o ţine pe furoul berbecului. Când masculul face saltul pe femelă (castrat), operatorul dirijează penisul spre lumenul vaginului artificial. La puţin timp după ce penisul a fost introdus, berbecul efectuează brusc mişcările caracteristice reflexului de ejaculare. Masa spermatică este proiectată în paharul colector. Odată cu coborârea masculului de pe femelă, vaginul artificial se scoate de pe penis, se dirijează cu paharul colector în jos şi se ţine în poziţie verticală pentru ca sperma rămasă pe pereţii camerei să se scurgă în paharul colector. După aceasta paharul colector se scoate şi se transmite în laborator.
Recoltarea spermei prin electroejaculare
La berbeci, electroejacularea prezintă unele deosebiri faţă de tehnica descrisă la taurine. Berbecii se fixează în decubit lateral drept, de obicei pe o scară, ce se aşează pe sol sau masa de lucru. Se face toaleta regiunii furoului cu o soluţie de bicarbonat de sodiu, se extrage penisul din furou, acţionând asupra flexiunii sigmoidale, se fixează cu o meşă sterilă, ce se trece pe la baza glandului, astfel ca apendicele vermiform să fie introdus în recipientul colector.
Dispozitivul bipolar anal, cu lungimea de 30 cm şi diametrul de 2 cm se inseră în rect până în dreptul regiunii lombare, circa 15 cm (se stabileşte contactul electric, dându-se excitaţii electrice în serii de câte 5 secunde la intervale de 10 secunde. Sperma este ejaculată după 3-5 reprize, deoarece actul se produce fără erecţie. Berbecii reacţionează mai promt la electroejaculare.
Dispozitivul se conectează la o sursă de curent electric continuu cu valori ale tensiunii de 2,5 şi 8 volţi.
Examinarea şi aprecierea spermei
Pentru aprecierea fertilităţii unui reproducător, controlul calităţii materialului seminal constituie un factor esenţial. Fecunditatea unui mascul este în funcţie de cantitatea şi calitatea spermei. Noţiunea de calitate a spermei se referă la însuşirile macro- şi microscopice ale ejaculatului, corelate cu fertilitatea spermilor.
Importanţa controlului şi evaluării ejaculatelor rezultă din:
· necesitatea cunoaşterii calităţii ejaculatelor înainte de a se proceda la diluare, în vederea excluderii celor necorespunzătoare;
· necesitatea stabilirii gradului de diluţie optim, al fiecărui ejaculat în parte;
· necesitatea verificării calităţii spermei diluate atât la diferite etape de prelucrare, cât şi în urma conservării;
· necesitatea aprecierii calităţii de reproducători la masculii folosiţi la monta naturală.
Pentru evaluarea cantităţii şi calităţii spermei (ejaculatelor) se folosesc metodele de laborator, care pot fi:
· macroscopice;
· microscopice;
· biochimice;
· bacteriologice.
Aprecierea definitivă a fecundităţii unui mascul reproducător se va face în urma obţinerii rezultatului probei biologice, coroborată cu capacitatea productivă a descendenţilor (testul după descendentă).
Controlul spermei prin metode de laborator
Indiferent de scopul în care s-a realizat, după prelevare sperma este examinată pentru evaluarea însuşirilor macroscopice şi microscopice. Acest examen se efectuează imediat după recoltare, prin asigurarea tuturor cerinţelor pentru a menţine sperma «in vitro» şi a nu deteriora calitatea acesteia.
În acest scop:
· se va utiliza un echipament curat, fără urme de substanţe chimice (alcool, antiseptice de orice fel), agent lubrifiant, lichid prepuţial, apă sau urină;
· sticlăria de laborator trebuie să fie confecţionată din sticlă neutră, curată, sterilizată şi încălzită până la temperatura fiziologică (37-38°C);
· ejaculatul nu se va expune la lumina solară directă şi se va evita variaţia de temperatură a ejaculatului care determină şocarea termică a spermilor.
Examenul macroscopic
Prin examen macroscopic se apreciază volumul ejaculatului, culoarea spermei, mirosul, densitatea şi prezenţa valurilor spermatice.
Volumul ejaculatului
Volumul ejaculatului diferă în funcţie de specie, iar în cadrul speciei de la o rasă la alta şi chiar la acelaşi reproducător, de la un ejaculat la altul. Deterinarea volumului ejaculatului se poate stabili în paharul colector sau în cilindrii gradaţi.
În condiţii optime de recoltare, volumul ejaculatului se menţine în limite constante. Utilizarea unor metode de stimulare sexuală, cum ar fi prezenţa unei femele în călduri, masarea transrectală a anexelor aparatului genital al masculilor şi altele, pot mări volumul ejaculatului şi numărul de spermi din spermă. La masculii tineri volumul ejaculatului este mai redus, în comparaţie cu cel al masculilor adulţi.
Din contra, aplicarea unor tehnici de recoltare neadecvate, o frecvenţă ridicată a recoltărilor, starea de boală, inflamaţia unor anexe ale aparatului genital, precum şi alţi factori, cum ar fi alimentaţia, întreţinerea şi exploatarea neraţională pot provoca reducerea volumului materialului seminal (oligospermatismul) sau chiar sistarea completă a ejaculării (aspermatismul).
Deşi în practica însămânţărilor artificiale s-au stabilit valori minime ale principalelor însuşiri ale spermei, mai jos de care ejaculatele nu se prelucrează, fecunditatea masculilor nu este afectată de scăderea volumului spermei, renunţarea la prelucrarea lor este motivată din punct de vedere economic.
Culoarea spermei
Culoarea spermei diferă puţin de la o specie la alta, dar se află în corelaţie strânsă cu concentraţia de spermi: la taur şi berbec este albă sau asb-cremă; la vier este albă-lăptoasă, cu reflexe albăstrui; la armăsar este albicioasă, uşor cenuşie şi opacă; la câne sperma are un aspect apos şi uşor tulbure, fiind semitransparentă.
Abaterile de la aspectul şi culoarea considerate normale se datorează:
- culoarea maronie apare în orhite şi se datorează pigmenţilor sanguini;
- culoarea roz-roşietică a spermei evidenţiază prezenţa în ejaculat a sângelui care extravazează din tractusul genital, uretră sau penis;
- culoarea gălbuie denotă că sperma este amestecată cu urină;
- flocoanele de puroi modifică culoarea spermei conferindu-i ejaculatului un aspect neomogen; ele provin din ampulele canalelor deferente sau glandele anexe ale aparatului genital;
- infecţiile cu Pseudomonas spiralis modifică în galben-verzui culoarea spermei.
În toate aceste cazuri sperma nu poate fi folosită.
Mirosul spermei
Este specific şi se aseamănă cu cel al mucilagiului de amidon. În cazul când sperma prezintă alte mirosuri care nu corespund cu cel menţionat, acest lucru indică prezenţa unor procese inflamatoare la nivelul căilor genitale şi, în acest caz, se modifică şi culoarea.
Aprecierea valorilor spermatice
La unele specii prin examen macroscopic, în funcţie de densitatea şi mobilitatea spermilor se poate constata prezenţa valurilor, de diferite intensităţi, provocate de mişcările gameţilor. Acest lucru este vizibil în sperma deasă, proaspăt recoltată, la rumegătoare, care prezintă particule fine în continuă mişcare (mai ales la berbec), asemănătoare cu nişte valuri, care se agită în paharul colector sau într-o lamă exavată. Sperma mijlocie şi rară nu prezintă valuri spermatice.
Examenul microscopic al spermei
Acest examen furnizează date mai sigure despre calitatea ejaculatului şi permite să se aprecieze densitatea şi concentraţia spermei, mobilitatea spermilor, procentul de spermi viabili, teratologici sau imaturi etc.
Aprecierea densităţii spermei
Densitatea spermilor în spermă diferă de la o specie la alta, iar în cadrul speciei se constată variaţii între reproducători şi chiar la acelaşi reproducător între două ejaculate. Stabilirea densităţii spermei constă în aprecierea la microscop a distanţei dintre doi spermi. Cu o pipetă sterilă se ia o picătură de spermă şi se pune pe o lamă degrestă încălzită sau pe o plăcuţă încălzitoare. Lama se acoperă cu o lamelă, având grijă să nu se formeze între ele bule de aer. Astfel pregătite, se examinează cel puţin ¾ câmpuri microscopice. În funcţie de distanţele dintre doi gameţi, se deosebesc mai multe categorii de spermă:
Sperma densă se notează cu «D», câmpul microscopic este plin cu spermi, distanţa dintre gameţi este mai mică decât lungimea capului unui sperm. Se constată o concentraţie de peste 1 miliard de spermi la un mililitru.
Sperma mijlocie (M), are o concentraţie de 0,5-1 miliard de spermi pe ml, iar distanţa dintre doi spermi este egală cu lungimea capului unui gamet.
Sperma rarefiată (R) corespunde unei concentraţii mai mici de sub 0,5 miliarde spermi/ml; distanţa dintre doi spermi este mai mare decât lungimea capului, ajungând până la lungimea unui gamet.
Sperma foarte rară (oligospermie) (O) prezintă doar câţiva spermi în câmpul microscopic.
Azoospermie (A) denotă lipsa spermilor din spermă.
În mod normal, la taur, berbec şi ţap se întâlneşte spermă densă şi mijlocie, iar la vier şi armăsar – spermă rară. La vier se poate întâlni spermă mijlocie când recoltarea spermei se întrerupe înainte de fracţiunea postspermatică. La păsări sperma este deasă.
Determinarea concentraţiei spermei.
Concentraţia spermilor pe unitatea de măsură, de obicei miliarde pe milimetru, are mare importanţă în procesul de prelucrare a materialului seminal. De numărul de spermi din ejaculat şi de mobilitatea lor depinde gradul de diluţie a spermei.
Aprecierea concentraţiei spermilor dintr-un ejaculat se poate realiza prin metoda hemocitocolorimetrică, fotocolorimetrică, electronică etc.
Metoda hemocitometrică
Se bazează pe principiul similar cu cel de apreciere a elementelor figurate din sânge, folosindu-se camerele de numărat de tip Goreaev, Thoma, Burker etc. şi pipetele Potain.
În pipeta Potain se aspiră spermă până la diviziunea de 0,5 şi se completează cu o soluţie de clorură de sodiu 3%, până la diviziunea 101 (pentru sperma de berbec şi taur) sau 11 (pentru sperma de vier şi armăsar). Pipeta se menţine în poziţie verticală pentru a se evita formarea bulelor de aer. În continuare se prind capetele pipetei între pulpa degetului mare şi a celui mijlociu şi se agită bine conţinutul acesteia, pentru a se face omogenizarea lui cu ajutorul mărgelelor (albe sau roşii) care se găsesc în ampula pipetei. Se elimină 2-3 picături de spermă diluată şi apoi se depune o picătură pe reţeaua camerei de numărat Goreaev pe care, în prealabil, s-a aşezat o lamelă.
Se procedează în continuare la numărarea spermilor din 5 pătrate mari (respectiv 80 de pătrăţele), luate în diagonala reţelei.
Concentraţia de spermi în spermă/mm3
se calculează după formula:
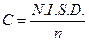 , în care: , în care:
N – numărul de spermi număraţi în 5 pătrate;
I – înălţimea sau adâncimea camerei (1/10mm);
S – suprafaţa unui pătrăţel (1/400 mm2
);
D – gradul de diluţie a spermei (1/200 pentru sperma de taur şi berbec şi 1/20 pentru sperma de vier şi armăsar);
n – numărul pătrăţelelor în care s-au numărat spermii (80).
În cazul spermei de taur şi berbec, cu gradul de diluţie de 1/200, înlocuind formula se obţine: 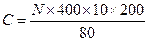 sau sau  , sau formula simplificată este: C=Nx10000 şi pentru a afla numărul de spermi într-un mililitru de spermă, rezultatul se înmulţeşte cu 1000. , sau formula simplificată este: C=Nx10000 şi pentru a afla numărul de spermi într-un mililitru de spermă, rezultatul se înmulţeşte cu 1000.
În cazul spermei de vier şi armăsar, cu gradul de diluţie de 1/20, formula simplificată pentru aprecierea concentraţiei gameţilor este: C=Nx1000, iar pentru exprimarea concentraţiei în spermi/ml rezultatul de asemenea obţinut se mai înmulţeşte cu 1000.
Metoda fotocolorimetrică
Este o metodă rapidă de numărare care se bazează pe diferitele grade de opacitate pe care le are sperma pusă în faţa unui fascicul de lumină ce trece prin dreptul unei celule fotoelectrice.
În practică se folosesc fie fotocolorimetre ce indică direct numărul de spermi în miliarde, fie fotocolorimetre ce trebuie în prealabil etalonate prin măsurători repetate executate prin metoda hemocitometrică.
Metoda electronică
Principiul metodei se bazează pe modificarea de către spermi a câmpului electronic creat de 2 electrozi din platină, plasaţi într-un capilar de pasaj al spermei. Există diferite tipuri de aparate electronice cel mai utilizat fiind tipul Coulter.
Aprecierea mobilităţii spermilor
Mobilitatea spermilor se apreciază în funcţie de mişcările spermilor, care se pot urmări cu uşurinţă în câmpul microscopic. În funcţie de aspectul mişcărilor, într-o picătură de spermă aplicată pe o lamă şi acoperită cu o lamelă, la temperatura fiziologică, putem întâlni mai multe categorii de spermi şi anume:
- spermi cu mişcare de înaintare sau rectilinie;
- spermi cu mişcări circulare sau «în manej»;
- spermi cu mişcări vibratorii sau ondulatorii;
- spermi fără mişcări (morţi).
Posedă fecunditate numai spermii care au mişcări de retropulsie (pendulare), «în manej» şi cei imobili.
În cazul când toţi spermii din câmpul microscopic sunt imobili (morţi), sperma respectivă se notează cu «N» (necrospermie).
Deoarece o mare varietate de factori fizico-chimici şi biologici afectează mobilitatea spermilor, examinarea spermei trebuie efectuată imediat după recoltare, evitându-se variaţiile de temperatură (şocul termic), poluarea cu apă, urină, alte substanţe chimice, lubrefianţi etc. La speciile cu spermă foarte deasă (berbecul), pentru facilitarea examinării microscopice a spermei este indicată diluarea materialului seminal cu o soluţie citrată sau cu clorură de sodiu, sol. 1%.
Pentru aprecierea mobilităţii spermilor, la noi în republică se foloseşte sistemul notelor de la 10 la 1.
Conform acestui sistem, aprecierea activităţii sau mobilităţii spermilor se face astfel:
10 puncte – când toţi spermii au mişcare rectilinie;
9 puncte – când 90% au mişcare de înaintare;
8 puncte – când 80% au mişcare de înaintare;
…2 puncte – când 20% au mişcare de înaintare.
În mod obişnuit, se admit pentru prelucrare ejaculatele notate cu cel puţin 8 puncte la taur şi berbec şi 6-7 puncte la vier şi armăsar, (60-80% spermi cu mişcări active de înaintare).
Spermii care prezintă altfel de mişcări (circulatorii, ondulatorii, retrograde împreună cu cei cu mişcări de înaintare foarte lente sau agonice primesc aceeaşi apreciere ca şi spermii morţi.
Examenul morfologic al spermilor
În sperma reproducătorilor domestici se întâlnesc frecvent, în proporţii variabile, spermi cu diferite anomalii (teratologici), precum şi spermi imaturi, care pot influenţa negativ fecunditatea, când procentul acestora depăşeşte anumite limite. Pentru acest motiv, examenul spermei trebuie completat şi cu determinarea raportului de spermi teratologici şi imaturi.
Anomaliile morfologice ale gameţilor se pot încadra în:
- anomalii primare, determinate de tulburarea spermiogenezei, având o localizare în tubii seminiferi, până la ajungerea în epididim şi constau în alterarea morfologică şi structurală a capului spermului;
- anomalii secundare, care se produc în epididim datorită stagnării prelugite la acest nivel, sau sunt efecte ale acţiunii unor factori termici (şocul termic), chimici sau mecanici din timpul ejaculării şi manipulării spermei. Anomaliile secundare vizează alterarea piesei intermediare sau a cozii gameţilor.
Anomaliile capului pot fi de formă şi mărime şi se referă la micro- şi macrocefalie, spermi cu capul dublu sau multiplu, cap alungit şi îngust, în formă de pară, neregulat şi mic – sferic. Alte anomalii ale capului spermului constau în cap detaşat (liber) şi invaginarea învelişului nuclear.
Anomaliile acrozomului se referă la: acrozom aplatizat, incomplet, curbat sau detaşat.
Piesele intermediare anormale pot fi: îngroşate, răsucite, cu noduri duble, gât filiform şi cu picătura protoplasmatică proximală sau distală. În procesul maturării epididimare a spermilor picăturile protoplasmatice migrează de la gât spre extremitatea distală a piesei intermediare şi dispare de regulă înaintea ejaculării; această migrare a picăturii protoplasmatice se realizează în capul epididimului. Într-un ejaculat normal, procentul spermilor cu picătura protoplasmatică (imaturi) nu trebuie să depăşească 2-3% la berbec şi taur şi 10% la vier şi armăsar. Depăşirea acestui procent denotă epiuizarea sexuală a masculilor.
Afecţiunile epididimului alterează conformaţia normală a piesei intermediare, fapt care reduce mobilitatea spermilor şi se asociază cu infecunditatea.
Examenul morfologic al spermilor poate depista unele forme de anomalii ale cozii: cozi duble sau răsucite, scurte sau absente, picături protoplasmatice localizate proximal sau distal.
După datele din literatura de specialitate, procentul maxim de spermi anormali (teratologici) admişi în sperma de taur este de 18%, inclusiv 3-4% cu anomalii ale capului, 4-10% - la piesa intermediară şi 0,5-2% - la coada spermului.
Berbecii cu o fecunditate normală nu depăşesc 14% incidenţă a spermilor anormali; vierii şi armăsarii au în medie 20% de spermi teratologici.
Determinarea spermilor anormali se face prin utilizarea diferitor metode de colorare, care permit atât aprecierea de ansamblu a gameţilor, cât şi anumitelor aspecte legate de structura lor. Determinarea spermilor cu anomalii primare sau secundare sau a celor imaturi, se poate face prin efectuarea unor frotiuri din spermă, care apoi se colorează cu: Giemsa rapid, fuxină Pfeiffer, soluţie albastru de metilen 1%, eozină 5%, hematoxilină etc.
Din sperma proaspăt recoltată se prepară mai multe frotiuri, care se fixează prin uscare la aer sau în alcool 96°, timp de 2 minute. După fixare se procedează la colorarea cu o soluţie din cele menţionate timp de 3-5 minute. Frotiurile colorate se spală sub un jet mic de apă, se usucă şi apoi se examinează la microscop cu putere de mărire de 200-400 ori. În timpul examenului microscopic se notează separat numărul de spermi normali şi al celor cu anomalii, până se examinează cca 500 spermi. Pe baza numărului de spermi examinaţi se calculează proporţia dintre cei anormali şi normali.
Determinarea proporţiei de spermi vii şi morţi
Se poate realiza printr-o coloraţie intravitală, compusă din 3 gr citrat de sodiu, 100 ml apă distilată, 1 gr eozină şi 5 gr negrozină. Membrana celulară a spermilor morţi devine permeabilă la eozină, astfel că aceştia se colorează în roşu, în comparaţie cu spermii vii, care rămân necoloraţi.
Calculul acestei proporţii rezultă din numărarea a 100-500 celule spermatice şi exprimarea procentuală a gameţilor vii şi morţi dintr-un ejaculat.
Teste biochimice pentru aprecierea calităţii spermei
În practica însămânţărilor artificiale, testele biochimice sunt puţin folosite, totuşi cu valoare de diagnostic sunt: testele de rezistenţă termică, rezistenţa la soluţii hipertonice şi testul reducerii albastrului de metilen.
Proba biologică
Rolul hotărâtor în analiza spermei îl are aprecierea fecundităţii spermilor, realizată prin proba biologică. Concepţia (fecunditatea) depinde de gradul de înrudire al femelei cu masculul, de starea sănătăţii reproducătorilor (femelei şi masculului), condiţiile de alimentaţie şi întreţinere etc. De aceea, pentru aprecierea fecundităţii unui reproducător se alege un grup de femele tinere, nulipare, cu stare de sănătate perfectă, care se montează sau se însămânţează artificial cu sperma masculului respectiv. După numărul femelelor devenite gestante se fac concluzii asupra capacităţii de fecundare a reproducătorului. Astfel, se consideră normală sperma unui reproducător care realizează instalarea gestaţiei, după prima însămânţare, la 70-75% din femele.
Diluarea spermei
Diluarea şi conservarea materialului seminal sunt operaţii prin care se asigură menţinerea viabilităţii şi puterii fecundative a spermilor un timp variabil în afara căilor genitale.
Practicarea însămânţărilor artificiale arată că într-un diluant bine pregătit şi ales spermii îşi păstrează viabilitatea şi celelalte însuşiri biologice un timp mai mult mai îndelungat decât în mediul natural. Aceasta se explică prin următoarele.
În primul rând, plasma seminală, constituită din secreţiile anexelor testiculare şi ale glandelor anexe ale aparatului genital nu serveşte ca mediu ideal pentru păstrarea spermilor în afara organismului. Secreţia slab alcalină a prostatei stimulează mobilitatea spermiilor, care până la acest moment se aflau în canalul epididimar, în stare de anabioză. Acest fenomen este important pentru a asigura înaintarea spermilor prin căile genitale femele şi fecundarea normală a ovulelor. Însă, activarea mobilităţii şi menţinerea viabilităţii spermilor de către produsul de secreţie al glandelor anexe este însoţită de distrugerea tegumentului lipoproteic al spermilor sub acţiunea ionilor de Na+
şi K-
, care se conţin în plasma seminală. Ionii de Na+
şi alte metale neutralizează încărcătura electrică negativă a spermilor şi provoacă aglutinarea lor.
Altă cauză care duce la peirea spermilor în afara organismului este diminuarea resurselor energetice pentru metabolismul celulelor spermatice şi, în primul rând, al zaharurilor. Glucoza este considerată sursă principală de energie a spermilor atât în mediu aerob, cât şi în cel aerob. La sperma cu o concentraţie ridicată şi bogată în fructoză (taur, berbec) se constată diminuarea într-un timp foarte scurt a pH-ului rezultat din acumularea acidului lactic, deci din fructoliză. Ritmul creşterii acidităţii după ejaculare are o semnificaţie importantă; acidul lactic acţionează negativ asupra spermilor, iar concentraţiile mari îi omoară. Scăderea sau absenţa sarcinii electrice, care are loc mai ales în urma acidifierii mediului, este urmată, de asemenea, de aglutinarea spermilor.
Unul din factorii importanţi ai mediului care acţionează asupra spermilor este temperatura. La coborâre bruscă, mai ales sub +18°C spermii sunt supuşi şocului termic
şi mor.
Prin urmare, cauzele concrete care duc la peirea spermilor în afara căilor genitale sunt:
· subnutriţia spermilor ca urmare a epuizării rezervelor energetice din gameţi şi plasma seminală;
· intoxicaţia spermilor cu produsele metabolice;
· deteriorarea tegumentului lipoproteic, exfolierea membranei celulei spermatice şi pierderea sarcinii electrice negative datorită acumulării în plasma seminală a acidului lactic;
· acţiunea negativă asupra spermilor a bacteriotoxinelor şi bacteriolizinelor;
· variaţiile de temperatură care provoacă şocul termic.
De aceea, pentru prelungirea viabilităţii spermilor în afara organismului se impune:
· reducerea activităţii cinetice a celulelor spermatice;
· asigurarea gameţilor cu substanţe nutritive;
· protejarea spermilor de distrugerea tegumentului lipoproteic şi al membranei celulei spermatice;
· diminuarea intoxicaţiei spermilor prin diluarea plasmei seminale.
Toate aceste condiţii le asigură mediile de diluţie care conţin ingridienţi cu proprietăţi protectoare, nutritive, neutralizante etc.
În afară de asigurarea mediilor favorabile pentru prelungirea viabilităţii spermilor «in vitro», diluarea spermei urmăreşte şi alte obiective, printre care: creşterea volumului total al ejaculatului şi posibilitatea de a însămânţa un număr cât mai mare de femele dintr-un ejaculat.
Principiul ştiinţific care stă la baza diluării spermei este acela că din numărul total de spermi depuşi de un mascul în căile genitale feminine prin montă, numai un procent mic de spermi (la taur circa 5%) participă la fecundarea ovulului, iar restul mor. În practică s-a demonstrat că pentru a obţine o rată normală de fecundare la vacă spre exemplu, pentru însămânţare sunt necesare într-o doză de spermă diluată, 12-25 milioane de spermi vii, însă conform cercetărilor mai recente, numai 10 mln şi chiar 5 milioane de gameţi. Rezultă că la stabilirea gradului de diluţie a materialului seminal trebuie să se rezerveze, pentru o doză de inoculare, un minim de 10-12 milioane de spermi cu mişcări active de înaintare.
Se admit pentru diluare şi conservare numai ejaculatele care se încadrează în anumiţi parametri, în funcţie de specie, aşa cum rezultă din tabelul următor.
Valorile medii şi minimale ale principalelor însuşiri ale spermei admise pentru diluare
| Specia
|
Volumul ejaculatului (ml)
|
Concentraţia spermei (miliarde spermi/ml)
|
Mobilitatea spermilor (puncte)
|
Procentul maxim de spermi anormali
|
| Media
|
Minim admisibil
|
Media
|
Minim admisibil
|
Media
|
Minim admisibil
|
| Taur
|
4,0
|
3,0
|
1,2
|
0,6
|
9
|
8
|
18
|
| Berbec
|
1,0
|
0,6
|
3,0
|
2,0
|
9
|
8
|
14
|
| Armăsar
|
75,0
|
40,0
|
0,12
|
0,05
|
6-7
|
5
|
20
|
| Vier
|
250,0
|
150,0
|
0,15
|
0,1
|
7-8
|
7
|
20
|
Condiţiile pe care trebuie să le îndeplinească un diluant pentru conservarea spermei
Menţinerea fecundităţii unei sperme un timp mai îndelungat după recoltare este în funcţie de calitatea diluantului şi metoda de conservare.
În procesul de prelucrare a materialului seminal se utilizează soluţii diluante, care trebuie să întrunească următoarele proprietăţi:
· să fie izoterme – temperatura soluţiei diluante, a sticlăriei diverse cu care sperma intră în contact în timpul procesului trebuie să aibă valori apropiate, evitându-se astfel deteriorarea mobilităţii prin şoc termic;
· să fie izoterme cu sperma – presiunea osmotică adecvată a diluantului se reglează prin echilibrarea cantitativă a ingredienţilor; citratul de sodiu realizează un mediu izotonic cu sperma;
· să aibă un pH apropiat de cel al plasmei seminale (6,2-6,8 pentru sperma de taur şi berbec şi 7,0-7,2 pentru cea de vier şi armăsar);
· să conţină substanţe nutritive pentru spermi; adaosul de glucoză, fructoză sau alte hexoze la diluant reprezintă substratul energetic pentru metabolismul anaerob al celulelor spermatice; alături de alte ingrediente, acestea permit prelungirea semnificativă a duratei de viaţă a spermilor. Fosfolipidele din lapte, lecitina şi lipoproteinele din gălbenuşul de ou reprezintă componentele nutritive şi spermioprotectoare.
Tot în gălbenuşul de ou se remarcă prezenţa triptofanului, tirozinei şi fenilalaninei, care au rol important în procesele de dezaminare oxidativă din spermă, iar colesterolul şi carotenul stimulează activitatea succinică, malică şi gliceroaldehid-3-fosfat-dehidrogenazică în spermi. Alţi compuşi din gălbenuş acţionează ca protectori ai enzimelor sulfhidrilice, servind în cadrul proceselor oxidative şi ca factori antiaglutinanţi în spermă;
· să conţină substanţe crioprotectoare – crioprotecţia este asigurată de glicerină, gălbenuşul de ou, lapte sau dimetilsulfoxid, substanţe care împiedică cristalizarea apei de constituţie şi pe această cale, deteriorarea ireversibilă a membranei celulare a spermilor în timpul congelării.
· să posede o acţiune bacteriostatică şi chiar bactericidă – adaosul de antibiotice sau sulfamide în concentraţii bacteriostatice împiedică multiplicarea microorganismelor din spermă, proces care determină elaborarea unor endo- şi exotoxine bacteriene, ambele extrem de toxice pentru celulele spermatice.
Apa din componenţa diluantului trebuie să fie distilată sau deionizată, deoarece ionii metalelor au un efect toxic asupra spermilor, în caz contrar se utilizează substanţe chelatoare, care complexează aceşti ioni.
Clasificarea diluanţilor pentru spermă
Clasificarea diluanţilor se face după următoarele criterii: compoziţie, scopul şi specia la care se utilizează.
După scopul în care sunt folosiţi diluanţii pot fi clasificaţi în felul următor:
· diluanţi pentru conservarea spermei la temperatura camerei;
· diluanţi pentru conservarea spermei prin refrigerare;
· diluanţi pentru conservarea spermei prin congelare.
În funcţie de compoziţie diluanţii se împart în următoarele grupe:
1 – diluanţi salini (cristaloizi). Se bazează pe folosirea substanţelor chimice (citraţi, fosfaţi, tartaţi, sulfaţi etc.) la care se adaugă gălbenuş de ou pentru protejarea spermilor de şocul termic şi glucide (glucoză, fructoză, lactoză etc.). La ora actuală diluanţii salini sunt cei mai utilizaţi pe plan mondial, încât ei prezintă 70% din numărul total, folosiţi la conservarea spermei. Exemplificăm câţiva diluanţi salini:
Diluanţi cu gălbenuş de ou
Apă distilată 100 ml
Citrat de sodiu + 2H2
O 2,9 grame
Gălbenuş de ou 20%
Se prepară soluţie salină din 29 grame citrat de sodiu şi 1 litru de apă bidistilată, apoi se sterilizează prin fierbere sau autoclavare. În ziua diluării spermei se adaugă 20% gălbenuş de ou proaspăt. La întregul diluant apoi se adaugă antibiotice: 1000 UI penicilină şi 500-1000 gama dehidrostreptomicină. Se pot folosi concentraţii diferite de citrat de sodiu: 3,2-3,6% în loc de 2,9 gr%.
Gălbenuş de ou citratat şi glucoză
Citrat de sodiu (Na3
C6
H5
O7
) cristalizat cu 2 H2
O 1,15 gr
Glucoză anhidră 3,00 gr
Apă distilată 100,0 ml
Gălbenuş de ou 20,0 ml
Gălbenuş de ou citratat şi fosfatat
Fosfat acid de potasiu (PO4
H2
K) 0,2 gr
Fosfat acid de sodiu (PO4
HNa) cristalizat
cu 2 molecule de H2
O 2,0 gr
Apă distilată ad. 100 ml
După răcire se adaugă gălbenuş de ou 20-25%
Gălbenuş de ou citratat cu glicerină
În diluantul cu gălbenuş de ou citratat se adaugă 2-10% glicerină pură. După 3 zile de conservare, acest diluant prezintă o fecundaţie mai bună decât a diluantului gălbenuş de ou citratat neglicerinat.
Diluantul TRIS cu gălbenuş de ou glicerinat, fructoză şi acid citric
Tris hidroximetil-aminometan 6,056 gr
Acid citric 3,0 gr
Fructoză 2,5 gr
Apă distilată 166,320 gr
După prepararea soluţiei se încălzeşte la 90°C, apoi se răceşte şi se împarte în două jumătăţi egale. Înainte de folosirea uneia din părţi se adaugă 15,840 grame de apă bidistilată, 25 grame gălbenuş de ou proaspăt, 0,1 grame streptomicină şi 100000 UI penicilină G. La cealaltă parte a diluantului se adaugă 19,68 grame glicerină pro analisis, 25 grame gălbenuş de ou proaspăt, 0,1 grame streptomicină şi 100000 UI penicilină G; pH trebuie să fie ajustat la 6,85.
|