Лекция 10.Фенолы и нафтолы
Фенолы
– органические соединения, содержащие в молекулах гидроксильную группу, связанную непосредственно с бензольным кольцом.
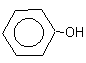
В зависимости от числа ОН-груп в бензольном кольце бывают: одно-, двух и трёхатомные.
Номенклатура и изомерия
1. Тривиальная
(фенол, резорцин, гидрохинон, пирокатехин)
2. Систематическая
(гидроксибензол, 1,3-дигидроксибензол, 1,4-дигидроксибензол, 1,2-дигидроксибензол)
Примеры:
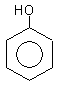 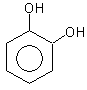 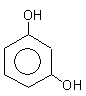
гидроксибензол(фенол) 1,2-дигидроксибензол 1,3-дигидроксибензол
(бензендиол-1,2) (бензендиол-1,3)
(пирокатехин) резорцин
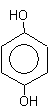 1,4-дигидрокибензол 1,4-дигидрокибензол
(бензендиол-1,4)
гидрохинон.
Изомерия в многоатомных фенолах обусловлена положением ОН-групп.
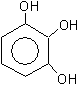 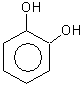 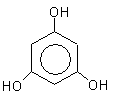
1,2,3-тригидроксибензол 1,2,4-тригидроксибзл 1,3,5-тригидроксибзл
(бензентриол-1,2,3) (бензентриол-1,2,4) (бензентриол-1,3,5)
пирогаллол оксигидрохинон флороглюцин
Способы получения.
1.Фенол получают из каменноугольной смолы.
2.Синтетический путь получения фенола - кумольный метод из изопропилбензола:
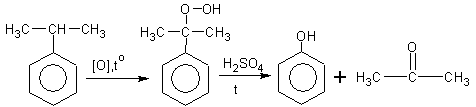
(кумол) гидроперекись фенол ацетон
изопропилбензол кумола
3.Гидролиз хлорбензола (SN
) :
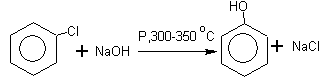
Условия протекания реакции:
а) давление, температура 300-350о
С, автоклав;
б) катализатор - соль Сu +8% p-pNaOH
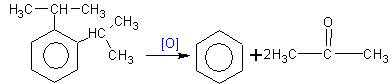
4. Получение двухатомных и трехатомных спиртов синтетическим путём сложнее, чем одноатомных. В природе источником их является сланец.Резорцин получают окислением м-диизопропилбензола, пирокатехин – окислением о-диизопропилбензола, гидрохинон – окислением п-диизопропилбензола:
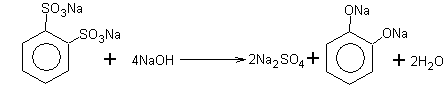
Бензолдисульфокислоты дифенолятдинатриевая соль
После кислотной обработки дифенолят легко превращается в пирокатехин.
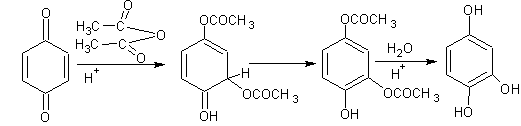
5. Трёхатомные фенолы , например, оксигидрохинон получают из хинона:
Физические свойства.
Фенол
– кристаллическое бесцветное вещество, трудно растворимое в Н2
О. С увеличением количества ОН-групп растворимость фенолов в Н2
О увеличивается. Ядовит, Является антисептиком, при попадании на кожу вызывает ожоги. Имеет tплав
= 43о
С. С Н2
О образует гидрат, называемый карболовой кислотой.
Пирокатехин (
1,2-бензендиол) имеет tплав
= 104о
С. При хранении темнеет. С FeCl3
дает зелёное окрашивание, которое переходит в красное при добавлении NaHCO3
.
Резорцин
(1,3-бензендиол) имеет tплав
= 118о
С.С FeCl3
дает фиолетовое окрашивание.
Реклама

Химические свойства.
Химические свойства определяются ОН-группой и бензольным кольцом
.
1. Фенолы обладают кислотными свойствами.
В отличие от спиртов в фенолах
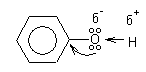
увеличивается поляризация связи О-Н.
oo
СН3
––>O–H
oo
наличие группы СН3
уменьшает поляризацию связи в спиртах
В молекуле фенола неподеленные пары  О вступают во взаимодействие (сопряжение) с π-электронами бензольного кольца. О вступают во взаимодействие (сопряжение) с π-электронами бензольного кольца.
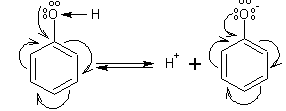
В результате поляризация ОН-группы усиливается и отрыв атома Н облегчается. Фенол -слабая кислота, слабее, чем Н2
СО3
, СН3
СООН,
КД
= 1,8*10-5
СН3
СООН
 КД
= 4,9*10-7
Н2
СО3
у фенола КД
меньше, чем кислот, но КД
= 4,9*10-7
Н2
СО3
у фенола КД
меньше, чем кислот, но
 КД
= 1,3*10-10
фенол КД
= 1,3*10-10
фенол
КД
= 1,8*10-16
Н2
О больше, чем у H2
O
CO2
выделяет свободный фенол из фенолятов.
NB
!!!
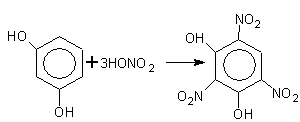
Кислотные свойства фенола можно усилить
. Для этого в бензольное кольцо вводят некоторые заместители, обладающие –J– индуктивным эффектом, например, NO2
.
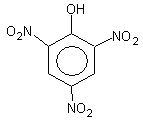
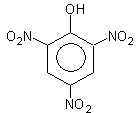
2,4,6-тринитрофенол (пикриновая кислота)
По кислотности пикриновая кислота приближается к минеральным кислотам.
2.
Образование солей (фенолятов)
NB
!!! В отличие от спиртов фенолы реагируют с
NaOH
.
С6
H5
OH + NaOH → С6
H5
ONa + H2
O
фенолят натрия
Фенолят натрия легко гидролизуется под действием кислот, даже таких слабых, как угольная кислота:
С6
H5
OH+CO2
+H2
O––>C6
H5
OH+NaHCO3
3.
Гидрирование
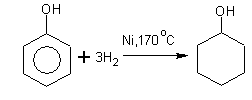 циклогексанол циклогексанол
Реакция используется для получения искусственного волокна (перлон, нейлон, капрон).
4.
Реакции электрофильного замещения:
Так как ОН-группа является ориентантом I-рода , то она направляет другие заместители в о- и n-положения, например:
а) Реакция бромирования
протекает легко в отличие от бензола, даже с бромной водой.
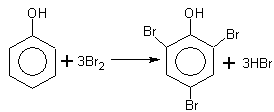
Замещение идёт преимущественно в n-положение, получается смесь о- и n-изомеров.
б) Реакция нитрования
.
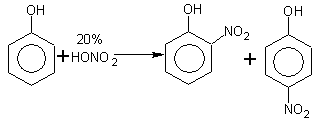
о-нитрофенол n-нитрофенол
Если азотная кислота разбавленная, то при нитровании получают преимущественно о-изомер.
Если кислота концентрированная, то можно получить 2,4,6-тринитрофенол
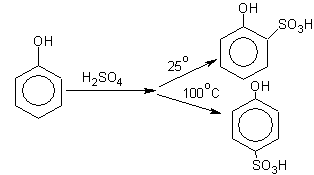
в) Сульфирование
– получение о- или п-изомеров зависит от температуры проведения реакции:
5. Реакция алкилирования фенолов
.
Сначала получают более реакционноспособные феноляты, а затем проводят их алкилирование.
C6
H5
ONa+C2
H5
Br––>C6
H5
OC2
H5
+NaBr
Этилфеноловый эфир
6. Реакция с окисью этилена (ОЭ) – оксиэтилирование
:
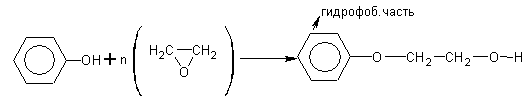
Фениловый эфир полиэтилен гликоля ПАВ
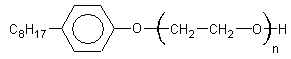
полиэтиленовые эфиры октилфенола
Реклама

Такие эфиры являются поверхностно-активными веществами. Технические названия: ОП-7 (n = 7), ОП-10 (n = 10)
7. Сложные эфиры фенолов можно получить только взаимодействием фенолятов
с галогенангидридами кислот
:
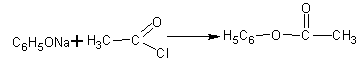
Реакция протекает в пиридине. В результате получается фениловый эфир уксусной кислоты
8. ОН-группа в фенолах с трудом
замещается галогеном
. Облегчить процесс её замещения можно только путем введения в о- и n-положения электроотрицательной группы, например, NO2
:
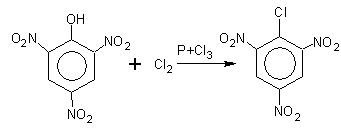
9. Реакции конденсации с формальдегидом или ароматическими альдегидами
:
а) в присутствии Н+
или ОН-
протекает конденсация фенола
c
CH
2
O
в о- и n-положениях. Реакция идет в две стадии. На первой стадии образуется феноло-спирт, который на второй стадии реагирует с фенолом:
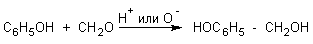
 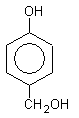
феноло-спирт
 фенолоформальдегидная смола ( новолак) фенолоформальдегидная смола ( новолак)
Таким образом получают так называемые лаковые, бакелитовые смолы.
Если реакцию проводят при нагревании, то конденсация приводит к образованию нерастворимого разветвленного продукта.
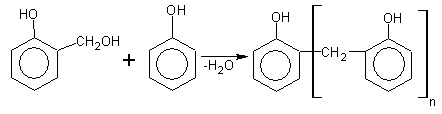
б) с ароматическими альдегидами
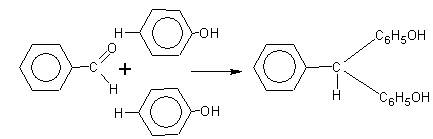
Таким образом получают красители.
Химические свойства многоатомных фенолов
Химические свойства двухатомных фенолов аналогичны свойствам одноатомных, но есть и специфика. Она заключается в следующем:
1. Так как в молекуле имеется две ОН-группы, то двухатомные фенолы проявляют более сильные кислотные свойства
, чем одноатомные. Они реагируют не только со щелочными металлами, но и их гидроксидами.
2. Для двухатомных фенолов характерна реакция образования нерастворимых солей
свинца:
3.

Пирокатехин не растворимая соль свинца и пирокатехина
4. Реакции замещения и конденсации
с участием атома Н бензольного кольца протекают легче, чем у фенола
:
5.
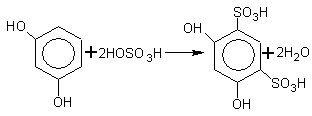
1,5-дигидрокси -2,4- бензолдисульфокислота
6. Двухатомные фенолы легко окисляются
, являясь сильными восстановителями:
7.
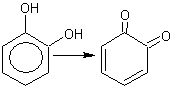 о-хинон о-хинон
Качественные реакции фенолов
Фенол и резорцин –
при взаимодействии с FeCl3
дают фиолетовое окрашивание, образуя трифенолят (трирезорцинолят) железа, пирокатехин и гидрохинон – зелёное и жёлтое окрашивание соответственно.
Применение фенолов
Фенол
– используют в производстве полимеров, красителей, лекарств, взрывчатки.
Гидрохинон
– применяют в фотографии в качестве проявителя. Является ингибитором полимеризации, а также антиокислителем жиров и масел.
Резорцин
– входит в состав красителей, используется в медицине, для синтеза поликонденсационных смол.
Нафтолы
Нафтолы
- это гидроксильные производные нафталина. Различают α-нафтол и β-нафтол в зависимости от положения ОН-групп в кольце. α-нафтол и β-нафтол – кристаллические вещества. β-нафтол имеет более высокую температуру плавления, чем α-нафтол. Оба нафтола трудно р-римы в H2
O. Дают окраску с FeCl3
, растворяются в растворах гидроксида натрия и калия.
Химические свойства
Основной тип реакций, характерный для нафтолов, реакции замещения
, которые идут в соответствии с ранее рассмотренными правилами ориентации.
а) галогенирование
(взаимодействие с Сl2
)
б) нитрование
( взаимодействие с HONO2
)
в) сульфирование
(взаимодействие с HOSO3
H)
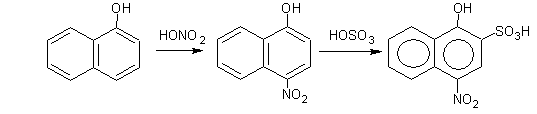
α-нафтол 4-нитронафтол 4-нитро-1-окси-2-нафтолинсульфокислота
Нитрование, сульфирование, хлорирование идут в п-положение по отношению к ОН-группе в том же кольце, в котором находится ОН-группа. Следующий заместитель занимает о-положение.
У β-нафтола замещение протекает в α-положении:
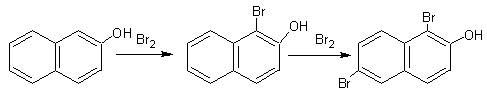
β-нафтол 1-бромнафтол 1,6-дибром-2- нафтол
С хлоридом железа (III) в спирто-водном растворе α-нафтол даёт фиолетовое окрашивание, β-нафтол – жёлтое. Важным является получение эфиров нафтолов. Эфиры нафтола имеют приятный запах. Используются, например, метиловый эфир β-нафтола, в парфюмерии. На основе нафтолов синтезируют красители для тканей.
|