№ 175.
| Дано: |
Розв’язок: |
l = 2;
l = 3
|
Для орбітального квантового числа l = 2, магнітне квантове число може мати п’ять значень: -2, -1, 0, 1, 2.
Для орбітального квантового числа l = 3, магнітне квантове число може мати сім значень: -3, -2, -1, 0, 1, 2, 3.
|
m = ?
|
Окреме завдання: конфігурація
атомних орбіталей атома заліза.
| 4s2
|
4p |
| 3d6
|
  |
| 3p6
|
  |
  |
  |
| 3s2
|
  |
  |
  |
| 2p6
|
  |
| 2s2
|
  |
  |
  |
| 1s2
|
  |
  |
Конфігурація
атомних орбіталей атома заліза у збудженому стані (
Fe+6
)
| 4s1
|
  |
4p1
|
| 3d6
|
  |
| 3p6
|
  |
  |
  |
  |
  |
| 3s2
|
  |
  |
  |
| 2p6
|
  |
| 2s2
|
  |
  |
  |
| 1s2
|
  |
  |
№ 289
| Дано: |
Розв’язок: |
ΔНС
2
Н
4
= 52,3 кДж/моль
ΔНН
2
О
= -285,8 кДж/моль
ΔНСО
2
= -383,5 кДж/моль
|
 Н2
С = СН2
+ 3О2 Н2
С = СН2
+ 3О2
 2СО2
+ 2Н2
О(ж.)
+ 6226 кДж 2СО2
+ 2Н2
О(ж.)
+ 6226 кДж
Визначимо кількість моль етилену, що бере участь у даній реакції. З термохімічного рівняння, використовуючи стандартні ентальпії утворення речовин (
Δ
Н простих речовин = 0)
, що входять в реакцію (подані у довідкових матеріалах підручника)
, запишемо вираз, позначивши кількість моль етилену за Х:
52,3Х = 2Х(-285,8) + 2Х(-393,5) + 6226;
1410,9Х = 6226
Звідки:
Х = 4,41 моль.
З рівняння реакції бачимо, що оксиґену для проходження такого перетворення потрібно в тричі більше ніж етилену, тому νО2
= 3νС2
Н4
= 3*4,41 =13,24 моль.
Звідки об’єм оксигену:
VO2
= νО2
* Vm
=
= 13,24 моль * 22,4 л/моль =
= 296,5л.
|
VO2
= ?
|
№ 398.
| Дано: |
Розв’язок: |
| m 50%
р-на
KOH
= 1кг |
Складемо рівняння, позначивши масу необхідного для розведення розчина за Х:
В 50%-му розчині міститься 500г КОН і 500г Н2
О, тому коли ми додаватимемо 20%-ний р-н, до присутнього в 50%-му р-ні КОН додаватиметься 0.2Х (по масі)
КОН, а загальна маса розчину збільшуватиметься на Х. В результаті розведення має вийти 25% р-н.
Вище сказане можна записати у вигляді виразу:
 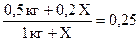 ; ;
0,5кг + 0,2Х = 0,25кг + 0,25Х;
0,25кг = 0,05Х;
Х = 5кг.
|
Отримати
25% р-н КОН
m2
0%
р-на
KOH
= ?
|
№ 540.
| Дано: |
Розв’язок: |
Р-н С СН3
СООН = 0,01н
К СН3
СООН = 0,042
|
Рівняння дисоціації:
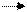 СН3
СООН СН3
СООН  СН3
СОО –
+ Н + СН3
СОО –
+ Н +
Запишемо вираз для константи дисоціації оцтової кислоти:
 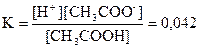 ; ;
З умови, що даний розчин 0,01н слідує – концентрація
[CH3
COOH] = 0,01 моль/л
Враховуючи [CH3
COO-
] = [H+
] підставимо у вираз для константи дисоціації:
 ; ;
[СН3
СОО –
] [Н +
] = 0,00042 ;
Знайдемо концентрацію іонів гідроґену:
[H+
] = 0,02049;
Звідки pHсередовища:
pH = - ln[0,02049] = 3,88
|
рН р-на = ?
Реклама

|
№ 626а
| Дано: |
Mn(OH)2
+ Cl2
+ KOH  MnO2
+ ... MnO2
+ ... |
| Розв’язок: |
Аналізуючи ліву і праву частину рівняння можна зробити висновок, що в даній реакції Mnбуде виступати відновником:
Mn+2
– 2e Mn+4
(
втрачає два електрони) Mn+4
(
втрачає два електрони)
Через те, що оксиґен у даному рівнянні не змінює ступеня окислення – окисником може виступити тільки хлор. Можливий хід реакції:
Mn(OH)2
+ Cl2
+ KOH MnO2
+ KCl + H2
O MnO2
+ KCl + H2
O
Тоді:
Cl2
+ 2e 2Cl – 2Cl –
Прирівняємо кількість речовин у обох частинах рівняння реакції:
Mn(OH)2
+ Cl2
+ 2KOH MnO2
+ 2KCl + 2H2
O MnO2
+ 2KCl + 2H2
O
|
№
650.
| Дано: |
Розв’язок: |
Гальванічний
елемент
|
Cu – катод:
Для того, щоб в гальванічному елементі купрум міг виступати в якості катода, для анода потрібно обрати менш електронегативний елемент – наприклад цинк (
Zn
)
.
Схема такого гальванічного елемента:
Zn | ZnSO4
|| CuSO4
| Cu
Реакція, що відбувається:
Zn + CuSO4
= ZnSO4
+ Cu
Zn = Zn+2
+ 2e – анод окислюється (φZn
= - 0,76 В)
Cu+2
+ 2e = Cu – катод відновлюється (φCu
= 0,34 В)
Стандартна ЕРС даної реакції:
Е = φCu
– φZn
= 0,34 – ( – 0,76) = 1,1В
Cu – анод:
Для того, щоб в гальванічному елементі купрум міг виступати в якості анода, для катода потрібно обрати більш електронегативний елемент – наприклад золото (
Au
)
.
Схема такого гальванічного елемента:
Cu | CuCl2
|| AuCl3
| Au
Реакція, що відбувається:
3Cu + 2AuCl3
= 3CuCl2
+ 2Au
Cu = Cu+2
+ 2e – анод окислюється (φCu
= 0,34 В)
Au+3
+ 3e = Au – катод відновлюється (φAu
= 1,50 В)
Стандартна ЕРС даної реакції:
Е = φAu
– φCu
= 1,50 – 0,34 = 1,16В
|
Cu – катод
Cu – анод
|
№ 672а.
| Дано: |
H2
O2
+ HOCl  HCl + O2
+ H2
O HCl + O2
+ H2
O |
| Знайти: |
| В якому напрямку самовільно може відбуватися реакція? |
| Розв’язок: |
Запишемо стандартні електродні потенціали електрохімічних систем, що беруть участь у реакції:
HOCl + H+
+ 2e = Cl–
+ H2
O (φ1
= 1,49)
H2
O2
= O2
+ 2H+
+ 2e (φ2
= 0,68)
Через те, що φ1
> φ2
, окисником в даній реакції є HOCl, значить реакція відбуватиметься з ліва на право.
|
№ 690.
| Дано: |
Скласти схему електролізу водного розчину хлориду цинку.
а) анод цинковий б) анод вугільний
|
| Розв’язок: |
Вугільний анод:
Вугільний анод є нейтральним – він не братиме участі в електрохімічних реакціях.
Реакції, що можуть відбуватися на аноді:
2Сl–
= Cl2
+ 2e (φ1
= 1,36) – окислення хлорид-іону
або 2H2
O = O2
+ 4H+
+ 4e (φ2
= 1,23)
Хоча φ1
> φ2
, але відбуватиметься саме перший процес. Це пов’язано зі значним перенавантаженням другого процесу: матеріал анода гальмує його протікання.
На катоді в цей час можуть відбуватися такі реакції:
Zn+2
+ 2e = Zn(φ3
= – 0,76) *
Реклама

або 2H2
O + 2e = H2
 + 2OH– + 2OH–
Та через те, що стандартний електродний потенціал системи (*) негативніший за потенціал водневого електрода в нейтральному водному середовищі ( – 0,41В), відбуватиметься електрохімічне відновлення води, що супроводжується виділенням гідроґену.
Цинковий анод:
Завдяки тому, що (φ3
= – 0,76) значно менший за потенціали (φ1
= 1,36) і (φ2
= 1,23), буде відбуватися анодне розчинення цинку.
|
№ 716.
| Дано: |
| Із розчину комплексної солі PtCl4
*6NH3
нітрат срібла осаджує весь хлор у вигляді хлориду срібла, а з розчину солі PtCl4
*3NH3
– тільки ¼ частину хлору. |
| Знайти: |
| Написати координаційні формули цих солей, визначити координаційне число платини у кожній із них. |
| Розв’язок: |
З умови задачі: з PtCl4
*6NH3
нітрат срібла осаджує весь хлор, значить він входить у зовнішню сферу комплексної сполуки, а 6NH3
у внутрішню, тому координаційна формула речовини: [Pt(NH3
)6
]Cl4
і відповідно координаційне число платини дорівнює 6 – за кількістю лігандів.
Аналогічно міркуючи: з PtCl4
*3NH3
нітрат срібла осаджує тільки ¼ хлору, значить, тільки один атом хлору входить у зовнішню сферу комплексної сполуки, три інші, разом з 3NH3
– у внутрішню, тому координаційна формула речовини: [Pt(NH3
)3
Cl3
]Clі відповідно координаційне число платини в цій сполуці теж дорівнює 6.
|
№
232
.
| Дано: |
| CHCl3
|
| Знайти: |
Скласти валентну схему молекули.
а) який зв’язок найбільш полярний?
б) в якому напрямку зміщена електронна хмара цього зв’язку?
|
| Розв’язок: |
 Молекула хлороформу має вигляд представлений на рис. 1. Чотири неспарених електрони збудженого атома вуглецю беруть участь в утворенні чотирьох ковалентних зв’язків з трьома атомами хлору (1s2
2s2
2p6
3s2
3p5
) і одним атомом водню (1s1
), що мають по одному неспареному електрону на зовнішніх орбіталях. Молекула хлороформу має вигляд представлений на рис. 1. Чотири неспарених електрони збудженого атома вуглецю беруть участь в утворенні чотирьох ковалентних зв’язків з трьома атомами хлору (1s2
2s2
2p6
3s2
3p5
) і одним атомом водню (1s1
), що мають по одному неспареному електрону на зовнішніх орбіталях.
Найбільш полярним зв’язком є зв’язок між атомами вуглецю і хлору.
В цьому легко переконатися обчисливши різниці відносних електронегативностей атомів для зв’язків: C – ClіC – H.(Cl = 3,0; C = 2,5; H = 2,1)
Δχ
c
–
cl
=3,0 – 2,5 = 0,5; Δχ
c
–
н
= 2,5 – 2,1 = 0,4 => Δχ
c
–
cl
> Δχ
c
–
н
.
Електронна хмара цього зв’язку зміщена в сторону Cl, як більш електронегативного атома.
|
№
3
14.
| Дано: |
| CaO, ZnO, SnO2
, NiO, Al2
O3
. |
| Знайти: |
| Які з перелічених оксидів можуть бути відновлені воднем до вільного метала за температури 298 К? |
| Розв’язок: |
Щоб дати відповідь на це питання потрібно обчислити стандартну енергію Ґібса реакцій:
1) CaO + H2  Ca + H2
O*
Ca + H2
O*
2) ZnO + H2  Zn + H2
O
Zn + H2
O
3) SnO2
+ 2H2  Sn + 2H2
O
Sn + 2H2
O
4) NiO + H2  Ni + H2
O
Ni + H2
O
5) Al2
O3
+ 3H2  2Al + 3H2
O*
2Al + 3H2
O*
По-перше реакції позначені (*) не можуть відбутися (за даних умов), бо в них беруть участь оксиди активних металів, які під час відновлення воднем одразу перетворяться в гідрооксиди.
Стандартні енергії Ґібса для сполук, що беруть участь в реакціях:
ΔGo
298
: CaO(–604,2), ZnO(–320,7), SnO2
(–519,3), NiO (–211,6), Al2
O3
(–1582,0), H2
O (–237,3)
1) ΔGo
298
= –237,3 – ( – 604,2) = 366,9 кДж > 0 => не може
2) ΔGo
298
= –237,3 – (–320,7) = 83,4 кДж > 0 => не може
3) ΔGo
298
= 2∙( –237,3) – (–519,3) = 44,7 кДж > 0 => не може
4) ΔGo
298
= –237,3 – ( – 211,6) = – 25,7 кДж > 0 => може
5) ΔGo
298
= 3∙(–237,3) – ( – 1582,0) = 1344,7 кДж > 0 => не може
|
№
668
.
| Дано: |
| Водневий електрод занурений в розчин з рН = 0. |
| Знайти: |
| На скільки зміниться електродний потенціал електрода, якщо розчин нейтралізувати до рН = 7 ? |
| Розв’язок: |
Для того, щоб дати відповідь на це питання обчислимо значення φ якщо рН розчину дорівнює 7. φ = – 0,059 рН = –0,41 В. Відповідно значення водневого електрода зменшиться на 0,41 В.
Відповідь в).
|
№
362
.
| Дано: |
C(
графіт
)
+ СО2 (г.)
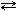 2СО(г.)
ΔНо
= 172,5 кДж 2СО(г.)
ΔНо
= 172,5 кДж |
| Знайти: |
а) Як зміниться вміст СО в рівноважній суміші з підвищенням температури але за незмінного тиску? Зі зростанням загального тиску але за незмінної температури?
б) Чи зміниться константа рівноваги за умови підвищення загального тиску і незмінній температурі? За умови збільшення температури? За умови введення в систему каталізатора?
|
| Розв’язок: |
а) Через те, що ΔНо
= 172,5 кДж > 0 – реакція екзотермічна, тому за умови підвищення температури, та за незмінного тиску, рівновага зміститься вліво, тобто в сторону оберненої, відповідно концентрація СО в суміші зменшиться.
За незмінної температури збільшення тиску призведе до зменшення об’єму системи, що в свою чергу викличе збільшення концентрації речовин, що беруть участь в реакції.
Якщо до збільшення тиску швидкість прямої реакції була: v1
= k1
[CO2
], а оберненої: v2
= k2
[CO]2
. Вважатимемо, що концентрації речовин збільшились в nразів, тоді швидкості реакцій:
v1
’
= k1
n[CO2
] = nv1
– пряма;
v2
’
= k2
(n[CO])2
= n2
v2
– обернена; =>
Швидкість оберненої реакції після підвищення тиску збільшиться в n2
разів, а пряма лише в n, значить концентрація СОв суміші зменшиться
.
б) На константу рівноваги зміна тиску за незмінної температури не вплине тому, що вона залежить лише від природи речовин, що беруть участь в реакції і від температури.
Так. – К.Р. залежить від температури.
Ні. Тому що каталізатор однаково змінює енергію активації як прямої, так і оберненої реакції. Через це він не впливає на відношення констант і швидкостей реакцій, тому каталізатор не впливає на розмір константи рівноваги і, відповідно, не може ні збільшити, ні зменшити вихід реакції. Він лише може пришвидшити або сповільнити настання рівноваги.
|
№
2
.
| Дано: |
| Маса О2
дорівнює 0,200г; маса ґалоґену – 3,17г. |
| Знайти: |
| Еквівалентна маса галоґену? |
| Розв’язок: |
Еквівалентна маса кисню – 8 г/моль. Використовуючи закон еквівалентів, складемо дві пропорції для кожної реакції: метал – кисень; метал – ґалоґен:
1) 0,2г кисню еквівалентні Хг метала
8г/моль кисню – Zг/моль метала
2) Хг метала – 3,17г ґалоґена
Zг/моль метала – Yг/моль ґалоґена
Права частина пропорції №1 дорівнює лівій частині пропорції №2, відповідно ліва частина 1-ї дорівнює правій частині 2-ї, тому можна записати:
0,2г кисню еквівалентні 3,17г ґалоґена
8г/моль кисню – Yг/моль ґалоґена
Звідки еквівалентна маса галогена:
Егалогена
= (3,17г ∙ 8г/моль) /
0,2г = 126,8 г/моль.
|
№ 84.
| Дано: |
| Dпов.
= 0,875 (етилен). |
| Знайти: |
| МСН2=СН2
=? |
| Розв’язок: |
| D = M1
/M2
; => МСН2=СН2
=Mпов.
/D = 32г/моль ∙ 0,875 = 28 г/моль. |
№ 61.
| Дано: |
| Vпов.
= 1л; ωсо2
= 0,03%. |
| Знайти: |
| Кількість молекул СО2
? |
| Розв’язок: |
Обчислимо який об’єм СО2
міститься у 1л повітря:
VCO2
= Vпов.
∙ 0,03 / 100% = 1л ∙ 0,03 / 100% = 3 ∙ 10–4
л.
Кількість речовини, що відповідає такому об’єму СО2
:
υ = V/Vm
= 3 ∙ 10–4
л / 22,4л/моль = 1,34∙10–5
моль.
Звідки:
n =υ∙ NA
= 1,34 ∙ 10–5
∙ 6,02 ∙ 10–23
= 8,0625 ∙ 1018
шт.
|
№ 105.
| Дано: |
| ωс = 93,75% ; ωН
= 6,25% Dпов.
= 4,41. |
| Знайти: |
| Молекулярну формулу речовини. |
| Розв’язок: |
Позначимо кількість атомів карбону та гідроґену в простій формулі речовини відповідно через XіY. Атомні маси цих елементів: 12 і 1. Тому відношення мас карбону і гідроґену в складі речовини складає 12X:Y. За умовою задачі це відношення: 93,75 : 6,25. Значить: 12X:Y = 93,75 : 6,25, звідки: 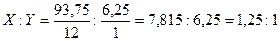 . .
Найпростіша формула сполуки: С1,25
Н1
. Цій формулі відповідає молекулярна маса
М = 12 ∙ 1,25 + 1∙ 1 = 16. Справжню молекулярну масу речовини знайдемо, виходячи з її густини за повітрям: Мпов.
= 29г/моль
D = M1
/M2
; => Мречовини
=Mпов.
/D = 29г/моль ∙ 4,41 = 127,89 ≈ 128 г/моль.
Відношення коефіцієнтів у формулі речовини знайдемо з відношення молекулярних мас речовини і її найпростішої формули:
Мреч.
/Мнайпрост. ф-ли
= 128 / 16 = 8
X = 1,25 ∙ 8 = 10, Y = 1 ∙ 8 = 8. =>
Формула речовини: С10
Н8
.
|
№
111
.
| Дано: |
| А) Mg(OH)2
; б) Fe(NO3
)3
; в) H2
SO4
; г) (NH4
)2
SO4
. |
| Знайти: |
| Обчислити вміст у відсотках кожного елемента у сполуках. |
| Розв’язок: |
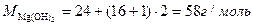
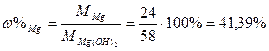
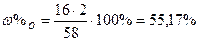
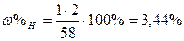
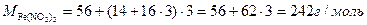
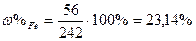
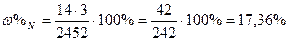
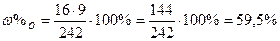
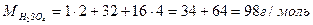
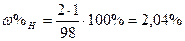
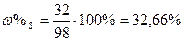
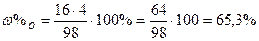
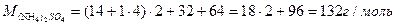
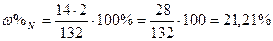
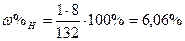
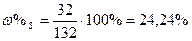
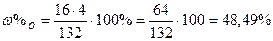
|
№
177
.
| Дано: |
| n + l : а) 5; б) 6; в) 7. |
| Знайти: |
| Послідовність заповнення електронних орбіталей. |
| Розв’язок: |
а) Знайдемо можливі значенняnі l, що відповідають сумі:
| n = |
5 |
4 |
3 |
2 |
1 |
0 |
| l = |
0 |
1 |
2 |
3 |
4 |
5 |
Але n > 0, l = n –1 іl < n, томумножина
можливих значень зменшується:
Атомні орбіталі, яким відповідають значення l, що рівні 0, 1, 2, 3, називаються відповідно s-, p-, d- і f-орбіталями. Значенню nвідповідає номер енергетичного рівня.
Виходячи з другого правила Клечковського (за однакових значень суми nі l атомні орбіталі заповнюються у порядку послідовного зростання головного квантового числа n), отримаємо, що електронні орбіталі заповнюються у такому порядку:
3d  4p 4p  5s. 5s.
Аналогічно міркуючи запишемо послідовність заповнення електронних орбіталей для суми nіl, що дорівнює 6, 7:
б)
| n = |
6 |
5 |
4 |
3 |
2 |
1 |
| l = |
0 |
1 |
2 |
3 |
4 |
5 |
Звідки: 4d 5p 5p 6s. 6s.
в)
| n = |
7 |
6 |
5 |
4 |
3 |
2 |
1 |
| l = |
0 |
1 |
2 |
3 |
4 |
5 |
6 |
Звідки: 4f  5d 5d  6p 6p  7s. 7s.
|
№ 142.
№
207
.
| Дано: |
| Атом: ядро: 16 – нейтронів; 15 – електронів. |
| Знайти: |
| Атом (символ, заряд ядра і масове число)? |
| Розв’язок: |
Електронна оболонка цього атома містить 15 електронів, значить до складу його ядра входить 15 протонів – це випливає з загальної електронейтральності атома. Кількість протонів відповідає заряду ядра атома і його порядковому номеру в таблиці хімічних елементів: Z = 15, №15.Номеру 15 відповідає хімічний елемент Фосфор, його масове число рівне: 30,97376. Отже символ даного елемента:
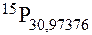
|
№ 230.
| Дано: |
| K –Cl, Ca – Cl, Fe – Cl, Ge – Cl. |
| Знайти: |
| Обчислити різниці відносних електронегативностей зв’язків. Яка з них характеризується найбільшим ступенем йонності? |
| Розв’язок: |
Відносні електронегативності елементів:
Cl = 3,0; Ge = 2,0; Fe = ?; Ca = 1,04; K = 0,91.
(
В справочних відомостях не було знайдено відносної електронегативності для
Fe
, але виходячи з таблиці відносних електронегативностей для інших елементів і періодичної таблиці хімічних елементів, можна зробити висновок, що значення електронегативності феруму знаходиться між значеннями 2,0 і 1,04 (Ґерманію і Кальцію), тому суттєво не вплине на відповідь.)
Обчислимо різниці електронегативностей зв’язків:
K –Cl = 3,0 – 0,91 = 2,09;
Ca – Cl = 3,0 – 1,04 = 1,96;
Fe – Cl = 3,0 – ? = (1,96 < ? > 1,0);
Ge – Cl = 3,0 – 2,0 = 1,0.
Робимо висновок, що найбільшою йонністю характеризується зв’язок K – Cl, а найменшою – Ge – Cl, значення для зв’язку Fe – Clзнаходиться між ними.
|
№
255
.
| Дано: |
| l = 4 ∙ 10–11
м. |
| Знайти: |
| Дипольний момент (D, Кл/м)? |
| Розв’язок: |
Заряд електрона: q = 1,60 ∙ 10–19
Кл.
Один Дебаль: 1D = 3,33 ∙ 10–30
Кл/м.
μ = q ∙ l = 1,60 ∙ 10–19
∙ 4 ∙ 10 –11
= 6,4 ∙ 10–30
Кл/м = 6,4 ∙ 10–30
/(3,33 ∙ 10–30
)D = =1,92 D.
|
№
291
.
| Дано: |
| VH2
= VC2
H2
(н. у.); H2
O(г.)
. |
| Знайти: |
| В якому випадку виділиться більше теплоти? У скільки разів? |
| Розв’язок: |
Те, що H2
іC2
H2
було взято за однакових умов і їх об’єми рівні, відповідає тому, що кількість речовини у першому і другому випадках однакова. Запишемо рівняння реакцій горіння відносно 1моль речовин, і розрахуємо тепловий ефект:
H2
+ ½O2
= H2
O(г.)
ΔH1
= – 241,8кДж;
C2
H2
+ 2,5O2
= 2CO2
+ H2
OΔH2
= –241,8 – 2 ∙ (–393,5) – (226,8) = – 1255,6кДж
Бачимо, що під час горіння ацетилену виділяється більше теплоти. Обчислимо у скільки разів її кількість перевищує кількість теплоти, що виділяється під час горіння гідроґену:
ΔH1
/ΔH2
= 1255,6/241,8 = 5,19 рази.
|
№ 329.
| Дано: |
3A + B  2C + D; [A] = 0,03моль/л; [B] = 0,01моль/л; [C] = 0,008моль/л. 2C + D; [A] = 0,03моль/л; [B] = 0,01моль/л; [C] = 0,008моль/л. |
| Знайти: |
| Вихідні концентрації А і В? |
| Розв’язок: |
(В умові задачі нам не було задано концентрацію речовини
D
, аналізуючи відповідь у підручнику і концентрації даних речовин, робимо висновок, що в умові задачі допущена помилка, речовина
D
не бере участь у реакції, а тому рівняння реакції запишеться:
3
A
+
B
 2
C
).
2
C
).
Щоб знайти вихідні концентрації речовин А і В врахуємо, що згідно з рівнянням реакції з 3-х молей А і 1-го моля В утворюється 2моль С. Оскільки за умовою задачі в кожному літрі системи утворилося 0,008моля речовини С, то в ході реакції було витрачено С/2 = 0,004моля речовини В і (С/2) ∙ 3 = 0,012моля речовини А.
Таким чином вихідні концентрації А і В:
[Ao
] = 0,012 + 0,03 = 0,042моль/л;
[Bo
] = 0,01 + 0,004 = 0,014моль/л.
|
№
401
.
| Дано: |
| V20%р-нуH2
SO4
= 100мл (ρ = 1,14г/мл) => 5%р-н. |
| Знайти: |
| VH2
O – ? |
| Розв’язок: |
Обчислимо масу 20% розчину сульфатної кислоти:
mр-ну
= V ∙ ρ = 100мл ∙ 1,14г/мл = 114г.
Тепер знайдемо масу сірчаної кислоти у цьому розчині:
m(H2
SO4
) = mр-ну
∙ 20 / 100% = 114 ∙ 20 / 100% = 22,8г;
маса води у цьому розчині: m(H2
O)20%р-н
= 114 – 22,8 = 91,2.
Використовуючи знайдену масу, обчислимо масу 5%р-ну:
m5%
р-ну
= 22,8 ∙ 100 / 5 = 456г.
Маса води, що міститься у даному розчині:
m(H2
O)5%р-н
=456 – 22,8 = 433,2г.
Для того, щоб знайти об’єм потрібної для приготування розчину води, віднімемо від отриманного значення m(H2
O)20%р-н
:
m(H2
O)необх.
= m(H2
O)5%р-н
– m(H2
O)20%р-н
= 433,2 – 91,2 = 342г або ж 342мл.
|
№ 466.
| Дано: |
| V0,5Mр-ну
(С12
H22
O11
) = 100мл; VH2
O= 300мл; t = 25o
C => T = 298K. |
| Знайти: |
| P =? |
| Розв’язок: |
Обчислимо кількість моль сахарози у розчині виходячи з її молярної концентрації 0,5М: за означенням молярної концентрації (відношення кількості розчиненої речовини до об’єму розчину; наприклад 1М розчин або См
= 1моль/л)
0,5 моль 1000мл
ν 100мл =>
ν = 0,05моль.
Після того, як ми додамо до розчину 300мл води, його об’єм стане рівним 400мл, а кількість сахарози в розчині залишиться сталою, тобто 0,05моль, тому молярна концентрація розчину стане:
0,05моль 400мл
См
1000мл =>
См
= 0,125М
Звідки осмотичний тиск:
P = CM
RT = 0,125 ∙ 8,31 ∙ 298 = 309,55кПа.
|
№ 541.
| Дано: |
| Vр-ну
NaOH= 1л; mNaOH
=1г. |
| Знайти: |
| pH = ? |
| Розв’язок: |
MNaOH
= 40г/моль.
Обчислимо кількість речовини NaOH, що міститься у розчині:
νNaOH
=m / M = 1г / 40г/моль = 0,0025моль.
Рівняння дисоціації даного лугу:
NaOH = Na+
+ OH–
=>
Кількість іонів OH–
дорівнює кількості молекул NaOH, значить [OH–
] = 0,0025моль/л
звідки pOH = – lg[OH–
] = – lg0,0025 = 2,6,
відповідно pH = 14 – pOH = 14 – 2,6 = 11,4.
|
№
580
.
| Дано: |
а)Pb(NO3
)2
+ KI; б)NiCl2
+ H2
S ; в) K2
CO3
+ HCl; г) CuSO4
+ NaOH;
ґ) CaCO3
+ HCl; д) Na2
SO3
+ H2
SO4
; е) AgBr3
.
|
| Знайти: |
| Написати в іонно-молекулярній формі рівняння реакцій, що призводять до утворення малорозчинних осадів або газів. |
| Розв’язок: |
№
580
б.
| Дано: |
| NiCl2
+ H2
S |
| Знайти: |
| Написати в іонно-молекулярній формі рівняння реакції, що призводить до утворення малорозчинного осаду. |
| Розв’язок: |
Через те, що солі утворені сульфуром мало розчинні, то сульфіт нікелю випаде в осад:
NiCl2
+ H2
S NiS NiS + 2HCl + 2HCl
Ni2+
+ S2–
 NiS NiS
|
№ 586.
| Дано: |
| ZnBr2
, K2
S, Fe2
(SO4
)3
, MgSO4
, Cr(NO3
)3
, K2
CO3
, Na3
PO4
, CuCl2
. |
| Знайти: |
| Які з перерахованих солей гідролізуються? Для кожної написати в молекулярній і йонно-молекулярній формі рівняння гідролізу по кожному ступеню, зазначити реакцію водного розчину солі. |
| Розв’язок: |
Через те, що всі перераховані солі утворені або слабкими основами і сильними кислотами, або сильними основами і слабкими кислотами, то всі вони будуть гідролізуватися.
ZnBr2
Iступінь: ZnBr2
+ H2
O ZnOHBr + HBr ZnOHBr + HBr
Zn2+
+ H2
O  ZnOH+
+ H+ ZnOH+
+ H+
ІІ ступінь: ZnOHBr + H2
O Zn(OH)2
+ HBr Zn(OH)2
+ HBr
ZnOH+
+ H2
O  Zn(OH)2
+ H+ Zn(OH)2
+ H+
Реакція розчину: кисла
K2
S
Iступінь: K2
S + H2
O  KHS + KOH KHS + KOH
S2–
+ H2
O  HS–
+ OH– HS–
+ OH–
ІІ ступінь: KHS + H2
O  H2
S + OH– H2
S + OH–
HS–
+ H2
O  H2
S + OH– H2
S + OH–
Реакція розчину: лужна
Fe2
(SO4
)3
I ступінь: Fe2
(SO4
)3
+ 2H2
O 2(FeOH)SO4
+ H2
SO4 2(FeOH)SO4
+ H2
SO4
Fe3+
+ H2
O  FeOH2+
+ H+ FeOH2+
+ H+
ІІ ступінь: 2(FeOH)SO4
+ 2H2
O  (Fe(OH)2
)2
SO4
+ H2
SO4 (Fe(OH)2
)2
SO4
+ H2
SO4
FeOH2+
+ H2
O  Fe(OH)+
2
+ H+ Fe(OH)+
2
+ H+
IІІ ступінь:(Fe(OH)2
)2
SO4
+ H2
O  Fe(OH)3
+ H2
SO4 Fe(OH)3
+ H2
SO4
Fe(OH)2+
+ H2
O  Fe(OH)3
+ H+ Fe(OH)3
+ H+
Реакція розчину: кисла
MgSO4
I ступінь: 2MgSO4
+ 2H2
O  (MgOH)2
SO4
+ H2
SO4 (MgOH)2
SO4
+ H2
SO4
Mg2+
+ H2
O  MgOH+
+ H+ MgOH+
+ H+
ІІ ступінь: (MgOH)2
SO4
+ H2
O  Mg(OH)2
+ H2
SO4 Mg(OH)2
+ H2
SO4
MgOH+
+ H2
O  Mg(OH)2
+ H+ Mg(OH)2
+ H+
Cr(NO3
)3
I ступінь: Cr(NO3
)3
+ H2
O  CrOH(NO3
)2
+ HNO3 CrOH(NO3
)2
+ HNO3
Cr3+
+ H2
O  CrOH+
+ H+ CrOH+
+ H+
ІІ ступінь: CrOH(NO3
)2
+ H2
O  Cr(OH)2
NO3
+ HNO3 Cr(OH)2
NO3
+ HNO3
CrOH+
+ H2
O  CrOH2+
+ H+ CrOH2+
+ H+
IІІ ступінь: Cr(OH)2
NO3
+ H2
O  Cr(OH)3
+ HNO3 Cr(OH)3
+ HNO3
Cr(OH)2+
+ H2
O  Cr(OH)3
+ H+ Cr(OH)3
+ H+
Реакція розчину: кисла
K2
CO3
I ступінь: K2
CO3
+ H2
O  KHCO3
+ KOH KHCO3
+ KOH
CO3
2–
+ H2
O  HCO3
–
+ OH– HCO3
–
+ OH–
ІІ ступінь: KHCO3
+ H2
O  KOH + H2
CO3 KOH + H2
CO3
 H2
O + CO2 H2
O + CO2
HCO3
–
+ H2
O  H2
CO3
+ OH– H2
CO3
+ OH–
Реакція розчину: лужна
Na3
PO4
I ступінь: Na3
PO4
+ H2
O  Na2
HPO4
+ NaOH Na2
HPO4
+ NaOH
PO3–
4
+ H2
O  HPO2–
+ OH– HPO2–
+ OH–
ІІ ступінь: Na2
HPO4
+ H2
O  NaH2
PO4
+ NaOH NaH2
PO4
+ NaOH
HPO2–
4
+ H2
O  H2
PO–
4
+ OH– H2
PO–
4
+ OH–
IІІ ступінь: NaH2
PO4
+ H2
O  H3
PO4
+ NaOH H3
PO4
+ NaOH
H2
PO–
4
+ H2
O  H3
PO4
+ OH– H3
PO4
+ OH–
Реакція розчину: лужна
CuCl2
I ступінь: CuCl2
+ H2
O  Cu(OH)Cl + HCl Cu(OH)Cl + HCl
Cu2+
+ H2
O  Cu(OH)+
+ H+ Cu(OH)+
+ H+
ІІ ступінь: Cu(OH)Cl + H2
O  Cu(OH)2
+ HCl Cu(OH)2
+ HCl
Cu(OH)+
+ H2
O  Cu(OH)2
+ H+ Cu(OH)2
+ H+
Реакція розчину: кисла
|
№ 626б.
| Дано: |
| MnO2
+ O2
+ KOH = K2
MnO4
+ ... |
| Знайти: |
| Закінчити рівняння реакції. |
| Розв’язок: |
MnO2
+ O2
+ KOH = K2
MnO4
+H2
O2
Через те, що в розчині присутній KOH, то MnO2
не може бути окисником (тому що не проявляє окислювальних властивостей у лужних розчинах), він не буде відновлюватись, а навпаки – окислюватись, до Mn6+
(тобто змінить ступінь окислення з 4+ на 6+), з утворенням манґаната. Окисником у даній реакції буде молекулярний кисень: він змінить ступінь окислення з 0 до 2–, а також (через те, що утворюється H2
O2
) з 0 до 1–. Підрахувавши кількість атомів кисню і калію в обох частинах реакції, побачимо, що потрібно поставити коефіцієнт 2 біля KOH. Остаточно рівняння буде мати вигляд:
MnO2
+ O2
+ 2KOH = K2
MnO4
+H2
O2
|
№ 652.
| Дано: |
| Гальванічний елемент:срібний і стандартний гідроґенний електроди, 1М р-н AgNO3
. |
| Знайти: |
| Рівняння електродних процесів і сумарної реакції. Яка ЕРС елемента? |
| Розв’язок: |
Запишемо рівняння реакцій, що відбуваються на електродах:
Ag+
+ 2e  Ag φ = 0,80В Ag φ = 0,80В
2H+
+ 2e  H2
φ = 0B H2
φ = 0B
Сумарне рівняння реакції:
2Ag+
+ H2
 2Ag + 2H+ 2Ag + 2H+
Щоб визначити ЕРС елемента необхідно обчислити електродні потенціали на електродах за даної концентрації розчину. Обчислимо значення φ, використавши рівняння Нернста:
φAg
= 0,80 + 0,059lg1 = 0,80 + 0 = 0,80B
Аналогічно для гідрогену:
φH
= 0.
ЕРС гальванічного елементу:
E = φAg
– φH
= 0,80 – 0 = 0,80B.
|
№
672
б.
| Дано: |
| 2HIO3
+ 5H2
O2
= I2
+ 5O2
+ 6H2
O |
| Знайти: |
| В якому напрямку самовільно може відбуватись реакція? |
| Розв’язок: |
Запишемо стандартні електродні потенціали електрохімічних систем, що беруть участь в реакції:
2IO–
3
+ 12H+
+ 10e = I2
+ 5O2
+ 6H2
Oφ1
= 1,19B
O2
+ 2H+
+ 2e = H2
O2
φ2
= 0,68B.
Оскільки φ1
> φ2
, то окисником буде HIO3
, а відновником – H2
O2
; дана реакція буде протікати з ліва на право.
|
№ 695.
| Дано: |
| Розчин KCl і Cu(NO3
)2
. |
| Знайти: |
| Запропонувати найбільш простий спосіб отримання KNO3
. |
| Розв’язок: |
| Найбільш простим способом отримання KNO3
буде електроліз даного розчину, з мідним катодом і інертним анодом. Під час проходження струму крізь розчин на катоді буде осідати купрум, а на аноді виділятиметься хлор. Йони калію і NO–
3
будуть залишатися в розчині, утворюючи KNO3
. |
№
717
.
| Дано: |
| Відомі дві комплексні солі кобальту, що відповідають одній емпіричній формулі CoBrSO4
∙ 5NH3
, вони відрізняються лише тим, що розчин однієї солі дає з BaCl2
осад, але не утворює осаду з AgNO3
, а розчин іншої солі навпаки. |
| Знайти: |
| Написати координаційні формули обох солей і рівняння їх дисоціації на йони. |
| Розв’язок: |
Те, що перша сіль дає осад з BaCl2
, але не дає осаду з AgNO3
, означає, що йон SO2–
4
знаходиться у зовнішній сфері комплексної сполук, а Br–
у внутрішній, значить формула цієї речовини:
[Co(NH3
)5
Br]SO4
Рівняння дисоціації:
[Co(NH3
)5
Br]SO4
 [Co(NH3
)5
Br]2+
+ SO2–
4
. [Co(NH3
)5
Br]2+
+ SO2–
4
.
Друга сіль реагує навпаки, значить Br–
у зовнішній сфері, а SO2–
4
– у внутрішній, формула:
[Co(NH3
)5
SO4
]Br
Рівняння дисоціації:
[Co(NH3
)5
SO4
]Br [Co(NH3
)5
SO4
]+
+ Br–
. [Co(NH3
)5
SO4
]+
+ Br–
.
|
№ 1.
| Дано: |
Розв’язок: |
MMe = 5,00г.
MMex
Oy
= 9,44г.
|
З умови задачі випливає, що в оксиді металу на 5г метала припадає 9,44 – 5 = 4,44г оксиґену. Відповідно до означення еквівалента, еквівалент оксиґену – ½. Виходячи з молекулярної маси оксиґену його еквівалентна маса ЕО
= 16 ∙ ½ = 8г/моль. Із закону еквівалентів, маси речовин, що взаємодіють, пропорційні їх еквівалентним масам. Значить:
5,00г металу еквівалентні 4,44г оксиґену
ЕМе
г/моль 8г/моль
Звідки: ЕМе
= 5,00 ∙ 8г/моль / 4,44г = 9,009г/моль.
|
ЕМе
= ?
|
№ 85.
| Дано: |
Розв’язок: |
VГ
= 0,001м3
mГ
= 0,00152кг
VN2
= 0,001м3
mN2
= 0,00125кг
|
а) Виходячи з закону Авогадро m1
/ m2
= M1
/ M2
, підставивши дані з умови задачі отримаємо:
(MN2
= 28г/моль)  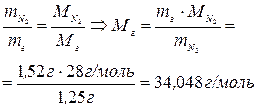
|
МГ
= ?
|
№ 107.
| Дано: |
Розв’язок: |
mр-ни
= 1,88г
mCO2
= 0,88г
mH2
O = 0,3г
mAgBr = 3,76г
D = 94
|
З умови задачі видно, що спалена сполука містила в собі карбон, гідроґен і бром, але до її складу міг входити і оксиґен. Масу вуглецю, що містився в речовині знайдемо виходячи з мали отриманого під час спалювання СО2
. Молярна маса СО2
– 44г/моль (1моль СО2
= 44г), а в 1 молі СО2
міститься 12г карбону. Знайдемо масу карбону, що міститься у 0,88г СО2
:
В 44г міститься 12г
0,88 mС
mС
= 12 ∙ 0,88 / 44 = 0,24г.
Обчислимо подібним чином масу гідроґену і брому, що містилися у сполуці:
MH2
O = 18г/моль MAgBr = 188г/моль
mH2
=2 ∙ 0.3 / 18 =0,04
mBr = 80 ∙ 3,76 /188 = 1,6г
Таким чином у речовині, що згоріла на 0,24г карбону припадає 0,04г гідроґену і 1,6г брому. Через те, що сума цих трьох мас дорівнює масі вихідної речовини (1,88), то оксиґен в ній не містився.
Обчислимо відношення кількості атомів карбону (Х), гідроґену (Y) і брому (Z) в молекулі речовини, що згоріла:
X:Y:Z = 0,24/12 : 0,04/1 : 1,6/80 = 0,02 : 0,04 : 0,02 = 2 : 4 : 2
Значить, найпростіша формула речовини C2
H4
Br2
, молекулярна маса MC2
H4
Br2
=188г/моль.
Густина речовини за гідроґеном D = 94, відповідно молярна маса:
Мр-ни
= МН2
∙ D =2 ∙ 94 = 188г/моль вона співпадає з молекулярною масою найпростішої формули речовини, тому формула речовини: C2
H4
Br2
|
Молекулярна формула ?
|
№ 121.
| Дано: |
Розв’язок: |
mHCl
= 7,3г
mNH3
= 4,0г
|
Рівняння реакції:
HCl +NH3
 NH4
Cl NH4
Cl
Знайдемо кількість речовини HClі NH3
, що відповідають їх масам (7,3 і 7,0): νHCl
= m / MHCl
=7,3г / 36,5г/моль = 0,2моль
νNH3
= m / MNH3
= 4,0г / 17г/моль = 0,235моль
Через те, що HClі NH3
реагують у співвідношенні 1:1, то скільки моль HClвізьме участь в реакції, стільки ж реагуватиме і NH3
. Виходячи з того, що кількість HCl менша ніж NH3
, робимо висновок, що NH3
буде у надлишку, він прореагує лише в кількості 0,2моль. 0,035моль залишиться після реакції.
З рівняння реакції видно, що кількість NH4
Cl буде такою ж як і HClі NH3
, тобто 0,2моль. Його маса:
mNH4
Cl = ν ∙ M = 0,2моль ∙ 53,5г/моль = 10,7г.
Маса NH3
, що залишиться:
mNH3
= 0,035моль ∙ 17г/моль = 0,595г ≈ 0,6г.
|
mNH4
Cl = ?
mгазів
= ?
|
№ 187.
| Дано: |
Розв’язок: |
Cr, Cu
|
Cr 1s2
2s2
2p6
3s2
3p6
3d5
4s1
Cu 1s2
2s2
2p6
3s2
3p6
3d10
4s1
Особливістю цих атомів є те, що вони мають однакову кількість підрівнів у електронних оболонках. Але атомCuмістить на 5 електронів більше ніжCr.Обидва атоми містять один 4sелектрон.
|
Особливості електронних оболонок?
Кількість 4s електронів?
|
№ 261.
№
2
8
9
.
| Дано: |
Розв’язок: |
| ΔHo
298
= 6226 кДж |
Рівняння реакції горіння етилену:
C2
H4
+ 3О2
 2СО2
+ 2Н2
О(р)
– 6226кДж 2СО2
+ 2Н2
О(р)
– 6226кДж
Стандартні ентальпії утворення:
ΔHo
(H2
O(р)
) = –285,8кДж; ΔHo
(С2
H4
) = 52,3кДж;
ΔHo
(СO2
) = –393,5кДж.
Обчислимо тепловий ефект реакції у перерахунку на 1 моль C2
H4
ΔHo
= 2 ∙ ( – 285,8) + 2 ∙ (–293,5) – (52,3) = 1410,9кДж
Тепер обчислимо кількість моль C2
H4
, що беруть участь у реакції. В ході реакції виділилось 6226кДж енергії, а з 1молю 1410,9кДж. Відповідно кількість моль C2
H4
:
νC2
H4
= 6226 / 1410,9 = 4,41моль.
З рівняння реакції: на один моль C2
H4
припадає три моль О2
, значить кількість моль О2
, що взяли участь у реакції:
νО2
= 4,41 ∙ 3 = 13,23.
За н. у. він буде мати об'єм:
VО2
=νО2
∙Vm
= 13,23моль ∙ 22,4л/моль = 296,352л.
|
VO2
= ?
|
№ 336.
| Дано: |
Розв’язок: |
Т = 150о
С
t = 16хв.
γ = 2,5
а) Т2
= 200о
С
б) Т2
= 80о
С
|
Переведемо 16хв. в секунди t = 960с. Використаємо рівняння, що визначає зміну швидкості реакції від температури:
υt + Δt
/ υt
= γΔt / 10
Припустимо, що за 1с. в реакцію вступає 1л речовин. Тоді υ = V / t = л /с. А через те, що ця величина стоїть і в чисельнику, і в знаменнику дробу, то не важливо, в яких одиницях вимірюється швидкість. Ми можемо відставити в рівняння час, і тоді відповідь теж буде у одиницях часу(у нашому випадку в секундах). Отже для випадку а) :
υ–50
/ υ150
= γ–50
/ 10
=>υ–50
= 960 ∙ 2,5–5
= 9,8304с
Для випадку б):
υ70
/ υ150
= γ70
/ 10
=>υ70
= 960 ∙ 2,57
= 585937,5c або 162год. 45,6хв.
|
t= ?
|
№ 454.
| Дано: |
Розв’язок: |
VН2
О = 1л
Т = 0о
С
VН2
S = 4,62л
ω% = 5%
|
Визначимо скільки грамів Н2
Sпотрібно для приготування 5%(по масі) розчину Н2
S. Позначимо невідому масу за X, тоді:
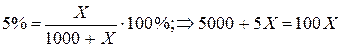
95X = 5000
X = 52,63г
В них міститься:
νН2
S = m / M = 52,63г / 34г/моль =1,55моль речовини.
Через те, що об’єм газу і його розчинність зменшуються пропорційно тискові, то якщо потрібно розчинити в:
n = νН2
Sпотр.
/ νН2
S = 1,55 / 0,206 = 7,5разів більше газу, відповідно потрібно збільшити тиск у стільки ж разів.
Po
=101,3кПа – нормальний тиск. P = n ∙ Po
= 7,5 ∙ 101,3кПа ≈ 760кПа.
|
Р= ?
|
№ 499.
| Дано: |
| В 200г води розчинено: 1) 31г карбаміду CO(NH2
)2
; 2) 90г глюкози C6
H12
O6
. |
| Знайти: |
| Чи буде температура кипіння цих розчинів однакова? |
| Розв’язок: |
Щоб відповісти на це питання потрібно обчислити моляльну концентрацію розчинів CO(NH2
)2
і C6
H12
O6
.
МCO(NH2
)2
= 60г/моль; МC6
H12
O6
= 180г/моль
mCO(NH2
)2
= νCO(NH2
)2
/ mН2
O = 31г / 60г/моль / 0,2кг = 2,58моль/кг
mC6
H12
O6
= νC6
H12
O6
/ mН2
O = 90г / 180г/моль / 0,2кг = 2,5моль/кг.
Відповідь НІ, тому що розчинник один(вода) Δtкип.
= Е ∙ m,m1
> m2
=> t1
> t2
.
|
№
553
.
| Дано: |
| В 0,01н. розчині одноосновної кислоти рН = 4. |
| Знайти: |
| Ця кислота сильна, чи слабка? |
| Розв’язок: |
Щоб визначити силу кислоти нам потрібно знати її константу дисоціації:
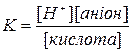
Концентрацію кислоти визначаємо за нормальністю розчину: [кислота] = 0,01моль/л. Через те, що вона одноосновна, то розпадається на один іон гідроґена і аніон(їх концентрації в розчині будуть рівні). Концентрацію йонів гідроґену знайдемо із значення рН розчину: [H+
] = 10–4
=> [аніон] = 10–4
, тоді вираз для константи дисоціації кислоти запишеться:
К = (10–4
)2
/ 0,01 = 1 ∙ 10–6
. Через те, що константа дисоціації кислоти дуже мала, робимо висновок, що кислота слабка. Відповідь а).
|
№ 584е.
| Дано: |
| Ca(OH)2
+ CO2
|
| Знайти: |
| Написати в йонно-молекулярній формі рівняння реакції. |
| Розв’язок: |
Ca(OH)2
+ CO2
 СaCO3 СaCO3
 + H2
O + H2
O
Ca2+
+ 2OH–
+ CO2
 СaCO3 СaCO3
 + H2
O + H2
O
Зміщення рівноваги реакції відбувається тому, що продуктами є нерозчинна сіль СaCO3
і малодисоціююча речовина Н2
О.
|
№ 526.
| Дано: |
а) CH3
COOH – NaCl – C6
H12
O6
– CaCl2
б) C6
H12
O6
– CH3
COOH – NaCl – CaCl2
в) CaCl2
– NaCl – CH3
COOH – C6
H12
O6
г) CaCl2
– CH3
COOH – C6
H12
O6
– NaCl
Концентрація 0,01М.
|
| Знайти: |
| В якому випадку спостерігається зменшення осмотичного тиску? |
| Розв’язок: |
Осмотичний тиск над електролітом: P =iCm
RT. З формули видно, що RіT сталі, за умовою задачі Сm
теж, значить величина осмотичного тиску залежатиме лише від ізотонічного коефіцієнту речовин, що розчиняються (чим більший і тим більший тиск). Вважатимемо ступінь дисоціації α = 1, тоді для:
CH3
COOH і = 1 + 1(2 – 1) = 2
NaCl і = 1 + 1(2 – 1) = 2
C6
H12
O6
і = 1 + 1(1 – 1) = 1
CaCl2
і = 1 + 1(3 – 1) = 3
а) 2 = 2 > 1 < 3
б) 1 < 2 = 2 < 3
в) 3 > 2 > 2 > 0 (тому, щоNaCl сильніше дисоціює ніж CH3
COOH)
г) 3 > 2 > 1 < 2
Варіант в) відповідає зменшенню осмотичного тиску.
|
№ 671.
| Дано: |
Гальванічний елемент з двома гідроґенними електродами.
Розчини а) 0,1М HClб) 0,1MCH3
COOH в) 0,1MH3
PO4
|
| Знайти: |
| В якому розчині буде найбільша ЕРС? |
| Розв’язок: |
| Стандартний гідроґенний електрод має φ = 0, тому ЕРС елементу залежатиме від потенціалу другого електрода – чим більшим, за модулем він буде, тим більшою буде ЕРС. Через те, що всі розчини мають однакову концентрацію, потенціал електрода буде обумовлений концентрацією йонів у кожному з розчинів, вони ж, в свою чергу, залежать від константи дисоціації кислоти, отже найбільший потенціал буде в розчині оцтової кислоти. |
№ 714.
| Дано: |
Розв’язок: |
Р-н NaOH
VO2
= 2,8л
|
Складемо рівняння процесів, що відбуваються піл час електролізу розчину NaOH. Через те, що електродний потенціал натрію φNa
= -2,71 – значно менший за потенціал гідроґену, то на катоді буде виділятися Н2
:
2Н2
О + 2е = Н2
 + 2ОН–
. + 2ОН–
.
На аноді буде виділятися оксиґен, його виділення буде наслідком реакції:
4ОН–
= О2
 + 2Н2
О + 4е. + 2Н2
О + 4е.
В другій реакції з чотирьох моль йонів ОН–
утворюється 1моль молекул оксиґену. А в другій з двох молей Н2
О буде утворено 2моля молекул Н2
. Щоб зрівняти кількість моль молекул і йонів в обох рівняннях, помножимо коефіцієнти на 2, тоді з чотирьох молей Н2
О буде утворено 2моля молекул Н2
. Значить гідроґену внаслідок електролізу розчину NaOH виділиться вдвічі більше ніж оксиґену, тобто 2,8л ∙ 2 = 5,6л.
|
VH2
= ?
|
№ 636а.
| Дано: |
| Cu2
S + HNO3
= H2
SO4
+ ... |
| Знайти: |
| Закінчити рівняння реакції. |
| Розв’язок: |
З умови бачимо, що сульфур змінює свій ступінь окислення з 2– на 6+, тому виступає в даній реакції сильним відновником. Купрум ймовірніше змінить ступінь окислення з 1+ на 2+, тому теж буде відновником. Окисником у даній реакції виступатиме нітроґен – знаходиться у найвищому з можливих для нього ступенів окислення – 5+.
Використаємо залежність продуктів реакції HNO3
з речовинами, які виявляють сильні відновні властивості. Припустимо, що нітроґен змінить свій ступінь окислення до 0. Тоді можливий перебіг реакції:
Cu2
S + HNO3
= H2
SO4
+ Cu(NO3
) + H2
O + N2
Розставимо коефіцієнти і остаточно отримаємо:
Cu2
S + 6HNO3
= H2
SO4
+ 2Cu(NO3
) + 2H2
O + N2
|
№ 681.
| Дано: |
| а) Fe2+
до Fe3+
б) Cu+
доCu2+
в)Mn2+
доMnO–
4
г) Sn2+
до Sn4+
|
| Знайти: |
| Які з даних йонів можна окислити бромною водою? |
| Розв’язок: |
Запишемо значення стандартних електродних потенціалів для кожного з процесів. А також потенціал брому.
а) φ = 0,77
б) φ = 0,15
в) φ =1,51
г) φ = 0,15
φBr
= 1,07
Бромна вода може окислити тільки ті йони, потенціал яких менший ніж потенціал брому: а), б), г).
|
№ 598.
№
305
.
| Дано: |
| а) розширення ідеального газу у вакуум; б) випаровування води за температури 100о
С і парціальному тискові 101,325кПа; в) кристалізація переохолодженої води. |
| Знайти: |
| Знаки ΔH, ΔS, ΔG. |
| Розв’язок: |
а) розширення ідеального газу – це ендотермічна реакція (ΔU> 0), тому і ентальпія цього процесу буде більше 0 (знак +). За умови збільшення об’єму буде зростати невпорядкованість системи, тому ΔS > 0 (знак +). А ΔG = ΔH – TΔS => за сталої температури >0 (знак +).
б) Закипання води ендотермічна реакція => ΔU> 0 => ΔH> 0, також під час закипання збільшується невпорядкованість системи => ΔS> 0. Цей процес відбувається за досить високої температури, тому ΔG < 0.
в) Кристалізація води екзотермічний процес => ΔU< 0 => ΔH< 0. Під час кристалізації збільшується впорядкованість системи, тому ΔS< 0. Кристалізація відбувається за досить низької температури => ΔG< 0.
| ΔH |
ΔS |
ΔG |
| а) |
+ |
+ |
+ |
| б) |
+ |
+ |
– |
| в) |
– |
– |
– |
|
|