| 
БИОЛОГИЯ
Под редакцией академика РАМН профессора В.Н. Ярыгина
В двух книгах
• Книга 1 •
Издание пятое, исправленное и дополненное
Рекомендовано Министерством образования Российской Федерации
в качестве учебника для студентов медицинских специальностей
высших учебных заведений
Москва «Высшая школа» 2003
УДК 574/578
ББК 28.0
Б 63
Авторы:
В.Н. Ярыгин, В.И. Васильева, И.Н. Волков, В.В. Синелыцикова
Рецензент:
кафедра медицинской биологии и генетики Тверской государственной медицинской академии (зав. кафедрой — проф. Г.В. Хомулло);
кафедра биологии Ижевской государственной медицинской академии (зав. кафедрой — проф. В.А. Глумова)
Б 63 Биология.
В 2 кн. Кн. 1: Учеб. для медиц. спец. Вузов / В.Н. Ярыгин, В.И. Васильева, И.Н. Волков, В.В. Синелыцикова;
Под ред. В.Н. Ярыгина. — 5-е изд., испр. и доп. — М.: Высш. шк., 2003.— 432 с.: ил.
ISBN 5-06-004588-9 (кн. 1)
В книге (1-й и 2-й) освещены основные свойства жизни и эволюционные процессы последовательно на молекулярно-генетическом, онтогенетическом (1-я книга), популяционно-видовом и биогеоценотическом (2-я книга) уровнях мерностей в онтогенезе и популяциях людей, их значение для медицинской практики. Уделено внимание биосоциальной сущности человека и его роли во взаимосвязях с природой.
Учебник отражает современные достижения биологической науки, играющие большую роль в практическом здравоохранении.
Для студентов медицинских специальностей вузов.
УДК 574/578
ББК 28.0
ISBN 5-06-004588-9 (кн. 1) © ФГУП «Издательство «Высшая школа», 2003
ISBN 5-06-004590-0
Оригинал-макет данного издания является собственностью издательства «Высшая школа», и его репродуцирование (воспроизведение) любым способом без согласия издательства запрещается.
Биологическая подготовка играет принципиальную и все более возрастающую роль в структуре медицинского образования. Будучи фундаментальной естественнонаучной дисциплиной, биология раскрывает закономерности возникновения и развития, а также необходимые условия сохранения жизни как особого явления природы нашей планеты. Человек, отличаясь несомненным своеобразием в сравнении с другими живыми формами, тем не менее представляет собой закономерный результат и этап развития жизни на Земле, поэтому само его существование прямо зависит от общебиологических (молекулярных, клеточных, системных) механизмов жизнедеятельности.
Реклама

Связь людей с живой природой не ограничивается рамками исторического родства. Человек был и остается неотъемлемой частью этой природы, влияет на нее и в то же время испытывает на себе влияние окружающей среды. Характер таких двусторонних отношений сказывается на состоянии здоровья человека.
Развитие промышленности, сельского хозяйства, транспорта, рост народонаселения, интенсификация производства, информационные перегрузки, усложнение отношений в семьях и на работе порождают серьезные социальные и экологические проблемы: хроническое психоэмоциональное напряжение, опасное для здоровья загрязнение среды жизни, уничтожение лесов, разрушение природных сообществ растительных и животных организмов, снижение качества рекреационных зон. Поиск эффективных путей преодоления указанных проблем невозможен без понимания биологических закономерностей внутривидовых и межвидовых отношений организмов, характера взаимодействия живых существ, включая человека, и среды их обитания. Уже отмеченного достаточно, чтобы уяснить, что многие разделы науки о жизни, даже в ее классическом формате, имеют очевидное прикладное медицинское значение.
На самом деле в наше время в решении проблем охраны здоровья и борьбы с болезнями биологические знания и «высокие биотехнологии» (генетическая, клеточная инженерия) начинают занимать не просто важное, но по-настоящему определяющее место. Действительно, минувшее XX столетие, наряду с тем, что оно, в соответствие с главными направлениями научно-технического прогресса, характеризовалось химизацией, технизацией, компьютеризацией медицины, стало также веком превращения последней в биомедицину.
Представление об этапах названного превращения, стартовавшего в конце XIX — начале XX веков дает метафора смены «поколений охотников», принадлежащая лауреату нобелевской премии 1959 г. за открытие механизма биологического синтеза нуклеиновых кислот Артуру Корнбергу. На каждом из следующих друг за другом этапов биология обогащала мир выдающимися фундаментальными открытиями или технологиями, дальнейшая разработка и использование которых в интересах медицины позволяли здравоохранению достичь решающих успехов в той или иной области борьбы с недугами людей.
В первые десятилетия минувшего столетия, по мнению А. Корнберга, лидирующая роль принадлежала «охотникам» за микробами, с результатами исследований которых связаны поразительные достижения мирового и отечественного здравоохранения в решении проблемы контроля над инфекциями, прежде всего особо опасными.
Реклама

Во второй четверти XX века лидирующее положение перешло к «охотникам» за витаминами, в 50-60-е годы — за ферментами, на рубеже XX—XXI столетий — к «охотникам» за генами. Приведенный перечень можно дополнить также поколениями «охотников» за гормонами, факторами тканевого роста, рецепторами к биологически активным молекулам, за клетками —участницами иммунологического надзора за белковым и клеточным составом организма и другими. Сколь длинным однако не был бы этот перечень, очевидно, что в нем «охоте» за генами принадлежит качественно особое место.
В наши дни главная задача такой «охоты», уже оформившейся в самостоятельную научно-практическую дисциплину — геномику, состоит в выяснении порядка расположения нуклеотидных пар в молекулах ДНК или, другими словами, прочтении ДНК-текстов геномов людей (проект «геном человека») и других организмов. Не трудно видеть, что исследования в названном направлении открывают врачам доступ к содержанию первичной генетической информации, заключенной в геноме каждого отдельно взятого человека (генодиагностика), которой, собственно, определяются особенности процесса индивидуального развития организма, многие его свойства и качества во взрослом состоянии. Указанный доступ создает перспективу адресного изменения информации в целях борьбы с болезнями или предрасположенностью к ним (генотерапия, генопрофилактика), а также предоставления каждому человеку биологически обоснованных рекомендаций к выбору, например, оптимального региона для проживания, характера питания, рода трудовой деятельности, в широком плане к конструированию образа жизни соответственно личной генетической конституции в интересах собственного здоровья.
Прочтение и осознанное манипулирование с ДНК-текстами геномов вирусов, патогенных микроорганизмов и паразитов человека предоставляют беспрецедентные возможности осуществлять высокоэффективные профилактические и лечебные мероприятия, создавая вакцины и целевые лекарственные средства, избавляющие людей от разного рода инфекционной патологии. Молекулярнобиологические технологии генетического модифицирования, в частности вирусов, открывают перспективы появления нефармацевтических методов лечения серьезных неинфекционных болезней, например опухолей Так, в настоящее время в стадии клинических испытаний в качестве противоопухолевого средства находится штамм аденовируса, геном которого изменен таким образом, что он размножается только в опухолевых клетках с недостаточностью гена р53, приводя к их гибели, и не затрагивает здоровые клетки. Согласно современным представлениям, развитие опухолей обусловлено либо слишком высоким, вышедшим из-под контроля организма уровнем пролиферации определенного вида клеток, либо несостоятельностью процесса их естественной, генетически обусловленной гибели (апоптоза), либо сочетанием обоих факторов. Белок, контролируемый геном р53, обладает способностью при определенных условиях блокировать клеточное деление и запускать механизм апоптоза. Мутационные изменения и, следовательно, дефектность функции названного гена или регулирующих его активность нуклеотидных последовательностей ДНК встречаются, по данным разных исследователей, у 55—70% раковых больных. Число примеров такого рода может быть легко увеличено.
Главным объектом внимания и профессиональной деятельности врача является человек, представляющий неотъемлемую часть природы. В силу этого в настоящем учебнике значительное место занимает описание процессов и механизмов, свойственных всем живым организмам. Вместе с тем авторы старались подобрать такие примеры, которые раскрывают действие этих механизмов в организме человека, популяции людей, антропобиогеоценозах. Известно, что отличительной чертой природы людей является наличие социальной составляющей, что проявляется в определенной специфике некоторых важных сторон их развития и жизнедеятельности. Вытекающие из указанной специфики особенности, наиболее заметно проявляющиеся в структуре онтогенеза, особенно постнатального (наличие только у людей периода отрочества и юности, отчетливо представленный период старости), на уровне генетико-популяционных процессов (доминирующая роль социальных факторов в определении состава популяций в сравнении с климатогеографическими), в биогеоценозах и биосфере (целенаправленное преобразование природы, очеловечивание среды жизни), также находят отражение в учебнике. Вопросы наследственности и изменчивости, индивидуального развития (включая старение и факторы регуляции продолжительности жизни), экологии (включая паразитизм), учение о биосфере и ноосфере рассмотрены в свете задач высшего медицинского образования. Проблемы эволюции освещены с позиций популяционной биологии, а филогенез — с позиций, раскрывающих естественноисторические предпосылки определенных пороков развития.
Избранный подход способствует формированию у студентов генетического, онтогенетического и экологического образа мышления, совершенно необходимого современному врачу, который связывает здоровье своих пациентов с сочетанным действием трех главных факторов: наследственности, среды жизни и образа жизни.
В соответствии с магистральными направлениями и «зонами прорыва» современной биомедицины наибольшие дополнения и изменения в настоящем издании относятся к разделам генетики, онтогенеза, популяционной биологии человека, антропогенеза.
Для уяснения содержания биологических основ жизнедеятельности и развития человека в их наиболее полном объеме материал излагается соответственно всеобщим уровням организации жизни: молекулярно-генетическому, клеточному, организменному, популяционно-видовому, экосистемному. Наличие перечисленных уровней отражает структуру и необходимые условия процесса исторического развития, в связи с чем присущие им закономерности проявляют себя более или менее типичным образом во всех без исключения живых формах, включая человека.
Велика роль курса биологии не только в естественнонаучной, но и в мировоззренческой подготовке врача. Предлагаемый материал учит разумному и осознанно внимательному отношению к окружающей природе, себе самому и окружающим как части этой природы, способствует выработке критической оценки последствий воздействия человека на среду обитания. Биологические знания воспитывают бережное и уважительное отношение к детям и лицам преклонного возраста. Открывшаяся на рубеже веков в связи с развитием геномики возможность активно и фактически произвольно изменять генетическую конституцию людей неизмеримо увеличивает ответственность врача, требуя от него неукоснительного следования этическим нормам, гарантирующим соблюдение интересов пациента. Это важнейшее обстоятельство также находит отражение в учебнике.
При написании отдельных разделов и глав авторы стремились отразить современное состояние соответствующих направлений биологической и биомедицинской науки. Биомедицина — это строящееся здание. Стремительно увеличивается число научных фактов. Важнейшие теоретические положения и выдвигаемые гипотезы являются объектом острых дискуссий, тем более что современные биотехнологии быстро находят путь в практику. С другой стороны, ряд фундаментальных концепций, остававшихся незыблемыми на протяжении десятилетий, под прессом новейших данных пересматриваются. В таких условиях авторам нередко приходилось делать выбор в пользу той или иной точки зрения, в любом случае аргументируя этот выбор обращением к фактам.
Авторы испытывают чувство искренней признательности исследователям, труды которых были ими использованы в процессе работы над учебником, приносят свои извинения ученым, взгляды которых в /силу ограниченного объема издания не нашли в нем достаточного освещения, и с благодарностью примут и учтут в дальнейшей работе критические замечания и пожелания коллег и студентов.
Авторы
Термин биология
(от греч. биос —
жизнь, логос —
наука) введен в начале XIX в. независимо Ж.-Б. Ламарком и Г. Тревиранусом для обозначения науки о жизни как особом явлении природы. В настоящее время его используют и в ином смысле, относя к группам организмов, вплоть до вида (биология микроорганизмов, биология северного оленя, биология человека), биоценозам (биология арктического бассейна), отдельным структурам (биология клетки).
Предметом биологии как учебной дисциплины служит жизнь во всех ее проявлениях: строение, физиология, поведение, индивидуальное (онтогенез) и историческое (эволюция, филогенез) развитие организмов, их взаимоотношение друг с другом и с окружающей средой.
Современная биология представляет комплекс, систему наук. Отдельные биологические науки или дисциплины возникли вследствие процесса дифференциации, постепенного обособления относительно узких областей изучения и познания живой природы. Это, как правило, интенсифицирует и углубляет исследования в соответствующем направлении. Так, благодаря изучению в органическом мире животных, растений, простейших одноклеточных организмов, микроорганизмов, вирусов и фагов произошло выделение в качестве крупных самостоятельных областей зоологии, ботаники, протистологии, микробиологии, вирусологии.
Изучение закономерностей, процессов и механизмов индивидуального развития организмов, наследственности и изменчивости, хранения, передачи и использования биологической информации, обеспечения жизненных процессов энергией является основой для выделения эмбриологии, биологии развития, генетики, молекулярной биологии и биоэнергетики. Исследования строения, функциональных отправлений, поведения, взаимоотношений организмов со средой обитания, исторического развития живой природы привели к обособлению таких дисциплин, как морфология, физиология, этология, экология, эволюционное учение. Интерес к проблемам старения, вызванный увеличением средней продолжительности жизни людей, стимулировал развитие возрастной биологии (геронтологии).
Для уяснения биологических основ развития, жизнедеятельности и экологии конкретных представителей животного и растительного мира неизбежно обращение к общим вопросам сущности жизни, уровням ее организации, механизмам существования жизни во времени и пространстве. Наиболее универсальные свойства и закономерности развития и существования организмов и их сообществ изучает общая биология.
Сведения, получаемые каждой из наук, объединяются, взаимодополняя и обогащая друг друга, и проявляются в обобщенном виде, в познанных человеком закономерностях, которые либо прямо, либо с некоторым своеобразием (в связи с социальным характером людей) распространяют свое действие на человека.
Вторую половину XX столетия справедливо называют веком биологии.
Такая оценка роли биологии в жизни человечества представляется еще более оправданной в наступившем XXI в. К настоящему времени наукой о жизни получены важные результаты в области изучения наследственности, фотосинтеза, фиксации растениями атмосферного азота, синтеза гормонов и других регуляторов жизненных процессов. Уже в реально обозримом будущем путем использования генетически модифицированных растительных и животных организмов, бактерий могут быть решены задачи обеспечения людей продуктами питания, необходимыми медицине и сельскому хозяйству лекарствами, биологически активными веществами и энергией в достаточном количестве, несмотря на рост населения и сокращение природных запасов топлива. Исследования в области геномики и генной инженерии, биологии клетки и клеточной инженерии, синтеза ростовых веществ открывают перспективы замещения дефектных генов у лиц с наследственными болезнями, стимуляции восстановительных процессов, контроля за размножением и физиологической гибелью клеток и, следовательно, воздействия на злокачественный рост.
Биология относится к ведущим отраслям естествознания. Высокий уровень ее развития служит необходимым условием прогресса медицинской науки и здравоохранения.
Интерес к познанию мира живых существ возник на самых ранних стадиях зарождения человечества, отражая практические нужды людей. Для них этот мир был источником средств к существованию, так же как и определенных опасностей для жизни и здоровья. Естественное желание узнать, следует ли избегать встречи с теми или иными животными и растениями или же, наоборот, использовать их в своих целях, объясняет, почему первоначально интерес людей к живым формам проявляется в попытках их классификации, подразделения на полезные и опасные, болезнетворные, представляющие пищевую ценность, пригодные для изготовления одежды, предметов обихода, удовлетворения эстетических запросов.
По мере накопления конкретных знаний наряду с представлением о разнообразии организмов
возникла идея о единстве всего живого.
Особенно велико значение этой идеи для медицины, так как это указывает на универсальность биологических закономерностей для всего органического мира, включая человека. В известном смысле история современной биологии как науки о жизни представляет собой цепь крупных открытий и обобщений, подтверждающих справедливость этой идеи и раскрывающих ее содержание.
Важнейшим научным доказательством единства всего живого послужила клеточная теория Т.
Шваннаи М. Шлейдена (1839). Открытие клеточного строения растительных и животных организмов, уяснение того, что все клетки (несмотря на имеющиеся различия в форме, размерах, некоторых деталях химической организации) построены и функционируют в целом одинаковым образом, дали толчок исключительно плодотворному изучению закономерностей, лежащих в основе морфологии, физиологии, индивидуального развития живых существ.
Открытием фундаментальных законов наследственности
биология обязана Г. Менделю (1865), Г. де Фризу, К. Корренсу и К. Чермаку (1900), Т. Моргану (1910—1916), Дж. Уотсону и Ф. Крику (1953). Названные законы раскрывают всеобщий механизм передачи наследственной информации от клетки к клетке, а через клетки — от особи к особи и перераспределения ее в пределах биологического вида. Законы наследственности важны в обосновании идеи единства органического мира; благодаря им становится понятной роль таких важнейших биологических явлений, как половое размножение, онтогенез, смена поколений.
Представления о единстве всего живого получили основательное подтверждение в результатах исследований биохимических
(обменных, метаболических) и биофизических
механизмов жизнедеятельности клеток. Хотя начало таких исследований относится ко второй половине XIX в., наиболее убедительны достижения молекулярной биологии,
ставшей самостоятельным направлением биологической науки в 50-е гг. XX столетия, что связано с описанием Дж. Уотсоном и Ф. Криком (1953) строения дезоксирибонуклеиновой кислоты (ДНК). На современном этапе развития молекулярной биологии и генетики возникло новое научно-практическое направление — геномика,
имеющая в качестве главной задачи прочтение ДНК-текстов геномов человека и других организмов. На основе доступа к личной биологической информации возможно ее целенаправленное изменение, в том числе путем введения генов от других видов. Такая возможность представляет собой важнейшее доказательство единства и универсальности базисных механизмов жизнедеятельности.
Молекулярная биология уделяет главное внимание изучению в процессах жизнедеятельности роли биологических макромолекул (нуклеиновые кислоты, белки), закономерностей хранения, передачи и использования клетками наследственной информации. Молекулярно-биологические исследования раскрыли универсальные физико-химические механизмы, от которых зависят такие всеобщие свойства живого, как наследственность, изменчивость, специфичность
биологических структур и функций, воспроизведение
в ряду поколений клеток и организмов определенного строения.
Клеточная теория, законы наследственности, достижения биохимии, биофизики и молекулярной биологии свидетельствуют в пользу единства органического мира в его современном состоянии. То, что живое на планете представляет собой единое целое в историческом плане, обосновывается теорией эволюции.
Основы названной теории заложены Ч. Дарвином (1858). Свое дальнейшее развитие, связанное с достижениями генетики и популяционной биологии, она получила в трудах А. Н. Северцова, Н. И. Вавилова, Р. Фишера, С. С. Четверикова, Ф. Р. Добжанского, Н. В. Тимофеева-Ресовского, С. Райта, И. И. Шмальгаузена, чья плодотворная научная деятельность относится к XX столетию.
Эволюционная теория объясняет единство мира живых существ общностью их происхождения.
Она называет пути, способы и механизмы, которые за несколько миллиардов лет привели к наблюдаемому ныне разнообразию живых форм, в одинаковой мере приспособленных к среде обитания, но различающихся по уровню морфофизиологической организации. Общий вывод, к которому приходит теория эволюции, состоит в утверждении, что живые формы связаны друг с другом генетическим родством,
степень которого для представителей разных групп различается. Свое конкретное выражение это родство находит в преемственности в ряду поколений фундаментальных молекулярных, клеточных и системных механизмов развития и жизнеобеспечения. Такая преемственность сочетается с изменчивостью, позволяющей на основе этих механизмов достичь более высокого уровня приспособленности биологической организации.
Современная теория эволюции обращает внимание на условность грани между живой и неживой природой, между живой природой и человеком. Результаты изучения молекулярного и атомного состава клеток и тканей, строящих тела организмов, получение в химической лаборатории веществ, свойственных в естественных условиях только живому, доказали возможность перехода в истории Земли от неживого к живому. Не противоречит законам биологической эволюции появление на планете социального существа — человека. Клеточная организация, физико-химические и генетические законы неотделимы от его существования, так же как и любого другого организма. Эволюционная теория показывает истоки биологических механизмов развития и жизнедеятельности людей, т.е. того, что может быть названо их биологическим наследством.
В классической биологии родство организмов, относящихся к разным группам, устанавливали путем сравнения их во взрослом состоянии, в эмбриогенезе, поиска переходных ископаемых форм. Современная биология подходит к решению этой задачи также путем изучения различий в нуклеотидных последовательностях ДНК или аминокислотных последовательностях белков. По главным своим результатам схемы эволюции, составленные на основе классического и молекулярно-биологического подходов, совпадают (рис. 1.1).
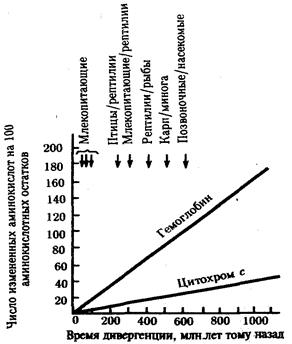
Рис. 1.1. Время дивергенции различных – групп животных
согласно молекулярно-биологическим исследованиям
Выше было сказано, что первоначально люди классифицировали организмы в зависимости от их практического значения. К. Линней (1735) ввел бинарную классификацию,
согласно которой для определения положения организмов в системе живой природы указывается их принадлежность к конкретному роду и виду. Хотя бинарный принцип сохранен в современной систематике, оригинальный вариант классификации К. Линнея носит формальный характер. Биологи до создания теории эволюции относили живые существа к соответствующему роду и виду по их подобию друг другу, прежде всего близости строения. Эволюционная теория, объясняющая сходство между организмами их генетическим родством, составила естественнонаучную основу биологической классификации. Приобретя в эволюционной теории такую основу, современная классификация органического мира непротиворечиво отражает, с одной стороны, факт разнообразия живых форм, а с другой — единство всего живого.
Идея единства мира живых существ находит свое подтверждение также в экологических исследованиях,
относящихся главным образом к XX в. Представления о биоценозе (В. Н. Сукачев) или экологической системе
(А. Тенсли) раскрывают универсальный механизм обеспечения важнейшего свойства живого — постоянно происходящего в природе обмена веществ
и энергии.
Названный обмен возможен только в случае сосуществования на одной территории и постоянного взаимодействия организмов разного плана строения (продуцентов, консументов, деструкторов) и уровня организации. Учение о биосфере
и ноосфере
(В. И. Вернадский) раскрывает место и планетарную роль живых форм, включая человека, в природе, так же как и возможные последствия ее преобразования людьми.
Каждый крупный шаг на пути познания фундаментальных законов жизни неизменно оказывал влияние на состояние медицины, приводил к пересмотру содержания и понимания механизмов патологических процессов. Соответственно пересматривались принципы организации лечебной и профилактической медицины, методы диагностики и лечения.
Так, исходя из клеточной теории и разрабатывая ее дальше, Р. Вирхов создал концепцию клеточной патологии
(1858), которая на долгое время определила главные пути развития медицины. Эта концепция, придавая особое значение в течении патологических состояний структурно-химическим изменениям на клеточном уровне, способствовала возникновению в практическом здравоохранении патологоанатомической, прозекторской службы.
Применив генетико-биохимический подход в изучении болезней человека, А. Гаррод заложил основы молекулярной патологии
(1908). Этим он дал ключ к пониманию практической медициной таких явлений, как различная восприимчивость людей к болезням, индивидуальный характер реакции на лекарственные препараты.
Успехи общей и экспериментальной генетики 20—30-х годов стимулировали исследования по генетике человека. В результате возник новый раздел патологии — наследственные заболевания,
появилась особая служба практического здравоохранения — медико-генетические консультации.
Геномика
и современные молекулярно-генетические технологии открывают доступ к диагностике на уровне нуклеотидных последовательностей ДНК не только собственно генных болезней, но также предрасположенности к ряду тяжелых соматических патологических состояний (астма, диабет и др). Доступный уровень генодиагностики
создает предпосылки для осознанного манипулирования с наследственным материалом людей в целях генотерапии
и генопрофилактики
заболеваний. Достижения в названных областях науки привели к появлению целой отрасли производства, работающей на здравоохранение,— медицинской биотехнологии.
Зависимость состояния здоровья людей от качества среды и образа жизни уже не вызывает сомнений ни у практикующих врачей, ни у организаторов здравоохранения. Закономерным следствием этого является наблюдаемая в настоящее время экологизация медицины.
Многочисленные находки ученых в виде окаменелостей, отпечатков в мягких породах и других объективных свидетельств указывают на то, что жизнь на Земле существует не менее 3,5 млрд. лет. На протяжении более чем 3 млрд. лет область ее распространения ограничивалась исключительно водной средой. К моменту выхода на сушу жизнь уже была представлена разнообразными формами: прокариотами, низшими и высшими растениями, простейшими и многоклеточными животными, включая ранних представителей позвоночных.
За указанный период, составляющий примерно 6
/? всего времени существования жизни на нашей планете, произошли эволюционные преобразования, предопределившие лицо современного органического мира и, следовательно, появление человека. Знакомство с важнейшими из них помогает понять стратегию жизни.
Организмы, которые появились первыми, современная наука называет прокариотами.
Это одноклеточные существа, отличающиеся относительной простотой строения и функций. К ним относятся бактерии и синезеленые водоросли (цианобактерии). О простоте их организации свидетельствует, например, имевшийся у них небольшой объем наследственной информации. Для сравнения: длина ДНК современной бактерии, кишечной палочки, составляет 4·106
пар нуклеотидов. Не больше ДНК было, по-видимому, и у древних прокариот. Названные организмы господствовали на Земле более 2 млрд. лет. С их эволюцией связано появление, во-первых, механизма фотосинтеза и, во-вторых, организмов эукариотического типа.
Фотосинтез
открыл доступ к практически неисчерпаемой кладовой солнечной энергии, которая с помощью этого механизма накапливается в органических веществах и затем используется в процессах жизнедеятельности. Широкое распространение фотосинтезирующих автотрофных организмов, прежде всего зеленых растений, привело к образованию и накоплению в атмосфере Земли кислорода. Это создало предпосылки для возникновения в эволюции механизма дыхания,
который отличается от бескислородных (анаэробных) механизмов энергообеспечения жизненных процессов гораздо большей эффективностью (примерно в 18 раз).
Эукариоты
появились среди обитателей планеты около 1, 5 млрд. лет назад. Отличаясь от прокариот более сложной организацией, они используют в своей жизнедеятельности больший объем наследственной информации. Так, общая длина молекул ДНК в ядре клетки млекопитающего составляет примерно 2—5·109
пар нуклеотидов, т.е. в 1000 раз превосходит длину молекулы ДНК бактерии.
Первоначально эукариоты имели одноклеточное строение.
Доисторические одноклеточные эукариоты послужили основой для возникновения в процессе эволюции организмов, имеющих многоклеточное строение тела.
Они появились на Земле около 600 млн. лет назад и дали широкое разнообразие живых существ, расселившихся в трех основных средах: водной, воздушной, наземной. Полезно заметить, что многоклеточность возникла в эволюции в период, когда атмосфера планеты, обогатившись 02, приобрела устойчивый окислительный характер.
Около 500 млн. лет назад среди многоклеточных появляются хордовые животные,
общий план строения которых радикальным образом отличается от плана строения существ, населявших планету до их появления. В процессе дальнейшей эволюции именно в этой группе возникают позвоночные животные.
Среди них примерно 200—250 млн. лет назад появляются млекопитающие,
характерной чертой которых становится особый тип заботы о потомстве — вскармливание народившегося детеныша молоком. Названная черта соответствует новому типу отношений между родителями и потомством, способствующему укреплению связи между поколениями, созданию условий для выполнения родителями воспитательной функции, передачи ими опыта.
Именно через группу млекопитающих животных, в частности через отряд приматов, прошла линия эволюции, ведущая к человеку (примерно 1, 8 млн. лет назад). Однозначного соответствия уровню морфофизиологической организации количества ДНК среди представителей разных классов многоклеточных животных не установлено. Тем не менее для появления процветающего класса насекомых понадобилось, чтобы общая длина молекулы ДНК в геноме превысила 108
пар нуклеотидов, предшественников хордовых — 4 · 108
, амфибий — 8 · 108
, рептилий — 109
, млекопитающих — 2 · 109
пар нуклеотидов (рис. 1.2).
Выше названы узловые пункты исторического развития жизни от одноклеточных форм до людей, наделенных разумом и способностью к активной созидательной деятельности и сознательному переустройству среды жизни. Знакомство с составом обитателей планеты на любом из этапов развития жизни свидетельствует о его разнообразии, сосуществовании в одни и те же периоды организмов, различающихся как по общему плану строения тела, так и по времени появления в процессе эволюции (рис. 1.3). И в наши дни органический мир представлен наряду с эукариотами микроорганизмами и синезелеными водорослями, относящимися к прокариотам. На фоне разнообразия многоклеточных эукариотических организмов имеется значительное число видов одноклеточных эукариот.
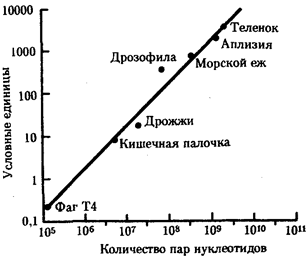
Рис. 1.2. Изменение объема уникальных нуклеотидных последовательностей в геномах в процессе прогрессивной эволюции
Заслуживает упоминания еще одно обстоятельство, характеризующее органический мир в самом общем виде. Среди организмов разного плана строения, сосуществующих в определенный исторический период времени, некоторые формы, имевшие некогда широкое распространение, представлены относительно небольшим количеством особей и занимают ограниченную территорию. Фактически они лишь поддерживают свое пребывание во времени, избегая (благодаря наличию у них определенных приспособлений) вымирания в ряду поколений. Другие, напротив, увеличивают свою численность, осваивают новые территории и экологические ниши. В таких группах возникают разнообразные варианты организмов, отличающихся в той или иной мере от предковой формы и друг от друга деталями строения, физиологии, поведения, экологии.
Из изложенного можно заключить, что эволюция жизни на Земле характеризуется следующими общими чертами. Во-первых, возникнув в виде простейших одноклеточных форм, жизнь в своем развитии закономерно порождала существа со все более сложным типом организации тела, совершенными функциями, повышенной степенью независимости от прямых влияний со стороны окружающей среды на выживаемость. Во-вторых, любые варианты живых форм, возникавшие на планете, сохраняются столь долго, сколь долго существуют геохимические, климатические, биогеографические условия, удовлетворяющие в достаточной мере их жизненным запросам. В-третьих, в своем развитии отдельные группы организмов проходят стадии подъема и нередко спада. Стадия, достигнутая группой на данный исторический момент, определяется по тому месту, которое ей принадлежит на этот момент в органическом мире в зависимости от численности и распространенности.
Развитию событий или явлений во времени соответствует понятие прогресса.
С учетом описанных выше общих черт в процессе исторического развития жизни наблюдаются три формы прогресса, качественно отличающиеся друг от друга. Эти формы по-разному характеризуют положение соответствующей группы организмов, достигнутое в итоге предшествующих этапов эволюции, экологические и эволюционные перспективы.

Рис. 1.3. Филогенетические отношения основных групп растений, грибов, животных и прокариот
Пунктиром обозначено предполагаемое положение групп
Биологическим прогрессом
называют состояние, когда численность особей в группе от поколения к поколению растет, расширяется территория (ареал) их расселения, нарастает количество подчиненных групп более низкого ранга — таксонов.
Биологический прогресс соответствует понятию процветания. Из ныне существующих групп к процветающим относят насекомых, млекопитающих. Период процветания, к примеру, пресмыкающихся завершился около 60—70 млн. лет назад.
Морфофизиологический прогресс
означает состояние, приобретаемое группой в процессе эволюции, которое дает возможность части ее представителей выжить и расселиться в среде обитания с более разнообразными и сложными условиями. Такое становится возможным благодаря появлению существенных изменений в строении, физиологии и поведении организмов, расширяющих их приспособительные возможности за рамки обычных для предковой группы. Из трех главных сред обитания наземная представляется наиболее сложной. Соответственно выход животных на сушу, например в группе позвоночных, был связан с рядом радикальных преобразований конечностей, дыхательной и сердечно-сосудистой систем, процесса размножения.
Появление среди земных обитателей человека соответствует качественно новому состоянию жизни. Переход к этому состоянию, хотя и был подготовлен ходом эволюционного процесса, означает смену законов, которым следует развитие человечества, с биологических на социальные. Вследствие названной смены выживание и неуклонный рост численности людей, их расселение по территории планеты, проникновение в глубины океана, недра Земли, воздушное и даже космическое пространство определяются результатами труда и интеллектуальной деятельности, накоплением и преумноженном в ряду поколений опыта преобразующих воздействий на природную среду. Эти воздействия превращают природу в очеловеченную среду жизни людей.
Ряд последовательных крупных эволюционных изменений, таких, как эукариотический тип организации клеток, многоклеточность, возникновение хордовых, позвоночных и, наконец, млекопитающих животных (что обусловило в конечном итоге появление человека), составляет в историческом развитии жизни линию неограниченного прогресса.
Обращение к трем формам прогресса, названным выше, помогает раскрыть главные стратегические принципы эволюции жизни, от которых зависят ее сохранение во времени и распространение по разным средам обитания. Во-первых, эволюция по своим результатам на любом из этапов носит приспособительный характер. Во-вторых, в процессе исторического развития закономерно повышается уровень организации живых форм, что соответствует прогрессивному характеру эволюции.
Чем выше уровень морфофизиологической организации, тем большее количество энергии требуется для ее поддержания. В силу этого еще один стратегический принцип эволюции заключается в освоении новых источников
и эффективных механизмов энергообеспечения
жизненных процессов.
Для образования высокоорганизованных форм в сравнении с низкоорганизованными в целом необходим больший объем наследственной информации. Закономерное увеличение объема используемой в жизнедеятельности генетической информации
также является стратегическим принципом развития жизни.
Поразительное многообразие жизни создает большие трудности для ее однозначного и исчерпывающего определения как особого явления природы. Во многих определениях жизни, предлагавшихся выдающимися мыслителями и учеными, указываются ведущие свойства, качественно отличающие (по мнению того или иного автора) живое от неживого. К примеру, жизнь определяли как «питание, рост и одряхление» (Аристотель); «стойкое единообразие процессов при различии внешних влияний» (Г. Тревиранус); «совокупность функций, сопротивляющихся смерти» (М. Биша); «химическую функцию» (А. Лавуазье); «сложный химический процесс» (И. П. Павлов). Неудовлетворенность ученых этими определениями понятна. Наблюдения показывают, что свойства живого не носят исключительного характера и по отдельности обнаруживаются среди объектов неживой природы.
Определение жизни как «особой, очень сложной формы движения материи» (А. И. Опарин) отражает ее качественное своеобразие, несводимость биологических законов к химическим и физическим. Однако оно носит общий характер, не раскрывая конкретного содержания этого своеобразия.
В практическом отношении полезны определения, основанные на выделении комплекса свойств, который обязателен для живых форм. Одно из них характеризует жизнь как макромолекулярную открытую систему, которой свойственны иерархическая организация, способность к самовоспроизведению, обмен веществ, тонко регулируемый поток энергии. Жизнь, согласно этому определению, представляет собой ядро упорядоченности, распространяющееся в менее упорядоченной Вселенной.
Рассмотрим главные, обязательные свойства жизни более подробно. Живым существам присущ особый способ взаимодействия с окружающей средой — обмен веществ.
Его содержание составляют взаимосвязанные и сбалансированные процессы ассимиляции
(анаболизм) и диссимиляции
(катаболизм). Результатом ассимиляции является образование и обновление структур организма, диссимиляции — расщепление органических соединений с целью обеспечения различных сторон жизнедеятельности необходимыми веществами и энергией. Для осуществления обмена веществ необходим постоянный приток определенных веществ извне; некоторые продукты диссимиляции выделяются во внешнюю среду. Таким образом, организм является по отношению к окружающей среде открытой системой.
Процессы ассимиляции и диссимиляции представлены многочисленными химическими реакциями, объединенными в метаболические цепи, циклы, каскады. Последние представляют собой совокупность взаимосвязанных реакций, протекание которых строго упорядочено во времени и пространстве.
В итоге осуществления клеткой метаболического цикла достигается определенный биологический результат: из аминокислот образуется молекула белка, молекула молочной кислоты расщепляется до С02 и Н20. Упорядоченность различных сторон обмена веществ достигается благодаря структурированности
объема клетки, например выделения в ней водной и липидной фаз, наличия обязательных внутриклеточных структур, таких, как митохондрии, лизосомы и др. На важность свойства структурированности указывает следующий пример. Тело микоплазмы (микроорганизма, занимающего по размерам промежуточное положение между вирусами и типичными бактериями) превосходит по диаметру атом водорода всего в 1000 раз. Даже в таком малом объеме осуществляется примерно 100 биохимических реакций, необходимых для жизнедеятельности этого организма. Для сравнения: жизнедеятельность клетки человека требует согласованного протекания более 10 000 реакций.
Из сказанного следует, что структурированность необходима для эффективного обмена веществ. С другой стороны, любая упорядоченность для своего поддержания требует затраты энергии.
Для выяснения характера связей между структурированностью, обменом веществ и открытостью живых систем полезно обратиться к понятию энтропии.
Согласно закону сохранения энергии
(первое начало термодинамики), при химических и физических превращениях она не исчезает и не образуется вновь, а переходит из одной формы в другую. Поэтому теоретически любой процесс должен протекать одинаково легко в прямом и обратном направлениях. В природе такового, однако, не наблюдается. Без воздействий извне процессы в системах идут в одном направлении: теплота переходит от более теплого объекта к холодному, в растворе молекулы перемещаются из зоны высокой концентрации в зону с малой концентрацией и т.д.
В приведенных примерах первоначальное состояние системы благодаря наличию градиентов температуры или концентрации характеризовалось определенной структурированностью. Естественное развитие процессов неизбежно приводит к состоянию равновесия
как статистически более вероятному. Одновременно утрачивается структурированность. Мерой необратимости природных процессов служит энтропия, количество которой в системе обратно пропорционально степени упорядоченности (структурированности).
Закономерности изменения энтропии
описываются вторым началом термодинамики. Согласно этому закону, в энергетически изолированной системе при неравновесных процессах количество энтропии изменяется в одну сторону. Оно увеличивается, становясь максимальным по достижении состояния равновесия. Живой организм отличается высокой степенью структурированности и низкой энтропией. Это достигается благодаря постоянному притоку извне энергии, используемой на поддержание внутренней структуры. Способность противостоять нарастанию энтропии,
сохранять высокий уровень упорядоченности является обязательным свойством жизни.
Жизнь представляет собой постоянный процесс самообновления,
в результате которого воссоздаются структуры, соответствующие снашиваемым и утрачиваемым. Это достигается благодаря использованию живыми формами для построения своих структур и обеспечения всех сторон жизнедеятельности биологической
(генетической
) информации.
Последняя отбиралась по признаку биологической полезности в процессе эволюции видов, населяющих планету. Она хранится, записанная с помощью специального кода, в наследственном веществе клеток.
Молекулярный механизм использования живыми организмами биологической информации основан на функционировании в клетках уникальных химических соединений —биологических полимеров, не встречающихся в природных условиях в неживых объектах. Во-первых, это белки,
которые, выполняя роль биологических катализаторов (ферменты), обусловливают протекание биохимических реакций в нужном направлении, с достаточной скоростью, при достаточно мягких условиях температуры и давления. Ферменты отличаются специфичностью. Они катализируют превращения веществ определенного химического строения или даже отдельного вещества. Специфичность ферментов, так же как и белков, не выполняющих каталитической функции, зависит от первичной структуры белка, т.е. постоянства последовательности аминокислот в их молекуле. Белки организма постоянно обновляются. Важнейшей особенностью является то, что каждое очередное поколение белковых молекул сохраняет исходную первичную структуру. Таким образом, всякий раз белки несут в себе одну и ту же биологическую информацию и, следовательно, выполняют одни и те же функции, необходимые клетке или организму.
Постоянство биологической информации белковых молекул достигается тем, что в качестве матриц для их синтеза используются молекулы нуклеиновых кислот.
Информация, сохраняемая в ДНК, переносится на белок с помощью молекул рибонуклеиновой кислоты — РНК. Хранение и использование биологической (генетической) информации на основе уникальных информационных макромолекул белков и нуклеиновых кислот составляет важное свойство жизни.
Хранение информации в ДНК, утилизация ее в процессе жизнедеятельности путем переноса на белки и далее на различные биологические структуры находят свое отражение в наличии генотипа
и фенотипа,
что также обязательно для всех живых существ. Воплощение исходной наследственной информации генотипа в информацию рабочих структур организма происходит в процессе онтогенеза — индивидуального развития,
типичного для живых форм. В ходе этого процесса проявляется такое свойство, как способность к росту.
Организмы обладают свойством менять свое состояние в зависимости от колебаний параметров окружающей или внутренней среды. Такая реакция имеет приспособительное значение и зависит от наличия механизмов регистрации соответствующих колебаний, анализа поступающих данных, выработки решений по содержанию и интенсивности ответа. Названное свойство позволяет рассматривать живые формы как кибернетические устройства,
которые подчиняются законам передачи и переработки информации. Термин информация
употребляется здесь в широком смысле. Биологическая информация, о которой шел разговор, качественно и количественно соответствует наследственной информации ДНК. Информация в кибернетическом смысле включает и личный опыт организма. Индивидуальные реакции живых существ на внешние и внутренние стимулы обусловливаются такими общими свойствами жизни, как раздражимость
и возбудимость.
Область жизни представлена совокупностью отдельных организмов, т.е. характеризуется дискретностью.
Продолжительность жизни организмов ограничена. В связи с этим сохранение жизни во времени зависит от такого ее свойства, как способности к размножению,
т.е. к воспроизведению себе подобных по типу обмена веществ и главным чертам морфофизиологической организации.
Существуют также свойства, распространяющиеся на область жизни в целом. Они отражают универсальные принципы ее существования во времени и пространстве. Одно из таких свойств — включенность организмов в процесс эволюции.
Благодаря этому жизнь как особое явление материального мира сохраняется на протяжении вот уже более 3 млрд. лет. Второе такое свойство — существование отдельных организмов лишь во взаимодействии с другими в составе особых сообществ — биоценозов.
Существуют две главные гипотезы, по-разному объясняющие появление жизни на Земле. Согласно гипотезе панспермии, жизнь занесена из космоса либо в виде спор микроорганизмов, либо путем намеренного «заселения» планеты разумными пришельцами из других миров.
Прямых свидетельств в пользу космического происхождения жизни нет. Космос, однако, наряду с вулканами мог быть источником низкомолекулярных органических соединений, раствор которых послужил средой для развития жизни.
Современной наукой возраст Земли оценивается в 4,5—4,6 млрд. лет. Появление на планете первых водоемов, с которыми связывают зарождение жизни, отстоит от настоящего времени на 3,8—4 млрд. лет. Полагают, что около 3,8 млрд. лет назад жизнь могла стать определяющим фактором планетарного круговорота углерода. В породах вблизи местечка Фиг-Три (Южная Африка), имеющих возраст более 3,5 млрд. лет, обнаружены бесспорные следы жизнедеятельности микроорганизмов.
Таким образом, процесс образования примитивных живых существ шел относительно быстро. Ускорению процесса могло способствовать то, что простейшие органические вещества были из нескольких источников: абиогенно образующиеся в первичной атмосфере и в то же время поступающие с оседающей на поверхность планеты космической и вулканической пылью. Подсчитано, что Земля, проходя через пылевое облако в течение 1 млрд. лет, могла получить с космической пылью 10 млрд. т органического материала. Это всего в 300 раз меньше суммарной биомассы современных наземных организмов (3 • 1012
т). Вулкан за одно извержение выбрасывает до 1000 т органических веществ.
Согласно второй гипотезе, жизнь возникла на Земле, когда сложилась благоприятная совокупность физических и химических условий, сделавших возможным абиогенное образование органических веществ из неорганических.
В середине прошлого столетия Л. Пастер окончательно доказал невозможность
самозарождения жизни в теперешних условиях. В 20-х годах текущего столетия биохимики А. И. Опарин и Дж. Холдейн предположили, что в условиях, имевших место на планете несколько миллиардов лет назад, образование живого вещества было возможно.
К таким условиям они относили наличие атмосферы восстановительного типа, воды, источников энергии (в виде ультрафиолетового (УФ) и космического излучения, теплоты остывающей земной коры, вулканической деятельности, атмосферных электрических явлений, радиоактивного распада), приемлемой температуры, а также отсутствие других живых существ.
Главные этапы на пути возникновения и развития жизни, по-видимому, состоят в: 1) образовании атмосферы из газов, которые могли бы служить «сырьем» для синтеза органических веществ (метана, оксида и диоксида углерода, аммиака, сероводорода, цианистых соединений), и паров воды; 2) абиогенном (т.е. происходящем без участия организмов) образовании простых органических веществ, в том числе мономеров биологических полимеров — аминокислот, Сахаров, азотистых оснований, АТФ и других мононуклеотидов; 3) полимеризации мономеров в биологические полимеры, прежде всего белки (полипептиды) и нуклеиновые кислоты (полинуклеотиды); 4) образовании предбиологических форм сложного химического состава — протобионтов, имеющих некоторые свойства живых существ; 5) возникновении простейших живых форм, имеющих всю совокупность главных свойств жизни,—примитивных клеток; 6) биологической эволюции возникших живых существ.
Возможность абиогенного образования органических веществ,
включая мономеры биологических полимеров, в условиях, бывших на Земле около 4 млрд. лет назад, доказана опытами химиков. В лабораторных условиях при пропускании электрических разрядов через различные газовые смеси, напоминающие примитивную атмосферу планеты, а также при использовании других источников энергии ученые получали среди продуктов реакций аминокислоты (аланин, глицин, аспарагиновую кислоту), янтарную, уксусную, молочную кислоты, мочевину, азотистые основания (аденин, гуанин), АДФ и АТФ. Низкомолекулярные органические соединения накапливались в водах первичного океана в виде первичного бульона
или же адсорбировались на Поверхности глинистых отложений. Последнее повышало концентрацию этих веществ, создавая тем самым лучшие условия для полимеризации.
Возможность полимеризации низкомолекулярных соединений с образованием полипептидов
и полинуклеотидов
(определяющая следующий этап на пути возникновения жизни) непосредственно в первичном бульоне вызывает сомнения по термодинамическим соображениям. Водная среда благоприятствует реакции деполимеризации. Ученые предполагают, что образование полипептидов и полинуклеотидов могло происходить в пленке из низкомолекулярных органических соединений в безводной среде, например на склонах вулканических конусов, покрытых остывающей лавой. Это предположение находит подтверждение в опытах. Выдерживание в течение определенного времени при 130°С сухой смеси аминокислот в сосудах из кусков лавы приводило к образованию полипептидов.
Образующиеся описанным образом биополимеры смывались ливневыми потоками в первичный бульон, что защищало их от разрушающего действия УФ-излучения, которое в то время из-за отсутствия в атмосфере планеты озонового слоя было очень жестким.
По мере повышения концентрации полипептидов, полинуклеотидов и других органических соединений в первичном бульоне сложились условия для следующего этапа — самопроизвольного возникновения предбиологических форм сложного химического состава, или протобионтов.
Предположительно они могли быть представлены коацерватами
(А. И. Опарин) или микросферами
(С. Фоке). Это коллоидные капли с уплотненным поверхностным слоем, имитирующим мембрану, содержимое которых составляли один или несколько видов биополимеров. Возможность образования в коллоидных растворах структур типа коацерватов или микросфер доказана опытным путем.
При определенных условиях коацерваты проявляют некоторые общие свойства живых форм. Они способны до известной степени избирательно поглощать вещества из окружающего раствора. Часть продуктов химических реакций, проходящих в коацерватах с участием поглощаемых веществ, выделяется ими обратно в среду. Происходит процесс, напоминающий обмен веществ. Накапливая вещества, коацерваты увеличивают свой объем (рост). По достижении определенных размеров они распадаются на части, сохраняя при этом некоторые черты исходной химической организации (размножение). Поскольку устойчивость коацерватов различного химического состава различна, среди них происходит отбор.
Перечисленные выше свойства ученые усматривают у протобионтов. Протобионты представляются как обособленные от окружающей среды, открытые макромолекулярные системы, возникавшие в первичном бульоне и способные к примитивным формам роста, размножения, обмена веществ и предбиологическому химическому отбору.
Предбиологическая эволюция протобионтов осуществлялась в трех главных направлениях. Важное значение имело совершенствование каталитической
(ферментной) функции белков. Один из путей, дающих требуемый результат, заключается, по-видимому, в образовании комплексов металлов с органическими молекулами. Так, включение железа в порфириновое кольцо Гемоглобина увеличивает его каталитическую активность в сравнении с активностью самого железа в растворе в 1000 раз. Развивалось такое свойство биологического катализа, как специфичность.
Во-вторых, исключительная роль в эволюции протобионтов принадлежит приобретению полинуклеотидами способности к самовоспроизведению,
что сделало возможным передачу информации от поколения к поколению, т.е. сохранение ее во времени. В основе этой способности лежит матричный синтез.
Механизм матричного синтеза был использован также для переноса информации с полинуклеотидов на полипептиды. Третье главное направление эволюции протобионтов состояло в возникновении мембран.
Отграничение от окружающей среды мембраной с избирательной проницаемостью превращает протобионт в устойчивый набор макромолекул, стабилизирует важные параметры обмена веществ на основе специфического катализа.
Разделение функций хранения и пространственно-временной передачи информации, с одной стороны (нуклеиновые кислоты), и использование ее для организации специфических структуры и обмена веществ — с другой (белки); появление молекулярного механизма матричного синтеза биополимеров; освоение эффективных систем энергообеспечения жизнедеятельности (АТФ); образование типичной биологической мембраны — все это привело к возникновению живых существ, которые поначалу были представлены примитивными клетками.
С момента появления клеток предбиологический химический отбор уступил место биологическому отбору. Дальнейшее развитие жизни шло согласно законам биологической эволюции.
Переломным моментом на этом пути было возникновение клеток эукариотического типа, многоклеточных организмов, человека.
Наряду с рассмотренными выше, предлагались и другие гипотезы происхождения жизни (см. 3.6.4.1), которые здесь в деталях не рассматриваются.
Ископаемые останки клеток эукариотического типа обнаружены в породах, возраст которых не превышает 1,0—1,4 млрд. лет. Более позднее возникновение, а также сходство в общих чертах их основных биохимических процессов (самоудвоение ДНК, синтез белка на рибосомах) заставляют думать о том, что эукариотические клетки произошли от предка, имевшего прокариотическое строение.
Наиболее популярна в настоящее время симбиотическая гипотеза
происхождения эукариотических клеток, согласно которой (рис. 1.4) основой, или клеткой-хозяином, в эволюции клетки эукариотического типа послужил анаэробный прокариот,
способный лишь к амебоидному движению. Переход к аэробному дыханию связан с наличием в клетке митохондрии, которые произошли путем изменений симбионтов — аэробных бактерий, проникших в клетку-хозяина и сосуществовавших с ней.

Рис. 1.4. Происхождение эукариотической клетки согласно симбиотической (I
) и инвагинационной (II
) гипотезам:
1
— анаэробный прокариот (клетка-хозяин), 2 —
прокариоты, имеющие митохондрии, 3 —
сине-зеленая водоросль (презумптивный хлоропласт), 4 —
сиирохетообразная бактерия (презумпгивный жгутик), 5 —
примитивный эукариот со жгутиком, 6 —
растительная клетка, 7 — животная клетка со жгутиком, 8 —
аэробный прокариот (презумптивная митохондрия), 9 —
аэробный прокариот (клетка-родоначальница согласно гипотезе II
), 10 —
инвагинации клеточной оболочки, давшие ядро и митохондрии, 11
— примитивный эукариот 12 —
впячивание клеточной оболочки, давшее хлоропласт, 13 —
растительная клетка; а—
ДНК прокариотической клетки, б —
митохондрия, в —
ядро эукариотической клетки, г —
жгутик, д —
хлоропласт
Сходное происхождение предполагают для жгутиков, предками которых служили симбионты-бактерии, имевшие жгутик и напоминавшие современных спирохет. Приобретение клеткой жгутиков имело наряду с освоением активного способа движения важное следствие общего порядка. Предполагают, что базальные тельца, которыми снабжены жгутики, могли эволюционировать в центриоли в процессе возникновения механизма митоза.
Способность зеленых растений к фотосинтезу обусловлена присутствием в их клетках хлоропластов. Сторонники симбиотической гипотезы считают, что симбионтами клетки-хозяина, давшими начало хлоропластам, послужили прокариотические синезеленые водоросли.
Серьезным доводом в пользу симбиотического происхождения митохондрий, центриолей и хлоропластов является то, что перечисленные органеллы имеют собственную ДНК. Вместе с тем белки бациллин и тубулин, из которых состоят жгутики и реснички соответственно современных прокариот и эукариот, имеют различное строение. У бактерий не найдено также структур со свойственной жгутикам, ресничкам, базальным тельцам и центриолям эукариотических клеток комбинацией микротрубочек: «9 + 2» или «9 +
0».
Внутриклеточные мембраны гладкой и шероховатой цитоплазматической сети, пластинчатого комплекса, пузырьков и вакуолей рассматривают как производные наружной мембраны ядерной оболочки, которая способна образовывать впячивания.
Центральным и трудным для ответа является вопрос о происхождении ядра. Предполагают, что оно также могло образоваться из симбионта-прокариота. Увеличение количества ядерной ДНК, во много раз превышающее в современной эукариотической клетке ее количество в митохондрий или хлоропласте, происходило, по-видимому, постепенно путем перемещения групп генов из геномов симбионтов. Нельзя исключить, однако, что ядерный геном формировался путем наращивания генома клетки-хозяина (без участия симбионтов).
Согласно инвагинационной гипотезе,
предковой формой эукариотической клетки был аэробный прокариот
(рис. 1.4). Внутри такой клетки-хозяина находилось одновременно несколько геномов, первоначально прикреплявшихся к клеточной оболочке. Органеллы, имеющие ДНК, а также ядро, возникли путем впячивания и отшнуровывания участков оболочки с последующей функциональной специализацией в ядро, митохондрий, хлоропласты. В процессе дальнейшей эволюции произошло усложнение ядерного генома, появилась система цитоплазматических мембран.
Инвагинационная гипотеза хорошо объясняет наличие в оболочках ядра, митохондрий, хлоропластов, двух мембран. Однако она не может ответить на вопрос, почему биосинтез белка в хлоропластах и митохондриях в деталях соответствует таковому в современных прокариотических клетках, но отличается от биосинтеза белка в цитоплазме эукариотической клетки.
История показала, что эволюционные возможности клеток эукариотического типа несравнимо выше, чем прокариотического. Ведущая роль здесь принадлежит ядерному геному эукариот,
который во много раз превосходит по размерам геном прокариот. Количество генов у бактерии и в клетке человека, например, соотносится как 1: (100-1000). Важные отличия заключаются в диплоидности эукариотических клеток благодаря наличию в ядрах двух комплектов генов, а также в многократном повторении некоторых генов. Это расширяет масштабы мутационной изменчивости без угрозы резкого снижения жизнеспособности, эволюционно значимым следствием чего является образование резерва наследственной изменчивости.
При переходе к эукариотическому типу усложняется механизм регуляции
жизнедеятельности клетки, что на уровне генетического материала проявилось в увеличении относительного количества регуляторных генов, замене кольцевых «голых» молекул ДНК прокариот хромосомами, в которых ДНК соединена с белками. В итоге стало возможным считывать биологическую информацию по частям с разных групп генов в разном их сочетании в различных типах клеток и в разное время. В бактериальной клетке, напротив, одновременно считывается до 80—100% информации генома. В клетках взрослого человека в разных его органах транскрибируется от 8—10% (печень, почка) до 44% (головной мозг) информации. Использованию биологической информации частями
принадлежит исключительная роль в эволюции многоклеточных организмов, так как именно это позволяет разным группам клеток специализироваться по различным функциональным направлениям.
Большое значение при переходе к многоклеточности имело наличие у эукариотических клеток эластичной оболочки,
что необходимо для образования устойчивых клеточных комплексов.
Среди цитофизиологических особенностей эукариот, увеличивающих их эволюционные возможности, необходимо назвать аэробное дыхание,
которое также послужило предпосылкой для развития многоклеточных форм. Интересно, что сами эукариотические клетки появились на Земле после того, как концентрация O2
в атмосфере достигла 1% (точка Пастера). Названная концентрация является необходимым условием аэробного дыхания.
В условиях усложнения генетического аппарата эукариот, увеличения суммарного количества ДНК и распределения ее по хромосомам трудно переоценить значение возникновения в эволюции митоза
как механизма воспроизведения в поколениях генетически сходных клеток.
Появление вследствие эволюционных преобразований митоза такого способа деления клеток, как мейоз,
дающего возможность сохранить постоянство хромосом в ряду поколений, наилучшим образом решило проблему размножения многоклеточных организмов. Связанный с мейозом переход к половому размножению усилил эволюционную роль комбинативной изменчивости, способствовал увеличению скорости эволюции.
Благодаря отмеченным особенностям за 1 млрд. лет эволюции эукариотический тип клеточной организации дал широкое разнообразие живых форм от одноклеточных простейших до млекопитающих и человека.
Существование клетки зависит от выполнения ею ряда обязательных условий. К ним относятся отграничение от окружающей среды и вместе с тем обмен веществами с этой средой. На основе биохимических механизмов внутри клетки происходят реакции диссимиляции и ассимиляции, образуются химические соединения для выполнения тех или иных функций. В процессе жизнедеятельности возникают вещества, которые подлежат удалению. Приобретение клеткой способности к активному движению облегчает задачу поиска пищи и избегания опасных ситуаций. Сохранение жизни во времени зависит от способности клеток к делению. В ходе эволюции совершенствование жизненно важных функций происходит путем их дифференциации, т.е. обособления. Нередко такое обособление связано с возникновением специальных структур. У одноклеточных организмов, например у инфузории, это проявляется в приобретении некоторыми внутриклеточными структурами специализации (см. рис. 2.2). Так, пищеварительные вакуоли обеспечивают переваривание поступающих извне веществ с утилизацией клеткой необходимых химических соединений и выведением вовне непереваренных остатков. Функция сократительных вакуолей состоит в регулировании водного баланса, ресничек — в обеспечении двигательной активности.
Названная закономерность, проявляющаяся в разделении и специализации функций и структур, представляет собой одно из всеобщих свойств жизни. Возникновение среди живых форм многоклеточных организмов,
с которыми связано прогрессивное направление эволюции, является логичным развитием этого свойства. В таких организмах усиление жизненной силы благодаря многократному повторению клеточных механизмов сочетается с широчайшим размахом разделения функций, их совершенствованием, образованием разнообразных специализированных структур — органов и их систем.
Переход к многоклеточности — одновременно и новое качественное состояние жизни, для которого характерно ускорение эволюционных преобразований на основе более полного использования резерва наследственной изменчивости. Это обусловлено, во-первых, объединением у многоклеточных организмов полового процесса и размножения в единое целое — половое размножение
(см. гл. 5). Во-вторых, хотя цикл индивидуального развития имеют все живые формы, включая вирусы, только у многоклеточных организмов выделяется эмбриональный период.
Значение названного периода заключается в том, что, с одной стороны, в нем отражен весь длительный процесс исторического развития данного биологического вида, с другой — именно путем изменений в ходе эмбриогенеза происходят эволюционные изменения (см. § 13.2).
Отмеченные особенности многоклеточной организации живых существ сделали их основой дальнейшей прогрессивной эволюции. Эволюционными предшественниками многоклеточных организмов были колониальные формы простейших организмов (см. § 13.1). Наиболее ранние ископаемые останки многоклеточных животных имеют возраст около 700 млн. лет. Палеонтологическая летопись свидетельствует о том, что многоклеточные организмы возникали в ходе эволюции от одноклеточных эукариот независимо не менее 17 раз. Из ныне существующих многоклеточных животных губки ведут свою родословную от одного предка, тогда как все другие формы — от какого-то другого. В процессе исторического развития на планете возникло не менее 35 типов многоклеточных организмов. Из них до сих пор существует 26, будучи представленными более чем 2 млн. видов.
Живая природа является целостной, но неоднородной системой, которой свойственна иерархическая организация.
Под системой,
в науке понимают единство, или целостность, составленное из множества элементов, которые находятся в закономерных отношениях и связях друг с другом. Главные биологические категории, такие, как геном (генотип), клетка, организм, популяция, биогеоценоз, биосфера, представляют собой системы. Иерархической
называется система, в которой части, или элементы, расположены в порядке от низшего к высшему. Так, в живой природе биосфера слагается из биогеоценозов, представленных популяциями организмов разных видов, а тела организмов имеют клеточное строение.
Иерархический принцип организации позволяет выделить в живой природе отдельные уровни,
что удобно с точки зрения изучения жизни как сложного природного явления.
В медико-биологической науке широко используют классификацию уровней
в соответствии с важнейшими частями, структурами и компонентами организма, являющимися для исследователей разных специальностей непосредственными объектами изучения. Такими объектами могут быть организм как таковой, органы, ткани, клетки, внутриклеточные структуры, молекулы. Выделение уровней рассматриваемой классификации хорошо согласуется с разрешающей способностью методов, которыми пользуются биологи и врачи: изучение объекта невооруженным глазом, с помощью лупы, светооптического микроскопа, электронного микроскопа, современных физико-химических методов. Очевидна связь этих уровней и с типичными размерами изучаемых биологических объектов (табл. 1.1).
Таблица 1.1. Уровня организации (изучения), выделяемые в многоклеточном организме (по Э. Дс. Робертсу и др., 1967, с изменениями)
| Размеры объекта
|
Объект изучения
|
Уровень организации (по объекту изучения)
|
Уровень организации (по методу изучения)
|
| 0,1 мм (100мкм) и
более
|
Организм, органы
|
Организменный, органный
|
Анатомический
|
| 100—10 мкм
|
Ткани
|
Тканевый
|
Гистологический (светооптический)
|
| 20—0,2 мкм (200 нм)
|
Клетки (эукариотические и прокариотические)
|
Клеточный
|
Цитологический
|
| 200—1 нм
|
Клеточные компоненты
|
Субклеточный
|
Ультраструктурный (электронно-микроскопический)
|
| Менее 1 нм
|
Молекулы
|
Макромолеку-лярный
|
Физико-химический
|
Взаимопроникновение идей и методов различных областей естествознания (физики, химии, биологии), возникновение наук на стыке этих областей (биофизика, биохимия, молекулярная биология) повлекли за собой расширение классификации, вплоть до выделения молекулярного и электронно-атомного уровней. Медико-биологические исследования, проводимые на этих уровнях, уже сейчас дают практический выход в здравоохранение. Так, приборы, основанные на явлениях электронного парамагнитного и ядерного магнитного резонанса, с успехом применяют для диагностики заболеваний и состояний организма.
Возможность исследовать фундаментальные биологические процессы, происходящие в организме, на клеточном, субклеточном и даже молекулярном уровнях является выдающейся, но не единственной отличительной чертой современной биологии. Для нее типичен углубленный интерес к процессам в сообществах организмов, которые определяют планетарную роль жизни.
Таким образом, классификация пополнилась надорганизменными уровнями, такими, как видовой, биогеоценотический, биосферный.
Разобранной выше классификации придерживается большинство конкретных медико-биологических и антропобиологических наук. Это неудивительно, так как она отражает уровни организации живой природы через исторически сложившиеся уровни ее изучения. В задачу курса биологии медицинского вуза входит преподать наиболее полную характеристику биологического «наследства» людей. Для решения этой задачи целесообразно воспользоваться классификацией, наиболее близко отражающей именно уровни организации жизни.
В названной классификации выделяются молекулярно-генетический, клеточный, Организменный, или онтогенетический, популяционно-видовой, биогеоценотический уровни. Особенность данной классификации заключается в том, что отдельные уровни иерархической системы жизни определяются в ней на общей основе выделения для каждого уровня элементарной единицы
и элементарного явления.
Элементарная единица — это структура или объект, закономерные изменения которых, обозначаемые как элементарное явление, составляют специфический для соответствующего уровня вклад в процесс сохранения и развития жизни. Соответствие выделяемых уровней узловым моментам эволюционного процесса, вне которого не стоит ни одно живое существо, делает их всеобщими, распространяющимися на всю область жизни, включая человека.
Элементарной единицей на молекулярно-генетическом уровне
служит ген — фрагмент молекулы нуклеиновой кислоты, в котором записан определенный в качественном и количественном отношении объем биологической (генетической) информации. Элементарное явление заключается прежде всего в процессе конвариантной редупликации,
или самовоспроизведении, с возможностью некоторых изменений в содержании закодированной в гене информации. Путем редупликации ДНК происходит копирование заключенной в генах биологической информации, что обеспечивает преемственность и сохранность (консерватизм) свойств организмов в ряду поколений. Редупликация, таким образом, является основой наследственности.
В силу ограниченной стабильности молекул или ошибок синтеза в ДНК (время от времени, но неизбежно) случаются нарушения, которые изменяют информацию генов. В последующей редупликации ДНК эти изменения воспроизводятся в молекулах-копиях и наследуются организмами дочернего поколения. Указанные изменения возникают и тиражируются закономерно, что и делает редупликацию ДНК конвариантной, т.е. происходящей иногда с некоторыми изменениями. Такие изменения в генетике получили название генных
(или истинных) мутаций.
Конвариантность редупликации, таким образом, служит основой мутационной изменчивости.
Биологическая информация, заключающаяся в молекулах ДНК, не участвует непосредственно в процессах жизнедеятельности. Она переходит в действующую форму, будучи перенесена в молекулы белков. Отмеченный перенос осуществляется благодаря механизму матричного синтеза,
в котором исходная ДНК служит, как и в случае с редупликацией, матрицей (формой), но для образования не дочерней молекулы ДНК, а матричной РНК, контролирующей биосинтез белков. Отмеченное дает основание причислить матричный синтез информационных макромолекул также к элементарному явлению на молекулярно-генетическом уровне организации жизни.
Воплощение биологической информации в конкретные процессы жизнедеятельности требует специальных структур, энергии и разнообразных химических веществ (субстратов). Описанные выше условия в живой природе обеспечивает клетка, служащая элементарной структурой клеточного уровня.
Элементарное явление представлено реакциями клеточного метаболизма,
составляющими основу потоков энергии, веществ и информации. Благодаря деятельности клетки поступающие извне вещества превращаются в субстраты и энергию, которые используются (в соответствии с имеющейся генетической информацией) в процессе биосинтеза белков и других соединений, необходимых организму. Таким образом, на клеточном уровне сопрягаются механизмы передачи биологической информации и превращения веществ и энергии. Элементарное явление на этом уровне служит энергетической и вещественной основой жизни на всех других уровнях ее организации.
Элементарной единицей организме/того уровня
является особь
в ее развитии от момента зарождения до прекращения существования в качестве живой системы, что позволяет также назвать этот уровень онтогенетическим.
Закономерные изменения организма в индивидуальном развитии составляют элементарное явление данного уровня. Эти изменения обеспечивают рост организма, дифференциацию его частей и одновременно интеграцию развития в единое целое, специализацию клеток, органов и тканей. В ходе онтогенеза в определенных условиях внешней среды происходит воплощение наследственной информации в биологические структуры и процессы, на основе генотипа формируется фенотип организмов данного вида.
Элементарной единицей популяционно-видового уровня
служит популяция —
совокупность особей одного вида. Объединение особей в популяцию происходит благодаря общности генофонда,
используемого в процессе полового размножения для создания генотипов особей следующего поколения. Популяция в силу возможности межпопуляционных скрещиваний представляет собой открытую генетическую систему.
Действие на генофонд популяции элементарных эволюционных факторов, таких, как мутационный процесс, колебания численности особей, естественный отбор, приводит к эволюционно значимым изменениям генофонда, которые представляют элементарные явления на данном уровне.
Организмы одного вида населяют территорию с известными абиотическими показателями (климат, химизм почв, гидрологические условия) и взаимодействуют с организмами других видов. В процессе совместного исторического развития на определенной территории организмов разных систематических групп образуются динамичные, устойчивые во времени сообщества — биогеоценозы,
которые служат элементарной единицей биогеоценотического
(экосистемного) уровня.
Элементарное явление на рассматриваемом уровне представлено потоками энергии и круговоротами веществ. Ведущая роль в этих круговоротах и потоках принадлежит живым организмам. Биогеоценоз — это открытая в вещественном и энергетическом плане система. Биогеоценозы, различаясь по видовому составу и характеристикам абиотической своей части, объединены на планете в единый комплекс — область распространения жизни, или биосферу.
Приведенные выше уровни отражают важнейшие биологические явления, без которых невозможны эволюция и, следовательно, само существование жизни. Хотя элементарные единицы и явления на выделяемых уровнях различны, все они тесно взаимосвязаны, решая свою специфическую задачу в рамках единого эволюционного процесса. С конвариантной редупликацией на молекулярно-генетическом уровне связаны элементарные основы этого процесса в виде явлений наследственности и истинной мутационной изменчивости. Особая роль клеточного уровня состоит в энергетическом, вещественном и информационном обеспечении происходящего на всех других уровнях. На онтогенетическом уровне биологическая информация, находящаяся в генах, преобразуется в комплекс признаков и свойств организма. Возникающий таким образом фенотип становится доступным действию естественного отбора. На популяционно-видовом уровне определяется эволюционная ценность изменений, относящихся к молекулярно-генетическому, клеточному и онтогенетическому уровням. Специфическая роль биогеоценотического уровня состоит в образовании сообществ организмов разных видов, приспособленных к совместному проживанию в определенной среде обитания. Важной отличительной чертой таких сообществ является их устойчивость во времени.
Рассмотренные уровни отражают общую структуру эволюционного процесса, закономерным результатом которого является человек. Поэтому типичные для этих уровней элементарные структуры и явления распространяются и на людей, правда, с некоторыми особенностями в силу их социальной сущности.
В § 1.3 мы рассмотрели главные свойства жизни. В данный момент полезно еще раз вернуться к этому вопросу с учетом представлений о многоуровневой организации.
Среди перечисленных выше свойств дискретность, структурированность, вещественно-энергетическая открытость, противоэнтропийная направленность характеризуют в равной степени гены, клетки, особи, популяции, биогеоценозы, проявляясь, таким образом, на всех уровнях. Вместе с тем такое свойство, как наличие генотипа и фенотипа, прямо относится лишь к организменному уровню и, возможно, к клеточному. Нетрудно, однако, видеть, что и оно является всеобщим, определяющим жизнь как таковую. Действительно, генотипы
представляют собой совокупность генов. С другой стороны, генотипы особей, принадлежащих одной популяции, образуют ее генофонд.
Именно этот генофонд служит источником генотипов организмов каждого следующего поколения.
Биоценозы,
в свою очередь, представляют собой не случайные ассоциации организмов разных видов, а исторически сложившиеся сообщества взаимоприспособленных организмов. Взаимоприспособленность складывалась в процессе эволюции живого населения определенной территории и закреплена наследственно в генофондах соответствующих популяций. Совокупность таких генофондов составляет генофонд биогеоценоза.
Непосредственными носителями биологической (генетической) информации являются нуклеиновые кислоты и белки, составляющие элементарную основу соответственно генотипа и фенотипа. С учетом рассуждении, приведенных выше, наличие информационных макромолекул с полным основанием рассматривают как специфическую общую характеристику не только клетки или организма, но и жизни в целом.
Традиционно способность к росту как одно из свойств живого относят к организму, связывая его с индивидуальным развитием последнего. На самом деле закономерные циклы развития, включающие изменения размеров, характеризуют элементарные структуры всех уровней. Редупликация ДНК, образование четвертичных структур белков за счет объединения отдельных полипептидов в функциональный комплекс, рост клетки между делениями и особи в процессе онтогенеза, изменение численности особей в популяции, сукцессия биогеоценоза с достижением им климаксного состояния — вот примеры, обосновывающие приложимость названного свойства ко всей области жизни.
Результатом закономерных циклов развития элементарные структур разных уровней организации жизни нередко, действительно, бывает увеличение их количества, т.е. размножение в буквальном смысле. Редупликация приводит к увеличению числа молекул ДНК, клеточные циклы —количества клеток, размножение на популяционном уровне — числа особей. Вместе с тем размножение в биологическом понимании — это обязательно воспроизведение в известных пределах колебаний определенной внутренней организации. Принцип воспроизведения «себе подобного» лежит в основе сохранения во времени элементарных структур всех уровней и, следовательно, тех элементарных явлений, которые с ними связаны. На молекулярно-генетическом уровне это двойная спираль ДНК, клеточном —клетка, онтогенетическом — особь данного биологического вида, популяционно-видовом — популяция с присущим ей генофондом, возрастной и половой структурой, биогеоценотическом — определенный видовой состав, включающий продуценты, консументы, деструкторы.
Любая упорядоченность возникает на основе информации, которая и воспроизводится в соответствующей структуре. Первичная биологическая информация записана в молекулах нуклеиновых кислот. Расчеты показывают, однако, что ее одной недостаточно для кодирования всего многообразия живых структур от белковых молекул до различных биоценозов. Необходимая дополнительная информация появляется в биологических структурах в процессе их развития вследствие того, что они являются самоорганизующимися системами.
Законы, которым следуют эти системы, изучает междисциплинарное направление науки — синергетика.
Самоорганизующиеся системы отличаются низкими значениями энтропии, т.е. находятся далеко от состояния термодинамического равновесия. Подобное неравновесное состояние поддерживается благодаря потокам энергии и веществ, проходящих через названные системы. Процессы в самоорганизующихся системах сопровождаются рассеиванием энергии, в связи с чем их называют диссипативными.
Важная черта диссипативных систем — целостность.
Она проявляется в том, что поведение элементов в этих системах определяется в большей мере структурой самой системы и в меньшей — их собственными свойствами. В своем развитии системы проходят ряд устойчивых состояний, разделенных периодами неустойчивости, с которыми связано возникновение новой информации. В каждом из таких периодов возможен выбор между несколькими вариантами дальнейшего развития, однако в целом процессу развития свойственна эквифинальность,
т.е. закономерное достижение определенного конечного результата. В периоды неустойчивости система отличается повышенной чувствительностью к действию разнообразных факторов (критические периоды
).
Описанными выше чертами обладают такие биологические системы, как геном, клетка, организм, популяция, биогеоценоз. Всем им присуща способность к воспроизведению собственной структуры.
В основе проявлений жизни как особого явления лежит генетическая информация ДНК клеток. В ходе развертывания этой информации по законам, характерным для самоорганизующихся диссипативных систем, воссоздается иерархия биологических структур соответственно главным уровням организации жизни с типичными для них элементарными единицами и явлениями. Благодаря последним происходит процесс эволюции живой природы, сохраняющий жизнь на планете вот уже более 3,5 млрд. лет.
На планете среди других существ людям принадлежит уникальное место, что обусловлено приобретением ими в процессе антропогенеза особого качества — социальной сущности.
Это означает, что уже не биологические механизмы, а в первую очередь общественное устройство, интеллект, производство, труд обеспечивают выживание, всесветное и даже космическое расселение, благополучие человечества. Социальность, однако, не противопоставляет людей остальной живой природе. Приобретение этого качества указывает лишь на то, что отныне историческое развитие представителей вида Homo sapiens,
т.е. человечества, подчиняется законам общественного, а не биологического развития.
Человек остается включенным в систему органического мира. Этот мир складывался и развивался на протяжении большей части истории планеты независимо от человеческого фактора, более того, на определенном этапе своего развития он этот фактор породил. Человечество составляет своеобразный, но неотъемлемый компонент биосферы. Благодаря животному происхождению жизнедеятельность человеческого организма основывается на фундаментальных биологических механизмах, которые составляют его биологическое наследство.
Биологическому наследству, формировавшемуся в процессе эволюции жизни, отводится видная роль в патологии человека. Крупный отечественный патолог И. В. Давыдовский писал, что естественность и законность болезней вытекают из основных свойств жизни, а именно из универсального и важнейшего свойства организмов — приспосабливаться к меняющимся условиям внешней среды.
По его мнению, полнота такого приспособления и есть полнота здоровья.
Развитие жизни в одной из ее ветвей привело к появлению современного человека, объединяющего в себе биологическое и социальное. Характер взаимоотношения социального и биологического в человеке нельзя представить как простое сочетание в некоторой пропорции или прямое подчинение одного другому. Особенностью человеческого биологического является то, что оно проявляется в условиях определяющего действия законов общественного развития. Биологические процессы с необходимостью совершаются в организме человека, и им принадлежит фундаментальная роль в определении важнейших сторон жизнеобеспечения и развития. Вместе с тем эти процессы в популяциях людей не дают результата, закономерного и обязательного для популяций остальных представителей мира живых существ.
В качестве примера обратимся к процессу эволюции, которым в конечном итоге обусловливаются биологические механизмы главных уровней организации жизни — молекулярно-генетического, клеточного, онтогенетического, популяционно-видового, биогеоценотического. Генофонды популяций людей и в настоящее время изменяются в результате мутаций, комбинативной изменчивости, неслучайного подбора брачных пар, дрейфа генов, изоляции и некоторых форм естественного отбора. Однако благодаря действию в социальной сфере естественный отбор утратил здесь свою важнейшую биологическую функцию — видообразование. В таком случае среди людей исключается возможность завершенного эволюционного цикла путем достижения закономерного биологического результата — появления новых видов рода Человек. Сохраняющееся же действие элементарных эволюционных факторов, перечисленных выше, оборачивается в отношении человеческих популяций необычными с эволюционно-биологической точки зрения последствиями (например, не имеющим по масштабам равных в других видах организмов генетическим и, следовательно, фенотипическим разнообразием).
Знакомство с уже обширными, но еще мало систематизированными материалами, касающимися естественнонаучной стороны проблемы человека, указывает на неуклонный рост интереса к биологическим основам жизнедеятельности людей. Отчасти это обусловливается успехами биологической науки, открывающими перспективы активно влиять на ход многих физиологических процессов в организме. В немалой степени это связано с тем, что в условиях современной энергетической и технической оснащенности воздействие человечества на биосферу оказывается по своим результатам таким, что уже невозможно, даже с медицинской точки зрения, дальнейшее игнорирование людьми своей собственной биологии, своего биологического наследства.
Клетка
представляет собой обособленную, наименьшую по размерам структуру, которой присуща вся совокупность свойств жизни и которая может в подходящих условиях окружающей среды поддерживать эти свойства в самой себе, а также передавать их в ряду поколений. Клетка, таким образом, несет полную характеристику жизни. Вне клетки не существует настоящей жизнедеятельности. Поэтому в природе планеты ей принадлежит роль элементарной структурной, функциональной и генетической единицы.
Это означает, что клетка составляет основу строения, жизнедеятельности
и развития
всех живых форм — одноклеточных, многоклеточных и даже неклеточных. Благодаря заложенным в ней механизмам клетка обеспечивает обмен веществ, использование биологической информации, размножение, свойства наследственности и изменчивости, обусловливая тем самым присущие органическому миру качества единства и разнообразия.
Занимая в мире живых существ положение элементарной единицы, клетка отличается сложным строением. При этом определенные черты обнаруживаются во всех без исключения клетках, характеризуя наиболее важные стороны клеточной организации как таковой.
Клеточная теория сформулирована немецким исследователем, зоологом Т. Шванном (1839). Поскольку при создании этой теории Шванн широко пользовался работами ботаника М. Шлейдена, последнего по праву считают соавтором клеточной теории. Исходя из предположения о схожести (гомологичности) растительных и животных клеток, доказываемой одинаковым механизмом их возникновения, Шванн обобщил многочисленные данные в виде теории, согласно которой клетки являются структурной и функциональной основой живых существ.
В конце XIX столетия немецкий патолог Р. Вирхов на основе новых фактов пересмотрел клеточную теорию. Ему принадлежит вывод о том, что клетка может возникнуть лишь из предсуществующей клетки.
Им также создана вызвавшая критику концепция «клеточного государства», согласно которой многоклеточный организм состоит из относительно самостоятельных единиц (клеток), поставленных в своей жизнедеятельности в тесную зависимость друг от друга.
Клеточная теория в современном виде включает три главных положения.
Первое положение соотносит клетку с живой природой планеты в целом. Оно утверждает, что жизнь, какие бы сложные или простые (например, вирусы) формы она ни принимала, в ее структурном, функциональном и генетическом отношении обеспечивается
в конечном итоге только клеткой. Выдающаяся роль клетки как первоисточника жизни обусловливается тем, что именно она является биологической единицей, с помощью которой происходит извлечение из внешней среды, превращение и использование организмами энергии и веществ. Непосредственно в клетке сохраняется и используется биологическая информация.
Второе положение указывает, что в настоящих условиях единственным способом возникновения новых клеток является деление предсуществующих клеток.
В обосновании клеточной природы жизни на Земле тезису о единообразии путей возникновения клеток принадлежит особая роль. Именно этот тезис был использован М. Шлейденом и Т. Шванном для обоснования представления о гомологии разных типов клеток1
. Современная биология расширила круг доказательств этому. Независимо от индивидуальных структурно-функциональных особенностей все клетки одинаковым образом: а) хранят биологическую информацию, б) редуплицируют генетический материал с целью его передачи в ряду поколений, в) используют информацию для осуществления своих функций на основе синтеза белка, г) хранят и переносят энергию, д) превращают энергию в работу, е) регулируют обмен веществ.
Третье положение клеточной теории соотносит клетку с многоклеточными организмами, для которых характерен принцип целостности и системной организации. Для системы свойственно наличие новых качеств благодаря взаимному влиянию и взаимодействию единиц, составляющих эту систему. Структурно-функциональными единицами
многоклеточных существ являются клетки.
Вместе с тем многоклеточный организм характеризуется рядом особых свойств, которые нельзя свести к свойствам и качествам отдельных клеток. В третьем положении клеточной теории мы встречаемся с проблемой соотношения части и целого.
Системный подход
как научное направление используется в биологических исследованиях с начала прошлого столетия. Системный характер организации и функционирования свойствен не только организму, но и другим главным биологическим образованиям — геному, клетке, популяции, биогеоценозу, биосфере.
В природе существует значительное разнообразие клеток, различающихся по размерам, форме, химическим особенностям. Число же главных типов клеточной организации ограничено двумя. Выделяют прокариотический и эукариотический типы с подразделением второго на подтип, характерный для простейших организмов, и подтип, характерный для многоклеточных.
Клеткам прокариоттеского типа
(рис. 2.1) свойственны малые размеры (не более 0,5—3,0 мкм в диаметре или по длине), отсутствие обособленного ядра, так что генетический материал в виде ДНК не отграничен от цитоплазмы оболочкой. В клетке отсутствует развитая система мембран. Генетический аппарат представлен ДНК единственной кольцевой хромосомы, которая лишена основных белков — гистонов (гистоны являются белками клеточных ядер). Благодаря значительному количеству диаминокислот аргинина и лизина гистоны имеют щелочной характер.
Различия прокариотических и эукариотических клеток по наличию гистонов указывают на разные механизмы регуляции функции генетического материала. В прокариотических клетках отсутствует клеточный центр. Не типичны внутриклеточные перемещения цитоплазмы и амебоидное движение. Время, необходимое для образования двух дочерних клеток из материнской (время генерации), сравнительно мало и исчисляется десятками минут. К прокариотическому типу клеток относятся бактерии и синезеленые водоросли.
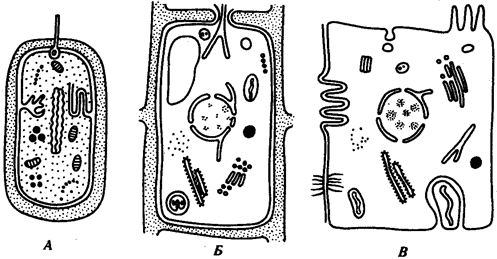
Рис. 2.1. Типичные черты структурной организации клеток. А -Б —
эукариотическая растительная; В —
животная
Эукариотический тип
клеточной организации представлен двумя подтипами. Особенностью организмов простейших
(рис. 2.2) является то, что они (исключая колониальные формы) соответствуют в структурном отношении уровню одной клетки, а в физиологическом — полноценной особи. В связи с этим одной из черт клеток части простейших является наличие в цитоплазме миниатюрных образований, выполняющих на клеточном уровне функции жизненно важных органов многоклеточного организма. Таковы (например, у инфузорий) цитостом, цитофарингс и порошица, аналогичные пищеварительной системе, и сократительные вакуоли, аналогичные выделительной системе.
В традиционном изложении клетку растительного или животного организма
описывают как объект, отграниченный оболочкой, в котором выделяют ядро и цитоплазму. В ядре наряду с оболочкой и ядерным соком обнаруживаются ядрышко и хроматин. Цитоплазма представлена ее основным веществом (матриксом, гиалоплазмой), в котором распределены включения и органеллы.
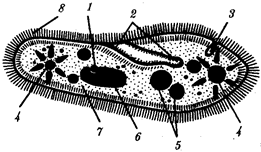
Рис. 2.2. Структурная организация одноклеточного организма (инфузория):
1—
генеративное ядро, 2—
цигостом с цитофарингсом, 3—
порошица, 4—
сократительные вакуоли, 5—
пищеварительные вакуоли, 6—
вегетативное ядро, 7—гиалоплазма, 8—
реснички
Высокая упорядоченность внутреннего содержимого эукариотиче-ской клетки достигается путем компартментации
ее объема — подразделения на «ячейки», отличающиеся деталями химического (ферментного) состава. Компартментация (рис. 2.3) способствует пространственному разделению веществ и процессов в клетке. Отдельный компартмент представлен органеллой (лизосома) или ее частью (пространство, отграниченное внутренней мембраной митохондрии).
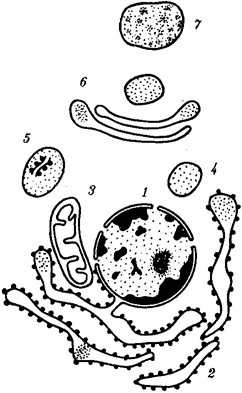
Рис. 2.3. Компартментация объема клетки с помощью мембран:
1
—ядро, 2—
шероховатая цитоплазматическая есть, 3—
митохондрия, 4—
транспортный цитоплазматический пузырек, 5—
лизосома, 6—
пластинчатый комплекс, 7 — гранула секрета
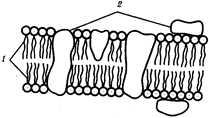
Рис. 2.4. Молекулярная организация биологической мембраны:
1
— бимолекулярный слой липидов, 2 —
белки
Предложено несколько схем взаимоотношения в мембране основных химических компонентов — белков и липидов, а также веществ, размещаемых на мембранной поверхности. В настоящее время принята точка зрения, согласно которой мембрана составлена из бимолекулярного слоя липидов.
Гидрофобные участки их молекул повернуты друг к другу, а гидрофильные — находятся на поверхности слоя. Разнообразные белковые молекулы
встроены в этот слой или размещены на его поверхностях (рис. 2.4).
Благодаря компартментации клеточного объема в эукариотической клетке наблюдается разделение функций между разными структурами. Одновременно различные структуры закономерно взаимодействуют друг с другом.
Клетки многоклеточных организмов, как животных, так и растительных, обособлены от своего окружения оболочкой. Клеточная оболочка,
или плазмалемма,
животных клеток образована мембраной, покрытой снаружи слоем гликокаликса
толщиной 10—20 нм. Основными составляющими гликокаликса служат комплексы полисахаридов с белками (гликопротеины) и жирами (гликолипиды). Изнутри к мембране примыкает кортикальный (корковый) слой цитоплазмы толщиной 0,1—0,5 мкм, в котором не встречаются рибосомы и пузырьки, но в значительном количестве находятся микротрубочки и микрофиламенты, имеющие в своем составе сократимые белки.
Плазмалемма выполняет отграничивающую, барьерную, транспортную и рецепторную функции. Благодаря свойству избирательной проницаемости она регулирует химический состав внутренней среды клетки. В плазмалемме размещены молекулы рецепторов, которые избирательно распознают определенные биологически активные вещества (гормоны). В удержании (заякоривании) этих веществ на клеточной поверхности участвуют белки кортикального слоя. Наличие в оболочке рецепторов дает клеткам возможность воспринимать сигналы извне, чтобы целесообразно реагировать на изменения в окружающей их среде или состоянии организма. В пластах и слоях соседние клетки удерживаются благодаря наличию разного вида контактов, которые представлены участками плазмалеммы, имеющими особое строение.
В клетке выделяют ядро и цитоплазму. Клеточное ядро
состоит из оболочки, ядерного сока, ядрышка и хроматина. Функциональная роль ядерной оболочки
заключается в обособлении генетического материала (хромосом) эукариотической клетки от цитоплазмы с присущими ей многочисленными метаболическими реакциями, а также регуляции двусторонних взаимодействий ядра и цитоплазмы. Ядерная оболочка состоит из двух мембран, разделенных околоядерным (перинуклеарным) пространством. Последнее может сообщаться с канальцами цитоплазматической сети.
Ядерная оболочка пронизана порожу диаметром 80—90 нм. Область поры или поровый комплекс с диаметром около 120 нм имеет определенное строение, что указывает на сложный механизм регуляции ядерно-цитоплазматических перемещений веществ и структур. Количество пор зависит от функционального состояния клетки. Чем выше синтетическая активность в клетке, тем больше их число. Подсчитано, что у низших позвоночных животных в эритробластах, где интенсивно образуется и накапливается гемоглобин, на 1 мкм2
ядерной оболочки приходится около 30 пор. В зрелых эритроцитах названных животных, сохраняющих ядра, на 1 мк»г оболочки остается до пяти пор, т.е. в 6 раз меньше.
В области перового комплекса начинается так называемая плотная пластинка —
белковый слой, подстилающий на всем протяжении внутреннюю мембрану ядерной оболочки. Эта структура выполняет прежде всего опорную функцию, так как при ее наличии форма ядра сохраняется даже в случае разрушения обеих мембран ядерной оболочки. Предполагают также, что закономерная связь с веществом плотной пластинки способствует упорядоченному расположению хромосом в интерфазном ядре.
Основу ядерного сока,
или матрикса,
составляют белки. Ядерный сок образует внутреннюю среду ядра, в связи с чем он играет важную роль в обеспечении нормального функционирования генетического материала. В составе ядерного сока присутствуют нитчатые,
или фибриллярные, белки,
с которыми связано выполнение опорной функции: в матриксе находятся также первичные продукты транскрипции генетической информации — гетероядерные РНК (гя-РНК), которые здесь же подвергаются процессингу, превращаясь в м-РНК (см. 3.4.3.2).
Ядрышко
представляет собой структуру, в которой происходит образование и созревание рибосомальных
РНК (рРНК). Гены рРНК занимают определенные участки (в зависимости от вида животного) одной или нескольких хромосом (у человека 13—15 и 21—22 пары) — ядрышковые организаторы, в области которых и образуются ядрышки. Такие участки в метафазных хромосомах выглядят как сужения и называются вторичными перетяжками. С
помощью электронного микроскопа в ядрышке выявляют нитчатый и зернистый компоненты. Нитчатый (фибриллярный) компонент представлен комплексами белка и гигантских молекул РНК-предшественниц, из которых затем образуются более мелкие молекулы зрелых рРНК. В процессе созревания фибриллы преобразуются в рибонуклеопротеиновые зерна (гранулы), которыми представлен зернистый компонент.
Хроматиновые структуры в виде глыбок,
рассеянных в нуклеоплазме, являются интерфазной формой существования хромосом клетки (см. 3.5.2.2).
В цитоплазме
различают основное вещество (матрикс, гиалоплазма), включения и органеллы. Основное вещество цитоплазмы
заполняет пространство между плазмалеммой, ядерной оболочкой и другими внутриклеточными структурами. Обычный электронный микроскоп не выявляет в нем какой-либо внутренней организации. Белковый состав гиалоплазмы разнообразен. Важнейшие из белков представлены ферментами гаиколиза, обмена Сахаров, азотистых оснований, аминокислот и липидов. Ряд белков гиалоплазмы служит субъединицами, из которых происходит сборка таких структур, как микротрубочки.
Основное вещество цитоплазмы образует истинную внутреннюю среду клетки, которая объединяет все внутриклеточные структуры и обеспечивает взаимодействие их друг с другом. Выполнение матриксом объединяющей, а также каркасной функции может быть связано с выявляемой с помощью сверхмощного электронного микроскопа микротрабекулярной сети, образованной тонкими фибриллами толщиной 2—3 нм и пронизывающей всю цитоплазму. Через гиалоплазму осуществляется значительный объем внутриклеточных перемещений веществ и структур. Основное вещество цитоплазмы следует рассматривать так же, как сложную коллоидную систему, способную переходить из золеобразного (жидкого) состояния в гелеобразное. В процессе таких переходов совершается работа. О функциональном значении таких переходов см. разд. 2.3.8.
Включениями
(рис. 2.5) называют относительно непостоянные компоненты цитоплазмы, которые служат запасными питательными веществами (жир, гликоген), продуктами, подлежащими выведению из клетки (гранулы секрета), балластными веществами (некоторые пигменты).
Органеллы —
это постоянные структуры цитоплазмы, выполняющие в клетке жизненно важные функции.
Выделяют органеллы общего значения
и специальные.
Последние в значительном количестве присутствуют в клетках, специализированных к выполнению определенной функции, но в незначительном количестве могут встречаться и в других типах клеток. К ним относят, например, микроворсинки всасывающей поверхности эпителиальной клетки кишечника, реснички эпителия трахеи и бронхов, синаптические пузырьки, транспортирующие вещества — переносчики нервного возбуждения с одной нервной клетки на другую или клетку рабочего органа, миофибриллы, от которых зависит сокращение мышцы. Детальное рассмотрение специальных органелл входит в задачу курса гистологии.
К органеллам общего значения относят элементы канальцевой и вакуолярной системы в виде шероховатой и гладкой цитоплазматической сети, пластинчатый комплекс, митохондрии, рибосомы и полисомы, лизосомы, пероксисомы, микрофибриллы и микротрубочки, центриоли клеточного центра. В растительных клетках выделяют также хлоропласта, в которых происходит фотосинтез.
Канальцевая
и вакуолярная системы
образованы сообщающимися или отдельными трубчатыми или уплощенными (цистерна) полостями, ограниченными мембранами и распространяющимися по всей цитоплазме клетки. Нередко цистерны имеют пузыревидные расширения. В названной системе выделяют шероховатую
и гладкую цитоплазматическую сети
(см. рис. 2.3). Особенность строения шероховатой сети состоит в прикреплении к ее мембранам полисом. В силу этого она выполняет функцию синтеза определенной категории белков, преимущественно удаляемых из клетки, например секретируемых клетками желез. В области шероховатой сети происходит образование белков и липидов цитоплазматических мембран, а также их сборка. Плотно упакованные в слоистую структуру цистерны шероховатой сети являются участками наиболее активного белкового синтеза и называются эргастоплазмой.
Мембраны гладкой цитоплазматической сети лишены полисом. Функционально эта сеть связана с обменом углеводов, жиров и других веществ небелковой природы, например стероидных гормонов (в половых железах, корковом слое надпочечников). По канальцам и цистернам происходит перемещение веществ, в частности секретируемого железистой клеткой материала, от места синтеза в зону упаковки в гранулы. В участках печеночных клеток, богатых структурами гладкой сети, разрушаются и обезвреживаются вредные токсические вещества, некоторые лекарства (барбитураты). В пузырьках и канальцах гладкой сети поперечно-полосатой мускулатуры сохраняются (депонируются) ионы кальция, играющие важную роль в процессе сокращения.
Рис. 2.5. Цитопдазматические включения эукариотической клетки.
А —
липофусцин; Б —
липидная капля; В —
гранулы секрета
Рибосома —
это округлая рибонуклеопротеиновая частица диаметром 20—30 нм. Она состоит из малой и большой субъединиц, объединение которых происходит в присутствии матричной (информационной) РНК (мРНК). Одна молекула мРНК обычно объединяет несколько рибосом наподобие нитки бус. Такую структуру называют полисомой.
Полисомы свободно располагаются в основном веществе цитоплазмы или прикреплены к мембранам шероховатой цитоплазматической сети. В обоих случаях они служат местом активного синтеза белка. Сравнение соотношения количества свободных и прикрепленных к мембранам полисом в эмбриональных недифференцированных и опухолевых клетках, с одной стороны, и в специализированных клетках взрослого организма —с другой, привело к заключению, что на полисомах гиалоплазмы образуются белки для собственных нужд (для «домашнего» пользования) данной клетки, тогда как на полисомах гранулярной сети синтезируются белки, выводимые из клетки и используемые на нужды организма (например, пищеварительные ферменты, белки грудного молока).
Пластинчатый комплекс Голъджи
образован совокупностью диктиосом числом от нескольких десятков (обычно около 20) до нескольких сотен и даже тысяч на клетку.
Диктиосома
(рис. 2.6, А
) представлена стопкой из 3—12 уплощенных дискообразных цистерн, от краев которых отшнуровываются пузырьки (везикулы). Ограниченные определенным участком (локальные) расширения цистерн дают более крупные пузырьки (вакуоли). В дифференцированных клетках позвоночных животных и человека диктиосомы обычно собраны в околоядерной зоне цитоплазмы. В пластинчатом комплексе образуются секреторные пузырьки или вакуоли, содержимое которых составляют белки и другие соединения, подлежащие выводу из клетки. При этом предшественник секрета (просекрет), поступающий.в диктиосому из зоны синтеза, подвергается в ней некоторым химическим преобразованиям. Он также обособляется (сегрегируется) в виде «порций», которые здесь же одеваются мембранной оболочкой. В пластинчатом комплексе образуются лизосомы. В диктиосомах синтезируются полисахариды, а также их комплексы с белками (гликопротеины) и жирами (гликолипиды), которые затем можно обнаружить в гликокаликсе клеточной оболочки.
Митохондрии
(рис. 2.6, Б
) —
это структуры округлой или палочко-видной, нередко ветвящейся формы толщиной 0,5 мкм и длиной обычно до 5—10 мкм. В большинстве животных клеток количество митохондрий колеблется от 150 до 1500, однако в женских половых клетках их число достигает нескольких сотен тысяч. В сперматозоидах нередко присутствует одна гигантская митохондрия, спирально закрученная вокруг осевой части жгутика. Одна разветвленная митохондрия обнаружена в клетке такого паразита человека, как трипаносома.
Оболочка митохондрий состоит из двух мембран, различающихся по химическому составу, набору ферментов и функциям. Внутренняя мембрана образует впячивания листовидной (кристы) или трубчатой (тубулы) формы. Пространство, ограниченное внутренней мембраной, составляет матрикс
органеллы. В нем с помощью электронного микроскопа обнаруживаются зерна диаметром 20—40 нм. Они накапливают ионы кальция и магния, а также полисахариды, например гликоген.

Рис. 2.6. Общеклеточные органеллы Объяснение см. в тексте
В матриксе размещен собственный аппарат биосинтеза белка органеллы. Он представлен 2—б копиями кольцевой и лишенной гистонов (как у прокариот) молекулы ДНК, рибосомами, набором транспортных РНК (тРНК), ферментами редупликации ДНК, транскрипции и трансляции наследственной информации. По основным свойствам: размерам и структуре рибосом, организации собственного наследственного материала — этот аппарат сходен с таковым у прокариот и отличается от аппарата биосинтеза белка цитоплазмы эукариотической клетки (чем подтверждается симбиотическая гипотеза происхождения митохондрий; см. § 1.5). Гены собственной ДНК кодируют нуклеотидные последовательности митохондриальных рРНК и тРНК, а также последовательности аминонокислот некоторых белков органеллы, главным образом ее внутренней мембраны. Аминокислотные последовательности (первичная структура) большинства белков митохондрий закодированы в ДНК клеточного ядра и образуются вне органеллы в цитоплазме.
Главная функция митохондрий состоит в ферментативном извлечении из определенных химических веществ энергии (путем их окисления) и накоплении энергии в биологически используемой форме (путем синтеза молекул аденозинтрифосфата —АТФ). В целом этот процесс называется окислительным
(расформированием.
В энергетической функции митохондрий активно участвуют компоненты матрикса и внутренняя мембрана. Именно с этой мембраной связаны цепь переноса электронов (окисление) и АТФ-синтетаза, катализирующая сопряженное с окислением фосфорилирование АДФ в АТФ. Среди побочных функций митохондрий можно назвать участие в синтезе стероидных гормонов и некоторых аминокислот (глутаминовая).
Лизосомы
(рис. 2.6, В
) представляют собой пузырьки диаметром обычно 0,2—0,4 мкм, которые содержат набор ферментов кислых гидролаз, катализирующих при низких значениях рН гидролитическое (в водной среде) расщепление нуклеиновых кислот, белков, жиров, полисахаридов. Их оболочка образована одинарной мембраной, покрытой иногда снаружи волокнистым белковым слоем (на электронограммах «окаймленные» пузырьки). Функция лизосом — внутриклеточное переваривание оазличных химических соединений и структур.
Первичными лизосомами
(диаметр 100 нм) называют неактивные органеллы, вторичными —
органеллы, в которых происходит процесс переваривания. Вторичные лизосомы образуются из первичных. Они подразделяются на гетеролизосомы
(фаголизосомы) и аутолизосомы
(цитолизосомы). В первых (рис. 2.6, Г
) переваривается материал, поступающий в клетку извне путем пиноцитоза и фагоцитоза, во вторых разрушаются собственные структуры клетки, завершившие свою функцию. Вторичные лизосомы, в которых процесс переваривания завершен, называют остаточными тельцами
(телолизосомы). В них отсутствуют гидролазы и содержится непереваренный материал.
Микротельца составляют сборную группу органелл. Это ограниченные одной мембраной пузырьки диаметром 0,1—1,5 мкм с мелкозернистым матриксом и нередко кристаллоидными или аморфными белковыми включениями. К этой группе относят, в частности, пероксисомы.
Они содержат ферменты оксидазы, катализирующие образование пероксида водорода, который, будучи токсичным, разрушается затем под действием фермента пероксидазы. Эти реакции включены в различные метаболические циклы, например в обмен мочевой кислоты в клетках печени и почек. В печеночной клетке число пероксисом достигает 70—100.
К органеллам общего значения относят также некоторые постоянные структуры цитоплазмы, лишенные мембран. Микротрубочки
(рис. 2.6, Д
) —
трубчатые образования различной длины с внешним диаметром 24 нм, шириной просвета 15 нм и толщиной стенки около 5 нм. Встречаются в свободном состоянии в цитоплазме клеток или как структурные элементы жгутиков, ресничек, митотического веретена, центриолей. Свободные микротрубочки и микротрубочки ресничек, жгутиков и центриолей имеют разную устойчивость к разрушающим воздействиям, например химическим (колхицин). Микротрубочки строятся из стереотипных субьединиц белковой природы путем их полимеризации. В живой клетке процессы полимеризации протекают одновременно с процессами деполимеризации. Соотношением этих процессов определяется количество микротрубочек. В свободном состоянии микротрубочки выполняют опорную функцию, определяя форму клеток, а также являются факторами направленного перемещения внутриклеточных компонентов.
Микрофиламентами
(рис. 2.6, Е
) называют длинные, тонкие образования, иногда образующие пучки и обнаруживаемые по всей цитоплазме. Существует несколько разных типов микрофиламентов. Актиновые микрофиламенты
благодаря присутствию в них сократимых белков (актин) рассматривают в качестве структур, обеспечивающих клеточные формы движения, например амебоидные. Им приписывают также каркасную роль и участие в организации внутриклеточных перемещений органелл и участков гиалоплазмы.
По периферии клеток под плазмалеммой, а также в околоядерной зоне обнаруживаются пучки микрофиламентов толщиной 10 нм — промежуточные филстенты.
В эпителиальных, нервных, глиальных, мышечных клетках, фибробластах они построены из разных белков. Промежуточные филаменты выполняют, по-видимому, механическую, каркасную функцию.
Актиновые микрофибриллы и промежуточные филаменты, как и микротрубочки, построены из субъединиц. В силу этого их количество зависит от соотношения процессов полимеризации и деполимеризации.
Для животных клеток, части клеток растений, грибов и водорослей характерен клеточный центр,
в состав которого входят центриоли. Центриолъ
(под электронным микроскопом) имеет вид «полого» цилиндра диаметром около 150 нм и длиной 300—500 нм. Ее стенка образована 27 микротрубочками, сгруппированными в 9 триплетов. В функцию центриолей входит образование нитей митотического веретена, которые также образованы микротрубочками. Центриоли поляризуют процесс деления клетки, обеспечивая расхождение сестринских хроматид (хромосом) в анафазе митоза.
Жизнедеятельность клетки как единицы биологической активности обеспечивается совокупностью взаимосвязанных, приуроченных к определенным внутриклеточным структурам, упорядоченных во времени и пространстве обменных (метаболических) процессов. Эти процессы образуют три потока: информации, энергии и веществ.
Благодаря наличию потока информации
клетка на основе многовекового эволюционного опыта предков приобретает структуру, отвечающую критериям живого, поддерживает ее во времени, а также передает в ряду поколений.
В потоке информации участвуют ядро (конкретно ДНК хромосом), макромолекулы, переносящие информацию в цитоплазму (мРНК), цитоплазматический аппарат трансляции (рибосомы и полисомы, тРНК, ферменты активации аминокислот). На завершающем этапе этого потока полипептиды, синтезированные на полисомах, приобретают третичную и четвертичную структуры и используются в качестве катализаторов или структурных белков (рис. 2.7). Кроме основного по объему заключенной информации ядерного генома в эукариотических клетках функционируют также геномы митохондрий, а в зеленых растениях — и хлоропластов.
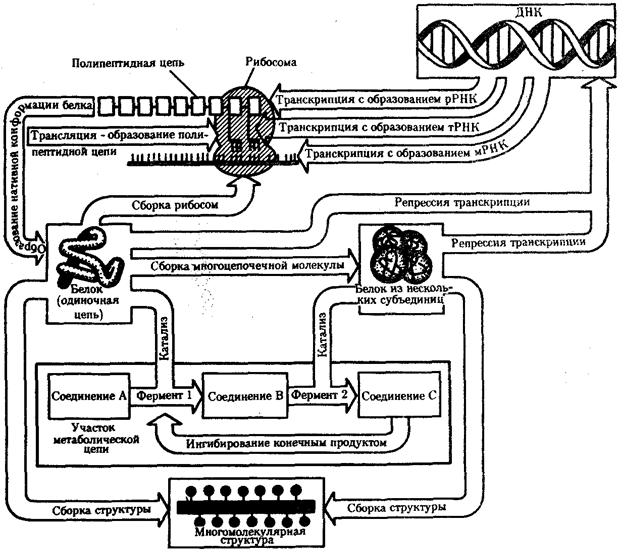
Рис. 2.7. Поток биологической информации в клетке
Поток энергии
у представителей разных групп организмов обеспечивается механизмами энергоснабжения —брожением, фото- или хемосинтезом, дыханием.
Центральная роль в биоэнергетике клеток животных принадлежит дыхательному обмену.
Он включает реакции расщепления низкокалорийного органического «топлива» в виде глюкозы, жирных кислот, аминокислот, а также использование выделяемой энергии для образования высококалорийного клеточного «топлива» в виде аденозинтрифосфата
(АТФ). Энергия АТФ, непосредственно или будучи перенесена на другие макроэргические соединения (например, креатинфосфат), в разнообразных процессах преобразуется в тот или иной вид работы —
химическую (синтезы), осмотическую (поддержание перепадов концентрации веществ), электрическую, механическую, ре-гуляторную. Макроэргическим
называют соединение, в химических связях которого запасена энергия в форме, доступной для использования в биологических процессах. Универсальным соединением такого рода служит АТФ. Основное количество энергии заключено в связи, присоединяющей третий остаток фосфорной кислоты.

Рис. 2.8. Поток энергии в клетке
Среди органелл животной клетки особое место в дыхательном обмене принадлежит митохондриям, выполняющим функцию окислительного фосфорилирования, а также матриксу цитоплазмы, в котором протекает процесс бескислородного расщепления глюкозы — анаэробный гликолиз
(рис. 2.8). Из двух механизмов, обеспечивающих жизнедеятельность клетки энергией, анаэробный гликолиз менее эффективен. В связи с неполным (в отсутствие кислорода) окислением, прежде всего глюкозы, в процессе гликолиза для нужд клетки извлекается не более 10% энергии. Недоокисленные продукты гликолиза (пируват) поступают в митохондрий, где в условиях полного окисления, сопряженного с фосфорилированием АДФ до АТФ, отдают для нужд клетки оставшуюся в их химических связях энергию.
Из преобразователей энергии химических связей АТФ в работу наиболее изучена механохимическая система поперечно-полосатой мышцы. Она состоит из сократительных белков (актомиозиновый комплекс) и фермента аденозинтрифосфатазы, расщепляющего АТФ с высвобождением энергии.
Особенность потока энергии растительной клетки состоит в наличии фотосинтеза —
механизма преобразования энергии солнечного света в энергию химических связей органических веществ.
Механизмы энергообеспечения клетки отличаются эффективностью. Коэффициенты полезного действия хлоропласта и митохондрий, достигая соответственно 25 и 45—60%, существенно превосходят аналогичный показатель паровой машины (8%) или двигателя внутреннего сгорания (17%).
Реакции дыхательного обмена не только поставляют энергию, но и снабжают клетку строительными блоками для синтеза разнообразных молекул. Ими являются многие продукты расщепления пищевых веществ. Особая роль в этом принадлежит одному из этапов дыхательного обмена — циклу Кребса,
осуществля-емому в митохондриях. Через этот цикл проходит путь углеродных атомов (углеродных скелетов) большинства соединений, служащих промежуточными продуктами синтеза химических компонентов клетки. В цикле Кребса происходит выбор пути превращения того или иного соединения, а также переключение обмена клетки с одного пути на другой, например с углеводного на жировой. Таким образом, дыхательный обмен одновременно составляет ведущее звено потока веществ,
объединяющего метаболические пути расщепления и образования углеводов, белков, жиров, нуклеиновых кислот (рис. 2.9).
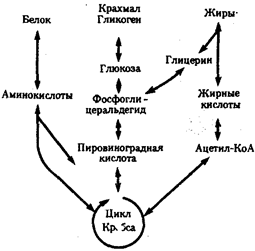
Рис. 2.9. Взаимосвязь внутриклеточного обмена белков, жиров и углеводов через цикл Кребса
Потоки информации, энергии и веществ осуществляются непрерывно
и составляют необходимое условие сохранения клетки как живой системы.
Кроме структур и процессов, прямо включенных в названные потоки, в клетке функционируют механизмы, которые также являются жизненно необходимыми. Так, лизосомы,
воздействуя ферментами на пиноцитированный или аутофагированный материал, обеспечивают гидролитическое расщепление макромолекул до низкомолекулярных соединений. Они же обусловливают разрушение внутриклеточных структур, утративших свое функциональное значение. Образовавшиеся при этом химические соединения включаются в потоки энергии, веществ и информации. Пероксисомы
ликвидируют возникающие в клетке пероксиды, токсичные для живой протоплазмы. Организация внутриклеточных транспортных потоков обусловливается наличием и активностью микротрубочек, микрофибрилл.
Выше мы познакомились с различными по строению и функциям клеточными структурами. Однако, взаимодействуя с окружающей средой и отвечая на регуляторные стимулы, клетка ведет себя как целостная структура.
Об этом свидетельствует однотипность реакции разных видов клеток на действие раздражителей, вызывающих переход клетки в возбужденное состояние1
.
Важная роль в функциональном объединении структурных компонентов и компартментов клетки принадлежит свойствам живой протоплазмы
2
. В целом ее принято рассматривать как особую многофазную коллоидную систему, или биоколлоид. От банальных коллоидных систем биоколлоид
отличается сложностью дисперсной фазы. Основу ее составляют макромолекулы, которые присутствуют либо в составе плотных микроскопически видимых структур (органелл), либо в диспергированном состоянии, близком к растворам или рыхлым сетеобразным структурам типа гелей.
Будучи коллоидным раствором в физико-химическом смысле, биоколлоид благодаря наличию липидов и крупных частиц проявляет одновременно свойства соответственно эмульсии и суспензии. На обширных поверхностях макромолекул оседают разнообразные «примеси», что ведет к изменению агрегатного состояния протоплазмы.
Между крайними полюсами организации протоплазмы в виде вязких гелей и растворов имеются переходные состояния. При указанных переходах совершается работа, в результате которой осуществляются различные внутриклеточные превращения,—образование мембран, сборка микротрубочек или микрофиламентов из субъединиц, выброс из клетки секрета, изменение геометрии белковых молекул, приводящее к торможению или усилению ферментативной активности. Особенностью биоколлоида является также и то, что в физиологических условиях переходы протоплазмы из одного агрегатного состояния в другое (в силу наличия особого ферментативного механизма) обратимы.
Названное свойство биоколлоида обеспечивает клетке способность при наличии энергии многократно совершать работу в ответ на действие стимулов.
Закономерные изменения структурно-функциональных характеристик клетки во времени составляют содержание жизненного цикла клетки
(клеточного цикла
).
Клеточный цикл — это период существования клетки от момента ее образования путем деления материнской клетки до собственного деления или смерти.
Важным компонентом клеточного цикла является митотический
(пролиферативный
) цикл
—комплекс взаимосвязанных и согласованных во времени событий, происходящих в процессе подготовки клетки к делению и на протяжении самого деления. Кроме того, в жизненный цикл включается период выполнения клеткой
многоклеточного организма специфических функций,
а также периоды покоя. В периоды покоя ближайшая судьба клетки не определена: она может либо начать подготовку к митозу, либо приступить к специализации в определенном функциональном направлении (рис. 2.10).
Продолжительность митотического цикла для большинства клеток составляет от 10 до 50 ч. Длительность цикла регулируется путем изменения продолжительности всех его периодов. У млекопитающих время митоза составляет 1—1,5 ч, 02-периода интерфазы —2—5 ч, S-периода интерфазы — 6—10 ч.
Биологическое значение митотического цикла состоит в том, что он обеспечивает преемственность хромосом в ряду клеточных поколений, образование клеток, равноценных по объему и содержанию наследственной информации. Таким образом, цикл является всеобщим механизмом воспроизведения клеточной организации эукариотического типа в индивидуальном развитии.
Главные события митотического цикла заключаются в редупликации
(самоудвоении
) наследственного материала материнской клетки и в равномерном распределении
этого материала между дочерними клетками. Указанным событиям сопутствуют закономерные изменения химической и морфологической организации хромосом —
ядерных структур, в которых сосредоточено более 90% генетического материала эукари-отической клетки (основная часть внеядерной ДНК животной клетки находится в митохондриях).
Хромосомы во взаимодействии с внехромосомными механизмами обеспечивают: а) хранение генетической информации, б) использование этой информации для создания и поддержания клеточной организации, в) регуляцию считывания наследственной информации, г) удвоение (самокопирование) генетического материала, д) передачу его от материнской клетки дочерним. Химическая организация и строение хромосом описаны в разд. 3.5.2.
Рис. 2.10. Жизненный цикл клетки многоклеточного организма.
I
— митотический цикл; II —
переход клетки в дифференцированное состояние; III
— гибель клетки:
G1
— пресинтетический период, G2
— постсинтетический (предмитотический) период, М —митоз, S — синтетический период, R1
и R2
— периоды покоя клеточного цикла; 2с —количество ДНК в диплоидном наборе хромосом, 4с —удвоенное количество ДНК
По двум главным событиям митотического цикла в нем выделяют репродуктивную
и разделительную
фазы, соответствующие интерфазе
и митозу
классической цитологии (рис. 2.11).
Рис. 2.11. Интерфазная и митотическая формы структурной организации хромосом. А —
хроматин в интерфазном ядре; Б —
включение в ядро радиоактивного предшественника ДНК в синтетическом периоде митотического цикла; В
—
клетка в анафазе митоза
В начальный отрезок интерфазы (постмитотический, пресинтетический,
или Gi-период
) восстанавливаются черты организации интерфазной клетки, завершается формирование ядрышка, начавшееся еще в телофазе. Из цитоплазмы в ядро поступает значительное (до 90%) количество белка. В цитоплазме параллельно реорганизации ультраструктуры интенсифицируется синтез белка. Это способствует росту массы клетки. Если дочерней клетке предстоит вступить в следующий митотический цикл, синтезы приобретают направленный характер: образуются химические предшественники ДНК, ферменты, катализирующие реакцию редупликации ДНК, синтезируется белок, начинающий эту реакцию. Таким образом осуществляются процессы подготовки следующего периода интерфазы — синтетического.
В синтетическом
или S-периодв
удваивается количество наследственного материала клетки. За малыми исключениями редупликация1
ДНК осуществляется полуконсервативным способом (рис. 2.12).
Он заключается в расхождении биспирали ДНК на две цепи с последующим синтезом возле каждой из них комплементарной цепочки. В результате возникают две идентичные биспирали (детали см. 3.4.2.1). Молекулы ДНК, комплементарные материнским, образуются отдельными фрагментами по длине хромосомы, причем неодномоментно (асинхронно) в разных участках одной хромосомы, а также в разных хромосомах. Затем участки (единицы репликации — репликоны
) новообразованной ДНК «сшиваются» в одну макромолекулу.
В клетке человека содержится более 50 000 репликонов. Длина каждого из них около 30 мкм. Число их меняется в онтогенезе. Смысл редупликации ДНК репликонами становится понятным из следующих сопоставлений. Скорость синтеза ДНК составляет 0,5 мкм/мин. В этом случае редупликация нити ДНК одной хромосомы человека длиной около 7 см должна была бы занять около трех месяцев. Продолжительность же синтетического периода в клетках человека составляет 7—12 ч.
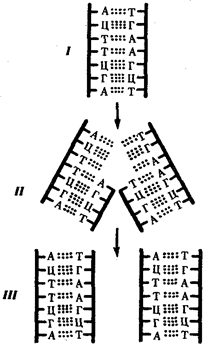
Рис. 2.12. Полуконсервативный редупликации ДНК. I
—
материнская биспираль ДНК; II—
достраивание комплементарных полинуклеотидных цепей; III —
две дочерние биспирали ДНК: А, Т, Г, Ц - символы азотистых оснований нуклеотидов
Участки хромосом, в которых начинается синтез, называют точками инициации.
Возможно, ими являются места прикрепления интерфазных хромосом к внутренней мембране ядерной оболочки. Можно думать, что ДНК отдельных фракций, о которых речь пойдет ниже (см. разд. 2.4.2), редуплицируется в строго определенной фазе S-периода. Так, большая часть генов рРНК удваивает ДНК в начале периода. Редупликация запускается поступающим в ядро из цитоплазмы сигналом, природа которого не выяснена. Синтезу ДНК в репликоне предшествует синтез РНК. В клетке, прошедшей S-период интерфазы, хромосомы содержат удвоенное количество генетического материала. Наряду с ДНК в синтетическом периоде интенсивно образуются РНК и белок, а количество гистонов строго удваивается.
Примерно 1% ДНК животной клетки находится в митоховдриях. Незначительная часть митохондриальной ДНК редуплицируется в синтетическом, тогда как основная —в постсинтетическом периоде интерфазы. Вместе с тем известно, что продолжительность жизни митохондрий печеночных клеток, например, составляет 10 сут. Учитывая, что в обычных условиях гепатоциты делятся редко, следует допустить, что редупликация ДНК митохондрий может происходить независимо от стадий митотического цикла.
Отрезок времени от окончания синтетического периода до начала митоза занимает постсинтетический
(предмитотический
),
или G2
-ne
риод
интерфазы. Он характеризуется интенсивным синтезом РНК и особенно белка. Завершается удвоение массы цитоплазмы по сравнению с началом интерфазы. Это необходимо для вступления клетки в митоз. Часть образуемых белков (тубулины) используется в дальнейшем для построения микротрубочек веретена деления. Синтетический и постсинтетический периоды связаны с митозом непосредственно. Это позволяет выделить их в особый период интерфазы — препрофазу.
В митозе можно выделить
четыре фазы. Главные события по отдельным фазам представлены ниже и на рис. 2.13.
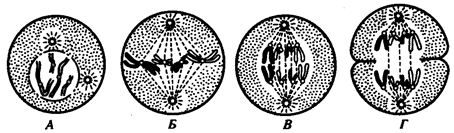
Рис. 2.13. Митоз в животной клетке.
А —
профаза; Б —
метафаза; В —
анафаза; Г —
телофаза
| Фаза митоза
|
Содержание изменений
|
| Профаза
Метафаза
Анафаза
Телофаза
|
Хромосомы спирализуются и приобретают вид нитей. Ядрышко разрушается. Распадается ядерная оболочка. В цитоплазме уменьшается количество структур шероховатой сети. Резко сокращается число полисом. Центриоли клеточного центра расходятся к полюсам клетки, между ними микротрубочки образуют веретено деления
Заканчивается образование веретена деления. Хромосомы выстраиваются в экваториальной плоскости клетки (метафазная пластинка). Микротрубочки веретена деления связаны с кинетохорами хромосом. Каждая хромосома продольно расщепляется на две хроматиды (дочерние хромосомы), соединенные в области кинетохора
Связь между хроматидами нарушается, и они в качестве самостоятельных хромосом перемещаются к полюсам клетки со скоростью 0,2—5 мкм/мин. По завершении движения на полюсах собирается два равноценных полных набора хромосом Реконструируются интерфазные ядра дочерних клеток. Хромосомы де-спирализуются. Образуются ядрышки. Разрушается веретено деления. Материнская клетка делится на две дочерние
|
Наряду с преобразованием строения и упорядоченными перемещениями хромосом обязательным для разделительной фазы цикла является построение митотического аппарата.
Он состоит из системы микротрубочек (ахроматиновое веретено, или веретено деления светооптической микроскопии) и структур, поляризующих митоз1
, т.е. обозначающих два полюса в клетке, к которым разойдутся дочерние хромосомы. В клетках млекопитающих и человека роль поляризующих структур выполняют центриоли.
Митотический аппарат обеспечивает направленное перемещение дочерних хромосом
в анафазе. Для этого необходим контакт микротрубочек со специализированными участками хромосом — центромерами
(кинетохорами
).
При разрушении центромер в эксперименте расхождения хромосом к полюсам клетки не происходит.
Природа сил, обеспечивающих расхождение, неизвестна. Предполагают, что функциональную основу митотического аппарата составляет механохимическая система, сходная с действующей в поперечно-полосатой мышце. В нее входят сократимые белки и фермент, катализирующий расщепление АТФ для обеспечения процесса энергией.
Нарушения той или иной фазы митоза приводят к патологическим изменениям клеток. Отклонение от нормального течения процесса спирализации может привести к набуханию и слипанию хромосом. Иногда наблюдается отрыв участка хромосомы, который, если он лишен центромеры, не участвует в анафазном перемещении к полюсам и теряется. Отставать при движении могут отдельные хроматиды, что приводит к образованию дочерних ядер с несбалансированными хромосомными наборами. Повреждения со стороны веретена деления приводят к задержке митоза в метафазе, рассеиванию хромосом. При изменении количества центриолей возникают многополюсные или асимметричные митозы. Нарушение цитотомии приводит к появлению дву- и многоядерных клеток.
Данные генетики и цитологии указывают на сохранение структурной индивидуальности хромосом в клеточном цикле. Есть свидетельства в пользу упорядоченного размещения хромосом в объеме интерфазного ядра.
Особенности взаиморасположения хромосом могут иметь большое функциональное значение. Так, пространственная близость в клетках человека хромосом 13, 14, 15, 21 и 22-й пар, содержащих гены рРНК, объясняется, по-видимому, их участием в формировании ядрышка и образовании рибосом, а 11-й и 16-й хромосом —в образовании молекулы гемоглобина. Есть указания на то, что в клетках разных типов расположение хромосом не одинаково.
На основе митотического цикла возник ряд механизмов, с помощью которых в том или ином органе количество генетического материала и, следовательно, интенсивность обмена могут быть увеличены при сохранении постоянства числа клеток. Удвоение ДНК клетки не всегда сопровождается ее разделением на две. Поскольку механизм такого удвоения совпадает с предмитотической редупликацией ДНК и оно сопровождается кратным увеличением количества хромосом, это явление получило название эндомитоза.
С генетической точки зрения, эндомитоз — геномная соматическая мутация, о чем будет сказано ниже. Другое явление, сходное по результату и названное политенией,
заключается в кратном увеличении содержания ДНК в хромосомах при сохранении их диплоидного количества. Эндомитоз и политения приводят к образованию полиплоидных клеток,
отличающихся кратным увеличением объема наследственного материала. В таких клетках в отличие от диплоидных гены повторены более чем два раза. Пропорционально увеличению числа генов растет масса клетки, что повышает ее функциональные возможности. В организме млекопитающих полиплоидизация с возрастом свойственна печеночным клеткам.
Жизнь как особое явление характеризуется продолжительностью существования во времени (на Земле она возникла более 3,5 млрд. лет назад), что обеспечивается преемственностью поколений живых систем. Происходит смена поколений клеток в организме, смена поколений организмов в популяциях, смена видов в системе биоценоза, смена биоценозов, образующих биосферу. В основе непрерывного существования жизни во времени лежит способность живых систем к самовоспроизведению. Сохранение жизни в меняющихся условиях оказывается возможным благодаря эволюции живых форм, в процессе которой у них появляются изменения, обеспечивающие приспособление к новой среде обитания. Непрерывность существования и историческое развитие живой природы обусловлены двумя фундаментальными свойствами жизни: наследственностью
и изменчивостью.
В учебных курсах свойства наследственности и изменчивости традиционно рассматривают относительно клетки и организма. На самом деле они проявляются и на надорганизменных уровнях. На клеточном и организменном (онтогенетическом) уровнях организации живого под наследственностью
понимают свойство клеток или организмов в процессе самовоспроизведения передавать новому поколению способность к определенному типу обмена веществ и индивидуального развития, в ходе которого у них формируются общие признаки и свойства данного типа клеток и вида организмов, а также некоторые индивидуальные особенности родителей. На популяционно-видовом уровне организации жизни наследственность проявляется в поддержании постоянного соотношения различных генетических форм в ряду поколений организмов данной популяции (вида). На биоценотическом уровне продолжительное существование биоценоза обеспечивается сохранением определенных соотношений видов организмов, образующих этот биоценоз.
В ходе возникновения и развития жизни на Земле наследственность играла решающую роль, так как закрепляла в ряду поколений биологически полезные эволюционные приобретения, обеспечивая определенный консерватизм организации живых систем. Наследственность является одним из главных факторов эволюции.
Продолжительное существование живой природы во времени на фоне меняющихся условий было бы невозможным, если бы живые системы не обладали способностью к приобретению и сохранению некоторых изменений, полезных в новых условиях среды. Свойство живых систем приобретать изменения и существовать в различных вариантах называется изменчивостью.
У отдельных клеток и организмов одного вида изменчивость, затрагивая их индивидуальное развитие, проявляется в возникновении отличий между ними. На популяционно-видовом уровне организации жизни это свойство проявляется в наличии генетических различий между отдельными популяциями вида, что лежит в основе образования новых видов. Появление новых видов вносит изменения в межвидовые взаимоотношения в биоценозах. Изменчивость в определенном смысле отражает динамичность организации живых систем и наряду с наследственностью является ведущим фактором эволюции.
Несмотря на то что по своим результатам наследственность и изменчивость разнонаправлены, в живой природе эти два фундаментальных свойства образуют неразрывное единство, чем достигается одновременно сохранение в процессе эволюции имеющихся биологически целесообразных качеств и возникновение новых, делающих возможным существование жизни в разнообразных условиях.
Наследственность и изменчивость как важнейшие свойства любой живой системы обеспечиваются функционированием особого материального субстрата. В ходе исторического развития биологической науки представления о его свойствах, организации и химической природе постоянно расширяются и усложняются.
В 60-х гг. XIX в. основоположник генетики (науки о наследственности и изменчивости) Г. Мендель (1865) высказал первые предположения об организации наследственного материала. На основании результатов своих экспериментов на горохе он пришел к заключению, что наследственный материал дискретен,
т.е. представлен отдельными наследственными задатками, отвечающими за развитие определенных признаков организмов. По утверждению Менделя, в наследственном материале организмов, размножающихся половым путем, развитие отдельного признака обеспечивается парой аллельных задатков,
пришедших с половыми клетками от обоих родителей. При образовании гамет в каждую из них попадает лишь один из пары аллельных задатков, поэтому гаметы всегда «чисты».
В 1909 г. В. Иогансен назвал «наследственные задатки» Менделя генами.
80-е гг. XIX в. ознаменовались важными достижениями в области цитологии: были описаны митоз и мейоз —
деление соответственно соматических и половых клеток, в ходе которых закономерно между дочерними клетками распределяются ядерные структуры —хромосомы
(В. Вольдейер, 1888).
Данные о характере распределения хромосом в процессе клеточного деления позволили в начале XX в. Т. Бовери (1902—1907) и У. Сетгону (1902—1903) сделать вывод о том, что преемственность свойств в ряду поколений
клеток и организмов определяется преемственностью их хромосом.
Хромосомы стали рассматривать как материальные носители наследственной программы.
Дальнейшая разработка хромосомной теории наследственности,
объединяющей представления о наследственных задатках и хромосомах, была осуществлена в начале XX в. Т. Морганом и его сотрудниками. В опытах, выполненных на дрозофиле, было подтверждено ранее высказанное предположение о роли хромосом в обеспечении наследственности. Установлено, что гены размещаются в хромосомах, располагаясь в них в линейном порядке. Гены каждой хромосомы образуют группу сцепления,
число которых определяется количеством хромосом в половых клетках. Гены одной группы сцепления наследуются, как правило, совместно. Однако в ряде случаев происходит их перекомбинация
в связи с кроссинговером
(см. разд. 5.3.2), частота которого зависит от расстояния между генами.
Таким образом, в хромосомной теории нашел отражение один из важнейших принципов генетики — единство дискретности и непрерывности наследственного материала.
Необходимо отметить, что также в начале XX в. были обнаружены факты, которые доказывали наличие в клетках внехромосомного наследственного материала, располагающегося в различных цитоплазматических структурах и определяющего особую цитоплазматическую наследственность
(К. Корренс, 1908).
Примерно в это же время X. де Фризом (1901) были заложены основы учения о мутационной изменчивости,
связанной с внезапно возникающими изменениями в наследственных задатках или хромосомах, что приводит к изменениям тех или иных признаков организма. В последующие годы было обнаружено мутагенное действие на хромосомы и гены рентгеновских лучей, радиационного излучения, определенных химических веществ и биологических агентов.
В результате этих исследований стало очевидным, что наследственность и изменчивость обусловлены функционированием одного и того же материального субстрата.
В первые десятилетия XX в. были получены данные, свидетельствующие в пользу зависимости состояния признаков от характера взаимодействия генов, что выходило за рамки отношений доминантности и рецессивности, описанных еще Менделем. Отсюда появилось представление о генетическом аппарате
как о системе взаимодействующих генов — генотипе,
который сосредоточен в хромосомном наборе — кариотипе.
Изучение химического состава хромосом выявило два основных вида соединений, образующих эти структуры,— белки
и нуклеиновые кислоты.
В первой половине XX в. исследователями решался вопрос о химической природе субстрата наследственности и изменчивости. Первоначально высказывались предположения в пользу белков. В 1928 г. Ф. Гриффитом был поставлен опыт на пневмококках, в котором наблюдалось изменение (трансформация) некоторых наследственных свойств одного бактериального штамма под влиянием материала, полученного из убитых клеток другого штамма. Химическая природа вещества, трансформирующего наследственные свойства бактерий, была установлена лишь в 1944 г. О. Эйвери, доказавшим его принадлежность к нуклеиновым кислотам (ДНК).
Другими доказательствами участия ДНК в обеспечении наследственности и изменчивости являются: 1) постоянство содержания ДНК во всех типах соматических клеток организма; 2) соответствие содержания ДНК плоидности клеток (в соматических клетках ее вдвое больше, чем в половых, в полиплоидных клетках оно соответствует количеству наборов хромосом); 3) явление генетической рекомбинации у бактерий при их конъюгации, в ходе которой осуществляется проникновение части ДНК из одной клетки в другую и изменение свойств последней; 4) изменение наследственных свойств бактериальных клеток путем переноса ДНК от одного штамма к другому с помощью ДНК-фага — явление трансдукции; 5) инфицирующая активность изолированной нуклеиновой кислоты вирусов.
Важным результатом целенаправленного изучения нуклеиновых кислот было создание Дж. Уотсоном и Ф. Криком (1953) пространственной модели молекулы ДНК.
Во второй половине XX в. усилия ученых направлены на изучение свойств нуклеиновых кислот, составляющих основу их генетических функций, способов записи и считывания наследственной информации, характера и структуры генетического кода, механизмов регуляции активности генов в процессе формирования отдельных признаков и фенотипа в целом. В 60-х гг. работами М. Ниренберга, С. Очоа, X. Кораны и других была произведена полная расшифровка генетического кода,
установлено соответствие триплетов нуклеотидов в молекуле нуклеиновых кислот определенным аминокислотам. В 70-х гг. стали активно разрабатываться методы генной инженерии,
позволяющие целенаправленно изменять наследственные свойства живых организмов.
К концу XX столетия, благодаря новым молекулярно-генетическим технологиям, появилась возможность определять последовательности нуклеотидов в молекулах ДНК геномов различных организмов (прочтение ДНК-текстов). ДНК-тексты генома человека, представленные в целом 3 млрд. пар нуклеотидов, в основном прочитаны к 2001 году. Научно-практическое направление молекулярной биологии, имеющее целью определение нуклеотидных последовательностей молекул ДНК, получило название геномики.
На основании приведенных выше определений наследственности и изменчивости можно предположить, каким требованиям должен отвечать материальный субстрат этих двух свойств жизни.
Во-первых, генетический материал должен обладать способностью к самовоспроизведению,
чтобы в. процессе размножения передавать наследственную информацию, на основе которой будет осуществляться формирование нового поколения. Во-вторых, для обеспечения устойчивости характеристик в ряду поколений наследственный материал должен сохранять постоянной свою организацию.
В-третьих, материал наследственности и изменчивости должен обладать способностью приобретать изменения и воспроизводить их,
обеспечивая возможность исторического развития живой материи в меняющихся условиях. Только в случае соответствия указанным требованиям материальный субстрат наследственности и изменчивости может обеспечить длительность и непрерывность существования живой природы и ее эволюцию.
Современные представления о природе генетического аппарата позволяют выделить три уровня его организации: генный, хромосомный
и геномный.
На каждом из них проявляются основные свойства материала наследственности и изменчивости и определенные закономерности его передачи и функционирования.
Элементарной функциональной единицей генетического аппарата, определяющей возможность развития отдельного признака клетки или организма данного вида, является ген
(наследственный задаток, по Г. Менделю). Передачей генов в ряду поколений клеток или организмов достигается материальная преемственность — наследование потомками признаков родителей.
Под признаком
понимают единицу морфологической, физиологической, биохимической, иммунологической, клинической и любой другой дискретности организмов (клеток), т.е. отдельное качество или свойство, по которому они отличаются друг от друга.
Большинство перечисленных выше особенностей организмов или клеток относится к категории сложных признаков,
формирование которых требует синтеза многих веществ, в первую очередь белков со специфическими свойствами — ферментов, иммунопротеинов, структурных, сократительных, транспортных и других белков. Свойства белковой молекулы определяются аминокислотной последовательностью ее полипептидной цепи, которая прямо задается последовательностью нуклеотидов в ДНК соответствующего гена и является элементарным,
или простым, признаком.
Основные свойства гена как функциональной единицы генетического аппарата определяются его химической организацией,
Исследования, направленные на выяснение химической природы наследственного материала, неопровержимо доказали, что материальным субстратом наследственности и изменчивости являются нуклеиновые кислоты,
которые были обнаружены Ф. Мишером (1868) в ядрах клеток гноя. Нуклеиновые кислоты являются макромолекулами, т.е. отличаются большой молекулярной массой. Это полимеры, состоящие из мономеров — нуклеотидов,
включающих три компонента: сахар
(пентозу), фосфат
и азотистое основание
(пурин или пиримидин). К первому атому углерода в молекуле пентозы С-1' присоединяется азотистое основание (аденин, гуанин, цитозин, тимин или урацил), а к пятому атому углерода С-5' с помощью эфирной связи — фосфат; у третьего атома углерода С-3' всегда имеется гидроксильная группа — ОН (рис. 3.1).
Соединение нуклеотидов в макромолекулу нуклеиновой кислоты происходит путем взаимодействия фосфата одного нуклеотида с гидроксилом другого так, что между ними устанавливается фосфодиэфирная связь
(рис. 3.2). В результате образуется полинуклеотидная цепь. Остов цепи состоит из чередующихся молекул фосфата и сахара. К молекулам пентозы в положении С-1' присоединено одно из перечисленных выше азотистых оснований (рис. 3.3).
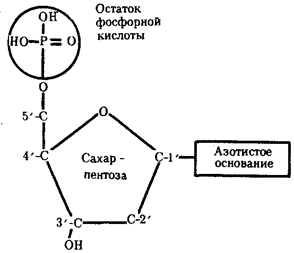
Рис. 3.1. Схема строения нуклеотида
Объяснение см. в тексте; обозначения компонентов нуклеотида, использованные в этом рисунке, сохраняются во всех последующих схемах нуклеиновых кислот
Сборка полинуклеотидной цепи осуществляется при участии фермента полимеразы, который обеспечивает присоединение фосфатной группы следующего нуклеотида к гидроксильной группе, стоящей в положении 3', предыдущего нуклеотида (рис. 3.3). Благодаря отмеченной специфике действия названного фермента наращивание полинуклеотидной цепи происходит только на одном конце: там, где находится свободный гидроксил в положении 3'. Начало цепи всегда несет фосфатную группу в положении 5'. Это позволяет выделить в ней 5' и 3 '-концы.
Среди нуклеиновых кислот различают два вида соединений: дезоксирибонуклеиновую
(ДНК
) и рибонуклеиновую
(РНК
) кислоты.
Изучение состава основных носителей наследственного материала — хромосом — обнаружило, что их наиболее химически устойчивым компонентом является ДНК, которая представляет собой субстрат наследственности и изменчивости.
| 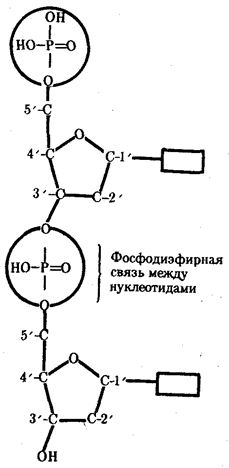
Рис. 3.2. Схема соединения нуклеотидов в полинуклеотидную цепь
|
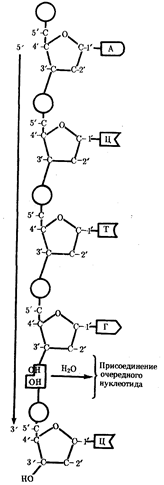
Рис. 3.3. Схема полинуклеотидной цепи (стрелкой указано направление роста цепи)
Присоединение очередного нуклеотида сопровождается образованием эфирной связи между ОН-группой на 3'-конце полинуклеотидной цепи и фосфатом свободного нуклеотида, остальные пояснения см. в тексте
|
ДНК состоит из нуклеотидов, в состав которых входят сахар — дезоксирибоза, фосфат и одно из азотистых оснований — пурин (аденин или гуанин) либо пиримидин (тимин или цитозин).
Особенностью структурной организации ДНК является то, что ее молекулы включают две полинуклеотидные цепи, связанные между собой определенным образом. В соответствии с трехмерной моделью ДНК, предложенной в 1953 г. американским биофизиком Дж. Уотсоном и английским биофизиком и генетиком Ф. Криком, эти цепи соединяются друг с другом водородными связями между их азотистыми основаниями по принципу комплементарности. Аденин одной цепи соединяется двумя водородными связями с тимином другой цепи, а между гуанином и цитозином разных цепей образуются три водородные связи. Такое соединение азотистых оснований обеспечивает прочную связь двух цепей и сохранение равного расстояния между ними на всем протяжении.
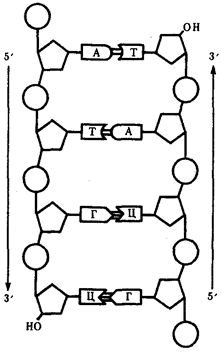
Рис. 3.4. Схема строения молекулы ДНК
Стрелками обозначена антилараллельность целей
Другой важной особенностью объединения двух полинуклеотидных цепей в молекуле ДНК является их антипараллельность: 5'-конец одной цепи соединяется с 3'-концом другой, и наоборот (рис. 3.4).
Данные рентгеноструктурного анализа показали, что молекула ДНК, состоящая из двух цепей, образует спираль, закрученную вокруг собственной оси. Диаметр спирали составляет 2 нм, длина шага — 3, 4 нм. В каждый виток входит 10 пар нуклеотидов.
Чаще всего двойные спирали являются правозакрученными — при движении вверх вдоль оси спирали цепи поворачиваются вправо. Большинство молекул ДНК в растворе находится в правозакрученной — В-форме (В-ДНК). Однако встречаются также левозакрученные формы (Z-ДНК). Какое количество этой ДНК присутствует в клетках и каково ее биологическое значение, пока не установлено (рис. 3.5).
Рис. 3.5. Пространственные модели левоэакрученной Z-формы (I
)
и правозакрученной В-формы (II
) ДНК
Таким образом, в структурной организации молекулы ДНК можно выделить первичную структуру —
полинуклеотидную цепь, вторичную структуру—
две комплементарные друг другу и антипараллельные полинуклеотидные цепи, соединенные водородными связями, и третичную структуру —
трехмерную спираль с приведенными выше пространственными характеристиками.
Первично все многообразие жизни обусловливается разнообразием белковых молекул, выполняющих в клетках различные биологические функции. Структура белков определяется набором и порядком расположения аминокислот в их пептидных цепях. Именно эта последовательность аминокислот в пептидах зашифрована в молекулах ДНК с помощью биологического
(генетического
) кода.
Относительная примитивность структуры ДНК, представляющей чередование всего лишь четырех различных нуклеотидов, долгое время мешала исследователям рассматривать это соединение как материальный субстрат наследственности и изменчивости, в котором должна быть зашифрована чрезвычайно разнообразная информация.
В 1954 г. Г. Гамовым было высказано предположение, что кодирование информации в молекулах ДНК должно осуществляться сочетаниями нескольких нуклеотидов. В многообразии белков, существующих в природе, было обнаружено около 20 различных аминокислот. Для шифровки такого их числа достаточное количество сочетаний нуклеотидов может обеспечить лишь триплетный код,
в котором каждая аминокислота шифруется тремя стоящими рядом нуклеотидами. В этом случае из четырех нуклеотидов образуется 43
= 64 триплета. Код, состоящий из двух нуклеотидов, дал бы возможность зашифровать только 42
= 16 различных аминокислот.
Полная расшифовка генетического кода проведена в 60-х гг. нашего столетия. Из 64 возможных триплетов ДНК 61 кодирует различные аминокислоты; оставшиеся 3 получили название бессмысленных, или «нонсенс-триплетов». Они не шифруют аминокислот и выполняют функцию знаков препинания при считывании наследственной информации. К ним относятся АТТ, АЦТ, АТЦ.
Обращает на себя внимание явная избыточность кода, проявляющаяся в том, что многие аминокислоты шифруются несколькими триплетами (рис. 3.6). Это свойство триплетного кода, названное вырожденностью,
имеет очень важное значение, так как возникновение в структуре молекулы ДНК изменений по типу замены одного нукле-отида в полинуклеотидной цепи может не изменить смысла триплета. Возникшее таким образом новое сочетание из трех нуклеотидов кодирует ту же самую аминокислоту.
В процессе изучения свойств генетического кода была обнаружена его специфичность.
Каждый триплет способен кодировать только одну определенную аминокислоту. Интересным фактом является полное соответствие кода у различных видов живых организмов. Такая универсальность
генетического кода свидетельствует о единстве происхождения всего многообразия живых форм на Земле в процессе биологической эволюции.
Незначительные отличия генетического кода обнаружены в ДНК митохондрий некоторых видов. Это не противоречит в целом положению об универсальности кода, но свидетельствует в пользу определенной дивергентности в его эволюции на ранних этапах существования жизни. Расшифровка кода в ДНК митохондрий различных видов показала, что во всех случаях в митохондриальных ДНК отмечается общая особенность: триплет АЦТ читается как АЦЦ, и поэтому из нонсенс-триплета превращается в шифр аминокислоты триптофана.

Рис. 3.6. Аминокислоты и кодирующие их триплеты ДНК
Другие особенности являются специфичными для различных видов организмов. У дрожжей триплет ГАТ и, возможно, все семейство ГА кодирует вместо аминокислоты лейцина треонин. У млекопитающих триплет ТАГ имеет то же значение, что и ТАЦ, и кодирует аминокислоту метионин вместо изолейцина. Триплеты ТЦГ и ТЦЦ в ДНК митохондрий некоторых видов не кодируют аминокислот, являясь нонсенс-триплетами.
Наряду с триплетностью, вырожденностью, специфичностью и универсальностью важнейшими характеристиками генетического кода являются его непрерывность
и неперекрываемость кодонов при считывании.
Это означает, что последовательность нуклеотидов считывается триплет за триплетом без пропусков, при этом соседние триплеты не перекрывают друг друга, т.е. каждый отдельный нуклеотид входит в состав только одного триплета при заданной рамке считывания (рис. 3.7). Доказательством неперекрываемости генетического кода является замена только одной аминокислоты в пептиде при замене одного нуклеотида в ДНК. В случае включения нуклеотида в несколько перекрывающихся триплетов его замена влекла бы за собой замену 2—3 аминокислот в пептидной цепи.
Рис. 3.7. Непрерывность и непререкаемость генетического кода
при считывании наследственной информации
Цифрами обозначены нуклеотиды
Одним из основных свойств материала наследственности является его способность к самокопированию —репликация.
Это свойство обеспечивается особенностями химической организации молекулы ДНК, состоящей из двух комплементарных цепей. В процессе репликации на каждой полинуклеотидной цепи материнской молекулы ДНК синтезируется комплементарная ей цепь. В итоге из одной двойной спирали ДНК образуются две идентичные двойные спирали. Такой способ удвоения молекул, при котором каждая дочерняя молекула содержит одну материнскую и одну вновь синтезированную цепь, называют полуконсервативным
(см. рис. 2.12).
Для осуществления репликации цепи материнской ДНК должны быть отделены друг от друга, чтобы стать матрицами, на которых будут синтезироваться комплементарные цепи дочерних молекул.
Инициация репликации осуществляется в особых участках ДНК, обозначаемых ori
(от англ. origin —начало). Они включают последовательность, состоящую из 300 нуклеотидных пар, узнаваемую специфическими белками. Двойная спираль ДНК в этих локусах разделяется на две цепи, при этом, как правило, по обе стороны от точки начала репликации образуются области расхождения полинуклеотидных цепей — репликацчонные вилки,
которые движутся в противоположных от локуса ori
направлениях. Между репликационными вилками образуется структура, называемая репликаци-онным глазком,
где на двух цепях материнской ДНК образуются новые полинуклеотидные цепи (рис 3.8, А
).
С
помощью фермента геликазы, разрывающего водородные связи, двойная спираль ДНК расплетается в точках начала репликации. Образующиеся при этом одинарные цепи ДНК связываются специальными дестабилизирующими белками, которые растягивают остовы цепей, делая их азотистые основания доступными для связывания с комплементарными нуклеотидами, находящимися в нуклеоплазме. На каждой из цепей, образующихся в области репликационной вилки, при участии фермента ДНК-полимеразы осуществляется синтез комплементарных цепей (рис 3.8, Б
).
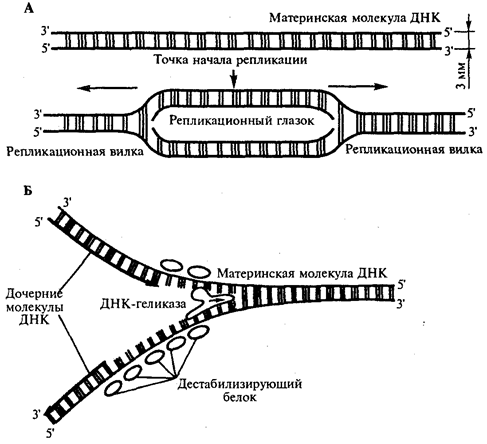
Рис. 3.8. Область начала репликации. Репликационная вилка
А. Образование репликационного глазка.
В. Область репликационной вилки в молекуле ДНК
В процессе синтеза репликационные вилки движутся вдоль материнской спирали в противоположных направлениях, захватывая все новые зоны.
Разделение спирально закрученных цепей родительской ДНК ферментом геликазой вызывает появление супервитков перед репликационной вилкой. Это объясняется тем, что при расхождении каждых 10 пар нуклеотидов, образующих один виток спирали, родительская ДНК должна совершить один полный оборот вокруг своей оси. Следовательно, для продвижения репликационной вилки вся молекула ДНК перед ней должна была бы быстро вращаться, что потребовало бы большой затраты энергии. В действительности это не наблюдается благодаря особому классу белков, называемых ДНК-топоизомеразами.
Топоизомераза разрывает одну из цепей ДНК, что дает ей возможность вращаться вокруг второй цепи. Это ослабляет накопившееся напряжение в двойной спирали ДНК (рис. 3.9).
К высвобождающимся водородным связям нуклеотидных последовательностей разделенных родительских цепей присоединяются свободные нуклеотиды из нуклеоплазмы, где они присутствуют в виде дезоксирибонуклеозидгрифосфатов: дАТФ, дГТФ, дЦТФ, дТТФ. Комплементарный нуклеозидтрифосфат образует водородные связи с определенным основанием материнской цепи ДНК. Затем при участии фермента ДНК-полимеразы он связывается фосфодиэфирной связью с предшествующим нуклеотидом вновь синтезируемой цепи, отдавая при этом неорганический пирофосфат (рис. 3.10).
Поскольку ДНК-полимераза присоединяет очередной нуклеотид к ОН-группе в 3'-положении предшествующего нуклеотида, цепь постепенно удлиняется на ее 3'-конце.
Особенностью ДНК-полимеразы является ее неспособность начать синтез новой полинуклеотидной цепи путем простого связывания двух нуклеозидтрифосфатов: необходим 3'-ОН-конец какой-либо полинуклеотидной цепи, спаренной с матричной цепью ДНК, к которой ДНК-полимераза может лишь добавлять новые нуклеотиды. Такую полинук-леотиднуй цепь называют затравкой
или праймером.
Роль затравки для синтеза полинуклеотидных цепей ДНК в ходе репликации выполняют короткие последовательности РНК, образуемые при участии фермента РНК-праймазы (рис. 3.11). Указанная особенность ДНК-полимеразы означает, что матрицей при репликации может служить лишь цепь ДНК, несущая спаренную с ней затравку, которая имеет свободный 3'-ОН-конец.
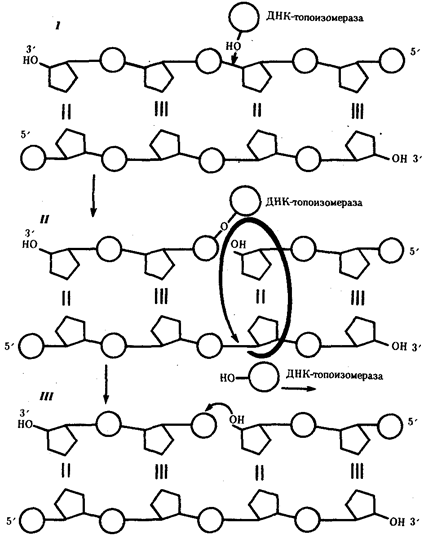
Рис. 3.9. Разрыв одной из цепей ДНК
с помощью фермента ДНК-топоизомеразы:
I
— ДНК-топоизомераза образует ковалентаую связь с одной из фосфатных групп ДНК (верхняя цепь); II —
в
результате разрыва фосфодиэфирной связи в одной полинуклеотидной цепи вокруг соответствующей ей связи другой цепи осуществляется вращение, которое снимает напряжение, вызванное расхождением двух цепей ДНК в области репликационной вилки; III —
после снятия напряжения в спирали ДНК происходит спонтанное отделение ДНК-топоизомеразы и восстановление фосфодиэфирной связи в цепи ДНК
Способность ДНК-полимеразы осуществлять сборку полинуклеотида в направлении от 5'- к 3' -концу при антипараллельном соединении двух цепей ДНК означает, что процесс репликации должен протекать на них по-разному. Действительно, если на одной из матриц (3' → 5') сборка новой цепи происходит непрерывно от 5'- к 3'-концу и она постепенно удлиняется на 3'-конце, то другая цепь, синтезируемая на матрице (5' → 3'), должна была бы расти от 3'- к 5'-концу. Это противоречит направлению действия фермента ДНК-полимеразы.
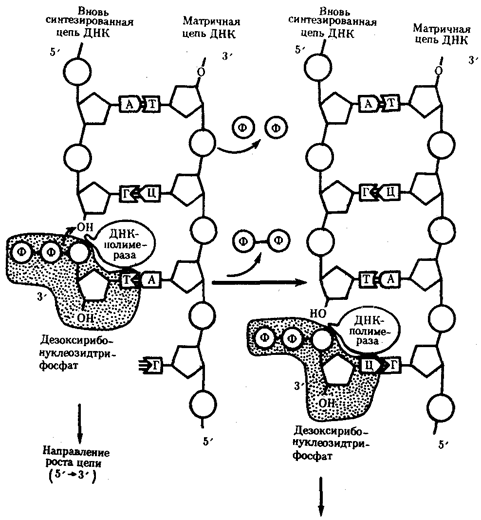
Рис. 3.10. Присоединение очередного нуклеотида к дочерней цепи ДНК, синтезируемой при участии ДНК-полимеразы:
ФФ—пирофосфат
В настоящее время установлено, что синтез второй цепи ДНК осуществляется короткими фрагментами (фрагменты Оказаки
) также в направлении от 5'- к 3'-концу (по типу шитья «назад иголкой»). У прокариот фрагменты Оказаки содержат от 1000 до 2000 нуклеотидов, у эукариот они значительно короче (от 100 до 200 нуклеотидов). Синтезу каждого такого фрагмента предшествует образование РНК-затравки длиной около 10 нуклеотидов. Вновь образованный фрагмент с помощью фермента ДНК-лигазы соединяется с предшествующим фрагментом после удаления его РНК-затравки (рис. 3.12, А
).
В связи с указанными особенностями репликационная вилка является асимметричной. Из двух синтезируемых дочерних цепей одна строится непрерывно, ее синтез идет быстрее и эту цепь называют лидирующей.
Синтез другой цепи идет медленнее, так как она собирается из отдельных фрагментов,требующих образования, а затем удаления РНК-затравки. Поэтому такую цепь называют запаздывающей
(отстающей
).
Хотя отдельные фрагменты образуются в направлении 5' → 3', в целом эта цепь растет в направлении 3' → 5' (рис. 3.12, А
).
В виду того, что от локуса ori
как правило начинаются две репликационные вилки, идущие в противоположных направлениях, синтез лидирующих цепей в них идет на разных цепях материнской ДНК (рис 3.12, Б
).
Конечным результатом процесса репликации является образование двух молекул ДНК, нуклеотидная последовательность которых идентична таковой в материнской двойной спирали ДНК.
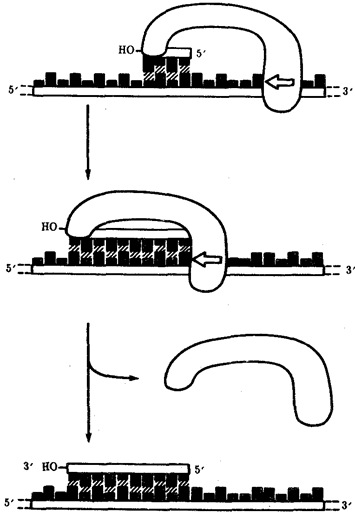
Рис. 3.11. Схема реакции синтеза короткой РНК-затравки,
катализируемой РНК-праймазой
Рассмотренная последовательность событий, происходящих в ходе репликативного синтеза, предполагает участие целой системы ферментов: геликазы, топоизомеразы, дестабилизирующих белков, ДНК-полимеразы и других, совместно действующих в области репликационной вилки (рис 3.13).
Репликация ДНК у про- и эукариот в основных чертах протекает сходно, однако, скорость синтеза у эукариот (около 100 нуклеотидов/с) на порядок ниже, чем у прокариот (1000 нуклеотидов/с). Причиной этого может быть образование ДНК эукариот достаточно прочных соединений с белками (см. гл 3.5.2. ), что затрудняет ее деспирали-зацию, необходимую для осуществления репликативного синтеза.
Фрагмент ДНК от точки начала репликации до точки ее окончания образует единицу репликации — репликон.
Однажды начавшись в точке начала (локус on
),
репликация продолжается до тех пор, пока весь репликон не будет дуплицирован. Кольцевые молекулы ДНК прокариотических клеток имеют один локус on
и представляют собой целиком отдельные репликоны. Эукариотические хромосомы содержат большое число репликонов. В связи с этим удвоение молекулы ДНК, расположенной вдоль эукариотической хромосомы, начинается в нескольких точках. В разных репликонах удвоение может идти в разное время или одновременно.

Рис. 3.12. Синтез двух дочерних цепей ДНК
на разных цепях материнской молекулы
А. В связи с антипараллельностью цепей ДНК синтез дочерних цепей идет по-разному, на верхней материнской цепи дочерняя цель синтезируется непрерывно—лидирующая цепь, на нижней материнской цепи дочерняя цепь собирается из фрагментов Оказаки —отстающая цепь
Б. Синтез лидирующих цепей в раэнонаправленных вилках происходит на разных цепях материнской ДНК
Для поддержания главных характеристик клетки или организма на протяжении их жизни, а также в ряду поколений наследственный материал должен отличаться устойчивостью к внешним воздействиям или должны существовать механизмы коррекции возникающих в нем изменений. В живой природе используются оба фактора. Третьим фактором является точность копирования нуклеотидных последовательностей материнской ДНК в процессе ее репликации.

Рис. 3. 13. Белки, участвующие в процессе репликации ДНК
ДНК-геликаза расплетает двойную спираль ДНК, разделяя ее полинуклеотидные цепи; дестабилизирующие белки выпрямляют участок цепи ДНК; ДНК-топоизомераза разрывает фосфодиэфирную связь в одной из полинуглеотидных цепей ДНК, снимая напряжение, вызываемое расплетенисм спирали и расхождением цепей в репликационной вилке; РНК-праймаза синтезирует РНК-затравки для дочерней цепи и для каждого фрагмента Оказаки; ДНК-полимераза осуществляет непрерывный синтез лидирующей цепи и синтез фрагментов Оказаки отстающей цепи; ДНК-лигаза сшивает фрагменты Оказаки после удаления РНК-затравки
По реакционной способности молекулы ДНК относятся к категории химически инертных веществ. Известно, что роль вещества наследственности может выполнять не только ДНК, но и РНК (некоторые вирусы). Считают, что выбор в пользу ДНК обусловлен ее более низкой по сравнению с РНК реакционной способностью.
Рассмотренный выше механизм репликации отличается чрезвычайно высокой точностью воспроизведения структуры ДНК. При удвоении ДНК ошибки возникают в среднем с частотой 1·10-6
комплементарных пар оснований.
В поддержании высокой точности репликации важная роль принадлежит прежде всего ферменту ДНК-полимеразе. Этот фермент осуществляет отбор необходимых нуклеотидов из числа имеющихся в ядерном соке нуклеозидтрифосфатов (АТФ, ТТФ, ГТФ, ЦТФ), точное присоединение их к матричной цепи ДНК и включение в растущую дочернюю цепь (см. рис. 3.10). Частота включения неправильных нуклеотидов на этой стадии составляет 1·10-5
пар оснований.
Такие ошибки в работе ДНК-полимеразы связаны с возникновением измененных форм азотистых оснований, которые образуют «незаконные» пары с основаниями материнской цепи. Например, измененная форма цитозина вместо гуанина связывается водородными связями с аденином. В результате в растущую цепь ДНК включается ошибочный нуклеотид. Быстрый переход измененной формы такого основания в обычную нарушает его связывание с матрицей, появляется неспаренный 3'-ОН-конец растущей цепи ДНК. В этой ситуации включается механизм самокоррекции
, осуществляемый ДНК-полимеразой (или тесно связанным с ней ферментом — редактирующей эндонуклеазой). Самокоррекция заключается в отщеплении ошибочно включенного в цепь ДНК нуклеотида, не спаренного с матрицей (рис. 3.14). Следствием самокоррекции является снижение частоты ошибок в 10 раз (с 10-5
до 10-6
).
Несмотря на эффективность самокоррекции, в ходе репликации после удвоения ДНК в ней обнаруживаются ошибки. Особенно часто это наблюдается при нарушении концентрации четырех нуклеозидтрифосфатов в окружающем субстрате. Значительная часть изменений возникает также в молекулах ДНК в результате спонтанно происходящих процессов, связанных с потерей пуриновых оснований — аденина и гуанина (апуринизацией) — или дезаминированием цитозина, который превращается в урацил. Частота последних изменений достигает 100 на 1 геном/сут.
Содержащиеся в ДНК основания могут изменяться под влиянием реакционноспособных соединений, нарушающих их нормальное спаривание, а также под действием ультрафиолетового излучения, которое может вызвать образование ковалентной связи между двумя соседними остатками тимина в ДНК (димеры тимина). Названные изменения в очередном цикле репликации должны привести либо к выпадению пар оснований в дочерней ДНК, либо к замене одних пар другими. Указанные изменения действительно сопровождают каждый цикл репликации ДНК, однако их частота значительно меньше, чем должна была бы быть. Это объясняется тем, что большинство изменений такого рода устраняется благодаря действию механизма репарации
(молекулярного восстановления) исходной нуклеотидной последовательности ДНК.
Механизм репарации основан на наличии в молекуле ДНК двух комплементарных цепей. Искажение последовательности нуклеотидов в одной из них обнаруживается специфическими ферментами. Затем соответствующий участок удаляется и замещается новым, синтезированным на второй комплементарной цепи ДНК. Такую репарацию называют эксцизионной,
т.е. с «вырезанием» (рис. 3.15). Она осуществляется до очередного цикла репликации, поэтому ее называют также дорепликативной
.
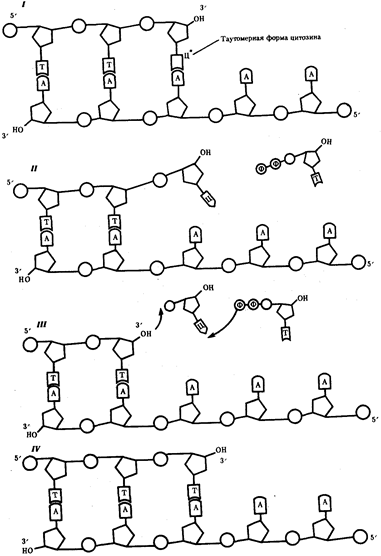
Рис. 3.14. Схема процесса коррекции при синтезе ДНК:
I
—включение в цепь ДНК нуклеотида с измененной (таутомерной) формой цитоэина, который «незаконно» спаривается с аденином; II
— быстрый переход цитозина в обычную форму нарушает его спаривание с аденином; неспаренный 3'—ОН-конец синтезируемой цепи препятствует дальнейшему ее удлинению под действием ДНК-полимеразы; III —
ДНК-полимераза удаляет незаконный нуклеотид, в результате чего вновь появляется спаренный с матрицей 3 '—
ОН-конец; IV
— ДНК-полимераза продолжает наращивание цепи на 3'—ОН-конце
Восстановление исходной структуры ДНК требует участия ряда ферментов. Важным моментом в запуске механизма репарации является обнаружение ошибки в структуре ДНК. Нередко такие ошибки возникают во вновь синтезированной цепи в процессе репликации. Ферменты репарации должны обнаружить именно эту цепь. У многих видов живых организмов вновь синтезированная цепь ДНК отличается от материнской степенью метилирования ее азотистых оснований, которое отстает от синтеза. Репарации при этом подвергается неметилированная цепь. Объектом узнавания ферментами репарации могут также служить разрывы в цепи ДНК. У высших организмов, где синтез ДНК происходит не непрерывно, а отдельными репликонами, вновь синтезируемая цепь ДНК имеет разрывы, что делает возможным ее узнавание.
Восстановление структуры ДНК при утрате пуриновых оснований одной из ее цепей предполагает обнаружение дефекта с помощью фермента эндонуклеазы, которая разрывает фосфоэфирную связь в месте повреждения цепи. Затем измененный участок с несколькими примыкающими к нему нуклеотидами удаляется ферментом экзонуклеазой, а на его месте в соответствии с порядком оснований комплементарной цепи образуется правильная нуклеотидная последовательность (рис. 3.15).
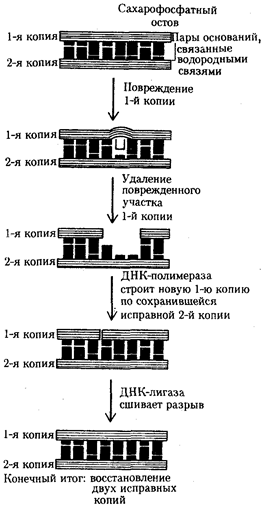
Рис. 3.15. Схема эксцизионной, дорепликативной репарации ДНК
При изменении одного из оснований в цепи ДНК в восстановлении исходной структуры принимают участие ферменты ДНК-гликозилазы числом около 20. Они специфически узнают повреждения, обусловленные дезаминированием, алкилированием и другими структурными преобразованиями оснований. Такие модифицированные основания удаляются. Возникают участки, лишенные оснований, которые репарируются, как при утрате пуринов. Если восстановление нормальной структуры не осуществляется, например в случае дезаминирования азотистых оснований, происходит замена одних пар комплементарных оснований другими —пара Ц—Г может заменяться парой Т—А и т.п. (см. разд. 3.4.2.3).
Образование в полинуклеотидных цепях под действием УФ-лучей тиминовых димеров (Т—Т) требует участия ферментов, узнающих не отдельные измененные основания, а более протяженные повреждения структуры ДНК. Репаративный процесс в этом случае также связан с удалением участка, несущего димер, и восстановлением нормальной последовательности нуклеотидов путем синтеза на комплементарной цепи ДНК.
В том случае, когда система эксцизионной репарации не исправляет изменения, возникшего в одной цепи ДНК, в ходе репликации происходит фиксация этого изменения и оно становится достоянием обеих цепей ДНК. Это приводит к замене одной пары комплементарных нуклеотидов на другую либо к появлению разрывов (брешей) во вновь синтезированной цепи против измененных участков. Восстановление нормальной структуры ДНК при этом может произойти и после репликации.
Пострепликативная репарация
осуществляется путем рекомбинации (обмена фрагментами) между двумя вновь образованными двойными спиралями ДНК. Примером такой пострепликативной репарации может служить восстановление нормальной структуры ДНК при возникновении тиминовых димеров (Т—Т), когда они не устраняются самопроизвольно под действием видимого света (световая репарация
) или в ходе дорепликативной эксцизионной репарации.
Ковалентные связи, возникающие между рядом стоящими остатками тимина, делают их не способными к связыванию с комплементарными нуклеотидами. В результате во вновь синтезируемой цепи ДНК появляются разрывы (бреши), узнаваемые ферментами репарации. Восстановление целостности новой полинуклеотидной цепи одной из дочерних ДНК осуществляется благодаря рекомбинации с соответствующей ей нормальной материнской цепью другой дочерней ДНК. Образовавшийся в материнской цепи пробел заполняется затем путем синтеза на комплементарной ей полинуклеотидной цепи (рис. 3.16). Проявлением такой пострепликативной репарации, осуществляемой путем рекомбинации между цепями двух дочерних молекул ДНК, можно считать нередко наблюдаемый обмен материалом между сестринскими хроматидами (рис. 3.17).
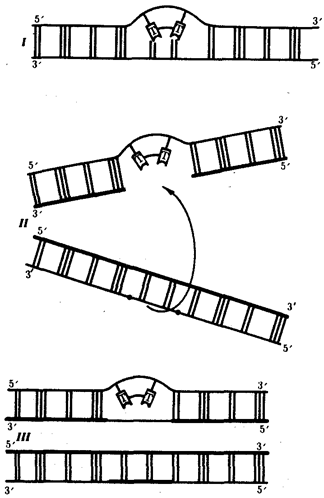
Рис. 3.16. Схема пострепликативной репарации ДНК:
I
— возникновение тиминового димера в одной из цепей ДНК;
II
— образование «бреши» во вновь синтезируемой цепи против измененного участка материнской молекулы после репликации (стрелкой показано последующее заполнение «бреши» участком из соответствующей цепи второй дочерней молекулы ДНК);
III
— восстановление целостности дочерней цепи верхней молекулы за счет рекомбинации и в нижней молекуле за счет синтеза на комплементарной цепи

Рис. 3.17. Межхроматидные обмены (указаны стрелками)
В ходе дорепликативной и пострепликативной репарации восстанавливается большая часть повреждений структуры ДНК. Однако, если в наследственном материале клетки возникает слишком много повреждений и часть из них не ликвидируется, включается система индуцируемых (побуждаемых) ферментов репарации (SOS-система). Эти ферменты заполняют бреши, восстанавливая целостность синтезируемых полинуклеотидных цепей без точного соблюдения принципа комплементарности. Вот почему иногда сами процессы репарации могут служить источником стойких изменений в структуре ДНК (мутаций). Названная реакция также относится к SOS-системе.
Если в клетке, несмотря на осуществляемую репарацию, количество повреждений структуры ДНК остается высоким, в ней блокируются процессы репликации ДНК. Такая клетка не делится, а значит, не передает возникших изменений потомству.
Вызываемая повреждениями ДНК остановка клеточного цикла в сочетании с невозможностью молекулярной репарации измененного наследственного материала может с участием белка, синтез которого контролируется геном р53, приводить к активации процесса самоликвидации (апотпоз) дефектной клетки с целью устранения ее из организма.
Таким образом, обширный набор различных ферментов репарации осуществляет непрерывный «осмотр» ДНК, удаляя из нее поврежденные участки и способствуя поддержанию стабильности наследственного материала. Совместное действие ферментов репликации (ДНК-полимераза и редактирующая эндонуклеаза) и ферментов репарации обеспечивает достаточно низкую частоту ошибок в молекулах ДНК, которая поддерживается на уровне 1 · 10-9
пар измененных нуклеотидов на геном. При размере генома человека 3 · 109
нуклеотидных пар это означает появление около 3 ошибок на реплицирующийся геном. Вместе с тем даже этот уровень достаточен для образования за время существования жизни на Земле значительного генетического разнообразия в виде генных мутаций.
Нескорректированные изменения химической структуры генов, воспроизводимые в последовательных циклах репликации и проявляющиеся у потомства в виде новых вариантов признаков, называют генными мутациями.
Изменения структуры ДНК, образующей ген, можно разделить на три группы. Мутации первой группы заключаются в замене одних оснований другими. Они составляют около 20% спонтанно возникающих генных изменений. Вторая группа мутаций обусловлена сдвигом рамки считывания, происходящим при изменении количества нуклеотидных пар в составе гена. Наконец, третью группу представляют мутации, связанные с изменением порядка нуклеотидных последовательностей в пределах гена (инверсии).
Мутации по типу замены азотистых оснований.
Эти мутации происходят в силу ряда конкретных причин. Одной из них может быть возникающее случайно или под влиянием конкретных химических агентов изменение структуры основания, уже включенного в спираль ДНК. Если такая измененная форма основания остается не замеченной ферментами репарации, то при ближайшем цикле репликации она может присоединять к себе другой нуклеотид. Примером может служить дезаминирование цитозина, превращающегося в урацил самопроизвольно или под влиянием азотистой кислоты (рис. 3.18). Образующийся при этом урацил, не замеченный ферментом ДНК-гликозилазой, при репликации соединяется с аденином, который впоследствии присоединяет тимидиловый нуклеотид. В результате пара Ц—Г замещается в ДНК парой Т—А (рис. 3.19, I
). Дезаминирование метилированного цитозина превращает его в тимин (см. рис. 3.18). Тимидиловый нуклеотид, являясь естественным компонентом ДНК, не обнаруживается ферментами репарации как изменение и при следующей репликации присоединяет адениловый нуклеотид. В результате вместо пары Ц—Г в молекуле ДНК также появляется пара Т—А (рис. 3.19, II
).
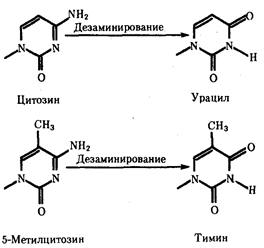
Рис. 3.18. Спонтанное дезаминирование цитозина
Другой причиной замены оснований может быть ошибочное включение в синтезируемую цепь ДНК нуклеотида, несущего химически измененную форму основания или его аналог. Если эта ошибка остается не замеченной ферментами репликации и репарации, измененное основание включается в процесс репликации, что нередко приводит к замене одной пары на другую. Примером этого может служить присоединение в ходе репликации к аденину материнской цепи нуклеотида с 5-бромурацилом (5-БУ), аналогичного тимидиловому нуклеотиду. При последующей репликации 5-БУ охотнее присоединяет к себе не аденин, а гуанин. Гуанин в ходе дальнейшего удвоения образует комплементарную пару с цитозином. В итоге пара А—Т заменяется в молекуле ДНК парой Г—Ц (рис. 3.20).

Рис. 3. 19. Мутации по типу замены основания
(дезаминирование азотистых оснований в цепи ДНК):
I
— превращение цитозина в урацил, замена Ц—Г-пары на Т—А-пару;
II —
превращение метил-
цитозина в тимин, замена Ц—Г-пары на Т—А-пару
Из приведенных примеров видно, что изменения структуры молекулы ДНК по типу замены оснований возникают либо до, либо в процессе репликации первоначально в одной полинуклеотидной цепи. Если такие изменения не исправляются в ходе репарации, то при последующей репликации они становятся достоянием обеих цепей ДНК.
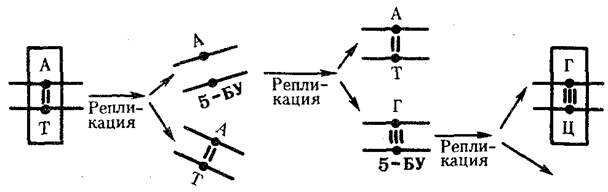
Рис. 3.20. Мутации по типу замены оснований
(включение аналога азотистого основания при репликации ДНК)
Следствием замены одной пары комплементарных нуклеотидов на другую является образование нового триплета в нуклеотидной последовательности ДНК, кодирующей последовательность аминокислот в пептидной цепи. Это может и не отразиться на структуре пептида в том случае, если новый триплет будет «синонимом» прежнего, т.е. будет кодировать ту же аминокислоту. Например, аминокислота валин шифруется четырьмя триплетами: ЦАА, ЦАГ, ЦАТ, ЦАЦ. Замена третьего основания в любом из этих триплетов не изменит его смысла (вырожденность генетического кода).
В том случае, когда вновь возникший триплет шифрует другую аминокислоту, изменяются структура пептидной цепи и свойства соответствующего белка. В зависимости от характера и места случившейся замены специфические свойства белка изменяются в разной степени. Известны случаи, когда замена лишь одной аминокислоты в пептиде существенно влияет на свойства белка, что проявляется в изменении более сложных признаков. Примером может служить изменение свойств гемоглобина человека при серповидно-клеточной анемии (рис. 3.21). В таком гемоглобине—(HbS) (в отличие от нормального НbА) — в р-глобиновых цепях в шестом положении глутаминовая кислота заменена валином. Это является следствием замены одного из оснований в триплете, шифрующем глутаминовую кислоту (ЦТТ или ЦТЦ). В результате появляется триплет, шифрующий валин (ЦАТ или ЦАЦ). В данном случае замена одной аминокислоты в пептиде существенно изменяет свойства глобина, входящего в состав гемоглобина (снижается его способность связываться с 02), у человека развиваются признаки серповидно-клеточной анемии.
В некоторых случаях замена одного основания на другое может привести к появлению одного из нонсенс-триплетов (АТТ, АТЦ, АЦТ), не шифрующего никакой аминокислоты. Последствием такой замены будет прерывание синтеза пептидной цепи. Подсчитано, что замены нуклеотидов в одном триплете приводят в 25% случаев к образованию триплетов-синонимов; в 2—3 —бессмысленных триплетов, в 70— 75% —к возникновению истинных генных мутаций.
Таким образом, мутации по типу замены оснований могут возникать как в результате спонтанных изменений структуры основания в одной из цепей уже существующей двойной спирали ДНК, так и в ходе репликации во вновь синтезируемой цепи. В том случае, если эти изменения не исправляются в процессе репарации (или, наоборот, возникают в ходе репарации), они фиксируются в обеих цепях и далее будут воспроизводиться в следующих циклах репликации. Следовательно, важным источником возникновения таких мутаций являются нарушения процессов репликации и репарации.
Мутации со сдвигом рамки считывания.
Этот тип мутаций составляет значительную долю спонтанных мутаций. Они происходят вследствие выпадения или вставки в нуклеотидную последовательность ДНК одной или нескольких пар комплементарных нуклеотидов. Большая часть изученных мутаций, вызывающих сдвиг рамки, обнаружена в последовательностях, состоящих из одинаковых нуклеотидов.
Изменению числа нуклеотидных пар в цепи ДНК способствуют воздействия на генетический материал некоторых химических веществ, например акридиновых соединений. Деформируя структуру двойной спирали ДНК, они приводят к вставке дополнительных оснований или их выпадению при репликации. Примером служат мутации, полученные у фага Т4 при воздействии профлавина. Они состоят во включении или удалении всего одной нуклеотидной пары. Важной причиной изменения количества нуклеотидных пар в гене по типу крупных делений (выпадений) может быть рентгеновское облучение. У плодовой мухи, например, известна мутация гена, контролирующего окраску глаза, которая вызывается облучением и состоит в делении порядка 100 нуклеотидных пар.
Рис. 3.21. Плейотропный эффект замены одной аминокислоты в β-цепи гемоглобина человека, приводящей к развитию серповидно-клеточной анемии
Большое число мутаций по типу вставок происходит вследствие включения в последовательность нуклеотидов подвижных генетических элементов — транспозонов. Транспозоны
—
это достаточно протяженные нуклеотидные последовательности, встроенные в геномы эу- и прокариотических клеток, способные самопроизвольно менять свое положение (см. разд. 3.6.4.3). С определенной вероятностью вставки и делении могут возникать в результате ошибок рекомбинации при неравноценном внутригенном кроссинговере (рис. 3.22).
Рис. 3.22. Мутации со сдвигом рамки считывания (неравноценный обмен при внутригенном кроссинговере):
I
— разрывы аллельпых генов в разных участках и обмен фрагментами между ними;
II
— выпадение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания;
III
—удвоение 3-й и 4-й пар нуклеотидов, сдвиг рамки считывания
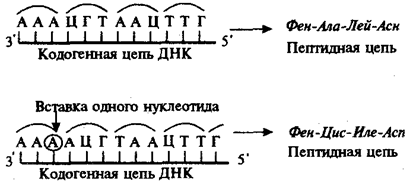
Рис. 3.23. Следствие изменения количества нуклеотидных пар в молекуле ДНК
Сдвиг рамки считывания в результате вставки одного нуклеотида в кодогенную цепь приводит к изменению состава зашифрованного в ней пептида
При непрерывности считывания и неперекрываемости генетического кода изменение количества нуклеотидов, как правило, приводит к сдвигу рамки считывания и изменению смысла биологической информации, записанной в данной последовательности ДНК (рис. 3.23). Однако, если количество вставленных или утраченных нуклеотидов кратно трем, сдвига рамки может не произойти, но это приведет к включению дополнительных аминокислот или выпадению части их из полипептидной цепи. Возможным следствием сдвига рамки является возникновение нонсенс-триплетов, ведущее к синтезу укороченных пептидных цепей.
Мутации по типу инверсии нуклеотидных последовательностей в гене.
Данный тип мутаций происходит вследствие поворота участка ДНК на 180°. Обычно этому предшествует образование молекулой ДНК петли, в пределах которой репликация идет в направлении, обратном правильному.
В пределах инвертированного участка нарушается считывание информации, в результате изменяется аминокислотная последовательность белка.
Ген представляет собой элементарную единицу функции наследственного материала.
Это означает, что фрагмент молекулы ДНК, соответствующий отдельному гену и определяющий благодаря содержащейся в нем биологической информации возможность развития конкретного признака, является далее неделимым в функциональном отношении. Сведения о генных мутациях, изложенные выше, указывают на значение изменений химической структуры, затрагивающих не весь ген, а отдельные его участки, вследствие чего появляются новые варианты признака.
Минимальное количество наследственного материала, способное, изменяясь, приводить к появлению вариантов признака, соответствует элементарной единице мутационного процесса и называется мутоном.
Рассмотренные выше примеры генных мутаций свидетельствуют о том, что достаточно заменить одну пару комплементарных оснований в гене, чтобы изменились свойства кодируемого им белка. Таким образом, мутон соответствует одной паре комплементарных нуклеотидов.
Часть генных мутаций по типу вставок и выпадений нуклеотидных пар происходит вследствие неравноценного обмена между молекулами ДНК при кроссинговере, т.е. при нарушении рекомбинации между ними. Это сопровождается сдвигом рамки считывания и приводит к нарушению синтеза пептидной цепи с заданными свойствами. Наблюдения показывают, что для искажения записанной в гене биологической информации достаточно вставки или выпадения одной пары нуклеотидов. Из сказанного следует, что элементарная единица рекомбинации — рекон —
на молекулярном уровне соответствует одной паре нуклеотидов.
Возникающие самопроизвольно или под влиянием различных внешних воздействий изменения нуклеотидных последовательностей приводят к тому, что один и тот же ген может существовать в нескольких вариантах, различающихся по содержащейся в них биологической информации. Конкретную форму существования гена, определяющую возможность развития конкретного варианта данного признака, называют аллелем.
Аллели гена располагаются в одном и том же участке—локусе—
определенной хромосомы, которая в норме может одновременно содержать лишь один из серии аллелей. Это делает аллели альтернативными (взаимоисключающими) вариантами существования гена.
Изменения химической структуры могут возникать в различных участках гена. Если они совместимы с жизнью, т.е. не приводят к гибели клеток или организмов — носителей данных мутаций, все они сохраняются в генофонде вида.
Присутствие в генофонде вида одновременно различных аллелей гена называют множественным аллелизмом.
Примером этому служат разные варианты окраски глаз у плодовой мухи: белая, вишневая, красная, абрикосовая, эозиновая,— обусловленные различными аллелями соответствующего гена. У человека, как и у других представителей органического мира, множественный аллелизм свойствен многим генам. Так, три аллеля гена I определяют групповую принадлежность крови по системе АВ0 (IA
, IB
, I0
). Два аллеля имеет ген, обусловливающий резус-принадлежность. Более ста аллелей насчитывают гены α- и β-полипептидов гемоглобина.
Причиной множественного аллелизма являются случайные изменения структуры гена (мутации), сохраняемые в процессе естественного отбора в генофонде популяции. Многообразие аллелей, рекомбинирующихся при половом размножении, определяет степень генотипического разнообразия среди представителей данного вида, что имеет большое эволюционное значение, повышая жизнеспособность популяций в меняющихся условиях их существования. Кроме эволюционного и экологического значения аллельное состояние генов оказывает большое влияние на функционирование генетического материала. В диплоидных соматических клетках эукариотических организмов большинство генов представлено двумя аллелями, которые совместно влияют на формирование признаков.
Изменения структуры гена, как правило, являются неблагоприятными, снижая жизнеспособность клетки, организма (вредные мутации
),
и иногда приводят к их гибели (летальные мутации
).
Реже возникающие мутации существенно не отражаются на жизнеспособности их носителей, поэтому их рассматривают как нейтральные.
Наконец, крайне редко возникают аллели, оказывающие благоприятное действие (полезные мутации
),
обеспечивая их носителям преимущественное выживание. В большинстве случаев вновь возникший аллель гена выступает как рецессивный по отношению к распространенному в природе аллелю «дикого» типа, т.е. не проявляется в сочетании с ним. Но иногда мутантная форма гена может быть доминантной, т.е. подавлять проявление «дикого» аллеля, который чаще встречается в генофонде популяции.
В результате генных мутаций изменяется смысл биологической информации. Последствия этого могут быть двоякого рода. В условиях обитания, изменяющихся незначительно, новая информация обычно снижает выживаемость. При резкой смене условий существования, при освоении новой экологической ниши наличие разнообразной информации полезно. В связи с этим интенсивность мутационного процесса в природных условиях поддерживается на уровне, не вызывающем катастрофического снижения жизнеспособности вида. Важная роль в ограничении неблагоприятных последствий мутаций принадлежит антимутационным механизмам,
возникшим в эволюции.
Некоторые из этих механизмов рассмотрены выше. Речь идет об особенностях функционирования ДНК-полимеразы, отбирающей требуемые нуклеотиды в процессе репликации ДНК, а также осуществляющей самокоррекцию
при образовании новой цепи ДНК наряду с редактирующей эндонуклеазой. Подробно разобраны различные механизмы репарации структуры ДНК, роль вырожденности
генетического кода (см. разд. 3.4.3.2). Решением этой задачи служит триплетность биологического кода, которая допускает минимальное число замен внутри триплета, ведущих к искажению информации. Так, 64% замен третьего нуклеотида в триплетах не дает изменения их смыслового значения. Правда, замены второго нуклеотида в 100% приводят к искажению смысла триплета.
Фактором защиты против неблагоприятных последствий генных мутаций служит парность хромосом в диплоидном кариотипе
соматических клеток эукариот. Парность аллелей генов препятствует фенотипическому проявлению мутаций, если они имеют рецессивный характер.
Определенный вклад в снижение вредных последствий генных мутаций вносит явление экстракопирования генов,
кодирующих жизненно важные макромолекулы. Оно заключается в наличии в генотипе нескольких десятков, а иногда и сотен идентичных копий таких генов. Примером могут служить гены рРНК, тРНК, гистоновых белков, без которых жизнедеятельность любой клетки невозможна. При наличии экстракопий мутационное изменение в одном или даже нескольких одинаковых генах не ведет к катастрофическим для клетки последствиям. Копий, остающихся неизменными, вполне достаточно, чтобы обеспечить нормальное функционирование.
Существенное значение имеет также функциональная неравнозначность замен аминокислот
в полипептиде. Если новая и сменяемая аминокислоты сходны по физико-химическим свойствам, изменения третичной структуры и биологических свойств белка незначительны. Так, мутантные гемоглобины HbS и НЬС человека отличаются от нормального гемоглобина НЬА заменой в 6-м положении р-цепи глутаминовой кислоты соответственно на валин или лизин. Первая замена резко изменяет свойства гемоглобина и приводит к развитию тяжелого заболевания — серповидно-клеточной анемии. При второй замене свойства гемоглобина изменяются в гораздо меньшей степени. Причиной этих различий является то, что глутаминовая кислота и лизин проявляют сходные гидрофильные свойства, тогда как валин — это гидрофобная аминокислота.
Таким образом, перечисленные механизмы способствуют сохранению отобранных в ходе эволюции генов и одновременно накоплению в генофонде популяции различных их аллелей, формируя резерв наследственной изменчивости. Последний определяет высокую эволюционную пластичность популяции, т.е. способность выживать в разнообразных условиях.
Наследственная информация, записанная с помощью генетического кода, хранится в молекулах ДНК и размножается для того, чтобы обеспечить вновь образуемые клетки необходимыми «инструкциями» для их нормального развития и функционирования. Вместе с тем непосредственного участия в жизнеобеспечении клеток ДНК не принимает. Роль посредника, функцией которого является перевод наследственной информации, сохраняемой в ДНК, в рабочую форму, играют рибонуклеиновые кислоты — РНК.
В отличие от молекул ДНК рибонуклеиновые кислоты представлены одной полинуклеотидной цепью, которая состоит из четырех разновидностей нуклеотидов, содержащих сахар, рибозу, фосфат и одно из четырех азотистых оснований — аденин, гуанин, урацил или цитозин. РНК синтезируется на молекулах ДНК при помощи ферментов РНК-полимераз с соблюдением принципа комплементарности и антипараллельности, причем аденину ДНК в РНК комплементарен урацил. Все многообразие РНК, действующих в клетке, можно разделить на три основных вида: мРНК, тРНК, рРНК.
Матричная, или информационная, РНК (мРНК, или иРНК). Транскрипция.
Для того чтобы синтезировать белки с заданными свойствами, к месту их построения поступает «инструкция» о порядке включения аминокислот в пептидную цепь. Эта инструкция заключена в нуклеотидной последовательности матричных,
или информационных РНК
(мРНК, иРНК), синтезируемых на соответствующих участках ДНК. Процесс синтеза мРНК называют транскрипцией.
Синтез мРНК начинается с обнаружения РНК-полимеразой особого участка в молекуле ДНК, который указывает место начала транскрипции — промотора.
После присоединения к промотору РНК-полимераза раскручивает прилежащий виток спирали ДНК. Две цепи ДНК в этом месте расходятся, и на одной из них фермент осуществляет синтез мРНК. Сборка рибонуклеотидов в цепь происходит с соблюдением их комплементарности нуклеотидам ДНК, а также антипараллельно по отношению к матричной цепи ДНК. В связи с тем, что РНК-полимераза способна собирать полинуклеотид лишь от 5'-конца к 3'-концу, матрицей для транскрипции может служить только одна из двух цепей ДНК, а именно та, которая обращена к ферменту своим 3'-концом (3' → 5'). Такую цепь называют кодогенной
(рис. 3.24). Антипараллельность соединения двух полинуклеотидных цепей в молекуле ДНК позволяет РНК-полимеразе правильно выбрать матрицу для синтеза мРНК.
Продвигаясь вдоль кодогенной цепи ДНК, РНК-полимераза осуществляет постепенное точное переписывание информации до тех пор, пока она не встречает специфическую нуклеотидную последовательность — терминатор
транскрипции. В этом участке РНК-полимераза отделяется как от матрицы ДНК, так и от вновь синтезированной мРНК (рис. 3.25). Фрагмент молекулы ДНК, включающий промотор, транскрибируемую последовательность и терминатор, образует единицу транскрипции — транскриптон.
В процессе синтеза, по мере продвижения РНК-полимеразы вдоль молекулы ДНК, пройденные ею одноцепочечные участки ДНК вновь объединяются в двойную спираль. Образуемая в ходе транскрипции мРНК содержит точную копию информации, записанной в соответствующем участке ДНК. Тройки рядом стоящих нуклеотидов мРНК, шифрующие аминокислоты, называют кодонами.
Последовательность кодонов мРНК шифрует последовательность аминокислот в пептидной цепи. Кодонам мРНК соответствуют определенные аминокислоты (табл. 3.1).
Таблица 3.1. Генетический код мРНК (подчеркнуты кодоны-терминаторы)
Второй нуклеотид
| |
У
|
Ц
|
А
|
Г
|
|
| П
Е
Р
В
Ы
Й
Н
У
К
Л
Е
О
Т
И
Д
|
У
|
УУУ УУЦ
УУФ УУГ
|
Фен
Лей
|
УЦУ УЦЦ
УЦА УЦГ
|
Сер
|
УАУ УАЦ
УАА УАГ
|
Тир
|
УГУ УГЦ
УГА УГГ
|
Цис
Три
|
У
Ц
А
Г
|
Т
Р
Е
Т
И
Й
Н
У
К
Л
Е
О
Т
И
Д
|
| Ц
|
ЦУУ
ЦУЦ ЦУА
ЦУГ
|
Лей
|
ЦЦУ
ЦЦЦ
ЦЦА
ЦЦГ
|
Про
|
ЦАУ
ЦАЦ ЦАА
ЦАГ
|
Гис
Глн
|
ЦГУ
ЦГЦ
ЦГА
ЦГГ
|
Арг
|
У
Ц
А
Г
|
| А
|
АУУ
АУЦ
АУА
АУГ
|
Иле
Мет
|
АЦУ
АЦЦ
АЦА
АЦГ
|
Тре
|
ААУ
ААЦ
ААА
ААГ
|
Асн
Лиз
|
АГУ
АГЦ
АГА
АГГ
|
Сер
Арг
|
У
Ц
А
Г
|
| Г
|
ГУУ
ГУЦ ГУА
ГУГ
|
Вал
|
ГЦУ
ГЦЦ ГЦА
ГЦГ
|
Ала
|
ГАУ
ГАЦ ГАА
ГАГ
|
Лея
Глу
|
ГГУ
ГГЦ ГГА
ГГГ
|
Гли
|
У
Ц
А
Г
|
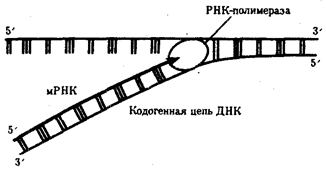
Рис. 3.24. Схема синтеза мРНК
Матрицей для транскрипции мРНК служит кодогенная цепь ДНК, обращенная к ферменту своим 3'-концом
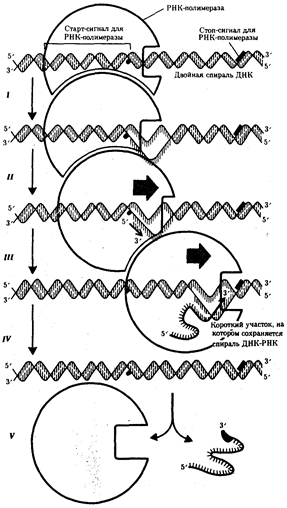
Рис. 3.25. Роль РНК-полимеразы в транскрипции:
I
— обнаружение промоторной области в молекуле ДНК и раскручивание спирали ДНК; II
— инициация синтеза цепи РНК путем связывания двух первых рибонуклеозидгрифосфатов; III —
наращивание цепи РНК в направлении 5' → 3' путем присоединения рибонуклеозидгрифосфатов; IV —
высвобождение 5'-конца синтезируемой РНК и восстановление двойной спирали ДНК; V
—
окончание синтеза РНК в области терминатора, отделение полимеразы от завершенной цепи РНК
Транспортная РНК (тРНК). Трансляция.
Важная роль в процессе использования наследственной информации клеткой принадлежит транспортной РНК
(тРНК). Доставляя необходимые аминокислоты к месту сборки пептидных цепей, тРНК выполняет функцию трансляционного посредника.
Молекулы тРНК представляют собой полинуклеотидные цепи, синтезируемые на определенных последовательностях ДНК. Они состоят из относительно небольшого числа нуклеотидов —75—95. В результате комплементарного соединения оснований, которые находятся в разных участках полинуклеотидной цепи тРНК, она приобретает структуру, напоминающую по форме лист клевера (рис. 3.26).
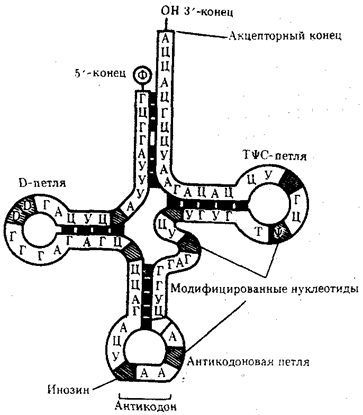
Рис. 3.26. Строение типичной молекулы тРНК
В ней выделяют четыре главные части, выполняющие различные функции. Акцепторный
«стебель» образуется двумя комплементарно соединенными концевыми частями тРНК. Он состоит из семи пар оснований. 3'-конец этого стебля несколько длиннее и формирует одноцепочечный участок, который заканчивается последовательностью ЦЦА со свободной ОН-группой. К этому концу присоединяется транспортируемая аминокислота. Остальные три ветви представляют собой комплементарно спаренные последовательности нуклеотидов, которые заканчиваются неспаренными участками, образующими петли. Средняя из этих ветвей — антикодоновая —
состоит из пяти пар нуклеотидов и содержит в центре своей петли антикодон.
Антикодон — это три нуклеотида, комплементарные кодону мРНК, который шифрует аминокислоту, транспортируемую данной тРНК к месту синтеза пептида.
Между акцепторной и антикодоновой ветвями располагаются две боковые ветви. В своих петлях они содержат модифицированные основания —дигидроуридин (D-петля) и триплет TψC, где \у —
псевдоуриаин (Т^С-петля). Между аитикодоновой и Т^С-ветвями содержится дополнительная петля, включающая от 3—5 до 13—21 нуклеотидов.
В целом различные виды тРНК характеризуются определенньм постоянством нуклеотидной последовательности, которая чаще всего состоит из 76 нуклеотидов. Варьирование их числа связано главным образом с изменением количества нуклеотидов в дополнительной петле. Комплементарные участки, поддерживающие структуру тРНК, как правило, консервативны. Первичная структура тРНК, определяемая последовательностью нуклеотидов, формирует вторичную структуру тРНК, имеющую форму листа клевера. В свою очередь, вторичная структура обусловливает трехмерную третичную структуру, для которой характерно образование двух перпендикулярно расположенных двойных спиралей (рис. 3.27). Одна из них образована акцепторной и ТψС-ветвями, другая —антикодоновой и D-ветвями.
На конце одной из двойных спиралей располагается транспортируемая аминокислота, на конце другой — антикодон. Эти участки оказываются максимально удаленными друг от друга. Стабильность третичной структуры тРНК поддерживается благодаря возникновению дополнительных водородных связей между основаниями полинуклеотидной цепи, находящимися в разных ее участках, но пространственно сближенных в третичной структуре.
Различные виды тРНК имеют сходную третичную структуру, хотя и с некоторыми вариациями.
Рис. 3.27. Пространственная организация тРНК:
I —
вторичная структура тРНК в виде «клеверного листа», определяемая ее первичной структурой (последовательностью нуклеотидов в цепи);
II —
двумерная проекция третичной структуры тРНК;
I
II
— схема укладки молекулы тРНК в пространстве
Одной из особенностей тРНК является наличие в ней необычных оснований, возникающих вследствие химической модификации уже после включения нормального основания в полинуклеотидную цепь. Эти измененные основания обусловливают большое структурное многообразие тРНК при общем плане их строения. Наибольший интерес представляют модификации оснований, формирующих антикодон, которые влияют на специфичность его взаимодействия с кодоном. Например, нетипичное основание инозин, иногда стоящий в 1-м положении антикодона тРНК, способен комплементарно соединяться с тремя разными третьими основаниями кодона мРНК — У, Ц и А (рис. 3.28). Так как одной из особенностей генетического кода является его вырожденность (см. разд. 3.4.1.2), многие аминокислоты шифруются несколькими кодонами, которые, как правило, различаются своим третьим основанием. Благодаря неспецифичности связывания модифицированного основания антикодона одна тРНК узнает несколько кодонов-синонимов.
Рис. 3.28. Соединение инозина водородными связями с тремя различными азотистыми основаниями Водородные связи обозначены точками
Установлено также существование нескольких видов тРНК, способных соединяться с одним и тем же кодоном. В результате в цитоплазме клеток встречается не 61 (по количеству кодонов), а около 40 различных молекул тРНК. Этого количества достаточно, чтобы транспортировать 20 разных аминокислот к месту сборки белка.
Наряду с функцией точного узнавания определенного кодона в мРНК молекула тРНК осуществляет доставку к месту синтеза пептидной цепи строго определенной аминокислоты, зашифрованной с помощью данного кодона. Специфическое соединение тРНК со «своей» аминокислотой протекает в два этапа и приводит к образованию соединения, называемого аминоацил-тРНК
(рис. 3.29).
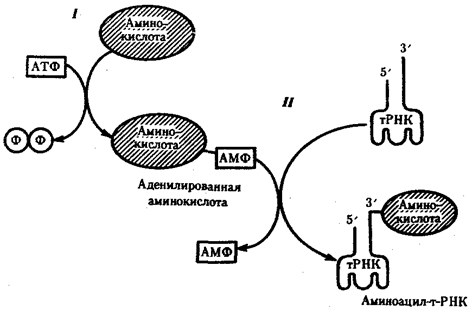
Рис. 3.29. Присоединение аминокислоты к соответствующей тРНК:
I
— 1-й этап, взаимодействие аминокислоты и АТФ с выделением пирофосфата;
II
— 2-й этап, присоединение аденилировашюй аминокислоты к 3'-концу РНК
На первом этапе аминокислота активируется, взаимодействуя своей карбоксильной группой с АТФ. В результате образуется адепилированная аминокислота.
На втором этапе это соединение взаимодействует с ОН-группой, находящейся на 3'-конце соответствующей тРНК, и аминокислота присоединяется к нему своей карбоксильной группой, высвобождая при этом АМФ. Таким образом, этот процесс протекает с затратой энергии, получаемой при гидролизе АТФ до АМФ.
Специфичность соединения аминокислоты и тРНК, несущей соответствующий антикодон, достигается благодаря свойствам фермента аминоацил-тРНК-синтетазы.
В цитоплазме существует целый набор таких ферментов, которые способны к пространственному узнаванию, с одной стороны, своей аминокислоты, а с другой — соответствующего ей антикодона тРНК (рис. 3.30).
Наследственная информация, «записанная» в молекулах ДНК и «переписанная» на мРНК, расшифровывается в ходе трансляции
благодаря двум процессам специфического узнавания молекулярных поверхностей. Сначала фермент аминоацил-тРНК-синтетаза обеспечивает соединение тРНК с транспортируемой ею аминокислотой. Затем аминоацил-тРНК комплементарно спаривается с мРНК благодаря взаимодействию антикодона с кодоном. С помощью системы тРНК язык нуклеотидной цепи мРНК. транслируется в язык аминокислотной последовательности пептида (рис. 3.30).
Рибосомная РНК (рРНК). Рибосомный цикл синтеза белка.
Процесс взаимодействия мРНК и тРНК, обеспечивающий трансляцию информации с языка нуклеотидов на язык аминокислот, осуществляется на рибосомах.
Последние представляют собой сложные комплексы рРНК и разнообразных белков, в которых первые образуют каркас. Рибосомные РНК являются не только структурным компонентом рибосом, но и обеспечивают связывание их с определенной нуклеотидной последовательностью мРНК. Этим устанавливаются начало и рамка считывания при образовании пептидной цепи. Кроме того, они обеспечивают взаимодействие рибосомы и тРНК. Многочисленные белки, входящие в состав рибосом наряду с рРНК, выполняют как структурную, так и ферментативную роль.

Рис. 3.30. Схема трансляции генетического кода:
I
— присоединение аминокислоты (триптофана) к соответствующей тРНК с помощью фермента аминоацил-тРНК-синтетазы; II
— присоединение тРНК, несущей свою аминокислоту, к мРНК благодаря связыванию ее антикодона с кодоном мРНК
Рибосомы про- и эукариот очень сходны по структуре и функциям. Они состоят из двух субчастиц: большой и малой. У эукариот малая субчастица образована одной молекулой рРНК и 33 молекулами разных белков. Большая субчастица объединяет три молекулы рРНК и около 40 белков. Прокариотические рибосомы и рибосомы митохондрий и пластид содержат меньше компонентов.
В рибосомах имеется две бороздки. Одна из них удерживает растущую полипептидную цепь, другая — мРНК. Кроме того, в рибосомах выделяют два участка, связывающих тРНК. В аминоацильном, А-участке размещается аминоацил-тРНК, несущая определенную аминокислоту. В пептидильном, П-участке располагается обычно тРНК, которая нагружена цепочкой аминокислот, соединенных пептидными связями. Образование А- и П-участков обеспечивается обеими субчастицами рибосомы.
В каждый момент рибосома экранирует сегмент мРНК протяженностью около 30 нуклеотидов. При этом обеспечивается взаимодействие только двух тРНК с двумя расположенными рядом кодонами мРНК (рис. 3.31).
Трансляция информации на «язык» аминокислот выражается в постепенном наращивании пептидной цепи в соответствии с инструкцией, заключенной в мРНК. Этот процесс протекает на рибосомах, которые обеспечивают последовательность расшифровки информации с помощью тРНК. В ходе трансляции можно выделить три фазы: инициацию, элонгацию и терминацию синтеза пептидной цепи.
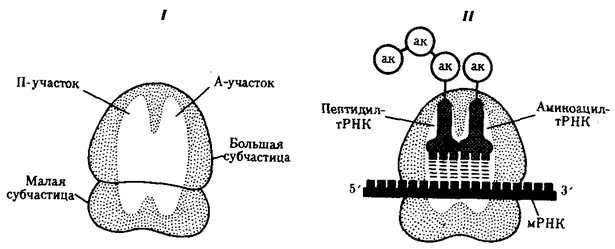
Рис. 3.31. Участки связывания молекул тРНК и рибосомы:
I
— ненагруженная рибосома, II
— нагруженная рибосома; ак — аминокислота
Фаза инициации,
или начало синтеза пептида, заключается в объединении двух находящихся до этого порознь в цитоплазме субчастиц рибосомы на определенном участке мРНК и присоединении к ней первой аминоацил-тРНК. Этим задается также рамка считывания информации, заключенной в мРНК (рис. 3.32).
В молекуле любой мРНК вблизи ее 5'-конца имеется участок, комплементарный рРНК малой субчастицы рибосомы и специфически узнаваемый ею. Рядом с ним располагается инициирующий стартовый кодон АУТ, шифрующий аминокислоту метионин. Малая субчастица рибосомы соединяется с мРНК таким образом, что стартовый кодон АУТ располагается в области, соответствующей П-участку. При этом только инициирующая тРНК, несущая метионин, способна занять место в недостроенном П-участке малой субчастицы и комплементарно соединиться со стартовым кодоном. После описанного события происходит объединение большой и малой субчастиц рибосомы с образованием ее пептидильного и аминоацильного участков (рис. 3.32).
Рис. 3.32. Инициация белкового синтеза:
I
— соединение малой субчаспщы рибосомы с мРНК, присоединение к стартовому кодону несущей метионин тРНК, которая располагается в недостроенном П-участке; II
— соединение большой и малой субчастиц рибосомы с образованием П- и А-участков; следующий этап связан с размещением в А-участке аминоацил-тРНК, соответствующей расположенному в нем кодону мРНК,—начало элонгации; ак — аминокислота
К концу фазы инициации П-участок занят аминоацил-тРНК, связанной с метионином, тогда как в А-участке рибосомы располагается следующий за стартовым кодон.
Описанные процессы инициации трансляции катализируются особыми белками —
факторами инициации,
которые подвижно связаны с малой субчастицей рибосомы. По завершении фазы инициации и образования комплекса рибосома — мРНК — инициирующая аминоацил-тРНК эти факторы отделяются от рибосомы.
Фаза элонгации,
или удлинения пептида, включает в себя все реакции от момента образования первой пептидной связи до присоединения последней аминокислоты. Она представляет собой циклически повторяющиеся события, при которых происходит специфическое узнавание аминоацил-тРНК очередного кодона, находящегося в А-участке, комплементарное взаимодействие между антикодоном и кодоном.
Благодаря особенностям трехмерной организации тРНК. (см. разд. 3.4.3.1) при соединении ее антикодона с кодоном мРНК. транспортируемая ею аминокислота располагается в А-участке, поблизости от ранее включенной аминокислоты, находящейся в П-участке. Между двумя аминокислотами образуется пептидная связь, катализуемая особыми белками, входящими в состав рибосомы. В результате предыдущая аминокислота теряет связь со своей тРНК и присоединяется к аминоацил-тРНК, расположенной в А-участке. Находящаяся в этот момент в П-участке тРНК высвобождается и уходит в цитоплазму (рис. 3.33).
Перемещение тРНК, нагруженной пептидной цепочкой, из А-участка в П-участок сопровождается продвижением рибосомы по мРНК на шаг, соответствующий одному кодону. Теперь следующий кодон приходит в контакт с А-участком, где он будет специфически «опознан» соответствующей аминоацил-тРНК, которая разместит здесь свою аминокислоту. Такая последовательность событий повторяется до тех пор, пока в А-участок рибосомы не поступит кодон-терминатор, для которого не существует соответствующей тРНК.
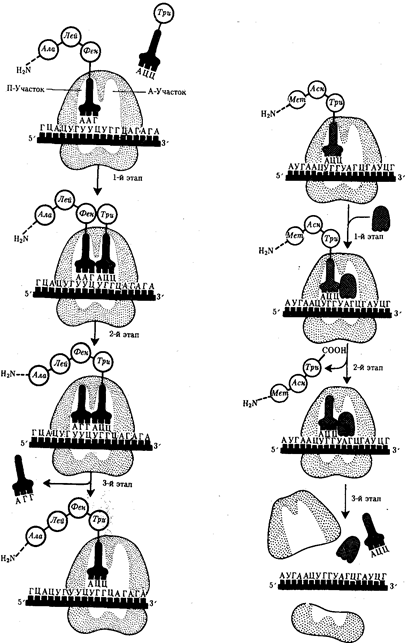
| Рис. 3.33. Фаза элонгации в синтезе белка:
1-й этап—аминоацил-тРНК присоединяется к кодону, расположенному в А-участке;
2-й этап — между аминокислотами, расположенными в А- и П-участках, образуется пептидиая связь: тРНК, расположенная в П-участке, освобождается от своей аминокислоты и покидает рибосому;
3-й этап —рибосома перемещается по мРНК на один кодон так, что тРНК, нагруженная пептидной цепочкой, переходит из А-участка в П-участок; свободный А-участок может быть занят соответствующей аминоацил-тРНК
|
Рис. 3.34. Терминация синтеза пептидной цепи:
1-й этап — присоединение фактора освобождения к стоп-кодону;
2-й этап — терминация, высвобождение завершенного пептида;
3-й этап —диссоциация рибосомы на две субчастицы
|
Сборка пептидной цепи осуществляется с достаточно большой скоростью, зависящей от температуры. У бактерий при 37 °С она выражается в добавлении к подипептиду от 12 до 17 аминокислот в 1 с. В эукариотических клетках эта скорость ниже и выражается в добавлении двух аминокислот в 1 с.
Фаза терминации,
или завершения синтеза полипептида, связана с узнаванием специфическим рибосомным белком одного из терминирующих кодонов (УАА, УАГ или У ГА), когда тот входит в зону А-участка рибосомы. При этом к последней аминокислоте в пептидной цепи присоединяется вода, и ее карбоксильный конец отделяется от тРНК. В результате завершенная пептидная цепь теряет связь с рибосомой, которая распадается на две субчастицы (рис. 3.34).
По химической организации материала наследственности и изменчивости эукариотические и прокариотические клетки принципиально не отличаются друг от друга. Генетический материал у них представлен ДНК. Общим для них является и принцип записи генетической информации, а также генетический код. Одни и те же аминокислоты шифруются у про- и эукариот одинаковыми кодонами. Принципиально одинаковым образом у названных типов клеток осуществляется и использование наследственной информации, хранящейся в ДНК. Сначала она транскрибируется в нуклеотидную последовательность молекулы мРНК, а затем транслируется в аминокислотную последовательность пептида на рибосомах с участием тРНК. Однако некоторые особенности организации наследственного материала, отличающие эукариотические клетки от прокариотических, обусловливают различия в использовании их генетической информации.
Наследственный материал прокариотической клетки содержится главным образом в единственной кольцевой молекуле ДНК. Она располагается непосредственно в цитоплазме клетки, где также находятся необходимые для экспрессии генов тРНК и ферменты, часть из которых заключена в рибосомах. Гены прокариот состоят целиком из кодирующих нуклеотидных последовательностей, реализующихся в ходе синтеза белков, тРНК или рРНК.
Наследственный материал эукариот больше по объему, чем у прокариот (см. разд. 3.6.3). Он расположен в основном в особых ядерных структурах —хромосомах
(см. разд. 3.5.2), которые отделены от цитоплазмы ядерной оболочкой. Необходимый для синтеза белков аппарат, состоящий из рибосом, тРНК, набора аминокислот и ферментов, находится в цитоплазме клетки.
Значительные отличия имеются в молекулярной организации генов эукариотической клетки. В большинстве из них кодирующие последовательности экзоны
прерываются интронными
участками, которые не используются при синтезе тРНК, рРНК или пептидов. Количество таких участков варьирует в разных генах. Установлено, что ген оваль-бумина кур включает 7 интронов, а ген проколлагена млекопитающих — 50. Эти участки удаляются из первично-транскрибируемой РНК, в связи с чем использование генетической информации в эукариотической клетке происходит несколько иначе. В прокариотической клетке, где наследственный материал и аппарат биосинтеза белка пространственно не разобщены, транскрипция и трансляция происходят почти одновременно. В эукариотической клетке эти два этапа не только пространственно отделены ядерной оболочкой, но и во времени их разделяют процессы созревания мРНК, из которой должны быть удалены неинформативные последовательности (рис. 3.35).
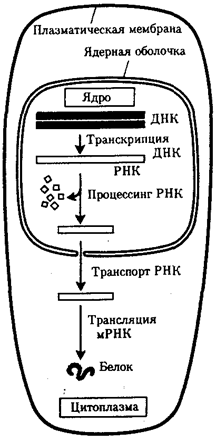
Рис. 3.35. Обобщенная схема процесса экспрессии генетической информации
в эукариотической клетке
Кроме указанных различий на каждом этапе экспрессии генетической информации можно отметить некоторые особенности течения этих процессов у про- и эукариот.
Транскрипция у про- и эукариот.
Транскрипция — это синтез РНК на матрице ДНК. У прокариот синтез всех трех видов РНК катализируется одним сложным белковым комплексом — РНК-полимеразой.
Транскрипционный аппарат эукариотических клеток включает три ядерные РНК-полимеразы, а также РНК-полимеразы митохондрий и пластид. РНК-полимераза I обнаруживается в ядрышках клеток и отвечает за транскрипцию генов рРНК. РНК-полимераза II локализуется в ядерном соке и отвечает за синтез предшественника мРНК. РНК-полимераза III —небольшая фракция, находящаяся в ядерном соке и осуществляющая синтез малых рРНК и тРНК. Каждый из этих ферментов имеет две большие субъединицы и до 10 малых. РНК-полимеразы митохондрий и пластид отличаются от ядерных.
Ферментный комплекс РНК-полимеразы специфически узнает некую нуклеотидную последовательность (часто не одну), расположенную на определенном расстоянии от стартовой точки транскрипции, — промотор.
Стартовой точкой считают нуклеотид ДНК, которому соответствует первый нуклеотид, включаемый ферментом в РНК-транскрипт.
У прокариот обычно недалеко от стартовой точки против хода транскрипции располагается последовательность из шести нуклеотидов — ТАТААТ, называемая блоком Прибнова.
Это среднестатистическая последовательность, состоящая из наиболее часто встречаемых оснований, самыми консервативными из которых являются 1,2 и 6-е основания. Наличие в этой последовательности оснований, преимущественно соединенных двойными водородными связями с комплементарными основаниями другой цепи, очевидно, облегчает локальное плавление двойной спирали ДНК и образование двух ее одноцепочечных участков при контакте с РНК-полимеразой. Блок Прибнова располагается в положении от —11 до —5 или от —14 до —8, т.е. за несколько нуклеотидов перед стартовой точкой транскрипции (рис. 3.36). Обнаруживая эту последовательность, РНК-полимераза прочно связывается с ней и начинает синтез РНК.
Столь же важная роль в установлении контакта РНК-полимеразы с ДНК принадлежит другой нуклеотидной последовательности, центр которой находится в положении —35. Ее называют областью узнавания —
ТТГАЦА. Между двумя указанными участками расстояние достаточно постоянно и составляет от 16 до 19 пар нуклеотидов (п.н.).
Промоторы эукариотических генов также включают по меньшей мере две специфические нуклеотидные последовательности, центры которых находятся в положении —25 и —75 п.н. На расстоянии 19—27 нуклеотидов от стартовой точки против хода транскрипции у многих генов эукариот обнаружена среднестатистическая последовательность ТАТА
Т
АА
Т
(ТАТА-блок, или блок Хогнесса), в которой, так же как в блоке Прибнова у прокариот, преобладают основания, образующие более слабые связи.
Вторую последовательность, встречаемую во многих промоторах эукариот и состоящую из ГГЦ
Т
ЦААТЦТ, обозначают как ЦААТ-блок. Она занимает положение между —70 и —80 нуклеотидами и также является областью, узнаваемой полимеразой.
В некоторых генах обнаружены многокомпонентные промоторы. Так, в отдельных генах вируса герпеса для эффективной инициации транскрипции необходимы три последовательности ДНК, расположенные между —19 и —27, между —47 и —61, а также между —80 и —105 нуклеотидами.
Рис. 3.36. Точки контакта для РНК-полимеразы,
находящиеся в верхней цепи ДНК (промотор)
Особенности промоторных участков свидетельствуют о том, что для инициации транскрипции имеет значение не только сочетание оснований в определенных областях промотора, но и взаимное расположение в молекуле ДНК этих областей, с которыми связывается ферментный комплекс РНК-полимеразы.
После установления контакта между РНК-полимеразой и промоторным участком начинается сборка молекулы РНК, в которую первым чаще всего включается нуклеотид, несущий пуриновое основание (как правило, аденин) и содержащий три 5'-фосфатных остатка. Далее, по мере продвижения РНК-полимеразы вдоль молекулы ДНК происходит постепенное удлинение цепи РНК, которое продолжается до встречи фермента с областью терминатора (см. разд. 3.4.3.1). Терминатор —
это участок, где прекращается дальнейший рост цепи РНК и происходит ее освобождение от матрицы ДНК. РНК-полимераза также отделяется от ДНК, которая восстанавливает свою двухцепочечную структуру.
Рис. 3.37. Область ДНК с двойной симметрией —палиндром:
I
— палиндром, в котором имеется последовательность, одинаковая при чтении в противоположных направлениях;
II —
палиндром, в котором заштрихованный инвертированный повтор находится на расстоянии от оси симметрии
В прокариотических клетках терминаторы обязательно содержат палиндромы —
двухцепочечные последовательности нуклеотидов ДНК, которые одинаково читаются в обоих направлениях (рис. 3.37). Участок РНК, транскрибированный с такой последовательности, способен образовывать двухцепочечные шпильки за счет комплементарного спаривания нуклеотидов палиндрома. Возможно, это и является сигналом для завершения транскрипции, узнаваемым РНК-полимеразой (рис. 3.38). Возникающие шпильки, видимо, останавливают полимеразу на терминаторе. Следом за шпилькой в молекулу РНК включается последовательность из нуклеотидов, содержащих урацил (полиУ), которая, вероятно, принимает участие в высвобождении РНК от матрицы ДНК. Действительно, полиУ-последовательность РНК, соединенная с полиадениловой (полиА) последовательностью ДНК, характеризуется слабым взаимодействием. Обращает на себя внимание тот факт, что участок ДНК, богатый парами А-Т, встречается не только в месте инициации транскрипции (блок Прибнова), но и в терминаторной области.
Бактериальные терминаторы значительно различаются по своей эффективности. Некоторые из них как бы не замечаются РНК-полимеразой, и она продолжает транскрипцию за пределами терминатора. Такое прочитывание терминатора при транскрипции бактериальных генов наблюдается в результате предотвращения терминации специфическими белками — факторами антитерминацш.
Следствием антитерминации является синтез полицистронной мРНК, включающей в себя информацию, списанную с нескольких последовательно расположенных структурных генов.
Терминаторы эукарйогических генов изучены в меньшей степени, чем у проскариот, но в них также обнаружены районы, богатые Г-Ц парами, соединенными тройными водородными связями, в которых располагается, участок с А-Т парами. На этом участке в транскрипт включается полиУ-последовательность, слабо взаимодействующая с матричной полиА-областыо ДНК.
Возможно, область терминатора, богатая Г-Ц парами, играет определенную роль в остановке РНК-полимеразы, а участок РНК, содержащий УУУУ обеспечивает отделение транскрипта от матрицы ДНК.
У эукариот не обнаружено образования структур, подобных шпилькам в прокариотических РНК. Поэтому, каким образом у них осуществляется терминация транскрипции, остается неясным.
В составе всех мРНК можно выделить кодирующие участки, представляющие набор кодонов, которые шифруют последовательность аминокислот в пептиде. Как правило, эти участки начинаются стартовым кодоном АУГ, но иногда у бактерий используется кодон ГУТ. На конце кодирующей последовательности располагается терминирующий кодон. Помимо кодирующих участков в мРНК на обоих концах могут располагаться дополнительные последовательности. На 5'-конце это лидерный участок, расположенный перед стартовым кодоном. На 3'-конце — трейлер, следующий за кодоном-терминатором.
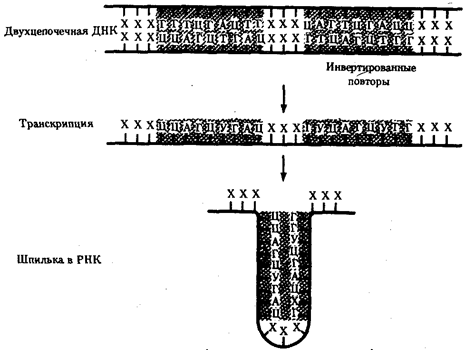
Рис. 3.38. Образование шпильки участком РНК
при терминации транскрипции у прокариот
Область РНК, несущая палиндром, образует комплементарно спаривающуюся структуру — шпильку (инвертированные повторы заштрихованы)
В полицистронной мРНК прокариот между кодирующими участками имеются межцистронные области, варьирующие по размерам (рис. 3.39).
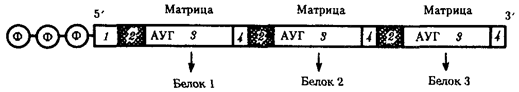
Рис. 3.39. Полицистронная матричная РНК прокариот:
1
— некодирующие области, 2 —
межцистронные области, 3 —
кодирующие области, 4 —
терминирующие кодоны
В связи с тем что прокариотические гены целиком состоят из нуклеотидных последовательностей, участвующих в кодировании информации, транскрибированные с них РНК сразу после их синтеза способны выполнять функцию матриц для трансляции. Лишь в исключительных случаях требуется их предварительное созревание — процессинг.
В отличие от прокариотических генов большинство генов эукариотических клеток прерывисты, так как несут в своем составе неинформативные нуклеотидные последовательности — интроны,
не участвующие в кодировании информации. В связи с этим первичные транскрипты, синтезированные РНК-полимеразой II, обладают большими, чем необходимо для трансляции, размерами и оказываются менее стабильными. В совокупности они образуют так называемую гетерогенную ядерную РНК
(тяРНК
),
которая прежде чем выйти из ядра и начать активно функционировать в цитоплазме, подвергается процессингу и превращается в зрелые мРНК.
Процессинг эукариотических мРНК.
Созревание, или процессинг, мРНК предполагает модифицирование первичного транскрипта и удаление из него некодирующих интронных участков с последующим соединением (сплайсингом
) кодирующих последовательностей — экзонов.
Модифицирование первичного транскрипта эукариотической мРНК начинается вскоре после синтеза его 5'-конца, содержащего одно из пуриновых оснований (аденин или гуанин). На этом конце образуется колпачок — кэп,
который блокирует 5'-конец мРНК путем присоединения к первому нуклеотиду транскрипта трифосфонуклео-зида, содержащего гуанин, связью 5'—5'
Гффф
+ фффАфN… → Гф
ффАфN.. + фф +
ф
В результате образуется последовательность ГфффАфЧМ..., в которой остаток туанина находится в обратной ориентации по отношению к другим нуклеотидам мРНК. Модификация 5'-конца мРНК предполагает также метилирование присоединенного гуанина и первых двух-трех оснований первичного транскрипта (рис. 3.40). Образуемые на 5' -концах мРНК кэпы обеспечивают узнавание молекул мРНК малыми субчастицами рибосом в цитоплазме. Кэширование осуществляется еще до окончания синтеза первичного транскрипта.
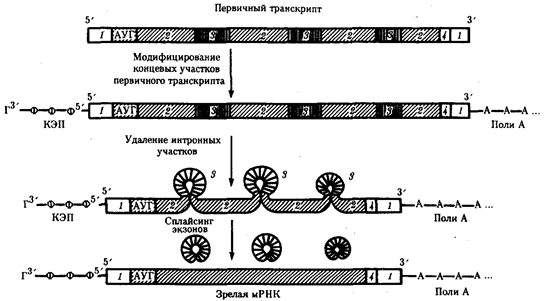
Рис. 3.40. Образование зрелой мРНК эукариот в ходе процессинга:
1
— некодирующие последовательности, 2 —
экзоны, 3 —
интроны,
4 —
кодон-терминатор
После завершения транскрипции происходит удаление части нуклеотидов на 3'-конце первичного транскрипта и присоединение к нему последовательности, состоящей из 100—200 остатков адениловой кислоты (полиА) (рис. 3.40). Считают, что эта последовательность способствует дальнейшему процессингу и транспорту зрелой мРНК из ядра. После выхода мРНК в цитоплазму ее полиА-последовательность постепенно укорачивается под действием ферментов, отщепляющих нуклеотиды на 3'-конце. Таким образом, по длине полиА-последовательности можно косвенно судить о времени пребывания мРНК в цитоплазме. Возможно, добавление полиА-последовательности в ходе процессинга повышает стабильность мРНК. Однако около трети мРНК вообще не содержат полиА-участка. К ним относятся, например, гистоновые мРНК.
Образование кэпа на 5'-конце и полиА-последовательности на 3'-конце характерно только для процессинга РНК, синтезируемых РНК-полимеразой II. Кроме метилирования при формировании кэпов в мРНК высших эукариот происходит метилирование небольшой части внутренних нуклеотидов с частотой приблизительно одно на тысячу оснований мРНК.
Наряду с модифицированием мРНК эукариот процессинг предполагает удаление из первичных транскриптов неинформативных для данного белка интронных участков, размер которых варьирует от 100 до 10 000 нуклеотидов и более. На долю интронов приходится около 80% всей гяРНК. Удаление интронов с последующим соединением экзонных участков называют сплайсингом
(рис. 3.40).
Сплайсинг представляет собой механизм, который должен обеспечивать удаление из первичного транскрипта строго определенных интронных участков. Нарушение этого процесса может привести к сдвигу рамки считывания при трансляции и невозможности синтеза нормального пептида. Закономерность вырезания интронов, очевидно, обеспечивается благодаря наличию на их концах специфических нуклеотидных последовательностей, служащих сигналами для сплайсинга.
В настоящее время описано несколько вероятных механизмов сплайсинга, обеспечивающих точность этого процесса. Возможно, она достигается действием каких-то ферментов, специфически узнающих концевые участки интронов и катализирующих разрыв фосфодиэфирных связей на границе экзон — интрон, а затем образование связей между двумя экзонами.
Установлено активное участие в сплайсинге особых малых, ядерных РНК
(мяРНК), образующих комплексы с белками (мяРНП). Очевидно, мяРНК своими нуклеотидными последовательностями комплементарно взаимодействуют с концевыми участками интронов, которые образуют при этом замкнутые петли. Расщепление РНК в устье интронной петли приводит к удалению неинформативной последовательности и соединению (сплайсингу) сближенных концов экзонов.
Обсуждается также автокаталитическая способность РНК-транскрипта к сплайсингу. Описанные способы сплайсинга свидетельствуют об отсутствии универсального механизма этого процесса, однако во всех случаях достигается точное удаление интронов с образованием определенной мРНК, обеспечивающей синтез необходимого клетке белка.
В настоящее время доказана возможность альтернативного (взаимоисключающего) сплайсинга, при котором из одного и того же первичного транскрипта могут удаляться разные нуклеотидные последовательности и образовываться разные зрелые мРНК. В результате одна и та же последовательность нуклеотидов ДНК может служить информацией для синтеза разных пептидов. Альтернативный сплайсинг, вероятно, очень характерен в системе генов иммуноглобулинов у млекопитающих, где он позволяет формировать на основе одного транскрипта мРНК для синтеза разных видов антител.
Благодаря преобразованиям, происходящим с РНК-транскриптом в ходе процессинга, зрелые мРНК эукариот характеризуются большей стабильностью по сравнению с прокариотическими мРНК.
По завершении процессинга зрелая мРНК проходит отбор перед выходом в цитоплазму, куда попадает всего 5% гяРНК. Остальная часть расщепляется, не покидая ядра.
Таким образом, преобразования первичных транскриптов эукариотических генов, обусловленные их экзон-итронной организацией и необходимостью перехода мРНК из ядра в цитоплазму, определяют особенности реализации генетической информации в эукариотической клетке.
Трансляция у про- и эукариот.
В прокариотических клетках процесс трансляции сопряжен с синтезом мРНК: они происходят практически одновременно. В значительной степени это связано с недолговечностью бактериальной мРНК, которая достаточно быстро подвергается распаду. Взаимосвязанность транскрипции и трансляции у бактерии проявляется в согласованности скоростей этих процессов. При 37°С транскрипция идет со скоростью 2500 нуклеотидов/мин (14 кодонов/с), а трансляция осуществляется со скоростью 15 аминокислот/с.
Трансляция у прокариот начинается вскоре после образования 5'-конца мРНК, раньше, чем заканчивается ее синтез. В результате вслед за РНК-полимеразой по мРНК движутся рибосомы, осуществляющие сборку пептидных цепей (рис. 3.41). Через некоторое время после начала транскрипции (около 1 мин) и до завершения трансляции 3'-конца матрицы начинается деградация ее 5'-конца. Ввиду того что время жизни разных мРНК не одинаково, количество белка, синтезированного на разных матрицах, различно.
Одной из особенностей трансляции у прокариот является включение в пептидную цепь в качестве первой аминокислоты модифицированного метионина — формилметионина, с которого начинаются все вновь синтезированные пептиды. Даже в том случае, когда роль стартового кодона выполняет кодом ГУГ, в обычных условиях шифрующий валин, в первом положении пептида оказывается формилметионин. Стартовый кодон АУГ или ГУГ следует за лидерным участком, который экранируется рибосомой в момент инициации трансляции.
Соединение рибосомы с мРНК обусловлено комплементарным взаимодействием нуклеотидов одной из рРНК с нуклеотидной последовательностью лидера мРНК.
Эта последовательность (Шайна—Дальгарно) располагается на расстоянии 4—7 оснований перед кодоном АУГ и обнаруживается повсеместно в лидерных участках у прокариот.
При соединении 5'-конца мРНК с малой субчастицей рибосомы стартовый кодон обычно оказывается почти в середине экранированного рибосомой фрагмента мРНК, в области, соответствующей ее П-участку.
У эукариот трансляция осуществляется в цитоплазме, куда попадает из ядра зрелая мРНК. Копированный конец мРНК распознается малой субчастицей рибосомы, затем лидирующая последовательность, содержащая до 100 нуклеотидов, взаимодействует с рРНК. При этом стартовый кодон АУГ оказывается в недостроенном П-участке рибосомы. После присоединения к стартовому кодону аминоацил-тРНК, несущей метионин, происходит воссоединение двух субчастиц рибосомы и формируются ее А- и П-участки. Синтез белка в эукариотической клетке, осуществляемый на моноцистронной мРНК, завершается после прохождения рибосомой по всей мРНК, вплоть до узнавания ею кодона-терминатора, прекращающего образование пептидных связей.
Посттрансляционные преобразования белков.
Синтезированные в ходе трансляции пептидные цепи на основе своей первичной структуры приобретают вторичную и третичную, а многие—и четвертичную организацию, образуемую несколькими пептидными цепями. В зависимости от функций, выполняемых белками, их аминокислотные последовательности могут претерпевать различные преобразования, формируя функционально активные молекулы белка.
Многие мембранные белки синтезируются в виде пре-белков,
имеющих на N-конце лидерную последовательность,
которая обеспечивает him узнавание мембраны. Эта последовательность отщепляется при созревании и встраивании белка в мембрану. Секреторные белки также имеют на N-конце лидерную последовательность, которая обеспечивает их транспорт через мембрану.
Некоторые белки сразу после трансляции несут дополнительные аминокислотные про-последовательности, определяющие стабильность предшественников активных белков. При созревании белка они удаляются, обеспечивая переход неактивного пробелка в активный белок. Например, инсулин вначале синтезируется как пре-проинсулин. Во время секреции пре-последовательность отщепляется, а затем проинсулин подвергается модификации, при которой из него удаляется часть цепи и он превращается в зрелый инсулин.
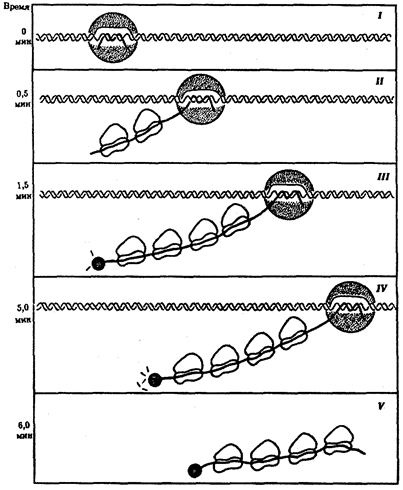
Рис. 3.41. Транскрипция, трансляция и деградация мРНК у прокариот:
I
— РНК-полимераза связывается с ДНК и начинает синтезировать мРНК в направлении 5' → 3';
II
— по мере продвижения РНК-полимеразы к 5'-концу мРНК прикрепляются рибосомы, начинающие синтез белка;
III —
группа рибосом следует за РНК-полимеразой, на 5'-конце мРНК начинается ее деградация;
IV —
процесс деградации протекает медленнее, чем транскрипция и трансляция;
V —
после окончания транскрипции мРНК освобождается от ДНК, на ней продолжается трансляция и деградация на 5'-конце
Формируя третичную и четвертичную организацию в ходе посттрансляционных преобразований, белки приобретают способность активно функционировать, включаясь в определенные клеточные структуры и осуществляя ферментативные и другие функции.
Рассмотренные особенности реализации генетической информации в про- и эукариотических клетках обнаруживают принципиальное сходство этих процессов. Следовательно, механизм экспрессии генов, связанный с транскрипцией и последующей трансляцией информации, которая зашифрована с помощью биологического кода, сложился в целом еще до того, как были сформированы эти два типа клеточной организации. Дивергентная эволюция геномов про- и эукариот привела к возникновению различий в организации их наследственного материала, что не могло не отразиться и на механизмах его экспресии.
Постоянное совершенствование наших знаний об организации и функционировании материала наследственности и изменчивости обусловливает эволюцию представлений о гене как функциональной единице этого материала.
Долгое время ген рассматривали как минимальную часть наследственного материала (генома), обеспечивающую развитие определенного признака у организмов данного вида. Однако каким образом функционирует ген, оставалось неясным. В 1945 г. Дж. Бидлом и Э. Татумом была сформулирована гипотеза, которую можно выразить формулой «Один ген — один фермент». Согласно этой гипотезе, каждая стадия метаболического процесса, приводящая к образованию в организме (клетке) какого-то продукта, катализируется белком-ферментом, за синтез которого отвечает один ген.
Позднее было показано, что многие белки имеют четвертичную структуру, в образовании которой принимают участие разные пептидные цепи. Например, гемоглобин взрослого человека включает четыре глобиновых цепи — 2α и 2β, кодируемые разными генами. Поэтому формула, отражающая связь между геном и признаком, была несколько преобразована: «Один ген — один полипептид».
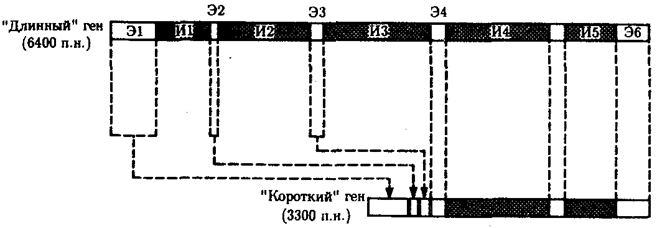
Рис. 3.42. Две формы гена box (cob) митохондрий дрожжей,
кодирующего цитохром b
«Короткий» ген box образуется в результате удаления из «длинного» гена первых трех интронных участков и сплайсинга первых четырех экзонов; И — интрон, Э — экзон; п.н. — пары нуклеотидов
Изучение химической организации наследственного материала и процесса реализации генетической информации привело к формированию представления о гене как о фрагменте молекулы ДНК, транскрибирующемся в виде молекулы РНК, которая кодирует аминокислотную последовательность пептида или имеет самостоятельное значение (тРНК и рРНК).
Открытия экзон-интронной организации эукариотических генов и возможности альтернативного сплайсинга показали, что одна и та же нуклеотидная последовательность первичного транскрипта может обеспечить синтез нескольких полипептидных цепей с разными функциями или их модифицированных аналогов. Например, в митохондриях дрожжей имеется ген box (или cob), кодирующий дыхательный фермент цитохром b.
Он может существовать в двух формах (рис. 3.42). «Длинный» ген, состоящий из 6400 п. н., имеет 6 экзонов общей протяженностью 1155 п.н. и 5 интронов. Короткая форма гена состоит из 3300 п.н. и имеет 2 интрона. Она фактически представляет собой лишенный первых трех интронов «длинный» ген. Обе формы гена одинаково хорошо экспрессируются.
После удаления первого интрона «длинного» гена box на основе объединенной нуклеотидной последовательности двух первых экзонов и части нуклеотидов второго интрона образуется матрица для самостоятельного белка — РНК-матуразы (рис. 3.43). Функцией РНК-матуразы является обеспечение следующего этапа сплайсинга — удаление второго интрона из первичного транскрипта и в конечном счете образование матрицы для цитохрома b.
Рис. 3.43. Образование матрицы для РНК-матуразы в ходе сплайсинга первичного транскрипта гена цитохрома b
митохондрий дрожжей:
п.н. — пары нуклеотидов
Другим примером может служить изменение схемы сплайсинга первичного транскрипта, кодирующего структуру молекул антител в лимфоцитах. Мембранная форма антител имеет на С-конце длинный «хвост» аминокислот, который обеспечивает фиксацию белка на мембране. У секретируемой формы антител такого хвоста нет, что объясняется удалением в ходе сплайсинга из первичного транскрипта кодирующих этот участок нуклеотидов.
У вирусов и бактерий описана ситуация, когда один ген может одновременно являться частью другого гена или некоторая нуклеотидная последовательность ДНК может быть составной частью двух разных перекрывающихся генов. Например, на физической карте генома фага ФХ174 (рис. 3.44) видно, что последовательность гена В располагается внутри гена А, а ген Е является частью последовательности гена D. Этой особенностью организации генома фага удалось объяснить существующее несоответствие между относительно небольшим его размером (он состоит из 5386 нуклеотидов) и числом аминокислотных остатков во всех синтезируемых белках, которое превышает теоретически допустимое при данной емкости генома. Возможность сборки разных пептидных цепей на мРНК, синтезированной с перекрывающихся генов (А и В или Е и D), обеспечивается наличием внутри этой мРНК участков связывания с рибосомами. Это позволяет начать трансляцию другого пептида с новой точки отсчета.
Рис. 3.44. Физическая карта генома фага ФХ174
Нуклеотидная последовательность гена В является одновременно частью гена А, а ген Е составляет часть гена D
В геноме фага λ были также обнаружены перекрывающиеся гены, транслируемые как со сдвигом рамки, так и в той же рамке считывания. Предполагается также возможность транскрибирования двух разных мРНК с обеих комплементарных цепей одного участка ДНК. Это требует наличия промоторных областей, .определяющих движение РНК-полимеразы в разных направлениях вдоль молекулы ДНК.
Описанные ситуации, свидетельствующие о допустимости считывания разной информации с одной и той же последовательности ДНК, позволяют предположить, что перекрывающиеся гены представляют собой довольно распространенный элемент организации генома вирусов и, возможно, прокариот. У эукариот прерывистость генов также обеспечивает возможность синтеза разнообразных пептидов на основе одной и той же последовательности ДНК.
Имея в виду все сказанное, необходимо внести поправку в определение гена. Очевидно, нельзя больше говорить о гене как о непрерывной последовательности ДНК, однозначно кодирующей определенный белок. По-видимому, в настоящее время наиболее приемлемой все же следует считать формулу «Один ген — один поли-пептид», хотя некоторые авторы предлагают ее переиначить: «Один полипептид — один ген». Во всяком случае, под термином ген надо понимать функциональную единицу наследственного материала, по химической природе являющуюся полинуклеотидом и определяющую возможность синтеза полипептидной цепи, тРНК или рРНК.
В процессе реализации наследственной информации, заключенной в гене, проявляется целый ряд его свойств. Определяя возможность развития отдельного качества, присущего данной клетке или организму, ген характеризуется дискретностью
действия.
Ввиду того что в гене заключается информация об аминокислотной последовательности определенного полипептида, его действие является специфичным.
Однако в некоторых случаях одна и та же нуклеотидная последовательность может детерминировать синтез не одного, а нескольких полипептидов. Это наблюдается в случае альтернативного сплайсинга у эукариот и при перекрывают генов у фагов и прокариот. Очевидно, такую способность следует оценить как множественное, или плейотропное,
действие гена (хотя традиционно под плейотропным действием гена принято понимать участие его продукта — полипептида — в разных биохимических процессах, имеющих отношение к формированию различных сложных признаков). Например, участие фермента (рис. 3.45) в ускорении определенной реакции (А → В), которая является звеном нескольких биохимических процессов, делает зависимыми результаты этих процессов (D и Е) от нормального функционирования гена а,
кодирующего этот белок.
Определяя возможность транскрибирования мРНК для синтеза конкретной полипептидной цепи, ген характеризуется дозированностью
действия, т.е. количественной зависимостью результата его экспрессии от дозы соответствующего аллеля этого гена. Примером может служить зависимость степени нарушения транспортных свойств гемоглобина у человека при серповидно-клеточной анемии от дозы аллеля HbS. Наличие в генотипе человека двойной дозы этого аллеля, приводящего к изменению структуры β-глобиновых цепей гемоглобина, сопровождается грубым нарушением формы эритроцитов и развитием клинически выраженной картины анемии вплоть до гибели. У носителей только одного аллеля HbS при нормальном втором аллеле лишь незначительно изменяется форма эритроцитов и анемия не развивается, а организм характеризуется практически нормальной жизнеспособностью.
Рис. 3.45. Зависимость формирования нескольких признаков
от нормального функционирования продукта гена
Нарушение реакции А → В, катализируемой белком, в результате мутации гена ведет к выключению последующих этапов формирования признаков D и Е
Дискретность наследственного материала, предположение о которой высказал еще Г. Мендель, подразумевает делимость его на части, являющиеся элементарными единицами,—гены. В настоящее время ген рассматривают как единицу генетической функции. Он представляет собой минимальное количество наследственного материала, которое необходимо для синтеза тРНК, рРНК или полипептида с определенными свойствами. Ген несет ответственность за формирование и передачу по наследству отдельного признака или свойства клеток, организмов данного вида. Кроме того, изменение структуры гена, возникающее в разных его участках, в конечном итоге приводит к изменению соответствующего элементарного признака.
Таким образом, на генном уровне организации наследственного материала обеспечиваются индивидуальное наследование и индивидуальное изменение отдельных признаков и свойств клеток, организмов данного вида.
Реальное существование генного уровня организации наследственного материала дало возможность исследователям при анализе характера наследования отдельных признаков открыть главные закономерности, которые легли в основу наших представлений об организации материального носителя наследственности и изменчивости.
Термин хромосома
был предложен в 1888 г. немецким морфологом В. Вальдейером, который применил его для обозначения внутриядерных структур эукариотической клетки, хорошо окрашивающихся основными красителями (от греч. хрома —
цвет, краска, и сома —
тело). К началу XX в. углубленное изучение поведения этих структур в ходе самовоспроизведения клеток, при созревании половых клеток, при оплодотворении и раннем развитии зародыша обнаружило строго закономерные динамические изменения их организации. Это привело немецкого цитолога и эмбриолога Т. Бовери (1902—1907) и американского цитолога У. Сеттона (1902—1903) к утверждению тесной связи наследственного материала с хромосомами, что легло в основу хромосомной теории наследственности. Детальная разработка этой теории была осуществлена в начале XX в. школой американских генетиков, возглавляемой Т. Морганом.
Работы Т. Моргана и его сотрудников не только подтвердили значение хромосом как основных носителей наследственного материала, представленного отдельными генами, но и установили линейность расположения их по длине хромосомы.
Доказательством связи материального субстрата наследственности и изменчивости с хромосомами было, с одной стороны, строгое соответствие открытых Г. Менделем закономерностей наследования признаков поведению хромосом в ходе митоза, при мейозе и оплодотворении. С другой стороны, в лаборатории Т. Моргана был обнаружен особый тип наследования признаков, который хорошо объяснялся связью соответствующих генов с Х-хромосомой. Речь идет о сцепленном с полом наследовании окраски глаз у дрозофилы.
Представление о хромосомах как носителях комплексов генов было высказано на основе наблюдения сцепленного наследования ряда родительских признаков друг с другом при передаче их в ряду поколений. Такое сцепление неальтернативных признаков было объяснено размещением соответствующих генов в одной хромосоме, которая представляет собой достаточно устойчивую структуру, сохраняющую состав генов в ряду поколений клеток и организмов.
Согласно хромосомной теории наследственности, совокупность генов, входящих в состав одной хромосомы, образует группу сцепления.
Каждая хромосома уникальна по набору заключенных в ней генов. Число групп сцепления в наследственном материале организмов данного вида определяется, таким образом, количеством хромосом в гаплоидном наборе их половых клеток. При оплодотворении образуется диплоидный набор, в котором каждая группа сцепления представлена двумя вариантами — отцовской и материнской хромосомами, несущими оригинальные наборы аллелей соответствующего комплекса генов.
Представление о линейности расположения генов в каждой хромосоме возникло на основе наблюдения нередко возникающей рекомбинации
(взаимообмена) между материнским и отцовским комплексами генов, заключенными в гомологичных хромосомах. Было установлено, что частота рекомбинации характеризуется определенным постоянством для каждой пары генов в данной группе сцепления и различна для разных пар. Это наблюдение дало возможность высказать предположение о связи частоты рекомбинации с последовательностью расположения генов в хромосоме и процессом кроссинговера, происходящим между гомологами в профазе I мейоза (см. разд. 3.6.2.3). Представление о линейном распределении генов хорошо объясняло зависимость частоты рекомбинации от расстояния между ними в хромосоме.
Открытие сцепленного наследования неальтернативных признаков легло в основу разработки методики построения генетических карт хромосом с использованием гибридологического метода генетического анализа.
Таким образом, в начале XX в. была неопровержимо доказана роль хромосом как основных носителей наследственного материала в эука-риотической клетке. Подтверждение этому было получено при изучении химического состава хромосом.
Изучение химической организации хромосом эукариотических клеток показало, что они состоят в основном из ДНК и белков, которые образуют нуклеопротеиновый комплекс—хроматин,
получивший свое название за способность окрашиваться основными красителями.
Как было доказано многочисленными исследованиями (см. § 3.2), ДНК является материальным носителем свойств наследственности и изменчивости и заключает в себе биологическую информацию — программу развития клетки, организма, записанную с помощью особого кода. Количество ДНК в ядрах клеток организма данного вида постоянно и пропорционально их плоидности. В диплоидных соматических клетках организма ее вдвое больше, чем в гаметах. Увеличение числа хромосомных наборов в полипловдных клетках сопровождается пропорциональным увеличением количества ДНК в них.
Белки составляют значительную часть вещества хромосом. На их долю приходится около 65% массы этих структур. Все хромосомные белки разделяются на две группы: гистоны и негистоновые белки.
Гистоны
представлены пятью фракциями: HI, Н2А, Н2В, НЗ, Н4. Являясь положительно заряженными основными белками, они достаточно прочно соединяются с молекулами ДНК, чем препятствуют считыванию заключенной в ней биологической информации. В этом состоит их регуляторная роль. Кроме того, эти белки выполняют структурную функцию, обеспечивая пространственную организацию ДНК в хромосомах (см. разд. 3.5.2.2).
Число фракций негистоновых
белков превышает 100. Среди них ферменты синтеза и процессинга РНК, редупликации и репарации ДНК. Кислые белки хромосом выполняют также структурную и регуляторную роль. Помимо ДНК и белков в составе хромосом обнаруживаются также РНК, липиды, полисахариды, ионы металлов.
РНК хромосом
представлена отчасти продуктами транскрипции, еще не покинувшими место синтеза. Некоторым фракциям свойственна регуляторная функция.
Регуляторная роль компонентов хромосом заключается в «запрещении» или «разрешении» списывания информации с молекулы ДНК.
Массовые соотношения ДНК: гистоны: негистоновые белки: РНК: липиды — равны 1:1:(0,2—0,5):(0,1—0,15):(0,01—-0,03). Другие компоненты встречаются в незначительном количестве.
Сохраняя преемственность в ряду клеточных поколений, хроматин в зависимости от периода и фазы клеточного цикла меняет свою организацию. В интерфазе при световой микроскопии он выявляется в виде глыбок, рассеянных в нуклеоплазме ядра. При переходе клетки к митозу, особенно в метафазе, хроматин приобретает вид хорошо различимых отдельных интенсивно окрашенных телец — хромосом.
Интерфазную и метафазную формы существования хроматина расценивают как два полярных варианта его структурной организации, связанных в митотическом цикле взаимопереходами. В пользу такой оценки свидетельствуют данные электронной микроскопии о том, что в основе как интерфазной, так и метафазной формы лежит одна и та же элементарная нитчатая структура. В процессе электронно-микроскопических и физико-химических исследований в составе интерфазного хроматина и метафазных хромосом были выявлены нити (фибриллы) диаметром 3,0—5,0, 10, 20—30 нм. Полезно вспомнить, что диаметр двойной спирали ДНК составляет примерно 2 нм, диаметр нитчатой структуры интерфазного хроматина равен 100—200, а диаметр одной из сестринских хроматид метафазной хромосомы — 500— 600 нм.
Наиболее распространенной является точка зрения, согласно которой хроматин (хромосома) представляет собой спирализованную нить. При этом выделяется несколько уровней спирализации (компак-тизации) хроматина (табл. 3.2).
Таблица 3.2. Последовательные уровни компактизации хроматина
| Фибрилла
|
Степень укорочения
|
Диаметр, нм
|
| по сравнению
с предшествующей структурой
|
по сравнению
с молекулой ДНК
|
| ДНК
|
1
|
1
|
1—2
|
| Нуклесомная нить
|
7
|
7
|
10
|
| Элементарная хроматиновая фибрилла
|
6
|
42
|
20—30
|
| Интерфазная хромонема
|
40
|
1600
|
100—200
|
| Метафазная хроматида
|
5
|
8000
|
500—600
|
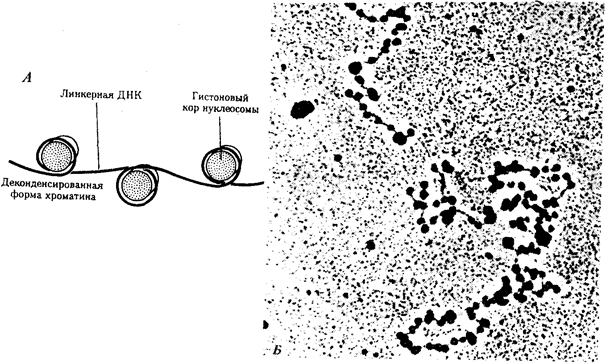
Рис. 3.46. Нуклеосомная организация хроматина.
А —
деконденсированная форма хроматина;
Б —
электронная микрофотография эукариотического хроматина:
А —
молекула ДНК накручена на белковые коры;
Б —
хроматин представлен нуклеосомами, соединенными линкерной ДНК
Нуклеосомиая нить.
Этот уровень организации хроматина обеспечивается четырьмя видами нуклеосомных гистонов: Н2А, Н2В, НЗ, Н4. Они образуют напоминающие по форме шайбу белковые тела — коры,
состоящие из восьми молекул (по две молекулы каждого вида гистонов) (рис. 3.46).
Молекула ДНК комплектируется с белковыми корами, спирально накручиваясь на них. При этом в контакте с каждым кором оказывается участок ДНК, состоящий из 146 пар нуклеотидов (п.н.). Свободные от контакта с белковыми телами участки ДНК называют связующими
или линкерными.
Они включают от 15 до 100 п.н. (в среднем 60 п.н.) в зависимости от типа клетки.
Отрезок молекулы ДНК длиной около 200 п. н. вместе с белковым кором составляет нуклеосому.
Благодаря такой организации в основе структуры хроматина лежит нить, представляющая собой цепочку повторяющихся единиц — нуклеосом (рис. 3.46, Б
).
В связи с этим геном человека, состоящий из 3 · 109
п. н., представлен двойной спиралью ДНК, упакованной в 1,5 · 107
нуклеосом.
Вдоль нуклеосомной нити, напоминающей цепочку бус, имеются области ДНК, свободные от белковых тел. Эти области, расположенные с интервалами в несколько тысяч пар нуклеотидов, играют важную роль в дальнейшей упаковке хроматина, так как содержат нуклеотидные последовательности, специфически узнаваемые различными негистоновыми белками.
В результате нуклеосомной организации хроматина двойная спираль ДНК диаметром 2 нм приобретает диаметр 10—11 нм.
Хроматиновая фибрилла.
Дальнейшая компактизация нуклеосомной нити обеспечивается пистоном HI, который, соединяясь с линкерной ДНК и двумя соседними белковыми телами, сближает их друг с другом. В результате образуется более компактная структура, построенная, возможно, по типу соленоида. Такая Хроматиновая фибрилла, называемая также элементарной,
имеет диаметр 20—30 нм (рис. 3.47).
| 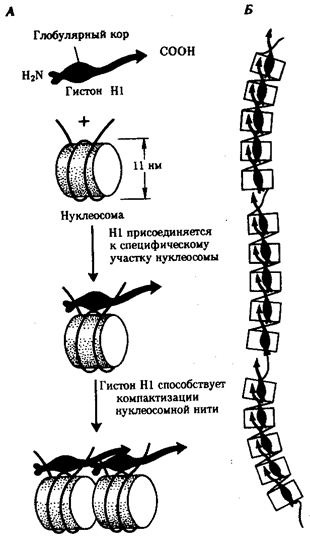
|

Рис. 3.47. Хроматиновая фибрилла диаметром 20—30 нм. А —
соединение соседних нуклеосом с помощью гистона HI; Б —
цепочка, образуемая нуклеосомами разделенными участками ДНК, свободными от белковых тел; В —
возможная модель упаковки ДНК в хроматиновой фибрилле в виде соленоида
|
Интерфазная хромонема.
Следующий уровень структурной организации генетического материала обусловлен укладкой хроматиновой фибриллы в петли. В их образовании, по-видимому, принимают участие негистоновые белки, которые способны узнавать специфические нуклеотидные последовательности вненуклеосомной ДНК, отдаленные друг от друга на расстояние в несколько тысяч пар нуклеотидов. Эти белки сближают указанные участки с образованием петель из расположенных между ними фрагментов хроматиновой фибриллы (рис. 3.48). Участок ДНК, соответствующий одной петле, содержит от 20 000 до 80 000 п. н. Возможно, каждая петля является функциональной единицей генома. В результате такой упаковки Хроматиновая фибрилла диаметром 20—30 нм преобразуется в структуру диаметром 100—200 нм, называемую интерфазной хромонемой.
Отдельные участки интерфазной хромонемы подвергаются дальнейшей компактизации, образуя структурные блоки,
объединяющие соседние петли с одинаковой организацией (рис. 3.49). Они выявляются в интерфазном ядре в виде глыбок хроматина. Возможно, существование таких структурных блоков обусловливает картину неравномерного распределения некоторых красителей в метафазных хромосомах, что используют в цитогенетических исследованиях (см. разд. 3.5.2.3 и 6.4.3.6).

Неодинаковая степень компактизации разных участков интерфазных хромосом имеет большое функциональное значение. В зависимости от состояния хроматина выделяют эухроматиновые
участки хромосом, отличающиеся меньшей плотностью упаковки в неделящихся клетках и потенциально транскрибируемые, и гетерохроматиновые
участки, характеризующиеся компактной организацией и генетической инертностью. В их пределах транскрипции биологической информации не происходит.
Различают конститутивный (структурный) и факультативный гетерохроматин.
Конститутивный
гетерохроматин содержится в околоцентромерных и теломерных участках всех хромосом, а также на протяжении некоторых внутренних фрагментов отдельных хромосом (рис. 3.50). Он образован только нетранскрибируемой ДНК. Вероятно, его роль заключается в поддержании общей структуры ядра, прикреплении хроматина к ядерной оболочке, взаимном узнавании гомологичных хромосом в мейозе, разделении соседних структурных генов, участии в процессах регуляции их активности.
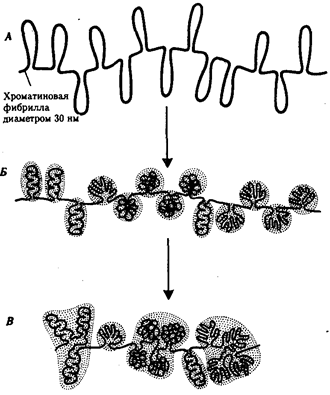
Рис. 3.49. Структурные блоки в организации хроматина.
А —
петельная структура хроматина;
Б —
дальнейшая конденсация хроматиновых петель;
В —
объединение петель, имеющих сходную структуру, в блоки с образованием окончательной формы интерфазной хромосомы
Рис. 3.50. Конститутивный гетерохроматин в метафазных хромосомах человека
Примером факультативного
гетерохроматина служит тельце полового хроматина, образуемое в норме в клетках организмов гомогаметного пола (у человека гомогаметным является женский пол) одной из двух Х-хромосом. Гены этой хромосомы не транскрибируются. Образование факультативного гетерохроматина за счет генетического материала других хромосом сопровождает процесс клеточной дифференцировки и служит механизмом выключения из активной функции групп генов, транскрипция которых не требуется в клетках данной специализации. В связи с этим рисунок хроматина ядер клеток из разных тканей и органов на гистологических препаратах различается. Примером может служить гетерохроматизация хроматина в ядрах зрелых эритроцитов птиц.
Перечисленные уровни структурной организации хроматина обнаруживаются в неделящейся клетке, когда хромосомы еще недостаточно компактизованы, чтобы быть видимыми в световой микроскоп как отдельные структуры. Лишь некоторые их участки с более высокой плотностью упаковки выявляются в ядрах в виде хроматиновых глыбок (рис. 3.51).

Рис. 3.51. Гетерохроматин в интерфазном ядре
Компактные участки гетерохроматина сгруппированы около ядрышка и ядерной мембраны
Метафазная хромосома.
Вступление клетки из интерфазы в митоз сопровождается суперкомпактизацией хроматина. Отдельные хромосомы становятся хорошо различимы. Этот процесс начинается в профазе, достигая своего максимального выражения в метафазе митоза и анафазе (см. разд. 2.4.2). В телофазе митоза происходит декомпак-тизация вещества хромосом, которое приобретает структуру интерфазного хроматина. Описанная митотическая суперкомпактизация облегчает распределение хромосом к полюсам митотического веретена в анафазе митоза. Степень компактизации хроматина в разные периоды митотического цикла клетки можно оценить по данным, приведенным в табл. 3.2.
Митотическая суперкомпактизация хроматина делает возможным изучение внешнего вида хромосом с помощью световой микроскопии. В первой половине митоза они состоят из двух хроматид, соединенных между собой в области первичной перетяжки (центромеры
или кинетохора
) особым образом организованного участка хромосомы, общего для обеих сестринских хроматид. Во второй половине митоза происходит отделение хроматид друг от друга. Из них образуются однонитчатые дочерние хромосомы,
распределяющиеся между дочерними клетками.
В зависимости от места положения центромеры и длины плеч, расположенных по обе стороны от нее, различают несколько форм хромосом: равноплечие, или метацентрические (с центромерой посередине), неравноплечие, или субметацентрические (с центромерой, сдвинутой к одному из концов), палочковидные, или акроцентрические (с центромерой, расположенной практически на конце хромосомы), и точковые —очень небольшие, форму которых трудно определить (рис. 3.52). При рутинных методах окраски хромосом они различаются по форме и соотносительным размерам. При использовании методик дифференциальной окраски выявляется неодинаковая флуоресценция или распределение красителя по длине хромосомы, строго специфические для каждой отдельной хромосомы и ее гомолога (рис. 3.53).
Таким образом, каждая хромосома индивидуальна не только по заключенному в ней набору генов, но и по морфологии и характеру дифференциального окрашивания.
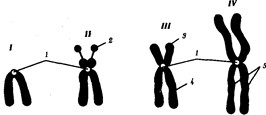
Рис. 3.52. Формы хромосом:
I
— телоцентрическая, II
— акроцентрическая, III—
субметацентрическая, IV—
метацентрическая;
1
— центромера, 2 —
спутник, 3 —
короткое плечо, 4 —
длинное плечо, 5 —
хроматиды
Рис. 3.53. Расположение локусов в хромосомах человека
при их дифференциальном окрашивании:
р — короткое плечо, q — длинное плечо; 1—22 — порядковый номер хромосомы; XY — половые хромосомы
Описанная организация наследственного материала эукариот, связанная с расположением его функциональных единиц в ядерных структурах—хромосомах, у прокариот отсутствует. Основная часть генетического материала заключена у них в единственной кольцевой молекуле ДНК длиной около 1 мм (Е.
coli
), причем у прокариот не обнаружено гистонов, обеспечивающих нуклеосомную организацию хроматина эукариот. Однако кольцевой молекуле ДНК прокариот также присуща укладка в виде петель. ДНК прокариот тоже комплексируется с некоторыми негастоновыми белками, образуя нуклеоид,
который гораздо менее устойчив по сравнению с хроматином эукариот (рис. 3.54).
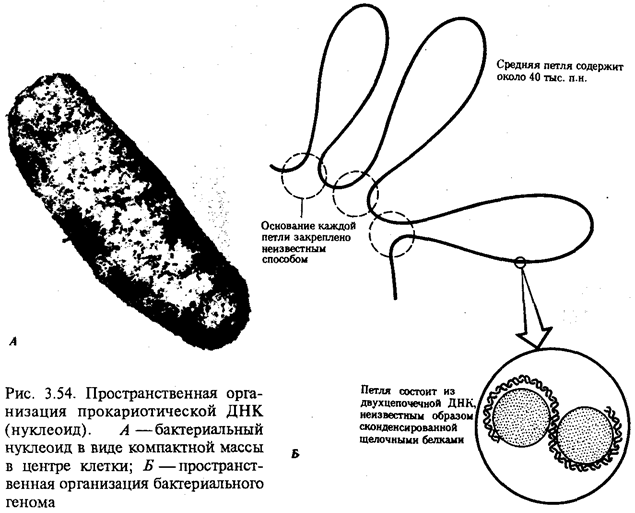
На хромосомном уровне организации, который появляется в процессе эволюции у эукариотических клеток, генетический аппарат должен удовлетворять всем требованиям, предъявляемым к субстрату наследственности и изменчивости: обладать способностью к самовоспроизведению, поддержанию постоянства своей организации и приобретению изменений, которые могут передаваться новому поколению клеток.

Рис. 3.55. Возникновение двунитчатой хромосомы из однонитчатой:
I
— интерфазная хромосома до репликации ДНК,
II
— интерфазная хромосома после репликации ДНК,
III
— метафазная хромосома
Процесс самовоспроизведения — редупликации хромосом осуществляется в период подготовки клетки к митозу — в интерфазе. Вследствие этого в ходе после- дующего деления клетка передает дочернему поколению полноценный комплекс генов, заключенный в каждой отдельной хромосоме. В основе самовоспроизведения хромосомы лежит репликация ДНК с образованием из одной материнской спирали двух дочерних молекул, на базе которых образуются две сестринские хроматиды (рис. 3.55). Благодаря высокой точности репликации ДНК (см. разд. 3.4.2.2 ) сестринские хроматиды несут практически одинаковую информацию, записанную в ее дочерних молекулах. В каждой хроматиде ДНК находится в комплексе с гистонами, и ей присущи все описанные выше уровни компактизации хроматина, свойственные интерфазной клетке.
Таким образом, готовясь к самовоспроизведению, клетка удваивает содержание ДНК в каждой хромосоме. При этом последняя приобретает двунитчатую структуру.
Известны случаи, когда репликация ДНК, причем неоднократная, не сопровождается формированием хроматид на базе дочерних спиралей. При этом образуются так называемые политенные хромосомы,
содержащие многие сотни копий ДНК. Такие хромосомы обнаруживаются, например, в неделящихся клетках слюнных желез личинок некоторых насекомых при обычной световой микроскопии (рис. 3.56).
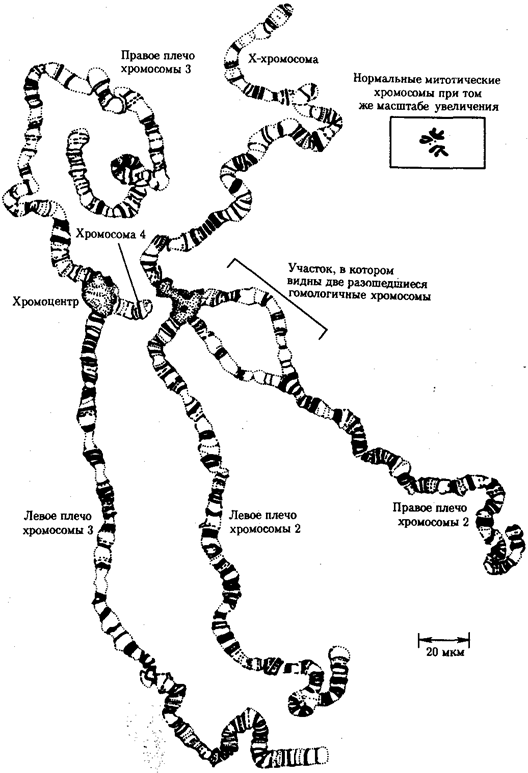
Рис. 3.56. Полный набор политенных хромосом
из клетки слюнной железы дрозофилы
В ходе митотического деления обеспечивается закономерное распределение сестринских хроматид каждой хромосомы между дочерними клетками. В составе дочерних хромосом (бывших сестринских хроматид) каждая клетка нового поколения получает одну из двух молекул ДНК, образовавшихся в результате репликации материнской двойной спирали. Следовательно, новое поколение клеток получает одинаковую генетическую информацию в составе каждой группы сцепления.
Таким образом, процессы, происходящие с хромосомами при подготовке клеток к делению и в самом делении, обеспечивают самовоспроизведение и постоянство их структуры в ряду клеточных поколений (см. разд. 3.6.2.1).
После митоза хромосомы дочерней клетки представлены одной молекулой ДНК, компактно упакованной с помощью белков в одну хроматиновую нить, т.е. имеют такую же структуру, какую имели хромосомы материнской клетки до начала процесса репликации ДНК. Если вновь образованная клетка выбирает путь подготовки к делению, то в ней должны произойти все описанные выше события, связанные с динамикой структурной организации ее хромосом.
Несмотря на эволюционно отработанный механизм, позволяющий сохранять постоянной физико-химическую и морфологическую организацию хромосом в ряду клеточных поколений, под влиянием различных воздействий эта организация может изменяться. В основе изменения структуры хромосомы, как правило, лежит первоначальное нарушение ее целостности — разрывы, которые сопровождаются различными перестройками, называемыми хромосомными мутациями
или аберрациями.
Разрывы хромосом происходят закономерно в ходе кроссинговера, когда они сопровождаются обменом соответствующими участками между гомологами (см. разд. 3.6.2.3). Нарушение кроссинговера, при котором хромосомы обмениваются неравноценным генетическим материалом, приводит к появлению новых групп сцепления, где отдельные участки выпадают — делении —
или удваиваются — дупликации
(рис. 3.57). При таких перестройках изменяется число генов в группе сцепления.
Разрывы хромосом могут возникать также под влиянием различных мутагенных факторов, главным образом физических (ионизирующего и других видов излучения), некоторых химических соединений, вирусов.
128
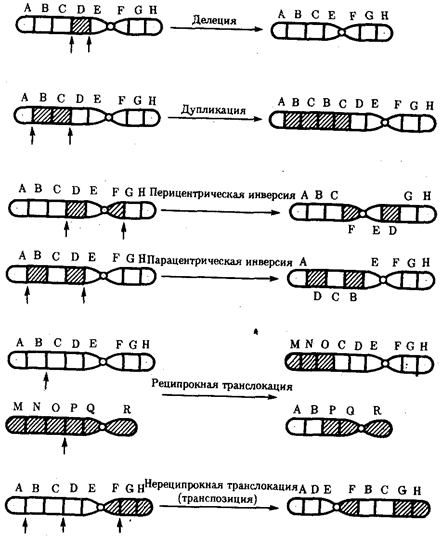
Рис. 3.57. Виды хромосомных перестроек
Нарушение целостности хромосомы может сопровождаться поворотом ее участка, находящегося между двумя разрывами, на 180° — инверсия.
В зависимости от того, включает ли данный участок область центромеры или нет, различают перицентрические
и парацентрические инверсии
(рис. 3.57).
Фрагмент хромосомы, отделившийся от нее при разрыве, может быть утрачен клеткой при очередном митозе, если он не имеет центромеры. Чаще такой фрагмент прикрепляется к одной из хромосом — транслокация.
Нередко две поврежденные негомологичные хромосомы взаимно обмениваются оторвавшимися участками —ре-ципрокная транслокация
(рис. 3.57). Возможно присоединение фрагмента к своей же хромосоме, но в новом месте — транспозиция
(рис. 3.57). Таким образом, различные виды инверсий и транслокаций характеризуются изменением локализации генов.
Хромосомные перестройки, как правило, проявляются в изменении морфологии хромосом, что можно наблюдать в световой микроскоп. Метацентрические хромосомы превращаются в субметацентрические и акроцентрические и наоборот (рис. 3.58), появляются кольцевые и полицентрические хромосомы (рис. 3.59). Особую категорию хромосомных мутаций представляют аберрации, связанные с центрическим слиянием или разделением хромосом, когда две негомологичные структуры объединяются в одну — робертсоновская транслокация,
или одна хромосома образует две самостоятельные хромосомы (рис. 3.60). При таких мутациях не только появляются хромосомы с новой морфологией, но и изменяется их количество в кариотипе.
Рис. 3.58. Изменение формы хромосом
в результате перицентрических инверсий
Рис. 3.59. Образование кольцевых (I
) и полицентрических (II
) хромосом
Рис. 3.60. Хромосомные перестройки, связанные с центрическим слиянием
или разделением хромосом являются причиной изменения числа хромосом
в кариотипе
Рис. 3.61. Петля, образующаяся при конъюгации гомологичных хромосом, которые несут неравноценный наследственный материал в соответствующих участках в результате хромосомной перестройки
Описанные структурные изменения хромосом, как правило, сопровождаются изменением генетической программы, получаемой клетками нового поколения после деления материнской клетки, так как изменяется количественное соотношение генов (при делениях и дупликациях), меняется характер их функционирования в связи с изменением взаимного расположения в хромосоме (при инверсии и транспозиции) или с переходом в другую группу сцепления (при транслокации). Чаще всего такие структурные изменения хромосом отрицательно сказываются на жизнеспособности отдельных соматических клеток организма, но особенно серьезные последствия имеют хромосомные перестройки, происходящие в предшественниках гамет.
Изменения структуры хромосом в предшественниках гамет сопровождаются нарушением процесса конъюгации гомологов в мейозе и их последующего расхождения. Так, делении или дупликации участка одной из хромосом сопровождаются при конъюгации образованием петли гомологом, имеющим избыточный материал (рис. 3.61). Реципрокная транслокация между двумя негомологичными хромосомами приводит к образованию при конъюгации не бивалента, а квадривалента, в котором хромосомы образуют фигуру креста благодаря притягиванию гомологичных участков, расположенных в разных хромосомах (рис. 3.62). Участие в реципрокных транслокациях большего числа хромосом с образованием поливалента сопровождается формированием еще более сложных структур при конъюгации (рис. 3.63).
| 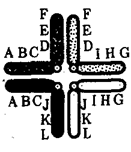
Рис. 3.62. Образование при конъюгации квадривалента из двух пар хромосом, несущих реципрокную транслокацию
|
Рис. 3.63. Образование при конъюгации поливалента шестью парами хромосом, участвующих
в реципрокных транслокациях:
I
— конъюгация между парой хромосом, не несущих транслокацию;
II
— поливалент, образуемый шестью парами хромосом, участвующих
в транслокации
|
В случае инверсии бивалент, возникающий в профазе I мейоза, образует петлю, включающую взаимно инвертированный участок (рис. 3.64).
Конъюгация и последующее расхождение структур, образованных измененными хромосомами, приводит к появлению новых хромосомных перестроек. В результате гаметы, получая неполноценный наследственный материал, не способны обеспечить формирование нормального организма нового поколения. Причиной этой является нарушение соотношения генов, входящих в состав отдельных хромосом, и их взаимного расположения.
Однако, несмотря на неблагоприятные, как правило, последствия хромосомных мутаций, иногда они оказываются совместимыми с жизнью клетки и организма и обеспечивают возможность эволюции структуры хромосом, лежащей в основе биологической эволюции. Так, небольшие по размеру делении могут сохраняться в гетерозиготном состоянии в ряду поколений. Менее вредными, чем делении, являются дупликации, хотя большой объем материала в увеличенной дозе (более 10% генома) приводит к гибели организма.
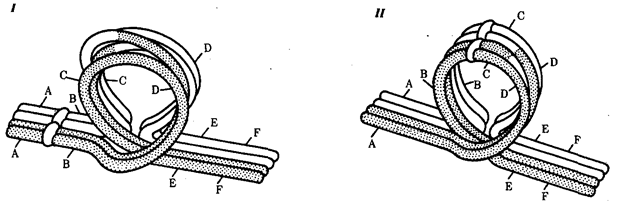
Рис. 3.64. Конъюгация хромосом при инверсиях:
I
— парацентрическая инверсия в одном из гомологов, II
— перидентрическая инверсия в одном из гомологов
Нередко жизнеспособными оказываются робертсоновские транслокации, часто не связанные с изменением объема наследственного материала. Этим можно объяснить варьирование числа хромосом в клетках организмов близкородственных видов. Например, у разных видов дрозофилы количество хромосом в гаплоидном наборе колеблется от 3 до 6, что объясняется процессами слияния и разделения хромосом. Возможно, существенным моментом в появлении вида Homo sapiens
были структурные изменения хромосом у его обезьяноподобного предка. Установлено, что два плеча крупной второй хромосомы человека соответствуют двум разным хромосомам современных человекообразных обезьян (12-й и 13-й —шимпанзе, 13-й и-14-й —гориллы и орангутана). Вероятно, эта человеческая хромосома образовалась в результате центрического слияния по типу робертсоновской транслокации двух обезьяньих хромосом.
К существенному варьированию морфологии хромосом, лежащему в основе их эволюции, приводят транслокации, транспозиции и инверсии. Анализ хромосом человека показал, что его 4, 5, 12 и 17-я хромосомы отличаются от соответствующих хромосом шимпанзе перицентрическими инверсиями.
Таким образом, изменения хромосомной организации, чаще всего оказывающие неблагоприятное воздействие на жизнеспособность клетки и организма, с определенной вероятностью могут быть перспективными, наследоваться в ряду поколений клеток и организмов и создавать предпосылки для эволюции хромосомной организации наследственного материала.
Хромосомный уровень организации наследственного материала обеспечивает в эукариотической клетке не только определенный характер функционирования отдельных генов, тип их наследования, но и регуляцию их активности.
Хромосома как комплекс генов представляет собой эволюционно сложившуюся структуру, свойственную всем особям данного вида. Взаимное расположение генов в составе хромосомы играет немаловажную роль в характере их функционирования. Расположение гена в той или иной хромосоме определяет тип наследования соответствующего признака (см. разд. 6.3.1).
Принадлежность генов к одной хромосоме обусловливает сцепленный характер наследования детерминируемых ими признаков, а расстояние между генами влияет на частоту рекомбинации этих признаков в потомстве (правило Т. Моргана). Расположение генов в разных хромосомах служит основой независимого наследования признаков (закон независимого наследования признаков Г. Менделя).
Образуя в хромосоме устойчивый комплекс с гистонами, ДНК эукариотической клетки оказывается недоступной для других белков, осуществляющих транскрипцию (РНК-полимераза) и выполняющих регуляторные функции (см. разд. 3.6.6.4). У прокариот кольцевая молекула ДНК, формирующая неустойчивый комплекс с негистоновыми белками, остается доступной для белков, активирующих отдельные гены путем прямого взаимодействия с определенными нуклеотидными последовательностями ДНК. Таким образом, гистоны, участвующие в пространственной организации ДНК в хромосоме, регулируют генную активность, угнетая ее.
Процесс транскрипции с участка ДНК эукариотической клетки предполагает необходимость предварительной декомпактизации хроматина путем временного ослабления связи ДНК с этими белками. Примером такой декомпактизации хроматина являются пуфы
(вздутия), наблюдаемые в участках политенных хромосом и соответствующие активно функционирующим генам (рис. 3.65) или обнаруженные в овоцитах амфибий хромосомы типа ламповых щеток,
в которых активные участки ДНК формируют петлеобразные структуры с меньшей степенью компактизации (рис. 3.66).

Рис. 3.66. Хромосомы типа ламповых щеток.
А
—
схема строения; Б
—
хромосомы из овоцита амфибий

Рис. 3.66. Продолжение
Возникновение хромосомной организации наследственного материала в эукариотической клетке тесно связано с большим его объемом по сравнению с прокариотической клеткой. Распределение основной массы генетического материала в ограниченном количестве ядерных структур — хромосом — обеспечивает упорядоченность его пространственной организации по группам сцепления. Относительная самостоятельность хромосом в процессах репликации ДНК и распределения ее молекул между дочерними клетками позволяет закономерно воспроизводить и передавать обширную информацию в ряду клеточных поколений, сохраняя постоянство ее организации. Наконец, распределение генов по группам сцепления допускает возможность рекомбинации генетического материала гомологичных и негомологичных хромосом при мейозе и оплодотворении (см. разд. 3.6.2.3).
Эффективность рекомбинации наследственного материала, возрастающая у эукариот благодаря его хромосомной организации, существенно увеличивает степень комбинативной изменчивости у данных организмов. Это является важным эволюционным фактором, обеспечивающим разнообразный исходный материал для естественного отбора.
Геномом
называют всю совокупность наследственного материала, заключенного в гаплоидном наборе хромосом клеток данного вида организмов. Геном видоспецифичен, так как представляет собой тот необходимый набор генов, который обеспечивает формирование видовых характеристик организмов в ходе их нормального онтогенеза. Например, у некоторых видов появляются гаплоидные организмы, которые развиваются на основе одинарного набора генов, заключенного в геноме. Так, у ряда видов членистоногих гап-лоидными являются самцы, развивающиеся из неоплодотворенных яйцеклеток.
При половом размножении в процессе оплодотворения объединяются геномы двух родительских половых клеток, образуя генотип
нового организма. Все соматические клетки такого организма обладают двойным набором генов, полученных от обоих родителей в виде определенных аллелей. Таким образом, генотип — это генетическая конституция организма, представляющая собой совокупность всех наследственных задатков его клеток, заключенных в их хромосомном наборе — кариотипе.

Рис. 3.67. Кариотипы организмов различных видов:
I
— скерды, II
— дрозофилы. III —
человека
Кариотип —
диплоидный набор хромосом, свойственный соматическим клеткам организмов данного вида, являющийся видоспецифическим признаком и характеризующийся определенным числом, строением и генетическим составом хромосом (рис. 3.67). Ниже приведены количества хромосом соматических клеток некоторых видов организмов.
Если число хромосом в гаплоидном наборе половых клеток обозначить п,
то общая формула кариотипа будет выглядеть как 2п,
где значение п
различно у разных видов. Являясь видовой характеристикой организмов, кариотип может отличаться у отдельных особей некоторыми частными особенностями. Например, у представителей разного пола, имеются в основном одинаковые пары хромосом (аутосомы
),
но их кариотипы отличаются по одной паре хромосом (гетерохромосомы,
или половые хромосомы
).
Иногда эти различия состоят в разном количестве гетерохромосом у самок и самцов (XX или ХО). Чаще различия касаются строения половых хромосом, обозначаемых разными буквами —X и Y (XX или XY).
Каждый вид хромосом в кариотипе, содержащий определенный комплекс генов, представлен двумя гомологами, унаследованными от родителей с их половыми клетками. Двойной набор генов, заключенный в кариотипе,— генотип — это уникальное сочетание парных аллелей генома. В генотипе содержится программа развития конкретной особи.
| Животные
|
Число хромосом
|
| Малярийный плазмодий
Гидра
Таракан
Комнатная муха
Сазан
Окунь
Зеленая лягушка
Голубь
Кролик
Шимпанзе
Человек
|
2
32
48
12
104
28
26
80
44
48
46
|
В основе самовоспроизведения кариотипа в ряду клеточных поколений лежат процессы самоудвоения отдельных хромосом, описанные в разд. 3.5.3.1. Жизнедеятельность клеток как структурно-функциональных единиц живого обеспечивается всей совокупностью получаемого ими генетического материала, поэтому особое значение приобретает поддержание постоянства кариотипа в ряду их поколений. На геномном уровне организации наследственного материала это обеспечивается всей совокупностью процессов, происходящих в митотическом цикле (см. гл. 2).
Рис. 3.68. Образование двуядерных клеток
в результате торможения цитотомии при их делении
Если содержание ДНК в гаплоидном наборе хромосом, т.е. в геноме, является видоспецифическим и соответствует с,
то в диплоидном кариотипе, равном 2n,
оно составляет 2с
. В ходе митотического цикла количество ДНК в клетке изменяется от 2с
(сразу после ее образования, когда хромосомы состоят из одной нити) до 4с
(после репликации ДНК в S-периоде интерфазы, когда хромосомы становятся двунитчатыми). Число хромосом при этом остается неизменным и равным 2n
на протяжении всего митотического цикла. Благодаря описанным ранее процессам, происходящим в ходе интерфазы и последующего митоза (см. гл. 2), дочерние клетки получают от материнской полноценную наследственную программу — генотип, заключенный в кариотипе.
Однако не всегда клетки, удвоившие свой наследственный материал, вступают в митоз. Этим обусловлено существование в тканях некоторого количества клеток с формулой наследственного материала 2я4с, представляющих определенный резерв, готовый немедленно приступить к делению. Наконец, не всегда начавшееся деление заканчивается образованием двух дочерних клеток. Нарушение деления цитоплазмы при нормальном формировании дочерних ядер приводит к образованию двуядерных клеток (рис. 3.68). Разрушение ахромата-нового веретена, делающее невозможным распределение дочерних хромосом между его полюсами, сопровождается появлением полиплоидных клеток (рис. 3.69), в которых 4п дочерних хромосом остаются в одном неразделившемся ядре.
Указанные отклонения от обычного течения митотического цикла являются причиной появления в тканях клеток, несущих больший по объему наследственный материал.
Рис. 3.69. Образование полиплоидньк клеток в результате разрушения веретена деления. А
— различные наборы хромосом (12, 24, 48) в пыльцевых зернах одного из сортов гиацинта; Б —
образование полиплоидных клеток
/—в норме, II—
при разрушении веретена деления колхицином
У организмов, размножающихся бесполым путем, новое поколение появляется из неспециализированных в отношении генеративной функции клеток тела. В основе их самовоспроизведения лежит митоз, обеспечивающий таким образом сохранение постоянной структуры наследственного материала в ряду поколений не только клеток, но и организмов.
| 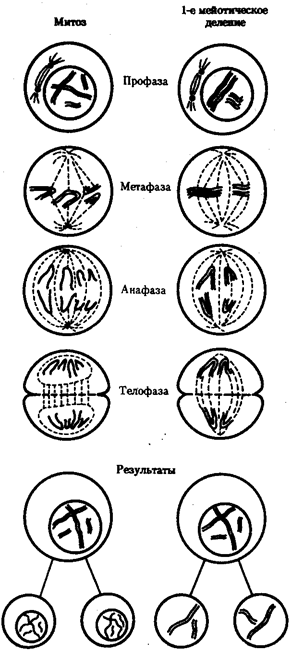
|
Рис. 3.70. Сравнение первого мейотического (редукционного) деления с митозом
Профаза — спирализация хромосом, начало формирования веретена деления; в мейозе, кроме того, происходит конъюгация гомологичных хромосом с образованием бивалентов;
метафаза — в митозе в экваториальной плоскости веретена деления располагаются отдельные хромосомы числом 2n
, в мейоэе в плоскости экватора выстраивается п
бивалеитов;
анафаза —в митозе в результате расщепления центромер дочерние хромосомы (бывшие сестринские хроматиды) расходятся к разным полюсам (по 2n
к каждому полюсу), в мейозе разрушаются бивалеиты и гомологи расходятся к разным полюсам (по одному из каждой лары); формируется гаплоидный набор хромосом;
телофаза—в митозе формируются ядра дочерних клеток, в мейозе телофаза сокращена во времени, так как не происходит полной деспирализации хромосом и клетки сразу переходят ко второму делению.
Результаты митоза — сохранение в дочерних клетках диплоидного набора хромосом (2n
2с
); результаты первого мейотического деления—образование клеток с гаплоидным набором двунитчатых хромосом (п2с
)
|
При половом размножении процесс воспроизведения организмов осуществляется с участием специализированных половых клеток — гамет,
вступающих в оплодотворение.
При оплодотворении наследственный материал двух родительских гамет сливается, образуя генотип организма нового поколения — зиготы.
Чтобы потомки получили соответствующую программу для развития видовых и индивидуальных характеристик, они должны обладать кариотипом, которым располагало предыдущее поколение. В такой ситуации поддержание постоянства кариотипа в ряду поколений организмов достигается предварительным уменьшением вдвое набора хромосом в гаметах, который восстанавливается до диплоидного при их оплодотворении: п + п
= 2n.
Образование гаплоидных гамет осуществляется в ходе гаметогенеза путем особой формы клеточного деления — мейоза.
При мейозе из клеток с диплоидным набором In
образуются гаметы с гаплоидным набором хромосом п
(см. гл. 5). Такой результат достигается благодаря тому, что после однократного удвоения ДНК клетка делится дважды. В отличие от митоза в первом мейотическом делении в результате конъюгации гомологичные хромосомы объединяются в пары — биваленты. Последующее расхождение гомологов к разным полюсам веретена деления приводит к образованию клеток с гаплоидным набором хромосом: 2n
4с
→
п
2с.
На рис. 3.70 представлены особенности первого деления мейоза в сравнении с митозом. В ходе второго мейотического деления сестринские хроматиды каждой хромосомы, как и в митозе, распределяются между дочерними клетками с наследственным материалом пс
(рис. 3.71).
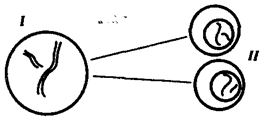
Рис. 3.71. Схема второго (эквационного) деления мейоза:
I — клетка, образованная в результате первого мейотического деления и несущая гаплоидный набор двунитчатых хромосом (n
2c
);
II — клетки, образующиеся после второго деления мейоза и несущие гаплоидный набор однонитчатых хромосом (nc
)
Благодаря особенностям мейоза образуются клетки, несущие полноценный геном, в котором каждая группа сцепления представлена в единственном экземпляре (гаплоидный набор хромосом).
При самооплодотворении гаметы одного и того же родителя, а при перекрестном оплодотворении половые клетки разных организмов взаимодействуют друг с другом. Сперматозоиды, проникая в яйцеклетку, вводят в нее свой ядерный наследственный материал, заключенный в гаплоидном наборе хромосом. Ядра гамет сливаются и формируют диплоидное ядро зиготы, в котором каждая группа сцепления представлена в двойном экземпляре — отцовской и материнской хромосомами.
Таким образом, мейоз и последующее оплодотворение обеспечивают сохранение у нового поколения организмов диплоидного кариотипа, присущего всем особям данного вида.
Мейоз и оплодотворение обеспечивают получение организмами нового поколения эволюционно сложившегося, сбалансированного по дозам генов наследственного материала, на основе которого осуществляется развитие организма и отдельных его клеток. Благодаря этим двум механизмам в ряду поколений особей данного вида формируются определенные видовые характеристики и вид как реальная единица живой природы существует продолжительное время. Однако у разных представителей вида в силу постоянно идущего мутационного процесса один и тот же набор генов генома представлен разными их аллелями. Так как при половом размножении у многих видов в воспроизведении потомства принимают участие две особи, то совершенно очевидно, что в результате оплодотворения разные зиготы получают неодинаковый набор аллелей в их генотипах. Увеличению генотипического разнообразия представителей вида способствуют также механизмы, приводящие к перекомбинации родительских аллелей особи в ее гаметах. Действительно, если бы гаметы, образуемые организмом, были одинаковы по набору аллелей в их геноме, то у потомков одной пары организмов при раздельнополости или одного гермафродитного организма не наблюдалось бы генотипического разнообразия. В каждом новом поколении вида генотипически различными были бы лишь дети разных родителей.
Реально в природе наблюдается разнообразие потомков одних и тех же родителей. Например, родные братья и сестры различаются не только по полу, но и по другим признакам. Такие различия потомков объясняются тем, что в каждом акте оплодотворения встречаются генетически различающиеся гаметы. Механизмом,обеспечивающим разнообразие гамет, образуемых одним и тем же организмом, является мейоз, в ходе которого происходит не только уменьшение вдвое наследственного материала, попадающего в гаметы, но и эффективное перераспределение родительских аллелей между гаметами. Процессами, приводящими к перекомбинации генов и целых хромосом в половых клетках, являются Кроссинговер и расхождение бивалентов в анафазе I мейоза (см. гл. 5).
Кроссинговер.
Этот процесс происходит в профазе I мейоза в то время, когда гомологичные хромосомы тесно сближены в результате конъюгации и образуют биваленты. В ходе кроссинговера осуществляется обмен соответствующими участками между взаимно переплетающимися хроматидами гомологичных хромосом (рис. 3.72). Этот процесс обеспечивает перекомбинацию отцовских и материнских аллелей генов в каждой группе сцепления. В разных предшественниках гамет Кроссинговер происходит в различных участках хромосом, в результате чего образуется большое разнообразие сочетаний родительских аллелей в хромосомах.

Рис. 3.72. Кроссинговер как источник генетического разнообразия гамет:
I — оплодотворение родительских гамет а и б с
образованием зиготы в;
II
—
гаметогенез в организме, развившемся из зиготы в
; г
— кроссинговер, происходящий между гомологами в профазе I
;
д —
клетки, образовавшиеся после 1-го мейотического деления; е, ж —
клетки, образовавшиеся после 2-го деления мейоза (е —
некроссоверные гаметы с исходными родительскими хромосомами; ж —
кроссоверные гаметы с перекомбинацией наследственного материала в гомологичных хромосомах)
Понятно, что кроссинговер как механизм рекомбинации эффективен лишь в том случае, когда соответствующие гены отцовской и материнской хромосом представлены разными аллелями. Абсолютно идентичные группы сцепления при кроссинговере не дают новых сочетаний аллелей.
Кроссинговер происходит не только в предшественницах половых клеток при мейозе. Он наблюдается также в соматических клетках при митозе. Соматический кроссинговер описан у дрозофилы, у некоторых видов плесеней. Он осуществляется в ходе митоза между гомологичными хромосомами, однако его частота в 10 000 раз меньше частоты мейотического кроссинговера, от механизма которого он ничем не отличается. В результате митотического кроссинговера появляются клоны соматических клеток, различающихся по содержанию в них аллелей отдельных генов. Если в генотипе зиготы данный ген представлен двумя разными аллелями, то в результате соматического кроссинговера могут появиться клетки с одинаковыми либо отцовскими, либо материнскими аллелями данного гена (рис. 3.73).
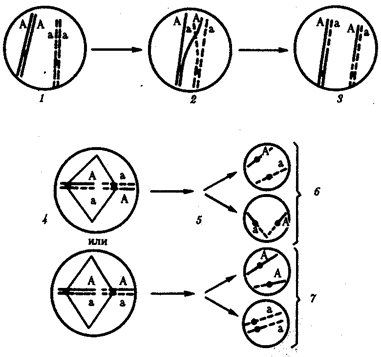
Рис. 3.73. Кроссинговер в соматических клетках:
1
— соматическая клетка, в гомологичных хромосомах которой ген А представлен двумя разными аллелями (А и а); 2 —
кроссинговер; 3 —
результат обмена соответствующими участками между гомологичяыми хромосомами; 4 —
расположение гомологов в плоскости экватора веретена деления в метафазе митоза (два варианта); 5 — образование дочерних клеток; 6 —
образование гетерозитотиых по гену А клеток, сходных с материнской клеткой по набору аллелей (Аа); 7 — образование гомозиготных по гену А клеток, отличающихся от материнской клетки по набору аллелей (АА или аа)
Расхождение бивалентов в анафазе I мейоза.
В метафазе I мейоза в экваториальной плоскости ахромативнового веретена выстраиваются биваленты, состоящие из одной отцовской и одной материнской хромосомы. Расхождение гомологов, которые несут разный набор аллелей генов в анафазе I мейоза, приводит к образованию гамет, отличающихся по аллельному составу отдельных групп сцепления (рис. 3.74).
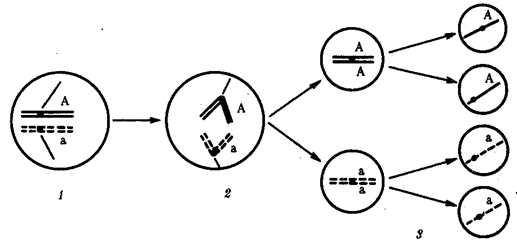
Рис. 3.74. Расхождение гомологичных хромосом в анафазе I мейоза
как источник генетического разнообразия гамет:
1
—метафаза I мейоза (расположение бивалента в плоскости экватора веретена деления); 2 —
анафаза I мейоза (расхождение гомологов, несущих разные аллели гена А к разным полюсам); 3 —
второе мейотическое деление (образование двух типов гамет, различающихся по аллелям гена А)
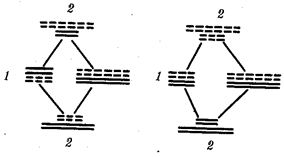
Рис. 3.75. Случайный характер расположения бивалентов в метафазе (1
)
и независимое расхождение их в анафазе (2
) первого мейотического деления
В связи с тем что ориентация бивалентов по отношению к полюсам веретена в метафазе I оказывается случайной, в анафазе I мейоза в каждом отдельном случае к разным полюсам направляется гаплоидный набор хромосом, содержащий оригинальную комбинацию родительских групп сцепления (рис. 3.75). Разнообразие гамет, обусловленное независимым поведением бивалентов, тем больше, чем больше групп сцепления в геноме данного вида. Оно может быть выражено формулой 2n
, где п —
число хромосом в гаплоидном наборе. Так, у дрозофилы п
= 4 и количество типов гамет, обеспечиваемое перекомбинацией родительских хромосом в них, равно 24
= 16. У человека п =
23, и разнообразие гамет, обусловленное этим механизмом, соответствует 223
, или 8388608.
Кроссинговер и процесс расхождения бивалентов в анафазе I мейоза обеспечивают эффективную рекомбинацию аллелей и групп сцепления генов в гаметах, образуемых одним организмом.
Оплодотворение.
Случайная встреча разных гамет при оплодотворении приводит к тому, что среди особей вида практически невозможно появление двух генотипически одинаковых организмов. Достигаемое с помощью описанных процессов генотипическое разнообразие особей предполагает наследственные различия между ними на базе общего видового генома.
Таким образом, геном как высший уровень организации наследственного материала благодаря мейозу и оплодотворению сохраняет свои видовые характеристики. Но одновременно эти же процессы обеспечивают индивидуальные наследственные различия особей, в основе которых лежит рекомбинация генов и хромосом, т.е. комбинативную изменчивость.
Комбинативная изменчивость, проявляющаяся в генотипическом разнообразии особей, повышает выживаемость вида в изменяющихся условиях его существования.
Рассмотренные выше механизмы рекомбинации наследственного материала (кроссинговер, расхождение гомологичных хромосом и независимое поведение негомологичных хромосом в анафазе I мейоза, оплодотворение) при закономерном их течении обусловливают комбинативную изменчивость, но не изменяют общей структуры генома как видовой характеристики. Эволюционно сложившаяся у данного вида сбалансированность по дозам отдельных генов, распределение этих генов по группам сцепления остаются стабильной характеристикой генома каждого вида. Однако как на генном и хромосомном уровнях организации наследственного материала, так и на геномном уровне он способен приобретать мутационные изменения. Эти изменения могут использоваться как эволюционный материал. При этом ускоренные темпы эволюционного процесса, наблюдаемые на отдельных этапах исторического развития, как правило, бывают обусловлены не столько накоплением генных мутаций, сколько существенными изменениями структуры именно всего генома. К последним относятся изменения дозового соотношения различных генов и изменение состава групп сцепления внутри генома.
Причиной структурных изменений генома может быть нарушение тех процессов, которые в норме обеспечивают его устойчивость, в первую очередь процессов, протекающих в мейозе.
Так, нарушение кроссинговера, приводящее к обмену неравноценными участками ДНК между хроматидами, может привести к утрате или удвоению определенной нуклеотидной последовательности в них. Если это затрагивает структуру отдельного гена, то возможно возникновение генной мутации с изменением количества нуклеотидов в нем (см. разд. 3.4.2.3). Если при неравноценном обмене затронут участок хроматиды, содержащий несколько генов, изменяется доза этих генов в геноме. Он либо лишается каких-то генов (деления), либо эти гены оказываются в геноме в двойном количестве (дупликапия). Изменение дозового соотношения отдельных генов наблюдается также при разных видах хромосомных перестроек, не обязательно связанных с неравноценным кроссинговером (см. разд. 3.5.3.3).
Нарушение расхождения бивалентов в анафазе I мейоза является причиной изменения количества хромосом в гаплоидном наборе гамет. Нерасхождение отдельного бивалента приводит к появлению одной гаметы, лишенной данной хромосомы, и другой, имеющей эту группу сцепления в двойном количестве (рис. 3.76). Оплодотворение таких гамет нормальными половыми клетками приводит к появлению особей, в кариотипе которых изменено общее число хромосом за счет уменьшения (моносомия) или увеличения (трисомия) числа отдельных хромосом. Нарушения структуры генома, заключающиеся в изменении количества отдельных хромосом, называют анэуплоидией.
Рис. 3.76. Нарушение расхождения отдельных бивалентов (1
, 2, 3
) в мейозе
как причина возникновения анэуплоидий:
А —
метафаза 1 мейоза; Б —
образование аномальных гамет в результате нарушения расхождения 3-го бивалента в анафазе I мейоза; В —
оплодотворение аномальных гамет нормальными гаметами другого пола; Г —
образование зигот с анэуплоидным кариотипом (моносомия или трисомия по 3-й хромосоме, соответственно сверху и снизу)
В том случае, если в целом повреждается механизм распределения гомологичных хромосом между полюсами веретена (что наблюдается при его разрушении), клетка остается неразделившейся. Во второе деление мейоза она вступает не гаплоидной, а диплоидной. Из нее образуются диплоидные гаметы. Оплодотворение таких гамет приводит к образованию триплоидных организмов. Увеличение в кариотипе зиготы числа наборов хромосом называют полиплоидией.
Такие структурные изменения наследственного материала довольно часто встречаются в природе у растений, что обеспечивает у них относительно быстрые темпы видообразования. Полиплоидизацию путем искусственного разрушения веретена деления с помощью колхицина широко применяют в селекции при выведении новых сортов растений.
Структурные изменения генома могут выражаться в ином распределении генов по группам сцепления. Когда отдельные хромосомы соединяются по типу робертсоновской транслокации или, наоборот, из одной хромосомы образуются две самостоятельные, это ведет к изменению числа групп сцепления в геноме (см. разд. 3.5.3.3). При реципрокных транслокациях между негомологичными хромосомами или при инверсиях изменяется место положения отдельных генов, что нередко сказывается на характере их функционирования (эффект положения
).
Любые мутационные изменения в наследственном материале гамет —генеративные мутации —
становятся достоянием следующего поколения, если такие гаметы участвуют в оплодотворении. Поэтому отклонения в течении митоза или мейоза в клетках-предшественницах гамет имеют большое эволюционное значение. Если же мутации любого ранга (генные, хромосомные или геномные) возникают в соматических клетках — соматические мутации —
они передаются только потомкам этих клеток, т.е. не выходят за пределы данного организма. Исключение составляют соматические мутации, возникшие в клетках органов вегетативного размножения, от которых они передаются новому поколению организмов. Одной из причин соматических мутаций являются патологические митозы. При нарушении нормального течения митоза (нерасхождение хроматид отдельных хромосом, многополюсные митозы и т.д.) дочерние клетки получают аномальную наследственную программу и их дальнейшее развитие отклоняется от нормы. Патологические митозы часто наблюдаются в клетках злокачественных опухолей.
Таким образом, несмотря на существование механизмов, обеспечивающих стабильность структуры генома, на этом уровне организации наследственного материала могут появляться эволюционно значимые изменения. Они способны обеспечить достаточно резкий скачок в ходе исторического развития живой природы.
Геном современных прокариотических клеток характеризуется относительно небольшими размерами. У кишечной палочки (Е.
coli
) он представлен кольцевой молекулой ДНК длиной около 1 мм, которая содержит 4·106
пар нуклеотидов, образующих около 4000 генов. Основная масса ДНК прокариот (около 95%) активно транскрибируется в каждый данный момент времени. Как было сказано выше, геном прокариотической клетки организован в виде нуклеоида — комплекса ДНК с негистоновыми белками (см. разд. 3.5.2.4).
У эукариот объем наследственного материала значительно больше. У дрожжей он составляет 2,3 · 107
п.н., у человека общая длина ДНК в диплоидном хромосомном наборе клеток — около 174 см. Его геном содержит 3·109
п.н. и включает по последним данным 30—40 тыс. генов.
У некоторых амфибий и растений геном характеризуется еще большими размерами, достигающими 1010
и 1011
п. н. В отличие от прокариот в эукариотических клетках одновременно активно транскрибируется от 1 до 10% ДНК. Состав транскрибируемых последовательностей и их количество зависят от типа клетки и стадии онтогенеза. Значительная часть нуклеотидных последовательностей у эукариот не транскрибируется вообще — молчащая ДНК.
Большой объем наследственного материала эукариот объясняется существованием в нем помимо уникальных также умеренно и высоко повторяющихся последовательностей. Так, около 10% генома мыши составляют тандемно расположенные (друг за другом) короткие нуклеотидные последовательности, повторенные до 106
раз. Эти высоко повторяющиеся последовательности ДНК располагаются в основном в гетерохроматине, окружающем центромерные участки. Они не транскрибируются. Около 20% генома мыши образовано умеренными повторами, встречающимися с частотой 103
—105
раз. Такие повторы распределены по всему геному и транскрибируются в РНК. К ним относятся гены, контролирующие синтез гистонов, тРНК, рРНК и некоторые другие. Остальные 70% генома мыши представлены уникальными нуклеотидными последовательностями. У растений и амфибий на долю умеренно и высоко повторяющихся последовательностей приходится до 60% генома.
Избыточность генома эукариот объясняется также экзон-интронной организацией большинства эукариотических генов, при которой значительная часть транскрибированной РНК удаляется в ходе следующего за синтезом процессинга и не используется для кодирования аминокислотных последовательностей белков (см. разд. 3.4.3.2).
В настоящее время окончательно не выяснены функции молчащей ДНК, которая составляет значительную часть генома, реплицируется, но не транскрибируется. Высказывают предположения об определенном значении такой ДНК в обеспечении структурной организации хроматина (см. разд. 3.5.2.2). Некоторая часть нетранскрибируемых нуклеотидных последовательностей, очевидно, участвует в регуляции экспрессии генов (см. разд. 3.6.6).
Характеризуя наследственный материал прокариотической клетки в целом, необходимо отметить, что он заключен не только в нуклеоиде, но также присутствует в цитоплазме в виде небольших кольцевых фрагментов ДНК — плазмид.
Плазмиды —
это широко распространенные в живых клетках внехромосомные генетические элементы, способные существовать и размножаться в клетке автономно от геномной ДНК. Описаны плазмиды, которые реплицируются не автономно, а только в составе геномной ДНК, в которую они включаются в определенных участках. В этом случае их называют эписомами.
В прокариотических (бактериальных) клетках обнаружены плазмиды, которые несут наследственный материал, определяющий такие свойства, как способность бактерий к конъюгации, а также их устойчивость к некоторым лекарственным веществам.
В эукариотических клетках внехромосомная ДНК представлена генетическим аппаратом органелл — митохондрий и пластид, а также нуклеотидными последовательностями, не являющимися жизненно необходимыми для клетки (вирусоподобными частицами). Наследственный материал органелл находится в их матриксе в виде нескольких копий кольцевых молекул ДНК, не связанных с гистонами. В митохондриях, например содержится от 2 до 10 копий мтДНК.
Внехромосомная ДНК составляет лишь небольшую часть наследственного материала эукариотической клетки. Например, мтДНК человека содержит 16569 п.н. и на её долю приходится менее 1% всей клеточной ДНК.
В отличие от хромосомной ДНК, мтДНК характеризуется высокой «плотностью генов». В них нет интронов, а межгенные промежутки невелики. В кольцевой мтДНК человека содержится 13 генов, кодирующих белки (3 субъединицы цитохром С-оксидазы, 6 компонентов АТФазы и др.) и 22 гена тРНК. Значительная часть белков митохондрий и пластид синтезируется в цитоплазме под контролем геномной ДНК.
Если большинство ядерных генов представлены в клетках организма в двойной дозе (аллельные гены), то митохондриальные гены представлены многими тысячами копий па клетку.
Для генома митохондрий характерны межиндивидуальные различия, но в клетках одного индивида, как правило, мтДНК идентична.
Совокупность генов, расположенных в цитоплазматических молекулах ДНК, называют плазмоном.
Он определяет особый тип наследования признаков — цитоплазматическое наследование (см. разд. 6.3.2.).
Общие принципы организации наследственного материала, представленного нуклеиновыми кислотами, а также принципы записи генетической информации у про- и эукариот свидетельствуют в пользу единства их происхождения от общего предка, у которого уже была решена проблема самовоспроизведения и записи информации на основе репликации ДНК и универсальности генетического кода. Однако геном такого предка сохранял большие эволюционные возможности, связанные с развитием надмолекулярной организации наследственного материала, разных путей реализации наследственной информации и регуляции этих процессов.
Многочисленные указания на различия в организации генома, деталях процессов экспрессии генов и механизмов ее регуляции у про- и эукариот (см. §3.4; 3.5; 3.6) свидетельствуют в пользу эволюции названных типов клеток по разным направлениям после их дивергенции от общего предка.
Существует предположение, что в процессе возникновения жизни на Земле первым шагом явилось образование самовоспроизводящихся молекул нуклеиновых кислот, не несущих первоначально функции кодирования аминокислот в белках. Благодаря способности к самовоспроизведению эти молекулы сохранялись во времени. Таким образом, первоначальный отбор шел на способность к самосохранению через самовоспроизведение.
В соответствии с рассмотренным предположением позднее некоторые участки ДНК приобрели функцию кодирования, т.е. стали структурными генами, совокупность которых на определенном этапе эволюции составила первичный генотип. Экспрессия возникших кодирующих последовательностей ДНК привела к формированию первичного фенотипа, который оценивался естественным отбором на способность выживать в конкретной среде.
Важным моментом в рассматриваемой гипотезе является предположение о том, что существенным компонентом первых клеточных геномов была избыточная ДНК,
способная реплицироваться, но не несущая функциональной нагрузки в отношении формирования фенотипа. Предполагают, что разные направления эволюции геномов про- и эукариот связаны с различной судьбой этой избыточной ДНК предкового генома, который должен был характеризоваться достаточно большим объемом. Вероятно, на ранних стадиях эволюции простейших клеточных форм у них еще не были в совершенстве отработаны главные механизмы потока информации (репликация, транскрипция, трансляция). Избыточность ДНК в этих условиях создавала возможность расширения объема кодирующих нуклеотидных последовательностей за счет некодирующих, обеспечивая возникновение многих вариантов решения проблемы формирования жизнеспособного фенотипа.
По мере совершенствования и повышения надежности главных механизмов потока информации значение избыточной ДНК в повышении выживаемости организмов снижалась. В такой ситуации одним из возможных направлений изменения генома было уменьшение его размеров
за счет утраты некодирующих нуклеотидных последовательностей. Именно так можно представить эволюционный путь, пройденный геномом современных прокариот. Одновременно в качестве механизмов, поддерживающих выживаемость этих форм, в историческом развитии закреплялось свойственное им короткое время генерации,
т.е. интенсивное размножение и быстрая смена поколений (кишечная палочка делится каждые 20 мин). Перечисленные особенности хорошо сочетаются с гаплоидностью прокариот, что приводит к воспроизведению в фенотипе любой мутации.
Экспрессия 95% ДНК, относительно малые размеры генома, гаплоидность, проявление в фенотипе практически каждой мутации в сочетании с коротким временем генерации обусловливают высокую приспособленность. Вместе с тем для прокариотического типа организации не свойственны обширные и разнообразные изменения структуры. Вследствие этого описанное направление эволюции, обеспечивая высокую способность к выживанию (прокариоты существуют на Земле около 3,5 млрд. лет), является тупиковым в плане прогрессивной эволюции живых существ.
В отличие от изменений прокариотического генома преобразования генома в эволюции эукариот связаны с нарастающим увеличением количества ДНК.
Это увеличение наблюдается в процессе прогрессивной эволюции эукариот (см. рис. 1.2 и разд. 3.6.3). На фоне такого увеличения большая часть ДНК является «молчащей», т.е. не кодирует аминокислот в белках или последовательностей нуклеотидов в рРНК и тРНК. Даже в пределах одного гена молчащие (интроны) и кодирующие (экзоны) участки могут перемежаться. В составе ДНК обнаруживаются высоко и умеренно повторяющиеся последовательности. Вся масса ДНК распределена между определенным числом специализированных структур —хромосом. Хромосомы в отличие от нуклеоида прокариот имеют сложную химическую организацию. Эукариоты в большинстве случаев диплоидны. Время генерации у них значительно больше, чем у прокариот. Отмечаемые особенности, оформившиеся в ходе эволюции генома эукариот, допускают широкие структурные изменения и обеспечивают не только адаптивную (приспособительную), но и прогрессивную эволюцию.
Среди перечисленных выше моментов увеличение размеров генома в эволюции эукариот привлекает особое внимание. Этот процесс может осуществляться различными способами. Наиболее резко размер генома изменяется в результате полиплоидизации,
которая достаточно широко распространена в природе. Она заключается в увеличении количества ДНК и хромосом, кратном гапловдному. Достигаемое в результате состояние полиплоидии приводит к увеличению дозы всех генов и создает избыток «сырого» генетического материала, который впоследствии видоизменяется в результате мутаций и отбора.
По-видимому, в ходе эволюции в результате накопления мутаций и дивергенции нуклеотидных последовательностей полиплоидизация сопровождалась переходом к диплоидному состоянию. Само по себе увеличение дозы генов еще не означает достижения однозначно положительного биологического результата. Об этом свидетельствует развитие в эволюции эукариот механизмов компенсации возрастающей дозы генов в ходе их экспрессии путем сокращения времени жизни в клетках зрелой РНК. Так, у тетраплоидных карповых рыб в ответ на увеличение дозы генов рРНК в молекулах рРНК соматических клеток возникают скрытые внутренние разрывы, которые приводят к преждевременному их старению и сокращению содержания в цитоплазме.
Если бы увеличение объема генома происходило только в результате полиплоидизации, то в природе должно было бы наблюдаться скачкообразное изменение его размеров. На самом деле этот процесс демонстрирует плавное увеличение содержания ДНК в геноме. Это позволяет допустить возможность других механизмов, изменяющих его объем.
Действительно, некоторое значение в определении размера генома имеют хромосомные перестройки,
сопровождающиеся изменением содержания ДНК в них, такие, как дупликации, делении и транслокации. Они обусловливают повторение, утрату некоторых последовательностей в составе хромосомы или перенос их в другие хромосомы.
Важным механизмом увеличения объема генома является амплификация
нуклеотидных последовательностей, которая заключается в образовании их копий, что приводит к возникновению повторяющихся участков ДНК. Особенностью генома эукариот является наличие таких повторов в большом количестве, свидетельствующее о существенном вкладе механизма амплификации в увеличение размеров наследственного материала. Амплифицированные последовательности образуют семейства, в которых они собраны вместе (тандемная организация) или же распределяются по разным хромосомам. Конкретные изменения, приводящие,, к амплификации, бывают различными. Появление тандемов повторяющихся последовательностей объясняется, например, неравным кроссинговером, вследствие которого возникают многократные дупликации отдельных участков ДНК. Возможна амплификация путем вырезания фрагмента с последующей его репликацией вне хромосомы и встраиванием копий в другие хромосомы. Предполагают также амплификацию, осуществляемую путем «обратной транскрипции» ДНК на РНК с участием фермента обратной транскриптазы с последующим встраиванием копий ДНК в различные локусы хромосом.
Во всех случаях амплификация некоторой последовательности приводит к возникновению в геноме более или менее многочисленных повторов и способствует некратному увеличению его объема. Наличие таких повторов в сочетании с мутационным процессом является предпосылкой дивергентной эволюции однотипных последовательностей в пределах семейства с соответствующим изменением свойств кодируемых белков или РНК.
Ярким примером эволюционной судьбы амплифицированных нуклеотидных последовательностей являются семейства глобиновых генов, широко распространенных в природе у видов разных уровней организации. У высших позвоночных известен ряд глобиновых генов, контролирующих синтез полипептидов гемоглобина. У человека в геноме имеется восемь активных глобиновых генов, образующих два семейства (см. рис. 6.5). Семейство генов, определяющих синтез α-глобинов, содержит ξ1-глобиновый ген, активно функционирующий в эмбриогенезе, и два α-глобиновых гена, которые экспрессируются у плода и взрослого человека. Это семейство генов располагается в 16-й хромосоме в следующем порядке: 5'—ξ2
—ψξ1
—α2
—α1
—3'. Семейство генов, определяющих синтез β-глобинов, расположенное в 11-й хромосоме, содержит ε-глобиновый ген эмбриона, два сходных γ-глобиновых гена плода GγAγ малый δ- и большой β-глобиновые гены взрослых: 5' — ε —Gγ —
Aγ — δ — β — 3'.
Изучение гомологии продуктов указанных генов и генов миоглобина у разных видов организмов позволило предположить общность происхождения этих семейств. Вероятно, около 1100 млн. лет назад произошла дупликация гена-предшественника, давшая начало гемоглобиновым и миоглобиновым генам. Позднее, около 500 млн. лет назад, на ранней стадии эволюции позвоночных произошла дупликация, давшая начало двум (α и β) семействам глобиновых генов, сопровождавшаяся транслокацией. Примерно 200 млн. лет назад очередная дупликация привела к возникновению в семействе β-глобиновых генов генов β-глобинов плодов и взрослых. Около 100 млн. лет назад произошло образование ε- и γ-глобиновых генов и, наконец, 40 млн. лет назад появились δ- и β-глобиновые гены.
Семейства α- и β-глобиновых генов организованы в генные кластеры, возникшие, вероятно, в результате тандемной дупликации генов. В составе указанных кластеров наряду с активно функционирующими на разных стадиях онтогенеза генами обнаружены неактивные, или псевдогены.
Последние возникли, вероятно, в результате появления в них изменений, несовместимых с врзможностью их экспрессии. В семействе β-глобиновых генов содержится два псевдогена: ψβ1
и ψβ2
. В α-семействе имеются ψξ1
и ψξ2
псевдогены.
Дивергенция амплифицированных последовательностей с образованием разных генов или их семейств обусловлена накоплением в них различных изменений в виде замен оснований или других генных мутаций. О гомологии глобиновых генов обоих семейств свидетельствует наличие во всех активных глобиновых генах позвоночных двух интронных участков, занимающих в них строго одинаковое положение. Такую же организацию имеют и псевдогены ψα1
человека, ψα2
у кролика. Однако в ψα3
-псевдогене мыши в ходе эволюции оба интрона оказались точно вырезанными.
Результатом амплификации небольших последовательностей ДНК в пределах функциональной единицы является удлинение гена, при котором из простых генов могут возникать более сложные. Это может происходить за счет тандемных дупликации. Например, в генах, кодирующих вариабельные участки иммуноглобулинов мыши, последовательности из 600 п.н. образуются в результате 12 тандемных повторов исходной предковой последовательности в 48 п.н. Другим примером удлинения гена посредством тандемных дупликации служит ген коллагена α2
, который у курицы состоит из 34 000 п.н. и содержит больше 50 экзонов. Длина таких участков во всех случаях кратна девяти нуклеотидным парам. Эволюция этих экзонов, очевидно, шла от гипотетического исходного строительного блока длиной в 54 пары нуклеотидов.
Таким образом, амплификация нуклеотидных последовательностей, происходившая в процессе эволюции генома, обеспечивала не только его количественное увеличение, появление семейств генов, но и создавала предпосылки для накопления в них изменений, дивергенции генов, увеличения разнообразия контролируемых ими продуктов.
Определенная роль в эволюции геномов как про-, так и эукариотических клеток принадлежит так называемым подвижным генетическим элементам —
транспозонам. Они представляют собой автономные единицы, несущие в нуклеотидной последовательности информацию о структуре особых белков, которые обеспечивают их способность к перемещению из одного участка генома в другой. Такое перемещение — транспозиция —
может происходить в строго определенные участки хромосом, узнаваемые этими специфическими белками. Транспозиция предполагает репликацию нуклеотидной последовательности подвижного генетического элемента и встраивание копии в ДНК-мишень с сохранением другой копии в прежнем месте.
Установлена также способность подвижных генетических элементов к точному вырезанию и удалению их из хромосомы. Перемещение таких нуклеотидных последовательностей в пределах генома может влиять на регуляцию экспрессии генов, которые прилежат к месту встраивания этих элементов. В результате таких перемещений могут активироваться ранее не активные гены, и наоборот.
Обнаружение подвижных генетических элементов в геномах как про-, так и эукариот указывает на определенные эволюционные преимущества, связанные с их наличием в наследственном материале. Возможно, рекомбинационные процессы, обеспечиваемые подвижными генетическими элементами, имеют немаловажное значение в структурной эволюции генома.
Наряду с транспозонами, не способными очевидно, существовать вне генома и образовывать свободные молекулы ДНК, описаны элементы, обнаруживаемые как в составе генома, так и вне его. Существование таких подвижных элементов дает возможность обсуждать роль горизонтального переноса генетического материала
в эволюции генома.
Если описанные выше изменения структуры генома передаются из поколения в поколение организмов одного и того же вида, т.е. по вертикали, то горизонтальный перенос генетической информации может происходить и между организмами разных видов, одновременно существующими на Земле. В настоящее время доказана возможность изменения наследственных свойств у бактерий путем введения в бактериальную клетку чужеродной ДНК при конъюгации или с помощью фагов. Оказывается, чужеродную ДНК можно ввести и в эукариотическую клетку, где она будет сохраняться как внехромосомный элемент или интегрироваться в геном и экспрессироваться.
Недавно получены данные, свидетельствующие о том, что гены могут переходить от одного эукариотического организма к другому и даже от эукариот к прокариотам, хотя это происходит крайне редко. Примером могут служить данные о несовпадении скоростей эволюции отдельных последовательностей генов гистонов у некоторых видов морских ежей. Это можно объяснить относительно поздним по сравнению с временем дивергенции этих видов горизонтальным переносом указанных последовательностей, проявляющих большее сходство, чем этого можно было ожидать.
Другим примером является более высокая гомология фермента супероксиддисмутазы у рыбы семейства сребробрюшковых и ее бактериального симбионта, чем у последнего и других прокариот. Объяснением такого сходства может служить горизонтальный перенос гена, кодирующего этот фермент от рыбы-хозяина к бактерии-симбионту.
Вероятно, ведущая роль в горизонтальном переносе генетической информации принадлежит вирусам. В настоящее время широко обсуждается роль ретровирусов, наследственный материал которых представлен молекулой РНК, в перенесении информации
от клетки к клетке. Включая в свой геном мРНКэукариотической клетки-хозяина, вирус затем переносит ее в другую клетку, где происходит обратная транскрипция. ДНК, синтезированная на матрице РНК вируса, включается в геном новой клетки-хозяина, неся в себе информацию от предыдущего хозяина, и начинает работать в ней, обеспечивая этой клетке новые наследственные свойства.
Данных по горизонтальному переносу генов еще очень мало, и они не являются бесспорными, поскольку не исключены и другие объяснения. Если же такой перенос имеет место, то это означает, что существуют пути эволюции, считавшиеся невозможными для эукариот. В любом случае подобное явление происходит крайне редко, так как необходимость взаимного приспособления генов в геноме ограничивает возможность встраивания в него чужеродных функциональных последовательностей.
У организмов, размножающихся половым путем, генотип формируется в результате слияния геномов двух родительских половых клеток. Он представляет собой двойной набор генов, заключенных в геноме данного вида. Так как при каждом акте оплодотворения взаимодействующие гаметы несут определенные и часто разные аллели генов, генотип каждого отдельного организма представляет собой оригинальный двойной набор аллелей генов. Таким образом, гены, представленные в геноме уникальными нуклеотидными последовательностями, в генотипе присутствуют в двойной дозе.
Однако многие гены, особенно у эукариот, в результате амплификации присутствуют в геноме в виде нескольких копий (гены гистонов, тРНК, рРНК). Они занимают разное место в геноме, но определяют возможность развития одного и того же признака. Такие нуклеотидные последовательности присутствуют в генотипе в виде многих двойных доз.
Наконец, так как геномы гамет разного пола отличаются друг от друга по набору генов, заключенных в половых хромосомах, в генотипе встречаются гены, представленные лишь одной дозой. Например, у некоторых видов два пола имеют разное число гетерохромосом — XX или ХО. Следовательно, генотипы особей гетерогаметного пола ХО содержат гены Х-хромосомы не в двойной, а в единственной дозе.. Чаще два пола различаются по набору гетерохромосом XX или XY. Ввиду того что морфология этих хромосом различна и одна из них часто крупнее, многие гены имеются лишь в одной гетерохромосоме и отсутствуют или неактивны в другой. В результате в генотипе особей гетерогаметного пола XY гены, расположенные в негомологичных участках Х- и Y-хромосом, встречаются в одной дозе.
Рис. 3.77. Наличие и отсутствие полового хроматина в ядрах клеток
слизистой рта женщины (♀) и мужчины (♂)
У женщин половой хроматин (тельце Барра) имеет вид темного тельца (отмечено стрелкой), располагающегося у оболочки ядра
Таким образом, сформировавшийся в процессе эволюции геном каждого отдельного вида представляет собой совокупность генетических единиц, представленных в нем в строго определенных дозах. В результате и генотипы особей и их клеток — сбалансированные по дозам генов системы.
Значение поддержания определенного дозового соотношения генов в генотипе для формирования видовых характеристик подтверждается возникшим в процессе эволюции механизмом инактивации одной из Х-хромосом у гомогаметного пола XX. Это приводит дозу активно функционирующих Х-генов у данного пола в соответствие с их дозой у гетерогаметного пола ХО или XY.
У млекопитающих гомогаметным является женский пол XX, а гетерогаметным —мужской XY. У мышей такая инактивация происходит на 3—6-е сутки эмбрионального развития. У человека на 16-е сутки во всех клетках женского эмбриона одна из Х-хромосом образует тельце полового хроматина (тельце Барра), которое может быть обнаружено вблизи ядерной мембраны интерфазных клеток в виде хорошо окрашивающегося гетерохроматинового образования (рис. 3.77).
Ввиду того что гены, расположенные в инактивированной Х-хромосоме, не функционируют, в генотипе каждой клетки организма гомогаметного пола в диплоидном наборе остальных генов экспрессируется лишь одна доза Х-генов. Так как инактивация Х-хромосомы происходит, когда организм уже представляет собой многоклеточное образование и выключаться может любая из двух Х-хромосом, клетки такого организма образуют мозаику, в которой экспрессируются разные аллели Х-генов (рис. 3.78, 3.79).
Рис. 3.78. Клональное наследование инакгивированной Х-хромосомы
в клетках женского организма:
ХМ
, ХО
— материнская и отцовская Х-хромосомы
Феномен инактивации хромосомы Х в клетках женского организма на самом деде является более тонким фактором регуляции соотношения доз определенных генов, требуемого для воспроизведения нормального фенотипа. Так, процесс сперматогенеза блокируется, если на известной его стадии в клетках гаметогенной линии не инактивируется единственная (!) в мужском кариотипе хромосома X. Об этом свидетельствует бесплодие лиц мужского пола с синдромом Дауна (трисомия по хромосоме 21). В данном случае, как предполагают, требуемой инактивации препятствует конъюгация «лишней» хромосомы 21 с комплексом X-Y в пахитене профазы I мейоза. С другой стороны, при синдроме Шерешевского—Тернера (кариотип 46, Х0, фенотип женского типа) больные бесплодны вследствие дегенерации тканей яичников. Считают, что нормальное развитие яйцеклеток требует на определенной стадии овогенеза активности генов обеих хромосом X.
Нарушение дозовой сбалансированности генотипа организма (клетки) сопровождается, как правило, различными отклонениями в развитии. Примером служат нарушения развития организма при хромосомных перестройках, когда доза генов изменяется в результате отрыва и утраты или перемещения фрагмента хромосомы, а также при изменении количества хромосом в кариотипе (анэуплоидия или полиплоидия) (см. 4.2.2.). Таким образом, неблагоприятные последствия хромосомных и геномных мутаций обусловлены в первую очередь нарушением дозовой сбалансированности генов в генотипе.
Отрицательные последствия нарушения дозового баланса связаны с тем, что генотип представляет собой не простую сумму отдельных генов. Гены в генотипе объединены в систему благодаря сложным и разнообразным взаимодействиям между ними, которые играют немаловажную роль в реализации информации, заключенной в каждом отдельном гене.
Взаимодействие аллельных генов.
Постоянно возникающие разнообразные изменения структуры генов обусловливают явление множественного аллелизма (см. разд. 3.4.2.4), поэтому взаимодействующие при оплодотворении гаметы часто несут в своих геномах разные аллели одного и того же гена. В связи с этим генотип нового организма является гетерозиготным по многим локусам, т.е. его аллельные гены,
расположенные в соответствующих участках гомологичных хромосом и пришедшие от обоих родителей, представлены разными аллелями — А и А', В и В' С и С' и т.д. Если аллельные гены представлены одинаковыми аллелями, т.е. находятся в гомозиготном
состоянии (АА или A'A', BB или B'B', CC или С'С'), то развивается соответствующий данному аллелю вариант признака. В случае гетерозиготности
(АА', BB', CC') развитие данного признака (А, В или С) будет зависеть от взаимодействия аллельных генов.
Доминирование —
это такое взаимодействие аллельных генов, при котором проявление одного из аллелей (А) не зависит от присутствия в генотипе другого аллеля (А') и гетерозиготы АА' фенотипически не отличаются от гомозигот по этому аллелю (АА). Такая ситуация наблюдается, например, когда один из аллелей гена А («дикий») способен обеспечить формирование определенного варианта признака (синтез пептида с определенными свойствами), а другой А'—не обладает такой способностью. Наличие в генотипе АА' единственного нормального аллеля А приводит к формированию нормального признака. Этот аллель выступает как доминантный
в данном гетерозиготном генотипе. Присутствие другого аллеля (А') фенотипически не проявляется, поэтому его называют рецессивным.
Примером доминирования одного из алледей в гетерозиготном генотипе может служить определение групповой принадлежности крови у человека по системе АВ0. Генотипы, содержащие аллель IA
либо в гомозиготном состоянии, либо в сочетании с аллелем I0
(IA
IA
или IA
I0
), определяют развитие у человека второй группы крови (группа крови А). Такая же ситуация наблюдается и в отношении аллеля IB
, обусловливающего формирование третьей, или В-группы крови. Следовательно, аллели IA
и IB
выступают как доминантные по отношению к аллелю I0
, формирующему в гомозиготном состоянии I0
I0
первую, или 0-группу крови.
Неполное доминирование
наблюдается, когда фенотип гетерозигот BB' отличается от фенотипа гомозигот по обоим аллелям (BB или B'B') промежуточным проявлением признака. Это объясняется тем, что аллель, способный сформировать нормальный признак, находясь в двойной дозе у гомозиготы BB, проявляется сильнее, чем в единственной дозе у гетерозиготы BB'. Указанные генотипы отличаются экспрессивностью,
т.е. степенью выраженности признака. Демонстрацией такого типа взаимодействия генов могут быть многочисленные наследственные заболевания у человека, проявляющиеся клинически у гетерозигот по мутантным аллелям, а у гомозигот заканчивающиеся смертью. Иногда гетерозиготы имеют почти нормальный фенотип, а гомозиготы характеризуются пониженной жизнеспособностью.
Так, гомозиготы по аллелю серповидноклеточности эритроцитов в связи с развитием у них тяжелой формы анемии и других фенотипических проявлений (см. рис. 3.21) обычно не переживают детский возраст. Напротив, гетерозиготы — это как правило нормальные люди. Вместе с тем, они все-таки испытывают кислородную недостаточность в большей степени в сравнении с гомозиготами по аллелю дикого типа, в частности при подъеме на высоту (см. 4.1).
Кодоминирование
представляет собой такой тип взаимодействия аллельных генов, при котором каждый из аллелей проявляет свое действие. В результате этого формируется некий промежуточный вариант признака, новый по сравнению с вариантами, определяемыми каждым аллелем самостоятельно. Примером может служить формирование IV, или АВ-группы, крови у человека, гетерозиготного по аллелям IA
и IB
, которые по отдельности детерминируют образование II и III групп крови.
Межаллельная комплементация
относится к достаточно редко встречаемым способам взаимодействия аллельных генов. В этом случае возможно формирование нормального признака D у организма, гетерозиготного по двум мутантным аллелям гена D(D'D"). Допустим, что ген D отвечает за синтез какого-то белка, который имеет четвертичную структуру, состоящую из нескольких одинаковых пептидных цепей. Мутантный аллель D' определяет синтез измененного пептида D', a мутантный аллель D" приводит к синтезу другой, но тоже измененной структуры пептида D". Можно представить ситуацию, когда взаимодействие таких измененных пептидов (D' и D") при формировании четвертичной структуры, как бы взаимно компенсируя эти изменения, обеспечивает образование белка с нормальными свойствами. В то же время отдельно взаимодействующие пептиды D' или D" формируют аномальные белки. Таким образом, с определенной вероятностью у гетерозигот D'D" в результате межаллельной комплементации может образовываться нормальный признак в виде белка с нормальными свойствами.
Аллельное исключение—
такой вид взаимодействия аллельных генов в генотипе организма, который можно понять на примере рассмотренного выше механизма инактивации одной из Х-хромосом у особей гомогаметного пола, приводящего в соответствие дозы Х-генов у всех представителей вида. Инактива-ция одного из аллелей в составе Х-хромосомы способствует тому, что в разных клетках организма, мозаичных по функционирующей хромосоме, фенотипически проявляются разные аллели (рис. 3.79). Аллельное исключение наблюдается также в В-лимфоцитах, синтезирующих специфичные антитела к определенным антигенам. Моноспецифичность таких иммуноглобулинов требует выбора, который должна осуществить каждая клетка между экспрессией отцовского или материнского аллеля.
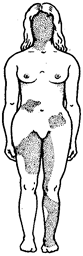
Рис. 3.79. Мозаицизм женского организма по наличию или отсутствию нормальных потовых желез в коже, обусловленный экспрессией нормального или мутантного аллелей гена Х-хромосомы
Затемнены участки кожи, лишенные потовых желез, в клетках которых экспрессируется мутантный аллель
Таким образом, даже процесс формирования элементарного признака — синтез полипептида с определенной последовательностью аминокислот — зависит, как правило, от взаимодействия по меньшей мере двух аллельных генов, и конечный результат определяется конкретным сочетанием их в генотипе.
Формирование сложных признаков предполагает необходимость взаимодействия неаллельных генов, занимающих разное положение в геноме данного вида.
Взаимодействие неаллельных генов.
Большинство признаков и свойств организма, по которым он отличается от других представителей вида, являются результатом действия не одной пары аллельных генов, а нескольких неаллельных генов или их продуктов. Поэтому эти признаки называют сложными.
Сложным признаком может быть четвертичная структура белка, образуемая разными пептидными цепями, которые детерминируются разными (неаллельными) генами. Например, молекула гемоглобина, содержит две о,- и две (3-цепи, гены которых расположены у человека в 16-й и 11-й хромосомах (см. разд. 3.6.4.3). Сложный признак может быть обусловлен совместным однозначным действием нескольких генов или являться конечным результатом цепи биохимических преобразований, в которых принимают участие продукты многих генов. Наконец, на формирование как простых, так и сложных признаков определенные регуляторные воздействия оказывают другие локусы.
В зависимости от характера участия неаллельных генов в формировании того или иного признака различают несколько видов их взаимодействия.
Большинство количественных признаков организмов определяется полигенами,
т.е. системой неаллельных генов, одинаково влияющих на формирование данного признака. Взаимодействие таких генов в процессе формирования признака называют полимерным.
Оно сводится чаще всего к суммированию действия сходных аллелей этих генов, определяющих формирование одинакового варианта признака. Совместное действие полигенов обусловливает различную экспрессивность — степень выраженности признака, зависящую от дозы соответствующих аллелей. В основе появления в геноме таких генов, очевидно, лежит их дупликация или амплификация (см. разд. 3.6.4.3). Это позволяет увеличить синтез соответствующего продукта в клетках организма.
По полимерному типу взаимодействия у человека определяется интенсивность окраски кожных покровов, зависящая от уровня отложения в клетках пигмента меланина. В геноме человека имеется четыре гена, отвечающих за этот признак. В генотипе все они представлены в двойной дозе. В связи с тем что эти гены отвечают за развитие одного и того же признака, их обозначают одной и той же буквой, но с разными символами, чтобы подчеркнуть их неаллельность — P1
P2
P3
P4
.
Наличие в генотипе восьми доминантных аллелей в системе полигенов, определяющих цвет кожи, обусловливает максимальную ее пигментацию, наблюдаемую у африканских негров (P1
P1
P2
P2
P3
P3
P4
P4
). Полное отсутствие доминантных аллелей у. рецессивных гомозигот (р1
р2
р2
р3
р3
р4
р4
) проявляется в виде минимальной пигментации у европеоидов. Большее или меньшее количество доминантных аллелей, колеблющееся от 8 до 0, обеспечивает разную интенсивность окраски кожи (рис. 3.80). Полимерное взаимодействие генов лежит в основе определения главным образом количественных признаков (рост, масса организма, возможно, интеллект).
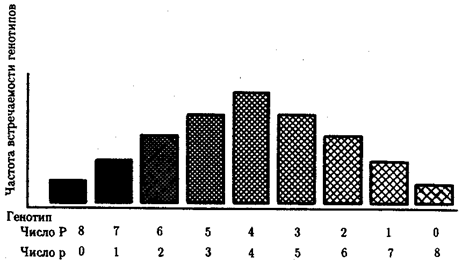
Рис. 3.80. Зависимость интенсивности пигментации кожи у человека
от количества доминантных аллелей в системе полигенов (Р) в генотипе
Остальные пояснения см. в тексте
Большинство сложных признаков, являясь результатом целой цепи биохимических и структурных преобразований, требует участия многих генов, влияющих на разные звенья этого процесса. Отсутствие нормального первичного продукта, хотя бы одного из них, не позволяет сформировать нормальный сложный признак. Так как часто нормальный первичный продукт гена является результатом экспрессии его доминантного аллеля, сложный признак формируется при наличии в генотипе доминантных аллелей всех взаимодействующих генов. Такое взаимодействие неаллельных генов, при котором они взаимно дополняют друг друга, называют комплементарным взаимодействием.
В качестве примера комплементарного взаимодействия неаллельных генов можно рассмотреть процесс формирования половой принадлежности организма у человека. Развитие признаков пола у человека, так же как у большинства животных, определяется в первую очередь сочетанием гетерохромосом в его кариотипе. Наличие Х- и Y-хромосом обусловливает возможность формирования мужского пола, а двух Х-хромосом —женского. Однако установлено, что для развития организма мужского пола не достаточно присутствия одного лишь Y-сцепленного гена, который определяет дифференцировку половых желез по мужскому типу и синтез ими гормона тестостерона. Для этого необходим также продукт другого гена — белок-рецептор, обеспечивающий проникновение гормона в клетки тканей-мишеней. За синтез такого белка отвечает особый ген, расположенный в Х-хромосоме. Его мутация, нарушающая образование нормального белка-рецептора, делает ткани-мишени невосприимчивыми к гормону, направляющему их развитие по мужскому типу. Не использовав такую возможность на определенном этапе онтогенеза, организм осуществляет развитие по женскому типу. В результате появляется особь с кариотипом XY, но внешне более сходная с женщиной. Такие субъекты не способны иметь потомство, так как их половые железы (семенники) недоразвиты, а их выводные протоки часто формируются по женскому типу (недоразвитая матка, влагалище). Вторичные половые признаки также характерны для женского пола. Описанная картина известна у человека как тестикулярная феминизация,
или синдром Морриса
(рис. 3.81).
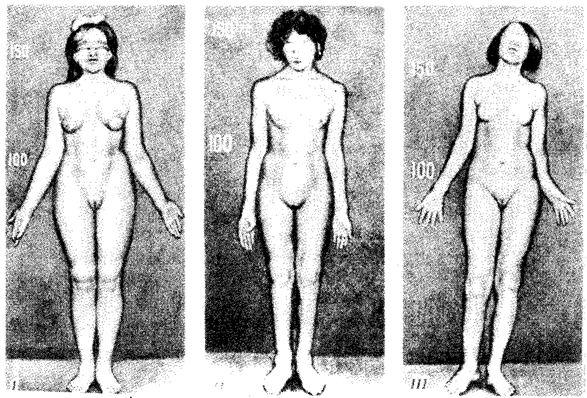
Рис. 3.81. Тестикулярная феминизация —синдром Морриса:
I
— кариотип XY (удаление семенников в детском возрасте); II
— евнухоидная форма, кариотип XY (отсутствие молочных желез, вторичного оволосения, естественного влагалища); III —
кариотип XY
Таким образом, достижение конечного результата при формировании у человека признаков мужского пола является следствием взаимодополняющего действия нескольких (по меньшей мере двух) генов, определяющих возможность синтеза мужского полового гормона и белка-рецептора.
Другим примером взаимодействия неаллельных генов служит формирование у человека групповой принадлежности крови по системе АВО. Выше этот признак рассматривался с точки зрения взаимодействия аллельных генов. Отвечающий за формирование данного признака ген I обеспечивает синтез антигенов А и В, фиксирующихся на поверхности эритроцитов. Однако для синтеза антигенов А и В необходимо образование неспецифического вещества-предшественника, которое детерминируется геном Н, находящимся в доминантном состоянии. У гомозигот по рецессивному аллелю hh даже при наличии в генотипе доминантных аллелей гена ^ или Iй
антигены А и В не синтезируются и фенотипически эти люди имеют I группу крови.
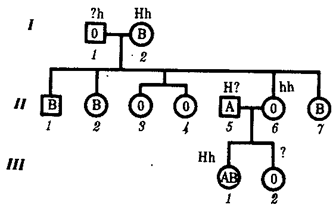
Рис. 3.82. Родословная, иллюстрирующая наследование группы крови
по системе АВО при бомбейском феномене
Женщина II.6
с
группой крови 0(1) имеет ребенка III.1
с группой крови АВ (ГУ); вероятно, в ее геноме имеется аллель Iе
, полученный ею от матери (1.2
),
но не проявившийся в связи с ее гомозиготностыо по рецессивному аллелю hh. Бомбейский фенотип встречается с частотой 1:13000 среди индусов, живущих в окрестностях Бомбея
Такая ситуация характерна для бомбейского феномена,
описанного впервые в семье, где у женщины I группы крови родился ребенок с IV группой крови. Очевидно, ее фенотип был обусловлен непроявлением имеющегося в генотипе аллеля IВ
, что связано с гомозиготностью матери по рецессивному аллелю hh (рис. 3.82).
Вероятно с этих же позиций можно рассматривать и случаи альбинизма у человека, когда даже у африканских негров, которые обладают максимумом доминантных аллелей в системе полигенов, определяющих пигментацию кожи, появляются альбиносы с полным отсутствием пигмента в клетках кожи, радужке глаз, волосах (рис. 3.83). Альбинизм связывают с гомозиготностыо генотипа по рецессивному аллелю гена, не относящегося к полигенам пигментации. Возможно, его доминантный аллель определяет синтез продукта, принимающего участие в процессах, предшествующих синтезу пигмента. В таком случае здесь также имеет место взаимодополняющее действие соответствующих аллелей разных генов.
В некоторых случаях при взаимодействии неаллельных генов для развития сложного признака необходимо обязательное присутствие одного из генов (А) в гомозиготном рецессивном состоянии (аа), тогда другой ген (В) обеспечивает формирование признака.
Наличие в генотипе доминантного аллеля гена А каким-то образом препятствует проявлению гена В(b), и признак не формируется. Такое взаимодействие неаллельных генов принято называть эпистатическим,

Рис. 3.83. Пример рождения альбиноса у негритянки (отсутствие пигментации кожи у ребенка может быть результатом рецессивного эпистаза)
Примером эпистатического взаимодействия генов может быть подавление у многих видов развития окраски покровов, определяемое одним из генов, при наличии в генотипе другого гена в доминантном состоянии. Так, у тыквы развитие окраски плодов определяется геном В. Доминантный его аллель детерминирует желтую, а рецессивный — зеленую окраску. Однако окраска не развивается вообще, если в генотипе имеется неаллельный ген А в доминантном состоянии. У кур породы леггорн белое оперение является результатом эпистатического воздействия доминантного аллеля одного гена на проявление неаллельного ему гена, отвечающего за пигментацию оперения.
Отсутствие необходимых данных о роли первичных продуктов многих генов в формировании сложных признаков часто не позволяет точно установить характер взаимодействия неаллельных локусов, участвующих в биохимических процессах и составляющих основу образования этих признаков. В одних случаях развитие признака при наличии двух неаллельных генов в доминантном состоянии рассматривают как комплементарное взаимодействие, в других — неразвитие признака, определяемого одним из генов при отсутствии другого гена в доминантном состоянии, расценивают как рецессивный эпистаз; если же признак развивается при отсутствии доминантного аллеля неаллельного гена, а в его присутствии не развивается, говорят о доминантном эпистазе.
Вероятно, само разделение взаимодействия генов на комплементарное и эпистатическое несколько искусственно, ибо во всех этих случаях сложный признак является результатом сочетания в генотипе определенных аллелей соответствующих генов, которые обеспечивают синтез продуктов, участвующих в цепи биохимических преобразований на разных уровнях формирования сложного признака.
Так как при определенных сочетаниях аллелей неаллельных генов становится невозможным фенотипическое проявление доминантных аллелей некоторых из них, нередко наблюдается неполная пенетрантность
доминантных аллелей — они проявляются не у всех носителей. Так, аллели IA
и IB
, определяющие групповую принадлежность крови по системе АВО, не проявляются фенотипически в отсутствие доминантного аллеля гена Н (бомбейский феномен). У альбиносов (аа) не проявляются доминантные аллели полигенов пигментации кожных покровов (Р1
Р2
Р3
Р4
). У тыквы не развивается окраска плодов, а у кур породы леггорн — пестрая окраска оперения, контролируемые доминантными аллелями соответствующих генов, при наличии в их генотипе определенных неаллельных генов в доминантном состоянии.
Особый вид представляет взаимодействие, обусловленное местом положения гена в системе генотипа,— эффект положения.
Непосредственное окружение, в котором находится ген, может сказываться на характере его экспрессии. Изменение активности гена, наблюдаемое при хромосомных перестройках, нередко связано с перемещением его в другую группу сцепления при транслокациях или изменением его положения в своей хромосоме при инверсиях. Особый случай, очевидно, представляет изменение экспрессии генов в результате деятельности подвижных генетических элементов, активирующих или угнетающих проявление генов, вблизи которых они встраиваются.
Наконец, большое значение в объединении генов в единую систему генотипа имеют регуляторные взаимодействия,
обеспечивающие регуляцию генной активности. Продукты генов-регуляторов — белки-регуляторы — обладают способностью узнавать определенные последовательности ДНК, соединяться с ними, обеспечивая, таким образом, транскрибирование информации со структурных генов или препятствуя транскрипции (см. разд. 3.6.6).
Реализация наследственной информации, заключенной в генотипе организма,— это сложный процесс, который требует тонкой регуляции для того, чтобы в клетках разной тканевой принадлежности в определенное время в процессе развития организма обеспечить синтез специфических белков в необходимом количестве.
Все клетки многоклеточного организма, возникая из зиготы путем митоза, получают полноценный набор генетической информации. Несмотря на это, они отличаются друг от друга по морфологии, биохимическим и функциональным свойствам. В основе этих различий лежит активное функционирование в разных клетках неодинаковых частей генома. Большая часть генома находится в клетках организма в неактивном, репрессированном,
состоянии, и только 7—10% генов дерепрессированы,
т.е. активно транскрибируются. Спектр функционирующих генов зависит от тканевой принадлежности клетки, от периода ее жизненного цикла и стадии индивидуального развития организма.
Основная масса генов, активно функционирующих в большинстве клеток организма на протяжении онтогенеза, — это гены, которые обеспечивают синтез белков общего назначения (белки рибосом, гистоны, тубулины и т.д.), тРНК и рРНК. Транскрибирование этих генов обеспечивается соединением РНК-полимеразы с их промоторами и, видимо, не подчиняется каким-либо другим регулирующим воздействиям. Такие гены называют конститутивными.
Другая группа генов, детерминирующих синтез специфических продуктов, в своем функционировании зависит от различных регулирующих факторов, ее называют регулируемыми
генами (рис. 3.84). Их активное функционирование, скорость и продолжительность транскрипции регулируются путем стимуляции или запрещения соединения РНК-полимеразы с промоторной областью гена.
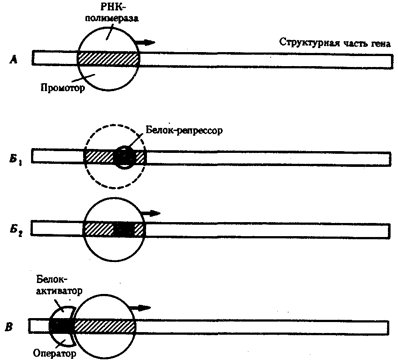
Рис. 3.84. Схема конститутивных и регулируемых генов:
А —
конститутивный ген; Б, В —
регулируемые гены; Б1
Б2
—связывание РНК-полимеразы с промотором возможно лишь в отсутствие белка-репрессора, который специфически соединяется с оператором, частично или полностью перекрывающим промоторную последовательность; В —
связывание РНК-полимеразы с промотором облегчается белком-активатором (апоиндуктором), который специфически узнает область оператора, расположенную перед промотором; стрелкой обозначено направление транскрипции
Важнейшим фактором регуляции генной активности являются элементы генома, отвечающие за синтез регуляторных белков,— гены-регуляторы.
Соединяясь с определенными нуклеотидными последовательностями ДНК, предшествующими структурной части регулируемого гена,—операторами, белки-регуляторы способствуют или препятствуют соединению РНК-полимеразы с промотором. Если белок-регулятор взаимодействует с оператором, занимающим часть промотора или расположенным между ним и структурной частью гена, то это не дает возможности РНК-полимеразе соединиться с промоторной последовательностью и осуществить транскрипцию. Такой белок называют репрессором,
и в этом случае осуществляется негативный контроль
экспрессии гена со стороны гена-регулятора (рис. 3.85). Если промотор обладает слабой способностью соединяться с РНК-полимеразой, а ему предшествует область, узнаваемая белком-регулятором, присоединение последнего непосредственно перед промотором к молекуле ДНК облегчает связывание РНК-полимеразы с промотором, вслед за чем следует транскрипция. Такие белки называют активаторами
(или апоиндукторами
),
а контроль экспрессии гена со стороны гена-регулятора — позитивным
(рис. 3.85).
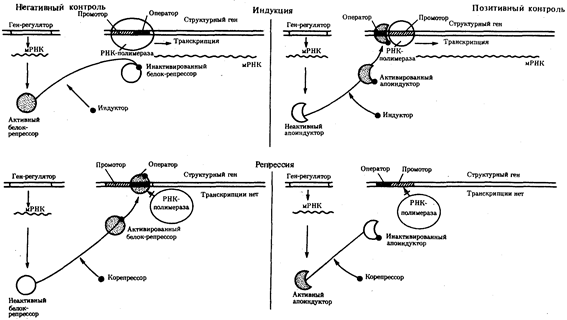
Рис. 3.85. Негативный и позитивный контроль экспрессии генов
и участие эффекторов в регуляции генной активности
Наряду с генетическими факторами в регуляции экспрессии генов на стадии транскрипции принимают участие негенетические факторы — эффекторы.
К ним относят вещества небелковой природы, взаимодействующие с белками-регуляторами и изменяющие их способность соединяться с нуклеотидными последовательностями операторов. В зависимости от результатов такого взаимодействия среди эффекторов различают индукторы,
запускающие транскрипцию, и корепрессоры,
препятствующие ей.
Индукторы могут инактивировать белки-репрессоры, которые перестают соединяться с операторами, или повышать способность белков-активаторов (апоиндукторов) к связыванию с ними, что облегчает соединение РНК-полимеразы с промотором. В результате такого воздействия на регуляторные белки регулируемые гены активно транскрибируются.
Корепрессоры могут модифицировать апоиндукторы, теряющие при этом способность соединяться с операторами, или активировать репрессоры, находящиеся в неактивном состоянии. Следствием такого взаимодействия эффектора с белками-регуляторами является невозможность соединения РНК-полимеразы с промотором и отсутствие транскрипции.
Изучение регуляции генной активности у прокариот привело французских микробиологов Ф. Жакоба и Ж. Моно к созданию (1961) оперонной модели регуляции транскрипции. Оперон —
это тесно связанная последовательность структурных генов, определяющих синтез группы белков, которые участвуют в одной цепи биохимических преобразований. Например, это могут быть гены, которые детерминируют синтез ферментов, участвующих в метаболизме какого-либо вещества или в синтезе какого-то компонента клетки. Оперонная модель регуляции экспрессии генов предполагает наличие единой системы регуляции у таких объединенных в один оперон структурных генов, имеющих общий промотор и оператор.
Особенностью прокариот является транскрибирование мРНК со всех структурных генов оперона в виде одного полицистронного транскрипта, с которого в дальнейшем синтезируются отдельные пептиды.
Примером участия генетических и негенетических факторов в регуляции экспрессии генов у прокариот может служить функционирование лактозного оперона у кишечной палочки Е.
colt
(рис. 3.86). При отсутствии в среде, на которой выращиваются бактерии, сахара лактозы активный белок-репрессор, синтезируемый геном-регулятором (I), взаимодействует с оператором (О), препятствуя соединению РНК-полимеразы с промотором (Р) и транскрипции структурных генов Z, Y, А. Появление в среде лактозы инактивирует репрессор, он не соединяется с оператором, РНК-полимераза взаимодействует с промотором и осуществляет транскрипцию полицистронной мРНК. Последняя обеспечивает синтез сразу всех ферментов, участвующих в метаболизме лактозы. Уменьшение содержания лактозы в результате ее ферментативного расщепления приводит к восстановлению способности репрессора соединяться с оператором и прекращению транскрипции генов Z, Y, А.
Таким образом, регуляция экспрессии генов, организованных у прокариот в опероны, является координированной.
Синтез полицистронной мРНК обеспечивает одинаковый уровень синтеза всех ферментов, участвующих в биохимическом процессе.
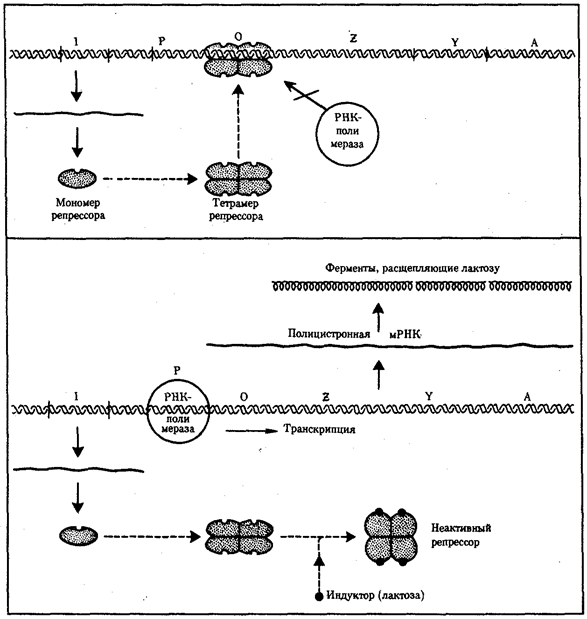
Рис. 3.86. Лактозный оперон Е. Со
li
Включение loc
-оперона с помощью индуктора — лактозы; объяснение см. в тексте
В связи с особенностями организации отдельных генов эукариот и генома в целом регуляция генной активности у них характеризуется некоторыми отличиями по сравнению с прокариотами.
У эукариот не установлено оперонной организации генов. Гены, определяющие синтез ферментов одной цепи биохимических реакций, могут быть рассеяны в геноме и, очевидно, не имеют, как у прокариот, единой регулирующей системы (ген-регулятор, оператор, промотор). В связи с этим синтезируемые мРНК у эукариот моноцистронны, т.е. являются матрицами для отдельных пептидных цепей.
В настоящее время механизмы регуляции и координации активности эукариотических генов интенсивно изучаются. Установлено, что их функционирование несомненно подчиняется регуляторным воздействиям, однако регуляция транскрипции у эукариот является комбинационной,
т.е. активность каждого гена регулируется большим спектром генов-регуляторов (рис. 3.87).
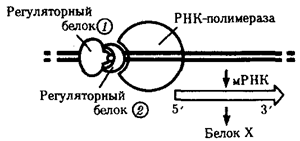
Рис. 3.87. Регуляция экспрессии гена, кодирующего белок Х у эукариот,
двумя регуляторными белками
У многих эукариотических генов, кодирующих белки и транскрибируемых РНК-полимеразой II, в ДНК имеется несколько областей, которые узнаются разными белками-регуляторами. Одной из них является область, расположенная вблизи промотора. Она включает около 100 пар нуклеотидов, в том числе ТАТА-блок, располагающийся на расстоянии 25 пар нуклеотидов от точки начала транскрипции. Установлено, что для успешного присоединения РНК-полимеразы II к промотору необходимо предварительное соединение с ТАТА-блоком особого белка — фактора транскрипции — с
образованием стабильного транскрипционного комплекса. Именно этот комплекс ДНК с белком узнается РНК-полимеразой II. Последовательности нуклеотидов, примыкающие к ТАТА-блоку, формируют требуемый для транскрипции элемент, расположенный перед промотором.
Другая область, играющая важную роль в регуляции активности эукариотических генов, располагается на большом расстоянии от промотора (до нескольких тысяч пар нуклеотидов) и называется энхансером
(от англ. enhance —усиливать).
И энхансер, и препромоторный элемент эукариотических генов содержат серию коротких нуклеотидных последовательностей, которые связываются с соответствующими регуляторными белками. В результате взаимодействия этих белков происходит включение или выключение генов.
Особенностью регуляции экспрессии эукариотических генов является также существование белков-регуляторов, которые способны контролировать транскрипцию многих генов, кодирующих, возможно, другие белки-регуляторы. В связи с этим некоторые (главные) белки-регуляторы обладают координирующим влиянием на активность многих генов и их действие характеризуется плейотропным эффектом (рис. 3.88). Примером может служить существование белка, который активирует транскрипцию нескольких специфических генов, определяющих дифференцировку предшественников жировых клеток.
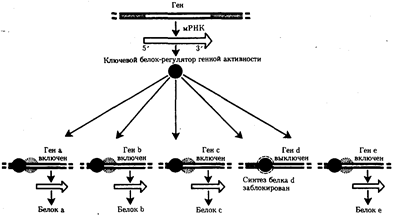
Рис. 3.88. Регуляция экспрессии многих генов эукариот
одним белком-регулятором
Ввиду того что в геноме эукариот имеется много избыточной ДНК, а в каждой клетке организма транскрибируется всего 7—10% генов, логично предположение о том, что у них преобладает позитивный генетический контроль, при котором активация небольшой части генома оказывается более экономичной, нежели репрессия основной массы генов.
Несомненной особенностью регуляции транскрипции у эукариот является подчиненность этих процессов регулирующим влияниям со стороны гормонов
организма. Последние часто играют роль индукторов транскрипции. Так, некоторые стероидные гормоны обратимо связываются особыми белками-рецепторами, образуя с ними комплексы. Активированный гормоном рецептор приобретает способность соединяться со специфическими участками хроматина, ответственными за регуляцию активности генов, в которых рецепторы узнают определенные последовательности ДНК.
Специфичность регулирующего воздействия гормона на транскрипцию обусловлена не только природой самого гормона, но и природой клетки-мишени, синтезирующей специфический белок-рецептор, который влияет на транскрипцию определенного для данной клетки набора генов. Примером участия гормонов в регуляции активности определенных генов может служить влияние тестостерона на развитие тканей организма по мужскому типу при наличии специфического белка-рецептора. Отсутствие последнего при мутации соответствующего гена не дает возможности гормону проникнуть в ядра клеток-мишеней и обеспечить включение определенного набора генов: развивается синдром тестикулярной феминизации, или синдром Морриса (см. разд. 3.6.5.2).
Следующая особенность регуляции генной активности у эукариот связана с образованием стойкого комплекса ДНК с белками — хроматина
(см. разд. 3.5.2.2). Ведущая роль в компактизации ДНК принадлежит гистонам, поэтому они, несомненно, участвуют и в процессах регуляции генной активности (см. разд. 3.5.4). Непременным условием для осуществления транскрипции у эукариот является предварительная декомпактизация хроматина на соответствующем участке, где временно утрачивается связь с Hi-гистонами и несколько ослабляется связь с нуклеосомными гистонами. Правда, нуклеосомная организация хроматина не утрачивается даже в ходе транскрипции, однако контакт ДНК и негистоновых белков становится возможным и происходит дерепрессия гена.
Отличительной особенностью регуляции экспрессии генов у эукариот является возможность ее осуществления не только на стадии транскрипции, но и на других этапах растянутого во времени процесса реализации наследственной информации. Регуляция на стадии транскрипции является наиболее экономичной, но недостаточно быстро реагирующей на изменение ситуации. Так, возникшая в клетке потребность в каком-либо белке не может быть быстро удовлетворена путем включения транскрипции соответствующего гена. Синтезированный транскрипт должен подвергнуться процессингу, затем зрелая мРНК должна выйти из ядра в цитоплазму и, образуя комплекс с рибосомами, осуществить трансляцию информации, синтезировав пептид, который, лишь пройдя посттрансляционное изменение, формирует активный белок, необходимый клетке.
В том случае, когда клетке нужно прекратить синтез какого-то продукта, после выключения транскрипции соответствующего гена в цитоплазму некоторое время будут продолжать поступать созревающие молекулы мРНК, осуществляющие там синтез пептидных цепей, пока они не деградируют под действием ферментов. Таким образом, для эффективной регуляции экспрессии генов у эукариот должны существовать механизмы, работающие не только на стадии транскрипции, но и на других этапах этого процесса.
Связанная с экзон-интронной организацией генов необходимость процессичга,
в том числе сплайсинга,
делает возможным регуляцию этих процессов в ядре. В настоящее время обсуждается роль интронных участков ДНК в изменении схемы сплайсинга при синтезе антител (см. разд. 3.4.3.2) или цитохрома b
(см. разд. 3.4.3.3). Это создает возможность, используя один и тот же первичный транскрипт, обеспечивать образование матриц для разных пептидов, вырезая из них разные последовательности или изменяя последовательности на 5'- и 3'-концах мРНК.
Очевидно, и транспорт зрелых мРНК из ядра в цитоплазму также регулируется определенным образом, так как установлено, что лишь небольшая часть РНК, транскрибируемой с генов, после сплайсинга покидает ядро. Значительное количество ее деградирует. Возможно, это является результатом процессинга, приводящего к появлению «неправильных» матриц.
Существуют механизмы, обеспечивающие регуляцию процессов синтеза пептидных цепей.
Они менее экономичны, но отличаются быстротой реагирования на изменения потребностей клетки в данном белке. Регуляция трансляции осуществляется на стадии инициации путем воздействия на один из факторов инициации, катализирующий присоединение к малой субъединице рибосомы тРНК, несущей метионин (формилметионин) (см. разд. 3.4.3). В результате при наличии в цитоплазме мРНК трансляции на ней не происходит. Такая ситуация наблюдается, например, при отсутствии в цитоплазме гема, что ведет к выключению трансляции глобиновых цепей гемоглобина.
Наконец, регуляция процесса реализации наследственной информации может осуществляться и на стадии посттрансляционных изменений.
Прекращение этих процессов обусловливает задержку в формировании активных молекул белка при наличии необходимых для этого пептидных цепей. Например, для формирования активной формы белкового гормона — инсулина — из проинсулина должны вырезаться две субъединицы. Торможение этих процессов уменьшает выход конечного активного продукта.
Таким образом, рассмотренный выше пример регуляции экспрессии генов демонстрирует сложнейшие взаимосвязи, которые существуют между ними в геноме. Формирование любого признака поэтому нельзя рассматривать как результат действия одной пары аллельных генов в генотипе. В любом случае регуляция экспрессии ответственного за этот признак гена осуществляется при участии других генов.
Геномный уровень организации наследственного материала, объединяющий всю совокупность хромосомных генов, является эволюционно сложившейся структурой, характеризующейся относительно большей стабильностью, нежели генный и хромосомный уровни. На геномном уровне система сбалансированных по дозам и объединенных сложнейшими функциональными взаимосвязями генов представляет собой нечто большее, нежели простую совокупность отдельных единиц. Поэтому результатом функционирования генома является формирование фенотипа целостного организма. В связи с этим фенотип организма нельзя представлять как простую совокупность признаков и свойств, это организм во всем многообразии его характеристик на всем протяжении индивидуального развития. Таким образом, поддержание постоянства организации наследственного материала на геномном уровне имеет первостепенное значение для обеспечения нормального развития, организма и воспроизведения у особи в первую очередь видовых характеристик.
В то же время допустимость рекомбинации единиц наследственности в генотипах особей обусловливает генетическое разнообразие их, что имеет важное эволюционное значение. Мутационные изменения, реализующиеся на геномном уровне организации наследственного материала,— мутации регуляторных генов, обладающих широким плейотропным действием, количественные изменения доз генов, транслокации и транспозиции генетических единиц, влияющие на характер экспрессии генов, наконец, возможность включения в геном чужеродной информации при горизонтальном переносе нуклеотидных последовательностей между организмами разных видов, — оказываясь иногда эволюционно перспективными, вероятно, являются основной причиной ускорения темпов эволюционного процесса на отдельных этапах исторического развития живых форм на Земле.
Человек как вид является продуктом биологической эволюции. Процесс возникновения вида Homo sapiens
и длительное существование его на Земле, так же как и других видов, обусловлены реализацией таких свойств живого, как наследственность и изменчивость. Важнейшим доказательством родства Человека с другими живыми организмами, населяющими Землю, является в первую очередь сходство химической и морфологической организации их наследственного материала, способа записи наследственной информации и ее использования. Большое сходство наблюдается также в спектре белков, образуемых в организме человека и высших животных, например человекообразных обезьян.
Как у большинства видов, наследственная программа развития, записанная в молекулах ДНК с помощью универсального триплетного кода, организована у человека главным образом в его кариотипе. Хромосомный набор вида Homo sapiens
состоит из 23 пар хромосом, содержащих 30—40 тыс. генов. Изучение структуры кариотипа и отдельных хромосом с использованием методик дифференциального (избирательного) окрашивания показало, что характер распределения красителя в разных хромосомах сходен у человека и человекообразных обезьян — шимпанзе и гориллы, имеющих 24 пары хромосом. Это сходство позволило сделать вывод, что одна из крупных хромосом человеческого кариотипа, очевидно, появилась в результате слияния двух акроцентрических хромосом обезьяноподобного предка (см. разд. 3.5.3.3).
Изучение процессов мутагенеза обнаружило, что отдельные гены человека могут изменять свою структуру с частотой, соизмеримой с таковой у других живых организмов (10-5
—10-6
на один ген на поколение). Правда, в силу социальности человек создает в ходе своей деятельности новую среду с более высокими дозами и более широким спектром мутагенов, что не может не сказываться на интенсивности мутационного процесса в наследственном материале не только человечества, но и других видов живых организмов.
Таким образом, молекулярно-генетические механизмы обеспечения наследственности и изменчивости у человека имеют много общего с таковыми у других видов. Это делает возможным использование сведений, получаемых в ходе экспериментов на животных, для изучения наследственности и изменчивости у человека.
Благодаря большому объему человеческого генома и более низкому давлению естественного отбора, связанному с социальной природой человека (см. § 1,9), в генофонде человечества за тысячелетия его существования в результате постоянно идущего мутационного процесса накоплено большое число аллелей многих генов. Это является причиной формирования у людей разнообразных вариантов признаков и свойств как на структурном, так и на биохимическом уровнях. В основе индивидуальных различий по многим белкам лежат изменения соответствующих генов. Изучение аминокислотного состава вариантов белков человеческого организма, интенсивности их синтеза, функциональной активности дает ценные сведения об организации и экспрессии его наследственного материала.
Удобной моделью для изучения молекулярно-генетических механизмов наследственности и изменчивости у человека является гемоглобин —
специфический белок эритроцитов, легко выделяемый из организма без применения трудоемких биохимических методик. В результате длительного изучения этого белка накопилось много фактов, свидетельствующих об изменчивости его первичной структуры и свойств. В настоящее время обнаружено около 400 различных разновидностей гемоглобина, встречающихся как в нормальном развитии на разных стадиях онтогенеза, так и приводящих к различным заболеваниям.
Молекула гемоглобина состоит из четырех полипептидных цепей (двух α- и двух β-цепей), каждая из которых соединена с небелковым компонентом — гемом, содержащим железо. Две названные полипептидные цепи имеют варианты, контролируемые разными, но близкими нуклеотидными последовательностями, которые образуют два семейства генов (см. разд. 3.6.4.3). Различные нуклеотидные последовательности экспрессируются на определенных стадиях индивидуального развития — у эмбриона, плода, после рождения (см. § 6.2). При этом полипептиды, сменяющиеся в зависимости от стадии онтогенеза, незначительно различаются по аминокислотному составу. Так, A
γ и G
γ-глобины различаются по одной аминокислоте в 136-м положении (аланин или глицин). Вариант A
γ-глобина (TA
γ) в 75-м положении вместо изолейцина имеет треонин. Цепь δ отличается от β-цепи лишь десятью аминокислотными остатками.
Из многочисленных мутаций гемоглобина большинство достаточно редки и лишь немногие из них встречаются чаще других, например HbS, HbC, НЬЕ. Большая часть вариантов гемоглобина (около 350) различается единичными аминокислотными заменами, причиной которых являются генные мутации, связанные с заменой оснований в нуклеотидных последовательностях α- или β-глобинового семейства. Многие аминокислотные замены существенно не влияют на функцию гемоглобина и не приводят к патологическим проявлениям. Как правило, это замены в обращенных наружу участках полипептидных цепей тетрамера.
Замены аминокислот, нарушающие нормальную спиральную структуру цепей, часто вызывают неустойчивость гемоглобина. Замена в участках, которыми α- и β-цепи контактируют друг с другом, влияют на сродство гемоглобина к кислороду. Нарушения функций гемоглобина, возникающие в результате таких изменений структуры α- и β-глобиновых генов, ведут к появлению заболеваний, которые можно разделить на четыре основные группы.
1. Гемолитические анемии.
Проявляются в распаде эритроцитов, зависящем от неустойчивости гемоглобина (описано около 100 вариантов нестабильных гемоглобинов с мутациями в гене β-цепи).
2. Метгемоглобинемии.
Обусловлены ускоренным окислением двухвалентного железа до трехвалентного и образованием гемоглобина М (известны пять таких мутаций в генах α- и β-цепей, состоящих в замене одного основания).
3. Эритроцитоз.
Заключается в образовании большего, чем обычно, количества эритроцитов, что обусловлено повышенным сродством гемоглобина к кислороду, который с трудом высвобождается в тканях (таких мутаций известно около 30).
4. Серповидно-клеточная анемия.
Заключается в замене гемоглобина НЬА на HbS, который отличается растворимостью и кристаллизацией в условиях гипоксии, что приводит к изменению формы эритроцитов, и проявляется фенотипическим многообразием симптомов (см. рис. 3.21).
Заболевания первых трех групп наследуются по доминантному типу, так что гетерозиготы по мутантному гену страдают нарушением здоровья. Наследование серповидно-клеточной анемии при обычных условиях осуществляется по рецессивному типу, но в условиях сильной гипоксии, например при нахождении на высоте свыше 3000 м над уровнем моря гетерозиготы НbА HbS также страдают анемией.
Описанные мутантные формы гемоглобина возникают в результате изменений структуры генов по типу замены оснований. Мутации иного характера приводят к появлению аллелей глобинов, обусловливающих другие виды патологии. Так, нарушение процесса рекомбинации между аллельными генами (неравноценный кроссинговер) приводит к изменению числа нуклеотидов в них. Следствием этого может быть сдвиг рамки считывания. Нередким результатом таких структурных изменений генов является подавление синтеза той или иной цепи гемоглобина, приводящее к развитию патологических состояний, известных под общим названием талассемии.
Деления одного нуклеотида в 139-м триплете α-глобинового гена, состоящего из 141 триплета, приводит к сдвигу рамки считывания и прочитыванию в новой рамке терминирующего 142-го кодона. При этом (α-глобиновая цепь удлиняется на пять дополнительных аминокислот. Такой особенностью α-цепей характеризуется гемоглобин Vayne. Когда деления располагается ближе к 5'-концу, активный продукт не синтезируется и развиваются различные формы α-, β- и γ-талассемий.
Некоторые варианты гемоглобинов возникают в результате дупли-каций. Так, гемоглобин Grady несет дупликацию 116—118 аминокислотных остатков в γ-цепи. В гемоглобине Cranston удлинение р-цепи до 158 аминокислотных остатков является результатом дупликации AG-последовательности после 144-го триплета и последующего сдвига рамки с пропитыванием терминального кодона.
Описанное выше свидетельствует о том, что различные отклонения в структуре ДНК глобиновых генов приводят к замене аминокислот или удлинению полипептидных цепей. Это является причиной образования многих вариантов гемоглобина, которые определяют развитие у человека заболеваний, наследующихся в ряду поколений.
Не меньший интерес представляют механизмы развития различных заболеваний человека, в основе которых лежат мутации генов, приводящие к синтезу белков-ферментов со сниженной активностью или к его подавлению. Это нарушает течение процессов, катализируемых данными ферментами в клетках организма. Примером наследственно детерминированных повреждений метаболизма в организме человека служит фенилкетонурия,
развивающаяся вследствие нарушения процессов обмена аминокислоты фенилаланина и накопления в организме токсических промежуточных продуктов.
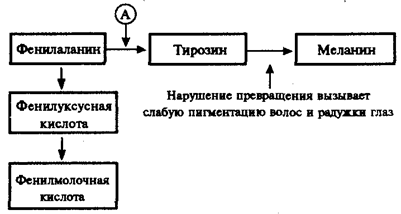
Рис. 4.1. Краткая схема обмена фенилаланина:
А —
фермент фенилаланингидроксилаза, наследственный дефект которого приводит к развитию фенилкетонурии
При дефекте фермента фенилаланингидроксилазы фенилаланин не превращается в тирозин (рис. 4.1) и накапливается в крови больных в больших концентрациях (до 0,5—0,6 г/л вместо 0,003— 0,04 г/л в норме). Это приводит к частичному превращению фенилаланина в фенилуксусную и фенилмолочную кислоты, накопление которых наряду с повышенной концентрацией самого фенилаланина оказывает токсическое действие на мозг ребенка. В результате у детей наблюдается различная степень дефекта умственного развития. Нарушение метаболизма фенилаланина сопровождается также нарушением синтеза пигмента меланина, поэтому у больных наблюдается слабая пигментация волос и радужки глаз. Кроме того, высокая концентрация фенилаланина оказывает ингибирующее влияние на ряд ферментных систем, участвующих в превращении других аминокислот: у больных развивается судорожный синдром, нарастает отставание интеллектуального развития. Наследование фенилкетонурии осуществляется по рецессивному типу.
Таким образом, рассмотренные выше примеры демонстрируют весь спектр действия молекулярно-генетических механизмов, обеспечивающих образование в человеческом организме белков как нормально функционирующих, так и обусловливающих развитие различных патологических состояний. Из сказанного по поводу гемоглобина следует, что, во-первых, образование главного функционального белка эритроцитов находится под генным контролем, во-вторых, формирование тетрамерной формы этого белка, с которой связана его физиологическая активность, требует взаимодействия неаллельных генов α- и β-глобинов.
Специфический контроль небелковой части молекулы гемоглобина также имеет место и осуществляется независимо, через гены ферментов, необходимых для синтеза гема. Особенности проявления патологических признаков у носителей мутантных аллелей свидетельствуют о существовании определенных отношений между ними и нормальными аллелями. Так, аллель серповидно-клеточности в сочетании с нормальным аллелем (3-глобина (НbА HbS) проявляет себя в обычных условиях как рецессивный. Так же ведет себя мутантный аллель гена, детерминирующего синтез фермента фенилаланингидроксилазы. Проявлением взаимодействия между мутантным и нормальным аллелями по типу доминирования последнего является формирование в организме белка с нормальными свойствами у гетерозигот. Отсутствие нормального аллеля в генотипе организма, гомозиготного по мутантному аллелю, приводит к развитию патологического состояния, обусловленного нарушением функциональной активности соответствующего белка.
Особую группу наследственно обусловленных патологических состояний у человека представляют заболевания, причиной которых являются мутации митохондриальной ДНК (мгДНК).
Биосинтез митохондриальных белков находится под контролем двух генетических систем: ядерных и митохондриальных генов. Большая часть белков кодируется ядерной ДНК, синтезируется в цитоплазме, а затем транспортируется в митохондрии. Наряду с этим в кольцевой молекуле ДНК органеллы имеются гены, которые отвечают за собственный синтез белков, а также участвующих в нем тРНК и рРНК. В ядерном геноме имеется значительное количество генов, обеспечивающих функционирование митохондриальной ДНК. Предполагают, что мутации некоторых ядерных генов приводят к делениям значительных участков ДНК митохондрии. В результате нарушается синтез собственных белков, к числу которых относятся и ферменты дыхательных цепей, нарушается дыхательная функция митохондрии.
У человека описано более 100 заболеваний, причиной которых являются изменения в структуре мтДНК (см. 6.4.1.4).
В генетическом материале человека в ряде ситуаций возникают изменения, которые, непосредственно не затрагивая отдельных генов, вызывают серьезные нарушения в состоянии организма. Такие изменения чаще всего касаются структуры хромосом или их числа в клетках. Результатом этого является нарушение баланса генов, т.е. того соотношения доз различных аллелей, которое требуется для нормального развития признаков и организма в целом.
Постоянство кариотипа поддерживается в ряду клеточных поколений благодаря митозу. В ряду поколений организмов это постоянство обеспечивается сочетанием мейоза и оплодотворения. Нарушение митоза и мейоза, обусловливающих закономерное распределение хромосом при образовании соматических и половых клеток, может служить причиной изменения строения и числа этих ядерных структур.
Нередко хромосомные перестройки появляются в результате воздействия на клетки внешних факторов. К таким факторам относится, например, ионизирующее излучение, вызывающее разрывы хромосом и последующие изменения их структуры. У человека описаны также случаи наследственно обусловленной неустойчивости хромосом, их сверхчувствительности к действию агентов различной природы, приводящих к хромосомным разрывам. Это наблюдается при анемии Фанкони, синдроме Блума, атаксии-телеангиэктазии, пигментной ксеродерме. Так, при пигментной ксеродерме высокая чувствительность к ультрафиолетовому свету, сопровождающаяся повышенной ломкостью хромосом, связана с наследственно обусловленным нарушением репарации ДНК.
Изменение числа хромосом, как правило, является результатом нарушения нормального течения клеточных делений, что приводит к образованию анэуплоидных и полиплоидных соматических клеток или гамет с аномальным числом хромосом.
Повреждения механизмов обеспечения наследственности, действующих на клеточном уровне, в масштабе организма приводят к разным результатам. Так, мутации в соматических клетках организма (соматические мутации) могут приводить к различным заболеваниям особи, однако без передачи их потомству при половом размножении. Нарушения наследственной программы в половых клетках (генеративные мутации), не Проявляясь в фенотипе данного организма, ведут к появлению мутантного потомства. Следовательно, точное воспроизведение определенных наследственных характеристик в ряду поколений клеток организма способствует поддержанию здоровья данной особи. Залогом появления здорового в наследственном отношении потомства является в первую очередь сбалансированность генома родительских гамет, содержащего благоприятные аллели генов. При наличии в геноме гаметы одного из родителей «неблагоприятных» аллелей генов их действие может снижаться в результате взаимодействия с нормальными аллелями другого родителя.
Мутации различного ранга (генные, хромосомные или геномные), возникающие в соматических клетках организма, наследуются потомками этих клеток и делают организм мозаиком,
т.е. особью со смешанными популяциями клеток. В разд. 3.6.5.1 и 3.6.5.2 рассмотрены примеры естественного мозаицизма женского организма по активно функционирующим в его клетках Х-хромосомам и связанное с этим явление аллельного исключения, когда в разных клетках организма экспрессируются разные аллели Х-сцепленных генов.
К примеру, у женщины — гетерозиготной носительницы рецессивного аллеля гемофилии — степень нарушения свертывающей системы крови зависит от соотношения соответствующих клеток с генетически инактивированными Х-хромосомами, несущими нормальный или му-тантный аллель.
Нередко у человека встречается мозаицизм по геномным мутациям, связанный с нарушением расхождения хромосом при митозе. Например, в случае синдрома Дауна (трисомия по 21-й хромосоме) мозаицизм встречается с частотой 2 на 48 пациентов, а в популяции их частота равна 1 на 31 000. Чем раньше в ходе развития организма происходит нарушение деления соматических клеток, сопровождающееся нерасхождением дочерних хромосом к полюсам ахроматинового веретена, тем более выраженной будет симптоматика заболевания, вызываемого данной анэуплоидией. Нарушение митоза на более поздних стадиях индивидуального развития приводит к локальному мозаицизму, который может не сопровождаться выраженными отклонениями от нормы. В этом случае наиболее опасным является мозаицизм клеток генеративных тканей, из которых с достаточно большой вероятностью организм может образовывать гаметы с аномальным числом хромосом.
Иногда возникающие соматические мутации являются причиной появления злокачественных новообразований.
На рис. 4.2 представлена последовательность событий, приводящих к образованию таких опухолей. Как правило, в основе лежит повреждение ДНК, вызываемое внутренними факторами (нарушением процессов репликации, репарации или рекомбинации) или внешними воздействиями (ионизирующей радиацией, химическими мутагенами или вирусами). Одним из результатов такого повреждения ДНК может оказаться появление клона клеток, обладающего дефектами регуляции клеточного размножения, что приводит к опухолевому росту.
Причиной злокачественного разрастания ткани могут быть также нарушение митоза и неравноценное распределение хромосом между дочерними клетками с возникновением анэуплоидий или хромосомных аберраций. Это вызывает либо гибель клеток, либо приводит к появлению клонов, способных к неконтролируемому росту. В злокачественных образованиях обычно встречаются субклоны, имеющие разные кариотипы, что свидетельствует о множественных аномалиях митоза в клетках опухолей.
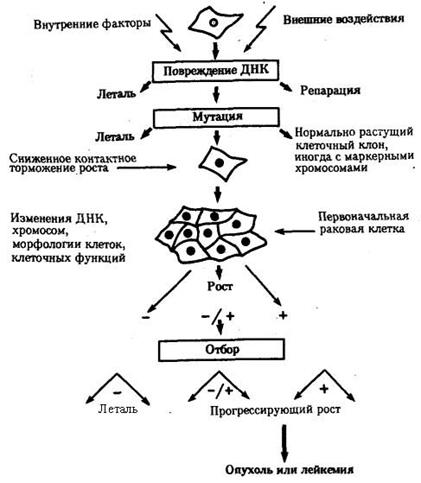
Рис. 4.2. Соматические мутации
как причина злокачественного перерождения тканей
Так как в основе злокачественного перерождения тканей может лежать изменение наследственного материала клеток, становится очевидной важная роль мутагенных факторов в процессе возникновения опухолей. Одним из таких мутагенных факторов являются вирусы,
которые могут индуцировать в хромосомах то или иное мутационное изменение. Среди опухолей человека вирусное происхождение имеет лимфома Беркитта.
Пониманию молекулярно-биологических механизмов опухолевого роста способствовало открытие так называемых онкогенов,
вызывающих злокачественное перерождение клеток и входящих в состав генома ретровирусов. Геном ретровируса состоит из одноцепочечной РНК и содержит ген обратной транскриптазы. При проникновении вируса в клетку-хозяина под контролем фермента обратной транскриптазы образуются множественные копии генетической информации вируса, но уже в виде двухцепочечной ДНК, которые встраиваются в ДНК клетки-хозяина. Функционирование таких ДНК-копий в составе генома клетки приводит к синтезу вирусных РНК и белков, причем вирусный онкоген (v-onc) трансформирует клетку-хозяина в опухолевую.
Использование ДНК-зондов на основе ретровирусных онкогенов обнаружило их гомологию некоторым собственным нуклеотидным последовательностям генома клеток. Эти участки получили название протоонкогенов
или клеточных онкогенов
(c-onc). Протоонкогены участвуют в контроле клеточного роста, но в обычном состоянии не приводят к опухолевой трансформации. Их мутантные аллели, стимулируя митоз, могут вызвать рост опухолей. Иногда активация клеточного онкогена обусловливается единичной точковой мутацией в нем. В других случаях нет необходимости в такой мутации, так как трансформирующий эффект наблюдается при присоединении онкогена к фрагментам ДНК, обладающим сильными промоторными свойствами. В таких ситуациях следует допустить, что протоонкогенам присущи свойства транспозонов, или «прыгающих генов».
Предполагают, что вирусные онкогены на каком-то этапе эволюции произошли от клеточных онкогенов, интегрированных в геном вируса. Причины, обусловливающие большую трансформирующую активность вирусных онкогенов в сравнении с клеточными, до настоящего времени не вполне ясны.
В опухолевых клетках часто наблюдаются хромосомные аномалии, причем некоторые опухоли отличаются наличием специфических хромосомных дефектов.
Установлено, что онкогены нередко обнаруживаются в непосредственной близости от точек разрывов, происходящих при опухолеспецифичных хромосомных перестройках. Это подтверждает их роль в злокачественной трансформации клеток.
Изменения наследственной программы половых клеток человека приводят к рождению потомства с различными наследственно обусловленными болезнями, в зависимости от ранга мутаций — генными
или хромосомными.
Различные генные мутации по-разному сказываются на жизнеспособности организма, причем в случае их рецессивности они могут долго не проявляться фенотипически у потомков. Хромосомные перестройки и геномные мутации приводят к выраженным отклонениям в развитии и часто являются причиной гибели организма на разных стадиях его онтогенеза, обычно в раннем эмбриогенезе. В значительной степени именно этими мутациями определяется высокий процент (15%) прерывания диагностированных беременностей.
Триплоидии плода,
как правило, приводят к прерыванию беременности на ранних стадиях, однако описано очень небольшое число случаев живорождения триплоидов. Анэуплоидия
по разным хромосомам встречается как в материале абортусов, так и у рожденных детей. Некоторые анэуплоидий несовместимы с жизнью. Так, трисомия по 16-й хромосоме обнаруживается только в материале абортусов. В то же время у человека известны синдромы, связанные с аномалиями числа хромосом, характеризующиеся разной степенью жизнеспособности.
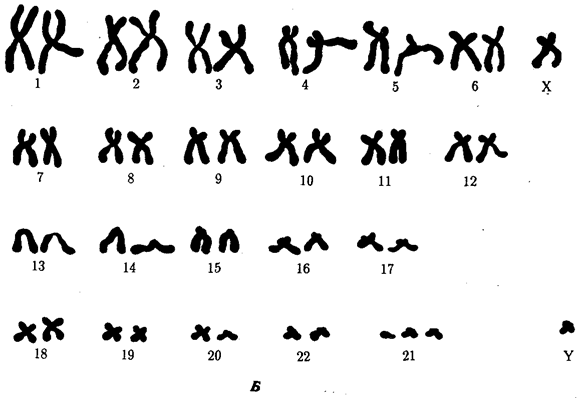
Рис. 4.3. Синдром трисомии 21 (синдром Дауна).
А —
внешний вид больного; Б —
кариотип больного
Наиболее частым хромосомным заболеванием у человека является синдром Дауна,
обусловленный три-сомией по 21-й хромосоме, встречающийся с частотой 1—2 на 1000 (рис. 4.3). Примерно в 60% случаев трисомия 21 является причиной гибели плода, около 30% родившихся умирает на первом году жизни. Еще 46% не переживает Злетний рубеж, однако иногда люди с синдромом Дауна доживают до значительного возраста (рис. 4.4), хотя в целом продолжительность их жизни сокращена. Применение эффективных противомикробных препаратов позволяет несколько увеличить продолжительность жизни таких больных. Трисомия 21 может быть результатом случайного нерасхождения гомологичных хромосом в мейозе. Наряду с этим известны случаи регулярной трисомии, связанной с транслокацией 21-й хромосомы на другую —21, 22, 13, 14 или 15-ю хромосому (рис. 4.5).

Рис. 4.4. Женщина с синдромом Дауна в возрасте 38 лет
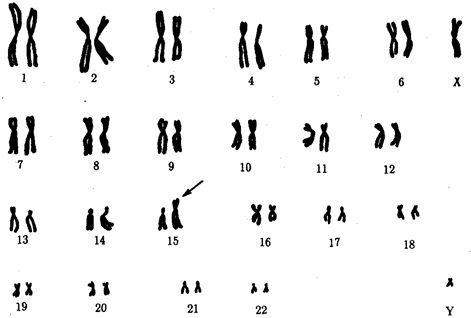
Рис. 4.5. Кариотип при транслокационном синдроме Дауна
(одна 21-я хромосома присоединена к 15-й хромосоме — указано стрелкой)
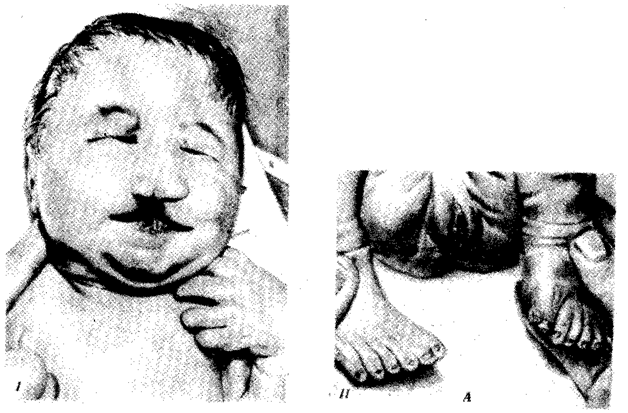
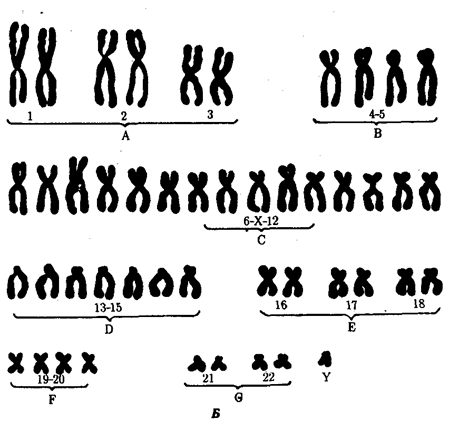
Рис. 4.6. Синдром трисомии 13 (синдром Патау).
А —
внешний вид больного; Б —
кариотип больного с трисомией в группе D:
I
— аномалии лица, II
— двусторонняя полисиндактилия стоп
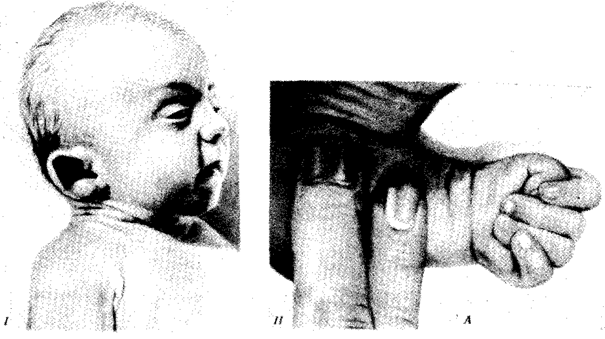
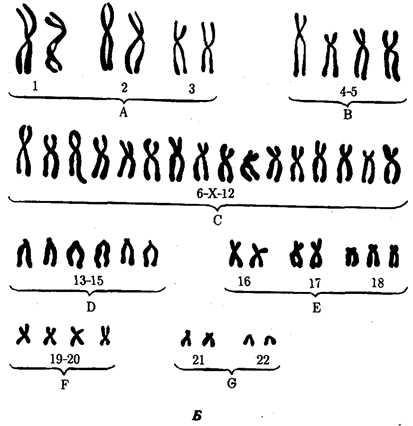
Рис. 4.7. Синдром трисомии 18 (синдром Эдвардса). А —
внешний вид больного; Б —
кариотип больного при трисомии в группе Е:
I
— черепно-лицевые аномалии, II
— характерное расположение пальцев на кистях больного
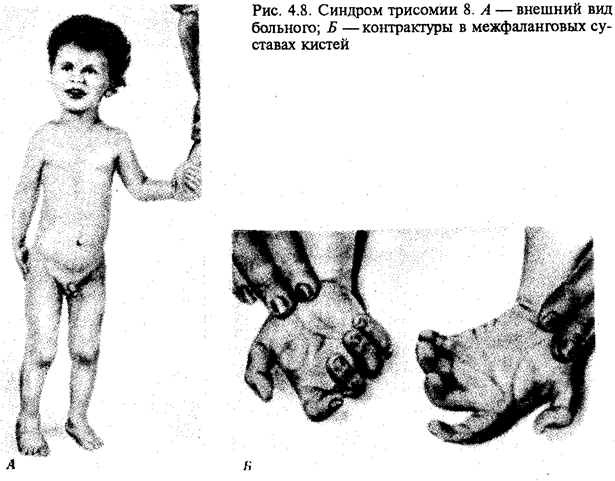
Среди других аутосомных трисомий известны трисомии по 13-й хромосоме — Синдром Патау
(рис. 4.6), а также по 18-й хромосоме — синдром Эдвардса
(рис. 4.7), при которых жизнеспособность новорожденных резко снижена. Они гибнут в первые месяцы жизни из-за множественных пороков развития. Применение методов дифференциального окрашивания хромосом позволило открыть три новых синдрома, обусловленных трисомиями по 8, 9 и 22-й хромосомам, при которых также наблюдаются тяжелые комплексные пороки развития (рис. 4.8).
Достаточно часто у человека встречаются анэуплоидии по половым хромосомам
(рис. 4.9—4.11). В отличие от анэуплоидии по аутосомам дефекты умственного развития у больных выражены не столь отчетливо, у многих оно в пределах нормы, а иногда даже выше среднего. Вместе с тем у них постоянно наблюдаются нарушения развития половых органов и гормонозависимого роста тела. Реже встречаются пороки развития других систем. Относительно благоприятные последствия увеличения числа Х-хромосом, видимо, связаны с возможностью компенсации дозы соответствующих генов благодаря естественной генетической инактивации этих хромосом, а также мозаичному характеру такой инактивации.
Среди анэуплоидных синдромов по половым хромосомам моносомия
Х (ХО) (синдром Шерешевского — Тернера
) встречается много реже, чем трисомия
X, синдром Клайнфельтера
(XXY, XXXY), а также XYY, что указывает на наличие сильного отбора против гамет, не содержащих половых хромосом, или против зигот ХО. Это предположение подтверждается достаточно часто наблюдаемой моносомией Х среди спонтанно абортированных зародышей. В связи с этим допускается, что выжившие зиготы ХО являются результатом не мейотического, а митотического нерасхождения, или утраты Х-хромосомы на ранних стадиях развития (см. рис. 4.9). Моносомии YO у человека не обнаружено.
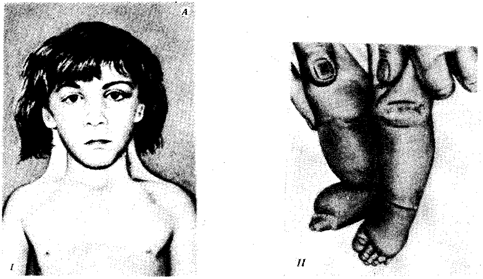
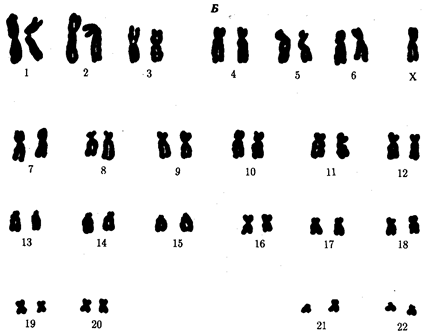
Рис. 4.9. Синдром моносомии Х (ХО-синдром, синдром Шерешерского — Тернера). А —
внешний вид больной; Б —
кариотип женщины с синдромом ХО:
I
— выраженная трапециевидная шейная складка, широкая грудная клетка, широко расставленные, слаборазвитые соски молочных желез,
II —
характерные лимфатические отеки на ногах
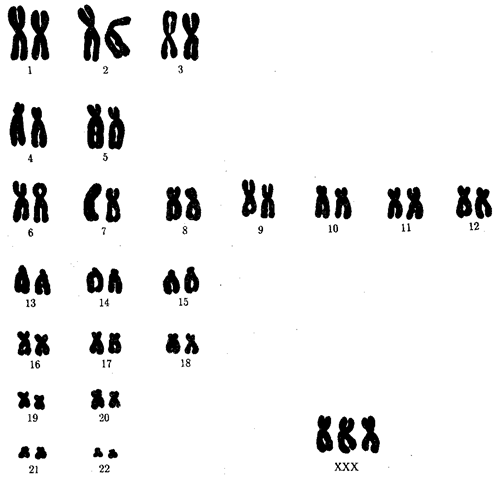
Рис. 4.10. Кариотип женщины с синдромом трисомии Х
Рис. 4.11. Синдром Клайнфельтера. А —
внешний вид больного (характерен высокий рост, непропорционально длинные конечности); Б—
кариотип больного (XXY)
Организмы с анэуплоидией по половым хромосомам при наличии Y-хромосомы развиваются по мужскому типу и фенотипически дают синдром Клайнфельтера (рис. 4.11). Это является еще одним свидетельством в пользу расположения фактора, определяющего мужской тип развития в Y-хромосоме.
Из синдромов, связанных со структурными аномалиями хромосом, известен транслокационный синдром Дауна
(см. рис. 4.5), при котором число хромосом в кариотипе формально не изменено и равно 46, так как дополнительная 21-я хромосома транслоцирована на одну из акроцентрических хромосом. При транслокации длинного плеча 22-й хромосомы на 9-ю развивается хронический миелолейкоз.
При делении короткого плеча 5-й хромосомы развивается синдром кошачьего крика,
при котором наблюдаются общее отставание в развитии, низкая масса при рождении, лунообразное лицо с широко расставленными глазами и характерный плач ребенка, напоминающий кошачье мяукание, причиной которого является недоразвитие гортани (рис. 4.12).
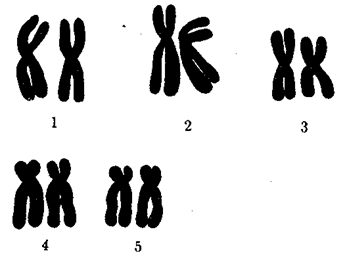
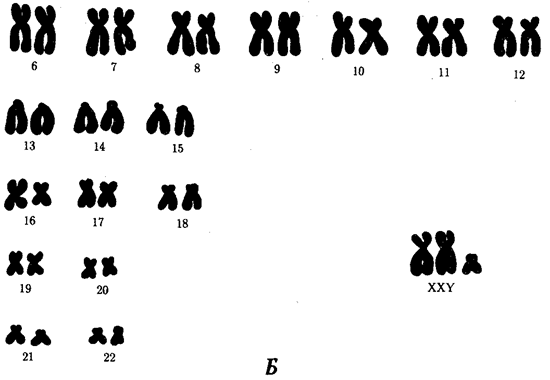
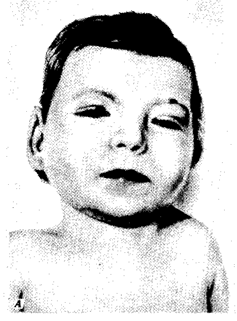
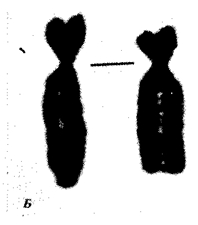
Рис. 4.12. Синдром хромосомы 5р (синдром кошачьего крика).
А —
внешний вид больного; Б —
деления короткого плеча 5-й хромосы
У носителей некоторых перицентрических инверсий
нередко наблюдаются аномалии в виде умственной отсталости той или иной степени и пороков развития. Довольно часто такие перестройки наблюдаются в 9-й хромосоме человека, однако они существенно не влияют на развитие организма.
Таким образом, нарушение наследственной программы организма, развивающегося из аномальных гамет, или мозаицизм его клеток, связанный с соматическими мутациями, являются причиной либо гибели организма, либо более или менее выраженного снижения его жизнеспособности.
В иерархической системе организации живого онтогенетический уровень
тесно связан с другими уровнями. Элементарной единицей жизни здесь является особь
, в процессе ее индивидуального развития. Реально существующие в природе организмы на протяжении жизни непосредственно взаимодействуют с окружающей средой — неживой природой, особями своего и других видов. В этом проявляется взаимосвязь онтогенетического, популяционно-видового, биогеоценотического и биосферного уровней, в .которые так или иначе включены отдельные организмы. В процессе взаимодействия особей с окружающей средой осуществляется отбор организмов, наиболее приспособленных в силу их наследуемых свойств. Основной задачей, решаемой на онтогенетическом уровне, является формирование организма, способного произвести потомство, передав ему наследственную программу, на основе которой у нового поколения формируются характерные черты данного вида. При половом размножении эта задача решается не единичной особью, а в рамках популяции организмов данного вида, в которой находятся особи обоих полов.
Установив непосредственную связь онтогенетического уровня с надорганизменными уровнями организации жизни, нужно отметить, что для осуществления основной задачи — оставления потомства и обеспечения непрерывности существования вида — необходимо обеспечить формирование зрелого в репродуктивном отношении организма и его жизнеспособность на всех стадиях онтогенеза. Это достигается благодаря функционированию элементарных единиц суборганизменных уровней организации —молекулярно-генетического и клеточного.
Изучение биологических закономерностей, действующих на онтогенетическом уровне организации живого, представляет особый интерес в системе медицинского образования, так как индивидуальное развитие человека в норме и при патологических отклонениях является важным объектом непосредственной врачебной деятельности.
Среди многообразных проявлений жизнедеятельности (питание, обустройство местообитания, защита от врагов) размножению
принадлежит особая роль. В известном смысле существование организма является подготовкой к выполнению им главной биологической задачи — участию в размножении. В основе способности организмов к размножению лежат определенные клеточные механизмы.
Продолжительность жизни особи короче продолжительности существования вида, к которому она принадлежит. Поэтому история вида — это история сменяющихся поколений организмов. Очередное (дочернее) поколение образуется в результате размножения особей предшествующего (родительского) поколения. Способность к размножению является неотъемлемым свойством живых существ. С его помощью сохраняются во времени биологические виды и жизнь как таковая. Биологическая роль размножения состоит в том, что оно обеспечивает смену поколений.
Различия, закономерно проявляющиеся в фенотипах особей разных поколений, делают возможным естественный отбор и, следовательно, эволюцию жизни.
Размножение возникло в ходе исторического развития органического мира на. самом раннем этапе вместе с клеткой. В процессе биологического размножения наряду со сменой поколений и поддержанием достаточного уровня внутривидовой изменчивости решаются также задачи увеличения числа особей, сохранения складывающихся в эволюции типов структурно-физиологической организации
(путем воспроизведения себе подобного). Последнее связано с тем, что при размножении осуществляется передача в ряду поколений генетического материала (ДНК), т.е. определенной, специфичной для данного вида биологической информации.
В зависимости от характера клеточного материала, используемого в целях размножения, выделяют различные способы и формы последнего. Различают два способа размножения: бесполое
и половое
(табл. 5.1).
Различные формы бесполого размножения
представлены на сх. 5.1. Деление надвое
приводит к возникновению из одного родительского организма двух дочерних. Оно является преобладающей формой у прокариот и простейших, но встречается и у многоклеточных: продольное
у медуз, поперечное
у кольчатых червей. Множественное деление
(шизогония
) встречается среди простейших, в том числе паразитов человека (малярийный плазмодий). При размножении почкованием
потомок формируется первоначально как вырост на теле родителя с последующей его отшнуровкой (гидра). Фрагментация
заключается в распаде тела многоклеточного организма на части, которые далее превращаются в самостоятельных особей (плоские черви, иглокожие). У видов, размножающихся спорами,
дочерний организм развивается из специализированной клетки-споры.
Таблица 5.1. Общая характеристика бесполого и полового размножения
| Показатель
|
Способ размножения
|
| бесполое
|
половое
|
| 1. Клеточные источники наследственной информации для развития потомка
Родители
Потомство
Главный клеточный
механизм
Эволюционное значение
|
Многоклеточные: одна или несколько соматических (телесных) клеток родителя; одноклеточные: клетка-организм как целое
Одна особь
Генетически точная копия родителя, т.е. в отсутствие
соматических мутаций клон
организмов
Митоз
Способствует поддержанию наибольшей приспособленности в маломеняющихся условиях обитания, усиливает роль
стабилизирующего естественного отбора
|
Родители образуют половые клетки (гаметы), специализированные к выполнению функции размножения. Родитель представлен в потомке исходно одной клеткой
Обычно две особи
Генетически отличны от обоих родителей
Мейоз
За счет генетического
разнообразия создает пред
посылки к освоению разнообразных условий обитания; дает эволюционные и экологические перспективы;
способствует осуществлению
творческой роли естественного отбора
|
В зависимости от формы бесполого размножения потомок развивается либо из одной клетки (спорообразование, шизогония, деление), либо из группы клеток родителя. В последнем случае размножение называют вегетативным.
Оно распространено среди растений.
Бесполое размножение наблюдается у животных с относительно низким уровнем структурно-физиологической организации, к которым принадлежат многие паразиты человека. У паразитов бесполое размножение не только служит увеличению численности особей, но способствует расселению, помогает пережить неблагоприятные условия.
Хотя в процессе развития жизни бесполое размножение возникло первьш, половое размножение существует на Земле уже более 3 млрд. лет. Оно обнаруживается в жизненных циклах всех основных групп организмов. Распространенность полового размножения объясняется тем, что оно обеспечивает значительное генетическое разнообразие
и, следовательно, фенотипическую изменчивость потомства.
Этим достигаются большие эволюционные и экологические (расселение в разные среды) возможности.
Схема 5.1. Формы бесполого размножения
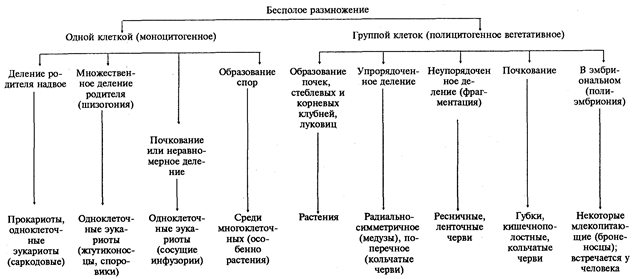
В основе полового размножения лежит половой процесс,
суть которого сводится к объединению в наследственном материале для развития потомка генетической информации от двух разных источников — родителей. Представление о половом процессе дает явление конъюгации,
например инфузорий. Он заключается во временном соединении двух особей с целью обмена (рекомбинации) наследственным материалом. В результате появляются особи, генетически отличные от родительских организмов. В дальнейшем они осуществляют бесполое размножение. Поскольку количество инфузорий после конъюгации остается неизменным, говорить о размножении в прямом смысле нет оснований. У простейших половой процесс может осуществляться в виде копуляции,
которая заключается в слиянии двух особей в одну, объединении и рекомбинации наследственного материала. Далее такая особь размножается делением. На определенном этапе эволюции у многоклеточных организмов половой процесс как способ обмена генетической информацией между особями в пределах вида оказался связанным с размножением.
Для участия в половом размножении в родительских организмах вырабатываются гаметы —
клетки, специализированные к обеспечению генеративной функции. Слияние материнской и отцовской гамет приводит к возникновению зиготы —
клетки, представляющей собой дочернюю особь на первой, наиболее ранней стадии индивидуального развития.
У некоторых организмов зигота образуется в результате объединения гамет, неотличимых по строению. В таких случаях говорят об изогамии,
У большинства видов по структурным и функциональным признакам половые клетки делятся на материнские
(яйцеклетки
) и отцовские
(сперматозоиды
).
Как правило, яйцеклетки и сперматозоиды вырабатываются разными организмами — женскими (самки) и мужскими (самцы). В подразделении гамет на яйцеклетки и сперматозоиды, а особей на самок и самцов заключается явление полового диморфизма
(рис. 5.1; 5.2). Наличие его в природе отражает различия в задачах, решаемых в процессе полового размножения мужской или женской гаметой, самцом или самкой.
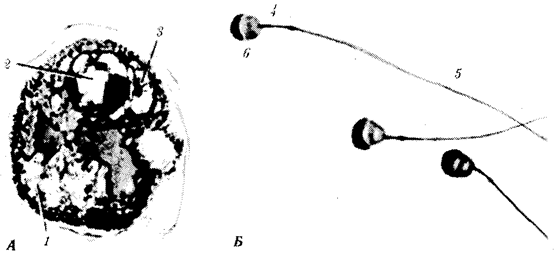
Рис. 5.1. Половой диморфизм на уровне половых клеток.
А —
яйцеклетка; Б —
сперматозоиды:
1
— цитоплазма, 2 —
ядро, 3 —
хроматин ядра, 4 —
шейка, 5 —
жгутик,
6 —
головка
Образование гамет обоих видов в одном организме, имеющем и мужскую, и женскую половые железы, называют гермафродитизмом
1
.
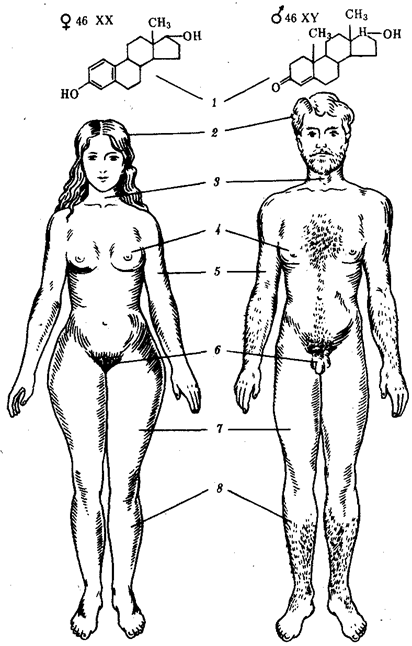
Рис. 5.2. Половой диморфизм у людей на организменном уровне
Характерны различия по: 1 —
кариотипу и главному половому гормону, 2 —
структуре волос и характеру оволосения, 3 —
строению гортани, 4 —
развитию молочных желез, 5 —
развитию мускулатуры, 6 —
строению половых органов, 7 — распределению жировой ткани, 8 —
показателям роста длинных трубчатых костей
Гермафродитизм характерен для некоторых паразитов человека, например плоских червей. Несмотря на продукцию гермафродитами и мужских, и женских гамет, самооплодотворение для них нетипично, что связано обычно с несовпадением времени созревания яйцеклеток и сперматозоидов. Истинный гермафродитизм описан у человека. Чаще он развивается в результате нарушения эмбриогенеза при одинаковом наборе половых хромосом — XX или XY во всех соматических клетках. У некоторых людей-гермафродитов обнаружен мозаицизм по половым хромосомам. Одни соматические клетки имеют пару XX, другие — XY.
Хотя оплодотворение представляет собой характерный признак полового размножения, дочерний организм иногда развивается из неоплодотворенной яйцеклетки. Это явление называют девственным развитием
или партеногенезом.
Источником наследственного материала для развития потомка в этом случае обычно служит ДНК яйцеклетки — гиногенез.
Реже наблюдается андрогенез —
развитие потомка из клетки с цитоплазмой ооцита и ядром сперматозоида. Ядро женской гаметы в случае андрогенеза погибает.
Обязательный партеногенез является измененной формой полового размножения в эволюции некоторых видов животных. У пчел, например, он используется как механизм генотипического определения пола: женские особи (рабочие пчелы и царицы) развиваются из оплодотворенных яйцеклеток, а мужские (трутни) — партеногенетически. Партеногенез включен в жизненные циклы многих паразитов. Он обеспечивает рост численности особей в условиях, затрудняющих встречу партнеров противоположного пола. Имеются указания на возможность девственного развития у человека. В яичниках девушек, погибших при случайных обстоятельствах, в отсутствие предшествующего осеменения находили зародыши на ранних этапах дробления. Невозможность завершенного партеногенеза у людей в настоящее время доказана и связана с необходимостью наличия обоих геномов, мужского и женского (см. с. 250—251). Наблюдения завершенного эмбриогенеза с партеногенетическим развитием в отношении человека отсутствуют. При партеногенезе, как и при типичном половом размножении, развиваются особи с диплоидными соматическими клетками. Восстановление диплоидного набора хромосом происходит обычно путем слияния ооцита и редукционного тельца во втором делении мейоза.
У некоторых видов закономерно наблюдается полиэмбриония —
бесполое размножение зародыша, возникающего путем полового размножения. Полиэмбриония, к примеру, типична для броненосцев и заключается в разделении на стадии бластулы клеточного материала первоначально одного зародыша между 4—8 зародышами, из которых развиваются полноценные особи. В результате полиэмбрионии у человека рождаются однояйцевые близнецы.
Большинство организмов, обычно размножающихся бесполым путем, способно к половому размножению. При этом ряд поколений с бесполым размножением сменяется поколением особей, размножающихся с помощью гамет или же осуществляющих половой процесс. Вслед за этим вновь наблюдается бесполое размножение. Смена
(чередование
) половых и бесполых поколений
происходит у разных видов с разной периодичностью, регулярно или через неодинаковые промежутки времени.
Первичное чередование поколений
заключается в смене полового размножения спорообразованием. Оно наблюдается у представителей классов споровиков, жгутиконосцев, некоторых растений и отражает сохранение в филогенезе соответствующих организмов как более древней (бесполой), так и более прогрессивной (половой) форм размножения. Вторичное чередование поколений
заключается в переходе на некоторых стадиях жизненного цикла к бесполому или партеногенетическому размножению животных, освоивших половое размножение. Оно распространено у кишечнополостных, членистоногих.
Включение в цикл развития организмов, размножающихся преимущественно бесполым путем, полового поколения время от времени активизирует комбинативную изменчивость и этим способствует преодолению генетического однообразия потомков, расширяя эволюционные и экологические перспективы группы.
По сравнению с другими клетками функция гамет уникальна. Они обеспечивают передачу наследственной информации между особями разных поколений, чем сохраняют жизнь во времени. Был период в биологии, когда половые и соматические клетки противопоставляли друг другу, наделяя лишь первые всей полнотой свойств жизни, проносимых ими через поколения. В настоящее время экспериментально доказана возможность развития полноценного организма на основе наследственной информации ядра дифференцированной соматической клетки, например кишечного эпителия (рис. 5.3).
В 1990-х годах группе английских ученых, использовавших принципиально аналогичный подход, удалось вырастить (клонировать) овцуДолли. Это был пример успешного решения задачи получения взрослой особи на основе генетического материала соматической клетки у млекопитающих. Напомним, что клоны представлены генетически идентичными клетками, образовавшимися путем последовательных митотических делений исходно одной клетки-родоначальницы и ее потомков. Вытекающая из этого техническая возможность клонирования людей порождает серьезные морально-этические проблемы, так как допускает преднамеренное «тиражирование» избранного человека с присущим только ему набором физических психо-эмоциональных свойств и даже интеллектуального потенциала. В настоящее время общественностью, в том числе и научной, признается недопустимым клонирование людей. Вместе с тем, использование технологии клонирования для получения достаточного числа клеток определенного типа, генетически неотличимых от клеток данного организма и, следовательно, иммунологически с ним совместимых, рассматривается как перспективное направление в области трансплантации тканей.
Рис. 5.3. Опыт, показывающий функциональную полноценность наследственного материала дифференцированной клетки:
1
— яйцеклетка с убитым УФ-лучами ядром — источник цитоплазмы, 2 — эпителиальные клетки кишечника головастика — источник наследственного материала, 3 —
ядро, 4 —
пересадка ядра из эпителиальной клетки в яйцеклетку, 5 —
головастик, 6 —
лягушка
Гаметы
представляют собой одно из многих направлений дифференцировки клеток многоклеточного организма. Они образуют «клеточную линию», специализированную к выполнению репродуктивной функции. Предполагают, что клетки указанной линии возникают из бластомеров, имеющих на вегетативном полюсе цитоплазму особого рода — так называемую зародышевую плазму
1
, богатую РНК.
В сравнении с другими линиями соматических клеток (эпителиальные, нервные, мышечные) гаметы характеризуются рядом отличий. Важнейшее из них — гаплоидный набор хромосом
в ядрах, что обеспечивает воспроизведение в зиготе типичного для организмов данного вида диплоидного числа хромосом.
Действительно, оплодотворение сперматозоидом яйцеклетки, ядра которых содержат по 23 хромосомы, обусловливает формирование зиготы с 46 хромосомами, что типично для соматических клеток человека. Гаметы отличаются необычным для других клеток значением ядерно-цитоплазматического отношения.
У яйцеклеток оно снижено благодаря увеличенному объему цитоплазмы, в которой размещен питательный материал (желток) для развития зародыша. У сперматозоидов благодаря малому количеству цитоплазмы ядерно-цитоплазматическое отношение высокое. Это находится в соответствии с главной функциональной задачей мужской гаметы — транспортировкой наследственного материала к яйцеклетке.
Половые клетки отличаются низким уровнем обменных процессов,
близким к состоянию анабиоза. Мужские гаметы не вступают в митотический цикл.
У яйцеклеток эта способность восстанавливается при оплодотворении или действии фактора, активирующего партеногенез.
По ряду признаков женские и мужские гаметы отличаются друг от друга, что связано с различными функциями яйцеклетки и сперматозоида в процессе размножения. Яйцеклетки имеют оболочки, которые выполняют защитную функцию, обеспечивают требуемый уровень обмена веществ, препятствуют проникновению в яйцеклетку более одного спермия, способствуют внедрению (имплантации) зародыша в стенку матки у плацентарных животных, поддерживают форму зародыша.
Для яйцеклетки характерна плазматическая сегрегация.
После оплодотворения (у асцидий уже через 5 мин) в еще не дробящемся яйце происходит закономерное перераспределение цитоплазмы. В дальнейшем цитоплазма разного состава также закономерно распределяется по клеткам тканей разных зачатков. По-видимому, на ранних стадиях способность бластомеров развиваться в определенном направлении зависит от наследования ими веществ, концентрирующихся в разных участках цитоплазмы яйцеклетки.
Сперматозоид имеет аппарат движения
в виде жгутика. В семенной жидкости мужская гамета человека развивает скорость до 5 см/ч. Поясним приводимую цифру следующим примером. Если учесть соотношение преодолеваемого расстояния и длины движущегося объекта, то при названной скорости сперматозоид человека перемещается в 1,5 раза быстрее, чем пловец олимпийского ранга. Яйцеклетка, лишенная аппарата активного движения, преодолевает расстояние до полости матки, равное примерно 10 см, за 4—7 сут. Сперматозоиды некоторых видов животных имеют акросомный аппарат,
выбрасывающий при контакте с яйцеклеткой длинную нить. Он обеспечивает проникновение ядра мужской гаметы в цитоплазму яйцеклетки путем растворения особыми ферментами ее оболочек. Описаны и другие приспособления, способствующие оплодотворению.
Гаметогенез —
процесс образования яйцеклеток (овогенез
) и сперматозоидов (сперматогенез
) —
подразделяется наряд стадий (рис. 5.4).
В стадии размножения
диплоидные клетки, из которых образуются гаметы, называют сперматогониями
и овогониями.
Эти клетки осуществляют серию последовательных митотических делений, в результате чего их количество существенно возрастает. Сперматогонии размножаются на протяжении всего периода половой зрелости мужской особи. Размножение овогоний приурочено главным образом к периоду эмбриогенеза. У человека в женском организме этот процесс наиболее интенсивно протекает в яичниках между 2-м и 5-м месяцами внутриутробного развития. К 7-му месяцу большая часть овоцитов входит в профазу I мейоза.
Так как способом размножения клеток-предшественниц женских и мужских гамет является митоз, то овогоний и сперматогонии, как и все соматические клетки, характеризуются диплоидностью. В ходе митотического цикла их хромосомы имеют либо однонитчатую (после митоза и до завершения синтетического периода интерфазы), либо двунитчатую (постсинтетический период, профаза и метафаза митоза) структуру в зависимости от количества биспиралей ДНК. Если в одинарном, гаплоидном наборе число хромосом обозначить как п,
а количество ДНК — как с
, то генетическая формула клеток в стадии размножения соответствует 2п
2с
до S-периода и 2n
4c
после него.
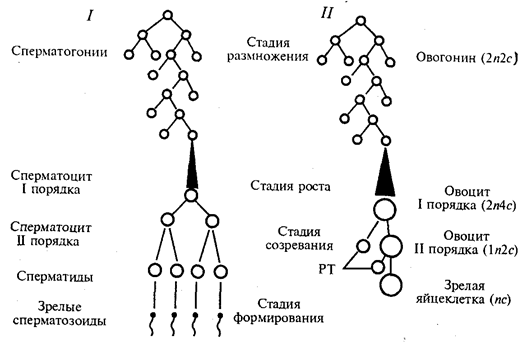
Рис. 5.4. Схема гаметогенеза:
1
— сперматогенез, 2 —
овогенез, n
— количество хромосомных наборов,
с
— количество ДНК, РТ — редукционные тельца
На стадии роста
происходит увеличение клеточных размеров и превращение мужских и женских половых клеток в сперматоциты
и овоциты I порядка,
причем последние достигают больших размеров, чем первые. Одна часть накапливаемых веществ представляет собой питательный материал (желток в овоцитах), другая — связана с последующими делениями. Важным событием этого периода является репликация ДНК при сохранении неизменным числа хромосом. Последние приобретают двунитчатую структуру, а генетическая формула сперматоцитов и овоцитов I порядка приобретает вид 2n
4с
.
Основными событиями стадии созревания
являются два последовательных деления: редукционное и эквационное, которые вместе составляют мейоз
(см. разд. 5.3.2). После первого деления образуются сперматоциты
и овоциты II порядка
(формула n
2с
), а после второго — сперматиды и зрелая яйцеклетка
(пс
).
В результате делений на стадии созревания каждый сперматоцит I порядка дает четыре сперматиды,
тогда как каждый овоцит I порядка — одну полноценную яйцеклетку
и редукционные тельца,
которые в размножении не участвуют. Благодаря этому в женской гамете концентрируется максимальное количество питательного материала — желтка.
Процесс сперматогенеза завершается стадией формирования,
или спермиогенеза.
Ядра сперматид уплотняются вследствие сверхспирализации хромосом, которые становятся функционально инертными. Пластинчатый комплекс перемещается к одному из полюсов ядра, образуя акросомный аппарат, играющий большую роль в оплодотворении. Центриоли занимают место у противоположного полюса ядра, причем от одной из них отрастает жгутик, у основания которого в виде спирального чехлика концентрируются митохондрии. На этой стадии почти вся цитоплазма сперматиды отторгается, так что головка зрелого сперматозоида практически ее лишена.
Центральным событием гаметогенеза является особая форма клеточного деления — мейоз.
В отличие от широко распространенного митоза, сохраняющего в клетках постоянное диплоидное число хромосом, мейоз приводит к образованию из диплоидных клеток гаплоидных гамет. При последующем оплодотворении гаметы формируют организм нового поколения с диплоидным кариотипом (пс
+ пс
== 2n
2c
). В этом заключается важнейшее биологическое значение мейоза, который возник и закрепился в процессе эволюции у всех видов, размножающихся половьм путем (см. разд. 3.6.2.2).
Мейоз состоит из двух быстро следующих одно за другим делений, происходящих в периоде созревания. Удвоение ДНК для этих делений осуществляется однократно в периоде роста. Второе деление мейоза следует за первым практически сразу так, что наследственный материал не синтезируется в промежутке между ними (рис. 5.5).
Первое мейотическое деление называют редукционным,
так как оно приводит к образованию из диплоидных клеток (2п
2с
) гаплоидных клеток п
2с.
Такой результат обеспечивается благодаря особенностям профазы первого деления мейоза. В профазе I мейоза, так же как в обычном митозе, наблюдается компактная упаковка генетического материала (спирализация хромосом). Одновременно происходит событие, отсутствующее в митозе: гомологичные хромосомы конъюгируют друг с другом, т.е. тесно сближаются соответствующими участками.
В результате конъюгации образуются хромосомные пары, или биваленты,
числом п.
Так как каждая хромосома, вступающая в мейоз, состоит из двух хроматид, то бивалент содержит четыре хроматиды. Формула генетического материала в профазе I остается 2n
4c
. К концу профазы хромосомы в бивалентах, сильно спирализуясь, укорачиваются. Так же как в митозе, в профазе I мейоза начинается формирование веретена деления, с помощью которого хромосомный материал будет распределяться между дочерними клетками (рис. 5.5).
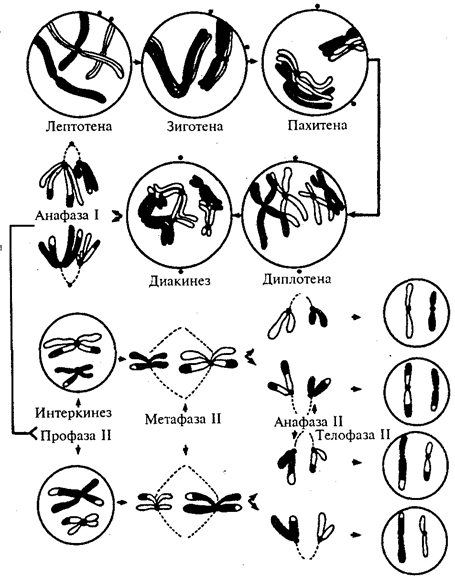
Рис. 5.5. Стадии мейоза
Отцовские хромосомы обозначены черным цветом, материнские —неокрашснные. На рисунке не изображена метафаза I, в которой биваленты располагаются в плоскости экватора веретена деления, и телофаза I, быстро переходящая в профазу II
Процессы, происходящие в профазе I мейоза и определяющие его результаты, обусловливают более продолжительное течение этой фазы деления по сравнению с митозом и дают возможность выделить несколько стадий в ее пределах (рис. 5.5).
Лептотена —
наиболее ранняя стадия профазы I мейоза, в которой начинается спирализация хромосом, и они становятся видимыми в микроскоп как длинные и тонкие нити. Зиготена
характеризуется началом конъюгации гомологичных хромосом, которые объединяются синаптонемальным комплексом в бивалент (рис. 5.6). Пахитена —
стадия, в которой на фоне продолжающейся спирализации хромосом и их укорочения, между гомологичными хромосомами осуществляется кроссинговер —
перекрест с обменом соответствующими участками. Диплотена
характеризуется возникновением сил отталкивания между гомологичными хромосомами, которые начинают отдаляться друг от друга в первую очередь в области центромер, но остаются связанными в областях прошедшего кроссинговера — хиазмах
(рис. 5.7).
Диакинез —
завершающая стадия профазы I мейоза, в которой гомологичные хромосомы удерживаются вместе лишь в отдельных точках хиазм. Биваленты приобретают причудливую форму колец, крестов, восьмерок и т.д. (рис. 5.8).

Рис. 5.6. Образование бивалентов конъюгирующими хромосомами в зиготене:
1 —
центрмеры
Таким образом, несмотря на возникающие между гомологичными хромосомами силы отталкивания, в профазе I не происходит окончательного разрушения бивалентов. Особенностью мейоза в овогенезе является наличие специальной стадии — диктиотены,
отсутствующей в сперматогенезе. На этой стадии, достигаемой у человека еще в эмбриогенезе, хромосомы, приняв особую морфологическую форму «ламповых щеток», прекращают какие-либо дальнейшие структурные изменения на многие годы. По достижении женским организмом репродуктивного возраста под влиянием лютеинизирующего гормона гипофиза, как правило, один овоцит ежемесячно возобновляет мейоз.
В метафазе
I
мейоза завершается формирование веретена деления. Его нити прикрепляются к центромерам хромосом, объединенных в биваленты, таким образом, что от каждой центромеры идет лишь одна нить к одному из полюсов веретена. В результате нити, связанные с центромерами гомологичных хромосом, направляясь к разным полюсам, устанавливают бивалентны в плоскости экватора веретена деления.

Рис. 5.7. Стадии диплотены в мейозе кузнечика
В анафазе I
мейоза ослабляются связи между гомологичными хромосомами в бивалентах и они отходят друг от друга, направляясь к разным полюсам веретена деления. При этом к каждому полюсу отходит гаплоидный набор хромосом, состоящих из двух хроматид (см. рис. 5.5).

Рис. 5.8. Стадия диакинеза в мейозе у человека.
Стрелками указаны хиазмы
В телофазе
I мейоза у полюсов веретена собирается одинарный, гаплоидный набор хромосом, каждая из них содержит удвоенное количество ДНК.
Формула генетического материала образующихся дочерних клеток соответствует п
2с.
Второе мейотическое
(эквационное
) деление
приводит к образованию клеток, в которых содержание генетического материала в хромосомах будет соответствовать их однонитчатой структуре пс
(см. рис. 5.5). Это деление протекает, как митоз, только клетки, вступающие в него, несут гаплоидный набор хромосом. В процессе такого деления материнские двунитчатые хромосомы, расщепляясь, образуют дочерние однонитчатые.
Одна из главных задач мейоза — создание клеток с гаплоидным набором однонитчатых хромосом —
достигается благодаря однократной редупликации ДНК для двух последовательных делений мейоза, а также благодаря образованию в начале первого мейотического деления пар гомологичных хромосом и дальнейшего их расхождения в дочерние клетки.
Процессы, протекающие в редукционном делении, обеспечивают также не менее важное следствие — генетическое разнообразие гамет,
образуемых организмом. К таким процессам относят кроссинговер, расхождение гомологичных хромосом в разные гаметы
и независимое поведение бивалентов в первом мейотическом делении
(см. разд. 3.6.2.3).
Кроссинговер
обеспечивает перекомбинацию отцовских и материнских аллелей в группах сцепления (см. рис. 3.72). Ввиду того что перекрест хромосом может происходить в разных участках, кроссинговер в каждом отдельном случае приводит к обмену разным по количеству генетическим материалом. Необходимо отметить также возможность возникновения нескольких перекрестов между двумя хроматидами (рис. 5.9) и участия в обмене более чем двух хроматид бивалента (рис. 5.10). Отмеченные особенности кроссинговера делают этот процесс эффективным механизмом перекомбинации аллелей.
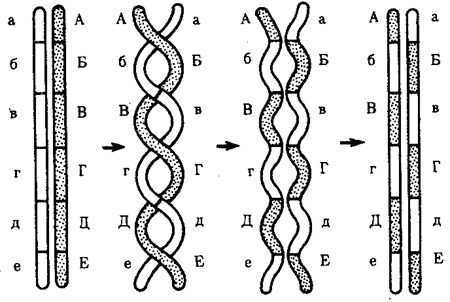
Рис. 5.9. многократный кроссинговер между гомологичными хромосомами:
А—Е, а—е — локусы хромосом
Расхождение гомологичных хромосом в разные гаметы
в случае гетерозиготности приводит к образованию гамет, различающихся по аллелям отдельных генов (см. рис. 3.74).
Случайное расположение бивалентов в плоскости экватора
веретена деления и последующее
их расхождение в анафазе
I
мейоза обеспечивают перекомбинацию родительских групп сцепления в гаплоидном наборе гамет (см. рис. 3.75).
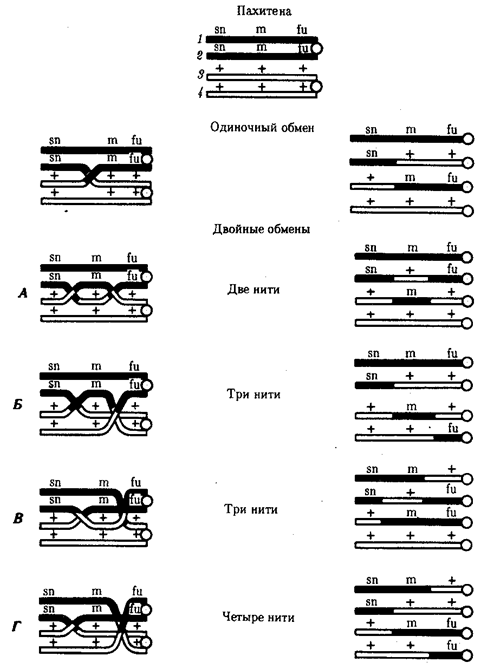
Рис. 5.10. Множественный обмен участками на стадии четырех хроматид
в пахитене мейоза
В кроссинговер могут вступать все четыре хроматиды бивалента, латинскими буквами обозначены мутантные аллели; знаком «+» —нормальные аллели
Последние стадии овогенеза воспроизводятся и вне организма женщины, в искусственной питательной среде. Это позволило осуществить зачатие человека «в пробирке». Перед овуляцией хирургическим путем яйцо извлекается из яичника и переносится в среду со сперматозоидами. Возникающая в результате оплодотворения зигота, будучи помещена в подходящую среду, осуществляет дробление. На стадии 8—16 бластомеров зародыш переносится в матку женщины-реципиента, которая осуществляет донашивание и роды. Число успешных результатов такого переноса в последнее время возрастает.
Гаметогенез отличается высокой производительностью. За время половой жизни мужчина продуцирует не менее 500 млрд. сперматозоидов. На пятом месяце эмбриогенеза в зачатке женской половой железы насчитывается 6—7 млн. клеток-предшественниц яйцеклеток. К началу репродуктивного периода в яичниках обнаруживается примерно 100 000 овоцитов. От момента полового созревания до прекращения гаметогенеза в яичниках созревает 400—500 овоцитов.
Организмы с половым размножением в результате мейоза образуют гаплоидные гаметы. В момент оплодотворения благодаря слиянию двух таких клеток возникает диплоидная зигота. Многократные митотиче-ские деления зиготы и ее потомков приводят к увеличению числа диплоидных клеток, которые строят тело организма в процессе его развития. По достижении последним половой зрелости возобновляется процесс образования гаплоидных гамет. Таким образом, в жизненных циклах организмов, размножающихся половым способом, выделяются две фазы: гаплоидная и диплоидная
(рис. 5.11). Относительная продолжительность этих фаз варьирует у представителей различных групп живых существ: у простейших и грибов преобладает первая, у высших растений и животных — вторая.
Удлинение диплофазы в ходе эволюции объясняется преимуществами диплоидного состояния перед гаплоидным. Благодаря гетерозиготности и рецессивности в диплоидном состоянии укрываются от естественного отбора, сохраняются и накапливаются разнообразные аллели. Это повышает объем генетической информации в генофондах популяций и видов, ведет к образованию резерва наследственной изменчивости, от которого зависят эволюционные перспективы. В то же время у гетерозигот вредные рецессивные аллели, не оказывая влияния на развитие фенотипа, не снижают жизнеспособности.
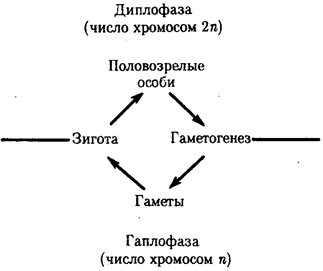
Рис. 5.11. Фазы жизненного цикла многоклеточных животных
Благодаря генетической рекомбинации, которая закономерно происходит в процессе гаметогенеза и при оплодотворении, половое размножение представляет собой эволюционно обусловленный механизм обмена генетической информацией между организмами одного биологического вида. Некоторые факты из области зоологии и особенно вирусологии и микробиологии указывают и на то, что имеются пути приобретения биологической информации и от организмов других видов (см. 3.6.4.5). Эта информация воспроизводится в фенотипе организма и определяет развитие признаков, не закодированных в генетическом материале родителей. Так, в клетках пищеварительного дивертикула брюхоногого моллюска Elysia viridis
сохраняются хлоропласты поедаемой водоросли Codium bragile,
в результате чего моллюск приобретает способность к фотосинтезу. Стрекательные капсулы гидроидных полипов, которые поедаются некоторыми реснитчатыми червями, не перевариваются, а перемещаются в эпителиальный пласт и используются червем в качестве орудия защиты. В классической зоологии такие примеры получили название клептогенеза
или эволюции путем воровства.
Явление трансдукции
заключается в том, что в генетический материал клетки-хозяина (бактериальной или эукариотической) встраивается нуклеиновая кислота вируса с фрагментом генома другой клетки. Привносимая таким образом биологическая информация вследствие редупликации чужеродной ДНК может передаваться в ряду клеточных поколений, а также воздействовать на состояние генетической системы клетки-хозяина, изменяя, например, частоту мутирования отдельных генов. Чужеродная ДНК может присутствовать в клетке в виде плазмид и эписом — фрагментов нуклеиновой кислоты, лишенных в отличие от вирусных частиц белковых чехлов. Плазмиды
самостоятельны по отношению к хромосомам клетки-хозяина, а эписомы
могут встраиваться в них. Биологическая информация плазмид и эписом, проявляясь в фенотипе, дает широкий круг признаков, включая устойчивость к антибиотикам (см. 3.6.3).
Примеры проникновения в организм действующей биологической информации организмов из других таксонов, прежде всего вирусов, описаны у высших животных и человека. Так, сотрудники, длительно работающие в онкологических лабораториях с вирусной опухолью кроликов — папилломой Шопа, имеют, как правило, пониженное содержание в плазме крови аминокислоты аргинина. Объясняется это тем, что вирус папилломы, которым «заражены» такие люди, несет ген синтеза аргиназы, катализирующей обмен аргинина. Будучи активным, этот ген обусловливает образование дополнительных молекул фермента. Описанный факт относится к широкой области так называемого вирусоносительства
или латентных вирусных инфекций.
Вирус, присутствуя в клетках организма длительное время и не вызывая собственно патологических изменений, приводит к развитию некоторых фенотипических признаков. У человека известен генетический дефект, который проявляется в серьезных нарушениях развития и зависит от недостатка аргиназы. Открытие способа контролируемого «заражения» таких людей вирусом папилломы Шопа могло бы нормализовать их фенотип.
Технологии геномики (см. разд. 3.2), расшифровывающие нуклеотидные последовательности ДНК, создают почву для целенаправленного изменения или введения в человеческий геном нормальных нуклеотидных последовательностей, что в перспективе может стать основой генотерапии.
Половой процесс служит универсальным механизмом обмена генетической информацией между особями в пределах вида. Рассмотренные факты свидетельствуют о том, что количество и содержание информации, используемой различными организмами для развития и жизнедеятельности, не всегда ограничиваются той, которая была ими приобретена от родителей. Существуют дополнительные пути приобретения биологической информации. Видоспецифическая информация, получаемая в процессе размножения, обеспечивает развитие особей определенного морфофизиологического типа. Дополнительная информация по биологическому содержанию в значительной степени случайна и нередко нарушает реализацию собственной генетической информации хозяина. В связи с этим в эволюции возникли механизмы защиты от проникновения чужеродного наследственного материала.
Примером может служить интерферон — белок, вырабатываемый клетками млекопитающих и птиц в ответ на внедрение вирусов и представляющий собой фактор неспецифического противовирусного иммунитета, а также система иммунологического надзора.
Онтогенез,
или индивидуальное развитие организма, осуществляется на основе наследственной программы, получаемой через вступившие в оплодотворение половые клетки родителей. При бесполом размножении эта программа заключена в неспециализированных клетках единственного родителя, дающего потомство. В ходе реализации наследственной информации в процессе онтогенеза у организма формируются видовые и индивидуальные морфологические, физиологические и биохимические свойства, иными словами — фенотип.
В процессе развития организм закономерно меняет свои характеристики, оставаясь тем не менее целостной системой. Поэтому под фенотипом надо понимать совокупность свойств на всем протяжении индивидуального развития, на каждом этапе которого существуют свои особенности.
Ведущая роль в формировании фенотипа принадлежит наследственной информации,
заключенной в генотипе организма. При этом простые признаки развиваются как результат определенного типа взаимодействия соответствующих аллельных генов (см. разд. 3.6.5.2). Вместе с тем существенное влияние на их формирование оказывает вся система генотипа (см. разд. 3.6.6). Формирование сложных признаков осуществляется в результате разнообразных взаимодействий неаллельных генов непосредственно в генотипе либо контролируемых ими продуктов. Стартовая программа индивидуального развития зиготы содержит также так называемую пространственную информацию, определяющую передне-задние и спинно-брюшные (дорзовентральные) координаты для развития структур.
Наряду с этим результат реализации наследственной программы, заключенной в генотипе особи, в значительной мере зависит от условий, в которых осуществляется этот процесс. Факторы внешней по отношению к генотипу среды могут способствовать или препятствовать фенотипическому проявлению генетической информации, усиливать или ослаблять степень такого проявления. В разд. 3.6.6.2 была рассмотрена роль негенетических факторов-эффекторов в регуляции экспрессии генов. Уже на стадии транскрипции контроль экспрессии отдельных генов осуществляется путем взаимодействия генетических и негенетических факторов. Следовательно, даже в формировании элементарных признаков организма — полипептидов — принимают участие генотип как система взаимодействующих генов и среда, в которой он реализуется.
В генетике индивидуального развития среда
представляет собой сложное понятие. С одной стороны, это непосредственное окружение, в котором осуществляют свои функции отдельные гены и генотип в целом. Оно образовано всей совокупностью факторов внутренней среды организма: клеточное содержимое (исключая ДНК), характер прямых межклеточных взаимодействий, биологически активные вещества (гормоны). Совокупность внутриорганизменных факторов, влияющих на реализацию наследственной программы, обозначают как среду 1-го порядка.
Особенно большое влияние на функцию генотипа факторы этой среды оказывают в период активных формообразовательных процессов, прежде всего в эмбриогенезе. С другой стороны, выделяют понятие окружающей среды, или среды 2-го порядка,
как совокупности внешних по отношению к организму факторов.
Благодаря влиянию факторов среды на формирование фенотипа даже генетически идентичные организмы в различных условиях развития и существования в большей или меньшей степени различаются по своим признакам. Фенотипические изменения, возникающие на основе одного и того же генотипа в разных условиях его реализации, называют модификациями.
Примером модификаций могут служить изменения содержания жира в молоке животных или массы тела в зависимости от их питания, изменения количества эритроцитов в крови, в зависимости от парциального давления кислорода в воздухе, изменения темпа роста растений при разной освещенности и содержании минеральных веществ в почве. Другим примером модификационной изменчивости являются различия, наблюдаемые у генетически идентичных монозиготных близнецов или потомков одного растения, полученных путем вегетативного размножения, но развивавшихся в разных условиях среды.
Модификации отдельного признака или свойства, формируемого данным генотипом, образуют непрерывный ряд. Частота встречаемости каждого варианта в таком вариационном
ряду различна. Чаще обнаруживаются средние значения признака. Чем дальше признак отстоит от среднего значения, тем реже он наблюдается (рис. 6.1).
Так как фенотипическое проявление наследственной информации может модифицироваться условиями среды, в генотипе организма запрограммировано не конкретное значение отдельных его характеристик, а лишь возможность их формирования в определенных пределах, называемых нормой реакции.
Таким образом, норма реакции представляет собой пределы модификационной изменчивости признака,
допустимой при данном генотипе. Некоторые признаки характеризуются широкой нормой реакции. Как правило, это количественные признаки, контролируемые полигенами (масса тела, жирность молока, пигментация кожи), другие свойства характеризуются узкой нормой реакции и слабо или почти не модифицируются в разных условиях (цвет глаз, группа крови).

Рис. 6.1. Кривая распределения модификаций признака в вариационном ряду:
V —
варианты признака, Р —
частота встречаемости вариантов признака, Мо —
мода, или наиболее часто встречаемое значение признака, lim — пределы модификационной изменчивости признака (норма реакции)
Фенотипическое проявление информации, заключенной в генотипе, характеризуется показателями пенетрантности и экспрессивности. Пенетрантностъ
отражает частоту фенотипического проявления имеющейся в генотипе информации. Она соответствует проценту особей, у которых доминантный аллель гена проявился в признак, по отношению ко всем носителям этого аллеля. Неполная пенетрантность доминантного аллеля гена может быть обусловлена системой генотипа, в которой функционирует данный аллель и которая является своеобразной средой для него. Взаимодействие неаллельных генов в процессе формирования признака может привести при определенном сочетании их аллелей к непроявлению доминантного аллеля одного из них.
В рассмотренных выше примерах (см. разд. 3.6.5.2) наличие в генотипе одного из генов в рецессивном гомозиготном состоянии не давало возможности проявиться доминантному аллелю другого гена (альбинизм, бомбейский феномен). Известны также случаи, когда фенотипическому проявлению определенного аллеля препятствуют факторы окружающей организм среды. Например, у китайской примулы развитие или отсутствие красной окраски цветков зависит от температуры и влажности воздуха: при t
= 5—20°С — красные цветы, при t
= 30—35°С и повышенной влажности — белые. У кроликов гималайской окраски темная пигментация шерсти, развивающаяся в обычных условиях лишь на отдельных участках тела, при выращивании их при пониженной температуре может быть получена на всем теле.
Экспрессивность
также является показателем, характеризующим фенотипическое проявление наследственной информации. Она характеризует степень выраженности признака и, с одной стороны, зависит от дозы соответствующего аллеля гена при моногенном наследовании или от суммарной дозы доминантных аллелей генов при полигенном наследовании, а с другой — от факторов среды. Примером служит интенсивность красной окраски цветков ночной красавицы, убывающая в ряду генотипов АА, Аа, аа, или интенсивность пигментации кожи у человека, увеличивающаяся при возрастании числа доминантных аллелей в системе полигенов от 0 до 8 (см. рис. 3.80). Влияние средовых факторов на экспрессивность признака демонстрируется усилением степени пигментации кожи у человека при ультрафиолетовом облучении, когда появляется загар, или увеличением густоты шерсти у некоторых животных в зависимости от изменения температурного режима в разные сезоны года.
Соотносительная роль наследственной программы и факторов среды в формировании фенотипа особи может быть прослежена на примере развития признаков половой принадлежности организма.
Пол организма представляет собой важную фенотипическую характеристику, которая проявляется в совокупности свойств, обеспечивающих воспроизведение потомства и передачу ему наследственной информации. В зависимости от значимости этих свойств различают первичные и вторичные половые признаки.
Под первичными половыми признаками
понимают морфофизиологические особенности организма, обеспечивающие образование половых клеток — гамет, сближение и соединение их в процессе оплодотворения. Это наружные и внутренние органы размножения. Вторичными половыми признаками
называют отличительные особенности того или другого пола, не связанные непосредственно с гаметогенезом, спариванием и оплодотворением, но играющие важную роль в половом размножении (обнаружение, и привлечение партнера). Их развитие контролируется гормонами, синтезируемыми первичными половыми органами.
Важным доказательством в пользу наследственной детерминированности половой принадлежности организмов является наблюдаемое у большинства видов соотношение по полу 1:1 (табл. 6.1).
Таблица 6.1. Соотношение по полу у разных видов
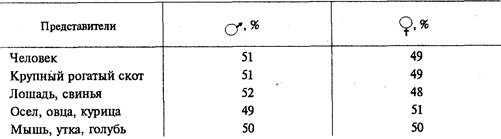
Такое соотношение может быть обусловлено образованием двух видов гамет представителями одного пола (гетерогаметный пол) и одного вида гамет — особями другого пола (гомогаметный пол). Это соответствует различиям в кариотипах организмов разных полов одного и того же вида, проявляющимся в половых хромосомах. У гомогаметного пола, имеющего одинаковые половые хромосомы XX,
все гаметы несут гаплоидный набор аутосом плюс Х-хромосому. У гетерогаметного пола в кариотипе кроме аутосом содержатся две разные или только одна половая хромосома (XY или ХО). Его представители образуют два вида гамет, различающиеся по гетерохромосомам: Х и Y или Х и 0.
У разных видов организмов хромосомный механизм определения пола реализуется по-разному. У человека и других млекопитающих, а также у дрозофилы гомогаметным является женский пол (XX), а гетерогаметным — мужской (XY). У некоторых насекомых (клопы рода Protenor
) гетерогаметный мужской пол имеет лишь одну Х-хромосому (ХО). У птиц и некоторых насекомых женский пол является гетерогаметным (XY), а мужской — гомогаметным (XX). У некоторых бабочек гетерогаметный женский пол имеет одну Х-хромосому (ХО). В большинстве выше описанных случаев пол вновь образующегося организма определяется сочетанием половых хромосом, возникающим в зиготе при оплодотворении (табл. 6.2).
Таблица 6.2. Хромосомный механизм определения полов
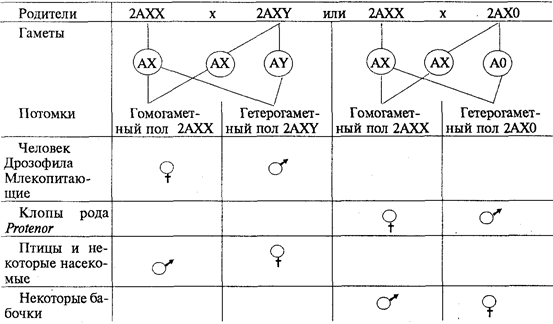
Таким образом, хромосомный механизм определения половой принадлежности организмов обеспечивает равновероятность встречаемости представителей обоих полов. Это имеет большой биологический смысл, так как обусловливает максимальную вероятность встречи самки и самца, потомки получают более разнообразную наследственную информацию, поддерживается оптимальная численность особей в популяции.
Исследования, проведенные на дрозофиле, обнаружили незначительную роль Y-хромосомы в определении пола. Особи с кариотипом ХО внешне являются типичными самцами, но стерильными, а особи с кариотипом XXY — плодовитые самки. Y-хромосома у дрозофилы по размеру близка к Х-хромосоме, однако она генетически инертна, так как состоит в основном из гетерохроматина. В связи с этим первичное определение пола у дрозофилы обусловлено не столько сочетанием в зиготе Х- и Y-хромосом, сколько соотношением числа Х-хромосом и наборов аутосом (половой индекс). У нормальных самок половой индекс равен 1 (2Х:2А), у нормальных самцов — 0,5 (XY:2A). Увеличение полового индекса более 1 при увеличении дозы Х-хромосомы (ЗХ:2А) приводит к развитию сверхсамок, а величина этого показателя ниже 0,5 (XY:3A) обеспечивает появление самцов. При значениях полового индекса более 0,5, но менее 1 (2Х:ЗА) развиваются интерсексы.
О значении дозы Х-хромосом в определении пола у дрозофилы свидетельствует развитие латерального гинандроморфизма
у мух при утрате Х-хромосомы одной из клеток на стадии первого деления зиготы. В результате половина тела, развивающаяся из клетки с нормальным кариотипом (2АХХ), несет признаки самки, а другая половина, клетки которой лишены одной Х-хромосомы (2АХО), имеет признаки самца (рис. 6.2).
Рис. 6.2. Латеральный гинадроморфизм у Drosophila melanogaster,
гетерозиготной по гену окраски глаз, находящемуся в Х-хромосоме
Левая половина мухи, клетки которой несут 2Х, имеет признаки самки и красный глаз; правая половина мухи, клетки которой несут одну Х-хромосому, имеет признаки самца и белый глаз
Обнаружение зависимости половой принадлежности развивающегося организма от дозы Х-хромосом у дрозофилы и некоторых других насекомых привело американского генетика С. Бриджеса (1922) к формулировке гипотезы генного баланса,
в соответствии с которой организм изначально бисексуален, т.е. несет в себе задатки и мужского, и женского полов. Развитие признаков одного из них в ходе онтогенеза определяется балансом женских и мужских генов — детерминаторов пола. У дрозофилы эти гены сосредоточены не только в половой Х-хромосоме, но и в аутосомах. Поэтому пол организма у них зависит от соотношения этих хромосом. У плодовой мухи Y-хромосома, будучи генетически инертной, в определении признаков пола не участвует.
У человека Y-хромосома играет важную роль в детерминации пола. Она содержит определенное количество генов, часть из которых гомологична генам Х-хромосомы, а часть не имеет в ней гомологов и наследуется только по мужской линии. Некоторые из этих генов непосредственно связаны с детерминацией мужского пола. Поэтому у человека присутствие Y-хромосомы в кариотипе независимо от количества Х-хромосом (2AXXY, 2AXXXY) обеспечивает развитие мужского пола. Особи с кариотипом 2АХО являются женщинами, несмотря на уменьшение дозы Х-хромосомы. Однако значение баланса генов в определении половой принадлежности организма подтверждается тем, что особи с кариотипами 2АХО, 2АХХХ, 2AXXY, 2AXXXY и т.д. отличаются наличием пороков развития и часто стерильны.
Как было отмечено, у большинства видов животных пол организма определяется сочетанием или количеством половых хромосом в диплоидном наборе аутосом. Однако у некоторых насекомых (пчелы, муравьи, осы) представители разных полов отличаются числом наборов хромосом. Самки у них развиваются из оплодотворенных яиц и поэтому диплоидны, самцы — из неоплодотворенных яиц и первично гаплоидны. В такой ситуации соотношение по полу зависит от того, происходит оплодотворение или нет. Половой состав популяции может быть различным в разные периоды ее жизни.
Зависимость половой принадлежности организмов от сочетания или количества половых хромосом в его кариотипе свидетельствует о том, что гены, определяющие пол, располагаются главным образом в этих хромосомах. Однако известен целый ряд примеров, указывающих на то, что в развитии признаков пола принимают участие также гены, локализованные в аутосомах. В частности, в геноме дрозофилы присутствует ген, называемый трансформатором.
Рецессивный аллель этого гена в гомозиготном состоянии tt превращает женские зиготы 2Х в фенотипических самцов, которые оказываются стерильными. Самки1
XXt+
t+
или XXt+
t плодовиты, особи с кариотипом XYtt — нормальные самцы, организмы с кариотипом XXtt — превращенные стерильные самцы. Другим примером влияния аутосомных генов на развитие признаков пола может служить существование у кукурузы генов, мутантные аллели которых превращают ее из однодомного растения в двудомное, препятствуя развитию органов либо мужского, либо женского пола. Рецессивный аллель гена sk(silkless) в гомозиготном состоянии вызывает недоразвитие семяпочек и превращает растение в мужское. Мутантный аллель другого гена ts (tassel seed) в гомозиготном состоянии вызывает развитие семяпочек и семян в метелке, а пыльники не развиваются.
У человека развитие организма по мужскому типу обеспечивается не только геном, расположенным в Y-хромосоме и определяющим способность к синтезу мужского полового гормона — тестостерона,
но и Х-сцепленным геном, контролирующим синтез белка-рецептора этого гормона. Мутация упомянутого Х-сцепленного гена приводит к развитию синдрома тестикулярной феминизации (см. разд. 3.6.5.2).
Приведенные примеры доказывают, что пол организмов как признак развивается на основе полученной от родителей наследственной информации и находится под контролем группы взаимодействующих генов, расположенных как в половых хромосомах, так и в аутосомах.
У большинства видов развитие признаков пола осуществляется на основе наследственной программы, заключенной в генотипе. Однако известны примеры, когда половая принадлежность организма целиком зависит от условий, в которых он развивается. Так, у морского червя Bonellia viridis
пол зависит от того, будет зигота развиваться в непосредственном контакте с материнским организмом или самостоятельно. В первом случае образуется самец, во втором —самка (рис. 6.3).
У высших организмов значение среды в определении признаков пола, как правило, невелико. Вместе с тем даже для них известны примеры, когда в определенных условиях развития происходило переопределение пола
на противоположный, несмотря на имеющуюся комбинацию хромосом в зиготе. Возможность переопределения пола обусловлена тем, что первичные закладки гонад у эмбрионов всех животных изначально бисексуальны. В процессе онтогенеза происходит выбор направления развития закладки в сторону признаков одного пола, включая дифференцировку половых желез, формирование половых путей и вторичных половых признаков. Первостепенная роль в развитии мужского или женского фенотипа принадлежит гормонам, образуемым гонадами.
Ведущим началом в дифференцировке пола являются гены, контролирующие уровень мужских и женских половых гормонов. Соотношение этих гормонов в организме является особенно важным для формирования и поддержания соответствующих признаков. Так как у млекопитающих и человека дифференцировка пола начинается очень рано, то полное переопределение пола в эмбриогенезе у них невозможно. Известны, однако, случаи, в частности у крупного рогатого скота, когда в разнополых двойнях рождались бесплодная телочка — интерсекс (фри-мартин) — и бычок. Это происходит потому, что клетки семенников мужского эмбриона начинают синтез соответствующего гормона раньше, чем клетки яичников эмбриона женского пола, оказывая на организм последнего маскулинизирующее действие, вплоть до формирования половых органов мужского типа.
Рис. 6.3. Роль условий среды в развитии признаков пола
у морского червя Bonellia viridis:
1 —
самка, 2 —
яйца, 3 —
личинка, 4 —
молодая самка, 5 —
самец, 5' —
самец в увеличенном виде
У некоторых видов в ходе обычного онтогенеза при определенных условиях происходит естественное переопределение пола. Так, в Тихом океане обитают рыбки Labroides dimidiatus,
живущие стайками из самок и одного самца. Каждый из членов такой семьи, кроме самца, постоянно находится в состоянии стресса, источником которого является самец. При этом уровень напряженности различается от самки к самке, так что можно выделить α-, β-, γ- самок и т.д. Гибель самца вызывает превращение α-самки (главной самки, сбрасывающей напряжение) в самца с полноценными семенниками. Описанное переопределение зависит от уровня в организме гормонов, выделяемых клетками надпочечников.
У человека угнетение эндокринной функции яичников, наступающее после прекращения гаметогенеза (в определенном возрасте у женщин), приводит к появлению некоторых вторичных признаков мужского пола, например росту волос на лице.
Искусственное изменение условий развития организмов в эксперименте приводит у некоторых видов к полному переопределению пола, вплоть до появления способности образовывать гаметы противоположного пола (некоторые виды амфибий, рыб, птиц). Например, кормление мальков самцов аквариумных рыбок до 8 мес. пищей с добавкой эстрогенов превращало их в самок, способных к скрещиванию с натуральными самцами и образованию полноценного потомства. В экспериментах на курах удаление половых желез до окончания периода полового созревания или подсадка гонад противоположного пола вели к появлению вторичных признаков другого пола: у курицы развивались петушиное оперение и инстинкты петуха, а петух приобретал куриное оперение. Исходная генетическая конституция, в том числе и по половым хромосомам, при этом оставалась прежней.
Из примеров, рассмотренных выше, следует, что генотип особи заключает в себе информацию о возможности формирования признаков того или иного пола, которая реализуется лишь при определенных условиях индивидуального развития. Изменение этих условий может стать причиной переопределения признаков пола. При этом у организмов разных видов относительное значение генетических и средовых факторов не одинаково: у одних видов определяющим фактором является среда, у других — наследственная программа.
В процесса индивидуального развития организм закономерно меняет свои характеристики. Особенно интенсивные изменения происходят в эмбриональном периоде онтогенеза, когда из зиготы формируются структуры многоклеточного организма. При этом все многообразие клеток, выполняющих в организме различные функции, происходит из одной клетки путем митотического деления. Так как в результате митоза дочерние клетки получают полноценную наследственную информацию, заключенную в кариотипе, все клетки организма в генотипическом отношении равноценны. Некоторые различия, однако, наблюдаются за счет цитоплазматических генов, например митохондриальных, которые распределяются при делении не строго равномерно.
Чем определяются морфологические, физиологические и биохимические различия, появляющиеся между клетками в ходе развития? В процессе овогенеза в цитоплазме яйцеклетки накапливаются не только богатые энергией вещества, обеспечивающие развитие зародыша, но и мРНК для синтеза белков, необходимых на самых ранних стадиях эмбрионального развития. Распределение этих веществ в цитоплазме яйцеклетки оказывается неравномерным. Проникновение сперматозоида в яйцеклетку вызывает перераспределение отдельных компонентов в объеме клетки, в связи с чем уже при первых делениях зиготы в дочерних клетках оказывается цитоплазма с разным составом веществ.
Взаимодействие между компонентами цитоплазмы и ядром приводит к дерепрессии
определенных генов. Их продукты определяют дальнейшее углубление различий между разными частями зародыша, т.е. дифференцировку.
Возникающие различия порождают новые взаимодействия между соседними клеточными группами, которые вызывают дерепрессию новых генов, вследствие чего меняется спектр активных генов и, следовательно, генетическая программа на последующий отрезок процесса развития. Таким образом, в ходе индивидуального развития первоначально репрессированный геном зиготы подвергается постепенной дерепрессии, причем в разных частях зародыша дерепрессируются разные группы генов. Набор активно функционирующих генов определяет своеобразие спектра белков, которые синтезируются клетками, выполняющими различные функции.
Как отмечалось выше, в процессе онтогенеза в клетках организма происходит смена активно функционирующих генов. Гены, транскрибировавшиеся в эмбриональном периоде, к моменту рождения или непосредственно после него репрессируются, в то же время активируются гены, определяющие специфические функции клеток во взрослом организме. Нередко вещества, продуцируемые определенным типом клеток в разные периоды онтогенеза, несколько различаются по своим свойствам. Изменение свойств диктуется изменением условий существования организма, например в эмбриональном и постэмбриональном периодах развития. Эти различия объясняются сменой функционирования близких, но не идентичных по заключенной в них информации генов. Такие гены в ряде случаев образуют группы, получившие название мультигенных семейств. Примером тому служат гены гемоглобина.
Мультигенное семейство —
это группа генов, очень близких по нуклеотидным последовательностям, со сходными фенотипическими функциями. Число генов в разных семействах у представителей разных видов варьирует от единиц до нескольких сотен. К примеру, число генов гистонов у разных видов в отдельных семействах колеблется от 10 до 1200, генов тРНК — от 6 до 400, генов 5SPHK — от 200 до 24000, генов α-глобинов — от 1 до 5, (β-глобинов — от 2 до 7. К числу белков, кодируемых мультигенными семействами, кроме указанных выше, относятся актины и тубулины, играющие важную роль в подвижности клеток, коллагены соединительной ткани, некоторые белки клеточных мембран и сыворотки крови.
Мультигенные семейства могут быть организованы в геноме по-разному (рис. 6.4). Так, члены семейства идентичных генов РНК у человека располагаются в виде тандемных повторов, в которых структурные гены разделены некодирующими — спейсерными —
участками. Однако гены семейства не всегда идентичны. Например, в семействах глобиновых генов тандемно сцеплены близкие, но не одинаковые гены. В случае гистоновых генов у некоторых видов тандемно повторяются целые пакеты (кластеры) неидентичных генов, определяющих синтез разных видов гистонов, что может быть описано формулой Н2А — НЗ —Н2В — Н4 — H1 —. Возможно также диффузное распределение генов семейства по нескольким хромосомам, что показано для генов актинов и тубулинов.
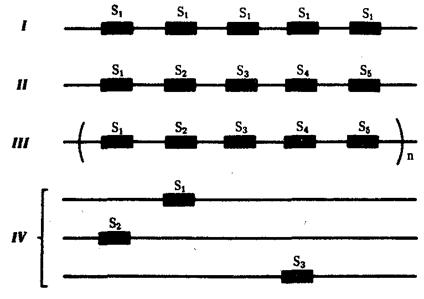
Рис. 6.4. Типы организации мультигенных семейств:
I —
идентичные гены, сцепленные тандемно (гены рРНК); II —
близкие, но не идентичные гены, сцепленные тандемно (гены глобинов); III
— скопления неидентичных генов, сцепленных тандемно (гистоновые гены); IV —
близкие гены, рассеянные по нескольким хромосомам (гены актинов или тубулинов)
Описанные варианты организации мультигенных семейств создают необходимые условия для эффективной регуляции экспрессии соответствующих генов. Так, если продукт определенного гена необходим лишь на небольшом отрезке времени в онтогенезе, но в значительных количествах, мультигенное семейство образовано большим числом идентичных генных копий, обычно соединенных тандемно. Примером могут служить гены рРНК, которые в геноме соматических клеток взрослой шпорцевой лягушки представлены 450 копиями. Вместе с тем в овогенезе для быстрого образования необходимого количества рибосом, которых в яйце Xenopus
содержится около 1012
, гены рРНК амплифицируются и число их копий возрастает в 4000 раз. В других мультигенных семействах, состоящих, как правило, из неидентичных генов, в ходе онтогенеза происходит переключение с одного гена на другой. Белки, контролируемые определенными генами такого семейства, наилучшим образом соответствуют либо условиям на разных стадиях онтогенеза, либо клеткам различных типов.
Рис. 6.5. Распределение генов α- и β-глобинов человека
Глобиновые гены изображены в виде прямоугольников; вертикальные полосы внутри соответствуют экзонам, остальные участки — интронам
Наиболее изучены в этом отношении мультигенные семейства α- и β-глобиновых генов (рис. 6.5). У человека они представлены кластером из 7 β-глобиновых генов, расположенных в 11-й хромосоме, и кластером из 5 α-глобиновых генов, локализующихся в 16-й хромосоме. У эмбрионов человека активно функционируют ζ
(дзета)-глобиновый ген из α- семейства и ε (эпсилон)-глобиновый ген из β-семейства, обеспечивающие образование эмбрионального ζ2
ε2
-гемоглобина.
На более поздних стадиях онтогенеза у плода эти гены репрессируются, но дерепрессируются другие гены семейств, определяющие синтез фетального α2
γ2
-гемоглобина. После рождения начинают экспрессироваться δ (дельта)- β и (бета)-глобиновые гены, обеспечивающие образование преобладающего α2
β2
- и минорного α2
β2
- видов гемоглобина взрослого человека. В обоих кластерах имеются также неэкспрессирующиеся псевдогены ψα1
, ψξ1
, ψβ1
, ψβ2
.
Переключение генов в мультигенных семействах происходит не только в соответствии со стадией индивидуального развития, но и с типом и местом локализации клеток в организме. Так, эмбриональный гемоглобин С,г
б2 образуется имеющими ядра мегалобластами в стенке желточного мешка. На 6-й неделе развития происходит смена экспрес-сируемых генов и переход к синтезу гемоглобина безъядерными эритроцитами печени и селезенки плода. Позднее главным местом образования гемоглобина становится костный мозг, где вскоре после рождения начинается синтез взрослых гемоглобинов α2
β2
и α2
δ2
. Смена типов синтезируемого гемоглобина у эмбриона, плода и после рождения связана с конкретными условиями существования организма на разных стадиях онтогенеза. Так, у человека гемоглобин плода имеет более высокое сродство к кислороду, чем гемоглобин взрослого, что облегчает перенос кислорода через плаценту.
Таким образом, изменение характеристик фенотипа организма на разных стадиях онтогенеза является результатом регуляции экспрессии генов, которая имеет целью в одних случаях наращивание продукции определенных белков, а в других — переход от синтеза одного белка к синтезу белка более соответствующего изменяющимся условиям существования.
Наследственная программа, на основе которой формируется фенотип организма, сосредоточена главным образом в его хромосомном наборе. Некоторое количество наследственного материала заключено также в цитоплазме клеток. Ядерные и цитоплазматические структуры в процессе клеточного размножения распределяются между дочерними клетками по-разному. Это касается не только соматических клеток организма, но и его гамет. В связи с этим передача ядерных и цитоплазматических генов потомству подчиняется разным закономерностям, что обусловливает особенности наследования соответствующих признаков.
Гены, расположенные в ядерных структурах — хромосомах, закономерно распределяются между дочерними клетками благодаря механизму митоза, который обеспечивает постоянную структуру кариотипа в ряду клеточных поколений (см. разд. 3.6.2.1). Мейоз и оплодотворение обеспечивают сохранение постоянного кариотипа в ряду поколений организмов, размножающихся половым путем (см. разд. 3.6.2.2). В результате набор генов, заключенный в кариотипе, также остается постоянным в ряду поколений клеток и организмов. Закономерное поведение хромосом в митозе, мейозе и при оплодотворении обусловливает закономерности наследования признаков, контролируемых ядерными генами.
В связи с тем что кариотип организма — это диплоидный набор хромосом, большинство генов в соматических клетках представлены аллельными парами. Аллелъные гены,
расположенные в соответствующих участках гомологичных хромосом, взаимодействуя между собой, определяют развитие того или иного варианта соответствующего признака (см. разд. 3.6.5.2). Являясь специфической характеристикой вида, кариотип представителей разного пола различается по паре половых хромосом (см. разд. 6.1.2.1).Гомогаметный пол, имеющий две одинаковые половые хромосомы XX, диплоиден по генам этих хромосом. Гетерогаметный пол имеет одинарный набор генов Х-хромосомы (ХО) или негомологичных участков Х- и Y-хромосом. Фенотипическое проявление и наследование отдельных признаков из поколения в поколение организмов зависит от того, в каких хромосомах располагаются соответствующие гены и в каких дозах они присутствуют в генотипах отдельных особей. Различают два основных типа наследования признаков: аутосомное
и сцепленное с полом
(схема 6.1).
Схема 6.1. Классификация типов наследования признаков
при моногенном наследовании
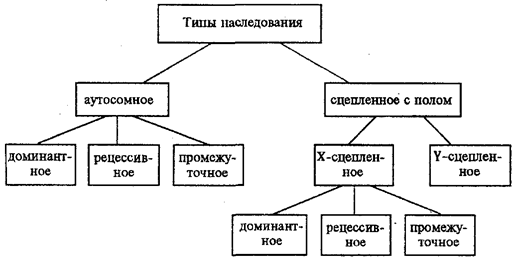
Аутосомное наследование.
Характерные черты аутосомного наследования признаков обусловлены тем, что соответствующие гены, расположенные в аутосомах, представлены у всех особей вида в двойном наборе. Это означает, что любой организм получает такие гены от обоих родителей. В соответствии с законом чистоты гамет
в ходе гаметогенеза все половые клетки получают по одному гену из каждой аллельной пары (рис. 6.6). Обоснованием этого закона является расхождение гомологичных хромосом, в которых располагаются аллельные гены, к разным полюсам клетки в анафазе I мейоза (см. рис. 5.6).
Рис. 6.6. Обоснование закономерностей аутосомного наследования признаков:
I
— гаплоидные гаметы родителей, II
— диплоидный генотип особи (фенотип зависит от взаимодействия аллельных генов Аа); III—
гаплоидные гаметы гетерозиготной особи (гаметы «чисты», так как несут по одному из пары аллельных генов); черным и белым обозначены гомологичные хромосомы; буквами — определенные локусы
Ввиду того что развитие признака у особи зависит в первую очередь от взаимодействия аллельных генов, разные его варианты, определяемые разными аллелями соответствующего гена, могут наследоваться по аутосомно-доминантному
или аутосомно-рецессивному
типу, если имеет место доминирование. Возможен также промежуточный тип наследования признаков при других видах взаимодействия аллелей (см. разд. 3.6.5.2).
При доминировании
признака, описанном Г. Менделем в его опытах на горохе, потомки от скрещивания двух гомозиготных родителей, различающихся по доминантному и рецессивному вариантам данного признака, одинаковы и похожи на одного из них (
закон единообразия F1
)
. Описанное Менделем расщепление по фенотипу в F2
в отношении 3:1 в действительности имеет место лишь при полном доминировании одного аллеля над другим, когда гетерозиготы фенотипически сходны с доминантными гомозиготами (закон расщепления в
F2
)
.
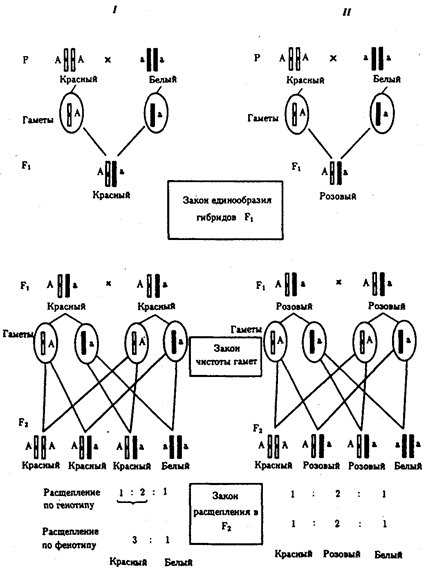
Рис. 6.7. Аутосомное наследование признака:
I
— полное доминирование (наследование цвета лепестков у гороха); II —
неполное доминирование (наследование цвета лепестков у ночной красавицы)
Наследование рецессивного варианта признака характеризуется тем, что он не проявляется у гибридов F1
, а в F2
проявляется у четверти потомков (рис. 6.7.7).
В случаях формирования у гетерозигот нового варианта признака по сравнению с гомозиготами, что наблюдается при таких видах взаимодействия аллельных генов, как неполное доминирование, кодоминирование, межаллельная комплементация, гибриды F1
не похожи на родителей, а в F2
образуется три фенотипических группы потомков (рис. 6.7, II
).
Завершая описание характерных черт аутосомно-доминантного и аутосомно-рецессивного наследования, уместно напомнить, что хотя в случае доминирования одного из аллелей присутствие в генотипе другого, рецессивного, аллеля не сказывается на формировании доминантного варианта признака, на фенотипическое проявление аллеля оказывает влияние вся система генотипа конкретного организма, а также среда, в которой реализуется наследственная информация. В связи с этим существует возможность неполной пенетрантности доминантного аллеля у особей, имеющих его в генотипе.
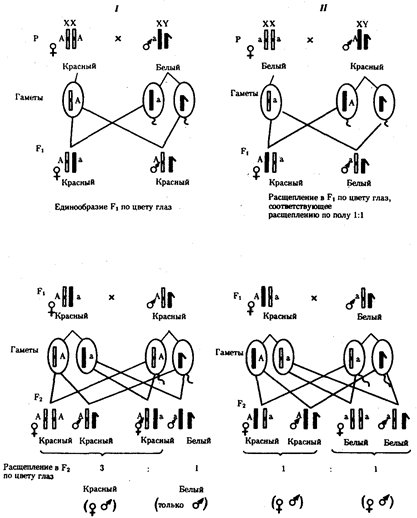
Рис. 6.8. Наследование признака окраски глаз у дрозофилы:
I
, II —
различие результатов скрещивания в зависимости от пола родителя с доминантным признаком; зачернены отцовские хромосомы
Сцепленное с полом наследование.
Анализ наследования признака окраски глаз у дрозофилы в лаборатории Т. Моргана выявил некоторые особенности, заставившие выделить в качестве отдельного типа наследования признаков сцепленное с полом наследование
(рис. 6.8).
Зависимость результатов эксперимента от того, кто из родителей являлся носителем доминантного варианта признака, позволила высказать предположение, что ген, определяющий окраску глаз у дрозофилы, расположен в Х-хромосоме и не имеет гомолога в Y-хромосоме. Все особенности сцепленного с полом наследования объясняются неодинаковой дозой соответствующих генов у представителей разного — гомо- и гетерогаметного пола.
Гомогаметный пол несет двойную дозу генов, расположенных в Х-хромосоме. Развитие соответствующих признаков у гетерозигот (ХA
Хa
) зависит от характера взаимодействия между аллельными генами. Гетерогаметный пол имеет одну Х-хромосому (ХО или XY). У некоторых видов Y-хромосома генетически инертна, у других она содержит некоторое количество структурных генов, часть из которых гомологична генам Х-хромосомы (рис. 6.9). Гены негомологичных участков Х- и Y-хромосом (или единственной Х-хромосомы) у гетерогаметного пола находятся в гемизиготном
состоянии. Они представлены единственной дозой: ХA
Y,
Хa
Х, XYB
. Формирование таких признаков у гетерогаметного пола определяется тем, какой аллель данного гена присутствует в генотипе организма.
Характер наследования сцепленных с полом признаков в ряду поколений зависит от того, в какой хромосоме находится соответствующий ген. В связи с этим различают Х-сцепленное и Y-сцепленное (голандрическое) наследование.
Х-сцепленное наследование.
Х-хромосома присутствует в кариотипе каждой особи, поэтому признаки, определяемые генами этой хромосомы, формируются у представителей как женского, так и мужского пола. Особи гомогаметного пола получают эти гены от обоих родителей и через свои гаметы передают их всем потомкам. Представители гетерогаметного пола получают единственную Х-хромосому от гомогаметного родителя и передают ее своему гомогаметному потомству.
У млекопитающих (в том числе и человека) мужской пол получает Х-сцепленные гены от матери и передает их дочерям. При этом мужской пол никогда не наследует отцовского Х-сцепленного признака и не передает его своим сыновьям (рис. 6.10).
Так как у гомогаметного пола признак развивается в результате взаимодействия аллельных генов, различают Х-сцепленное доминантное и Х-сцепленное рецессивное наследование. Х-сцепленный доминантный признак
(красный цвет глаз у дрозофилы) передается самкой всему потомству. Самец передает свой Х-сцепленный доминантный признак лишь самкам следующего поколения. Самки могут наследовать такой признак от обоих родителей, а самцы — только от матери.
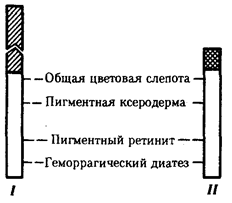
Рис. 6.9. Схема гомологичных и негомологичных локусов
в половых хромосомах человека:
I
— Х-хромосомы: заштрихованы локусы, отсутствующие в Y-хромосоме (красно-зеленая слепота, гемофилия и др.); II —
Y-хромосома: заштрихованы локусы, отсутствующие в Х-хромосоме (перепонки между пальцами, гены-детерминаторы развития организма по мужскому типу); участки Х- и Y-хромосом, соответствующие гомологичным локусам, не заштрихованы
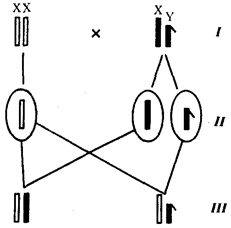
Рис. 6.10. Обоснование закономерностей сцепленного с полом
наследования признаков:
I
— сочетание половых хромосом в кариотипе представителей разного пола; II
— гомогаметный пол образует один тип гамет, гетерогаметный — два; III —
представители гомогаметного пола получают хромосомы от обоих родителей; представители гетерогаметного пола получают Х-хромосому от гомогаметного родителя, а Y-хромосому — от гетерогаметного родителя; это справедливо для генов, расположенных в негомологичных локусах Х- и Y-хромосом; зачернены отцовские хромосомы
Х-сцепленный рецессивный признак,
(белый цвет глаз у дрозофилы) у самок проявляется только при получении ими соответствующего аллеля от обоих родителей (Xa
Xa
). У самцов Xa
Y он развивается при получении рецессивного аллеля от матери. Рецессивные самки передают рецессивный аллель потомкам любого пола, а рецессивные самцы —только «дочерям» (см. рис. 6.8).
При Х-сцепленном наследовании, так же как и при аутосомном, возможен промежуточный характер проявления признака у гетерозигот. Например, у кошек пигментация шерсти контролируется Х-сцепленным геном, разные аллели которого определяют черную (XA
и рыжую (XA’
) пигментацию. Гетерозиготные самки XA
XA’
имеют пеструю окраску шерсти. Самцы же могут быть либо черными (XA
Y, либо рыжими (XA’
Y).
Голандрическое наследование.
Активно функционирующие гены Y-хромосомы, не имеющие аллелей в Х-хромосоме, присутствуют в генотипе только гетерогаметного пола, причем в гемизиготном состоянии. Поэтому они проявляются фенотипически и передаются из поколения в поколение лишь у представителей гетерогаметного пола. Так, у человека признак гипертрихоза ушной раковины («волосатые уши») наблюдается исключительно у мужчин и наследуется от отца к сыну.
Ранее были рассмотрены характерные черты фенотипического проявления и наследования отдельных признаков. Однако фенотип организма представляет собой совокупность многих свойств, за формирование которых отвечают разные гены. Так как общее число генов в генотипе значительно больше числа хромосом, каждая хромосома заключает в себе комплекс генов. В связи с этим неаллельные гены могут располагаться либо в разных хромосомах, либо входить в состав одной из них, занимая разные локусы АВС, КМР. Этим определяется характер наследования группы признаков, которое может быть независимым или сцепленным.
Независимое наследование признаков.
Такой характер наследования признаков впервые был описан Г. Менделем в опытах на горохе, когда одновременно анализировалось наследование в ряду поколений нескольких признаков, например цвета и формы горошин (рис. 6.11). Каждый из них в отдельности подчинялся закону расщепления в F2
. В то же время разные варианты этих признаков свободно комбинировались у потомков, встречаясь как в сочетаниях, наблюдаемых у их родителей (желтый цвет и гладкая форма или зеленый цвет и морщинистая форма), так и в новых сочетаниях (желтый цвет и морщинистая форма или зеленый цвет и гладкая форма). На основании анализа полученных результатов Г. Мендель сформулировал закон независимого наследования признаков,
в соответствии с которым: «Разные пары признаков, определяемые неаллельными генами, передаются потомкам независимо друг от друга и комбинируются у них во всех возможных сочетаниях».
Очевидно, этому закону должны подчиняться в первую очередь неаллельные гены, располагающиеся в разных (негомологичных) хромосомах. В таком случае независимый характер наследования признаков объясняется закономерностями поведения негомологичных хромосом в мейозе. Названные хромосомы образуют со своими гомологами разные пары, или биваленты, которые в метафазе I мейоза случайно выстраиваются в плоскости экватора веретена деления. Затем в анафазе I мейоза гомологи каждой пары расходятся к разным полюсам веретена независимо от других пар. В результате у каждого из полюсов возникают случайные сочетания отцовских и материнских хромосом в гаплоидном наборе (см. рис. 3.75). Следовательно, различные гаметы содержат разные комбинации отцовских и материнских аллелей неал-лельных генов.
Разнообразие типов гамет, образуемых организмом, определяется степенью его гетерозиготности и выражается формулой 2n
, где n —
число локусов в гетерозиготном состоянии. В связи с этим дигетерозиготные гибриды F1
образуют четыре типа гамет с одинаковой вероятностью. Реализация всех возможных встреч этих гамет при оплодотворении приводит к появлению в F2
четырех фенотипических групп потомков в соотношении 9:3:3:1. Анализ потомков F2
по каждой паре альтернативных признаков в отдельности выявляет расщепление в соотношении 3:1.
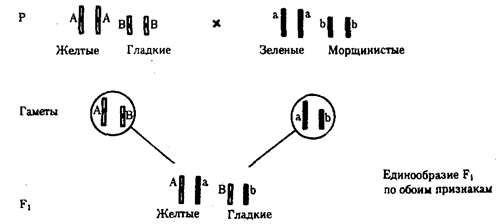
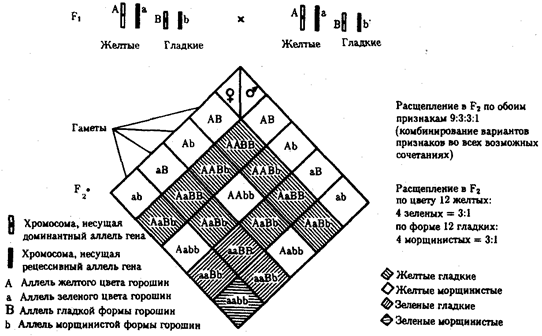
Рис. 6.11. Независимое наследование признаков (цвета и формы горошин)
Открытие независимого характера наследования разных признаков у гороха дало возможность Г. Менделю высказать предположение о дискретности наследственного материала, в котором за каждый признак отвечает своя пара наследственных задатков, сохраняющих в ряду поколений свою структуру и не смешивающихся друг с другом. Современные представления о надмолекулярной организации наследственного материала в хромосомах и закономерностях их передачи в ряду поколений клеток и организмов объясняют независимый характер наследования признаков расположением соответствующих генов в негомологичных хромосомах.

Рис. 6.12. Анализирующее (моногибридное) скрещивание
Объяснение см. в тексте
Анализирующее скрещивание.
В опытах Г. Менделя наследственная конституция гибридов F1
устанавливалась на основе анализа результатов их самоопыления, получаемых в F2
. В настоящее время с целью выяснения генотипа организмов с доминантным фенотипом (гомо- или гетерозигота) широко применяют также анализирующее скрещивание.
Оно заключается в скрещивании организма, генотип которого необходимо определить, с организмом, несущим рецессивный признак, а следовательно, гомозиготным по рецессивному аллелю (рис. 6.12).
Так как гомозиготные организмы образуют один тип гамет: аа — (a), aabb — (ab), aabbcc — (abc) и т.д., — при анализирующем скрещивании количество фенотипов потомков зависит от числа типов гамет, образуемых организмом с доминантным фенотипом. Если последний гомозиготен по анализируемым генам, то он также образует только один тип гамет и потомство от анализирующего скрещивания единообразно и имеет доминантный фенотип (рис. 6.12, I
).
Если анализируемый организм гетерозиготен по одному гену, он образует два типа гамет и при анализирующем скрещивании появляются потомки двух разных фенотипов с доминантным или рецессивным признаком (рис. 6.12, II
).
Дигетерозиготный организм при анализирующем скрещивании дает четыре вида потомков (рис. 6.13).
В том случае, когда неаллельные гены А и В наследуются независимо, располагаясь в разных хромосомах, Дигетерозиготный организм образует четыре типа гамет с равной вероятностью. Поэтому в результате анализирующего скрещивания четыре фенотипически различающиеся вида потомков появляются в соотношении 1:1:1:1 и несут различные сочетания вариантов двух признаков.
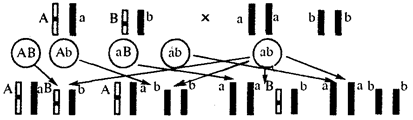
Рис. 6.13. Анализирующее (дигибридное) скрещивание Объяснение см. в тексте
Сцепленное наследование признаков.
Анализ наследования одновременно нескольких признаков у дрозофилы, проведенный Т. Морганом, показал, что результаты анализирующего скрещивания гибридов Fi иногда отличаются от ожидаемых в случае их независимого наследования. У потомков такого скрещивания вместо свободного комбинирования признаков разных пар наблюдали тенденцию к наследованию преимущественно родительских сочетаний признаков. Такое наследование признаков было названо сцепленным.
Сцепленное наследование объясняется расположением соответствующих генов в одной и той же хромосоме. В составе последней они передаются из поколения в поколение клеток и организмов, сохраняя сочетание аллелей родителей.
Зависимость сцепленного наследования признаков от локализации генов в одной хромосоме дает основание рассматривать хромосомы как отдельные группы сцепления.
На рис. 6.14 представлены результаты анализа наследования признаков окраски тела и формы крыльев у дрозофилы, а также их цитологическое обоснование. Обращает внимание, что при анализирующем скрещивании самцов из F1
появлялось всего два вида потомков, сходных с родителями по сочетанию вариантов анализируемых признаков (серая окраска тела и нормальные крылья или черная окраска тела и короткие крылья) в соотношении 1:1. Это указывает на образование самцами F1
всего двух типов гамет с одинаковой вероятностью, в которые попадают исходные родительские сочетания аллелей генов, контролирующих названные признаки (BV или bv).
При анализирующем скрещивании самок F1
появлялось четыре вида потомков со всеми возможными сочетаниями признаков. При этом потомки с родительскими сочетаниями признаков встречались в 83%. У 17% потомков имелись новые комбинации признаков (серая окраска тела и короткие крылья или черная окраска тела и нормальные крылья). Видно, что и в этих скрещиваниях проявляется склонность к сцепленному наследованию либо доминантных признаков, либо рецессивных (83%). Частичное нарушение сцепления (17% потомков) было объяснено процессом кроссинговера — обменом соответствующими участками гомологичных хромосом в профазе I мейоза (см. рис. 3.72).
Из результатов скрещивания следует, что самки дрозофилы образуют четыре типа гамет, большинство из которых (83%) некроссоверные ((BV) и (bv)), 17% образуемых ими гамет появляются в результате кроссинговера и несут новые комбинации аллелей анализируемых генов ((Bv) и (bV)). Различия, наблюдаемые при скрещивании самцов и самок из F1
с рецессивными гомозиготными партнерами объясняются тем, что по малопонятным причинам у самцов дрозофилы не происходит кроссинговера. В итоге самцы-дигетерозиготы по генам, расположенным в одной хромосоме, образуют два типа гамет. У самок кроссинговер имеет место и приводит к образованию некроссоверных и кроссоверных гамет, по два типа каждых. Поэтому в потомстве от анализирующего скрещивания появляется четыре фенотипа, два из которых обладают новыми по сравнению с родителями сочетаниями признаков.
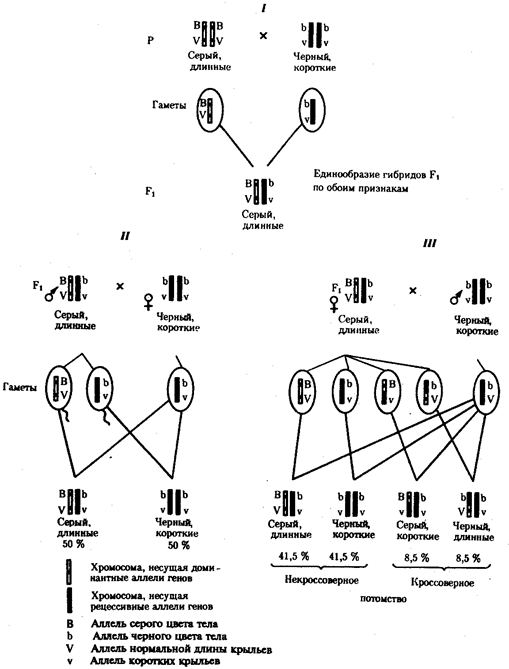
Рис. 6.14. Сцепленное наследование признаков
(цвета тела и длины крыльев у дрозофилы):
I
— скрещивание чистых линий, II,
III —
анализирующее скрещиваний самцов и самок из F1
.
Изучение наследования других сочетаний признаков показало, что процент кроссоверного потомства для каждой пары признаков всегда один и тот же, но он различается для разных пар. Это наблюдение стало основанием для заключения, что гены в хромосомах расположены в линейном порядке. Выше отмечалось, что хромосома является группой сцепления определенных генов. Гомологичные хромосомы — это одинаковые группы сцепления, которые отличаются друг от друга лишь
аллелями отдельных генов. При конъюгации гомологи сближаются своими аллельными генами, а при кроссинговере они обмениваются соответствующими участками. В результате появляются кроссоверные хромосомы с новым набором аллелей. Частота, с которой происходит обмен на участке между двумя данными генами, зависит от расстояния между ними (правило Т. Моргана).
Процент кроссоверных гамет, несущих кроссоверные хромосомы, косвенно отражает расстояние между генами. Это расстояние принято выражать в сантшюрганидах.
За одну сантиморганиду принимают расстояние между генами, при котором образуется 1% кроссоверного потомства (кроссоверных гамет).
При увеличении расстояния между генами увеличивается вероятность кроссинговера на участке между ними в клетках-предшественницах гамет. Так как в акте кроссинговера участвуют две хроматиды из четырех, присутствующих в биваленте, то даже в случае осуществления обмена между генами данной пары во всех клетках-предшественницах гамет процент кроссоверных половых клеток не может превысить 50 (рис. 6.15). Однако такая ситуация возможна лишь теоретически. Практически с увеличением расстояния между генами возрастает возможность прохождения одновременно нескольких кроссинговеров на данном участке (см. рис. 5.9). Так как каждый второй перекрест приводит к восстановлению прежнего сочетания аллелей в хромосоме, с увеличением расстояния число кроссоверных гамет может не увеличиваться, а уменьшаться. Из этого следует, что процент кроссоверных гамет является показателем истинного расстояния между генами лишь при достаточно близком их расположении, когда возможность второго кроссинговера исключается.
Нарушение сцепленного наследования родительских аллелей в результате кроссинговера позволяет говорить о неполном сцеплении
в отличие от полного сцепления,
наблюдаемого, например, у самцов дрозофилы.
Использование анализирующего скрещивания в опытах Т. Моргана показало, что с его помощью можно выяснять не только состав пар неаллельных генов, но и характер их совместного наследования. В случае сцепленного наследования признаков по результатам анализирующего скрещивания можно установить также расстояние между генами в хромосоме.
Рис. 6.15. Схема, поясняющая низкий процент кроссоверных гамет
(по отношению к двум данным генам)
Плюсом обозначены клетки-предшественницы гамет, в которых кроссинговер прошел на участке между двумя данными генами; зачернены кроссоверные гаметы
На характер наследования в ряду поколений сложных признаков определенное влияние оказывает тип взаимодействия неаллельных генов (см. разд. 3.6.5.2). Различные комбинации их аллелей могут обеспечивать появление нового признака или его варианта, исчезновение признака, изменение характера его проявления у потомков. Существенную роль в этом играет также характер наследования взаимодействующих генов по отношению друг к другу. Они могут наследоваться независимо или сцепленно, и от этого зависит, с какой частотой в потомстве будут появляться комбинации аллелей, обеспечивающие тот или иной тип их взаимодействия (полимерия, комплементарность, эпистаз).
Ниже будут рассмотрены закономерности наследования признаков при независимом наследовании взаимодействующих неаллельных генов.
Наследование признаков при полимерном взаимодействии генов.
В том случае, когда сложный признак определяется несколькими парами генов в генотипе и их взаимодействие сводится к накоплению эффекта действия определенных аллелей этих генов, в потомстве гетерозигот наблюдается разная степень выраженности признака, зависящая от суммарной дозы соответствующих аллелей. Например, степень пигментации кожи у человека, определяемая четырьмя парами генов, колеблется от максимально выраженной у гомозигот по доминантным аллелям во всех четырех парах (Р1
Р1
Р2
Р2
Р3
Р3
Р4
Р4
) до минимальной у гомозигот по рецессивным аллелям (р1
р1
р2
р2
р3
р3
р4
р4
) (см. рис. 3.80). При браке двух мулатов, гетерозиготных по всем четырем парам, которые образуют по 24
= 16 типов гамет, получается потомство, 1/256 которого имеет максимальную пигментацию кожи, 1/256 — минимальную, а остальные характеризуются промежуточными показателями экспрессивности этого признака. В разобранном примере доминантные аллели полигенов определяют синтез пигмента, а рецессивные — практически не обеспечивают этого признака. В клетках кожи организмов, гомозиготных по рецессивным аллелям всех генов, содержится минимальное количество гранул пигмента.
В некоторых случаях доминантные и рецессивные аллели полигенов могут обеспечивать развитие разных вариантов признаков. Например, у растения пастушьей сумки два гена одинаково влияют на определение формы стручочка. Их доминантные аллели образуют одну, а рецессивные — другую форму стручочков. При скрещивании двух дигетерозигот по этим генам (рис. 6.16) в потомстве наблюдается расщепление 15:1, где 15/16 потомков имеют от 1 до 4 доминантных аллелей, а 1/16, не имеет доминантных аллелей в генотипе.
Наследование при комплементарном взаимодействии генов.
Если сложный признак формируется в результате взаимодополняющего действия определен-ленных аллелей неаллельных генов, то, очевидно, он будет появляться лишь у тех организмов, которые имеют в генотипе именно такую комбинацию аллелей.
Например, присутствие в генотипе доминантных аллелей обоих неаллельных генов обеспечивает развитие сложного признака, чего не происходит при отсутствии одного из них в доминантном состоянии. В этом случае при скрещивании двух дигетерозиготных организмов, имеющих данный признак, лишь у определенной части потомства (9/16) будет формироваться такой признак, а у остальных (7/16) он не разовьется (рис. 6.17).
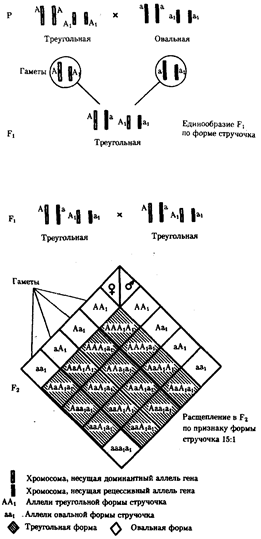
Рис. 6.16. Полимерное наследование формы стручочка у пастушьей сумки
Возможна также ситуация, когда каждый из неаллельных генов в отсутствие доминантного аллеля другого обеспечивает развитие определенного варианта
признака, а вместе они формируют новый его вариант (рис. 6.18). Тогда расщепление в потомстве двух дигетерозигот будет соответствовать расщеплению при независимом наследовании признаков (9:3:3:1).
У человека два гена, детерминирующих отложение в волосах черного и красного пигментов; при определенных сочетаниях их аллелей обеспечивают появление нового признака — особого блеска волос.
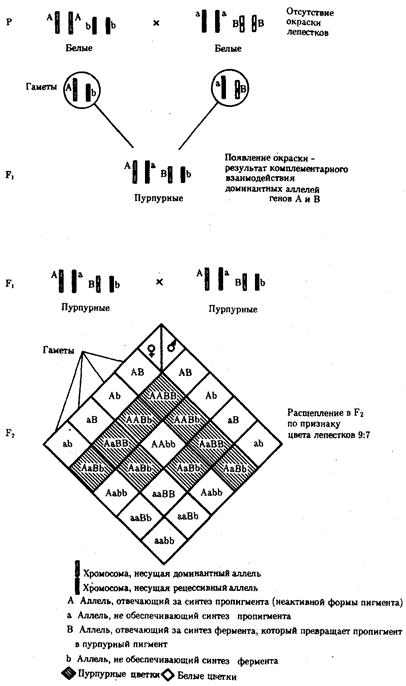
Рис. 6.17. Комплементарное взаимодействие генов I
(наследование признака окраски лепестков у душистого горошка)
Наследование признаков при эпистатическом взаимодействии генов.
При эпистазе один из генов (В) выражается фенотипически лишь при отсутствии в генотипе определенного аллеля другого гена (А). В его присутствии действие гена В не проявляется. В строгом смысле слова, этот вид взаимодействия неаллельных генов может быть рассмотрен как вариант взаимодополняющего действия определенных аллелей этих генов, когда один из них способен обеспечить развитие признака, но лишь в присутствии определенного аллеля другого гена. В этой ситуации фенотип организма зависит от конкретного сочетания аллелей неаллельных генов в их генотипах и расщепление по фенотипу в потомстве двух дигетерозигот по этим генам может быть различным.
Рис. 6.18. Комплементарное взаимодействие генов II
(наследование формы гребня у кур):
I
— А?bb —розовидная, II
— ааВ? — гороховидная, III
— А?В? —ореховидная, IV —
aabb —листовидная
При доминантном эпистазе,
когда доминантный аллель одного гена (А) препятствует проявлению аллелей другого гена (В или b), расщепление в потомстве зависит от их фенотипического значения и может выражаться соотношениями 12:3:1 или 13:3 (рис. 6.19). При рецессивном эпистазе
ген, определяющий какой-то признак (В), не проявляется у гомозигот по рецессивному аллелю другого гена (аа). Расщепление в потомстве двух дигетерозигот по таким генам будет соответствовать соотношению 9:3:4 (рис. 6.20). Невозможность формирования признака при рецессивном эпистазе расценивают также как проявление несостоявшегося комплементарного взаимодействия, которое возникает между доминантным аллелем эпистатического гена и аллелями гена, определяющего этот признак.
С этой точки зрения может быть рассмотрен «Бомбейский феномен» у человека, при котором у организмов-носителей доминантного аллеля гена, определяющего группу крови по системе АВ0 (IA
или IB
), фенотипически эти аллели не проявляются и формируется I группа крови (см. рис. 3.82). Отсутствие фенотипического проявления доминантных аллелей гена I связывают с гомозиготностью некоторых организмов по рецессивному аллелю гена Н (hh), что препятствует формированию антигенов на поверхности эритроцитов. В браке дигетерозигот по генам Н и I (НhIA
IB
) 1/4 потомства будет иметь фенотипически I группу крови в связи с их гомозиготностью по рецессивному аллелю гена Н — hh.
Рассмотренные выше расщепления по фенотипу в потомстве от скрещивания гетерозиготных родителей или анализирующего скрещивания как при моногенном типе наследования признаков, так и в случае взаимодействия неаллельных генов носят вероятностный характер. Такие расщепления наблюдаются лишь в том случае, если реализуются все возможные встречи разнообразных гамет при оплодотворении и все потомки оказываются жизнеспособными. Выявление близких расщеплений вероятно при анализе большого количества потомков, когда случайные события не способны изменить характер расщепления. Г. Мендель, разработавший приемы гибридологического анализа, впервые применил статистический подход к оценке получаемых результатов. Он анализировал большое число потомков, поэтому расщепления по фенотипу, наблюдаемые им в опытах, оказались близкими к расчетным, которые получаются при учете всех типов гамет, образуемых в мейозе, и их встреч при оплодотворении.
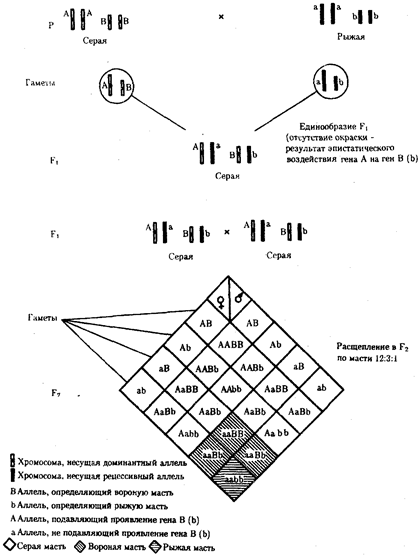
Рис. 6.19. Эпистатическое взаимодействие генов. Доминантный эпистаз (наследование масти у лошадей)
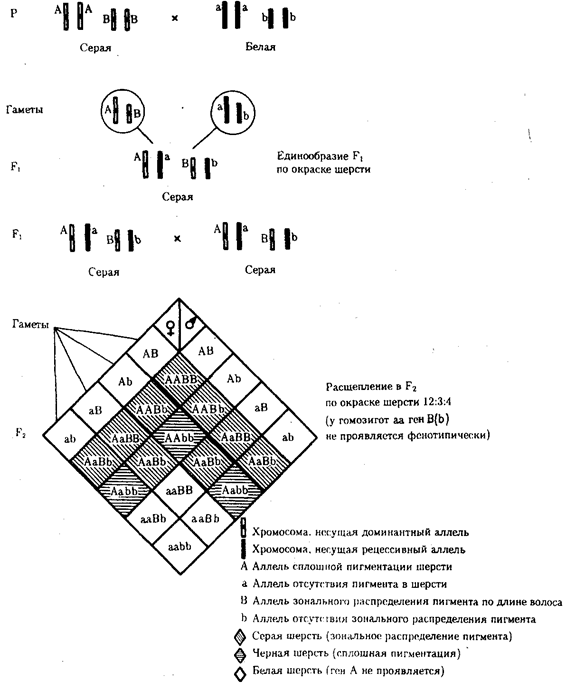
Рис. 6.20. Эпистатическое взаимодействие генов. Рецессивный эпистаз (наследование пигментации шерсти у мышей)
Наличие некоторого количества наследственного материала в цитоплазме в виде кольцевых молекул ДНК митохондрий и пластид, а также других внеядерных генетических элементов дает основание специально остановиться на их участии в формировании фенотипа в процессе индивидуального развития. Цитоплазматические гены
не подчиняются менделевским закономерностям наследования, которые определяются поведением хромосом при митозе, мейозе и оплодотворении. В связи с тем что организм, образуемый вследствие оплодотворения, получает цитоплазматические структуры главным образом с яйцеклеткой, цитоплазматическое наследование признаков осуществляется по материнской линии. Такой тип наследования был впервые описан в 1908 г. К. Корренсом в отношении признака пестрых листьев у некоторых растений (рис. 6.21).
Как было установлено позднее, развитие этого признака обусловлено мутацией, возникающей в ДНК хлоропластов и нарушающей синтез хлорофилла в них. Размножение в клетках нормальных (зеленых) и мутантных (бесцветных) пластид и последующее случайное распределение их между дочерними клетками приводят к появлению отдельных клеток, совершенно лишенных нормальных пластид. Потомство этих клеток образует обесцвеченные участки на листьях. Фенотип потомства, таким образом, зависит от фенотипа материнского растения. У растения с зелеными листьями потомство абсолютно нормально. У растения с бесцветными листьями потомство имеет такой же фенотип. У материнского растения с пестрыми листьями потомки могут иметь все описанные фенотипы по данному признаку. При этом внешний вид потомства не зависит от признака отцовского растения.
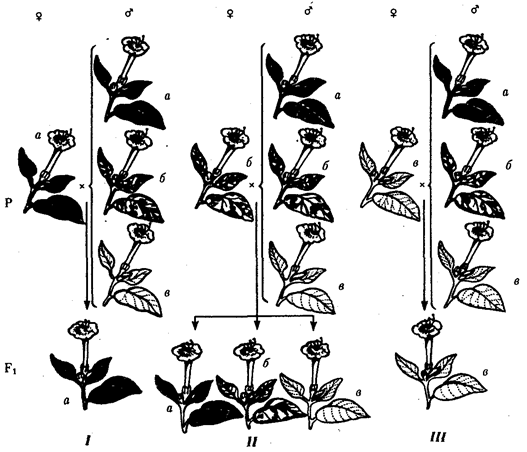
Рис. 6.21. Наследование пестролистости у ночной красавицы:
а —зеленые листья, б—пестрые листья, в
—белые листья; I
, II,
Ш—
результаты скрещивания различных материнских растений (а, б, в
) с
разными отцовскими
Другим примером цитоплазматического наследования признаков могут служить некоторые патологические состояния, описанные у человека, причиной которых является первичный дефект митохондриальной ДНК (мтДНК) (см. гл. 4.1 и гл. 6.4.1.4).
Наряду с описанными выше типами и вариантами наследования ядерных и цитоплазматических генов в последнее время внимание ученых привлекает нетрадиционное наследование
некоторых признаков и патологических состояний у человека (см. гл. 6.4.1.4.).
Фенотип человека, формирующийся на различных стадиях его онтогенеза, так же как фенотип любого живого организма, является в первую очередь продуктом реализации наследственной программы. Степень зависимости результатов этого процесса от условий, в которых он протекает, у человека определяется его социальной природой (см. гл. 12).
Определяя формирование фенотипа организма в процессе его онтогенеза, наследственность и среда могут быть причиной или играть определенную роль в развитии порока или заболевания. Вместе с тем доля участия генетических и средовых факторов варьирует при разных состояниях. С этой точки зрения формы отклонений от нормального развития принято делить на три основные группы.
Наследственные болезни.
Развитие этих заболеваний целиком обусловлено дефектностью наследственной программы, а роль среды заключается лишь в модифицировании фенотипических проявлений болезни. К этой группе патологических состояний относят хромосомные болезни,
в основе которых лежат хромосомные и геномные мутации, и моногенно наследуемые заболевания,
обусловленные генными мутациями. В качестве примера можно назвать болезнь Дауна, гемофилию, фенилкетонурию.
Наследственные болезни всегда связаны с мутацией, однако фенотипическое проявление последней, степень выраженности патологических симптомов у разных индивидумов могут различаться. В одних случаях эти различия обусловлены дозой мутантного аллеля в генотипе. В других — степень выраженности симптомов зависит от факторов среды, в том числе от наличия специфических условий для проявления соответствующей мутации. Так, гомозиготы по аллелю HbS HbS болеют анемией, а гетерозиготы НbА HbS в обычных условиях вполне здоровые люди, тогда как при пониженном парциальном давлении кислорода, например в условиях высокогорья, они страдают от гипоксии. Неблагоприятные последствия нарушения развития центральной нервной системы, приводящие к слабоумию у гомозигот по аллелю фенилкетонурии, удается в значительной степени снизить, применяя на протяжении определенного отрезка времени после рождения искусственную диету, лишенную аминокислоты фенилаланина. Подагра, обусловленная патологически измененным геном, развивается при длительном неблагоприятном воздействии среды, связанном с особенностями питания. Ее проявления также можно ослабить диетотерапией.
Мультифакториальные заболевания,
или болезни с наследственным предрасположением. К ним относится большая группа распространенных заболеваний, особенно болезни зрелого и преклонного возраста, такие, как гипертоническая болезнь, ишемическая болезнь сердца, язвенная болезнь желудка и двенадцатиперстной кишки и т.д. Причинными факторами их развития выступают неблагоприятные воздействия среды, однако реализация этих воздействий зависит от генетической конституции, определяющей предрасположенность организма. Соотносительная роль наследственности и среды в развитии разных болезней с наследственным предрасположением неодинакова.
Лишь немногие формы патологии обусловлены исключительно воздействием факторов среды—
травма, ожог, обморожение, особо опасные инфекции. Но и при этих формах патологии течение и исход заболевания в значительной степени определяются генетическими факторами.
В 90-х годах XX в. предложена рабочая классификация наследственных болезней человека, включающая:
1) синдромы, обусловленные хромосомными аномалиями (хромосомные болезни);
2) болезни, вызванные мутацией отдельного гена (генные или менделевские болезни);
3) мультифакториальные заболевания (МФЗ) как результат взаимодействия генетических и средовых факторов (болезни с наследственным предрасположением);
4) болезни с нетрадиционным типом наследования;
5) генетические болезни соматических клеток (новообразования, старение, аутоиммунные болезни).
Эта группа заболеваний обусловлена изменением структуры отдельных хромосом или их количества в кариотипе (см. разд. 4.2.1; 4.2.2; 6.4.3.6). Как правило, при таких мутациях наблюдается дисбаланс наследственного материала, который и ведет к нарушению развития организма. У человека описаны геномные мутации по типу полиплоидии, которые редко наблюдаются у живорожденных, а в основном обнаруживаются у абортированных эмбрионов и плодов и у мертворожденных. Основную часть хромосомных болезней составляют анэуплоидии, причем моносомии по аутосомам у живорожденных встречаются крайне редко. Большинство из них касаются 21-й и 22-й хромосом и чаще обнаруживаются у мозаиков, имеющих одновременно клетки с нормальным и мутантным кариотипом. Достаточно редко обнаруживается моносомия и по Х-хромосоме (синдром Шерешевского — Тернера).
В отличие от моносомии трисомии описаны по большому числу аутосом: 8, 9, 13, 14, 18, 21, 22-й и Х-хромосоме, которая может присутствовать в кариотипе в 4—5 экземплярах, что вполне совместимо с жизнью.
Структурные перестройки хромосом также, как правило, сопровождаются дисбалансом генетического материала (делеции, дупликации). Степень снижения жизнеспособности при хромосомных аберрациях зависит от количества недостающего или избыточного наследственного материала и от вида измененной хромосомы.
К настоящему времени описано около 100 клинико-цитогенетических синдромов, в основе которых лежат различные хромосомные аномалии.
Хромосомные изменения, приводящие к порокам развития, чаще всего привносятся в зиготу с гаметой одного из родителей при оплодотворении. При этом все клетки нового организма будут содержать аномальный хромосомный набор и для диагностики такого заболевания достаточно проанализировать кариотип клеток какой-нибудь ткани.
Если хромосомные нарушения возникают в одном из бластомеров во время первых делений зиготы, образующейся из нормальных гамет, то развивается мозаичный организм, большая или меньшая часть клеток которого несет нормальный хромосомный набор. Диагностика мозаичных форм хромосомных болезней отличается большей трудоемкостью и требует изучения кариотипа большого числа клеток из разных тканей.
Для определения вероятности появления хромосомной болезни в потомстве в семьях, уже имеющих больных детей, важно установить, является ли это хромосомное нарушение заново возникшим или оно унаследовано от предыдущего поколения. Чаще родители человека с хромосомным заболеванием имеют нормальный кариотип, а появление больного потомства является результатом мутации, возникшей в одной из гамет. В этом случае возможность повторного хромосомного нарушения у детей в данной семье маловероятна и не превосходит таковой в целом для популяции. Вместе с тем описано немало семей, в которых наблюдается предрасположение, например, к нерасхождению хромосом.
В случае наследуемых хромосомных болезней в соматических клетках родителей обнаруживаются хромосомные или геномные мутации, которые могут передаваться их зрелым половым клеткам в ходе гаметогенеза. Передают потомству хромосомные нарушения обычно фенотипически нормальные родители, являющиеся носителями сбалансированных хромосомных перестроек — реципрокных транслокаций, робертсоновских транслокаций или перицентрических инверсий. У носителей такого рода хромосомных перестроек с определенной вероятностью образуются нормальные гаметы, а также гаметы, несущие сбалансированную перестройку, и половые клетки с нарушенным балансом генов в геноме (рис. 6.22).
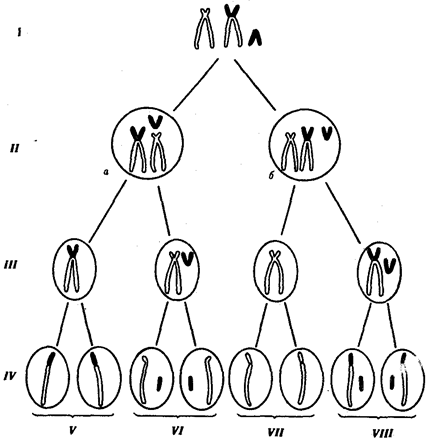
Рис. 6.22. Вероятность образования нормальных и аномальных гамет у носителей сбалансированной хромосомной перестройки
Показана робертсоновская транслокация 21-й хромосомы (окрашена) на одну из акродентрических хромосом (не окрашена);
I
— кариотип носителя сбалансированной хромосомной перестройки, II
— варианты (а, б
) расположения бивалентов в экваториальной плоскости веретена деления (метафаза I), III —
результат 1-го редукционного деления мейоза; IV —
результат 2-го эквационного деления мейоза; V —
гаметы со сбалансированной хромосомной перестройкой; VI —
нормальные гаметы; VII —
гаметы, не имеющие 21-й хромосомы; VIII —
гаметы, содержащие две 21-е хромосомы (VII
и VIII —
гаметы с несбалансированным геномом)
Возможность наследования хромосомных аномалий делает необходимым анализ кариотипа родителей, уже имеющих больных детей, и пренатальную диагностику развивающегося внутриутробно плода для исключения вероятности повторного рождения ребенка с хромосомной болезнью.
Фенотипическое проявление различных хромосомных и геномных мутаций характеризуется ранним и множественным поражением различных систем органов. Типичными являются задержка общего физического и умственного развития, отклонения в строении скелета, в частности мозгового и лицевого черепа, пороки развития сердечно-сосудистой, мочеполовой, нервной систем, нарушения в биохимическом, гормональном и иммунологическом статусе организма. Хромосомные болезни, как правило, характеризуются сочетанием многих врожденных пороков. Для них также характерны многообразие и вариабельность фенотипических проявлений. Наиболее специфические проявления хромосомных заболеваний связаны с дисбалансом по относительно небольшому фрагменту хромосомы. Так, фенотипическое проявление синдрома Дауна наблюдается в случае трисомии всего лишь по небольшому сегменту длинного плеча 21-й хромосомы. Картина синдрома «кошачьего крика» развивается при утрате участка короткого плеча 5-й хромосомы. Дисбаланс по значительному объему хромосомного материала делает фенотипическую картину менее специфической.
Специфичность проявления хромосомного заболевания определяется изменением содержания определенных структурных генов, кодирующих синтез специфических белков. Так, при болезни Дауна обнаружено повышение в 1,5 раза активности фермента супероксид-дисмутазы I, ген которого располагается в 21-й хромосоме и представлен у больных в трехкратной дозе. Эффект «дозы гена» обнаружен более чем для 30 генов, локализованных в разных хромосомах человека.
Полуспецифические симптомы проявления хромосомных болезней связаны в значительной мере с дисбалансом генов, представленных многими копиями, которые контролируют ключевые процессы в жизнедеятельности клеток и кодируют, к примеру, структуру рРНК, тРНК, гистонов, рибосомальных белков, актина, тубулина.
Неспецифические проявления при хромосомных болезнях связывают с изменением содержания гетерохроматина в клетках, который оказывает влияние на нормальное течение клеточного деления и роста, формирование в онтогенезе количественных признаков, определяемых полигенами.
К указанным заболеваниям относятся моногенно
обусловленные патологические состояния, наследуемые в соответствии с законами Менделя.
В зависимости от функциональной значимости первичных продуктов соответствующих генов генные болезни подразделяют на наследственные нарушения ферментных систем (энзимопатии), дефекты белков крови (гемоглобинопатии), дефекты структурных белков (коллагеновые болезни) и генные болезни с невыясненным первичным биохимическим дефектом.
Энзимопатии.
В основе энзимопатии лежат либо изменения активности фермента, либо снижение интенсивности его синтеза. У гетерозигот-носителей мутантного гена присутствие нормального аллеля обеспечивает сохранение около 50% активности фермента по сравнению с нормальным состоянием. Поэтому наследственные дефекты ферментов клинически проявляются у гомозигот, а у гетерозигот недостаточная активность фермента выявляется специальными исследованиями.
В зависимости от характера нарушения обмена веществ в клетках среди энзимопатий различают следующие формы.
1. Наследственные дефекты обмена углеводов (галактоземия — нарушение метаболизма молочного сахара —
лактозы; мукополисаха-ридозы — нарушение расщепления полисахаридов).
2. Наследственные дефекты обмена липидов и липопротеинов (сфинголипидозы — нарушение расщепления структурных липидов; нарушения обмена липидов плазмы крови, сопровождающиеся увеличением или снижением в крови холестерина, лецитина).
3. Наследственные дефекты обмена аминокислот (фенилкетонурия —нарушение обмена фенилаланина (см. разд. 4.1); тирозиноз— нарушение обмена тирозина; альбинизм — нарушение синтеза пигмента меланина из тирозина и др.).
4. Наследственные дефекты обмена витаминов (гомоцистинурия — развивается как результат генетического, дефекта кофермента витаминов В6
и B12
, наследуется по аутосомно-рецессивному типу).
5. Наследственные дефекты обмена пуриновых и пиримидиновых азотистых оснований (синдром Леша — Найяна, связанный с недостаточностью фермента, который катализирует превращение свободных пуриновых оснований в нуклеотиды, наследуется по Х-сцепленному рецессивному типу).
6. Наследственные дефекты биосинтеза гормонов (адреногенитальный синдром, связанный с мутациями генов, которые контролируют синтез андрогенов; тестикулярная феминизация, при которой не образуются рецепторы андрогенов).
7. Наследственные дефекты ферментов эритроцитов (некоторые гемолитические несфероцитарные анемии, характеризующиеся нормальной структурой гемоглобина, но нарушением ферментной системы, участвующей в анаэробном (бескислородном) расщеплении глюкозы. Наследуются как по аутосомно-рецессивному, так и по Х-сцепленному рецессивному типу).
Гемоглобинопатии.
Это группа наследственных заболеваний, вызываемых первичным дефектом пептидных цепей гемоглобина и связанным с этим нарушением его свойств и функций. К ним относят метгемоглобинемии, эритроцитозы, серповидно-клеточную анемию, талассемии (см. § 4.1).
Коллагеновые болезни.
В основе возникновения этих заболеваний лежат генетические дефекты биосинтеза и распада коллагена — важнейшего структурного компонента соединительной ткани. К этой группе относят болезнь Эллерса — Данлоса, характеризующуюся большим генетическим полиморфизмом и наследующуюся как по аутосомно-доминантному, так и по аутосомно-рецессивному типу, болезнь Марфана, наследующуюся по аутосомно-доминантному типу, и ряд других заболеваний.
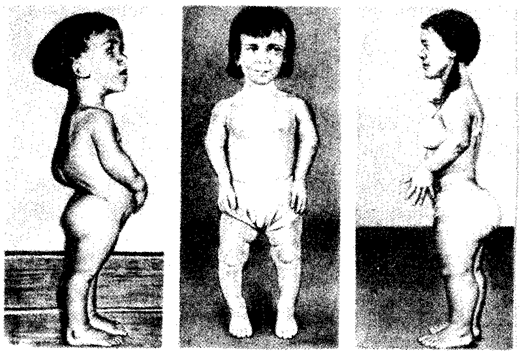
Рис. 6.23. Больные с ахондроплазией
Наследственные болезни с невыясненным первичным биохимическим дефектом.
К этой группе принадлежит подавляющее большинство моногенных наследственных болезней. Наиболее распространенными являются следующие.
1. Муковисцидозы —
встречаются с частотой 1:2500 новорожденных; наследуются по аутосомно-рецессивному типу. В основе патогенеза заболевания —наследственное поражение экзокринных желез и железистых клеток организма, выделение ими густого, измененного по составу секрета и связанные с этим последствия.
2. Ахондроплазия —
заболевание, в 80—95% случаев обусловленное вновь возникшей мутацией; наследуется по аутосомно-доминантному типу; встречается с частотой приблизительно 1:100 000. Это заболевание костной системы, при котором наблюдаются аномалии развития хрящевой ткани преимущественно в эпифизах трубчатых костей и костях основания черепа (рис. 6.23).
3. Мышечные дистрофии
(миопатии
) —
заболевания, связанные с поражением поперечно-полосатых и гладких мышц. Различные формы характеризуются разным типом наследования. Например, прогрессирующая псевдогипертрофическая миопатия Дюшена наследуется по Х-сцепленному рецессивному типу и проявляется преимущественно у мальчиков в начале первого десятилетия жизни. Известна мышечная псевдогипертрофическая дистрофия, наследующаяся по аутосомно-рецессивному типу, которая начинает развиваться во второй половине первого десятилетия жизни и встречается с одинаковой частотой у обоих полов. Мышечная дистрофия плечевого и тазового пояса: наследуется по аутосомно-доминантному типу и т.д.
Генетическое многообразие генных болезней.
Изучение наследственных заболеваний у человека свидетельствует о том, что нередко сходное фенотипическое проявление болезни бывает обусловлено несколькими различными мутациями. Это явление впервые было описано в 30-х гг. С. Н. Давиденковым и названо генетической гетерогенностью наследственных заболеваний.
Генетическая гетерогенность наследственных болезней может быть обусловлена мутациями разных генов, кодирующих ферменты одного метаболического пути, а также мутациями одного и того же гена, приводящими к появлению разных его аллелей.
Среди рассмотренных выше наследственных болезней особенно высокой степенью генетического полиморфизма отличаются мукопо-лисахаридозы, генетическая разнородность которых объясняется множественными мутациями в 11—12 генах, связанных общей функцией расщепления полисахаридов. Большой генетической гетерогенностью характеризуется врожденная аутосомно-рецессивная форма глухоты, при которой различают не менее 35 генетически различных вариантов с фенотипически сходным проявлением.
Большие перспективы в расшифровке наследственной гетерогенности генных болезней открываются в связи с применением молекулярно-генетических методов их прямого анализа с помощью ДНК-зондов.
Клиническое многообразие наследственных болезней.
Разнообразие клиники наследственных болезней проявляется в различии времени начала заболевания, в спектре и степени выраженности симптомов, в течении и исходе у разных больных. Например, наследуемая по аутосомно-доминантному типу хорея Гентингтона, при которой поражаются базальные ганглии головного мозга, клинически начинает проявляться в виде непроизвольных движений в разном возрасте, но чаще в 40—45 лет. С временем начала клинического проявления связана и тяжесть течения заболевания (см. 6.4.1.4).
О клиническом полиморфизме можно говорить лишь в отношении генетически определенной наследственной формы. Причины клинического полиморфизма могут быть как генетическими, так и средовы-ми. К генетическим причинам можно отнести действие генов-модификаторов на проявление патологически измененного гена и сложную систему разнообразных взаимодействий между ним и другими генами. Кроме того, разнообразие клинического проявления наследственных заболеваний может зависеть от факторов среды, в которой развивается организм и которая влияет на проявление патологически измененных генов.
Эта группа болезней отличается от генных болезней тем, что для своего проявления нуждается в действии факторов внешней среды.
Среди них также различают моногенные,
при которых наследственная предрасположенность обусловлена одним патологически измененным геном, и полигенные.
Последние определяются многими генами, которые в нормальном состоянии, но при определенном взаимодействии между собой и с факторами среды создают предрасположение к появлению заболевания. Они называются мультифакториальными
заболеваниями (МФЗ).
Заболевания моногенные с наследственным предрасположением относительно немногочисленны. К ним применим метод менделевского генетического анализа. Учитывая важную роль среды в их проявлении, они рассматриваются как наследственно обусловленные патологические реакции на действие различных внешних факторов (лекарственных препаратов, пищевых добавок, физических и биологических агентов), в основе которых лежит наследственная недостаточность некоторых ферментов.
К таким реакциям могут быть отнесены наследственно обусловленная непереносимость сульфаниламидных препаратов, проявляющаяся в гемолизе эритроцитов, повышении температуры при применении общих анестезирующих средств.
У человека описана мутация, обусловливающая патологическую реакцию на загрязнение атмосферы, которая проявляется в раннем развитии эмфиземы легких (в возрасте 30—40 лет). У генетически чувствительных индивидов нежелательные реакции могут вызывать некоторые компоненты пищи и пищевые добавки. Известна непереносимость у ряда людей молочного сахара —лактозы. Гены непереносимости лактозы широко распространены среди азиатского населения (до 95—100%) и среди американских негров и индейцев (до 70—75%). У некоторых людей наблюдается непереносимость к употребляемым в пищу конским бобам, вызывающим у них гемолиз. Ряд лиц не переносит жирной пищи и в раннем возрасте страдает атеросклерозом, что повышает риск инфаркта миокарда. У некоторых людей употребление в пищу сыра и шоколада провоцирует мигрень. Отмечены специфические реакции людей на алкоголь. Консерванты и пищевые красители у некоторых людей не подвергаются нормальному усвоению, что также проявляется в непереносимости этих компонентов пищи.
Наряду с химическими агентами у людей отмечается наследуемая патологическая реакция на физические факторы (тепло, холод, солнечный свет) и факторы биологической природы (вирусные, бактериальные, грибковые инфекции, вакцины). Иногда отмечается наследственная устойчивость к действию биологических агентов. Например гетерозиготы HbA HbS устойчивы к заражению возбудителем тропической малярии.
К болезням с наследственной предрасположенностью, обусловленной многими генетическими и средовыми факторами, относятся такие заболевания, как псориаз, сахарный диабет, шизофрения. Этим заболеваниям присущ семейный характер, и участие наследственных факторов в их возникновении не вызывает сомнений. Однако генетическая природа предрасположенности к ним пока не расшифрована.
Нередко предрасположенность к ряду заболеваний наблюдается у людей с определенным сочетанием различных генов. Так, у людей со II (А) группой крови чаще наблюдается рак желудка и кишечника, матки, яичников и молочной железы, а также пернициозная анемия, сахарный диабет, ишемическая болезнь сердца, холецистит, желчно-каменная болезнь, ревматизм. У людей с I (0) группой крови чаще встречается язвенная болезнь желудка и двенадцатиперстной кишки. Установление с помощью различных методов генетических исследований точного диагноза заболевания, выяснение роли наследственности и среды в его развитии, определение типа наследования в случае наследственных болезней дают возможность врачу разрабатывать методы лечения и профилактики появления этих заболеваний в следующих поколениях.
В последние годы стало очевидным, что далеко не все случаи наследственной патологии у человека можно рассматривать как результат менделирующих генных мутаций, хромосомных аномалий или как мультифакториальные заболевания (МФЗ).
В настоящее время описано достаточно много заболеваний, которые в современной классификации наследственной патологии человека объединяют в отдельную группу: болезни с нетрадиционным типом наследования. Среди них различают: болезни импринтинга, митохондриальные болезни, болезни экспансии тринуклеотидных повторов с явлением антиципации и др.
Болезни импринтинга.
Особенности наследования и фенотипического проявления при болезнях импринтинга обусловлены явлением геномного импринтинга
(ГИ) (импринтинг от англ. imprinting — запечатление).
Явление геномного импринтинга связывают со специфическими изменениями хромосом или их участков во время образования мужских и женских гамет. Этим объясняется дифференциальная маркировка отцовских и материнских хромосом у потомков.
Точные механизмы дифференциальной маркировки хромосом или их участков в сперматогенезе или овогенезе пока окончательно не выяснены. Однако, немаловажная роль, вероятно, принадлежит процессам специфического метилирования цитозиновых оснований ДНК, выключающим транскрипцию гена.
Импринтированные участки в хромосомах определенного родительского происхождения (отцовских иди материнских) избирательно репрессируются у потомка. В связи с этим фенотипически проявляется только информация, полученная от другого родителя, т.е. имеет место моноаллельная экспрессия. Следовательно, фенотипическое проявление мутантного аллеля зависит от того с какой половой клеткой (яйцеклеткой или сперматозоидом) он был передан потомку.
Явлением ГИ объясняется, например, избирательная инактивация у млекопитающих отцовской Х-хромосомы в клетках провизорных органов (см. гл. 7.5.4.). В клетках самого зародыша имеет место равновероятная инактивация отцовской и материнской Х-хромосом (см. рис. 3.78).
Таким образом, следствием ГИ (дифференциальной маркировки в гаметогенезе родителей и последующей избирательной инактивации у потомков участков хромосом) является функциональная неравноценность в генотипе потомка аллелей разного родительского происхождения.
Связь этиологии ряда наследственных заболеваний с феноменом ГИ может быть прослежена на разных уровнях организации генетического материала.
На геномном уровне организации наследственного материала доказательством роли ГИ в патологии служит различное фенотипическое проявление триплоидных состояний при разном соотношений гаплоидных наборов отцовского и материнского происхождения.
У диандрических триплоидов (соотношение числа гаплоидных наборов отца и матери 2:1) и у дигенических триплоидов (соотношение 1:2) патологические отклонения в развитии плаценты и собственно зародышевых тканей проявляются по-разному. Это свидетельствует о неравноценности функционирования гаплоидных наборов отца и матери в тканях зародыша и плаценты (см, разд. 7.5.4 и 7.6.1).
Связь феномена ГИ с патологией на уровне отдельных хромосом можно проследить в случае однородительской дисомии (ОРД), при которой происходит удвоение хромосомы одного из родителей при утрате гомологичной хромосомы другого родителя.
В основе возникновения ОРД лежит нарушение процессов гаметогенеза. При нерасхождении сестринских хроматид в анафазе II мейоза появляются гаметы, в галлоидном наборе которых присутствуют две генетически идентичные хромосомы (изодисомия).
В случае нерасхождения гомологичных хромосом в анафазе I мейоза образуются гаметы, в гаплоидном наборе которых имеется пара гомологичных, генетически неидентичных хромосом (гетеродисомия). В обоих случаях гаметы данного индивида дисомны по одной из хромосом.
При оплодотворении дисомных гамет нулисомными по той же хромосоме подовыми клетками происходит комплемеитация гамет,
приводящая к возникновению нормального диплоидного кариотипа зиготы. Однако в генотипе такой зиготы присутствует двойной набор генов данной хромосомы, происходящих от одного, а не от обоих родителей.
Иногда оплодотворение дисомных гамет нормальными половыми клетками сопровождается «коррекцией трисомии»
в результате потери сверхчисленной хромосомы. Если при этом сохраняются две хромосомы, пришедшие от одного родителя, то наблюдается явление ОРД.
Наконец, состояние ОРД по отдельным локусам хромосом может возникать в результате соматической рекомбинации
— кроссинговера между хроматидами гомологичных хромосом, происходящего в соматических клетках (см. рис 3.73).
Когда хромосома не содержит импринтированных участков, при ОРД по данной хромосоме может не наблюдаться аномалий фенотипа. Исключением может быть проявление аутосомно-рецессивного заболевания как результат гомозиготизации по рецессивному аллелю при изодисомии.
Если хромосома содержит импринтированные участки, то при возникновении однородительской дисомии локализованные в них аллели могут быть либо экспрессированы, либо инактивированы в зависимости от родительского происхождения ОРД. Это может стать причиной возникновения патологических отклонений в развитии организма. Фенотипическое проявление при ОРДмат и ОРДотц может быть сходным или прямо противоположным. Возможен летальный эффект уже на ранних сроках развития.
В настоящее время эффект импринтинга установлен достаточно определенно для четырех хромосом человека 15, 11, 7, 14. Так в проксимальном отделе длинного плеча 15-й хромосомы имеется район, подверженный импринтингу. Мутации, связанные с микроделециями в этом районе, приводят к развитию у человека синдрома Прадера — Вилли, при котором у пациентов наблюдается умственная отсталость, мышечная гипотония, сильное ожирение, гипогонадизм, низкий рост, акромикрия (непропорционально малые размеры дистальных отделов конечностей). В настоящее время описано более 30 случаев синдрома Прадера —Вилли, когда у пациентов определяется ОРДмат 15. Считается, что ОРДмат 15 является причиной 20—25% всех случаев этого синдрома. Большая же часть остальных случаев заболевания связана с делецией сегмента 15qll — ql3 отцовской хромосомы. Указанный пример свидетельствует об активной экспрессии соответствующего участка 15-й хромосомы исключительно отцовского происхождения. В материнской же хромосоме он метилирован и репрессирован.
Делеция другого участка, также расположенного в сегменте 15qll — ql3, но в 15-й хромосоме материнского происхождения, в 70% случаев приводит к развитию синдрома Энгельмана (синдрома «счастливой куклы»), характеризующегося глубокой умственной отсталостью с резкими судорожными движениями и неадекватной счастливой улыбкой. В 2% случаев этот синдром обусловлен ОРДотц15.
Из сказанного выше следует, что в проксимальном районе длинного плеча 15-й хромосомы имеются близкорасположенные и противоположно импринтированные локусы, отвечающие за возникновение фенотипически различных синдромов Прадера — Вилли и Энгельмана.
Таким образом импринтироваться могут участки хромосом разного родительского происхождения, что и определяет нетрадиционное наследование многих патологических состояний, обусловленных мутациями локусов, подверженных импринтингу.
Митохондриальные болезни.
Начиная с конца 80-х годов XX века получены убедительные доказательства связи некоторых видов наследственной патологии у человека с мутациями митохондриальной ДНК (см. гл. 4.1) В зависимости от типа мутаций митохондриальные болезни разделяют на 4 группы:
а
) болезни, вызванные точковыми мутациями, приводящими к замене консервативных аминокислот в собственных белках митохондрий.
К ним относятся пигментный ретинит и нейроофтальмопатия Лебера, при которой наступает двусторонняя потеря зрения. Выраженность клинических признаков у больных этими заболеваниями коррелирует с количеством мутантной мтДНК, которое у разных больных может варьировать от 5 до 100% всей мтДНК;
б
) болезни, вызванные мутациями в генах т-РНК,
приводящими к многочисленным дегенеративным заболеваниям с различной степенью тяжести клинических проявлений, коррелирующей с количеством мутантной мтДНК;
в
) болезни вызванные делениями и дупликациями участков митохондриалъных генов.
У человека описано тяжелое заболевание молодого и среднего возраста — отсроченная кардиопатия, при которой обнаружены делеции мтДНК кардиоцитов. Заболевание носит семейный характер. В ряде случаев предполагается Х-сцепленное наследование, что позволяет думать о существовании ядерного гена, мутация которого вызывает делению до 50% мтДНК кардиоцитов;
г
) болезни, вызванные снижением числа копий мтДНК,
что является следствием определенных мутаций. К данной группе относятся летальная инфантильная дыхательная недостаточность и синдром молочнокислого ацидоза, при которых число копий мтДНК снижается до 1—2% от нормы. Снижение содержания мтДНК в клетках различных органов приводит к развитию миопатий, нефропатий, печеночной недостаточности и т.д. вследствие ослабления синтеза белков, кодируемых мтДНК.
Изменения в ДНК митохондрий сопровождаются нарушением их функций, связанных с клеточным дыханием. Это определяет характер и степень тяжести клинических проявлений митохондриалъных болезней.
Выдвинута также гипотеза о том, что накопление спонтанно возникающих мутаций мтДНК является звеном механизмов старения и развития дегенеративных процессов у человека.
Болезни экспансии тринуклеотвдных повторов с явлением антиципации.
Под генетической антиципацией (или упреждением) понимается более раннее проявление и возрастание тяжести симптомов наследственного заболевания в последующих поколениях родословной. Антиципация реально проявляется при определенных видах моногенной неврологической патологии, а также при некоторых мультифакториальных заболеваниях.
В начале 90-х годов XX века при исследовании ряда тяжелых неврологических заболеваний были обнаружены «динамические» мутации с экспансией (резким увеличением числа копий) тринуклеотидных повторов у индивидов в последующих поколениях родословной. Развивающиеся в результате таких мутаций наследственные заболевания характеризуются четко выраженным проявлением антиципации.
Феномен экспансии числа тринуклеотидных повторов был впервые обнаружен при исследовании синдрома Мартина—Белла или синдрома фрагильной (ломкой) Х-хромосомы, основным фенотипическим проявлением которого является умственная отсталость. Синдром ломкой Х-хромосомы характеризуется довольно широкой распространенностью в популяции (1:1000) и необычным характером наследования. Лишь у 80% мужчин-носителей мутантного локуса имеются клинические и цитогенетические признаки заболевания. 20% носителей как клинически, так и цитогенетически нормальны, но после передачи мутации всем своим дочерям они могут иметь пораженных внуков. Неэкспрессируемый мутантный ген в таком случае становится экс-прессируемым в последующих поколениях.
Таким образом мутантный ген при синдроме ломкой Х-хромосомы может существовать в двух формах, отличающихся по своей пенетрантности. Одна — фенотипически не проявляющаяся — премутация, которая при прохождении через женский мейоз превращается в другую форму — полную мутацию. При таком необычном способе наследования и фенотипического проявления мутантного гена, отличном от классического Х-сцепленного наследования, обнаруживается феномен антиципации — более тяжелое проявление заболевания в последующих поколениях.
В основе клинических проявлений и цитологической нестабильности в локусе, ответственном за синдром ломкой Х-хромосомы, лежит многократное увеличение повторов тринуклеотида ЦГГ. В норме число повторов колеблется от 5 до 50. Премутация — неэкспрессируемая форма — характеризуется увеличением числа повторов до 50—200. Возрастание числа повторов тринуклеотида ЦГГ свыше 200 приводит к клинической манифестации заболевания и цитогенетическому проявлению ломкой Х-хромосомы. Как правило, у пораженных лиц наблюдается также аномальное метилирование ДНК, приводящее к репрессированию гена.
Интересно, что переход от состояния премутации к полной мутации возникает при передаче от матери, причем экспансия ЦГГ-повторов значительно выше при передаче от матери к сыну, чем от матери к дочери.
Антиципация, характерная для синдрома ломкой Х-хромосомы, объясняется четкой связью между числом тринуклеотидных повторов и тяжестью клинических проявлений заболевания с цитологической экспрессией ломкости Х-хромосомы.
Таблица 6.3. Некоторые заболевания человека,
связанные с экспансией тринуклеотидных повторов
| Вид патологии
|
Локализация гена
|
Тринуклеотидный повтор
|
Число тринуклеотидных повторов
|
| норма
|
патология
|
| Синдром ломкой
Х-хромосомы (FRAXA)
|
Xq 27,3
|
ЦГГ
|
5—50
|
>200
|
| Спино-бульбарная мышечная атрофия
|
Xq 11-12
|
ЦАГ
|
17—26
|
40—52
|
| Миотоническая дистрофия
|
19q 13,3
|
ЦТГ
|
5—27
|
50—1600
|
| Хорея Гентинггона
|
4р 16,3
|
ЦАГ
|
11—34
|
>42
|
Увеличение числа тринуклеотидных повторов и связанное с этим явление антиципации обнаружены при целом ряде заболеваний (табл. 6.3). Например, при аутосомно-доминантном заболевании—хорее Гетинггона выявляется четкая корреляция между числом ЦАГ-повторов и возрастом дебюта заболевания. У потомков пораженных отцов обнаруживается более тяжелое клиническое течение заболевания. Экспансия числа тринуклеотидных повторов происходит в мужском гаметогенезе.
Таким образом, в настоящее время описан новый класс наследственных болезней (около 10 заболеваний), при которых проявляется феномен антиципации, материнский или отцовский эффект, варьирующая пенетрантность. Установлена связь указанных особенностей наследования и фенотипического проявления этих заболеваний с возникновением динамических мутаций, приводящих к экспансии тринуклеотидных повторов.
Генетические болезни соматических клеток частично описаны в разд. 4.2.1.
Основные закономерности наследственности и изменчивости живых организмов были открыты благодаря разработке и применению гибридологического метода генетического анализа, основоположником которого является Г. Мендель. Наиболее удобными объектами, широко используемыми генетиками для гибридизации и последующего анализа потомства, стали горох, дрозофила, дрожжи, некоторые бактерии и другие виды, легко скрещивающиеся в искусственных условиях. Отличительной особенностью этих видов является достаточно высокая плодовитость, позволяющая применять статистический подход при анализе потомства. Короткий жизненный цикл и быстрая смена поколений позволяют исследователям в относительно небольшие промежутки времени наблюдать передачу признаков в последовательном ряду многих поколений. Немаловажной характеристикой видов, используемых в генетических экспериментах, является также небольшое число групп сцепления в их геномах и умеренное модифицирование признаков под влиянием окружающей среды.
С точки зрения приведенных выше характеристик видов, удобных для применения гибридологического метода генетического анализа, человек как вид обладает целым рядом особенностей, не позволяющих применять этот метод для изучения его наследственности и изменчивости. Во-первых, у человека не может быть произведено искусственного направленного скрещивания в интересах исследователя. Во-вторых, низкая плодовитость делает невозможным применение статистического подхода при оценке немногочисленного потомства одной пары родителей. В-третьих, редкая смена поколений, происходящая в среднем через 25 лет, при значительной продолжительности жизни дает возможность одному исследователю наблюдать не более 3—4 последовательных поколений. Наконец, изучение генетики человека затрудняется наличием в его геноме большого числа групп сцепления генов (23 у женщин и 24 у мужчин), а также высокой степенью фенотипического полиморфизма, связанного с влиянием среды.
Все перечисленные особенности человека делают невозможным применение для изучения его наследственности и изменчивости классического гибридологического метода генетического анализа, с помощью которого были открыты все основные закономерности наследования признаков и установлены законы наследственности. Однако генетиками разработаны приемы, позволяющие изучать наследование и изменчивость признаков у человека, несмотря на перечисленные выше ограничения.
Невозможность направленного скрещивания, проводимого в интересах исследования, и малочисленность потомства, получаемого от каждой родительской пары, компенсируются подбором в популяции семей с интересующим генетика признаком в количестве, достаточном для проведения статистического анализа потомства. Ограниченность числа поколений, которые может наблюдать один генетик, компенсируется возможностью подбора и регистрации последовательных поколений семей с интересующим признаком многими поколениями исследователей. Существенно облегчается генетический анализ у человека благодаря высокой степени изученности его фенотипа методами морфологии, физиологии, биохимии, иммунологии, клиники. Большие перспективы в изучении наследственности и изменчивости у человека открываются в связи с применением ранее используемых и новых методов генетических исследований.
К методам, широко используемым при изучении генетики человека, относятся генеалогический, популяционно-статистический, близнецовый, метод дерматоглифики, цитогенетический, биохимический, методы генетики соматических клеток.
В основе этого метода лежит составление и анализ родословных. Этот метод широко применяют с древних времен и до наших дней в коневодстве, селекции ценных линий крупного рогатого скота и свиней, при получении чистопородных собак, а также при выведении новых пород пушных животных. Родословные человека составлялись на протяжении многих столетий в отношении царствующих семейств в Европе и Азии.
Как метод изучения генетики человека генеалогический метод стали применять только с начала XX столетия, когда выяснилось, что анализ родословных, в которых прослеживается передача из поколения в поколение какого-то признака (заболевания), может заменить собой фактически неприменимый в отношении человека гибридологический метод.
При составлении родословных исходным является человек — пробанд, родословную которого изучают. Обычно это или больной, или носитель определенного признака, наследование которого необходимо изучить. При составлении родословных таблиц используют условные обозначения, предложенные Г. Юстом в 1931 г. (рис. 6.24). Поколения обозначают римскими цифрами, индивидов в данном поколении — арабскими.
Рис. 6.24. Условные обозначения при составлении родословных (по Г. Юсту)
С помощью генеалогического метода может быть установлена наследственная обусловленность изучаемого признака, а также тип его наследования (аутосомно-доминантный, аутосомно-рецессивный, X-сцепленный доминантный или рецессивный, Y-сцепленный). При анализе родословных по нескольким признакам может быть выявлен сцепленный характер их наследования, что используют при составлении хромосомных карт. Этот метод позволяет изучать интенсивность мутационного процесса, оценить экспрессивность и пенетрантность аллеля. Он широко используется в медико-генетическом консультировании для прогнозирования потомства. Однако необходимо отметить, что генеалогический анализ существенно осложняется при малодетности семей.
Родословные при аутосомно-доминантном наследовании.
Для аутосомного типа наследования в целом характерна равная вероятность встречаемости данного признака как у мужчин, так и у женщин. Это обусловлено одинаковой двойной дозой генов, расположенных в аутосомах у всех представителей вида и получаемых от обоих родителей, и зависимостью развивающегося признака от характера взаимодействия аллельных генов.
При доминировании признака в потомстве родительской пары, где хотя бы один родитель является его носителем, он проявляется с большей или меньшей вероятностью в зависимости от генетической конституции родителей (рис. 6.25).
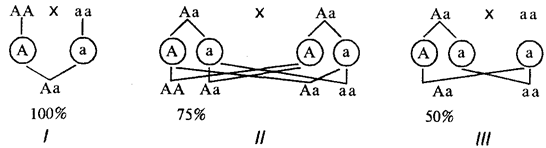
Рис. 6.25. Вероятность появления потомков с доминантным признаком от различных супружеских пар (/—III
)
Если анализируется признак, не влияющий на жизнеспособность организма, то носители доминантного признака могут быть как гомо-, так и гетерозиготами. В случае доминантного наследования какого-то патологического признака (заболевания) гомозиготы, как правило, нежизнеспособны, а носители этого признака — гетерозиготы.
Таким образом, при аутосомно-доминантном наследовании признак может встречаться в равной мере у мужчин и у женщин и прослеживается при достаточном по численности потомстве в каждом поколении по вертикали. Анализируя родословные, необходимо помнить о возможности неполного пенетрирования доминантного аллеля, обусловленной взаимодействием генов или факторами среды. Показатель пенетрантности может быть вычислен как отношение фактического числа носителей признака к числу ожидаемых носителей этого признака в данной семье. Необходимо также помнить, что некоторые заболевания проявляются не сразу с момента рождения ребенка. Многие болезни, наследуемые по доминантному типу, развиваются лишь в определенном возрасте. Так, хорея Гентингтона клинически проявляется к 35—40 годам, поздно проявляется и поликистоз почек. Поэтому при прогнозировании подобных заболеваний в расчет не принимаются братья и сестры, не достигшие критического возраста.
Первое описание родословной с аутосомно-доминантным типом наследования аномалии у человека было дано в 1905 г. В ней прослеживается передача в ряду поколений брахидактилии
(короткопалости). На рис. 6.26 приведена родословная с этой аномалией. На рис. 6.27 изображена родословная с ретинобластомой в случае неполной пенетрантности.
Родословные при аутосомно-рецессивном наследовании.
Рецессивные признаки проявляются фенотипически лишь у гомозигот по рецессивным аллелям. Эти признаки, как правило, обнаруживаются у потомков фенотипически нормальных родителей — носителей рецессивных аллелей. Вероятность появления рецессивного потомства в этом случае равна 25%. Если один из родителей имеет рецессивный признак, то вероятность проявления его в потомстве будет зависеть от генотипа другого родителя. У рецессивных родителей все потомство унаследует соответствующий рецессивный признак (рис. 6.28).

Рис. 6.26. Родословная (А
) при аутосомно-доминантном типе наследования (брахидактилия — Б
)
Для родословных при аутосомно-рецессивном типе наследования характерно, что признак проявляется далеко не в каждом поколении. Чаще всего рецессивное потомство появляется у родителей с доминантным признаком, причем вероятность появления такого потомства возрастает в близкородственных браках, где оба родителя могут являться носителями одного и того же рецессивного аллеля, полученного от общего предка. Примером аутосомно-рецессивного наследования является родословная семьи с псевдогипертрофической прогрессивной миопатией,
в которой часты близкородственные браки (рис. 6.29). Обращает внимание распространение заболевания в последнем поколении по горизонтали.
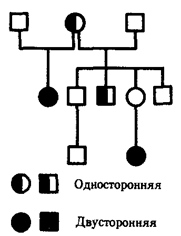
Рис. 6.27. Родословная с ретинобластомой в случае неполной пенетрантности
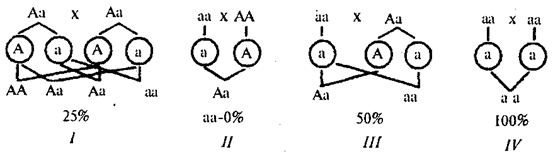
Рис. 6.28. Вероятность появления потомков с рецессивным признаком
от различных супружеских пар (I—IV
)
Родословные при доминантном Х-сцепленном наследовании признака.
Гены, расположенные в Х-хромосоме и не имеющие аллелей в Y-хромосоме, представлены в генотипах мужчин и женщин в разных дозах. Женщина получает две свои Х-хромосомы и соответствующие гены как от отца, так и от матери, а мужчина наследует свою единственную Х-хромосому только от матери. Развитие соответствующего признака у мужчин определяется единственным аллелем, присутствующим в его генотипе, а у женщин он является результатом взаимодействия двух аллельных генов. В связи с этим признаки, наследуемые по Х-сцепленному типу, встречаются в популяции с разной вероятностью у мужского и женского пола.
При доминантном Х-сцепленном наследовании признак чаще встречается у женщин в связи с большей возможностью получения ими соответствующего аллеля либо от отца, либо от матери. Мужчины могут наследовать этот признак только от матери. Женщины с доминантным признаком передают его в равной степени дочерям и сыновьям, а мужчины — только дочерям. Сыновья никогда не наследуют от отцов доминантного Х-сцепленного признака.
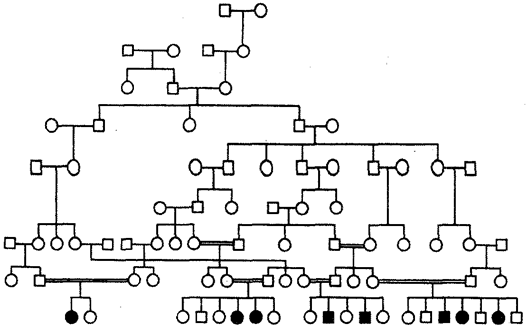
Рис. 6.29. Родословная при аутосомно-рецессивном типе наследования (псевдогипертрофическая прогрессирующая миопатия)
Примером такого типа наследования служит описанная в 1925 г. родословная с фолликулярным кератозом —
кожным заболеванием, сопровождающимся потерей ресниц, бровей, волос на голове (рис. 6.30). Характерным является более тяжелое течение заболевания у гемизиготных мужчин, чем у женщин, которые чаще всего являются гетерозиготами.
При некоторых заболеваниях наблюдается гибель мужчин-гемизигот на ранних стадиях онтогенеза. Тогда в родословных среди пораженных должны быть только женщины, в потомстве которых отношение пораженных дочерей, здоровых дочерей и здоровых сыновей равно 1:1:1. Мужские доминантные гемизиготы, не погибающие на очень ранних стадиях развития, обнаруживаются в самопроизвольных абортах или среди мертворожденных. Такими особенностями наследования у человека характеризуется пигментный дерматоз.
Родословные при рецессивном Х-сцепленном наследовании признаков.
Характерной особенностью родословных при данном типе наследования является преимущественное проявление признака у гемизиготных мужчин, которые наследуют его от матерей с доминантным фенотипом, являющихся носительницами рецессивного аллеля. Как правило, признак наследуется мужчинами через поколение от деда по материнской линии к внуку. У женщин он проявляется лишь в гомозиготном состоянии, вероятность чего возрастает при близкородственных браках.
Наиболее известным примером рецессивного Х-сцепленного наследования является гемофилия.
Наследование гемофилии типа А представлено в родословной потомков английской королевы Виктории (рис. 6.31).
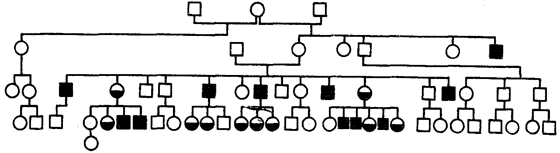
Рис. 6.30. Родословная при Х-сцепленном доминантном типе наследования (фолликулярный кератоз)
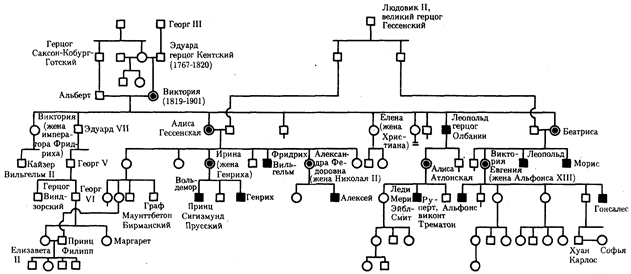
Рис. 6.31. Родословная при Х-сцепленном рецессивном типе наследования (гемофилия типа А)
Другим примером наследования по данному типу является дальтонизм —
определенная форма нарушения цветоощущения.
Родословные при Y-сцепленном наследовании.
Наличие Y-хромосомы только у представителей мужского пола объясняет особенности Y-сцепленного, или голандриче-ского, наследования признака, который обнаруживается лишь у мужчин и передается по мужской линии из поколения в поколение от отца к сыну.
Рис. 6.32. Родословная при Y-сцепленном (голандрическом) типе наследования
Одним из признаков, Y-сцепленное наследование которого у человека все еще обсуждается, является гипертрихоз ушной раковины,
или наличие волос на внешнем крае ушной раковины. Предполагают, что в коротком плече Y-хромосомы кроме этого гена находятся гены, определяющие мужской пол. В 1955 г. у мыши описан определяемый Y-хромосомой трансплантационный антиген, названный HY. Возможно, он является одним из факторов половой дифференцировки мужских гонад, клетки которых имеют рецепторы, связывающие этот антиген. Связанный с рецептором антиген активизирует развитие гонады по мужскому типу (см. разд. 3.6.5.2; 6.1.2). Этот антиген в процессе эволюции остался почти неизменным и встречается в организме многих видов животных, в том числе и человека. Таким образом, наследование способности к развитию гонад по мужскому типу определяется голандрическим геном, расположенным в Y-хромосоме (рис. 6.32).
Этот метод заключается в изучении закономерностей наследования признаков в парах одно- и двуяйцевых близнецов. Он предложен в 1875 г. Гальтоном первоначально для оценки роли наследственности и среды в развитии психических свойств человека. В настоящее время этот метод широко применяют в изучении наследственности и изменчивости у человека для определения соотносительной роли наследственности и среды в формировании различных признаков, как нормальных, так и патологических. Он позволяет выявить наследственный характер признака, определить пенетрантность аллеля, оценить эффективность действия на организм некоторых внешних факторов (лекарственных препаратов, обучения, воспитания).
Суть метода заключается в сравнении проявления признака в разных группах близнецов при учете сходства или различия их генотипов. Монозиготные близнецы,
развивающиеся из одной оплодотворенной яйцеклетки, генетически идентичны, так как имеют 100% общих генов. Поэтому среди монозиготных близнецов наблюдается высокий процент конкордантных пар,
в которых признак развивается у обоих близнецов. Сравнение монозиготных близнецов, воспитывающихся в разных условиях постэмбрионального периода, позволяет выявить признаки, в формировании которых существенная роль принадлежит факторам среды. По этим признакам между близнецами наблюдается дискордантность,
т.е. различия. Напротив, сохранение сходства между близнецами, несмотря на различия условий их существования, свидетельствует о наследственной обусловленности признака.
Сопоставление парной конкордантности по данному признаку у генетически идентичных монозиготных и дизиготных близнецов, которые имеют в среднем около 50% общих генов, дает возможность более объективно судить о роли генотипа в формировании признака. Высокая конкордантность в парах монозиготных близнецов и существенно более низкая конкордантность в парах дизиготных близнецов свидетельствуют о значении наследственных различий в этих парах для определения признака. Сходство показателя конкордантности у моно- и дизиготных близнецов свидетельствует о незначительной роли генетических различий и определяющей роли среды в формировании признака или развития заболевания. Достоверно различающиеся, но достаточно низкие показатели конкордантности в обеих группах близнецов дают возможность судить о наследственной предрасположенности к формированию признака, развивающегося под действием факторов среды.
Установление соотносительной роли наследственности и среды в развитии различных патологических состояний позволяет врачу правильно оценить ситуацию и проводить профилактические мероприятия при наследственной предрасположенности к заболеванию или осуществлять вспомогательную терапию при его наследственной обусловленности.
Трудности близнецового метода связаны, во-первых, с относительно низкой частотой рождения близнецов в популяции (1:86—1:88), что осложняет подбор достаточного количества пар с данным признаком; во-вторых, с идентификацией монозиготности близнецов, что имеет большое значение для получения достоверных выводов.
Для идентификации монозиготности близнецов применяют ряд методов. 1. Полисимптомный метод сравнения близнецов по многим морфологическим признакам (пигментации глаз, волос, кожи, форме волос и особенностям волосяного покрова на голове и теле, форме ушей, носа, губ, ногтей, тела, пальцевым узорам). 2. Методы, основанные на иммунологической идентичности близнецов по эритроцитарным антигенам (системы АВО, MN, резусу), по сывороточным белкам (γ-глобулину). 3. Наиболее достоверный критерий монозиготности предоставляет трансплантационный тест с применением перекрестной пересадки кожи близнецов.
Несмотря на трудоемкость близнецового метода и возможность ошибок при определении монозиготности близнецов, высокая объективность выводов делает его одним из широко применяемых методов генетических исследований у человека.
С помощью популяционно-статистического метода изучают наследственные признаки в больших группах населения, в одном или нескольких поколениях. Существенным моментом при использовании этого метода является статистическая обработка получаемых данных. Этим методом можно рассчитать частоту встречаемости в популяции различных аллелей гена и разных генотипов по этим аллелям, выяснить распространение в ней различных наследственных признаков, в том числе заболеваний. Он позволяет изучать мутационный процесс, роль наследственности и среды в формировании фенотипического полиморфизма человека по нормальным признакам, а также в возникновении болезней, особенно с наследственной предрасположенностью. Этот метод используют и для выяснения значения генетических факторов в антропогенезе, в частности в расообразовании.
При статистической обработке материала, получаемого при обследовании группы населения по интересующему исследователя признаку, основой для выяснения генетической структуры популяции является закон генетического равновесия Харди — Вайнберга.
Он отражает закономерность, в соответствии с которой при определенных условиях соотношение аллелей генов и генотипов в генофонде популяции сохраняется неизменным в ряду поколений этой популяции (см. разд. 10.2.3, т.2). На основании этого закона, имея данные о частоте встречаемости в популяции рецессивного фенотипа, обладающего гомозиготным генотипом (аа), можно рассчитать частоту встречаемости указанного аллеля (а) в генофонде данного поколения. Распространив эти сведения на ближайшие поколения, можно предсказать частоту появления в них людей с рецессивным признаком, а также гетерозиготных носителей рецессивного аллеля.
Математическим выражением закона Харди — Вайнберга служит формула (р
А. +
q
a)2
, где р
и q —
частоты встречаемости аллелей А и а соответствующего гена. Раскрытие этой формулы дает возможность рассчитать частоту встречаемости людей с разным генотипом и в первую очередь гетерозигот — носителей скрытого рецессивного аллеля: p
2
AA +
2pq
Aa +
q2
аа. Например, альбинизм обусловлен отсутствием фермента, участвующего в образовании пигмента меланина и является наследственным рецессивным признаком. Частота встречаемости в популяции альбиносов (аа) равна 1:20 000. Следовательно, q
2
= 1/20 000, тогда q
= 1/141, up
=
140/141. В соответствии с формулой закона Харди — Вайнберга частота встречаемости гетерозигот = 2pq
, т.е. соответствует 2 х (1/141) х (140/141) = 280/20000 = 1/70. Это означает, что в данной популяции гетерозиготные носители аллеля альбинизма встречаются с частотой один на 70 человек.
Анализ частот встречаемости разных признаков в популяции в случае их соответствия закону Харди — Вайнберга позволяет утверждать, что признаки обусловлены разными аллелями одного гена. Так, например, установлено, что в США 29,16% белого населения имеют группу крови М, 49,58%—группу MN, 21,26%—группу N. Эти частоты разных фенотипов соответствуют формуле p
2
М + 2pq
MN + q
2
N. Следовательно, эти три варианта признака обусловлены сочетанием двух аллелей одного гена, взаимодействующих по типу кодоминирования: группа М — Lm
Lm
, группа N — Ln
Ln
, группа MN—Lm
Ln
.
В том случае, если ген в генофонде популяции представлен несколькими аллелями, например ген группы крови системы АВО, соотношение различных генотипов выражается формулой (p
IA
+ q
IB
+ r
I0
) 2
.
В 1892 г. Ф. Гальтоном в качестве одного из методов исследования человека был предложен метод изучения кожных гребешковых узоров пальцев и ладоней, а также сгибательных ладонных борозд. Он установил, что указанные узоры являются индивидуальной характеристикой человека и не изменяются в течение его жизни. Ф. Гальтон уточнил и дополнил классификацию рельефа кожных узоров, основы которой были разработаны Я. Пуркинье еще в 1823 г. Позднее классификацию Гальтона усовершенствовали ряд ученых; она и сейчас широко используется в криминалистике и генетических исследованиях.
В настоящее время установлена наследственная обусловленность кожных узоров, хотя характер наследования окончательно не выяснен. Вероятно, этот признак наследуется по полигенному типу. На характер пальцевого и ладонного узоров организма большое влияние оказывает мать через механизм цитоплазматической наследственности.
Дерматоглифические исследования важны при идентификации зиготности близнецов. Считают, что если из 10 пар гомологичных пальцев не менее 7 имеют сходные узоры, это указывает на однояйцевость. Сходство узоров лишь 4—5 пальцев свидетельствует в пользу разнояйцевости близнецов.
Изучение людей с хромосомными болезнями выявило у них специфические изменения не только рисунков пальцев и ладоней, но и характера основных сгибательных борозд на коже ладоней. Характерные изменения этих показателей наблюдаются при болезни Дауна, при синдромах Клайнфельтера, Шерешевского — Тернера, что позволяет использовать методы дерматоглифики и пальмоскопии в диагностике этих заболеваний. Определяются специфические Дерматоглифические изменения и при некоторых хромосомных аберрациях, например при синдроме «кошачьего крика». Менее изучены Дерматоглифические изменения при генных болезнях. Однако описаны специфические отклонения этих показателей при шизофрении, миастении, лимфоид-ной лейкемии.
Применяют эти методы и с целью установления отцовства. Подробнее они описаны в специальной литературе.
С помощью этих методов изучают наследственность и изменчивость соматических клеток, что в значительной мере компенсирует невозможность применения к человеку метода гибридологического анализа.
Методы генетики соматических клеток, основанные на размножении этих клеток в искусственных условиях, позволяют не только анализировать генетические процессы в отдельных клетках организма, но благодаря полноценности наследственного материала, заключенного в них, использовать их для изучения генетических закономерностей целостного организма.
В связи с разработкой в 60-х гг. XX в. методов генетики соматических клеток человек оказался включенным в группу объектов экспериментальной генетики. Благодаря быстрому размножению на питательных средах соматические клетки могут быть получены в количествах, необходимых для анализа. Они успешно клонируются, давая генетически идентичное потомство. Разные клетки могут, сливаясь, образовывать гибридные клоны. Они легко подвергаются селекции на специальных питательных средах и долго сохраняются при глубоком замораживании. Все это позволяет использовать культуры соматических клеток, полученные из материала биопсий (периферическая кровь, кожа, опухолевая ткань, ткань эмбрионов, клетки из околоплодной жидкости), для генетических исследований человека, в которых используют следующие приемы: 1) простое культивирование, 2) клонирование, 3) селекцию, 4) гибридизацию.
Культивирование
позволяет получить достаточное количество клеточного материала для цитогенетических, биохимических, иммунологических и других исследований.
Планирование—
получение потомков одной клетки; дает возможность проводить в генетически идентичных клетках биохимический анализ наследственно обусловленных процессов.
Селекция
соматических клеток с помощью искусственных сред используется для отбора мутантных клеток с определенными свойствами и других клеток с интересующими исследователя характеристиками.
Гибридизация
соматических клеток основана на слиянии совместно культивируемых клеток разных типов, образующих гибридные клетки со свойствами обоих родительских видов. Для гибридизации могут использоваться клетки от разных людей, а также от человека и других животных (мыши, крысы, морской свинки, обезьяны, джунгарского хомячка, курицы).
Гибридные клетки, содержащие два полных генома, при делении обычно «теряют» хромосомы предпочтительно одного из видов. Например, в гибридных клетках «человек — мышь» постепенно утрачиваются все хромосомы человека, а в клетках «человек — крыса» — все, кроме одной, хромосомы крысы, с сохранением всех хромосом человека. Таким образом можно получать клетки с желаемым набором хромосом, что дает возможность изучать сцепление генов и их локализацию в определенных хромосомах.
Постепенная потеря хромосом человека из гибридных клеток параллельно с изучением ферментов дает возможность судить о локализации гена, контролирующего синтез данного фермента, в определенной хромосоме.
Благодаря методам генетики соматических клеток можно изучать механизмы первичного действия и взаимодействия генов, регуляцию генной активности. Они позволяют судить о генетической гетерогенности наследственных болезней, изучать их патогенез на биохимическом и клеточном уровнях. Развитие этих методов определило возможность точной диагностики наследственных болезней в пренатальном периоде.
Цитогенетический метод основан на микроскопическом изучении хромосом в клетках человека. Его стали широко применять в исследованиях генетики человека с 1956 г., когда шведские ученые Дж. Тийо и А. Леван, предложив новую методику изучения хромосом, установили, что в кариотипе человека 46, а не 48 хромосом, как считали ранее.
Современный этап в применении цитогенетического метода связан с разработанным в 1969 г. Т. Касперсоном методом дифференциального окрашивания хромосом,
который расширил -возможности цитогенетического анализа, позволив точно идентифицировать хромосомы по характеру распределения в них окрашиваемых сегментов (см. разд. 3.5.2.3).
Применение цитогенетического метода позволяет не только изучать нормальную морфологию хромосом и кариотипа в целом, определять генетический пол организма, но, главное, диагностировать различные хромосомные болезни, связанные с изменением числа хромосом или с нарушением их структуры. Кроме того, этот метод позволяет изучать процессы мутагенеза на уровне хромосом и кариотипа. Применение его в медико-генетическом консультировании для целей пренатальной диагностики хромосомных болезней дает возможность путем своевременного прерывания беременности предупредить появление потомства с грубыми нарушениями развития.
Материалом для цитогенетических исследований служат клетки человека, получаемые из разных тканей,—лимфоциты периферической крови, клетки костного мозга, фибробласты, клетки опухолей и эмбриональных тканей и др. Непременным требованием для изучения хромосом является наличие делящихся клеток. Непосредственное получение таких клеток из организма затруднено, поэтому чаще используют легкодоступный материал, каковым являются лимфоциты периферической крови.
В норме эти клетки не делятся, однако специальная обработка их культуры фитогемагглютинином возвращает их в митотический цикл. Накопление делящихся клеток в стадии метафазы, когда хромосомы максимально спирализованы и хорошо видны в микроскоп, достигается обработкой культуры колхицином или колцемидом, разрушающим веретено деления и препятствующим расхождению хроматид.
Микроскопирование мазков, приготовленных из культуры таких клеток, позволяет визуально наблюдать хромосомы. Фотографирование метафазных пластинок и последующая обработка фотографий с составлением кариограмм, в которых хромосомы выстроены парами и распределены по группам, позволяют установить общее число хромосом и обнаружить изменения их количества и структуры в отдельных парах (рис. 6.33). Кариотипы человека при некоторых хромосомных болезнях представлены на рис. 4.3—4.12.

Рис. 6.33. Нормальные кариотипы человка. А —
женщины; Б —
мужчины Вверху представлены хромосомные комплексы, внизу — кариограммы
В качестве экспресс-метода, выявляющего изменение числа половых хромосом, используют метод определения полового хроматина
в неделящихся клетках слизистой оболочки щеки. Половой хроматин, или тельце Барра, образуется в клетках женского организма одной из двух Х-хромосом. Оно выглядит как интенсивно окрашенная глыбка, расположенная у ядерной оболочки (см. рис. 3.77). При увеличении количества Х-хромосом в кариотипе организма в его клетках образуются тельца Барра в количестве на единицу меньше числа Х-хромосом. При уменьшении числа Х-хромосом (моносомия X) тельце Барра отсутствует.
В мужском кариотипе Y-хромосома может быть обнаружена по более интенсивной по сравнению с другими хромосомами люминесценции при обработке их акрихинипритом и изучении в ультрафиолетовом свете.
В отличие от цитогенетического метода, который позволяет изучать структуру хромосом и кариотипа в норме и диагностировать наследственные болезни, связанные с изменением их числа и нарушением организации, наследственные заболевания, обусловленные генными мутациями, а также полиморфизм по нормальным первичным продуктам генов изучают с помощью биохимических методов.
Впервые эти методы стали применять для диагностики генных болезней еще в начале XX в. В последние 30 лет их широко используют в поиске новых форм мутантных аллелей. С их помощью описано более 1000 врожденных болезней обмена веществ. Для многих из них выявлен дефект первичного генного продукта. Наиболее распространенными среди таких заболеваний являются болезни, связанные с дефектностью ферментов, структурных, транспортных или иных белков.
Дефекты структурных и циркулирующих белков выявляются при изучении их строения. Так, в 60-х гг. XX в. был завершен анализ (3-глобино-вой цепи гемоглобина, состоящей из 146 аминокислотных остатков. Установлено большое разнообразие гемоглобинов у человека, связанное с изменением структуры его пептидных цепей, что нередко является причиной развития заболеваний (см. § 4.1).
Дефекты ферментов устанавливают путем определения содержания в крови и моче продуктов метаболизма, являющихся результатом функционирования данного белка. Дефицит конечного продукта, сопровождающийся накоплением промежуточных и побочных продуктов нарушенного метаболизма, свидетельствует о дефекте фермента или его дефиците в организме (см. § 4.1).
Биохимическую диагностику наследственных нарушений обмена проводят в два этапа. На первом этапе отбирают предположительные случаи заболеваний, на втором —более точными и сложными методами уточняют диагноз заболевания. Применение биохимических исследований для диагностики заболеваний в пренатальном периоде или непосредственно после рождения позволяет своевременно выявить патологию и начать специфические медицинские мероприятия, как, например, в случае фенилкетонурии.
Для определения содержания в крови, моче или амниотической жидкости промежуточных, побочных и конечных продуктов обмена кроме качественных реакций со специфическими реактивами на определенные вещества используют хроматографические методы исследования аминокислот и других соединений.
Как было показано выше, нарушения первичных продуктов генов выявляются с помощью биохимических методов. Локализация соответствующих повреждений в самом наследственном материале может быть выявлена методами молекулярной генетики.
Разработка метода обратной транскрипции
ДНК на молекулах мРНК определенных белков с последующим размножением этих ДНК привела к появлению ДНК-зондов
для различных мутаций нуклеотидных последовательностей человека. Использование таких ДНК-зондов для гибридизации с ДНК клеток пациента дает возможность выявлять у него соответствующие изменения в наследственном материале, т.е. диагностировать определенные виды генных мутаций (генодиагностика).
Важными достижениями молекулярной генетики последних десятилетий явились работы по секвенированию —
определению нуклеотидной последовательности ДНК.
Это стало возможным благодаря открытию в 60-х гг. XX в. ферментов — рестриктаз,
выделенных из бактериальных клеток, которые разрезают молекулу ДНК на фрагменты в строго определенных местах. В естественных условиях рестрикгазы защищают клетку от проникновения в ее генетический аппарат и размножения в нем чужеродной ДНК. Применение этих ферментов в эксперименте дает возможность получать короткие фрагменты ДНК, в которых относительно легко можно определить последовательность нуклеотидов.
В настоящее время полностью установлена последовательность нуклеотидов многих генов человеческого генома, в том числе генов α- и (β-глобиновых цепей гемоглобина, некоторых полипептидных гормонов (инсулина, гормона роста, хорионического соматотропина, пролактина). Интенсивно изучаются нуклеотидные последовательности генов актинов, тубулинов, интерферонов. Этими исследованиями выявлена высокая степень генетического полиморфизма у человека, который часто не проявляется фенотипически.
Методы молекулярной генетики и генной инженерии позволяют не только диагностировать целый ряд генных мутаций и устанавливать нуклеотидную последовательность отдельных генов человека, но и размножать (клонировать) их и получать в большом количестве белки — продукты соответствующих генов.
Клонирование отдельных фрагментов ДНК осуществляется путем включения их в бактериальные плазмиды, которые, автономно размножаясь в клетке, обеспечивают получение в большом количестве копий соответствующих фрагментов ДНК человека. Последующая экспрессия рекомбинантных ДНК в бактериях позволяет получить белковый продукт соответствующего клонированного человеческого гена.
Таким образом, с помощью методов генной инженерии стало возможно получать на основе человеческих генов некоторые первичные генные продукты (инсулин). Это определяет перспективы терапии наследственных болезней, обусловленных связанным с генными мутациями дефицитом нормальных продуктов генов.
Дальнейшее совершенствование методов молекулярной генетики обеспечит возможность полного определения нуклеотидных последовательностей не только структурных, но и регуляторных локусов генома человека, а разработка методов включения в человеческий геном нормальных нуклеотидных последовательностей в перспективе может стать основой генотерапии.
Разработка методов генетики соматических клеток, молекулярной биологии, цитогенетических и биохимических методов сделала возможным получение, размножение и всестороннее изучение клеточного материала развивающегося плода с целью более ранней диагностики наследственной патологии у человека. В связи с отсутствием в настоящее время действенных методов лечения, тяжелым поражением здоровья при многих наследственных заболеваниях их ранняя диагностика дает возможность предупредить появление потомства с наследственным нарушением путем прерывания беременности, а иногда начать лечение сразу после рождения или даже в пренатальном периоде.
Получение материала развивающегося внутриутробно организма осуществляют разными способами. Одним из них является амниоцентез,
с помощью которого на 15—16-й неделе беременности получают амниотическую жидкость, содержащую продукты жизнедеятельности плода и клетки его кожи и слизистых (рис. 6.34, А
).
Забираемый при амниоцентезе материал используют для биохимических, цитогенетических и молекулярно-биологических исследований. Цитогенетическими методами определяют пол плода и выявляют хромосомные и геномные мутации. Изучение амниотической жидкости и клеток плода с помощью биохимических методов позволяет обнаружить дефект белковых продуктов генов, однако не дает возможности определять локализацию мутаций в структурной или регуляторной части генома. Важную роль в выявлении наследственных заболеваний и точной локализации повреждения наследственного материала плода играет использование ДНК-зондов.
Рис. 6.34. Методы получения материала для пренатальной диагностики. А —
амниоцентез (пункция околоплодного пузыря через брюшную стенку); Б—
биопсия ворсин хориона (проникновение в матку через влагалище и шейку матки):
1
—амниотическая жидкость, 2—плацента, 3—
матка, 4—
лобковое сращение, 5—
влагалище, б—шейка, 7—крестец, 8—
зеркало, 9—канюля, 10
—хорион
В настоящее время с помощью амниоцентеза диагностируются все хромосомные аномалии, свыше 60 наследственных болезней обмена веществ, несовместимость матери и плода по эритроцитарным антигенам.
С начала 80-х гг. XX в. стало возможным использование для целей медикогенетического диагностирования материала биопсии ворсин хориона.
В отличие от амниоцентеза это исследование проводят в первой трети беременности, что позволяет при наличии показаний прерывать ее в более ранние сроки (рис. 6.34, Б
).
Кроме амниоцентеза и исследования клеток ворсин хориона применяют и другие способы пренатальной диагностики. Для диагностики таких заболеваний, какгемоглобинопатия, используют пункцию сосудов плода с
получением клеток его крови.
Методы фетоскопии
и ультразвуковых исследований
позволяют определять пол плода и некоторые пороки его развития путем непосредственного наблюдения.
Пренатальная диагностика должна проводиться до 20—22-й недели беременности, когда плод еще нежизнеспособен после ее прерывания. Прерывание беременности в более поздние сроки может привести к рождению живого ребенка и быть опасным для организма матери. Прерывание беременности всегда проводится только с согласия родителей.
Так как многие методы пренатального обследования плода не являются абсолютно безвредными, а кроме того, они трудоемки и дорогостоящи, показания к такому обследованию должны быть обоснованы.
Пренатальное обследование плода проводят в случаях: 1) обнаружения структурных перестроек хромосом (транслокаций) у одного из родителей; 2) при наличии у родителей доминантного наследственного заболевания; 3) при наличии в семье детей с рецессивным наследственным заболеванием, что свидетельствует о гетерозиготности родителей; 4) при возрасте матери старше 35 лет, что прогрессивно повышает вероятность рождения у нее потомства с наследственной патологией; 5) при привычных выкидышах, вызывающих подозрение на несовместимость матери и плода по эритроцитарным антигенам; 6) при наличии в семье детей с врожденными пороками развития.
Благодаря разработке способов пренатальной диагностики удается сократить число рождающихся с наследственными заболеваниями.
Для подавляющего большинства наследственных болезней эффективных способов лечения не существует. Из этого следует, что в борьбе с наследственной патологией основная роль отводится профилактике рождения аномального потомства. Общий профилактический характер носят мероприятия, направленные на оздоровление окружающей среды, способствующие снижению ее мутагенного воздействия на наследственный материал человеческого организма. В последние десятилетия распространенным и эффективным способом профилактики наследственных болезней является медико-генетическое консультирование.
Медико-генетическое консультирование — это один из видов специализированной помощи населению, направленной в первую очередь на предупреждение появления в семье детей с наследственной патологией. С этой целью составляют прогноз рождения в данной семье ребенка с наследственной болезнью, родителям объясняют вероятность этого события и оказывают помощь в принятии решения. В случае большой вероятности рождения больного ребенка родителям рекомендуют либо воздержаться от деторождения, либо провести пренатальную диагностику, если она возможна при данном виде патологии.
Консультирование семей, обращающихся к врачу-генетику, включает три основных этапа. Как правило, за консультацией обращаются семьи, где уже имеется ребенок с наследственной патологией, или семьи, в которых имеются больные родственники. На первом этапе консультирования производится уточнение диагноза, что является необходимой предпосылкой любого консультирования. Уточнение диагноза
в медико-генетической консультации проводят с помощью генетического анализа. Для этой цели используют генеалогический, цитогенетический, биохимический и другие требуемые методы исследований, которым подвергаются пробанд и его родственники. Точный клинический и генетический диагноз заболевания позволяет установить степень генетического риска и выбор эффективных методов пренатальной диагностики и профилактического лечения.
На втором этапе консультирования делают прогноз потомства. Генетический риск
может быть определен либо путем теоретических расчетов, основанных на генетических закономерностях, либо с помощью эмпирических данных. Сущность генетического прогноза заключается в определении вероятности появления наследственной патологии в семье. Наиболее эффективным является проспективное консультирование,
когда риск рождения больного ребенка определяют до наступления беременности или в ранние ее сроки. Такие консультации чаще проводят в случае кровного родства супругов, при отягощенной наследственности по линии мужа или жены, при воздействии вредных средовых факторов на супругов незадолго до наступления беременности. Ретроспективное консультирование
проводят после рождения больного ребенка относительно здоровья будущих детей.
Определение прогноза потомства при разных формах наследственной патологии различно. При моногенных, менделирующих болезнях прогноз основывается на расчете вероятности появления потомства в соответствии с генетическими закономерностями. При этом, если известен тип наследования данного заболевания и по родословной удается установить генотип родителей, оценка риска сводится к анализу мевделевского расщепления. Если у пробанда установлена вновь возникшая мутация, то повторный риск рождения ребенка с такой же патологией незначителен.
Расчет риска при моногенном заболевании может осложниться при пониженной экспрессивности или неполной пенетрантности гена, позднем проявлении генетической аномалии, генетической гетерогенности заболевания и вообще в случае неточного диагноза.
При хромосомных болезнях определение риска повторного рождения потомства с хромосомными аномалиями зависит от того, нормальны ли кариотипы родителей, не обнаружено ли у них мозаицизма, не наблюдается ли семейной формы структурных аномалий хромосом. В случае отсутствия нарушений в кариотипе родителей вероятность повторного рождения второго ребенка с хромосомной аномалией оценивается по эмпирическим данным для каждого вида аномалии с учетом возраста родителей.
При мультифакториальных заболеваниях, т.е. заболеваниях с наследственным предрасположением, основой оценки риска являются эмпирические данные о популяционной и семейной частоте каждого из них.
Специфический генетический риск до 5% принято считать низким, до 10% —повышенным в легкой степени, до 20% —средним, выше 20% — высоким. Генетический риск средней степени расценивают как противопоказание к зачатию или показание к прерыванию уже имеющейся беременности. Возможность проведения пренатальной диагностики является определяющей для принятия положительного решения в отношении завершения беременности.
На третьем этапе консультирования врач-генетик в доступной форме объясняет семье степень генетического риска рождения наследственно аномального потомства, сущность пренатальной диагностики и помогает принять правильное решение в отношении деторождения.
Однако окончательное решение этого вопроса остается за родителями.
Широкое использование медико-генетического консультирования, разработка способов пренатальной диагностики наследственных заболеваний позволяют существенно уменьшить вероятность появления потомства с наследственной патологией в отдельных семьях.
Индивидуальное развитие представляет собой целостный непрерывный процесс, в котором отдельные события увязаны между собой в пространстве и времени. Существует несколько схем периодизации онтогенеза, каждая из которых является наиболее подходящей для решения конкретных научных или практических задач.
С общебиологической
точки зрения, важнейшим событием онтогенеза является возможность осуществления полового размножения. Если соотнести различные временные отрезки онтогенеза со способностью особи осуществлять функцию размножения, то его можно разделить на три периода: дорепродуктивный, репродуктивный
и пострепродуктивный.
В дорепродуктивном
периоде особь не способна к размножению. Основное содержание его заключается в развитии зрелого в половом отношении фенотипа. В этом периоде происходят наиболее выраженные структурные и функциональные преобразования, реализуется основная часть наследственной информации, организм обладает высокой чувствительностью ко всевозможным воздействиям.
В репродуктивном
периоде особь осуществляет функцию полового размножения, отличается наиболее стабильным функционированием органов и систем, а также относительной устойчивостью к воздействиям.
Пострепродуктивный
период связан со старением организма и характеризуется ослаблением или полным прекращением участия в размножении. Снижаются приспособительные возможности и устойчивость к разнообразным воздействиям. Применительно к онтогенезу человека названные периоды дополнительно характеризуются специфическими социальными моментами (образование, трудоспособность, творчество). Для каждого из указанных периодов характерны свои особенности заболеваемости.
Дорепродуктивный период подразделяют еще на четыре периода: эмбриональный, личиночный, метаморфоз
и ювенильный.
Эмбриональный,
или зародышевый, период онтогенеза начинается с момента оплодотворения и продолжается до выхода зародыша из яйцевых оболочек. Эмбриональный период отличается выраженностью процессов преобразования зиготы в организм, способный к более или менее самостоятельному существованию. У большинства позвоночных он включает стадии (фазы) дробления, гаструляции,
а также гисто-
и органогенеза.
Продолжительность его бывает различна. У плацентарных млекопитающих он особенно укорочен. Единственная яйцевая оболочка растворяется перед имплантацией бластоцисты в слизистую матки. Зародыш к этому моменту успевает пройти только стадии зиготы и дробления. Все дальнейшие процессы протекают под защитой и при участии материнского организма. Эволюционное значение этих особенностей будет рассмотрено ниже.
Дроблению предшествуют процессы гаметогенеза и оплодотворения, которые не являются непосредственно индивидуальным развитием и могут даже не привести к нему, но которые во многом определяют дальнейшее развитие зародыша в том случае, если зачатие состоится. Эти процессы называют прогенезом,
предшествующим собственно онтогенезу. Цитологически процессы гаметогенеза и оплодотворения представляют собой промежуточное звено, связывающее онтогенезы родителей с онтогенезом их потомства.
Личиночный
период в типичном варианте наблюдается в развитии тех позвоночных, зародыши которых выходят из яйцевых оболочек и начинают вести самостоятельный образ жизни, не достигнув дефинитивных (зрелых) черт организации. Так, он встречается у некоторых представителей низших позвоночных — миног, большинства костистых рыб и земноводных. Наиболее характерными чертами личинки являются эмбриональный характер ее организации, наличие временных (провизорных) органов, раннее начало функционирования ряда органов, дающее возможность самостоятельного существования. Благодаря активному питанию личинка получает возможность завершить развитие, а благодаря активному перемещению имеет возможность выбирать условия среды, оптимальные для развития, и выйти, таким образом, из конкуренции со своими же взрослыми сородичами. Продолжительность личиночного периода в сравнении с эмбриональным у всех позвоночных существенно больше.
Метаморфоз
состоит в превращении личинки в ювенильную форму. В процессе метаморфоза происходят такие важные морфогенетические преобразования, как частичное разрушение, перестройка и новообразование органов. Степень преобразований тем больше, чем больше различия между средой обитания личинки и взрослого организма, что хорошо иллюстрирует пример развития бесхвостных амфибий.
Ювенильный
период начинается с момента завершения метаморфоза и заканчивается половым созреванием и началом размножения. Особенности ювенильного периода проявляются в своеобразии питания молодого организма, его поведения и степени зависимости от родителей. С морфологической точки зрения для этого периода характерны интенсивный рост, установление окончательных пропорций между различными частями тела, завершение развития скелета, кожных покровов, смена зубов, завершение развития половых желез и гормональных регуляций. Продолжительность ювенильного периода у позвоночных варьирует от минимальной, равной 13—18 сут у полевок, до максимальной, равной 18—20 годам у белуги, крокодила, альбатроса, слона. У многих представителей позвоночных, особенно у человека, достижение половой зрелости и начало размножения могут быть разделены значительным промежутком времени.
Одним из подходов является эколого-эмбриологический,
в связи с которым онтогенез делят на этапы, протекающие до рождения, во время и после рождения особи. Само рождение, т.е. выход развивающейся особи из оболочек яйца или из организма матери, у разных видов происходит на разных стадиях зрелости. В то же время у всех видов до рождения организм находится под защитой яйцевых оболочек или материнского организма и не способен питаться и осуществлять другие важные функции самостоятельно. Защищенность ранних, морфофункционально незрелых стадий, обеспечивает выживаемость вида. После рождения особь устанавливает связи с новой средой, начинает самостоятельно питаться, передвигаться и осуществлять все другие функции.
Более подробное изложение периодизации онтогенеза человека, имеющее практическое значение в акушерской и педиатрической практике, см. в разд. 7.6.1 и табл. 7.2.
Диапауза. В эмбриональном периоде ряда позвоночных существует диапауза, т.е. остановка развития на более или менее продолжительный период. Она имеет приспособительное значение. Так, у сумчатых и грызунов развитие эмбрионов останавливается в случае совпадения по времени развития нового потомства со вскармливанием самкой предыдущего помета. Это лактационная пауза,
продолжающаяся обычно несколько суток. В других отрядах млекопитающих наблюдаются длительные, до 7 мес. обязательные диапаузы. К примеру, у соболя оплодотворение происходит в июле. Оплодотворенное яйцо дробится, процесс развития доходит до стадии бластоцисты и тормозится. Имплантация и дальнейшее развитие начинаются только в марте. Описанная диапауза возникла в эволюции названного вида животных путем отбора на рождение потомства в сезон, наиболее благоприятный для вскармливания.
Деэмбрионизация.
Под этим термином понимают сильное укорочение собственно эмбрионального периода, протекающего под оболочками яйца. Деэмбрионизация, наблюдающаяся у плацентарных млекопитающих, сочетается с резким уменьшением желтка в их яйцеклетках и установлением связи с материнским организмом через плаценту.
Эмбрионизация.
Процесс эмбрионизации заключается в удлинении времени защищенности зародыша от внешней среды благодаря зародышевым оболочкам и материнскому организму. Зародыш в это время проходит периоды, соответствующие собственно эмбриональному и личиночному. Развивающийся организм защищен до момента формирования ювенильной стадии. После рождения не происходит существенной перестройки организма и развитие идет прямое, т.е. без метаморфоза.
Эмбрионизация развития особенно проявилась в процессе эволюции наземных позвоночных. Уже у многих земноводных, например у рогатой лягушки Соломоновых островов, все развитие происходит под яйцевыми оболочками, из которых вылупляется уже претерпевшее метаморфоз животное. Полная Эмбрионизация имеет место у пресмыкающихся и птиц в связи с переходом их к наземному существованию. Особое изменение эмбрионального и личиночного периодов произошло у плацентарных млекопитающих. Наряду с деэмбрионизацией, о чем говорилось выше, у них произошла максимальная Эмбрионизация, но не под оболочками яйца, а внутриутробно. Период свободного личиночного развития полностью исчез.
Проходящие под яйцевыми оболочками или внутриутробно предплодный
и плодный
периоды развития вместе равнозначны личиночному периоду. Они следуют непосредственно за эмбриональным периодом, включают средние и более поздние фазы морфогенеза, характеризуются наличием провизорных органов, переходом к активному питанию, началом функционирования органов чувств (слуха, вкуса и др.).
К провизорным органам у млекопитающих относят зародышевые оболочки, некоторые отделы кровеносной системы, временные структуры кожного покрова. У яйцекладущих и сумчатых млекопитающих зародыш на предплодных этапах уже переходит к питанию молоком матери, а у птиц и плацентарных млекопитающих — заглатывает амниотическую жидкость. Начало функционирования органа слуха описано у зародышей страуса эму, которые энергично реагируют на крик взрослых птиц уже на последней четверти инкубационного периода.
Период метаморфоза у наземных позвоночных соответственно упрощается, так как плод в значительной степени похож на взрослую особь. Однако отбрасывание зародышевых оболочек, открытие эмбриональных заращений, изменения в органах дыхания, кровообращения и в коже в момент родов и в первую неделю после родов представляют собой перестройки, соответствующие метаморфозу.
Неотения.
Это выпадение ювенильного и взрослого периодов развития. В эволюции многих групп позвоночных наблюдается тенденция к более раннему достижению половой зрелости. Наиболее ярко эта тенденция выражена у хвостатых земноводных. Так, в семействе Ambistomatidae личинки (аксолотли) приобрели возможность размножаться до наступления периода метаморфоза и превращения во взрослую стадию, однако способности превращаться во взрослую стадию они полностью не потеряли.
Известны популяции таких животных, в которых сосуществуют неотенические и взрослые формы. Это частичная неотения.
При полной неотении
ювенильный и взрослый периоды выпадают полностью и о его существовании у предков судят только по близкородственным видам. Некоторые ученые полагают, что на основе преобразования личиночных стадий мог возникнуть ряд крупных таксонов. Считают, что неотения могла явиться основным направлением эволюции бескилевых бегающих птиц и человека.
Происхождение яйцеклеток.
Яйца хордовых состоят из яйцевой клетки, называемой иногда также яйцом, и яйцевых оболочек. Лицевые клетки
образуются в женской половой железе —яичнике. Они проходят долгий путь развития, который начинается в эмбриональном и продолжается в репродуктивном периоде онтогенеза особей женского пола.
Первичные половые клетки
возникают на ранних этапах эмбриогенеза из энтодермальных клеток вегетативного полюса, как, например, у бесхвостых амфибий, или из энтодермальных клеток желточного мешка, как у всех амниот —пресмыкающихся, птиц и млекопитающих. Первичные половые клетки очень рано отличимы от других клеток по крупным размерам и прозрачной цитоплазме. Половые железы в этот момент только начинают формироваться.
Несколькими экспериментальными методами было показано, что первичные половые клетки мигрируют из места возникновения в развивающиеся гонады и заселяют их. У млекопитающих они перемешаются по дорсальной брыжейке (рис. 7.1), будучи способньми в этот период к амебоидному движению. У птиц миграция происходит пассивно по кровяному руслу. Не исключено действие химических аттрактантов, стимулирующих миграцию первичных половых клеток к гонадам. Существует мнение, что первичные половые клетки, оказавшись в каких-либо других участках зародыша, гибнут, но иногда могут перерождаться в опухоли.
Попав в гонады, первичные половые клетки начинают пролиферировать.
Они делятся митозом и называются овогониями.
У большинства низших позвоночных овогонии сохраняют способность к делению на протяжении всего репродуктивного периода, так как, например, рыбы за один нерест выделяют тысячи яиц, земноводные — сотни. У высших позвоночных количество яиц, которые вызревают одномоментно, редко достигает 15, обычно их бывает меньше, иногда одно, чем можно объяснить и особенности овогенеза.
Рис. 7.1. Возникновение первичных половых клеток (I
) у зародыша человека
на стадии 16 сомитов
У человеческих эмбрионов женского пола овогонии размножаются наиболее интенсивно между 2-м и 5-м месяцами внутриутробного периода развития, когда их число достигает примерно 7 млн. К 7-му месяцу многие овогонии погибают, а сохранившиеся входят в профазу первого деления мейоза. Для части яйцеклеток мейоз завершается в момент наступления полового созревания, а для части — непосредственно перед менопаузой.
Специфика и значение химического состава цитоплазмы яйцеклетки.
Зрелая яйцеклетка, как правило, бывает крупнее овогонии и тем более крупнее любых других соматических клеток. В ходе овогенеза в цитоплазме яйцеклетки резервируется большое количество веществ, необходимых для ее созревания и обеспечения раннего эмбриогенеза. Функциональная роль запасенных веществ различна.
Во-первых,
это компоненты, необходимые для процессов репликации, транскрипции и трансляции, такие, как соответствующие ферменты, рибосомы, мРНК, тРНК и их предшественники.
Во-вторых,
это набор специфических регуляторных веществ, которые обеспечивают координированное функционирование всех запасенных компонентов. Некоторые из них, будучи в овоците уже к моменту оплодотворения, начинают действовать только в фазе гаструляции. К названным веществам относятся фактор дезинтеграции ядерной оболочки (с разрушения ядерной оболочки начинается прометафаза 1-го мейотического деления); фактор, вызывающий конденсацию хромосом; фактор, преобразующий ядро сперматозоида в пронуклеус и активирующий в нем синтез ДНК перед дроблением; фактор, ответственный за цитотомию во время дробления; фактор, ответственный за блок мейоза на стадии метафазы II (у многих позвоночных снятие этого блока происходит только в результате оплодотворения).
В-третьих,
это желток, в состав которого входят белки, фосфолипиды, нейтральные жиры, минеральные соли. Желток представляет собой запас питательных веществ и энергетических ресурсов, необходимых для обеспечения эмбрионального периода. Многие вещества, вырабатываемые печенью, попадают в овогонии в период их роста через фолликулярные клетки яичника. Это требует от самки больших энергетических затрат.
Благодаря описанным особенностям химического состава цитоплазмы яйцеклетки зародыш на протяжении периода дробления в ряде случаев не использует для развития генетическую информацию ядер зиготы и бластомеров. Специфический химический состав и закономерное распределение веществ в цитоплазме яйцеклетки имеют большое значение для начальных фаз эмбриогенеза. Запасенные питательные и энергетические вещества обеспечивают эмбриональное развитие без дополнительного поступления их извне.
Размер яиц и
его роль в эволюции. Типы яйцеклеток.
В процессе развития выявляется закономерность, заключающаяся в том, что чем длиннее эмбриональный период, тем больше желтка должно быть накоплено в яйцеклетке. Продолжительность эмбрионального периода зависит от стадии, на которой зародыш переходит к самостоятельному существованию во внешней среде. Если постэмбриональное развитие идет прямым путем, т.е. без личинки и метаморфоза, то желтка в яйцеклетке должно быть больше. По количеству желтка яйцеклетки хордовых делят на алецитальные, олиго-, мезо-
и полилецитальные,
т.е. с ничтожно малым, малым, средним и большим количеством желтка (от греч. лецитос —
желток).
У ланцетника,
представителя низших хордовых, яйцеклетка олиголецитальная.
У большинства позвоночных в яйцеклетках содержится значительное количество желтка. Среди низших позвоночных (Anamnia) наиболее крупные яйца у миксин (кл. Круглоротые), у акул и химер (кл. Хрящевые рыбы) и у безногих амфибий. У осетровых рыб, а также остальных амфибий
яйцеклетки мезолецитальные,
т.е. имеют среднее количество желтка. У высших позвоночных (Amniota), таких, как пресмыкающиеся, птицы и яйцекладущие млекопитающие,— полилецитальные,
т.е. в яйцеклетке очень много желтка. Эмбриональное развитие у них протекает особенно долго.
Эта закономерность нарушена у сумчатых и плацентарных
млекопитающих, которые имеют олиго-
и алецитальные
яйцеклетки соответственно. У сумчатых эмбрион выходит из яйцевых оболочек и матки при незавершенном органогенезе, переносится в сумку, где и продолжает развитие. У плацентарных и человека зародыш выходит из яйцевых оболочек еще раньше, в стадии бластоцисты, но затем переходит к внутриутробному существованию, где и завершает все основные периоды развития, подготавливающие его к появлению на свет. Уменьшение
количества желтка в яйцеклетках млекопитающих можно назвать вторичным,
поскольку их предки, освоившие наземную среду, имели, как и все амниоты, полилецитальные яйца.
Полярность яйцеклеток.
При малом количестве желтка в яйцеклетке он обычно распределен в цитоплазме равномерно и ядро располагается примерно в центре. Такие яйцеклетки называют изолецитальными
(от греч. изос —
равный). У большинства позвоночных желтка много, и он распределен в цитоплазме яйцеклетки неравномерно. Это анизолециталъные
клетки. Основная масса желтка скапливается у одного из полюсов клетки — вегетативного полюса.
Такие яйцеклетки называют телолецйтальными
(от греч. телос —
конец). Противоположный полюс, к которому оттесняется свободная от желтка активная цитоплазма, называют анималъным.
Если желток все же погружен в цитоплазму и не обособлен от нее в виде отдельной фракции, как у осетровых и земноводных, яйцеклетки называют умеренно телолецитальными.
Если желток полностью отделен от цитоплазмы, как у амниот, то это резко телолецитальные
яйцеклетки.
Изложенные особенности размеров и полярности яйцеклеток хордовых схематично сгруппированы в табл. 7.1.
Распределение желтка имеет решающее значение для всех последующих процессов эмбриогенеза, так как определяет будущую пространственную организацию зародыша. Вместе с тем необходимо отметить, что распределение желтка — это как бы внешнее проявление более тонких процессов поляризации яйцеклеток, осуществляющихся, по-видимому, в кортикальном слое и прилежащих к нему цитоскелетных структурах.
Таблица 7.1. Типы яйцеклеток, встречающиеся у хордовых
| Представители типа Хордовые
|
В зависимости от количества желтка
|
В зависимости от
распределения желтка
|
| Ланцетник Лягушка
Птица Плацентарные млекопитающие (и человек)
|
олиго
лецитальная мезо
лецитальная
поли
лецитальная а
лецитальная
|
изо
лецитальная
умеренно тело
лецитальная
резко тело
лецитальная
олецитальная изолецитальная
|
Кортикальный слой —
это поверхностный слой цитоплазмы яйца вместе с плазматической мембраной. В нем находятся микрофиламенты и кортикальные гранулы. Кортикальный слой играет важную роль в кортикальной реакции при оплодотворении.
Полярность яйцеклеток намечается еще на стадии накопления желтка в овоцитах во время их быстрого роста и закрепляется при выделении полярных телец именно на анимальном полюсе. Внутреннюю разнокачественность участков яйца называют овоплазматической сегрегацией.
Лицевые оболочки.
Различают первичную оболочку,
образуемую самой яйцевой клеткой, вторичную оболочку,
являющуюся продуктом деятельности фолликулярных клеток, и третичныеоболочки,
которыми яйцо окружается во время прохождения по яйцеводу.
Первичная оболочка, иногда называемая желточной, имеется у яйцеклеток всех животных. У позвоночных, в том числе млекопитающих и человека, первичная оболочка входит в состав плотной оболочки, образуя ее внутреннюю часть. Внешняя часть плотной оболочки продуцируется фолликулярными клетками и является вторичной оболочкой. Плотная оболочка изнутри пронизана микроворсинками яйцеклетки, а снаружи — микроворсинками фолликулярных клеток, отчего при большом увеличении она выглядит исчерченной и названа лучистой оболочкой
(corona radiata). За свои оптические свойства у млекопитающих она получила название блестящей оболочки
(zona pellucida). Таким образом, эта оболочка совмещает в себе первичную и вторичную оболочки.
Третичные оболочки хорошо развиты у хрящевых рыб и амфибий, но особенную сложность они приобретают у наземных позвоночных —пресмыкающихся, птиц и низших млекопитающих. Образуясь из секретов желез яйцевода, эти оболочки не имеют клеточного строения. У всех позвоночных они выполняют функции защиты зародыша от механических повреждений и действия вредных биотических факторов, таких, как бактериальные, грибковые и протозойные. Кроме того, у наземных позвоночных появляются принципиально новые функции запаса воды и питательных веществ для обеспечения нужд зародыша. У пресмыкающихся скорлуповая оболочка действует как насос, забирая воду из почвы и воздуха. У птиц запас воды находится в белковой оболочке. Поглощение и испарение воды регулируется порами в скорлуповой оболочке. Скорлупа содержит множество минеральных солей, необходимых для развития скелета зародыша.
Оплодотворение —
это процесс слияния половых клеток. Образующаяся в результате оплодотворения диплоидная клетка — зигота —
представляет собой начальный этап развития нового организма.
Процесс оплодотворения складывается из трех последовательных фаз: а) сближения гамет; б) активации яйцеклетки; в) слияния гамет, или сингамии.
1. Сближение сперматозоида с яйцеклеткой обеспечивается совокупностью неспецифических факторов, повышающих вероятность их встречи и взаимодействия. К ним относят скоординированность наступления готовности к оплодотворению у самца и самки, поведение самцов и самок, обеспечивающее совокупление и осеменение, избыточную продукцию сперматозоидов, крупные размеры яйцеклетки, а также вырабатываемые яйцеклетками и сперматозоидами химические вещества, способствующие сближению и взаимодействию половых клеток. Эти вещества, называемые гамонами
(гормоны гамет), с одной стороны, активируют движение сперматозоидов, а с другой — их склеивание. В особой структуре сперматозоида — акросоме —локализуются протеолитические ферменты. У млекопитающих большое значение имеет пребывание сперматозоидов в половых путях самки, в результате чего мужские половые клетки приобретают оплодотворяющую способность (капацитация), т.е. способность к акросомной реакции.
В момент контакта сперматозоида с оболочкой яйцеклетки происходит акросомная реакция,
во время которой под действием протеолитических ферментов акросомы яйцевые оболочки растворяются. Далее плазматические мембраны яйцеклетки и сперматозоида сливаются и через образующийся вследствие этого цитоплазматический мостик цитоплазмы обеих гамет объединяются. Затем в цитоплазму яйца переходят ядро и центриоль сперматозоида, а мембрана сперматозоида встраивается в мембрану яйцеклетки. Хвостовая часть сперматозоида у большинства животных тоже входит в яйцо, но потом отделяется и рассасывается, не играя какой-либо роли в дальнейшем развитии.
2. В результате контакта сперматозоида с яйцеклеткой происходит ее активация.
Она заключается в сложных структурных и физико-химических изменениях. Благодаря тому что участок мембраны сперматозоида проницаем для ионов натрия, последние начинают поступать внутрь яйца, изменяя мембранный потенциал клетки. Затем в виде волны, распространяющейся из точки соприкосновения гамет, происходит увеличение содержания ионов кальция, вслед за чем также волной растворяются кортикальные гранулы. Выделяемые при этом специфические ферменты способствуют отслойке желточной оболочки; она затвердевает, это оболочка оплодотворения.
Все описанные процессы представляют собой так называемую кортикальную реакцию.
Одним из значений кортикальной реакции является предотвращение полиспермии, т.е. проникновения в яйцеклетку более одного сперматозоида. У млекопитающих кортикальная реакция не вызывает образования оболочки оплодотворения, но суть ее та же.
У таких животных, как морской еж, костистые рыбы и земноводные, все изменения цитоплазмы сопровождаются видимыми морфологическими перестройками. Эти явления получили название расслоения или сегрегации плазмы.
Значение ее для дальнейшего эмбрионального развития будет рассмотрено ниже.
Активация яйцеклетки завершается началом синтеза белка на трансляционном уровне, поскольку мРНК, тРНК, рибосомы и энергия были запасены еще в овогенезе. Активация яйцеклетки может начаться и протекать до конца без ядра сперматозоида и без ядра яйцеклетки, что доказано опытами по энуклеации зиготы.
3. Яйцеклетка в момент встречи со сперматозоидом обычно находится на одной из стадий мейоза, заблокированной с помощью специфического фактора. У большинства позвоночных этот блок осуществляется на стадии метафазы II; у многих беспозвоночных, а также у трех видов млекопитающих (лошади, собаки и лисицы) блок происходит на стадии диакинеза. В большинстве случаев блок мейоза снимается после активации яйцеклетки вследствие оплодотворения. В то время как в яйцеклетке завершается мейоз, ядро сперматозоида, проникшее в нее, видоизменяется. Оно принимает вид интерфазного, а затем профазного ядра. За это время удваивается ДНК и мужской пронуклеус
получает количество наследственного материала, соответствующего п
2с
,
т.е. содержит гаплоидный набор редуплицированных хромосом.
Ядро яйцеклетки, закончившее мейоз, превращается в женский пронуклеус,
также приобретая п
2с.
Оба пронуклеуса проделывают сложные перемещения, затем сближаются и сливаются (синкарион
),
образуя общую метафазную пластинку. Это, собственно, и есть момент окончательного слияния гамет — сингамия.
Первое митотическое деление зиготы приводит к образованию двух клеток зародыша (бластомеров) с набором хромосом 2n
2c
в каждом.
Партеногенез
(от греч. партеноз
— девственница) — развитие без оплодотворения. В случае естественного партеногенеза
развитие идет на основе цитоплазмы и пронуклеуса яйцеклетки. Особи, формирующиеся из яйцеклетки, имеют либо гаплоидный, либо диплоидный набор хромосом, так как чаще всего в начале дробления срабатывает один из механизмов удвоения числа хромосом. В одних случаях в ходе мейоза женской половой клетки выпадает стадия редукции числа хромосом и яйцеклетка получается с диплоидным пронуклеусом. В других случаях диплоидизация происходит во время первого деления дробления, при котором не происходит цитотомии.
Естественный партеногенез —явление редкое и, как правило, не бывает единственным способом размножения вида. Он либо чередуется с нормальным половым размножением, либо встречается у отдельных рас. Естественный партеногенез обнаружен у летних поколений некоторых ракообразных и коловраток, у пчел, ос, рада чешуекрылых. Среди позвоночных партеногенетическое размножение описано у трех рас скальной ящерицы Армении, состоящих из одних самок. 40% яиц индеек, отложенных в отсутствие самца, могут начать развиваться, однако это развитие редко доходит до конца, чаще останавливается из-за возникающих аномалий. У других видов позвоночных естественное партеногенетическое размножение неизвестно.
Искусственный партеногенез возможен,
по-видимому, у всех животных. Разработка методов партеногенетического развития — важная проблема в научном и прикладном отношениях. Большой вклад в эту проблему внесли отечественные исследователи А. А. Тихомиров, Б. Л. Астауров, В. А. Струнников. Обнаружено, что активация яйцеклетки сперматозоидом не является специфической. В качестве активирующих могут выступать многие физические и химические факторы. На тутовом шелкопряде было показано, что с помощью искусственного партеногенеза можно регулировать соотношение мужского и женского пола в популяции, получая большой экономический эффект.
Естественный партеногенез чаще всего случается при незавершенном оплодотворении, т.е. в тех случаях, когда имела место активация яйцеклетки, но ядро сперматозоида не участвовало в оплодотворении. В активированных яйцах используется информация только женского пронуклеуса. Такой вид партеногенеза называют гиногенезом.
При искусственном партеногенезе можно удалить женский пронуклеус, и тогда развитие осуществится только за счет мужских пронуклеусов. Это андрогенез.
В специальных опытах на морских ежах было установлено, что потомки наследуют либо только признаки матери при гиногенезе, либо только признаки отца — при андрогенезе. Это указывает на то, что наследственные свойства особи определяются в основном ядром, а не цитоплазмой.
Сущность стадии дробления.
Дробление —
это ряд последовательных митотических делений зиготы и далее бластомеров, заканчивающихся образованием многоклеточного зародыша — бластулы.
Первое деление дробления начинается после объединения наследственного материала пронуклеусов и образования общей метафазной пластинки. Возникающие при дроблении клетки называют бластомерами
(от греч. бласте—
росток, зачаток). Особенностью митотических делений дробления является то, что с каждым делением клетки становятся все мельче и мельче, пока не достигнут обычного для соматических клеток соотношения объемов ядра и цитоплазмы. У морского ежа, например, для этого требуется шесть делений и зародыш состоит из 64 клеток. Между очередными делениями не происходит роста клеток, но обязательно синтезируется ДНК.
Все предшественники ДНК и необходимые ферменты накоплены в процессе овогенеза. В результате митотические циклы укорочены и деления следуют друг за другом значительно быстрее, чем в обычных соматических клетках. Сначала бластомеры прилегают друг к другу, образуя скопление клеток, называемое морулой.
Затем между клетками образуется полость — бластоцель,
заполненная жидкостью. Клетки оттесняются к периферии, образуя стенку бластулы — бластодерму.
Общий размер зародыша к концу дробления на стадии бластулы не превышает размера зиготы.
Главным результатом периода дробления является превращение зиготы в многоклеточный односменный зародыш.
Морфология дробления.
Как правило, бластомеры располагаются в строгом порядке друг относительно друга и полярной оси яйца. Порядок, или способ, дробления зависит от количества, плотности и характера распределения желтка в яйце. По правилам Сакса — Гертвига клеточное ядро стремится расположиться в центре свободной от желтка цитоплазмы, а веретено клеточного деления — в направлении наибольшей протяженности этой зоны.
В олиго- и мезолецитальных яйцах дробление полное,
или голобластическое.
Такой тип дробления встречается у миног, некоторых рыб, всех амфибий, а также у сумчатых и плацентарных млекопитающих. При полном дроблении плоскость первого деления соответствует плоскости двусторонней симметрии. Плоскость второго деления проходит перпендикулярно плоскости первого. Обе борозды первых двух делений меридианные, т.е. начинаются на анимальном полюсе и распространяются к вегетативному полюсу. Яйцевая клетка оказывается разделенной на четыре более или менее равных по размеру бластомера. Плоскость третьего деления проходит перпендикулярно первым двум в широтном направлении. После этого в мезолецитальных яйцах на стадии восьми бластомеров проявляется неравномерность дробления. На анимальном полюсе четыре более мелких бластомера — микромеры,
на вегетативном — четыре более крупных — макромеры.
Затем деление опять идет в меридианных плоскостях, а потом опять в широтных.
В полилецитальных яйцеклетках костистых рыб, пресмыкающихся, птиц, а также однопроходных млекопитающих дробление частичное,
или мероб-ластическое,
т.е. охватывает только свободную от желтка цитоплазму. Она располагается в виде тонкого диска на анимальном полюсе, поэтому такой тип дробления называют дискоидальным.
При характеристике типа дробления учитывают также взаимное расположение и скорость деления бластомеров. Если бластомеры располагаются рядами друг над другом по радиусам, дробление называют радиальным.
Оно типично для хордовых и иглокожих. В природе встречаются и другие варианты пространственного расположения бластомеров при дроблении, что определяет такие его типы, как спиральное у моллюсков, билатеральное у аскариды, анархичное у медузы.
Замечена зависимость между распределением желтка и степенью синхронности деления анимальных и вегетативных бластомеров. В олиголецитальных яйцах иглокожих дробление почти синхронное, в мезолецитальных яйцевых клетках синхронность нарушена после третьего деления, так как вегетативные бластомеры из-за большого количества желтка делятся медленнее. У форм с частичным дроблением деления с самого начала асинхронны и бластомеры, занимающие центральное положение, делятся быстрее.

Рис. 7.2. Дробление у хордовых животных с разным типом яйцеклетки.
А —
ланцетник; Б
—
лягушка; В —
птица; Г —
млекопитающее:
I
—два бластомера, II—
четыре бластомера, III
—
восемь бластомеров, IV
—
морула, V
—
бластула;
1
—борозды дробления, 2
—бластомеры, 3—
бластодерма, 4—
бластоиель, 5—
эпибласт, 6—
гипобласт, 7—эмбриобласт, 8—
трофобласт; размеры зародышей на рисунке не отражают истинных соотношений размеров
Рис. 7.2. Продолжение
К концу дробления образуется бластула. Тип бластулы зависит от типа дробления, а значит, от типа яйцеклетки. Некоторые типы дробления и бластул представлены на рис. 7.2 и схеме 7.1. Более подробное описание дробления у млекопитающих и человека см. разд. 7.6.1.
Особенности молекулярно-генетических и биохимических процессов при дроблении.
Как было отмечено выше, митотические циклы в периоде дробления сильно укорочены, особенно в самом начале.
Например, весь цикл деления в яйцах морского ежа длится 30—40 мин при продолжительности S-фазы всего 15 мин. gi- и 02-периоды практически отсутствуют, так как в цитоплазме яйцевой клетки создан необходимый запас всех веществ, и тем больший, чем она крупнее. Перед каждым делением происходит синтез ДНК и гистонов.
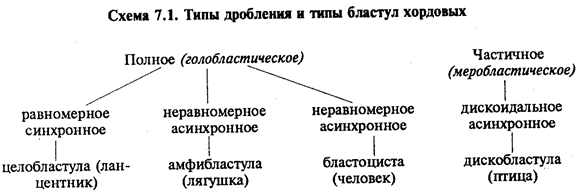
Скорость продвижения репликационной вилки по ДНК в ходе дробления обычная. Вместе с тем в ДНК бластомеров наблюдается больше точек инициации, чем в соматических клетках. Синтез ДНК идет во всех репликонах одновременно, синхронно. Поэтому время репликации ДНК в ядре совпадает с временем удвоения одного, притом укороченного, репликона. Показано, что при удалении из зиготы ядра дробление происходит и зародыш доходит в своем развитии почти до стадии бластулы. Дальнейшее развитие прекращается.
В начале дробления другие виды ядерной активности, например транскрипция, практически отсутствуют. В разных типах яиц транскрипция генов и синтез РНК начинаются на разных стадиях. В тех случаях, когда в цитоплазме много различных веществ, как, например, у земноводных, транскрипция активируется не сразу. Синтез РНК у них начинается на стадии ранней бластулы. Напротив, у млекопитающих синтез РНК уже начинается на стадии двух бластомеров.
В периоде дробления образуются РНК и белки, аналогичные синтезируемым в процессе овогенеза. В основном это гистоны, белки клеточных мембран и ферменты, необходимые для деления клеток. Названные белки используются сразу же наравне с белками, запасенными ранее в цитоплазме яйцеклеток. Наряду с этим в период дробления возможен синтез белков, которых не было ранее. В пользу этого свидетельствуют данные о наличии региональных различий в синтезе РНК и белков между бластомерами. Иногда эти РНК и белки начинают действовать на более поздних стадиях.
Важную роль в дроблении играет деление цитоплазмы — цитотомия.
Она имеет особое морфогенетическое значение, так как определяет тип дробления. В процессе цитотомии сначала образуется перетяжка с помощью сократимого кольца из микрофиламентов. Сборка этого кольца проходит под непосредственным влиянием полюсов митотического веретена. После цитотомии бластомеры олиголецитальных яиц остаются связанными между собой лишь тоненькими мостиками. Именно в это время их легче всего разделить. Это происходит потому, что цитотомия ведет к уменьшению зоны контакта между клетками из-за ограниченной площади поверхности мембран
Сразу после цитотомии начинается синтез новых участков клеточной поверхности, зона контакта увеличивается и бластомеры начинают плотно соприкасаться. Борозды дробления проходят по границам между отдельными участками овоплазмы, отражающим явление овоплазматической сегрегации. Поэтому цитоплазма разных бластомеров различается по химическому составу.
Сущность стадии гаструляции
заключается в том, что однослойный зародыш — бластула — превращается в многослойный —
двух- или трехслойный, называемый гаструлой
(от греч. гастер —
желудок в уменьшительном смысле).
У примитивных хордовых, например у ланцетника, однородная однослойная бластодерма во время гаструляции преобразуется в наружный зародышевый листок —эктодерму —и внутренний зародышевый листок — энтодерму.
Энтодерма формирует первичную кишку с полостью внутри—гастроцель.
Отверстие, ведущее в гастроцель, называют бластопором
или первичным ртом. Два зародышевых листка
являются определяющими морфологическими признаками гаструляции. Их существование на определенной стадии развития у всех многоклеточных животных, начиная с кишечнополостных и кончая высшими позвоночными, позволяет думать о гомологии зародышевых листков и единстве происхождения всех этих животных.
У позвоночных помимо двух упомянутых во время гаструляции образуется еще третий зародышевый листок — мезодерма,
занимающая место между экто- и энтодермой. Развитие среднего зародышевого листка, представляющего собой хордомезодерму, является эволюционным усложнением фазы гаструляции у позвоночных и связано с ускорением у них развития на ранних стадиях эмбриогенеза. У более примитивных хордовых животных, таких, как ланцетник, хордомезодерма обычно образуется в начале следующей после гаструляции фазы — органогенезе.
Смещение времени развития одних органов относительно других у потомков по сравнению с предковыми группами является проявлением гетерохронии.
Изменение времени закладки важнейших органов в процессе эволюции встречается не редко.
Процесс гаструляции характеризуется важными, клеточными преобразованиями,
такими, как направленные перемещения групп и отдельных клеток, избирательное размножение и сортировка клеток, начало цитодифференцировки и индукционных взаимодействий. Перечисленные клеточные механизмы онтогенеза подробно разбираются в гл. 8.2.
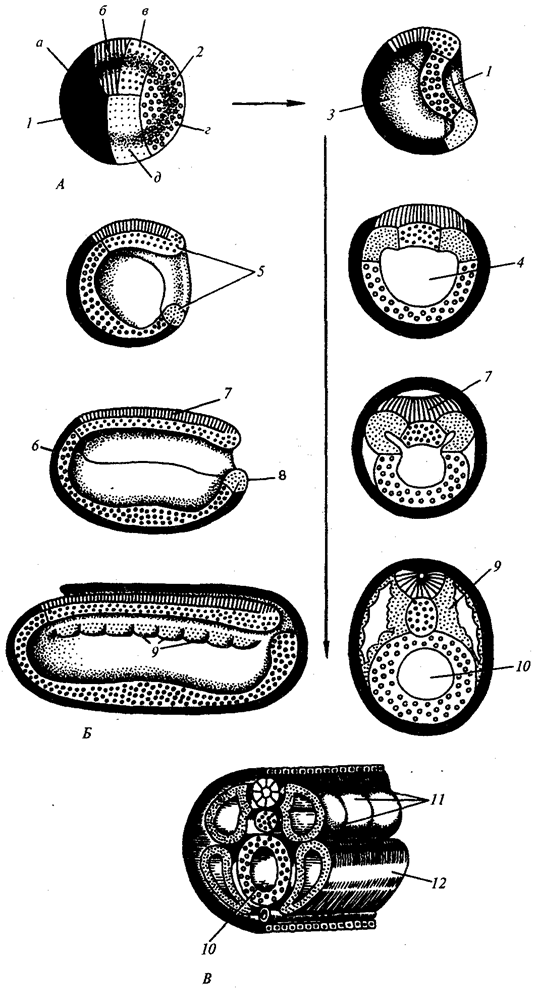
Рис. 7.3. Презумптивные зачатки, гаструляция и нейруляция у ланцетника.
А —
презумптивные зачатки на стадии бластулы (вид снаружи) и ранней гаструлы (вид на срезе); Б —
поздняя гаструла и нейруляция на сагиттальном (левый ряд) и поперечном (правый ряд) разрезах; В —
пластическая модель зародыша в конце периода нейруляции:
1—
анимальный полюс, 2—
вегетативный полюс, 3—
бластоцель, 4—
гастроцель, 5—спинная и брюшная губы бластопора, 6 —
головной конец зародыша, 7— модулярная пластинка, 8 —
хвостовой конец зародыша, 9—спинная часть мезодермы, 10—
полость вторичной кишки. 11 —
сегментированные сомиты, 12—
брюшная часть мезодермы; а, б, в, г, д —
обозначения презумптивных и развивающихся органов: а
— эктодерма кожная, б —
нервная трубка, в —
хорда, г —
эндотерма, эпителий кишки, д —
мезодерма
Способы гаструляции
различны. Выделяют четыре разновидности направленных в пространстве перемещений клеток, приводящих к преобразованию зародыша из однослойного в многослойный.
Инвагинация —
впячивание одного из участков бластодермы внутрь целым пластом. У ланцетника впячиваются клетки вегетативного полюса, у земноводных инвагинация происходит на границе между анимальным и вегетативным полюсами в области серого серпа. Процесс инвагинации возможен только в яйцах с небольшим или средним количеством желтка.
Эпиболия —
обрастание мелкими клетками анимального полюса более крупных, отстающих в скорости деления и менее подвижных клеток вегетативного полюса. Такой процесс ярко выражен у земноводных.
Деноминация —
расслоение клеток бластодермы на два слоя, лежащих друг над другом. Деламинацию можно наблюдать в дискобластуле зародышей с частичным типом дробления, таких, как пресмыкающиеся, птицы, яйцекладущие млекопитающие. Деламинация проявляется в эмбриобласте плацентарных млекопитающих, приводя к образованию гипобласта и эпибласта.
Иммиграция —
перемещение групп или отдельных клеток, не объединенных в единый пласт. Иммиграция встречается у всех зародышей, но в наибольшей степени характерна для второй фазы гаструляции высших позвоночных.
В каждом конкретном случае эмбриогенеза, как правило, сочетаются несколько способов гаструляции.
Морфология гаструляции.
Более детальное рассмотрение гаструляции у ланцетника, лягушки, цыпленка и млекопитающих, к чему мы переходим, поможет глубже понять эволюционные связи и разобраться в закономерностях индивидуального развития.
Гаструляция ланцетника
показана на рис. 7.3. Разными маркерами на стадии бластулы (рис. 7.3, А) отмечены презумптивные
(предполагаемые) зачатки. Это области бластулы, из клеточного материала которых, в ходе гаструляции и раннего органогенеза (нейруляции), обычно образуются совершенно определенные зародышевые листки и органы (рис. 7.3, Б
и В
).
Инвагинация начинается на вегетативном полюсе. Из-за более быстрого деления клетки анимального полюса разрастаются и толкают внутрь бластулы клетки вегетативного полюса. Этому способствует изменение состояния цитоплазмы в клетках, образующих губы бластопора и прилежащих к ним. Вследствие инвагинации бластоцель уменьшается, а гастроцель увеличивается. Одновременно с исчезновением бластоцеля эктодерма и энтодерма приходят в тесный контакт. У ланцетника, как и у всех вторичноротых животных (к ним относят тип Иглокожие, тип Хордовые и некоторые другие малочисленные типы животных), область бластопора превращается в хвостовую часть организма в отличие от первичноротых, у которых бластопор соответствует головной части. Ротовое отверстие у вторичноротых образуется на противоположном бластопору конце зародыша.
Рис. 7.4. Колбовидные клетки в области бластопора ранней гаструлы амфибий: 1
— колбовидные клеит, 2 —
спинная губа бласгопора
Гаструляция у земноводных имеет много общего с гаструляцией ланцетника, но так как в яйцеклетках у них желтка намного больше и расположен он преимущественно на вегетативном полюсе, крупные бластомеры амфибластулы не способны впячиваться внутрь. Инвагинация
проходит несколько иначе. На границе между анимальным и вегетативным полюсами в области серого серпа клетки сначала сильно вытягиваются внутрь, принимая вид «колбовидных» (рис. 7.4), а затем тянут за собой клетки поверхностного слоя бластулы. Возникают серповидная бороздка и спинная губа бластопора.
Одновременно более мелкие клетки анимального полюса, делящиеся быстрее, начинают перемещаться в сторону вегетативного полюса. В области спинной губы они подворачиваются и впячиваются, а с боков и со стороны, противоположной серповидной бороздке, обрастают более крупные клетки. Затем процесс эпиболии
приводит к тому, что образуются боковые и брюшная губы бластопора. Бластопор смыкается в кольцо, внутри которого некоторое время видны крупные светлые клетки вегетативного полюса в виде так называемой желточной пробки. Позднее они полностью погружаются внутрь, а бластопор сужается.
С помощью метода маркировки прижизненными (витальными) красителями у земноводных детально изучены перемещения клеток бластулы во время гаструляции, Установлено, что конкретные области бластодермы, называемые презумптивными
(от лат. praesumptio — предположение), при нормальном развитии оказываются сначала в составе определенных зачатков органов, а затем в составе самих органов (рис. 7.5). Известно, что у бесхвостых амфибий материал презумптивной хорды и мезодермы на стадии бластулы лежит не на ее поверхности, а во внутренних слоях стенки амфибластулы, однако примерно на тех уровнях, как это показано на рисунке. Анализ ранних этапов развития земноводных позволяет сделать заключение о том, что овоплазматическая сегрегация,
которая отчетливо проявляется в яйцеклетке и зиготе (рис. 7.6), имеет большое значение в определении судьбы клеток, унаследовавших тот или иной участок цитоплазмы. Определенное сходство процессов гаструляции и области презумптивных органов у земноводных и ланцетника, т.е. гомология основных органов, таких, как нервная трубка, хорда, вторичная кишка, указывает на их филогенетическое родство.
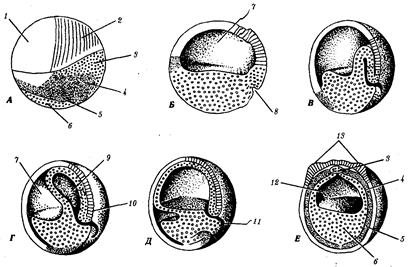
Рис. 7.5. Карта областей презумптивных зачатков органов на ранних стадиях эмбрионального развития амфибий. А —
стадия бластулы (вял слева); Б—Д —
последовательные этапы гаструляции (сагиттальные срезы); Е —
начало нейруляции (поперечный срез):
1
—кожная эктодерма, 2—
нервная трубка, 3—
хорда, 4—мезодерма сомитов, 5—
мезодерма спланхнотомов, 6 —энтодерма, 7 —бластоцель, 8
—серповидная бороздка, 9—гастроцель, 10—
спинная губа бластопора, 11
—желточная пробка, 12—
полость вторичной кишки, 13—
нервные валики
Гаструляция у зародышей с мepoблacтическим типом дробления и развития имеет свои особенности. У птиц
она начинается вслед за дроблением и образованием бластулы во время прохождения зародыша по яйцеводу. К моменту откладки яйца зародыш уже состоит из нескольких слоев: верхний слой называют эпибластом,
нижний — первичным гипобластом
(рис. 7.2, В
).
Между ними находится узкая щель — бластоцель. Затем образуется вторичный гипобласт,
способ образования которого не вполне ясен. Имеются данные о том, что в первичном гипобласте птиц берут начало первичные половые клетки, а вторичный — образует внезародышевую энтодерму. Образование первичного и вторичного гипобласта рассматривают как явление, предшествующее гаструляции.
Основные события гаструляции и окончательное образование трех зародышевых листков начинаются после откладки яиц с началом инкубации. Возникает скопление клеток в задней части эпибласта как результат неравномерного по скорости деления клеток и перемещения их с боковых участков эпибласта к центру, навстречу друг другу. Образуется так называемая первичная полоска,
которая вытягивается в направлении к головному концу. В центре первичной полоски образуется первичная бороздка,
а по краям — первичные валики. На головном конце первичной полоски возникает утолщение — гензеновский узелок,
а в нем — первичная ямка (рис. 7.7).
Когда клетки эпибласта входят в первичную бороздку, их форма изменяется. Они напоминают по форме «колбовидные» клетки гаструлы земноводных. Затем эти клетки приобретают звездчатую форму и погружаются под эпибласт, образуя мезодерму (рис. 7.8). Энтодерма образуется на основе первичного и вторичного гипобласта с добавлением нового поколения энтодермальных клеток, мигрирующих из верхних слоев, бластодермы. Наличие нескольких генераций энтодермальных клеток указывает на растянутость периода гаструляции во времени.
Рис. 7.6. Овоплазматическая сегрегация в икринке травяной лягушки.
А —
сразу после оплодотворения; Б—
через 2 ч после оплодотворения (вид слева): 1
— пигментированная анимальная область, 2—
непигментированная негативная область, 3
—головно-хвостовая ось будущего организма, 4—
серый серп, 5 —
спинная сторона, 6 —
брюшная сторона
Рис. 7.7. Куриный зародыш на стадии первичной полоски
(вид со спинной стороны):
1
— темная область, 2 —
просвечивающая область зародышевого диска
Часть клеток, мигрирующая из эпибласта через гензеновский узелок, образует будущую хорду. Одновременно с закладкой и удлинением хорды гензеновский узелок и первичная полоска постепенно исчезают в направлении от головного к хвостовому концу. Это соответствует сужению и закрытию бластопора. По мере сокращения первичная полоска оставляет за собой сформированные участки осевых органов зародыша в направлении от головных к хвостовым отделам. Представляется обоснованным рассматривать перемещения клеток в курином зародыше как гомологичные эпиболии, а первичную полоску и гензеновский узелок — как гомологичные бластопору в спинной губе гаструлы земноводных.
Интересно отметить, что клетки зародышей млекопитающих (гл. 7.6.1), несмотря на то что у названных животных яйцеклетки имеют малое количество желтка, а дробление полное, в фазе гаструляции сохраняют перемещения, свойственные зародышам пресмыкающихся и птиц. Это подтверждает представление о происхождении млекопитающих от предковой группы, у которой яйца были богаты желтком.
Рис. 7.8. Куриный зародыш на стадии первичной полоски (поперечный срез).
А, Б —
при малом и большом увеличении: 1
— эктодерма, 2 —
энтодерма, 3 —
мезодерма, 4 —
первичный валик, 5 — первичная бороздка
Особенности стадии гаструляции.
Гаструляция характеризуется разнообразными клеточными процессами. Продолжается митотическое размножение клеток,
причем оно имеет разную интенсивность в разных частях зародыша. Вместе с тем наиболее характерная черта гаструляции состоит в перемещении клеточных масс.
Это приводит к изменению строения зародыша и превращению его из бластулы в гаструлу. Происходит сортировка
клеток по их принадлежности к разным зародышевым листкам, внутри которых они «узнают» друг друга.
На фазу гаструляции приходится начало цитодифференцировки,
что означает переход к активному использованию биологической информации собственного генома. Одним из регуляторов генетической активности является различный химический состав цитоплазмы клеток зародыша, установившийся вследствие овоплазматической сегрегации. Так, эктодермальные клетки земноводных имеют темный цвет из-за пигмента, попавшего в них из анимального полюса яйцеклетки, а клетки энтодермы — светлый, так как происходят из вегетативного полюса яйца.
Во время гаструляции очень велика роль эмбриональной индукции.
Показано, что появление первичной полоски у птиц — результат индукционного взаимодействия между гипобластом и эпибластом. Гипобласту присуща полярность. Изменение положения гипобласта по отношению к эпибласту вызывает изменение ориентации первичной полоски.
Подробно обо всех перечисленных процессах рассказано в главе 8.2. Следует заметить, что такие проявления целостности
зародыша как детерминация, эмбриональная регуляция
и интегрированность
присущи ему во время гаструляции в той же мере как и во время дробления (см. разд. 8.3).
Органогенезы,
заключающиеся в образовании отдельных органов, составляют основное содержание эмбрионального периода. Они продолжаются в личиночном и завершаются в ювенильном периоде. Органогенезы отличаются наиболее сложными и разнообразными морфогенетическими преобразованиями. Необходимой предпосылкой перехода к органогенезам является достижение зародышем стадии гаструлы, а именно формирование зародышевых листков. Занимая определенное положение друг по отношению к Другу, зародышевые листки, контактируя и взаимодействуя, обеспечивают такие взаимоотношения между различными клеточными группами, которые стимулируют их развитие в определенном направлении. Это так называемая эмбриональная индукция —
важнейшее следствие взаимодействия между зародышевыми листками.
В ходе органогенезов изменяются форма, структура и химический состав клеток, обособляются клеточные группы, представляющие собой зачатки будущих органов. Постепенно развивается определенная форма органов, устанавливаются пространственные и функциональные связи между ними. Процессы морфогенеза сопровождаются дифференциацией тканей и клеток, а также избирательным и неравномерным ростом отдельных органов и частей организма. Обязательным условием органогенезов наряду с размножением, миграцией и сортировкой клеток является их избирательная гибель (см. разд. 8.2.4).
Самое начало органогенеза называют нейруляцией. Нейруляция
охватывает процессы от появления первых признаков формирования нервной пластинки до замыкания ее в нервную трубку (рис. 7.9). Параллельно формируются хорда
и вторичная кишка,
а лежащая по бокам от хорды мезодерма расщепляется в краниокаудальном направлении на сегментированные парные структуры — сомиты.
Нервная система позвоночных, включая человека, отличается устойчивостью основного плана строения на протяжении всей эволюционной истории подтипа. В формировании нервной трубки у всех хордовых много общего. Вначале неспециализированная спинная эктодерма, отвечая на индукционное воздействие со стороны хордомезодермы, превращается в нервную пластинку,
представленную нейроэпителиальными
клетками цилиндрической формы.
Рис. 7.9. Последовательные стадии формирования нервной трубки и нервного гребня на 3-й неделе развития человеческого эмбриона (поперечный срез):
1
—нервная пластинка, 2—
нервный гребень, 3—
эктодерма, 4—
хорда, 5—
нервная бороздка, 6—
невроцель
Нервная пластинка недолго остается уплощенной. Вскоре ее боковые края приподнимаются, образуя нервные валики,
которые лежат по обе стороны неглубокой продольной нервной бороздки.
Края нервных валиков далее смыкаются, образуя замкнутую нервную трубку с каналом внутри — невроцелем.
Раньше всего смыкание нервных валиков происходит на уровне начала спинного мозга, а затем распространяется в головном и хвостовом направлениях. Показано, что в морфогенезе нервной трубки большую роль играют микротрубочки и микрофиламенты нейроэпителиальных клеток. Разрушение этих клеточных структур колхицином и цитохалазином В приводит к тому, что нервная пластинка остается открытой. Несмыкание нервных валиков ведет к врожденным порокам развития нервной трубки.
После смыкания нервных валиков клетки, первоначально располагавшиеся между нервной пластинкой и будущей кожной эктодермой, образуют нервный гребень.
Клетки нервного гребня отличаются способностью к обширным, но строго регулируемым миграциям по всему телу (см. разд. 8.2.2, рис. 8.1) и образуют два главных потока. Клетки одного из них—поверхностного—включаются в эпидермис или дерму кожи, где дифференцируются в пигментные клетки. Другой поток мигрирует в брюшном направлении, образует чувствительные спинномозговые ганглии, симпатические нервные узлы, мозговое вещество надпочечников, парасимпатические ганглии. Клетки из черепного отдела нервного гребня дают начало как нервным клеткам, так и ряду других структур, таких, как жаберные хрящи, некоторые кроющие кости черепа.
Мезодерма, занимающая место по бокам от хорды и распространяющаяся далее между кожной эктодермой и энтодермой вторичной кишки, подразделяется на дорсальную и вентральную области. Дорсальная часть сегментирована и представлена парными сомитами.
Закладка сомитов идет от головного к хвостовому концу. Вентральная часть мезодермы, имеющая вид тонкого слоя клеток, называется боковой пластинкой.
Сомиты соединены с боковой пластинкой промежуточной мезодермой в виде сегментированных ножек сомитов.
Все области мезодермы постепенно дифференцируются. В начале формирования сомиты имеют конфигурацию, характерную для эпителия с полостью внутри. Под индукционным воздействием, исходящим от хорды и нервной трубки, вентромедиальные части сомитов — склеротомы —
превращаются во вторичную мезенхиму, выселяются из сомита и окружают хорду и вентральную часть нервной трубки. В конце концов из них образуются позвонки, ребра и лопатки.
Дорсолатеральная часть сомитов с внутренней стороны образует миотомы,
из которых разовьются поперечно-полосатые скелетные мышцы тела и конечностей. Наружная дорсолатеральная часть сомитов образует дерматомы,
которые дают начало внутреннему слою кожи — дерме. Из области ножек сомитов с зачатками нефротом
и гонотом
образуются органы выделения и половые железы.
Правая и левая несегментированные боковые пластинки расщепляются на два листка, ограничивающих вторичную полость тела — целом.
Внутренний листок, прилежащий к энтодерме, называют висцеральным. Он окружает кишку со всех сторон и образует брыжейку, покрывает легочную паренхиму и мышцу сердца. Наружный листок боковой пластинки прилежит к эктодерме и называется париетальным. В дальнейшем он образует наружные листки брюшины, плевры и перикарда.
Энтодерма у всех зародышей в конечном счете образует эпителий вторичной кишки и многие ее производные. Сама вторичная кишка всегда располагается под хордой.
Таким образом, в процессе нейруляции возникает комплекс осевых органов
нервная трубка — хорда — кишка, представляющих собой характернейшую черту организации тела всех хордовых. Одинаковое происхождение, развитие и взаимное расположение осевых органов выявляют их полную гомологию и эволюционную преемственность.
При углубленном рассмотрении и сравнении процессов нейруляции у конкретных представителей типа хордовых выявляются некоторые различия, которые связаны в основном с особенностями, зависящими от строения яйцеклеток, способа дробления и гаструляции (рис. 7.10). Обращают внимание отличающаяся форма зародышей и смещение времени закладки осевых органов друг относительно друга, т.е. описанная выше гетерохрония.
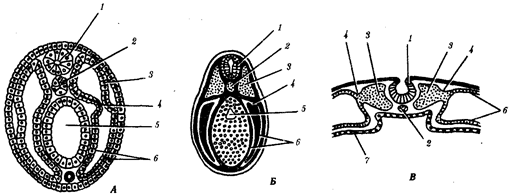
Рис. 7.10. Нейрулы различных хордовых животных.
А —
ланцетник; Б —
лягушка; В —
цыпленок:
1—нервная трубка, 2—
хорда, 3—
сомит, 4
—ножка сомита, 5
—
вторичная кишка, 6—
боковая пластинка, 7—энтодерма
Эктодерма, мезодерма и энтодерма в ходе дальнейшего развития, взаимодействуя друг с другом, участвуют в формировании определенных органов. Возникновение зачатка органа связано с местными изменениями определенного участка соответствующего зародышевого листка. Так, из эктодермы
развиваются эпидермис кожи и его производные (перо, волосы, ногти, кожные и молочные железы), компоненты органов зрения; слуха, обоняния, эпителий ротовой полости, эмаль зубов. Важнейшими эктодермальными производными являются нервная трубка, нервный гребень и образующиеся из них все нервные клетки.
Производными энтодермы
являются эпителий желудка и кишки, клетки печени, секретирующие клетки поджелудочной, кишечных и желудочных желез. Передний отдел эмбриональной кишки образует эпителий легких и воздухоносных путей, а также секретирующие клетки передней и средней долей гипофиза, щитовидной и паращитовидной желез.
Мезодерма
помимо уже описанных выше скелетных структур, скелетной мускулатуры, дермы кожи, органов выделительной и половой систем образует сердечно-сосудистую систему, лимфатическую систему, плевру, брюшину и перикард. Из мезенхимы, имеющей смешанное происхождение за счет клеток трех зародышевых листков, развиваются все виды соединительной ткани, гладкая мускулатура, кровь и лимфа (подробнее в разд. 8.2.5, схема 8.1).
Зачаток конкретного органа формируется первоначально из определенного зародышевого листка, но затем орган усложняется и в итоге в его формировании принимают участие два или три зародышевых листка.
Провизорные,
или временные,
органы образуются в эмбриогенезе ряда представителей позвоночных для обеспечения жизненно важных функций, таких, как дыхание, питание, выделение, движение и др. Недоразвитые органы самого зародыша еще не способны функционировать по назначению, хотя обязательно играют какую-то роль в системе развивающегося целостного организма. Как только зародыш достигает необходимой степени зрелости, когда большинство органов способны выполнять жизненно важные функции, временные органы рассасываются или отбрасываются.
Время образования провизорных органов зависит от того, какие запасы питательных веществ были накоплены в яйцеклетке и в каких условиях среды происходит развитие зародыша. У бесхвостых земноводных, например, благодаря достаточному количеству желтка в яйцеклетке и тому, что развитие идет в воде, зародыш осуществляет газообмен и выделяет продукты диссимиляции непосредственно через оболочки яйца и достигает стадии головастика. На этой стадии образуются провизорные органы дыхания (жабры), пищеварения и движения, приспособленные к водному образу жизни. Перечисленные личиночные органы дают возможность головастику продолжить развитие. По достижении состояния морфофункциональной зрелости органов взрослого типа временные органы исчезают в процессе метаморфоза.
У пресмыкающихся и птиц запасов желтка в яйцеклетке больше, но развитие идет не в воде, а на суше. В связи с этим очень рано возникает потребность в обеспечении дыхания и выделения, а также в защите от высыхания. У них уже в раннем эмбриогенезе, почти параллельно с нейруляцией, начинается формирование провизорных органов, таких, как амнион, хорион
и желточный мешок.
Чуть позднее формируется аллантоис. У плацентарных млекопитающих эти же провизорные органы образуются еще раньше, поскольку в яйцеклетке очень мало желтка. Развитие таких животных происходит внутриутробно, образование провизорных органов у них совпадает по времени с периодом гаструляции.
Наличие или отсутствие амниона и других провизорных органов лежит в основе деления позвоночных на две группы: Amniota и Anamnia. Эволюционно более древние позвоночные, развивающиеся исключительно в водной среде и представленные такими классами, как Круглоротые, Рыбы и Земноводные, не нуждаются в дополнительных водных и других оболочках зародыша и составляют группу анамний. К группе амниот относят первичноназемных позвоночных, т.е. тех, у кого эмбриональное развитие протекает в наземных условиях.
Это три класса: Пресмыкающиеся, Птицы и Млекопитающие. Они являются высшими позвоночными, так как имеют скоординированные и высокоэффективные системы органов, обеспечивающие им существование в наиболее сложных условиях, каковыми являются условия суши. Эти классы насчитывают большое количество видов, вторично перешедших в водную среду. Таким образом, высшие позвоночные оказались в состоянии освоить все среды обитания. Подобное совершенство было бы невозможным, в том числе и .без внутреннего осеменения и специальных провизорных эмбриональных органов.
В строении и функциях провизорных органов различных амниот много общего. Характеризуя в самом общем виде провизорные органы зародышей высших позвоночных, называемые также зародышевыми оболочками, следует отметить, что все они развиваются из клеточного материала уже сформировавшихся зародышевых листков. Некоторые особенности имеются в развитии зародышевых оболочек плацентарных млекопитающих, о чем будет сказано ниже.
Амнион
представляет собой эктодермальный мешок, заключающий зародыша и заполненный амниотической жидкостью. Амниотическая оболочка специализирована для секреции и поглощения амниотической жидкости, омывающей зародыш. Амнион играет первостепенную роль в защите зародыша от высыхания и от механических повреждений, создавая для него наиболее благоприятную и естественную водную среду. Амнион имеет и мезодермальный слой из внезародышевой соматоплевры, который дает начало гладким мышечным волокнам. Сокращения этих мышц вызывают пульсацию амниона, а медленные колебательные движения, сообщаемые при этом зародышу, по-видимому, способствуют тому, что его растущие части не мешают друг другу.
Хорион
(сероза) — самая наружная зародышевая оболочка, прилежащая к скорлупе или материнским тканям, возникающая, как и амнион, из эктодермы и соматоплевры. Хорион служит для обмена между зародышем и окружающей средой. У яйцекладущих видов основная его функция — дыхательный газообмен; у млекопитающих он выполняет гораздо более обширные функции, участвуя помимо дыхания в питании, выделении, фильтрации и синтезе веществ, например гормонов.
Желточный мешок
имеет энтодермальное происхождение, покрыт висцеральной мезодермой и непосредственно связан с кишечной трубкой зародыша. У зародышей с большим количеством желтка он принимает участие в питании. У птиц, например в спланхноплевре желточного мешка, развивается сосудистая сеть. Желток не проходит через желточный проток, соединяющий мешок с кишкой. Сначала он переводится в растворимую форму под действием пищеварительных ферментов, продуцируемых энтодермальными клетками стенки мешка. Затем попадает в сосуды и с кровью разносится по всему телу зародыша.
У млекопитающих нет запасов желтка и сохранение желточного мешка может быть связано с важными вторичными функциями. Энтодерма желточного мешка служит местом образования первичных половых клеток, мезодерма дает форменные элементы крови зародыша. Кроме того, желточный мешок млекопитающих заполнен жидкостью, отличающейся высокой концентрацией аминокислот и глюкозы, что указывает на возможность обмена белков в желточном мешке.
Судьба желточного мешка у разных животных несколько различна. У птиц к концу периода инкубации остатки желточного мешка уже находятся внутри зародыша, после чего он быстро исчезает и к концу 6-х суток после вылупления полностью рассасывается. У млекопитающих желточный мешок бывает развит по-разному. У хищников он сравнительно большой, с сильно развитой сетью сосудов, а у приматов быстро сморщивается и исчезает без остатка до родов.
Аллантоис
развивается несколько позднее других внезародышевых органов. Он представляет собой мешковидный вырост вентральной стенки задней кишки. Следовательно, он образован энтодермой изнутри и спланхноплеврой снаружи. У рептилий и птиц аллантоис быстро дорастает до хориона и выполняет несколько функций. Прежде всего это вместилище для мочевины и мочевой кислоты, которые представляют собой конечные продукты обмена азотсодержащих органических веществ. В аллантоисе хорошо развита сосудистая сеть, благодаря чему вместе с хорионом он участвует в газообмене. При вылуплении наружная часть аллантоиса отбрасывается, а внутренняя — сохраняется в виде мочевого пузыря.
У многих млекопитающих аллантоис тоже хорошо развит и вместе с хорионом образует хориоаллантоисную плаценту. Термин плацента
означает тесное наложение или слияние зародышевых оболочек с тканями родительского организма. У приматов и некоторых других млекопитающих энтодермальная часть аллантоиса рудиментарна, а мезодермальные клетки образуют плотный тяж, протягивающийся от клоакального отдела к хориону. По мезодерме аллантоиса к хориону растут сосуды, посредством которых плацента выполняет выделительную, дыхательную и питательную функции.
Доступнее и проще изучить образование и строение зародышевых оболочек на примере зародыша курицы. На стадии нейрулы три зародышевых листка непосредственно переходят от зародыша к внезародышевой части, никак не отграничиваясь. По мере того как зародыш приобретает форму, вокруг него образуется несколько складок, которые как бы подсекают зародыш, отделяют его от желтка и устанавливают четкие границы между зародышем и внезародышевыми областями. Они называются туловищными складками
(рис. 7.11).
Рис. 7.11. Образование туловищных складок и зародышевых оболочек
у зародыша цыпленка. А
—продольный срез; Б —
поперечный срез:
1 —
эктодерма, 2 —
мезодерма, 3 —
зачаток мозга, 4 —
глоточная мембрана,
5 —
нервная трубка, 6—
хорда, 7—клоачная мембрана, 8—
хорион, 9—
амнион, 10—
экзоделом, 11—
аллаитоис, 12—
область пупка, 13
—зачаток сердца,
14—
энтодерма, 15—
закладка кишечника, 16—
туловищные складки,
17—
желточный мешок
Сначала образуется головная складка. Она подсекает снизу головную часть. Задние концы этой складки переходят в боковые туловищные складки, отграничивающие туловище зародыша с боков. Хвостовая складка отграничивает задний конец зародыша. Постепенно сужается ножка, соединяющая среднюю кишку и желточный мешок, образуются передний и задний отделы кишки. Одновременно из эктодермы и прилежащей к ней соматоплевры образуется сначала головная складка (рис. 7.12), которая, как капюшон, нарастает на зародыш сверху. Концы головной складки образуют по бокам амниотические валики.
Они растут поверх зародыша навстречу друг другу и срастаются, образуя сразу стенки амниона, прилежащего к зародышу, и хориона, лежащего снаружи.
Рис. 7.12. Куриный зародыш около 40 ч инкубации:
1—
головная складка амниона, 2—
нервная трубка, 3 —
сомиты
Позднее образуется аллантоис (рис.7.13). Общий вид куриного зародыша на 6-е сутки инкубации изображен на рис. 7.14. У различных млекопитающих процессы образования провизорных органов больше или меньше похожи на описанные выше у птиц. Особенности развития их у приматов и человека показаны в следующей главе.

Рис. 7.13. Образование аллантоиса у зародыша цыпленка
(продольный срез хвостовой части):
1
—желточный мешок, 2—
средняя кишка, 3—
аорта, 4—
хорда, 5—
нервная трубка, 6—
эктодерма, 7—амнион, 8—
хорион, 9—
полость амниона,
10—
аллантоис, 11—
экзоцелом
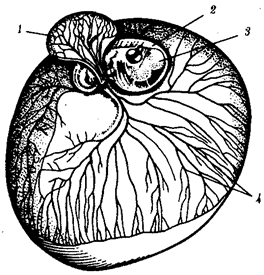
Рис. 7.14. Куриный зародыш на 6-е сутки инкубации
(белок и хорион удалены, аллантоис сдвинут вверх):
1—
аллантоис, 2—амнион, 3—
зародыш, 4—
сосуды желточного мешка
Изучение пренатального и, в частности, эмбрионального развития человека очень важно, так как помогает лучше понять взаимосвязи между органами и механизмы возникновения врожденных пороков развития. В эмбриональном развитии разных видов млекопитающих есть общие черты, но существуют и различия. У всех плацентарных, например, процессы раннего эмбриогенеза существенно отличаются от таковых, ранее описанных у других позвоночных. Вместе с тем и среди плацентарных есть межвидовые особенности.
Дробление
зиготы человека характеризуется следующими чертами. Плоскость первого деления проходит через полюса яйцеклетки, т.е., как и у других позвоночных, является меридианной. При этом один из образующихся бластомеров оказывается крупнее другого, что указывает на неравномерность деления. Два первых бластомера вступают в следующее деление асинхронно. Борозда проходит по меридиану и перпендикулярно первой борозде. Таким образом, возникает стадия трех бластомеров. Во время деления меньшего бластомера происходит поворот пары образующихся более мелких бластомеров на 90° так, что плоскость борозды деления оказывается перпендикулярной к первым двум бороздам. Аналогичное расположение бластомеров на 4-клеточ-ной стадии описано у мыши, кролика, норки и обезьяны (рис. 7.15). Благодаря асинхронному дроблению могут быть стадии с нечетным числом бластомеров —5, 7, 9.
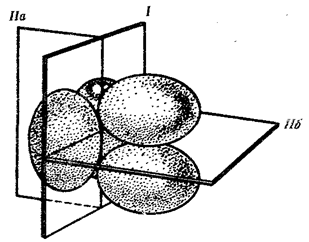
Рис. 7.15. Ранние стадии дробления зиготы кролика:
I
—плоскость первой борозды дробления. II
а —
плоскость второй борозды дробления одного из первых двух бластомеров, II
б —
плоскость второй борозды дробления второго из первых двух бластомеров
В результате дробления образуется скопление бластомеров—морула.
Поверхностно расположенные бластомеры образуют клеточный слой, а бластомеры, лежащие внутри морулы, группируются в центральный клеточный узелок. Примерно на стадии 58 бластомеров внутри морулы появляется жидкость, образуется полость (бластоцель) и зародыш превращается в бластоцисту.
В бластоцисте
различают наружный слой клеток (трофобласт) и внутреннюю клеточную массу (зародышевый узелок, или эмбриобласт). Внутренняя клеточная масса оттеснена жидкостью к одному из полюсов бластоцисты. Позднее из трофобласта
разовьется наружная плодовая оболочка—хорион, а из эмбриобласта —
сам зародыш и некоторые внезародышевые органы. Показано, что собственно зародыш развивается из очень небольшого количества клеток зародышевого узелка.
Стадия дробления протекает под лучистой оболочкой. На рис. 7.16 изображены ранние стадии эмбриогенеза человека с указанием, где в материнском организме располагается зародыш. Дробление человеческой зиготы и возникновение бластоциты схематично представлены на рис. 7.17 и 7.18.
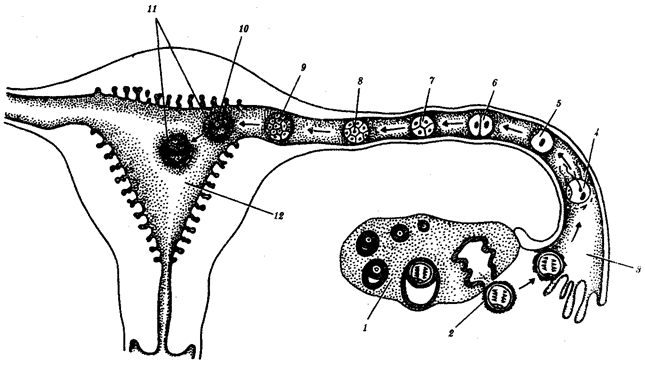
Рис. 7.16. Овуляция оплодотворение и человеческий зародыш
на 1-й неделе развития:
1
—яичник, 2—
овоцит II порядка (овуляция), 3
—яйцевод, 4—
оплодотворение, 5—
зигота, 6—
зародыш на стадии двух бластомеров, 7—зародыш на стадии четырех бластомеров, 8—
зародыш на стадии восьми бластомеров, 9
—морула. 10, 11
—бластодиста, 12—
задняя стенка матки
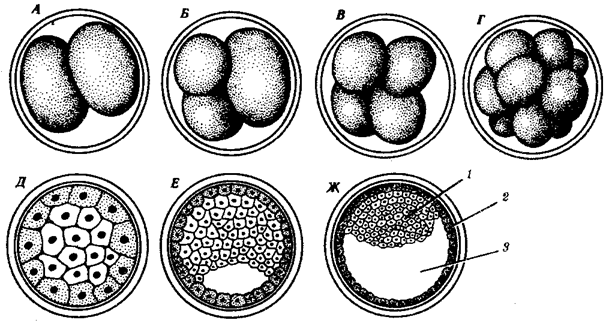
Рис. 7.17. Дробление зиготы человека.
А—
два бластомера; Б—
три бластомера; В—
четыре бластомера; Г—
морула; Д—
разрез морулы; Е, Ж—
разрез ранней и поздней бластоцисты:
1
—эмбриобласт, 2—
трофобласт, 3—
бластоцель
Примерно на 6—7-е сутки после оплодотворения зародыш, который уже 2—3 сут. свободно плавал в полости матки, готов к имплантации, т.е. к погружению в ее слизистую оболочку. Лучистая оболочка при этом разрушается. Вступив в контакт с материнскими тканями, клетки трофобласта быстро размножаются и разрушают слизистую матки. Они образуют два слоя: внутренний, называемый цитотрофобластом, поскольку он сохраняет клеточное строение, и наружный, называемый синцитиотрофобластом, поскольку он представляет собой синцитий. На рис. 7.19 показан зародыш человека в процессе имплантации.
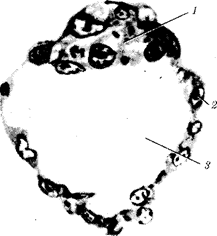
Рис. 7.18. Бластоциста зародыша человека (срез):
1—
эмбриобласт, 2—
трофобласт, 3—
бластоцель
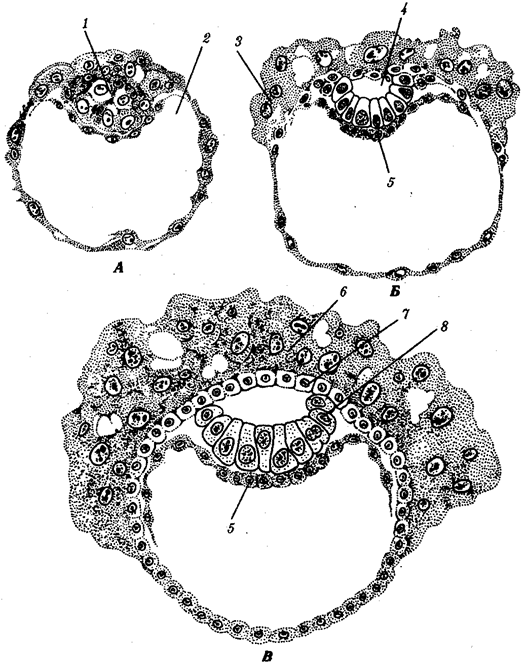
Рис. 7.19. Последовательные стадии имплантации и развития
зародыша человека в конце 1-й и на 2-й неделе.
А —
бластоциста; Б —
бластоциста в самом начале имплантации (7-е сутки развития); В —
частично имплантировавшая бластоциста (8-е сутки развития); Г —зародыш на 9—10-е сутки развития; Д—
зародыш на 13-е сутки развития:
1
—эмбриобласт, 2—
бластоцель, 3—
трофобласт, 4—
полость амниона,
5
—гипобласт, б—
синнитиотрофобласт, 7—цитотрофобласт, 8
—эпибласт,
9—амнион, 10—
лакуна трофобласта, 11—
эпителий матки, 12—
ножка тела,
13
—почка аллантоиса, 14—
желточный мешок, 15—
внезародышевый целом, 16—
ворсинка хориона, 17—
первичный желточный мешок, 18—
вторичный желточный мешок
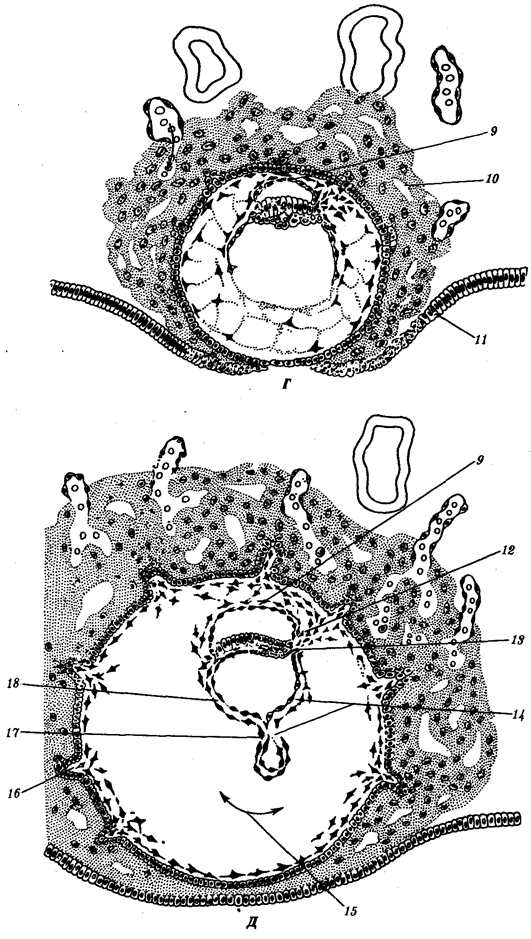
Рис. 7.19. Продолжение
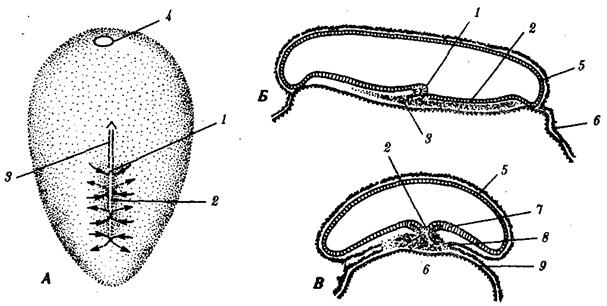
Рис. 7.20. Развитие зародыша человека на стадии первичной полоски
(15—17-е сутки).
А —
вид на зародыш сверху (амнион снят); Б —
продольный срез; В —
поперечный срез через первичную полоску:
1
—гензеновский узелок, 2—
первичная полоска, 3—
хорда, 4—
прехордальная пластинка, 5—
амнион, 6—
желточный мешок, 7—эктодерма. 8—
мезодерма, 9—
энтодерма
Гаструляция
у млекопитающих тесно связана с другими эмбриональными преобразованиями. Одновременно с разделением трофобласта на два слоя происходит уплощение зародышевого узелка и он превращается в двуслойный зародышевый щиток. Нижний слой щитка — гипобласт,
или первичная энтодерма, по мнению большинства авторов, образуется путем деламинации внутренней клеточной массы, примерно так, как это происходит в зародышевом диске птиц. Первичная энтодерма полностью расходуется на образование внезародышевой энтодермы. Выстилая полость трофобласта, она вместе с ним образует первичный желточный мешок млекопитающих.
Верхний клеточный слой — эпибласт —
является источником будущей эктодермы, мезодермы и вторичной энтодермы. На 3-й неделе в эпибласте образуется первичная полоска,
развитие которой сопровождается почти такими же перемещениями клеточных масс, как и при образовании первичной полоски птиц (рис. 7.20). В головном конце первичной полоски образуются гензеновский узелок
и первичная ямка,
гомологичные спинной губе бластопора других позвоночных. Клетки, которые перемещаются в области первичной ямки, направляются под эпибластом в сторону прехордальной пластинки.
Прехордальная пластинка
находится на головном конце зародыша и обозначает место будущей ротоглоточной мембраны. Клетки, перемещающиеся по центральной оси, образуют зачаток хорды и мезодермы и составляют хордомезодермальный отросток.
Гензеновский узелок постепенно смещается к хвостовому концу зародыша, первичная полоска укорачивается, а зачаток хорды удлиняется. По бокам от хордомезодермального отростка образуются мезодермальные пластинки, которые расширяются в обе стороны. Ниже представлена обобщающая схема (7.2) некоторых процессов раннего эмбрионального развития.
К концу 3-й недели в эктодерме зародыша над зачатком хорды образуется нервная пластинка.
Она состоит из высоких цилиндрических клеток. В центре нервной пластинки образуется прогиб в виде нервного желоба,
а по бокам его возвышаются нервные валики.
Это начало нейруляции. В средней части зародыша происходит смыкание нервных валиков — образуется нервная трубка.
Затем смыкание распространяется в головном и хвостовом направлениях. Нервная трубка и прилежащие к ней участки эктодермы, из которых в дальнейшем развивается нервный гребень,
полностью погружаются и отделяются от эктодермы, срастающейся над ними (см. рис. 7.9). Полоска клеток, лежащая под нервной трубкой, превращается в хорду. По бокам от хорды и нервной трубки в средней части зародыша появляются сегменты спинной мезодермы — сомиты. К концу 4-й недели они распространяются к головному и хвостовому концам, достигая примерно 40 пар.
К этому же времени относится начало формирования первичной кишки, закладок сердца и сосудистой сети желточного мешка. На рис. 7.21 видны соотношения размеров зародыша и внезародышевых органов на 21 -е сутки развития. Более детально обособление тела зародыша от зародышевых оболочек и закладку органов можно видеть на рис. 7.22, где изображены не только общий вид зародыша, но и планы разрезов. Обращает внимание быстрое (за 7 сут 4-й недели) формирование зародыша в виде вытянутого в длину и изогнутого тела, приподнятого и отсеченного туловищными складками от желточного мешка. За это время закладываются все сомиты, четыре пары жаберных дуг, сердечная трубка, почки конечностей, средняя кишка, а также «карманы» передней и задней кишки.
Схема 7.2. Дифференциация зародышевых листков млекопитающих
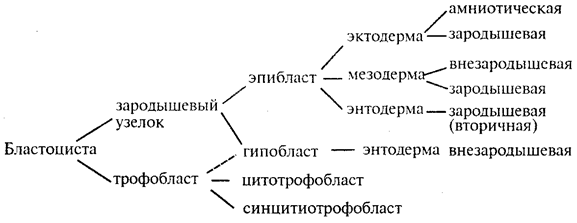
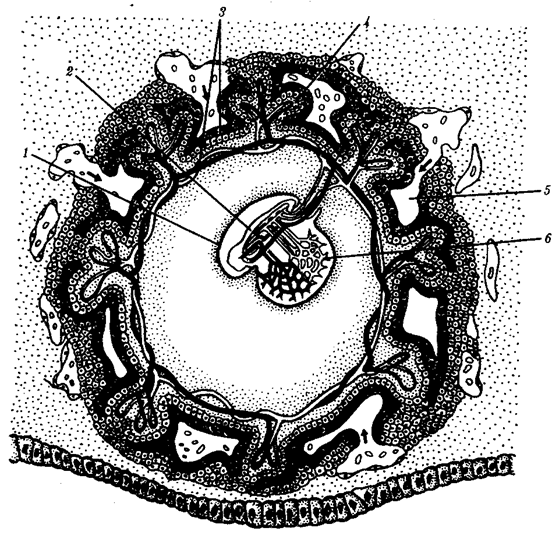
Рис. 7.21. Зародыш и внезародышевые органы человека на 21-е сутки развития:
1
—амнион, 2—
зародыш, 3—
хорион, 4—
третичная ворсина, 5—
материнская кровь, 6-
желточный мешок
В следующие четыре недели эмбрионального развития закладываются все основные органы. Нарушение процесса развития в этот период ведет к наиболее грубым и множественным врожденным порокам развития.
Как было отмечено выше, развитие внезародышевых провизорных органов у млекопитающих и человека имеет особенности. Эти органы образуются очень рано, одновременно с гаструляцией, и несколько иначе, чем у других амниот. Начало развития хориона и амниона приходится на 7—8-е сутки, т.е. совпадает с началом имплантации.
Хорион
возникает из трофобласта, который уже разделился на цитотрофобласт и синцитиотрофобласт. Последний под влиянием контакта со слизистой матки разрастается и разрушает ее. К концу 2-й недели образуются первичные ворсинки хориона в виде скопления эпителиальных клеток цитотрофобласта. В начале 3-й недели в них врастает мезодермальная мезенхима и возникают вторичные ворсинки, а когда к концу 3-й недели внутри соединительнотканной сердцевины появляются кровеносные сосуды, их называют третичными ворсинками. Область, где тесно прилежат ткани хориона и слизистая матки, называют плацентой.
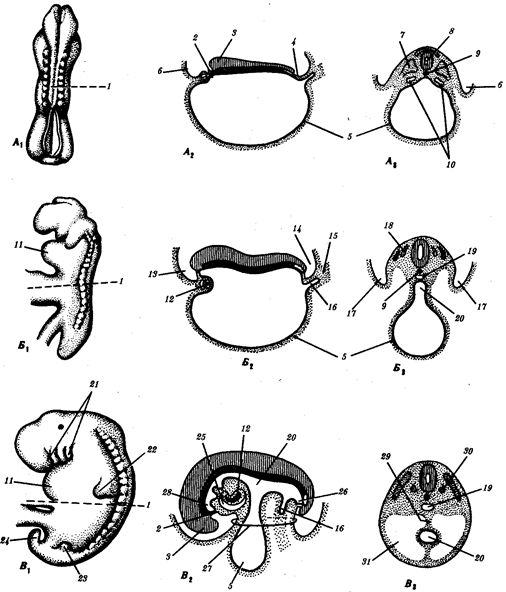
Рис. 7.22. Развитие зародыша человека на 4-й неделе.
A
1
Б
1
В
1
—
общий вид; А
2
Б
2
В
2
—
продольный срез; А
3
Б
3
В
3
—
поперечный срез; А
1
А
2
А
3
— 22
сут; Б
1
Б
2
Б
3
— 24
сут; В
1
В
2
B
3
—
28 сут:
1
—уровень поперечного среза, 2—
ротоглоточиая мембрана, 3—
мозг, 4—
клоачная мембрана, 5—
желточный мешок, 6—амнион, 7—сомиты, 8—
нервная трубка, 9—хорда, 10—
парные закладки брюшной аорты, 11
—сердечный выступ, 12—
сердце, 13—
головная туловищная складка. 14—
хвостовая туловищная складка, IS
—
ножка тела, 16—
аллантоис, 17—
боковые туловищные складки, 18 —
нервный гребень, 19 —
спинная аорта, 20 —
средняя кишка, 21 —
жаберные дуги, 22—
почка передней конечности, 23—
почка задней конечности. 24—
хвост, 25—
перикард, 26—
карман задней кишки, 27—пупочный канатик, 28—
карман передней кишки, 29—
спинная брыжейка, 30—
нервный узел заднего корешка, 31 —
внутризародышевый целом
У человека, как и у других приматов, сосуды материнской части плаценты утрачивают свою непрерывность и ворсинки хориона фактически омываются кровью и лимфой материнского организма. Такая плацента называется гемохориальной.
По мере развития беременности ворсинки увеличиваются в размерах, разветвляются, но кровь плода с самого начала и до конца изолирована от материнской крови плацентарным барьером.
Плацентарный барьер
состоит из трофобласта, соединительной ткани и эндотелия сосудов плода. Этот барьер проницаем для воды, электролитов, питательных веществ и продуктов диссимиляции, а также для антигенов эритроцитов плода и антител материнского организма, токсических веществ и гормонов. Клетками плаценты вырабатывается четыре гормона, в том числе хорионический гонадотропин, который обнаруживается в моче беременной женщины со 2—3-й недели беременности.
Амнион
возникает путем расхождения клеток эпибласта внутренней клеточной массы. Амнион человека называют шизамнионом
(см. рис. 7.19) в отличие от плеврамниона птиц и некоторых млекопитающих. Амниотическая полость некоторое время ограничена клетками эпибласта и частично участком трофобласта. Затем боковые стенки эпибласта образуют складки, направленные вверх, которые впоследствии срастаются. Полость оказывается полностью выстланной эпибластическими (эктодермальными) клетками. Снаружи амниотическую эктодерму окружают внезародышевые мезодермальные клетки.
Желточный мешок,
появляется, когда от внутренней клеточной массы отделяется тонкий слой гипобласта и его внезародышевые энтодермальные клетки, перемещаясь, выстилают изнутри поверхность трофобласта. Образовавшийся первичный желточный мешок на 12—13-е сутки спадается и преобразуется во вторичный желточный мешок, связанный с зародышем. Энтодермальные клетки обрастают снаружи внезародышевой мезодермой. Судьба и функции желточного мешка были описаны ранее.
Аллантоис
возникает у зародыша человека, как и у других амниот, в виде кармана вентральной стенки задней кишки, но его энтодермальная полость остается рудиментарной структурой. Тем не менее в его стенках развивается обильная сеть сосудов, соединяющаяся с главными кровеносными сосудами зародыша. Мезодерма аллантоиса соединяется с мезодермой хориона, отдавая в него кровеносные сосуды, Так происходит васкуляризация этой хориоаллантоисной плаценты.
При сравнении образования, строения и функций провизорных органов млекопитающих с подобными органами других амниот обращают внимание проявления гетерохронии, интенсификации одних и ослабления других функций, расширения функций. Таким образом, в эволюции провизорных органов проявляются те же способы филогенетических преобразований органов, что и у постоянных органов животных.
Некоторые этапы и сроки развития органов у зародышей человека представлены в табл. 7.2.
В этом разделе не ставится цель описать развитие всех органов человека. Будут рассмотрены лишь некоторые морфогенетические процессы, иллюстрирующие следующие общебиологические моменты:
1) значение межклеточных, тканевых и межорганных взаимодействий в морфогенезе; 2) отражение в морфогенезе человека эволюционно более древних черт организации позвоночных; 3) особенности органогенезов, позволяющие оценить стадию и механизмы нарушений развития при тех или иных врожденных пороках.
Сегментарное строение позвоночника
отражает его происхождение из сомитов зародыша. Кроме того, формирование позвонков тесно связано с хордой и спинным мозгом. Тела позвонков образуются из мигрирующих по направлению к хорде и окружающих ее скоплений мезенхимных клеток, которые происходят из склеротомов. В образовании тел позвонков участвуют мезенхимные клетки двух рядом лежащих пар сомитов, в связи с чем тела позвонков находятся не на уровне сомитов, а между ними. В то же время мышцы, развивающиеся из миотомов сомитов, как бы перекидываются через межпозвонковые сочленения и обеспечивают движение позвонков.
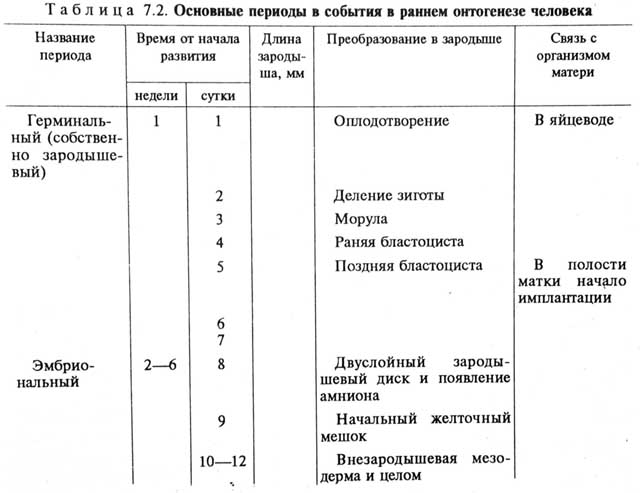


Дужки позвонков образуются из скопления мезенхимных склеротомных клеток, распространяющихся в спинном направлении, а поперечные отростки и ребра образуются из скоплений клеток, мигрирующих вбок. Спинной мозг и спинномозговые ганглии участвуют в морфогенезе спинных дужек позвонков. Если удалить спинномозговые ганглии, то хрящ спинных дужек формируется, но имеет вид несегментированного стержня (рис. 7.23).
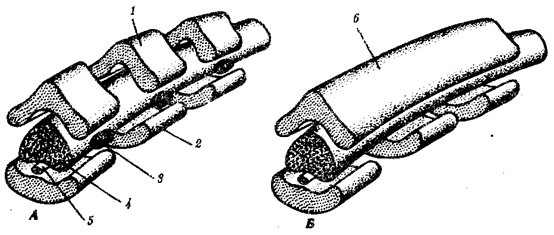
Рис. 7.23. Развитие спинных дужек позвонков у куриного зародыша.
А —
нормальное развитие; Б —
-после удаления спинномозговых ганглиев:
1
—спинная дужка, 2—
тело позвонка, 3—
спинномозговой узел, 4—
спинной мозг, 5—
хорда, 6 —
несегментированные спинные дужки позвонков
Постепенно изменяется гистологическое строение позвонков. На протяжении 4—5 недель образуются мезенхимные позвонки, на 6-й неделе появляются очаги хондрогенеза, а затем на 8-й неделе начинается окостенение, продолжающееся почти до 25 лет. Участки хорды, расположенные внутри тел позвонков, постепенно исчезают. Внутри межпозвонковых дисков хорда сохраняется в виде слизеподобной структуры, известной под названием nucleus pulposus.
Формирование среднего уха
связано с онтогенетическими преобразованиями первой и второй висцеральных дуг.
На рис. 7.24 схематично показаны области головы и шеи на 4-й и 24-й неделях развития человека. На 4-й неделе у эмбриона справа и слева закладываются в головной и шейной областях висцеральные (жаберные) дуги. Изнутри, со стороны глотки между ними образуются глоточные карманы.
Это выпячивания энтодермы, растущие вбок. Снаружи, соответственно глоточным, впячиваются внутрь эктодермальные жаберные карманы.
Энтодерма и эктодерма первого глоточного и жаберного карманов приходят в контакт на 4-й неделе развития (рис. 7.25, А
). Контакт продолжается недолго, слепой конец глоточного кармана отходит от поверхности и окружается мезенхимой (рис. 7.25, Б
). Из дистальной части глоточного кармана начинает развиваться полость среднего уха (барабанная полость), а из проксимальной части образуется слуховая (евстахиева) труба. Из мезенхимы в дальнейшем дифференцируются закладки слуховых косточек, служащих для проведения звука (рис. 7.25, В
). Молоточек и наковальня происходят из первой висцеральной дуги и гомологичны элементам меккелева хряща и квадратной кости; стремечко — из дорсальной части второй висцеральной дуги (гиомандибулярной кости). Мышцы и нервы, связанные с косточками среднего уха, формируются из области первой и второй висцеральных дуг.
Рис. 7.24. Голова и шея зародыша человека, вид сбоку.
А —
на 4-й неделе; Б —
на 24 чеделе:
1
—первая дуга, 2—
местоположение развивающегося внутреннего уха, 3—
вторая дуга, 4—
третья дуга, 5—
четвертая дуга, 6—
молоточек, 7—наковальня, 8—
стремечко, 9—
шиловидный отросток, 10—
большой рог подъязычной кости, 11—
щитовидный хрящ, 12—
перстневидный хрящ, 13
—
тело подъязычной кости, 14—
малый рог, 15—
нижняя челюсть; закладки висцеральных дуг (А
) и развивающиеся из них органы (Б
) обозначены одинаковой штриховкой
Рис. 7.25. Развитие среднего уха, фронтальный разрез.
А—
на 4-й неделе; Б—
на 5-й неделе; В—
более поздние стадии:
1
—первая жаберная пластинка. 2—
первый жаберный карман, 3—
первая висцеральная (жаберная) дуга, 4—
слуховой пузырек. 5—
первый глоточный карман, 6—
производные первой висцеральной дуги, 7 — производное второй висцеральной дуги, 8
—
трубобарабанная полость. 9—
пробка наружного слухового прохода. 10—
первичный наружный слуховой проход, 11—
молоточек, 12—
наковальня, 13—
стремечко, 14—
барабанная полость, 15—
слуховая (евстахиева) труба
В конце внутриутробной жизни и в течение нескольких месяцев после рождения эмбриональная соединительная ткань, находящаяся в барабанной полости, рассасывается. Только после этого косточки приобретают подвижность и колебания барабанной перепонки могут свободно передаваться на мембрану овального окна внутреннего уха.
Развитие пищеварительной
системы сложно рассмотреть в деталях, так как кишечная трубка сильно удлиняется, дифференцируется и связана в своем развитии со многими другими системами: эндокринной, дыхательной, выделительной, кровеносной, нервной и целомом. Рассмотрим только наиболее ранние и общие процессы, происходящие в кишечной трубке, а также изменения ее связи с желточным мешком.
Кишечная трубка возникает из энтодермы крыши желточного мешка и прилегающего к ней висцерального листка мезодермы в процессе обособления тела эмбриона от внезародышевых частей с помощью головной, хвостовой и боковых туловищных складок. На 4-й неделе она представлена сравнительно простой трубкой, состоящей из передней кишки, слепо замкнутой спереди стомодеальной (ротовой) пластинкой, средней кишки, связанной с желточным мешком посредством желточного стебелька, и задней кишки, слепо замкнутой на хвостовом конце клоакальной мембраной (см. рис. 7.22, Б
2
)
Рис. 7.26. Дифференцировка и поворот средней кишки у зародыша человека. А —
конец 5-й недели; Б —
около 10-й недели; А
1
и Б
1
—
схемы поворота кишки:
1
—печень, 2—
желудок, 3—
спинная аорта, 4—
спинная закладка поджелудочной железы, 5—
верхняя брыжеечная артерия, 6—
желточный стебелек, 7—каудальная ветвь U-образного выпячивания, 8—
краниальная ветвь U-образного выпячивания средней кишки, 9—
брюшная закладка поджелудочной железы, 10—
желчный пузырь, 11
—зачаток слепой кишки, 12—
пупок, 13—
место бывшего желточного стебелька
За период от 4-й до конца 8-й недели (рис. 7.26) эмбрионального развития кишка удлиняется и начинает дифференцироваться. Из переднего ее отдела формируются глотка, пищевод, желудок и двенадцатиперстная кишка с ее производными (печень и поджелудочная железа) до впадения в нее общего желчного протока. В конце 4-й недели ротовая пластинка прорывается, образуются ротовое отверстие и выстланная эктодермой неглубокая ротовая полость. Средняя кишка образует U-образную петлю, которая связана с желточным мешком посредством желточного стебелька. Участок кишки между желточньм стебельком и желудком превратится в тонкую кишку, а участок, лежащий каудальнее желточного стебелька, — в толстую кишку. Средняя кишка удлиняется, часть ее выпячивается в полость брюшного стебелька, образуя грыжеподобное выпячивание брюшной стенки зародыша.
За это же время некоторые участки кишки, вращаясь, изменяют свое положение. К 10-й неделе выступающая часть кишечной петли втягивается назад через пупочный ободок, занимая свое окончательное положение в брюшной полости. Несколько ранее в месте перехода тонкой кишки в толстую развивается слепая кишка. Сначала она увеличивается в размере, но к 3-му месяцу ее дистальная часть начинает отставать от роста других частей (неравномерность роста), в результате чего диаметр этой части оказывается значительно меньшим и образуется червеобразный отросток. Из задней кишки формируется толстая кишка ниже селезеночного угла, в том числе прямая. Развитие клоакального конца задней кишки тесно связано с развитием мочеполового отверстия (рис. 7.27 и 8.4). Уроректальная перегородка, разделяющая клоаку на мочеполовой синус и прямую кишку, образуется на 5—6-й неделе. Прорыв анальной мембраны происходит на 8-й неделе.
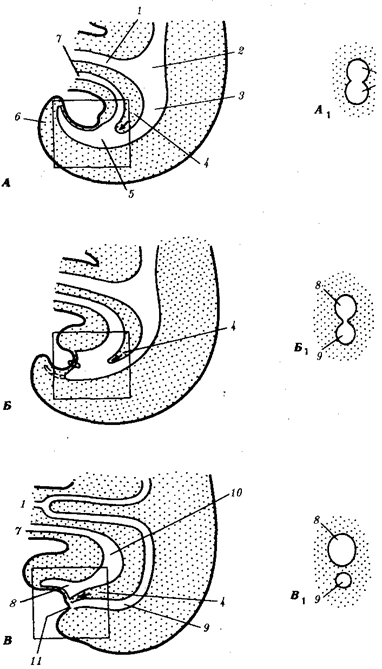
Рис. 7.27. Развитие клоакальной области задней кишки у зародыша человека. А—на 4-й неделе; Б—
на 6-й неделе; В—
на 7-й неделе; А
1
, Б
1
и В
1
—
поперечные срезы через клоаку (уровни среза обозначены квадратами на рис. А, Б, В
):
1—
желточный стебелек, 2—
средняя кишка, 3—
задняя кишка, 4—
мочеполовая перегородка, 5
—
клоака, 6—хвост, 7—аллантоис, 8—
мочеполовой синус, 9—
прямая кишка, 10—
мочевой пузырь, 11—анальная мембрана; стрелками показано направление роста мочеполовой перегородки
На 2-м месяце внутриутробного развития начинается быстрая пролиферация эпителия пищевода и двенадцатиперстной кишки, что приводит к временному закрытию их просвета. К концу 2-го месяца происходит реканализация названных органов, т.е. восстановление проходимости.
Нарушение скорости размножения или прекращение деления клеток в том или ином отделе, отсутствие гибели клеток, нарушение перемещения частей кишки и другие отклонения могут приводить к порокам развития пищеварительного тракта.
Сердце
человека начинает развиваться с конца 3-й —начала 4-й недели из спланхномезодермы в виде парных зачатков, расположенных под глоткой (рис. 7.28). По мере отграничения тела самого зародыша туловищными складками и замыкания передней кишки с брюшной стороны парные эндокардиальные трубки смыкаются в одну, лежащую по средней линии (рис. 7.28). Для земноводных доказано существование индукционного действия энтодермы на прекардиальную мезодерму. Об этом же свидетельствует опыт на курином зародыше, когда после удаления дна передней кишки был получен зародыш с двойным сердцем. Парные закладки целомических полостей сливаются на брюшной стороне, образуя перикардиальную полость.
Рис. 7.28. Развитие сердца человека на 21—22-е сутки:
А —
общий вид зародыша; Б —
продольный срез головного конуса зародыша;
В —
поперечный срез зародыша:
1
—уровень среза В, 2—
нервный валик, 3—
сомиты, 4—
первичная полоска, 5
—мозг, 6—
передняя кишка, 7—сердечная трубка, 8—
перикард, 9—
амнион, 10—
ротоглоточная мембрана, 11—
нервный желобок, 12—
хорда, 13—
парные закладки спинной аорты, 14—
сливающиеся сердечные трубки, 15—
желточный мешок
Региональная дифференцировка сердца начинается с быстрого удлинения первичной сердечной трубки, что приводит к ее изгибу и приобретению S-образной формы (рис. 7.29). Отмечено, что образование изгиба с локальными изменениями формы клеток вдоль сердечной трубки стимулируется из самой сердечной трубки. Будучи эксплантирована, сердечная трубка сохраняет способность к образованию S-образной структуры.
Рис. 7.29. Развивающееся сердце человека.
А—
на 21—22-е сутки; Б—
на 23-с сутки; В—
на 24-е сутки (вид с брюшной стороны); Г—
на 28-е сутки (продольный срез):
1
—первая пара дуг аорты, 2—
сливающиеся сердечные трубки, 3—
несливающиеся сердечные трубки, 4—
артериальный ствол, 5—
луковица сердца, 6—
желудочек, 7—предсердие, 8—
венозный синус, 9—кювьеров проток, 10—
пупочная вена, 11
—желточная вена, 12—
предсердно-желудочковый канал
На первоначально хвостовом конце находится венозный синус, в который впадают крупные вены: кювьеровы протоки, пупочные и желточные. Венозный синус позже войдет в состав правого предсердия. Краниальнее венозного синуса из расширенной части сердечной трубки образуется предсердие, а из изогнутой средней части — желудочек. Переходную область, где желудочек сужается, называют конусом или луковицей. Позже он будет включен в стенку правого желудочка. Конус переходит в артериальный ствол, от которого отходят корни брюшной аорты,
После образования предсердия и желудочка проявляются внешние признаки предстоящего разделения сердца на правую и левую половины, появляется срединная борозда. В этот момент в тканях формирующегося сердца отмечаются очаговая гибель клеток и взаимодействие внеклеточных и клеточных элементов. Некоторое время спустя на внутренней поверхности желудочка, соответственно уровню наружной борозды, образуется перегородка из мышечных тяжей, растущих от верхушки сердца по направлению к предсердию. На дорсальной и вентральной стенках суженного предсердно-желудочкового канала из рыхлой мезенхимы образуются эндокардиальные подушки. Позднее они трансформируются в плотную соединительную ткань, срастаются и разделяют канал на правый и левый протоки. В то же время появляется срединная перегородка, которая позднее заменяется вторичной. В ней имеется отверстие, называемое овальным, через которое кровь из правого предсердия попадает в левое. Это необходимо для кровообращения плода.
Одновременно с изменениями в основной части сердца происходит разделение артериального ствола на два канала. Этот процесс начинается в корне брюшной аорты между четвертой и шестой дугами. Разделение происходит за счет формирования продольных складок. Складки располагаются по спирали, растут внутрь артериального ствола и, встречаясь, делят его на аорту и легочный ствол. Кроме того, складки распространяются в сторону конуса, где из специализированных участков образуются полулунные клапаны аорты и легочного ствола, и далее в желудочки, где встречаются с перемещающейся эндокардиальной тканью предсердно-желудочкового канала и межпредсердной перегородки. Это приводит к полному зарастанию межжелудочкового отверстия.
До конца внутриутробной жизни остаются открытыми только клапан в овальном отверстии межпредсердной перегородки и артериальный (боталлов) проток, соединяющий легочный ствол с аортой. О нем подробнее будет сказано ниже. Артериальный проток служит для отведения части крови из правого желудочка в аорту минуя легкие, пока они не достигли необходимого развития и не получили функционального стимула в связи с началом дыхательной функции.
Крупные артерии
развиваются в комплексе с сердцем начиная с 4-й недели. Первичная система кровообращения эмбриона функционирует с конца 5-й недели, к концу 8-й недели реализуется основной план строения артериальной системы. Закладывающиеся на 4-й неделе парные висцеральные дуги получают соответствующее артериальное обеспечение в виде аортальных дуг. Эти дуги аорты поднимаются от артериального ствола, а точнее, от его расширенной части — артериального мешка (называемого также брюшной или восходящей аортой) — и заканчиваются в корнях спинной, или нисходящей, аорты.
Несмотря на то что закладывается шесть пар аортальных дуг, они не сосуществуют одновременно. В тот период, когда формируется шестая пара дуг, две первые пары уже дегенерируют. Источником первых двух пар аортальных дуг служат участки парных корней брюшной аорты (рис. 7.30). Уже не являясь крупными сосудами, они некоторое время существуют в виде небольших каналов, через которые происходит частичное кровоснабжение области рта и шеи из системы наружных сонных артерий (рис. 7.31). Пятая дуга появляется лишь на короткое время в виде рудиментарного сосуда. Таким образом, только корни брюшной и спинной аорты, а также третья, четвертая и шестая пары аортальных дуг играют существенную роль в формировании магистральных сосудов (рис. 7.32).
Проксимальные части третьей пары образуют общие сонные артерии. Левая четвертая дуга составляет часть дуги аорты. Правая четвертая дуга становится проксимальной частью правой подключичной артерии. Дистальная часть этой артерии образуется из правой спинной аорты. Проксимальная часть левой шестой дуги превращается в про-ксимальную часть левой легочной артерии, а дистальная часть — в артериальный (боталлов) проток. Проксимальная часть правой шестой дуги образует проксимальную часть правой легочной артерии, а дистальная часть редуцируется. Корни спинной аорты очень рано сливаются в непарную спинную аорту, но на 7-й неделе развития дистальная часть правого корня спинной аорты обычно включается в правую подключичную артерию, о чем уже было сказано выше. Это становится возможным благодаря обратному развитию участка, соединяющего правый корень с левым.
Рис. 7.30. Развитие сердечно-сосудистой системы у человека.
А—
на 21-е сутки (кратковременная стадия парных симметричных сосудов); Б—
на 26-е сутки; В —
на 37-е сутки (вид с левой стороны):
1—
желточные вены, 2—
сердечные трубки, 3—
передние кардинальные вены, 4—
спинные аорты, 5—
ножка тела, 6—
пупочные артерии, 7—третичная ворсина, 8—
хорион, 9—
пупочная вена, 10—
желточные артерии, 11
—первая, вторая и третья дуги аорты, 12—
пуповина, 13—
желточный мешок, 14—
сердце, 15—
мозг, 16—
третья, четвертая и шестая дуги аорты
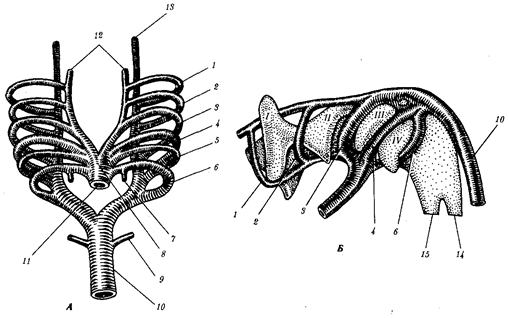
Рис. 7.31. Развитие аортальных дуг.
А
—вид с брюшной стороны; Б—
взаимоотношение аортальных дуг с глоточными карманами (вид слева):
1
—6—
аортальные дуги, 7—легочная артерия, 8—
артериальный мешок, брюшная аорта, 9—
седьмая межсегментарная артерия, подключичная, 10—
спинная нисходящая аорта, 11—
артериальный ствол, 12—
наружная сонная артерия, корень брюшной восходящей аорты, 13—
внутренняя сонная артерия, корень спинной аорты, 14—
пищевод, 15—
трахея; /—IV—
глоточные карманы
Рис. 7.32. Формирование крупнейших артерий, производных артериального ствола, аортального мешка, аортальных дуг и спинной аорты. А—
6-недельный зародыш; Б—
7-недельный зародыш; В—
6-месячный плод:
1
—6—
аортальные дуги, 7—артериальный ствол, 8
—
легочная артерия, 9—
подключичная артерия, 10—
спинная нисходящая аорта, 11
—аортальный мешок, 12—
внутренняя сонная артерия, 13—
артериальный (боталлов) проток, 14—
восходящая аорта, 15
—легочный ствол, 16—
наружная сонная артерия, 17—
общая сонная артерия
Более или менее подробное изложение развития сердца и крупных артерий дает богатый материал для сопоставлений онтогенеза человека с филогенетическим развитием позвоночных (см. га. 14), а также позволяет приблизиться к пониманию механизмов возникновения врожденных пороков развития сердца и сосудов.
В предыдущих главах были рассмотрены генетические закономерности, определяющие формирование определенного фенотипа, изложено основное содержание стадий онтогенеза, последовательно и закономерно сменяющих друг друга. Все эти сведения не дают, однако, ответа на вопрос, почему и каким образом генотип реализуется в фенотип в виде тех или иных клеточных и системных процессов, в виде сложных пространственных и упорядоченных во времени онтогенетических преобразований.
При сравнении зиготы и половозрелой особи, которые, по сути, являются двумя разными онтогенетическими стадиями существования одного и того же организма, обнаруживаются очевидные различия, касающиеся по крайней мере размеров и формы. Начиная с XVII в. ученые пытались познать и объяснить процессы, приводящие к этим количественным и качественным изменениям особи.
Первоначально возникла гипотеза, согласно которой онтогенез рассматривали лишь как рост расположенных в определенном пространственном порядке предсуществующих структур и частей будущего организма. В рамках этой гипотезы, получившей название преформизма,
каких-либо новообразований или преобразований структур в индивидуальном развитии не происходит. Логическое завершение идеи преформизма заключается в допущении абсурдной мысли о «заготовленности» в зиготе и даже в половых клетках прародителей структур организмов всех последующих поколений, как бы вложенных последовательно наподобие деревянных матрешек.
Альтернативная концепция эпигенеза
была сформулирована в середине XVIII в. Ф. К. Вольфом, впервые обнаружившим новообразование нервной трубки и кишечника в ходе эмбрионального развития. Индивидуальное развитие стали связывать целиком с качественными изменениями, полагая, что структуры и части организма возникают как новообразования из бесструктурной яйцеклетки.
В XIX в. К. Бэр впервые описал яйцо млекопитающих и человека, а также зародышевые листки и обнаружил сходство плана строения зародышей различных классов позвоночных — рыб, амфибий, рептилий, птиц, млекопитающих. Он же обратил внимание на преемственность в этапах развития — от более простого к более сложному. Бэр рассматривал онтогенез не как предобразование, не как новообразование структур, а как их преобразование, что вполне согласуется с современными представлениями.
Выяснение конкретных клеточных и системных механизмов таких преобразований составляет основную проблему современной биологии развития.
Увеличение массы тела особи, т.е. ее рост, и появление новых структур в ходе ее развития, называемое морфогенезом, нуждаются в объяснении. Рост и морфогенез подчиняются законам, которые обусловливают приуроченность конкретных процессов онтогенеза к определенному месту зародыша и периоду эмбриогенеза. Отдельные стадии индивидуального развития отличаются также определенной скоростью протекания с характерным качественным и количественным результатом.
Биология развития изучает способы генетического контроля индивидуального развития и особенности реализации генетической программы в фенотип в зависимости от условий. Под условиями понимают различные внутриуровневые и межуровневые процессы и взаимодействия: внутриклеточные, межклеточные, тканевые, внутриорганные, организменные, популяционные, экологические. Можно сказать, что усилия исследователей в области биологии развития концентрируются вокруг стержневой проблемы генетической предопределенности и лабильности онтогенетических процессов,
что в известном смысле на ином уровне познания возвращает нас к идеям неопреформизма и эпигенеза.
Не менее важными являются исследования конкретных онтогенетических механизмов роста и морфогенеэа. К ним относятся следующие процессы: пролиферация, или размножение клеток, миграция, или перемещение клеток, сортировка клеток, их запрограммированная гибель, дифференцировка клеток, контактные взаимодействия клеток (индукция и компетенция), дистантные взаимодействия клеток, тканей и органов (гуморальные и нервные механизмы интеграции). Все эти процессы носят избирательный характер, т.е. протекают в определенных пространственно-временных рамках с определенной интенсивностью, подчиняясь принципу целостности развивающегося организма. Биология развития стремится выяснить степень и конкретные пути контроля со стороны генома и одновременно уровень автономности различных процессов в ходе онтогенеза.
Деление клеток
играет большую роль в процессах онтогенеза. Во-первых, благодаря делению из зиготы, которая соответствует одноклеточной стадии развития, возникает многоклеточный организм. Во-вторых, пролиферация клеток, происходящая после стадии дробления, обеспечивает рост организма. В-третьих, избирательному размножению клеток принадлежит заметная роль в обеспечении морфогенетических процессов. В постнатальном периоде индивидуального развития благодаря клеточному делению осуществляется обновление многих тканей в процессе жизнедеятельности организма, а также восстановление утраченных органов, заживление ран.
Зигота, бластомеры и все соматические клетки организма, за исключением половых клеток, в периоде созревания гаметогенеза делятся митозом. Клеточное деление как таковое является одной из фаз клеточного цикла. От продолжительности интерфазы (G1
+ S + G2
-периоды) зависит частота последовательных делений в ряду клеточных поколений. В свою очередь интерфаза имеет разную продолжительность в зависимости от стадии развития зародыша, локализации и функции клеток.
Так, в периоде дробления эмбриогенеза клетки делятся быстрее, чем в другие, более поздние периоды. Во время гаструляции и органогенеза клетки делятся избирательно в определенных областях зародыша. Замечено, что там, где скорость клеточного деления высокая, происходят и качественные изменения в структуре эмбриональной закладки, т.е. органогенетические процессы сопровождаются активным размножением клеток. Показано, что растяжение клеток при их движении стимулирует клеточное деление. В сформировавшемся организме некоторые клетки, например нейроны, вообще не делятся, в то время как в кроветворной и эпителиальной тканях продолжается активное размножение клеток. Клетки некоторых органов взрослого организма в обычных условиях почти не делятся (печень, почка), но при наличии стимула в виде воздействия гормональных или внутритканевых факторов, часть из них может вступить в деление.
При изучении расположения делящихся клеток в тканях обнаружено, что они группируются гнездами. Само по себе деление клеток не придает эмбриональному зачатку определенной формы, и нередко эти клетки располагаются беспорядочно, но в результате последующего их перераспределения и миграции зачаток приобретает форму. Так, например, в зачатке головного мозга деление клеток сосредоточено исключительно в том слое стенки, который прилежит к полости невроцеля. Затем клетки передвигаются из зоны размножения к наружной стороне пласта и образуют ряд выпячиваний, так называемых мозговых пузырей. Таким образом, клеточное деление в эмбриогенезе носит избирательный и закономерный характер. Об этом же свидетельствует открытая в 60-х годах суточная периодичность количества делящихся клеток в обновляющихся тканях.
В настоящее время известен ряд веществ, которые побуждают клетки к делению, например фитогемагглютинин,
некоторые гормоны, а также комплекс веществ, выделяющихся при повреждении тканей. Открыты также и тканеспецифичные ингибиторы
клеточного деления — кейлоны.
Их действие заключается в подавлении или замедлении скорости деления клеток в тех тканях, которые их вырабатывают. Например, эпидермальные кейлоны действуют только на эпидермис. Будучи тканеспецифичными, кейлоны лишены видовой специфичности. Так, эпидермальный кейлон трески действует и на эпидермис млекопитающего.
За последние годы установлено, что многие структуры зародыша образуются клетками, происходящими от небольшого числа или даже одной клетки. Совокупность клеток, являющихся потомками одной родоначальной клетки, называют клоном.
Показано, например, что большие по объему участки центральной нервной системы формируются из определенных клеток раннего зародыша. Пока не ясно, в какой именно срок происходит отбор родоначальных клеток,
каков механизм этого отбора. Важным следствием такой селекции является то, что многим клеткам раннего зародыша не суждено участвовать в дальнейшем развитии. В опытах на мышах показано, что организм развивается всего из трех клеток внутренней клеточной массы на стадии, когда бластоциста состоит из 64 клеток, а сама внутренняя клеточная масса содержит примерно 15 клеток. Клональные клетки могут быть причиной мозаицизма, когда большие группы клеток отличаются по набору хромосом или аллельному составу.
По-видимому, количество циклов клеточных делений в ходе онтогенеза генетически предопределено. Вместе с тем известна мутация, изменяющая размеры организма за счет одного дополнительного клеточного деления. Это мутация gt (giant), описанная у Drosophila melanogaster.
Она наследуется по рецессивному сцепленному с полом типу. У мутантов gt развитие протекает нормально на протяжении всего эмбрионального периода. Однако в тот момент, когда нормальные особи окукливаются и начинают метаморфоз, особи gt продолжают оставаться в личиночном состоянии еще дополнительно 2—5 сут. За это время у них происходит одно, а может быть, и два дополнительных деления в имагинальных дисках, от количества клеток которых зависит размер будущей взрослой особи. Затем мутанты образуют куколку вдвое крупнее обычной. После метаморфоза несколько удлиненной по времени стадии куколки на свет появляется морфологически нормальная взрослая особь удвоенного размера.
У мышей описан ряд мутаций, обусловливающих снижение пролиферативной активности и следующие за этим фенотипические эффекты. К ним относят, например, мутацию or (ocular retardation), затрагивающую сетчатку глаза начиная с 10-х суток эмбрионального развития и приводящую к микрофтальмии (уменьшению размеров глазных яблок), и мутацию tgia, затрагивающую центральную нервную систему с 5—6-х суток после рождения и приводящую к отставанию роста и атрофии некоторых внутренних органов.
Таким образом, деление клеток является чрезвычайно важным процессом в онтогенетическом развитии. Оно протекает с разной интенсивностью в разное время и в разных местах, носит клональный характер и подвержено генетическому контролю. Все это характеризует клеточное деление как сложнейшую функцию целостного организма, подчиняющегося регулирующим влияниям на различных уровнях: генетическом, тканевом, онтогенетическом.
Миграции клеток,
или клеточные перемещения, наряду с другими клеточными процессами имеют очень большое значение, начиная с процесса гаструляции и далее, в процессах морфогенеза. Клетки мезенхимного типа мигрируют одиночно и группами, а клетки эпителиев обычно согласованно, пластом. Мезенхима — это скопление веретеновидных или звездчатых клеток, погруженных в межклеточный матрикс. Эпителий — группы клеток, плотно прилежащих друг к другу боковыми стенками и имеющих апикальную и базальную поверхности. Как мезенхима, так и эпителии могут быть образованы из любого из трех зародышевых листков. Клетки мезенхимного типа наиболее подвижны, так как не образуют между собой стойких контактов.
Наиболее яркий пример миграции мезенхимных клеток связан с нервным гребнем. При смыкании нервной трубки клетки нервных валиков выходят из ее состава и располагаются между ее дорсальной частью и эктодермой (см. рис. 7.9).
Рис. 8.1. Пути миграции клеток нервного гребня:
а—
поперечный срез зародыша, б—
производные клеток нервного гребня у взрослого организма; 1
—нервный гребень, 2—
узел спинного корешка, 3—
пигментные клетки, 4—
симпатический узел, 5—
развивающийся надпочечник, 6—
нервное сплетение в стенке кишки, 7— клетка шванновской оболочки, 8
—униполярный чувствительный нейрон, 9—
клетка-спутник, 10
—мультиполярный нейрон симпатического узла, 11
—хромаффинная клетка в мозговом веществе надпочечника, 12—
превертебральное сплетение, 13—
парасимпатическое сплетение в кишке; стрелками показано направление миграции клеток нервного гребня
Затем они мигрируют в разных направлениях, проявляя очень широкие формообразовательные потенции. Группа клеток нервного гребня в туловищной части зародыша мигрирует в эктодерму и там превращается в первичные пигментные клетки — меланоциты. Другие, двигаясь в центральном направлении, образуют нейроны спинальных ганглиев, еще дальше — ганглиев симпатической и парасимпатической систем. Третьи — превращаются в клетки шванновских оболочек нервов, четвертые — в хромаффинные клетки мозгового вещества надпочечников. Схематическое изображение этих миграций показано на рис. 8.1. Вообще клетки нервного гребня туловищного отдела дифференцируются в зависимости от того, куда попадут.
Клетки нервного гребня в головной части зародыша мигрируют в сторону лица, превращаясь в хрящевые, мышечные, соединительнотканные. Они строят хрящи висцерального скелета, мышцы кожи, соединительную ткань лица, языка и нижней челюсти, входят в состав аденогипофиза, паращитовидных желез и мякоти зуба. Если клетки головного отдела нервного гребня пересадить в туловищную область, то они все равно дифференцируются затем в хрящевые, мышечные и соединительнотканные. Еще одним убедительным примером выраженных миграций является перемещение первичных половых клеток из желточной энтодермы в зачаток половой железы.
Нарушение,
миграции клеток в ходе эмбриогенеза приводит к недоразвитию органов
или к их гетеротопиям,
изменениям нормальной локализации. То и другое представляет собой врожденные пороки развития. Примеры пороков развития, связанных с нарушениями миграции клеток, известны, в частности, в отношении конечного мозга. Если нарушается миграция нейробластов, то возникают островки серого вещества в белом веществе, при этом клетки утрачивают способность к дифференцировке. Более выраженные изменения миграции приводят к микрогирии и полигирии (большое число мелких и аномально расположенных извилин больших полушарий), либо, наоборот, к макрогирии (утолщение основных извилин), либо к агирии (гладкий мозг, отсутствие извилин и борозд больших полушарий). Все эти изменения сопровождаются нарушением цитоархитектоники и послойного строения коры, гетеротопиями нервных клеток в белом веществе. Подобные пороки развития отмечены и в мозжечке.
Существуют гипотезы о дистантных
воздействиях на клетки на основе хемотаксиса и о контактных
воздействиях. Мезенхимные клетки способны к амебоидным движениям. Движение их по типу хемотаксиса показано для некоторых видов специализированных клеток (гоноциты, сперматозоиды, некоторые клетки крови). Для эмбриональных клеток многоклеточных животных достоверных случаев хемотаксиса не обнаружено. Контактные взаимодействия более распространены. Они представляют собой взаимодействие клеток со структурированным субстратом. Клетки ощущают микроструктуру субстрата и движутся вдоль волокон, как это происходит при помещении фибробластов на каплю кровяной плазмы, натянутой в виде пленки между сторонами стеклянного треугольника. На неструктурированной подложке, например на ненатянутой пленке, фибробласты перемещаются беспорядочно.
Хорошо известно также, что нервные волокна проходят часто длинный путь по различным тканям от нервного центра к рецептору или эффектору и «узнают» их. Скорее всего нервные окончания растут по микроструктурам субстрата, как они делают это и в культуре тканей. Субстратом для движения может быть и соседняя клетка, если оболочка ее натянута. А так как поверхность направленно движущейся клетки сама вытягивается, то и она может служить субстратом для движения и поляризации следующей за ней клетки.
Рис. 8.2. Перемещение клеточных пластов.
А —
путем выпячивания на примере образования глазного пузырька; Б—
путем впячивания на примере образования слухового пузырька:
а —
стенка переднего мозга, б —
местное ускорение роста, в
— выпячивание, г —
глазной пузырек, д—ж —
углубление ямки, з —
отшнуровывание пузырька
Согласованные перемещения пластов эпителиальных клеток также изучаются. К ним относятся изгибы клеточных пластов путем выпячивания или впячивания, отшнуровка, образование утолщений — плакод (рис. 8.2).
Таким, образом, несомненно, что для миграции клеток очень важны их способность к амебоидному движению и свойства клеточных мембран. И то, и другое генетически детерминировано, так что и сама миграция клеток находится под генетическим контролем, с одной стороны, и влияниями окружающих клеток и тканей — с другой.
В процессе эмбриогенеза клетки не только активно перемешаются, но и «узнают»
друг друга, т.е. образуют скопления
и пласты
только с определенными клетками. Значительные координированные перемещения клеток характерны для периода гаструляции. Смысл этих перемещений заключается в образовании обособленных друг от друга зародышевых листков с совершенно определенным взаимным расположением. Клетки как бы сортируются в зависимости от свойств, т.е. избирательно.
Замечено, что необходимым условием сортировки являются степень подвижности клеток иособенности их мембран. В поздней бластуле амфибий, например, клетки будущей эктодермы обладают тенденцией слипаться друг с другом и распространяться в виде сплошного слоя над мезодермой и энтодермой. Эта тенденция проявляется и в культуре тканей. Клетки мезодермы имеют тенденцию впячиваться в любой находящийся поблизости комок клеток, а клетки энтодермы относительно неподвижны.
Эти особенности трудно объяснить, если наблюдать только за нормальным течением развития. Впервые на различия в подвижности и способности к слипанию (адгезии
) между клетками, относящимися к разным зародышевым листкам, обратил внимание Г. Гольтфретер в 30-х гг. XX столетия. Затем производили модификации его опытов с самыми разными клетками. Смысл этих опытов состоит в том, что зародыши тритонов или других животных на стадии гаструлы диссо-циируют с помощью фермента трипсина, который разрушает материал, соединяющий клетки друг с другом. Диссоциированные (дезагрегированные) клетки тщательно перемешивают и затем создают такие условия, чтобы клетки могли свободно перемещаться и воссоединяться друг с другом. Сначала клетки представляют собой беспорядочную смесь, затем клетки эктодермы, мезодермы и энтодермы разделяются (сегрегируют) и собираются в отдельные группы, каждая из которых представляет собой клеточный агрегат из однородных клеток. Образуются снова зародышевые листки, располагающиеся иногда даже в обычном для них порядке (рис. 8.3).

Рис. 8.3. Адгезия клеток зародышевых листков:
а
—смесь диссоциированных клеток гаструлы амфибий, б
—клетки эктодермы, мезодермы и энтодермы, группирующиеся послойно путем адгезии
Подобную агрегацию клеток зародышевого листка с себе подобными можно объяснить способностью к избирательному слипанию клеток одного типа между собой. Одновременно это является проявлением ранней дифференцировки клеток на стадии гаструлы.
Существует ряд гипотез, объясняющих избирательную сортировку клеток. Возможно, что контакты между подобными клетками сильнее, чем между чужеродными клетками, из-за различий в поверхностном заряде их мембран. Обнаружено, что поверхностный заряд клеток мезодермы ниже, чем клеток экю- или энтодермы, благодаря чему клетки мезодермы легче деформируются и втягиваются в бластопор в начале гаструляции. По другой гипотезе, контактные взаимодействия между одинаковыми клетками основываются на антигенных свойствах их мембран.
Избирательная адгезия клеток определенного зародышевого листка друг с другом является необходимым условием нормального развития. Это показано путем сопоставления двух процессов: течения гаструляции в естественных условиях и способности клеток определенного зародышевого листка агрегировать в комплекс с себе подобными. Показано, что если у межвидовых гибридов зародышей амфибий нарушена гаструляция, то диссоциированные в опыте клетки зародышевых листков таких гибридов не способны к агрегации с себе подобными, если же в некоторых случаях гибридам удавалось образовать гаструлу, то и в эксперименте диссоциированные клетки зародышевых листков были способны к реагрегации. По-видимому, в обеспечении сортировки клеток важное место принадлежит генетическим механизмам.
Одним из примером потери клетками способности к избирательной сортировке и слипанию является их беспорядочное поведение в злокачественной опухоли.
Таким образом, сортировка клеток и их избирательная адгезия наряду с другими клеточными процессами играет важную роль в морфогенезе развивающегося зародыша и одновременно подвержена многоуровневым регуляционным воздействиям
(генетическим, межклеточным, онтогенетическим
), отражая целостность организма как системы.
В развитии зародышей наряду с размножением клеток важную роль играют процессы гибели клеток.
В настоящее время различают два принципиально различных типа клеточной гибели: апоптоз
(в переводе с греческого «отпадающий») и некроз.
Апоптоз
широко распространен и типичен для физиологических условий. Наряду с описанными выше делением, сортировкой и миграцией клеток, он способствует достижению характерных для определенного биологического вида черт его морфофункциональной организации. Следовательно, апоптоз является естественным, эволюционно обусловленным и генетически контролируемым механизмом морфогенеза. Некроз
клеток возникает в нефизиологических условиях, например, в связи с действием неблагоприятных факторов, таких, как стойкое кислородное голодание, разного рода токсины и другие. Некроз обычно сопровождается воспалением и является патологическим процессом. Указанные воззрения в отношении апоптоза и некроза сформировались за последние три десятилетия и поэтому еще нередко некоторые физиологические процессы клеточной гибели описываются термином «некроз» вместо термина «апоптоз».
Наиболее яркие примеры разрушения клеток и органов относятся к постэмбриональным стадиям метаморфоза земноводных и насекомых. У головастиков резорбируются (рассасываются) хвост, кишечник и жаберные крышки, у личинок насекомых разрушается большинство внутренних органов. В ходе эмбрионального развития высших позвоночных и человека также имеют место процессы дегенерации органов, которые вначале закладываются, а затем исчезают. У особей женского пола дегенерируют вольфовы протоки, у особей мужского пола—мюллеровы протоки, что является, по-видимому, результатом влияния половых гормонов. У эмбриона человека вначале закладываются ребра у 7-го шейного позвонка и 9—10 хвостовых позвонков, затем они обычно исчезают, так что шейные позвонки, как правило, ребер не несут и в копчике остается 4—5 позвонков (рис. 8.4).
Рис. 8.4. Область клоаки и хвоста у зародышей человека.
А —
в конце 4-й недели; Б—
на 8-й неделе: 1—
ректальная область клоаки, 2—
уроректальная складка, 3—
область мочеполового синуса в клоаке, 4—
хорда, 5—
нервная трубка, 6—
половой бугорок, 7—аллантоис, 8—
желточный стебелек, 9—
прямая кишка, 10—
уроректальная перегородка, 11
—мочеполовой синус, 12—
мочевой пузырь
Немалое значение принадлежит процессам гибели клеток при образовании полостей тела или сосудов (так называемая кавитация), имеющих вначале вид тяжей без просвета.
В центральной нервной системе сначала образуется больше нервных клеток, чем затем сохраняется, так как часть нейронов, не установивших связи со своими мишенями, погибает.
Наиболее изучены процессы гибели клеток при образовании дефинитивной формы конечностей птиц и млекопитающих. У цыпленка почки конечностей закладываются в виде боковых утолщений соматоплевры примерно на 55-м часу развития. Они вырастают из тела зародыша в виде выступов, покрытых эктодермой и заполненных мезодермальной тканью. По мере их роста начинают проступать контуры конечностей. Процесс формирования контуров сопровождается отмиранием клеток в ряде мезодермальных участков почки конечности. Участки будущей гибели клеток выявлены с помощью прижизненных красителей.
Так называемая задняя некротическая зона (ЗНЗ) обеспечивает формирование контуров проксимальных областей конечностей. Максимальной протяженности ЗНЗ достигает к 96-му часу развития. К этому времени гибнет 1500—2000 клеток, поглощаемых примерно 150 макрофагами. Другие клетки мезодермы, примыкающие к зоне некроза, не погибают. Группа клеток будущей ЗНЗ, пересаженная со своего местонахождения на боковую поверхность тела зародыша за 40 ч до начала ожидаемого некроза, все равно погибает в те же сроки, что и на своем обычном месте. В данном примере проявляется генетическая запрограммированность гибели определенных клеток, которую можно образно назвать «внутренними часами смерти».
Если клетки ЗНЗ пересадить на дорсальную поверхность почки крыла, то ее клетки не погибнут. Следовательно, некоторые другие клетки способны предотвратить гибель клеток ЗНЗ. Такой способностью обладают клетки мезодермы из дорсальной ненекротической области крыла. Показано, что контакт клеток ЗНЗ с «защищающими» их от гибели клетками дорсальной мезодермы крыла должен продолжаться не менее 6 сут., после чего они могут уже продолжать существование и без контакта с этими клетками. Таким образом, гибель клеток контролируется не только генетически, но и на уровне клеточных взаимодействий. Очевидно, что в описанных событиях мы наблюдаем апоптоз, несмотря на сохранение в названиях гибнущих зонах — «некротические».
Интересно сравнение влияния условий на процессы гибели клеток в дистальной части лапок у цыпленка и утенка. Как известно, у утят гибель клеток в дистальной части лапки невелика, вследствие чего у них между вторым, третьим и четвертым пальцами образуются перепонки. Когда создавали химеры, соединяя мезодерму из почки ноги утки с эктодермой цыпленка и наоборот, подсаживая затем химерные почки конечностей на боковую поверхность куриного зародыша, в обоих случаях получали развитие по типу утиной конечности, т.е. с перепонкой между пальцами (рис. 8.5).
Рис. 8.5. Развитие задней конечности цыпленка (А
) и утенка (Б
);
мутация talpid (В
) и опыты по пересадке мезодермы и эктодермы в почках конечностей {Г
):
1—
мезодерма почки конечности, 2—апикальный эктодермальный гребень, 3—
участки некроза между пальцами у зародыша цыпленка, 4—
химерные почки конечностей, 5—
мезодерма утки, 6—
эктодерма цыпленка, 7—мезодерма цыпленка, 8—
эктодерма утки
Таким образом, мезодерма цыпленка, обладая способностью к гибели при нормальном развитии, в присутствии эктодермы утки не погибает, т.е. изменяет свои свойства. Приведенный опыт подтверждает значение межклеточных регуляторных механизмов в развитии.
Генетический контроль клеточной гибели прослеживается также на примере мутаций. Анализ мутации под названием ta (talpid) у цыпленка показывает, что в конечности отсутствуют передняя и задняя некротические зоны, в результате чего не происходит формирования контуров, сужающих конечность, и лапка получается очень широкой. Кроме того, у таких мутантов отсутствует область апоптоза под названием темного пятна, в результате чего не происходит разделения большой и малой берцовых костей. Неразделение костей голени и отсутствие их сужения сочетаются с костной полидактилией (многопалостью) и синдактилией (сращением) мягких тканей в ноге. Конечность имеет широкий и веслообразный вид с 6—7 пальцами. Это аутосомно-рецессивная мутация. Аналогичные пороки описаны у человека.
Существуют также мутации, расширяющие зоны апоптоза. У дрозофилы мутация Bar сильно уменьшает глаза, а мутация vestigial уменьшает крылья за счет увеличения участков гибели клеток. Описаны подобные мутации и у кур.
Новейшим примером генетического контроля апоптоза является открытие гена р53. Белок, контролируемый этим геном, обладает способностью при определенных условиях блокировать клеточное деление и запускать механизм апоптоза. Мутационные изменения и дефектность функции этого гена или регулирующих его активность нуклеотидных последовательностей ДИК встречаются в опухолевых клетках и обнаружены, по данным разных исследователей, у 55—70% раковых больных.
Таким образом очевидно, что избирательная гибель клеток, не менее важна для морфогенеза, чем другие клеточные процессы. 'Различные тонкие по замыслу опыты позволяют установить, что гибель клеток имеет три уровня регуляции: генетический контроль, межклеточные взаимодействия и организменный уровень.
Дифференцировка —
это процесс, в результате которого клетка становится специализированной, т.е. приобретает химические, морфологические и функциональные особенности. В самом узком смысле это изменения, происходящие в клетке на протяжении одного, нередко терминального, клеточного цикла, когда начинается синтез главных, специфических для данного клеточного типа, функциональных белков. Примером может служить Дифференцировка клеток эпидермиса кожи человека, при которой в клетках, перемещающихся из базального в шиповатый и затем последовательно в другие, более поверхностные слои, происходит накопление кератогиалина, превращающегося в клетках блестящего слоя в элеидин, а затем в роговом слое — в кератин. При этом изменяются форма клеток, строение клеточных мембран и набор органоидов. На самом деле дифференцируется не одна клетка, а группа сходных клеток. Примеров можно привести множество, так как в организме человека насчитывают порядка 220 различных типов клеток. Фибробласты синтезируют коллаген, миобласты — миозин, клетки эпителия пищеварительного тракта — пепсин и трипсин. 338
В более широком смысле под дифференцировкой
понимают постепенное (на протяжении нескольких клеточных циклов) возникновение все больших различий и направлений специализации между клетками, происшедшими из более или менее однородных клеток одного исходного зачатка. Этот процесс непременно сопровождают морфогенетические преобразования, т.е. возникновение и дальнейшее развитие зачатков определенных органов в дефинитивные органы. Первые химические и морфогенетические различия между клетками, обусловливаемые самим ходом эмбриогенеза, обнаруживаются в период гаструляции.
Зародышевые листки и их производные являются примером ранней дифференцировки, приводящей к ограничению потенций клеток зародыша. На схеме 8.1 представлен пример дифференцировки мезодермы (по В. В. Яглову, в упрощенном виде).
Схема 8.1. Дифференцировка мезодермы
Можно выделить целый ряд признаков, которые характеризуют степень дифференцированности клеток. Так, для недифференцированного состояния характерны относительно крупное ядро и высокое ядерно-цитоплазматическое отношение Vядра
/Vцитоплазмы
(V—
объем), диспергированный хроматин и хорошо выраженное ядрышко, многочисленные рибосомы и интенсивный синтез РНК, высокая митотическая активность и неспецифический метаболизм. Все эти признаки изменяются в процессе дифференцировки, характеризуя приобретение клеткой специализации.
Процесс, в результате которого отдельные ткани в ходе дифференцировки приобретают характерный для них вид, называют гистогенезом.
Дифференцировка клеток, гистогенез и органогенез совершаются в совокупности, причем в определенных участках зародыша и в определенное время. Это очень важно, потому что указывает на координированность и интегрированность эмбрионального развития.
В то же время удивительно, что, в сущности, с момента одноклеточной стадии (зиготы) развитие из нее организма определенного вида уже жестко предопределено. Всем известно, что из яйца птицы развивается птица, а из яйца лягушки —лягушка. Правда, фенотипы организмов всегда различаются и могут быть нарушены до степени гибели или возникновения порока развития, а нередко могут быть даже как бы искусственно сконструированы, например у химерных животных.
Требуется понять, каким образом клетки, обладающие чаще всего одинаковыми кариотипом и генотипом, дифференцируются и участвуют в гисто- и органогенезе в необходимых местах и в определенные сроки соответственно целостному «образу» данного вида организмов. Осторожность при выдвижении положения о том, что наследственный материал всех соматических клеток абсолютно идентичен, отражает объективную реальность и историческую неоднозначность в трактовке причин клеточной дифференцировки.
В. Вейсман выдвинул гипотезу о том, что только линия половых клеток несет в себе и передает потомкам всю информацию своего генома, а соматические клетки могут отличаться от зиготы и друг от друга количеством наследственного материала и поэтому дифференцироваться в разных направлениях. Ниже приведены факты, подтверждающие возможность изменения наследственного материала в соматических клетках, но их надо трактовать как исключения из правил.
Вейсман опирался на данные о том, что в ходе первых делений дробления яиц лошадиной аскариды происходит отбрасывание (элиминация) части хромосом в соматических клетках эмбриона. В дальнейшем было показано, что отбрасываемая ДНК содержит главным образом часто повторяющиеся последовательности, т.е. фактически не несущие информации.
Развитие представлений о механизмах цитодифференцировки изображено на схеме 8.2.

Позже были обнаружены и другие примеры изменения количества наследственного материала в соматических клетках как на геномном, так и на хромосомном и генном уровнях. Описаны случаи элиминации целых хромосом у циклопа, комара и у одного из представителей сумчатых. У последних из соматических клеток самки элиминируется Х-хромосома, а из клеток самца — Y-хромосома. В результате соматические клетки у них содержат только по одной Х-хромосоме, а в линии половых клеток сохраняются нормальные кариотипы: XX или XY.
В политенных хромосомах слюнных желез двукрылых ДНК может синтезироваться несинхронно, например при политенизации гетерохроматиновые участки реплицируются меньшее число раз, чем эухроматиновые. Сам процесс политенизации, напротив, приводит к значительному увеличению количества ДНК в дифференцированных клетках по сравнению с родоначальными клетками.
Такой механизм репликации ДНК, как амплификация, также приводит к многократному увеличению количества некоторых генов в одних клетках по сравнению с другими. В овогенезе многократно увеличивается число рибосомальных генов, могут амплифицироваться и некоторые другие гены. Имеются данные о том, что в некоторых клетках в процессе дифференцировки происходит перестройка генов, например иммуноглобулиновых генов в лимфоцитах.
Однако в настоящее время общепризнанной является точка зрения, ведущая начало от Т. Моргана, который, опираясь на хромосомную теорию наследственности, предположил, что дифференцировка клеток в процессе онтогенеза является результатом последовательных реципрокных (взаимных) влияний цитоплазмы и меняющихся продуктов активности ядерных генов. Таким образом, впервые прозвучала идея о дифферециальной экспрессии генов
как основном механизме цитодифференцировки. В настоящее время собрано много доказательств того, что в большинстве случаев соматические клетки организмов несут полный диплоидный набор хромосом, а генетические потенции ядер соматических клеток могут сохраняться, т.е. гены не утрачивают потенциальной функциональной активности.
Сохранение полного хромосомного набора развивающегося организма обеспечивается прежде всего механизмом митоза (возможные случаи соматических мутаций, возникающих, как исключение, во внимание не принимаем). Проведенные цитогенетическим методом исследования кариотипов различных соматических клеток показали почти полную их идентичность. Цитофотометрическим способом установлено, что количество ДНК в них не уменьшается, а методом молекулярной гибридизации показано, что клетки разных тканей идентичны по нуклеотидным последовательностям. На этом основании цитогенетический метод применяют для диагностики хромосомных и геномных болезней человека (хотя ошибки методов достигают 5— 10%), а метод гибридизации ДНК —для идентификации личности и установления степени родства.
Помимо установленной количественной полноценности ДНК большинства соматических клеток большой интерес представляет вопрос о сохранении функциональных свойств содержащегося в них наследственного материала. Все ли гены сохраняют способность к реализации своей информации? О сохранении генетических потенций ядер можно судить по результатам опытов, проведенных над растениями и животными. Прошедшая длительный путь дифференцировки соматическая клетка моркови способна развиваться в полноценный организм (рис. 8.6). У животных отдельные соматические клетки после стадии бластулы, как правило, не способны развиваться в целый нормальный организм, но их ядра, будучи пересажены в цитоплазму овоцита или яйцеклетки, начинают вести себя соответственно той цитоплазме, в которой они оказались.
Опыты по пересадке ядер соматических клеток в яйцеклетку впервые были успешно осуществлены в 50-х гг. в США, а в 60—70-х гг. получили широкую известность опыты английского ученого Дж. Гердона. Используя африканскую шпорцевую лягушку Xenopus laevis,
он в небольшом проценте случаев получил развитие взрослой лягушки из энуклеированной яйцеклетки, в которую пересаживал ядро из эпителиальной клетки кожи лягушки или кишечника головастика, т.е. из дифференцированной клетки (см. рис. 5.3). Энуклеацию яйцеклетки проводили большими дозами ультрафиолетового облучения, что приводило к функциональному удалению ее ядра. Для доказательства того, что в развитии зародыша участвует пересаженное ядро соматической клетки, применили генетическое маркирование. Яйцеклетку брали из линии лягушек с двумя ядрышками в ядре (соответственно двум ядрышковым организаторам в двух гомологичных хромосомах), а ядро клетки донора — из линии, имеющей в ядрах только одно ядрышко вследствие гетерозиготности по делении ядрышкового организатора. Все ядра в клетках особи, полученной в результате трансплантации ядра, имели только одно ядрышко.
Вместе с тем опыты Гердона обнаружили многие другие важнейшие закономерности. Во-первых, они еще раз подтвердили предположение Т. Моргана о решающем значении взаимодействия цитоплазмы и ядра в жизнедеятельности клеток и развитии организма. Во-вторых, в многочисленных экспериментах было показано, что чем старше стадия зародыша-донора, из клеток которого брали ядро для пересадки, тем в меньшем проценте случаев развитие оказывалось полностью завершенным, т.е. достигало стадий головастика, а затем лягушки.
Рис. 8.6. Опыт, показывающий сохранение функциональных свойств наследственного материала в соматической дифференцированной клетке моркови:
1
—срез корня в питательной среде, 2—
профилирующие клетки в культуре, 3—
клетка, изолированная из культуры, 4—
ранний зародыш, 5—
более поздний зародыш, 6—
молодое растение, 7—взрослое растение
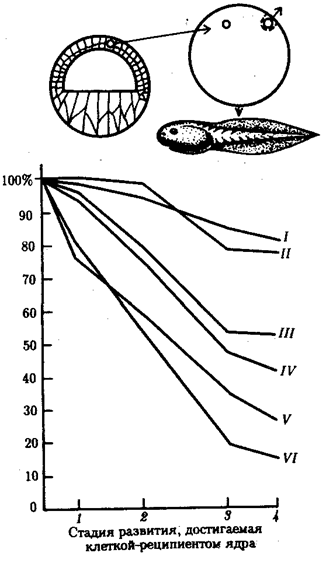
Рис. 8.7. Зависимость успеха пересадки ядер из дифференцированной клетки в яйцеклетку от возраста донора (I—VI) ядра: I
—бластула, II
—гаструла, III
—нейрула, IV—
появление мышечной реакции, V—
начало сердечной деятельности и вылупления, VI—
активное плавание; 1
—ранняя гаструла, 2—нейрула, 3—
плавающий головастик, 4—
питающийся головастик;
вверху изображена схема опыта
В большинстве случаев развитие останавливалось на более ранних стадиях. Зависимость результатов пересадки от стадии зародыша-донора ядер представлена на рис. 8.7. Анализ зародышей, останавливающихся в развитии после пересадки ядра, показал множество хромосомных аномалий в их ядрах. Другой причиной остановки развития считают неспособность ядер дифференцированных клеток к восстановлению синхронной репликации ДНК.
Главный вывод, который вытекает из этого опыта, заключается в том, что наследственный материал соматических клеток способен сохраняться полноценным не только в количественном, но и в функциональном отношении, цитодифференцировка не является следствием недостаточности наследственного материала.
Самым последним достижением в этой области является получение овечки Долли. Ученые не исключают возможности воспроизведения подобным же образом, т.е. путем пересадки ядер, генетических двойников человека. Следует однако отдавать себе отчет, что клонирование человека кроме научно-технологического имеет также этический и психологический аспекты.
Гипотеза дифференциальной экспрессии генов
в признак принимается в настоящее время в качестве основного механизма цитодифференцировки.
Общие принципы регуляции экспресии генов изложены в гл. 3.6.6. В данной главе делается попытка выяснить механизмы регуляции избирательной проявляемости генов в признак применительно к развивающемуся многоклеточному организму, у которого судьбы отдельных групп клеток неотрывны от пространственно-временных аспектов индивидуального развития. Уровни регуляции дифференциальной экспрессии генов соответствуют этапам реализации информации в направлении ген → полипептид → признак и включают не только внутриклеточные процессы, но тканевые и организменные.
Экспрессия гена в признак —
это сложный этапный процесс, который можно изучать разными методами: электронной и световой микроскопией, биохимически и другими. На схеме 8.3 приведены основные этапы экспрессии генов и методы, с помощью которых их можно изучать.
Схема 8.3
| Этапы экспресии генов
|
Методы их изучения
|
| Активность генов
Транскрипция, первичный РНК-транскрипт (ядерные РНК)
мРНК цитоплазмы
Трансляция (белки — продукты генной активности)
Морфологическая дифференцировка
Строение и жизнеспособность зародыша
|
Визуальное наблюдение строения соответствующих участков хромосомы (электронная и световая микроскопия)
Метод двумерного гельэлектрофореза
Биохимический метод
Биохимический метод
Цитологический метод, цитохимический метод
Гибридологический и сравнительно эмбриологический методы
|
Визуальное наблюдение в электронный микроскоп, как наиболее прямой подход к изучению уровня транскрипции, т.е. генной активности, проведено в отношении только отдельных генов — рибосомных, генов хромосом типа ламповых щеток и некоторых других (см. рис. 3.66). На элекгронограммах отчетливо видно, что одни гены транскрибируются активнее других. Хорошо различимы и неактивные гены.
Особое место занимает изучение политенных хромосом. Политенные хромосомы —
это гигантские хромосомы, обнаруживаемые в интерфазных клетках некоторых тканей у мух и других двукрылых. Такие хромосомы есть у них в клетках слюнных желез, мальпигиевых сосудов и средней кишки. Они содержат сотни нитей ДНК, которые редуплицировались, но не подверглись расхождению. При окраске в них выявляются четко выраженные поперечные полосы или диски (см. рис. 3.56). Многие отдельные полосы соответствуют местоположению отдельных генов. Ограниченное число определенных полос в некоторых дифференцированных клетках образует вздутия, или пуфы, выступающие за пределы хромосомы. Эти вздутые участки находятся там, где гены наиболее активны в отношении транскрипции. Было показано, что клетки разного типа содержат разные пуфы (см. рис. 3.65). Изменения в клетках, происходящие в ходе развития, коррелируют с изменениями в характере пуфов и синтезом определенного белка. Других примеров визуального наблюдения генной активности пока нет.
Все остальные этапы экспрессии генов являются результатом сложных видоизменений продуктов первичной генной активности. Под сложными изменениями подразумевают посттранскрипционные преобразования РНК, трансляцию и посттрансляционные процессы.
Имеются данные по изучению количества и качества РНК в ядре и цитоплазме клеток организмов, находящихся на разных стадиях эмбрионального развития, а также в клетках различных типов у взрослых особей. Обнаружено, что сложность и число различных видов ядерной РНК в 5—10 раз выше, чем мРНК. Ядерные РНК, которые представляют собой первичные продукты транскрипции, всегда длиннее, чем мРНК. Кроме того, ядерная РНК, изученная на морском еже, по количеству и качественному разнообразию идентична на различных стадиях развития особи, а мРНК цитоплазмы отличается.в клетках разных тканей. Это наблюдение приводит к мысли о том, что посттранскрипционные механизмы влияют на дифференциальную экспрессию генов.
Примеры посттранскрипционной регуляции экспрессии генов на уровне процессинга известны. Мембранно-связанная форма иммуноглобулина IgM у мышей отличается от растворимой формы дополнительной аминокислотной последовательностью, позволяющей мембранно-связанной форме «заякориваться» в клеточной мембране. Оба белка кодируются одним локусом, но процессинг первичного транскрипта протекает по-разному. Пептидный гормон кальцитонин у крыс представлен двумя разными белками, детерминированными одним геном. У них одинаковые первые 78 аминокислот (при общей длине 128 аминокислот), а различия обусловлены процессингом, т.е. опять наблюдается дифференциальная экспрессия одного и того же гена в различных тканях. Есть и другие примеры. Вероятно, альтернативный процессинг первичных транскриптов играет очень важную роль в дифференцировке, однако остается неясным его механизм.
Большая часть мРНК цитоплазмы одинакова по качественному составу в клетках, относящихся к различным стадиям онтогенеза. мРНК необходимы для обеспечения жизнедеятельности клеток и детерминируются генами «домашнего хозяйства», представленными в геноме в виде нескольких нуклеотидных последовательностей со средней частотой повторяемости. Продуктами их активности являются белки, необходимые для сборки клеточных мембран, различных субклеточных структур и т.д. Количество этих мРНК составляет примерно 9/10 от всех мРНК цитоплазмы. Остальные мРНК являются необходимыми для определенных стадий развития, а также различных типов клеток.
При изучении разнообразия мРНК в почках, печени и головном мозге мышей, в яйцеводах и печени кур было обнаружено около 12000 различных мРНК. Лишь 10—15% были специфичны для какой-либо одной ткани. Они считываются с уникальных нуклеотидных последовательностей тех структурных генов, действие которых специфично в данном месте и в данный момент и которые называются генами «роскоши». Количество их соответствует примерно 1000—2000 генов, ответственных за дифференцировку клеток.
Не все гены, имеющиеся в клетке, вообще реализуются до этапа образования мРНК цитоплазмы, но и эти образовавшиеся мРНК не все и не во всяких условиях реализуются в полипептиды и тем более в сложные признаки. Известно, что некоторые мРНК блокируются на уровне трансляции, будучи в составе рибонуклеопротеиновых частиц — информосом, вследствие чего происходит задержка трансляции. Это имеет место в овогенезе, в клетках хрусталика глаза.
В ряде случаев окончательная дифференцировка связана с «достройкой» молекул ферментов или гормонов или четвертичной структуры белка. Это уже посттрансляционные события. Например, фермент тирозиназа появляется у зародышей амфибий еще в раннем эмбриогенезе, но переходит в активную форму лишь после их вылупления.
Другим примером является дифференцировка клеток, при которой они приобретают способность реагировать на определенные вещества не сразу после синтеза соответствующего рецептора, а только в определенный момент. Показано, что мышечные волокна в своей мембране имеют рецепторы к медиаторному веществу ацетилхолину. Интересно, однако, что эти холинорецепторы обнаруживали внутри цитоплазмы клеток-миобластов до образования ими мышечных волокон, а чувствительность к ацетилхолину возникала только с момента встраивания рецепторов в плазматическую мембрану во время образования мышечных трубочек и мышечных волокон. Этот пример показывает, что экспрессия генов и тканевая дифференцировка могут регулироваться после трансляции в процессе межклеточных взаимодействий.
Таким образом, дифференцировка клеток не сводится только к синтезу специфических белков, поэтому применительно к многоклеточному организму эта проблема неотрывна от пространственно-временных аспектов и, следовательно, от еще более высоких уровней ее регуляции, нежели уровни регуляций биосинтеза белка на клеточном уровне. Дифференцировка всегда затрагивает группу клеток и соответствует задачам обеспечения целостности многоклеточного организма.
Эмбриональная индукция —
это взаимодействие частей развивающегося зародыша, при котором один участок зародыша влияет на судьбу другого участка. Явление эмбриональной индукции с начала XX в. изучает экспериментальная эмбриология.
Классическими считают опыты немецкого ученого Г. Шпемана и его сотрудников (1924) на зародышах амфибий. Для того чтобы иметь возможность проследить за судьбой клеток определенного участка зародыша, Шпеман использовал два вида тритонов: тритона гребенчатого, яйца которого лишены пигмента и потому имеют белый цвет, и тритона полосатого, яйца которого благодаря пигменту имеют желто-серый цвет.
Один из опытов заключается в следующем: кусочек зародыша из области дорсальной губы бластопора на стадии гаструлы тритона гребенчатого пересаживают на боковую или вентральную сторону гаструлы тритона полосатого (рис. 8.8). В месте пересадки происходит развитие нервной трубки, хорды и других органов. Развитие может достичь довольно продвинутых стадий с образованием дополнительного зародыша на боковой или вентральной стороне зародыша реципиента. Дополнительный зародыш содержит в основном клетки зародыша реципиента, но светлые клетки зародыша-донора тоже обнаруживаются в составе различных органов.
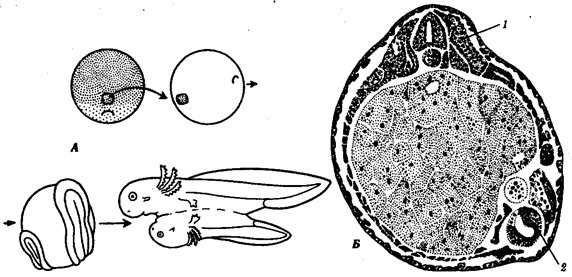
Рис. 8.8. Пересадка спинной губы от зародыша-донора на брюшную сторону зародыша-реципиента. А—
схема опыта; Б—
поперечный срез на стадии закладки двух комплексов осевых органов:
1
—первичный зародыш, 2—вторичный, индуцированный зародыш
Из этого и подобных опытов следует несколько выводов. Во-первых, участок, взятый из спинной губы бластопора, способен направлять или даже переключать развитие того материала, который находится вокруг него, на определенный путь развития. Он как бы организует, или индуцирует, развитие зародыша как в обычном, так и в нетипичном месте. Во-вторых, боковая и брюшная стороны гаструлы обладают более широкими потенциями к развитию, нежели их презумптивное (предполагаемое) проспективное направление, так как вместо обычной поверхности тела в условиях эксперимента там образуется целый зародыш. В-третьих, достаточно точное строение новообразованных органов в месте пересадки указывает на эмбриональную регуляцию. Это означает, что фактор целостности организма приводит к достижению хорошего конечного результата из нетипичных клеток в нетипичном месте, как бы управляя процессом, регулируя его в целях достижения этого результата.
Г. Шпеман назвал спинную губу бластопора первичным эмбриональным организатором.
Первичным потому, что на более ранних стадиях развития подобных влияний обнаружить не удавалось, а организатором потому, что влияние происходило именно на морфогенез. В настоящее время установлено, что главная роль в спинной губе бластопора принадлежит хордомезодермальному зачатку, который назвали первичным эмбриональным индуктором,
а само явление, при котором один участок зародыша влияет на судьбы другого,— эмбриональной индукцией.
В 30-е гг. исследователи пытались установить природу индуцирующего действия. Вскоре выяснилось, что разнообразные убитые ткани, вытяжки из самых различных тканей беспозвоночных и позвоночных животных, а также растений, несколько классов химических соединений (белки, нуклеопротеины, стероиды и даже неорганические вещества) могут вызывать индукцию. Таким образом была установлена химическая природа организаторов. Одновременно стало ясно, что специфичность ответа прямо не связана с. химическими свойствами индуктора.
Внимание эмбриологов переключилось на индуцируемые ткани. Оказалось, что специфичность
действия индуктора-раздражителя может быть весьма различной,
а сам эффект
индуцирующего воздействия ограничивается
способностью того или иного участка развивающегося зародыша воспринимать это воздействие и отвечать на него.
Некоторые индукторы, по-видимому, более или менее специфичны в определении судьбы индуцируемой ткани. Об этом свидетельствуют следующие опыты. Если пересадить спинную губу ранней гаструлы, то индуцируется развитие структур переднего мозга (головной индуктор), если же пересадить спинную губу поздней гаструлы, то развиваются спинной мозг и мезодермальные ткани (туловищный индуктор, рис. 8.9). Было показано также, что наиболее сильное нейрализующее влияние оказывает фракция нуклеопротеинов, а мезодермализующим индуктором оказался белок. Если имплантировать оба эти индуктора в виде смеси клеток или смеси веществ, то получаются хорошо развитые зародыши.

Рис. 8.9. Результаты пересадки головного (А
) и туловищного (Б
) индукторов Объяснение см. в тексте
Другие индукторы действуют как неспецифические пусковые механизмы, как бы высвобождая ответ, уже детерминированный в клетках индуцируемой ткани. Было показано, что, например, слуховой пузырек выступает не только в роли индуктора слухового аппарата, но и является активатором различных морфогенетических процессов. Будучи пересажен в область боковой линии эмбриона тритона, он влечет за собой индукцию конечности. Конечность можно индуцировать также пересадкой носовой плакоды или гипофиза. Легче всего добавочные конечности индуцируются в области боковой линии, но они могут быть получены и на брюшной стороне. Эти примеры указывают на то, что специфический ответ зависит не столько от индуктора, сколько отреагирующей области.
Способность эмбрионального материала реагировать на различного рода влияния изменением своей презумптивной судьбы получила название компетенции.
Установлено, например, что компетенция к образованию нервной системы у амфибий затрагивает всю эмбриональную эктодерму и возникает с момента начала гаструляции. К концу гаструляции эта компетенция прекращается. Таким образом, изменение хода развития возможно лишь в том случае, если область компетенции к образованию некоторой закладки шире, чем область, из которой она в норме развивается, а также если индукционное действие происходит в определенный интервал онтогенетического развития.
Изучение индукционных взаимодействий у разных представителей типа хордовых показало, что области и сроки компетенции неодинаковы. Так, у асцидий на стадии 8 бластомеров, когда уже все основные зачатки предопределены, проводили некоторые перемещения бластомеров. Материал хордомезодермы и основная часть нейрального материала у них локализованы в заднем вегетативном бластомере. Небольшая часть нейрального материала, формирующего головной ганглий, находится в заднем анимальном бластомере, расположенном над задним вегетативным (рис. 8.10).
Для проверки индукционных взаимодействий между ними анимальный ярус бластомеров поворачивали на 180° так, чтобы задний анимальный бластомер терял контакт с задним вегетативным. Головной ганглий не развился нигде. Это означает, что для развития головного ганглия необходимо индукционное влияние на задний анимальный бластомер со стороны заднего вегетативного. Кроме того, очевидно, что задний анимальный бластомер не обладает автономностью развития, но только он компетентен к восприятию воздействия со стороны заднего вегетативного бластомера, содержащего хордомезодермальный зачаток.
Рис. 8.10. Карта презумптивных зачатков у зародыша асцидий
на стадии восьми бластомеров:
1—
эпидермис, 2—
нервная пластинка, 3—
хорда, 4—
энтодерма, 5—
сомиты, 6—
мезенхима
Во всех других классах хордовых индукционные взаимодействия между хордомезодермальным и нейральным зачатками подобны таковым у амфибий. Полагают, что в ходе эволюции хордовых произошли расширение областей и удлинение срока компетенции. Это расценивают как признак существенного эволюционного прогресса.
Явления индукции многочисленны и разнообразны. Помимо первичной индукции со стороны спинной губы бластопора описаны индукционные влияния на более поздних, нежели гаструляция, этапах развития. Все они являются вторичными
и третичными,
представляя собой каскадные взаимодействия, типичные для дифференцировки, потому что индукция многих структур зависит от предшествующих индукционных событий. Примером вторичной
индукции может служить действие глазного бокала (выпячивание переднего мозга) на прилежащий покровный эпителий, под влиянием чего эпителий впячивается, а затем отшнуровывается хрусталиковый пузырек—зачаток глазного хрусталика (рис. 8.11). Расположенный над хрусталиком покровный эпителий тоже испытывает сложные изменения, теряет пигмент и становится роговичным эпителием. Это пример третичной
индукции. Таким образом получается, что глазной бокал возникает только после развития передней части головного мозга, хрусталик — после формирования бокала, а роговица — после образования хрусталика.
Вместе с тем индукция носит не только каскадный, но и переплетающийся характер, т.е. в индукции той или иной структуры может участвовать не одна, а несколько тканей. В свою очередь, такая структура может служить индуктором для нескольких других тканей. Например, глазной бокал служит главным, но не единственным индуктором хрусталика. Морфогенез всегда сопровождается значительными перемещениями тканей друг относительно друга. Так, презумптивный хрусталик, т.е. эпидермис, из которого в последующем должен развиться хрусталик, во время гаструляции лежит над энтодермой будущей глотки, которая служит первым индуктором хрусталика. Затем под этим эпидермисом оказывается сердечная мезодерма, которая тоже действует как индуктор. И только позднее, во время нейруляции на переднем конце нервной трубки выпячиваются глазные пузыри, образующие глазной бокал и сетчатку, являющуюся главным индуктором хрусталика (рис. 8.12).
Рис. 8.11. Развитие (А —Г
) глаза у хвостатой амфибии:
1
—хрусталиковая плакода, 2—
пигментный эпителий, 3—
сетчатка, 4
—роговица, 5—
хрусталиковые волокна, 6—хрусталиковый эпителий, 7—глазной бокал
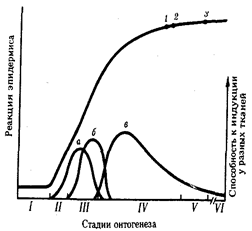
Рис. 8.12. Последовательные индукционные взаимодействия,
необходимые для образования хрусталика у зародыша амфибии:
I
—ранний зародыш, II
—гаструла, III—
нейрула, IV—
стадия хвостовой почки, V—
личинка, VI
—взрослая особь; 1
—плакода, 2—пузырек, 3—волокна, а
—энтодерма, б
—сердечная мезодерма, в
—сетчатка
Удаляя ту или иную из индуцирующих тканей, определили степень участия каждой из них в индукции хрусталика. Оказалось, что при удалении сетчатки глазного бокала у 42% зародышей амфибий все же формировались хрусталики и, следовательно, энтодерма и мезодерма в сумме обладают почти таким же индуцирующим действием, как и сетчатка глазного бокала. Полагают, что многочисленность индуцирующих тканей может иметь решающее значение для точного установления места формирования органа. Кроме того, сети индукции могут играть важную роль в канализации развития, обеспечивая нормальное течение органогенеза, даже если один из компонентов ин-
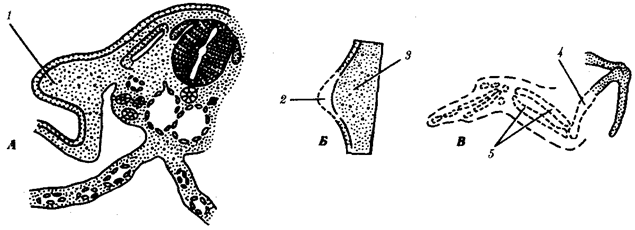
Рис. 8.13. Влияние удаления апикального эктодермального гребня
на развитие почки крыла.
А
—схема расположения почки крыла; Б—
почка крыла; В—
недоразвитие скелета (пунктир) после удаления апикального гребня:
1
—почка крыла, 2 —апикальный эктодермальный гребень, 3—
мезенхима, 4 —
плечевая кость, 5—
локтевая и лучевая кости
Чаще всего близлежащие участки зародыша оказывают взаимное влияние друг на друга. Демонстративным примером являются взаимодействия в зачатке конечности. Конечность развивается из скопления клеток, происходящих из боковой мезодермы, и покрывающих их клеток эктодермы (рис. 8.13). Развитие конечности начинается с активации клеток боковой мезодермы в непосредственной близости от сомитов, которые, возможно, и оказывают индуцирующие импульсы на мезодерму в области будущей конечности. Активированные мезодермальные клетки зачатка конечности влияют на покрывающую их эктодерму, в результате чего она утолщается. Образовавшееся утолщение эпидермиса на его верхушке называют апикальным эктодермальным гребнем. Последний стимулирует рост почки конечности (при удалении его рост почки конечности прекращается). Мезодерма же поддерживает гребень в активном состоянии и определяет форму конечности. Например, мезодерма из почки крыла при соединении с эктодермой почки ноги образует крыло, покрытое перьями, или мезодерма из почки конечности утиного зародыша с эктодермой куриного приводит к развитию перепончатой конечности.
Различают гетерономную
и гомономную
виды индукции. К гетерономной
относят случаи, подобные описанному, при которых один кусочек зародыша индуцирует иной орган (хордомезодерма индуцирует появление нервной трубки и всего зародыша в целом). Гомономная
индукция заключается в том, что индуктор побуждает окружающий материал к развитию в том же направлении, что и он сам. Например, область нефротома, пересаженная другому зародышу, способствует развитию окружающего материала в сторону формирования головной почки, а прибавление в культуру фибробластов сердца маленького кусочка хряща влечет за собой процесс образования хряща.
Чтобы воспринять действие индуктора, компетентная ткань
должна обладать хотя бы минимальной организацией. Одиночные клетки не воспринимают действие индуктора, а чем больше клеток в реагирующей ткани, тем активнее ее реакция. Для оказания индуцирующего действия иногда достаточно лишь одной клетки индуктора.
Индукционные взаимодействия могут проявляться в культуре ткани in vitro,
но по-настоящему полноценными они бывают только в структуре целостного организма.
Весьма интересны результаты опытов, помогающие оценить взаимосвязь индукционных взаимодействий с цитодифференцировкой и морфогенезом. Ранее уже было описано определяющее влияние мезенхимы на морфогенез конечностей позвоночных.
Многочисленными опытами показано также большое влияние мезенхимы на морфогенез желез эпителиального происхождения. Легочная энтодерма, например, при выращивании с печеночной мезенхимой приобретает строение печеночных балок, а эпителий молочной железы под влиянием мезенхимного зачатка слюнной железы приобретает морфологию слюнной железы. Это происходит как при выращивании in vitro,
так и при трансплантации в организм животного-реципиента. Подобные результаты с несомненностью указывают на необходимость индуцирующего влияния мезенхимы на морфогенез.
Однако не менее интересен факт, что морфогенез не всегда сопряжен с определенным направлением дифференцирован эпителия. Так, рекомбинантная слюнная железа, полученная из зачатка молочной железы и мезенхимы слюнной, при подсадке лактирующей самке-реципиенту начинает вырабатывать молоко несмотря на то, что имеет морфологию по типу слюнной железы. Это свидетельствует о возможности разобщения, об автономности процессов морфогенеза и цитодифференцировки и может быть объяснено более ранней детерминацией цитодифференцировки другими, более ранними актами индукции. Подобные наблюдения позволяют по-другому взглянуть на возможности преобразований морфогенезов в процессе эволюции.
Таким образом, явления индукции обнаружены на самых разных этапах развития многих позвоночных. В акте индукции следует различать два компонента: индуктор и реагирующую область. Изложенные выше положения кратко обобщены на схеме 8.4.
В настоящее время интенсивно ведутся работы по изучению молекулярных и клеточных механизмов индукции. В теоретическом смысле явление эмбриональной индукции помогает по-новому оценить взаимоотношение таких процессов, как зависимая дифференцировка и детерминация, а также цитодифференцировка и морфогенез. Понятия детерминации и морфогенеза более подробно рассматриваются в § 8.3.

Очевидно, что генетический контроль развития
существует, ибо как тогда понять, почему из яйца крокодила развивается крокодил, а из яйца человека — человек. Каким образом гены определяют процесс развития? Это центральный и очень сложный вопрос, к которому ученые начинают подходить, но для всеобъемлющего и убедительного ответа на него данных явно недостаточно. Главным приемом ученых, изучающих генетику индивидуального развития, является использование мутаций. Выявив мутации, изменяющие онтогенез, исследователь проводит сравнение фенотипов мутантных особей с нормальными. Это помогает понять, как данный ген влияет на нормальное развитие. С помощью многочисленных сложных и остроумных методов стараются определить время и место действия гена.
Анализ генетического контроля затрудняется несколькими моментами. Прежде всего тем, что роль генов неодинакова. Часть генома состоит из генов, определяющих так называемые жизненно важные функции и отвечающих, например, за синтез тРНК или ДНК-полимеразы, без которых невозможно функционирование ни одной клетки. Эти гены названы «house keeping» или генами «домашнего хозяйства». Другая часть генов непосредственно участвует в детерминации, дифференцировке и морфогенезе, т.е. функция их, по-видимому, более специфическая, ключевая.
Для анализа генетического контроля необходимо, кроме того, знать место первичного действия данного гена, т.е. следует различать случаи относительной,
или зависимой, плейотропии
от прямой,
или истинной, плейотропии.
В случае относительной плейотропии, как, например, при серповидно-клеточной анемии, существует одно первичное место действия мутантного гена — гемоглобин в эритроцитах, а все остальные наблюдаемые при ней симптомы, такие, как нарушение умственной и физической деятельности, сердечная недостаточность, местные нарушения кровообращения, увеличение и фиброз селезенки и многие другие, возникают как следствие аномального гемоглобина. При прямой плейотропии все разнообразные дефекты, возникающие в различных тканях или органах, вызываются непосредственным действием одного и того же гена именно в этих разных местах.
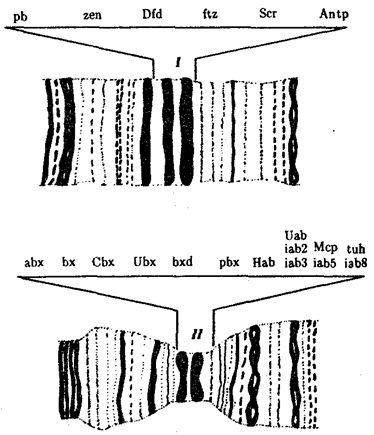
Рис. 8.14. Участки политенных хромосом дрозофилы
с указанием расположения комплексов ANT-C(I
) и ВХ-С(II
)
и генов, входящих в эти комплексы
Наконец, следует различать еще два способа действия мутаций на фенотип, вызывающих дизруптивные
либо гомеозисные
изменения. В первом случае, и это бывает чаще всего, мутации приводят к нарушению нормального развития, отсутствию или аномальному строению органов. В других случаях отклонение от нормы заключается в том, что под действием мутации типичный орган замещается гомологичным или совсем другим, но с нормальным строением. Это особый класс мутаций, описанный у насекомых и получивший название гомеозисных
мутаций.
Примером гомеозисных мутаций являются мутации в ВХ-С и ANT-C-комплексах генов у дрозофилы (рис. 8.14). ВХ-С (Bithorax Complex) и ANT-C (Antennapedia Complex) — это два набора генов, представляющих собой два кластера тесно сцепленных между собой генов, находящихся в одном плече 3-й хромосомы (рис. 8.15). В группу ВХ-С входит не менее 10 генов, которые отвечают за индивидуальность сегментов тела, расположенных сзади от среднегрудного сегмента. Чем больше дистальных локусов ВХ-С подвергается делении, тем больше брюшных сегментов превращается в грудные. При делении всего комплекса ВХ-С все сегменты от заднегрудного до 8-го брюшного превращаются в среднегрудь. В группу ANT-C входит не менее шести генов. Усиление в результате мутации функции этой группы вызывает превращение антенны в ногу, как должно быть в грудных сегментах.
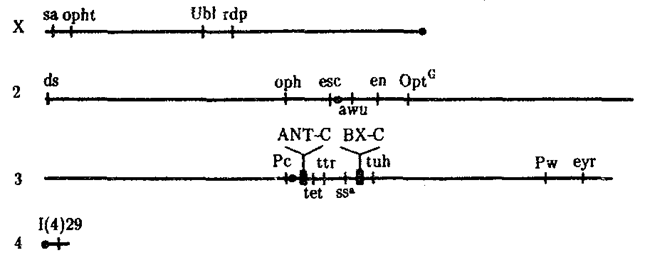
Рис. 8.15. Расположение гомеозисных комплексов мутантных генов
ANT-C и ВХ-С в геноме дрозофилы:
X, 2, 3, 4 —икс-, вторая, третья и четвертая хромосомы; черной точкой обозначены центромеры, латинскими буквами — некоторые гены
Обширные генетические исследования гомеозисных мутаций у дрозофилы показали, что эти комплексы генов отвечают за направление развития сегментов тела, т.е. являются как бы морфогенетическими переключателями. Этот вывод имеет большое теоретическое значение, так как позволяет предположить наличие таких генов-переключателей направления развития и у других видов организмов.
В предыдущих разделах были приведены примеры генетически запрограммированных процессов клеточного деления, клеточных миграций, клеточной гибели и клеточной дифференцировки, которые проявляются избирательно, т.е. в определенный период и в определенном месте. Можно привести еще множество примеров мутаций, которые показывают, как и когда действуют гены.
Существуют мутации, которые указывают на существование у многих видов животных так называемых генов с материнским эффектом.
Особенность этих генов состоит в том, что материнский геном во время овогенеза продуцирует ферменты, необходимые для метаболизма раннего зародыша, а также передает информацию, касающуюся расположения и организации структур зародыша, т.е. оказывает влияние на морфогенез. Поэтому самка, гомозиготная по рецессивному мутантному аллелю и продуцирующая аномальные яйца, даже при скрещивании с нормальным самцом дает нежизнеспособное потомство. Сама же она развивалась вполне нормально, поскольку ее мать в этом случае могла быть только гетерозиготной и в ее яйцах были все факторы, необходимые для раннего развития. Интересно, что если в дефектные яйца рецессивной самки ввести цитоплазму от нормальных яиц, то зародыши будут спасены. Факторы, детерминируемые генами с материнским эффектом, обычно оказывают свое влияние на зародыш до периода гаструляции. Начиная с гаструляции все большую роль играет информация самого зародыша.
Известны и другие мутации, оказывающие влияние на раннее развитие, но не связанные с материнским эффектом. К ним относятся, например, мутации рибосомных генов.
У шпорцевой лягушки (Xenopus laevis
) мутанты были лишены части или всех рибосомных генов. Цитологически это проявлялось в полном или частичном отсутствии ядрышка. В гомозиготном состоянии мутантных аллелей зародыши становятся полностью нежизнеспособными на стадии выклева, так как у них не образуются новые рибосомы, а те, что были запасены в яйце, уже полностью использованы.
У мышей также известен целый ряд рецессивных мутаций сложного локуса Т 17-й хромосомы, затрагивающих раннее развитие. Локус Т представлен множеством (117) аллелей, обозначаемых знаком t с дополнительными индексами: t1
, t2
, t3
и т.д. Около 30% t-генов в гомозиготном состоянии вызывает гибель зародышей, часть аллелей являются полулетальными. Весь этот ряд рецессивных аллелей t распадается на восемь групп, которые могут быть комплементарны друг другу и в гетерозиготном состоянии не приводить к гибели зародыша.
Известны также и пять доминантных мутаций Т-локуса. Каждая из восьми групп обусловливает разного рода дефекты. Один из аллелей останавливает превращение морулы в бластоцисту, состоящую из трофобласта и эмбриобласта. Такие морулы гибнут. Другая мутация приводит к тому, что развившийся трофобласт не вступает в контакт со стенкой матки и зародыш тоже гибнет. Третьи мутантные зародыши не образуют внезародышевой эктодермы, у четвертых — гибнут клетки зародышевой эктодермы, у пятых — клетки зародышевой эктодермы не способны мигрировать в области первичной полоски и образовывать мезодерму, у шестых — уже образовавшиеся структуры нервной системы дегенерируют и т.д. Первичное нарушение, лежащее в основе всех этих эффектов, всего лишь одного локуса пока не выяснено. Однако очевидно, что локус Т играет первостепенную роль в морфогенезе эктодермы мышиного зародыша и организма в целом.
Известны мутации с более специфическим действием. У аксолотля мутация с (cardial lethal), наследуемая как простой аутосомно-рецессивный признак, вызывает нарушение развития сердца и его неспособность к сокращениям. Мутантные особи раздуты переполняющей их жидкостью, а пищеварительная система и жабры у них недоразвиты. Установлено, что у позвоночных сердце развивается в результате индукционного воздействия со стороны головного участка энтодермы. Опыты по пересадке сердечной мезодермы показали, что мутантные зародыши не могут обеспечить развитие сердца из подсаженной нормальной сердечной мезодермы. Это указывает на отсутствие индукционной активности головного участка энтодермы у мутанта с генотипом cc.
Неразрывную связь генов с морфогенезом отдельных органов и систем органов можно наблюдать также на примере мутации Tfm (Testicular feminization locus) у млекопитающих. У человека, мышей и крыс этот ген наследуется как сцепленный с полом. Самки, гетерозиготные по мутантному гену, т.е. ХTfm
X, по существу, нормальны, но половина их генотипически мужских потомков ХTfm
Y имеют женский фенотип и стерильны. В основе этого дефекта лежит отсутствие специфического белка, служащего рецептором тестостерона. У особей ХTfm
Y рецептор не синтезируется. Самки ХTfm
ХTfm
нормальны во всех отношениях и фертильны. Это свидетельствует о том, что нормальное половое развитие самки может проходить без продукта этого гена.
Органогенез — период, когда действие мутаций проявляется в большой мере. Развитие каждого органа и тем более системы органов контролируется совокупным координированным действием сотен генов. У человека известны свыше 120 форм наследственной глухоты, которые возникают в результате экспрессии мутантных генов, отвечающих за формирование слухового анализатора. У человека описано также около 250 наследственных поражений глаз, около 150 наследственных аномалий развития скелета, не менее 18 генов, отвечающих за нормальную дифференциацию пола. О значении генетического контроля онтогенеза говорят многочисленные болезни, связанные с геномными и хромосомными мутациями.
В целом генетический контроль онтогенеза очевиден, однако в процессе развития зародыш и его части обладают способностью к саморазвитию, регулируемому самой целостной развивающейся системой и не запрограммированному в генотипе зиготы.
Детерминацией
(от лат. determinatio — ограничение, определение) называют возникновение качественных различий между частями развивающегося организма, которые предопределяют дальнейшую судьбу этих частей прежде, чем возникают морфологические различия между ними. Детерминация предшествует дифференцировке и морфогенезу.
Главным содержанием проблемы детерминации является раскрытие факторов развития, за исключением генетических. Исследователей обычно интересует, когда наступает детерминация и чем она обусловлена.
Исторически явление детерминации было обнаружено и активно обсуждалось в конце XIX в. В. Ру в 1887 г. укалывал горячей иглой один из первых двух бластомеров зародыша лягушки. Убитый бластомер оставался в контакте с живым. Из живого бластомера развивался зародыш, но не до конца и только в виде одной половины. Из результатов опыта Ру сделал вывод о зародыше как мозаике бластомеров, судьба которых предопределена. В дальнейшем стало ясно, что в описанном опыте Ру убитый бластомер, оставаясь в контакте с живым, служил препятствием для развития последнего в целый нормальный зародыш.
В 90-х гг. прошлого столетия О. Гертвиг и другие исследователи показали, что при полном разделении двух бластомеров амфибий из каждого развивается целый нормальный зародыш. Впоследствии многие ученые производили опыты по разделению бластомеров на разных этапах дробления у разных видов животных. Результаты оказались тоже разными. У многих беспозвоночных, например у гребневиков, круглых червей, спирально дробящихся кольчатых червей и моллюсков, а также у ящериц, изолированные бластомеры дают такие же зачатки, какие получаются из них при нормальном развитии. Они как бы обладают способностью к самодифференцировке.
Яйца таких животных назвали мозаичными.
Очень четко это показано у гребневиков, обладающих в норме восемью рядами гребных пластинок. При развитии зародыша из 1/2 яйца получается четыре ряда гребных пластинок, из 1/4,
- только два, из 1/8 — один ряд. На этом основании предположили, что у подобных форм в период овоплазматической сегрегации достигается жесткая, необратимая расстановка структур.
У многих других видов, например у гидромедуз, морского ежа и всех позвоночных, включая человека, отдельные изолированные бластомеры на стадии '/в и даже меньшей части зародыша могут развиваться в нормальную по строению особь. Яйцеклетки этих животных были названы регуляционными.
Развитие из мозаичных и регуляционных яиц отличается также и в случаях удаления одного или группы бластомеров из развивающегося зародыша. У первых удаление одного из 24 бластомеров приводит к дефектному развитию, а у вторых — к совершенно нормальному строению зародыша.
Известны картины овоплазматической сегрегации зигот и карты презумптивных зачатков зародышей асцидии и амфибии. При нормальном развитии из этих яиц, относящихся соответственно к мозаичным и регуляционным, образуются зародыши с такими органами и из таких участков зиготы, которые соответствуют карте презумптивных зачатков на стадии зиготы и бластулы. Это означает, что в обоих случаях имеет место очень ранняя детерминация будущих процессов развития, а различия заключаются в том, в какой момент она становится необратимой или жесткой. В зависимости от этого их яйца относят кмозаичным и регуляционным.
Интересны некоторые данные, позволяющие оценить, насколько точно детерминирована судьба клеток при нормальном развитии у разных видов. Многочисленные наблюдения неопровержимо показывают, что высокая точность встречается очень редко. Она имеется у коловраток, круглых червей и некоторых других животных. Так, у коловраток весь организм состоит из строго определенного числа клеток, каждая из которых расположена на определенном месте и выполняет строго определенную функцию. У одного из видов кожа содержит 301 клетку, глотка —165, половой аппарат — 19, мускулатура — 122, нервная система —247, выделительная —24, а все тело животного — 959 клеток. Но этот пример представляет собой любопытное исключение.
У большинства видов организмов клеточная точность утрачивается либо в ходе дробления, либо на последующих стадиях. Даже у круглых червей, характеризующихся детерминированным мозаичным дроблением, существует неточность в расположении бластомеров, а подчас даже несколько разных, но равноправных способов их взаимного расположения. У кишечнополостных с анархичным дроблением как бы самой природой поставлен опыт по перемешиванию бластомеров. У зародышей амфибий тоже показаны «ошибочные» вклинивания отдельных клеток в нетипичные для них зоны, не вредящие дальнейшему развитию.
Приведенные примеры показывают, что детерминация связана не со свойствами отдельных клеток, но со свойствами развивающегося организма как целостной системы, обладающей взаимосвязанными и взаимозависимыми частями.
Сохранение нормального хода развития целого зародыша после его нарушения, естественного или искусственного, получило название эмбриональной регуляции,
а достижение нормального конечного результата развития разными путями — эквифинальности.
Явление эмбриональной регуляции более подробно будет рассмотрено в следующем разделе.
Итак, в настоящее время представление об изначальной мозаичности сильно поколеблено, особенно в отношении спирально дробящихся яиц. Разделение на мозаичные и регуляционные типы яиц и типы дробления условно и заключает в себе фактор времени, или момент, когда обратимая, или лабильная, детерминация сменяется необратимой, или жесткой, детерминацией, т.е. когда регуляционные процессы становятся невозможными. В природе нет видов, у которых не было бы обнаружено явлений эмбриональной регуляции, а также нет развития, в котором регулятивные возможности были бы беспредельны.
Ранее было отмечено, что детерминация предшествует дифференцировке и морфогенезу, которые обычно начинаются после дробления, а именно в периоде гаструляции и органогенеза. Детерминация имеет место и на этих, более продвинутых фазах эмбрионального развития, но уже в значении более узкого предопределения конкретного зачатка органа или его части. Если в фазе яйца, зиготы или бластулы важнейшим фактором детерминации выступает овоплазматическая сегрегация, то начиная с периода гаструляции и дальше главное место занимают межклеточные и межзачатковые взаимодействия. Надо помнить тем не менее, что взаимодействие клеток начинается со стадии двух бластомеров. В основе взаимодействий лежат химические, физические и биологические процессы и явления (изменение в среде концентрации ионов, обмен молекулами, выделение в среду продуктов жизнедеятельности, электрические и механические взаимодействия, излучения, действия поля, контакты клеточных мембран).
В определениях понятия детерминации, данных виднейшими эмбриологами, подчеркиваются подчас разные аспекты. Г. Шпеман писал, что детерминированной называется часть зародыша с того момента развития, когда она несет в себе специфические причины своего дальнейшего развития, когда она может развиваться путем самодифференцировки в соответствии со своим проспективным значением. По определению Б.П. Токина, под детерминацией следует понимать установление в ходе онтогенеза организма, развивающегося в данных конкретных условиях, таких взаимосвязей между клетками, при которых клеточные комплексы проходят совершенно определенный путь развития. Оба эти определения не противоречат тому, которое дано в самом начале раздела.
Главным в понятии детерминации, по сути, есть проблема соотношения целостности
организма и автономности,
или способность к самодифференцировке, его частей в онтогенезе.
Выше было показано, что эксперименты по выявлению сроков детерминации в раннем развитии разных видов животных привели к открытию явления эмбриональной регуляции,
т.е. процесса восстановления нормального развития целого зародыша или зачатка После его естественного или искусственного нарушения. Опыты, многочисленные и очень разнообразные, дали интереснейшие результаты.
Для изучения регуляционных возможностей зародышей использовали следующие методические приемы: 1) удаление части материала зародыша; 2) добавление избыточного материала; 3) перемешивание материала, а также изменение пространственного взаиморасположения путем центрифугирования или сдавления. Эти манипуляции проводили на стадиях яйца, зиготы, дробления, гаструляции и органогенеза.
До начала дробления от яйцеклеток отбирали часть цитоплазмы путем отсасывания пипеткой или отрыва в результате сильного центрифугирования. Обнаружено, что за очень редкими исключениями изъятие даже 1/3 цитоплазмы яйца не препятствует дальнейшему нормальному развитию зародыша, хотя и меньшего размера. Такие результаты были получены на яйцеклетках кишечнополостных, многощетинковых червей, моллюсков, асцидий, иглокожих. Слияние двух или нескольких яйцеклеток тоже заканчивалось нормальным развитием.
Если яйца, выпущенные из гонад морского ежа, поместить в тесный сосуд, то отдельные яйца сливаются и образуются гигантские яйца. После искусственного оплодотворения такого яйца из него развивается совершенно нормальная личинка, но вдвое больших размеров. Количество клеток в ней такое же, как и у обычной личинки, но каждая клетка вдвое крупнее. Таким образом, две овоплазмы, сливаясь вместе, образуют одно органическое целое.
Опыты по центрифугированию яиц тоже дали интересные результаты. Показано, что сильное центрифугирование яиц моллюсков, червей и морского ежа не изменяет места выделения полярных телец, направления первой борозды дробления и характера развития. Получается совершенно нормальная личинка со случайным распределением пигмента и других веществ. Яйцо тритона после 20-минутного центрифугирования тоже дробится, несмотря на полное нарушение расположения в нем желтка и других компонентов. Существует предположение, что определенное размещение разных сортов цитоплазмы внутри яйца и зиготы не есть причина всего дальнейшего развития, а наоборот, само пространственное расположение цитоплазмы является следствием других, более глубоких причин, которые нужно искать в энергетике и физиологии яйца.
Все приведенные опыты показывают, что овоплазматическая сегрегация не является абсолютной причиной детерминации и при ее нарушении возможна эмбриональная регуляция.
Множество опытов проведено в стадии дробления. Почти у всех видов животных разделение бластомеров на первых этапах дробления приводит к развитию из них целых, нормальных зародышей, т.е. монозиготных близнецов. У морского ежа каждый из четырех бластомеров может образовать нормальную личинку. На стадии восьми бластомеров полноценная регуляция осуществляется в бластомерах вегетативного полюса, а в бластомерах анимального полюса она возможна при помещении их в слабый раствор солей лития.
Регуляция во время дробления широко распространена у позвоночных: миног, хрящевых и костных рыб, земноводных и высших позвоночных. Об этом свидетельствуют опыты по изоляции бластомеров и частое образование монозиготных близнецов и двойниковых уродств. Возможно развитие нормальных крольчат из одного удаленного бластомера двух-, четырех- и восьмиклеточной стадии зародыша в 30, 19 и 11% случаев соответственно. У четырехклеточного зародыша мыши при разделении бластомеров возможно развитие трех бластоцист и одного трофобластического пузырька. Даже у нематод, являющихся образцом мозаичного дробления, обнаружено, что изолированный бластомер с половым зачатком может образовать цельный зародыш. Из этих опытов следует, что потенции отдельного бластомера к морфогенезу шире, чем реализующиеся из него в ходе нормального развития зачатки. Потенции —
это максимальные возможности элементов зародыша, т.е. направления их развития, которые могли бы осуществиться. В норме реализуется лишь одно из них, а остальные могут быть выявлены в эксперименте. Широкие потенции называют еще тотипотентностью.
Широкие потенции бластомеров подтверждаются многочисленными опытами по их пересаже и перемешиванию. Бластомеры морского ежа разделяли и затем перемешивали в беспорядке. Получились нормальные личинки, но другим путем: кишечник, например, образовывался не инвагинацией, а шизоцельно (путем расхождения) из плотной клеточной массы; скелет возникал раньше, чем покровы. Это пример эквифинальности,
которую можно рассматривать как одно из важнейших свойств регуляционных процессов.
У зародышей млекопитающих бластомеры при пересадке ведут себя соответственно месту пересадки. Это подтверждено переносом клеток из трофобласта в зародышевый узелок, и наоборот. В этих случаях проявляются зависимость судьбы бластомера от взаимодействия с другими бластомерами и более широкие его потенции. В таком же ключе можно интерпретировать следующие опыты: если бластоцисту поместить в полость тела, то из нее развивается солидная опухоль (эмбриокарцинома). Клетки этой опухоли, будучи введены в бластоцисту, приводят к нормальному развитию зародыша.
Большой интерес представляют опыты по объединению зародышей. Искусственное слияние двух зародышей морского ежа на стадии бластулы может завершиться формированием совершенно нормальной структуры личинки. Такая личинка превосходит по размерам нормальных зародышей и имеет вдвое больше клеток. Это доказывает, что при совершенно тождественной архитектонике тела оно может быть построено из разного количества клеток. Следовательно, детерминация носит не целлюлярный характер, а является производной от организма как целого.
Слияние двубластомерных зародышей возможно получить у тритона.
В отношении млекопитающих было высказано предположение, что в их зародышах предетерминированные локализованные участки цитоплазмы не играют никакой роли. Зависимость судьбы клетки от ее положения была продемонстрирована следующим образом. Объединяли клетки двух мышиных зародышей, находящихся на стадии морулы и предварительно диссоциированных. Зародыши отличались по генам окраски шерсти. Образовавшуюся в результате гибридную бластоцисту имплантировали в приемную мать. Развился нормальный живой мышонок-химера, в окраске которого проявилось действие обоих генов обоих родителей (рис. 8.16).
Как было отмечено выше, в яйцах всех животных цитоплазма неоднородна. Она постепенно изменяет свои свойства вдоль главной оси яйца. Фактически у всех животных до дробления детерминируются полярность, симметрия, дорсовентральная ось и тип дробления. Однако нет основания понимать структуру цитоплазмы яйца в преформационном духе, т.е. думать, что в ней уже имеются в готовом виде органообразующие зачатки и что она столь же сложно сконструирована, как и взрослый организм. Об этом, в частности, свидетельствуют опыты по сдавливанию зародышей в стадии дробления. Если яйцо лягушки сдавить двумя пластинками в анимально-вегетативном направлении, то после двух меридиональных дроблений, происходящих, как и при нормальных условиях, следует не горизонтальное, а опять меридиональное, приводящее к расположению восьми бластомеров в один слой в виде пластинки. То же наблюдается и на стадии 16 и 32 бластомеров. После удаления давящей силы из таких яиц могут развиться нормальные зародыши. Судьба бластомеров в этом случае, конечно, иная, чем при нормальном развитии.
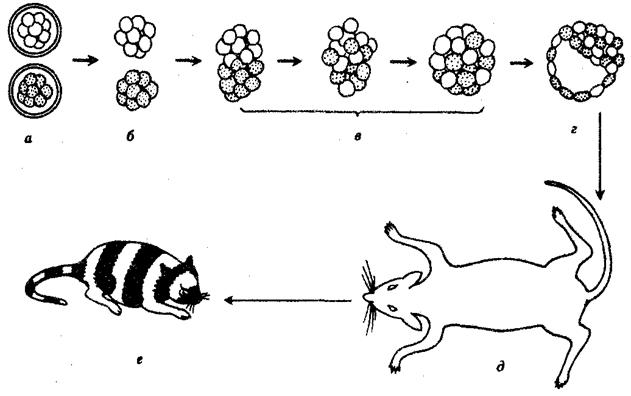
Рис. 8.16. Химерный мышонок, полученный в результате объединения
на стадии морулы двух зародышей с разными генотипами:
а—
дробящиеся яйца, б—
морулы, освобожденные от яйцевых оболочек путем обработки протеолитическими ферментами, в—
объединяющиеся морулы, инкубированные in vitro
при 37°С, г
—объединенный зародыш на стадии бластоцисты, д—
мать-реципиент с имплантированным химерным зародышем, е—
химерный мышонок
Наличие периода развития, когда потенции элементов зародыша шире, чем реализующиеся при обычном развитии, т.е. когда детерминация не носит окончательного, необратимого характера, лежит в основе эмбриональных регуляций. Эмбриональные регуляции были открыты немецким эмбриологом Г.Дришем (1908). Таким образом, детерминация и эмбриональная регуляция являются противоположными свойствами и теснейшим образом взаимосвязаны в системе целостного развивающегося зародыша.
Детерминация, как правило, идет от целого к частям: сначала детерминируется целый зачаток зародыша, но судьба отдельных его элементов (клеток) еще не определена, затем постепенно или скачкообразно детерминируются отдельные элементы. Обычно детерминация сменяется дифференциацией и специализацией частей организма, усиливается взаимная зависимость их друг от друга, возрастают интегрированность, целостность организма. Исключение составляют виды, у которых взрослые формы устроены проще личинок. Способность к эмбриональной регуляции в ходе онтогенеза соответственно падает, но не абсолютно, так как и у взрослого организма существует, например, способность к регенерации, т.е. к восстановлению утраченных или поврежденных частей.
Важно, что не только в эксперименте, где искусственно нарушается нормальный ход развития, но и в естественных условиях ход развития клеток регулируется согласно их положению в целом.
Вероятно гибкий регуляторный характер развития имеет существенные адаптивные преимущества: если какое-либо одно звено будет подавлено или полностью выпадает, сохраняются шансы на достижение нормального конечного результата. С другой стороны, в экстремальных условиях резерв изменчивости может стать источником эволюционных преобразований. Эти предположения вполне согласуются с фактом регуляционного типа яиц у позвоночных и с тем, что вообще способность к эмбриональной регуляции у них выражена сильнее, чем у многих беспозвоночных.
Морфогенез —
это процесс возникновения новых структур и изменения их формы в ходе индивидуального развития организмов. Морфогенез, как рост и клеточная дифференцировка, относится к ациклическим процессам, т.е. не возвращающимся в прежнее состояние и по большей части необратимым. Главным свойством ациклических процессов является их пространственно-временная организация. Морфогенез на надклеточном уровне начинается с гастру-ляции. У хордовых животных после гаструляции происходит закладка осевых органов. В этот период, как и во время гаструляции, морфологические перестройки охватывают весь зародыш. Следующие затем органогенезы представляют собой местные процессы. Внутри каждого их них происходит расчленение на новые дискретные (отдельные) зачатки. Так последовательно во времени и в пространстве протекает индивидуальное развитие, приводящее к формированию особи со сложным строением и значительно более богатой информацией, нежели генетическая информация зиготы.
Морфогенез связан с очень многими процессами, начиная с прогенеза. Поляризация яйцеклетки, овоплазматическая сегрегация после оплодотворения, закономерно ориентированные деления дробления, движения клеточных масс в ходе гаструляции и закладок различных органов, изменения пропорций тела — все это процессы, имеющие большое значение для морфогенеза. Помимо надклеточного уровня к морфопроцессам относятся такие процессы, которые протекают на субклеточном и молекулярном уровнях. Это изменения формы и строения отдельных клеток, распад и воссоздание молекул и крупных молекулярных комплексов, изменение конформации молекул.
Таким образом, морфогенез представляет собой многоуровневый динамический процесс. В настоящее время уже многое известно о тех структурных превращениях, которые происходят на внутриклеточном и межклеточном уровнях и которые преобразуют химическую энергию клеток в механическую, т.е. об элементарных движущих силах морфогенеза.
В расшифровке всех этих внутриуровневых и межуровневых процессов большую роль сыграл каузально-аналитический
(от лат. causa — причина) подход.
Данный отрезок развития считают объясненным, если его удалось представить в виде однозначной последовательности причин и следствий. В этом аспекте одним из первостепенных является вопрос о том, содержится ли в геноме данного вида или в генотипе зиготы информация о конкретных морфологических процессах. Очевидно, что в геноме данного вида заложена информация о конечном результате, т.е. развитии особи определенного вида. Очевидно также, что в генотипе зиготы содержатся определенные аллели родителей, обладающие возможностью реализоваться в определенные признаки. Но из каких именно клеток, в каком месте и в какой конкретно форме разовьется тот или иной орган, в генотипе не заложен о.
Это утверждение вытекает из всех сведений о явлениях эмбриональной регуляции, которые показывают, что конкретные пути морфогенеза как в эксперименте, так и в нормальном развитии могут варьировать. Гены, лишенные однозначного морфогенетического смысла, приобретают его, однако, в системе целостного развивающегося организма ив контексте определенных, структурно устойчивых схем морфогенеза.
Клетки и клеточные комплексы совершают закономерные спонтанные, не порождаемые внешними силами, макроскопические морфогенетические движения. При изменении положения, уменьшении или увеличении количества бластомеров и при пересадке эмбриональных индукторов в нетипичное место нередко достигается нормальный результат. Это позволяет рассматривать морфогенез как самоорганизующийся процесс образования структур из исходно однородного состояния, что является неотъемлемым свойством самоорганизующихся систем, обладающих свойством целостности.
Одновременно с взаимосвязью всех частей развивающегося эмбриона возникают относительно автономизированные биологические системы, способные продолжать развитие в условиях изоляции от целого организма. Если зачаток бедра куриного зародыша культивировать в искусственной среде, он продолжает развиваться в прежнем направлении. Глаз крысы, изолированный на стадии 14—17 сут, продолжает автоматически развиваться, хотя дефектно и медленнее. Через 21 сут глаз в культуре тканей приобретает ту степень сложности структуры, которую нормально он уже имеет на 8-е сутки после рождения крысы. Для объяснения всех этих явлений каузально-аналитический подход неприменим. На вооружение взята физико-математическая теория самоорганизации неравновесных природных систем,
как биологических, так и небиологических.
В настоящее время разрабатывают несколько подходов к проблеме регуляции и контроля морфогенеза.
Концепция физиологических градиентов,
предложенная в начале XX в. американским ученым Ч. Чайльдом, заключается в том, что у многих животных обнаруживаются градиенты интенсивности обмена веществ и совпадающие с ними градиенты повреждаемости тканей. Эти градиенты обычно снижаются от переднего полюса животного к заднему. Они определяют пространственное расположение морфогенеза и цитодифференцировки. Возникновение самих градиентов определяется гетерогенностью внешней среды, например питательных веществ, концентрации кислорода или силы тяжести. Любое из условий или их совокупность могут вызвать первичный физиологический градиент в яйцеклетке. Затем возможно возникновение вторичного градиента под некоторым углом к первому. Система из двух градиентов (или более) создает определенную координатную систему. Функцией координаты является судьба клетки.
Ч. Чайльд открыл также, что верхний конец градиента является доминирующим. Выделяя некоторые факторы, он подавлял развитие таких же структур из других клеток зародыша. Наряду с подтверждающими имеются явления, которые не укладываются в упрощенную схему, и поэтому концепцию Чайльда нельзя рассматривать как универсальное объяснение пространственной организации развития.
Более современной является концепция позиционной информации,
по которой клетка как бы оценивает свое местоположение в координатной системе зачатка органа, а затем дифференцируется в соответствии с этим положением. По мнению современного английского биолога Л. Вольперта, положение клетки определяется концентрацией некоторых веществ, расположенных вдоль оси зародыша по определенному градиенту. Ответ клетки на свое местоположение зависит от генома и всей предыдущей истории ее развития. По мнению других исследователей, позиционная информация есть функция полярных координат клетки. Существует также мнение о том, что градиенты представляют собой стойкие следы периодических процессов, распространяющихся вдоль развивающегося зачатка. Концепция позиционной информации позволяет формально интерпретировать некоторые закономерности онтогенетического развития, но она очень далека от общей теории целостности.
Концепция морфогенетических полей,
базирующаяся на предположении о дистантных либо контактных взаимодействиях между клетками зародыша, рассматривает эмбриональное формообразование как самоорганизующийся и самоконтролируемый процесс. Предыдущая форма зачатка определяет характерные черты его последующей формы. Кроме того, форма и структура зачатка способны оказать обратное действие на биохимические процессы в его клетках. Наиболее последовательно эту концепцию разрабатывал в 20—30-х гг. отечественный биолог А. Г. Гурвич, предложивший впервые в мировой литературе математические модели формообразования. Он, например, моделировал переход эмбрионального головного мозга из стадии одного пузыря в стадию трех пузырей.
Модель исходила из гипотезы об отталкивающих взаимодействиях между противоположными стенками зачатка. На рис. 8.17 эти взаимодействия отображены тремя векторами (А, А
1
,
А
2
).
Гурвич впервые указал также на важную роль неравновесных надмолекулярных структур, характер и функционирование которых определяются приложенными к ним векторами поля. В последние годы К. Уоддингтон создал более обобщенную концепцию морфогенетического векторного поля,
включающую не только формообразование, но и любые изменения развивающихся систем.
Рис. 8.17. Моделирование морфогенеза головного мозга зародыша курицы
Близкие идеи лежат в основе концепции диссипативных структур.
Диссипативными (от лат. dissipatio — рассеяние) называют энергетически открытые, термодинамически неравновесные биологические и небиологические системы, в которых часть энергии, поступающей в них извне, рассеивается. В настоящее время показано, что в сильно неравновесных условиях, т.е. при достаточно сильных потоках вещества и энергии, системы могут самопроизвольно и устойчиво развиваться, дифференцироваться. В таких условиях возможны и обязательны нарушения однозначных причинно-следственных связей и проявления эмбриональной регуляции и других явлений. Примерами диссипативных небиологических систем являются химическая реакция Белоусова — Жаботинского, а также математическая модель абстрактного физико-химического процесса, предложенная английским математиком А. Тьюрингом.
На пути моделирования морфогенеза как самоорганизующегося процесса сделаны первые шаги, а все перечисленные концепции целостности развития носят пока фрагментарный характер, освещая то одну, то другую сторону.
Рост —
это увеличение общей массы в процессе развития, приводящее к постоянному увеличению размеров организма. Если бы организм не рос, он никогда бы не стал больше оплодотворенного яйца.
Рост обеспечивается следующими механизмами: 1) увеличением размера клеток, 2) увеличением числа клеток, 3) увеличением неклеточного вещества, продуктов жизнедеятельности клеток. В понятие роста входит также особый сдвиг обмена веществ, благоприятствующий процессам синтеза, поступлению воды и отложению межклеточного вещества. Рост происходит на клеточном, тканевом, органном и организменном уровнях. Увеличение массы в целом организме отражает рост составляющих его органов, тканей и клеток.
Различают два типа роста: ограниченный
и неограниченный.
Неограниченный рост продолжается на протяжении всего онтогенеза, вплоть до смерти. Таким ростом обладают, в частности, рыбы. Многие другие позвоночные характеризуются ограниченным ростом, т.е. достаточно быстро выходят на плато своей биомассы. Обобщенная кривая зависимости роста организма от времени при ограниченном росте имеет s-образную форму (рис. 8.18).
Рис. 8.18. Обобщенная кривая зависимости роста организма от времени
До начала развития организм имеет некоторые исходные размеры, которые в течение короткого времени практически не изменяются. Затем начинается медленное, а потом и быстрое возрастание массы. Некоторое время скорость роста может оставаться относительно постоянной и наклон кривой не меняется. Но вскоре происходит замедление роста, а потом увеличение размеров организма прекращается. После достижения этой стадии устанавливается равновесие между расходованием материала и синтезом новых материалов, обеспечивающих увеличение массы.
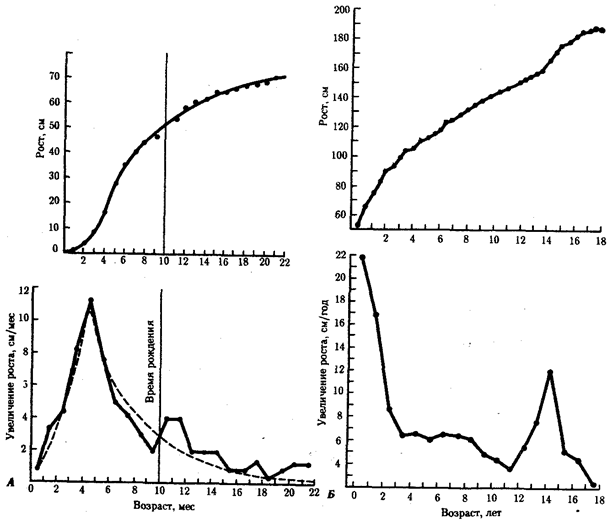
Рис. 8.19. Изменения скорости роста в зависимости от стадии развития человеческого организма.
А
— у плода и в первые два года после рождения, Б
— в начале постнатального периода
Важнейшей характеристикой роста является его дифференциальность.
Это означает, что скорость роста неодинакова, во-первых, в различных участках организма и, во -
вторых, на разных стадиях развития. Очевидно, что дифференциальный рост оказывает огромное влияние на морфогенез.
Не менее важной особенностью является такое свойство роста, как эквифинальность.
Это означает, что, несмотря на возникающие факторы, особь стремится достичь типичного видового размера. Как дифференциальность, так и эквифинальность роста указывают на проявление целостности
развивающегося организма.
Скорость общего роста человеческого организма зависит от стадии развития (рис. 8.19). Максимальная скорость роста характерна для первых четырех месяцев внутриутробного развития. Это объясняется тем, что клетки в это время продолжают делиться. По мере роста плода число митозов во всех тканях уменьшается, и принято считать, что после шести месяцев внутриутробного развития почти не происходит образования новых мышечных и нервных клеток, если не считать клеток нейроглии.
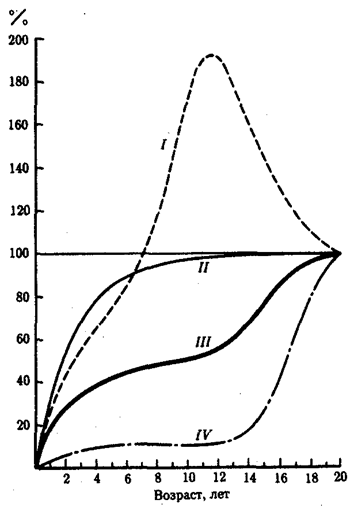
Рис. 8.20. Кривые роста отдельных органов и тканей
по сравнению с кривой обобщенного роста (пояснение см. в тексте)
Дальнейшее развитие мышечных клеток заключается в том, что клетки становятся больше, изменяется их состав, исчезает межклеточное вещество. Этот же механизм действует в некоторых тканях и в постнатальном росте. Скорость роста организма в постнатальном онтогенезе постепенно снижается к четырехлетнему возрасту, затем некоторое время остается постоянной, а в определенном возрасте опять делает скачок, называемый пубертатным скачком роста.
Это связано с периодом полового созревания.
Различие в скорости роста органов и тканей показано на рис. 8.20. Кривые роста большинства скелетных и мышечных органов повторяют ход кривой общего роста. То же касается изменения размеров и отдельных органов: печени, селезенки, почек. Однако кривые роста целого ряда других тканей и органов существенно отличаются. На рис. 8.20 приведены общая кривая роста тела и большей части других органов (III
),
рост наружных и внутренних органов размножения (IV
),
рост мозга, а также черепа, глаз и ушей (II
),
рост лимфатической ткани миндалин, червеобразного отростка, кишечника и селезенки (I
).
Значение различных скоростей роста органов и тканей для морфогенеза хорошо видно из рис. 8.21. Очевидно, что в плодном и постнатальном периодах скорость роста головы уменьшается по сравнению со скоростью роста ног.
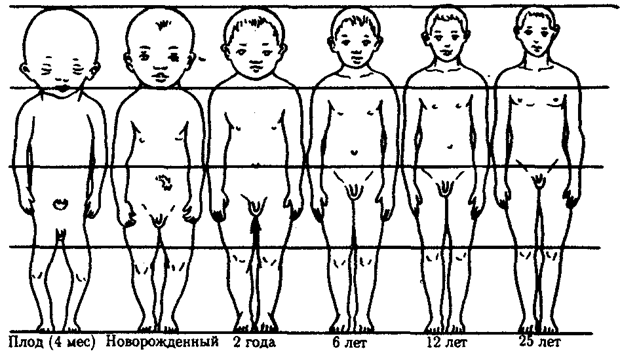
Рис. 8.21. Пропорции тела человека в эмбриогенезе и после рождения
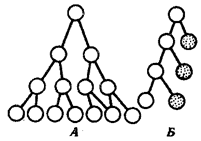
Рис. 8.22. Формы пролиферационного роста.
А —
мультипликативный; Б —
аккреционный (пояснение см. в тексте)
Пубертатный скачок роста характеризует только человека и обезьян. Это позволяет оценивать его как этап в эволюции приматов. Он коррелирует с такой особенностью онтогенеза, как увеличение отрезка времени между окончанием вскармливания и половым созреванием. У большинства млекопитающих этот интервал мал и отсутствует пубертатный скачок роста.
Как уже говорилось выше, рост осуществляется за счет таких клеточных процессов, как увеличение размеров клеток и увеличение их количества. Выделяют несколько типов роста клеток.
Ауксентичный —
рост, идущий путем увеличения размеров клеток. Это редкий тип роста, наблюдающийся у животных с постоянным количеством клеток, таких, как коловратки, круглые черви, личинки насекомых. Рост отдельных клеток нередко связан с полиплоидизацией ядер.
Пролиферационный —
рост, протекающий путем размножения клеток. Он известен в двух формах: мультипликативный
и аккреционный.
Мультипликативный
рост характеризуется тем, что обе клетки, возникшие от деления родоначальной клетки, снова вступают в деление (рис. 8.22, А
). Число клеток растет в геометрической прогрессии: если n
—
номер деления, то N
n
= 2n
. Мультипликативный рост очень эффективен и поэтому в чистом виде почти не встречается или очень быстро заканчивается (например, в эмбриональном периоде).
Аккреционный
рост заключается в том, что после каждого последующего деления лишь одна из клеток снова делится, тогда как другая прекращает деление (заштрихована, рис. 8.22, Б
).
При этом число клеток растет линейно. Если п —
номер деления, то N
n
= 2n.
Этот тип роста связан с разделением органа на камбиальную и дифференцированную зоны. Клетки переходят из первой зоны во вторую, сохраняя постоянные соотношения между размерами зон. Такой рост характерен для органов, где происходит обновление клеточного состава.
Пространственная организация роста сложна и закономерна. Именно с ней в значительной мере связана видовая специфичность формы. Это проявляется в виде аллометрического
роста. Его биологический смысл состоит в том, что организму в ходе роста надо сохранить не геометрическое, а физическое подобие, т.е. не превышать определенных отношений между массой тела и размерами опорных и двигательных органов. Так как с ростом тела масса возрастает в третьей степени, а сечения костей во второй степени, то для того, чтобы организм не был раздавлен собственной тяжестью, кости должны расти в толщину непропорционально быстро.
Регуляция роста сложна и многообразна. Большое значение имеют генетическая конституция и факторы внешней среды. Почти у каждого вида есть генетические линии, характеризующиеся предельными размерами особей, такими, как карликовые или, наоборот, гигантские формы. Генетическая информация заключена в определенных генах, детерминирующих длину тела, а также в других генах, взаимодействующих между собой. Реализация всей информации в значительной мере обусловлена посредством действия гормонов. Наиболее важным из гормонов является соматотропин, выделяемый гипофизом с момента рождения до подросткового периода. Гормон щитовидной железы — тироксин — играет очень большую роль на протяжении всего периода роста. С подросткового возраста рост контролируется стероидными гормонами надпочечников и гонад. Из факторов среды наибольшее значение имеют питание, время года, психологические воздействия.
Интересной является зависимость способности к росту от возрастной стадии организма. Ткани, взятые на разных стадиях развития и культивируемые в питательной среде, характеризуются различной скоростью роста. Чем старше зародыш, тем медленнее растут его ткани в культуре. Ткани, взятые от взрослого организма, растут очень медленно.
Как только в результате дробления образуются два первых бласто-мера, каждый из них становится неразрывной частью новой биологической системы
и его поведение определяется этой системой. Каждая стадия развития организма есть новое состояние целостности, интеграции.
На любой стадии развития зародыш представляет собой интегрированное целое, а не сумму бластомеров и клеток. Интеграция развивающихся зародышей непрерывно меняется по мере развития. Основными механизмами интеграции являются межклеточные взаимодействия, а также гуморальная и нервная регуляция.
Различия в уровне интеграции, в характере взаимодействия клеток у разных видов животных могут быть очень существенными. Кроме того, иногда на более молодых стадиях развития зародыш более интегрирован, чем на более поздних. Так, личинки асцидий, вероятно, более интегрированы, чем взрослые формы. То же наблюдается, по-видимому, у многих моллюсков и червей. У позвоночных животных Интегрированность нарастает по мере углубления процессов органогенеза и цитодифференцировки.
Регенерация
(от лат. regeneratio — возрождение) — процесс восстановления организмом утраченных или поврежденных структур. Регенерация поддерживает строение и функции организма, его целостность. Различают два вида регенерации: физиологическую и репаративную. Восстановление органов, тканей, клеток или внутриклеточных структур после разрушения их в процессе жизнедеятельности организма называют физиологической
регенерацией. Восстановление структур после травмы или действия других повреждающих факторов называют репаративной
регенерацией. При регенерации происходят такие процессы, как детерминация, дифференцировка, рост, интеграция и др., сходные с процессами, имеющими место в эмбриональном развитии. Однако при регенерации все они идут уже вторично, т.е. в сформированном организме.
Физиологическая
регенерация представляет собой процесс обновления функционирующих структур организма. Благодаря физиологической регенерации поддерживается структурный гомеостаз и обеспечивается возможность постоянного выполнения органами их функций. С общебиологической точки зрения, физиологическая регенерация, как и обмен веществ, является проявлением такого важнейшего свойства жизни, как самообновление.
Примером физиологической регенерации на внутриклеточном уровне являются процессы восстановления субклеточных структур в клетках всех тканей и органов. Значение ее особенно велико для так называемых «вечных» тканей, утративших способность к регенерации путем деления клеток. В первую очередь это относится к нервной ткани.
Примерами физиологической регенерации на клеточном и тканевом уровнях являются обновление эпидермиса кожи, роговицы глаза, эпителия слизистой кишечника, клеток периферической крови и др. Обновляются производные эпидермиса — волосы и ногти. Это так называемая пролиферативная
регенерация, т.е. восполнение численности клеток за счет их деления. Во многих тканях существуют специальные камбиальные клетки и очаги их пролиферации. Это крипты в эпителии тонкой кишки, костный мозг, пролиферативные зоны в эпителии кожи. Интенсивность клеточного обновления в перечисленных тканях очень велика. Это так называемые «лабильные» ткани. Все эритроциты теплокровных животных, например, сменяются за 2—4 мес, а эпителий тонкой кишки полностью сменяется за 2 сут. Это время требуется для перемещения клетки из крипты на ворсинку, выполнения ею функции и гибели. Клетки таких органов, как печень, почка, надпочечник и др., обновляются значительно медленнее. Это так называемые «стабильные» ткани.
Об интенсивности пролиферации судят по количеству митозов, приходящихся на 1000 подсчитанных клеток. Если учесть, что сам митоз в среднем длится около 1 ч, а весь митотаческий цикл в соматических клетках в среднем протекает 22—24 ч, то становится ясно, что для определения интенсивности обновления клеточного состава тканей необходимо подсчитать количество митозов в течение одних или нескольких суток. Оказалось, что количество делящихся клеток не одинаково в разные часы суток. Так был открыт суточный ритм клеточных делений,
пример которого изображен на рис. 8.23.
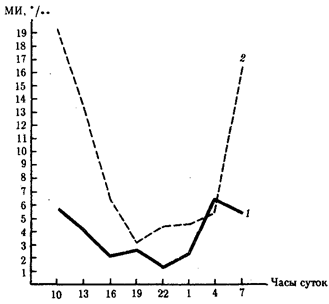
Рис. 8.23. Суточные изменения митотического индекса (МИ)
в эпителии пищевода (I
) и роговицы (2
) мышей.
Митотический индекс выражен в промилле (0
/00
), отражающем число митозов
в тысяче подсчитанных клеток
Суточный ритм количества митозов обнаружен не только в нормальных, но и в опухолевых тканях. Он является отражением более общей закономерности, а именно ритмичности всех функций организма. Одна из современных областей биологии — хронобиология —
изучает, в частности, механизмы регуляции суточных ритмов митотической активности, что имеет весьма важное значение для медицины. Существование самой суточной периодичности количества митозов указывает на регулируемость физиологической регенерации организмом. Кроме суточных существуют лунные и годичные
циклы обновления тканей и органов.
В физиологической регенерации выделяют две фазы: разрушительную и восстановительную. Полагают, что продукты распада части клеток стимулируют пролиферацию других. Большую роль в регуляции клеточного обновления играют гормоны.
Физиологическая регенерация присуща организмам всех видов, но особенно интенсивно она протекает у теплокровных позвоночных, так как у них вообще очень высока интенсивность функционирования всех органов по сравнению с другими животными.
Репаративная
(от лат. reparatio — восстановление) регенерация наступает после повреждения ткани или органа. Она очень разнообразна по факторам, вызывающим повреждения, по объемам повреждения, по способам восстановления. Механическая травма, например оперативное вмешательство, действие ядовитых веществ, ожоги, обморожения, лучевые воздействия, голодание, другие болезнетворные агенты,— все это повреждающие факторы. Наиболее широко изучена регенерация после механической травмы. Способность некоторых животных, таких, как гидра, планария, некоторые кольчатые черви, морские звезды, асцидия и др., восстанавливать утраченные органы и части организма издавна изумляла ученых. Ч. Дарвин, например, считал удивительными способность улитки воспроизводить голову и способность саламандры восстанавливать глаза, хвост и ноги именно в тех местах, где они отрезаны.
Объем повреждения и последующее восстановление бывают весьма различными. Крайним вариантом является восстановление целого организма из отдельной малой его части, фактически из группы соматических клеток. Среди животных такое восстановление возможно у губок и кишечнополостных. Среди растений возможно развитие целого нового растения даже из одной соматической клетки, как это получено на примере моркови и табака. Такой вид восстановительных процессов сопровождается возникновением новой морфогенетической оси организма и назван Б.П. Токиным «соматическим эмбриогенезом», ибо во многом напоминает эмбриональное развитие.
Существуют примеры восстановления больших участков организма, состоящих из комплекса органов. В качестве примера служат регенерация ротового конца у гидры, головного конца у кольчатого червя и восстановление морской звезды из одного луча (рис. 8.24). Широко распространена регенерация отдельных органов, например конечности у тритона, хвоста у ящерицы, глаз у членистоногих. Заживление кожных покровов, ран, повреждений костей и других внутренних органов является менее объемным процессом, но не менее важным для восстановления структурно-функциональной целостности организма. Особый интерес представляет способность зародышей на ранних стадиях развития восстанавливаться после значительной утраты материала. Эта способность была последним аргументом в борьбе между сторонниками преформизма и эпигенеза и привела в 1908 г. Г. Дриша к концепции эмбриональной регуляции.
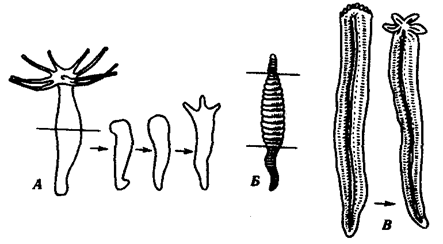
Рис. 8.24. Регенерация комплекса органов у некоторых видов беспозвоночных животных. А —
гидра;Б —
кольчатый червь; В —
морская звезда
(пояснение см. в тексте)
Существует несколько разновидностей или способов репаративной регенерации. К ним относят эпиморфоз, морфаллаксис, заживление эпителиальных ран, регенерационную гипертрофию, компенсаторную гипертрофию.
Эпителизация
при заживлении ран с нарушенным эпителиальным покровом идет примерно одинаково, независимо от того, будет далее происходить регенерация органа путем эпиморфоза или нет. Эпидермальное заживление раны у млекопитающих в том случае, когда раневая поверхность высыхает с образованием корки, проходит следующим образом (рис. 8.25). Эпителий на краю раны утолщается вследствие увеличения объема клеток и расширения межклеточных пространств. Сгусток фибрина играет роль субстрата для миграции эпидермиса в глубь раны. В мигрирующих эпителиальных клетках нет митозов, однако они обладают фагоцитарной активностью. Клетки с противоположных краев вступают в контакт. Затем наступает кератинизация раневого эпидермиса и отделение корки, покрывающей рану.
Рис. 8.25. Схема некоторых событий, происходящих
при эпителизации кожной раны у млекопитающих.
А—
начало врастания эпидермиса под некротическую ткань; Б—
срастание эпидермиса и отделение струпа:
1
—соединительная ткань, 2—
эпидермис, 3—
струп, 4—
некротическая ткань
К моменту встречи эпидермиса противоположных краев в клетках, расположенных непосредственно вокруг края раны, наблюдается вспышка митозов, которая затем постепенно падает. По одной из версий, эта вспышка вызвана понижением концентрации ингибитора митозов — кейлона.
Эпиморфоз
представляет собой наиболее очевидный способ регенерации, заключающийся в отрастании нового органа от ампутационной поверхности. Регенерация конечности тритона и аксолотля изучена детально. Выделяют регрессивную и прогрессивную фазы регенерации. Регрессивная фаза
начинается с заживления
раны, во время которого происходят следующие основные события: остановка кровотечения, сокращение мягких тканей культи конечности, образование над раневой поверхностью сгустка фибрина и миграция эпидермиса, покрывающего ампутационную поверхность.
Затем начинается разрушение
остеоцитов на дистальном конце кости и других клеток. Одновременно в разрушенные мягкие ткани проникают клетки, участвующие в воспалительном процессе, наблюдается фагоцитоз и местный отек. Затем вместо образования плотного сплетения волокон соединительной ткани, как это происходит при заживлении ран у млекопитающих, в области под раневым эпидермисом утрачиваются дифференцированные ткани. Характерна остеокластическая эрозия кости, что является гистологическим признаком дедифференцировки.
Раневой эпидермис, уже пронизанный регенерирующими нервными волокнами, начинает быстро утолщаться. Промежутки между тканями все более заполняются мезенхимоподобными клетками. Скопление мезенхимных клеток под раневым эпидермисом является главным показателем формирования регенерационной бластемы.
Клетки бластемы выглядят одинаково, но именно в этот момент закладываются основные черты регенерирующей конечности.
Затем начинается прогрессивная фаза,
для которой наиболее характерны процессы роста и морфогенеза. Длина и масса регенерационной бластемы быстро увеличиваются. Рост бластемы происходит на фоне идущего полным ходом формирования черт конечности, т.е. ее морфогенеза. Когда форма конечности в общих чертах уже сложилась, регенерат все еще меньше нормальной конечности. Чем крупнее животное, тем больше эта разница в размерах. Для завершения морфогенеза требуется время, по истечении которого регенерат достигает размеров нормальной конечности.
Некоторые стадии регенерации передней конечности у тритона после ампутации на уровне плеча показаны на рис. 8.26. Время, необходимое для полной регенерации конечности, варьирует в зависимости от размера и возраста животного, а также от температуры, при которой она протекает.
Рис. 8.26. Стадии регенерации передней конечности у тритона
У молодых личинок аксолотлей конечность может регенерировать за 3 нед, у взрослых тритонов и аксолотлей за 1—2 мес, а у наземных амбистом для этого требуется около 1 года.
При эпиморфной регенерации не всегда образуется точная копия удаленной структуры. Такую регенерацию называют атипичной.
Существует много разновидностей атипичной регенерации. Гипоморфоз —
регенерация с частичным замещением ампутированной структуры. Так, у взрослой шпорцевой лягушки возникает шиловидная структура вместо конечности. Гетероморфоз —
появление иной структуры на месте утраченной. Это может проявляться в виде гомеозисной регенерации, заключающейся в появлении конечности на месте антенн или глаза у членистоногих, а также в изменении полярности структуры. Из короткого фрагмента планарии можно стабильно получать биполярную планарию (рис. 8.27).
Встречается образование дополнительных структур, или избыточная регенерация.
После надреза культи при ампутации головного отдела планарии возникает регенерация двух голов или более (рис. 8.28). Можно получить больше пальцев при регенерации конечности аксолотля, повернув конец культи конечности на 180°. Дополнительные структуры являются зеркальным отражением исходных или регенерировавших структур, рядом с которыми они расположены (закон Бэйтсона).
Рис. 8.27. Биполярная планария
Морфаллаксис —
это регенерация путем перестройки регенерирующего участка. Примером служит регенерация гидры из кольца, вырезанного из середины ее тела, или восстановление планарии из одной десятой или двадцатой ее части. На раневой поверхности в этом случае не происходит значительных формообразовательных процессов. Отрезанный кусочек сжимается, клетки внутри него перестраиваются, и возникает целая особь
уменьшенных размеров, которая затем растет. Этот способ регенерации впервые описал Т. Морган в 1900 г. В соответствии с его описанием морфаллаксис осуществляется без митозов. Нередко имеет место сочетание эпиморфного роста на месте ампутации с реорганизацией путем морфаллаксиса в прилежащих частях тела.
Рис. 8.28. Многоголовая планария, полученная после ампутации головы
и нанесения насечек на культю
Регенерационная гипертрофия
относится к внутренним органам. Этот способ регенерации заключается в увеличении размеров остатка органа без восстановления исходной формы. Иллюстрацией служит регенерация печени позвоночных, в том числе млекопитающих. При краевом ранении печени удаленная часть органа никогда не восстанавливается. Раневая поверхность заживает. В то же время внутри оставшейся части усиливается размножение клеток (гиперплазия) и в течение двух недель после удаления 2/3 печени восстанавливаются исходные масса и объем, но не форма. Внутренняя структура печени оказывается нормальной, дольки имеют типичную для них величину. Функция печени также возвращается к норме.
Компенсаторная гипертрофия
заключается в изменениях в одном из органов при нарушении в другом, относящемся к той же системе органов. Примером является гипертрофия в одной из почек при удалении другой или увеличение лимфатических узлов при удалении селезенки.
Последние два способа отличаются местом регенерации, но механизмы их одинаковы: гиперплазия и гипертрофия.
Восстановление отдельных мезодермальных тканей, таких, как мышечная и скелетная, называют тканевой регенерацией.
Для регенерации мышцы важно сохранение хотя бы небольших ее культей на обоих концах, а для регенерации кости необходима надкостница. Регенерация путем индукции происходит в определенных мезодермальных тканях млекопитающих в ответ на действие специфических индукторов, которые вводят внутрь поврежденной области. Этим способом удается получить полное замещение дефекта костей черепа после введения в него костных опилок.
Таким образом, существует множество различных способов или типов морфогенетических явлений при восстановлении утраченных и поврежденных частей организма. Различия между ними не всегда очевидны, и требуется более глубокое понимание этих процессов.
Изучение регенерационных явлений касается не только внешних проявлений. Существует целый ряд вопросов, носящих проблемный и теоретический характер. К ним относятся вопросы регуляции и условий, в которых протекают восстановительные процессы, вопросы происхождения клеток, участвующих в регенерации, способности к регенерации у различных групп, животных и особенностей восстановительных процессов у млекопитающих.
Установлено, что в конечности амфибий после ампутации и в процессе регенерации происходят реальные изменения электрической активности. При проведении электрического тока через ампутированную конечность у взрослых шпорцевых лягушек наблюдается усиление регенерации передних конечностей. В регенератах увеличивается количество нервной ткани, из чего делается вывод, что электрический ток стимулирует врастание нервов в края конечностей, в норме не регенерирующих.
Попытки стимулировать подобным образом регенерацию конечностей у млекопитающих оказались безуспешными. Так, под действием электрического тока или при сочетании действия электрического тока с фактором роста нервов удавалось получить у крысы только разрастание скелетной ткани в виде хрящевых и костных мозолей, которые не походили на нормальные элементы скелета конечностей.
Несомненна регуляция регенерационных процессов со стороны нервной системы.
При тщательной денервации конечности во время ампутации эпиморфная регенерация полностью подавляется и бластема никогда не образуется. Были проведены интересные опыты. Если нерв конечности тритона отвести под кожу основания конечности, то образуется дополнительная конечность. Если его отвести к основанию хвоста — стимулируется образование дополнительного хвоста. Отведение нерва на боковую область никаких дополнительных структур не вызывает. Эти эксперименты привели к созданию концепции регенерационных полей.
.
Было установлено, что для инициации регенерации решающим является число нервных волокон. Тип нерва роли не играет. Влияние нервов на регенерацию связывается с трофическим действием нервов на ткани конечностей.
Получены данные в пользу гуморальной регуляции
регенерационных процессов. Особенно распространенной моделью для изучения этого является регенерирующая печень. После введения нормальным интактным животным сыворотки или плазмы крови от животных, подвергшихся удалению печени, у первых наблюдалась стимуляция митотической активности клеток печени. Напротив, при введении травмированным животным сыворотки от здоровых животных получали снижение количества митозов в поврежденной печени. Эти опыты могут свидетельствовать как о присутствии в крови травмированных животных стимуляторов регенерации, так и о присутствии в крови интактных животных ингибиторов клеточного деления. Объяснение результатов опытов затрудняется необходимостью учитывать иммунологический эффект инъекций.
Важнейшим компонентом гуморальной регуляции компенсаторной и регенерационной гипертрофии является иммунологический ответ.
Не только частичное удаление органа, но и многие воздействия вызывают возмущения в иммунном статусе организма, появление аутоантител и стимуляцию процессов клеточной пролиферации.
Большие разногласия существуют по вопросу о клеточных источниках
регенерации. Откуда берутся или как возникают недифференцированные клетки бластемы, морфологически сходные с мезенхимными? Существует три предположения.
1. Гипотеза резервных клеток
подразумевает, что предшественниками регенерационной бластемы являются так называемые резервные клетки, которые останавливаются на некоем раннем этапе своей дифференцировки и не участвуют в процессе развития до получения стимула к регенерации.
2. Гипотеза временной дедифференцировки,
или модуляции, клеток предполагает, что в ответ на регенерационный стимул дифференцированные клетки могут утрачивать признаки специализации, но затем снова дифференцируются в тот же клеточный тип, т.е., потеряв на время специализацию, они не утрачивают детерминацию.
3. Гипотеза полной дедифференцировки
специализированных клеток до состояния, сходного с мезенхимными клетками и с возможной последующей трансдифференцировкой или метаплазией, т.е. превращением в клетки другого типа, полагает, что в этом случае клетка утрачивает не только специализацию, но и детерминацию.
Современные методы исследования не позволяют с абсолютной достоверностью доказать все три предположения. Тем не менее абсолютно верно, что в культях пальцев аксолотля происходит высвобождение хондроцитов из окружающего матрикса и миграция их в регенерационную бластему. Дальнейшая их судьба не определена. Большинство исследователей признают дедифференцировку и метаплазию при регенерации хрусталика у амфибий. Теоретическое значение этой проблемы заключается в допущении возможности или невозможности изменений клеткой ее программы до такой степени, что она возвращается в состояние, когда снова способна делиться и репрограммироватьсвой синтетический аппарат. Например, хондроцит становится миоцитом или наоборот.
Способность к регенерации не имеет однозначной зависимости от уровня организации,
хотя давно уже было замечено, что более низко организованные животные обладают лучшей способностью к регенерации наружных органов. Это подтверждается удивительными примерами регенерации гидры, планарий, кольчатых червей, членистоногих, иглокожих, низших хордовых, например асцидий. Из позвоночных наилучшей регенерационной способностью обладают хвостатые земноводные. Известно, что разные виды одного и того же класса могут сильно отличаться по способности к регенерации. Кроме того, при изучении способности к регенерации внутренних органов оказалось, что она значительно выше у теплокровных животных, например у млекопитающих, по сравнению с земноводными.
Регенерация у млекопитающих
отличается своеобразием. Для регенерации некоторых наружных органов нужны особые условия. Язык, ухо, например, не регенерируют при краевом повреждении. Если же нанести сквозной дефект через всю толщу органа, восстановление идет хорошо. В некоторых случаях наблюдали регенерацию сосков даже при ампутации их по основанию. Регенерация внутренних органов может идти очень активно. Из небольшого фрагмента яичника восстанавливается целый орган. Об особенностях регенерации печени уже было сказано выше. Различные ткани млекопитающих тоже хорошо регенерируют. Есть предположение, что невозможность регенерации конечностей и других наружных органов у млекопитающих носит приспособительный характер и обусловлена отбором, поскольку при активном образе жизни нежные морфогенетические процессы затрудняли бы существование. Достижения биологии в области регенерации успешно применяются в медицине. Однако в проблеме регенерации очень много нерешенных вопросов.
Старость
представляет собой стадию индивидуального развития, по достижении которой в организме наблюдаются закономерные изменения в физическом состоянии, внешнем виде, эмоциональной сфере.
Старческие изменения становятся очевидными и нарастают в пострепродуктивном периоде онтогенеза. Однако начало угасания репродуктивной функции или даже ее полная утрата не могут служить нижней границей старости. Действительно, менопауза у женщин, заключающаяся в прекращении выхода зрелых яйцеклеток из яичника и соответственно прекращении месячных кровотечений, определяет окончание репродуктивного периода жизни. Вместе с тем к моменту достижения менопаузы большинство функций и внешних признаков далеко не достигают состояния, характерного для старых людей. С другой стороны, многие изменения, которые мы связываем со старостью, начинаются до снижения репродуктивной функции. Это относится как к физическим признакам (поседение волос, развитие дальнозоркости), так и к функциям различных органов. К примеру, у мужчин снижение выделения мужских половых гормонов половыми железами и повышение выделения гонадотропных гормонов гипофизом, что характерно для старого организма, начинается примерно от 25 лет.
Различают хронологический и биологический (физиологический) возраст. Согласно современной классификации, основанной на оценке многих средних показателей состояния организма, людей, хронологический возраст
которых достиг 60—74 лет, называют пожилыми, 75—89 лет —старыми, свыше 90 лет —долгожителями. Точное определение биологического возраста
затруднено тем, что отдельные признаки старости проявляются в разном хронологическом возрасте и характеризуются различной скоростью нарастания. Кроме того, возрастные изменения даже одного признака подвержены значительным половым и индивидуальным колебаниям.
Рассмотрим такой признак, как упругость (эластичность) кожи. Один и тот же биологический возраст достигается в этом случае женщиной примерно в 30 лет, а мужчиной — в 80. Именно поэтому прежде всего женщинам необходим грамотный и постоянный уход за кожей. С целью определения биологического возраста, что необходимо для суждения о скорости старения, используют батареи тестов,
проводя совокупную оценку одновременно многих признаков, закономерно изменяющихся в процессе жизни.
Основу таких батарей составляют сложные функциональные показатели, состояние которых зависит от согласованной деятельности нескольких систем организма. Простые тесты обычно бывают менее информативными. Например, скорость распространения нервного импульса, которая зависит от состояния нервного волокна, снижается в возрастном интервале 20—90 лет на 10%, тогда как жизненная емкость легких, определяемая координированной работой дыхательной, нервной и мышечной систем,—на 50%.
Состояние старости достигается благодаря изменениям, составляющим содержание процесса старения.
Этот процесс захватывает все уровни структурной организации особи — молекулярный, субклеточный, клеточный, тканевой, органный. Суммарный результат многочисленных частных проявлений старения на уровне целостного организма заключается в нарастающем с возрастом снижении жизнеспособности особи,
уменьшении эффективности приспособительных, гомеостатических механизмов. Показано, например, что молодые крысы после погружения в ледяную воду на 3 мин восстанавливают температуру тела примерно за 1 ч. Животным среднего возраста на это требуется 1,5 ч, а старым — около 2 ч.
В целом старение приводит к прогрессивному повышению вероятности смерти.
Таким образом, биологический смысл старения заключается в том, что оно делает неизбежной смерть
организма1
. Последняя же представляет собой универсальный способ ограничить участие многоклеточного организма в размножении2
. Без смерти не было бы смены поколений — одного из главных условий эволюционного процесса.
Возрастные изменения в процессе старения не во всех случаях заключаются в снижении приспособляемости организма. У человека и высших позвоночных в процессе жизни приобретается опыт, вырабатывается умение избегать потенциально опасных ситуаций. Интересна в этом плане и система иммунитета. Хотя ее эффективность после достижения организмом состояния зрелости в целом снижается, благодаря «иммунологической памяти» по отношению к некоторым инфекциям старые особи могут оказаться более защищенными, чем молодые.
Рассмотрим кратко изменения органов и функциональных систем животных и человека, которые становятся заметными и нарастают по завершении активного репродуктивного периода онтогенеза.
Как правило, после 40—50 лет у человека возникают стойкие внешние проявления старения, в частности кожных покровов. Появляются морщины, образующиеся из-за потери подкожной жировой ткани, пигментные пятна, бородавки. Кожа становится сухой и шершавой в связи с уменьшением количества потовых желез, теряется ее эластичность, она становится дряблой.
Общее направление этих изменений для сердечно-сосудистой, дыхательной систем, а также основного обмена, отражающего состояние энергетических процессов в организме, иллюстрирует рис. 8.29.
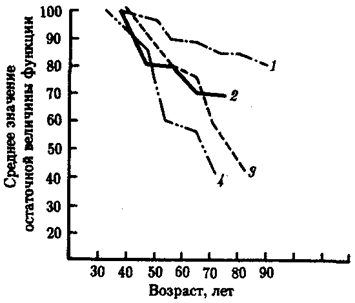
Рис. 8.29. Возрастные изменения некоторых жизненно важных функций человека: 1
— основной обмен, 2 —
сердечный индекс, 3—
скорость кровотока, 4—
емкость легких
Признаки старения сердечно-сосудистой системы
становятся заметными обычно в возрасте после 40 лет. Закономерные изменения наблюдаются в стенках сосудов: в них откладываются липиды, прежде всего холестерин, что наряду с другими структурными превращениями снижает эластичность и искажает ответы на различные стимулы, регулирующие кровообращение. Типичным является разрастание в стенках сосудов и сердца соединительной ткани, замещающей рабочую мышечную ткань. В результате снижается эффективность работы сердца. В итоге нарушается кровоснабжение тканей и органов. Так, кровоток по сосудам головного мозга 75-летнего человека по сравнению с 30-летним уменьшен на
В основе функциональных расстройств дыхательной системы
лежит разрушение межальвеолярных перегородок, что сокращает дыхательную поверхность, разрастание в легких соединительной ткани, снижает эффективность аэрогематического обмена кислорода. В итоге с возрастом падает жизненная емкость легких, которая к 75 годам достигает всего 56% от уровня в возрасте 30 лет.
Легко заметным изменением в системе пищеварения
является потеря зубов. Падает эффективность функционирования пищеварительных желез, нарушения двигательной (моторной) функции кишечника нередко приводят к привычным запорам.
В процессе старения страдает функция мочевыделительной системы,
снижается интенсивность фильтрации в почечных клубочках (на 31% в 75-летнем возрасте по сравнению с 30-летним), так же как и обратное всасывание веществ из фильтрата в почечных канальцах. Ухудшение функции мочевыделения объясняется гибелью с возрастом значительного количества нефронов (до 44% от уровня 30-летнего возраста), представляющих собой структурно-функциональные единицы почек.
Специального внимания заслуживают изменения в процессе старения со стороны мышечной системы
и скелета.
Снижается сила сокращений поперечно-полосатой мускулатуры, быстрее развивается утомление, наблюдается атрофия мышц. Характерная для стареющих людей перестройка костей заключается в разрежении их вещества (старческий остеопороз), что приводит к снижению прочности.
В процессе старения организма существенные изменения происходят в репродуктивной системе.
При этом они затрагивают обе основные функции главных органов названной системы — половых желез: выработку гамет и образование половых гормонов. У женщин овогенез прекращается по достижении ими менопаузы. Образование функционально полноценных сперматозоидов в мужском организме возможно, по-видимому, даже в преклонном возрасте.
Изменение гормонального профиля людей в связи с угасанием репродуктивной функции носит сложный характер. Распространенным является мнение о прогрессивном снижении с возрастом концентрации у мужчин тестостерона, а у женщин эстрадиола и прогестерона — главных мужского и женских половых гормонов. Напомним, что оба типа гормонов образуются организмами обоих полов, только в разном количестве. Указанные сдвиги сопровождаются повышением секреции эстрадиола и прогестерона у мужчин и тестостерона у женщин. Вместе с тем содержание фолликулостимулирующего гормона у 80—90-летних женщин выше в 14 раз, а лютеинизирующего гормона — в 5 раз, чем у 20—30-летних. Резко нарушено у старых людей соотношение названных гормонов гипофиза, что является важной причиной нарушения репродуктивной функции в целом. Картина усложняется также тем, что в процессе старения изменяется ответ ткани на половые гормоны в связи с сокращением количества клеточных рецепторов к ним.
Изменения в процессе старения функций эндокринной системы
носят объективно сложный характер. В качестве примера рассмотрим изменения в стареющем организме функции щитовидной железы. Обнаружено, что к старости падает содержание в крови трииодтиронина и тироксина, в связи с изменением белков плазмы крови ухудшается перенос гормонов к тканям, в клетках уменьшается количество рецепторов, узнающих гормоны, а чувствительность рецепторов повышается. Вместе с тем в крови сохраняется достаточно высокая концентрация тиреотропного гормона гипофиза; чувствительность к нему клеток щитовидной железы возрастает. Из приведенной картины видно, что в отдельных звеньях цепи регуляции жизненно важных функций гормонами щитовидной железы возрастные изменения не одинаковы по масштабу, а иногда и разнонаправлены. В таком случае важен общий результат, степень выраженности которого подвержена индивидуальным колебаниям.
Наряду с эндокринной системой нервной системе
принадлежит важнейшая роль в регуляции, координации и интеграции разнообразных проявлений жизнедеятельности. Изменения нервной системы в процессе старения включают нарастающую гибель нейронов, масштабы которой колеблются от отдела к отделу и составляют от 15—20 до 70—75%. С другой стороны, сохранившиеся клетки увеличивают свои размеры, образуют дополнительные разветвления окончаний отростков в тканях-мишенях, что имеет приспособительное, заместительное значение. Общий итог, однако, заключается в том, что после 40—50 лет в тканях образуется недостаток нервных влияний, что приводит к нарушению регуляций функций. Это справедливо, к примеру, в отношении иннервации сердца и сосудов, а также поперечно-полосатой скелетной мускулатуры симпатической нервной системой.
Функциональные нарушения в процессе старения в центральной нервной системе зависят как от уменьшения количества нервных клеток, так и от снижения синтеза медиаторов, ослабления связей между отдельньми мозговыми структурами, уменьшения скорости проведения нервных импульсов по волокнам и через синапсы. В стареющем организме с большим трудом вырабатываются условные рефлексы, приобретаются новые навыки. Изменения ряда функций носят более сложный характер. Так, интеллектуальные способности людей в возрасте 55—70 лет сохраняются такими же, какими они были в 20—30-летнем возрасте, а в возрасте 55—60 лет наблюдается второй пик творческой деятельности.
Одна из черт процесса старения заключается в снижении надежности механизмов регуляции,
направленных на поддержание постоянства жизненно важных параметров внутренней среды организма — гомеостаза.
Причину этого видят в функциональных изменениях стареющего гипоталамуса, с которым связывают действия своеобразных биологических часов
старения всего организма. К гипоталамической области головного мозга человека относятся 32 пары ядер, участвующих в регуляции важнейших вегетативных функций. В целом процесс старения гипоталамических структур характеризуется неравномерностью и разнонаправленностью, что типично для других областей нервной системы.
В старости наблюдается снижение функций практически всех органов чувств.
Уменьшается способность глаза к аккомодации, так как слабеют глазодвигательные мышцы и изменяется вещество хрусталика. Это ведет к старческой дальнозоркости. У старых людей хрусталик нередко теряет прозрачность — развивается катаракта. Падает острота зрения. Чувствительность органа слуха снижается, причем особенно к высокочастотным звуковым колебаниям. Старый человек хуже различает запах и вкус. К 75 годам люди сохраняют примерно 36% от количества вкусовых луковиц, которое имеется в возрасте 30 лет. У них нарушается чувство равновесия.
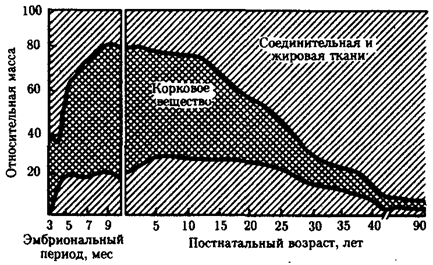
Рис. 8.30. Возрастные изменения вилочковой железы человека
С возрастом заметно изменяются функции иммунной системы.
За гуморальный иммунитет ответственны В-лимфоциты, вырабатывающие антитела к носителям чужеродной биологической информации — антигенам. Т-лимфоциты ответственны за клеточный иммунитет, например за отторжение трансплантата, хотя могут участвовать в реакциях гуморального иммунитета. К старости наблюдается ослабление реакций как гуморального, так и клеточного иммунитета. Становление функции иммунной системы во многом связано с активностью тимуса, которая прекращается в связи с инволюцией железы по достижении половозрелого возраста (рис. 8.30). Нарушение естественного развития иммунной системы в эксперименте путем удаления вилочковой железы (например, у мышей) сокращает продолжительность жизни животных. Напротив, пересадка тимуса и костного мозга от молодой мыши к старой приводит к омоложению иммунной системы 19-месячной мыши до уровня 4-месячной. Некоторые такие животные жили на Уз дольше своего обычного срока.
В стареющем организме клетки иммунной системы ошибочно вырабатывают антитела против собственных клеток и белков. Таким образом, старение сопровождается нарастанием аутоиммунных реакций.
Изменения в процессе старения органов кроветворной системы
заключаются в снижении продукции эритроцитов. С возрастом способность костного мозга к восстановлению массы эритроцитов падает почти в б раз. Восполнение утраченных вследствие потери 30—40% общего объема крови эритроцитов происходит у 2-месячных крыс по 4,8%, а у 25-месячных —по 0,8% в 1 сут (рис. 8.31).
Из изложенного в данном разделе следует, что процесс старения распространяется практически на все структуры и функции организма. При этом некоторые показатели (упругость кожи, поседение волос) изменяются с возрастом довольно монотонно. Другие (артериальное давление, жизненная емкость легких) изменения носят пороговый характер, начиная регистрироваться примерно в возрасте 35—45 лет.
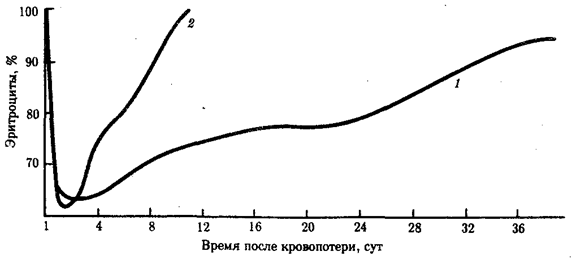
Рис. 8.31. Восстановление количества эритроцитов у 2-месячных (1)
и 25-месячных (2) мышей после кровопотери
Молекулярные и клеточные проявления старения многообразны. Они заключаются в изменении показателей потоков информации и энергии, состояния ультраструктур дифференцированных клеток, снижении интенсивности клеточной пролиферации.
Напомним, что функционирование ДНК, заключающей в себе биологическую информацию, связано с ее репродукцией, транскрипцией, репарацией. Учитывая возможную роль ошибок в молекулах ДНК, в нарушении клеточных функций в процессе старения изучали эффективность механизмов репарации повреждений молекулярной структуры ДНК (согласно расчетным данным, ежесекундно в геноме возникает минимум одно повреждение) в разном возрасте, а также корреляцию между интенсивностью этого процесса и продолжительностью жизни. В обоих случаях были получены противоречивые результаты. С одной стороны, уровень репарации повреждения ДНК УФ-облучением эмбриональных фибробластов трех линий мышей оказался пропорциональным средней продолжительности их жизни (900, 600 и 300 сут). С другой — репарация ДНК после УФ-облучения не различалась в культурах фибробластов в коже людей в диапазоне возрастов от 0 (новорожденные) до 88 лет. Общее заключение сводится к тому, что интенсивность молекулярной репарации ДНК меняется с возрастом в некоторых типах клеток, но не это является главной причиной клеточного старения.
В дифференцированных клетках млекопитающих животных старение сопровождается в целом снижением транскрипционной активности.
Так, у мышей интенсивность синтеза РНК в ядрах печеночных и нервных клеток между 12-м и 30-м месяцами жизни падает на 50%. Изменение синтеза относится не только к рРНК, не кодирующим структуру белков, но и к мРНК. В сравнении с активным репродуктивным периодом жизни в стареющем организме действительно наблюдается исчезновение в клетках определенных типов мРНК, правда, в это же время регистрируется появление некоторых типов мРНК, не образующихся ранее. Таким образом, речь идет о частичной смене биологической информации, используемой клеткой в разном возрасте.
Скорость снижения транскрипционной активности ДНК в постмитотических высокодифференцированных клетках, к примеру нервных, зависит от условий их существования в течение жизни, в частности от напряженности их функционирования. Так, одна и та же функциональная нагрузка, распределенная между меньшим количеством клеток, приводит к более раннему падению уровня транскрипции в их ядрах. Было также показано, что параллельно изменению скорости снижения транскрипции сокращается максимально достигаемая животными продолжительность жизни. ДНК эукариотических клеток находится в комплексе с белками — гистоновыми и негистоновыми, образуя вместе с ними хроматин ядер. Предполагают, что регуляция транскрипции информации с ДНК происходит путем изменения ДНК-белковых связей в хроматине. С возрастом такие связи становятся менее подвижными, отмечается снижение содержания в хроматине негистоновых белков.
Изменение трансляции
в процессе старения изучают по содержанию рРНК (показатель общей белокобразующей способности клетки), мРНК (набор образуемых белков), активности аминоацил-тРНК-синтетаз (ферменты активации аминокислот). Оказалось, что в возрасте от 12 до 70 лет у людей утрачивается до половины генов рРНК, относящихся, как известно, к умеренно повторяющимся нуклеотидным последовательностям, которые продублированы в геноме более 300 раз. Сохраняющееся число генов, по-видимому, способно обеспечить образование требуемого количества рРНК. Интенсивность белкового синтеза в целом снижается в зрелом возрасте.
О возрастных изменениях набора образуемых белков судят по содержанию в клетках различных ферментов. Полученные данные трудно оценить однозначно, так как обнаруженные отклонения даже в группах ферментов, сходных по функции, нередко разнонаправленны. Вместе с тем активность ферментов, ответственных за окисление, изменяется в стареющем организме однонаправленно: она снижается.
Немаловажное значение при старении имеют изменения энергетики организма,
в частности обратная связь между продолжительностью жизни животных различных видов и удельной скоростью обмена веществ отмечена давно. Существует особое понятие энергетического жизненного потенциала, отражающего общее количество расходуемой за жизнь энергии. Его величина для млекопитающих (кроме приматов) составляет примерно 924 кДж/г, большинства приматов — 1924, лемура, обезьяны-капуцина и человека — 3280 кДж/г массы тела. Изменения потока энергии в процессе старения состоят в снижении количества митохондрий в клетках, а также падении эффективности их функционирования. Так, у взрослых крыс количество кислорода, потребляемое на 1 мг белка митохондрий, более чем в 1,5 раза выше, чем у старых животных. Важным свойством стареющего организма является смещение в процессах энергообеспечения функций соотношения между тканевым дыханием и гликолизом (бескислородный путь образования АТФ) в пользу последнего.
Изменения в процессе старения ультраструктуры клеток затрагивают практически все органеллы как общего, так и специального значения. Одновременно может происходить накопление необычных веществ, иногда структурно оформленных (липофусцин). Наиболее заметна возрастная перестройка постмитотических высокоспециализированных клеток—нейронов, кардиомиоцитов. Для стареющих нервных клеток, например, типично обеднение цитоплазмы мембранами, сокращение объема шероховатой эндоплазматической сети, увеличение содержания в клеточных телах микрофибрилл, что, возможно, связано с нарушением транспорта веществ по отросткам.
В отростках мотонейронов старых крыс скорость транспорта составляет примерно 200, тогда как у зрелых животных —320 мм/сут. Параллельно наблюдается снижение интенсивности синтеза белка и РНК. Отмечается замедление проведения нервного импульса, а в некоторых типах нервных клеток — уменьшение количества образуемого медиатора. Наиболее типичной чертой старения нервных клеток млекопитающих и человека является нарастающее накопление с возрастом в цитоплазме пигмента липофусцина.
У 60-летних людей благодаря увеличению содержания пигмента доля цитоплазмы снижается в 1,3, ay 80-летних —в 2 раза в сравнении с 40-летними. Липофусцин часто называют пигментом изнашивания, т.е. балластом. Противоположная точка зрения приписывает липофусцину роль внутриклеточного депо кислорода.
Возрастное накопление липофусцина распространяется кроме нервной системы на сердечную и скелетную мускулатуру. Сдерживание роста содержания пигмента в клетках плодовых мух путем ограничения летательной активности сочеталось с двукратным увеличением средней продолжительности жизни.
Еще один пример изменения в ходе старения специальных органелл касается микрофибрилл в клетках сердечной мышцы, в отношении которых начинают преобладать деструктивные процессы.
На определенном этапе прогрессивная эволюция жизни на земле оказалась связанной с переходом к более эффективному аэробному типу энергообеспечения процессов жизнедеятельности. Не следует, однако, забывать, что использование клетками кислорода приводит к образованию свободных радикалов (О2
, ОН, Н2
О2
), которые в силу чрезвычайной реакционноспособности могут вызывать быстрые разрушения биологических структур (мембран, макромолекул). Неблагоприятным эффектам свободных радикалов в клетках противостоят закрепленные процессом эволюции природные антиоксидантные механизмы. К ним принадлежат ферменты, разрушающие пероксиды. В процессе старения действенность механизмов, нейтрализующих свободные радикалы и пероксиды, снижается. Свободные радикалы способны нарушить любое звено молекулярной организации клетки. Сказанное делает их универсальным фактором старения на молекулярном и субклеточном уровне вне зависимости от вида клетки.
С начала 60-х гг. появились новые взгляды на значение для старения и продолжительности жизни закономерностей клеточной пролиферации.
На основании подсчета числа делений фибробластов, высеваемых в культуру ткани от эмбриона человека и от людей в возрастете лет и выше, было сделано заключение о пределе клеточных делений
(лимит Хейфлика), которому соответствует видовая длительность жизни. Показано, что фибробласты мыши способны удваивать свою численность 14—28 раз, цыпленка — 15—35, человека — 40—60, черепахи — 72— 114 раз. Проверка результатов, о которых идет речь, выявила, что представление об ограниченности числа клеточных делений в индивидуальном развитии является неточным.
Вместе с тем сохраняют свое значение классические представления, уходящие корнями в XIX столетие, утверждающие, что старение и естественное его следствие — смерть — это своеобразная плата за явление клеточной дифференцировки. Выход клеток в дифференцировку для многих типов клеток означает старение и гибель в связи с утратой возможности возвращения в митотический цикл (нервные клетки, сердечная и скелетная мышцы, лейкоциты и эритроциты крови, эпителий ворсин кишечника).
Согласно данным многочисленных наблюдений, на скорость нарастания и выраженность изменений в процессе старения оказывают влияние генетическая конституция (генотип) организма, условия, в которых он развивается и живет, а для человека — его образ жизни.
Старение представляет собой всеобъемлющий процесс, охватывающий все уровни структурной организации особи — от макромолекулярного до организменного. Этим, а также тем, что главным биологическим результатом старения является прогрессивное повышение вероятности смерти, объясняется использование в исследованиях по генетике старения такого обобщающего показателя, как продолжительность жизни в пострепродуктивном периоде, наследуемость которого, собственно, и изучается.
Ряд наблюдений легли в основу достаточно распространенной точки зрения о наследуемости продолжительности жизни и, следовательно, наличии генетического контроля
или даже особой генетической программы
старения. Во-первых, максимальная продолжительность жизни ведет себя как видовой признак. При этом она положительно связана с такими важными эволюционно закрепленными показателями биологии вида, как длительность эмбрионального периода и возраст достижения половой зрелости (табл. 8.1). Во-вторых, величины продолжительности жизни у однояйцевых близнецов более близки (конкордантны), чем у разнояйцовых. Попарные различия по этому показателю составляют в среднем 14,5 года для первых и 18,7 года для вторых. Сходная картина наблюдается при сопоставлении колебаний длительности жизни среди лабораторных животных одной линии и различных линий. Так, у мышей получены линии с продолжительностью жизни от 120 до 700 сут.
В-третьих, описаны наследственные болезни с ранним проявлением признаков старости и одновременно резким сокращением продолжительности жизни. Например, при синдроме Хатчинсона — Гилфорда (инфантильная прогерия, или постарение в детском возрасте) уже на первом году жизни отмечаются задержка роста, раннее облысение, морщины, атеросклероз. Половой зрелости такие субъекты, как правило, не достигают, и смерть наступает в возрасте до 30 лет. Для названного синдрома установлено аутосомно-доминантное наследование.
В-четвертых, в лабораторных условиях путем близкородственных скрещиваний получены инбредные линии плодовой мухи и мыши, существенно различающиеся по средней и максимальной продолжительности жизни. Гибриды 1-го поколения от скрещивания родителей из разных короткоживущих линий (рис. 8.32) живут дольше родителей, что расценивают как явление гетерозиса.
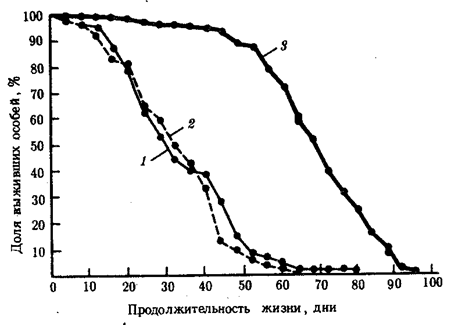
Рис. 8.32. Явление гетерозиса, заключающееся в увеличении длительности жизни гибридов первого поколения от скрещивания плодовых мух из двух короткоживущих линий: 1
— инбредная линия К, 2
— инбредная линия В,
3 —
гибриды F1 (В х К)
Таблица 8.1. Максимальная продолжительность жизни, длительность эмбрионального периода и возраст достижения половой зрелости
у различных видов млекопитающих животных
| Организм
|
Максимальная продолжительность жизни, мес
|
Длительность беременности, мес
|
Возраст достижения половой зрелости, мес
|
| Человек
Индийский слон
Лошадь
Шимпанзе
Бурый медведь
Домашняя собака
Крупный рогатый скот
Макака-резус
Кошка
Свинья
Саймири
Овца
Коза
Серая белка
Европейский кролик
Морская свинка
Домашний кролик
Золотистый хомячок
Мышь
|
1380
840
744
534
442
408
360
348
336
324
252
240
216
180
156
90
56
48
42
|
9
21
11
8
7
2
9
5,5
2
4
5
5
5
1,5
1
2
0,7
0,5
0,7
|
144
156
12
120
72
7
6
36
15
4
36
7
7
12
12
2
2
2
1,5
|
В-пятых, замечено, что среди плодовых мух особи, гомозиготные по аллелю зачаточных крыльев, имеют меньшую продолжительность жизни, чем мухи дикого типа (плейотропия). Потомки от скрещивания мутантов и мух дикого типа по рассматриваемому показателю проявляют единообразие и близки к последним. Среди гибридов 2-го поколения от скрещивания таких потомков между собой происходит расщепление по продолжительности жизни в отношении 3:1 (дикий тип: мутантный тип). Аналогично описанной мутации у мыши, также обнаружено много примеров влияния отдельных генов на продолжительность жизни, причем в сторону ее снижения.
Сходным примером у человека является мутация, приводящая к развитию синдрома Марфана и фенотипически проявляющаяся в дефектном развитии соединительной ткани: наряду с «паучьими» пальцами, подвывихом хрусталика, пороком сердца, повышенным выбросом в кровь адреналина такие субъекты отличаются сокращенной продолжительностью жизни. В-шестых, для людей выявлена положительная связь между длительностью жизни родителей и потомков.
Приведенные материалы, свидетельствуя в пользу генетического контроля длительности жизни и старения, не дают ответа на важные вопросы о том, насколько велика сила этого контроля и через какие конкретные генетические механизмы он осуществляется. Представление о величине наследуемости продолжительности жизни получают, определяя коэффициент наследуемости.
Он отражает меру сходства между родственниками по изучаемому признаку. По данным разных авторов, коэффициент корреляции между продолжительностью жизни детей и родителей составляет от 0,02 до 0,13, т.е. низок. Сходные цифры получены для мышей: 0,01 —0,40. Родители и дети принадлежат к разным поколениям, а условия проживания меняются. С целью избежать занижения значений коэффициента корреляции за счет различий в условиях жизни сопоставляли продолжительность жизни братьев и сестер. В данном случае коэффициент корреляции оказался выше: 0,15—0,30. Однако и здесь значения существенно ниже тех, которые характеризуют признаки с высокой наследуемостыо. К примеру, коэффициент наследуемости роста составляет примерно 0,70.
Данные по коэффициенту наследования долголетия полезно дополнить примерами, раскрывающими их биологический смысл. Так, если пронаблюдать 25-летних людей, предки которых жили либо достаточно мало, либо, наоборот, достаточно долго, то различие между этими группами по средней продолжительности жизни составит всего 2—4 года. Тем не менее существуют данные о некоторой связи между средней длительностью жизни предков и потомков, прослеживаемой до 70-летнего возраста.
| Возраст опрашиваемых
потомков, лет
40
50
60
70
90
95
100
105
|
Средняя продолжительность
жизни предков, лет
66,0
66,8
70,5
74,8
74,3
74,3
74,8
73,8
|
Изучение связи между продолжительностью жизни родителей и детей, достигших 20-летнего возраста, показало, что превышение родителями средней продолжительности жизни на 10 лет добавляет к жизни детей 1 год.
Результаты оценки степени генетического контроля старения путем расчета коэффициента наследуемости долгожительства указывают лишь на отсутствие специальной генетической программы старения.
Между тем первостепенный интерес для медицины представляет вопрос о факторах, влияющих на скорость этого процесса, среди которых могут быть и генетические. Общий вывод заключается в том, что при отсутствии специальных генов или целой программы, прямо определяющих развитие старческих признаков, процесс старения находится тем не менее под генетическим контролем путем изменения его скорости.
Называют разные пути такого контроля. Во-первых, это плейотропное действие,
свойственное многим генам. Допустим, что один из плейотропно действующих генов оказывает выраженное положительное влияние на ранних стадиях индивидуального развития, но ряд связанных с ним фенотипических проявлений носит отрицательный характер. Для сохранения полезных свойств гена и ослабления вредных в генотипе появляются и закрепляются отбором гены-модификаторы, ослабляющие неблагоприятное действие в раннем онтогенезе. В пострепродуктивном периоде онтогенеза действие модификаторов, уже не поддерживаемое отбором, снижается. Это дает возможность неблагоприятным свойствам гена проявить себя, ускоряя старение.
Во-вторых, со временем в генотипах соматических клеток,
особенно в области регуляторных нуклеотидных последовательностей, накапливаются ошибки
(мутации). Следствием этого является нарастающее с возрастом нарушение работы внутриклеточных механизмов, процессов репликации, репарации, транскрипции ДНК.
В-третьих, генетические влияния на скорость старения могут быть связаны с генами предрасположенности к хроническим заболеваниям,
таким, как ишемическая болезнь сердца, атеросклероз сосудов головного мозга, гипертония, наследуемым по полигенному типу. Правда, некоторые формы семейного повышения уровня холестерина в крови, что является фактором риска ишемической болезни сердца, наследуются моногенно. Частота этих форм составляет 6—8 на 1000 человек. Исследования на долгожителях показывают, что их отличает повышенная устойчивость к хроническим заболеваниям, а время наступления названных болезней отсрочено. Так, среди лиц, превысивших 80-летний возрастной рубеж и страдавших атеросклерозом сосудов головного мозга, свыше 86% лиц имели лишь начальную стадию заболевания. В пользу наличия генотипических влияний говорит то, что у родственников долгожителей как бы замедлен темп старения нервной системы: некоторые показатели функционирования этой системы соответствуют на 15—20 лет меньшему календарному возрасту. Об этом свидетельствует повышенная вероятность заболеть ишемической болезнью у родственников (особенно 1-й степени родства) лиц, страдающих этим заболеванием.
Приведенные выше примеры зависимости скорости старения от особенностей генотипа можно истолковать как доказательство участия генотипа в контроле старения, т.е. процессов, ведущих к снижению жизнеспособности в пострепродуктивном периоде. Вместе с тем правомерна и иная точка зрения. От индивидуальных особенностей генотипа зависит надежность молекулярных, клеточных, системных механизмов жизнеспособности организма. Таким образом, речь идет о генетической основе противостояния процессу старения,
снижения его скорости или степени риска заболеть достаточно рано хроническим заболеванием, большей устойчивости в стрессовых ситуациях.
Условия жизни
относятся к категории понятий, отличающихся широтой и некоторой размытостью границ. Если для животных оно включает природно-географические, прежде всего климатические, факторы, то в отношении человека необходимо учитывать также и социально-экономические факторы.
Исследование влияний условий жизни на процесс старения про-„водят несколькими путями. Во-первых, путем изучения скорости соответствующих изменений организмов, проживающих в разных условиях. Во-вторых, путем сопоставления значений смертности или продолжительности жизни в различающихся по условиям жизни популяциях в пределах одного или разных исторических периодов времени. Продолжительность жизни здесь выступает как обобщенный показатель жизнеспособности. В-третьих, свой вклад вносит изучение распределения по планете долгожителей.
Оценка влияния условий жизни на скорость старения требует предварительного отбора демонстративных показателей, значения которых закономерно изменяются соответственно возрасту. В исследованиях зависимости скорости старения от условий жизни, проводимых на лабораторных животных,
используют следующие признаки: 1) состояние белков соединительной ткани коллагена и эластина; 2) показатели сердечной деятельности и кровообращения; 3) содержание пигмента липофусцина в клетках нервной системы и сердца; 4) показатели произвольной двигательной активности; 5) способность к обучению.
Изучали влияние на скорость старения многих условий жизни: пониженной температуры окружающей среды, измененного режима двигательной активности, воздействий ионизирующим облучением, повышенного парциального давления кислорода. В опытах на плодовых мухах, например, установлено, что увеличение в атмосфере в три раза концентрации 02
приводит к ускоренному старению, что выражается в более быстром отложении в тканях липофусцина. Параллельно отмечалось сокращение вдвое длительности жизни. В другом опыте кроликов с раннего возраста систематически и длительно подвергали повышенным двигательным нагрузкам. В описанных условиях у кроликов замедлялся ритм сердечных сокращений, снижалось артериальное давление. Направление изменений со стороны сердечно-сосудистой системы дает возможность судить о снижении скорости старения животных. Одновременно было установлено, что подопытные кролики жили в 1,5 раза дольше животных с обычной для вида двигательной активностью.
В процесс старения вовлекаются все структуры
и функции
организма. Важным свойством этого процесса является его гетерогенность.
В соответствии с этим свойством изменения, характерные для старения, появляются в различных клетках, тканях и органах в разном календарном возрасте. С другой стороны, в любом органе стареющего организма типичные для этого процесса изменения сочетаются с изменениями приспособительными,
направленными на восполнение структурных и функциональных потерь. В таких условиях невозможно точно определить скорость старения организма как целостной системы путем оценки скорости старения по изменениям отдельных показателей, будь то накопление липофусцина или повышение артериального давления. Необходим обобщенный критерий, каковым является продолжительность жизни
или связанная с ней жизнеспособность.
Использование такого показателя, как продолжительность жизни, носящего статистический характер, позволяет проводить исследования непосредственно на людях, группируя условия жизни согласно их природе: социально-экономические, климатогеографические, местные, связанные, например, с минеральным составом почв и грунтовых вод или же уровнем радиации.
Влияние социально-экономических условий
на длительность жизни может быть оценено путем сравнения названного показателя для одной и той же популяции (например, население страны), но в разные исторические периоды или же путем сопоставления продолжительности жизни в двух популяциях, различающихся по жизненному уровню и сосуществующих в одно и то же историческое время. Социально-экономические условия жизни населения стран Европы, Северной Америки, некоторых стран Азии и Африки претерпели существенные изменения в текущем столетии. Главным итогом этих изменений явилось повышение жизненного уровня, улучшение питания, жилищных условий, качества охраны здоровья и медицинской помощи. Соответственно значения средней продолжительности жизни в таких странах возросли к 90-м гг. XX в. более чем в два раза в сравнении со значениями показателя для начала века. К примеру, в начале века средняя продолжительность жизни жителей России составляла 32 года, тогда как в 1987 г. она достигла уровня 64 лет для мужчин и 73 для женщин.
В экономически развитых странах средняя продолжительность жизни в целом превышает 70 лет, однако во многих развивающихся странах и в настоящий исторический период она не достигает 40 лет.
Приведенные сведения указывают на очевидную зависимость длительности жизни от социально-экономических условий. Означает ли это, что изменения социально-экономических условий в сторону их улучшения замедляют скорость старения? Зависимость смертности людей от возраста показана на рис. 8.33. По ходу приведенной кривой наблюдаются три отрезка, различающихся по интенсивности и направлению изменения смертности. Во-первых, это пик смертности, вершина которого приходится на период новорожденности: примерно 2000 младенческих смертей на 100 000 рождаемых. Далее интенсивность смертности снижается, и в возрасте 9—12 лет она минимальна: 20—30 умерших на 105
детей. Начиная с возраста половой зрелости смертность монотонно возрастает, причем рост происходит по экспоненте таким образом, что после 30—35 лет удвоение значений происходит каждые 8 лет. В возрасте более 80 лет интенсивность смертности высока и по мере прибавления лет практически не меняется.
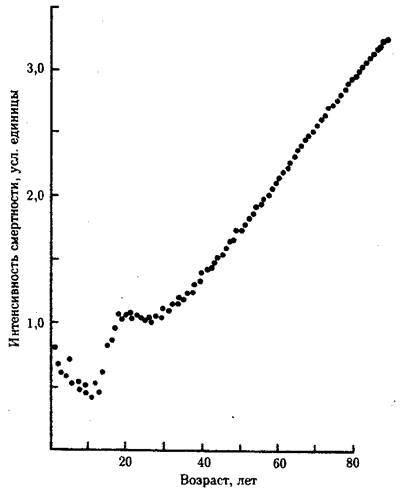
Рис. 8.33. Интенсивность смертности мужчин в зависимости от их возраста (Швеция, 1971— 1975 гг.)
Для суждения о зависимости скорости старения людей от социально-экономических условий жизни достаточно сравнить ход кривых возрастной интенсивности смертности в популяции в начале и во второй половине XX в. Видно, что принципиальных изменений конфигурация кривой не претерпела. На всем своем протяжении она лишь сместилась в область более низких значений. Следовательно, улучшение социально-экономических условий уменьшает вероятность смерти в молодом возрасте, но не изменяет скорости старения. На неизменяемость скорости старения в конкретной популяции людей в течение XX в., несмотря на существенное повышение жизненного уровня, указывают, например, данные об абсолютном возрастном приросте интенсивности смертности мужчин Швеции с 1900 по 1980 г. (рис. 8.34). Таким образом, лучшие социально-экономические условия делают людей, притом любого возраста, лишь менее доступными действию факторов, которые в иных условиях привели бы к смертельному исходу.
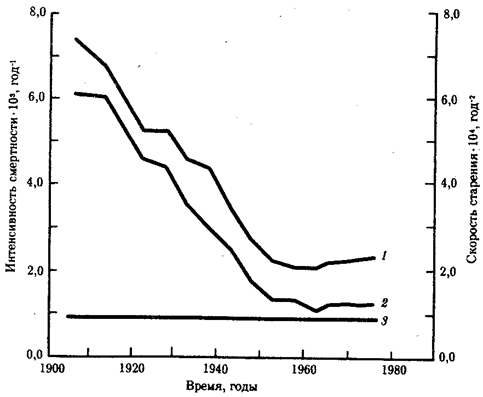
Рис. 8.34. Постоянство скорости старения людей
определенной популяции в XX в. (Швеция):
1
— интенсивность смертности мужчин в возрасте 40 лет,
2 —
то же, в возрасте 30 лет,
3 —
скорость старения мужчин в возрастном интервале 30—40 лет
Сделанное заключение хорошо согласуется с теми изменениями, которые произошли на протяжении текущего столетия в перечне главных причин смертности людей (на примере населения г. Нью-Йорка с 1900 по 1970 г.):
| Год, причина смерти
1900г.
Пневмония, грипп, бронхит
Туберкулез
Диаррея, энтериты
Болезни сердца
1930 г.
Болезни сердца
Пневмония, грипп, бронхит
Рак
Нефриты
1970 г.
Болезни сердца
Рак
Инсульт
Грипп, пневмония, бронхит
|
Количество всех смертных случаев, %
14,4
11,3
8,1
8,0
18,9
9,4
8,6
8,0
38,3
17,2
10,6
3,6
|
Относительно скромные значения средней продолжительности жизни (35—40 лет) в сравнении с максимально регистрируемой (115—120 лет) в первой трети XX в. в подавляющем большинстве стран Европы, отличавшихся в тот период относительно высоким жизненным уровнем, затрудняли прицельное изучение влияния физико-химических, климатических и иных природных факторов на скорость старения в популяциях, занимающих различные территории. В настоящее время с увеличением средней длительности жизни до 67,3—74,1 года у мужчин и до 74,2—79,9 года у женщин ситуация изменилась.
Рассмотрим следующий пример. Мужчин Финляндии отличает низкий показатель средней продолжительности жизни (69,2 года в 1980 г.) и один из самых высоких показателей смертности от сердечно-сосудистых заболеваний в Европе. При этом в самой Финляндии особенно высоких значений этот показатель достигает в Северной Карелии. При изучении минерального состава почв и грунтовых вод этого района оказалось, что в них исключительно низка концентрация микроэлемента селена. Соответственно низкой оказалась и концентрация Se в крови финнов: 0,056—0,081 мкг/мл, в сравнении с 0,206 мкг/мл, например, у жителей США. У мужчин с концентрацией Se в сыворотке крови менее 0,045 мкг/мл риск смерти от сердечно-сосудистых заболеваний выше в 2,7 раза, а от ишемической болезни сердца — в 3,6 раза. Зависимость скорости старения от поступления в организм достаточных количеств Se объясняется тем, что последний входит в состав фермента глутаминопероксидазы. Названный фермент катализирует реакции распада Н2
02
и органических гидропероксидов, разрушающих мембраны и другие клеточные структуры.
Следует отдавать отчет в том, что Se представляет собой лишь один из природных факторов, который, включаясь в процессы жизнедеятельности, изменяет риск смерти, влияя на скорость возрастной перестройки сердечно-сосудистой и других систем организма. Число таких факторов велико, причем большинство из них, видимо, еще не определены. С другой стороны, в Финляндии недостаток Se в диете мало сказывается на жизнеспособности женщин, которые по средней продолжительности жизни (77,6 года в 1980 г.) относятся в Европе к достаточно благополучным популяциям. Причина, по-видимому, кроется в генотипических различиях: у мужчин во всех клетках активна единственная хромосома Х материнского происхождения со всеми ее дефектами, а у женщин в разных клетках активна хромосома Х то материнского, то отцовского происхождения.
Испытания атомного и водородного оружия, развитие ядерной энергетики и технологий повышают уровень радиационного фона. Расчеты на человечество в целом показывают, что хроническое облучение населения планеты с мощностью дозы 1 Гр на поколение сокращает продолжительность жизни на 50 000 лет на каждый миллион живых новорожденных в первом облученном поколении. В настоящее время за счет естественных и созданных человеком источников радиации за поколение человечество получает менее 0,05 Гр. Воздействие на живые ткани ионизирующего облучения приводит к образованию в них свободных радикалов, которые повышают риск развития сердечно-сосудистых заболеваний и рака (рис. 8.35). Так как нарастание риска указанных заболеваний является показателем скорости старения, изменения условий жизни в сторону повышения радиационного воздействия ускоряют названный процесс.
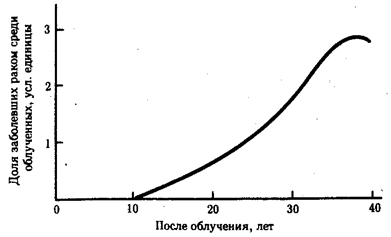
Рис. 8.35. Рост вероятности развития злокачественных опухолей
(кроме лейкозов) после однократного облучения всего тела дозой 0,01 Гр
Определенные, хотя и ограниченные представления о влиянии условий жизни на процесс старения дает изучение субпопуляций долгожителей.
Напомним, что к долгожителям причисляются лица в возрасте 90 лет и более. Их количество в популяции выражается индексом долгожительства, т.е. долей долгожителей среди населения старше 60 лет: 90/60·1000, где 90 — число долгожителей; 60 — число членов популяции в возрасте 60 лет. На большей территории бывшего СССР (названия государства и административных единиц соответствуют 1970 г.; приводимые цифры основаны на данных переписи, проведенной в указанном году) индекс долгожительства не превышает 20%. В ряде территорий, однако, его значения превосходят названное в 2,5—3 раза. Для абхазов в Абхазии, азербайджанцев в Нахичевани, балкарцев в Кабардино-Балкарии, ингушей в Северной Осетии и Чечено-Ингушетии он превосходит 60%, для эвенков в Якутии — 50%.
Из приведенных сведений видно, что долгожительство характеризует определенные этнические группы, проживающие в основном в сельской местности, для которых можно предполагать достаточно высокий уровень брачной изоляции. Это наводит на мысль о генетической основе явления или же каких-то особенностях образа жизни. Два факта тем не менее свидетельствуют в пользу того, что и условия жизни могут иметь некоторое значение. Во-первых, индекс долгожительства, например, азербайджанцев, проживающих в Грузии и Азербайджане, оказывается ниже примерно на 10%, чем для проживающих в Нахичевани. Во-вторых, русское население в зонах долгожительства (Кавказ, Якутия) отличается более низкими значениями индекса в сравнении с населением, исторически традиционным территории.
Понятие образа жизни
в строгом смысле применимо лишь к человеку, так как включает в себя осознанное отношение к собственным действиям и, следовательно, оставляет за индивидуумом право выбора поступать так или иначе. В повседневной жизни образ жизни нередко как бы навязывается людям внешними обстоятельствами (ограниченная двигательная активность работников интеллектуального труда и детей, увлеченных компьютерными играми, напряженный ритм жизни многомиллионного города, национальные традиции в питании). Значение образа жизни в изменении скорости старения усиливается тем, что те или иные привычки, среди которых есть вредные, устанавливаются в раннем зрелом возрасте и сопровождают человека обычно на протяжении всей жизни. Из многих важных сторон, характеризующих образ жизни, рассмотрим такие, как диета и семейная жизнь.
Осознание учеными зависимости скорости старения от особенностей питания
изначально связано с результатами экспериментальной геронтологии. Приведем данные одного из многих опытов. При скармливании крысам начиная с момента прекращения питания материнским молоком сбалансированной по витаминам и минеральным веществам, но низкокалорийной пищи удалось увеличить среднюю продолжительность жизни с 680 до 971 сут, а животные-рекордсмены доживали до 4-летнего возраста. По внешнему виду крысы 2—3-летнего возраста из этой группы походили на трехмесячных контрольных животных. Среди них на 50—90% снижалась частота гломерулонефрита, соединительнотканного перерождения сердечной мышцы (миокардиальный фиброз), а также некоторых опухолей.
Систематическое изучение влияния диеты на старение людей — дело исключительно трудное. С одной стороны, это длительные наблюдения, практически сопоставимые по времени с продолжительностью жизни, что требует от участников поистине сверхдисциплинированности. С другой стороны, ранний переход к низкокалорийной диете, как показали исследования на животных, резко повышает вероятность смерти в детском возрасте. Вместе с тем общий вывод заключается в том, что контролируемая диета представляет собой важнейший фактор здорового долголетия. Пища должна иметь пониженную калорийность с ограничением жирного, сладкого и соленого, но высоким содержанием клетчатки и пектиновых веществ. Основной источник калорий — белки и углеводы растительного происхождения, однако полного исключения продуктов животного происхождения не требуется. При этом пища должна быть разнообразной, содержать достаточное количество витаминов и микроэлементов.
Различные составляющие описанной диеты влияют на процесс старения через разные механизмы жизнедеятельности. О том, чем объясняется положительное действие микроэлемента Se, говорилось выше. Известно, что, при недостатке в пище клетчатки и пектиновых веществ растет вероятность сердечно-сосудистых заболеваний и рака. Показана сильная положительная связь между потреблением жиров и таким заболеванием, как рак молочной железы, толстого кишечника (рис. 8.36). Важно помнить, что для любой категории продуктов находятся заболевания, частота которых связана с их преимущественным потреблением. Так, преобладание в диете продуктов в основном животного происхождения (мясо, яйца, масло, молоко, но также сахар, пиво) свойственно популяциям с высокой смертностью от ишемической болезни сердца, рака толстого кишечника и молочной железы. Преобладание продуктов растительного происхождения (рис, бобовые, пшеница, овощи, фрукты, но рыба и вино) характеризует диету популяций с высокой смертностью от туберкулеза органов дыхания, язвенной болезни, цирроза печени, нефрита, рака полости рта, гортани, пищевода, желудка
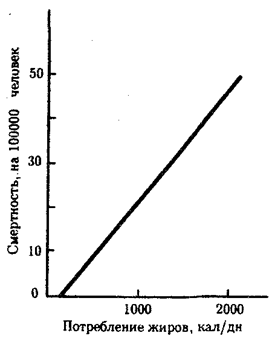
Рис. 8.36. Связь между потреблением жиров и смертностью
от рака толстой кишки (лица в возрасте 55—64 лет)
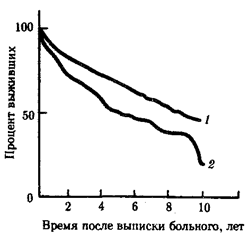
Рис. 8.37. Связь между выживанием мужчин
после перенесенного инфаркта миокарда и семейным положением:
1
— женатые, 2 —
неженатые
Приведенные данные говорят в пользу питания, сбалансированного по основным компонентам. Главным же правилом остается пониженная общая калорийность. Каковы возможные механизмы положительного действия низкокалорийного питания на старение? Ответ прост: речь может идти не о пользе низкокалорийной диеты, а о вреде переедания.
Статистика показывает, что защитное действие семейного образа жизни,
во-первых, распространяется на все возрасты и, во-вторых, проявляется в отношении подавляющего большинства причин смерти, включая сердечно-сосудистые заболевания, рак, аппендицит, туберкулез, болезни органов пищеварения.
Механизм действия семейного образа жизни, видимо, достаточно сложен. Об этом свидетельствуют данные об исходе такого заболевания, как острый инфаркт миокарда у семейных и не имеющих семьи людей. В больницах при этом заболевании погибает 19,7% женатых и 26,7% неженатых мужчин, 23,3% замужних и 37,4% незамужних женщин. Среди перенесших инфаркт миокарда половина неженатых мужчин погибает в первые пять лет, тогда как женатых — в первые девять лет (рис. 8.37). Для замужних женщин этот период составляет 10, а незамужних — 6 лет.
Конкретные пути благотворного влияния семейной жизни не установлены. Возможно, речь идет о благоприятной психоэмоциональной обстановке, сглаживании стрессовых ситуаций. Следует подумать также об особенностях функции желез внутренней секреции.
С понятием экология
мы связываем обычно совокупность абиологических и биологических факторов, действующих на организм в среде его обитания, т.е. внешние условия жизни. Но сходные по своей природе факторы, например микробные, могут действовать на организм и изнутри. Действительно, определенные штаммы бактерий, обитающие в кишечнике, являются обязательными симбионтами животных и человека, причем им принадлежит важная роль в осуществлении ряда функций (обмен витаминов и др.). Все это дает основание судить об эндоэкологии организма.
В последние десятилетия технические возможности позволяют, с одной стороны, получать и содержать животных, полностью лишенных обычной для них внутренней микрофлоры (гнотобионты), а с другой — произвольно заселять тот же кишечный тракт специальными штаммами бактерий. Есть данные, указывающие на увеличение средней и максимально регистрируемой продолжительности жизни безмикробных животных и замедлении скорости старения. Возможное объяснение этому факту кроется в особенностях функционирования иммунной системы.
Геронтология знает не менее 500 гипотез, объясняющих и первопричину, и механизмы старения организма. Подавляющее большинство их не выдержало проверки временем и представляет чисто исторический интерес. К ним, в частности, относятся гипотезы, связывающие старение с расходованием особого вещества клеточных ядер, страхом смерти, утратой некоторых невосполняемых веществ, получаемых организмом в момент оплодотворения, самоотравлением продуктами жизнедеятельности, токсичностью продуктов, образуемых под действием микрофлоры толстого кишечника. Гипотезы, представляющие научную ценность в наши дни, соответствуют одному из двух главных направлений.
Некоторые авторы рассматривают старение как стохастический процесс возрастного накопления «ошибок»,
неизбежно случающихся в ходе обычных процессов жизнедеятельности, а также повреждений биологических механизмов
под действием внутренних (спонтанные мутации) или внешних (ионизирующее облучение) факторов. Стохастичность обусловливается случайным характером изменений во времени и локализации в организме. В различных вариантах гипотез данного направления первостепенная роль отводится разным внутриклеточным структурам, от первичного повреждения которых зависят функциональные расстройства на клеточном, тканевом и органном уровнях. Прежде всего это генетический аппарат клеток (гипотеза соматических мутаций).
Многие исследователи связывают начальные изменения старения организма с изменениями строения и, следовательно, физико-химических и биологических свойств макромолекул: ДНК, РНК, белков хроматина, цитоплазматических и ядерных белков, ферментов. Особо выделяют также липиды клеточных мембран, часто являющиеся мишенью для свободных радикалов. Сбои в работе рецепторов, в частности клеточных оболочек, нарушают эффективность регуляторных механизмов, что приводит к рассогласованию процессов жизнедеятельности.
К рассматриваемому направлению относятся также гипотезы, усматривающие первооснову старения в нарастающем с возрастом износе структур
в диапазоне от макромолекул до организма в целом, приводящем в конце концов к состоянию, не совместимому с жизнью. Такое представление, однако, слишком прямолинейно. Напомним, что возникновению и накоплению мутационных изменений в ДНК противостоят природные антимутационные механизмы, а вредные последствия образования свободных радикалов снижаются благодаря функционированию антиоксидантных механизмов. Таким образом, если «концепция износа» биологических структур правильно отражает сущность старения, то итог в виде большей или меньшей скорости старческих изменений возраста, в котором у разных людей эти изменения становятся очевидными, является следствием наложения разрушительных и защитных процессов. В этом случае гипотеза износа с неизбежностью включает в себя такие факторы, как генетическая предрасположенность, условия и даже образ жизни, от которых, как мы видели, зависит скорость старения.
Второе направление представлено генетическими
или программными гипотезами,
согласно которым процесс старения находится под прямым генетическим контролем. Указанный контроль, согласно одним взглядам, осуществляется с помощью специальных генов.
По другим взглядам, он связан с наличием специальных генетических программ,
как это имеет место в отношении других стадий онтогенеза, например эмбриональной.
В пользу запрограммированности старения приводят доказательства, многие из которых уже рассмотрены в разд. 8.6.1. Обычно также ссылаются на наличие в природе видов, у которых вслед за размножением бурно нарастают изменения, приводящие животных к гибели. Типичный пример —тихоокеанские лососи (нерка, горбуша), погибающие после нереста. Пусковой механизм в этом случае связан с изменением режима секреции половых гормонов, что следует рассматривать как особенность генетической программы индивидуального развития лососевых, отражающей их экологию, а не как универсальный механизм старения. Примечательно, что кастрированная горбуша не нерестится и живет в 2—3 раза дольше. Именно в эти дополнительные годы жизни следует ожидать появления признаков старения в клетках и тканях.
Некоторые программные гипотезы основаны на допущении, что в организме функционируют биологические часы,
в соответствии с которыми происходят возрастные изменения. Роль «часов» приписывают, в частности, вилочковой железе, прекращающей функционирование при переходе организма в зрелый возраст. Еще один кандидат — это нервная система, особенно некоторые ее отделы (гипоталамус, симпатическая нервная система), главным функциональным элементом которой являются первично стареющие нервные клетки. Допустим, что прекращение в определенном возрасте функций тимуса, что, несомненно, находится под генетическим контролем, является сигналом начала старения организма. Это, однако, не означает генетического контроля процесса старения. В отсутствие тимуса ослабляется иммунологический контроль за аутоиммунными процессами. Но для того чтобы эти процессы пошли, необходимы либо мутантные лимфоциты (повреждения ДНК), либо белки с измененной структурой и антигенными свойствами.
Генетические программы, в том числе и индивидуального развития, являются всегда результатом эволюции, закрепляемым в генофонде вида вследствие естественного отбора. На первый взгляд, естественный отбор должен благоприятствовать увеличению продолжительности жизни. В связи с этим приобретение видом в ходе эволюции генетической программы старения, обусловливающего неизбежность смерти, представляется маловероятным. Рассмотрим следующий пример. В природных условиях в первый год жизни сохраняется в живых лишь 1/4 синиц каждого поколения. По истечении 2-го года от поколения остаются единицы, если это вообще происходит. В лабораторных условиях птицы достигают 9-летнего возраста. В таком случае практически невозможно объяснить, в силу каких обстоятельств естественный отбор мог формировать генетическую программу саморазрушения организма в процессе старения, рассчитанную на 7—8 лет жизни, которые синицами не проживаются.
Изложенное выше не исключает зависимости скорости старения и времени наступления старческих изменений от генетических факторов, однако этими факторами не являются специальные гены или программа. Рассмотрим еще один пример. Для хореи Гентингтона типичным признаком служит сильный тремор (дрожание) головы, конечностей (пляска святого Витта). Симптомы этого наследственного заболевания обычно появляются в возрасте 35—39 лет, причем у мужчин позднее, чем у женщин. Различие в сроках появления болезни объясняется особенностями эволюции мужского и женского генотипов. У мужчин, имеющих по сравнению с женщинами большую продолжительность репродуктивного периода, давление отбора против соответствующего признака угасает с возрастом более медленно. Неблагоприятное фенотипическое действие гена, лежащего в основе хореи Геттингтона, в юношеском и зрелом возрасте подавлялось благодаря присутствию в геноме генов-модификаторов (см. разд. 8.6.1).
Таким образом, из двух принципиально различных направлений в объяснении старения как закономерной стадии онтогенеза в настоящее время более обоснованным является представление, рассматривающее этот процесс как износ биологических структур, а не генетически предопределенное саморазрушение.
Продолжительность жизни
как житейская проблема связывается в нашем сознании обычно с геронтологией, т.е. с возможностью пережить период зрелости и дожить до преклонного возраста. На самом деле определенная вероятность умереть существует в любом возрасте. Отражением этого является, в частности, широкое использование наряду с видовой или максимальной зарегистрированной продолжительностью жизни такого показателя, как средняя продолжительность
жизни.
На рис. 8.33 приведена кривая дожития (интенсивности смертности) по возрастам для популяции людей.
Исключительный рост средней продолжительности жизни в экономически развитых странах в XX столетии связан с повышением жизненного уровня, качества питания, жилья, медицинской помощи, улучшением санитарно-гигиенических и эпидемиологических условий. Можно сказать, что в основе демографической революции XX в. лежат социальные по своей природе факторы. Вместе с тем, несмотря на отмеченный рост средней продолжительности жизни людей, форма кривой дожития не меняется. Более того такая же форма кривой воспроизводится в популяциях лабораторных животных, причем относящихся к разным типам животного царства (мышь, крыса, лошадь, головная вошь, плодовая муха).
Это означает, что продолжительность жизни кроме условий существования в немалой степени определяется биологическими факторами. Они отражают особенности структурно-функциональной организации, индивидуального развития, объема приспособительных возможностей и в конечном счете выживаемость отдельных особей. Таким образом, продолжительность жизни отличается исключительной индивидуальной изменчивостью. Указанное свойство проявляется, в частности, в наличии иногда значительного разрыва в значениях средней и максимальной зарегистрированной продолжительности жизни. Так, рекордсмен среди долгожителей японец Шигешио Изуми превысил 120-летний рубеж, тогда как средние показатели длительности жизни в Японии составили 74,1 года для мужчин и 79,6 года для женщин.
Закономерности изменений длительности жизни
в историческом времени или от популяции к популяции по понятной причине невозможно изучать на одном отдельно взятом организме. Такие исследования проводят в популяциях с применением статистических методов. Еще в 1825 г. Б. Гомперц описал зависимость увеличения смертности от возраста людей или животных. Позже оказалось, что в отличие от популяций лабораторных животных, вымирающих в силу достаточно комфортных условий существования в точном соответствии с уравнением Гомперца, часть людей умирает вне зависимости от возраста по причине производственных, транспортных и бытовых травм, природных катастроф, неблагоприятных изменений экологии. Указанная особенность была учтена У. Мейкемом, дополнившим уравнение Гомперца слагаемым, не зависящим от возраста. Обобщенный закон Гомперца — Мейкема выглядит следующим образом:
М
t
= А +
R
0
ехр(αt
)
где М
t
—
интенсивность смертности (вероятность смерти) людей возраста t
(доля ежегодно умирающих в заданном возрасте), А —
фоновая компонента смертности, одинаковая для всех возрастных групп (слагаемое Мейкема), R
0
ехр(αt
)—возрастная компонента смертности, отражающая экспоненциальный рост смертности с возрастом (слагаемое Гомперца).
Закон Гомперца — Мейкема описывает изменение вероятности смерти в интервале возрастов от 20 до 80 лет.
Одна из особенностей уравнения Гомперца — Мейкема заключается в том, что оно выделяет в общей смертности две части, которые различаются по природе факторов, их определяющих. Вклад в конечное значение смертности первого слагаемого А
определяется условиями жизни, тогда как вклад второго слагаемого R
0
ехр(αt
) зависит от сопротивляемости (жизнеспособности) организма. Фоновая компонента
смертности А
является социально-контролируемой, а возрастная компонента
R
0
ехр(αt
) — социально-независимой. Соответственно первую можно назвать социальной, вторую—биологической.
Практическое применение закона Гомперца — Мейкема дает точное представление о природе факторов, обусловливающих различие в интенсивности смертности людей из разных популяций или же из одной популяции, но в разное историческое время. На рис. 8.38 показано, как изменялась общая смертность (7), а также социальная (2
) и биологическая (3
) ее компоненты в популяции 40-летних женщин Финляндии в интервале с 1890 по 1970 г., т.е. в период исключительного роста средней продолжительности жизни. Нетрудно видеть, что примерно 5-кратное снижение интенсивности смертности к 1970 г. полностью обусловлено уменьшением вклада социально-контролируемой компоненты. Ход кривых 1
и 2
практически совпадает. С другой стороны, доля возрастной компоненты, отражающая состояние биологических механизмов выживания, за описанный исторический период не менялась.
Из представленных материалов вытекают два важных практических следствия. Во-первых, увеличение продолжительности жизни финок целиком связано с повышением жизненного уровня, улучшением социально-гигиенических условий, ростом эффективности профилактической и лечебной медицины. Во-вторых, дальнейшее увеличение длительности жизни в описываемой популяции не может быть достигнуто путем изменения социально-контролируемых факторов. Справедливость второго следствия подтверждается незначительным приростом средней продолжительности жизни среди населения Финляндии в последующее десятилетие. Так, если за 1969—1977 гг. названный показатель составлял для женщин Финляндии примерно 76,1 года, то в 1980г.—77,6 года.
Значение биологической компоненты в определении длительности жизни видно из сопоставления ее вклада в интенсивность смертности мужчин и женщин из итальянской популяции (рис. 8.39). Как и в предыдущем примере, за выбранный исторический период отмечается существенное снижение интенсивности общей смертности, причем и у мужчин, и у женщин. Достигнутый к середине 70-х гг. итог для женщин оказался выше, чем у мужчин, за счет биологических особенностей женского организма, что и нашло отражение в уровне возрастной компоненты смертности. Действительно, в 1978 г. средняя продолжительность жизни итальянок составляла 77,4 года, тогда как итальянцев — 70,7. Из материалов по итальянской популяции следует также, что дальнейшее приращение длительности жизни как мужчин, так и женщин требует воздействия на биологические механизмы выживания.
Различия в средней продолжительности жизни мужчин и женщин колеблются от популяции к популяции. Так, в США (1979), Финляндии и Франции (1980) они превышали 8 лет, тогда как в Греции (1981) составляли 4,5 года, а в Болгарии и Японии (1981)—5,5 года. О зависимости возрастной компоненты общей смертности от биологических механизмов свидетельствуют межпопуляционные колебания ее значений в различных европейских странах, в которых достигнут примерно одинаковый уровень жизни (рис. 8.40).
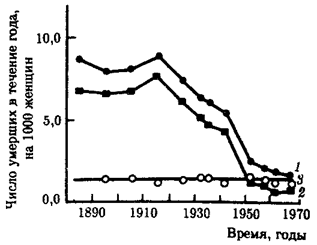
Рис. 8.38. Историческая динамика общей смертности и обеих ее компонент
в популяции 40-летних женщин Финляндии (пояснение см. в тексте)
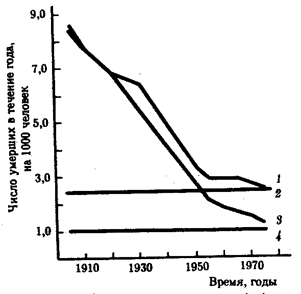
Рис. 8.39. Историческая динамика общей смертности и ее возрастной компоненты среди 40-летних мужчин и женщин (Италия, 1910—1970 гг.):
1
—общая стертость среди мужчин, 2—возрастная компонента смертности среди мужчин, 3—
общая смертность среди женщин, 4—
возрастная компонента смертности среди женщин
Рис. 8.40. Картограмма значений возрастной компоненты смертности
40-летних мужчин на территории Западной и Центральной Европы:
1—
низкий уровень (0,00160 год-1
), 2—
пониженный уровень (0,00161—0,002220 год-1
), 3—
средний уровень (0,00221—0,00280 год-1
), 4—
повышенный уровень (0,00281—0.00340 год-1
), 5—
высокий уровень (свыше 0,00341 год-1
)
С конца XIX в. существует представление о наличии в онтогенетическом развитии периодов наибольшей чувствительности к повреждающему действию разнообразных факторов. Эти периоды получили название критических, а
повреждающие факторы — тератогенных.
Единодушия в оценке различных периодов, как более или менее устойчивых, не существует.
Некоторые ученые полагают, что наиболее чувствительными к самым разнообразным внешним воздействиям являются периоды развития, характеризующиеся активным клеточным делением или интенсивно идущими процессами дифференциации. П. Г Светлов, в середине XX столетия внесший большой вклад в разработку проблемы, считал, что критические периоды совпадают с моментом детерминации, который определяет конец одной и начало другой, новой цепи процессов дифференциации, т.е. с моментом переключения направления развития. По его мнению, в это время имеет место снижение регуляционной способности. Критические периоды не рассматривают как наиболее чувствительные к факторам среды вообще, т.е. независимо от механизма их действия. Вместе с тем установлено, что в некоторые моменты развития зародыши чувствительны к ряду внешних факторов, причем реакция их на разные воздействия бывает однотипной.
Критические периоды различных органов и областей тела не совпадают друг с другом по времени. Причиной нарушения развития зачатка является ббльшая чувствительность его в данный момент к действию патогенного фактора, чем у других органов. При этом действие разных факторов может вызвать одну и ту же аномалию. Это свидетельствует о неспецифическом ответе зачатка на повреждающие воздействия. В то же время некоторая специфичность тератогенных факторов выражается в том, что, будучи различными, они оказывают максимальное повреждающее действие не на одних и тех же стадиях развития.
П. Г. Светлов установил два критических периода
в развитии плацентарных млекопитающих. Первый из них совпадает с процессом имплантации зародыща, второй — с формированием плаценты. Имплантация приходится на первую фазу гаструляции, у человека —на конец 1-й —начало 2-й недели. Второй критический период продолжается с 3-й по 6-ю неделю. По другим источникам, он включает в себя также 7-ю и 8-ю недели. В это время идут процессы нейруляции и начальные этапы органогенеза.
Повреждающее действие во время имплантации приводит к ее нарушению, ранней смерти зародыша и его абортированию. По некоторым данным, 50—70% оплодотворенных яйцеклеток не развиваются в период имплантации. По-видимому, это происходит не только от действия патогенных факторов в момент начавшегося развития, но и в результате грубых наследственных аномалий.
Действие тератогенных факторов во время эмбрионального (с 3 до 8 нед) периода может привести к врожденным уродствам. Чем раньше возникает повреждение, тем грубее бывают пороки развития. Развивающийся организм можно уподобить большому вееру. Достаточно небольших нарушений у его основания, чтобы вызвать большие изменения во всем веере. При действии тератогенных факторов в фетальном периоде возникают малые морфологические изменения, задержка роста и дифференцировки, недостаточность питания плода и другие функциональные нарушения.
У каждого органа есть свой критический период, во время которого его развитие может быть нарушено. Чувствительность различных органов к повреждающим воздействиям зависит от стадии эмбриогенеза (рис. 9.1).
Рис. 9.1. Чувствительность развивающегося зародыша человека
к повреждающим факторам
Заштрихованным отрезком обозначен период наиболее высокой чувствительности, незаштрихованным — период меньшей чувствительности; 1—
38
—
недели внутриутробного развития
Факторы, оказывающие повреждающее воздействие, не всегда представляют собой чужеродные для организма вещества или воздействия. Это могут быть и закономерные действия среды, обеспечивающие обычное нормальное развитие, но в других концентрациях, с другой силой, в другое время. К ним относят кислород, питание, температуру, соседние клетки, гормоны, индукторы, давление, растяжение, электрический ток и проникающее излучение.
Врожденными пороками
развития называют такие структурные нарушения, которые возникают до рождения (в пренатальном онтогенезе), выявляются сразу или через некоторое время после рождения и вызывают нарушение функции органа. Последнее отличает врожденные пороки развития органов от аномалий,
при которых нарушение функции обычно не наблюдается. Врожденные пороки развития являются причиной приблизительно 20% смертей в неонатальном периоде, а также занимают значительное место в практике акушерства и гинекологии, медицинской генетике детской хирургии и ортопедии, патологической анатомии. В связи с этим знания по вопросам профилактики, этиологии, патогенеза, лечения и прогнозирования врожденных пороков развития имеют большое значение.
Знакомство с закономерностями и механизмами нормального морфогенеза в процессе эмбрионального развития позволяет понять, какого рода нарушения могут привести к возникновению пороков. Кроме того, пороки развития представляют собой как бы природные эксперименты, обнаруживающие скрытые от глаз процессы. Таким образом, сами эти пороки представляют собой материал для научных поисков и обобщений. Примером могут служить такие врожденные пороки развития, которые напоминают некоторые черты строения, свойственные другим видам взрослых позвоночных животных или их зародышам. Они позволяют осознать теснейшую эволюционно-биологическую связь человека с животными и использовать ее для иллюстрации закономерностей макроэволюции, а также для формирования естественноисторического взгляда на возникновение и развитие человека.
Существует несколько различных критериев, на основе которых классифицируют врожденные пороки развития. Основные из них следующие: причина, стадия, на которой проявляется воздействие, последовательность их возникновения в организме, распространенность и локализация. Мы дополнительно обращаем внимание на филогенетическую значимость и нарушения основных клеточных механизмов, приводящие к пороку развития.
В зависимости от причины все врожденные пороки развития делят на наследственные, экзогенные
(средовые
) и мультифакториальные.
Наследственными
называют пороки, вызванные изменением генов или хромосом в гаметах родителей, в результате чего зигота с самого возникновения несет генную, хромосомную или геномную мутацию. Генетические факторы начинают проявляться в процессе онтогенеза последовательно, путем нарушения биохимических, субклеточных, клеточных, тканевых, органных и организменных процессов. Время проявления нарушений в онтогенезе может зависеть от времени вступления в активное состояние соответствующего мутированного гена, группы генов или хромосом. Последствия генетических нарушений зависят также от масштаба и времени проявления нарушений.
Экзогенными
называют пороки, возникшие под влиянием тератогенных факторов (лекарственные препараты, пищевые добавки, вирусы, промышленные яды, алкоголь, табачный дым и др.), т.е. факторов внешней среды, которые, действуя во время эмбриогенеза, нарушают развитие тканей и органов.
Историческими вехами являются работы Ц. Стоккарта в начале XX в., впервые показавшего тератогенное действие алкоголя, и работы офтальмолога Н. Грегга, открывшего тератогенное действие вируса краснухи (1941). Очень страшное событие имело место в 1959—1961 гг., когда после применения беременными талидомида в ряде стран Запада родились несколько десятков тысяч детей с тяжелыми врожденными пороками.
Поскольку средовые экзогенные факторы в конечном итоге оказывают влияние на биохимические, субклеточные и клеточные процессы, механизмы возникновения врожденных пороков развития при их действии такие же, как при генетических причинах. В результате фенотипическое проявление экзогенных и генетических пороков бывает весьма сходным, что обозначается термином фенокопия.
Для выявления истинных причин возникновения пороков в каждом конкретном случае следует привлекать множество различных подходов и критериев.
Мультифакториальными
называют пороки, которые развиваются под влиянием как экзогенных, так и генетических факторов. Вероятно, скорее всего бывает так, что экзогенные факторы нарушают наследственный аппарат в клетках развивающегося организма, а это приводит по цепочке ген — фермент — признак к фенокопиям. Кроме того, к этой группе относят все пороки развития, в отношении которых четко не выявлены генетические или средовые причины.
Установление причины врожденных пороков имеет большое прогностическое значение для носителя этих пороков и профилактическое — в отношении последующего потомства. В настоящее время медицинские генетики и патологоанатомы существенно продвинулись в области так называемого синдромологического анализа. Синдромологический анализ —
это обобщенный анализ фенотипа больных с целью выявления устойчивых сочетаний признаков. Овладение им помогает в установлении причины возникновения пороков и основных патогенетических механизмов.
В зависимости от стадии, на которой проявляются генетические или экзогенные воздействия, все нарушения, происходящие в пренатальном онтогенезе, подразделяют на гаметопатии, бластопатии, эмбриопатии
и фетопатии.
Если нарушения развития на стадии зиготы (гаметопатия
) или бластулы (бластопатия
) очень грубые, то дальнейшее развитие, видимо, не идет и зародыш погибает. Эмбриопатии
(нарушения, возникшие в период от 15 сут до 8 нед эмбрионального развития) как раз составляют основу врожденных пороков, о чем уже говорилось выше. Фетопатии
(нарушения, возникшие после 10 нед эмбрионального развития) представляют собой такие патологические состояния, для которых, как правило, характерны не грубые морфологические нарушения, а отклонения общего типа: в виде снижения массы, задержки интеллектуального развития, различных функциональных нарушений. Очевидно, что наибольшее клиническое значение имеют эмбриопатии и фетопатии.
В зависимости от последовательности возникновения различают первичные
и вторичные
врожденные пороки. Первичные пороки обусловлены непосредственным действием тератогенного фактора, вторичные — являются осложнением первичных и всегда патогенетически с ними связаны. Выделение первичных пороков из комплекса нарушений, обнаруженных у пациента, имеет большое значение для медико-генетического прогноза, поскольку риск определяется по основному пороку.
По распространенности в организме первичные пороки подразделяют на изолированные,
или одиночные, системные,
т.е. в пределах одной системы, и множественные,
т.е. в органах двух систем и более. Комплекс пороков, вызванный одной ошибкой морфогенеза, называют аномаладом.
В основу классификации врожденных пороков, принятой Всемирной организацией здравоохранения (ВОЗ), положен анатомо-физиологический принцип (по месту локализации).
По клеточным механизмам, которые преимущественно нарушены при том или ином врожденном пороке развития, можно выделить пороки, возникшие в результате нарушения размножения клеток, миграции клеток или органов, сортировки клеток, дифференцировки, а также гибели клеток. Нарушение перечисленных клеточных механизмов может привести к слишком малым или, наоборот, слишком большим размерам органов или их частей, к недостаточному или, напротив, очень сильному рассасыванию тканей в органах, к изменению положения отдельных клеток, тканей или органов относительно других органов и тканей, к нарушениям дифференцировки, так называемым дисплазиям.
По филогенетической значимости можно все врожденные пороки развития разделить на филогенетически обусловленные и не связанные с предшествующим филогенезом, т.е. нефилогенетические.
Филогенетически обусловленными
называют такие пороки, которые по виду напоминают органы животных из типа Хордовые и подтипа Позвоночные. Если они напоминают органы предковых групп или их зародышей, то такие пороки называют анцестральными
(предковыми) или атавистическими. Примерами могут служить несращение дужек позвонков, шейные и поясничные ребра, несращение твердого нёба, персистирование висцеральных дуг и др. Если пороки напоминают органы родственных современных или древних, но боковых ветвей животных, то их называют аллогенными.
Филогенетически обусловленные пороки показывают генетическую связь человека с другими позвоночными, а также помогают понять механизмы возникновения пороков в ходе эмбрионального развития.
Нефилогенетическими
являются такие врожденные пороки, которые не имеют аналогов у нормальных предковых или современных позвоночных животных. К таким порокам можно отнести, например, двойниковые уродства и эмбриональные опухоли, которые появляются в результате нарушения эмбриогенеза, не отражая филогенетических закономерностей.
При изложении клеточных механизмов в гл. 8 приводились примеры иллюстрирующие, как нарушение этих механизмов может приводить к формированию врожденных пороков развития. В данной главе описаны лишь некоторые пороки развития тех органов, морфогенез которых был рассмотрен в гл. 7. Их следует рассматривать как отдельные примеры подкрепляющие обоснованность изучения онтофилогенетических предпосылок формирования врожденных пороков развития.
Различные варианты расщелины позвоночника как
бы соответствуют очень древнему примитивному строению его у низших позвоночных Скрытая расщелина позвоночника (spina bifida occulta)—это дефект в виде аплазии спинных дужек и остистых отростков (рис. 9.2, А
). Дужки позвонков при нормальном развитии образуются из мигрирующих клеток склеротомов под индуцирующим влиянием со стороны хорды, спинного мозга и спинномозговых узлов. При описываемом пороке происходит остановка их развития, что, вероятно, может быть связано с нарушением необходимых индуцирующих воздействий.
Скрытые формы расщелины первого крестцового позвонка встречаются среди людей с частотой около 10%, а первого шейного—с частотой около 3%. Как правило, спинной мозг и спинномозговые нервы не изменены и не имеется никаких серьезных нарушений. Кожа над дефектом также не изменена, но иногда порок можно заподозрить по небольшой ямочке или пучку волос над ним. Чаще всего дефект выявляется как рентгенологическая находка. О возможной наследственной природе порока свидетельствуют такие данные: скрытые формы расщелины дужек позвонков встречаются у 14,3% матерей, у 6,1 % отцов и у 26,8% сибсов пробандов с различными формами несращения нервной трубки и позвонков.
Более грубым пороком являются кистозная расщелина позвоночника (spina bifida cystia) и полный рахисхиз. Кистозная расщелина характеризуется наличием грыжевого мешка (рис. 9.2, В, Г
), а
полный рахисхиз — дефектом мозговых оболочек, мягких покровов и лежащим открыто в виде пластинки или желоба спинным мозгом (рис. 9.2, Б
).
В последнем случае нервные валики не соединяются в трубку либо из-за ослабления индуцирующего влияния подлежащей хорды, либо из-за действия тератогенных факторов на нейроэпителиальные клетки.
Рис. 9.2. Различные варианты расщелины позвоночника. А —
скрытая расщелина; Б—
полный рахисхиз; В, Г—
кистозная расщелина:
1
—кожа, 2—
пучок волос, 3—
твердая мозговая оболочка, 4—
субарахноидальное пространство, 5
—спинной мозг, 6—
тело позвонка, 7—открытая нервная пластинка, 8
—спинной чувствительный узел
Пороки развития звукопроводящей системы
среднего уха могут быть причиной врожденного нарушения слуха наряду с нарушениями других отделов слухового анализатора. Врожденная фиксация стремечка приводит к врожденной проводниковой глухоте при нормальном развитии уха в остальном. Дефекты молоточка и наковальни часто сочетаются с синдромом первой дуги. Механизмами возникновения подобных пороков развития могут быть нарушения рассасывания (гибели) молодой соединительной ткани в барабанной полости и остановка развития всей области первой висцеральной дуги. Большинство видов врожденной глухоты обусловлены генетически и носят наследственный характер.
Атрезия наружного слухового прохода возникает из-за ослабления процесса канализации (рассасывания пробки наружного слухового прохода) в области первого жаберного кармана. Этот врожденный порок также часто сочетается с синдромом (аномаладом) первой дуги.
Пороки развития пищеварительной системы
выражаются в недоразвитии (гипогенезия) или полном отсутствии развития (агенезия) участков кишечной трубки или ее производных, в отсутствии естественного отверстия, сужении канала, персистировании эмбриональных структур, незавершенном повороте и гетерогонии различных тканей в стенку желудочно-кишечного тракта.
Атрезии и стенозы встречаются с частотой примерно 0,8 на 1000 новорожденных. Существует несколько гипотез, объясняющих механизм их возникновения. По одной из них, это персистирование физиологической атрезии, заключающееся во временной закупорке просвета кишечной трубки на 6-й неделе развития в связи с нарушением реканализации. По другой — это сосудистая недостаточность. В эксперименте на собаках путем перевязки у плодов верхней брыжеечной артерии удалось получить некоторые формы атрезии и стеноз. Есть гипотеза внутриутробного воспалительного процесса. Этиология этих пороков гетерогенна. Среди изолированных пороков, по-видимому, большинство мультифакториальны, а среди тех, что являются компонентами множественных врожденных пороков, значительная часть — результат хромосомных и генных мутаций.
Одним из распространенных врожденных пороков средней кишки является незаращение проксимального отрезка внутрибрюшной части желточного протока и выпячивание стенки подвздошной кишки длиной от 1 до 15 см на расстоянии 10—25 см у детей и 40—80 см у взрослых от подвздошно-слепокишечной заслонки. Этот порок получил название дивертикула Меккеля (по имени исследователя). Он обнаруживается примерно у 2% населения (из них в 80% случаев у мужчин). В половине случаев он диагностируется случайно, а в остальных случаях — в связи с воспалительными процессами, непроходимостью и кровотечениями кишечника. В 10% случаев дивертикул Меккеля сочетается с другими врожденными пороками. Некоторые варианты пороков эмбриональных структур желточного протока показаны на рис. 9.3.
Из многочисленных вариантов врожденных пороков прямой кишки и анального отверстия отметим персистирование клоаки (рис. 9.4), возникающее в результате нарушения разделения клоаки на мочеполовой синус и прямую кишку. Этот порок представляет собой недоразвитие мочеполовой перегородки и отражает эволюционно более древнее состояние органа.
Врожденные пороки сердечно-сосудистой системы
насчитывают десятки разновидностей. Частота встречаемости —б—10 на 1000 новорожденных. Пороки сердечно-сосудистой системы бывают изолированными и в сочетании с пороками других систем, т.е. множественными пороками. Изолированные пороки чаще мультифакториальные, но известны также доминантные и рецессивные формы. Среди пороков, входящих в группу множественных, поражение сердечно-сосудистой системы часто сопровождается хромосомными и генными синдромами. Пороки сердечно-сосудистой системы в основном представляют собой либо недоразвитие каких-либо структур в эмбриогенезе, либо персистирование этих эмбриональных структур, в то время как они должны видоизменяться и принять дефинитивный вид. Иногда встречаются грубые нарушения топографии сердца и сосудов. Цитологическими механизмами, как и в случаях других пороков развития, служат, видимо, нарушения индукционных взаимодействий, размножения, миграции, адгезии или избирательной гибели клеток, значение которых в нормальном морфогенезе сердца и артерий было показано в разд. 7.6.2.
Рис. 9.3. Различные варианты остатков желточного протока.
А—дивертикул Меккеля; Б—
пупочно-подвздошный свищ (персистирование желточного протока); В—
фиброзный шнур, соединяющий подвздошную кишку с пупком:
1
—подвздошная кишка, 2—
дивертикул Меккеля, 3—
пупочно-подвздошный свищ, 4—
фиброзный шнур
Рис. 9.4. Персистирование клоаки:
1
—мочевой пузырь, 2—матка, прямая кишка, 4—
клоака
Примеры некоторых врожденных пороков сердца и крупных артерий иллюстрируют вышеизложенные положения. Эктопия сердца —
расположение сердца вне грудной полости. Различают шейную, абдоминальную и экстрастернальную эктопию. Шейную эктопию объясняют задержкой перемещения сердца с места формирования его зачатка в шейной области в переднее средостение. Этот порок приводит к гибели сразу после рождения. Он отражает онтофилогенетическую зависимость.
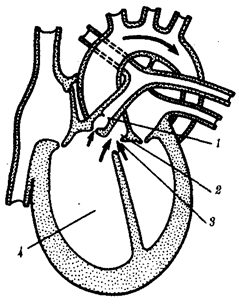
Рис. 9.5. Фронтальный срез сердца с тетрадой Фалло:
1
—стеноз легочного ствола. 2—
транспозиция аорты, 3—
дефект межжелудочковой перегородки, 4—
гипертрофия правого желудочка; стрелками показано направление движения крови
Правосторонняя дуга аорты
развивается из эмбриональной правой дуги при редукции левой, или двойные дуги аорты, представленные двумя стволами, из которых один впереди трахеи, а другой позади пищевода. При изолированных пороках такого типа клинические проявления зависят от степени сдавления пищевода и трахеи. Оба связаны с нарушениями дифференцировки эмбриональных артериальных дуг.
Открытый артериальный
(боталлов
) проток
(персистирование артериального протока) встречается с частотой около 1 на 1000 новорожденных.
Тетрада Фалло —
стеноз легочного ствола, высокий дефект межжелудочковой перегородки, правосмещение устья аорты и приобретенная гипертрофия правого желудочка. Порок возникает в результате праводеленности артериального конуса и неслияния всех компонентов, образующих межжелудочковую перегородку. Частота — 0,7 на 1000 новорожденных, прогноз неблагоприятный (рис. 9.5).
Айала Ф., Кайгер Дж.
Современная генетика. М., 1987. Т. 1—3.
Брода Э.
Эволюция биоэнергетических процессов. М., 1978.
Гаврилов Л. А., Гаврилова Н. С.
Биология продолжительности жизни. М., 1986.
Газарян К. Г., Белоусов Л. В.
Биология индивидуального развития животных М 1983
Грин Н., Стаут У., Тейлор Д.
Биология. М., 1990. Т. 1—3.
Гулберт С.
Биология развития. М., 1995. Т. 1-—3.
Зотин А. И., Зотина Р. С.
Феноменологическая теория развития, роста и старения организма, М., 1993.
Иванова-Казас О. М.
Бесполое размножение животных. Л., 1977.
Карлсон Б.
Основы эмбриологии по Пэпену. М., 1983. Т. 1, 2.
Кемп П., Армс К.
Введение в биологию. М., 1988.
Лиознер Л. Д., Бабаева А. Г., Маркелова И. В.
Регенерационные процессы и их изучение в СССР. М., 1990.
Льют Б.
Гены. М., 1987.
Лэмб М.
Биология старения. М., 1980.
Михайлов А. Т.
Эмбриональные индукторы. М., 1988.
Молекулярная
биология клетки / Б. Албертс, Д. Брей, Дж. Льюис и др. М., 1994.
Наследственные
синдромы и медико-генетическое консультирование / С. И Козлова, Е. Семенова, Н. С. Демикова, О. Е. Блинникова. Л., 1987.
Тератология
человека. Руководство для врачей / Под ред. Г. И. Лазюка М 1991
Токин Б. Д.
Общая эмбриология. М., 1987.
Фогель Ф., Мотульски А.
Генетика человека. М., 1990. Т. 1—3.
Фролькис В. В.
Старение и увеличение продолжительности жизни. Л., 1988.
Яблоков А. В., Юсуфов А. Г.
Эволюционное учение. М., 1989.
ОГЛАВЛЕНИЕ
ПРЕДИСЛОВИЕ................................................................................................. 2
ВВЕДЕНИЕ......................................................................................................... 6
РАЗДЕЛ I. ЖИЗНЬ КАК ОСОБОЕ ПРИРОДНОЕ ЯВЛЕНИЕ.................. 8
ГЛАВА 1. ОБЩАЯ ХАРАКТЕРИСТИКА ЖИЗНИ..................................... 8
1.1. ЭТАПЫ РАЗВИТИЯ БИОЛОГИИ.......................................................... 8
1.2. СТРАТЕГИЯ ЖИЗНИ. ПРИСПОСОБЛЕНИЕ, ПРОГРЕСС, ЭНЕРГЕТИЧЕСКОЕ И ИНФОРМАЦИОННОЕ ОБЕСПЕЧЕНИЕ............. 12
1.3. СВОЙСТВА ЖИЗНИ.............................................................................. 17
1.4. ПРОИСХОЖДЕНИЕ ЖИЗНИ................................................................ 20
1.5. ПРОИСХОЖДЕНИЕ ЭУКАРИОТИЧЕСКОЙ КЛЕТКИ...................... 23
1.6. ВОЗНИКНОВЕНИЕ МНОГОКЛЕТОЧНОСТИ.................................... 27
1.7. ИЕРАРХИЧЕСКАЯ СИСТЕМА. УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ 28
1.8. ПРОЯВЛЕНИЕ ГЛАВНЫХ СВОЙСТВ ЖИЗНИ НА РАЗНЫХ УРОВНЯХ ЕЕ ОРГАНИЗАЦИИ............................................................................................ 32
1.9. ОСОБЕННОСТИ ПРОЯВЛЕНИЯ БИОЛОГИЧЕСКИХ ЗАКОНОМЕРНОСТЕЙ У ЛЮДЕЙ. БИОСОЦИАЛЬНАЯ ПРИРОДА ЧЕЛОВЕКА......................... 34
РАЗДЕЛ II . КЛЕТОЧНЫЙ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЙ УРОВНИ ОРГАНИЗАЦИИ ЖИЗНИ — ОСНОВА ЖИЗНЕДЕЯТЕЛЬНОСТИ ОРГАНИЗМОВ................................................................................................ 36
ГЛАВА 2. КЛЕТКА — ЭЛЕМЕНТАРНАЯ ЕДИНИЦА ЖИВОГО......... 36
2.1. КЛЕТОЧНАЯ ТЕОРИЯ.......................................................................... 36
2.2. ТИПЫ КЛЕТОЧНОЙ ОРГАНИЗАЦИИ................................................ 38
2.3. СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ЭУКАРИОТИЧЕСКОЙ КЛЕТКИ................................................................. 39
2.3.1. Принцип компартментации. Биологическая мембрана................... 39
2.3.2. Строение типичной клетки многоклеточного организма................ 41
2.3.3. Поток информации............................................................................ 48
2.3.4. Внутриклеточный поток энергии..................................................... 49
2.3.5. Внутриклеточный поток веществ..................................................... 51
2.3.6. Другие внутриклеточные механизмы общего значения.................. 52
2.3.7. Клетка как целостная структура. Коллоидная система протоплазмы 52
2.4. ЗАКОНОМЕРНОСТИ СУЩЕСТВОВАНИЯ КЛЕТКИ ВО ВРЕМЕНИ 53
2.4.1. Жизненный цикл клетки.................................................................... 53
2.4.2. Изменения клетки в митотическом цикле......................................... 54
ГЛАВА 3......... . СТРУКТУРНО-ФУНКЦИОНАЛЬНАЯ ОРГАНИЗАЦИЯ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА............................................................. 60
3.1. НАСЛЕДСТВЕННОСТЬ И ИЗМЕНЧИВОСТЬ — ФУНДАМЕНТАЛЬНЫЕ СВОЙСТВА ЖИВОГО.................................................................................. 60
3.2. ИСТОРИЯ ФОРМИРОВАНИЯ ПРЕДСТАВЛЕНИЙ ОБ ОРГАНИЗАЦИИ МАТЕРИАЛЬНОГО СУБСТРАТА НАСЛЕДСТВЕННОСТИ И ИЗМЕНЧИВОСТИ......................................................................................................................... 61
3.3. ОБЩИЕ СВОЙСТВА ГЕНЕТИЧЕСКОГО МАТЕРИАЛА И УРОВНИ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО АППАРАТА.................................... 64
3.4. ГЕННЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО
АППАРАТА................................................................................................... 64
3.4.1. Химическая организация гена.......................................................... 65
3.4.1.1. Структура ДНК. Модель Дж. Уотсона и Ф. Крика................... 67
3.4.1.2. Способ записи генетической информации в молекуле ДНК. Биологический код и его свойства........................................................... 68
3.4.2 Свойства ДНК как вещества наследственности и изменчивости...... 71
3.4.2.1. Самовоспроизведение наследственного материала.
Репликация ДНК....................................................................................... 71
3.4.2.2. Механизмы сохранения нуклеогидной последовательности ДНК. Химическая стабильность. Репликация. Репарация................................ 78
3.4.2.3. Изменения нуклеотидных последовательностей ДНК.
Генные мутации........................................................................................ 84
3.4.2.4. Элементарные единицы изменчивости генетического материала. Мутон. Рекон.......................................................................................................... 90
3.4.2.5. Функциональная классификация генных мутаций..................... 91
3.4.2.6. Механизмы, снижающие неблагоприятный эффект генных мутаций................................................................................................................... 92
3.4.3. Использование генетической информации в процессах жизнедеятельности...................................................................................................................... 93
3.4.3.1. Роль РНК в реализации наследственной информации.............. 93
3.4.3.2. Особенности организации и экспрессии генетической информации у про- и эукариот....................................................................................... 104
3.4.3.3. Ген — функциональная единица наследственного материала. Взаимосвязь между геном и признаком................................................ 115
3.4.4. Функциональная характеристика гена........................................... 118
3.4.5. Биологическое значение генного уровня организации наследственного материала................................................................................................... 119
3.5. ХРОМОСОМНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ ГЕНЕТИЧЕСКОГО МАТЕРИАЛА.............................................................................................. 119
3.5.1. Некоторые положения хромосомной теории наследственности... 119
3.5.2. Физико-химическая организация хромосом эукариотической
клетки......................................................................................................... 121
3.5.2.1. Химический состав хромосом................................................... 121
3.5.2.2. Структурная организация хроматина...................................... 122
3.5.2.3. Морфология хромосом............................................................. 128
3.5.2.4. Особенности пространственной организации генетического материала в прокариотической клетке....................................................................... 129
3.5.3. Проявление основных свойств материала наследственности
и изменчивости на хромосомном уровне его организации..................... 130
3.5.3.1. Самовоспроизведение хромосом в митотическом цикле клеток 131
3.5.3.2. Распределение материала материнских хромосом между дочерними клетками в митозе................................................................................... 133
3.5.3.3. Изменения структурной организации хромосом. Хромосомные мутации................................................................................................................. 133
3.5.4. Значение хромосомной организации в функционировании
и наследовании генетического аппарата.................................................. 139
3.5.5. Биологическое значение хромосомного уровня организации наследственного материала...................................................................... 142
3.6. ГЕНОМНЫЙ УРОВЕНЬ ОРГАНИЗАЦИИ НАСЛЕДСТВЕННОГО МАТЕРИАЛА.............................................................................................. 142
3.6.1. Геном. Генотип. Кариотип.............................................................. 142
3.6.2. Проявление свойств наследственного материала на геномном уровне его организации............................................................................................... 144
3.6.2.1. Самовоспроизведение и поддержание постоянства кариотипа в ряду поколений клеток.................................................................................... 144
3.6.2.2. Механизмы поддержания постоянства кариотипа в ряду
поколений организмов........................................................................... 146
3.6.2.3. Рекомбинация наследственного материала в генотипе. Комбинативная изменчивость........................................................................................... 148
3.6.2.4. Изменения геномной организации наследственного материала. Геномные мутации.................................................................................. 152
3.6.3. Особенности организации наследственного материала у про-
и эукариот.................................................................................................. 154
3.6.4. Эволюция генома............................................................................ 156
3.6.4.1. Геном предполагаемого общего предка про- и эукариот....... 156
3.6.4.2. Эволюция прокариотического генома...................................... 157
3.6.4.3. Эволюция эукариотического генома........................................ 158
3.6.4.4. Подвижные генетические элементы.......................................... 161
3.6.4.5. Роль горизонтального переноса генетического материала
в эволюции генома.................................................................................. 161
3.6.5. Характеристика генотипа как сбалансированной по дозам системы взаимодействующих генов........................................................................ 162
3.6.5.1. Значение сохранения дозового баланса генов в генотипе
для формирования нормального фенотипа........................................... 162
3.6.5.2. Взаимодействия между генами в генотипе............................... 165
3.6.6. Регуляция экспрессии генов на геномном уровне организации наследственного материала...................................................................... 173
3.6.6.1. Общие принципы генетического контроля экспрессии генов.. 175
3.6.6.2. Роль негенетических факторов в регуляции генной активности 176
3.6.6.3. Регуляция экспрессии генов у прокариот................................. 176
3.6.6.4. Регуляция экспрессии генов у эукариот................................... 178
3.6.7. Биологическое значение геномного уровня организации наследственного материала................................................................................................... 181
ГЛАВА 4. КЛЕТОЧНЫЕ............ И МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ОБЕСПЕЧЕНИЯ СВОЙСТВ НАСЛЕДСТВЕННОСТИ
И ИЗМЕНЧИВОСТИ У ЧЕЛОВЕКА........................................................ 183
4.1. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ НАСЛЕДСТВЕННОСТИ И ИЗМЕНЧИВОСТИ У ЧЕЛОВЕКА.......................................................... 184
4.2. КЛЕТОЧНЫЕ МЕХАНИЗМЫ ОБЕСПЕЧЕНИЯ НАСЛЕДСТВЕННОСТИ И ИЗМЕНЧИВОСТИ У ЧЕЛОВЕКА.............................................................. 188
4.2.1. Соматические мутации.................................................................... 189
4.2.2. Генеративные мутации.................................................................... 191
РАЗДЕЛ III . ОНТОГЕНЕТИЧЕСКИЙ УРОВЕНЬ ОРГАНИЗАЦИИ ЖИВОГО......................................................................................................................... 201
ГЛАВА 5. РАЗМНОЖЕНИЕ....................................................................... 202
5.1. СПОСОБЫ И ФОРМЫ РАЗМНОЖЕНИЯ.......................................... 202
5.2. ПОЛОВОЕ РАЗМНОЖЕНИЕ.............................................................. 204
5.2.1. Чередование поколений с бесполым и половым размножением... 207
5.3. ПОЛОВЫЕ КЛЕТКИ............................................................................ 208
5.3.1. Гаметогенез...................................................................................... 210
5.3.2. Мейоз............................................................................................... 212
5.4. ЧЕРЕДОВАНИЕ ГАПЛОИДНОЙ И ДИПЛОИДНОЙ ФАЗ ЖИЗНЕННОГО ЦИКЛА......................................................................................................... 218
5.5. ПУТИ ПРИОБРЕТЕНИЯ ОРГАНИЗМАМИ БИОЛОГИЧЕСКОЙ ИНФОРМАЦИИ.......................................................................................... 219
ГЛАВА 6 . ОНТОГЕНЕЗ КАК ПРОЦЕСС РЕАЛИЗАЦИИ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ........................................................................................... 221
6.1. ФЕНОТИП ОРГАНИЗМА. РОЛЬ НАСЛЕДСТВЕННОСТИ И СРЕДЫ
В ФОРМИРОВАНИИ ФЕНОТИПА........................................................... 221
6.1.1. Модификационная изменчивость................................................... 222
6.1.2. Роль наследственных и средовых факторов. в определении половой принадлежности организма...................................................................... 224
6.1.2.1. Доказательства генетического определения признаков пола.. 224
6.1.2.2. Доказательства роли факторов среды в развитии
признаков пола....................................................................................... 228
6.2. РЕАЛИЗАЦИЯ НАСЛЕДСТВЕННОЙ ИНФОРМАЦИИ
В ИНДИВИДУАЛЬНОМ РАЗВИТИИ. МУЛЬТИГЕННЫЕ СЕМЕЙСТВА 230
6.3. ТИПЫ И ВАРИАНТЫ НАСЛЕДОВАНИЯ ПРИЗНАКОВ................ 234
6.3.1. Закономерности наследования признаков, контролируемых
ядерными генами....................................................................................... 234
6.3.1.1. Моногенное наследование признаков. Аутосомное и сцепленное
с полом наследование............................................................................. 234
6.3.1.2. Одновременное наследование нескольких признаков. Независимое и сцепленное наследование........................................................................ 240
6.3.1.3. Наследование признаков, обусловленных взаимодействием неаллельных генов........................................................................................................ 246
6.3.2. Закономерности наследования внеядерных генов.
Цитоплазматическое наследование.......................................................... 251
6.4. РОЛЬ НАСЛЕДСТВЕННОСТИ И СРЕДЫ......... В ФОРМИРОВАНИИ НОРМАЛЬНОГО И ПАТОЛОГИЧЕСКИ ИЗМЕНЕННОГО ФЕНОТИПА ЧЕЛОВЕКА.................................................................................................. 253
6.4.1. Наследственные болезни человека................................................. 254
6.4.1.1. Хромосомные болезни.............................................................. 254
6.4.1.2. Генные (или менделевские) болезни.......................................... 257
6.4.1.3. Мультифакториальные заболевания, или болезни
с наследственным предрасположением................................................. 260
6.4.1.4. Болезни с нетрадиционным типом наследования..................... 262
6.4.2. Особенности человека как объекта генетических исследований... 267
6.4.3. Методы изучения генетики человека.............................................. 268
6.4.3.1. Генеалогический метод.............................................................. 268
6.4.3.2. Близнецовый метод.................................................................... 275
6.4.3.3. Популяционно-статистический метод....................................... 276
6.4.3.4. Методы дерматоглифики и пальмоскопии............................... 278
6.4.3.5. Методы генетики соматических клеток..................................... 278
6.4.3.6. Цитогенетичвский метод............................................................ 280
6.4.3.7. Биохимический метод................................................................ 281
6.4.3.8. Методы изучения ДНК в генетических исследованиях............ 282
6.4.4. Пренатальная диагностика наследственных заболеваний............. 284
6.4.5. Медико-генетическое консультирование........................................ 285
ГЛАВА 7. ПЕРИОДИЗАЦИЯ ОНТОГЕНЕЗА.......................................... 288
7.1. ЭТАПЫ. ПЕРИОДЫ И СТАДИИ ОНТОГЕНЕЗА............................. 288
7.2. ВИДОИЗМЕНЕНИЯ ПЕРИОДОВ ОНТОГЕНЕЗА, ИМЕЮЩИЕ ЭКОЛОГИЧЕСКОЕ И ЭВОЛЮЦИОННОЕ ЗНАЧЕНИЕ......................... 290
7.3. МОРФОФИЗИОЛОГИЧЕСКИЕ И ЭВОЛЮЦИОННЫЕ ОСОБЕННОСТИ ЯИЦ ХОРДОВЫХ................................................................................................. 292
7.4. ОПЛОДОТВОРЕНИЕ И ПАРТЕНОГЕНЕЗ........................................ 296
7.5. ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ........................................................ 298
7.5.1. Дробление........................................................................................ 298
7.5.2. Гаструляция..................................................................................... 303
7.5.3. Образование органов и тканей....................................................... 311
7.5.4. Провизорные органы зародышей позвоночных........................... 314
7.6. ЭМБРИОНАЛЬНОЕ РАЗВИТИЕ МЛЕКОПИТАЮЩИХ
И ЧЕЛОВЕКА.............................................................................................. 320
7.6.1. Периодизация и раннее эмбриональное развитие......................... 320
7.6.2. Примеры органогенезов человека, отражающих эволюцию вида 330
ГЛАВА 8 . ЗАКОНОМЕРНОСТИ ИНДИВИДУАЛЬНОГО РАЗВИТИЯ ОРГАНИЗМОВ.............................................................................................. 344
8.1. ОСНОВНЫЕ КОНЦЕПЦИИ................................................................ 344
В БИОЛОГИИ ИНДИВИДУАЛЬНОГО РАЗВИТИЯ................................ 344
8.2. МЕХАНИЗМЫ ОНТОГЕНЕЗА........................................................... 345
8.2.1. Деление клеток................................................................................. 345
8.2.2. Миграция клеток............................................................................. 347
8.2.3. Сортировка клеток.......................................................................... 350
8.2.4. Гибель клеток.................................................................................. 352
8.2.5. Дифференцировка клеток................................................................ 356
8.2.6. Эмбриональная индукция............................................................... 366
8.2.7. Генетический контроль развития.................................................... 373
8.3. ЦЕЛОСТНОСТЬ ОНТОГЕНЕЗА......................................................... 378
8.3.1. Детерминация.................................................................................. 378
8.3.2. Эмбриональная регуляция............................................................. 380
8.3.3. Морфогенез..................................................................................... 384
8.3.4. Рост.................................................................................................. 388
8.3.5. Интегрированность онтогенеза...................................................... 393
8.4. РЕГЕНЕРАЦИЯ.................................................................................... 393
8.5. СТАРОСТЬ И СТАРЕНИЕ. СМЕРТЬ КАК БИОЛОГИЧЕСКОЕ ЯВЛЕНИЕ....................................................................................................................... 403
8.5.1. Изменение органов и систем органов в процессе старения........... 404
8.5.2. Проявление старения на молекулярном, субклеточном и клеточном уровнях...................................................................................................... 409
8.6. ЗАВИСИМОСТЬ ПРОЯВЛЕНИЯ СТАРЕНИЯ ОТ ГЕНОТИПА, УСЛОВИЙ И ОБРАЗА ЖИЗНИ......................................................................................... 412
8.6.1. Генетика старения............................................................................ 412
8.6.2. Влияние на процесс старения условий жизни................................ 417
8.6.3. Влияние на процесс старения образа жизни.................................. 423
8.6.4. Влияние на процесс старения эндоэкологической ситуации......... 425
8.7. ГИПОТЕЗЫ, ОБЪЯСНЯЮЩИЕ МЕХАНИЗМЫ СТАРЕНИЯ......... 426
8.8. ВВЕДЕНИЕ В БИОЛОГИЮ ПРОДОЛЖИТЕЛЬНОСТИ
ЖИЗНИ ЛЮДЕЙ......................................................................................... 428
8.8.1. Статистический метод изучения закономерностей
продолжительности жизни........................................................................ 429
8.8.2. Вклад социальной и биологической компонент в общую смертность
в историческом времени и в разных популяциях.................................... 430
ГЛАВА 9. РОЛЬ НАРУШЕНИЙ МЕХАНИЗМОВ ОНТОГЕНЕЗА
В ПАТОЛОГИИ ЧЕЛОВЕКА..................................................................... 433
9.1. КРИТИЧЕСКИЕ ПЕРИОДЫ В ОНТОГЕНЕЗЕ ЧЕЛОВЕКА............ 433
9.2. КЛАССИФИКАЦИЯ ВРОЖДЕННЫХ ПОРОКОВ РАЗВИТИЯ....... 435
9.3. ЗНАЧЕНИЕ НАРУШЕНИЯ МЕХАНИЗМОВ ОНТОГЕНЕЗА
В ФОРМИРОВАНИИ ПОРОКОВ РАЗВИТИЯ......................................... 438
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА............................................................ 443
Учебное издание
Ярыгин
Владимир Никитич,
Васильева
Вероника Игоревна,
Волков
Игорь Николаевич,
Синельщикова
Валерия Васильевна
БИОЛОГИЯ
В 2 книгах
Книга 1
Редактор Т.С. Костям.
Художник К.Э. Семенков.
Художественный редактор Ю.Э. Иванова.
Технические редакторы Н.В. Быкова, Л.А. Овчинникова.
Корректор Е.И. Борисова.
Компьютерная верстка Г.А. Шестакова.
Лицензия ИД №
06236 от 09.11.01.
Изд. № ХЕ-257. Подп. в печать 05.11.02. Формат 60x881
/16
. Бум. газетн. Гарнитура «Таймс». Печать офсетная. Объем 26,46 усл. печ. л..
26,46 усл. кр.-отт., 30,72 уч.-изд. л. Тираж 8000 экз. Заказ №258.
ФГУП «Издательство «Высшая школа»,
127994, Москва, ГСП-4, Неглинная ул., 29/14.
Тел.: (095) 200-04-56
E-mail: info@v-shkola.ru http://www.v-shkola.ru
Отдел реализации:
(095) 200-07-69, 200-59-39, факс: (095) 200-03-01.
E-mail: sales@v-shkola.ru
Отдел «Книга-почтой»:
(095) 200-33-36. E-mail:bookpost@v-shkola.ru
Отпечатано в ОАО «Оригинал».
101990, Москва, Центр, Хохловский пер., 7-9, стр. 1-7.
1
Авторы клеточной теории, утверждая верное положение о единообразии пути возникновения клеток, непосредственный механизм их образования представляли неверно. М. Шлейден считал, что молодые клетки возникают путем конденсации слизистого вещества первоначально в ядро с дальнейшим наслоением и отграничением цитоплазмы. Т. Шванн разделял эту точку зрения.
1
Под клеточным возбуждением понимают обратимые изменения протоплазмы, запускающие ту или иную клеточную деятельность и являющиеся ее основой.
2
Протоплазма — содержимое живой клетки, включающее ее ядро и цитоплазму.
1
Иногда удвоение ДНК обозначают термином репликация,
оставляя термин редупликация
для обозначения удвоения хромосом.
1
Ряд авторов включают в митотический аппарат также хромосомы.
1
От истинного гермафродитизма,
о котором здесь идет речь, следует отличать гермафродитизм ложный,
заключающийся в сочетании в одной особи наружных половых органов и вторичных половых признаков обоих полов при наличии половых желез одного типа — мужского или женского.
1
Термин зародышевая плазма
был ранее использован А. Вейсманом, но в совершенно ином смысле — для обозначения наследственного вещества ядра клетки (хромосом).
1
t+
— доминантный аллель гена.
1
Наступлению биологической смерти нередко предшествует состояние клинической смерти,
в котором клетки и ткани сохраняют достаточный уровень жизнеспособности, чтобы организм с помощью определенных воздействий мог быть возвращен к жизни (реанимация
).
2
Вопрос о потенциальном бессмертии и отсутствии старения у простейших, поставленный учеными в конце XIX — начале XX столетия на заре экспериментальной геронтологии, требует дальнейшей разработки. Наблюдения над амебами размножающимися бесполым способом, показали, что выживание клеточной культуры, образованной исходно одной клеткой (клеточный клон), зависит от условий культивирования. Клок инфузорий; для которых типична смена бесполого размножения и полового процесса, постепенно утрачивал способность к последнему.
|