Федеральное агентство по образованию Российской Федерации
ГОУ ВПО «Российский химико-технологический университет им. Д.И. Менделеева»
Новомосковский институт (филиал)
Кафедра общей и неорганической химии
КУРСОВАЯ РАБОТА
ПО НЕОРГАНИЧЕСКОЙ ХИМИИ
на тему:
Получение и исследование свойств гексанитрокобальтата (III) натрия
Руководитель: Кочетов В.А.
Студент группы ХП-07-1: Афонина Е.В.
Новомосковск 2008
ВВЕДЕНИЕ
Соединения высшего порядка – так называл знаменитый шведский химик И.Я. Берцелиус (1779-1848) сложные многокомпонентные химические соединения, строение которых очень долго оставалось загадкой для ученых. Данный термин широко использовал А.Вернер и многие другие ученые прошлого и начала настоящего века. Термин «комплексные соединения» введен в химическую литературу выдающимся химиком В. Оствальдом.
Комплексные соединения химики обнаруживали прежде всего среди неорганических веществ. Поэтому химия этих соединений долго считалась разделом неорганической химии. В середине прошедшего столетия она оформилась в самостоятельную отрасль химической науки. В последующие десятилетия комплексные соединения стали играть интегрирующую роль для отдельных отраслей химии. Во второй половине прошлого столетия выяснилось, что комплексные соединения являются объектами изучения различных отраслей химии: аналитической, металлорганической, биологической, гомогенного катализа. На базе общего интереса специалисты этих отраслей химии стали налаживать тесные контакты, организовывать общие конференции.
Время рождения координационной химии как науки связывают со случайным получением в 1798 году Тассером соединения кобальта, состав которого можно записать СоСl3
6NH3
.Однако человеку были известны соединения высшего порядка и до открытия Тассера. Вероятно, первым подобным соединением, синтезированным в лаборатории, является берлинская лазурь Fe4
[Fe(CN)6
]3
. Она случайно получена художником Дисбахом в 1704 году и использована как красящий пигмент.
В становление и развитие химии комплексных соединений большой вклад внесли шведские и датские химики Берцелиус, Бломстранд, Клеве, Иергенсен и другие. В конце 19 века центром по изучению комплексных соединений стал Цюрих, где работал создатель координационной теории Альфред Вернер. После кончины Вернера важные исследования по химии координационных соединений выполнены в Германии его учеником Паулем Пфейффером. В начале 20 века наибольший прогресс в этой области химии достигнут в нашей стране благодаря Льву Александровичу Чугаеву, который создал уникальную советскую школу химиков - комплексников. После Второй мировой войны в связи с необходимостью создания производств редких металлов в мире резко возрос интерес к химии комплексных соединений.
Реклама

Таким образом, в данной курсовой работе синтезировано комплексное соединение гексанитрокобальтат (III) натрия и изучены некоторые его свойства.
I
. ЛИТЕРАТУРНЫЙ ОБЗОР
1.1 Химическая связь и строение иона [
Co
(
NO
2
)6
]3-
с позиции валентных связей
Для комплексов с координационным числом 6 характерно октаэдрическое расположение лигандов, что отвечает sp3
d2
- или d2
sp3
- гибридизации атомных орбиталей комплексообразователя.
Октаэдрическим строением обладают ионы [PtCl6
]2-
, [Fe(CN)6
]3-
[Al(H2
O)2
(OH)4
]-
, [SnCl6
]2-
, [Co(NO2
)6
]3-
и многие другие. Октаэдрическое строение комплексов с координационным числом 6 является наиболее энергетически выгодным.
Таблица 1. Степени окисления и пространственная конфигурация комплексов (структурных единиц) элементов подгруппы кобальта [1].
| Степени окисления |
Электронная конфигурация |
Координационное число |
Пространственная конфигурация комплексов |
Примеры соединений |
| -1 |
d9
|
4 |
Тетраэдр |
[Co(CO)4
]-
, [Rh(CO)4
]-
|
| 0 |
6 |
Тетраэдр |
Co2
(CO)8
|
| +2 |
d7
|
4
6
|
Тетраэдр
Октаэдр
|
[CoCl4
]2-
[Co(NH3
)6
]2+
, [Co(OH2
)6
]2+
|
| +3 |
d6
|
6 |
Октаэдр |
[Co(NO2
)6
]3-
, [CoF6
]3-
|
| +4 |
d5
|
6 |
Октаэдр |
[IrF6
]2-
|
| +6 |
d3
|
6 |
Октаэдр |
RhF6
|
К элементам VIII группы семейства железа относятся железо, кобальт и никель. Эти элементы проявляют сходные свойства, отраженные в таблице 2[1].
Таблица 2. Краткая характеристика элементов VIII группы.
| Элемент |
Порядковый номер в периодической системе элементов |
Конфигурация внешнего и предвнешнего электронных слоев |
Радиус, нм |
Первый потенциал ионизации |
| атома |
иона Э2+
|
| Fe |
26 |
3s2
3p6
3d6
4s2
|
0,122 |
0,037 |
764 |
| Co |
27 |
3s2
3p6
3d7
4s2
|
0,118 |
0,035 |
760 |
| Ni |
28 |
3s2
3p6
3d8
4s2
|
0,113 |
0,033 |
739 |
Рассматриваемые элементы образуют химические связи за счет орбиталей внешнего и предвнешнего электронных слоев (табл. 1). У атома кобальта валентные электроны заполняют орбитали следующим образом:
Со
Число неспаренных электронов на 3d- подуровне соответственно равно трем.
Ион Co3+
имеет электронную формулу:[Ar]3d6
4s0
:
Во внутренней сфере между комплексообразователем и лигандами формируются полярные ковалентные связи. Частицы внешней сферы удерживаются около комплекса за счет электростатического ионного взаимодействия, т.е. характер связи - преимущественно ионный.
Для объяснения химической связи в комплексных соединениях используют: метод валентных связей (ВС),теорию кристаллического поля.
Рассмотрим метод ВС. Химическую связь в комплексе, т.е. между комплексообразователем и лигандами обычно объясняют с позиций донорно-акцепторного механизма. При этом, как правило, лиганды предоставляют неподеленные электронные пары, а комплексообразователи - свободные орбитали.
Реклама

3
d
4
s
4
p
4
d

Для комплексных соединений, так же как и для органических веществ, характерна изомерия. Изучение изомерии комплексов позволило установить их пространственное строение. Нитрит – ион как лиганд может координироваться через атом азота, образуя нитро-комплексы, или через атом кислорода, образуя нитрито-комплексы. Такая изомерия известна для комплексов многих переходных металлов (Co3+
, Rh3+
, Ir3+
, Pt4+
).
Например, в реакциях образования комплексов Co3+
с нитрит-ионами вначале получаются нитрито-комплексы, имеющие розовую окраску которые со временем переходят в устойчивые желто-коричневые нитро-комплексы. Следует отметить, что являясь лигандом сильного поля, нитрит-ион стабилизирует в комплексах высокие степени окисления 3d-металлов. Например, Co3+
в Nа3
[Со(NО2
)6
].
Так для иона [Co(NO2
)6
]3-
структура комплекса – октаэдрическая (рис 1).
Рис 1. 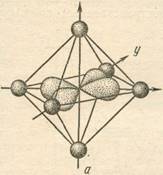
По характеру распределения электронов по орбиталям Co3+
ион [Co(NO2
)6
]3-
является низкоспиновым ионом (имеются неспаренные электроны). Комплекс Na3
[Co(NO2
)6
] диамагнитный, низкоспиновый, внутриорбитальный, октаэдрический.
1.2 Физические и химические свойства данного вещества (электролитическая диссоциация, устойчивость и способы разрушения комплексного соединения, участие в обменных реакциях)
Na3
[Co(NO2
)6
] – тонкий порошок желтого цвета, в безводном состоянии не выделен. При слабом нагревании разлагается. Хорошо растворяется в холодной воде. Водные растворы соли неустойчивы. Не реагирует с гидратом аммиака. Разлагается в кипящей воде, сильных кислотах и концентрированных щелочах. Устойчив на воздухе. Нерастворим в спирте и эфире. Устойчивое соединение. Плотность 2, 64 г/ см3
[2].
Химические свойства Na3
[Co(NO2
)6
]:
1)Разложение Na3
[Co(NO2
)6
] при температуре200-250 С:
4 Na3
[Co(NO2
)6
] 0,5H2
O=12NaNO2
+CoO+4NO+8NO2
+2H2
O
2)Взаимодействие с холодной водой:
Na3
[Co(NO2
)6
]+12H2
O(хол)
=3[Na(H2
O)4
]+
+ [Co(NO2
)6
]3-
3)Взаимодействие с горячей водой:
3Na3
[Co(NO2
)6
]+ 2H2
O(кип)
=9NaNO2
+3CoNO3
(OH) +5NO +HNO3
4)Реакции с разбавленными кислотами:
3Na3
[Co(NO2
)6
]+2HNO3(разб)
=9NaNO2
+3Сo(NO3
)2
+5NO+H2
O
5)Характерны реакции с концентрированными щелочами:
Na3
[Co(NO2
)6
]+2NaOH(
конц
)
=Co(OH)2
+4 NaNO2
+NaNO3
+NO
6)Взаимодействие с солями K+
,Cs+
,Tl+
,Ag+
,NH4
+
:
Na3
[Co(NO2
)6
]+3MeNO3
=Me3
[Co(NO2
)6
] +3 NaNO3
[2]
Электролитическая диссоциация.
Диссоциация по 1 ступени:
 Na3
[Co(NO2
)6
] 3Na+
+[Co(NO2
)6
]3- Na3
[Co(NO2
)6
] 3Na+
+[Co(NO2
)6
]3-
Диссоциация иона протекает по 6 ступеням:
 [Co(NO2
)6
]3-
Co3+
+6NO2
- [Co(NO2
)6
]3-
Co3+
+6NO2
-
= [Co(NO2
)6
]3-
/[Co3+
] [NO2
-
]6
1.3
Методы получения и очистки
1 способ.
Комплексы Co3+
обычно получают окислением соединений Co2+
в присутствии соответствующего лиганда.
Co(NO3
)2
+ 7 NaNO2
+ 2 CH3
COOH= Na3
[Co(NO2
)6
] + 2 NaNO3
+ 2 Na(CH3
COO) + NO + H2
O
РАБОТАТЬ ПОД ТЯГОЙ! В стакане емкостью 100 мл. при осторожном нагревании растворяют 7 г. NaNO2
в 7 мл. H2
O. В раствор вносят 2,5 г. кристаллического Co(NO3
)2
6H2
O и из капельной воронки приливают 2,5 мл. 50% CH3
COOH. Смесь в стакане перемешивают встряхиванием. После внедрения кислоты раствор перемешивают еще 10 минут. Если навеска была загрязнена KNO2
, то при окислении раствора осаждается K2
Na[Co(NO2
)6
], в этом случае раствор по окончании окисления следует отфильтровывать. К полученному раствору приливают при перемешивании 17 мл. C2
H5
OH. Раствор с выпавшим осадком оставляют на 1 час для окончательной кристаллизации. Осадок отфильтровывают на воронке Бюхнера, промывают небольшим количеством спирта, сушат на воздухе на листе фильтровальной бумаги, перемешивая стеклянной палочкой, и взвешивают. Рассчитывают выход продукта [3].
2 способ.
Растворяют 150 г. NaNO2
в 150 мл. H2
O при нагревании и к остывшему до 40-50 C раствору добавляют 50 г. нитрата кобальта. Затем при непрерывном помешивании приливают небольшими порциями 50 мл. 50% CH3
COOH (тяга!) и через смесь пропускают в течение получаса сильный ток воздуха, чтобы окислить двухвалентный Co:
4Co(NO3
)2
+24NaNO2
+12CH3
COOH+О2
=4Na3
[Co(NO2
)6
]+12Na(CH3
COO)+8HNO3
+2H2
O
Если исходный нитрит натрия был загрязнен калиевой солью, то при окислении из раствора осаждается гексанитрокобальтата (III) калия желтого цвета. Отстоявшийся раствор сливают через фильтр, желтый осадок отбрасывают.
Затем к фильтрату прибавляют при непрерывном перемешивании 350 мл. 96% спирта (или кристаллизуют над хлоридом кальция). При этом выпадает желтый осадок гексанитрокобальт (III) натрия Na3
[Co(NO2
)6
] H2
O.
Его отфильтровывают, промывают 2-3 раза небольшими порциями спирта, затем эфиром и высушивают на воздухе.
Для дальнейшей очистки сырой продукт перекристаллизовывают. Для этого его растворяют в полуторном количестве воды и осаждают спиртом [4].
3 способ.
Внесите в коническую колбу емкостью 500 мл. 15 г. нитрита натрия, 5г. гексагидрата нитрата кобальта и 15 мл. воды. Растворите кристаллы реагентов в воде при нагревании. Охладите реакционную смесь до 10-50 С и добавьте небольшими порциями 5 мл. 50% водного раствора уксусной кислоты. Наблюдайте бурную реакцию с выделением газа. По окончании реакции колбу закройте пробкой с двумя трубками и присоедините ее к водоструйному насосу. При включении насоса через раствор будет проходить воздух, удаляющий из реакционной смеси оксиды азота. Через 20 минут отключите колбу от насоса.
Раствор продукта отфильтруйте через складчатый фильтр для отделения примеси малорастворимого гексанитрокобальтата (III) калия.
К фильтрату добавьте по каплям 10 мл. этанола, при этом будет наблюдаться выпадение кристаллов желтого цвета. Продукт отделите от раствора вакуумным фильтрованием, промойте на фильтре этанолом и высушите на воздухе [5].
4 способ.
10 г. CoCl2
6H2
O или соответствующее количество Co(NO3
)2
6H2
O растворяют в 10 мл. воды. В другом стакане растворяют 30 г. NaNO2
в 100 мл. воды. Соли растворяют при умеренном нагревании. Растворы охлаждают, сливают вместе, осторожно перемешивают и приливают 10 мл. 50% уксусной кислоты. (Работают под тягой!) Образуется раствор гексанитрокобальтиата натрия
CoCl2
+ 7 NaNO2
+ 2 CH3
COOH= Na3
[Co(NO2
)6
] + 2 NaCl+ 2 Na(CH3
COO) + 2NO + H2
O
Смеси дают постоять, затем раствор сливают с осадка и фильтруют. Раствор представляет собой готовый реактив – раствор соли Na3
[Co(NO2
)6
]. Чтобы проверить его свойства, несколькими каплями раствора действуют на соль калия: должен выпадать желтый осадок соли K2
Na[Co(NO2
)6
] [6].
5 способ.
К 10 г. ацетата кобальта прибавляют 20 г. NaNO2
, растворенного в 40-50 мл. воды, и подкисляют уксусной кислотой. Полученному раствору дают постоять 1,5-2 часа и фильтруют его. В результате получается раствор Na3
[Co(NO2
)6
][6].
6 способ.
30 г. NaNO2
растворяют в 30 мл. воды при 40-50 С. К этому раствору прибавляют 10 г. Co(NO3
)2
6H2
O, затем малыми порциями приливают 10 мл. 50%-ной уксусной кислоты. В полученную смесь пропускают в течение 20 минут струю воздуха для удаления оксида азота.
Раствору дают постоять в течение 1-2 часов. Образуется осадок, состоящий из K2
Na[Co(NO2
)6
] и небольшого количества Na3
[Co(NO2
)6
](NaNO2
содержит примесь КNO2
). Осадок отфильтровывают. Основная масса соли Na3
[Co(NO2
)6
] остается в растворе. К раствору прибавляют 25 мл. спирта. При этом осаждается Na3
[Co(NO2
)6
].
Соль отфильтровывают, промывают 10 мл. спирта и 5 мл. эфира и сушат на воздухе. Если соль дает мутный раствор, то полученный препарат загрязнен. Для очистки его растворяют в полуторном количестве воды и отфильтровывают нерастворившуюся часть. В прозрачный раствор вливают тонкой струей спирт, который немного подкислен уксусной кислотой. Выпавший осадок Na3
[Co(NO2
)6
] отфильтровывают , еще раз промывают спиртом и эфиром и сушат при 60-70 С [6].
1.4 Применение
Na3
[Co(NO2
)6
] – пигмент для художественных красок и красок для росписи на стекле и фарфоре.
Комплексные соединения в организмах обычно координируются ионами переходных металлов, например Mn, Co, Fe. Содержание этих металлов в организмах очень мало, и уже из этого можно сделать предположение, что значение комплексов (доказанное прямым опытом – это почти всегда так) должно быть связано с катализом, т.к. именно активные катализаторы могут способствовать быстрым изменениям состава вещества, действуя в малых концентрациях. Также, комплексы переходных металлов могут играть роль переносчиков групп атомов и целых молекул, закреплять молекулы в определенном положении, поворачивать их, поляризовать и т.п. Металлы-комплексообразователи относятся к группе «жизненно важных», т.е. присутствуют во всех здоровых тканях человека и диапазон их концентраций практически постоянен в каждой ткани, а исключение из организма приводит к тяжелым последствиям [7].
Используют комплексные соединения для осаждения малорастворимых осадков.
Ряд комплексных солей, образованных катионами тяжелых металлов и анионами комплексных кислот, малорастворимые в воде. Например, многие катионы тяжелых металлов образуют с гексацианокобальтатом (III) ярко окрашенные, малорастворимые соли, например: Ni3
[Со(СN)6
]2
— зеленый, Со3
[Се(СN)6
]2
—розовато-красный Na3
[Co(NO2
)6
] – желтый и др.
Многие комплексные ионы отличаются высокой устойчивостью. Кроме того, большое число комплексных соединений имеет характерную окраску. Эти свойства комплексных соединений широко используют в качественном и количественном анализе. Например, ряд катионов обнаруживают путем образования комплексных соединений. Так, открывают ионы: К+
(Кз
[Со(NO2
)6
] — желтый осадок), Fе3+
(Fe4
[Fe(CN)6]3
— синий), Fе2+
(Fe2
[Fе(СN)6
] —синий), Сu2+
([Сu(NНз)4
](ОН)2
—синий и Cu2
[Fe(CN)6
] — красный) и другие[2].
II
.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
2.1 Выбор и обоснование метода получения
Na
3
[
Co
(
NO
2
)6
]
Исходя из возможностей лаборатории кафедры Общей и Неорганической Химии, был выбран 6 способ.
Способ приготовления:
Co(NO3
)2
6H2
O + 7NaNO2
+ 2 CH3
COOH=Na3
[Co(NO2
)6
] + 2NaNO3
+ 2Na(CH3
COO) + 2NO + 7H2
O
30 г. NaNO2
растворяют в 30 мл. воды при 40-50 С. К этому раствору прибавляют 10 г Co(NO3
)2
6H2
O, затем малыми порциями приливают 10 мл. 50%-ной уксусной кислоты. В полученную смесь пропускают в течение 20 минут струю воздуха для удаления оксида азота.
Раствору дают постоять в течение 1-2 часов. Образуется осадок, состоящий из K2
Na[Co(NO2
)6
] и небольшого количества Na3
[Co(NO2
)6
] (NaNO2
содержит примесь КNO2
). Осадок отфильтровывают. Основная масса соли Na3
[Co(NO2
)6
] остается в растворе. К раствору прибавляют 25 мл. спирта. При этом осаждается Na3
[Co(NO2
)6
].
Соль отфильтровывают, промывают 10 мл. спирта и 5 мл. эфира и сушат на воздухе. Если соль дает мутный раствор, то полученный препарат загрязнен. Для очистки его растворяют в полуторном количестве воды и отфильтровывают нерастворившуюся часть. В прозрачный раствор вливают тонкой струей спирт, который немного подкислен уксусной кислотой. Выпавший осадок Na3
[Co(NO2
)6
] отфильтровывают, еще раз промывают спиртом и эфиром и сушат при 60-70 С.
2.2 Расчет термодинамической возможности синтеза
Co(NO3
)2
6H2
O + 7NaNO2
+ 2 CH3
COOH=Na3
[Co(NO2
)6
] + 2NaNO3
+ 2Na(CH3
COO) + 2NO + 7H2
O
Co2+
+ 7NO2
-
+ 2CH3
COOH = [Co(NO2
)6
]3-
+ 2NO+ 2CH3
COO-
+ H2
O
Термодинамические константы веществ
| ΔH° (298) кДж/моль |
ΔG° (298) кДж/моль |
ΔS° (289) кДж/моль |
| Co2+
|
-59.41 |
-53.55 |
-112.97 |
| Na+
|
-239.9 |
-262.13 |
58.91 |
| NO3
-
|
-207.5 |
-111.7 |
147.3 |
| CH3
COOH |
-487 |
-393 |
160 |
| H+
|
0 |
0 |
0 |
| [Co(NO2
)6
]3-
|
- |
- |
- |
| NO2
-
|
90.25 |
86.58 |
210.6 |
| OH-
|
-230.19 |
-157.42 |
-10.86 |
Не оценена термодинамическая возможность протекания процесса, так как отсутствуют термодинамические данные по комплексу [8].
2.3 Синтез и исследование свойств
Na
3
[
Co
(
NO
2
)6
]
Реактивы:
Нитрит натрия NaNO2
, гексагидрат нитрата кобальта (II) Со(NO3
)2
· 6H2
O, раствор уксусной кислоты CH3
COOH (ώ(CH3
COOH) = 50 %), этиловый спирт C2
H5
OH, дистиллированная вода H2
O.
Посуда и оборудование:
Плоскодонная колба на 150 мл, мерный цилиндр на 10 мл, мерный цилиндр на 50 мл, стеклянная палочка, химический стакан на 100 мл (2 шт.), коническая воронка, фильтровальная бумага, весы, термометр, электрическая плитка, асбестовая сетка, воздуходувка.
Свойства исходных веществ.
Нитрит натрия NaNO2
– кристаллическое белое вещество, температура плавления 271 С, при более высокой температуре разлагается, плотность 2,17 г/см3
, растворимость в воде при 20 С 82,9 г. в 100 г. воды.
Гексагидрат нитрата кобальта (II) Co(NO3
)2
6H2
O – расплывчатые кристаллы красного цвета, при 55 С отщепляет 3 молекулы воды, при более высокой температуре разлагается, плотность 1,87 г/см3
, растворимость в воде при 0 С 263 г. в 100г.
Уксусная кислота CH3
COOH – бесцветная жидкость с резким запахом, плотность 1,049 г/см3
, температура плавления 16,75 С, температура кипения 118,1 С.
Этиловый спирт C2
H5
OH – бесцветная жидкость с характерным запахом, плотность 0,789 г/см3
, температура плавления –114,15 С, температура кипения 78,39 С.
Требования техники безопасности.
При работе с уксусной кислотой необходимо соблюдать правила работы с кислотами. При попадании раствора кислоты на кожу промыть место ожога струей воды в течение нескольких минут. После этого обработать обожженное место раствором питьевой соды.
При нагревании растворов необходимо соблюдать правила работы с нагревательными приборами. При термическом ожоге охладить пораженное место, для чего поместить его под струю холодной воды. После охлаждения смазать мазью от ожогов.
В качестве побочного продукта образуется оксид азота, поэтому синтез необходимо проводить в вытяжном шкафу.
2.4 Расчет практического выхода
30г – NaNO2
30г –H2
O
10г – Co(NO3
)2
•6H2
O
10мл – 50% CH3
COOH
35г – С2
H5
OH
Co(NO3
)2
6H2
O + 7NaNO2
+ 2 CH3
COOH=Na3
[Co(NO2
)6
] + 2NaNO3
+ 2Na(CH3
COO) + 2NO + 7H2
O
n(NaNO2
)= m(NaNO2
)/Mr(NaNO2
)=30г/69г/моль=0,434 моль
n(Co(NO3
)2
6H2
O)=m(Co(NO3
)2
6H2
O)/Mr(Co(NO3
)2
6H2
O)=10г/291г/моль=0,034моль
m(CH3
COOH)=Vwр=10мл 1,049г/мл 0,5=5,245г
n(CH3
COOH)= m(CH3
COOH)/Mr(CH3
COOH)=5,245г/60г/моль=0,087 моль
n(Na3
[Co(NO2
)6
])=0,034 моль
m(Na3
[Co(NO2
)6
])=Mr(Na3
[Co(NO2
)6
])n(Na3
[Co(NO2
)6
])=404г/моль0,034моль=13,73г =mэкспер.
/mтеор.
100%=10,5г/13,73г 100%=76,4%
2.5 Качественное определение ионов
Co
2+
,
Na
+
,
NO
-
2
1)Обнаружение Co2+
:
Прилить к 2-3 каплям раствора соли кобальта 2-3 капли уксусной кислоты, 5 капель раствора KNO2
и потрите стеклянной палочкой о стенки пробирки. Образуется желтый кристаллический осадок гексанитрокобальтата (III) натрия Na3
[Co(NO2
)6
].
Реакция основана на окислении при помощи NO-
2
в уксуснокислой среде:
Co2+
+ 6NO-
2
+ 2CH3
COOH = NO + 2CH3
COO-
+ Co3+
+H2
O
Кобальт (III), реагирует с избытком NO-
2,
тотчас образуя гексанитрокобальтата (III):
Co3+
+6NO-
2
= [Co(NO2
)6
]3-
2)Обнаружение Na3
[Co(NO2
)6
]:
Гексанитрокобальтат (III) натрия Nа3
[Со(NO2
)6
] образует с ионами калия желтый кристаллический осадок гексанитрокобальтата (III) калия-натрия:
2КСl + Na3
[Co(NO2
)6
] = K2
Na[Co(NO2
)6
]+ 2NaCl,
2К+
+ Na+
+ [Co(NO2
)6
]3-
= K2
Na[Co(NO2
)6
]
3)Обнаружение Na+
:
Окрашивание пламени горелки в желтый цвет говорит о наличии в соединении ионов натрия.
4)Обнаружение NO-
2
:
Пропитать фильтровальную бумагу крахмалом. На нее по каплям капать H2
SO4
2 н., 0,1 н. KI и раствор гексанитрокобальтата (III) натрия. В присутствии NO2
-
появляется синее окрашивание.
5)Обнаружение Co3+
:
В раствор гексанитрокобальтата (III) натрия добавляем 30% NaOH. При этом наблюдаем выпадение коричневого осадка Со(ОН)3
, т. е. происходит разрушение комплекса.
В раствор гексанитрокобальтата (III) натрия добавляем немного кристаллического или несколько капель концентрированного раствора NH4
SCN. Изменений не наблюдается [9].
2.6 Способы разрушения комплексного иона [
Co
(
NO
2
)6
]3-
В комплексных соединения имеет место первичная и вторичная диссоциация. Первая ступень протекает практически не обратимо:
 Na3
[Co(NO2
)6
] Na+
+ [Co(NO2
)6
]3- Na3
[Co(NO2
)6
] Na+
+ [Co(NO2
)6
]3-
Вторая ступень характеризует диссоциацию самого комплекса:
 [Co(NO2
)6
]3-
Co3+
+ 6NO2
- [Co(NO2
)6
]3-
Co3+
+ 6NO2
-
Разрушение данного комплекса осуществимо следующими способами:
Добавив в раствор гексанитрокобальтата (III) натрия щелочи
1)Na3
[Co(NO2
)6
] + NaOH(
кон
)
=Co(OH)3
+ NaNО2
+ H2
O
выпадает болотно-зеленый осадок Co(OH)3.
2)Na3
[Co(NO2
)6
] взаимодействует с KI в подкисленной среде
2Na3
[Co(NO2
)6
] + 2KI +6 H2
SO4
=2CoSO4
+ I2
+3 Na2
SO4
+ K2
SO4
+ 12NO+6H2
O
4)Na3
[Co(NO2
)6
] + Na2
S +2O2
=CoS + 5NaNO3
+NO
4)Na3
[Co(NO2
)6
]+3Br2
+9NaOH=6NaBr+Co(OH)3
+6NaNO2
+3H2
O
выпадает болотно- зеленый осадок Co(OH)3.
5)Na3
[Co(NO2
)6
]+2NaOH+2H2
O2
=5NaNO2
+Co(NO2
)3
+3 H2
O
ЗАКЛЮЧЕНИЕ
В данной курсовой работе было изучено комплексное соединение гексанитрокобальтат (III) натрия.
Проведен синтез, рассчитан практический выход продукта, он составил 76,4%. Были проведены реакции на определение ионов Co2+
, Na+
, NO-
2 .
Найдены способы разрушения комплексного иона [Co(NO2
)6
].
СПИСОК ЛИТЕРАТУРЫ
1. Ахметов Н.С. Общая и неорганическая химия. Учебник для ВУЗов. – М.: Высшая школа, 1982.– 594 с.
2. Лидин Р.А.,В.А. Молочко Л.Л. Андреева. Химические свойства неорганических веществ. Учебник для ВУЗов. – М.: КолосС, 2006. – 526 с.
3. Воробьев А.Ф.,С.И. Дракин. Практикум по неорганической химии. – М.: Химия,1984. – 207 с.
4. Ключников Н.Г. Практикум по неорганическому синтезу. – М: Просвещение,1979. –270 с.
5. Профильное обучение. – http://www.alhimik.ru.
6. Леснова Е.В. Практикум по неорганическому синтезу. – М: Высшая школа,1969. –168 с.
7. Некрасов Б.В. Основы общей химии. Учебник для ВУЗов. – М.:Химия,1965. –520 с.
8. Карапетьянц М.Х., Карапетьянц М.Л. Основные термодинамические константы неорганических и органических веществ. – М.: Химия, 1968. – 452 с.
9 Крешков А.П. Основы аналитической химии. - М.: Химия, 1970.– 366 с.
|