Содержание
1. Выпаривание, способы выпаривания, общие сведения
2. Однокорпусные выпарные установки, материальный и тепловой балансы
3. Выпарные аппараты, конструкции, интенсификация процессов выпаривания
4. Движущая сила выпаривания, температурные потери, схема передачи тепла в выпарных установках
5. Прямо и противоточные выпарные установки, явление самоиспаренияи
6. Материальный и тепловой балансы МВУ
7. Общая полезная разность температур и распределение по корпусам
8. Общая характеристика массообменных процессов, массоотдача и массопередача (аналогия с теплопередачей)
9. Движущая сила МОП, способы выражения сотавов фаз
10. Статика МОП, фазовые диаграммы
11. Линия равновесия, уравнение линии равновесия, системы газ-жидкость, пар-жидкость
12. Законы Дальтона, Генри, Рауля, идеальные и неидеальные системы
13. Классификация массообменных аппаратов
14. Материальный баланс МОП
15. Уравнение линий рабочих концентраций, рабочие линии, направление МОП
16. Кинетика МОП, молекулярная и конвективная диффузия, градиент концентраций
17. Модели массопереноса
18. Уравнение массопередачи, движущая сила
19. Основы расчета массообменной аппаратуры, расчет диаметра и высоты массообменного аппарата
20. Определение коэффициента массопередачи
21. Определение движущей силы МОП, ЧЕП, ВЕП
22. Определение числа ступеней (теоретическая и действительная тарелки КПД - локальный тарелки, колонны)
23. Метод кинетической кривой
24. Абсорбция, общие сведения, типы абсорберов, насадки, требования к насадкам и абсорбентам, гидродинамические режимы работы абсорберов
25. Статика процесса абсорбции, влияние температуры и давления на процесс абсорбции
26. Материальный баланс абсорбции, влияние удельного расхода абсорбента на размеры аппаратов
27. Скорость процесса абсорбции
28. Схемы абсорбционных установок
29. Перегонка жидкостей, общие сведения
30. Классификация бинарных систем, фазовые диаграмма P=f (x); t-x,y; y-x, азеотропные смеси
31. Простая перегонка, перегонка с дефлегмацией, материальный баланс
32. Ректификация, принцип ректификации
33. Непрерывная ректификация, схема, Материальный баланс
34. Допущения при расчете ректификации
35. Уравнение рабочих линий
Реклама

36. Построение рабочих линий по y-xдиаграмме
37. Минимальное и действительное флегмовое число, связь с размерами аппарата и расходом тепла в кубе колонны
38. Тепловой баланс ректификации
39. Расчет числа ступеней ректификации
40. Рекификация многокомпонентных смесей
41. Сушка, способы и особенности процесса сушки
42. Основные параметры влажного газа, I-x диаграмма
43. Изображение процессов при сушке на I-x диаграмме
44. Примерный механизм процесса сушки
45. Равновесие при сушке
46. Материальный и тепловой балансы процесса сушки, внутренний баланс сушки
47. Варианты процесса сушки
48. Кинетика сушки
Выпаривание - процесс концентрирования раствора практически нелетучих веществ путем испарения жидкого летучего растворителя.
Процесс выпаривания применяют как для частичного удаления растворителя, так и для полного разделения раствора на растворитель и растворенное вещество. В последнем случае выпаривание сопровождается кристаллизацией.
Физическая сущность: превращение растворителя в пар при кипении раствора и удалении образующегося пара.
Источник тепловой энергии - любые теплоносители (насыщенный водяной паргреющий или первичный). ГП отдает тепло выпариваемому раствору через стенку ("глухой" пар). Пар, образующийся при кипении выпариваемого раствора, называют вторичным.
В зависимости от свойств выпариваемого раствора и дальнейшего использования тепла вторичного пара выпаривание производят как при атмосферном давлении
, так и при давлениях выше (избыточном
) или ниже атмосферного (вакуум
). Самый простой - выпаривание под атмосферным давлением, но при этом вторичный пар не используется, а удаляется в атмосферу. Вторичный пар, отбираемый на сторону вне целей выпаривания, называют экстра-паром.
Выпаривание под избыточным давлением
позволяет использовать тепло вторичного пара, но обусловливает повышение температуры кипения раствора и, следовательно, требует применения греющего агента с более высокой температурой. Поэтому данный способ следует применять для выпаривания растворов не чувствительных к высоким температурам.
Выпаривание под вакуумом
имеет ряд преимуществ по сравнению с двумя рассмотренными выше способами:
а) позволяет снизить температуру кипения раствора (выпаривание растворов, чувствительных к высоким температурам, а также высококипящих растворов);
б) при вакууме увеличивается разность температур между греющим агентом и кипящим раствором, что, при прочих равных условиях, позволяет уменьшить поверхность теплообмена аппарата;
Реклама

в) за счет понижения температуры кипения раствора при разрежении можно использовать греющий агент более низких рабочих параметров (температуры и давления);
г) можно использовать в качестве греющего агента вторичный пар самой выпарной установки, что значительно снижает расход первичного греющего пара.
В химической технике выпаривание осуществляют либо в одном аппарате (однокорпусное выпаривание
), либо в нескольких последовательно соединенных между собой аппаратах (многокорпусное выпаривание
). Применяется также однокорпусное выпаривание с тепловым насосом.
При однокорпусном выпаривании раствор выпаривается от исходной до конечной концентрации в одном и том же аппарате. Однокорпусное выпаривание применяют либо в небольших по масштабу производствах, либо при агрессивных растворах, требующих для изготовления аппарата дефицитных материалов, либо если экономия пара не имеет существенного значения.
Процесс выпаривания проводится периодически
или непрерывно
. В периодически действующих
аппаратах загрузка исходного раствора, выпаривание его до необходимой более высокой концентрации и выгрузка упаренного раствора производятся последовательно. Опорожненный аппарат вновь наполняется исходным раствором и процесс повторяется. В аппаратах непрерывного действия
исходный раствор непрерывно подается на выпаривание в аппарат, а упаренный раствор также непрерывно отводится из него. Они более экономичны в тепловом отношении, так как в них отсутствуют потери тепла на периодический нагрев самого аппарата. Периодическая выпарка
целесообразна при выпаривании растворов с высокой температурной депрессией.
Выпарные аппараты с паровым обогревом можно объединить в три группы:
с естественной циркуляцией раствора;
с принудительной циркуляцией раствора (при выпаривании вязких растворов);
пленочные аппараты (для выпарки чистых некристаллизующихся растворов и растворов, чувствительных к высоким температурам).

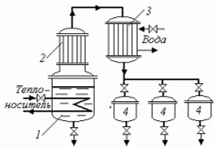
Греющий пар для облегчения чистки поверхности нагрева от накипи (во всех конструкциях выпарных аппаратов) подается в межтрубное пространство греющей камеры 1. Конденсат отводится снизу камеры. Выпариваемый раствор, предварительно нагретый до температуры кипения в выносном теплообменнике, поступает в пространство над трубками 3 и опускается по циркуляционной трубе 4 вниз. Затем, поднимаясь
по греющим трубкам, раствор вскипает. Отделение вторичного пара от раствора происходит в сепарационной части аппарата 2. Для более полного отделения пара от брызг и капель предусмотренбрызгоотделитель (каплеотбойник) 5. Очищенный вторичный пар удаляется сверху сепаратора.
Вследствие разности плотности раствора в циркуляционной трубе ипарожидкостной эмульсии в греющих трубках раствор циркулирует по замкнутому контуру (естественная циркуляция). Возникновение достаточной разности плотностей при этом обусловлено тем, что на единицу объема раствора в трубке приходится большая поверхность, чем в циркуляционной трубе, так как поверхность трубы находится в линейной зависимости от ее диаметра, а объем раствора в трубе пропорционален квадрату ее диаметра. Значит, парообразование в греющих трубках должно протекать интенсивнее, чем в циркуляционной трубе, а плотность раствора в них будет ниже, чем в циркуляционной трубе. Упаренный раствор удаляется из нижней части аппарата.
Материальный баланс: по всему веществу
по абсолютно сухому веществу
, находящемуся в растворе.
Тепловой баланс однокорпусного выпаривания.
Согласно схеме тепло в аппарат вносится:
с исходным растворомQ1
=Gн
cн
tн
;
с греющим паром Q2
=Diг
.
Тепло из аппарата уносится:
с упаренным раствором Q3
=Gк
cк
tк
;
с вторичным паром Q4
=Wiв
;
с конденсатом греющего пара Q5
=Dctкон
;
при концентрировании раствора Qк
;
с потерями в окружающую среду Qк
.
Уравнение теплового баланса принимает вид
Q1
+Q2
=Q3
+Q4
+Q5
+Qк
+Qк
или
Gн
cн
tн
+Diг
= Gк
cк
tк
+ Wiв
+ Dctкон
+ Qк
+ Qп
. (1)
Рассматривая исходный раствор как смесь упаренного раствора и испаренного растворителя, частное уравнение теплового баланса смешения при постоянной температуре кипения tк
раствора (температура упаренного раствора равна tк
) в аппарате можно записать:
Gн
cн
tн
=Gк
cк
·tк
+ Wс′·tк
где с′ - удельная теплоемкость растворителя при температуре кипения раствора, Дж/ (кг·К). Тогда:
Gк
cк
=Gн
cн
- Wс′ (2)
Подставляя правую часть уравнения (2) в уравнение (1), получим
Gн
cн
tн
+Diг
= Gн
cн
tк
+ Wс′·tк
+Wiв
+ Dctкон
+ Qк
+ Qп
. (3)
Из уравнения (3)
D (iг
-ctкон
) =Gн
cн
tк
+ +W (iв
+с′·tк
) + Qк
+ Qп
. (4)
Величина Qп в выпарных аппаратах, покрытых тепловой изоляцией, не превышает 3-5% полезно используемого тепла. Если раствор поступает в аппарат предварительно нагретый до температуры кипения, т.е. tн=·tк, то, пренебрегая суммой Qк+ Qп, получим из уравнения (4)
Практически iг
-ctкон
≈ iв
+с′·tк
, поэтому D≈W, т.е. теоретически на выпаривание 1 кг воды расходуется приблизительно 1 кг греющего пара. Практически, с учетом потерь тепла, удельный расход греющего пара составляет 1,1-1,2 кг/кг воды.

Триосн. Направления интенсификации:
1) интенсификация теплообмена - применение развитых поверхностей нагрева, напр. в виде набора стальных пластин, тонкостенных (1,2-1,5 мм) и ребристых труб, а также труб со спец. турбулизаторами в форме внутр. кольцевых выступов или проволочных спиральных вставок;
2) снижение накипеобразования - использование, напр., затравочных кристаллов, способствующих массовой кристаллизации в объеме р-ра, или антиадгезионных полимерных покрытий;
3) экономия энергозатрат - применение, напр., экстра-пара и конденсата для нагревания исходного р-ра либо его предварительное концентрирование с помощью мембранного разделения.
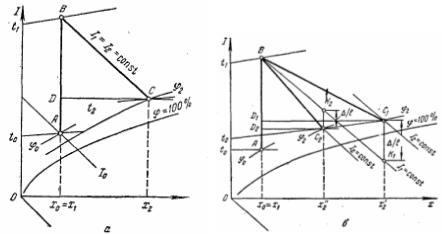
Движущая сила процессов выпаривания - разность температур
Δtпол
=tГП
-tК. Р-РА
Разность температур между греющим и вторичным паром в выпарном аппарате называют общей или располагаемой разностью температур. Общая разность температур Δtобщ
в многокорпусной выпарной установке определяется разностью между температурой Т1
греющего пара в первом корпусе и температурой Тк
вторичного пара, поступающего из последнего корпуса в конденсатор, т.е.
Δtобщ
= Т1
-Тк
Полезная разность температур Δtпол
в выпарном аппарате меньше общей разности температур на величину температурных потерь:
Δtпол
=Δtобщ
- ∑Δ
где ∑Δ - сумма температурных потерь (потерь температурного напора). Для многокорпусной выпарки общая полезная разность температур равна общей (располагаемой) разности температур за вычетом суммы температурных потерь по всем корпусам установки
∑Δtпол
=Δtобщ
- ∑Δ
Температурные потери при выпаривании обусловлены следующими причинами:
температурной депрессией Δ′ - уменьшением упругости паров растворителя над раствором по сравнению с упругостью паров чистого растворителя - рассмотренной ранее;
гидростатической депрессией Δ′′ - повышением температуры кипения раствора вследствие гидростатического давления столба жидкости в греющих трубках аппарата;
гидравлической депрессией Δ′′′ - понижением давления вторичного пара за счет гидравлических сопротивлений в паропроводах между корпусами многокорпусной выпарной установки.
Гидростатическая депрессия Δ′′ вызывается тем, что давление на жидкость в выпарном аппарате по высоте трубок неодинаково. Это обусловливает различную температуру кипения раствора по всей его высоте. Так, например, если нагревать воду в трубе высотой 10 м, то верхний слой воды закипит при температуре 100°С, а нижний же слой, находящийся под абсолютным давлением 0,2 МПа, - при температуре 120°С.
Полная депрессия в аппарате ΣΔ равна сумме температурной, гидростатической и гидравлической депрессии
tк
=T′ - ΣΔ,
где T′ - температура вторичного пара в выпарном аппарате, °С.

Многокорпусные выпарные установки различаются также по взаимному направлению движения
греющего пара и выспариваемого раствора.
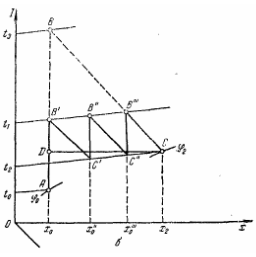
В прямоточной установке, ввиду более низкого давления во втором корпусе раствор, упаренный в первом корпусе, перемещается самотеком во второй корпус и здесь охлаждается до температуры кипения в этом корпусе. За счет выделяющегося при этом тепла образуется дополнительно некоторое количество вторичного пара. Такое явление, происходящее во всех корпусах установки, кроме первого, носит название самоиспарения
раствора.
Кроме наиболее широко распространенных установок с прямоточным движением пара и раствора (см. рис 2), применяются также противоточные
выпарные установки, в которых греющий пар и выпариваемый раствор перемещаются из корпуса в корпус во взаимно противоположных направлениях. Исходный раствор подается насосом в последний по ходу греющего пара (третий) корпус, из которого упаренный раствор перекачивается во второй корпус, и т.д., причем из первого корпуса удаляется окончательно упаренный раствор. Свежий (первичный) пар поступает в первый корпус, а вторичный пар из этого корпуса направляется для обогрева второго корпуса, затем вторичный пар из предыдущего корпуса используется для обогрева последующего. Из последнего корпуса вторичный пар удаляется в конденсатор.
Расход свежего (первичного) пара d1
кг/сек,
его энтальпия IГ1
кдж/кг
и температура θ1
°C.
После первого корпуса отбирается Е1
кг/сек
и после второго корпуса Е2
кг/сек
экстра-пара. Соответственно расход вторичного пара из первого корпуса, направляемого в качестве греющего во второй корпус, составляет (W1
-E1
) кг/сек
и вторичного пара из второго корпуса, греющего третий корпус (W1
-E3
) кг/сек,
где W1
и W2
- количества воды, выпариваемой в первом и втором корпусах соответственно.
Уравнения тепловых балансов корпусов:
первый корпус

второй корпус

третий корпус

а) F1
=F2
=…
Складывая полезные разности температур отдельных корпусов, получим или:
б) Оценим распределение общей полезной разности температур при условии минимальной суммарной поверхности нагрева корпусов.
При минимальной суммарной теплопередающей поверхности в каждом отдельном корпусе поверхность теплообмена будет различной. Различие поверхностей корпусов удорожает изготовление и эксплуатацию выпарной установки. Этот вариант рационален только при изготовлении выпарных аппаратов из дефицитных, дорогостоящих и коррозионностойких материалов.
В химической технологии широко распространены и имеют большое значение процессы массопередачи, которые характеризуются переходом одного или нескольких веществ из одной фазы в другую. С помощью таких процессов можно разделить как гетерогенные, так и гомогенные системы (газовые смеси, растворы жидкостей и т.п.). Причем наиболее часто процессы массопередачи используются для разделения гомогенных систем.
Перенос компонента, совершающийся в пределах фазы, и направленный либо из фазы к межфазной поверхности, либо от межфазной поверхности вглубь фазы, называется массоотдачей (по аналогии с теплоотдачей). А перенос компонента из данной фазы в смежную фазу называют массопередачей. При этом совершается перенос компонента через межфазную поверхность. Поэтому массопередачу можно рассматривать как состоящую в общем случае из следующих основных стадий: из двух стадий массоотдачи и находящейся между ними стадии передачи компонента через межфазную поверхность. В некоторых процессах одна из стадий массоотдачи может отсутствовать, например при кристаллизации.
Перенос компонентов в фазах осуществляется диффузией, поэтому промышленные массообменные процессы иногда называют диффузионными. Совокупность значений концентрации с какого-либо компонента во всех точках фазы называется полем концентрации этого компонента в данной фазе.
В промышленности используются, в основном, следующие процессы массопередачи.
Абсорбция - процесс разделения газовой или парогазовой смеси методом избирательного растворения ее компонентов в жидкости.
Адсорбция - процесс разделения газовой или парогазовой смеси или жидкого раствора методом избирательного поглощения твердым веществом. К этим процессам, называемым сорбционными, относится и десорбция, т.е. удаление поглощенных веществ из поглотителя.
Перегонка и ректификация - процессы разделения жидких смесей, основанные на различии в летучестях ее компонентов.
Экстракция - процесс разделения жидких смесей, основанный на различной растворимости компонентов жидкости в растворителе, который практически не смешивается с раствором или смешивается частично.
Сушка - процесс удаления влаги из твердых пористых материалов, основанный на переходе ее в паровую или парогазовую фазу.
Ионный обмен - избирательное извлечение ионов из растворов электролитов твердыми поглотителями.
Кристаллизация - процесс разделения раствора на растворитель и растворенное вещество за счет выделения растворенного вещества из его пересыщенного раствора или расплава.
Растворение - процесс перехода из твердой фазы в жидкую. Извлечение на основе избирательной растворимости какого-либо вещества (или веществ) из твердого пористого материала называют экстракцией из твердого материала, или выщелачиванием.
Мембранные процессы - избирательное извлечение компонентов смеси или их концентрирование с помощью полупроницаемой перегородки - мембраны.
Движущая сила МОП - градиент концентрации.
Составы жидкой и газовой фаз могут быть выражены в мольных или
массовых соотношениях. Наиболее распространены следующие способы выражения состава:
1. Объемная концентрация - количество компонента, содержащегося в единице объема фазы, кг/м3, кмоль/м3.
2. Мольные или массовые доли - количество компонента, отнесенное к количеству фазы (выраженные в мольных или массовых единицах).
3. Относительная концентрация - отношение количества компонента к количеству носителя, кг/кг, кмоль/кмоль.
4. Парциальные давления - выражение состава газовой фазы, кПа, МПа.
с - мольная объемная концентрация;
массовая объемная концентрация;
x, y - мольная доля;
массовая доля;
X, Y - мольная относительная концентрация;
массовая относительная концентрация;
10. Статика МОП, фазовые диаграммы
Правило фаз Гиббса:Ф+C=K+2. Оно указывает число параметров, которое можно менять произвольно (в известных пределах) при расчете равновесия в процессах массообмена. Применим это правило к реальным процессам:
1) каждая из двух взаимодействующих фаз содержит, помимо распределяемого компонента, инертный компонент носитель (абсорбция, экстракция) С=К+2-Ф=3+2-2=3 - можно изменять 3 параметра: концентрацию, давление и температуру
2) в каждой из двух фаз компонент носитель отсутствует (ректификация) С=К+2-Ф=2+2-2=2 - можно менять 2 параметра. При постоянном давлении с изменением концентрации фазы должна меняться температура, при постоянной температуре - разным концентрациям будут соответствовать разные давления.
Фазовая диаграмма - зависимость между независимыми переменными изображенные в линейных координатах.
В расчётах по массопередаче используют зависимости давления от концентрации (при t=const), температуры от концентрации (P=const) и между равновесными концентрациями фаз:

а) P=const, t=const б) P=const
При равновесии достигается определенная зависимость между предельными (равновесными) концентрациями и концентрациями распределяемого вещества в фазах для данных температуры и давления, при которых осуществляется процесс массопередачи.
В условиях равновесия некоторому значению отвечает строго определенная равновесная концентрация в другой фазе. И наоборот. В общем виде это представляет собой зависимость.
Эта зависимость в графическом виде называется линией равновесия, которая является либо прямой либо кривой.

а) система газ-жидкость, P=const, t=constб) система пар-жидкость P=const
Для случая бинарной газовой смеси, состоящей из распределяемого компонента А и газа-носителя В, взаимодействуют две фазы и три компонента. Поэтому по правилу фаз число степеней свободы будет равно
С=К-Ф+2=3-2+2=3
Это значит, что для данной системы газ-жидкость переменными являются температура, давление и концентрации в обеих фазах. Следовательно, при постоянных температуре и общем давлении зависимость между концентрациями в жидкой и газовой фазах будет однозначной.
Эта зависимость выражается законом Генри: парциальное давление газа над раствором пропорционально мольной доле этого газа в растворе, т.е.
(H-кф. Генри, - парциальное давление поглощаемого компонента в газе) Числовые значения коэффициента Генри для данного газа зависят от природы газа и поглотителя и от температуры, но не зависят от общего давления.
Для идеальных растворов на диаграмме рА
- хА
зависимость равновесных давлений от концентраций изображается прямой с угловым коэффициентом, равным константе Генри.
Для идеальных растворов связь между мольными долями компонента в газе и в растворе можно оценить по закону Дальтона:
где Р - общее давление газа. Тогда уравнение равновесия примет вид:
mA
является коэффициентом распределения или константой фазового равновесия.
Смеси с неограниченной взаимной растворимостью компонентов делятся, на идеальные и неидеальные. Неидеальные смеси можно подразделить на смеси с положительным и отрицательным отклонением от закона Рауля. Идеальные растворы следуют законам Рауля и Дальтона. Для бинарной смеси по закону Рауля.
В отличие от идеального раствора, для которого 1 = γA
= γB
, парциальные давления компонентов А и В неидеальной бинарной смеси составляют.
Для ряда смесей отклонения от закона Рауля настолько велики, что приводят к качественно новым свойствам смесей. При некотором составе подобные смеси имеют постоянную температуру кипения, которая может быть максимальной или минимальной. При этой температуре, согласно общему закону Коновалова, состав равновесного пара над смесью равен составу жидкости (у=х). Такие смеси называются азеотропными, или нераздельно кипящими.
В основу классификации массообменных аппаратов положен принцип образования межфазной поверхности:
1) аппараты с фиксированной поверхностью фазового контакта (насадочные и пленочные аппараты, а также аппараты (для сушки, с псевдоожижением), в которых осуществляется взаимодействие газа (жидкости) с твердой фазой);
2) аппараты с поверхностью контакта, образуемой в процессе движения потоков; среди аппаратов этого типа наиб. распространены тарельчатые, для которых характерно дискретное взаимодействие фаз по высоте аппарата; (насадочные колонны, работающие в режиме эмульгирования фаз, и аппараты, в которых осуществляется М. в системе жидкость - жидкость (экстракция));
3) аппараты с внешним подводом энергии (аппараты с мешалками, пульсационные аппараты, вибрационные роторные аппараты и др.)

Брутто: Gн
+Lн
=Gк
+Lк
По компоненту: Gн
ун
+Lн
хн
=Gк
ук
+Lк
ук
Для текущей концентрации:
Gн
ун
+Lх =Gу +Lк
ук
Решая, получим:
уравнение рабочей линии процесса
Рабочие концентрации распределяемого вещества не равны равновесным. Зависимость между рабочими концентрациями в координатах х-у - рабочая линия процесса
М.Б. по компоненту: Gн
ун
+Lн
хн
=Gк
ук
+Lк
ук
Для текущей концентрации: Gн
ун
+Lх =Gу +Lк
ук
Решая, получим: 
Распределяемое вещество всегда переходит из фазы, где его содержание выше равновесного в фазу, в которое концентрация этого вещества ниже равновесной. Направление переноса вещества определяется по линии равновесия и рабочей линии.

Если рабочая линия ниже линии равновесия - из жидкой в паровую (Ректификация).
Если рабочая линия выше линии равновесия - из газовой в жидкую (Абсорбция).
Перенос вещества внутри фазы: молекулярная диффузия, либо молекулярная+конвективная.
Молекулярная диффузия-перенос распределяемого вещества, обусловленный тепловым движением. Описывается первым законом Фика:
Масса вещества, придифундировавшая за время dtчерез элементарную поверхность dt, пропорциональная градиенту концентрации этого вещества:
dM=-D dFdt (dc/dx) =-D dFdt grad c.
D-коэффициент молекулярной диффузии.
Конвективная диффузия-перенос вещества вследствие конвективного переноса и молекулярной диффузии.

МD (x) =-D dzdydt grad c
МК (x) =wx
dzdycdt
Аналогично по yи z
МD (x+dx) = - Ddzdy dt dt
МК (x+dx) = [wx
C+ ] dzdydt ] dzdydt
Суммируем по трем осям
dM= dTdVв результате решения: dTdVв результате решения:
 -уравнение конвективной диффузии -уравнение конвективной диффузии

Допущения:
1. Общее сопротивление переносу из фазы в фазу складывается из сопротивления двух фаз
2. На поверхности фазы находятся в равновесии, равновесие на границе фаз устанавливается быстрее изменения средней концентрации в ядре фазы.
М=Кy
F (C0
y
-C0
y
*) t= Кy
FΔyср
М=Кx
F (C0
x
*-C0
x
) t = Кx
FΔxср
dM=-G dy =Ky
(y-y*) dF

подставим в M=G (yн
-yк
)
Расчет диаметра производится по уравнению расхода: Q=Sw0
(Q-объемный расход фазы, w0
-фиктивная скорость фазы). Для круглого аппарата:  значит D= значит D= . Скорость определяется исходя из технико-экономических расчетов. . Скорость определяется исходя из технико-экономических расчетов.
Высота массообменного аппарат определяется в зависимости от типа контакта фаз.
Высота аппаратов с непрерывным контактом
. Высота определяется на основе уравнения массопередачи, выраженного через объемный коэффициент массопередачи. M=Кy
αVΔyср
. Рабочий объем аппаратеV=SH. H=M/ (Кy
αSΔyср
) =h0
y
n0
y
.
Высота аппаратов со ступенчатым контактом. Для определения числа ступеней используют графические и аналитические методы. Рабочую высоту аппарата находят через число действительных ступеней, пользуясь зависимостью: H=nд
h (h-расстояние между ступенями).
Уравнение аддитивности фазовых сопротивлений
1/Kx
=1/βx
+1/βy
m
При кривой линии равновесия mи коэффициенты Kизменяются по длине аппарата. В этом случае при расчете его обычно разбивают на участки, в пределах каждого из которых mпринимают постоянной величиной и используют среднее для всего аппарата значение K.

Определение средней движущей силы процесса массопередаче

Число единиц переноса выражается интегралами ( ), которые могут быть решены аналитически и графически. Методом граф. интегрирования через площадь fи масштабов M1
и M2
: n0
y
=fM1
M2
. ), которые могут быть решены аналитически и графически. Методом граф. интегрирования через площадь fи масштабов M1
и M2
: n0
y
=fM1
M2
.

Упрощенный граф. метод.
Высота единиц переноса.
 ВЕП обратна пропорциональна объемному коэффициенту массопередачи. ВЕП обратна пропорциональна объемному коэффициенту массопередачи.
Теоретическая тарелка - такая ступень или тарелка, которая соответствует некоторому участку аппарата, на котором жидкость полностью перемешиваются, а концентрации удаляющихся фаз являются равновесными.
Существуют графические и аналитические методы.

Метод кинетической кривой.
Проводят линии A1
C1
и т.п.
Делят их в отношении к-та извлечения Ey
Проводят линию
Строят ступеньки
Нt учитывается влияние перемешивание.
При Ey
=1кинетическая кривая совмещена с кривой равновесия.

Определение числа теоретических тарелок.
Для перехода к числу действительных тарелок - КПД колоны nд
=nт
/КПД. КПД - учитывает реальную кинетику массообмена на действительных тарелках, на которых никогда не достигается равновесия.
КПД зависит от скорости движения фаз, перемешивания, направления движения, физ. свойств фаз.
КПД тарелки - отношение изменения концентрации данной фазы на тарелке к движущей силе на входе той же фазы в ступень.

Проводят линии A1
C1
и т.п.
Делят их в отношении к-та извлечения Ey
Проводят линию
Строят ступеньки
Нt учитывается влияние перемешивание.
При Ey
=1кинетическая кривая совмещена с кривой равновесия.
Абсорбцией называется процесс поглощения газов или паров из газовых или парогазовых смесей жидкими поглотителями (абсорбентами).
При физической абсорбции поглощаемый газ (абсорбтив) не взаимодействует химически с абсорбентом. В случае образования химического соединения между абсорбтивом и абсорбентом процесс называется хемосорбцией.
Физическая абсорбция в большинстве случаев обратима, на чем основано выделение поглощенного компонента из абсорбента - десорбция.
Абсорбционные процессы широко распространенны в химической технологии, например: поглощение водой серного ангидрида, хлористого водорода и двуокиси азота с образованием соответствующих серной, соляной и азотной кислот; поглощение паров бензола в коксохимическом производстве, поглощение компонентов природного и попутного газов в нефтехимии и нефтепереработке и т.д.
По способу создания этой поверхности абсорберы условно делят на следующие группы:
1. Поверхностные и пленочные.
2. Насадочные.
3. Барботажные (тарельчатые).
4. Распыливающие.
Требования к насадкам:
обладать большой поверхностью в единице объема (удельной поверхностью);
хорошо смачиваться орошающей жидкостью;
оказывать малое гидравлическое сопротивление потоку газа;
равномерно распределять орошающую жидкость;
быть стойкой к химическому воздействию среды в колонне;
иметь малый насыпной вес;
обладать высокой механической прочностью;
быть достаточно дешевой.

Режимы работы:
пленочный - наблюдается при небольших плотностях орошения и малых скоростях газа. Заканчивается он в переходной точке А, которая называется точкой подвисания.
подвисание. В режиме подвисания спокойное течение пленки нарушается: появляются завихрения и брызги, т.е. создаются условия перехода к барботажу. Это способствует увеличению интенсивности массообмена. Этот режим заканчивается в переходной точке В.
эмульгирование - возникает в результате накопления жидкости в свободном объеме насадки.
Гидравлическое сопротивление колонны при этом резко возрастает, что характеризуется отрезком ВС
режим уноса - отвечает обратному движению жидкости, выносимой из аппарата потоком газа. Режим аварийный и на практике не используется.
При абсорбции содержание газа в растворе зависит от свойств газа и жидкости, от общего давления, температуры и парциального давления распределяемого компонента.
Для случая бинарной газовой смеси, состоящей из распределяемого компонента А и газа-носителя В, взаимодействуют две фазы и три компонента. Поэтому по правилу фаз число степеней свободы будет равно
С=К-Ф+2=3-2+2=3
Это значит, что для данной системы газ-жидкость переменными являются температура, давление и концентрации в обеих фазах.
Следовательно, при постоянных температуре и общем давлении зависимость между концентрациями в жидкой и газовой фазах будет однозначной. Эта зависимость выражается законом Генри: парциальное давление газа над раствором пропорционально мольной доле этого газа в растворе.
 , ,
Числовые значения коэффициента Генри для данного газа зависят от природы газа и поглотителя и от температуры, но не зависят от общего давления.
Зависимость константы Генри от температуры выражается уравнением
 , ,
где q - дифференциальная теплота растворения газа;
С - постоянная, зависящая от природы газа и абсорбента.
Для идеальных растворов связь между мольными долями компонента в газе и в растворе можно оценить по закону Дальтона , ,
Тогда уравнение равновесия примет вид

ma-коэффициент распределения или константа фазового равновесия.
Примем расходы фаз по высоте аппарата постоянными и выразим содержание поглощаемого компонента в относительных единицах.
Тогда уравнение материального баланса будет иметь вид:
G (Yн
-Yк
) =L (Xк
-Xн
)
Удельный расход: l=L/G= (Yн
-Yк
) / (Xк
-Xн
)
Lmin
= (L/G) min
= (Yн
-Yк
) / (Xк
*-Xн
)
Увеличение удельного расхода ведет к снижению высоты аппарата и увеличению его диаметра. Оптимальный удельный расход определяется технико-экономическим расчетом.
Скорость процесса абсорбции характеризуется уравнением:
М=Кy
FΔyср
и М=КХ
FΔхср
Коэффициенты определяются:

Мольные концентрации газовой фазы можно заменить парциальными давлениями газа в долях общего давления: М=КХ
FΔpср
Поверхностный абсорбер:

Пластинчатый абсорбер:

Трубчатый абсорбер:

Насадочный абсорбер:

Одним из наиболее распространенных методов разделения жидких однородных смесей, состоящих из двух или большего числа компонентов, является перегонка. В широком смысле перегонка представляет процесс частичного испарения и последующей конденсации образующихся паров, осуществляемый однократно или многократно. В результате получается жидкость, состав которой существенно отличается от исходной смеси.
Разделение перегонкой основано на различной летучести компонентов смеси при одной и той же температуре. Поэтому при перегонке все компоненты смеси переходят в парообразное состояние в количествах, пропорциональных их фугитивности.
В простейшем случае исходная смесь является бинарной, т.е. состоящей только из двух компонентов. Получаемый при ее перегонке пар содержит относительно большее количество легколетучего или низкокипящего компонента (НКК), чем исходная смесь. Следовательно, в процессе перегонки жидкая фаза обедняется, а паровая фаза обогащается НКК. Неиспарившаяся жидкость имеет состав относительно более богатый труднолетучим или высококипящим компонентом (ВКК). Эта жидкость называется остатком, а жидкость, полученная в результате конденсации паров, - дистиллятом или ректификатом.
Степень обогащения паровой фазы НКК при прочих равных условиях зависит от вида перегонки. Существуют два принципиально отличных вида перегонки:
а) простая перегонка, или дистилляция;
б) ректификация.
Простая перегонка представляет собой процесс однократного частичного испарения жидкой смеси и конденсации образующихся паров. Простая перегонка применима только для смесей, летучести компонентов которых существенно различаются. Обычно ее используют для предварительного грубого разделения жидких смесей, а также для очистки сложных смесей от нежелательных примесей, смол и т.д.
Ректификация представляет собой процесс многократного частичного испарения жидкости и конденсации паров. Процесс осуществляется путем контакта потоков пара и жидкости, имеющих различную температуру, и проводится обычно в колонных аппаратах. При каждом контакте из жидкости испаряется преимущественно НКК, которым обогащаются пары, а из пара конденсируется преимущественно ВКК, переходящий в жидкость. Такой обмен компонентами, повторяющийся многократно, позволяет получить почти чистые НКК и ВКК. Пары после конденсации в отдельном конденсаторе разделяются на дистиллят и флегму - жидкость, возвращаемую для орошения колонны и взаимодействия с поднимающимися парами. Пары получают путем частичного испарения остатка, являющегося почти чистым ВКК.

Нерастворимые друге
Ограниченно растворимые друг в друге
С максимумом
Идеальные
С минимумом
3 и 5 - азеотропные, 3-5 – гомогенные

t-x,yдиаграмма - совмещенный график зависимостей температуры кипения жидкости от ее состава и температуры насыщенных паров от их состава. Для ее построения используются данные расчета равновесных составов паровой и жидкой фаз. Вначале в координатах t-х наносят точки, соответствующие температурам кипения жидкости и равновесным ее концентрациям Х. Через найденные точки проводят плавную линию, которая носит название линии кипения жидкости. Затем на эту же диаграмму наносят точки, соответствующие температурам кипения и равновесным составам пара У*
. Полученные точки так же соединяют плавной линией, которая называется линией насыщения (или конденсации)

Перегонку проводят путем постепенного испарения жидкости, находящейся в перегонном кубе. Образующиеся пары отводятся и конденсируются. Процесс осуществляется периодическим или непрерывным способом. Если процесс проводится периодически, то в ходе отгонки НКК содержание его в кубовой жидкости уменьшается. Вместе с тем изменяется и состав дистиллята, который обедняется НКК по мере протекания процесса. В связи с этим отбирают несколько фракций дистиллята, имеющих различный состав. Простая перегонка, проводимая с получением конечного продукта разного состава, называется фракционной, или дробной перегонкой.
Для составления материального баланса простой перегонки примем, что в кубе в некоторый момент времени содержится L кг перегоняемой смеси, имеющей текущую концентрацию по НКК х. Количество НКК в жидкости в этот момент равно Lx. Пусть за бесконечно малый промежуток времени dτ испарится dL кг смеси и концентрация жидкости в кубе изменится на dx. При этом образуется dL кг пара, равновесного с жидкостью и имеющего концентрацию у* количество НКК в паре будет dLy*. Соответственно остаток жидкости в кубе составит (L-dL) кг, а его концентрация будет (x-dx). Тогда материальный баланс по НКК выразится уравнением Lx= (L-dL) (x-dx) +dLy* Раскрывая скобки и отбрасывая бесконечно малые высших порядков, после разделения переменных получим  . Это дифференциальное уравнение можно проинтегрировать в пределах от начального количества L=F до конечного L=W и при изменении концентрации НКК в кубе от xF до xW. После интегрирования получим . Это дифференциальное уравнение можно проинтегрировать в пределах от начального количества L=F до конечного L=W и при изменении концентрации НКК в кубе от xF до xW. После интегрирования получим  . Средний состав получаемого дистиллята рассчитывают по уравнению материального баланса по НКК: . Средний состав получаемого дистиллята рассчитывают по уравнению материального баланса по НКК:
 , откуда , откуда  . .
Для повышения степени разделения смеси простую перегонку осуществляют, обогащая дополнительно дистиллят путем дефлегмации. Пары из перегонного куба 1 поступают в дефлегматор 2, где они частично конденсируются. Из пара конденсируется преимущественно ВКК и получаемая жидкость, так называемая флегма, сливается в куб. Пары, обогащенные НКК, поступают в конденсатор-холодильник 3, где полностью конденсируются. Дистиллят собирается в сборники 4. Окончание операции контролируют по температуре кипения жидкости в кубе, которая должна соответствовать заданному составу остатка.
В основе разделения жидких смесей летучих компонентов ректификацией используется принцип последовательно повторяющихся процессов однократного испарения. В свою очередь разделение жидких смесей однократным испарением основано на различии в летучестях компонентов (давлениях насыщенных паров чистых компонентов, взятых при одной и той же температуре). Процесс однократного испарения и принцип ректификационного разделения достаточно наглядно иллюстрируется схемами:

Процесс разделения жидких смесей ректификацией представляет собой ряд последовательно соединенных между собой процессов однократного испарения. Жидкость, содержащая НК в количестве Х1
, нагревается до температуры tкип.1.
Образуется насыщенный пар с равновесным содержанием НК У1
*
. Сконденсировав этот пар, получаем жидкость с содержанием НК Х2
=У1
*
. Вновь нагреваем эту жидкость до соответствующей температуры кипения tкип.2
. Образуется новый насыщенный пар с повышенным содержанием низкокипящего компонента, который вновь конденсируется и полученная жидкость вновь испаряется. В результате последовательно повторяющихся процессов однократного испарения пар обогащается низкокипящим компонентом, а жидкость - высококипящим компонентом.
Как следует из вышеизложенного, для практической реализации идеи многократных последовательно протекающих процессов испарения и конденсации необходимо проведение процессов теплообмена: в первом случае необходим подвод теплоты для испарения жидкости, а во втором - отвод теплоты для конденсации пара.
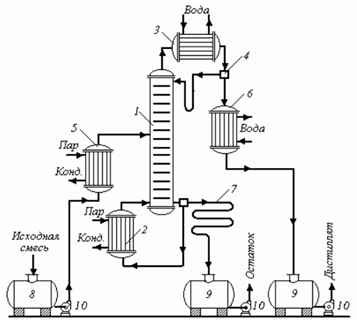
1 - ректификационная колонна;
2 - кипятильник;
3 - дефлегматор;
4 - делительфлегмы;
5 - подогреватель исходной смеси;
6 - холодильник дистиллята;
7 - холодильник остатка;
8 - емкость исходной смеси;
9 - сборники;
10 - насосы
МБ: F+Ф=G+W (т.к G=P+Ф) F=P+W
МБ. По н. к. к. FxF
=PxP
+WxW
1. Разделяемая смесь следует правилу Трутона, согласно которому отношение мольной теплоты испарения или конденсации r к абсолютной температуре кипения Т для всех жидкостей является приближенно постоянной величиной. Для смеси, состоящей из n компонентов:
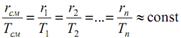 . .
Отсюда следует, что при конденсации в колонне 1 кмоль ВКК испаряется 1 моль НКК, т.е. мольное количество паров, поднимающихся по колонне постоянно.
2. Состав пара yD
, удаляющегося из колонны в дефлегматор, равен составу дистиллята хР
. При этом допускается, что укрепляющим действием дефлегматора в процессе конденсации в нем паров можно пренебречь и принять 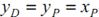 , гдеуР
- состав дистиллята в паровой фазе. , гдеуР
- состав дистиллята в паровой фазе.
3. Состав пара yW, поднимающегося из кипятильника в колонну, равен составу жидкости xW, стекающей в кипятильник из нижней части колонны. В этом случае пренебрегают исчерпывающим действием кипятильника, т.е. изменением состава фаз при испарении в нем жидкости.
4. Теплоты смешения компонентов разделяемой смеси равны нулю.
5. Исходная смесь поступает в колонну нагретой до температуры кипения.
Для получения уравнений рабочих линий используем общее для всех массообменных процессов уравнение, выразив применительно к ректификации входящие в него концентрации в мольных долях
 , т.к баланс по распределяемому компоненту: , т.к баланс по распределяемому компоненту:  , то: , то:  , в итоге получим: , в итоге получим:  . .
Укрепляющая часть колоны. L=Ф=PR, количество поднимающихся паров: G=P+Ф=P (R+1), yG
=yp
и согласно допущению yp
=xp
, значит yк
=xp
. Подставляя данные получим:  . .
Исчерпывающая часть колонны. L'=Ф+F=P (R+f) G'=G=P (R+1) xк
=xW
yн
=yW
=xW
. Подставляем:  . .
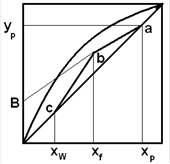
Для построения рабочих линий откладывают на оси абсцисс диаграммы составы xW
, xF
, xp
. Учитывая принятые допущения о равенстве составов пара и жидкостей на концах колонны, строят yp
. Величина Rизвестна, на оси ординат откладывают B=xp
/ (R+1), соединяют с точкой a. Из xf
поднимают перпендикуляр, получают точку b. ab - раб. Линия укрепляющей части колонны. В точке xW
- перпендикуляр до точки C. bc
- рабочая линия исчерпывающей части колонны. НКК переходит в паровую фазу, стремящуюся к равновсию с жидкой фазой.
При заданном составе дистиллята величина отрезка В зависит только от флегмового числа. С уменьшением R отрезок В увеличивается и рабочая линия как бы поворачивается вокруг точки а. Однако величину R можно уменьшать только до некоторого предела, определенного движущей силой процесса массопередачи между жидкой и паровой фазами. С уменьшением R точка b перемещается по вертикали и движущая сила снижается, пока не превратится в нуль. При этом рабочая линия отсекает от оси ординат максимальный отрезок, которому при заданном составе исходной смеси соответствует минимальное флегмовое число Rmin
.
Отметим, что в некоторой точке, лежащей на вертикали с абсциссой xF выше линии равновесия, рабочие линии пересечься не могут, так как в этом случае движущая сила будет отрицательной, что лишено физического смысла.
Очевидно, что нижнее предельное положение рабочих линий должно соответствовать точке их пересечения с диагональю диаграммы.
При этом B=B'=0, что истинно только при бесконечном флегмовом числе (R=∞). Поэтому действительное флегмовое число Rд, при котором должна работать колонна, находится в пределах от Rmin до R=∞.
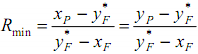
Рациональный выбор действительного флегмового числа представляет собой сложную задачу. Это объясняется тем, что флегмовое число определяет в конечном счете размеры аппарата и расходы теплоносителей (греющего пара в кипятильнике и воды в дефлегматоре). Следовательно, от значения флегмового числа зависят капитальные и эксплуатационные расходы на ректификацию.
C увеличением флегмового числа высота аппарата уменьшается, а расход теплоносителей возрастает. Вместе с тем с ростом R возрастает количество орошающей жидкости и поднимающихся паров, поэтому увеличивается диаметр аппарата, при прочих равных условиях.
Тепловой баланс ректификационной колонны. Приход тепла: С теплоносителем
в кипятильнике (Qкип
=Iк
Gп
), с исходной смесью (QF
=FiF
), с флегмой (QФ
=ФiФ
). Расход тепла: с парами, поступающими из колонны в дефлегматор (QG
=GI), с остатком (QW
=WiW
), потери тепла (Qп).
Iк
, I, iF
, iW
и iФ
- энтальпии соответственно греющего пара, паров, выходящих из колонны, исходной смеси, кубового остатка и флегмы. Приравнивая приход и расход тепла, получим уравнение теплового баланса
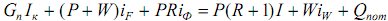
Решая уравнение относительно расхода греющего пара в кипятильнике, получим
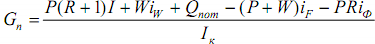
Потери тепла в окружающую среду обычно выражают в долях тепла, подводимого в кипятильник, т.е. принимают Qпот=αQкип, где при наличии хорошей тепловой изоляции α=0,03-0,05. Тогда окончательно уравнение примет вид
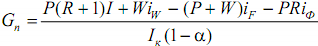
а) R - бесконечное, б) R-минимальное.
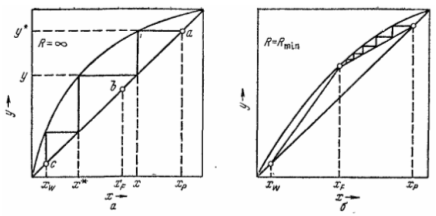
В промышленностти часто разделяют не бинарные, а много компонентные смеси. В отличии от бинарных смесей, обладающих двумя степенями свободы, у многокомпонентной смеси число степеней свободы равно числу комнонентов.
Число колонн для ректификации многокомпонентной смеси должно быть на 1 меньше, чем число компонентов, которые требуется разделить.
а. компоненты А и В более летучи, чем С
б. компоненты В и С менее летучи, чем А
Сушка - сложный диффузионный тепло - и массообменный процесс. Скорость сушки определяется скоростью диффузии влаги из глубины высушиваемого материала в окружающую среду.
По способам подвода тепла выделяют следящие виды сушки:
конвективная сушка (непосредственное соприкосновение материала с сушильным агентом (обычно нагретый воздух, топочные газы))
контактная сушка (тепло передается от теплоносителя к материалу через стенку)
специальные виды сушки (радиационная (инфракрасными лучами), диэлектрическая (токами высокой частоты), сублимационная (сушка в замороженном состоянии при глубоком вакууме))
Выбор типа сушилки зависит от химических свойств материала. Так, при сушке материалов с органическими растворителями используют герметичные аппараты и сушку обычно проводят под вакуумом; при сушке окисляющихся материалов применяют продувку инертными газами; при сушке жидких суспензий используют распыливание материала.
Абсолютная влажность
, [кг/м3
] - количество водяного пара в объеме влажного воздуха.
Относительная влажность
(степень насыщения) - отношения массы водяного пара в 1м3
влажного воздуха при данных условиях к максимально возможной массе водяного пара в 1м3
воздуха при тех же условиях.
Влагосодержание
- масса водяного пара во важном воздухе, приходящаяся на 1 кг абсолютно сухого воздуха.
Энтальпия
- относится к 1 кг абсолютно сухого воздуха и определяется при данной температуре воздуха как сумма энтальпий сухого воздуха и водяного пара
I=сс. в.
t+xiп
I-xдиаграмма влажного воздуха:
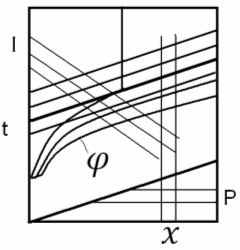
Теоретическая сушилка Действительная сушилка
С предварительным прогревом по зонам
При конвективной
сушке физическая сущность процесса сводится к удалению влаги из материала за счет разности парциальных давлений над материалом 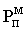 и в окружающей среде и в окружающей среде  . Процесс сушки происходит при условии, что . Процесс сушки происходит при условии, что 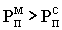 . При равенстве парциальных давлений . При равенстве парциальных давлений 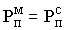 наступает состояние равновесия и процесс сушки прекращается. При этом в материале установится влажность, называемая равновесной наступает состояние равновесия и процесс сушки прекращается. При этом в материале установится влажность, называемая равновесной 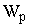 . Если сушить материал до влажности ниже равновесной, то неизбежно наступит состояние, при котором . Если сушить материал до влажности ниже равновесной, то неизбежно наступит состояние, при котором 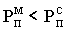 , и материал начнет увлажняться. Этот процесс называют сорбцией. Обычно сушку ведут до равновесной влажности. , и материал начнет увлажняться. Этот процесс называют сорбцией. Обычно сушку ведут до равновесной влажности.
При сушке удаление влаги с поверхности связано с диффузией влаги изнутри материала к поверхности. Эти два процесса должны находится в строгом соответствии, в противном случае возможно пересыхание, коробление поверхности материала и ухудшение его качества.
Таким образом, при конвективной сушке влага перемещается к поверхности за счет градиента влажности, градиент температуры несколько тормозит процесс. За счет разности температур на поверхности и внутри материала происходит движение влаги внутрь, в направлении снижения температуры.
Равновесная влажность, а следовательно протекание процесса сушки зависят от свойств высушиваемого материала, характера связи с ним влаги и параметров окружающей среды. Связь влаги с материалом может быть механической, физико-химической и химической.
Капиллярно связанная влага
заполняет макро - и микрокапилляры. Она механически связанна с материалом и наиболее легко удаляется. Давление пара над поверхностью материала тем меньше, чем прочнее связь между водой и материалом. Наиболее прочна эта связь у гигроскопических веществ. Давление пара над ними наиболее отличается от давления насыщенных паров.
Адсорбционно связанная влага.
Влажность обусловлена адсорбцией воды на наружной поверхности материала и на поверхности его пор. Осмотически связанная влага находится внутри структурного скелета материала и удерживается осмотическими силами. В этих двух случаях связь воды с материалом имеет физико-химическую природу.
Химически связанная влага.
Под химически связанной влагой понимают воду гидроокиси, которая в результате реакции гидратации вошла в состав гидроокиси и соединений типа кристаллогидратов. Связь нарушается только в результате химического воздействия (иногда в результате прокаливания), и влага не удаляется при сушке. Влажному материалу присущи все формы связи с водой, и очень трудно разграничить периоды сушки, соответствующие различным видам связи молекул воды с молекулами вещества. Поэтому экспериментальным путем строят изотермы сорбции при постоянной температуре. Изотермы сорбции позволяют установить связь между влажностью материала и относительной влажностью воздуха, а также определить равновесную влажность при сушке.
Возможны 2 процесса:
1. сушка (десорбция влаги) pм
>pп
2. увлажнение (сорбция влаги) pм
<pп
При pм
=pп
наступает динамическое равновесие, которому соответствует предельная влажность материала (wp
).
Равномерная влажность зависит от парциального давления пара над материалом или пропорциональной ему величины относительной влажности и определяется опытным путем.
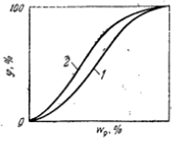
Зависимости wp
от относительной влажности при постоянной температуре - изотермы (2) сорбции (увлажнение материала) и (1) десорбции (удаление влаги из материала)
Наблюдается петля гестерезиса.
Форма связи влаги с материалом (по Рибендеру):
химическая
физическая (капилляры)
физико-химическая (адсорбционно и осмотически связанная)
М.Б. по всему материалу:
 , по абсолютно сухому веществу в высушиваемом материале: , по абсолютно сухому веществу в высушиваемом материале:
 , где G1-масса поступающего влажного материала, G2-масса высушенного материала, w1
и w2
- начальная и конечная влажность материала, W-масса влаги, удаляемой из материала. , где G1-масса поступающего влажного материала, G2-масса высушенного материала, w1
и w2
- начальная и конечная влажность материала, W-масса влаги, удаляемой из материала.
Тепловой баланс:
Приход тепла:
С наружным воздухом (LI0
), с влажным материалом (с сухим материалом (G2
cM
θ1
), с влагой, испаряемой из материала (WcВ
θ1
), с транспортными устройствами (GТ
TТ
tтн
), в основном калорифере (QК
), в дополнительном калорифере (QД
)).
Расход тепла:
С отработанным воздухом (LI2
), с высушенным материалом (G2
cM
θ2
), с транспортными устройствами (GТ
TТ
tтк
), приход тепла в окружающую среду (QП
))
LI0
+G2
cM
θ1
+WcВ
θ1
+GТ
TТ
Ttтн
+QК
+QД
=LI2
+G2
cM
θ2
+GТ
TТ
tтк
+QП
Из этого, расход тепла на сушку:
QК
+QД
= L (I2
- I0
) + G2
cM
(θ2
-θ1
) + GТ
TТ
(tтк
-tтн
) - WcВ
θ1
+QП
делим на W:
qК
+qД
=l (I2
-I0
) +qМ
+qТ
+ cВ
θ1
+qП
(q-удельные расходы)
Внутренний баланс сушилки
- величина, выражающая разность между приходом и расходом тепла непосредственно в сушилке без учета тепла, приносимого и уносимого воздухом, нагретом в основном в калорифере.
qК
=l (I1
-I0
)
l (I1
-I0
) +qД
=l (I2
-I0
) +qМ
+qТ
+ cВ
θ1
+qП
илиl (I2
-I1
) =qД
+ cВ
θ1
-qМ
-qТ
-qП
(
qД
+ cВ
θ1
) - (qМ
+qТ
+qП
) =Δ
Δ=l (I2
-I1
) I2
=I1
+Δ/l
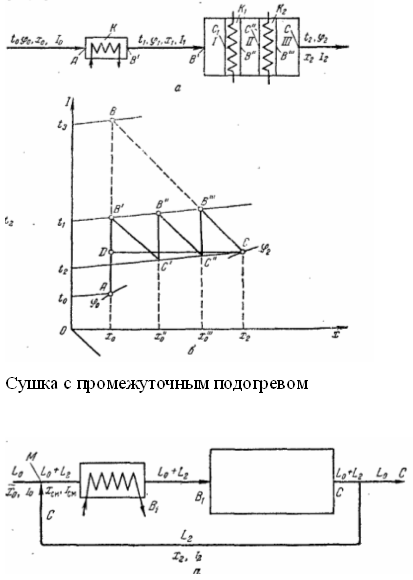
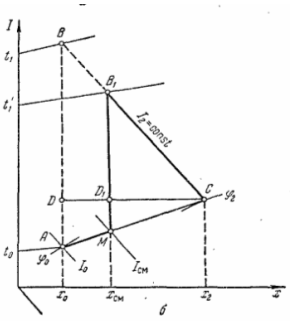
С частичной рециркуляцией
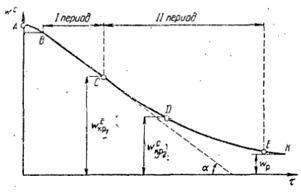
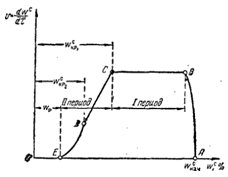
Кинетика сушки характеризуется изменением во времени средней влажности материала, отнесенной к количеству абсолютно сухого материала. Зависимость между влажностью материала от времени - кривая сушки.
AB- период прогрева
BC- период постоянной скорости сушки
C- первая критическая влажность
CDE- период падающей скорости сушки
D-точка перегиба, вторая критическая влажность
K- равновесная влажность
Скорость сушки: v=dwc
/dt, кривая vот t- кривая скорости сушки.
|