Теорія електролітичної дисоціації
Більшість хімічних реакцій, які використовуються у якісному аналізі, протікають у водних розчинах. Якщо речовина розчиняється у воді чи іншому розчиннику, то утворюється однорідний гомогенний розчин. Розчини не можна розглядати як прості механічні суміші. Процес розчинення завжди супроводжується виділенням чи поглинанням теплоти.
Водні розчини деяких речовин є провідниками електричного струму. Ці речовини належать до електролітів. Електролітами є кислоти, солі та луги. Багато речовин виявляють властивості електролітів у розплавленому стані. Електрична провідність розчинів і розплавів електролітів зумовлена наявністю у розчині негативно та позитивно заряджених іонів, які утворюються з молекул або кристалічних речовин. Уявлення про утворення іонів у розчинах електролітів утвердилося в хімії в першій половині XIXст. завдяки працям англійського фізика і хіміка М. Фарадея. Процес розщеплення електролітів на іони у водних
розчинах і розплавах називається електролітичною дисоціацією.
Розчини деяких речовин у воді не проводять електричний струм. Такі речовини називаються неелектролітами. Неелектролітами є багато органічних сполук, наприклад сахари, спирти.
Теорія електролітичної дисоціації для водних розчинів була сформульована шведським ученим С. Арреніусом у 1887 р. Розглянемо основні положення цієї теорії.
1. При розчиненні у воді молекули електролітів дисоціюють (розщеплюються) на позитивно і негативно заряджені іони. Іони можуть бути утворені з одного атома – прості іони ( Na+
, Cl-
) і кількох атомів – складні іони (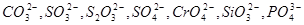 ). ).
2. Дисоціація – оборотний процес. Як правило, він
не відбувається до кінця, а в системі встановлюється динамічна рівновага, тобто такий стан, при якому швидкість дисоціації дорівнює швидкості зворотного процесу - утворення вихідних молекул. Тому у рівняннях дисоціації замість знака „ дорівнює ” ставлять знак оборотності,
наприклад:
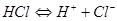
3. Іони у водному розчині перебувають у хаотичному безперервному русі. Якщо у розчин електроліту занурити електроди і прикласти до них електричну напругу, то іони набудуть направленого руху: позитивно заряджені іони переміщуватимуться у напрямі до катода ( негативно зарядженого електрода ), а негативно заряджені іони у напрямку анода ( позитивно зарядженого електрода ). Іони також одержали назви: позитивні іони – аніони, а негативні – катіони.
Реклама

Теорія С. Арреніуса не пояснює причин електролітичної дисоціації, вони були встановлені пізніше.
Розглянемо електролітичну дисоціацію речовин з іонним і полярним ковалентним зв'язком. Припустимо, що у воду помістили кристали хлориду натрію NаСІ – речовини з іонним зв’язком. Полярні молекули води електростатично притягуються позитивно зарядженими кінцями до негативно заряджених іонів С1-
у хлориді натрію, а негативно зарядженими кінцями – до позитивно заряджених іонів Na+
(див. рис. 1 ).

Рис. 1. Схема дисоціації хлориду натрію у водному розчині
Внаслідок такої взаємодії іонів з диполями води послаблюється зв’язок між іонами кристала, і вони переходять у розчин у вигляді гідратованих іонів. Уявлення про гідратацію іонів, тобто про виникнення хімічного зв'язку між іонами і молекулами води, введено російським вченим І. О. Каблуковим і стало розвитком хімічної теорії розчинів.
У неводних розчинниках також можлива електролітична дисоціація з утворенням соль ватованих іонів.
Гідратації зазнають всі іони у водних розчинах, у тому числі й іони водню, які можуть утворювати хімічні зв’язки з однією, двома і більшим числом молекул води. Звичайно гідратовані іони водню зображують формулою Н3
О+
( точніше, Н3
О+
ЧnН2
О, де n = 0...4 ) і називають іоном гідроксонію.
На рис. 2 зображено схему розщеплення молекули хлороводню з полярним ковалентним зв'язком. При взаємодії полярної молекули НС1 з диполями води відбувається розрив зв'язку між атомами водню і хлору, і молекула набуває іонної структури. Потім молекула із іонним зв’язком розщеплюється на окремі гідратовані іони.

Рис. 2 Схема дисоціації молекули хлороводню у водному розчині
Для кількісної характеристики електролітичної дисоціації введено поняття ступінь дисоціації,який дорівнює відношенню кількості речовини електроліту, що розщепився на іони, до загальної кількості речовини цього електроліту, введеного в розчин:
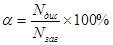
Ступінь дисоціації– безрозмірнавеличина, його виражають у частках одиниці або в процентах. При повній дисоціації електроліту на іони ω= 1, або 100 %.
Для неелектролітів, які не дисоціюють на іони, ω = 0.
Ступінь дисоціації залежить від концентрації електроліту і температури. З теорії електролітичної дисоціації випливає, що чим менша концентрація електроліту в розчині, тим більший ступінь дисоціації. При безкінечному розбавлянні розчину ступінь дисоціації наближається до 1 (100 %). Наприклад, ступінь дисоціації гідроксиду натрію NаОН залежно від концентрації електроліту змінюється так: для розчину з концентрацією с=1 моль/л ω = 0,73 (18°С), для с = 0,1 моль/л ω =0,84 і для с = 0,01 моль/л ω = 0,95.
Реклама

Залежно від ступеня електролітичної дисоціації всі електроліти поділяють на сильні та слабкі. Такий поділ досить умовний, оскільки ступінь дисоціації залежить від температури розчину, концентрації електроліту, і внаслідок цього може змінюватися у досить широких межах.
Слабкі електроліти – це речовини, які лише частково дисоціюють на іони. Із неорганічних сполук до них належить вода, пероксид водню, деякі неорганічні кислоти, як, наприклад, вугільна Н2
СО3
. Силу електроліта зручно характеризувати за допомогою константи дисоціації:
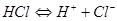
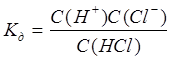
Якщо електроліт дисоціює ступінчато, то константу дисоціації слід записати для кожного ступеня дисоціації. Виходячи із значень константи дисоціації можна визначати та порівнювати силу електролітів, чим менше Кд
тим електроліт слабший і навпаки.
Для слабких електролітів між константою та ступенем дисоціації існує зв’язок, який для розбавлених розчинів можна виразити формулою:
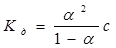 , ,
де с – молярна концентрація електроліту.
Сильні електроліти практично повністю дисоційовані на іони. До них відносять майже всі неорганічні кислоти ( сульфатна, нітратна, хлоридна ) та їх розчинні солі, луги.
Електростатична взаємодія із утворенням іонних пар зменшує реальну концентрацію іонів у розчині, а отже ступінь дисоціації електроліту менший за 100 %. Ступінь дисоціації сильного електроліту. Який визначають експериментально називають уявним ступенем дисоціації.
Тому замість концентрації використовують активність. Активність – це ефективна концентрація іонізованої частини електроліту в розчині, визначена із врахуванням взаємодії іонів: 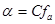 , де , де 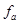 - це коефіцієнт активності речовини, який враховує сили взаємодії іонів, значення, якого завжди менше або дорівнює одиниці. - це коефіцієнт активності речовини, який враховує сили взаємодії іонів, значення, якого завжди менше або дорівнює одиниці.
П. Дебай та Г. Гюккель встановили, що в розведених розчинах сильних електролітів логарифм коефіцієнта активності пропорційний кореню квадратному із його іонної сили: 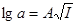 , де А – це стала, яка залежить від зарядів іонів, температури та діелектричної проникності розчинів. Поняття про іонну силу розчину ввели Г. Люїс та Рендель. Згідно із законом іонної сили коефіцієнт активності в розбавлених розчинах залежить не від природи електроліту, а тільки від величини іонної сили розчину. У різних електролітів із однаковими значеннями іонної сили коефіцієнти активності будуть однакові. , де А – це стала, яка залежить від зарядів іонів, температури та діелектричної проникності розчинів. Поняття про іонну силу розчину ввели Г. Люїс та Рендель. Згідно із законом іонної сили коефіцієнт активності в розбавлених розчинах залежить не від природи електроліту, а тільки від величини іонної сили розчину. У різних електролітів із однаковими значеннями іонної сили коефіцієнти активності будуть однакові.
Величина іонної сили І визначається як напівсуха добутків концентрацій іонів С на квадрати їх валентностей z:
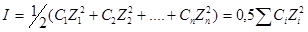
Теорія розчинів електролітів розвивається і у наш час.
В аналітичній хімії більшість хімічних реакцій проводять у розчинах. Для вираження вмісту аналізованої речовини у розчинах використовують поняття концентрації. Концентрація – це величина, яка характеризує вміст речовини у певному об’ємі її розчину. Виділяють моляльну, молярну, нормальну концентрації. Але найчастіше в аналітичній хімії використовують нормальну концентрацію ( нормальність ). Вона показує скільки еквівалентів речовини міститься в 1 л. розчину. Широке використання нормальності пов’язано із використанням її у розрахунках титраметричного аналізу.
Список використаної літератури.
1. Глинка Н. Л. Общая химия. – Л.: Химия, 1988. – 702 с.
2. Гончаров А. І., Корнілов М. Ю. Довідник з хімії. – К.: Вища школа, 1974. – 303 с.
3. Рабинович В. А., Хавин З. Я. Краткий химический справочник. – Л.: Химия, 1978. – 331 с.
4. Хомченко І. Г. Загальна хімія. – К.: Вища школа, 1993. – 420 с.
5. Щукарев С. А. Неорганическая химия. – М.: Высшая школа, 1970. – 437 с.
6. Полеес М. Э. Аналитическая химия. – М.: Медицина, 1981. – 286 с.
7. Крешков А. П., Ярославцев А. А. Курс аналитической химии. – М.: Химия, 1964. – 430 с.
8. Мороз А. С., Ковальова А. Г. Фізична та колоїдна хімія. – Львів : Світ, 1994. – 278 с.
9. Артеменко А. И., Тику нова И. В., Ануфриев Е. К. Практикум по органической химии. – М.: Высшая школа, 1991. – 175 с.
|