МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ХАРКІВСЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ ім. В.Н. Каразіна
Кафедра органічної хімії
КУРСОВА РОБОТА З ТЕМИ:
Перекисне окислення ліпідів
ХАРКІВ 2010
рЕФЕРАТ
Курсова робота містить: 30 сторінок, 5 малюнків, 12 джерел.
Об’єктами дослідження є реакції перекисного окислення ліпідів та антиоксидантні системи захисту живих організмів.
Мета даної роботи – вивчити механізм ланцюгових реакцій перекисного окислення ліпідів в біологічних мембранах, проаналізувати структуру і функції антиоксидантних систем організму, що обмежують небезпеку активації перекисного окислення і протидіють атаці вільних радикалів, а також визначити роль перекисного окислення в такому патологічному стані як променева хвороба.
активні форми кисню, Антиоксидантна система, Біологічні мембрани, вільнорадикальне окислення, глутатіон, дихальний ланцюг, жирні кислоти, Перекисне окислення ліпідів, пероксид водню, променеве ураження, убіхінон, ферменти
перелік умовних скорочень та позначень
| АО- |
- антиоксидантний |
| АОС |
- антиоксидантна система |
| АК |
- аскорбінова кислота |
| АТФ |
- аденозинтрифосфат |
| АФК |
- активні форми кисню |
| Гл-3-Ф |
- гліцерол-3-фосфат |
| β-ГО-ацил-КоА |
- β-гідроксіацил-КоА |
| ГПО |
- глутатіонпероксидаза |
| ГР |
- глутатіонредуктаза |
| ГТ |
- глутатіонтрансфераза |
| Г-SH |
- глутатіон відновлений |
| ГS-SГ |
- глутатіон окислений |
| ДАК |
- дегідроаскорбінова кислота |
| ЖК |
- жирні кислоти |
| α-КГ |
- α-кетоглутарат |
| КоQ |
- коензим Q (убіхінон) |
| НАД+
|
- нікотинамідаденіндинуклеотид |
| НАДН |
- нікотинамідаденіндинуклеотид відновлений |
| НАДФ+
|
- нікотинамідаденіндинуклеотидфосфат |
| НАДФН |
- нікотинамідаденіндинуклеотидфосфат відновлений |
| ПО |
- перекисне окислення |
| ПОЛ |
- перекисне окислення ліпідів |
| СОД |
- супероксиддісмутаза |
| ФАД |
- флавінаденіндинуклеотид |
| ФМН |
- флавінмононуклеотид |
| ФП |
- флавопротеїн |
| ЦХО |
- цитохромоксидаза |
В
ступ
Вивчення перекисного окислення ліпідів почалося з появи теорії вільнорадикального ланцюгового окислення ненасичених жирних кислот у клітині. На зміну їй прийшла теорія розгалужених ланцюгових реакцій, а в 50-60-ті роки минулого сторіччя основною стала гіпотеза про те, що різноманітні шкідливі впливи на живу клітину виявляються пероксидацією ліпідів мембран. Подальші дослідження процесів пероксидації засвідчили, що в організмі діє ланцюг взаємопов'язаних вільнорадикальних реакцій, швидкість яких підтримується на оптимальному рівні за допомогою складних і різноманітних механізмів регуляції. Процеси перекисного окислення, які потрібні для нормального функціонування біохімічних і фізіологічних систем, у нормі невпинно перебігають у всіх клітинах живих організмів і є одним із типів нормальних метаболічних процесів, таких як синтез деяких гормонів, медіаторів, ейкозаноїдів, нуклеїнових кислот, окиснювальне фосфорилювання, іонний транспорт, клітинний поділ.
У процесі розвитку деяких патологічних процесів різко підвищується інтенсивність ліпопероксидації, що робить її універсальним механізмом пошкодження клітинних мембран. Продукти перекисного окислення мембранотоксичні, вони деформують мембрани клітин, порушують їх осмотичну резистентність і електричний потенціал, окислюють тіолові сполуки і SH-групи білків мембран, розривають нуклеїнові кислоти, денатурують білки, пошкоджують амінокислоти, сприяють деградації макромолекул сполучної тканини.
Реклама

До числа «вільнорадикальних патологій» може бути віднесена променева хвороба, що виникає внаслідок дії на організм іонізуючої радіації. Події квітня 1986 р. продемонстрували всьому світові реальність та небезпеку для живих організмів променевого впливу, що спричиняє посилення процесів перекисного окислення в організмі і супроводжується ураженням життєво важливих клітинних структур.
Таким чином, актуальність досліджень реакції перекисного окислення ліпідів обумовлена важливої патогенетичною роллю вільнорадикального окислення як потужного фактора мембранодеструкції, а значить більшості патологічних процесів. Окрім того, вивчення механізмів функціонування системи антиоксидантного захисту надає можливості регулювати перекисне окислення шляхом адекватної антиоксидантної терапії.
1.літературний огляд
1.1 Молекулярна організація ланцюга біологічного окислення
Внутрішньомолекулярне окислення біологічних субстратів (біологічне окислення)
є основним молекулярним механізмом, за рахунок якого забезпечуються енергетичні потреби функціонування живих організмів.
У процесі розщеплення поживних речовин від субстратів шляхом окислення відщеплюються протони й електрони. Вони надходять на коферменти ферментів дегідрогеназ, які локалізовані у внутрішній мембрані мітохондрій і утворюють дихальний ланцюг -
сукупність молекулярних компонентів (ферментів, коферментів, додаткових електроно-транспортних білків), що здійснюють дегідрування органічних субстратів та послідовний перенос відновлювальних еквівалентів (протонів та електронів) на кисень через ряд проміжних переносників - транспортерів протонів та електронів (мал. 1); звільнена при переносі електронів по дихальному ланцюгу енергія запасається в пірофосфатних зв'язках АТФ. Реакції дихального ланцюга каталізують головним чином три групи окислювально-відновних ферментів: 1) піридинзалежні дегідрогенази; 2) флавін-залежні дегідрогенази; 3) цитохроми [1].
Перший етап тканинного дихання починається з дегідрування, тобто відщеплення атомів водню від відповідного субстрату. Цей процес здійснюється так званими піридинзалежними (для одних субстратів) та флавінзалежними (для інших субстратів) дегідрогеназами.
Реклама

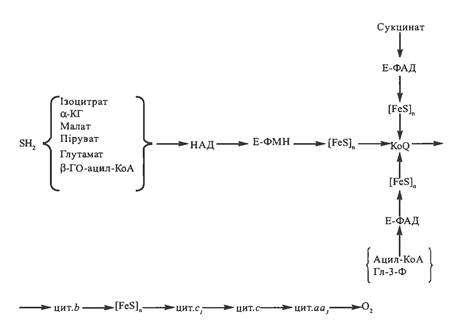
Мал. 1 - Схема організації дихального ланцюга мітохондрій [2]. Позначення: α-КГ - α-кетоглутарат; β-ГО-ацил-КоА - β-гідроксіацил-КоА; Гл-З-Ф - гліцерол-3-фосфат
У піридинзалежних дегідрогеназ
структура небілкового компонента містить похідне піридину - нікотинамід. Тому їх ще називають нікотинамідними дегідрогеназами. Ці дегідрогенази містять такі коферменти:
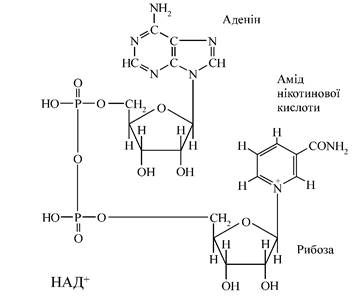
- нікотинамідаденіндинуклеотид (НАД+
). Він побудований із двох нуклеотидів: аденілової кислоти і другого нуклеотиду, в якого місце пуринової чи піримідинової основи займає нікотинамід (вітамін РР). Ці нуклеотиди з'єднані через залишки фосфатів (мал. 2):
Мал. 2
- нікотинамідаденіндинуклеотидфосфат – (НАДФ+
). Це НАД+
, у якого в 2′-положенні рибози аденілової кислоти є додаткова фосфатна група (мал. 3):
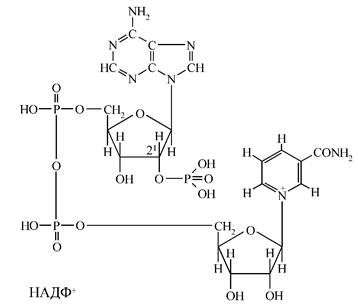
Мал. 3
У піридинзалежних дегідрогеназ коферменти НАД+
або НАДФ+
неміцно зв'язані з апоферментом і тому можуть у клітині знаходитися окремо від білкової частини ферменту, виконуючи функцію переносників атомів водню (протонів і електронів).
Флавінзалежні дегідрогенази
- це складні протеїни, що містять як простетичну групу один із двох похідних вітаміну В2
- флавінмононуклеотид (ФМН) або флавінаденіндинуклеотид (ФАД). Одні з них виконують функцію первинного дегідрування певних субстратів - вони здатні відщеплювати і приймати водень від субстратів; при цьому виключається дія піридинзалежних дегідрогеназ. Інші - оксидази - одразу передають одержані при дегідруванні атоми водню від субстратів на молекулярний кисень з утворенням перекису водню. Флавінові ферменти, які є проміжними переносниками водню від НАДH+H+
, що утворюються на першому етапі дихального ланцюга, на сполуки наступного етапу дихального ланцюга (убіхінон). Вони одержали назви НАДН2
-дегідрогеназ або флавопротеїнів-1 (ФП1
). Ці флавопротеїни представлені складними олігомерними білковими сполуками, які містять у своєму складі простетичну групу флавінового похідного, атоми металів, частіше за все у формі білків із залізосірчаними центрами (Fe-S-білки) (мал. 4).
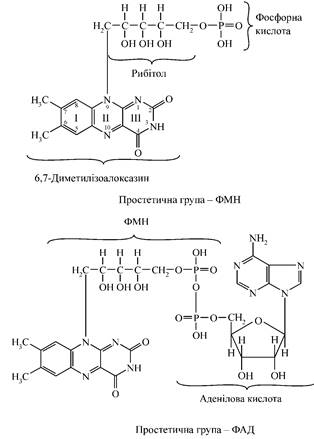
Мал. 4
Другий етап полягає в переносі по дихальному ланцюгу двох атомів водню від відновленої форми НАДH+H+
на флавопротеїни - проміжні переносники атомів водню. Загальну реакцію другого етапу біологічного окислення можна зобразити так (мал. 5):

Мал. 5
Третій етап - перенесення електронів і протонів від відновлених флавопротеїнів на убіхінон, який ще називають коферментом Q (КоQ). Убіхінон - це ліпорозчинний хінон, який містить довгий бічний ненасичений ланцюг (за хімічною структурою убіхінон є 2,3-диметокси-5-метил-1,4-бензохіноном з ізопреноїдним ланцюгом R у 6-му положенні) (мал. 6):
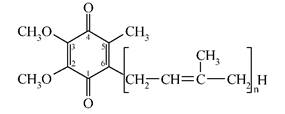
Мал. 6
Основна коферментна роль убіхінону полягає в тому, що, розчиняючись у ліпідах гідрофобної частини мембран мітохондрій, він здійснює перенос електронів і протонів, дифундуючи від внутрішньої до зовнішньої поверхні внутрішньої мембрани. Загальну реакцію третього етапу можна зобразити так (мал. 7):
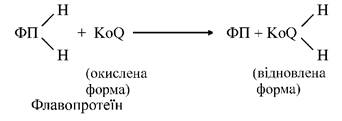
Мал. 7
Потім у дихальному ланцюзі шляхи електронів і протонів розходяться (четвертий етап). Електрони атомів водню від відновленої форми КоQH2
надходять до так званої цитохромної системи, а протони вивільняються у зовнішнє середовище. Цитохромна система складається з ряду ферментів, небілкова частина яких (простетична група) представлена залізопорфиринами, близькими за структурою до гему. Відомо близько 20 різних цитохромів. У процесах тканинного дихання найважливішу роль відіграють цитохроми b, c1, c, a, a3
. Цитохроми відрізняються один від одного будовою білкової частини, природою бічних ланцюгів порфіринів та способом приєднання гему до білків.
Ланка цитохромів розташовується між КоQH2
й киснем; при цьому в дихальний ланцюг цитохроми включаються в певній послідовності, залежно від окислювально-відновного потенціалу, переважно в такому порядку: b, c1, c, a, a3
. Комплекс цитохромів b
і c1
здійснює перенос електронів від атомів водню відновленого КоQH2
на цитохром с; протони при цьому звільнюються в міжмембранний простір. Цитохром c являє собою залізовмісний білок із невеликою молекулярною масою (~12000), який складається з одного поліпептидного ланцюга й порфіринової групи з атомом заліза. Аналогічно убіхінону цитохром с
- рухомий переносник електронів між цитохромами b
і комплексом цитохромів a
й a3
. Комплекс цитохромів aa3
діє як цитохромоксидаза (ЦХО), яка окрім гему містить іони міді, які теж беруть участь у переносі електронів, змінюючи валентність:
Cu2+
+ e → Cu+
Cu+
- e → Cu2+
П'ятий етап зв'язаний з передачею електронів від цитохромоксидази на молекулярний кисень. Електрони послідовно приєднуються до іонів заліза цитохромів aa3
, потім - до іона міді і, нарешті, потрапляють на кисень. У результаті утворюється активний іонізований кисень (O2-
), який, реагуючи згодом із двома протонами водню з матриксу, утворює воду.
Напрямок переносу протонів і електронів визначає окислювально-відновний потенціал. Кожен компонент дихального ланцюга у внутрішній мембрані мітохондрій вбудований між своїм відновником і окисником і може віддавати свій водень або свої електрони іншому компоненту, який має більш високий потенціал. Ця послідовність виглядає так (мал. 8):
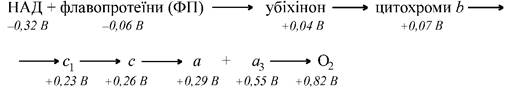
Мал. 8
При переході від одного переносника до іншого електрон поступово, невеликими порціями втрачає потенціал. Падіння потенціалу пов'язане зі зміною вільної енергії. У міру зменшення потенціалу вільна енергія, що виділилася, трансформується в хімічну форму, зручну для використання клітиною.
1.2 Вільнорадикальне окислення в біологічних мембранах
Активні форми кисню – ініціатори перекисного окислення ліпідів
Для клітини дуже важливо, щоб молекула кисню, приєднавши чотири електрони, повністю відновлювалась до двох молекул води. У результаті переносу першого електрону до молекули О2
утворюється супероксидний іон-радикал  . На наступному етапі перенос другого електрону і двох протонів призводить до утворення пероксиду водню Н2
О2
внаслідок розриву одного з двох зв’язків між атомами у молекулі кисню. Нарешті, при розриві другого зв’язку між атомами кисню та акцепції третього електрону утворюється гідроксильний радикал ·
ОН, а приєднання четвертого електрону закінчує процес відновлення молекули кисню утворенням двох молекул води. Нестійкі продукти, що виникають у ході цього універсального процесу, . На наступному етапі перенос другого електрону і двох протонів призводить до утворення пероксиду водню Н2
О2
внаслідок розриву одного з двох зв’язків між атомами у молекулі кисню. Нарешті, при розриві другого зв’язку між атомами кисню та акцепції третього електрону утворюється гідроксильний радикал ·
ОН, а приєднання четвертого електрону закінчує процес відновлення молекули кисню утворенням двох молекул води. Нестійкі продукти, що виникають у ході цього універсального процесу,  , Н2
О2
,·
ОН [3]– активні форми кисню (АФК) – через можливий «витік» з системи транспорту електронів, можуть грати роль ініціаторів процесу не ферментативного пер оксидного окислення (ПО), особливо при прискоренні процесу окислювального фосфорилювання. , Н2
О2
,·
ОН [3]– активні форми кисню (АФК) – через можливий «витік» з системи транспорту електронів, можуть грати роль ініціаторів процесу не ферментативного пер оксидного окислення (ПО), особливо при прискоренні процесу окислювального фосфорилювання.
У відсутності вільно радикального ініціатора процес не йде. Зокрема, присутність в органічному субстраті, що легко окислюється, речовин-перехоплювачів, інактиваторів радикалів, запобігає виникненню і розвитку в ньому окислювальних неферментативних реакцій. Однак радикали виступають не тільки в ролі ініціаторів ПО. При взаємодії радикалу з молекулою органічної сполуки утворюється новий радикал і нова молекула. Таким чином, ПО протікає як ланцюговий процес. Кінетика ПО органічних сполук відповідає механізму розгалужених (у кожному циклі реакції замість одного радикалу виникає три нових; кількість активних продуктів збільшується лавиноподібно) і вироджено-розгалуджених (кількість активних продуктів повільно збільшується за рахунок періодичного розпаду молекули, що утворюється, на два радикали) радикальних реакцій.
Радикали-ініціатори реакцій ПО можуть виникати під впливом квантів випромінювання - іонізуючого, УФ і навіть видимого, що падає ззовні або виникає усередині органічного субстрату (за рахунок вмісту в ньому природних радіонуклідів). В ролі ініціаторів ПО можуть виступати радикали, що утворюються під час функціонування електронно-транспортних ланцюгів, при взаємодії іонів заліза з киснем (Fe2+
+ О2-
® Fe3+
+  ® Н ® Н ) і т.п. [4]. Практично в клітинах будь-якого організму в кожний момент його життєдіяльності присутні радикали різної структури, здатні взяти на себе роль ініціаторів ПО. ) і т.п. [4]. Практично в клітинах будь-якого організму в кожний момент його життєдіяльності присутні радикали різної структури, здатні взяти на себе роль ініціаторів ПО.
Найбільш ефективно реакції ПО розвиваються в ліпідвмісних структурах (перекисне окислення ліпідів – ПОЛ), насамперед у біологічних мембранах, зокрема, при впливі іонізуючої радіації [5].
Відомо, що структура мембран ускладнює доступ молекулярного кисню в клітину внаслідок сильно вповільненої дифузії його через ліпідний бішар [5, 6], а також у результаті активного функціонування системи регуляції стаціонарного рівня кисню в клітині. Зміст у клітці молекулярного кисню становить усього 10-6
М [3], ще нижче рівень АФК. Саме низький рівень кисню і АФК забезпечує протікання корисних оксидазних біологічних процесів, а також нормальне протікання вільнорадикальних процесів ліпопероксидації в біологічних мембранах.
Вільнорадикальні реакції ПОЛ беруть участь у нормальних метаболічних процесах і регуляції функцій клітини. Так, гальмуючи або, навпаки, прискорюючи ПОЛ можна змінити склад клітинних мембран, їх структурну організацію й функціональну активність клітини.
Механізм перекисного окислення у біологічних мембранах
Ланцюгова реакція ПОЛ протікає в декілька стадій, які одержали назву ініціювання, продовження і обрив ланцюгу (мал. 9).
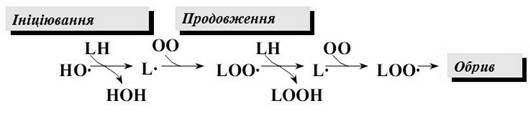
Мал. 9 - Стадії ланцюгової реакції ПОЛ
Ініціювання ланцюгової реакції починається з того, що в ліпідний шар мембран або ліпопротеїнів включається вільний радикал. Частіше за все це гідроксильний радикал ·
ОН. Являючись невеликою за розміром незарядженою частинкою, він здатен проникати в товщу гідрофобного ліпідного шару і вступати в хімічну взаємодію з поліненасиченими ЖК (які прийнято позначати як LH), що входять до складу біологічних мембран і ліпопротеїнів плазми крові. При цьому утворюються ліпідні радикали:
LH + ·
ОН®L·
+ Н2
О (1)
Ліпідний радикал (L·
) вступає в реакцію з розчиненим в середовищі молекулярним киснем; при цьому утворюється новий вільний радикал - радикал ліпоперекису (LОО·
):
L·
+ О2
® LОО·
;(2)
Цей радикал атакує одну із сусідніх молекул фосфоліпіду з утворенням гідроперекису ліпіду LOOH і нового радикала L·
:
LОО·
+ LH®LOOH + L·
.(3)
Чергування реакцій (2) і (3) саме й представляє собою ланцюгову реакцію перекісного окиснення ліпідів.
Істотне прискорення пероксидації ліпідів спостерігається в присутності невеликих кількостей іонів двовалентного заліза. В цьому випадку відбувається розгалуження ланцюгів у результаті взаємодії Fe2+
c гідроперекисами ліпідів:
Fe2+
+ LOOH → Fe3+
+ HO–
+ LО·
.(4)
Радикали LО·
ініціюють нові ланцюги окиснення ліпідів (мал. 10):
LО·
+ LH → LOH + L·
;(5)
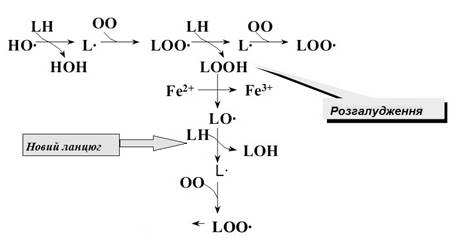
Мал. 10 - Розгалужена ланцюгова реакція окислення ліпідів
У біологічних мембранах ланцюги можуть складатися з десятка й більш ланок. Але в кінці кінців ланцюг обривається в результаті взаємодії вільних радикалів з антиоксидантами , іонами металів змінної валентності (наприклад, тими ж Fe2+
) або один з одним:
LОО·
+ Fe2+
+ H+
→ LOOH;(6)
LOO·
+ HIn
® LOOH + In
·
;(7)
LOO·
+ LOO·
→ молекулярні продукти(8)
Остання реакція особливо цікава, оскільки вона супроводжується світінням (хемілюмінесценцією). Інтенсивність "надслабкого" світіння однозначно відбиває швидкість ліпідної пероксидації в досліджуваному біологічному матеріалі, і вимір хемілюмінесценції досить часто використовується при вивченні перекисного окислення ліпідів у різних об'єктах [3].
Якщо частота обривів ланцюгу переважає над частотою розгалужень, процес ПО припиняється. При зворотнім співвідношенні цих реакцій швидкість ПО поступово зростає в міру збільшення кількості активних продуктів і залучення в процес зростаючої кількості молекул субстрату. Звідси одна з найважливіших особливостей ПО - і під час відсутності специфічних каталізаторів (ферментів) процес розвивається, самоприскорюючись, аутокаталітично за наявності сприятливих умов: температури, вільного доступу молекулярного кисню й достатньої кількості радикалів-ініціаторів [3].
Таким чином, продуктами пероксидного окислення ненасичених ЖК можуть бути альдегіди, кетони, диальдегіди, епоксиди тощо, наприклад (мал. 11):
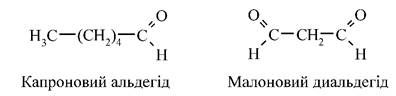
Мал. 11
1.3 Фізіологічна антиоксидантна система
1.3.1 Антиоксидантні ферменти клітини
До числа АО-ферментів відносяться супероксиддисмутаза (СОД), що інактивує супероксидний аніон-радикал  ; каталаза, що розкладає пероксид водню Н2
О2
, а також ферменти системи глутатіону (Г-SH): глутатіонпероксидаза (ГПО), що розкладає поряд з Н2
О2
також органічні (ліпідні) перекиси, глутатіонредуктаза (ГР), що відновлює глутатіон, окиснений у ході ферментативних (ГПО) і неферментативних реакцій, і сімейство глутатіонтрансфераз (ГТ), що алкілують глутатіоном різноманітні токсичні метаболіти. Нарешті, до числа АО-ферментів відноситься церулоплазмін - головний АО-фермент крові, а також частково трансферрин. ; каталаза, що розкладає пероксид водню Н2
О2
, а також ферменти системи глутатіону (Г-SH): глутатіонпероксидаза (ГПО), що розкладає поряд з Н2
О2
також органічні (ліпідні) перекиси, глутатіонредуктаза (ГР), що відновлює глутатіон, окиснений у ході ферментативних (ГПО) і неферментативних реакцій, і сімейство глутатіонтрансфераз (ГТ), що алкілують глутатіоном різноманітні токсичні метаболіти. Нарешті, до числа АО-ферментів відноситься церулоплазмін - головний АО-фермент крові, а також частково трансферрин.
Супероксиддісмутаза (СОД)
- каталізує реакцію
 + +  + 2Н+
® О2
+ Н2
О2
.(9) + 2Н+
® О2
+ Н2
О2
.(9)
У результаті реакції утворюється пероксид водню, здатний інактивувати СОД [3]. Тому СОД локалізована й функціонує звичайно в співдружності з каталазою, що швидко й ефективно розкладає Н2
О2
. Активний центр ферменту містить атоми металів зі змінною валентністю. Наприклад, у матриксі мітохондрій присутня й дисмутує радикали  , що «витікають» з електроно-транспортного ланцюга, СОД, яка містить марганець. , що «витікають» з електроно-транспортного ланцюга, СОД, яка містить марганець.
Каталаза
- каталізує реакцію
Н2
О2
+ Н2
О2
® О2
+ 2Н2
О(10)
Реакція протікає у дві стадії: спочатку утворюється комплекс ферменту з однієї, потім - із другою молекулою пероксиду водню. Каталаза здатна реагувати й з іншими донорами водню, у цьому випадку комплекс ферменту з однією молекулою пероксиду реагує із субстратами подібно пероксидазі:
Каталаза
+ Н2
О2
+ RH ® R·
+ 2Н2
О + Каталаза
(11)
Основна функція каталази в клітині - розкладання пероксиду водню, що утворюється при дисмутації супероксидного аніон-радикала [7]. Найбільш висока активність каталази відзначена в гепатоцитах.
Гемоглобін й міоглобін, піддаючись окисній атаці й перетворюючись відповідно в метгемоглобін і метміоглобін, вивільняють при цьому СОД і каталаза, що знаходяться в еритроцитах і м'язах усувають його продукцію [3].
Таким чином, АО-ферменти СОД і каталаза, функціонуючи спільно, у більшості випадків вчасно інактивують АФК -  і Н2
О2
, що утворюються як у процесі нормальної життєдіяльності клітин, так і в умовах значної активації ПОЛ, у тому числі патологічно обумовленої. Однак найбільше ефективно ПОЛ активується в ліпідних (фосфоліпідних) структурах біомембран і супроводжується утворенням ліпідних пероксидів, що слабко усуваються системою СОД - каталаза. і Н2
О2
, що утворюються як у процесі нормальної життєдіяльності клітин, так і в умовах значної активації ПОЛ, у тому числі патологічно обумовленої. Однак найбільше ефективно ПОЛ активується в ліпідних (фосфоліпідних) структурах біомембран і супроводжується утворенням ліпідних пероксидів, що слабко усуваються системою СОД - каталаза.
1.3.2 Система глутатіону
Глутатіонзалежна антиоксидантна система (АОС) включає три глутатіон-залежних ферменти: ГПО, ГР і ГТ. Центральний метаболіт системи - трипептид глутатіон, (Г-SH) - глутамілцистеїнілгліцин [8, 9], що володіє й власної антиоксидантною активністю й функціонує у якості кофактора, донора водню, метаболіту й субстрату з ферментами системи, а також із СОД і каталазою:
З функціональної точки зору в АОС глутатіону можна виділити чотири ланки:
1) забезпечення функціонування системи - ГР;
2) детоксикації пероксидних сполук - ГПО й каталаза;
3) антирадикального захисту - СОД і Г-SH,
4) детоксикації електрофільних сполук - ГТ [9].
Глутатіонредуктаза
(ГР) каталізує реакцію:
2НАД(Ф)Н + ГS-SГ ® 2НАД(Ф) + 2Г-SH(12)
Центральне місце цього ферменту в метаболізмі глутатіону й усієї його системи пов'язане з тим, що він здійснює єдиний відомий механізм відновлення Г-SH з його окисненої форми ГS-SГ Інші ферменти, крім глутатіонсинтетаз, є споживачами відновленого глутатіону [9].
Глутатіонпероксидаза
(ГПО) каталізує реакцію:
2Г-SH + Н2
О2
® ГS-SГ + 2Н2
О (13)
ГПО знешкоджує не тільки Н2
О2
, але й органічні, у тому числі ліпідні пероксиди, що утворюються в організмі при активації ПОЛ.
Глутатіонтрансфераза
(ГТ) каталізує реакції типу:
RX + Г-SH ® НХ + ГS-SГ(14)
З віком активність АО-ферментів крові людей суттєво зростає, досягаючи максимуму у віці 61-65 років, що перевищує рівень у молодих на 25-40 %. Найбільше сильно активується ГПО [3], що можна розглядати як непряме підтвердження вільнорадикальної теорії старіння.
1.3.3 Жиророзчинні антиоксиданти
Слідом за цитохром-с
-оксидазою і АО-ферментами клітини третю лінію АО- захисту утворюють речовини-антиоксиданти, що володіють антирадикальною й антипероксидною активностями й перебувають там, де розташовані субстрати-мішені атаки вільних радикалів і пероксидів, найбільш уразливі для процесу ПОЛ біологічні структури [3]. До таких структур належать насамперед біологічні мембрани, а найбільш адекватними мішенями в них є поліненасичені (полієнові) жирні кислоти - линолева (2), ліноленова (3), арахідонова (4 подвійних зв'язки).
Із числа жиророзчинних АО-мембранопротекторів найважливішу роль відіграє α-токоферол
– вітамін Е
. Молекула токоферолу складається з бензольного ядра з гідроксильною групою, що виконує АО-функцію, і бічного ланцюга молекули, що здійснює взаємодію молекули токоферолу з мембранними структурами [3], зокрема, з вуглеводневим ланцюгом арахідонової кислоти, що підвищує ефективність АО-захисту мембран:
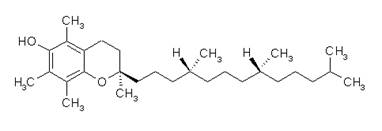
Головна АО-функція токоферолу полягає в тому, що він завдяки наявності в молекулі лабільного атома водню взаємодіє з пероксидними радикалами ліпідів, відновлюючи їх у гідропероксиди і перериваючи, таким чином, ланцюгову реакцію пероксидації [10]:
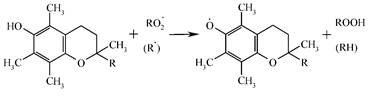
Утворений вільнорадикальний продукт токоферолу є малоактивним і вступає в реакцію рекомбінації з утворенням димерних і тримерних форм α-токоферолу и α-токоферилхінону, які підлягають екскреції. Інакше кажучи, він зупиняє процес утворення перекисів ліпідів у клітинних мембранах, зберігаючи цим їх цілісність і функціональну активність.
Вітамін А (ретинол, ретиналь, ретиноїва кислота)
та його провітаміни β–каротин та інші каротиноїди. Під назвою вітамін А об'єднується група похідних рослинних пігментів - каротинів. З хімічної точки зору ретинол являє собою циклічний ненасичений одноатомний спирт, який складається із шестичленного кільця (β-іонона), двох залишків ізопрену та первинної спиртової групи. Вітамін А2
відрізняється від А1
наявністю додаткового подвійного зв'язку в положенні 3-4 кільця циклогексану. Вітаміни А1
і А2
мають однакову біологічну дію і фізико-хімічні властивості, проте вітамін А2
є менш активним. Основною структурною особливістю, обумовлюючою хімічну і біологічну, зокрема, АО-активність є наявність системі спряжених, одинарних і подвійних зв’язків, що чергуються, між атомами вуглецю:
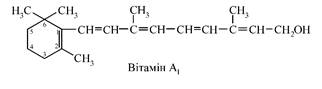
АО-потенціал ретиналя, його здатність до відновлення після світлового імпульсу сприяє захисту фоторецепторів сітківки ока відіграє найважливішу роль у самому сприйнятті зорової інформації. Вітамін А і каротиноїди виступають в якості антиокислювачів не тільки сітківки, вони беруть участь в захисті будь-яких біологічних мембран від пошкодження АФК (зокрема,  , пероксидними радикалами). , пероксидними радикалами).
Коензим
Q
(убіхінон)
– подібно α-токоферолу жиророзчинний і проявляє АО-активність, утворюючи окислювально-відновну буферну систему убіхінол-убіхінон. Молекула убихінону складається з бензохінонової частини (ядра) і бокового ланцюга, що має ізопреноїдну структуру:
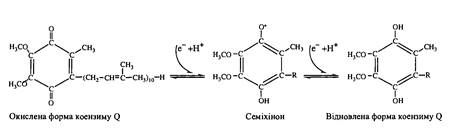
Найважливіша біологічна роль убіхінону пов’язана з участю у мітохондріальному ланцюгу електронного транспорту в якості одного з компонентів і коферменту сукцинат-Q-, НАДН-Q-редуктазних і цитохром с
-Q-оксидазною систем.
1.3.4 Водорозчинні антиоксиданти
Водні середовища організму (кров, лімфа, міжклітинна і внутрішньоклітинна вода) являють собою природну матрицю життєвих процесів, в якій протікають найважливіші метаболічні процеси, циркулює біологічно активні речовини (гормони, медіатори, метаболіти), за допомогою якої транспортуються у клітини поживні речовини і кисень, усуваються вуглекислота і продукти розкладу. Стабільність складу і властивостей біологічних рідин – найважливіша і необхідна умова гомеостазу організму, зокрема гомеостазу окислювального.
Транспорт молекулярного кисню, надходження в рідинні середовища організму його активних форм як резутат інтенсивної життєдіяльності і патологічних процесів в клітинах і тканинах створюють реальну небезпеку окислювального стресу, зміщення гомеостатичної рівноваги у напрямку інтенсифікації окислювальних, деструктивних процесів. Присутність в рідинних середовищах організму ліпідних утворень, що легко окислюються (ліпопротеїдів крові, а також холестерина, тригліцеридів і фосфоліпідів, адсорбованих і тих, що входять до складу мембран клітин крові)збільшує цю небезпеку. Тому існують спеціалізовані АО-системи, відповідальні за стабільність прооксидантно-антиоксидантної рівноваги рідинних середовищ організму. До них відноситься глутатіон та система аскорбінової кислоти. Кожна з цих АО-систем, в свою чергу, являє собою окислювально-відновну буферну систему, що складається з відновленого і окисленого членів, що переходять один в одного в залежності від найтонших коливань параметрів середовища і напрямку метаболічних процесів. В нормальних умовах рівновага всередині кожної з редокс-ситем зміщена в бік відновленого субстрату. Переважання останніх і створює АО-резерв, буферну ємність систем.
Глутатіон
(γ-глутамінілцистеїлгліцин) відіграє ключову роль в захисті клітин і внутрішньоклітинного середовища від реакційно здатних интермедіатів кисню, що утворюються при дії іонізуючої радиації і окислювальному стресі іншої природи. Тому зниження внутрішньоклітинного вмісту глутатіон, обумовлене генетичною недостатність ферментів його синтезу або введенням антагоністів, суттєво знижує стійкість клітин і організмів до променевого ураження та інтоксикації.
Одним з прикладів дефіциту глутатіону і як наслідку гепатотоксичної дії може бути передозування жарознижувального та знеболюючого препарату парацетамолу (ацетамінофенол):
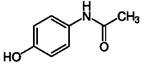
При збільшенні дози парацетамолу збільшується кількість гепатотоксичного метаболіту N-ацетілбензохіноніміну, при цьому виникає нестача глутатіону, щоб зв’язати весь N-ацетілбензохінонімін, тому останній вступає у взаємодію з нуклеофільними групами білків гепатоцитів, що призводить до некрозу печінки [11].
Система аскорбінової кислоти
(АК). При окисленні АК зазнає дегідрування з утворенням дегідроаскорбінової кислоти (ДАК). Перехід здійснюється через проміжну стадію нестійкого інтермедіату – семідегідроаскорбату (аскорбілу). При наступному необоротному окисленні утворюється дикетогулонова кислота. АК метаболічно високоактивна, тоді як аскорбіл-радикал – перший продукт її окислення – відносно інертний і може брати участь в окислювально-відновних реакціях [12]:
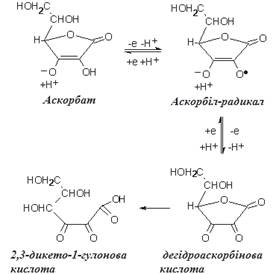
Таким чином, система АК – буферна. Фізиологічне зміщення рівноваги всередині неї в бік відновлених продуктів характеризує її роль як АО-системи наявність певної резервної потужності. Однак в екстремальних ситуаціях, за умов надлишку кисню і прооксидантів резервні можливості системи вичерпуються, вона починає функціонувати в пануючому прооксидантному напрямку.
1.4 Перекисне окислення і променеве ураження
1.4.1 Вільні радикали і пероксиди – продукти взаємодії радіації з речовиною
Кванти і частинки високої енергії при зустрічі з атомами і молекулами речовини поступово віддають ім. свою надлишкову енергію, яка витрачається на підйом одного з електронів на більш високий енергетичний рівень. Підсумок цієї первинної взаємодії іонізуючої радіації з речовиною - ефекти іонізації (електрон, що набув надлишкову енергію, залишає межі атома, у результаті чого виникає пара протилежно заряджених іонів) і збудження (якщо енергії, набута електроном, недостатньо для вибивання його з атома, збуджений електрон на короткий час – 10-7
- 10-12
с – переходить на більш високий енергетичний рівень, а потім стрибком вертається на основний рівень, віддаючи надлишкову енергію у вигляді кванта випромінювання). Обидва процеси - іонізації й збудження - розігруються насамперед у рідких фазах організму, водних і ліпідних, які поглинають більш 80% енергії іонізуючої радіації.
У результаті первинного процесу фізичної взаємодії радіації з речовиною за мільйонні частки секунди утворюється іони й збуджені стани води, а також ліпідів. На наступній, фізико-хімічній стадії процесу, також досить короткочасній, розгортаються первинні реакції радіолізу води (мал. 12):
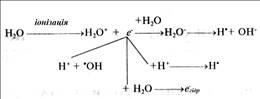
Мал. 12 - Схема первинних реакцій радіолізу води
Таким чином, при нейтральному рН середовища і за умов відсутності кисню в найбільшій кількості утворюються гідратовані електрони й гідроксильні радикали. Останні - потужні окислювачі й реагують із широким колом органічних молекул; завдяки своїй високій активності (час життя - 10-7
с) гідроксильні радикали, утворившись у надлишку поблизу біологічно активних молекул, здатні викликати їхнє ушкодження.
У присутності молекулярного кисню продукти радіолізу води здатні утворювати радикали гідропероксиду Н й супероксидні аніон-радикали й супероксидні аніон-радикали 
егідр
+ О2
+ Н+
→ Н ;(15) ;(15)
егідр
+ О2
→  ;(16) ;(16)
Н•
+ О2
→ Н → →  + Н+
.(17) + Н+
.(17)
До числа найбільш характерних реакцій окисні радикалів з органічними молекулами відносяться реакції утворення гідропероксидів. Вільні окисні радикали ·
ОН, Н , а також егідр
, , а також егідр
,  енергетично здатні окислити органічні речовини навіть за тими зв'язками, які вважаються стійкими у звичайних окисно-відновних реакціях. енергетично здатні окислити органічні речовини навіть за тими зв'язками, які вважаються стійкими у звичайних окисно-відновних реакціях.
Утворення вільних радикалів при впливі іонізуючої радіації відбувається на другій (фізико-хімічній) стадії їх дії також у ліпідних структурах. Це вільні окисні радикали ненасичених жирних кислот, здатні дифундувати на більші відстані й ініціювати процеси ПО в опроміненій клітині.
Третя, хімічна стадія процесу променевого ураження біологічних систем являє собою сукупність вільнорадикальних ланцюгових реакцій, породжених активними продуктами радіолізу води й ліпідів, насамперед радикалами ·
ОН,  й пероксидом водню. Взаємодія цих продуктів з молекулярним киснем у присутності іонів металів збільшує сумарний окисний потенціал і стимулює розвиток процесу ПОЛ. Ці реакції розгортаються як у ліпідних, так і у водних фазах організму, спочатку латентно, а потім, у міру вичерпання антиоксидантних ресурсів клітин, кількість активних продуктів радіолізу зростає й супроводжується ураженням життєво важливих клітинних структур. й пероксидом водню. Взаємодія цих продуктів з молекулярним киснем у присутності іонів металів збільшує сумарний окисний потенціал і стимулює розвиток процесу ПОЛ. Ці реакції розгортаються як у ліпідних, так і у водних фазах організму, спочатку латентно, а потім, у міру вичерпання антиоксидантних ресурсів клітин, кількість активних продуктів радіолізу зростає й супроводжується ураженням життєво важливих клітинних структур.
1.4.2 Радіотоксини
Після завершення дії іонізуючої радіації на живу систему в ній зберігаються прямі пошкодження унікальних структур клітинного ядра і маса активних продуктів радіолізу у ліпідних і водних фазах організму, схильних до аутокаталітичного накоплення і вторинного опосередкованого ураження біологічних мембран. На певній стадії радіаційної післядії саме ці продукти радіоліза, що живуть значно довше, ніж первинні радикали води, є матеріальними носіями, посередниками в реалізації радіобіологічного ефекту, тому вони одержали назву «радіотоксини». Їхній вплив на неопромінені організми, клітини, клітинні структури якісно аналогічний дії радіації.
Таким чином, безпосереднім біологічним ефектом радіаційного впливу є виникнення в опроміненому об’ємі тканин, в його водних і ліпідних фазах маси окисних радикалів, ініціюючих вільнорадикальні реакції ПОЛ, а також активацію стрес-реалізуючих систем, що призводить до ураження унікальних клітинних структур.
В
исновки
У підсумку розгляду комплексу проблем, пов'язаних з розвитком ПОЛ у живих системах, слід констатувати наступні положення.
- У всіх без винятку живих системах існують об'єктивні передумови розвитку неферментативних реакцій вільнорадикального окислення, що полягають у присутності в їхній структурі (насамперед біомембранах) органічних сполук, що легко окислюються та акумулюють у своїх молекулах запас потенційної енергії. Серед органічних молекул найбільш уразливі для реакції ПО полієнові молекули жирних кислот - лінолевої, ліноленової і особливо арахідонової, що входять до складу фосфоліпідів біологічних мембран і ліпопротеїнів крові.
- Присутність вільного кисню в біосфері, його використання в життєдіяльності рослинних і особливо тваринних організмів, присутність у біологічних рідинах робить неминучим постійний контакт кисню з ліпідами мембран.
- Йони металів зі змінною валентністю (Fe2+
, Cu2+
, Co2+
, Мо2+
, Мn2+
і тп.) можуть виступати в ролі факторів розгалуження ланцюгів вільнорадикального окислення й, отже, загального посилення ПОЛ.
- Сукупність перерахованих прооксидантних факторів обумовлює універсальний характер та поширення процесу ПОЛ у всіх живих системах. Більше того, двоїста роль проміжних продуктів ПОЛ, їх здатність виступати також у якості каталізаторів аутоокислення створюють реальну небезпеку розгортання вільнорадикальних ланцюгових реакцій і, як наслідок, повної деструкції мембранних структур, кліток і організмів при доступі кисню. Лише наявність факторів протилежної дії - антиоксидантних систем – утримує процес ПОЛ на стаціонарному рівні, який не перешкоджає нормальній життєдіяльності.
- Будь-яка значна напруга функціонування живої системи, обумовлена впливом незвичайних по силі, тривалості і якості зовнішніх агентів, супроводжується посиленням окисного метаболізму, збільшенням продукції активних форм кисню й активацією процесу ПОЛ, здатної подолати бар'єр антиоксидантного захисту. Таким чином, зовнішні стрес-впливи поряд із внутрішніми передумовами виступають у якості компонентів причинного комплексу, що детермінує розвиток у живих системах хвилі (спалаху) активації ПОЛ. Одним з таким стрес-агентів є іонізуюча радіація, дія якої на організм призводить до порушення унікальної структури біологічних мембран.
Список літератури
1. Біологічна хімія: [Підручник / Л.М. Вороніна, В.Ф. Десенко, Н.М. Мадієвська та ін.]; За ред.. проф.. Л.М. Вороніної. – Х.: Основа; Видавництво УкрФА, 1999.
2. Губський Ю.І. Біологічна хімія. Підручник / Видання 2-е. – Київ-Вінниця: НОВА КНИГА, 2009.
3. Окислительно-антиоксидантный гомеостаз в норме и патологии / Барабой В.А., Сутковой Д.А.; Под общ. ред. Зозули Ю.А. – Киев: Наук. Думка. 1997.
4. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. – М.: Наука, 1972.
5. Журавлев А.И. Развитие идей Б.Н. Тарусова о роли цепных процессов в биологии // Биоантиокислители и регуляция метаболизма в норме и патологи. – М.: Наука, 1982.
6. Гусев М.В., Гохлернер Г.Б. Свободный кислород и эволюция клетки. – М., 1980.
7. Ленинжер А. Основы биохимии. – М.: Мир, 1985. – Т. 1.
8. Кулинский В.И., Колесниченко Л.С. Биологическая роль глютатиона // Успехи соврем. биологии. – 1990. – 110, №1.
9. Косовер Н., Косовер Э. Глутатион-дисульфидная система // Свободные радиаклы в биологии / Под. ред. У. Прайора. – М.: Мир, 1979. – Т. 2. – с. 65-95.
10. Иванов И.И., Тарусов Б.Н. Молекулярные механизмы действия токоферолов в биологических мембранах // Свободнорадикальное окисление липидов в норме и патологии. – М.: Наука, 1976. – с.105-108.
11. Харкевич Д.А. Фармакология: Учебник. – 9-изд., перераб., доп. и испр. – М.: ГЭОТАР-Медиа, 2006.
12. Газдаров А.К., Лошкомоева И.Н. Свободнорадикальное окисление липидов и некоторые пути его регуляции аскорбиновой кислотой // Биофизика. – 1978. – 23, №2.
|