Содержание
Роль катализа в промышленности и экологии.
Определение катализа.
Селективность.
Общие представления о понятии "механизм химической реакции".
Классификация каталитических систем по фазам.
Классификация катализаторов по типам реакций.
Адсорбция.
Основные требования к промышленным катализаторам.
Роль катализа в промышленности и экологии
Основным потребителем катализаторов являются нефтепереработка, нефтехимия, химия и экология.
Маркет катализаторов в год составляет около 700 тысяч тонн. Примерно половина – катализаторы каталитического крекинга. Потребности химической промышленности – около одной трети, экологии – десятая часть.
Если средняя стоимость катализаторов – 4$ за килограмм, а средняя доля в себестоимости – 0,3%, то с помощью катализаторов производят продуктов на сумму не менее 1000 миллиардов $.
Катализ позволяет экономить сырье и энергию, а также не загрязнять окружающую среду.
Определение катализа
Катализ – это ускорение одного или нескольких возможных направлений превращения химических веществ.
Термодинамика дает ответ на вопрос, как далеко может пройти конкретная химическая реакция. Этот ответ не зависит от пути реакции. На вопрос, с какой скоростью будет достигаться это конечное состояние, отвечает кинетика.
Скорость зависит от пути реакции!
Например, смесь 1,5 % бутана с воздухом при бесконечном по времени их контакте при температуре 4500
С превратится в смесь диоксида углерода, воды и остатка воздуха. В присутствии катализатора, состоящего из смеси V, P и O, в течение 2-3 секунд примерно половина бутан окислится в малеиновый ангидрид.
Катализаторы ускоряют один или несколько термодинамически возможных превращений участников реакции, создавая, как правило, новый, энергетически более выгодный путь.
СН3
---СН2
---СН2
--- СН3
+ 3,5 О2
==
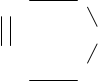 HCC ==O HCC ==O
O
HCC ==O
Новый путь появляется за счет того, что реагенты образуют химические (промежуточные) соединения с катализатором.
Селективность
Если превращения этих соединений протекает через более низкие энергетические барьеры, то каталитический путь может оказаться быстрее, чем некаталитический.
Путь, по которому превращаются или образуются интересующие нас вещества, часто называю механизмом.
Реклама

Что значит «более низкие энергетические барьеры»?
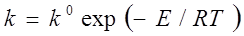
Число соударений молекул газа между собой при атмосферном давлении в 1 см3
в 1 сек из кинетической теории газов равно примерно 1030
.
Число ударов молекул газа при атмосферном давлении об 1 см2
поверхности в 1 сек равно примерно 1023
. Если внешняя поверхность гранул катализатора в 1 см3
равна 100 см2
, то для того, чтобы каталитический путь был более быстрым, необходимо, чтобы Екат
было бы примерно на 60 кДж/моль меньше, чем Енк
.
| Реакция |
Е нк
, кДж/моль |
Е кат
, кДж/моль |
Кат-р |
2HJ ® H2
+ J2
2N2
O ® 2N2
+ O2
|
184
245
|
105
59
121
134
|
Au
Pt
Au
Pt
|
Общие представления о понятии «механизм химической реакции»
Лимитирующая стадия.
Схемы механизма – химическая, физическая и кинетическая.
Физико-химический механизм реакции окисления бутана в малеиновый ангидрид.Микрокинетическая модель паровой конверсии метана.

Классификация каталитических систем по фазам.
| Катализатор |
Реактанты |
| Гомогенная |
газообразный
жидкий
|
газообразные
жидкие
|
| Гетерогенная |
жидкий
твердый
твердый
твердый
твердый
|
газообразные
жидкие
газообразные
жидкие + газообразные
твердые
|
Классификация катализаторов по типам реакций.
| Реакции |
Катализатор |
Металлы
Полупроводниковые оксиды и сульфиды
Изоляторы
Кислоты
|
Гидрирование
Дегидрирование
Гидрогенолиз
Алкилирование
Окисление
Окисление
Дегидрирование
Гидродесульфирование
Дегидрирование
Алкилирование
Гидратация
Крекинг
|
Ni, Cu, Pd, Pt, Fe
Ni, Cu, Pd, Pt
Pd, Pt
Ni, Cu
Cu, Ag
Bi-Mo-O, Fe-Mo-O,
Fe-Sn-O, V-P-O
Cr-O, Fe-Cr-O
Ni-Mo-S, Co-Mo-S
Al-O, Si-O, Mg-O
H2
SO4
H3
PO4
Цеолиты
|
Адсорбция
Роль адсорбции в катализе. Физическая и химическая адсорбции. Их характерные различия и общие черты
· зависимость от природы адсорбента,
· от температуры,
· покрытия поверхности,
· тепловой эффект,
· влияние на электропроводность.
Энергетическая диаграмма при химической адсорбции.
Теплота и термодинамика адсорбции.
Изотермы адсорбции.
Модель идеальной поверхности Ленгмюра.
Вывод изотермы Ленгмюра.
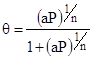
Физический смысл констант.
Вид изотермы при устремлении Р к нулю или бесконечности.
Связь между энергиями активации стадий адсорбции и десорбции и теплотой адсорбции.
Модели биографической и индуцированной неоднороднных поверхностей.
Вывод изотермы Темкина.
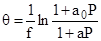
Физический смысл констант.
Вид изотермы при устремлении Р к нулю или бесконечности. Область средних покрытий.
Основные требования к промышленным катализаторам
Химические требования
· термическая стабильность,
· стойкость к отравлению «ядами»,
· легкая регенерируемость,
· высокая избирательность,
· активность при доступных температурах и давлениях.
Механические требования
· прочность,
Реклама

· малое гидравлическое сопротивление,
· однородность,
· оптимальная пористая структура.
|