| ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
Кафедра ХиХТ
КУРСОВОЙ ПРОЕКТ
Задание № _7_
ПО ДИСЦИПЛИНЕ: «Радиохимия»
Тема: «Состояние церия (III) в водных растворах»
| Зав. кафедрой
|
| (дата, подпись)
|
(Ф.И.О.)
|
| Преподаватель
|
| (дата, подпись)
|
(Ф.И.О.)
|
| Выполнил
студент группы
|
1ХТ–46Д
|
| (дата, подпись)
|
(Ф.И.О.)
|
2010 г
ЗАДАНИЕ № 7
НА КУРСОВУЮ РАБОТУ ПО РАДИОХИМИИ
Группа:
Студент:
Тема: Состояние церия (III) в водных растворах
Состав раствора: «Ce (NO3
)3
– Na3
PO4
– Na2
SO4
– KF – H2
O». Интервал рН = 1 – 12.
C(Ce(NO3
)3
) = 10-6
моль/л; С(Na3
PO4
) = 0,01 моль/л; С(Na2
SO4
) = 0,2 моль/л; С(KF) = 0,02 моль/л.
Задание:
1. Литературный обзор
1.1 Семейство лантаноидов, общая характеристика.
1.2. Церий: химические свойства. Комплексообразование в водных растворах.
1.3. Радиоактивные изотопы церия; методы получения, ядерно-физические свойства.
2. Расчетная часть.
2.1. Рассчитать долю и концентрацию форм состояния гидролизующихся лигандов в растворе во всем диапазоне рН; построить распределительную диаграмму для каждого из них.
2.2. Рассчитать долю всех возможных форм церия (III) в растворе данного состава; построить распределительную диаграмму.
2.3. Определить диапазон концентраций Na3
PO4
и рН где будут преобладать фосфатные комплексы.
2.4. Определить, при каких значениях концентраций KF и Na3
PO4
при рН = 3 – 6 в растворе будут преобладать фторидные комплексы.
| График выполнения курсовой работы
|
| Содержание работы
|
Сроки выполнения
|
| 1.
Выполнение разделов работы
|
| 1.1 Обзор литературы
|
20.03.10
|
| 1.2 Выполнение расчетов и построение диаграмм
|
20.04.10
|
| 1.3 Оформление пояснительной записки и компьютерной презентации доклада
|
15.05.10
|
| 2.
Защита курсовой работы
|
15.05 – 25.05
|
Преподаватель
Содержание
1 Литературный обзор……………………………………………………………………………………...4
1.1 Семейство лантаноидов, характеристика………………………………………………………………4
1.2 Церий. Химические свойства, комплексообразование………………………………………………..5
1.3 Изотопы церия, свойства………………………………………………………………………………...7
2 Расчетная часть …………………………………………………………………………………………..9
2.1 Расчет доли и концентрации гидролизующийся лигандов……………………………………………9
Реклама

2.2 Расчет доли форм церия (III)…………………………………………………………………………..13
2.3 Определение диапазона концентраций Na3
PO4
и рН, где будут преобладать фосфатные комплексы……………………………………………………………………………………………….15
2.4 Определение значений концентраций KF и Na3
PO4
при рН = 3 – 6 в растворе будут преобладать фторидные комплексы………………………………………………………………………………….16
Вывод………………………………………………………………………………………………………...17
Список литературы………………………………………………………………………………………….18
1.
Литературный обзор
1.1
Семейство лантаноидов, общая характеристика
.
Лантаноиды
— семейство из 14 химических элементов с порядковыми номерами 58—71, расположенных в VI периоде системы Менделеева за лантаном и сходных с ним по свойствам. Располагаются в отдельном ряду внизу Периодической системы химических элементов Д. И. Менделеева (в краткой и полудлиной формах таблицы). В атоме лантаноидов заполняется глубоко лежащий четвертый слой 4f14
. Поэтому лантаноидов может быть только 14. Поскольку по мере увеличения заряда ядра структура двух внешних электронных оболочек не меняется, все лантаноиды имеют сходные химические свойства.
Лантаноиды включают в себя: церий, празеодим, неодим, прометий, самарий, европий, гадолиний, тербий, диспрозий, гольмий, эрбий, тулий, иттербий, лютеций. Вместе с лантаном, скандием и иттрием входят в состав редкоземельных элементов. Лантаноиды условно разделяются на 2 подгруппы: цериевую, включающую элементы от церия до европия, и иттриевую, включающую элементы от гадолиния до лютеция. [1]
Все лантаноиды и лантан — металлы серебристо-белого цвета, в порошковом состоянии – от серого до черного. Пластичны, легко поддаются ковке, прокатке. Имеют твердость порядка 20-30 единиц по Бренелю. Всем им присущ полиморфизм. Лантаноиды химически активны, они образуют прочные оксиды, галогениды, сульфиды, реагируют с водородом, углеродом, азотом, фосфором. Разлагают воду, растворяются в соляной, серной и азотной кислотах. В плавиковой и фосфорной кислотах лантаноиды устойчивы, так как покрываются защитными пленками малорастворимых солей. [2]
С рядом органических соединений лантаноиды образуют комплексные соединения. Важное значение для разделения лантаноидов имеют комплексы с лимонной и этилендиаминтетрауксусной кислотой. В промышленности лантаноиды и лантан получают восстановлением соответствующих галогенидов чистым кальцием или электролизом расплавов. Лантаноиды и лантан применяют как добавки к сталям, чугунам и другим сплавам для улучшения механической стойкости, коррозионной устойчивости и жаропрочности. Используют лантаноиды и лантан для получения специальных сортов стекла, в атомной технике. Соединения лантан, а также лантаноидов используют для изготовления лаков и красок, светящихся составов, в производстве кожи, в текстильной промышленности, в радиоэлектронике для изготовления катодов. Соединения лантаноидов применяются в лазерах. [1]
Реклама

Валентные состояния.
Конфигурация валентных электронов атомов лантаноидов может быть выражена общей формулой 4f2-14
5d0-1
6s2
. У них достраивается третий снаружи энергетический уровень (4f – подуровень) при одинаковом количестве электронов наружного энергетического уровня (6s2
) и у большинства лантаноидов предвнешнего (5s2
5p6
) энергетического уровня. По правилу Хунда у элементов подгруппы церия 4f орбитали заполняются по одному электрону, а те же орбитали у элементов подгруппы тербия – по второму электрону.
4f
– электроны сильно экранированы электронами подуровней 5s
и 5p
, менее подвержены действию соседних атомов и молекул. Более устойчивое трехвалентное состояние лантана, гадолиния, и лютеция среди других РЗЭ объясняется особенностью структуры их атомов. Некоторые лантаноиды кроме валентности III, проявляют так же валентность IV среди таких элементов Ce, Pr, Tb. Валентность II – Sm, Eu, Yb. Эти аномальные валентности объясняются различием энергетических состояний на подуровне 4f
.
[2]
Причём, одни степени окисления характерны при одних условиях, другие – при других. Так, например, в щелочной среде устойчив ион Cе4+
, а в кислой среде – Се3+
. Эти состояния окисления связывают с образованием наиболее устойчивых электронных конфигураций 4f0
, 4f7
, 4f14
. Так, Ce и Tb приобретают конфигурации 4f0
и 4f7
, переходя в состояние окисления +4, тогда как Eu и Yb имеют соответственно конфигурации – 4f7
и 4f14
в состоянии окисления +2. Однако существование Pr (IV), Sm (II), Dy (IV) и Tm (II) свидетельствует об относительности критерия особой устойчивости электронных конфигураций 4f0
, 4f7
и 4f14
.
Лантаноидное сжатие.
Причина этого явления – экранирование одного электрона другим в той же оболочке. Лантаноидное сжатие следует квалифицировать как f
– сжатие. Оно есть следствие заполнения 4f
– подуровня. Он расположен ближе к ядру, нежели d
– подуровень, а его экранизирующие действие настолько велико, что влияние возрастающего заряда ядра сильно затормаживается. [2]
1.2. Церий: химические свойства. Комплексообразование в водных растворах.
Церий (Се), химический элемент III группы периодической системы. Относится к редкоземельным элементам (цериевая подгруппа лантаноидов), атомный номер 58, атомная масса 140,12. В природе 4 стабильных нуклида: 136
Се (0,19%), 138
Се (0,25%), 140
Се (88,48%), 142
Се (11,08%). Поперечное сечение захвата тепловых нейтронов 0,6 x 10-28
м2
. Конфигурация внешних электронных оболочек атома 4f2
5s2
5p6
6s2
;степени окисления +3, реже +4. [3,4]
Церий – весьма реакционно-способный металл, на воздухе он окисляется за несколько суток, образуя серый рассыпающийся порошок, состоящий из гидратированных карбонатов. При нагревании на воздухе в виде монолитного блока церий загорается при 160–180° С, мелкодисперсный металлический порошок вспыхивает на воздухе в результате энергичного окисления. Церий разлагает воду при кипячении, растворим в минеральных кислотах, устойчив к действию щелочей. Бурно взаимодействует с галогенами, азотом и углеродом. Наиболее характерны для церия степени окисления Се(III) и Ce(IV). Ионы Се(III), бесцветные в водных растворах, в щелочной среде в присутствии окислителей легко переходят в ионы Ce(IV), имеющие желтую окраску. Это свойство церия позволило обнаружить неизвестный ранее тип реакций, названных колебательными. [4]
Соединения церия.
Диоксид СеО2
, светло-желтый порошок, температура плавления 2400° С. При растворении СеО2
в концентрированной HNO3
в присутствии NH4
NO3
образуется легко кристаллизующаяся комплексная соль (NH4
)2
[Ce(NO3
)6
], растворимая в большинстве органических растворителей, при 180° С разлагается. Диоксид церия, взаимодействуя с Н2
при температуре выше 800° С, частично восстанавливается, образуя смесь оксидов, содержащих ионы Се(III) и Ce(IV). [2]
Тетрафторид CeF4
, бесцветный кристаллический порошок, получают при обработке металлического Се или СеО2
фтором при температуре 200–250° С. CeF4
при взаимодействии с водой гидролизуется; при температуре выше 700° С в вакууме сублимирует без разложения.
Трифторид CeF3
бесцветный кристаллический порошок, получают взаимодействием СеО2
с HF при 500° С, или термическим разложением CeF4
·7H2
O - при 390–400° С. CeF3
реагирует с водой с образованием гидратов. [4]
Свойства соединений церия в (
III
) и (
IV
) валентном состоянии.
Церий в ряду Ce – Lu является наиболее химически активным элементом. Способен взаимодействовать с большинством элементов периодической системы. Далее в ряду активность несколько уменьшается из-за уменьшения радиусов.
4Се + 3O2
200-400°С
→ 2Се2
O3
Се + О2
→ СеО2
2Сe + 3Hal2
→ 2СeHal3
2Сe + 3S → Сe2
S3
4Сe + 3C → Сe4
C3
2Сe + N2
750-1000ْ C
→ 2СeN
Ce3+
— проявляет себя как восстановитель. Ce3+
+ окислитель ® Ce4+
. Например: 3Ce(OH)3
+ KMnO4
+ 2H2
O ® (pН > 7) ® 3Ce(OH)4
+ MnO2
+ KOH.
Ce4+
— окислитель.
Ce4+
+ восстановитель ® Ce3+
. Например: при pH < 7 идет реакция 2Ce(OH)4
+ 8HCl ® Cl2
+ 2CeCl3
+ 7H2
O.
Кислотно-основные свойства Ce4+
.
Основные: Ce(OH)4
+ H2
SO4
® Ce(SO4
)2
+ 2H2
O; 2Ce(OH)3
+ 3H2
SO4
® Ce2
(SO4
)3
+ 3H2
O.
Кислотные: Ce+4
(OH)4
+ NaOH ® Na2
CeO3
+ H2
O.
В кислых растворах гидроксид церия (IV) выступает как сильный окислитель:
2Ce(OH)4
+ 8HCl → 2CeCl3
+ Cl2
↑ + 8H2
O
  2Cl-
-2℮-
→ Cl2
2 1 2Cl-
-2℮-
→ Cl2
2 1
 Ce(OH)4
+ 4H+
+℮-
→ Ce3+
+ 4H2
O 1 2 Ce(OH)4
+ 4H+
+℮-
→ Ce3+
+ 4H2
O 1 2
2Ce(OH)4
+ 2Cl-
+ 8H+
→ 2Ce3+
+ Cl2
+ 8H2
O
Гидратированный ортофосфат церия (IV) получают, действуя фосфорной кислотой на слабокислый раствор сульфата или нитрата Се (IV). При нагревании постепенно обезвоживается:
Се3
(РО4
)4
*nH2
O →1100
C →Ce3
(PO4
)4
*11H2
O →2000
C →
→Ce3
(PO4
)4
*5H2
O →5000
C →Ce3
(PO4
)4
Трудно растворяется в минеральных кислотах, но в присутствии Н2
О2
хорошо растворяется в них за счет перехода в ортофосфат церия (III):
2Се3
(РО4
)4
+3Н2
О2
→ 6CePO4
+ 2H3
PO4
+ 3O2
Это свойство используется для отделения церия от остальных РЗЭ. [2]
Комплексообразование
Наибольшую способность к комплексообразованию проявляет церий, поскольку катион Се4+
обладает большим значением ионного потенциала. При этом высшая степень окисления более стабильна. Для церия с такой степенью известны довольно устойчивые комплексы: [Ce(C2
O4
)3
]2-
и [Ce(NO3
)6
]2-
.
Церий, в отличие от других редкоземельных элементов, в степени окисления +3 способен образовывать комплексы с растворами оксалатов и карбонатов.
Ce(C2
O4
)2
+ (NH4
)C2
O4
® (NH4
)[Ce+4
(C2
O4
)]4-
При растворении СеО2
в концентрированной HNO3
в присутствии NH4
NO3
образуется легко кристаллизующаяся комплексная соль (NH4
)2
[Ce(NO3
)6
], растворимая в большинстве органических растворителей, при 180° С разлагается. [2]
1.3 Радиоактивные изотопы церия; методы получения, ядерно-физические свойства.
Природный церий состоит из смеси четырёх стабильных изотопов: 136
Ce (0,185%), 138
Ce (0,251%), 140
Ce (88,450%) и 142
Ce (11,114%). Два из них (136
Ce и 142
Ce) в принципе могут испытывать двойной бета-распад, однако их радиоактивность не наблюдалась, установлены лишь нижние ограничения на периоды полураспада (3,8×1016
лет и 5,0×1016
лет, соответственно). Известны также 26 радионуклидов церия. Из них наиболее стабильны 144
Ce (период полураспада 284,893 д), 139
Ce (137,640 д) и 141
Ce (32,501 д). Остальные известные радионуклиды церия имеют периоды полураспада менее 4 дней, а большинство из них - менее 10 минут. Известны также 2 изомерных состояния изотопов церия. [5]
Церий-144 (период полураспада 285 суток) является одним из продуктов деления урана-235, в связи с чем нарабатывается в больших количествах в ядерных реакторах. Максимальная энергия излучения бета частиц - 91 кэВ. Применяется в виде двуокиси (плотность около 6,4 г/см³) в производстве радиоизотопных источников тока в качестве источника тепла, его энерговыделение составляет около 12,5 Вт/см³. [1]
Методы определения.
Определение содержания церия 144 в объектах окружающей среды проводят по гамма-, бета излучению на бета-гамма радиометрах или спектрометре. При радиохимическом определении в объектах внешней среды церия 141 и 144 основано на групповом осаждении изотопов редкоземельных элементов с носителем лантаном в виде оксалатов и гидроксидов с последующим разделением.
Радиоактивные изотопы церия получают в ядерном реакторе при делении ядер атомов тяжелых элементов или при ядерных взрывах. Содержание изотопов церия в неразделенной смеси продуктов деления составляют 6 %. [5]
2. Расчетная часть.
Исходные данные
:
Состав раствора: «Ce(NO3
)3
– Na3
PO4
– Na2
SO4
– KF – H2
O»
C(Ce(NO3
)3
) = 10-6
моль/л
С(Na3
PO4
) = 0,01 моль/л
С(Na2
SO4
) = 0,2 моль/л
С(KF) = 0,02 моль/л
рН = 1-12
Основные реакции
1.
Ce(NO3
)3
↔ Ce3+
+ 3 NO3
-
2.
Na3
PO4
↔ 3 Na+
+ PO4
3-
3.
Na2
SO4
↔ 2 Na+
+ SO4
2-
4.
KF ↔ K+
+ F-
2.1. Рассчитать долю и концентрацию форм состояния гидролизующихся лигандов в растворе во всем диапазоне рН; построить распределительную диаграмму для каждого из них.
1.
Серная кислота:
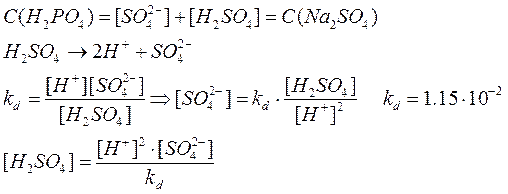
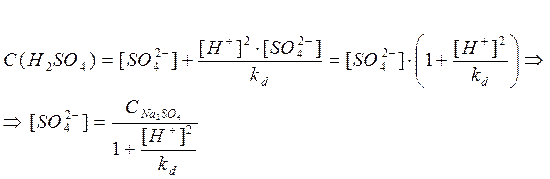
т.к. серная кислота является сильной кислотой, то далее в расчетах примем что: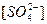 = = 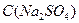 = 0,2 моль/л (по условию). = 0,2 моль/л (по условию).
2. Фосфорная кислота
РО4
3-
+ НОН → НРО4
2-
+ ОН-
НРО4
2-
+ НОН → Н2
РО4
-
+ ОН-
Н2
РО4
-
+ НОН → Н3
РО4
+ ОН-
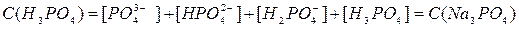
Н3
РО4
→ Н+
+ Н2
РО4
-
k1
d
= 7.6*10-3
Н2
РО4
-
→ Н+
+ НРО4
2-
k2
d
= 6.2*10-8
НРО4
2-
→ Н+
+ РО3
3-
k3
d
= 4,2*10-13
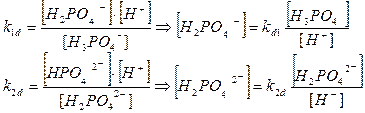
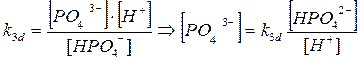
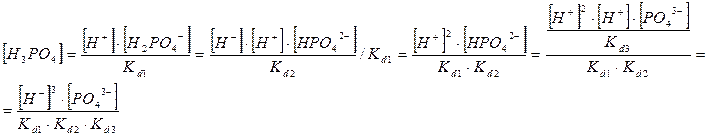
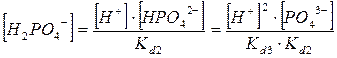
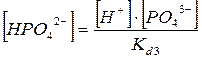
C(Na3
PO4
) = 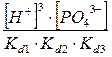 + + 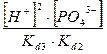 + + 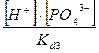 + + 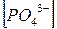
Все члены равенства разделим на [PO4
3-
] и получим:
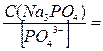 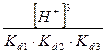 + + 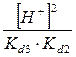 + + 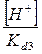 + 1 + 1
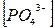 = C(Na3
PO4
) / = C(Na3
PO4
) / 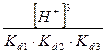 + + 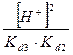 + + 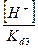 + 1 + 1
Расчет концентраций ионов при рН
= 1
C
(Na
3
PO
4
) = 0,01 моль
/л
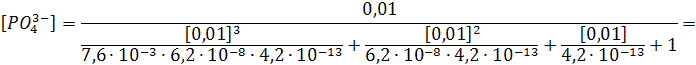
= 1,83 ∙ 10-21
[HPO
4
2-
] = (0,01 · 1,83 · 10-21
) / 4,2 ∙ 10-13
= 4,37 ∙ 10-10
[H
2
PO
4
-
] = (0,012
· 1,83 · 10-21
) / (6,2 · 10-8
· 4,2 · 10-13
) = 0,000706
[H
3
PO
4
] = (0,013
· 1,83 ∙ 10-21
) / (7,6·10-3
·6,2·10-8
·4,2·10-13
) = 0,009293
Табл. 1. Расчет концентрации ионов при C
(Na
3
PO
4
) = 0,01 моль
/л
| рН
|
[PO4
3-
]
|
[HPO4
2-
]
|
[H2
PO4
-
]
|
[H3
PO4
]
|
Проверка
|
| 1
|
1,83926E-21
|
4,37918E-10
|
0,00070632
|
0,00929368
|
0,01
|
| 2
|
1,12445E-18
|
2,67727E-08
|
0,00431817
|
0,005681803
|
0,01
|
| 3
|
2,30108E-16
|
5,47877E-07
|
0,008836725
|
0,001162727
|
0,01
|
| 4
|
2,56861E-14
|
6,11574E-06
|
0,009864094
|
0,000129791
|
0,01
|
| 5
|
2,58457E-12
|
6,15375E-05
|
0,009925403
|
1,30597E-05
|
0,01
|
| 6
|
2,45167E-10
|
0,000583732
|
0,009415029
|
1,23882E-06
|
0,01
|
| 7
|
1,60739E-08
|
0,003827123
|
0,006172779
|
8,12208E-08
|
0,01
|
| 8
|
3,61654E-07
|
0,008610798
|
0,001388838
|
1,82742E-09
|
0,01
|
| 9
|
4,13163E-06
|
0,009837204
|
0,000158665
|
2,08769E-11
|
0,01
|
| 10
|
4,17573E-05
|
0,009942207
|
1,60358E-05
|
2,10998E-13
|
0,01
|
| 11
|
0,000403009
|
0,009595444
|
1,54765E-06
|
2,03638E-15
|
0,01
|
| 12
|
0,002957713
|
0,007042174
|
1,13583E-07
|
1,49452E-17
|
0,01
|
Рассчитаем доли ионов α.
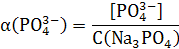
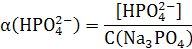
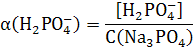
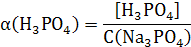
рН
= 1
α(PO
4
3-
) = 1,84 * 10-21
/ 0,01 = 1,83 * 10-19
α(HPO
4
2-
) = 4,37 * 10-10
/ 0,01 = 4,37 * 10-8
α(H
2
PO
4
-
) = 0,0007063 / 0,01 = 0,0706
α(H
3
PO
4
) = 0,0092937 / 0,01 = 0,9294
Табл. 2. Расчет доли ионов α при C
(Na
3
PO
4
) = 0,01 моль
/л
| рН
|
α[PO4 3-]
|
α[HPO4 2-]
|
α[H2PO4 -]
|
α[H3PO4]
|
Проверка
|
| 1
|
1,83926E-19
|
4,37918E-08
|
0,070631967
|
0,929367989
|
1
|
| 2
|
1,12445E-16
|
2,67727E-06
|
0,431817026
|
0,568180297
|
1
|
| 3
|
2,30108E-14
|
5,47877E-05
|
0,883672513
|
0,116272699
|
1
|
| 4
|
2,56861E-12
|
0,000611574
|
0,986409356
|
0,01297907
|
1
|
| 5
|
2,58457E-10
|
0,00615375
|
0,992540276
|
0,001305974
|
1
|
| 6
|
2,45167E-08
|
0,058373181
|
0,941502913
|
0,000123882
|
1
|
| 7
|
1,60739E-06
|
0,382712326
|
0,617277945
|
8,12208E-06
|
1
|
| 8
|
3,61654E-05
|
0,861079811
|
0,138883841
|
1,82742E-07
|
1
|
| 9
|
0,000413163
|
0,983720378
|
0,015866458
|
2,08769E-09
|
1
|
| 10
|
0,004175727
|
0,994220691
|
0,001603582
|
2,10998E-11
|
1
|
| 11
|
0,040300864
|
0,959544371
|
0,000154765
|
2,03638E-13
|
1
|
| 12
|
0,295771288
|
0,704217353
|
1,13583E-05
|
1,49452E-15
|
1
|
Диаграмма 1. Зависимость α (PO
4
3-
, HPO
4
2-
, H
2
PO
4
-
, H
3
PO
4
) от рН
раствора C
(Na
3
PO
4
) = 0,01 моль
/л

3.
Фтороводородная кислота
HF ↔ H+
+ F-

Kd
4
= 6.9∙10-4
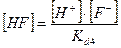
C(KF) = [HF] + [F-
] = 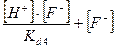 = = 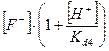
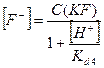
Табл. 3. Расчет концентрации и доли ионов при C
(KF
) = 0,02 моль
/л
| pH
|
[F-]
|
α[F-]
|
| 1
|
0,017222222
|
0,861111111
|
| 2
|
0,01968254
|
0,984126984
|
| 3
|
0,019967794
|
0,998389694
|
| 4
|
0,019996775
|
0,999838736
|
| 5
|
0,019999677
|
0,999983871
|
| 6
|
0,019999968
|
0,999998387
|
| 7
|
0,019999997
|
0,999999839
|
| 8
|
0,02
|
0,999999984
|
| 9
|
0,02
|
0,999999998
|
| 10
|
0,02
|
1
|
| 11
|
0,02
|
1
|
| 12
|
0,02
|
1
|
2.2. Рассчитаем долю всех возможных форм церия (
III
) в растворе данного состава; построить распределительную диаграмму.
1. Ce3+
+ OH-
→ CeOH2+
kd
5
= 4,6
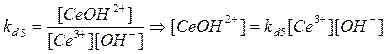
2. Ce3+
+ SO4
2-
→ CeSO4
+
kd
6
= 3,72
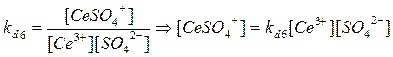
3. Ce3+
+ PO4
3-
→ CePO4
kd
7
= 18,53
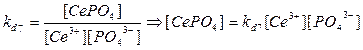
4. Ce3+
+ F-
→ CeF2+
kd
8
= 3,99
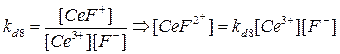
Ce3+
+ 2F-
→ CeF2
+
kd
9
=7,9*106
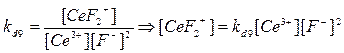
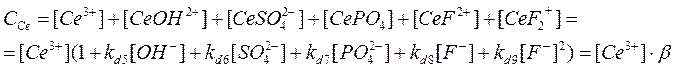
Расчет при
pH
= 1
β(Cm
3+
) = 1+ 39810,71706 * 1 * 10-13
+ 5248,074602 * 0,2 + 3,38 *10+18
* 1,83*10-21
+ +9772,37221* 0,02 + 7943282,347 * (0,02)2
= 3574,939
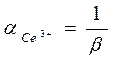
α(Ce
3+
) = 1 / 3574,939 = 0,000279
Рассчитаем доли присутствующих ионов:
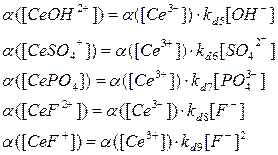
Табл. 4. Расчет α(Ce3+
) и долей образующихся комплексов
| β[Сe3+]
|
α[Сe3+
]
|
α[CeOH2+
]
|
α[CeSO4
+
]
|
α[CePO4
]
|
α[CeF2+
]
|
α[CeF2
+
]
|
| 3574,939889
|
0,000279725
|
1,11361E-12
|
0,293603516
|
1,74331E-06
|
0,047078265
|
0,659036751
|
| 4324,016556
|
0,000231266
|
9,20688E-12
|
0,242740727
|
0,000881157
|
0,044482971
|
0,711663879
|
| 5192,544524
|
0,000192584
|
7,6669E-11
|
0,202138839
|
0,150159252
|
0,037579401
|
0,609929924
|
| 91458,16661
|
1,0934E-05
|
4,35289E-11
|
0,011476448
|
0,951646537
|
0,00213667
|
0,034729411
|
| 8762104,207
|
1,14128E-07
|
4,54351E-12
|
0,00011979
|
0,999495182
|
2,23056E-05
|
0,000362608
|
| 830739690,5
|
1,20375E-09
|
4,7922E-13
|
1,26347E-06
|
0,999994675
|
2,35269E-07
|
3,82467E-06
|
| 54465535151
|
1,83602E-11
|
7,30934E-14
|
1,92712E-08
|
0,999999919
|
3,58846E-09
|
5,83362E-08
|
| 1,22544E+12
|
8,16032E-13
|
3,24868E-14
|
8,5652E-10
|
0,999999996
|
1,59491E-10
|
2,59279E-09
|
| 1,39998E+13
|
7,14297E-14
|
2,84367E-14
|
7,49737E-11
|
1
|
1,39608E-11
|
2,26955E-10
|
| 1,41492E+14
|
7,06753E-15
|
2,81364E-14
|
7,41819E-12
|
1
|
1,38133E-12
|
2,24558E-11
|
| 1,36557E+15
|
7,32294E-16
|
2,91532E-14
|
7,68627E-13
|
1
|
1,43125E-13
|
2,32673E-12
|
| 1,0022E+16
|
9,97801E-17
|
3,97232E-14
|
1,04731E-13
|
1
|
1,95018E-14
|
3,17033E-13
|
Диаграмма 2. Зависимость α(Ce
3+
) и долей образующихся комплексов от рН
раствора

2.3. Определить диапазон концентраций
Na
3
PO
4
и рН где будут преобладать фосфатные комплексы.
В ходе определения концентраций Na
3
PO
4
и интервалов рН
было установлено, что фосфатные комплексы будут преобладать в диапазоне С
Na
3
PO
4
= (0,1*10-12
– 0,1) моль/л. При этом рН
будет варьироваться в широком диапазоне от 3 до 12.
Например: возьмем концентрацию Na
3
PO
4
равную 0,1*10-5
. На графике представленном ниже видно, что комплекс [CePO4
]
преобладать в пределах рН
от 5 до 12.
Диаграмма 3.

2.4. Определить, при каких значениях концентраций
KF
и
Na
3
PO
4
при рН = 3 – 6 в растворе будут преобладать фторидные комплексы.
Определил, что при С
KF
= 0,9 моль/л и при С
Na
3
PO
4
= 0,5*10-4
моль/л в растворе при рН
= 3 – 6 в растворе будет преобладать фторидный комплекс [CeF2
+
], (график данного комплекса показан оранжевым цветом).
Диаграмма 4.

Вывод.
В ходе проделанной работы по теме «состояние церия (III) в водных растворах» было определено следующее:
- доля и концентрация форм состояния гидролизующихся лигандов, построил соответствующую диаграмму;
- определил наличие всех возможных комплексов церия (III) в растворе состава «Ce (NO3
)3
– Na3
PO4
– Na2
SO4
– KF – H2
O», отобразив это на диаграмме.
Так же был определен диапазон концентраций Na3
PO4
и рН где будут преобладать фосфатные комплексы; и при каких значениях концентраций KF и Na3
PO4
при рН = 3 – 6 в растворе преобладают фторидные комплексы.
Список литературы
1. Свободная энциклопедия Википедия http://ru.wikipedia.org/
2. «Химия и технология редких и рассеянных элементов», часть II, под редакцией К. А. Большакова, Москва «Высшая школа» 1978 (стр. 46-86)
3. Дж. Эмсли «Элементы», Москва «Мир» 1993г.
4. Розен Б.Я. «Редкие элементы и их применение» М., «Знание», 1964
5. Вредные химические вещества. Радиоактивные вещества: Справ. изд. / Под ред. В.А. Филова и др. Л.: Химия , 1990.
Для поиска необходимых в расчетах констант пользовался справочником по аналитической химии Ю.Ю.Лурье.
|