Теория образования оксидов азота при горении.
Условия образования оксидов при горении до сих пор не разработаны в достаточной мере и требуют глубокой проработки весьма сложной химической кинетики процесса в сочетании с детальным изучением тепломассообмена и его влияния на кинетику. В 1960-70 гг. в большинстве публикаций в качестве основной модели образования NO принималась «термическая» схема. Согласно этой схеме выход NO определяется реакцией между атомом кислорода и молекулой азота. При этом количество атомарного кислорода определяется диссоциацией молекулы О2 . Эти процессы имеют очень большой энергетический барьер Е = 561 кДж/моль и, следовательно, определяются температурой процесса. Однако исследования за последнии 20 лет показали:
1) образование NO в пламенах имеет место не после окончания реакции горения, а не посредственно в зоне горения и зависит от ряда других химических реакций в пламенах. При этом собственно образование NO происходит не только в результате реакции атомарного кислорода с молекулой азота, но и в ряде других ;
2) образование О в пламенах происходит не только за счёт диссоциации О2 , но и в ряде других реакций, концентрация атомарного кислорода в зоне горения на 1-2 порядка выше равновесного, определяемого из условий диссоциации молекулярного кислорода и в пламенах углеводородов составляет 0,4-0,8% ;
3) максимальная температура в ядре зоны горения существенно ниже расчётной теоретической вследствие наличия сверхравновесных концентраций промежуточных продуктов реакций и теплообменных процессов ;
4) зависимость выхода NO от температуры значительно слабее, чем это предполагалось ранее.
К настоящему времени приближенно до детальной разработки процесса можно отметить 3 основных группы источников образования оксида азота при горении, которые рассмотрим ниже.
«Термические» оксиды азота.
Условия протекания цепной реакции окисления атмосферного азота свободным кислородом при горении, формальная кинетика которой описывается уравнением :
 , ,
В результате ряда работ различных учённых было получено уравнение для равновесного количества NO.
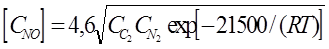
Температура, К
|
300 |
700 |
800 |
1800 |
2500 |
| Равновесная концентрация, [CNO], мг.м^3 |
0,00127 |
0,38 |
2,54 |
4700 |
31700 |
Так же была разработана цепная схема окисления азота, в которой активную роль играют свободные атомы кислорода и азота :
Реклама

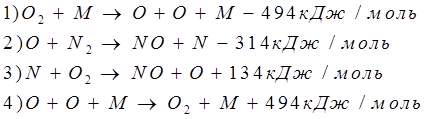
При этом концентрация атомарного кислорода остается неизменной, а скорость процесса определяется реакцией 2 схемы.
Энергетический барьер этой реакции складывается из двух составляющих :
а) энергии, требующейся на образование одного атома кислорода (Е1);
б) энергии активации реакции атома кислорода с молекулой азота (Е2);
Таким образом,
Е=Е1+Е2=494/2+314=516 кДж/моль.
Так как энергия активация этой реакции очень высока, то она предопределяет исключительно сильную зависимость скорости образования оксида азота от температуры.
Так же стоит отметить, что концентрация оксидов азота линейно увеличивается с увеличением концентрации атомарного кислорода и экспоненциально с увеличением температуры.
На основе имеющихся научных исследований были сформулированы методы подавления образования «термических» NO путем снижения скорости реакции их образования :
1) снижение общего уровня температур в топке путем рециркуляции продуктов сгорания с Т<400 C, подачи пара и воды в зону горения и в дутьевой воздух ;
2) снижение максимальных локальных температур в топке путём усиленной подачи газов рециркуляции, пара и воды в зоны максимальных температур (впрыск воды, пара в отдельные зоны факела, подача газов рециркуляции по оси, усиленная подача газов рециркуляции в центральные горелки) ;
3) уменьшение максимальной температуры и содержания кислорода в зоне максимальных температур путем организации ступенчатого горения ;
4) уменьшение общего избытка окислителя в пределах, допустимых по условиям начала быстрого увеличения выхода продуктов неполного горения С, СО, С20Н12.
Образование «быстрых» оксидов азота.
Для получения равновесных концентраций NO при горении стехиометрической метановоздушной смеси требуется период времени около10^-2---10^-3 с, однако время горения составляет 10^-4 с. Вместе с тем в углеводородных пламенах в отличие от пламен Н2 и СО непосредственно в зоне горения обнаруживается достаточно высокие концентрации NO.
С. Фенимор на основание ряда реакций сделал предположение, что быстрое образование NO объясняется связыванием молекул азота радикалами СН и С2 в реакциях с очень малыми энергетическими затратами:
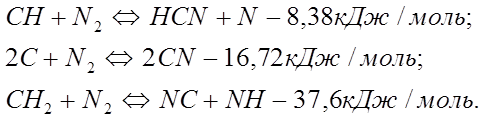
Так же многие учёные проводили опыты и соответствующие измерения по данному вопросу и благодаря им можно отметить, что быстрое образование оксида азота во фронте пламени - явление, органически связанное с горением и присуще пламенам углеводородов и углесодержащих топлив. С точки зрения минимизации выхода NOx перспективным топливом является водород, в пламенах которого образуется оксида азота на порядок меньше по сравнению с пламенами метана и оксида углерода. Задача снижения «быстрых» NOx пока не решена.
Реклама

Так же анализ работ, проведенные Н.А. Гуревичем, В.Г. Ляскоронским, И.Я. Сигалом, позволяют сделать сделать следующие выводы.
1) Быстрое окисление азота во фронте пламени является достоверным и надежно установленным фактом. Явление хорошо воспроизводится в лабораторных условиях независимо от разнообразия используемых для его наблюдения горелочных устройств и типов пламени.
2) Наиболее характерными признаками быстрого окисления азота в пламенах служат :
а) кратковременность процесса, в результате чего зона образования NO локализована на сравнительно небольшом участке фронта ламинарного пламени;
б) слабая зависимость выхода NO от температуры горения;
в) сильная зависимость выхода NO от соотношения топливо-воздух ;
3) «Быстрые» оксиды азота образуются непосредственно во фронте ламинарного пламени, на участке, составляющем около 10% ширины фронта пламени. Причем процесс образования начинается уже у передней границы фронта пламени в области температур около 1000 К.
4) Наиболее вероятным механизмом образования «быстрых» NO является механизм С. Фенимора с участием углеводородных радикалов, хотя дополнительная проверка его является необходимой.
Образование «топливных» оксидов азота.
Работы различных ученых показали, что азотсодержащие соединения, входящие в состав топлив, также являются источником образования оксидов азота, поступающих в атмосферу с продуктами сгорания.
В России особое значение изучение механизма образования «топливных» оксидов азота имеет в связи с проблемой сжигания Канско-Ачинских (Np=0,6-1,1%) и некоторых других бурых углей. Сжигание их осуществляется при весьма низких температурах (1600-1700) К, при которых выход «термических» NOx невелик, а выход «топливных» NOx приобретает существенное значение (при 1600 К он может составлять до 75% общего выхода NOx). Некоторые данные о содержание связанного азота в топлива, применяемых на территории бывшего СССР, приведены в следующих таблицах :
(Содержание азота в углях некоторых месторождений).
| Месторождение
|
Марка угля
|
N
г, %
|
Донецкое
Кузнецкое
Кузнецкое
Кузнецкое
Нерюнгринское
Экибастузское
Печорское
Березовское
|
АШ
Т
2СС
ГЖ
СС
СС
Д
БЗ
|
0,8
2,1
1,9
2,2
1,0
1,2
2,7
0,95
|
(Содержание азота в жидком топливе, %)
| Топливо
|
N
г,%
|
Топочный мазут
Сланцевое масло
Моторное
Дизельное
Газотурбинное :
лёгкое
тяжелое
|
0,30-0,50
0,14-0,50
0,12-0,13
0,007-0,01
0,02-0,03
0,07-0,09
|
Топливные NOx образуются из азотосодержащих соединений топлива при продувании его горячим воздухом уже при температуре 900-1000 К. Во всяком случае при температурах 1000-1400 К на начальном участке факела, где происходит воспламенение и горение летучих, обнаруживается значительный выход NOx.
Если бы всё количество азота, содержащегося в топливе, окислялось до NO, то только за счёт топливного азота могло бы образоваться при горении углей до 2-4 г/м^3, при горении мазута до 0,5-1,0 г/м^3. В действительных процессах лишь некоторая часть топливного азота переходит в оксиды азота. Азотосодержащие соединения в углях состоит из аминов, пептидов, аминокислот и др. При нагреве угля в корне факела в зоне выхода летучих обнаруживаются пиридины, хинолины и другие смолистые вещества, аммиак. Значительная часть азотосодержащих соединений, однако, переходит не в эти соединения, а в более прочные - нитриды и др. Однако поскольку для превращения топливного азота, входящего в такие соединения, как пиридины, хинолины, нитробензол, нитроамины, аммиак и некоторые другие, а также на образование NO, требуется меньшая энергия, чем энергия расщепления молекулы N2 , образование существенных количеств NO даже при сравнительно невысоких температурах (1300-1400 С) вполне возможно.
Параллельно описанной выше одной из теорий, проходили и другие изучения на основании которой были сделаны следующие выводы :
1) Азотосодержащие соединения топлива при горении частично окисляются до NO , и влияние этого процесса на общее содержание оксида азота в продуктах сгорания должно быть учтено.
2) Влияние топливных NOx на общий выброс оксида азота более существенно при низких температурах процесса горения (Tmax<1800 K), например, при сжигании низкокачественных углей, особенно при сжигании топлива в кипящем слое, при горении мазута, антрацитов и других высокореакционных топлив в крупных топливосжигающих установках влияние топливных NOx меньше.
3) Образование топливных оксидов азота происходит на начальном участке факела, в области образования «быстрых» NO и до образование «термических» NO.
4) Степень перехода азотосодержащих соединений топлива в NO уменьшается с увеличением концентрации азота в топливе. Однако абсолютный выход NO при большем содержании азота топлива будет выше.
5) Степень перехода азотосодержащих соединений топлива в NO быстро нарастает с увеличением коэффициента избытка.
6) Выход топливных NO сравнительно слабо (особенно по сравнению с термическим NO) зависит от температуры процесса.
7) Вид азотосодержащего соединения и содержание кислорода в топливе не оказывают влияния на выход топливных NO.
Из способов снижения образования «топливных»
NOx
наиболее подробно испытаны методы ступенчатого сжигания топлива.
Выводы .
Выше было показано, что оксид азота может образоваться по трём известным механизмам :
· «термическому», в результате диссоциации молекул на атомы и радикалы и последующего окисления молекул азота, он исходит из значительной зависимости выхода NO от температуры, что качественно подтверждается исследованиями на крупных промышленных установках ;
· «быстрому», действующему в начале зоны горению, в основу которого положены реакции с участием радикалов СН, СН2, он определяет минимальный выход NO при горении газового топлива, слабо зависит от температуры и сильно от структуры молекулы топлива ;
· «топливному», зависящему от содержания азота в топливе и избытка воздуха.
Образование диоксида азота в процессах горения.
В течении ряда лет существовало мнение, что оксиды азота образуются в процессах горения в виде монооксида азота и лишь после выхода из дымовой трубы доокисляются в диоксид. Однако при сжигании богатых смесей и при сжигании газовоздушных смесей, по составу близких к стехиометрическим , было зафиксировано в предпламенной зоне до 14 мг/м^3 диоксида азота. Во фронте пламени существенных количеств NO2 обнаружить не удалось, что можно объяснить разложением NO2 в ходе реакции :
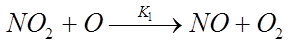
Так же не исключены и другие реакции разложения NO2.
Образование NO начинается на расстоянии 1 мм от видимого фронта пламени и достигает максимума во фронте пламени. Отношение NO2/NO уменьшается с повышением температуры. Разложение NO2происходит за период = 4*10^-3 с на отрезке длинной 1 мм от начальной границы видимого фронта пламени. Зона разложения предпламенной NO2во фронте пламени совпадает с зоной образования «быстрых» NO, т.е зоной интенсивного нарастания концентраций оксида азота. Эффект разложения NO2в факеле известен и начинает использовать с целью очистки газов, содержащих высокие концентрации NO2(отходящие газы химической и других отраслей промышленности).
Процесс доокисления NO в NO2в пламенах молекулярным кислородом имеет высокую энергию активации реакций и большое время реагирования, поэтому существенных количеств NO2он дать не может. Из двух наиболее вероятных окислителей NO в NO2(атомарный кислород и пероксидный радикал - HO2) практически значение имеет лишь НО2. Доокисление NO в NO2 происходит за счёт реакции с пероксидным радикалом и имеет место при сильном охлаждении пламен избыточным воздухом и водоохлаждаемыми поверхностями нагрева :
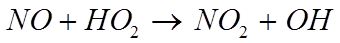
«Время жизни» НО2 составляет от 10^-4 с до (2-3)*10^-2 с. Процесс окисления лимитируется только количеством НO2 , так как концентрация NO существенно выше, чем радикальность НO2 .
В области минимальных температур в зоне горения при содержании NO в продуктах сгорания 100-120 мг/м^3 время реагирования не превышает 10^-4 с , т.е можно считать, что при наличии НO2 NO практически мгновенно переходит в NO2 и только недостаточное количество НO2 препятствует полному доокислению NO в NO2 . Всё количество пероксидного радикала, вынесенного из зоны горения в результате диффузионного процесса в предпламенную и послепламенную области, прореагирует с образованием NO2 .
Критическая температура, ниже которой происходит образование NО2 в пламенах, равна 977 К. Резкое охлаждение продуктов сгорания имеет место в частности, в малых отопительных котлах . Время, необходимое для достижения частицей, находящейся во фронте пламени, наиболее удаленной экранной поверхности, невелико и составляет 0,10-0,12 с, что создает благоприятные условия для образования пероксидных радикалов и способствует образованию значительных количеств диоксида азота в продуктах сгорания топлива в отопительных котлах.
С уменьшением мощности котла содержание NO2 в продуктах сгорания возрастает, что объясняется рядом факторов, но прежде всего :
а) большим коэффициентом избытка воздуха ;
б) более интенсивным охлаждением зоны горения.
|