Билеты по химии за курс 10 класса.
Билет №1
Периодический закон и периодическая система химических элементов Д. И. Менделеева на основе представлений о строении атомов. Значение периодического закона для развития науки.
В 1869 г. Д. И. Менделеев на основе анализа свойств простых веществ и соединений сформулировал Периодический закон:
Свойства простых тел... и соединений элементов находятся в периодической зависимости от величины атомных масс элементов.
На основе периодического закона была составлена периодическая система элементов. В ней элементы со сходными свойствами оказались объединены в вертикальные столбцы — группы. В некоторых случаях при размещении элементов в Периодической системе приходилось нарушать последовательность возрастания атомных масс, чтобы соблюдалась периодичность повторения свойств. Например, пришлось "поменять местами" теллур и йод, а также аргон и калий.
Причина состоит в том, что Менделеев предложил периодической закон в то время, когда не было ничего известно о строении атома.
После того, как в XX веке была предложена планетарная модель атома, периодический закон формулируется следующим образом:
Свойства химических элементов и соединений находятся в периодической зависимости от зарядов атомных ядер.
Заряд ядра равен номеру элемента в периодической системе и числу электронов в электронной оболочке атома.
Эта формулировка объяснила "нарушения" Периодического закона.
В Периодической системе номер периода равен числу электронных уровней в атоме, номер группы для элементов главных подгрупп равен числу электронов на внешнем уровне.
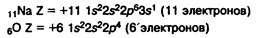
Причиной периодического изменения свойств химических элементов является периодическое заполнение электронных оболочек. После заполнения очередной оболочки начинается новый период. Периодическое изменение элементов ярко видно на изменении состава и свойств и свойств оксидов.
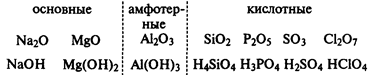
Научное значение периодического закона. Периодический закон позволил систематизировать свойства химических элементов и их соединений. При составлении периодической системы Менделеев предсказал существование многих еще не открытых элементов, оставив для них свободные ячейки, и предсказал многие свойства неоткрытых элементов, что облегчило их открытие.
Реклама

Билет №2
Строение атомов химических элементов на примере элементов второго периода и IV-A группы периодической системы химических элементов Д. И. Менделеева. Закономерности в изменении свойств этих химических элементов и образованных ими простых и сложных веществ (оксидов, гидроксидов) в зависимости от строения их атомов.
При перемещении слева направо вдоль периода металлические свойства элементов становятся все менее ярко выраженными. При перемещении сверху вниз в пределах одной группы элементы, наоборот, обнаруживают все более ярко выраженные металлические свойства. Элементы, расположенные в средней части коротких периодов (2-й и 3-й периоды), как правило, имеют каркасную ковалентнуто структуру, а элементы из правой части этих периодов существуют в виде простых ковалентных молекул.
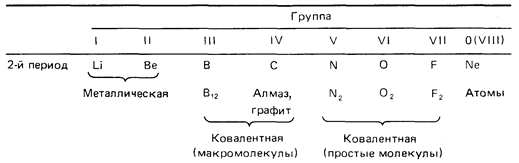
Атомные радиусы изменяются следующим образом: уменьшаются при перемещении слева направо вдоль периода; увеличиваются при перемещении сверху вниз вдоль группы. При перемещении слева направо по периоду возрастает электроотрицательность, энергия ионизации и сродство к электрону, которые достигают максимума у галогенов. У благородных же газов электроотрицательность равна 0. Изменение сродства к электрону элементов при перемещении сверху вниз вдоль группы не столь характерны, но при этом уменьшается электроотрицательность элементов.

В элементах второго периода заполняются 2s, а затем 2р-орбитали.
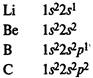 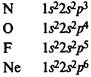
Главная подгруппа IV группы периодической системы химических элементов Д. М. Менделеева содержит углерод С, кремний Si, германий Ge, олово Sn и свинец Pb. Внешний электронный слой этих элементов содержит 4 электрона (конфигурация s2
p2
). Поэтому элементы подгруппы углерода должны иметь некоторые черты сходства. В частности, их высшая степень окисления одинакова и равна +4.
А чем обусловлено различие в свойствах элементов подгруппы? Различием энергии ионизации и радиуса их атомов. С увеличением атомного номера свойства элементов закономерно изменяются. Так, углерод и кремний — типичные неметаллы, олово и свинец — металлы. Это проявляется прежде всего в том, что углерод образует простое вещество-неметалл (алмаз), а свинец типичный металл.
Германий занимает промежуточное положение. Согласно строению электронной оболочки атома p-элементы IV группы имеют четные степени окисления: +4, +2, – 4. Формула простейших водородных соединений — ЭН4
, причем связи Э—Н ковалентны и равноценны вследствие гибридизации s- и р- орбиталей с образованием направленных под тетраэдрическими углами sp3
-орбиталей.
Реклама

Ослабление признаков неметаллического элемента означает, что в подгруппе (С—Si—Ge—Sn—Pb) высшая положительная степень окисления +4 становится все менее характерной, а более типичной становится степень окисления +2. Так, если для углерода наиболее устойчивы соединения, в которых он имеет степень окисления +4, то для свинца устойчивы соединения, в которых он проявляет степень окисления +2.
А что можно сказать об устойчивости соединений элементов в отрицательной степени окисления —4? По сравнению с неметаллическими элементами VII—V групп признаки неметаллического элемента р-элементы IV группы проявляют в меньшей степени. Поэтому для элементов подгруппы углерода отрицательная степень окисления нетипична.
Билет №3.
Виды химической связи и способы ее образования в неорганических соединениях: ковалентная (полярная, неполярная, простые и кратные связи), ионная, водородная.
Ковалентная связь
образуется за счет перекрывания электронных облаков двух атомов. Каждый атом предоставляет один неспаренный электрон для образования одной химической связи, при этом происходит образование общей электронной пары
. Если ковалентная связь образуется между двумя одинаковыми атомами, она называется неполярной
.
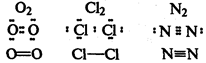
Если ковалентная связь образуется между двумя различными атомами, общая электронная пара смещайся к атому с большей электроотрицательностью (электроотрицательностью называется способность атома притягивать электроны). В этом случае возникает полярная ковалентная связь
.
Частным случаем ковалентной связи является донорно-акцепторная связь
. Для ее образованья у одного атома должна быть свободная орбиталь на внешнем электронном уровне, а у другого — пара электронов. Один атом (донор) предоставляет другому (акцептору) свою электронную пару, в результате она становится общей, образуется химическая связь. Пример — молекула СО:

Ионная связь
образуется между атомами с сильно отличающейся электроотрицательностью. При этом один атом отдает электроны и превращается в положительно заряженный ион, а атом, получивший электроны, в отрицательно заряженный. Ионы удерживаются вместе за счет сил электростатического притяжения.
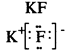
Водородная связь
образуется между полярными молекулами (вода, спирты, аммиак) за счет притяжения разноименных зарядов.
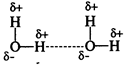
Прочность водородной связи существенно (~20 раз) меньше, чем ионной или ковалентной связи.
Билет №4.
Классификация химических реакций в неорганической химии.
Классификация по составу исходных веществ и продуктов реакции.
Реакции соединения
— из нескольких веществ (простых или сложных) образуется сложное вещество:
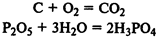
Реакции разложения
— сложное вещество превращается в несколько веществ (простых или сложных):
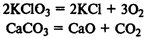
Реакции замещения
— из простого и сложного веществ образуется простое и сложное вещества:
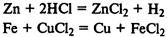
Реакции обмена
— из двух сложных веществ образуются два сложных вещества:
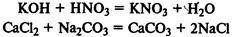
Классификация по изменению степени окисления.
Окислительно-восстановительные реакции
— в ходе реакции происходит изменение степеней окисления элементов:
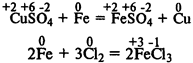
Реакции ионного обмена
— изменения степеней окисления не происходит:
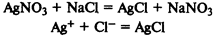
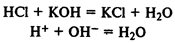
Классификация во тепловому эффекту.
Экзотермические реакции
— в ходе реакции выделяется тепло:
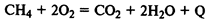
Эндотермические реакции
— в ходе реакции поглощается тепло:
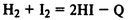
Билет №5.
Электролиты и неэлектролиты. Электролическая диссоциация неорганических кислот, солей, щелочей. Степень диссоциации.
Электролиты и неэлектролиты
Электрический ток — направленное движение заряженных частиц под действием внешнего электромагнитного поля.
Заряженные частицы:
электроны — ток в металлах;
ионы — ток в растворах.
Электролиты — вещества, растворы которых проводят электрический ток: растворимые кислоты, щелочи, соли. Связь ионная или сильнополярная.
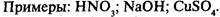
Неэлектролиты — вещества, растворы которых не проводят электрический ток: большинство органических веществ. Связь неполярная или слабополярная.
Электролитическая диссоциация
Электролитическая диссоциация — распад электролита на ионы под действием полярных молекул растворителя.
Основы теории электролитической диссоциации – С.Аррениус, 1887г.:
1. Электролиты при растворении в воде диссоциируют.
2. Под действием электрического тока ионы движутся в растворе: положительно заряженные - к катоду, отрицательно заряженные — к аноду.
3. Диссоциация – обратимый процесс
В молекуле воды связь ковалентная полярная, молекула угловая, следовательно, молекула воды — диполь.
Причина диссоциации веществ с ионной связью: диполи воды разрушают кристаллическую решетку. 
Причина диссоциации веществ с ковалентной полярной связью: молекулы воды вызывают еще большую поляризацию связи вплоть до ее разрыва.
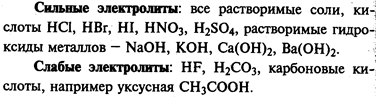
Степень диссоциации. Сильные и слабые электролиты
Степень диссоциации — отношение числа распавшихся молекул к общему числу молекул растворенного вещества:
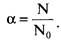
Если а ® 1, то электролит сильный
. В растворе практически нет молекул. Примеры: НСl; NaOH; KBr.
Если а ® 0, то электролит слабый
. В растворе много молекул и мало ионов. Примеры: H2
S; NH3
; Fe(SCN)3
.
Диссоциация кислот, щелочей и солей
Кислоты
— электролиты, в растворах которых нет других катионов, кроме катионов водорода.
Многоосновные кислоты диссоциируют ступенчато:
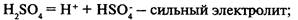
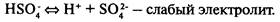
Основания
— электролиты, в растворах которых нет других анионов, кроме гидроксид-ионов.
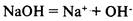
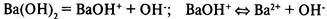
Соли
— электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
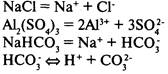
Билет №5. (углубленный)
Электролиты и неэлектролиты. Электролическая диссоциация неорганических кислот, солей, щелочей. Степень диссоциации.
Электролит
проводит электрический ток в результате того, что направленное перемещение его ионов создает поток электрических зарядов. Таким образом, пропускание электрического тока через электролит сопровождается переносом вещества.
Электролитами чаще всего являются такие соединения, как кислоты, основания или соли, находящиеся в расплавленном состоянии или в водных растворах. Способность электролитов проводить электрический ток называется электролитической проводимостью
. Ее следует отличать от электронной проводимости обычных проводников электрического тока, например металлов. В веществах с электронной проводимостью поток заряда обусловлен потоком электронов, а не перемещением ионов. Поэтому пропускание электрического тока через проводники с электронной проводимостью не сопровождается переносом вещества.
Электролиты в свою очередь могут быть подразделены на два типа: сильные и слабые электролиты. Сильный электролит
– это соединение, которое в расплавленном состоянии или в растворе полностью ионизировано. Примером сильного электролита может служить соляная кислота. При растворении хлороводорода в воде происходит его полная ионизация:
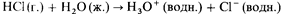
В этом уравнении использована простая (а не двойная) стрелка, чтобы показать, что процесс идет в указанную сторону до полного завершения.
Слабый электролит
– это вещество, которое диссоциирует на ионы лишь частично. Следовательно, в растворе устанавливается равновесие между недиссоциированными молекулами такого вещества и диссоциированными ионами. Примером слабого электролита является уксусная кислота:
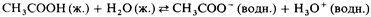
Органические кислоты и основания обычно являются слабыми электролитами.
Неэлектролит
вообще не диссоциирует на ионы и поэтому не обладает способностью проводить электрический ток. Большинство органических соединений принадлежат к неэлектролитам.
Механизм электролитической диссоциации — распада молекул или кристаллов растворяемого вещества на ионы под влиянием молекул растворителя
— был понят несколько позднее. Согласно современным воззрениям, такой распад является результатом взаимодействия полярных молекул растворителя, например воды, с молекулами или кристаллической решеткой растворяемого вещества. Молекулы растворителя атакуют кристаллическую решетку, разрушая ее и переводя составные части решетки (ионы) в раствор в форме сольватированных (гидратированных) заряженных частиц Окружающие эти ионы полярные молекулы растворителя ориентированы в соответствии с зарядом ионов. Растворение электролита в известной мере упорядочивает молекулы растворителя. Естественно предположить, что эта способность к упорядочению молекул растворителя у многозарядных ионов выражена сильнее, чем у однозарядных. В этом и нужно искать причину того, что соли, содержащие многозарядные ионы, плохо растворимы (в ряде случаев практически нерастворимы) в воде. Например, хлорид бария растворим хорошо, а сульфат бария — очень плохо. Следовательно, влияние растворенного вещества и растворителя является обоюдным: полярные молекулы растворителя разрушают кристаллическую решетку растворяемого вещества на отдельные ионы, а эти ионы, переходя в раствор, вызывают изменение растворителя, заставляя его молекулы упорядочиваться.
Кроме того, сольватированные ионы растворенного вещества не индифферентны по отношению друг к другу. Противоположно заряженные ионы имеют тенденцию притягиваться силами электростатического взаимодействия, образуя нейтральные молекулы или нейтральные группы молекул. Разумеется, в реальном растворе всегда присутствуют как отдельные сольватированные ионы, так и нейтральные молекулы.
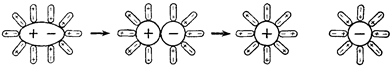
Действие растворителя на растворенное вещество настолько велико, что может вызывать электролитическую диссоциацию веществ, не обладающих ионным типом связи. Например, полярные молекулы хлороводорода, растворяясь в воде, разрываются ее молекулами на ионы. При растворении хлороводорода в бензоле, являющемся менее полярным растворителем, чем вода, диссоциации молекул не происходит. Поэтому раствор хлороводорода (кислота) в воде проводит электрический ток, а в бензоле нет.
Степень электролитической диссоциации
a – число, показывающее, какая часть молекул электролита находится в растворе в виде ионов.
Согласно этому определению
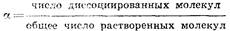
Очевидно, во всех растворах неэлектролитов, где диссоциация на ионы полностью отсутствует, a=0, а в растворах, в которых все растворенное вещество присутствует в форме ионов (полная диссоциация), a=1. Очень часто для растворов средней и высокой концентраций (с»5,0%...с»10,0%) считают, что слабые электролиты характеризуются a£0,03, а сильные – a³0,30. Электролиты средней силы характеризуются промежуточными значениями степени диссоциации: 0,03£a£0,30. Однако необходимо отметить, что предложенная классификация является в значительной степени условной (особенно в случае слабых электролитов и электролитов средней силы). Это объясняется следующим. Степень диссоциации в общем случае зависит от природы электролита и растворителя, от концентрации и температуры раствора. Для растворов, образованных одними и теми же компонентами (растворителем и растворенным веществом), наибольший интерес представляет зависимость степени диссоциации от концентрации раствора. Для слабых электролитов типа H+
B–
(кислота) или А+
ОН–
(основание) степень диссоциации ос и концентрация раствора с связаны зависимостью:
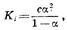
где Кi
— константа, характеризующая способность того или иного слабого электролита к диссоциации.
При малых значениях a (a£0,05) разность 1–a приблизительно равна 1. Тогда из этого уравнения можно получить:
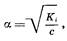
что является математическим выражением закона разведения Оствальда
: степень диссоциации слабого электролита в растворе тем выше, чем более разбавлен раствор.
Допустим, что при растворении электролита ВА в воде образуется раствор, имеющий концентрацию с. В результате некоторая часть а электролита ВА диссоциирует, образуя ионы B+
и А–
. Величина a называется степенью диссоциации
. Равновесная концентрация неионизированного электролита ВА оказывается равной с(1– a). Таким образом, можно записать
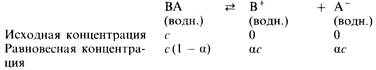
Запишем теперь выражение для константы равновесия рассматриваемой диссоциации
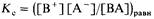
Подставив в это выражение равновесные концентрации участников диссоциации, получим
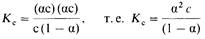
Это соотношение и представляет собой закон разбавления Оствальда. Константа Кс
называется константой диссоциации электролита
. Чем больше Kc
, тем сильнее электролит.
Билет №6.
Обратимые и необратимые химические реакции. Химическое равновесие и условия его смещения (изменение концентрации реагентов, температуры, давления).
Необратимые реакции
протекают до полного расходования одного из исходных веществ, т. е. если одно из получающихся веществ выпадает в осадок или выделяется в виде газа:
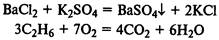
Обратимые реакции
протекают до достижения состояния химического равновесия.
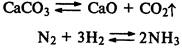
Химическое равновесие — состояние, при котором скорости прямой и обратной реакций равны.
Обратимые реакции протекают до достижения состояния равновесия.
Обратимость многих реакций кажущаяся. Так, реакция водорода с кислородом с образованием воды кажется обратимой. Однако при температуре 2000°С с заметной скоростью протекает обратный процесс — разложение воды на водород и кислород и устанавливается равновесие.
Смещение химического равновесия при изменении условий описывается принципом Ле-Шателье.
При изменении внешних условий равновесие реакции смещается таким образом, чтобы уменьшить это воздействие.
Смещение равновесия при изменении температуры.
В случае экзотермической реакции (протекающей с выделением тепла) равновесие смещается влево (в сторону исходных веществ) при повышении температуры, и вправо (в сторону продуктов реакции) при понижений температуры: |
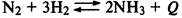
В случае эндотермической реакции (протекающей с поглощением тепла) равновесие смещается вправо при повышении температуры и влево при понижении температуры:

Смещение равновесия при изменении давления.
Если реакция протекает с увеличением числа молекул газообразных веществ, при повышении давления равновесие смещается влево, а при понижении давления вправо:
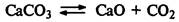
Если реакция протекает с уменьшением числа молекул газообразных веществ, то при повышении давления равновесие смещается вправо, а при понижений давления влево:
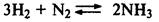
Если реакция протекает без изменения числа молекул газообразных веществ, то при изменении давления равновесие не смещается:

Билет №7.
Реакции ионного обмена. Условия их необратимости.
В растворах электролитов реакции протекают между ионами.
Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления.
Условия течения реакций в растворах электролитов до конца:
1) в результате реакции выпадает осадок:
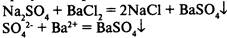
2) в результате реакции выделяется газ:
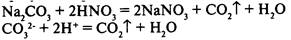
3) в результате реакции образуется малодиссоциирующее вещество:
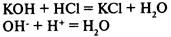
Ионный обмен
– это процесс, в результате которого ионы, находящиеся в твердой фазе. обмениваются с ионами, находящимися в растворе. Нерастворимое твердое вещество может представлять собой какой-либо природный материал либо синтетическую смолу. Природные материалы, используемые для ионного обмена, включают цеолиты (комплексные алюмосиликаты натрия) и глауконитовый песок.
На поверхности этих твердых веществ имеются электрически заряженные центры, расположенные на более или менее регулярном расстоянии друг от друга. Эти центры удерживают на себе простые ионы с зарядами противоположного знака. Именно эти ионы обмениваются с другими ионами, содержащимися в растворе.
Катионообменники.
Катионообменные материалы состоят из трех частей:
1) основная масса, или скелет, обычно обозначаемый символом R–;
2) активные центры (такие группы, как —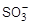 либо — либо —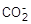 ); );
3) катионы, подлежащие обмену (обычно это ионы Н+
или Н3
О+
).
Когда твердый катионообменник приходит в соприкосновение с раствором, в котором содержатся какие-либо ионы, между ними устанавливается равновесие. Например,
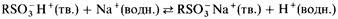
Если первоначально раствор содержит, например, хлорид натрия, то ионы натрия обмениваются с ионами водорода и из нижней части колонки вытекает разбавленный раствор соляной кислоты.
Ионообменный материал можно регенерировать (восстанавливать), промывая колонку разбавленной соляной кислотой. Это приводит к смещению влево рассматриваемого равновесия, в результате чего ионы натрия замещаются ионами водорода.
Анионообменники
. Анионообменник удаляет из раствора анионы. Типичным примером анионного обмена является следующее равновесие:
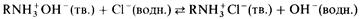
Для регенерации анионообменника может использоваться какое-либо основание, например раствор гидроксида натрия. Это сдвигает указанное равновесие влево.
Билет №8.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (зависимость скорости от природы, концентрации вещества, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора).
Скоростью химической реакции называется изменение количества вещества за единицу времени в единице объема.
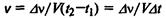
Скорость реакции зависит от природы реагирующих веществ.
При реакции металлов с соляной кислотой, чем левее расположен металл в раду напряжений, тем быстрее протекает реакция, а металлы, находящиеся правее водорода, не реагируют вообще:
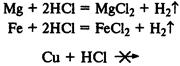
Скорость реакции увеличивается при увеличении концентрации реагирующих веществ.
Горение веществ в чистом кислороде происходит быстрее, чем в воздухе, содержание кислорода в котором составляет 21%:
Скорость реакции увеличивается при увеличении поверхности соприкосновения реагирующих веществ.
Железные опилки быстрее реагируют с соляной кислотой, чем железные гвозди:
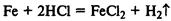
Скорость реакции увеличивается с увеличением темпера-
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
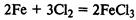
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет, то есть ее скорость равна 0:
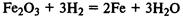
Скорость многих реакций увеличивается в присутствии специальных веществ — катализаторов.
Катализаторы увеличивают скорость реакции, но по окончании реакции остаются неизменными.
Примеры каталитических реакций:
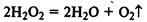
(реакция сильно ускоряется в присутствии МnО2
).
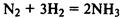
(реакция протекает только в присутствии катализаторов — платины, оксида ванадия (V), железа и др).
Билет №9.
Общая характеристика металлов главных подгрупп I – III групп (I-A – III-A групп) в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенности строение их атомов, металлическая химическая связь, химические свойства металлов как восстановителей.
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
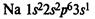
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s1
, во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s2
. Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s2
p1
. Они относятся к p-элементам.
В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
Оксиды типа R2
O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2
O2
, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.
Химические свойства.
Атомы металлов имеют больший радиус, чем атомы неметаллов, поэтому легко теряют валентные электроны. Вследствие этого металлы проявляют восстановительные свойства.
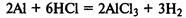
Билет №10.
Общая характеристика неметаллов главных подгрупп IV – VII групп (IV-A – VII-A) в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенностями строения их атомов. Изменение окислительно-восстановительных свойств неметаллов на примере элементов VI-A группы.
-
При движении сверху вниз по группам увеличивается радиус атома и следовательно уменьшаются окислительные свойства.
Сравнительная характеристика окислительно-восстановительных свойств неметаллов на примере кислорода и серы.
Схемы электронных оболочек:
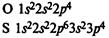
На внешнем электронном уровне атомов кислорода и серы находится по 6 электронов.
У кислорода окислительные свойства выражены сильнее, так как радиус атома меньше и валентные электроны сильнее притягиваются к ядру. Для кислорода наиболее характерна степень окисления —2, проявляющаяся при достройке внешнего энергетического уровня до 8 электронов.
Сера также может являться окислителем, проявляя степень окисления —2, но характерны также степени окисления +4 (при потере 4 р-электронов) и +6 (при потере всех шести валентных электронов).
В реакциях с металлами кислород и сера проявляют окислительные свойства, образуя оксиды и сульфиды соответственно:
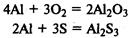
В реакциях с неметаллами кислород проявляет свойства окислителя:
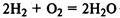
Сера может быть как окислителем
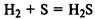
так и восстановителем:
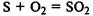
Сера выступает в роли восстановителя в реакции с концентрированной азотной кислотой:

Билет №11.
Аллотропия веществ, состав, строение, свойства аллотропных модификаций.
Если какой-либо элемент может существовать в двух или нескольких твердых формах (кристаллических либо аморфных), то считается, что он проявляет аллотропию. Различные формы одного элемента называются аллотропами. Аллотропы существуют приблизительно у половины всех элементов.
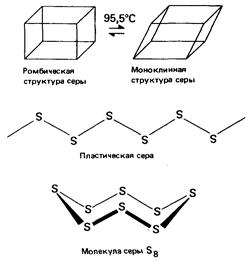
Например, углерод существует в виде алмаза либо графита. Сера существует в двух кристаллических формах - ромбической и моноклинной - в зависимости от температуры. Обе ее кристаллические формы являются примерами молекулярных кристаллов. Молекулы в них представляют собой гофрированные циклы, в каждом из которых содержится по восемь ковалентно связанных атомов серы. Твердая сера может существовать еще в третьей аллотропной форме как пластическая сера. Эта форма серы неустойчива. Она состоит из длинных цепочек атомов серы, которые при комнатной температуре разрушаются и снова образуют молекулы S8
, кристаллизующиеся в ромбическую решетку.
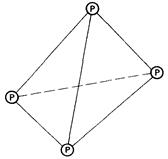
Фосфор может существовать в трех аллотропных формах. Наиболее устойчивая из них-красный фосфор. Красный фосфор имеет каркасную кристаллическую структуру, в которой каждый атом ковалентно связан с тремя другими атомами фосфора. Белый фосфор представляет собой молекулярный кристалл. Каждая его молекула содержит четыре атома фосфора, ковалентно связанных в тетраэдричес-кую структуру. Третий аллотроп - черный фосфор - образуется только при высоких давлениях. Он существует в виде макромолекулярной слоистой структуры.
Билет №12.
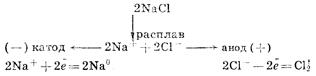
Электролиз растворов и расплавов солей (на примере хлорида натрия). Практическое значение электролиза.
Электролизом называются реакции в растворах или расплавах электролитов, происходящие под действием электрического тока.
В расплавах или растворах происходит диссоциация электролита. Катионы смещаются к катоду, анионы — к аноду.
Электролиз расплавов.
На катоде происходит восстановление катионов, на аноде — окисление анионов.
Электролиз расплава хлорида натрия. На катоде восстанавливаются катионы Na+
и выделяется металлический натрий, на аноде окисляются хлорид-ионы и выделяется хлор:
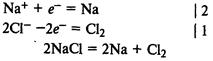
Электролиз водных растворов.
В процессах на катоде и аноде могут участвовать не только ионы электролита, но и молекулы воды.
Будут ли на катоде восстанавливаться катионы металла или молекулы воды, зависит от положения металла в ряду напряжений металлов.
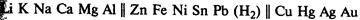
Если металл находится в ряду напряжений правее водорода, на катоде восстанавливаются катионы металла; если металл находится в ряду напряжений левее водорода, на катоде восстанавливаются молекулы воды и выделяется водород. Наконец, в случае катионов металлов от цинка до свинца может происходить либо выделение металла, либо выделение водорода, в зависимости от концентрации раствора и других условий.
На аноде также может происходить либо окисление анионов электролита, либо окисление молекул воды. При электролизе солей бескислородных кислот или самих кислот на аноде окисляются анионы (кроме F–
.) В случае кислородсодержащих кислот на аноде окисляются молекулы воды и выделяется кислород.
Электролиз раствора хлорида натрия. На катоде восстанавливаются молекулы воды и выделяется водород, а на аноде окисляются хлорид-ионы и выделяется хлор:
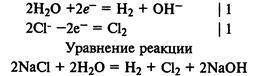
Электролиз раствора нитрата серебра. На катоде восстанавливаются катионы Ag+
и выделяется серебро, на аноде окисляются молекулы воды и выделяется кислород:
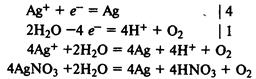
Применение
. Электролиз расплавов используют для получения фтора, активных металлов (натрий, калий, магний, кальций, алюминий). Электролиз растворов используют для получения хлора, щелочей, очистки металлов (электрорафинирование).
Билет №12 (углубленно).
Электролиз растворов и расплавов солей (на примере хлорида натрия). Практическое значение электролиза.
Совокупность химических реакций, которые протекают на электродах в растворах или расплавах при пропускании через них электрического тока, называется электролизом.
Указанную совокупность реакций принято подразделять на первичные
и вторичные
процессы. Первичные процессы — окислительно-восстановительные реакции, протекающие на электродах и ведущие, как правило, к образованию электрически нейтральных активных молекулярных или атомных частиц. Вторичные процессы — реакции взаимодействия активных частиц, образовавшихся в первичных процессах, со средой. Например, при электролизе раствора сульфата натрия протекают следующие электродные реакции:
Первичные реакции
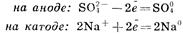
Вторичные реакции
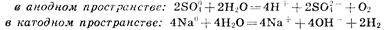
Приведенная совокупность химических реакций может быть представлена суммарным процессом:
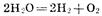
Из этого примера видно, что при электролизе, как и при работе химического источника тока, на аноде происходят процессы окисления, а на катоде — восстановления. При этом анод заряжен положительно (+), а катод — отрицательно (—). Отметим, что при работе химического источника тока, напротив, анод заряжается отрицательно, а катод — положительно, поскольку в этом случае протекают процессы, обратные электролизу.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого)
анода (например, графита), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов
на катоде — восстановление катионов и ионов водорода
При проведении электролиза с использованием активного (расходуемого)
анода процесс усложняется и конкурирующими реакциями на электродах являются следующие:
на аноде — окисление анионов и гидроксид-ионов;
анодное растворение металла — материала анода
на катоде — восстановление катиона соли и ионов водорода;
восстановление катионов металла, полученных при растворении анода
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с нерасходуемым электродом используют следующие правила.
1. На аноде могут образовываться следующие продукты: а) при окислении анионов 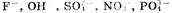 выделяется кислород; б) при окислении анионов выделяется кислород; б) при окислении анионов 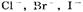 выделяются соответственно хлор, бром, иод; в) при окислении анконов органических кислот происходит процесс: выделяются соответственно хлор, бром, иод; в) при окислении анконов органических кислот происходит процесс: 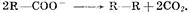
2. Если конкурирующими процессами на катоде является восстановление катионов (металл стоит в электрохимическом ряду напряжений металлов левее водорода) и ионов водорода, то при этом выделяется водород.
В тех случаях, когда в процессе электролиза используется активный (расходуемый) анод, то последний будет окисляться в ходе электролиза и переходить в раствор в виде катионов. Энергия электрического тока при этом расходуется ка перенос металла с анода на катод. Данный процесс широко используется при рафинировании (очистка) металлов. Так, на этом принципе основано, в частности, получение чистой меди из загрязненной. В раствор медного купороса погружают пластины из очищенной и неочищенной меди. Пластины соединяют с источником постоянного тока таким образом, чтобы первая из них (очищенная медь) была отрицательным электродом (катод), а вторая — положительным (анод). В результате пластина из неочищенной меди растворяется и ионы меди из раствора осаждаются на катоде. При этом примесь остается в растворе или оседает на дно ванны. Этот же принцип используется для защиты металлов от коррозии путем нанесения на защищаемое изделие тонких слоев хрома или никеля.
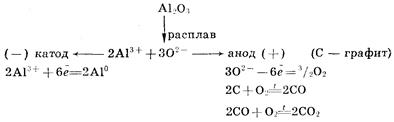
Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей:
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фа-радея:
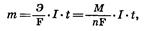
где m — масса образовавшегося при электролизе i-вещества (г); Э — эквивалентная масса i-вещества (г/моль); М — молярная масса i-вещества (г/моль); n — заряд i-иона; I — сила тока (A); t — продолжительность процесса; F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 К = 26,8 А•ч).
Билет №13.
Водородные соединения неметаллов. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева.
Гидриды
. В соединениях с неметаллами водород проявляет степень окисления +1. Поскольку энергия ионизации водорода очень большая, химическая связь его с неметаллами не ионная, а полярно-ковалентная. Наиболее электроотрицательные р-элементы в правой части периодов, например сера и хлор, реагируют с водородом, образуя ковалентные гидриды, которые обладают кислотными свойствами и сила этих кислот увеличивается по мере увеличения размера атома присоединяемого к водороду неметалла. Исключениями являются метан СН4
, представляющий собой нейтральное соединение, а также аммиак NH3
, обладающий основными свойствами. Водородные соединения неметаллов хорошо растворимы в воде и образуют кислоты с теми же формулами.
Более электроотрицательные р-элементы, например алюминий, кремний и фосфор, в нагретом состоянии не реагируют с водородом.
Билет №14.
Высшие оксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе Д. И. Менделеева. Характерные химические свойства оксидов: основных, амфотерных, кислотных.
Реакционная способность элементов во взаимодействии с кислородом, вообще говоря, уменьшается при перемещении вправо вдоль каждого периода. Например, в 3-м периоде два s-металла, натрий и магний, и два р-элемента, алюминий и фосфор, бурно реагируют с кислородом, образуя оксиды. В том же периоде элементы кремний и сера способны только медленно реагировать с кислородом. Хлор и аргон, расположенные в правом конце периода, вообще не реагируют с кислородом.
Электроположительные s-металлы образуют ионные оксиды, как, например, оксид натрия Na2
O и оксид магния MgO. Оксиды элементов, расположенных в средней и правой частях периода, являются преимущественно ковалентными соединениями, как, например, оксиды азота и серы.
Кислотно-основный характер оксидов тоже изменяется от основного у оксидов элементов левой части периода к амфотерному у оксидов элементов средней части периода и далее к кислотному у оксидов элементов правой части периода. Например, s-металлы обычно образуют оксиды, которые растворяются в воде с образованием щелочных растворов:
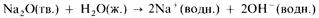
Молекулярные оксиды р-элементов, например диоксид углерода и триоксид серы, обычно обладают кислотными свойствами. Закономерное изменение основных свойств с переходом к кислотным свойствам наглядно проявляется у оксидов элементов 3-го периода.
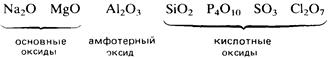
Билет №15.
Кислоты, их классификация и химические свойства на основе представлений об электролитической диссоциации. Особенности свойств концентрированной серной кислоты на примере взаимодействия с медью.
Кислота — сложное вещество, при диссоциации которого образуется только один тип катионов — ионы водорода.
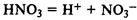
Классификация кислот.
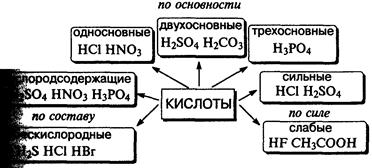
Соляная кислота — водный раствор газа хлоро-водорода в воде.
Химические свойства.
Кислоты изменяют цвет индикаторов: лакмус окрашивается в красный цвет, метилоранж — в желтый.
При реакции с основаниями образуется соль и вода (реакция нейтрализации). В реакцию вступают как растворимые, так и нерастворимые в воде основания:
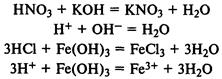
При реакции с основными оксидами
образуются со ли:
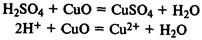
Кислоты реагируют с металлами,
находящимися в ряду напряжений
до водорода, при этом выделяется газообразный водород и образуется соль:
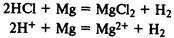
Сильные кислоты реагирует с солями слабых кислот,
вытесняя слабые кислоты из их солей:
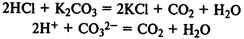
Получение кислот.
Многие кислоты можно получить при реакции кислотных оксидов с водой:
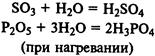

Концентрированная серная кислота
при обычной температуре не действует на многие металлы. По этой причине, например, безводная серная кислота в отличие от её растворов может сохраняться в железной таре.
Но концентрированная серная кислота действует почти на все металлы при нагревании. При этом образуются соли серной кислоты, однако водород не выделяется, а получаются другие вещества, например сернистый газ.
Так, при нагревании концентрированной серной кислоты с медью вначале серная кислота окисляет медь до окиси меди, а сама восстанавливается при этом до сернистой кислоты, которая тотчас же разлагается на сернистый газ и воду:
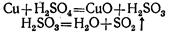
Образовавшаяся окись меди реагирует с избытком серной кислоты, образуя соль и воду:
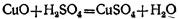
Таким образом, окись меди является промежуточным веществом в этой реакции. Сложив эти уравнения, мы получим итоговое уравнение реакции, в которое входят только исходные и конечные вещества:
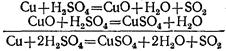
Билет №16.
Основания, их классификация и химические свойства на основе представлений об электролитической диссоциации.
Основания — электролиты, при диссоциации которых образуется только один вид анионов — гидроксид-ионы.
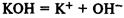
Классификация оснований
1. Растворимые в воде (щелочи)
— гидроксиды металлов главных подгрупп I и II групп.
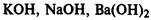
2. Нерастворимые в воде
— гидроксиды остальных металлов.
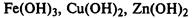
Химические свойства
. Щелочи изменяют окраску индикаторов (лакмус становится синим, фенолфталеин – малиновым).
Взаимодействие с кислотами:
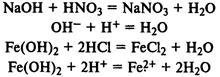
Взаимодействие с кислотными оксидами:
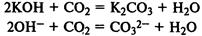
Растворы щелочей вступают в реакции ионного обмена с растворами солей, если образующийся при этом гидроксид нерастворим в воде:
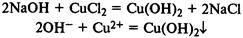
При нагревании слабые основания разлагаются на оксиды металлов и воду:
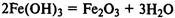
Получение оснований.
Щелочи получают электролизом растворов солей.
Электролиз раствора хлорида натрия. Процессы на катоде и аноде:
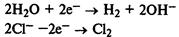
Уравнение реакции:
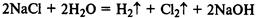
Нерастворимые в воде основания получают реакцией обмена со щелочами:
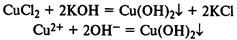
Билет №17.
Средние соли, их состав, названия, химические свойства (взаимодействие с металлами, кислотами, щелочами, друг с другом с учетом особенностей реакций окисления-восстановления и ионного обмена).
Соли — электролиты, в растворах которых есть катионы металлов или ион аммония и анионы кислотных остатков.
Названия: название аниона + название катиона в родительном падеже + степень окисления металла.
1.B водных растворах соли могут реагировать со щелочами. Так, хлористый магний MgCl2 взаимодействует с едким натром, образуя новую соль и новое основание:
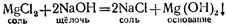
2. Соли могут реагировать с кислотами. Так, раствор азотнокислого бария Ва(гЮз)а взаимодействует с раствором серной кислоты, образуя новую кислоту и новую соль:
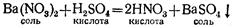
З.В водных растворах соли могут реагировать между собой.
Если слить вместе водные растворы хлористого кальция CaCl2
я углекислого натрия Na2
CO3
TO тотчас же образуется белый осадок нерастворимого в воде углекислого кальция СаСО3
, а в растворе — хлористый натрий:
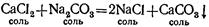
4. В водных растворах солей металл, входящий в их состав, может замещаться другим металлом, стоящим до него в ряду активности.
Если в раствор сернокислой меди опустить чистую железную проволоку или кусочек цинка, то на их поверхности выделяется медь, а в растворе образуется сернокислое железо (если было опущено железо) или сернокислый цинк (если был опущен цинк):
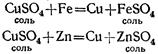
Но из сернокислого цинка нельзя вытеснить цинк медью: медь в ряду активности стоит после цинка.
Билет №18.
Гидролиз солей (разобрать первую стадию гидролиза солей, образованных сильным основанием и слабой кислотой, слабым основанием и сильной кислотой).
Взаимодействие ионов соли с водой, в результате которого образуются малодиссоциирующие соединения (ионы или молекулы), называют гидролизом соли
Четыре типа солей, которые по-разному взаимодействуют с водой.
I. Соль образована сильным основанием и сильной кислотой.
NaCI + НОН — ни один из ионов соли с водой не вза-имодействет. Реакция среды нейтральная.
II. Соль образована сильным основанием и слабой кислотой.
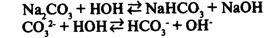 - реакция среды щелочная. - реакция среды щелочная.
Гидролиз солей, образованных сильным основанием и слабой кислотой, заключается в присоединении анионами кислотного остатка ионов водорода и накоплении в растворе гидроксид-ионов, образующихся при диссоциации воды.
Теперь выясним, почему раствор хлорида алюминия приобрел кислую реакцию среды. В растворе АlСl3
диссоциирует на ионы:
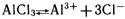
Столкновение ионов Н+
и С–
к образованию соединения не приводит. Из имеющихся в растворе ионов малодиссоциирующий продукт образуют ионы Аl3+
и ОН–
. Связывание ионов ОН–
в малодиссоциирующий ион АlOН2+
(К= 1,38 • 10–9
) вызывает дальнейший распад молекул воды на ионы:
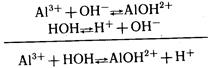
Таким образом, в растворе хлорида алюминия осуществляется реакция, в результате которой появляется избыток ионов Н+
, т. е. раствор приобретает кислую реакцию. Подобным образом ведут себя в растворах все соли, образованные слабым основанием и сильной кислотой.
III. Соль образована слабым основанием и сильной кислотой.
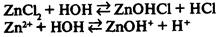 — реакция среды кислая. — реакция среды кислая.
Гидролиз соли, образованной слабым основанием и сильной кислотой, заключается в присоединении катионами металла гидроксид-ионов и накоплении в растворе ионов водорода, образующихся при диссоциации воды. Гидролиз хлорида алюминия можно выразить уравнением реакции:
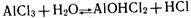
IV. Соль образована слабым основанием и слабой кислотой.
Реакция среды зависит от сравнительной силы кислоты и основания. В некоторых случаях гидролиз идет до конца:
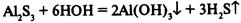
Билет №19.
Коррозия металлов (химическая и электрохимическая). Способы предупреждения коррозии.
Разрушение металлов и сплавов вследствие химического взаимодействия их с окружающей средой называются коррозией металлов.
Коррозию, вызванную непосредственным химическим взаимодействием между металлом и окружающей средой, называют химической коррозией
.
Химическая коррозия — окисление металла без возникновения гальванической пары. Газовая коррозия — при t > 600°С:
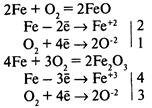
Коррозию, сопровождающуюся возникновением электрического тока за счет появления гальванической пары, называют электрохимической коррозией
.
Электрохимическая коррозия – разрушение металла в электролите с возникновением гальванической пары.
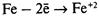 – ионы выходят в раствор, электроны перемещаются к менее активному металлу, например к меди. – ионы выходят в раствор, электроны перемещаются к менее активному металлу, например к меди.
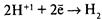 – разряжаются на менее активном металле, например на меди. – разряжаются на менее активном металле, например на меди.
Одним из наиболее широко распространенных видов электрохимической коррозии является ржавление обычной стали в водной среде и на воздухе. На поверхности металлических изделий всегда имеется пленка влаги, адсорбированной из воздуха. Она является электролитом, так как в ней растворены различные газы (СО2
, SO2
и др.). Зерна карбида железа Fe3
С химически менее активны, чем железо. Поэтому возникают микрогальваническис элементы: зерна Fe3
С играют роль катодов, а зерна чистого железа — роль анодов. Железо разрушается — оно ржавеет. Протекающие при этом процессы весьма сложные. Укажем лишь суммарное уравнение реакции:
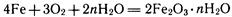
Ржавчина имеет неопределенный состав 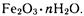
Для защиты от коррозии металлов
широко используют лакокрасочные покрытия
. Однако краски не вечны, изделия приходится перекрашивать. На это затрачивается ручной труд, расходуется много лакокрасочных материалов.
Из неметаллических покрытий для защиты стали и чугуна большое значение имеет эмаль. Эмаль
— это силикатное стекло с добавками оксидов металлов. Ее наносят на поверхность материала в виде порошка и обжигают при 500—1000 °С.
Покрытия из эмалей обладают стойкостью по отношению к щелочам и кислотам, длительно противостоят атмосферной коррозии. Но эмаль легко разрушается при ударе. Благодаря термостойкости, декоративному виду, легкости очистки эмаль широко используется для покрытия изделий домашнего хозяйства и санитарной техники.
С целью защиты металлов от коррозии (и для декоративных целей) издавна используют металлические покрытия. Железо оцинковывают, лудят (покрывают оловом), покрывают никелем, хромируют и т. д.
Защитить металл от коррозии можно с помощью металла и другим способом. Например, если соединить железное изделие или сооружение проводником с куском более активного металла, например магния, то возникает гальванический элемент. При этом сооружение (железо) играет роль катода, а более активный металл выполняет роль анода. Анод разрушается, а катод — защищаемый металл — не изменяется. Такая защита называется протекторной.
Одним из способов борьбы с коррозией является использование ингибиторов
. Это химические соединения, ничтожные концентрации которых способны почти полностью предотвращать коррозию. В некоторых случаях применение ингибиторов позволяет изготовлять аппаратуру из обычной стали вместо нержавеющей.
Одно из наиболее эффективных направлений борьбы с коррозией металлов — создание коррозионно-стойких сплавов. В больших количествах выплавляют так называемые нержавеющие стали. В их состав входят металлы (хром, никель), образующие устойчивые защитные оксидные пленки.
Билет №20.
Окислительно-восстановительные реакции (разобрать на примерах взаимодействия алюминия с оксидом железа (III), азотной кислоты с медью).
К окислительно-восстановительным реакциям могут быть отнесены химические реакции следующих типов.
Реакции замещения (вытеснения)
Примером реакций этого типа может служить реакция между оксидом железа (III) и алюминием. В этой реакции алюминий вытесняет железо из раствора, причем сам алюминий окисляется, а железо восстанавливается.
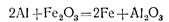
Приведем еще два примера:
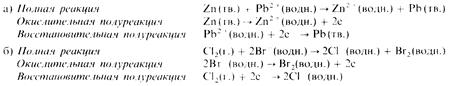
В этой реакции хлор вытесняет бром из раствора (хлор окисляется, бром восстанавливается), содержащего ионы брома.
Реакции металла с кислотами
Эти реакции, в сущности, тоже представляют собой реакции замещения. В качестве примера приведем реакцию между медью и азотной кислотой. Медь вытесняет водород из кислоты. При этом происходит окисление меди, которая превращается в гидратированный катион, а содержащиеся в растворе кислоты гидратированные протоны азота восстанавливаются, образуя оксид азота.

Реакции металлов с водой
Эти реакции тоже принадлежат к типу реакций замещения. Они сопровождаются вытеснением из воды водорода в газообразном состоянии. В качестве примера приведем реакцию между металлическим натрием и водой:
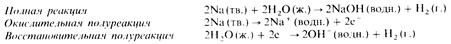
Реакции металлов с неметаллами
Эти реакции могут быть отнесены к реакциям синтеза. В качестве примера приведем образование хлорида натрия в результате сгорания натрия в атмосфере хлора
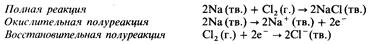
Билет №21.
Железо, положение в периодической системе, строение атома, возможные степени окисления, физические свойства, взаимодействие с кислородом, галогенами, растворами кислот и солей. Сплавы железа. Роль железа в современной технике.
Железо находится в побочной подгруппе VIII группы периодической системы. Электронная формула атома железа:
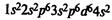
Типичные степени окисления железа +2 и +3. Степень окисления +2 проявляется за счет потери двух 4s-электронов. Степень окисления +3 соответствует также при потере еще одного Зd-электрона, при этом Зd-уровень оказывается заполненным наполовину; такие электронные конфигурации относительно устойчивы.
Физические свойства.
Железо – типичный металл, образует металлическую кристаллическую решетку. Железо проводит электрический ток, довольно тугоплавко, температура плавления 1539°С. От большинства других металлов железо отличается способностью намагничиваться.
Химические свойства.
Железо реагирует со многими неметаллами:
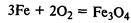
Образуется железная окалина – смешанный оксид железа. Его формулу записывают также так: FeО•Fe2
О3
.
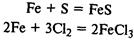
Реагирует с кислотами с выделением водорода:
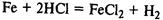
Вступает в реакции замещения с солями металлов, расположенных правее железа в ряду напряжений:
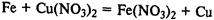
Соединения железа.
FeО — основной оксид, реагирует с растворами кислот с образованием солей железа (II). Fe2
О3
— амфотерный оксид, реагирует также с рас творами щелочей.
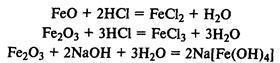
Гидроксиды железа.
Fe(ОН)2
— типичный основной оксид, Fe(ОН)3
обладает амфотерными свойствами, реагирует не только с кислотами, но и с концентрированными растворами щелочей.
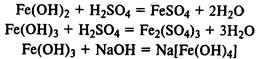
Гидроксид железа (II) легко окисляется до гидроксида железа (III) кислородом воздуха:
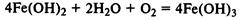
При реакции солей железа (II) и (III) со щелочами в осадок выпадают нерастворимые гидроксиды:
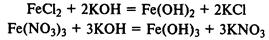
Сплавы железа.
Современная металлургическая промышленность производит железные сплавы разнообразного состава.
Все железные сплавы разделяются по составу и свойствам на две группы. К первой группе относятся различные сорта чугуна, ко второй — различные сорта стали.
Чугун хрупок; стали же пластичны, их можно ковать, прокаты^ вать, волочить, штамповать. Различие в механических свойствах чугунов и сталей зависит прежде всего от содержания в них углерода — в чугунах содержится около 4% углерода, а в сталях — обычно менее 1,4%.
В современной металлургии из железных руд получают сначала чугун, а затем из чугуна — сталь. Чугун выплавляют в доменных печах, сталь варят в сталеплавильных печах. До 90% всего выплавленного чугуна перерабатывают в стали.
Чугун
. Чугун, предназначенный для переработки в сталь, называют передельным чугуном. Он содержит от 3,9 до 4,3% С, 0,3—1,5% Si, 1,5—3,5% Мn, не более 0,3% Р и не более 0,07% S. Чугун, предназначенный'для получения отливок, называется литейным чугуном, В доменных печах выплавляются также ферросплавы, применяемые преимущественно в производстве сталей в качестве добавок. Ферросплавы имеют, по сравнению с передельным чугуном, повышенное содержание кремния (ферросилиций), марганца (ферромарганец), хрома (феррохром) и других элементов.
Стали
. Все стали делятся на углеродистые и легированные.
Углеродистые стали содержат в несколько раз меньше углерода, кремния и марганца, чем чугун, а фосфора и серы совсем мало. Свойства углеродистой стали зависят прежде всего от содержания в ней углерода: чем больше в стали углерода, тем она твёрже. Промышленность производит мягкие стали, стали средней твёрдости и твёрдые. Мягкие стали и стали средней твёрдости применяются для изготовления деталей машин, труб, болтов, гвоздей и т. д., а твёрдые стали—для изготовления инструментов.
В сталях должно быть возможно меньше серы и фосфора, так как эти примеси ухудшают механические свойства сталей. В повышенных количествах сера вызывает красноломкость — образование трещин при горячей механической обработке металла. Фосфор вызывает хладноломкость—хрупкость стали при обыкновенной температуре. -
Легированные стали.
Физические, химические и механические свойства сталей существенно изменяются от введения в их состав повышенного количества марганца и кремния, а также хрома, никеля, вольфрама и других элементов. Эти элементы называются легирующими, а стали — легированными [от латинского слова ligare – связывать, соединять].
Наиболее широко в качестве легирующего элемента применяется хром. Особенно большое значение для сооружения машин, аппаратов и многих деталей машин имеют хромоникелевые
стали. Эти стали обладают высокой пластичностью, прочностью, жаростойкостью и стойкостью к действию окислителей. Азотная кислота любой концентрации не разрушает их даже при температурах кипения. Хромоникелевые стали не ржавеют в атмосферных условиях и в воде. Блестящие, серебристого цвета, листы хромоникелевой стали украшают арки станции «Маяковская» Московского метро. Из этой же стали делают нержавеющие ножи, ложки, вилки и другие предметы домашнего обихода.
Молибден и ванадий повышают твёрдость и прочность сталей при повышенных температурах и давлениях. Так, хромомолибденовые
и хромованадиевые
стали применяются для изготовления трубопроводов и деталей компрессоров в производстве синтетического аммиака, авиационных моторов.
При резании с большой скоростью инструмент сильно разогревается и быстро изнашивается. При добавлении вольфрама твёрдость стали сохраняется и при повышенных температурах. Поэтому хромовольфрамовые стали применяются для изготовления режущих инструментов, работающих при больших скоростях '
Увеличение содержания в стали марганца повышает её сопротивление трению и удару. Марганцовистые стали применяются для изготовления железнодорожных скатов, стрелок, крестовин, камнедробильных машин.
Применение легированных сталей позволяет значигельно снизить вес металлических конструкций, повысить их прочность, долговечность и надёжность в эксплуатации.
Билет №22.
Высшие кислородосодержащие кислоты химических элементов третьего периода, их состав и сравнительная характеристика свойств.
Фосфор образует целый ряд кислородсодержащих кислот (оксокислот). Некоторые из них мономерны. например фосфиновая, фосфористая и фосфорная(V) (ортофосфорная) кислоты. Кислоты фосфора могут быть одноосновными (однопротонными) либо многоосновными (многопротонными). Кроме того, фосфор образует еще полимерные оксокислоты. Такие кислоты могут иметь ациклическое либо циклическое строение. Например, дифосфорная(V) (пирофосфорная) кислота представляет собой димерную оксокислоту фосфора.
Наиболее важной из всех этих кислот является фосфорная(V) кислота (другое ее название - ортофосфорная кислота). При нормальных условиях она представляет собой белое кристаллическое вещество, расплывающееся при поглощении влаги из воздуха. Ее 85%-ный водный раствор называют «сиропообразной фосфорной кислотой». Фосфорнця(V) кислота является слабой трехосновной кислотой:
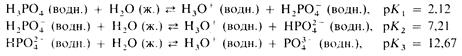
Хлор образует несколько кислородсодержащих кислот. Чем выше степень окисления хлора в этих кислотах, тем выше их термическая устойчивость и сила кислоты:
НОCl < НСlO2
< НСlO3
< НClO4
НClO3
и НClO4
– сильные кислоты, причем НСlO4
– одна из самых сильных среди всех известных кислот. Остальные две кислоты лишь частично диссоциируют в воде и существуют в водном растворе преимущественно в молекулярной форме. Среди кислородсодержащих кислот хлора только НСlO4
удается выделить в свободном виде. Остальные кислоты существуют только в растворе.
Окислительная способность кислородсодержащих кислот хлора уменьшается с возрастанием его степени окисления:
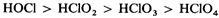
НОСl и НClO2
– особенно хорошие окислители. Например, кислый раствор НОCl:
1) окисляет ионы железа (II) до ионов железа (III):
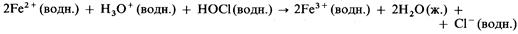
2) на солнечном свету разлагается с образованием кислорода:
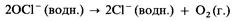
3) при нагревании приблизительно до 75 °С он диспропорционирует на хлорид-ионы и хлорат (V)-ионы:
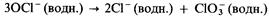
Остальные высшие кислотсодержащие кислоты элементов третьего периода (H3
AlO3
, H2
SiO3
) более слабые, чем фосфорная кислота. Серная кислота (H2
SO4
) менее сильнае, чем хлорная (VII) кислота, но более сильная, чем фосфорная кислота. Вообще, при увеличении степени окисления элемента, образующего кислоту, увеличивается сила самой кислоты:
H3
AlO3
< H2
SiO3
< H3
PO4
< H2
SO4
< НСlO4
Билет №23.
Общие способы получения металлов.
Металлы находятся в природе преимущественно в виде соединений. Только металлы с малой химической активностью (благородные металлы) встречаются в природе в свободном состоянии (платиновые металлы, золото, медь, серебро, ртуть). Из конструкционных металлов в достаточном количестве имеются в природе в виде соединений лишь железо, алюминий, магний. Они образуют мощные залежи месторождений относительно богатых руд. Это облегчает их добычу в больших масштабах.
Поскольку металлы в соединениях находятся в окисленном состоянии (имеют положительную степень окисления), то получение их в свободном состоянии сводится к процессу восстановления:

Этот процесс можно осуществить химическим или электрохимическим путем.
При химическом восстановлении в качестве восстановителя чаще всего применяют уголь или оксид углерода (II), а также водород, активные металлы, кремний. С помощью оксида углерода (II) получают железо (в доменном процессе), многие цветные металлы (олово, свинец, цинк и др.):
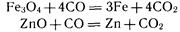
Восстановление водородом используется, например, для получения вольфрама из оксида вольфрама (VI):
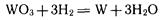
Применение в качестве восстановителя водорода обеспечивает наибольшую чистоту получаемого металла. Водород используют для получения очень чистого железа, меди, никеля и других металлов.
Способ получения металлов, в котором в качестве восстановителя применяют металлы, называют металлотермическим
. В этом способе в качестве восстановителя используют активные металлы. Примеры металлотермических реакций:
алюминотермия:
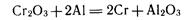
магниетермия:
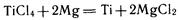
Металлотермические опыты получения металлов впервые осуществил русский ученый Н. Н. Бекетов в XIX в.
Металлы наиболее часто получают восстановлением их оксидов, которые в свою очередь выделяют из соответствующей природной руды. Если исходной рудой являются сульфидные минералы, то последние подвергают окислительному обжигу например:
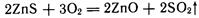
Электрохимическое получение металлов осуществляется при электролизе расплавов соответствующих соединений. Таким путем получают наиболее активные металлы, щелочные и щелочноземельные металлы, алюминий, магний.
Электрохимическое восстановление применяют также для рафинирования
(очистки) «сырых» металлов (меди, никеля, цинка и др.), полученных другими способами. При электролитическом рафинировании в качестве анода используют «черновой» (с примесями) металл, в качестве электролита — раствор соединений данного металла.
Способы получения металлов, осуществляемые при высоких температурах, называют пирометаллургическими
(по-гречески pyr — огонь). Многие из этих способов известны с древних времен. На рубеже XIX—XX вв. начинают развиваться гидрометаллургические
способы получения металлов (по-гречески hydor—вода). При этих способах компоненты руды переводят в водный раствор и далее выделяют металл электролитическим или химическим восстановлением. Так получают, например, медь. Медную руду, содержащую оксид меди (II) CuО, обрабатывают разбавленной серной кислотой:
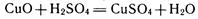
Для восстановления меди полученный раствор сульфата меди (II) либо подвергают электролизу, либо действуют на раствор порошком железа.
Гидрометаллургический способ имеет большое будущее, так как позволяет получать продукт, не извлекая руду из земли. (Сравните достоинства гидрометаллургического способа получения металлов с подземной газификацией угля.)
|