| Содержание.
- Введение ––––––––––––––––3
- Окисление ––––––––––––––– 4-11
- Хлорирование –––––––––– 4-7
- Кислородом –––––––––––– 7-9
- Озонирование –––––––––– 9-11
- Нейтрализация ––––––––––––– 11-15
- Восстановление –––––––––––– 15 – 18
- Электрохимические методы ––– 18-26
- Электроокисление –––– 21
- Элетровосстановление ––-– 23
- Электродиализ ––––––– 24-26
- Выводы -–––––––––––––––––––––26
- Дополнительные материалы –––– 27-30
- Литература -–––––––––––– 31
Качество сточных вод, образующихся на промышленных предприятиях, и концентрация в них загрязняющих веществ (ЗВ) определяется технологией производства и видом используемого исходного сырья, возможностью утилизации отходов, удельным расходом воды на единицу продукции. Выбор подходящего метода очистки необходимо осуществлять, исходя из качественно-количественных показателей состава загрязнённой воды и гигиенических требований. Среди разнообразных методов предпочтение отдаётся наиболее эффективным и дешёвым с низкой энергоёмкостью, используя доступные вещества.
Химические и электрохимические методы применяются для очистки СВ предприятий от токсичных веществ (на локальных очистных и общезаводских сооружениях) (возможно в совокупности с другими методами) например, перед сбросом в канализацию (т.е. дальше вместе с бытовыми СВ на городские очистные сооружения). Также эти методы могут использоваться на городских очистных сооружениях после биологической очистки (т.е. как доочистка) перед сбросом воды в поверхностные водоёмы. Несмотря на то, что эти методы эффективны при обезвреживании токсичных соединений, обеззараживании, доочистке от УВ, ПАВ и т.д., их целесообразно применять с другими методами (механическими, физико-химическими) из-за высокой стоимости, а также для достижения высокой степени очистки. Ещё химические методы используются для обеззараживания воды, например, при заборе воды из водохранилищ для коммунально-бытовых нужд (водопроводная вода).
К данным методам относятся:
· Окисление
· Восстановление
· Нейтрализация
· Электроокисление
· Электровосстановление
· Электродиализ
Тот или иной метод применяется в зависимости от состава СВ, объёма, а также стоимости очистки.
Реклама

Дальше постараюсь в общем описать принципы работы данных способов и привести примеры их использования.
Окисление.
Очистка производственных СВ. Метод применяют для окисления HCN,цианидов, H2
S, HS-
метилмеркаптана, хлорпроизводных органических в-в, фенолов, ПАВ, нефти.
Важным моментом является выбор окислителя. Ниже приведены основные окислители и значения окислительно-восстановительного потенциала. Как правило, чем больше E0
, тем эффективней окислитель:
Cl2
E0
=1,36 (B)
HClO 1,50 (pH<7) ; 0,88 (pH>=7)
ClO4
-
1,38 ; 0,56
O3
2,07
H2
O2
1,77 ; 0,88
MnO4
-
1,7-1,5 ; 0,57
FeO4
2-
2,20 ; 0,72
CH3
COOOH 1,8
Самые распространённые, дешёвые и простые – кислородом воздуха и хлорированием.
Хлорирование.
Для обезвреживания цианидов согласно СНиП 2.04.03-85 применяют окисление реагентами, содержащими активный хлор:
Cl2
+ H2
O=>HCl + HClO
HClO = H+
+ ClO-
К таким реагентам относятся жидкий хлор, хлорная известь, гипохлориты Са и Na. Чаще всего используют NaClO, обеспечивающий наибольшую технологическую безопасность процесса. Водный р-р NaClO выпускают в промышленном масштабе С=180-200 г/л. Вследствие гидролиза раствор имеет щелочную реакцию:
NaClO+ H2
O= HClO + Na+
+ OH -
При pH=6-8 в растворе присутствуют HClO и ClO -
в соизмеримых кол-вах, идёт р-я диспропорционирования:
2HClO + ClO-
=> ClO3
-
+2Cl -
+ 2H +
При Т>70° С реакция становится преобладающей.
Цианиды переходят в цианаты:
CN -
+ ClO-
=> CNO -
+ Cl -
Последние быстро подвергаются гидролизу:
CNO -
+2H2
O => HCO3
-
+ NH3
Аммиак окисляется до азота:
2NH3
+ 2ClO-
=> N2
+ 2H2
O + 2HCl
Суммарная реакция:
2CN-
+ 5 ClO-
+ H2
O => 5Cl -
+2 HCO3
-
+ N2
+ Q
Чтобы избежать перегрева, концентрацию циансодержащего раствора подбирают, чтобы она не превышала 10,6 г/л по CN-
(20 г/л NaCN). Вследствие гидролиза такой раствор имеет щелочную среду pH≈11,2. Обезвреженный раствор pH≈8,7. При pH<9,2 возникает опасность образования хлорциана при взаимодействии цианидов с оксидом хлора (Cl2
O), образующимся по реакции разложения хлорноватистой кислоты.
CN-
+Cl2
O = ClCN + ClO-
Образование хлорциана легко обнаруживается по слезоточивому действию. Начальная раздражающая С 0,002 мг/л.
Чтобы этого избежать, в раствор необходимо добавлять щёлочь.
2СN+5ClO-
+2OH-
=> CO3
2-
+N2
+5Cl-
+H2
O+Q
2NaCN+5NaClO+2NaOH=>2Na2
CO3
+N2
+5NaCl+H2
O
Реклама

Q=1815,83 кДж/моль
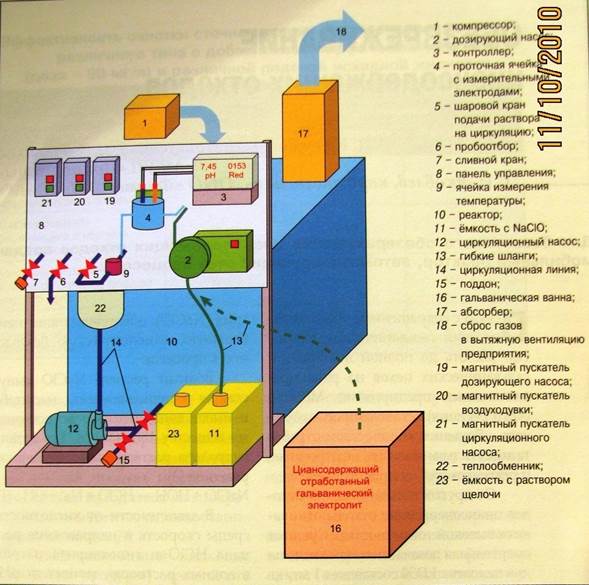
На рисунке представлен общий вид мобильной установки по обезвреживанию цианидов, в которой проходят вышеперечисленные реакции. Основа установки – реактор 10 из толстостенного полиэтилена V≈0,6-1 м3
. Циансодержащий раствор из ёмкости 16 и раствор гипохлорита из 11 по шлангам 13 насосом 2 подаются в реактор. Выполнение условий для оптимального протекания процесса определяется в проточной ячейке с измерительными электродами 4, соединённой с контроллером 3. Последний даёт команды насосу для подачи растворов цианидов, а также расчётного количества гипохлорита из ёмкости 11 и щёлочи из 23 для поддержания pH≈11. Система циркуляции раствора обеспечивает поддержание Т не более 70° С. Это достигается засчёт наличия ячейки измерения Т 9, передающей показания на контроллер, с которого команды поступают на шаровой кран 5 для подачи раствора на циркуляцию, которая осуществляется с помощью насоса 12 через теплообменник 22. Выделяющиеся газы через абсорбер 17 в системы вентиляции 18. По завершении через пробоотборник 6 отбирается проба для анализа на отсутствие цианидов в растворе.
Рис.1 Пример установки (опытная, мобильная) по обезвреживанию СВ от цианидов.
При хлорировании воды с последующей сорбцией на активном угле происходит удаление аммонийного азота. При хлорировании воды, содержащей аммонийный азот, в зависимости от рН, соотношения дозы активного хлора и концентрации аммонийного азота образуется смесь монохлораминов, дихлораминов, треххлористого азота, сорбируемых при фильтрации активным углем, и молекулярного азота, уходящего в атмосферу.
Недостатком способа является увеличение концентрации хлоридов в очищенной воде, особенно при обработке сточных вод с относительно высокой концентрацией аммонийного азота; преимуществом - увеличение срока службы угля до замены или регенерации за счет окисления органических веществ хлором на пористой поверхности угля, более высокая степень очистки от органических веществ, полное обеззараживание воды, удаление аммонийного азота с превращением в молекулярный азот, уходящий в атмосферу.
Окисление О2
воздуха под давлением.
Крупнотоннажным отходом нефтеперерабатывающей и химической промышленности являются сернисто-щелочные стоки. Они содержат сульфиды, гидросуьфиды, меркаптаны, фенолы и т.д. Их обезвреживают методом карбонизации и окисления О2
воздуха. При наличии в таких СВ заметного количества нафтеновых кислот их целесообразно выделять с последующей переработкой в мылонафт. Если количество СЩС невелико, то их можно подвергать биологической очистке. Сточные воды с высоким содержанием H2
S поступают в основном с установок первичной переработки, кат. крекинга, замедленного коксования, гидроочистки, гидрокрекинга. Наибольшее распространение в промышленности получил способ окисления в жидкой фазе кислородом под давлением. Окисление проходит последовательно:
S2-
- S0
– Sn
O6
2-
- S2
O3
2-
- SO3
2-
- SO4
2-
S2-
=> S2
O3
2-
; SO3
2-
2S2
-
+2O2
+H2
O => S2
O3
2
-
+ 2OH-
NaHS + CO2
+ H2
O = NaHCO3
+ H2
S
Скорость возрастает при использовании катализаторов. Известен способ локального обезвреживания СЩС, основанный на жидкофазном гетерогенно-каталитическом окислении кислородом воздуха при Т 60-90° С в присутствии полифталоцианина кобальта, нанесённого на полимерную основу. Сульфиды окисляются до тиосульфатов и сульфатов. Однако при высокой С(10000-20000 мг/л) сульфидов необходимо увеличивать расход воздуха, энергозатраты, продолжительность. Поэтому проводятся различные исследования по улучшению качества очистки. Например предварительная нейтрализация СЩС H2
SO4
(например, отработанной с установки кат. алкилирования). NaHS можно выделять как товарный продукт.
Очистку бензина прямой гонки от сернистых соединений традиционно проводят щелочью. Для этих целей используется 15-20 % раствор NaOH. В ходе очистки протекают реакции:
RSH + NaOH → RSNa + H2
O
НS-
+ NaOH → Na2
S + H2
O
CO2 + 2NaOH → Na2
CO3
+ H2
O
Натриевые соли кислых компонентов хорошо растворяются в воде и при расслаивании смеси щелочью – нефтепродукт переходят в водную фазу, которая и образует сернисто-щелочные стоки. Так как сульфид натрия является солью сильно основания и слабой кислоты, то в водном растворе он гидролизуется. В результате гидролиза в водном растворе будут находиться одновременно NaOH
, Na2
S
и NaНS
.
При рН = 7,0 – 13,75 основным продуктом окисления Na2S, NaНS, H2S является тиосульфат. В щелочной среде (рН = 9,0 – 9,5) протекают реакции с образованием сульфитов, сульфатов. При этом рН сточной воды понижается. При окислении в щелочной среде (рН = 12,15 – 12,75) сульфидов и гидросульфидов до сульфита и сульфата изменения рН сточной воды не происходит.
Повышение температуры и давления увеличивает скорость и глубину окисления сульфидов и гидросульфидов, не изменяя механизм реакции.
В случае применения катализаторов скорость окисления возрастает. Высокими каталитическими свойствами обладают графитовые материалы. При использовании кристаллического графита окисление гидросульфида и сульфида натрия идет в основном до тиосульфата, а при использовании коллоидно-дисперсных материалов – до элементарной серы. Исследования показали, что скорость окисления пропорциональна концентрации сульфидов. Скорость окисления сульфидов повышается с увеличением давления.
Обогащение необработанной воды кислородом является важным шагом в получении высококачественной питьевой воды (посредством удаления метана, железа (II), марганца (II), ионов аммония и т.д.). Концентрация кислорода в поступающей в распределительные трубопроводы воды свыше 6 мг/л обеспечивает надежную защиту от коррозии.
Парциальное давление чистого кислорода превышает это значение для воздуха, в результате концентрация кислорода в воде будет до 4,8 раз больше, чем при использовании воздуха. Обогащение воды чистым кислородом позволяет повысить эффективность протекания различных процессов и уменьшить затраты.
На примере фирмы:
Система SOLVOX® решает проблему дефицита кислорода посредством нагнетания в воду чистого кислорода. В зависимости от конкретных требований, кислород может нагнетаться с помощью форсунок (SOLVOX®-D) или реакторов (SOLVOX®-R) непосредственно в трубопровод перед фильтрами или перед распределительными трубопроводами.
- SOLVOX®-D: Нагнетание кислорода с помощью форсунки со сферической головкой.
- SOLVOX®-R: Встроенное или перепускное нагнетание кислорода с использованием реакторов из нержавеющей стали (значения расхода от 15 до 1000 м3 H2O/час).
Желаемое количество кислорода контролируется вручную или автоматически.
Преимущества использования кислорода вместо воздуха
- Высокий окислительный потенциал чистого кислорода
- Повышение производительности системы фильтрации
- Отсутствие нежелательного выделения азота в водопроводном кране
- Повышение качества питьевой воды
- Почти полное отсутствие воздействия очистки на двуокись углерода, таким образом, баланс извести / двуокиси углерода остается неизменным
- Улучшение вкуса
Озонирование.
При озонировании окисляются как растворенные, так и взвешенные органические вещества. Так как взвешенные вещества можно удалить более дешёвыми способами (механической очисткой, флотация…) для снижения расхода О3
озонирование применяют на завершающей стадии очистки СВ. Озон можно получать непосредственно на очистных сооружениях. Среди преимуществ также можно отметить высокую реакционною способность, бактерицидное действие (обеззараживающее) отсутствие в воде остатков озона. Поэтому О3
является перспективным методом.
Озонирование как метод глубокой очистки биологически очищенных городских сточных вод, несмотря на высокую себестоимость, является универсальным, так как оно позволяет одновременно снизить концентрацию загрязнений по ХПК на 40%, по БПК5
на 60-70%, содержание взвешенных веществ на 60%, ПАВ на 90%, фенолов на 40%, азота на 20%, канцерогенных веществ на 80%, а также снять окраску вод на 60% с одновременным обеззараживанием воды. Рекомендуемая доза О3
составляет 10-15 мг/л при времени его контакта с СВ 15 мин.
Совмещение озонирования с процессом удаления взвеси флотацией получило название озонофлотации. Озонофлотатор – аппарат, в который подаётся сточная вода, прошедшая реактор для растворения в ней озоновоздушной смеси. Одновременно в аппарате создаются условия образования мелких пузырьков озоновоздушной смеси, которые увлекают с собой взвесь и окисляют её при подъёме. Взвесь образует на поверхности жидкости флотопену, которая удаляется на обработку. Сбор флотопены с поверхности жидкости на практике осуществить сложно, и это является одним из препятствий для внедрения метода.
Обеззараживание; СВ, содержащие фенолы, циклопентан, тетраэтилсвинец, ПАВы, нефть и др.
Перед подачей на биологическую очистку. Переводит трудноокисляемые в биоразлагаемые в-ва.
ПАВ: например, алкиларилсульфонаты, алкилнафталинсульфонаты.
Скорость при фиксации веществ (при сорбции на Сакт
)
H2
S + O3
→ S + Н2
О + О2
3H2
S + O3
→ 3S + 3Н2
О
Пример озонатора ( для оборотной системы) на фото:
В комплект озонирующей установки (представлена модель «Озон-20ПВ-2Б-С», выпускаемая в период 2005 года) входит:
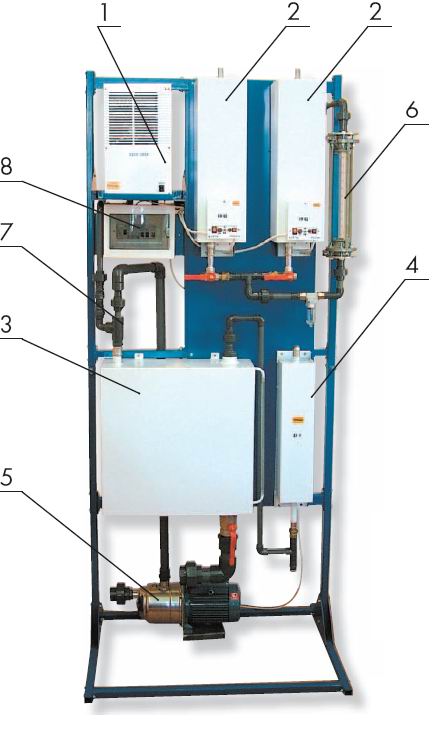
1 - Генератор озона, 2 - Осушитель воздуха,
3 - Контактно-смесительная камера, 4 - Деструктор озона, 5 - Насос, 6 - Ротаметр, 7 - Эжектор, 8 - Блок управления
Принцип работы станции (рис. внизу справа) основан на растворении озона в воде методом вакуумного эжектирования. Вода из емкости при помощи насоса подается на вход вакуумного эжектора. Вакуумное реле генератора замыкает цепь питания газоразрядного реактора и начинается выработка озона. Озоновоздушная смесь подсасывается эжектором и интенсивно перемешивается с потоком воды, проходящим через эжектор с большой скоростью. В результате вода насыщается мельчайшими пузырьками озоновоздушной смеси, а на поверхности раздела жидкой и газовой фаз начинается массоперенос газообразного озона в воду. Насыщенная озоном вода поступает обратно в емкость через специальные смесительные насадки - турбо-миксеры.
ORP-контроллер непрерывно контролирует значение окислительно-восстановительного потенциала в емкости. При достижении заданного верхнего порога значения потенциала по сигналу контроллера насос отключается и поступление озона в воду прекращается. При последующем снижении величины потенциала до нижнего порогового значения потенциала по сигналу контроллера насос включается и процесс озонирования воды возобновляется.Поддержание уровня воды в емкости происходит автоматически.
 Рис. - установка с аналогичным принципом работы: Рис. - установка с аналогичным принципом работы:
Нейтрализация.
Этот метод позволяет предотвратить коррозию водоотводящих сетей и очистных сооружений, нарушение биохимических процессов в биологических окислителях и водоёмах.
Для нейтрализации кислых сточных вод применяют взаимную нейтрализацию кислых и щелочных сточных вод, обработку известковым молоком. При небольших объёмах кислой воды эффективно фильтрование через фильтрующие материалы (известняк, мел, доломит, магнезит и т.п.). В результате нейтрализации СВ образуются нерастворимые и плохо растворимые соли Са, которые могут отложиться на стенках оборудования. Поэтому необходима периодическая очистка открытых желобов и кратковременная промывка трубопроводов чистой водой.
Автоматические нейтрализационные установки для создания нейтральной среды в промышленных сточных водах/отработанных технологических растворах
Описание принципа работы установки по нейтрализации сточных вод (рис. внизу)
Щелочные и кислые промывные сточные воды или отработанные технологические растворы, собираются в буферную ёмкость. Если растворы сильно загрязнены крупным мусором, то перед буферной ёмкостью устанавливается отстойник для того, чтобы осадить твердые частицы.
Из буферной ёмкости промывные сточные воды/отработанные растворы непрерывно поступают в реактор-нейтрализатор — SPLIT-O-MAT® NOM, с помощью насоса, работа которого регулируется в зависимости от уровня раствора в реакторе. Раствор автоматически нейтрализируется реагентами до необходимого значения pH. Установка оборудована мешалкой, которая позволяет получить эффективное гидродинамическое перемешивание растворов с нейтрализующими реагентами.
Достижение нужного значения pH контролируется автоматически (измерение и регистрация) также установкой SPLIT-O-MAT® NOM. Всякий раз, когда значение pH становится выше или ниже заданных параметров, подающий насос включается в работу.

Нейтрализация щелочных стоков.
В настоящее время приняты более строгие законы по охране окружающей среды, и власти чаще проводят проверки их выполнения, что отражает озабоченность общества этими вопросами.
В связи с этим сточные воды разрешается сбрасывать в канализационные системы только в том случае, если значение pH для них не превышает законодательно установленных значений.
Двуокись углерода все шире используется для нейтрализации щелочных сточных вод. При растворении двуокиси углерода в воде образуется угольная кислота. Применение двуокиси углерода обладает многими преимуществами по сравнению с использованием минеральных кислот, при этом предотвращается избыточное накопление таких солей, как хлориды, сульфаты и т.д. Кроме того, благодаря пологой кривой нейтрализации с помощью двуокиси углерода, оказывается практически невозможным избыточное подкисление сточных вод.
Двуокись углерода также намного безопаснее в использовании, чем очень едкие кислоты, в связи с этим почти полностью устраняются проблемы с коррозией.
На рисунке справа показана передвижная система нейтрализации компании Linde.
Щелочные сточные воды образуются в следующих отраслях промышленности:
- Производство напитков (мытье повторно используемых бутылок)
- Молочные заводы, бойни и мясоперерабатывающие заводы
- Хлебобулочная и кондитерская промышленность
- Нанесение гальванических покрытий (обработка поверхности металлов)
- Целлюлозно-бумажная промышленность
- Кожевенная промышленность
- Текстильная промышленность
- Предприятия химической чистки и крашения
- Производство цемента и бетона
- Фотохимическая промышленность и т.д.
- Строительная промышленность
Преимущества нейтрализации сточных вод с использованием CO2:
- Двуокись углерода является компонентом природной воды, а минеральные кислоты – нет
- Не требуется вносить плату за избыточные концентрации солей
- Увеличение срока службы вследствие уменьшения коррозии
- Отсутствие опасности слишком сильного подкисления
- Не требуется много места и не предъявляются высокие требования к персоналу
- Низкие затраты на техническое обслуживание
- Низкие затраты на эксплуатацию
Процесс SOLVOCARB® для впрыскивания двуокиси углерода в воду:
Двуокись углерода подается через аэрационные шланги с очень маленькими отверстиями
Двуокись углерода поступает через форсунки со сферическими головками
Двуокись углерода подается с помощью специальных реакторов.
Процесс SOLVOX® усиливает аэрацию посредством нагнетания в сточные воды чистого кислорода. Это существенно повышает эффективность действия установок очистки сточных вод.
Процесс SOLVOX® используется для нагнетания чистого кислорода в баки с активным илом
- SOLVOX®-B (Нагнетание кислорода с использованием перфорированных шлангов)
- SOLVOX®-I (Нагнетание кислорода с использованием систем форсунок)
- SOLVOX®-R (Нагнетание кислорода с использованием реакторов)
На фото - форсунка SOLVOX®-I:

Таким образом нейтрализацию можно разделить на 3 основных способа:
· Взаимная нейтрализация щелочных и кислых сточных вод
· Реагентная очистка
· Нейтрализация кислыми газами (CO2 ,
NO2
)
В условиях НПЗ могут быть взаимно нейтрализованы сточные воды, содержащие кислоту и щёлочь. Позволяет предотвратить коррозию водоотводящих сетей и очистных сооружений.
Обработка р-ром Ca(OH)2
2CH3
(CH)x
COOH+ Ca(OH)2
= (CH3
(CH)x
COO)2
Ca+2H2
O
Фильтрующие материалы: CaCO3
известняк, доломит
CaCO3
.
MgCO3
, MgCO3
магнезит, алюмосиликаты, бетонитовые глины, цеолиты и др.
также бруситовая руда Mg(OH)2
для нейтрализации кислых СВ, удаления тяжёлых Ме
схема блока реагентной нейтрализации на предприятиях гальванического производства:

Восстановление.
Данный метод используется для очистки СВ от тяжёлых металлов (катионов, которые токсичней, чем комплексные формы и гидратированные ионы).
Полноценное извлечение ионов тяжёлых металлов из сточных вод и отработанных технологических растворов объясняется не только необходимостью защиты ОС, но и ценностью самих металлов.
Технологическая схема очистки хромсодержащих сточных вод приведена на рис. 2.1(в дополнительны материалах). Очистка хромсодержащих стоков осуществляется в две ступени. Хромсодержащие сточные воды самотеком поступают на усреднитель У, откуда насосами подаются в реакторы Р1 и Р2, установленные на первом этаже станции. Первая ступень – восстановление шестивалентного хрома до трехвалентного бисульфитом аммония (при добавлении серной кислоты) в кислой среде при рН= 2.5:
4CrO3
+ 6NH4
HSO3
+ 3H2
O = 2Cr2
(SO4
)3
+ 3(NH4
)2
SO4
+ 6H2
O
Процесс автоматизирован: при наполнении бака и подаче сжатого воздуха, по сигналу датчика рН-метра (в настоящее время рН измеряется вручную) открывается вентиль подачи кислоты. При рН=2.5 вентиль закрывается. По сигналу датчика, сигнализирующего наличие хрома (VI) в баке, открывается вентиль подачи бисульфита аммония. Реакция идет при перемешивании (мешалкой), цикл составляет 45 мин. При концентрации хрома (VI) в баке равной 0.1 мг/л, вентиль закрывается и сток со станции очистки самотеком поступает в приемную камеру насосной станции, где происходит предварительное его смешение с кисло-щелочными стоками.
Вторая ступень – перевод ионов трехвалентного хрома в гидроксид хрома с последующим его осаждением. Из реакторов сточная вода поступает в камеру реакции и смешения К, куда после смешения с кисло-щелочными и циансодержащими сточными водами и 15-ти минутного перемешивания воздухом подается известковое молоко (при рН стока не меньше 8.5):
 Cr 2
(SO4
)3
+ 3Ca(OH)2
= 2Cr(OH)3
+ 3CaSО4 Cr 2
(SO4
)3
+ 3Ca(OH)2
= 2Cr(OH)3
+ 3CaSО4
Обезвреженные сточные воды из камеры смешения и реакциии самотеком поступают в отстойник О, куда для ускорения осаждения подается 0.1% раствор полиакриламида. После часового отстаивания вода поступают в горколлектор на доочистку, а осадок через донные клапаны насосом подается в шламоуплотнитель Ш. Шлам со шламоуплотнителя подается на фильтр-пресс ФП. Фильтрация идет до тех пор, пока не перестанет идти фильтрат, который подается обратно в камеру смешения и реакции. Отфильтрованный осадок легко отделяется от фильтроткани отдувкой воздухом и выгружается машинистами в поддоны, а затем увозят автопогрузчиком (см. рис. 2.1.) [69,70]. Количество шлама около 7 - 8 т/сут. Состав основного оборудования для очистки сточных вод станции нейтрализации площадки «А» приведен в табл. 2.2. Показатели очистки хромсодержащих сточных вод приведены в табл. 2.3:
Таблица 2.3.
Показатели очистки хромсодержащих сточных вод по
технологической схеме (рис 2.1).
| Наименование
|
Единицы
|
До
очистки
|
После
очистки
|
ПДК
|
Степень
очистки,%
|
| pH
|
-
|
2.0
|
8.0
|
|
|
| Сухой остаток
|
мг/л
|
820.5
|
70.9
|
1000
|
91.4
|
| Цианиды
|
мг/л
|
0.2
|
0 .00005
|
0.28
|
98.9
|
| Хром (VI)
|
мг/л
|
94.2
|
0.00008
|
0.14
|
98.9
|
| Хром (III)
|
мг/л
|
16.3
|
0.32
|
0.5
|
98.0
|
| Железо
|
мг/л
|
0.3
|
0.2
|
0.736
|
50.0
|
| Цинк
|
мг/л
|
175.5
|
0.45
|
0.079
|
98.7
|
| Медь
|
мг/л
|
8.5
|
0.21
|
0.05
|
97.5
|
| Никель
|
мг/л
|
5.7
|
0.086
|
0.09
|
98.5
|
| Кадмий
|
мг/л
|
не обн.
|
-
|
0.021
|
-
|
| Нефтепродукты
|
мг/л
|
1.0
|
1.0
|
0.69
|
0
|
Электрохимические методы.
В настоящее время электрохимические методы выделения тяжелых цветных металлов из сточных вод гальванопроизводства находят все более широкое применение. К ним относятся процессы анодного окисления и катодного восстановления, электрокоагуляции, электрофлокуляции и электродиализа [6, 13 - 15]. Все эти процессы протекают на электродах при пропускании через раствор постоянного электрического тока.
Проведенные исследования по очистке сточных вод гальванического производства в условиях электрохимической неравновесности установили, что восстановительные процессы в сточых водах протекают при взаимодействии сольватированных электронов с гидратированными и связанными в комплексные соединения ионами металлов. Показано, что содержание Zn,Cu,Cd,Mo,Co в сточных водах после обработки в условиях электрохимической неравномерности не превышает, а в ряде случаев значительно ниже ПДК
Метод электрокоагуляции
Метод наиболее пригоден для выделения хрома. Сущность метода заключается в восстановлении Cr(VI) до Cr(III) в процессе электролиза с использованием растворимых стальных электродов. При прохождении растворов через межэлектродное пространство происходит электролиз воды, поляризация частиц, электрофорез, окислительно-восстановительные процессы, взаимодействие продуктов электролиза друг с другом.
Суть протекающих при этом процессов заключается в
следующем: при протекании постоянного электрического тока через хромсодержащие растворы гальваношламов, анод подвергается электролитическому растворению с образованием ионов Fe, которые, с одной стороны, являются эффективными восстановителями для ионов хрома (VI), с другой - коагулянтами:
 Cr 2
O7
2-
+ 6Fe 2+
6Fe 2+
+ 2Cr3+ Cr 2
O7
2-
+ 6Fe 2+
6Fe 2+
+ 2Cr3+
На катоде выделяется газообразный водород, что ведет к
выщелачиванию раствора и созданию таким образом условий для выделения гидроксидов примесных металлов, также происходит процесс электрохимического восстановления по реакциям:
 2H +
+ 2e H2 2H +
+ 2e H2
 Cr2
O7
2-
+ 14H +
2Cr 3+
+ 7H2
O Cr2
O7
2-
+ 14H +
2Cr 3+
+ 7H2
O
Находящиеся в растворе ионы Fe +3
, Fe 2+
,Cr+3
гидратируют с образованием гидроксидов Fe(OH)3
,Fe(OH)2
,Cr(OH)3
. Образующиеся гидроксиды железа являются хорошими коллекторами для осаждения гидроксидов примесных металлов и адсорбентами для других металлов.
Электрокоагуляторы внедрены на ряде предприятий. Разработчики: электрокоагуляционная установка (ЦНТИ, Петропавловск-Камчатский); установка “Лоста” (НИЦ “Потенциал”, Ровно); напорный электрокоагулятор “Эко” (трест “Цветводоочистка”, Екатеринбург); электрокоагулятор (НИИ “Стрела”, Тула); электрокоагулятор (ЦНИИСТ, Севастополь),ОАО “Диод” (Владимир) и др.
Электрокоагуляционная установка на ОАО “Диод” состоит из трехсекционной гальванической ванны, выпрямителя ВАКР-1600-12У4 и промежуточной емкости с двумя насосами для откачки обезвреженных стоков на отстойник. По мере пропускания постоянного тока через сточные воды в электролизной ванне в железными электродами происходит анодое растворение электродов, образующиеся при этом ионы 2-х валентного железа восстанавливают ионы хрома шестивалентного до трехвалентного. Одновременно происходит гидролиз ионов железа и вторичных соединений с образованием нерастворимых гидроксидов Fe(OH)2
,Fe(OH)3
,Cr(OH)3
и др. Процесс является неперерывным, под напряжением 12В и плотности тока 0.5 – 1 А/дм2
. Фильтрация сточной воды производится на нутч-фильтре.
Достоинства метода
1) Очистка до требований ПДК от соединений Cr (VI).
2) Высокая производительность.
3) Простота эксплуатации.
4) Малые занимаемые площади.
5) Малая чувствительность к изменениям параметров
процесса.
6) Получение шлама с хорошими структурно-механическими
свойствами.
Недостатки метода
1) Не достигается ПДК при сбросе в водоемы рыбохозяйственного назначения.
2) Значительный расход электроэнергии.
3) Значительный расход металлических растворимых
анодов.
4) Пассивация анодов.
5) Невозможность извлечения из шлама тяжелых
металлов из-за высокого содержания железа.
6) Невозможность возврата воды в оборотный цикл
из-за повышенного солесодержания.
7) Потребность в значительных площадях для шламоотвалов.
8) Необходимость предварительного разбавления стоков до
суммарной концентрации ионов тяжелых металлов 100 мг/л.
Электролиз. (окисление)
В процессах электрохимическое окисление протекает на положительном электроде - аноде, которому ионы отдают электроны. Вещества, находящиеся в сточных водах, полностью распадаются с образованием более простых и нетоксичных веществ, которые можно удалять другими методами. В качестве анодов используют различные электрически нерастворимые вещества: графит, магнетит, диоксиды свинца, марганца и рутения, которые наносят на титановую основу. Катоды изготавливают из молибдена, сплава железа с вольфрамом, сплава вольфрама с никелем, из графита, нержавеющей стали и других металлов, покрытых молибденом, вольфрамом или их сплавами. Метод используется на многих предприятиях.
Применению электролиза до последнего времени препятствовала низкая производительность аппаратов с плоскими электродами. Перспективы решения этой проблемы открылись с разработкой и внедрением в практику достаточно простых и надежных электролизеров с проточными объемно-пористыми волокнистыми электродами. Они позволяют ускорить процесс извлечения металлов более чем в 100 раз за счет высокой удельной поверхности и повышенного коэффициента массопередачи (до 0.05 – 0.1 м3
/с). Применяются и другие типы аппаратов с развитой электродной поверхностью, например псевдоожиженного типа, разрабатываемые в Киеве и Санкт-Петербурге.
Работы в этом направлении также требуют дальнейшего развития: поиск путей увеличения доступной электролизу внутренней поверхности электродов; оптимизация стадии регенерации осажденного металла и анодных процессов; разработка более компактных, дешевых и экономичных электролизеров, а также стойких и дешевых анодных материалов.
Разработаны электролизеры типа Э-ЭУК, Е-91А, ЭПУ (ВПТИЭМП), модуль - МОПВ (НИТИАП, Нижний Новгород), регенераторы (ЦМИ “Контакт”, Пермь).
В США разработана конструкция электролизера для извлечения тяжелых металлов, в котором однородный поток мельчайших пузырьков воздуха, направленный перпендикулярно поверхности катода, разрушает примыкающий к катоду диффузный слой электролита. Это резко улучшает массообмен в электролите и повышает выход по току. Также в США широко используется электролизер, оборудованный биполярными электродами из углеродистой стали. Расход электроэнергии составляет 10 кВт на 1 кг тяжелых металлов. При содержании тяжелых металлов более 50 мг/л электрохимическая обработка осуществляется в несколько стадий. Концентрация вредных примесей тяжелых металлов после очистки не превышает по каждому из них 0.05 мг/л.
В Днепропетровском химико-технологическом институте предложено сточные воды обрабатывать в электролизере с растворимым анодом из пористого титана в присутствии замещенного амида иминосульфиновой кислоты формулы C6
H5
S(=NSO2
C6
H5
)NHSO2
C6
H5
.Размеры пор пористого титана 20 – 300 мкм, общая пористость 20 – 40 % .
Приведена схема одноступенчатой электролитической установки для удаления тяжелых металлов (удаление 90% металлических ионов) из сточных вод. В бездиафрагменном электролизере используются 2 насыпных катода, между которыми расположен пластинчатый анод. Катод состоит из гранул, изготовленных из материала, который плохо сцепляется с осаждаемыми металлами и поэтому осаждаемый металл выпадает на дно в виде порошка.
Достоинства метода
1) Отсутствие шлама.
2) Незначительный расход реагентов.
3) Простота эксплуатации.
4) Малые площади, занимаемые оборудованием.
5) Возможность извлечения металлов из концентрированных
стоков.
Недостатки метода
1) Не обеспечивает достижение ПДК при сбросе в водоемы рыбохозяйственного назначения.
2) Аноды из дефицитного материала.
3) Неэкономичность очистки разбавленных стоков
Метод гальванокоагуляции
Метод внедрен на ряде предприятий. Разработчики: “Гипроцветметобработка”, “Казмеханобр”. Изготовители: Востокмашзавод (Усть-Каменогорск), Бердичевский машиностроительный завод и др.
На предприятии “Казмеханобр” испытан
гальванокоагуляционный аппарат типа КБ-1 производительностью 50-100 м3
/сут для очистки сточных вод.
Достоинства метода
1) Очистка до требований ПДК от соединений Cr(VI).
2) В качестве реагента используются отходы железа.
3) Малая энергоемкость.
4) Низкие эксплуатационные затраты.
5) Значительное снижение концентрации сульфат-ионов.
6) Высокая скорость процесса
Недостатки метода
1) Не достигается ПДК при сбросе в водоемы рыбохозяйственного назначения.
2) Высокая трудоемкость при смене загрузки.
3) Необходимость больших избытков реагента (железа).
4) Большие количества осадка и сложность его
При электроокислении
сточные воды пропускаются через электролизер, в котором происходит электрохимическое окисление органических примесей на нерастворимом аноде. Например, фенол окисляется на аноде до оксида углерода и малеиновой кислоты:
С6
Н5
ОН + 7Н2
О - 16е = 2СО2
+ (СНСООН)2
+ 16Н+
Метод электрохимического восстановления
с применением нерастворимых электродов особенно эффективен для обезвреживания хромсодержащих сточных вод с большими концентрациями Cr6+ (более 2 г/литр). Катодное восстановление металлов происходит по схеме:
Men
+ne-
→ Me0
При этом металлы осаждаются на катоде и могут быть рекуперированы. При использовании метода электрохимического восстановления можно снизит концентрацию хрома в сточных водах на 3 порядка.
Наиболее широко для выделения металлов из промышленных сточных вод применяются следующие виды катодов:
Пористые, объемно-насыпные проточные, плоские пластины с инертной загрузкой
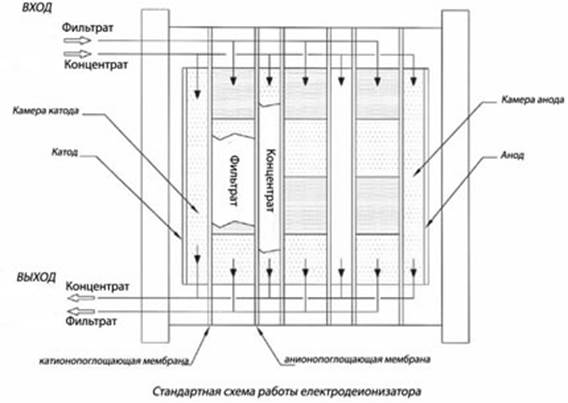
Электродиализ.
Процесс удаления из раствора ионов растворённых веществ путём избирательного их переноса через мембраны, селективные к этим ионам, в поле постоянного тока. Движущей силой процесса является градиент электрического потенциала.

На фото – установка.
 При наложении постоянного эл. поля на р-р возникает направленное движение ионов солей и Н+
и ОН-
. Катионы к катоду, анионы к аноду. Если р-р разделить на секции с помощью спец. мембран, проницаемых только для катионов или только для анионов, то катионы, например, будут свободно будут свободно проходить через эту катионитовую мембрану, т.о. р-р разделится на Н2
О и концентрированные р-ры. При использовании проницаемых для ионов неселективных мембран можно разделять электролиты и неэлектролиты. При наложении постоянного эл. поля на р-р возникает направленное движение ионов солей и Н+
и ОН-
. Катионы к катоду, анионы к аноду. Если р-р разделить на секции с помощью спец. мембран, проницаемых только для катионов или только для анионов, то катионы, например, будут свободно будут свободно проходить через эту катионитовую мембрану, т.о. р-р разделится на Н2
О и концентрированные р-ры. При использовании проницаемых для ионов неселективных мембран можно разделять электролиты и неэлектролиты.
Матрица анионообменной мембраны имеет катионные группы. Заряд катионов нейтрализован зарядом подвижных анионов, находящихся в порах мембраны. Анионы раствора электролита могут внедряться в матрицу мембраны и замещать первоначально присутствующие в ней анионы. Проникновению в мембрану катионов препятствуют силы отталкивания их фиксированными в матрице мембраны катионами.
На электродах протекает процесс электролиза. В многокамерном аппарате неизбежные непроизводительные затраты электроэнергии, обусловленные этим процессом, распределяются на большое число камер. Поэтому в расчете на единицу продукции эти затраты сводятся к минимуму.

Процесс электродиализа реже применяется в промышленности, чем процессы обратного осмоса и ультрафильтрации, так как применяя электродиализ возможно удалять из раствора только ионы. Наиболее широко электродиализные установки применяются для опреснения морской воды при получении питьевой и/или технической воды. Но чаще процесс электродиализа применяют для очистки воды, содержание растворенных солей в которой составляет примерно 10 г/л. В этом случае процесс электродиализа является более экономичным по сравнению с обратным осмосом или выпариванием. При помощи электродиализа можно получать растворы солей со сравнительно высокой концентрацией. Благодаря этой особенности рассматриваемого процесса электродиализ применяется также при производстве поваренной соли и других солей из морской воды. Электродиализ применяется также для предочистки воды для теплоэнергетических установок.
Применяется для обессоливания сточных вод гальванического производств (гальванических стоков). Также мембранный электролиз используется для концентрирования сточных вод, содержащих ценные компоненты (например, драгоценные металлы), перед последующим извлечением этих компонентов. По сравнению с обратным осмосом электродиализ имеет то преимущество, что позволяет использовать термически и химически более стойкие мембраны, поэтому процесс электродиализа может осуществляться при повышенных температурах, а также при очень малых или наоборот больших значениях pH раствора. Ограничением в применении электродиализа для очистки стоков гальванического производства является невозможность удалить незаряженные компоненты, которые также присутствуют в сточных водах.
Общая схема:
Выводы.
В результате анализа научно-технической и патентной литературы становится очевидно, что не существует универсального, т.е. эффективного и дешевого метода очистки промышленных сточных вод.
Наиболее широко применяемый реагентный метод, достаточно прост и дешев, однако не решает проблему утилизации ценных компонентов, которые безвозвратно теряются с осадками. В результате чего почвы загрязняются токсичными шламами. Кроме того, метод не обеспечивает необходимого качества очистки сточных вод, предполагая направлять стоки на доочистку в городской коллектор, причиняя немалый ущерб окружающей среде и подрывая бюджет предприятия.
ХПК и БПК.
ХПК – 1) выражает количество кислорода, необходимое для полного химического окисления органических веществ загрязнений в СВ, мг/л. «Сhemical oxyden demand» (COD)
Присутствующие в воде органические соединения могут претерпевать не только аэробное биохимическое окисление в результате жизнедеятельности бактерий, используемое при определении БПК. При наличии в пробе воды сильных окислителей и соответствующих условий протекают химические реакции окисления органических веществ, причем характеристикой процесса химического окисления, а также мерой содержания в пробе органических веществ является потребление в реакции кислорода, химически связанного в окислителях. Показатель, характеризующий суммарное содержание в воде органических веществ по количеству израсходованного на окисление химически связанного кислорода, называется химическим потреблением кислорода (ХПК)
.
БПК – количество кислорода в миллиграммах, требуемое для окисления находящихся в 1 л воды органических веществ в аэробных условиях, без доступа света, при 20°С, за определенный период в результате протекающих в воде биохимических процессов.
БПК - количество кислорода, необходимое для окисления органических веществ в естественных условиях до полной их минерализации.
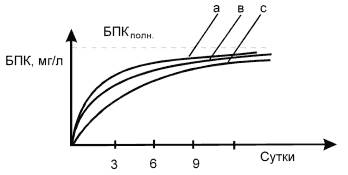

Особенностью биохимического окисления органических веществ в воде является сопутствующий ему процесс нитрификации, искажающий характер потребления кислорода
Нитрификация протекает под воздействием особых нитрифицирующих бактерий – Nitrozomonas, Nitrobacter и др. Эти бактерии обеспечивают окисление азотсодержащих соединений, которые обычно присутствуют в загрязненных природных и некоторых сточных водах, и тем самым способствуют превращению азота сначала из аммонийной в нитритную, а затем и нитратную формы. Соответствующие процессы описываются уравнениями:
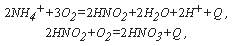
где: Q – энергия, высвобождающаяся при реакциях.
Рекомендуемые реагенты при реагентной очистке и количества:
| |
|
|
|
Доза реагента, мг/л
|
| Сточные воды
|
Загрязняющие вещества
|
Концентрация загряз- няющих веществ, мг/л
|
Реагенты
|
извес-ти
|
солей алюми- ния
|
солей железа
|
анионного флокулянта по активному полимеру
|
катионного флокулянта по активному полимеру
|
| Нефтеперерабаты- вающих заводов,
|
Нефтепро- дукты
|
До 100
|
Соли Al совместно
|
-
|
50-75
|
-
|
0,5
|
2,5-5
|
| нефтеперевалоч-
|
|
100-200
|
с анионным
|
-
|
75-100
|
-
|
1,0
|
5-10
|
| ных баз
|
|
200-300
|
флокулянтом
или без, катионные флокулянты
|
-
|
100-150
|
-
|
1,5
|
10-15
|
| Машиностроитель- ных, коксохими- ческих заводов
|
Масла
|
До 600
|
Соли Al или Fe с анионным флоку- лянтом или без, катионные флокулянты
|
-
|
50-300
|
50-300
|
0,5-2
|
5-20
|
| Пищевой промыш-
|
Эмульсии
|
100
|
Соли Al
|
-
|
150
|
150
|
-
|
-
|
| ленности, шерсто- мойных фабрик,
|
масел
и жиров
|
300
|
или Fe совместно
|
-
|
300
|
300
|
0,5-3
|
-
|
| заводов металло- обрабатывающих,
|
|
500
|
с анионным флокулянтом
|
-
|
500
|
500
|
0,5-3
|
-
|
| синтетических во- локон
|
|
1000
|
или без него
|
-
|
700
|
700
|
0,5-3
|
-
|
| Целлюлозно-бу-
|
Цветность
|
950
|
То же
|
-
|
250
|
250
|
-
|
-
|
| мажной промыш-
|
(сульфатный
|
1450
|
|
-
|
275
|
275
|
-
|
-
|
| ленности
|
лигнин),
|
2250
|
|
-
|
400-500
|
400-500
|
-
|
-
|
| |
град ПКШ
|
|
|
|
|
|
|
|
| |
Цветность
|
1000
|
Известь СаО
|
1000
|
-
|
-
|
-
|
-
|
| |
(лигносуль-
|
2000
|
|
2500
|
-
|
-
|
-
|
-
|
| |
фат),
|
|
|
|
|
|
|
|
| |
град ПКШ
|
|
|
|
|
|
|
|
| Шламовые воды
|
Суспензия
|
До 100
|
Анионный флоку-
|
-
|
-
|
-
|
2-5
|
-
|
| углеобогатитель-
|
угольных
|
100-500
|
лянт
|
-
|
-
|
-
|
5-10
|
-
|
| ных фабрик, шахт-
|
частиц
|
500-1000
|
|
-
|
-
|
-
|
10-15
|
-
|
| ные воды
|
|
1000-2000
|
|
-
|
-
|
-
|
15-25
|
-
|
| Бумажных и кар- тонных фабрик
|
Суспензия целлюлозы
|
До 1000
|
Соли Al совместно
|
-
|
50-300
|
-
|
0,5-2
|
-
|
| |
|
|
с анионным флокулянтом
|
|
|
|
|
|
| |
|
|
Катионный флоку- лянт
|
-
|
-
|
-
|
-
|
2,5-20
|
| Городские и бы-
|
БПКполн
|
До 300
|
Соли Al
|
-
|
30-40*
|
-
|
0,5-1,0
|
-
|
| товые
|
|
|
совместно
с анионным флокулянтом
или без него
|
-
|
40-50*
|
-
|
-
|
-
|
| |
Взвешенные
|
До 350
|
Соли железа
|
-
|
-
|
40-50**
|
0,5-1,0
|
-
|
| |
вещества
|
|
совместно
с анионным флокулянтом
|
-
|
-
|
100-150***
|
0,5-1,0
|
-
|
| |
|
|
или без него
|
-
|
-
|
50-70***
|
-
|
-
|
| |
|
|
Катионный флоку- лянт
|
-
|
-
|
-
|
-
|
10-20
|
П р и м е ч а н и е. Дозы реагентов приведены по товарному продукту, флокулянтов - по активному полимеру, за исключением: * - по Аl2
О3
, ** - по FeSO4
, *** - по FeCl3
.
Более подробное описание катализаторов для окисления СЩС кислородом воздуха.
Предшествующее поколение катализаторов, применявшихся в процессе окисления сернистых соединений в жидких средах, представляло собой, как правило, гомогенные соединения, в состав которых входили высокотоксичные вещества, включающие мышьяк, хиноны, ионы тяжелых металлов, которые вызывали в свою очередь вторичное загрязнение очищаемой среды.
В настоящее наиболее перспективными для очистки сернисто-щелочных сточных вод специалисты считают гетерогенные катализаторы, в которых активной основой являются металлоорганические комплексы переменной валентности, а в качестве носителя выступает полиэтилен. Подобные катализаторы разрабатывают, в частности, в НПО «Катализ».
Синтез осуществляется путем иммобилизации металлоорганических комплексов переходных металлов, обратимо связывающих молекулярный кислород на поверхности полимера – полиэтилена, полипропилена, – которые регулируют силу поля лигандов и окислительно-восстановительный потенциал поверхности катализатора. При этом происходит закрепление на жесткой непористой поверхности полимера комплексов металлов переменной валентности, особенно первого переходного в низких степенях окисления – Mn (II), Fe (II), Co (II), Ni (II), Cu (II), которые способны в водных растворах проводить активацию координированного молекулярного кислорода, поставлять в реакционную среду супероксид-ионы – О2
- и О2-
или пероксид-ионы О2
2-
и обеспечивать тем самым окисление субстратов в кинетически выгодных условиях.
Важнейшей стадией окисления Н2
S и RSH является образование тройных комплексов [Kt… анионная форма субстрата (Аn-
) ...O2
], в которых происходит взаимная активация кислорода и субстрата по отношению друг к другу. Участие ионов металлов переменной валентности в координационной сфере катализатора делает возможным реализовать запрещенный по синтезу процесс прямого взаимодействия триплетного кислорода с молекулой субстрата, находящейся в основном в синглетном состоянии. Наблюдается реализация прямого двухэлектронного восстановления кислорода. Активность каталитической системы [Men+
...Аn-
...О2
] настолько велика, что кислород в этом случае выступает в качестве одного из самых активных окислителей.
Катализаторы на полимерном носителе отличаются хорошими техническими характеристиками: высокой каталитической активностью в широком интервале концентраций сернистых соединений при температуре процесса 60-90º С, механической прочностью, химической и гидролитической стойкостью, устойчивостью к каталитическим ядам, стабильность работы в течение 2-5 лет.
Полимерный катализатор имеет форму гранул неправильной формы размером 15-20 мм и размещается в колонне окисления секционно, выполняя, таким образом, роль насадки, способствующей интенсификации массообменного процесса. Каждая секция заполняется катализатором на 75% объема, что необходимо для свободного движения катализатора внутри секции в процессе работы. Процесс осуществляется в условиях «кипения» катализатора.
Для монтажа реактора окисления может быть использовано имеющееся резервное колонно-емкостное оборудование достаточной вместимости. которое удовлетворяет условиям ведения процесса. В результате эксплуатации промышленной установки не происходит увеличения скорости коррозии колонного оборудования ни в целом, ни в местах контакта металлических конструкций с катализатором.
Эффективность процесса по сероводороду составляет не менее 99-100%, по меркаптанам – 95-99%. При совместном присутствии сульфидов и меркаптанов снижения скорости окисления не наблюдается. Окисление проходит до нетоксичных сернистых соединений – тиосульфатов и сульфатов. Меркаптаны окисляются до сульфоксида и сульфоновых кислот. Отдувка сероводорода и меркаптанов отходящим воздухом при рН менее 9 составляет не более 0,5%, при рН более 9 – практически отсутствует.
Литература.
1. «Нормирование содержания вредных веществ в водных объектах и поступающих в них сточных водах», методическое пособие, РГУ, кафедра пром. безопасности, Л.В. Столярова 1999
2. «Очистка хозяйственно-бытовых сточных вод и обработка осадков» Афанасьева А.Ф. , Сирота М.Н., Савельева Л.С. , Эпов А.Н. 1997 изд. «Изограф»
3. «Сточные воды НПЗ и нефтепромыслов» под ред. Ю.Д. Лебедева, Т.Е. Нагибиной, И.Л. Монгайт, выпуск V, 1960 гос. изд. мед. лит.
4. «Экология нг комплекса» учебное пособие в 2 томах, Бухгалтер Э.Б., Мкртычан В.Р., Том 1 ; изд. «нефть и газ» 2003
5. «Технологии очистки сточных вод» РГУ, пособие, 1997, Е.А. Мазлова
6. «Канализация», V издание, С.В. Яковлев, Я. А Карелин, А. И. Жуков, С. К. Колобанов, Стройиздат; 1975, раздел: химическая очистка производственных сточных вод.
7. Орлов В.А. «Озонирование воды» Стройиздат, 1984
Фото и схемы: сайты компаний и предприятий по очистке сточных вод:
· www.envirochemie.ru/Neitralizacija-stochnykh-vod.185.0.html
enviro-chemie.ru/envochem/nom.htm
нейтрализация сточных вод, описание принципа работы установки, фото.
· http://www.vkk-pumps.ru/rbsv.htm - схема блока по нейтрализации.
· http://www.linde-gas.ru/international/web/lg/ru/like35lgru.nsf/docbyalias/ind_neutralisation - нейтрализация с помощью СО2
.
· http://www.water.ru/catalog/el-di_faq.shtml - схема процесса элетродиализа.
Журналы, статьи (в чит. зале):
· Экология и промышленность России 2008, выпуск за ноябрь(№11) стр. 4-6 (очистка реагентным методом) ; также за этот год выпуски №7,2,6,1
· Экология и промышленность России 2010 №2,4,7
· Экология производства 2010 № 6,4,5,1 ; 2009 №4; 2008 №5,1
· Инженерная экология 2010 №3 /гидроэкология
· Технологии нефти и газа 2010 №2
· Вода и экология 2008 №1,2 2009 № 1,4
· Защита окружающей среды в нефтегазовом комплексе 2009 №1 2008 №2,8
· Нефтегазовые технологии 2008 №11
· Безопасность жизнедеятельности 2008 № 10,9,11 2009 №7
|