| Казахский Гуманитарно-Юридический Инновационный Университет
Кафедра: Информационных технологий и экономики
СРСП №1
На тему: «Классификация органических соединений. Виды связи. Специфические свойства органических соединений. Структурные формулы. Изомерия.»
Выполнил: Студент I-го курса, группа Э-124
Увашов Азамат
Проверила: Абылкасымова Б. Б
г.Семей 2010 год
Содержание
1. Введение
2. Классификация органических соединений
3. Виды связи
4. Структурные формулы
5. Специфические свойства органических соединений
6. Изомерия
Введение
Трудно представить прогресс в какой бы то ни было области хозяйства без химии – в частности, без органической химии. Все сферы хозяйства связаны с современной химической наукой и технологией.
Органическая химия изучает вещества, содержащие в своем составе углерод, за исключением окиси углерода, углекислого газа и солей угольной кислоты (эти соединения по свойствам ближе к неорганическим соединениям).
Как наука органическая химия до середины XVIII века не существовала. К тому времени различали три вида химии: химию животных, растительную и минеральную. Химия животных
изучала вещества, входящие в состав животных организмов; растительная
– вещества, входящие в состав растений; минеральная
– вещества, входящие в состав неживой природы. Этот принцип, однако, не позволял отделить органические вещества от неорганических. Например, янтарная кислота относилась к группе минеральных веществ, так как ее получали перегонкой ископаемого янтаря, поташ входил в группу растительных веществ, а фосфат кальция – в группу животных веществ, так как их получали прокаливанием соответственно растительных (древесина) и животных (кости) материалов.
В первой половине XIX века было предложено выделить соединения углерода в самостоятельную химическую дисциплину – органическую химию.
Среди ученых в то время господствовало виталистическое
мировоззрение, согласно которому органические соединения образуются только в живом организме под влиянием особой, сверхъестественной "жизненной силы". Это означало, что получить органические вещества путем синтеза из неорганических невозможно, что между органическими и неорганическими соединениями лежит непреодолимая пропасть. Витализм настолько укрепился в умах ученых, что долгое время не предпринималось никаких попыток синтеза органических веществ. Однако витализм был опровергнут практикой, химическим экспериментом.
Реклама

Развитие органической химии в настоящее время достигло уровня, позволяющего начать решение такой основополагающей проблемы органической химии, как проблема количественного соотношения структуры вещества и его свойства, в качестве которого может выступать любое физическое свойство, биологическая активность любого строго заданного типа решение задач такого типа осуществляется с использованием математических методов.
Классификация органических соединений.
Огромное количество органических соединений классифицируют с учетом строения углеродной цепи (углеродного скелета) и наличия в молекуле функциональных групп.
На схеме представлена классификация органических соединений в зависимости от строения углеродной цепи.
| |
|
Органические соединения
|
|
|
| |
|
¯
|
|
|
¯
|
|
|
| Ациклические (алифатические)
(соединения с открытой цепью)
|
Циклические
(соединения с замкнутой цепью)
|
| |
¯
|
¯
|
|
|
¯
|
¯
|
|
| Насыщенные (предельные)
|
Ненасыщенные (непредельные)
|
Карбоциклические (цикл состоит только из атомов углерода)
|
Гетероциклические (цикл состоит из атомов углерода и других элементов)
|
| |
|
|
|
¯
|
¯
|
|
|
| |
|
|
Алициклические (алифатические циклические)
|
Ароматические
|
|
В качестве основы при классификации приняты углеводороды, их считают базовыми соединениями в органической химии. Все остальные органические соединения рассматривают как их производные.
При систематизации углеводородов принимают во внимание строение углеродного скелета и тип связей, соединяющих атомы углерода.
I. АЛИФАТИЧЕСКИЕ (aleiphatos. греч.
масло) углеводороды представляют собой линейные или разветвленные цепочки и не содержат циклических фрагментов, они образуют две крупные группы.
1.
Предельные или насыщенные углеводороды (названы так потому, что не способны что-либо присоединять) представляют собой цепочки атомов углерода, соединенных простыми связями и окруженных атомами водорода. В том случае, когда цепочка имеет разветвления, к названию добавляют приставку изо
. Простейший насыщенный углеводород – метан, с него начинается ряд этих соединений.
НАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
ОБЪЕМНЫЕ МОДЕЛИ НАСЫЩЕННЫХ УГЛЕВОДОРОДОВ. Валентности углерода направлены к вершинам мысленного тетраэдра, в результате цепочки насыщенных углеводородов представляют собой не прямые, а ломаные линии.
Реклама

Основные источники насыщенных углеводородов – нефть и природный газ. Реакционная способность насыщенных углеводородов очень низкая, они могут реагировать только с наиболее агрессивными веществами, например, с галогенами или с азотной кислотой. При нагревании насыщенных углеводородов выше 450 С° без доступа воздуха разрываются связи С-С и образуются соединения с укороченной углеродной цепью. Высокотемпературное воздействие в присутствии кислорода приводит к их полному сгоранию до СО2
и воды, что позволяет эффективно использовать их в качестве газообразного (метан – пропан) или жидкого моторного топлива (октан).
При замещении одного или нескольких атомов водорода какой-либо функциональной (т.е. способной к последующим превращениям) группой образуются соответствующие производные углеводородов. Соединения, содержащие группировку С-ОН, называют спиртами, НС=О – альдегидами, СООН – карбоновыми кислотами (слово «карбоновая» добавляют для того, чтобы отличить их от обычных минеральных кислот, например, соляной или серной). Соединение может содержать одновременно различные функциональные группы, например, СООН и NH2
, такие соединения называют аминокислотами. Введение в состав углеводорода галогенов или нитрогрупп приводит соответственно к галоген- или нитропроизводным.
НЕНАСЫЩЕННЫЕ УГЛЕВОДОРОДЫ
в виде объемных моделей. Валентности двух атомов углерода, соединенных двойной связью, расположены в одной плоскости, что можно наблюдать при определенных углах поворота, в этот момент вращение молекул приостанавливается.
Наиболее характерно для ненасыщенных углеводородов присоединение по кратной связи, что позволяет синтезировать на их основе разнообразные органические соединения.
АЛИЦИКЛИЧЕСКИЕ УГЛЕВОДОРОДЫ
. Из-за определенной направленности связей у атома углерода молекула циклогексана представляет собой не плоский, а изогнутый цикл – в форме кресла (/
-/
), что отчетливо видно при определенных углах поворота (в этот момент вращение молекул приостанавливается)
Помимо показанных выше существуют иные варианты соединения циклических фрагментов, например, они могут иметь один общий атом, (так называемые, спироциклические соединения), либо соединяться таким образом, чтобы два или более атомов были общими для обоих циклов (бициклические соединения), при объединении трех и более циклов возможно также образование углеводородных каркасов.
ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
. Их названия сложились исторически, например, фуран получил название от фуранового альдегида – фурфурола, получаемого из отрубей (лат.
furfur – отруби). Для всех показанных соединений реакции присоединения затруднены, а реакции замещения проходят достаточно легко. Таким образом, это ароматические соединения небензольного типа.
Ароматический характер этих соединений подтверждается плоским строением циклов, что отчетливо заметно в тот момент, когда их вращение приостанавливается
Разнообразие соединений этого класса увеличивается дополнительно за счет того, что гетероцикл может содержать два и более гетероатомов в цикле
ВИДЫ СВЯЗИ
Химическая связь
— это взаимодействие частиц (атомов, ионов), осуществляемое путем обмена электронами. Различают несколько видов связи.
При ответе на данный вопрос следует подробно остановиться на характеристике ковалентной и ионной связи.
Ковалентная связь образуется в результате обобществления электронов (с образованием общих электронных пар), которое происходит в ходе перекрывания электронных облаков. В образовании ковалентной связи участвуют электронные облака двух атомов.
Различают две основные разновидности ковалентной связи:
а) неполярную и б) полярную.
а) Ковалентная неполярная связь образуется между атомами неметалла одного и того химического элемента. Такую связь имеют простые вещества, например О2
; N2
; C12
. Можно привести схему образования молекулы водорода: 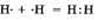 (на схеме электроны обозначены точками). (на схеме электроны обозначены точками).
б) Ковалентная полярная связь образуется между атомами различных неметаллов.
Схематично образование ковалентной полярной связи в молекуле НС1 можно изобразить так: 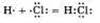
Общая электронная плотность оказывается смещенной в сторону хлора, в результате чего на атоме хлора возникает частичный отрицательный заряд 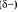 , а на атоме водорода — частичный положительный , а на атоме водорода — частичный положительный 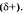 . Таким образом, молекула становится полярной: . Таким образом, молекула становится полярной: 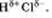
Ионной называется связь между ионами, т. е. заряженными частицами, образовавшимися из атома или группы атомов в результате присоединения или отдачи электронов. Ионная связь характерна для солей и щелочей.
Сущность ионной связи лучше рассмотреть на примере образования хлорида натрия. Натрий, как щелочной металл, склонен отдавать электрон, находящийся на внешнем электронном слое. Хлор же, наоборот, стремится присоединить к себе один электрон. В результате натрий отдает свой электрон хлору. В итоге образуются противоположно заряженные частицы — ионы Na+
и Сl-
, которые притягиваются друг к другу. При ответе следует обратить внимание, что вещества, состоящие из ионов, образованы типичными металлами и неметаллами. Они представляют собой ионные кристаллические вещества, т. е. вещества, кристаллы которых образованы ионами, а не молекулами.
После рассмотрения каждого вида связи следует перейти к их сравнительной характеристике.
Для ковалентной неполярной, полярной и ионной связи общим является участие в образовании связи внешних электронов, которые еще называют валентными. Различие же состоит в том, насколько электроны, участвующие в образовании связи, становятся общими. Если эти электроны в одинаковой мере принадлежат обоим атомам, то связь ковалентное неполярная; если эти электроны смещены к одному атому больше, чем другому, то связь ковалентная полярная. В случае, если электроны, участвующие в образовании связи, принадлежат одному атому, то связь ионная.
Металлическая связь — связь между ион-атомами в кристаллической решетке металлов и сплавах, осуществляемая за счет притяжения свободно перемещающихся (по кристаллу) электронов (Mg, Fe).
Все вышеперечисленные отличия в механизме образования связи объясняют различие в свойствах веществ с разными видами связей.
СТРУКТУРНАЯ ФОРМУЛА
Структурная формула
— это разновидность химической формулы, графически описывающая расположение и порядок связи атомов в соединении, выраженное на плоскости. Связи в структурных формулах обозначаются валентными черточками.
Часто используются структурные формулы, где связи с атомами водорода не обозначаются валентными черточками (тип 2). В другом типе структурных формул (скелетных), применяемых для крупных молекул в органической химии, не указываются атомы водорода связанные с углеродными атомами и не обозначаются атомы углерода (тип 3).
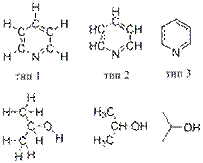
С помощью разных типов условных обозначений, используемых в структурных формулах, указываются также координационные связи, водородные связи, стереохимия молекул, делокализованные связи, локализация зарядов и т.д.
СПЕЦИФИЧЕСКИЕ СВОЙСТВА ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
Реакции органических соединений имеют некоторые специфические особенности. В реакциях неорганических соединений обычно участвуют ионы; эти реакции протекают очень быстро, иногда мгновенно при нормальной температуре. В реакциях органических соединений обычно участвуют молекулы; при этом одни ковалентные связи разрываются, а другие образуются. Такие реакции протекают медленнее ионных (например, десятки часов), и для их ускорения часто требуется повысить температуру или добавить катализатор. Наиболее часто используют в качестве катализаторов кислоты и основания. Обычно протекает не одна, а несколько реакций, так что выход нужного продукта очень часто составляет менее 50%. В связи с этим в органической химии употребляют не химические уравнения, а схемы реакций без указания стехиометрических соотношений.
Реакции органических соединений могут протекать очень сложным образом и вовсе не обязательно соответствовать простейшей относительной записи. Как правило, простая стехиометрическая реакция на самом деле происходит в несколько последовательных стадий. В качестве промежуточных соединений (интермедиатов) в многостадийных процессах могут возникать карбкатионы R+, карбанионы R-, свободные радикалы , карбены: СХ2, катион-радикалы (например, анион-радикалы (например, Аr ) и другие нестабильные частицы, живущие доли секунды. Подробное описание всех изменений, которые происходят на молекулярном уровне в процессе превращения реагентов в продукты, называется механизмом реакции.
Исследование влияния строения органических соединений на механизм их реакций изучает физическая органическая химия, основы которой заложили К.Инголд, Робинсон и Л.Гаммет (1930-е гг.).
Реакции органических соединений могут классифицированы в зависимости от способа разрыва и образования связей, метода возбуждения реакции, ее молекулярности и др.
ИЗОМЕРИЯ
ИЗОМЕРИЯ (греч. isos – одинаковый, meros – часть) – одно из важнейших понятий в химии, главным образом, в органической. Вещества могут иметь одинаковый состав и молекулярную массу, но различное строение и соединения, содержащие в своем составе одни и те же элементы в одинаковом количестве, но различающиеся пространственным расположением атомов или групп атомов, называют изомерами. Изомерия является одной из причин того, что органические соединения так многочисленны и разнообразны.
Изомерия была впервые обнаружена Ю.Либихом в 1823, который установил, что серебряные соли гремучей и изоциановой кислот: Ag-О-N=C и Ag-N=C=O имеют одинаковый состав, но разные свойства. Термин «Изомерия» в 1830 ввел И.Берцелиус, предположивший, что различия в свойствах соединений одинакового состава возникают из-за того, что атомы в молекуле расположены в неодинаковом порядке. Представления об изомерии окончательно сформировались после создания A.M.Бутлеровым теории химического строения (1860-е). Основываясь на положениях этой теории, он предположил, что должно существовать четыре различных бутанола. К моменту создания теории был известен лишь один бутанол (СН3
)2СНСН2
ОН, получаемый из растительного сырья.
Последовавший затем синтез всех изомеров бутанола и определение их свойств стали убедительным подтверждением теории.
Согласно современному определению два соединения одинакового состава считают изомерами, если их молекулы нельзя совместить в пространстве так, чтобы они полностью совпадали. Совмещение, как правило, проделывают мысленно, в сложных случаях используют пространственные модели, либо расчетные методы. Есть несколько причин возникновения изомерии.
Структурная изомерия
Обусловлена, как правило, различиями в строении углеводородного скелета либо неодинаковым расположением функциональных групп или кратных связей.
Изомерия углеводородного скелета. Насыщенные углеводороды, содержащие от одного до трех атомов углерода (метан, этан, пропан), не имеют изомеров. Для соединения с четырьмя атомами углерода С4
Н10
(бутан) возможно существование двух изомеров, для пентана С5
Н12
– трех изомеров, для гексана С6
Н14
– пяти
С увеличением числа атомов углерода в молекуле углеводорода количество возможных изомеров резко возрастает. Для гептана С7
Н16
существует девять изомеров, для углеводорода С14
Н30
– 1885 изомеров, для углеводорода С20
Н42
– свыше 366 000.
В сложных случаях вопрос о том, являются ли два соединения изомерами, решают, используя различные повороты вокруг валентных связей (простые связи это допускают, что в определенной степени соответствует их физическим свойствам). После перемещения отдельных фрагментов молекулы (не допуская при этом разрыва связей) накладывают одну молекулу на другую. Если две молекулы полностью совпадают, то это не изомеры, а одно и то же соединение:
 Изомеры, отличающиеся структурой скелета, обычно имеют разные физические свойства (температура плавления, температура кипения и т.п.), что позволяет отделить один от другого. Изомерия такого типа существует и у ароматических углеводородов.
Изомеры, отличающиеся структурой скелета, обычно имеют разные физические свойства (температура плавления, температура кипения и т.п.), что позволяет отделить один от другого. Изомерия такого типа существует и у ароматических углеводородов.
|