| Содержание
1. Общие сведения 1 стр.
2. Получение алюминия 1 стр.
3. Особенности и свойства алюминия 2 стр.
4. Применение алюминия 4 стр.
5. Оксид, гидроксид, хлорид и сульфат алюминия 4 стр.
6. Список литературы 6 стр.
Общие сведения
Алюминий (Aluminium) — самый распространённый в земной коре металл. Он входит в состав глин, полевых шпатов, слюд и многих других минералов. Общее содержание алюминия в земной коре составляет 8 % (масс.).
Основным сырьём для производства алюминия служат бокситы, содержащие 32-60 % глинозёма Al2
O3
. К важнейшим алюминиевым рудам относятся также алунит K2
SO4
· Al2
(SO4
)3
· 2Al2
O3
· 6H2
O и нефелин Na2
O · Al2
O3
· 2SiO2
.
Россия располагает запасами алюминиевых руд. Кроме бокситов, месторождения которых имеются у нас на Урале, в Башкирии, богатейшим источником алюминия является нефелин, залегающий совместно с апатитом в Хибинах. Значительные залежи алюминиевого сырья имеются в Сибири.
Впервые алюминий был получен Велером в 1827 году действием металлического калия на хлорид алюминия. Однако на широкую распространённость в природе, алюминий до конца ΧΙΧ века не принадлежал к числу редких металлов.
Получение алюминия
В настоящее время алюминий в громадных количествах получают из оксида алюминия Al2
O3
электролитическим методом. Используемый для этого оксид алюминия должен быть достаточно чистым, поскольку из выплавленного алюминия примеси удаляются с большим трудом. Очищенный Al2
O3
получают переработкой природного боксита.
Получение алюминия - сложный процесс, сопряжённый с большими трудностями. Основное исходное вещество - оксид алюминия - не проводит электрический ток и имеет высокую температуру плавления (около 2050 ºС). Поэтому электролизу подвергают расплавленную смесь криолита*
NA3
[AlF6
] и оксида алюминия. Смесь, содержащая около 10 % (масс.) Al2
O3
, плавиться при 960 ºС и обладает электропроводимостью, плотностью и вязкостью, наиболее благоприятствующими проведения процесса. Для дополнительного улучшения этих характеристик в состав смеси вводят добавки AlF3
, CaF2
и MgF2
. Благодаря этому проведения электролиза оказывается возможным при 950 ºС.
Реклама

Электролизёр для выплавки алюминия представляет собой железный кожух, выложенный изнутри огнеупорным кирпичом. Его дно (под), собранное из блоков спрессованного угля, служит катодом. Анодом (один или несколько) располагаются сверху: это - алюминиевые каркасы, заполненные угольными брикетами. На современных заводах электролизёры устанавливают сериями; каждая серия состоит из 150 и большего числа электролизёров.
При электролизе в катоде выделяется алюминий, а на аноде - кислород. Алюминия, обладающий большей плотностью, чем исходный расплав, собирается на дне электролизёра; отсюда его периодически выпускают.
По мере выделения металла, в расплав добавляют новые порции оксида алюминия. Выделяющийся при электролизе кислород взаимодействует с углеродом анода, который выгорает, образуя СО и СО2
.
В дореволюционной России алюминий не производился. Первый алюминиевые завод (Волховский) вступил в строй в 1932 году, а уже в 1935 году наша страна заняла по производству алюминия третье место в мире.
Особенности и свойства алюминия
Одинаковое строение внешнего электронного слоя атомов бора и алюминия обуславливает сходство в свойствах этих металлов. Так, для алюминия, как и для бора, характерна только степень окисленности +3. однако при переходе от бора к алюминию сильно возрастает радиус атома (от 0,091 до 0,143 нм) и, кроме того, появляется ещё один промежуточный восьмиэлектронный слой, экранирующее ядро. Всё это приводит к ослаблению связи внешних электронов с ядром и к уменьшению энергии ионизации атома (см. табл.1.).
Таблица 1. Свойства алюминия и его аналогов
| |
B
|
Al
|
Ga
|
In
|
Ti
|
| Строение внешнего электронного слоя атома
Радиус атома, нм
Энергии ионизации
Э → Э+
, эВ
Э+
→ Э2+
, эВ
Э2+
→ Э3+
, эВ
Радиус иона Э3+
, нм
Стандартная энтальпия атомизации, кДж на 1 моль атомов
Плотность, г/см3
Температура плавления, ºС
Температура кипения, ºС
|
2s2
2p1
0,091
8,3
25,15
37,9
0,020
561,5
2,34
2075
3700
|
3s2
3p1
0,143
5,99
18,8
28,4
0,057
329,3
2,70
660
2520
|
4s2
4p1
0,139
6,00
20,5
30,7
0,062
272,9
5,90
29,8
2205
|
5s2
5p1
0,166
5,79
18,9
28,0
0,092
238,1
7,31
159,4
2000
|
6s2
6p1
0,171
6,11
20,4
29,8
0,105
180,7
11,85
304
1475
|
Поэтому у алюминия металлические свойства выражены гораздо сильнее, чем у бора. Тем не менее, химические связи, образуемые алюминием с другими элементами, имеют в основном ковалентный характер. Другая особенность алюминия (как и его аналогов - галлия, индия и таллия) по сравнению с бором заключается в существовании свободных d-подуровней во внешнем электронном слое его атома. Благодаря этому координационное число алюминия в его соединениях может равняться не только четырем, как у бора, но и шести.
Реклама

Соединение алюминия типа ALЭ3
, как и аналогичные соединения бора, электронодефицитны: в отдельных молекулах подобных соединений во внешнем электронном слое атома алюминия находятся только шесть электронов поэтому здесь атом алюминия способен быть акцептом электронных пар. В частности, донорно-акцептному способу (на схеме Г - атом галогена): 
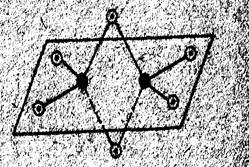 Как видно, подобные димерные молекулы содержат по два «мостиковых» атома галогена. Пространственное строение Al2
Cl6
показано на рисунке 1. Галогениды алюминия существуют в виде димерных молекул Al2
Г6
в расплавах и в парах. Однако по традиции их состав обычно выражают в форме AlГ3
. Ниже мы тоже будем придерживаться этого способа написания формул галогенидов алюминия. Как видно, подобные димерные молекулы содержат по два «мостиковых» атома галогена. Пространственное строение Al2
Cl6
показано на рисунке 1. Галогениды алюминия существуют в виде димерных молекул Al2
Г6
в расплавах и в парах. Однако по традиции их состав обычно выражают в форме AlГ3
. Ниже мы тоже будем придерживаться этого способа написания формул галогенидов алюминия.
Гидрид алюминия AlH3
- тоже электронодефицитное соединение. Однако атом водорода, в отличие от атомов галогенов в молекулах AlГ3
, не имеет неподелённой электронной пары и не может играть роль донора электронов. Рис 1 Схема пространственного Поэтому здесь отдельные молекулы AlH3
связываются друг с строения молекулы Al2
Cl6
: другом через «мостиковые» атомы водорода трёхцентровыми черные кружки - атомы алюминия, связями, аналогичными связям в молекулах бороводородов светлые - атомы хлора. В результате образуется твердый полимер, состав которого можно выразить формулой (AlH3
)n
.
Алюминий – серебристо - белый лёгкий металл. Он легко вытягивается в проволоку и прокатывается в тонкие листы.
при комнатной температуре алюминий не изменяется на воздухе, но лишь потому, что его поверхность покрыта тонкой плёнкой оксида, обладающей очень сильным защитным действием. Уничтожение этой плёнки, например, путем амальгамирования алюминия, вызывает быстрое окисление металла, сопровождающееся разогреванием.
Стандартный электродный потенциал алюминия равен - 1,663 В. Несмотря на столь отрицательное значение, алюминий, вследствие образовании на его поверхности защитной оксидной плёнки, не вытесняет водород из воды. Однако амальгамированный алюминий, на котором не образуется плотного слоя оксида, энергично взаимодействует с водою с выделение водорода.
Разбавленная соляная и серная кислоты легко растворяют алюминий, особенно при нагревании. Сильно разбавленная и холодная концентрированная азотная кислота алюминий не растворяет.
При действии на алюминий водных растворов щелочей слой оксида растворяется, причём образуются алюминаты - соли, содержащие алюминий в составе аниона:
Al2
O3
+ 2NaOH + 3H2
O = 2Na[Al(OH)4
]
Тетрагидроксоалюминат натрия
Алюминий, лишённый защитной плёнки, взаимодействует с водой, вытесняя водород:
2Al + 6H2
O = 2Al(OH)3
+ 3H2
Образующийся гидроксид алюминия реагирует с избытком щелочи, образуя гидроксоалюминат:
Al(OH)3
+ NaOH = Na[Al(OH)4
]
Удвоив последнее уравнение и сложив его с предыдущим, получим суммарное уравнение растворения алюминия в водном растворе щелочи:
2Al + 2NaOH + 6H2
O + 2Na[Al(OH)4
]+3H2
Алюминий заметно растворяется в растворах солей, имеющих вследствие их гидролиза кислую или щелочную реакцию, например, в растворе Na2
CO3
.
Если порошок алюминия (или его тонкую алюминиевую фольгу) сильно нагрет, то он воспламеняется и сгорает ослепительным белым пламенем, образуя оксид алюминия Al2
O3
.
Применение алюминия
Основное применение алюминия - производство сплавов на его основе. Легирующие добавки (например, медь, кремний, магний, цинк, марганец) вводят в алюминий главным образом для повышения его прочности. Широкое распространение имеют дуралюмины, содержащие медь и магний, силумины, в которых основной добавкой служит кремний, магналий (сплав алюминия с 9,5 - 11,5 % магния). Основные достоинства всех сплавов алюминия - это его малая плотность (2,5 - 2,8 г/см³), высокая прочность (в расчёте на единицу массы), удовлетворительная стойкость против атмосферной коррозии, сравнительная дешевизна и простота получения и обработки. Алюминиевые сплавы применяют в ракетной технике, в авиа-, авто-, судо- и приборостроении, в производстве посуды и во многих других областях промышленности. При широте применения сплавы алюминия занимают второе место после стали и чугуна.
Алюминий - одна из наиболее распространённых добавок в сплавах на основе меди, магния, титана, никеля, цинка, железа.
В чистом виде алюминий используется для изготовления химической аппаратуры, электрических проводов, конденсаторов. Хотя электропроводность у алюминия меньше чем у меди (около 60 % электропроводности меди), но это компенсируется лёгкостью алюминия, позволяющей делать провода более толстыми: при одинаковой электропроводности алюминиевый провод весит вдвое меньше медного.
Важным является применения алюминия для алитирования, которое заключается в насыщении поверхности стальных и чугунных изделий алюминием с целью защиты основного материала от окисления при сильном нагревании. В металлургии алюминий применяется для получения кальция, бария, лития и некоторых других металлов методом алюминотермии.
Оксид, гидроксид, хлорид и сульфат алюминия
Оксид алюминия Al2
O3
, называемый также глинозёмом, встречается в природе в кристаллическом виде, образуя минерал корунд. Корунд обладает очень высокой твёрдостью. Его прозрачные кристаллы, окрашенные примесями в красный или синий цвет, представляют собой драгоценные камни - рубин и сапфир. Теперь рубины получают искусственно, сплавляя глинозем в электрической печи. Они используются не столько для украшений, сколько для технических целей, например, для изготовления деталей точных приборов, камней в часах и т.п. Кристаллы рубинов, содержащих малую примесь Cr2
O3
, применяют в качестве квантовых генераторов - лазеров, создающих направленный пучок монохроматического излучения.
Корунд и его мелкозернистая разновидность, содержащая большое количество примесей, - наждак, применяется как абразивные материалы.
Гидроксид алюминия Al(OH)3
выпадает в виде студенистого осадка при действии щелочей на растворы солей алюминия и легко образует коллоидные растворы.
Гидроксид алюминия типичный атмосферный гидроксид. С кислотами образует соли, содержащие катион алюминия, со щелочами алюминаты. При взаимодействии гидроксида алюминия с водными растворами щелочей или при растворении металлического алюминия в растворах щелочей образуются, как уже говорилось выше, гидроксоалюминаты, например Na[Al(OH)4
]. при расплавлении же оксида алюминия с соответствующими оксидами или гидроксидами получают метаалюминаты - производные метаалюминиевой кислоты HAlO2
, например:
Al2
O3
+ 2KOH = 2KAlO2
+ H2
O
Как соли алюминия, так и алюминаты в растворах сильно гидролизованны. Поэтому соли алюминия и слабых кислот в растворах превращаются в основные соли или подвергаются полному гидролизу. Например, при взаимодействии в растворе какой-либо соли алюминия с Na2
CO3
образуется не карбонат алюминия, а его гидроксид и выделяется диоксид углерода:
2Al3+
+ 3CO3
2-
+ 3H2
O = 2Al(OH)3
¯ + 3CO2
Хлорид алюминия AlCl3
. Безводный хлорид алюминия получается при непосредственном взаимодействии хлора с алюминием. Он широко применяется в качестве катализатора при различных органических синтезах. В воде хлорид алюминия растворяется с выделением большого количества теплоты. При выпаривании раствора происходит гидролиз, выделяется хлористый водород и получается гидроксид алюминия. Если выпаривание вести в присутствии избытка соляной кислоты, то можно получить кристаллы состава AlCl3
· 6H2
O. При нормальном атмосферном давлении безводный хлорид алюминия уже при 180 ºС, а при высоких давлениях плавиться при 193 ºС, причем в расплавленном состоянии не проводит электрический ток. Поэтому расплав хлористого алюминия нельзя использовать для электролитического получения алюминия.
Сульфат алюминия Al2
(SO4
)3
· 18H2
O получается при действии горячей серной кислоты на оксид алюминия или на каолин. Применяется для очистки воды, а также при приготовлении некоторых сортов бумаги.
Алюмокалиевые квасцы KAl(SO4
)3
· 12H2
O применяются в больших количествах для дубления кож, а также в красильном деле в качестве протравы для хлопчатобумажных тканей. В последнем случае действие квасцов основано на том, что образующийся вследствие их гидролиза гидроксид алюминия отлагается на волокнах ткани в мелкодисперсионном состоянии и, адсорбируя краситель, прочно удерживает его на волокне.
Список литературы
1 Глинка Н. Л. Общая химия. - СПб.:Химия., 1978 г.
2 Курс общей химии под редакцией Коровина Н. В. - М.: Высшая школа., 1990 г.
ФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ
Петрозаводский государственный университет
Форма обучения________________Заочная сокращенная________________
Специальность__________________УОГР_____________________________
РЕФЕРАТ ПО ХИМИИ
На тему___Алюминий (Распространение, получение, химические свойства, соединения, ________________ __________________________ использование в технике)__________
____________________________________________________________________________
Студента____Гулкова Е.А._______________________________________
Рецензент __________Ханина Е. Я._______________________________
Петрозаводск
2007
*
Месторождение криолита, этого очень важного для алюминиевой промышленности минерала, встречаются крайне редко. Поэтому обычно криолит получают искусственно - взаимодействием гидроксида алюминия с плавиковой кислотой и последующей нейтрализацией кислого раствора содой.
|