| Содержание
1. Задание стр. 2
2. Выполнение стр. 3
3. Список литературы стр. 9
1. ОСНОВНЫЕ ХИМИЧЕСКИЕ ПОНЯТИЯ И ЗАКОНЫ
4
. Олово образует два оксида. Первый содержит 78,8 %, второй — 88,2% олова.
Вычислите молярные массы эквивалентов олова в этих соединениях.
2. ТЕРМОХИМИЯ
34.
Определите ∆H0
298
Fe2
O3
, если при реакции 2Fe + А12
03
= Fe2
O3
+ 2AI на
каждые 80 г Fe2
O3
поглощается 426,5 кДж теплоты.
3.
ИЗМЕНЕНИЕ ЭНТРОПИИ В РАЗЛИЧНЫХ ПРОЦЕССАХ.
НАПРАВЛЕННОСТЬ ХИМИЧЕСКИХ ПРОЦЕССОВ
64
. Определите изменение энтропии в следующих реакциях:
А1(
k
)
+Сr2
О3(
k
)
=Сr(
k
)
+А12
03(
k
)
; 2С(графит)
+СО2(г)
=2СО(г)
при стандартных условиях
4. ХИМИЧЕСКАЯ КИНЕТИКА
94
. Реакция идет по уравнению 4НСlг
+ О2
<=>2Н2
Ог
+ 2 Cl2
. Как изменится
скорость реакции, если давление в системе увеличить в 3 раза?
5. ХИМИЧЕСКОЕ РАВНОВЕСИЕ
124
. При некоторой температуре равновесие гомогенной системы 2NO+ О2
<=>
2NO2
установилось при следующих концентрациях участников реак-ции: [NO]=0,2 моль/л; [О2
]=0,1 моль/л; [NO2
]=0,1
моль/л. Вычислите кон-станту равновесия и исходные концентрации NO и О2
.
6. СПОСОБЫ ВЫРАЖЕНИЯ КОНЦЕНТРАЦИИ РАСТВОРА
154
. Какие массы безводного сульфата меди и медного купороса
CuSO4
.
5Н2
О потребуются для приготовления раствора (ρ
=1,084 r мл -1
)
объемом 1 л, для которой ω
(СuSO4
)=0,05?
7. ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА РАСТВОРОВ
184
. Раствор, содержащий 16,05 г Ва(NО3
)2
в 500 r воды, кипит при 100,122°С. Рассчитайте изотонический коэффициент
этого раствора.
8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Методом электронного баланса подберите коэффициенты в данной схеме окислительно-восстановительной реакции. Укажите окислитель и восстано-витель.
214
. КМnO4
+ H2
O2
→ МnО2
+O2
+
KOH+H2
O.
9. ЭЛЕКТРОДНЫЕ ПОТЕНЦИАЛЫ. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ
Напишите уравнения электродных реакций, суммарную реакцию, за счет которой работает гальванический элемент и рассчитайте ЭДС гальвани-ческого элемента, составленного по данной схеме:
244
. Hg, Нg2
Сl2
, Сl-
// Hg2+
(0,01 моль/л) Hg;
10.
КОРРОЗИЯ
274
. Как происходит атмосферная коррозия лужёного и оцинкованного желе-за при нарушении целостности покрытия?
Реклама

Составьте электронные уравнения анодного и катодного процессов.
11. ЭЛЕКТРOЛИ3
304
. Какова была сила тока при электролизе водного раствора нитрата свинца (ІІ), если за 20 мин. был выделен весь
металл из 500мл 0,1н раствора? Напишите уравнения протекающих реакций на электродах
Выполнение
:
№4
  Дано: Найти: Дано: Найти:
ω1
(
Sn)=
78,8% M
э1
(
Sn
) ?
ω2
(
Sn)=
88,2% M
э2
(
Sn
) ?
Решение:
M
э
= M
·
ƒэ
г/моль
1) ω1
(О
)=
100 - 78,8 = 21,2%
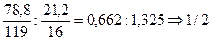
Sn
І
V
O
2
ƒэ
=1/4 M
э1
(
Sn
)=
119 : 1/4 =29,75г/моль
2) ω2
(О
)=
100 - 88,2 = 11,8%
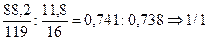
Sn
ІІ
O
ƒэ
=1/2 M
э2
(
Sn
)=
119 : 1/2 =59,5г/моль
Ответ: M
э1
(
Sn
)=
119 : 1/4 =29,75г/моль , M
э2
(
Sn
)=
119 : 1/2 =59,5г/моль
№34
  Дано: Найти: Дано: Найти:
т(
Fe2
O3
)=
80 г 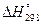 (
Fe2
O3
) ? (
Fe2
O3
) ?
Q=
426,5кДж
Решение:
2Fe
+ Al2
O3
→
Fe2
O3
+ 2Al
2моль 1моль 1моль 2моль
160г/моль
80г Fe2
O3
→
426,5кДж
160г Fe2
O3
→
Х кДж
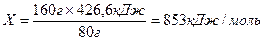
Ответ: 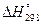 (
Fe2
O3
)
=
853кДж/моль (
Fe2
O3
)
=
853кДж/моль
№64
Дано:
А1(
k)
+С
r2
О3(
k)
=С
r(
k)
+А12
03(
k)
2С
(графит)
+СО2(г)
=
2СО(г)
при стандартных условиях
Найти:
Изменение энтропии
Решение:
∆S
°хим.реакции = ΣS
°(продуктов) - ΣS
°(реагентов)
1) 2А1(
k)
+С
r2
О3(
k)
= 2С
r(
k)
+ А12
03(
k)
28,31 81,1 23,76 51,02 S
° Дж/моль
·К
∆S
°х.р.1 = (23,76 · 2 + 51,02) – (28,31 · 2 + 81,1) = -39,18 Дж/К
2) 2С
(графит)
+ СО2(г)
=
2СО(г)
5,6978 213,78 198,03 S
° Дж/моль
·К
∆S
°х.р.2 = 198,03 · 2 – ( 213,78 + 5,6978 · 2 ) = 170,88 Дж/К
Ответ: ∆S
°х.р.1 = -39,18 Дж/К
∆S
°х.р.2 = 170,88 Дж/К
№94
  Дано: Найти: Дано: Найти:
Р2 > Р1 в 3раза изменение νх.р.
Решение:
4HCl
(г)
+ O
2
↔ 2H
2
О
(г)
+ 2Cl
2
Ответ : νх.р. увеличится
№124
  Дано: Найти: Дано: Найти:
[NO
] =0,2 моль/л Кр = ?
[O
2
] = 0,1моль/л С1
(NO
)=?
[NO
2
]=0,1моль/л C1
(O
2
)=?
Решение:
2NO + O2 ↔ 2NO2
Kр=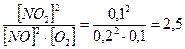 моль/л моль/л
С1
(NO
) = 0,2 + 0,1 = 0,3 моль/л
С1
(O
2
) = 0,1 + 0,005 = 0,105 моль/л
Ответ: С1
(NO
) = 0,2 + 0,1 = 0,3 моль/л ; С1
(O
2
) = 0,1 + 0,005 = 0,105 моль/л
№154
Дано: Найти:
ρ
(р-ра)
= 1,084 г/мл m
(СuSO4
) -?
V
(р-ра)
= 1 л m
(СuSO4
· 5H2
O) -?
ω
(СuSO4
) = 0,05
Решение:
1л = 1000мл
m
(р-ра) = ρ
· V=
1,084 г/мл · 1000 мл = 1084 г
Реклама

m
(СuSO4
) = 0,05 · 1084 г = 54,2 г
m
(СuSO4
· 5H2
O) = M
(СuSO4
· 5H2
O) · = 250г/моль · = 85,76 г
Ответ: m
(СuSO4
) = 54,2 г ; m
(СuSO4
· 5H2
O) = 85,76 г
№ 184
Дано: Найти:
m
(Ba(NO3
)2
) = 16,05 г l
= ?
V
(H2
O) = 500 мл
t
k
= 100,122 °С
Решение :
l
=∆t
/ Ст ·
t
k
Ст=
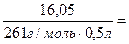 0,123 моль/кг 0,123 моль/кг
∆t=
t
k
- 100° = 100,122-100 = 0,122°
l
= 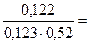 1,91 1,91
Ответ: l
= 1,91
№214
Дано:
КМnO4
+ H2
O2
→ МnО2
+O2
+
KOH+H2
O
Найти:
Методом электронного баланса подберите коэффициенты в данной схеме окислительно-восстановительной реакции. Укажите окислитель и восстано-витель.
Решение:
+7 -1 +4 0
2КМnO4
+ 3H2
O2
→ 2МnО2
+3O2
+
2KOH+2H2
O
↑ ↓
ок-ль вост-ль
вост-е окис-е
№244
Дано:
Hg, Нg2
Сl2
, Сl-
// Hg2+
(0,01 моль/л) Hg
Найти:
уравнения электродных реакций, суммарную реакцию, за счет которой работает гальванический элемент и рассчитайте ЭДС гальвани-ческого элемента
Решение:
2+
К(+) Hg + 2e → Hg ок-ль, вост-е
ox
red
А(-) 2Сl + 2 Нg – 2е → Нg2
Сl2
вост-ль, окис-е
  2+
red
-
ox 2+
red
-
ox
Hg + 2Cl +2Hg → Hg + Нg2
Сl2
Нg2
Сl2
+ Hg → Нg2
Сl2
E=E0
+( R·T/n ·F) · lg(x) = E0
+(0,059/n) · lg(x)
Е= 0,86 + (0,59/2) · lg(0,01) =0,801B
Е= 0,268 + (0,059/2) · lg(1) = 0,268В
Е = Е(ок-ля)
- Е(в-ля)
= Е(катода)
- Е(анода)
Е=0,801 – 0,268 = 0,533В
№274
Найти:
Как происходит атмосферная коррозия лужёного и оцинкованного желе-за при нарушении целостности покрытия? Составьте электронные уравнения анодного и катодного процессов.
Решение:
Е0
(Fe2+
/Fe) = -0,440 B
Е0
(Zn2+
/Zn) = -0,763 B
Схема коррозии оцинкованного железа
:
A(+)/Zn: Zn - 2e → Zn2+
- окисление
K(-)/Fe: 2 H2
O + O2
+ 4e → 4 OH-
- восстановление
2 Zn + 2 H2
O + O2
→ 2 Zn(OH)2
Схема коррозии луженого железа
:
E0
(Fe2+
/Fe) = -0,44 В
E0
(Sn2+
/Sn) = -0,14 В
Атмосферная коррозия луженого железа
А(-): Fe - 2e → Fe2+
- окисление
К(+): 2 H2
О + O2
+ 4e → 4 OH-
- восстановление
2 Fe + 2 H2
О + O2
→ 2 Fe(OH)2
Далее происходит окисление гидроксида железа (II)
4 Fe(OH)2
+ 2 H2
О + O2
→ 4 Fe(OH)3
№304
  Дано: Найти: Дано: Найти:
t
= 20 мин
V
(р-ра) = 500 мл I
= ?
С
(р-ра) = 0,1н
Решение:
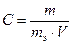 → m =
C ·
mэ
·
V
; → m =
C ·
mэ
·
V
; 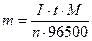 →
→ 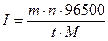
2+
К(+) Pb + 2e → Pb ок-ль, вост-е
-
A(-) 2 H2
O – 4e → O2
+ 4H вост-ль, окис-е
mэ
=
331· 1/2 = 165,5 г
m
= 0,1н · 0,5л · 165,5 г = 8,275 г
I
=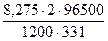 = 4А = 4А
Ответ: I
=4А
Список литературы:
1. Глинка, Н.Л. Общая химия / Н.Л. Глинка. Под ред. А.И. Ермакова. — М.: Ин-теграл-Пресс,
2002. — 727 с.
2. Глинка, Н.Л. Задачи и упражнения по общей химии / Н.Л. Глинка. Под ред.
В.А. Рабиновича, Х.М. Рубиной. — М.: Интеграл-Пресс, 2001. — 240 с.
3. Коровин, Н.В. Общая химия. — М,: Высш. шк., 2000. — 558 с.
4. Угай, Я.А. Общая и неорганичсская химия / Я.А. Угай. — М.: Высш. шк., 2002.
— 527 с.
5. Фримантл, М. Химия в действии. Ч.1 / М. Фримантл. — М.: Мир, 1998. — 528 с.
6. Фримантл, М. Химия в действии. Ч.2 / М. Фримантл. — М.: Мир, 1998. — 511 с.
|