Реферат
на тему
Озон
Як приємно прогулятися після грози! Повітря чисте й свіже, його струмені здається, без жодних зусиль проникають у легені. «Озоном пахне, — часто кажуть у таких випадках. —Дуже корисно для здоров'я» Чи це так? І взагалі, що ми знаємо про дивну речовину — озон, його властивості й застосування?
Уперше люди зустрілися з відчутними кількостями озону, коли були винайдені електростатичні машини на зразок тих, котрі можна побачити в шкільному кабінеті фізики. Так що вперше з цією речовиною познайомилися не хіміки, а фізики.
У 1785 році голландський фізик Мартін ван Марум одержав озон, піддаючи кисень дії електричних іскор, і навіть подумав, що знайшов особливу «електричну матерію».
Назву ж озону дав у 1840 році вже хімік, швейцарець Крістіан Шенбейн; він використовував грецьке слово ozon —
«той, що пахне». Виявилося, що озон дійсно родич кисню, але значно більш агресивний. Так, він миттєво окиснює безбарвний калій йодид з виділенням бурого йоду:
2КІ + 03
+ Н2
О + І2
+ 02
+ 2КОН.
незабарв- бурий
лений
Навіть малоактивна при кімнатній температурі ртуть не може встояти під натиском цього газу — вона втрачає свій блиск і набуває здатності прилипати до скла. Окиснюється озоном і срібло:
8Ag + 2О2
→ 4Ag2
0 + Ог
Озон і кисень — єдиний приклад утворення одним хімічним елементом двох газоподібних (за звичайних умов) простих речовин. Молекула кисню складається, як відомо, із двох атомів, а озону — із трьох, причому ці три атоми розташовані не на прямій лінії, а під кутом. Це є причиною ще однієї унікальної особливості цього газу — із усіх газоподібних речовин тільки молекули озону полярні, тобто являють собою діполь із розділеними в просторі зарядами.
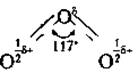
Шлях до отримання озону завжди однаковий — спочатку треба отримати вільні атоми Оксигену, наприклад, зруйнувавши молекулу кисню: О2
↔ 20 - Q.
Потім кожен утворений атом Оксигену «прилипає» до молекули кисню з утворенням молекули озону:
О + 02
→ О3
+ Q.
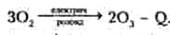
Молекули кисню дуже міцні, для їхнього руйнування треба витратити дуже велику енергію — майже 500 кДж/моль, щоправда, при другій реакції частина її виділиться, так що для отримання 1 моль озону треба витратити 142 кДж енергії. Цю енергію простіше отримати фізичними методами — дією на кисень електричних розрядів, ультрафіолетових променів, гамма-квантів, електронів, тому, наприклад, озоном завжди пахне біля увімкнутих електричних машин, у яких «іскрять» щітки. Зараз озон найчастіше отримують дією на кисень так званим «тихим» (без іскор) електричним розрядом:
Реклама

Але можливі й чисто хімічні способи отримання озону, щоправда, у дуже малих кількостях. Це відбувається при електролізі підкисленої води, при повільному окиснюванні на повітрі вологого білого фосфору, при розкладанні сполук із високим вмістом кисню (калій перманганату КМn04
, калій дихромату К2
Сг2
07
та ін.), при дії на воду фтору або на барій пероксид концентрованої сірчаної кислоти. Атоми Оксигену завжди присутні в полум'ї, тому якщо спрямувати струмінь стиснутого повітря поперек верхньої частини полум'я пальника, то з'явиться характерний запах озону. Зворотна реакція утворення кисню з озону відбувається з виділенням енергії, озон нестійкий.
Швидкість його розкладання значно збільшується в присутності каталізаторів (газів — нітроген оксидів, хлору; твердих речовин — металів, оксидів).
Які ж властивості чистого озону? Скраплюється він значно легше кисню, при температурі лише -111,9 °С (кисень — при -183 °С), а твердішає при-192,7 °С. Твердий озон синьо-чорний. Інтенсивність забарвлення рідкого озону настільки велика, що вже через дуже тонкий його шар не видно нитки палаючої електричної лампочки. Досліди з озоном небезпечні. Газоподібний озон здатен вибухати, якщо його концентрація в повітрі перевищує 9 %.
Озон відрізняється надзвичайно високою реактивною здатністю. Він найсильніший окиснювач, і в цьому відношенні поступається тільки фтору й оксиген фториду OF2
. Важлива відмінність озону від кисню в тому, що він виявляє окисні властивості вже при кімнатній температурі. Наприклад. PbS і Pb(OH)2
у звичайних умовах не реагують із киснем, тоді як у присутності озону сульфід перетворюється на PbSO4
, а гідроксид - на РbО
PbS + 20, → PbSO4
+ O2
Pb(OH)2
+ 2O3
→ РbО + Н2
O + 3O2
Якщо в посуд з озоном налити концентрований розчин амоніаку, з'явиться білий дим — це озон окиснив амоніак з утворенням амоній нітриту NH4
N02
2NH3
Н2
О + О3
→ NH4
NО2
+ ЗН2
О
Особливо характерна для озону здатність «чорнити» срібні вироби з утворенням Ag2
0. Якщо спрямувати на поверхню твердого сухого лугу струмінь озону. то утвориться оранжево-червона кірка, що містить озон іди, наприклад
Реклама

4КОН + 4О3
→ 4КО3
+ О3
↑ + 2Н2
0
калій озонід
При цьому твердий луг ефективно зв'язує воду, що вберігає озонід від негативного гідролізу. Однак при надлишку води озоніди бурхливо розкладаються.
4КО3
+ 2Н2
О → 4КОН + 5О2
↑.
Розкладання озондів відбувається також за відсутності води — просто при зберіганні, наприклад
2К02
→ 2КО2
+ О2
↑
Озоніди добре розчиняються в рідкому амоніаку, що дозволило виділити їх у чистому вигляді й вивчити їхні властивості.
Озон руйнує органічні речовини, із якими стикається. Так, озон, на відміну від хлору, здатен розщеплювати бензенове кільце
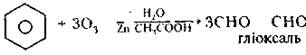
При роботі з озоном не можна використовувати гумові трубки і шланги вони моментально «продірявляться». Реакції озону з органічними сполуками відбуваються з виділенням великої кількості енергії. Наприклад, ефір, спирт, вата, змочена скипидаром, метан і багато інших речовин самозаймаються при зіткненні з озонованим повітрям, а зміщення озону з етиловим спиртом призводить до сильного вибуху.
ЗАСТОСУВАННЯ ОЗОНУ
Після того як у 1888 році на Міжнародному гігієнічному конгресі у Відні було визнано, що з питною водою можуть поширюватися заразні хвороби, почалися пошуки найбільш ефективного способу знезаражування води. їх було знайдено безліч, і серед інших — хімічна обробка води озоном Перевага цього способу в тому, що озонована вода, на відміну від хлорованої, не набуває стороннього запаху й смаку, при повному окиснюванні озоном багатьох органічних сполук утворюються зовсім нешкідливі речовини — вуглекислий газ і вода, а надлишок озону досить швидко розпадається з утворенням також нешкідливого кисню Однак озонування води обходиться дорожче, ніж хлорування, наприклад, озон не можна перевозити, він повинен вироблятися на місці використання, це перешкоджає повсюдному поширенню методу озонування
ОЗОН В АТМОСФЕРІ
Як відомо зараз навіть далеким від хімії людям, озоновий шар в атмосфері фактично забезпечує життя на нашій планеті Озону в атмосфері небагато — 4 млрд т, (тобто всього 1 міліграм у 1 кубічному метрі). Концентрація озону росте з віддаленням від поверхні Землі й сягає максимуму на висоті 20—25 км. Це і є «озоновий шар» Якщо весь озон зібрати біля поверхні Землі при нормальному тиску, вийде шар завтовшки всього 2—3 мм.
Двоетапна реакція утворення озону з кисню починається під дією сонячної радіації У реакції розпаду атмосферного озону також бере участь сонячна радіація — тверде ультрафіолетове випромінювання з довжиною хвилі від 240 до 320 нм Енергія ультрафіолету витрачається на розкладання озону, і згубна радіація не доходить до поверхні Землі. Однак розпадатися озон може не тільки під впливом сонячних променів, але й самодовільно, а прискорюють цю реакцію численні каталізатори. Основний каталізатор — це нітроген оксид NO, що утворюється з азоту й кисню під дією найтвердішої сонячної радіації у верхніх шарах атмосфери. Потрапляючи в озоносферу, він вступає в цикл із двох реакцій:
О3
+ NO → NО2
+ О2
,
NО2
+ О → NO + О2
,
у результаті яких його вміст в атмосфері не змінюється, а концентрація озону знижується. Існують й інші цикли, що призводять до зниження вмісту озону, наприклад, за участю хлору:
Сl + О3
→ СlO + O2
,
СlO + О → СlO + O2
.
Руйнують озон також пил і гази, які у великій кількості потрапляють в атмосферу при виверженні вулканів. В останні десятиліття крім природних факторів, що впливають на озоновий шар, з'явились і штучні. Добре відомий приклад — фреони, які є джерелами атомів Хлору. Фреони — це вуглеводні, у яких атоми Гідрогену замінені на атоми Флуору і Хлору. Фреони не отруйні, чимало з них — леткі рідини або гази, що легко скраплюються, тому їх широко використовують у холодильній техніці та для заповнення аерозольних балончиків, які в усьому світі випускаються у величезній кількості (дезодоранти, лаки для волосся, освіжувачі повітря, засоби для миття вікон, полірування меблів та ін.). У результаті цього в повітря щорічно потрапляють сотні тисяч тонн фреонів, які повільно протягом багатьох років і навіть десятиліть піднімаються вище й вище, досягаючи озонового шару. Тут, розкладаючись під дією сонячної радіації, вони самі починають каталітично розщеплювати озон, і це призводить до зниження його концентрації. Фреони — не єдині рукотворні руйнівники озону. Наприклад, надзвукові літаки, що літають у стратосфері, викидають досить багато нітроген оксиду.
Як показують розрахунки, усе це може призвести до того, що через 50 років концентрація озону в стратосфері зменшиться на 25 %. Але ті ж розрахунки свідчать про одночасне збільшення концентрації озону в приземному шарі — тропосфері, і це також не обіцяє нам нічого доброго. І якщо стратосферний озон впливає на наше життя побічно, через зміну складу сонячної радіації, то озон у приземному шарі, як і продукти його хімічних перетворень, безпосередньо потрапляють у наші легені.
Звідки береться в тропосфері озон? Традиційне його джерело — конвекційне перенесення з масами повітря висотного (стратосферного) озону в нижні шари, за рахунок чого щохвилини на 1 квадратний метр приноситься в середньому 5—6 мкг озону. Отже, щорічно в приземний шар озону надходить приблизно 1,6 млрд тонн. Однак це створює лише невелику концентрацію приземного озону, хоча час життя молекули озону в нижній частині атмосфери значно вищий — більше 100 діб (це пояснюється тим, що тут меншою є інтенсивність ультрафіолетових променів, які руйнують озон). У чистому свіжому повітрі концентрація озону приблизно постійна і складає всього 0,016 мкг/л. Разом із цим нові дослідження показали, що сучасні люди вдихають значно більше озону, ніж їхні предки. Основна причина цього — збільшення в повітрі кількості метану й нітроген оксидів. Справа в тому, що в результаті довгого ланцюжка реакцій, у
яких крім метану, азоту, кисню і води бере участь також сонячне світло і
довжиною хвилі менше 430 нм, утворюється вода, формальдегід НСНО й озон Концентрація озону біля поверхні не залишається постійною протягом доби Після сходу сонця вона починає збільшуватися, сягає максимального значення до 14—16 години, потім зменшується — швидше вдень і повільніше вночі. Над океанами озону завжди більше, ніж над сушею. Не всі подібні факти вдається поки пояснити. Так, у знаменитому лос-анджелеському смозі концентрація озону в 20 разів більша за нормальну, але іноді в містах його виявляється менше, ніж у сільській місцевості. Очевидно, що різні забруднювачі в повітрі можуть призводити як до утворення, так і до руйнування озону.
Завжди вважалося, що під час грози концентрація озону різко збільшується, тому що блискавки сприяють перетворенню кисню на озон. Однак і тут усе виявилося складніше. Під час грози і протягом декількох годин після неї концентрація озону суттєво знижується, причому тим сильніше, чим потужніше хмара. Це пов'язано з тим, шо при розвитку грозової хмари під нею виникають потужні висхідні потоки повітря, які несуть озон догори. А при віддаленні хмари на 5—7 км концентрація озону підвищується — це вже працюють спадні потоки на периферії грозової хмари, що переносять озон зверху вниз.
А чи правда, що особливо багато озону в повітрі хвойних лісів? Знайти відповідь на це питання виявилося не так просто. Насамперед, жодна рослина озон не виділяє. Але хвойні й деякі листяні дерева (тополя, евкаліпт), а також злакові культури виділяють у повітря різні органічні речовини, які належать до ненасичених вуглеводнів. Вкрита лісом площа Землі складає мільйони гектарів, і
звідтіля в атмосферу надходять сотні тисяч тонн різних вуглеводнів, що набагато більше кількості фреонів, які викидаються. Але якщо фреони «вбивають» атмосферний озон, то вуглеводні сприяють його утворенню — за умови, що в повітрі є й інші домішки і
що все це піддається дії сонячної радіації. Так що озон у хвойному лісі — експериментально встановлений факт. Слід ще зазначити, що вуглеводні виділяють не тільки живі рослини. Величезна їхня кількість, у тому числі й метан, потрапляє в повітря під час
лісових і степових пожеж, коли горіння відбувається з браком кисню.
Отже, хочемо ми цього чи ні, нам доводиться вдихати озон — у великих або менших кількостях. Добре це чи погано? Якщо концентрація озону у вдихуваному повітрі перевищує певний поріг, це може викликати масу неприємних наслідків. У залежності від концентрації й часу вдихання, озон викликає зміни в легенях, подразнення слизуватих оболонок очей і
носа, головний біль, запаморочення, зниження кров'яного тиску. Але це не все. Озон зменшує опірність організму бактеріальним інфекціям дихальних шляхів. Гранично допустима його концентрація в повітрі складає всього 0,1 мкг/л, а це означає, що озон набагато небезпечніший за хлор!
Якщо довго дихати озоном при концентрації більше 2 мкг/л, наслідки можуть бути більш загрозливими — аж до заціпеніння або зниження серцевої діяльності. При вмісті озону 8—9 мкг/л через кілька годин виникає набряк легень, що загрожує смертельним результатом. Але ж такі незначні кількості навіть важко піддаються хімічному аналізу звичайними методами. На щастя, людина відчуває присутність озону вже при дуже малих його концентраціях (менше 1:1000 000), при яких йодокрохмальний папір ще й не збирається синіти. Одним людям запах озону в малих концентраціях нагадує запах хлору, іншим—сірчистого газу, третім—часнику.
Отруйний не тільки сам озон. За його участю в повітрі утворюється, наприклад, пероксиацетилнітрат (ПАН) СН3
—CO—OON02
— речовина, що має сильну подразливу, у тому числі сльозоточиву дію, ускладнює дихання, а в більш високих концентраціях викликає параліч серця. ПАН — один із компонентів смогу. Не дивно, шо наслідки виникнення смогу у великих містах можуть бути катастрофічними, особливо якщо повітря над містом не продувається «протягами» і утворюється застійна зона. Так, у Лондоні в 1952 році від смогу протягом декількох днів загинуло більше 4000 осіб. А смог у Нью-Йорку в 1963 році убив 350"осіб. Аналогічні історії були в Токіо та інших великих містах. Страждають від атмосферного озону не тільки люди. В областях з підвищеним вмістом озону в повітрі час служби автомобільних шин та інших виробів із гуми значно скорочується.
Проте, на думку вчених, повна відсутність у повітрі озону матиме несприятливі наслідки, тому що це знизить бактерицидні властивості свіжого повітря і збільшить вміст у ньому мікроорганізмів, прискорить ріст цвілі й грибків, призведе до нагромадження в повітрі шкідливих речовин і неприємних запахів, які він знищує. Таким чином, стає зрозумілою необхідність регулярного й тривалого провітрювання приміщень. Крім всього іншого, у такий спосіб поповнюється вміст у них озону.
|