Доклад
Электролиз и сферы его применения.
Содержание
1. Ведение 3
2. Теоретическое обоснование процессов электролиза. 5
3. Применение электролиза в промышленности 8
4. Производство хлора и едкого натрия при помощи электролиза. 10
5. Заключение 12
Введение
Электролиз – это совокупность процессов, протекающих в растворе или расплаве электролита, при пропускании через него электрического тока. Электролиз является одним из важнейших направлений в электрохимии.
Еще в начале позапрошлого столетия было установлено, что при прохождении электрического тока через водные растворы солей происходят химические превращения, приводящие к образованию новых веществ. В результате этого, в начале прошлого века возникло научное направление по изучению электрохимических процессов в растворах и расплавах веществ – электрохимия. К концу семидесятых годов оно разделилось на два самостоятельных раздела – ионику, изучающую явления электропроводности и движения заряженных частиц под воздействием электрического поля, и электродику, изучающую явления происходящие непосредственно на поверхности электродов, когда через границу электрод-раствор (расплав) протекает электрический ток. Химические превращения, происходящие при воздействии электрического тока на вещества, называются электролитическими.
Электролиз представляет собой довольно сложную совокупность процессов, к которым относятся: миграция ионов (положительных к катоду, отрицательных к аноду), диффузия ионов, разряжающихся на электродах, электрохимические реакции разряда ионов, вторичные химические реакции продуктов электролиза между собой, с веществом электролита и электрода.
Актуальность электролиза объясняется тем, что многие вещества получают именно этим способом. Например, такие металлы как никель, натрий, чистый водород и другие, получают только с помощью этого метода. Кроме того с его помощью электролиза относительно легко можно получить чистые металлы, массовая доля самого элемента в которых стремиться к ста процентам. В промышленности алюминий и медь в большинстве случаев получают именно электролизом. Преимущество этого способа в относительной дешевизне и простоте. Однако чтобы производство было наиболее выгодным: с наименьшими затратами электроэнергии и с наибольшим выходом продукции, необходимо учитывать различные факторы, влияющие на количество и качество продуктов электролиза (сила тока, плотность тока, температура электролита, материал электродов и др.).
На сегодняшний день большой популярностью пользуются различные предметы, покрытые драгоценными металлами. (позолоченные или посеребренные вещи).
К тому же металлические изделия покрывают слоем другого металла электролитическим способом с целью защитить его от коррозии.
Таким образом, исследование электрохимических процессов, определение факторов, влияющих на них, установление новых способов использования процессов электролиза в промышленных условиях сохранило свою актуальность и востребованность в наши дни.
Реклама

Теоретическое обоснование процессов электролиза.
Электролиз протекает только в тех средах, которые проводят электрический ток. Способностью проводить ток обладают также водные растворы оснований и солей. Безводные кислоты – очень плохие проводники, но водные растворы кислот хорошо проводят ток. Растворы кислот, оснований и солей в других жидкостях в большинстве случаев тока не проводят, но и осмотическое давление таких растворов оказывается нормальным, точно так же не проводят тока водные растворы сахара, спирта, глицерина и другие растворы с нормальным осмотическим давлением.
Различные отношения веществ к электрическому току можно иллюстрировать следующим опытом:
Соединим провода идущие от осветительной сети, с двумя угольными электродами. В один из проводов включим электрическую лампу, позволяющую грубо судить о наличии тока в цепи. Погрузим теперь свободные концы электродов в сухую поваренную соль или безводную серную кислоту. Лампа не загорается, т.к. эти вещества не проводят тока и цепь остается не замкнутой. То же самое происходит, если погрузить электроды в стакан с чистой дистиллированной водой. Но стоит только растворить в воде немного соли или прибавить к ней какой-нибудь кислоты или основания, как лампа тотчас же начинает ярко светиться. Свечение прекращается если опустить электроды в раствор сахара или глицерина и т.п.
Таким образом, среди растворов способностью проводить ток обладают преимущественно водные растворы кислот, оснований и солей. Сухие соли, безводные кислоты и основания (в твердом виде) тока не проводят; почти не проводит тока чистая вода, очевидно, что при растворении в воде кислоты основания или соли подвергаются каким-то глубоким изменениям, которые и обуславливают электропроводность получаемых растворов.
Электрический ток, проходя через растворы, вызывает в них, так же как и в расплавах, химические изменения, выражающиеся в том, что из растворов выделяются продукты разложения растворенного вещества или растворителя. Вещества, растворы которые проводят электрический ток, получили названия электролитов. Электролитами являются кислоты, основания и соли.
Химический процесс, происходящий при пропускании тока через раствор электролита, называется электролизом. Исследуя продукты, выделяющиеся у электрода, при электролизе кислот, оснований и солей, установили, что у катодов всегда выделяются металлы и водород, а у анода кислотные остатки или гидроксильные группы, которые затем подвергаются дальнейшим изменениям. Таким образом, первичными продуктами электролиза оказываются те же части кислот, оснований и солей, которые при реакциях обмена, не изменяются, переходят из одного вещества в другое.
Теперь, рассмотрим процесс электролиза подробнее.
Через проводники первого рода электричество переносится электронами, а через проводники второго рода—ионами. В тех местах электрической цепи, где проводник первого рода граничит с проводником второго рода, электроны вступают во взаимодействие с ионами—происходят электрохимические процессы. Если эти процессы протекают самопроизвольно, то система называется химическим источником энергии. Если же их протекание обусловлено подводом электрической энергии извне, то происходит электролиз.
Примером электролиза может служить электролиз расплава хлорида магния. При прохождении тока через расплав MgCl2
катионы магния по действием электрического поля движутся к отрицательному электроду. Здесь, взаимодействуя с приходящими по внешней цепи электронами, они восстанавливаются: Анионы хлора перемещаются к положительному электроду, и, отдавая избыточные электроны, окисляются. При этом первичным процессом является собственно электрохимическая стадия—окисление ионов хлора, а вторичным—связывание образующихся атомов хлора в молекулы. Складывая уравнения процессов, протекающих у электродов, получим суммарное уравнение окислительно-восстановительной реакции, происходящей при электролизе расплава MgCl2
:
Mg2
+ 2Cl-l=Mg + Cl2
Эта реакция не может протекать самопроизвольно; энергия, необходимая для её осуществления, поступает от внешнего источника тока.
Как и в случае химического источника электрической энергии, электрод, на котором происходит восстановление, называется катодом; электрод, на котором происходит окисление, называется анодом. Но при электролизе катод заряжен отрицательно, а анод—положительно, т.е. распределение знаков заряда электродов противоположно тому, которое имеется при работе гальванического элемента. При электролизе химическая реакция осуществляется за счёт энергии электрического тока, подводимой извне, в то время как при работе гальванического элемента энергия самопроизвольно протекающей в нем химической реакции превращается в электрическую энергию. На основании этого были выведены следующие законы:
Первый закон Фарадея
В 1832 году Фарадей установил, что масса M вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду Q, прошедшему через электролит: 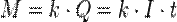
если через электролит пропускается в течение времени t постоянный ток с силой тока I. Коэффициент пропорциональности 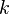 называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества. называется электрохимическим эквивалентом вещества. Он численно равен массе вещества, выделившегося при прохождении через электролит единичного электрического заряда, и зависит от химической природы вещества.
Второй закон Фарадея
Электрохимические эквиваленты различных веществ относятся, как их химические эквиваленты
.
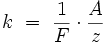 Химическим эквивалентомиона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент Химическим эквивалентомиона называется отношение молярной массы A иона к его валентности z. Поэтому электрохимический эквивалент
, где 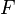 — постоянная Фарадея. — постоянная Фарадея.
Первый закон Фарадея записывается в следующем виде:
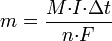
где 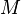 — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, — молярная масса данного вещества, образовавшегося (однако не обязательно выделившегося — оно могло и вступить в какую-либо реакцию сразу после образования) в результате электролиза, 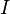 — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), — сила тока, пропущенного через вещество или смесь веществ (раствор, расплав), 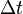 — время, в течение которого проводился электролиз, — время, в течение которого проводился электролиз, 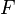 — постоянная Фарадея, — постоянная Фарадея, 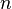 — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока). — число участвующих в процессе электронов, которое при достаточно больших значениях силы тока равно абсолютной величине заряда иона (и его противоиона), принявшего непосредственное участие в электролизе (окисленного или восстановленного). Однако это не всегда так; например, при электролизе раствора соли меди(II) может образовываться не только свободная медь, но и ионы меди(I) (при небольшой силе тока).
Не все вещества будут электролизироваться при пропускании электрического тока. Существуют некоторые закономерности и правила.
| Катионы
активных
металлов
|
Катионы
менее активных
металлов
|
Катионы
неактивных
металлов
|
| Li+
, Cs+
, Rb+
, K+
, Ba2+
, Sr2+
, Ca2+
, Na+
, Mg2+
, Be2+
, Al3+
|
Mn2+
, Cr3+
, Zn2+
, Ga3+
, Fe2+
, Cd2+
, In3+
, Tl+
, Co2+
, Ni2+
, Mo4+
, Sn2+
, Pb2+
|
Bi3+
, Cu2+
, Ag+
, Hg2+
, Pd3+
, Pt2+
, Au3+
|
| тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением водорода |
В водном растворе восстанавливаются металлы (при малой концентрации катионов в растворе — металл и водород) |
Легко разряжаются и восстанавливается только металлы |
| Анионы
кислородсодержащих
кислот
|
Гидроксид-ионы
;
анионы
бескислородных
кислот
(кроме
F
-
)
|
| PO4
3-
, CO3
2-
, SO4
2-
, NO3
-
, NO2
-
, ClO4
-
|
OH-
, Cl-
, Br-
, I-
, S2-
|
| Тяжело разряжаются (только из расплавов), в водном растворе электролизу подвергается вода с выделением кислорода |
Легко разряжаются |
Мнемоническое правило
Для запоминания катодных и анодных процессов в электрохимии существует следующее мнемоническое правило:
· На аноде анионы окисляются.
· На катоде катионы восстанавливаются.
· В первой строке все слова начинаются с гласной буквы, во второй - с согласной.
Применение электролиза в промышленности
Электролиз широко применяется в различных отраслях промышленности. В химической промышленности электролизом получают такие важные продукты как хлор и щелочи, хлораты и перхлораты, надсерную кислоту и персульфаты, перманганат калия, органические соединения, химически чистые водород, кислород, фтор и ряд других ценных продуктов.
В цветной металлургии электролиз используется для рафинирования металлов, для извлечения металлов из руд. Металлы, которые не могут быть выделены из водных растворов вследствие высокого отрицательного потенциала получают в цветной металлургии электролизом расплавленных сред, в качестве которых служат соли этих металлов, содержащие добавки различных соединений, вводимые с целью понижения температуры плавления расплава, повышения электропроводности и т.д. К числу металлов, получаемых электролизом расплавленных сред относятся алюминий, магний, цирконий, титан, уран, бериллий и ряд других металлов.
Электролиз применяют во многих отраслях машиностроения, радиотехники, электронной, полиграфической промышленности для нанесения тонких покрытий металлов на поверхность изделий для защиты их от коррозии, придания декоративного вида, повышения износостойкости, жаростойкости, получения металлических копий.
Несмотря на большое разнообразие электролитов, электродов, электролизеров, имеются общие проблемы технического электролиза. К ним следует отнести перенос зарядов, тепла, массы, распределение электрических полей. Для ускорения процесса переноса целесообразно увеличивать скорости всех потоков и применять принудительную конвекцию. Электродные процессы могут контролироваться путем измерения предельных токов.
Реклама

Заключение
Исследование процессов электролиза растворов и расплавов электролитов не потеряло своей актуальности и в настоящее время, т.к. не только обогащает теоретические положения об этом достаточно сложно физико-химическом явлении, но и позволяет определить перспективные направления практического использования этого процесса с целью получения целевых продуктов с заданными свойствами и качествами.
Электролиз широко используют в промышленности для выделения и очистки металлов, получения щелочей, хлора, водорода.
Алюминий, магний, натрий, кадмий, кальций, бериллий, титан получают только электролизом расплавов, т.к. потенциалы их выделения из водных растворов более отрицательны, чем потенциал выделения водорода.
Очистку меди, никеля, свинца проводят целиком электрохимическим методом. Производство фтора основано на электролизе расплавленной смеси фторида калия и фтороводородной кислоты, хлора – при электролизе водных растворов или расплавов хлоридов. Водород и кислород высокой степени чистоты получают электролизом водных растворов щелочей. Таким образом, с помощью электролиза удается осуществлять реакции окисления и восстановления с большим выходом и высокой селективностью, которые в обычных химических процессах трудно достижимы.
Важной отраслью применения электролиза является защита металлов от коррозии: при этом электрохимическим методом на поверхность металлических изделий наносится тонкий слой другого металла (хрома, серебра, меди, никеля, золота) устойчивого к коррозии.
Отличительной особенностью электролиза растворов или расплавов электролитов является возможность протекания на электродах совокупности конкурирующих химических реакций окисления и восстановления. Оказывает влияние на продукты электролиза и материал электродов.
При электролизе водных растворов электролитов окислительно-восстановительные процессы на катоде и аноде зависят от окислительной способности катионов и характера аниона электролита.
На основании проделанной работы можно сделать следующие выводы:
|