Взаимодействие низкомолекуляных соединений с мембранами: пространственное разделение, проницаемость и электрические эффекты
Введение
Биомембрана — это не просто пассивный барьер, разграничивающий клетки или органеллы и препятствующий свободному переносу растворенных веществ между водными компартментами. Мы остановимся именно на функции мембраны как барьера. Основной акцент будет сделан на взаимодействии между фосфолипидным бислоем и растворенными в окружающей его водной среде низкомолекулярными соединениями — как ионами, так и неэлектролитами. Вначале мы обсудим связывание таких молекул с мембраной, причем под связыванием будем понимать как адсорбцию на поверхности, так и проникновение внутрь бислоя. Любое попавшее в бислой вещество может диффундировать через него и выйти с противоположной стороны. В этих рамках здесь обсуждается проблема проницаемости мембраны для неэлектролитов. Чтобы понять, каков механизм взаимодействия ионов с мембраной, необходимо рассмотреть общий профиль электрической составляющей потенциальной энергии мембраны. Знание электрической составляющей свободной энергии иона, находящегося вблизи мембраны или внутри ее, чрезвычайно важно не только для понимания того, как связываются с поверхностью мембраны ионы двух- или одновалентных металлов, но и для оценки локальных значений рН на поверхности мембраны, а также для моделирования механизмов регуляции ферментов и ионных каналов с помощью изменения электрического напряжения на бислое.
1. АНАЛИЗ АДСОРБЦИИ ЛИГАНДОВ НА БИСЛОЕ
Перед тем как приступить к изложению материала, обсудим, каким образом можно описать адсорбцию лигандов на поверхности бислоя. Необходимость такого описания возникает при анализе многочисленных экспериментальных ситуаций, при этом можно использовать несколько подходов. Здесь мы подробно рассмотрим адсорбцию на бислое ионов и амфифильных молекул, хотя такой же анализ применим для любых молекул, способных связываться с поверхностью бислоя. В связывании низкомолекулярных соединений с белками обычно участвуют вполне определенные специфические центры. Изучая связывание молекул с белком, можно определить 1) число центров связывания на молекуле белка; 2) сродство центра связывания к лиганду; 3) степень взаимодействия между центрами связывания, т.е. кооперативность. Экспериментально все эти характеристики можно получить из анализа кривой связывания, т.е. зависимости количества связанного лиганда от концентрации свободного лиганда. Анализ такой зависимости относительно несложен, поскольку имеется лишь фиксированное число центров связывания, которые могут быть либо заняты, либо свободны. Такой же подход применим при изучении связывания каких-либо лигандов с определенным центром на мембране.
Реклама

Анализ адсорбции молекул на поверхности липидного бислоя, однако, гораздо более сложен, поскольку в этом случае понятие центра связывания не столь однозначно. Подход, который следует использовать в этом случае, и информация, которую можно получить, зависят от конкретной экспериментальной ситуации. Рассмотрим несколько таких подходов.
Равновесное распределение
Данная модель рассматривает мембрану как отдельную фазу. Небольшие молекулы распределяются между водной фазой и мембраной в соответствии с коэффициентом распределения Кр
,
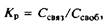
где Ссвяз
и Ссвоб
— концентрации связанного с мембраной и свободного лиганда соответственно. В такой модели насыщение отсутствует, т. е. концентрация связанного лиганда будет расти до бесконечности с увеличением его концентрации в водной фазе. Естественно, это нереальная ситуация, и данная модель применима только в том случае, если количество связанного лиганда относительно мало. Отметим, что в данной модели не содержится никакой информации о центрах связывания. При концентрациях лиганда, далеких от насыщения, т. е. в условиях, когда заполнена лишь небольшая доля потенциальных центров связывания, практически любое уравнение адсорбции сводится к уравнению.
Коэффициент распределения можно выразить несколькими способами. Проще всего представить концентрацию связанного лиган-да как поверхностную концентрацию NCB
„, имеющую размерность моль/см2
, и тогда коэффициент распределения /3 имеет размерность длины:
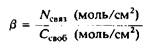
Если N. Тогда, если пренебречь краевыми эффектами, 10000 молекул липида в квадратной решетке дадут 20000 возможных пар перекрывающихся центров. Аккуратное вычисление числа доступных центров связывания представляет собой основную проблему при получении правильного выражения для изотермы адсобрции.
Связывание с п лигандами
Проблему правильного подсчета перекрывающихся центров связывания можно частично решить, рассмотрев простое равновесное связывание лиганда с п молекулами фосфолипида. В этом случае образование комплекса между лигандом L и фосфолипидами Р можно представить в следующем виде:
Реклама

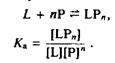
Такой способ с успехом применялся, например, для анализа связывания Са2+
с фосфатидилхолиновым бислоем с п = 2, которое
нельзя описать с помощью простой изотермы Лэнгмюра. Получаемое в рамках такой модели уравнение показывает, что график Скэтчарда должен быть не линейным, а вогнутым.
Учет формы лиганда
Решить до конца эту задачу не удается даже с помощью приведенного выше анализа, поскольку он не учитывает форму лиганда. Если рассматривать мембрану как двумерную решетку, то для полного анализа нужно рассчитать укладку на такой плоскости крупных лигандов определенной формы, каждый из которых способен связываться с несколькими определенным образом расположенными друг относительно друга узлами решетки. Например, молекула, имеющая форму стержня, будет связываться с расположенными линейно центрами решетки. Каждая связавшаяся с решеткой молекула лиганда будет в зависимости от формы блокировать определенное число дополнительных центров связывания. Полный анализ, учитывающий как перекрывание центров связывания, так и форму лиганда, хотя и довольно сложен, был все же проделан. Такой анализ можно также распространить на лиганды, которые способны проникать внутрь мембраны и поэтому будут занимать дополнительные узлы решетки.
Основной вывод состоит в том, что формальный термодинамический анализ связывания с мембраной даже небольших молекул лиганда может оказаться весьма сложным, и часто для этого недостаточно простого применения стандартных уравнений. Как мы увидим, помимо перекрывания центров связывания, ограниченного стерическими взаимодействиями, для полного описания адсорбции на поверхности мембраны заряженных лигандов необходимо учитывать также и электростатические взаимодействия.
2. КЛАССЫ ЛИГАНДОВ, СПОСОБНЫХ ВЗАИМОДЕЙСТВОВАТЬ С ЛИПИДНЫМ БИСЛОЕМ
Литература, описывающая взаимодействие низкомолекулярных соединений с биологическими и модельными мембранами, чрезвычайно обширна. Для простоты разделим эти соединения в соответствии с их полярностью на следующие классы: неполярные, ам-фифильные и ионные. С учетом такой классификации кратко рассмотрим некоторые работы, посвященные взаимодействию лигандов с мембранами.
Класс I: неполярные вещества
Липидный бислой, вообще говоря, можно рассматривать как двумерную жидкость, поэтому определенный интерес представляет способность этой жидкости растворять небольшие неполярные молекулы. Такие данные весьма ценны для понимания того, как гидрофобные домены белков взаимодействуют с бислоем. В качестве примера можно привести исследование раствора гексана в диолеил-фосфатидилхолине. Вероятнее всего, в большинстве случаев такие неполярные молекулы, как гексан, локализуются в центре бислоя. Такая локализация для гексана была выявлена с помощью метода нейтронной дифракции, хотя при более высоких концентрациях гексана вполне возможны более сложные варианты взаимодействия.
Класс II: аифифильиые молекулы
Это, безусловно, наиболее обширная из исследованных группа молекул. В нее входят многие анестетики, лекарственные препараты, фармакологическая активность которых зависит от их способности взаимодействовать с мембранами. К этой категории также можно отнести целый ряд антибиотиков и другие природные соединения, в частности соли желчных кислот и жирные кислоты. Кроме того, амфифильными свойствами обладают многие используемые для изучения мембран флуоресцентные и спиновые метки. Все эти соединения имеют четко различимые полярные и неполярные части и эффективно взаимодействуют с поверхностью мембраны. Некоторые из таких амфифильных соединений при достаточно больших концентрациях действуют на мембрану как детергенты и разрушают бислой. Показано также, что некоторые амфифильные вещества даже в умеренных концентрациях оказывают на биомембраны повреждающее действие.
Анестетики
Существует много типов анестетиков — от атомарного ксенона до сложных органических гетероциклических соединений. Вообще говоря, фармакологическая активность анестетиков хорошо коррелирует с их коэффициентом распределения в системе масло/вода. Это позволяет предположить, что механизм их действия включает в себя неспецифические взаимодействия с липидами мембран нервных клеток. Исследованию природы взаимодействия анестетиков с биологическими или модельными мембранами посвящено довольно много работ. Хотя в этих работах и было показано, что анестетики способны нарушать структуру липидного бислоя, механизм их действия до сих пор остается загадкой. Вполне вероятно, что эффект этих соединений прямо или косвенно связан с влиянием на специфические белки мембран нервных клеток. Методом
ЯМР исследовали непосредственное действие на мембраны ряда анестетиков, в частности анестетика общего действия хлоральги-драта, анестетиков местного действия прокаина, тетрака-ина и дибукаина и стероидных анестетиков. Распределение между мембраной и водной фазами стероидов, обладающих анестезирующим эффектом, не отличается от распределения любых других стероидов, и их влияние на состояние липидного слоя определяется, по-видимому, специфическими структурными особенностями.
Лекарственные препараты
Из лекарственных препаратов лучше всего исследован хлорпро-мазин. В частности, изучено его проникновение в липидные бислой-ные везикулы и в мембраны эритроцитов. В обоих случаях коэффициенты распределения в системе мембрана/вода были одинаковы. При введении в эритроциты хлорпромазина в больших количествах происходит существенное изменение структуры бислоя вплоть до его полного разрушения. Максимальное количество проникшего в мембрану хлорпромазина, по оценкам, занимает объем, превышающий объем самого бислоя. Вероятно, при больших концентрациях происходит агрегация незаряженной формы этого препарата в центре бислоя, что приводит к значительному увеличению толщины мембраны. В более умеренных количествах хлорпромазин вызывает образование в мембране пор диаметром ~ 14 А и, как следствие, лизис. Природа формирования пор неясна.
Антибиотики
Токсичность некоторых антибиотиков обусловлена, по всей видимости, их взаимодействием с мембраной.
1. Полимиксин В представляет собой циклический полипептид, состоящий из пяти положительно заряженных аминокислотных остатков и гидрофобной ацильной боковой цепи. Антибиотик 'специфичен в отношении грамотрицательных бактерий; его мишенью являются в первую очередь отрицательно заряженные липиды в наружной клеточной и цитоплазматической мембранах. Полимиксин имеет настолько высокое сродство к отрицательно заряженным липидам, что с его помощью можно вызвать латеральное перераспределение разных форм липидов в фосфоли-пидных везикулах. Взаимодействие клеток Е. соЧ с полимиксином Приводит к увеличению проницаемости мембран и выходу цито-Олазматического материала наружу, что однозначно указывает на разрушение мембраны.
2.Полиеновые антибиотики — амфотерицин В, нистатин и филипин — представляют собой мембрано-активные противогрибковые препараты. Они могут вызывать лизис дрожжевых клеток, эритроцитов и клеток млекопитающих. Предполагают, что литическая активность этих антибиотиков обусловлена их ассоциацией со стероидами в мембране и формированием пор. Образование таких комплексов было обнаружено методом ЯМР; определены константы комплексообра-зования с различными стероидами, встроенными в фосфолипидные везикулы. Богатые стероидами мембраны выявляли по флуоресценции комплексов филипина со стероидами.
3.Адриамицин по своей структуре относится к антрациклиновым гликозидам. Это противоопухолевый препарат, чье применение, правда, ограничено вследствие его кардиотоксич-ности. Адриамицин специфически связывается с кардиолипином в мембране, и, возможно, именно этим обусловлена его токсичность. С помощью молекулярного моделирования и минимизации энергии пытались рассчитать конформацию адриамицина, связанного с поверхностью бислоя за счет электростатического связывания с фосфатными группами кардиолипина.
Детергенты
Дигитонин и близкие ему по структуре сапонины, которые имеют высокое сродство к мембраносвязанным стеролам и, по-видимому, связываются в стехиометрии 1:1 с содержащимся в мембране холестеролом. Полиеновые антибиотики, адриамицин и дигитонин, — это необычные примеры амфифильных молекул, обладающих избирательным сродством к определенным мембранным липидам.
Мембршнные метки
Часто флуоресцентные и спиновые метки представляют собой амфифильные молекулы. В качестве примера можно привести кар-боцианиновые красители, используемые для изучения кинетики восстановления флуоресценции после фотообесцвечивания. Эта метка связывается с одной стороной мембраны и не может с помощью флип-флоп-перехода попасть на другую сторону и связаться с мембранами внутриклеточных органелл. Такая асимметрия связывания доказана экспериментально. Другой пример — спиновые и флуоресцентные метки, которые могут связываться с мембраной и используются для изучения электрических свойств бислоя.
Класс Ilk гидрофобные ионы
Это молекулы, в которых заряженная группа находится в окружении неполярных групп, чем они и отличаются от простых амфи-фильных соединений, у которых полярная и неполярная части молекулы разделены. При связывании амфифильной молекулы с мембраной ее полярная группа оказывается локализованной ближе к водной фазе, а неполярная — погруженной в бислой. В случае же гидрофобных ионов зяряженная часть по крайней мере на несколько ангстрем проникает в гидрофобную область мембраны. Примерами могут служить ионы тетрафенилбората и тетрафенилфос-фония. Гидрофобными ионами являются и некоторые ионофоры.
Класс IV: ионы
Особый интерес представляют одно- и двухвалентные катионы, поскольку они уравновешивают суммарный отрицательный заряд большинства мембран. Кроме того, многие катализируемые мембраносвязанными ферментами мембранные процессы зависят от рН, поэтому большую роль играет распределение протонов вблизи бислоя.
3. Проницаемость липидных бислойных мембран длл неэлектролитов
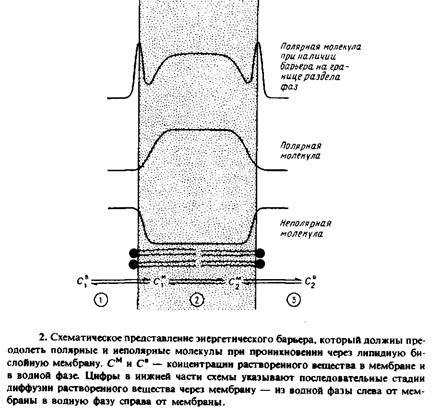
Способность молекулы растворенного низкомолекулярного вещества проникать через мембрану количественно выражается коэффициентом проницаемости. Физиологическое значение изучения мембранной проницаемости не вызывает сомнения. В отсутствие специфических транспортных белковых систем молекулы растворенного вещества могут попасть в клетку, только проникнув в ли-пидный бислой. Кроме того, по мембранной проницаемости можно судить о структуре и динамических свойствах липидного бислоя. Скорость вращательной и латеральной диффузии молекул в мембранах определяют с помощью сложных методов, однако коэффициент трансмембранной диффузии для пересекающих бислой молекул можно определить на основе простого измерения проницаемости. Механизм проникновения молекул через бислой также представляет большой интерес и может зависеть от наличия лабильных структурных дефектов в углеводородной области мембраны.
Чтобы пересечь бислой, молекула должна 1) проникнуть в мембрану, преодолев поверхностное натяжение или барьер свободной энергии на границе мембраны; 2) продиффундировать через бислой; 3) выйти из мембраны с противоположной стороны, вновь преодолев энергетический барьер на границе раздела фаз. Каждый из этих этапов в принципе может быть лимитирующей стадией всего процесса. Способность большинства неэлектролитов проходить через бислойные липидиые мембраны можно с успехом описать с помощью модели, учитывающей растворение данного вещества в мембране и его диффузию поперек бислоя. Согласно этой модели, лимитирующей стадией является диффузия молекулы в липидном бислое, а энергетические барьеры на границе раздела фаз считаются пренебрежимо малыми. Это позволяет полагать, что равновесие между водной и мембранной фазами устанавливается быстро. Коэффициент распределения Кр
задается в
этом случае выражением
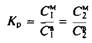
Определим коэффициент проницаемости Р как коэффициент пропорциональности в выражении для суммарного потока растворенного вещества со стороны 1 на сторону 2 через мембрану толщиной d, когда концентрации вещества в водных фазах по разные стороны мембраны различны:
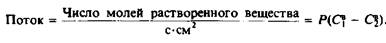
Этот же поток можно выразить через коэффициент диффузии, используя первый закон Фика. Коэффициент диффузии определяется как коэффициент пропорциональности, связывающий поток и градиент концентрации растворенного вещества внутри мембраны:
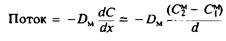
Предполагается, что в мембране устанавливается линейный градиент концентрации. Подставляя выражение в, получим
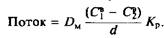
Сравнение выражений и показывает, что
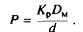
Таким образом, коэффициент проницаемости равен произведению коэффициента распределения и коэффициента диффузии вещества в мембране, деленному на толщину мембраны. Он измеряется в см/с, т. е. имеет размерность скорости.
С другой стороны, поток через мембрану можно выразить через константу скорости первого порядка к, имеющую размерность с '1
:
Поток = к AN,
где AN— разность поверхностных концентраций растворенного вещества между двумя сторонами мембраны в моль/см2
. Константа скорости также связана с коэффициентом проницаемости следующим соотношением, получаемым аналогично уравнению:
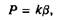
где 0 — коэффициент распределения для поверхностных концентраций. Такой подход удобен тем, что величина, обратная к, является мерой характерного времени перехода молекулы через бислой и к можно использовать для определения высоты энергетического барьера для пассивного транспорта.
Заметим, что уравнение для проницаемости по своей форме аналогично выражению для закона Ома для электрического тока. Такая аналогия помогает понять физический смысл проницаемости. Разность концентраций ДС представляет собой движущую силу, аналогичную электрическому напряжению, а поток растворенного вещества через мембрану эквивалентен электрическому току. Тогда величина, обратная проницаемости, эквивалентна электрическому сопротивлению, а сам коэффициент проницаемости — проводимости:
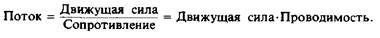
Продолжая аналогию, поток растворенного вещества через мембрану в соответствии с рис. 2 можно представить в виде эквивалентной электрической схемы, содержащей три последовательно соединенных сопротивления: сопротивление на входе в мембрану и выходе из нее и сопротивление самой мембраны. Уравнение выведено исходя из предположения, что сопротивление на границе ли-пид — вода пренебрежимо мало, что, вообще говоря, не всегда верно.
Экспериментально измеренный коэффициент распределения неэлектролита между водной фазой и мембраной близок к коэффициенту распределения в системе вода/неполярный растворитель. Из рис. 7.3 видно, что проницаемость фосфолипидного бислоя для неэлектролитов хорошо коррелирует с коэффициентом распределения в системе вода/гексадекан, причем эта корреляция сохраняется при изменении проницаемости в миллион раз. Эти данные подтверждают так называемое правило Овертона, согласно которому коэффициент проницаемости коррелирует с коэффициентом распределения в системе масло/вода. Наблюдения, послужившие основой правила Овертона, были сделаны еще в прошлом веке и послужили первыми указаниями на существование ограничивающего клетку мембранного барьера. Приведенная на рис. 7.3 линейная корреляция не означает, что коэффициент диффузии в уравнении одинаков для всех веществ. Однако эти данные указывают на систематическое изменение DM
с изменением коэффициента распределения для данного рода соединений, т. е. DM
нельзя рассматривать как независимую переменную. Это положение выполняется не всегда: например, Стейн и др. показали, что для некоторых биомембран отклонения от правила Овертона могут объясняться различиями в величине DM
для разных веществ.
Прямая на рис. 3 проведена по методу наименьших квадратов

через точки, соответствующие веществам с мол. массой от 50 до 300. Светлыми кружками представлены данные для веществ с очень маленькими молекулярными массами, например для воды. Для них величина Р в 2—15 раз больше, чем ожидаемая исходя из данных для крупных молекул. Это и другие отклонения от правила Овертона, полученные при изучении проницаемости мембран эритроцитов, использовались для подтверждения адекватности модели процесса диффузии через бислой. Согласно модели, эти отклонения отражают крутую зависимость коэффициента мембранной диффузии Du
от размеров молекулы растворенного в бислое вещества. Такая зависимость наблюдалась ранее для диффузии в некоторых полимерах. Диффузия молекул в полимере и в жидкости по-разному зависит от размеров и формы молекулы растворенного вещества. Согласно уравнению Стокса — Эйнштейна, коэффициент поступательной диффузии для сферической частицы обратно пропорционален ее радиусу. Поступательную диффузию в полимере можно рассматривать как цепь последовательных переходов молекулы между соседними элементами свободного объема, которые спонтанно формируются при флуктуациях полимера. Скорость диффузии в таком случае будет зависеть от числа элементов необходимого объема и от скорости их образования. В результате зависимость коэффициента диффузии вещества в полимере от размеров и формы диффундирующей молекулы будет очень сильно отличаться от аналогичной зависимости для диффузии в жидкости. И биомембраны, и чистые фосфолипидные бислой, по-видимому, в отношении коэффициентов поступательной диффузии низкомолекулярных неэлектролитов ведут себя как размягченные полимеры.
В табл. 7.1 приведены коэффициенты проницаемости биологических и модельных мембран для нескольких типов небольших молекул. Детальное обсуждение способов измерения этих коэффициентов выходит за рамки данной книги, однако в работе Стейна можно найти некоторые методические подробности. Обычно такого рода исследования включают измерение количества радиоактивно меченных соединений, накопившихся или вышедших из клеток или многослойных липосом либо перенесенных через плоскую мембрану. Плоские мембраны более всего подходят для электрометрического измерения ионных потоков, но нередко используются и для изучения транспорта неэлектролитов. Липосомы позволяют получить очень большую площадь поверхности и весьма стабильны, что дает возможность изучать транспорт молекул при чрезвычайно низких коэффициентах проницаемости. По оценкам, площадь поверхности мембран в суспензии липосом с концентрацией 2 мг/мл составляет 10000 А2
/мл. При этом за проницаемостью липосом следят, измеряя мутность или светорассеяние суспензии. Как видно из табл. 1, вода проникает через бислойные мембраны относительно легко и при изменении осмотичности среды в результате переноса растворенных веществ будет перемещаться внутрь липосом или из них. При сжатии или набухании многослойных липосом будет изменяться мутность суспензии, и следя за этим изменением, можно определить проницаемость мембран для' того или иного вещества. Единственная техническая проблема в таких исследованиях — наличие у поверхности мембраны непереме-шивающегося слоя толщиной 50 мкм или более. Локальная концентрация растворенного вещества в этом слое из-за плохого перемешивания может очень сильно отличаться от концентрации данного вещества в объеме.
Таблица 1. Коэффициенты распределения некоторых веществ и проницаемость для них мембран
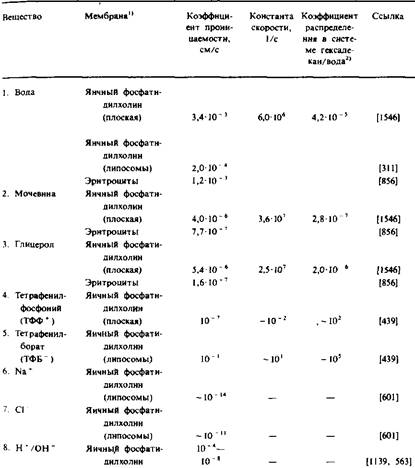
Таким образом, барьером проницаемости биомембран для низкомолекулярных неэлектролитов является фосфолипидный бислой. В отсутствие специфических каналов модельные бислойные мембраны и биомембраны ведут себя сходным образом.
2.1. ПРОНИЦАЕМОСТЬ ДЛЯ ВОДЫ
Как это ни удивительно, вода может довольно легко проникать через фосфолипидный слой. Данные однозначно показывают, что внутри мембраны в гидрофобной ее области воды практически нет. Коэффициент распределения для воды в гексадекане не противоречит этому выводу, поскольку предсказывает, что концентрация воды в мембране должна быть порядка нескольких миллимолей, т. е. на 103
молекул фосфолипида должна приходиться примерно одна молекула воды. Кроме того, из значения коэффициента проницаемости следует, что при движущей силе, соответствующей трансмембранной разности концентраций 0,1 М, скорость потока воды должна составить около 10—100 молекул в секунду на молекулу фосфолипида. Как следует из рис. 3, по сравнению с другими неэлектролитами проницаемость фосфолипидного бислоя для воды выше, но не намного. Константа скорости для потока воды составляет 10б
с ~ 1
, т. е. молекула воды диффундирует через всю толщину мембраны всего за 1 мкс. Таким образом, очень маленькая стационарная концентрация воды в гидрофобной области мембраны вполне согласуется с наличием весьма интенсивного ее потока через бислой.
Не исключено также, что концентрация воды в гидрофобной области бислоя выше, чем оцениваемая исходя из данных о коэффициенте распределения. Более того, в ряде работ высказывается предположение о существовании в мембране временных трансбислой-ных цепочек из молекул воды, соединенных водородными связями. Предполагается, что такие структуры играют роль проводников протонов через мембрану.
Транспорт воды через липидный бислой можно также изучать, используя и однослойные везикулы. Такие везикулы представляют собой прекрасные осмометры. Если концентрация соли внутри них выше, чем снаружи, то поток воды будет направлен внутрь везикулы, что приведет к созданию осмотического давления и последующему набуханию липосом. При набухании везикулы могут увеличиваться в радиусе вплоть до 5% и при этом оставаться стабильными, но степень набухания в очень большой степени зависит от размеров везикулы.
Проницаемость биомембран для воды обычно раз в 10 выше, чем проницаемость модельных мембран. Наиболее детально изучены в этом отношении эритроциты. Как показано в целом ряде лабораторий, обработка мембран эритроцитов сульфгидриль-ным реагентом л-хлормеркурийбензосульфонатом приводит к инги-бированию транспорта воды, уменьшая проницаемость для нее до уровня, характерного для липидного бислоя. По-видимому, этот SH-реагент действует на белок полосы 3, а возможно, и на белок полосы 4.5 анионного канала эритроцитов. По-видимому, проницаемость эритроцитарных мембран для воды обусловлена главным образом транспортом через канал, образуемый белком анионного переносчика. Аналогичные результаты были получены для препаратов мембран почек, откуда следует, что каналы для воды имеются и в этой системе.
3. Электрические свойства мембран
Прежде чем перейти к обсуждению проницаемости липидного бислоя для ионов, рассмотрим электрические свойства мембран. Нам нужно найти суммарный трансмембранный электрический потенциал, что позволит оценить работу, необходимую для перемещения заряда из одной точки в другую. Это нужно для понимания механизма перемещения ионов через мембрану и для анализа распределения зарядов внутри мембраны и у ее поверхности. Это могут быть ионы, находящиеся в водной фазе у поверхности бислоя или на границе раздела фаз мембрана—вода, а также белки с заряженными аминокислотными остатками.
Напомним некоторые определения.
1. Число Фарадея F— это заряд одного моля одновалентного иона:
F= Число АвогадроЭлементарный заряд =
= -1,602-10" 19
кулон = 105
кулон/моль.
2. Электрическое напряжение V. Применительно к мембранам термины «напряжение», «потенциал», «разность потенциалов» и «разность напряжений» эквивалентны. Напряжение — это электрическая работа, необходимая для перемещения заряда из одной точки пространства в другую. Напряжение 1 В соответствует разности потенциалов, для перемещения против которой заряда, равного 1 Кл, нужно совершить работу в 1 Дж. При измере
нии напряжения всегда нужна некая точка отсчета. Для мембран обычно в качестве такой точки берется точка, расположенная очень далеко от поверхности мембраны, и потенциал в ней принимается равным нулю.
3.Сила тока I измеряется в амперах; один ампер по определению равен одному 1 Кл/с.
4.Проводимость или сопротивление характеризует сопротивление потоку заряженных частиц, направленному от одной точки к другой. Эти величины определяются из закона Ома, связывающего силу тока с разностью потенциалов: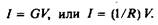
Проводимость измеряется в сименсах, а обратная ей величина — сопротивление — в омах. Проводимость 1 См означает, что при изменении разности потенциалов на 1 В сила тока изменяется на 1 Клс-1
.
5.Удельное сопротивление qиспользуется для характеристики гомогенных проводящих сред, в частности для описания ионного потока через заполненные водой мембранные каналы. Удельное сопротивление — это электрическое сопротивление среды между двумя электродами площадью 1 см2
, находящимися друг от друга на расстоянии 1 см. Размерность удельного сопротивления — Ом-см. Сопротивление среды между двумя электродами площадью А, находящимися на расстоянии х друг от друга, можно определить по формуле
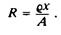
6. Емкость С. Для создания разности потенциалов между двумя
точками, в частности между двумя сторонами бислоя, достаточно
просто разделить заряды между этими точками. Емкость — это ве-
личина разделенных зарядов, необходимая для создания определен-
ной разности потенциалов:
С = Q/V,
где Q— величина заряда с каждой стороны мембраны, положительного с одной и отрицательного с другой, V — создаваемая разность потенциалов. Емкость измеряется в фарадах. Емкость мембраны — очень важная электрическая характеристика, поскольку она определяет, какое количество зарядов нужно перенести через мембрану, чтобы создать на ней определенное напряжение. Удельная емкость равна емкости единицы площади и зависит от количества зарядов, разделенных на единице площади мембраны.
В первом приближении бислойную мембрану можно предста-
вить в виде тонкой пластины из непроводящего материала, разделяющей два водных раствора. Таким образом, мембрана является обычным плоским конденсатором, в котором заряды находятся на двух границах раздела фаз мембрана—вода. Емкость такого конденсатора зависит только от расстояния между двумя заряженными поверхностями и диэлектрической проницаемости материала между этими поверхностями. Диэлектрическая проницаемость характеризует поляризуемость материала, т. е. то, насколько эффективно помещенный в среду из этого материала постоянный электрический диполь «чувствует» приложенное электрическое поле. Большая диэлектрическая проницаемость формально означает «компенсацию» части зарядов на поверхности мембраны, так что для создания одной и той же разности потенциалов в случае большой е необходимо перенести через мембрану ббльший заряд.
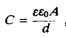
где £о — так называемая абсолютная диэлектрическая проницаемость, т. е. диэлектрическая проницаемость вакуума, равная 8,85-10~12
Кл-В_1
-м~. Для фосфолипидных бислоев и биомембран измеряемые значения удельной емкости примерно равны и составляют около 1 мкФ/см2
, что соответствует диэлектрической проницаемости е = 2 при толщине около 25 А. В отличие от емкости электрическое сопротивление мембраны зависит от ее типа и от числа ионных каналов и для разных мембран варьирует в широких пределах.
Теперь мы можем перейти к определению суммарного трансмембранного электрического потенциала. Работа, необходимая для перемещения заряда, который находится на бесконечно большом расстоянии от мембраны, к поверхности мембраны, а затем в гидрофобную область бислоя, имеет следующие составляющие.
1.Работа, связанная с переносом заряда из среды с одной диэлектрической проницаемостью в среду с другим ее значением. Необходимость совершения такой работы связана с различием в поляризации диполей этих сред, и именно этим в значительной степени обусловлена дестабилизация зарядов в гидрофобной области мембраны.
2.Дипольный потенциал. Основной вклад вносят, по-видимому, ориентированные карбонильные группы фосфолипидных молекул. Возможно, определенную роль играют и ориентированные молекулы воды.
3.Поверхностный потенциал. Создается заряженными группами на поверхности мембраны.
4.Трансмембранный потенциал. Образуется за счет разделения
зарядов между водными фазами по разные стороны мембраны. Ои может создаваться в результате работы электрогенных ионных насосов или благодаря пассивной проницаемости бислоя для ионов в равновесных или стационарных условиях.
Рассмотрим вкратце каждый из этих компонентов.
3.1. РАБОТА, СОВЕРШАЕМАЯ ПРИ ПЕРЕНОСЕ ИОНА ВНУТРЬ БИСЛОЙНОЙ МЕМБРАНЫ
Любой ион в воде стабилизируется благодаря взаимодействиям с диполями воды. Перемещение иона из воды в центр мембраны энергетически невыгодно, поскольку сопряжено с затратами энергии на освобождение иона от гидратной оболочки. Наиболее адекватной количественной моделью такого перехода является модель Борна. Работа, необходимая для переноса иона с зарядом qи радиусом г из среды с диэлектрической проницаемостью £2 в среду с диэлектрической проницаемостью Е\, определяется по формуле
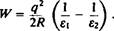
Диэлектрическая проницаемость воды равна 80; для внутренней части мембраны обычно используют характерную для углеводородов величину Јi = 2. Тогда работа, совершаемая при переносе иона с валентностью Z, составит W = ккал/моль. То есть для_ перемещения внутрь мембраны одновалентного иона радиусом 2 А нужно затратить 40 ккал/моль. Ясно, что такое перемещение энергетически весьма невыгодно, иными словами, бислой является труднопреодолимым барьером для ионов. Отметим, однако, что ионы большого радиуса весьма эффективно могут стабилизироваться в мембране. Это помогает понять, каким образом про^' никают через мембрану такие ионы, как I3
~ SCN" и заряженные комплексы ионов с ионофорами.
Помимо энергии Борна имеется еще один компонент, связанный с возникновением на границе с диэлектриком сил поляризации. Появление заряда по одну сторону от границы раздела фаз вызывает переориентацию диполей в среде по другую сторону мембраны. Соответствующая энергия называется энергией «отображения». Для мембран она соответствует только 10—15%-ному уменьшению энергии Борна.
Все упомянутые модели рассматривают мембрану как простой слой диэлектрика. Ясно, однако, что находящиеся по краям бислоя полярные головки создают слой толщиной около 10 А, существенно отличающийся по своим свойствам от гидрофобного центра.
Диэлектрическая проницаемость в этой области должна измениться от 2 по одну сторону до 80 — по другую; в качестве средней величины приводятся значения от 10 до 30. Согласно модели, в это значение вносит свой вклад вращение полярных фосфолипидных головок. Гидрофильные области мембран интересны еще и тем, что именно здесь происходит связывание многих мембранных зондов и амфифильных молекул.
3.2. ПОТЕНЦИАЛ ВНУТРЕННИХ ДИПОЛЕЙ
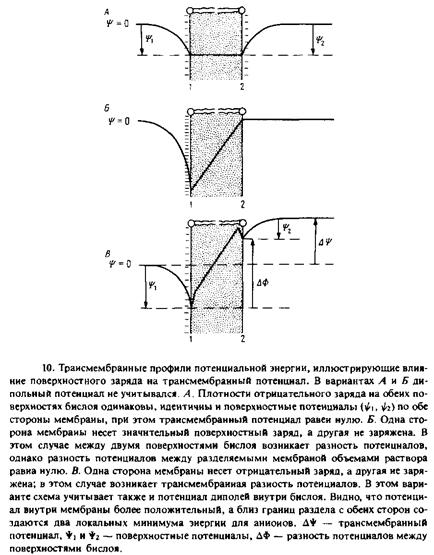
Как показывают экспериментальные и теоретические данные, ориентированные диполи на поверхности мембраны создают в центре фосфолипидного бислоя потенциал, равный примерно 240 мВ, положительный внутри. Это эквивалентно вкладу в свободную энергию 5,5 ккал/моль, положительному для катионов и отрицательному для анионов. Полярные фосфохолиновые головки ориентированы параллельно плоскости мембраны и не должны ни при каких условиях образовывать диполи, направленные положительным концом внутрь мембраны, поскольку для этого положительно заряженный остаток холина должен располагаться ближе к центру бислоя, чем отрицательно заряженный фосфат. Вероятнее всего, внутренние диполи связаны с ориентированными карбонильными группами эфирных связей фосфолипидных молекул. Влияние этого потенциала на профиль потенциальной энергии, по-видимому, ограничивается лишь внутренней частью мембраны и проиллюстрировано на рис. 7.4.
При транспорте ионов небольшого размера, например Na+
и О ", это приводит к тому, что высота энергетического барьера для транспорта анионов через бислой оказывается несколько меньшей, чем для транспорта катионов. Тем не менее, для небольших ионов любого заряда этот барьер остается достаточно высоким, а результирующие коэффициенты проницаемости через бислой — очень малыми.
Все сказанное не распространяется на такие гидрофобные ионы, как ТФФ+
и ТФБ~. У этих ионов заряд окружен неполярными группами, и благодаря вкладу гидрофобной компоненты в суммарное изменение свободной энергии коэффициент распределения для этих ионов сильно сдвинут в пользу мембраны. Гидрофоб-ность окружения позволяет скомпенсировать большую часть электростатической энергии. Кроме того, сама энергия Борна для этих ионов меньше из-за их относительно больших размеров. Профиль свободной энергии для гидрофобных ионов также показан на рис. 7.4. Как видно из этих данных, гидрофобная компонента свободной энергии для обоих ионов составляет около - 7 ккал/моль, а взаимодействие с внутренними диполями приво-

дит к стабилизации гидрофобных анионов в бислое. Обратите внимание на минимумы в профиле потенциальной энергии, соответствующие связыванию гидрофобных анионов вблизи поверхности мембраны — в той области, где локализуются эфирные группы фосфолипидов.
В результате влияния потенциала внутренних диполей гидрофобные анионы значительно прочнее связываются с бислоем и легче проникают через мембрану, чем гидрофобные катионы, имеющие очень близкую структуру: коэффициенты проницаемости для них различаются на шесть порядков, а константы связывания с бислоем — на четыре-пять порядков.
При связывании некоторых гидрофобных ионов с фосфатидилхолиновым бислоем наблюдается насыщение при концентрации ионов ~ 1 молекула на 100 молекул ли-пида. Это обусловливается электростатическим отталкиванием за счет поверхностного потенциала, образующегося при связывании ионов с поверхностью бислоя.
3.3. ПОВЕРХНОСТНЫЙ ПОТЕНЦИАЛ МЕМБРАНЫ
Поверхность большинства биомембран отрицательно заряжена в основном благодаря присутствию кислых фосфолипидов: обычно 10—20% мембранных липидов находятся в форме анионов. Отрицательным зарядом обладают и другие мембранные компоненты, например ганглиозиды или белки. Так, суммарный отрицательный заряд мембран тилакоидов в основном обусловлен белками. Отрицательно заряженные группы, например фосфатные или карбоксильные, фиксированы на поверхности мембраны, и, естественно, их заряд нейтрализуется Противоионами. Однако противоионы подвижны, а не закреплены жестко на поверхности мембраны; их концентрация меняется в объеме водной фазы таким образом, что устанавливается определенный баланс между стремлением ионов к равномерному распределению по объему вследствие энтропийного фактора и электростатическим притяжением к поверхностным зарядам. В результате противоионы локализуются не на самой поверхности мембраны, а на некотором расстоянии от нее, создавая так называемый двойной диффузионный слой. С физической точки зрения он представляет собой поверхность мембраны с фиксированной плотностью зарядов и диффузное облако противоионов вблизи нее. Электрический потенциал в околомембранном слое раствора является функцией поверхностной плотности заряда, а также концентрации и валентности иоиов в растворе. Наличие поверхностного потенциала приводит к ряду важных последствий, которые можно проверить экспериментально и объяснить с помощью довольно несложных теоретических построений. Мы не будем останавливаться на выводе соответствующих соотношений, а сконцентрируем свое внимание на тех последствиях, к которым приводит существование фиксированных зарядов на поверхности мембраны.
В теоретическом плане задача состоит в определении величины электрической потенциальной энергии как функции расстояния от поверхности мембраны. После нахождения этой зависимости можно вычислить локальную концентрацию любого иона и количественно описать любое связанное с поверхностным потенциалом явление, например электрофоретическую подвижность везикул или электростатическое притяжение между двумя соседними мембранами. Соответствующая теория разработана в начале века Пои и Чапменом, а позднее, в 20-х гг., дополнена Штерном. Эта теория, получившая название теории Пои—Чампена или Пои—Чапмена— Штерна, весьма успешно описывает связанные с заряженной мембраной электростатические эффекты.
В основу теории Гюи—Чапмена положены четыре предположения: 1) заряды равномерно распределены по поверхности мембраны; 2) ионы в растворе являются простыми точечными зарядами пренебрежимо малых размеров; 3) так называемые эффекты отображения — притяжение подвижных ионов при приближении к поверхности диэлектрика — считаются пренебрежимо малыми; 4) диэлектрическая проницаемость водной фазы считается величиной постоянной, одинаковой на поверхности мембраны и в объеме раствора. Каждое из этих предположений было проверено экспериментально и показано, что все они вполне разумны. Дополнение Штерна учитывает размеры связанных с поверхностью противоионов, что дает верхний предел числа ионов, которые физически могут связаться с мембраной.
Теоретические предсказания удобнее всего проиллюстрировать графически. На рис. 5 приведен профиль электрического потенциала в среде, содержащей соль одновалентных металлов в концентрации 0,1 М при разной поверхностной плотности заряда. Один заряд на 300 А2
соответствует примерно 20 мол.% отрицательно заряженного фосфолипида, а один заряд на 60 А2
— би-слою из чисто отрицательного заряженного липида. Как можно видеть из рисунка, электростатические эффекты распространяются на довольно значительные расстояния от поверхности мембраны. Потенциал на поверхности мембраны называется поверхностным, ♦о, и, очевидно, является функцией поверхностной плотности заряда. Рис. 7.5 иллюстрирует также влияние увеличения концентрации соли одновалентного металла в растворе. При высоких концентрациях соли электростатические эффекты в значительной мере нивелируются. При этом наблюдается уменьшение как поверхност-
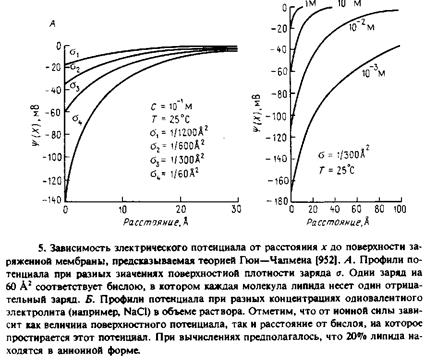
ного потенциала, так и эффективного расстояния, на которое простирается двойной электрически слой. Как следует из теории, для двухвалентных ионов экранирующий эффект выражен еще сильнее: влияние на поверхностный потенциал мембраны двухвалентных катионов, например Са2+
, проявляется при значительно меньших концентрациях, чем одновалентных. Эффекты, которые иллюстрирует рис. 7.6, не связаны с сорбцией ионов на поверхности мембраны, а обусловлены только экранированием. Наблюдаемое же довольно часто связывание двухвалентных катионов с заряженными группами на поверхности мембраны приводит к еще более выраженному уменьшению поверхностного потенциала.
Рис. 7 иллюстрирует влияние электрического потенциала на распределение анионов и катионов в растворе. Локальную концентрацию любого иона при известном электрическом потенциале несложно найти с помощью уравнения Больцмана:
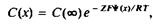
где С и if— концентрация иона и электрический потенциал на расстоянии х от поверхности мембраны, С — концентрация иона на бесконечном расстоянии от поверхности, Z— валентность иона, F— постоянная Фарадея. Потенциал 60 мВ при 25 °С соответствует примерно десятикратному изменению концентрации иона. Отметим еще раз, что значительное влияние на концентрационный профиль оказывает входящий в показатель экспоненты заряд иона Z.
С влиянием поверхностного потенциала связывают целый ряд самых разнообразных наблюдаемых в эксперименте эффектов. Можно считать экспериментально доказанным, что под влиянием поверхностного мембранного потенциала ♦о концентрация ионов в околомембранном слое изменяется в соответствии с теорией Гюи—Чапмена. Это касается протонов, ионов металлов и органических ионов.
Локальное значение рН на поверхности мембраны
Концентрация ионов вблизи отрицательно заряженной поверхности мембраны выше, чем концентрация в объеме, которую измеряют с помощью рН-метра. Поэтому кажущееся значение рКа
любой группы на поверхности отличается от истинного рКл
. Это касается, в частности, и титруемых групп самих фосфолипидов. На рис. 7.8 приведены кривые титрования карбоксильных групп
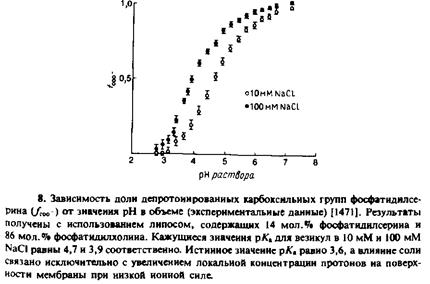
фосфатидилсерина, включенного в фосфатидилхолиновые везикулы. Кажущееся рКл
составляет 4,7 при 10 мМ NaCl и 3,9 при 100 мМ NaCl. Это различие обусловлено не изменением истинного значения рКл
этой группы, а увеличением концентрации Н +
на поверхности мембраны при низкой ионной силе из-за увеличения ifо- Истинное значение рКл
по оценкам должно составлять 3,6, а зависимость рКл
от концентрации ионов очень хорошо описывается теорией Гюи— Чапмена. Локальное значение рН вычисляли по уравнению, приняв х = 0. Близкие результаты были получены с использованием помещенных на поверхность мембраны рН-индикаторов. Было показано, что значение локального околомембранного рН отличается от рН в объеме на величину, предсказываемую теорией Гюи—Чапмена.
Истинное и кажущееся значения рКа
группы на поверхности мембраны
Константа диссоциации рКл
для протонирования группы на поверхности мембраны определяется следующим образом:

Связывание ионов металлов
Физиологическая значимость взаимодействия фосфолипидов с ионами металлов, в частности с Са2+
, не вызывает сомнений, и таким взаимодействиям было посвящено значительное число исследований. Для ответа на вопрос о том, как ионы металлов связываются с фосфолипидным бислоем и изменяют структуру мембраны, был привлечен целый ряд экспериментальных методов, в частности калориметрия, рамановская и инфракрасная спектроскопия, дифракция нейтронов и рентгеновских лучей, 31
Р-ЯМР и 2
Н-ЯМР. В табл. 2 приведены истинные константы диссоциации для некоторых катионов металлов, связанных с кислыми или цвиттерионными липидами. Некоторые из этих величин получали, регистрируя изменение поверхностного потенциала при связывании ионов металлов с фосфолипидными везикулами. Связывание катионов приводит к уменьшению плотности отрицательных зарядов в случае кислых фосфолипидов либо к увеличению плотности положительных зарядов в случае везикул из цвиттерионных липидов. И в той и в другой системах для анализа данных применима теория Гюи—Чапме-на. Истинные константы связывания рассчитывали, исходя из концентрации свободных ионов вблизи поверхности мембраны, которая в свою очередь зависит от поверхностного потенциала, а саму константу диссоциации определяли из уравнения, аналогичного. Здесь стоит остановиться на нескольких моментах.

1.Одновалентные ионы, например натрий, действительно свя-зываюется с кислыми фосфолипидами, но с низким сродством.
2.Истинное сродство Са2+
к поверхности цвиттерионных фосфолипидных везикул близко или чуть меньше, чем к поверхности кислых фосфолипидов. Более сильное связывание Са2+
с кислыми фосфолипидами обусловлено не ббльшим сродством к ним Са2
+
, а скорее всего электростатическим эффектом более высокой плотности отрицательных зарядов, приводящим к возрастанию локальной концентрации Са2+
на поверхности.
3.Связывание как одно-, так и двухвалентных катионов, по-видимому, почти не влияет на конформацию полярных головок фосфолипидов, по крайней мере для фосфатидилхолина и фосфатидилглицерола. При связывании с фосфатидилсерином наблюдается иммобилизация карбоксильных групп.
4.Обычно Са2+
связывается с фосфолипидами в стехиометрии 1:1, хотя в случае фосфатидилхолина один ион Са2+
связывается с двумя молекулами липида. По-видимому, образуется и комплекс со стехиометрией 1:2, когда в результате связывания металла происходит агрегация мембран; при этом двухвалентный катион может служить мостиком между двумя плотно прижатыми поверхностями мембраны.
5.Связывание Са2+
может приводить к изменению физического состояния липида. Например, связывание Са2+
с фосфатидилсерином или фосфатидной кислотой может сопровождаться переходом бислоя в фазу геля, а при взаимодействии с кар-диолипином стабилизируется гексагональная фаза. Если везикулы состоят из смеси кислых и цвиттерионных липидов, то связывание с Са2+
вызывает латеральное разделение фаз; при этом могут образовываться обширные домены в однослойных везикулах.
6.Свои преимущества дает связывание фосфолипидов с Мп2
+
, поскольку этот парамагнитный ион изменяет спектр 31
Р-ЯМР. Эти изменения зависят от локальной концентрации Мп2+
и, следовательно, могут использоваться для измерения поверхностного потенциала.
7.С поверхностью кислых бислоев прочно связываются также поликатионы, например поли- или гентамицин.
Дзета-потенциал и электрокинетические явления
Если заряженные везикулы поместить в электрическое поле, то они будут перемещаться по направлению к электроду, заряд которого противоположен по знаку заряду везикул. Электрофоретиче-ская подвижность везикул определяется так называемым дзета-потеициалом, который равен электрическому потенциалу между объемом раствора и так называемой плоскостью Гельмгольца, параллельной плоскости мембраны. Эта плоскость отделяет плотную часть двойного электрического слоя, которая перемещается в электрическом поле вместе с мембраной и находится на расстоянии около 2 А от заряженной поверхности везикулы. Таким образом, величина дзета-потенциала меньше, чем величина поверхностного потенциала, и связана с поверхностным потенциалом соотношением, определяемым теорией Гюи—-Чапмена. Измерение дзета-потенциала лежит в основе одного из стандартных методов оценки поверхностного потенциала и может использоваться для изучения связывания ионов с поверхностью фосфолипидных везнкул. На электрофоретическую подвижность влияет также наличие выступающих над поверхностью бислоя заряженных нели-пидных мембранных компонентов, например белков или ганглиози-дов, и с помощью электрокинетических методов можно получить определенную информацию о распределении зарядов вблизи поверхности везикул.
Связывание гидрофобных ионов и мембранных зондов
Наличие поверхностного потенциала может повлиять на связывание с поверхностью мембраны гидрофобных ионов и амфифиль-ных мембранных зондов. Это позволяет использовать некоторые зонды в качестве индикаторов поверхностного потенциала. На рис. 7.9 приведены структурные формулы некоторых зондов. Для всех этих соединений интенсивность спектрального сигнала можно соотнести с количеством связанного с мембраной зонда и, следовательно, с величиной поверхностного потенциала. Такие зонды применяли для изучения многих заряженных фосфолипидных везикул
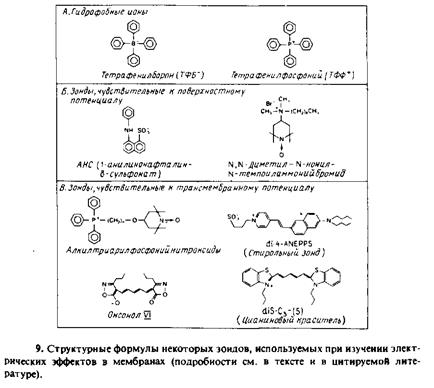
Исследование с их помощью биомембран более проблематично, поскольку спектральные характеристики зонда могут зависеть не только от поверхностного потенциала, но и от рН или трансмембранного потенциала, что сильно затрудняет интерпретацию наблюдаемых спектральных изменений. В качестве примера можно привести связывание с митохондриями АНС и изменение спектральных характеристик нейтрального красного при связывании с субмитохондриальными частицами.
На рис. 7.10, А представлен профиль электрического потенциала для мембраны, обе поверхности которой отрицательно заряжены. При наличии на мембране поверхностного потенциала увеличивается концентрация в этой мембране таких гидрофобных катионов, как ТФФ+
или комплекс К +
-валиномицин. Это связано с тем, что локальная концентрация ионов вблизи поверхности мембраны больше, чем их концентрация в объеме. Напомним, что коэффициент проницаемости может быть представлен в виде произведения коэффициента распределения /3 на константу скорости перемещения иона через мембрану к, поэтому из-за большой величины /3 проницаемость отрицательно заряженной мембраны для гидрофобных катионов будет выше, чем незаряженной. Зависимость проводимости мембраны от поверхностного заряда удовлетворительно описывается уравнением Гюи—Чапмена для поверхностного потенциала.
Заметим, что потенциал внутренних диполей может влиять как на связывание гидрофобных ионов с поверхностью бислоя, так и на константы скорости трансмембранного транспорта, в то время как эффект симметричного поверхностного потенциала на проницаемость обусловлен исключительно его влиянием на коэффициент распределения. В случае асимметричного распределения поверхностных зарядов ситуация усложняется. Подобное асимметричное распределение липидов — явление отнюдь не редкое. В этом случае существующий на мембране градиент потенциала будет затруднять перенос катионов из водной фазы 1 в фазу 2 и облегчать перенос катионов в противоположном направлении.
4. Трансмембранный потенциал
Трансмембранный потенциал по определению есть разность электрических потенциалов между двумя водными фазами, разделенными мембраной. Связь между трансмембранным потенциалом и поверхностными потенциалами *i и ♦г графически представлена на рис. 7.10, А Из схемы видно, что разность потенциалов между двумя поверхностями мембраны ДФ может отличаться от Д* из-за асимметричного распределения заряда между двумя поверхностями бислоя. Любая находящаяся внутри мембраны заряженная группа будет перемещаться в поле с потенциалом ДФ. Д* называют также потенциалом покоя, и именно эту величину, если удается, измеряют парой электродов.
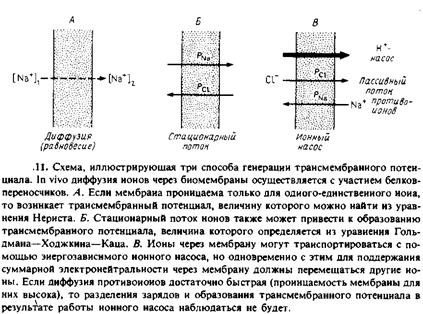
Создать трансмембранный потенциал можно несколькими способами. Схематически они изображены на рис. 7.11.
1. Равновесные условия. Если мембрана проницаема для какого-то определенного иона, например Na+
, и непроницаема для других, то на ней может возникнуть диффузионный потенциал, пропорциональный логарифму отношения концентраций проникающего иона по одну и другую стороны мембраны. Диффузия иона через мембрану сопровождается трансмембранным разделением зарядов, и создаваемая при этом разность потенциалов препятствует дальнейшей диффузии. Заряд, который нужно переместить через мембрану для создания на ней данного значения Aif, можно вычислить исходя из емкости мембраны. Для создания Д* = 100 мВ нужно перенести примерно один заряд на 250 молекул фосфолипида. Ясно, что поверхностная плотность заряда при этом изменится крайне незначительно.
В равновесии Д* определяется уравнением Нернста:
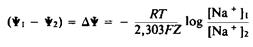
Это же уравнение следует использовать в случае переноса иона с валентностью Z. Проницаемость биомембран для ионов связана с работой специфических ионных каналов. Ее можно искусственно увеличить с помощью специфических переносчиков ионов или ионофоров, например К +
-вали-номицина.
2.Стационарный диффузионный ионный ток. Если мембрана проницаема дял нескольких ионов, то все они будут перемещаться через нее. При этом в стационарных условиях из-за различий в коэффициентах проницаемости для разных ионов может возникнуть трансмембранная разность потенциалов. Иными словами, разделение зарядов на мембране в такой ситуации будет связано с тем, что одни ионы диффундируют через мембрану быстрее других. Уравнение, описывающее данную ситуацию, называется уравнением Гольдмана—Ходжкина—Каца и для случая двух ионов имеет следующий вид:
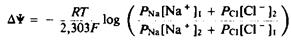
Перемещение ионов будет продолжаться до тех пор, пока не установится равновесие.
3.Активный перенос ионов. Трансмембранное разделение зарядов может происходить и с помощью процессов активного транспорта. Многие ферменты катализируют реакции, сопряженные с векторным переносом зарядов через бислой. В качестве примеров можно привести разнообразные АТР-зависимые ионные насосы, например Са2
+
-АТРазу или цитохром с-оксидазу, представляющую собой протонный насос. Здесь мы отметим лишь, что катализируемые этими ферментами реакции являются электрогенными, т. е. сопровождаются переносом зарядов через бислой. Очевидно, в такой системе должен существовать какой-то трансмембранный нейтрализующий ионный поток. В системе, представленной на рис. 7.11, таким потоком является пассивный контртранспорт ионов CI ~, возникающий при работе протонного насоса. Как и в случае пассивных ионных потоков, скорость потока противоионов будет меньше, чем скорость активного процесса, и в результате суммарный поток ионов через бислой не будет электронейтральным и на мембране возникнет разность потенциалов №. Если проницаемость бислоя для нейтрализующих ионов сделать достаточно большой, то разделения зарядов уже не будет. На этом принципе основано использование ионофоров для устранения трансмембранного электрического потенциала, создаваемого как на биологических мембранах, так и в модельных системах.
4.1. ИЗМЕРЕНИЕ ТРАНСМЕМБРАННОГО ПОТЕНЦИАЛА
Величину трансмембранного потенциала лучше всего измерять с помощью двух электродов, помещенных по разные стороны мембраны. Однако этот способ применим лишь для плоских модельных мембранных систем и некоторых крупных клеток. Обычно же приходится измерять потенциал на мембране либо протеоли-посом, либо клеток или органелл, например митохондрий или хло-ропластов. Для этих случаев разработано несколько методов.
1. Распределение ионов в соответствии с уравнением Нернста. В систему добавляют ион, способный проникать через мембрану, и он перераспределяется между внешней средой и внутренним объемом в соответствии с уравнением Нернста. На этом принципе основано использование в качестве молекулярных зондов таких гидрофобных ионов, как ТФФ+
или 86
кЬ-валиномицин. Чтобы определить трансмембранный потенциал, нужно знать концентрацию иона внутри везикулы, органеллы или клетки, что нередко превращается в серьезную проблему. Ошибки в измерении Д* могут, в частности, возникнуть, если большие количества зонда связываются с мембранами клетки или если неправильно определен внутренний объем.
2. Спин-меченные ЭПР-зонды. Для этой цели используют несколько зондов — гидрофобных ионов, к которым ковалентно пришита парамагнитная нитроксильная группа. Концентрацию зонда, связанного с мембраной, легко определить из спектра ЭПР; при образовании на мембране потенциала зонд перераспределяется между фазами, и по изменению его концентрации в мембране можно оценить величину Д*. Изменение концентрации мембраносвязанного зонда обусловлено тем, что для внутривезику-лярного пространства отношение площади поверхности к объему гораздо больше, чем для внешнего раствора.
3. Оптические молекулярные зонды. Спектральные характеристики многих оптических зондов зависят от трансмембранного потенциала. Из наиболее распространенных назовем флуоресцентные производные мероцианина, оксонола и цианиновые красители. Все эти соединения связываются с мембраной, и, по-видимому, в основе их реакции на изменения трансмембранного потенциала может лежать несколько механизмов. Чаще всего взаимодействие электрического диполя, каким является зонд, с электрическим полем приводит к изменению ориентации диполя в бислое. В ряде случаев изменение степени агрегации зонда в бислое влечет за собой изменение квантового выхода флуоресценции. Большинство зондов применяют для определения трансмембранного потенциала, имеющего знак минус внутри везикулы, однако некоторые красители, например оксонолы, используются при обратной полярности потенциала.
К зондам другого типа, спектр поглощения которых чувствителен к трансмембранному потенциалу, относятся соединения стирольной природы, образующие в мембране конъюгированные структуры. Изменение их спектров поглощения при наложении потенциала обусловлено так называемым явлением электрохро-мизма. Переход молекулы зонда из основного состояния в возбужденное при поглощении кванта света сопровождается перераспределением электронов. На энергию электронного перехода влияет градиент потенциала, вектор которого параллелен направлению этого смещения заряда. Подобные электрохромные изменения спектра наблюдаются также для природных пигментов фотосинтетических мембран — каротиноидов. Преимущество зондов этого типа состоит в том, что соответствующие реакции происходят очень быстро и не зависят от степени агрегации или распределения зонда. Все эти свойства делают такие зонды особенно полезными для быстрых кинетических измерений.
4.2 КОНЦЕПЦИЯ ЭНЕРГИЗОВАННОЙ МЕМБРАНЫ
Термин «энергизованная мембрана» трактуется обычно довольно широко, но в действительности он означает лишь, что поток ионов через бислой может использоваться для совершения работы. Чаще всего ионный поток создают протоны, и разность электрохимических потенциалов протонов между двумя разделенными бислоем фазами называется протондвижущей силой.
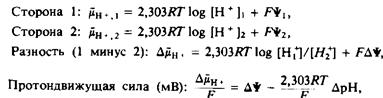
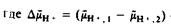
— разность электрохимических потенциалов протонов, выраженная в Дж/моль; частное от деления этой величины на постоянную Фарадея будет иметь размерность мВ.
А* = относительно наружного раствора,
ДрН = относительно наружного раствора.
При 30 °С
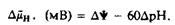
Протондвижущая сила является мерой изменения свободной энергии при переносе протонов с одной стороны мембраны на другую. В митохондриях и фотосинтетических системах за счет протондвижущей силы происходит синтез АТР, но она может использоваться и системами транспорта растворенных веществ. Все сказанное выше детально рассматривается в рамках хемиосмотической теории.
Для нахождения Дн
, нужно знать как Д*, так и ДрН. Методы определения Д* мы обсудили выше. ДрН обычно оценивают из данных по распределению по обе стороны мембраны слабых кислот или оснований. Их нейтральные формы проникают через липидный бислой, а непроникающие заряженные формы накапливаются в зависимости от рН с той или другой стороны мембраны. Можно использовать для этой цели как радиоактивные производные, так и оптические зонды. Один из наиболее часто используемых для измерения ДрН зондов — 9-аминоакридин — аккумулируется внутри везикул с кислым содержимым, что ведет к тушению флуоресценции зонда.
5. Проницаемость липидных бислойных мембран для ионов
Как мы уже говорили, бислой создает весьма высокий энергетический барьер для ионов металлов. Коэффициент проницаемости однослойных везикул для Na+
составляет всего 10" 12
—Ю-14
см/с, но даже столь малая величина на порядок выше скорости, предсказываемой исходя из модели растворения—диффузии, если воспользоваться уравнением Борна для оценки энергии, необходимой для перемещения иона из водной фазы в центр мембраны. Механизм переноса ионов через липидный бислой пока неясен, но в литературе обсуждается несколько конкурирующих теорий, в основе которых лежит предположение о существовании дефектов упаковки молекул фосфолипидов в бислое. Постулируется, что эти дефекты возникают спонтанно, подобно флуктуирующим полостям или кинкам, либо формируются на границе раздела сосуществующих в мембране жидкокристаллической фазы и фазы геля. Ионная проницаемость в общем случае максимальна при температуре фазового перехода гель — жидкий кристалл, но это не так для воды и протонов. Следует напомнить, что стационарный поток ионов через бислой должен быть электронейтральным, т. е. для поддержания нейтральности поток одних ионов должен быть сопряжен с потоком других ионов.
Как бы то ни было, ясно, что бислой представляет собой труднопреодолимый барьер для простых анионов и катионов. Однако, как уже говорилось, ионы большего радиуса из-за уменьшения энергии Борна будут легко проникать через мембрану. Довольно легко могут пересекать бислой и гидрофобные ионы.
5.1 ПРОНИЦАЕМОСТЬ ДЛЯ ПРОТОНОВ
Как показывают измерения на модельных мембранах, проницаемость липидного бислоя для протонов исключительно высока. Экспериментально отличить проницаемость для протона от проницаемости для гидроксила довольно трудно, поэтому в литературе ее обозначают Н +
/ОН". В дальнейшем эту проницаемость мы будем для простоты называть протонной. Приводимые в литературе значения коэффициента проницаемости для протона варьируют в довольно широких пределах, обычно от Ю-4
до 10 8
см/с. Столь значительный разброс объясняют экспериментальными различиями в размерах везикул, в величине создаваемого трансмембранного градиента рН, в степени ненасыщенности липидов. Ясно тем не менее, что проницаемость для протона по крайней мере в 106
раз выше, чем для других простых ионов, причем это относится как к биомембранам, так и к модельным системам.
Приведенные данные однозначно указывают на существование специального механизма протонной проницаемости. Это, в частности, подтверждает тот факт, что скорость транспорта протонов не определяется простым электростатическим барьером в мембране. Природа этого явления неизвестна. Согласно одной из моделей, в мембране имеются временные пересекающие всю толщу бислоя цепочки из молекул воды, соединенных водородными связями; по этим цепочкам по эстафетному механизму и осуществляется перенос протонов. Однако прямых даннах о существовании таких цепочек воды пока нет. В других работах постулируется, что аномально высокая проводимость фосфолипидных бислоев для протонов обусловлена в основном присутствием в мембране небольших количеств слабых кислот, например свободных жирных кислот, которые при физиологических рН выступают в роли переносчиков протонов. Однако расчеты показывают, что всю аномально большую протонную проводимость липосом эта гипотеза объяснить не может.
Было показано также, что протоны способны быстро диффундировать вдоль границы раздела мембрана—раствор и протонировать анионные формы адсорбированных на поверхности мембраны слабых кислот. При этом околоповерхностный барьер для быстрого установления равновесия по протонам между наружным раствором и протонированными группами на поверхности мембраны отсутствует.
Поскольку перенос протонов через бислой является ключевым процессом для большинства биоэнергетических систем, вопрос о механизме диффузионной проницаемости мембраны для протонов представляет особый интерес. В экспериментальном плане протонная проводимость имеет большое значение при изучении реконструированных в фосфолипидные везикулы протонпереносящих белков. Исследования показывают, что встраивание белков в такие системы почти не влияет на протонную проводимость, однако важным фактором, способным изменить пассивную проницаемость мембраны для протонов, могут служить противоионы и величина трансмембранного потенциала.
Другой важный для биоэнергетики вопрос заключается в том, каким образом происходит диффузия протона из одного места в другое на поверхности мембраны. Например, изображенный на рис. 6.5 протонный цикл предполагает диффузию протонов от про-тонпереносящих ферментов к АТР-синтазам. Весь вопрос в том, устанавливается ли равновесие между этими протонами и наружным раствором или существует некий локализованный путь переноса протонов вдоль поверхности или внутри мембраны. Как уже упоминалось, отсутствие околомембранного барьера для быстрого уравновешивания протона между локализованными на поверхности бислоя протолитическими группами и раствором доказано экспериментально. Однако в серии изящных исследований было показано, что латеральная диффузия протонов вдоль поверхности фос-фолипидного монослоя может осуществляться в 20 раз быстрее, чем диффузия через объем. Предполагается, что диффузия идет посредством эстафетной передачи вдоль двумерной сетки водородных связей, образованных полярными головками фосфолипидов и молекулами воды на поверхности мембраны. Биологическую значимость обнаруженного явления, однако, еще предстоит выяснить, а с выводами согласны далеко не все исследователи.
5.2 ИОНОФОРЫ
Ионофоры — это довольно разнородная группа соединений, увеличивающих проницаемость мембран для ионов. Один ионофоры, например грамицидин А и аламетицин, формируют в бислое каналы, другие образуют стехиометрические комплексы с катионами и тем самым облегчают транспорт этих ионов через липидный бислой. Ионофоры являются весьма полезными инструментами в мембранных исследованиях, особенно при изучении биоэнергетических или иных зависимых от ионного градиента систем. Поскольку такие ионофорно-катионные комплексы могут проявлять довольно высокую специфичность к определенным ионам, с их помощью можно избирательно манипулировать ионными градиентами и электрическим потенциалом на мембране. Некоторые комплексы ионофора и катиона не заряжены, и катион переносится в нейтрализованной форме. Другие комплексы заряжены и диффундируют через бислой подобно уже обсуждавшимся гидрофобным ионам. Ниже кратко охарактеризованы некоторые наиболее часто используемые ионофоры.
СССР и близкий к нему FCCP представляют собой слабые кислоты. Протонированная форма электронейтральна и, как показано, легко проникает через мембрану, в то время как проницаемость депротонированной формы составляет — 1 <Уо от проницаемости формы нейтральной. Растворимость анионных форм этих и других протонофоров в гидрофобной области бислоя обусловливается несколькими причинами. Отрицательный заряд этих молекул делокализован, а благодаря большому ионному радиусу уменьшается энергия Борна. Кроме того, потенциал диполей, ориентированных положительным зарядом внутрь бислоя, стабилизирует анионы в мембране. И наконец, ионофор в мембране стабилизируют гидрофобные группы молекулы.
СССР, FCCP и другие слабые кислоты эффективно увеличивают проницаемость мембраны для протонов, что позволяет достичь электрохимически равновесного распределения протонов по обе стороны бислоя.
Валиномицин
Это циклодепсипептид, образующий с одновалентными катионами комплекс со стехиометрией 1:1. Структура комплекса напоминает ячейку, в центре которой находится ион калия, стабилизированный взаимодействием с карбонила-ми эфирных групп. Комплекс К +
-валиномицин является гидрофобным ионом и с легкостью проникает через бислой. С помощью этого ионофора можно создавать калиевый диффузионный потенциал на мембране везикул, концентрация К +
в которых отличается от концентрации снаружи. В системе, где трансмембранный потенциал создается с помощью какого-либо активного процесса, К+
-валиномицин будет устранять электрическую составляющую не влияя непосредственно на величину ДрН.
Нигерицин и моненсин
Это полиэфиры, имеющие одну отрицательно заряженную карбоксильную группу. Как и валиномицин, они образуют ком-
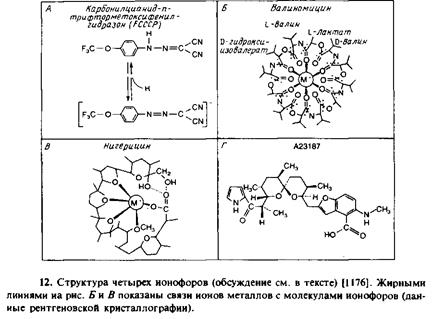
плексы с одновалентными катионами в стехиометрии 1:1, но эти комплексы электронейтральны. Нигерицин селективно связывает К +
, а моненсин — Na+
. Эти ионофоры также могут с успехом проникать через бислой в нейтральной протонированной форме, поэтому их используют для ускорения обмена Н+
на Na+
или Н +
на К +
через мембрану. Добавление рассматриваемых ионофоров к везикулам приводит к выравниванию градиентов Н+
и Na*. Чаще всего их применяют для рассеивания АрН на мембране. Поскольку при суммарной реакции обмена сохраняется электронейтральность, на Д* это прямым образом не сказывается.
А23187
Этот катионный переносчик содержит заряженную карбоксильную группу и с высокой избирательностью связывает двухвалентные катионы. Обычно А23187 используют как Са2
+
-ионофор. Вероятно, при своей работе этот ионофор образует растворимый в бислое нейтральный комплекс, состоящий из двух молекул А23187 и одной молекулы Са2+
; существование таких комплексов со стехиометрией 2:1 доказано экспериментально.
Резюме
Основная функция любой биологической мембраны состоит в создании барьера с селективной проницаемостью между разделяемыми ею водными компартментами. Тонкий гидрофобный центральный слой в мембране является очень эффективным барьером для неорганических ионов, но он в той или иной степени проницаем для неполярных веществ. Скорость проникновения неэлектролитов через бислой зависит от растворимости данного вещества в бислое, определяемой исходя из данных о коэффициенте его распределения между водой и органическими растворителями. Проницаемость модельных мембран для воды неплохо согласуется с растворимостью воды в органических растворителях, однако через некоторые биологические мембраны вода может проникать также по трансмембранным каналам белковой природы.
Липидный бислой является довольно хорошим барьером для неорганических ионов, однако проницаемость модельных и биологических мембран для протонов по не совсем понятным причинам необычайно высока.
Органические ионы или органические хелатные комплексы, содержащие неорганические ионы, могут растворяться в углеводородной области бислоя благодаря своим гидрофобным свойствам и большим размерам. К молекулам такого типа относятся и ио-нофоры.
Электрические свойства биологических мембран довольно хорошо изучены. Проницаемость биологических мембран для неорганических ионов практически полностью обусловлена работой трансмембранных ионных каналов белковой природы. Образующийся при разделении зарядов трансмембранный потенциал связан с электрической емкостью мембраны, которая практически одинакова для модельных липидных бислоев и биологических мембран. Существование зарядов на поверхности мембраны создает дополнительный поверхностный потенциал, который может весьма существенным образом изменять концентрацию любого заряженного соединения в непосредственной близости от мембраны. Это в свою очередь может сказаться на каталитических свойствах мембраносвя-занных ферментов.
|