Явление ускорения скорости химической реакции под действием веществ, непосредственно не участвующих в стехиометрическом уравнении реакции, называется катализом. Эти “сторонние” вещества, влияющие лишь на скорость реакции, называются катализа-торами. Они не смещают химическое равновесие, и с его достижением могут быть выде-лены из реакционной смеси в химически неизменном виде. Их присутствие в равновесной системе сказывается лишь на тех термодинамических признаках системы, которые зави-сят от числа присутствующих в ней компонентов. Напомним, что в наиболее общей форме такое влияние должно учитываться через посредство активностей, связанных уравнением Гиббса-Дюгема, но в этом почти не бывает необходимости.
Классификация каталитических процессов разнообразна. Катализ бывает гомогенным и гетерогенным. Гомогенный катализ может протекать в газе и в растворе.
Гомогенный катализ
Катализ - явление разностороннее, и даже сама среда -растворитель может принци-пиально изменить механизм реакции, оказывая решающее влияние на её скорость а, значит, играть роль катализатора. Его основными видами в растворе считают катализ: кислотный, металлокомплексный, ферментный.
Внешне наиболее прост для теоретического моделирования кислотный катализ. Намного разноообразнее варианты металлокомплексного катализа. С ферментным катализом связана вся химия живых организмов. Он не имеет равных в части ускорения реакций – ферментно-катализиру-емые процессы могут ускоряться в десятки миллионов раз. Ферменты это биокатализаторы-белки.
Основные положения теории гомогенного катализа по Шпитальскому: (изложено по книге Ерёмина – научная школа МГУ):
Катализатор - вещество переводящее систему реагентов в реакционноспособное состояние путём образования с реагентами лабильного каталитического комплекса.
2) Образование комплекса - относительно быстрый квазиравновесный процесс.
3) Лабильный каталитический комплекс продукт необратимо и относительно медленно изменяется .
Общая скорость реакции пропорциональна концентрации промежуточного каталитического комплекса, но не концентрации реагента. Непосредственная пропорциональная связь между скоростью и концентрацией реагента является следствием сложного механизма процесса.
В зависимости от значения константы равновесия на стадии образования промежуточного продукта определённая доля катализатора находится в системе в свободном состоянии.
В образовании промежуточных продуктов могут одновременно принимать участие многие вещества, так что многие катализаторы, приводящие к одному общему промежуточному продукту, будут действовать как один смешанный катализатор.
Помимо катализатора в образовании промежуточных продуктов могут участвовать «сопутствующие вещества (лучше сказать частицы) », главным образом ионы H+ и OH- . (Текст в ред. Ерёмина, стр. 308).
«Сопутствующие вещества» помимо участия в образовании промежуточных продуктов могут влиять на степень лабильности промежуточного продукта, и, следовательно, на скорость его разложения даже без участия в процессе его обратимого образования.
Реклама

Один и тот же катализатор может образовать с реагирующим веществом многие промежуточные продукты.
При одновременном действии многих катализаторов (пункт 6) как и при образовании многих промежуточных продуктов из одного катализатора (пункт 9) результирующая скорость реакции равна сумме скоростей реакции разложения отдельных промежуточных продуктов.
И для большей полноты см. книгу Ерёмина !!!.
Общая кинетическая схема гомогенного катализа. (см. книгу Ерёмина)
Сравнение маршрутов превращения:
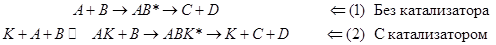 (11.1) (11.1)
 (11.2) (11.2)
Различают два предельных случая гомогенного катализа, в зависимости от типа образующегося каталитического комплекса.
Каталитические комплексы бывают двух типов, а именно: 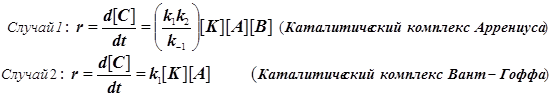 (11.3) (11.3)
Энергетические профили некаталитического (1) и каталитического (2) маршрутов химической реакции совмещены на рисунке. Верхняя кривая отвечает некаталитическому протеканию процесса, нижняя с двумя максимумами соответствует механизму реакции в присутствие катализатора (на самом деле вдоль оси ординат обе кривые раздвинуты на величину энергии катализатора).
Кислотный катализ в растворе
Имеется большое число различных механизмов кислотно-основного катализа. Некоторые из них приводят к общему катализу, а другие - к специфическому. Исчерпывающе общая классификация этого материала практически невозможна. Речь может идти лишь о каких-то достаточно общих принципах и подходах. (см. К. Лейдлер. Кинетика органических реакций, стр. 272-273).
Вначале можно рассмотреть несложный катализ в водном растворе. Реакции этого типа обычно протекают в две стадии. На первой происходит передача протона субстрату S. На второй происходит отделение протона от протонированного субстрата SH+. Присоединяющийся протон может происходить из катиона гидроксония H3O + или других кислых веществ, присутствующих в растворе; эти вещества обозначаются как BH+
Во второй стадии протон от SH+ может переходить к молекуле H2O или к любым другим основным веществам, присутствующим в растворе. Природа веществ, передающих протоны субстрату, не играет первоочередной роли в формировании кинетического закона. Однако важное значение имеют вещества, которым SH+ передаёт протон на второй стадии.
Передача протона может происходить двояко:
молекуле растворителя: SH+ + H2O = S + H3O+ . Такой механизм называется протолитическим.
Реклама

Здесь может иметь место и общий, и специфический катализ в зависимости от разных причин.
молекуле растворённого вещества: SH+ + B = S + BH+. Такой механизм называется прототропным.
Здесь может иметь место лишь общий кислотный катализ...
Стандартная кинетическая схема и скорости элементарных стадий.
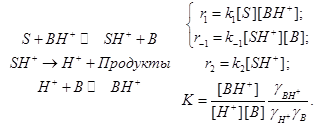 (11.4) (11.4)
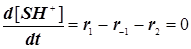 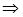 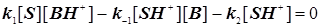 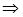
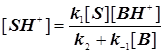 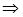 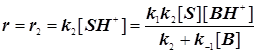 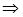
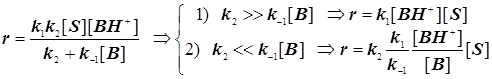 . (11.5) . (11.5)
Случай 1: Общий кислотный катализ
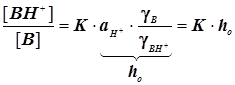 ; ; 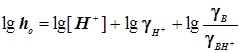 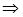
Кислотность 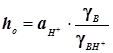 ; Функция кислотности Гамметта ; Функция кислотности Гамметта 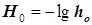 . (11.6) . (11.6)
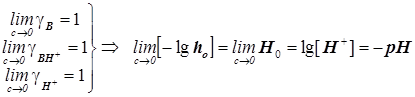 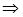 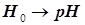 . (11.7) . (11.7)
Случай 2: Специфический протонный катализ: 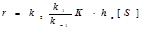 (11.8) (11.8)
Пример 1
Каталитический активированный комплекс типа Вант-Гоффа (протонированный енол) Реакция йодирования ацетона (см. Ерёмин, стр.307)
H3C-CO-CH3 + J2+ H2O ® H3C-CO-C H2J + HJ . (уравнение в молекулярном виде)
Механизм катализа общий кислотный (под действием всех кислот Брёнстеда). Катализ связан с равновесием CH3-CO-CH3 + H+ Û CH3-CHO=CH2 + H+, (...и с таутомерным превращением кетон-енол: AcÛEn).
Простейшее формально-кинетическое описание механизма:
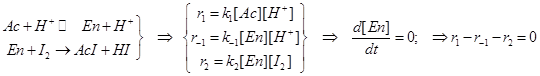 
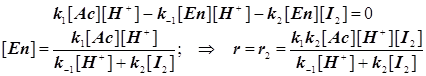
Если скорость обратной реакции мала, то получается нулевой порядок по йоду: 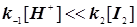 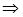 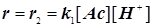 . В этой сложной реакции вторая стадия - стадия присоединения йода к енолу самая медленная. Эта стадия определяет скорость всей реакции. Она оказывается лимитирующей. Процесс этот протекает в режиме автокатализа... На рис.23 показан график изменения скорости такой автокаталитической реакции во времени. Ускорение реакции на первоначальном этапе кривой вызвано образованием в ходе реакции катализатора – кислоты HJ , т.е. соответственно H+ , (в воде ® в виде H3O+). . В этой сложной реакции вторая стадия - стадия присоединения йода к енолу самая медленная. Эта стадия определяет скорость всей реакции. Она оказывается лимитирующей. Процесс этот протекает в режиме автокатализа... На рис.23 показан график изменения скорости такой автокаталитической реакции во времени. Ускорение реакции на первоначальном этапе кривой вызвано образованием в ходе реакции катализатора – кислоты HJ , т.е. соответственно H+ , (в воде ® в виде H3O+).
Пример 2
Каталитический активированный комплекс типа Аррениуса.
Разложение муравьиной кислоты в среде концентрированной серной кислоты
 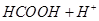 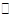 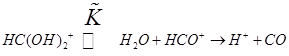
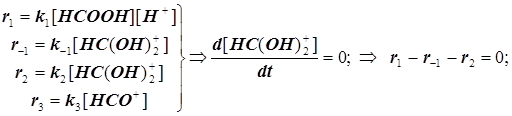
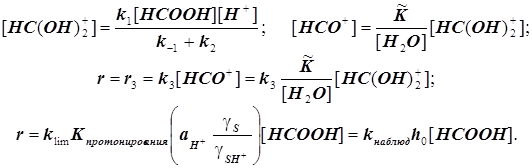 (11.9) (11.9)
Полезно привести некоторые общие инженерно-технологические соображения.
Продукты гомогенно-катализируемой реакции находятся в одной фазе с реагентами, исключая те редкие случаи, когда они удаляются в отдельную фазу (из жидкости в виде газа, либо из газа или жидкости в виде осадка, либо иногда выделяются в виде несмешивающейся жидкости). По этой причине в реальных условиях почти всегда возникает потребность в разделении реакционной смеси. Технологическое оформление процессов разделения обычно стоит дорого, нередко намного дороже самого синтеза. Согласно простейшей термодинамической оценке энергетические затраты на разделение смеси не могут быть менее полезной работы образования смеси из компонентов, по абсолютной величине равной
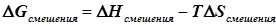 . .
Реальные энергозатраты всегда существенно больше этого нижнего предела, и поэтому желанными являются такие технологические процессы, в которых необходимость в процессах разделения минимальна, и это уже ближе к предмету гетерогенного катализа...
Гомогенно-каталитизируемое превращение протекает в одной фазе, где смешаны и реагенты, и катализатор, и продукты. В гетерогенно-катализируемом превращении катализатор образует отдельную фазу, а химический элементарный акт протекает на её поверхности и пространственно как бы отделён от основной массы и реагентов, и продуктов. Поэтому для кинетического моделирования этого сложного превращения его необходимо представить как результат суперпозиции нескольких элементарных процессов. Это:
- 1) Диффузия реагента из объёма к поверхности катализатора (массоперенос).
- 2) Адсорбция реагента на поверхности катализатора.
- 3) Химическое превращение реагента в продукт на поверхности катализатора.
- 4) Десорбция продукта с поверхности катализатора.
- 5) Диффузия продукта от поверхности катализатора в объём (массоперенос).
Эти элементарные процессы удобно математически вначале смоделировать по отдельности:
1) Диффузия из объёма к поверхности
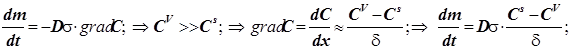 (12.1) (12.1)
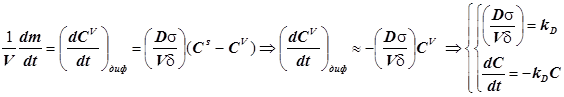 ; (12.2) ; (12.2)
Уравнение массопереноса под влиянием диффузии имеет первый порядок по концентрации. Формально оно не отличается от обычного кинетического уравнения. Диффузия - процесс активационный с относительно небольшой энергией активации - всего около 4-9 кДж/моль.
2) Режим диффузионнный и режим кинетический.
В стационарном режиме скорость химического превращения на поверхности
равна скорости диффузии вещества из объёма к поверхности:
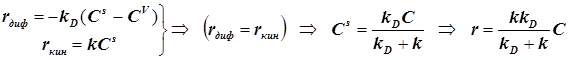 ; (12.3) ; (12.3)
Отсюда появляется две возможности -два возможных режима процесса:
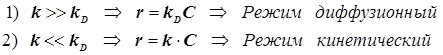 (12.4) (12.4)3)Адсорбция на поверхности. Уравнение Лангмюра для одного адсорбата.

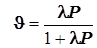 ; ; 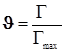 ; ; 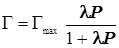 ; (12.5) ; (12.5)
Кривая Лангмюра в области начала кривой
 адсорбции может быть заменено более простым адсорбции может быть заменено более простым
уравнением Бедекера-Фрейндлиха: 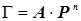
Рис.24. Кривая адсорбции.
3.1) Адсорбция на поверхности
Уравнение Лангмюра для нескольких адсорбатов.
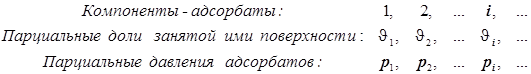
В таком случае
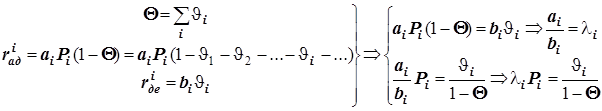
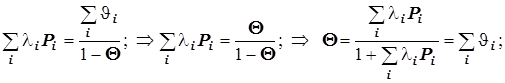 
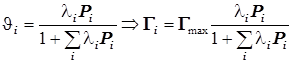 (12.6) (12.6) 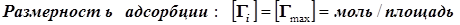 ® ( масса/площадь) ® ( масса/площадь)
Это уравнение полезно для формально-кинетического описания гетерогенно-каталитических реакций
|