| Государственное образовательное учреждение высшего профессионального образования
ВОЛЖСКИЙ ГОСУДАРСТВЕННЫЙ ИНЖЕНЕРНО-ПЕДАГОГИЧЕСКИЙ УНИВЕРСИТЕТ
Автомобильный институт
Кафедра экологии и природопользования
Курсовая работа
ОЦЕНКА ВЛИЯНИЯ СБРОСА ОЧИСТНЫХ СООРУЖЕНИЙ ЛИВНЕВЫХ СТОКОВ ОАО «ГАЗ» НА АНИОННЫЙ СОСТАВ ВОД р. ОКА
  Автор курсовой работы К.В. Клочкова Автор курсовой работы К.В. Клочкова
(подпись) (дата)
Специальность 013400 Природопользование
 (номер, название специальности) (номер, название специальности)
Руководитель работы
(доцент,к.б.н.)
  М.В.Дабахов М.В.Дабахов
(подпись) (дата)
 Оценка Оценка
(прописью)
Н.Новгород, 2008
План работы:
I. Введение……………………………………………………………………3
II. Обзор литературы………………………………………………………4-10
III. Методика и объект исследования…………………………………….11-14
IV. Результаты исследования…………………………………………….15-25
V. Выводы…………………………………………………………………….26
VI. Список литературы………………………………………………………..27
Введение
Целью
данной курсовой работы является оценка влияния сброса очистных сооружений ливневых стоков ОАО «ГАЗ» на анионный состав вод р. Ока. В рамках работы решались следующие задачи:
-оценка уровня загрязнения поверхностных вод хлоридами, сульфатами, нитратами, нитритами, фосфатами;
-анализ динамики анионного состава в створе №2 и створе № 3 за период наблюдения;
-выявление возможных причин расхождения концентраций;
Актуальность темы
заключается в том, что загрязнения поверхностных вод может привести к нарушению здоровья населения, развитию массовых инфекционных, паразитарных и неинфекционных заболеваний, а также к ухудшению условий водопользования населения. Именно поэтому необходимо регулярно осуществлять мониторинг поверхностных вод, который позволяет:
- своевременно выявлять и прогнозировать развитие негативных процессов, влияющих на качество воды в водных объектах и их состояние;
- разрабатывать и реализовывать меры по предотвращению негативных последствий этих процессов;
- оценивать эффективность осуществляемых мероприятий по охране водных объектов.
Обзор литературы
Рассмотрим характеристику исследуемых неорганических веществ, особенности их поведения в объекте исследования, миграции и трансформации.
Вначале обратим внимание на характеристику хлоридов
, так как они являются преобладающим анионом в высокоминерализованных водах. Известно, что содержание хлоридов в речных водах и водах пресных озер обычно колеблется от долей миллиграмма до десятков, сотен, а иногда и тысяч миллиграммов на литр. Тогда как в морских и подземных водах содержание хлоридов значительно выше — вплоть до пересыщенных растворов и рассолов.
Реклама

Концентрация хлоридов в поверхностных водах подвержена заметным сезонным колебаниям, коррелирующим с изменением общей минерализации воды.
Первичными источниками хлоридов являются магматические породы, в состав которых входят хлорсодержащие минералы (содалит, хлорапатит и др.), соленосные отложения, в основном галит. Значительные количества хлоридов поступают в воду в результате обмена с океаном через атмосферу, взаимодействия атмосферных осадков с почвами, особенно засоленными, а также при вулканических выбросах. Возрастающее значение приобретают промышленные и хозяйственно-бытовые сточные воды.
Из всех анионов хлориды обладают наибольшей миграционной способностью, что объясняется их хорошей растворимостью, слабо выраженной способностью к сорбции взвешенными веществами и потреблением водными организмами. Повышенные содержания хлоридов ухудшают вкусовые качества воды, делают ее малопригодной для питьевого водоснабжения и ограничивают применение для многих технических и хозяйственных целей, а также для орошения сельскохозяйственных угодий. Если в питьевой воде есть ионы натрия, то концентрация хлорида выше 250 мг/дм3
придает воде соленый вкус. Нет данных о том, что высокие концентрации хлоридов оказывают вредное влияние на человека. ПДКв
составляет 350 мг/дм3
, ПДК вр
— 300 мг/дм3
(Гусева Т. В. и др.).
А теперь остановимся подробнее на характеристике сульфатов,
которые присутствуют практически во всех поверхностных водах и являются одними из важнейших анионов.
Главным источником сульфатов в поверхностных водах являются процессы химического выветривания и растворения серосодержащих минералов, в основном гипса, а также окисления сульфидов и серы:
2FeS2
+ 7O2
+ 2H2
O = 2FeSO4
+ 2H2
SO4
;
2S + 3O2
+ 2H2
O = 2H2
SO4
.
Значительные количества сульфатов поступают в водоемы в процессе отмирания организмов, окисления наземных и водных веществ растительного и животного происхождения и с подземным стоком.
В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота, например, окисление пирита. Сульфаты выносятся также со сточными водами коммунального хозяйства и сельскохозяйственного производства.
Реклама

Концентрация сульфата в природной воде лежит в широких пределах. В речных водах и в водах пресных озер содержание сульфатов часто колеблется от 5-10 до 60 мг/дм3
, в дождевых водах — от 1 до 10 мг/дм3
. В подземных водах содержание сульфатов нередко достигает значительно больших величин.
Концентрация сульфатов в поверхностных водах подвержена заметным сезонным колебаниям и обычно коррелирует с изменением общей минерализации воды. Важнейшим фактором, определяющим режим сульфатов, являются меняющиеся соотношения между поверхностным и подземным стоками. Заметное влияние оказывают окислительно-восстановительные процессы, биологическая обстановка в водном объекте и хозяйственная деятельность человека.
Повышенные содержания сульфатов ухудшают органолептические свойства воды и оказывают физиологическое воздействие на организм человека. Поскольку сульфат обладает слабительными свойствами, его предельно допустимая концентрация строго регламентируется нормативными актами. Весьма жесткие требования по содержанию сульфатов предъявляются к водам, питающим паросиловые установки, поскольку сульфаты в присутствии кальция образуют прочную накипь. Вкусовой порог сульфата магния лежит в пределах от 400 до 600 мг/дм3
, для сульфата кальция — от 250 до 800 мг/дм3
. Наличие сульфата в промышленной и питьевой воде может быть как полезным, так и вредным.
ПДКв
сульфатов составляет 500 мг/дм3
, ПДКвр
— 100 мг/дм3
.
Не замечено, чтобы сульфат в питьевой воде влиял на процессы коррозии, но при использовании свинцовых труб концентрация сульфатов выше 200 мг/дм3
может привести к вымыванию в воду свинца (Гусева Т. В. и др.).
Перейдем к характеристике нитратов.
Присутствие нитратных ионов в природных водах связано с такими процессами как:
· внутриводоемными процессами нитрификации аммонийных ионов в присутствии кислорода под действием нитрифицирующих бактерий;
· атмосферными осадками, которые поглощают образующиеся при атмосферных электрических разрядах оксиды азота (концентрация нитратов в атмосферных осадках достигает 0,9 - 1 мг/дм3
);
· промышленными и хозяйственно-бытовыми сточными водами, особенно после биологической очистки, когда концентрация достигает 50 мг/дм3
;
· стоком с сельскохозяйственных угодий и со сбросными водами с орошаемых полей, на которых применяются азотные удобрения.
Главными процессами, направленными на понижение концентрации нитратов, являются потребление их фитопланктоном и денитрофицирующими бактериями, которые при недостатке кислорода используют кислород нитратов на окисление органических веществ.
В поверхностных водах нитраты находятся в растворенной форме. Концентрация нитратов в поверхностных водах подвержена заметным сезонным колебаниям: минимальная в вегетационный период, она увеличивается осенью и достигает максимума зимой, когда при минимальном потреблении азота происходит разложение органических веществ и переход азота из органических форм в минеральные. Амплитуда сезонных колебаний может служить одним из показателей эвтрофирования водного объекта.
В незагрязненных поверхностных водах концентрация нитрат-ионов не превышает величины порядка десятков микрограммов в 1 дм3
(в пересчете на азот). С нарастанием эвтрофикации абсолютная концентрация нитратного азота и его доля в сумме минерального азота возрастают, достигая n
·10-1
мг/дм3
. В незагрязненных подземных водах содержание нитратных ионов обычно выражается сотыми, десятыми долями миллиграмма и реже единицами миллиграммов в 1 дм3
. Подземные водоносные горизонты в большей степени подвержены нитратному загрязнению, чем поверхностные водоемы (т.к. отсутствует потребитель нитратов).
При длительном употреблении питьевой воды и пищевых продуктов, содержащих значительные количества нитратов (от 25 до 100 мг/дм3
по азоту), резко возрастает концентрация метгемоглобина в крови. Крайне тяжело протекают метгемоглобинемии у грудных детей (прежде всего, искусственно вскармливаемых молочными смесями, приготовленными на воде с повышенным — порядка 200 мг/дм3
— содержанием нитратов) и у людей, страдающих сердечно-сосудистыми заболеваниями. Особенно в этом случае опасны грунтовые воды и питаемые ими колодцы, поскольку в открытых водоемах нитраты частично потребляются водными растениями.
Присутствие нитрата аммония в концентрациях порядка 2 мг/дм3
не вызывает нарушения биохимических процессов в водоеме; подпороговая концентрация этого вещества, не влияющая на санитарный режим водоема, 10 мг/дм3
. Повреждающие концентрации соединений азота (в первую очередь, аммония) для различных видов рыб составляют величины порядка сотен миллиграммов в 1 дм3
воды.
Смертельная доза нитратов для человека составляет 8-15 г; допустимое суточное потребление по рекомендациям ФАО/ВОЗ — 5 мг/кг массы тела.
Наряду с описанными эффектами воздействия немаловажную роль играет тот факт, что азот — это один из первостепенных биогенных (необходимых для жизни) элементов. Именно этим обусловлено применение соединений азота в качестве удобрений, но, с другой стороны, с этим связан вклад вынесенного с сельскохозяйственных земель азота в развитие процессов эвтрофикации (неконтролируемого роста биомассы) водоемов. Так, с одного гектара орошаемых земель выносится в водные системы 8-10 кг азота.
ПДКв
нитратов составляет 45 мг/дм3
(по NO3
-
) (тождественно равен стандарту США для питьевой воды), ПДКвр
- 40 мг/дм3
(по NO3
-
) или 9,1 мг/дм3
(по азоту) (Хараев Г.И. и др., 2004)
Нитриты
Нитриты представляют собой промежуточную ступень в цепи бактериальных процессов окисления аммония до нитратов (нитрификация — только в аэробных условиях) и, напротив, восстановления нитратов до азота и аммиака (денитрификация — при недостатке кислорода). Подобные окислительно-восстановительные реакции характерны для станций аэрации, систем водоснабжения и собственно природных вод. Кроме того, нитриты используются в качестве ингибиторов коррозии в процессах водоподготовки технологической воды и поэтому могут попасть и в системы хозяйственно-питьевого водоснабжения. Широко известно также применение нитритов для консервирования пищевых продуктов.
В поверхностных водах нитриты находятся в растворенном виде. В кислых водах могут присутствовать небольшие концентрации азотистой кислоты (HNO2
) (не диссоциированной на ионы). Повышенное содержание нитритов указывает на усиление процессов разложения органических веществ в условиях более медленного окисления NO2
-
в NO3
-
, что указывает на загрязнение водного объекта, т.е. является важным санитарным показателем.
Концентрация нитритов в поверхностных водах составляет сотые (иногда даже тысячные) доли миллиграмма в 1 дм3
; в подземных водах концентрация нитритов обычно выше, особенно в верхних водоносных горизонтах (сотые, десятые доли миллиграмма в 1 дм3
).
Сезонные колебания содержания нитритов характеризуются отсутствием их зимой и появлением весной при разложении неживого органического вещества. Наибольшая концентрация нитритов наблюдается в конце лета, их присутствие связано с активностью фитопланктона (установлена способность диатомовых и зеленых водорослей восстанавливать нитраты до нитритов). Осенью содержание нитритов уменьшается.
Для нитритов ПДКв
установлена в размере 3,3 мг/дм3
в виде иона NO2
-
или 1 мг/дм3
в пересчете на азот. ПДКвр
- 0,08 мг/дм3
в виде иона NO2
-
или 0,02 мг/дм3
в пересчете на азот.
В соответствии с требованиями глобальной системы мониторинга состояния окружающей среды (ГСМОС/GEMS) нитрит- и нитрат-ионы входят в программы обязательных наблюдений за составом питьевой воды и являются важными показателями степени загрязнения и трофического статуса природных водоемов.
Смертельная доза нитратов для человека составляет 8-15 г; допустимое суточное потребление по рекомендациям ФАО/ВОЗ - 5 мг/кг массы тела. При длительном употреблении питьевой воды и пищевых продуктов, содержащих значительные количества нитратов (от 25 до 100 мг/дм3 по азоту), резко возрастает концентрация метгемоглобина в крови. Крайне тяжело протекают метгемоглобинемии у грудных детей (прежде всего, искусственно вскармливаемых молочными смесями, приготовленными на воде с повышенным - порядка 200 мг/дм3 - содержанием нитратов) и у людей, страдающих сердечно-сосудистыми заболеваниями (Гусева Т. В. и др.).
Фосфаты
Избыточное содержание фосфатов в воде, особенно в грунтовой, может быть отражением присутствия в водном объекте примесей удобрений, компонентов хозяйственно-бытовых сточных вод, разлагающейся биомассы. Концентрация фосфатов в природных водах обычно очень мала – сотые, редко десятые доли миллиграммов фосфора в 1 дм3
, в загрязненных водах она может достигать нескольких миллиграммов в 1 дм3
. Подземные воды содержат обычно не более 100 мкг/дм3
фосфатов; исключение составляют воды в районах залегания фосфорсодержащих пород. Содержание соединений фосфора подвержено значительным сезонным колебаниям, поскольку оно зависит от соотношения интенсивности процессов фотосинтеза и биохимического окисления органических веществ. Минимальные концентрации фосфатов в поверхностных водах наблюдаются обычно весной и летом, максимальные – осенью и зимой, в морских водах – соответственно весной и осенью, летом и зимой. Общее токсическое действие солей фосфорной кислоты возможно лишь при весьма высоких дозах и чаще всего обусловлено примесями фтора. В методике оценки экологической ситуации, принятой Госкомэкологией РФ, рекомендован норматив содержания растворимых фосфатов в воде – 50 мкг/дм3
. Без предварительной подготовки проб колориметрически определяются неорганические растворенные и взвешенные фосфаты. (Хараев Г.И. и др., 2004)
Методика и объект исследования
Объект исследования
Р. Ока — река в Европейской части России, крупнейший из правых притоков Волги, имеет более ста притоков и бесчисленное количество прибрежных и донных родников. Наиболее крупные притоки: Мокша, Теша - справа, Клязьма - слева. Длина около 1500 км. Площадь бассейна 245 тыс. км². Средняя глубина Оки 1,5 метра. Русло Оки по большей части мало извилистое, местами образует крутые повороты. Правый берег реки в пределах Нижегородской области в начале низкий (до впадения Теши), а затем поднимается высокими кручами.
Питание преимущественно снеговое – 60%; дождевое более 20%; подземное менее 20%. Половодье - с апреля по май в верховьях и до начала июня в низовьях. Летом и зимой межень, осенью дождевые паводки. Скорость течения Оки в период паводка достигает 2,5 м/сек, в межень на перекатах достигает 1 м/сек, на плесах - 0,6 м/сек. За весну проходит 78% годового стока в верховьях и 73% в низовьях, летом 7-8%, осенью 8-10%, зимой 7-9%. Замерзает в верховьях в ноябре - начале января, в низовьях в конце октября - декабре; вскрывается в верховьях в конце марта - апреле, в низовьях до начала мая. Продолжительность ледохода от 1 до 20 сут, в низовьях до 15 сут. (Жданова И., 2007)
Перечень показателей для контроля, порядок отбора проб
Контроль экологического состояния атмосферного воздуха, почвенного покрова и поверхностных вод осуществляется в ходе отбора и анализа проб.
Для проведения отборов и анализов проб выбраны створ №3, находящийся выше по течению реки Ока, и створ №2, находящийся ниже по течению от очистных сооружений ливневых стоков ОАО «ГАЗ».
Створ – условное поперечное сечение водоема и водотока, в котором производится комплекс работ для получения данных о качестве воды.
Качество воды определяется наличием в ней различных веществ неорганического и органического происхождения, а также микроорганизмов.
Классы качества вод в зависимости от значения индекса загрязнения воды
| Воды
|
Значения ИЗВ
|
Классы качества вод
|
| Очень чистые
|
до 0,2
|
1
|
| Чистые
|
0,2–1,0
|
2
|
| Умеренно загрязненные
|
1,0–2,0
|
3
|
| Загрязненные
|
2,0–4,0
|
4
|
| Грязные
|
4,0–6,0
|
5
|
| Очень грязные
|
6,0–10,0
|
6
|
| Чрезвычайно грязные
|
>10,0
|
7
|
Створ №3, расположенный выше источника загрязнения, показывает фоновое содержание анионов в воде, створ №2 – фактическую концентрацию. Сравнивая концентрации веществ в этих створах, можно судить о характере и степени загрязненности воды под влиянием очистных сооружений ливневых стоков.
Перечень показателей для контроля
:
- температура;
- органолептические показатели;
- взвешенные вещества;
- водородный показатель (рH);
- тяжелые металлы;
- диоксид углерода;
- алюминий;
- цианиды;
- анионный состав (сульфаты, хлориды, нитраты, нитриты, фосфаты);
- аммоний;
- СПАВ;
- ХПК;
- БПК5
;
- сухой остаток;
- фенолы,
- нефтепродукты.
Отбор проб
Пробы отбираются в летние и осенние месяцы, когда наблюдается наиболее низкий уровень воды (Гусева Т. В. и др.).
Место для отбора проб выбирают только после подробного ознакомления с технологией производства, системой канализации, назначением и работой отдельных элементов станции очистки и т.д.
При отборе проб с определенной глубины используют специальные пробоотборные устройства различных конструкций. Основной их частью является цилиндрический сосуд (пластмассовый, металлический), открытый с обеих сторон и снабженный плотно прилегающими крышками, закрывающимися при помощи пружины фиксированными спусковыми устройствами. Последние приводятся в действие при помощи вспомогательного тросика или посредством удара груза, опускаемого по подвесному тросику. Сосуд с крышками, зафиксированными в открытом положении, погружают в воду до требуемой глубины. После достижения требуемой глубины при помощи спускового устройства закрывают крышки и сосуд поднимают на поверхность. Пробу выливают в бутыль через выпускной кран. Пробоотборник можно снабдить термометром для одновременного измерения температуры. (Р 52.24.353-94).
При отборе проб соблюдаются требования и рекомендации по предварительной обработке и срокам хранения, объемам необходимой для анализа воды и способу консервации согласно ГОСТ 17.1.5.04-81 (Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия).
Объем отбираемой пробы, необходимый для проведения анализа обычно составляет от 1 до 5л. В нашем случае достаточно 2л.
Методы анализа
| Ингредиенты
|
Метод анализа
|
Методики
|
| Хлориды
|
Фотометрия
|
ПНДФ 14.1:2.96-97
|
| Сульфаты
|
Фотометрия
|
ПНДФ 14.1:2.159-2000
|
| Нитраты
|
Фотометрия
|
ПНДФ 14.1:2.4-95
|
| Нитриты
|
Фотометрия
|
ПНДФ 14.1:2.3-95
|
| Фосфаты
|
Фотометрия
|
ПНДФ 14.1:2.112-97
|
Оборудование, используемое для химического анализа вод:
Для качественного и количественного определения ионов в растворах используется ионный хроматограф, основным элементом которого является разделяющая аналитическая колонка. Также для анализа вод может использоваться следующее оборудование и посуда:
1. Переносной деревянный штатив с набором капель с растворами солей,
реактивов, кислот и щелочей и баночек с сухими солями;
2. Штатив для пробирок;
3. Металлический штатив с кольцом, фарфоровым треугольником и асбестированной сеткой;
4. Держатели для пробирок;
5. Центрифужные пробирки;
6. Пробирки цилиндрические;
7. Капиллярные пипетки;
8. Стеклянные палочки;
9. Фарфоровые чашки диаметром 3—5 см;
10. Промывалка;
11. Предметные стекла;
12. Фарфоровая капельная пластинка;
13. Предметные стекла с углублениями;
15. Водяная баня;
16. Центрифуга.
Результаты исследований
Анализ результатов исследования
Результаты, полученные в ходе лабораторных исследований, сгруппируем в соответствии с датами отбора проб и шириной створа. Где створ №3 показывает фоновое содержание анионов в воде, а створ №2 – фактическую концентрацию.
| Дата
|
16.07.04
|
27.07.04
|
02.08.04
|
| Ингредиенты
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
| Хлориды
|
17,02
|
17,02
|
15,31
|
17,37
|
16,20
|
16,21
|
| Сульфаты
|
57,7
|
64,10
|
27,8
|
45,9
|
51,0
|
43,2
|
| Нитраты
|
3,85
|
5,39
|
4,59
|
5,87
|
4,90
|
4,82
|
| Нитриты
|
0,126
|
0,115
|
0,057
|
0,145
|
0,060
|
0,131
|
| Фосфаты
|
0,29
|
0,138
|
0,52
|
0,246
|
0,31
|
0,231
|
Таблица 1
Результаты анализа из створа №2(0,3) и створа №3(0,3)
| Дата
|
25.08.04
|
31.08.04
|
08.09.04
|
| Ингредиенты
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
| Хлориды
|
18,23
|
18,24
|
20,42
|
21,71
|
23,45
|
22,58
|
| Сульфаты
|
66,0
|
84,6
|
76,9
|
84,4
|
82,4
|
97,4
|
| Нитраты
|
3,94
|
4,04
|
2,39
|
3,85
|
5,04
|
2,90
|
| Нитриты
|
0,149
|
<0,02
|
0,049
|
0,029
|
0,044
|
0,058
|
| Фосфаты
|
0,09
|
0,072
|
0,14
|
0,058
|
<0,05
|
0,13
|
Таблица 2
Результаты анализа из створа №2(0,3) и створа №3(0,3)
Таблица 3
Результаты анализа из створа №2(0,3) и створа №3(0,3)
| Дата
|
21.09.04
|
07.10.04
|
20.10.04
|
| Ингредиенты
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
| Хлориды
|
24,67
|
27,23
|
25,52
|
24,50
|
22,12
|
25,52
|
| Сульфаты
|
102,6
|
86,8
|
69,2
|
45,8
|
78,2
|
69,6
|
| Нитраты
|
4,77
|
4,59
|
9,17
|
8,62
|
11,56
|
8,80
|
| Нитриты
|
0,058
|
0,061
|
0,08
|
0,061
|
0,101
|
0,109
|
| Фосфаты
|
0,073
|
0,145
|
0,254
|
0,101
|
0,870
|
0,464
|
Таблица 4
Результаты анализа из створа №2(0,6) и створа №3(0,6)
| Дата
|
16.07.04
|
27.07.04
|
02.08.04
|
| Ингредиенты
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
| Хлориды
|
17,87
|
15,31
|
22,58
|
17,37
|
17,10
|
16,32
|
| Сульфаты
|
60,3
|
58,8
|
43,6
|
56,6
|
41,0
|
51,2
|
| Нитраты
|
2,94
|
4,04
|
4,77
|
5,50
|
4,20
|
4,90
|
| Нитриты
|
0,123
|
0,058
|
0,057
|
0,58
|
0,051
|
0,51
|
| Фосфаты
|
0,29
|
0,28
|
0,56
|
0,30
|
0,51
|
0,28
|
Таблица 5
Результаты анализа из створа №2(0,6) и створа №3(0,6)
| Дата
|
25.08.04
|
31.08.04
|
08.09.04
|
| Ингредиенты
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
| Хлориды
|
17,37
|
17,37
|
19,11
|
19,11
|
20,84
|
22,97
|
| Сульфаты
|
82,1
|
94,9
|
65,2
|
35,3
|
78,8
|
84,6
|
| Нитраты
|
6,15
|
5,50
|
2,75
|
3,12
|
1,65
|
2,39
|
| Нитриты
|
0,507
|
0,217
|
0,025
|
0,022
|
0,045
|
0,051
|
| Фосфаты
|
0,45
|
0,30
|
0,09
|
0,08
|
0,09
|
0,12
|
Таблица 6
Результаты анализа из створа №2(0,6) и створа №3(0,6)
| Дата
|
21.09.04
|
07.10.04
|
20.10.04
|
| Ингредиенты
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
Факт. конц-я, мг/дм3
|
Фоновая
конц-я, мг/дм3
|
| Хлориды
|
25,52
|
25,52
|
23,99
|
24,67
|
22,12
|
23,82
|
| Сульфаты
|
115,4
|
99,5
|
82,4
|
82,4
|
66,7
|
33,0
|
| Нитраты
|
4,59
|
4,77
|
9,17
|
8,62
|
11,74
|
9,27
|
| Нитриты
|
0,08
|
0,062
|
0,06
|
0,059
|
0,101
|
0,101
|
| Фосфаты
|
0,109
|
0,12
|
0,130
|
0,10
|
0,430
|
0,46
|
Построим гистограммы для каждого ингредиента и рассчитаем индекс загрязнения вод по формуле:
где Ci
– фактическая концентрация загрязнителя, ПДКi
– установленная величина химических веществ для водных объектов хозяйственно-питьевого и культурно-бытового водопользования (ПДКв
)
Величины ПДК для исследуемых загрязнителей отобразим в таблице (ГН 2.1.5.1315-03)
| Наименование
|
Величина ПДК, мг/дм3
|
Класс опасности
|
| Хлориды
|
350
|
4
|
| Сульфаты
|
500
|
4
|
| Нитраты
|
45
|
3
|
| Нитриты
|
3,3
|
2
|
| Фосфаты
|
50
|
1
|
Гистограмма 1
Сравнение концентраций хлоридов в створе №2(0,3) и в створе №3(0,3) за 2004 год.

ИЗВ = 0,9
Гистограмма 2
Сравнение концентраций хлоридов в створе №2(0,6) и в створе №3(0,6) за 2004 год.
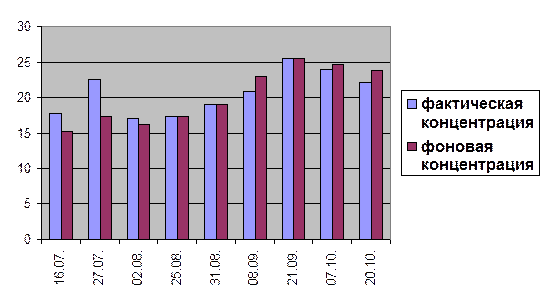
ИЗВ = 1,02
Вывод:
За весь период наблюдения, а точнее с 16 июля по 20 октября фактическая концентрация хлоридов в реке Оке практически не превышала фоновые показатели. Однако видно, что концентрации хлоридов в поверхностных водах подвержены заметным сезонным колебаниям, коррелирующим с изменением общей минерализации воды. (Гусева Т. В. и др.). Так максимальное фактическое содержание хлоридов по створу №2(0,3) и створу №3(0,3) достигается в осенние месяцы, а именно 7 октября и 21 сентября соответственно. Наименьшее содержание вещества наблюдается в летние месяцы: 27 июля и 2 августа соответственно. Аналогичная ситуация касается створа №2(0,6) и створа №3(0,6): максимальные концентрации по обоим створам достигаются 21 сентября; минимальные – 2 августа и 16 июля соответственно. При этом превышений по санитарно-гигиеническим нормативам не наблюдается.
Гистограмма 3
Сравнение концентраций сульфатов в створе №2(0,3) и в створе №3(0,3) за 2004 год.

ИЗВ = 0,9
Гистограмма 4
Сравнение концентраций сульфатов в створе №2(0,6) и в створе №3(0,6) за 2004 год.

ИЗВ = 1,06
Вывод:
Из полученных выше гистограмм видно, что концентрации сульфатов подвержены сезонным колебаниям. Так в течение июля наблюдаются наименьшие показатели, а начиная с августа по створу №2(0,3) и створу №3(0,3) концентрации возрастают в среднем на 10 мг/дм3
. По створам №2(0,6) и №3(0,6) наблюдается несколько иная ситуация: в конце августа наблюдается с начала резкое увеличение концентрации (на 100% и на 84% соответственно), а затем резкое уменьшение (на 20% и на 63% соответственно). Данное явление связано с изменением общей минерализации воды. С сентября и до конца октября фактические концентрации сульфатов значительно превышают фоновые показатели, на что могли повлиять как окислительно-восстановительные процессы в реке, так и хозяйственная деятельность (Хараев Г.И. и др., 2004). Но необходимо отметить, что содержание сульфатов в створе №2 и створе №3 соответствует санитарно-гигиеническим нормативам.
Гистограмма 5
Сравнение концентраций нитратов в створе №2(0,3) и в створе №3(0,3) за 2004 год.

ИЗВ = 1,02
Гистограмма 6
Сравнение концентраций нитратов в створе №2(0,6) и в створе №3(0,6) за 2004 год.

ИЗВ = 0,9
Вывод:
В летние месяцы концентрации нитратов по обоим створам минимальные. Но уже в начале сентября и вплоть до конца октября наблюдается резкое увеличение (почти в 2 раза) содержания вещества с одновременным превышением фактической концентрации над фоновой (в среднем на 12%). Происходит эвтрофирование водного объекта, связанное прежде всего с процессами разложения органических веществ и переходом азота из органических форм в минеральные. Подобные процессы могут быть вызваны в результате сброса промышленных и хозяйственно-бытовых сточных вод (Гусева Т. В. и др.). Необходимо отметить, что сброс очистных сооружений ливневых стоков ОАО «ГАЗ» не значительно влияет на состав вод реки, так как превышений по санитарно-гигиеническим нормативам не наблюдается.
Гистограмма 7
Сравнение концентраций нитритов в створе №2(0,3) и в створе №3(0,3) за 2004 год.
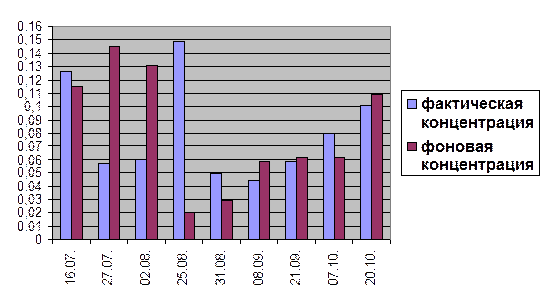
ИЗВ = 0,9
Гистограмма 8
Сравнение концентраций нитритов в створе №2(0,6) и в створе №3(0,6) за 2004 год.

ИЗВ = 0,6
Вывод:
Из полученных выше гистограмм видно, что максимальные значения содержания нитритов в воде наблюдается в летние месяцы, а уже ближе к сентябрю происходит резкое уменьшение этого значения, с последующим его увеличением до конца октября в среднем на 0,03 мг/дм3
. Наибольшая концентрация нитритов в конце лета связана с активностью фитопланктона (установлена способность диатомовых и зеленых водорослей восстанавливать нитраты до нитритов) (Хараев Г.И. и др., 2004). В некоторых месяцах, а именно в июле, августе и октябре фактические показатели превышают фоновые (почти в 2 раза), но как видно из расчета ИЗВ, данное превышение не значительно влияет на состояние водного объекта.
Гистограмма 9
Сравнение концентраций фосфатов в створе №2(0,3) и в створе №3(0,3) за 2004 год.
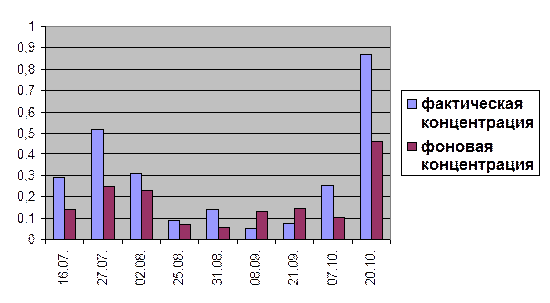
ИЗВ = 1,6
Гистограмма 10
Сравнение концентраций фосфатов в створе №2(0,6) и в створе №3(0,6) за 2004 год.
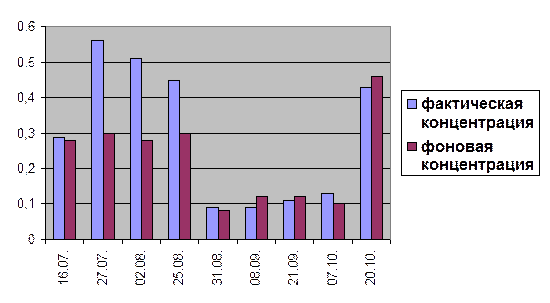
ИЗВ = 1,3
Вывод:
концентрации фосфатов подвержены значительным сезонным колебаниям. Данное явление зависит от соотношения интенсивности процессов фотосинтеза и биохимического окисления органических веществ. (Хараев Г.И. и др., 2004). Так минимальные значения преобладают летом, а именно в августе, и в начале осени – в сентябре и начале октября. Максимальное значение по створам №2(0,3) и №3(0,3) достигается 20 октября, а по створам №2(0,6) и №3(0,6) – 27 июля. На протяжении всего лета, а также в октябре месяце наблюдается превышение фактических концентраций фосфатов, по сравнению с фоновыми. Данное явление может быть отражением присутствия в водном объекте компонентов хозяйственно-бытовых сточных вод. Но в соответствии с санитарно-гигиеническими нормативами, данное превышение не значительно влияет на состояние водного объекта.
Выводы
В данной курсовой работе была осуществлена оценка влияния сброса очистных сооружений ливневых стоков ОАО «ГАЗ» на анионный состав вод р. Ока.
Для этого были проведены следующие мероприятия
:
- отбор проб в створе №2, отражающий фактические концентрации анионов в воде и в створе №3, отражающий фоновое содержание.
- группировка результатов, полученных в ходе лабораторных исследований, в соответствии с датами отбора проб и шириной створа.
- сравнение концентраций каждого ингредиента в створе №2 и №3 с помощью построения гистограмм, что делает изображение результатов мониторинга более наглядным.
- расчет индекса загрязнения вод.
- непосредственный анализ результатов исследования.
По итогам работы можно сделать следующий вывод:
В период с июля по октябрь месяц концентрации анионов, а именно хлоридов, сульфатов, нитратов, нитритов, фосфатов в р. Оке изменялся как в сторону увеличения, так и в сторону уменьшения. Но при этом фактическое и фоновое содержание ингредиентов не превышало санитарно-гигиенические нормативы (ГН 2.1.5.1315-03). Следовательно, влияние сброса очистных сооружений ливневых стоков ОАО «ГАЗ» на анионный состав вод р. Ока не значительно, что говорит об эффективной работе данных очистных сооружений.
Список литературы
1 . Гидрохимические показатели состояния окружающей среды : справочные материалы/под.ред. Гусевой Т.В., Молчановой Я.П., Заика Е.А., Винниченко В.Н., Аверочкина Е.М.
2.
Методические указания к контрольной работе по дисциплине Экологический мониторинг/ М.В. Дабахов – Н.Новгород: Изд-во ВГИПУ,2007.
3 . ГОСТ 17.1.3.13-86 "Охрана природы. Гидросфера. Общие требования к охране поверхностных вод от загрязнения". - М.: Изд-во стандартов, 1987.
4 . Гигиенические нормативы ГН 2.1.5.1315-03 «Предельно допустимые концентрации (ПДК) химических веществ в воде водных объектов хозяйственно-питьевого и культурно-бытового водопользования» (утв. Главным государственным санитарным врачом РФ 30 апреля 2003 г.)
5 . Методическое пособие по дисциплине «Экологический мониторинг»: Учебное пособие/под ред. Г. И. Хараева. – Улан-Удэ: Изд-во ВСГТУ,2004.-77с.
6 . Экологический мониторинг: шаг за шагом / Е. В. Веницианов и др.Под ред. Е. А. Заика. – М.: РХТУ им. Д. И. Менделеева, 2003. – 252 с.
|