Федеральное агентство по образованию
Государственное образовательное учреждение высшего
профессионального образования
«Ярославский государственный технический университет»
Кафедра «Химическая технология органических веществ»
Отчет защищен
с оценкой ____________
Преподаватель,
доцент
____________ Н. П. Герасимова
14.01.2011
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ РЕАКЦИИ АЛКИЛИРОВАНИЯ АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ
Контрольная работа
по курсу «Химическая технология органических веществ»
ЯГТУ 240401.65 – 014 к/р
Отчет выполнил
студент гр. ЗО-50
____________ А. И. Коротков
14.01.2011
2011

Реферат
25 с., 3 рис., 2 источника
АЛКИЛИРОВАНИЕ, АЛКИЛИРУЮЩИЕ АГЕНТЫ, АРЕНЫ, АРОМАТИЧЕСКИЕ УГЛЕВОДОРОДЫ, КАТАЛИЗАТОР
Объектом исследования является процесс алкилирования ароматических углеводородов.
Цель работы – изучение теоретических основ реакции алкилирования ароматических углеводородов.
В работе использовался персональный компьютер с операционной системой WindowsXP и пакетом MSOfFice
В процессе работы были изучены и рассмотрены теоретические основы реакции алкилирования ароматических углеводородов.
|
|


Введение
Алкилированиемназывают процессы введения алкильных групп в молекулы органических и некоторых неорганических веществ. Эти реакции имеют очень большое практическое значение для синтеза алкилированных в ядро ароматических соединений, изопарафинов, меркаптанов и сульфидов, аминов, продуктов переработки α-оксидов и ацетилена. Процессы алкилирования часто являются промежуточными стадиями в производстве мономеров, моющих веществ и т.д.
1 Общая характеристика процессов алкилирования
Классификация реакций алкилирования
Наиболее рациональная классификация процессов алкилирования основана на типе вновь образующейся связи:
− алкилирование по атому углерода (С-алкилирование) состоит в замещении на алкильную группу атома водорода, находящегося при атоме углерода. К этому замещению способны парафины, но наиболее характерно алкилирование для ароматических соединений (реакция Фриделя–Крафтса);
− алкилирование по атомам кислорода и серы (О- и S-алкилирова- ние) представляет собой реакцию, в результате которой алкильная группа связывается с атомом кислорода или серы;
Реклама

− алкилирование по атому азота (N-алкилирование) состоит в замещении атомов водорода в аммиаке или в аминах на алкильные группы;
− алкилирование по атомам других элементов (Si-, Pb-, Al-алкили- рование) представляет собой важнейший путь получения элемент- и металлорганических соединений, когда алкильная группа непосредственно связывается с гетероатомом.
Другая классификация реакций алкилирования основана на различиях в строении алкильной группы, вводимой в органическое или неорганическое соединение. Она может быть насыщенной алифатической (например, этильной и изопропильной) или циклической. В последнем случае реакцию иногда называют циклоалкилированием. При введении фенильной или вообще арильной группы образуется непосредственная связь с углеродным атомом ароматического ядра. В алкильную группу может входить ароматическое ядро или двойная связь, и, если последняя достаточно удалена от реакционного центра, реакция мало отличается от обычных процессов алкилирования. Введение винильной группы (винилирование) занимает особое место и осуществляется главным образом при помощи ацетилена. Наконец, алкильные группы могут содержать различные заместители, например атомы хлора, гидрокси-, карбокси-, сульфокислотные группы. Важнейшей из реакций введения замещенных алкильных групп является процесс β-оксиалкилирования (в частном случае оксиэтилирование), охватывающий широкий круг реакций оксидов олефинов.
Алкилирующие агенты и катализаторы.
Все алкилирующие агенты по типу связи, разрывающейся в них при алкилировании, можно разделить на следующие группы:
1) ненасыщенные соединения (олефины и ацетилен), у которых происходит разрыв π-электронной связи между атомами углерода;
2) хлорпроизводные с достаточно подвижным атомом хлора, способным замещаться под влиянием различных агентов;
3) спирты, простые и сложные эфиры, в частности оксиды олефинов, у которых при алкилировании разрывается углерод-кислородная связь.
Олефины(этилен, пропилен, бутены и высшие) имеют первостепенное значение в качестве алкилирующих агентов.
Ввиду дешевизны ими стараются пользоваться во всех случаях, где это возможно. Главное применение они нашли для С-алкилирования парафинов и ароматических соединений. Они не применимы для N-алкилирования и не всегда эффективны при S- и О-алкилировании и синтезе металлорганических соединений.
Алкилирование олефинами в большинстве случаев протекает по ионному механизму через промежуточное образование карбокатионов и катализируется протонными и апротонными кислотами. Реакционная способность олефинов при реакциях такого типа определяется их склонностью к образованию карбокатионов:
Реклама

RCH = CH2
+ H+
⇔ RC+
H−CH3
Это означает, что удлинение и разветвление цепи углеродных атомов в олефине значительно повышает его способность к алкилированию:
CH2
=CH2
< CH3
−CH=CH2
< CH3
−CH2
–CH=CH2
< (CH3
)2
C=CH2
В ряде случаев алкилирование олефинами протекает под влиянием инициаторов радикально-цепных реакций, освещения или высокой температуры. Здесь промежуточными активными частицами являются свободные радикалы. Реакционная способность разных олефинов при таких реакциях значительно сближается.
Хлорпроизводныеявляются алкилирующими агентами наиболее широкого диапазона действия. Они пригодны для С-, О-, S- и N-алкилирования и для синтеза большинства элемент- и металлорганических соединений. Применение хлорпроизводных рационально для тех процессов, в которых их невозможно заменить олефинами или когда хлорпроизводные дешевле и доступнее олефинов.
Алкилирующее действие хлорпроизводных проявляется в трех различных типах взаимодействий: в электрофильных реакциях, при нуклеофильном замещении и в свободно-радикальных процессах. Механизм электрофильного замещения характерен, главным образом, для алкилирования по атому углерода, но, в отличие от олефинов, реакции катализируются только апротонными кислотами (хлориды алюминия, железа). В предельном случае процесс идет с промежуточным образованием карбокатиона
RCl + AlCl3
⇔δ+
R→ Cl→δ−
AlCl3 ⇔ R+
+ AlCl4−
,
в связи с чем реакционная способность алкилхлоридов зависит от поляризации связи С–Сl или от стабильности карбокатионов и повышается при удлинении и разветвлении алкильной группы:
CH3
−CH2
Cl < (CH3
)2
CHCl < (CH3
)3
CCl
При другом типе реакций, характерном для алкилирования по атомам кислорода, серы и азота, процесс состоит в нуклеофильном замещении атома хлора. Механизм аналогичен гидролизу хлорпроизводных, причем реакция, как правило, протекает в отсутствие катализаторов:
RCl + :NH3 → R N+
H3 + Cl−
⇔ RNH2
+ HCl
Реакционная способность хлорпроизводных изменяется в данных процессах таким же образом, как при гидролизе, а именно:
ARCH2
Cl > CH2
=CH−CH2
Cl > AlkCl > ArCl,
перв. AlkCl > втор. AlkCl > трет. AlkCl.
Целый ряд процессов алкилирования хлорпроизводными протекает по свободно радикальному механизму. Это особенно характерно для синтезов элементо- и металлорганических соединений, когда свободные радикалы образуются за счет взаимодействия с металлами:
4PbNa + 4C2
H5
Cl → 4Pb + 4NaCl + 4С2
Н5
•
→ 4NaCl + Pb(C2
H5
)4
+ 3Pb.
Спирты и простые эфирыспособны к реакциям С-, О-, N- и S-алкилирования. К простым эфирам можно отнести и оксиды олефинов, являющиеся внутренними эфирами гликолей, причем из всех простых эфиров только оксиды олефинов практически используют в качестве алкилирующих агентов. Спирты применяют для О- и N-алкилирования в тех случаях, когда они дешевле и доступнее хлорпроизводных. Для разрыва их алкил-кислородной связи требуются катализаторы кислотного типа:
R−OH + H+
⇔ R−
+ OH2
⇔ R+
+ H2
O.
2 Химия и теоретические основы алкилирования ароматических соединений
Катализаторы
При алкилировании ароматических углеводородов (бензол, толуол и др.) хлорпроизводными в промышленности в качестве катализатора используют только хлорид алюминия, отличающийся наибольшей активностью из всех доступных апротонных кислот. Он же применяется при алкилировании углеводородов олефинами, но в этом случае пригодны и другие катализаторы кислотного типа (H2
SO4
, безводный HF, BF3
, фосфорная кислота на носителях, алюмосиликаты, цеолиты). Процесс с H2
SO4
и HF проводят в жидкой фазе при 10…40 0
С и 0,1…1,0 МПа, с Н3
РО4
– в газовой фазе при225…275 0
С и 2…6 МПа, с алюмосиликатами и цеолитами – в жидкой или газовой фазе при 200…400 0
С и 2…6 МПа.
Хлорид алюминия в твердом виде практически не растворим в углеводородах и слабо катализирует реакцию. Однако по мере выделения НСl хлорид алюминия начинает превращаться в темное жидкое вещество, также не растворимое в избытке углеводорода (комплекс Густавсона), которое обладает высокой каталитической активностью, и реакция постепенно ускоряется. Его можно приготовить, пропуская НСl при нагревании через суспензию АlСl3
в ароматическом углеводороде. Комплекс представляет собой соединение АlСl3
и НСl с 1-6 молекулами ароматического углеводорода, одна из которых находится в особом структурном состоянии положительно заряженного иона (σ-комплекс), а остальные образуют сольватную оболочку
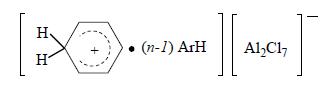
Во избежание медленного катализа твердым хлоридом алюминия этот активный каталитический комплекс целесообразно готовить предварительно и потом подавать на реакцию. Кроме НСl его образованию способствуют небольшие добавки воды или соответствующего хлорпроизводного, роль которых состоит в генерации НСl. Более приемлемо использовать НСl или RCl, так как вода дезактивирует часть катализатора, разлагая его. По этой же причине необходимо хорошо осушать реагенты и следить, чтобы в реакционную смесь не попадала вода, способная вызвать бурное разложение комплекса. Другими катализаторными ядами являются многие соединения серы и аммиак, в меньшей степени – диены и ацетилен.
Механизм реакции
В качестве алкилирующих агентов в промышленности применяют, главным образом, хлорпроизводные и олефины. Использование спиртов менее эффективно, потому что при алкилировании спиртами хлорид алюминия разлагается, а протонные кислоты разбавляются образующейся водой. В обоих случаях происходит дезактивирование катализатора, что обусловливает его большой расход.
При реакции с хлорпроизводными или олефинами АlСl3
расходуется только в каталитических количествах. В первом случае он активирует атом хлора, образуя сильно поляризованный комплекс или карбокатион, что с олефинами происходит только в присутствии сокатализатора – НСl:
RCH=CH2
+ HCl + AlCl3
→ RC+
H − CH3
+ AlCl–
4
.
Строение алкильной группы в полученном продукте определяется правилом о промежуточном образовании наиболее стабильного карбокатиона (трет- > втор- > перв-). Поэтому в случае низших олефинов только из этилена образуется первичный алкилбензол (этилбензол), из пропилена – вторичный (изопропилбензол), а из изобутена – третбутилбензол:
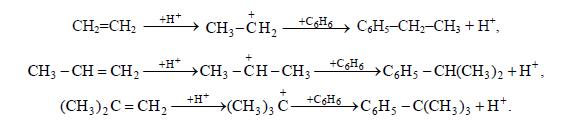
Однако при алкилировании высшими олефинами и хлорпроизводными наблюдается изомеризация алкильных групп, которая происходит перед алкилированием, поскольку алкилбензолы к ней уже не способны. Эта изомеризация протекает в направлении промежуточного образования наиболее стабильного карбокатиона, но без нарушения углеродного скелета алкильной группы, а лишь с перемещением реакционного центра. Вследствие этого из хлорпроизводных и олефинов с прямой цепью атомов углерода получается смесь втор-алкилбензолов, а из соединений с разветвленной цепью – преимущественно трет-алкилбензолы.
Влияние строения ароматического соединения при реакциях алкилирования в общем такое же, как при других процессах электрофильного замещения в ароматическое ядро, но имеет свои особенности. Реакция алкилирования отличается сравнительно малой чувствительностью к электронодонорным заместителям в ядре. Так, активирующее влияние алкильных групп и конденсированных ядер при катализе реакции АlСl3 изменяется следующим образом (для бензола величина принятаза 1,0):
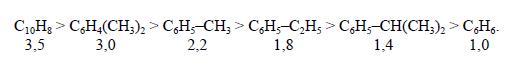
Электроноакцепторные заместители сильно дезактивируют ароматическое ядро. Хлорбензол алкилируется примерно в 10 раз медленнее бензола, а карбонильные, карбокси-, циано- и нитрогруппы приводят к полному дезактивированию ароматического ядра, вследствие чего соответствующие производные вообще не способны к алкилированию. Этим реакция алкилирования значительно отличается от других процессов замещения в ароматическое ядро, например от хлорирования и сульфирования.
Правила ориентации при алкилировании в общем подобны другим реакциям электрофильного замещения в ароматическое ядро, но строение продукта может существенно изменяться в зависимости от катализаторов и условий реакции. Так, электронодонорные заместители и атомы галогена направляют дальнейшее замещение преимущественно в пара-и орто- положения, однако в более жестких условиях и особенно при катализе хлоридом алюминия происходит изомеризация гомологов бензола с внутримолекулярной миграцией алкильных групп и образованием равновесных смесей, в которых преобладают термодинамически более стабильные изомеры. При алкилировании нафталина это позволяет в мягких условиях получать 1-алкил-, а в более жестких – 2-алкилнафталин.
Последовательное алкилирование
При алкилировании ароматических соединений в присутствии любых катализаторов происходит последовательное замещение атомов водорода с образованием смеси продуктов разной степени алкилирования. Например, метилирование и этилирование бензола идет вплоть до получения гексаалкилбензолов
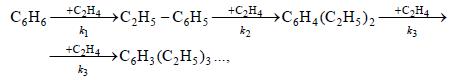
пропилирование – до получения тетраизопропилбензола и т.д. Каждая из реакций при умеренной температуре является практически необратимой. Однако при катализе АlСl3
и достаточно жестких условиях катализа алюмосиликатами и цеолитами происходит обратимая реакция переалкилирования (диспропорционирование) с межмолекулярной миграцией алкильных групп:
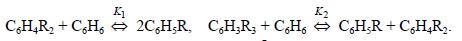
С теми же катализаторами протекает и рассмотренная выше обратимая изомеризация с внутримолекулярной миграцией алкильных групп, в результате которой среди диалкилбензолов преобладает мета-
изомер, среди триалкилбензолов 1,3,5-изомер и т.д.
Способность алкильных групп к миграции изменяется в такой последовательности:
(CH3
)3
C > (CH3
)2
CH > CH3
–CH2
>> CH3
,
причем с активным комплексом хлорида алюминия эти реакции довольно быстро идут уже при комнатной температуре, в то время как для метилбензолов требуется длительное нагревание.
Побочные реакции
Кроме рассмотренного ранее образования полиалкилбензолов при алкилировании нежелательны смолообразование, деструкция алкильных групп и полимеризация олефинов.
Смолообразованиесостоит в получении конденсированных ароматических соединений с высокой температурой кипения. Из подобных продуктов при алкилировании бензола обнаружены диарилалканы, диарилолефины и др. При алкилировании нафталина получается больше смолы, и в ней найдены динафтил и другие вещества с конденсированными циклами.
Смолообразование становится особенно существенным при повышении температуры.
Эти же условия ведут к деструкцииалкильных групп и побочному образованию алкилбензолов с более короткой алкильной группой. Так, при реакции с пропиленом побочно получается этилбензол, с этиленом – толуол и т.д. Особенно заметна такая деструкция при алкилировании алкилгалогенидами и олефинами с достаточно длинной углеродной цепью.
Наконец, образование полимеровпроисходит в результате последовательного взаимодействия карбокатиона с олефином. Полимеры имеют небольшую молекулярную массу, и их образование подавляется наличием избытка ароматического углеводорода при снижении концентрации олефина в жидкой фазе.
Кинетика процесса
Сама реакция алкилирования с активным комплексом хлорида алюминия идет очень быстро, сильно ускоряется при механическом перемешивании или интенсивном барботировании газообразных олефинов через реакционную массу и протекает в диффузионной или близкой к ней области. Ее скорость повышается при росте давления, но мало зависит от температуры, имея низкую энергию активации. Лимитирующей является стадия диффузии олефина через пограничную пленку каталитического комплекса хлорида алюминия, в которой протекают все реакции. В отличие от этого, переалкилирование идет значительно медленнее и существенно ускоряется при повышении температуры, так как имеет энергию активации ≈ 63 кДж/моль.
Обе реакции замедляются при постепенном дезактивировании катализатора, но особенно сильно падает скорость переалкилирования. В результате в реакционной смеси будет накапливаться значительное количество полиалкилбензолов, не успевающих вступить в реакцию переалкилирования.
Во избежание этого приходится ограничивать подачу реагентов, и возможность интенсификации процесса лимитируется медленной реакцией переалкилирования.
На дезактивирование катализатора влияет, кроме примесей реагентов, накопление некоторых побочных продуктов алкилирования, способных прочно связывать АlСl3 или образовывать стабильные σ-комплексы, с трудом отдающие свой протон молекуле олефина. Такими веществами при низкой температуре, когда переалкилирование идет медленно, являются полиалкилбензолы, а при высокой температуре – полициклические ароматические соединения и смолы. В результате оказывается, что оптимальные производительность и расход катализатора при получении этил- и изопропилбензола достигаются при некоторой средней температуре (≈ 100 0
С), когда переалкилирование протекает уже достаточно быстро, но полициклических веществ, дезактивирующих катализатор, получается еще мало. При синтезе соединений с более длинной алкильной группой выбор температуры лимитируется побочной реакцией деструкции, а при получении алкилнафталинов – процессами конденсации и осмоления. В этих случаях ее оптимум равен 30…50 0
С, причем при алкилировании нафталина селективность можно дополнительно повысить применением растворителя.
3 Технология алкилирования ароматических углеводородов
К наиболее многотоннажным продуктам, вырабатываемым алкилированием ароматических соединений, относятся этил- и изопропилбензол.
ЭтилбензолС6
Н5
–С2
Н5
– бесцветная жидкость, кипящая при 136 °С. Его практическое значение состоит почти исключительно в дальнейшем превращении в стирол С6
Н5
–СН=СН2
, являющийся одним из важнейших мономеров для выработки пластических масс и синтетического каучука. Наиболее дешевый этил-бензол получают, выделяя его из ксилольной фракции продуктов риформинга или пиролиза, где он содержится в количестве 10…15 %; основная же масса этилбензола производится алкилированием бензола этиленом.
ДиэтилбензолС6
Н4
(С2
Н5
)2
, побочно образующийся при этой реакции и представляющий собой смесь мета-
и пара-
изомеров, приобрел значение для получения дивинилбензола С6
Н4
(СН=СН2
)2
– ценного мономера для выработки ионообменных смол. Диэтилбензол лучшего качества получается, однако, переалкилированием этилбензола с А1Сl3
:
2 C6
H5
–C2
H5
⇔ C6
H4
(C2
H5
)2
+ C6
H6
.
Аналогично этилбензолу, алкилированием толуола производят этилтолуол, а из него дегидрированием – винилтолуол:
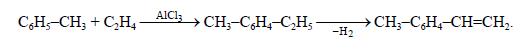
ИзопропилбензолС6
Н5
–СН(СН3
)2
, иначе называемый кумолом, представляет собой бесцветную жидкость ( tкип
= 152,5 °С). Его получают алкилированием бензола пропиленом:
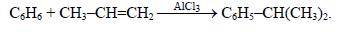
Первоначально изопропилбензол применяли в качестве высокооктановой добавки к моторным топливам, а в настоящее время основным его потребителем является химическая промышленность. Изопропилбензол перерабатывают в α-метилстирол С6
Н5
–С(СН3
)=СН2
, являющийся мономером для синтетического каучука, и в изопропилфенилгидропероксид С6
Н5
–С(СН3
)2
–ООН, из которого получают фенол и ацетон.
Алкилбензолы с достаточно длинной алкильной группой являются промежуточными продуктами для выработки поверхностно-активных и моющих веществ типа сульфонолов RC6
H4
SO2
ONa, которые получают при дальнейшем сульфировании алкилбензолов и нейтрализации.
Исходные вещества
Технический бензол или другой ароматический углеводород, применяемый для алкилирования, нужно предварительно осушать, для чего используют отгонку воды в виде азеотропной смеси с ароматическим углеводородом (бензол или толуол). При такой азеотропной осушке содержание влаги снижается до 0,002…0,005 %. Фракции низших олефинов поступают с газоразделительных установок пиролиза или крекинга достаточно сухими, но нередко содержат различные примеси, ведущие к повышенному расходу реагентов и катализатора, а также к образованию побочных веществ, от которых иногда трудно очистить целевой продукт (С2
Н2
или его гомологи, бутадиен-1,3, другие олефины). Нередко очистку фракций от этих веществ не проводят, допуская наличие 2…3 % (об.) указанных примесей. Более тонкая очистка фракций от ненасыщенных веществ для алкилирования не требуется, что в еще большей степени относится к примесям парафинов. Оптимальная степень очистки фракций должна определяться экономическими расчетами.
Хлорид алюминия поступает на реакцию в виде жидкого каталитического комплекса, который готовят в аппарате с мешалкой при небольшом нагревании из технического АlСl3
, диэтилбензола или примерно равных количеств бензола и диалкилбензола (только из бензола комплекс не получается) с небольшой добавкой хлорпроизводного (например, C2
H5
Cl) или, иногда, воды. При наличии на предприятии безводного НСl его тоже можно использовать для получения комплекса.
Можно готовить комплекс из отходов металлического алюминия, ароматических углеводородов и безводного НСl:
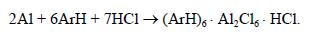
Реакционный узел
Периодический процесс проводят в реакторе с мешалкой и охлаждающей рубашкой, а иногда – со змеевиком. В реактор загружают бензол и АlСl3
или каталитический комплекс (10…20 % от объема реакционной массы), после чего при перемешивании добавляют жидкий олефин или хлорпроизводное, поддерживая заданную температуру. Переход к непрерывному процессу в случае жидких алкилирующих агентов осуществляется двумя основными способами.
При первом из них используют трубчатый реактор (рис. 1а), в нижней части которого имеется мощная мешалка, эмульгирующая реакционную массу. Исходные реагенты и отстоявшийся в сепараторе каталитический комплекс поступают в нижнюю часть реактора, а образующаяся эмульсия поднимается вверх по трубам и охлаждается водой, проходящей в межтрубном пространстве. В сепараторе углеводородный слой отделяют от каталитического комплекса и затем направляют на переработку. Время пребывания смеси в аппарате должно обеспечивать завершение реакции.
Другой способ непрерывного проведения процесса для жидких алкилирующих агентов состоит в применении каскада из двух – четырех реакторов с мешалками (рис. 1б). В первый аппарат подают исходные реа- генты, а реакционная масса через боковой перелив перетекает в следующий реактор, проходя предварительно сепаратор; в нем каталитический комплекс отделяется и возвращается обратно в реактор. Устройство каскада обусловлено тем, что в единичном реакторе смешения трудно избежать потерь алкилирующего агента с готовым продуктом. Время пребывания реакционной массы в каскаде при температуре реакции 40…60 °С составляет ≈ 50 мин, причем оно определяется условиями отвода тепла и стремлением приблизиться к равновесию, благоприятному для получения моноалкилированных соединений.
Алкилирование ароматических углеводородов газообразными олефинами проводят в барботажных колоннах (рис. 1в), внутренняя поверхность которых защищена от коррозии кислотостойкими плитками. Жидкая реакционная масса, заполняющая колонну до бокового перелива, состоит из каталитического комплекса АlСl3
(20…40 % (об.)) и нерастворимой в нем смеси ароматических углеводородов. В нижнюю часть колонны подают сухой бензол и олефиновую фракцию, которая барботирует через жидкость, интенсивно ее перемешивая. Жидкая реакционная масса стекает через боковой перелив в сепаратор, где отстаивается более тяжелый каталитический комплекс, возвращаемый в низ алкилатора, а алкилат поступает на дальнейшую переработку.

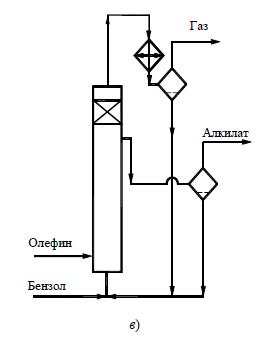
Рисунок 1 Реакционные узлы для алкилирования ароматических углеводородов в присутствии хлорида алюминия: а– трубчатый реактор; б – каскад реакторов с мешалками; в– реакторколонного типа
Тепло реакции отводится практически только за счет нагревания реагентов и испарения бензола. Пары бензола вместе с отходящими газами попадают в обратный холодильник, где бензол конденсируется и возвращается в алкилатор, а отходящие газы поступают на дальнейшую переработку. Следовательно, в алкилаторе устанавливается автотермический режим, и температура в нем зависит от применяемого давления и количества отходящих газов (или от концентрации исходной олефиновой фракции).
При работе на разбавленных фракциях олефинов нередко применяют давление до 0,5…0,6 МПа, чтобы облегчить последующее улавливание бензола из отходящих газов. Температура в алкилаторе достигает 130…140 °С, что ведет к повышенному смолообразованию и дезактивированию катализатора. Целесообразно поэтому снижать давление до 0,15…0,20 МПа при наличии умеренного количества отходящих газов, когда температура сохраняется на оптимальном уровне – примерно 100 °С.
Технологическая схема производства
На рисунке 2 изображена технологическая схема производства этил- или изопропилбензола алкилированием бензола газообразным олефином в присутствии АlСl3
.
Свежий бензол вместе с бензолом, возвращенным со стадии разделения, поступает в колонну 3, предназначенную для осушки бензола азеотропной ректификацией. Низкокипящая азеотропная смесь бензола с водой конденсируется в конденсаторе 4и разделяется в сепараторе 5на два слоя. Воду с растворенным в ней бензолом отводят (ее можно использовать для промывки реакционной массы), а бензольный слой стекает на верхнюю тарелку колонны 3, создавая орошение. Осушенный бензол из куба колонны 3в теплообменнике 2 подогревает бензол, идущий на осушку, и попадает в сборник 8, откуда насосом непрерывно закачивается в алкилатор 9.
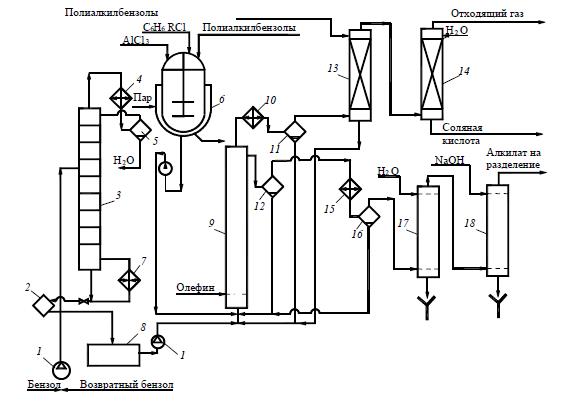
Рисунок 2 Технологическая схема производства этил- или изопропилбензола:
1 – насос; 2– теплообменник; 3– колонна осушки бензола; 4, 10– конденсаторы; 5– сепаратор; 6– аппарат для получения каталитического комплекса; 7 – кипятильник; 8– сборник; 9– алкилатор; 11– газоотделитель; 12, 16– сепараторы; 13– абсорбер; 14 – водяной скруббер; 15– холодильник; 17, 18– промывные колонны
Каталитический комплекс готовят в аппарате 6
с мешалкой и рубашкой для обогрева паром. В него загружают полиалкилбензолы (ПАБ) или смесь бензола и полиалкилбензола (примерно в отношении 1:1) и хлорид алюминия (1 моль на 2,5…3,0 моль ароматических углеводородов), после чего при нагревании и перемешивании подают хлорпроизводное. Приготовленный комплекс периодически вводят в алкилатор.
Реакция проводится в колонне-алкилаторе 9 с горячим сепаратором 12 для отделения каталитического комплекса и обратным конденсатором 10для возвращения испарившегося бензола и отвода тепла. Олефин поступает в низ колонны, предварительно проходя расходомер. Бензол из емкости 8поступает в низ алкилатора, как и конденсат из конденсатора 10.
Газы, отходящие после конденсатора 10, содержат значительное количество паров легколетучего бензола (особенно при использовании разбавленных фракций олефинов). Для улавливания бензола эти газы направляют в абсорбер 13, который орошается полиалкилбензолами, выделенными из реакционной массы на стадии разделения. Собирающийся в нижней части абсорбера раствор бензола в полиалкилбензолах поступает в реакционный аппарат 9для переалкилирования. Газы после абсорбера 13 промывают водой в скруббере 14для удаления НСl и выводят в атмосферу или используют в качестве топочного газа.
Углеводородный слой, отбираемый после сепаратора 12, состоит из бензола, моно- и полиалкилбензолов. В нем присутствуют также в небольшом количестве другие гомологи бензола, получившиеся за счет примесей олефинов в исходной фракции или путем частичной деструкции алкильной группы под действием АlСl3
. При синтезе этил- и изопропилбензолов реакционная масса содержит 45…55 % бензола, 35…40 % моноалкилбензола, 8…12 % диалкилбензола и до 3 % более высокоалкилированных соединений, побочных продуктов и смол. Вся эта смесь проходит водяной холодильник 15и дополнительно отстаивается в холодном сепараторе 16, откуда каталитический комплекс периодически возвращают в алкилатор.
Алкилат направляют после этого на очистку от растворенного хлорида водорода и хлорида алюминия. С этой целью смесь промывают в системе противоточных колонн 17и 18вначале водой, а затем – водной щелочью. Нейтрализованная смесь углеводородов (алкилат) поступает на ректификацию.
Продукты реакции разделяют в нескольких непрерывно действующих ректификационных колоннах (на рисунке не показаны). В первой отгоняют бензол и воду, растворившуюся в углеводородах на стадии промывки. В следующей колонне в вакууме отгоняют фракцию, содержащую главным образом целевой продукт, но с примесью ближайших гомологов бензола.
Ее подвергают затем дополнительной ректификации с выделением технического этил- или изопропилбензолов. Кубовая жидкость второй колонны содержит полиалкилбензолы с примесью продуктов осмоления, которые образуются под действием АlСl3
. Полиалкилбензолы отгоняют в вакууме от смол и используют для абсорбции бензола из отходящих газов и приготовления каталитического комплекса. Через эти промежуточные операции полиалкилбензолы снова возвращают в аппарат 9, где их подвергают деалкилированию. Выход целевого продукта с учетом всех потерь достигает 94…95 % при расходе 5…10 кг АlСl3
на 1 т моноалкилбензола.
Рассмотренная технология алкилирования имеет ряд недостатков и непрерывно совершенствуется. Так, образование большого объема сточных вод можно устранить, разлагая кислотный алкилат небольшим количеством воды; при этом получается концентрированный раствор гексагидрата АlСl3
, находящий разнообразное применение. Предлагалось проводить неодинаковые по скорости процессы алкилирования бензола и переалкилирования полиалкилбензолов в разных аппаратах, что снижает количество рециркулята и энергетические затраты и позволяет работать при меньшем избытке бензола по отношению к олефину.
Один из вариантов усовершенствованного процесса алкилирования состоит в применении небольшого количества каталитического комплекса, растворяющегося в алкилате (гомогенное алкилирование). В этом случае, ввиду отсутствия больших масс катализатора, проводят реакцию при 160…200 °С и соответствующем давлении, необходимом для поддержания смеси в жидком состоянии. В алкилатор 1(рис. 3) подают этилен, бензол и небольшое количество каталитического комплекса, снимая выделяющееся тепло кипящим водным конденсатом и генерируя технологический пар (при обычной технологии это тепло не утилизируется). Полученный алкилат поступает в переалкилатор 2, куда подают полиалкилбензолы (ПАБ) со стадии разделения; они дают с бензолом дополнительное количество целевого продукта. Алкилат из аппарата 2дросселируют до атмосферного дав-ления, причем выделяющуюся энергию полезно утилизируют для испарения части бензола, который конденсируют и возвращают на алкилирование. Жидкий алкилат из сепаратора охлаждают и направляют на нейтрализацию и последующее разделение.
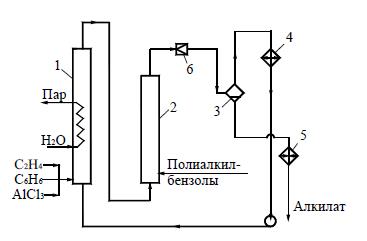
Рисунок 3 Схема гомогенного алкилирования бензола:
1 – алкилатор; 2– переалкилатор; 3– сепаратор; 4– конденсатор; 5– холодильник; 6– дроссельный вентиль
4 Алкилирование фенолов
Фенолы образуют с АlСl3
неактивные соли АrОАlСl2
, поэтому для алкилирования фенолов в качестве катализаторов применяют протонные кислоты или металлоксидные катализаторы кислотного типа. Это позволяет использовать в качестве алкилирующих агентов только спирты и олефины. Наряду с продуктами замещения в ядро получается немного простых эфиров фенола, которые легко перегруппировываются в алкилфенолы:
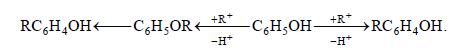
Установлено, однако, что алкилфенолы преимущественно образуются путем прямого алкилирования в ядро. Механизм этой реакции аналогичен рассмотренному ранее для ароматических углеводородов, причем OH-груп- па фенолов сильно активирует в особенности 4- и 2-положения при почти полном отсутствии в продуктах мета-изомеров.
Алкилирование протекает последовательно с образованием моно-, ди- и триалкилфенолов, но одновременно происходит катализируемая кислотами перегруппировка с миграцией орто-алкильных групп с образованием пара-изомеров, которые в данном случае являются термодинамически наиболее стабильными.
Из моноалкилфенолов при катализе протонными кислотами всегда преобладает пара-изомер; при повышении активности катализатора, температуры и продолжительности реакции доля этого изомера среди монозамещенных может возрастать от 60…80 до 95 % и более в связи с изомеризацией орто-изомера.
Из дизамещенных всегда значительно преобладает 2,4-диалкилфенол, доля которого еще больше растет при указанных выше условиях.
При последовательном введении алкильных групп, в отличие от алкилирования ароматических углеводородов, первая стадия протекает быстрее второй, а вторая, в свою очередь, быстрее третьей. На состав продуктов последовательного замещения влияет, кроме того, обратимая реакция переалкилирования
R2
C6
H3
OH + C6
H5
OH ⇔ 2RC6
H4
OH
равновесие которой значительно сдвинуто вправо. Поэтому при повышении активности катализатора, температуры и продолжительности реакции в получаемой смеси может значительно возрасти содержание моноалкилфенола.
Кроме эфиров фенолов и полиалкилзамещенных фенолов побочными продуктами алкилирования являются полиолефины и образующиеся из них алкилфенолы с более длинной цепью атомов углерода. Наоборот, при реакции с высшими, особенно с разветвленными олефинами наблюдается их деполимеризация с получением алкилфенолов, имеющих более короткую алкильную группу. Общий метод подавления этих побочных реакций – понижение температуры, поскольку алкилирование имеет самую низкую энергию активации (≈ 20 кДж/моль). Во избежание полимеризации олефина необходимо также снижать его концентрацию в жидкости, что достигается постепенным введением олефина в реакционную массу.
Реакции фенолов с изоолефинами в заметной степени обратимы, и нагревание соответствующих алкилфенолов с кислотным катализатором ведет к выделению олефина:
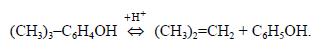
Изомеризация и переалкилирование частично протекают за счет этой реакции.
В качестве катализаторов – протонных кислот – в промышленности чаще всего применяют серную кислоту. Она является наиболее активной среди других доступных и дешевых кислот, но в то же время сильнее катализирует и побочные реакции, приводя дополнительно к сульфированию фенола и сульфатированию олефина и образуя фенолсульфокислоты HOC6
H4
SО2
OH и моноалкисульфаты ROSO2
OH, которые также участвуют в катализе процесса. С серной кислотой алкилирование н-олефинами (кроме этилена) происходит при 100…120 °С, а с более реакционноспособными изоолефинами и стиролом – уже при 50 °С, однако для ускорения процесса и в последнем случае алкилирование проводят при ≈ 100 °С, применяя H2
SO4
в количестве 3…10 %.
Другим катализатором, не вызывающим побочных реакций сульфирования и более мягким по своему действию, является n-толуолсульфо кислота. Однако она имеет меньшую активность и большую стоимость, чем серная кислота. С этими катализаторами алкилирование фенола протекает как гомогенная реакция.
Общим их недостатком является необходимость в отмывке кислотного катализатора, вследствие чего образуется значительное количество токсичных сточных вод. Поэтому широкое распространение получили гетерогенные катализаторы, особенно катионообменные смолы, которые отделяются от реакционной массы простым фильтрованием.
Орто-алкилирование фенолов осуществляют при катализе фенолятами алюминия (АrО)3
А1. В этом случае даже при незанятом пара-положении алкильная группа преимущественно направляется в орто-положение с последовательным образованием моно- и диалкилфенолов.
Газофазный процесс алкилирования применим только для метилирования фенола метанолом. Его осуществляют с гетерогенным катализатором кислотного типа (оксид алюминия, алюмосиликаты и др.).
Получаемые продукты
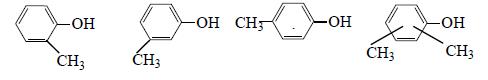
Простейшие гомологи фенола: о-, м-, и п-крезолы и изомерные ксиленолы:
Один из путей их синтеза состоит в газофазном метилировании фенола метанолом над гетерогенным катализатором:
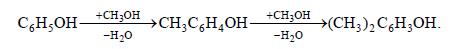
Из моноалкилфенолов представляет практический интерес п-третбутилфенол, получаемый из фенола и изобутена:
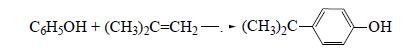
Моноалкилфенолы с алкильной группой из 5 – 8 атомов углерода являются сильными бактерицидными средствами, а при ее удлинении до 8 – 12 атомов С оказываются ценными промежуточными продуктами для синтеза неионогенных поверхностно-активных веществ.
Технология процесса
Для алкилирования фенолов часто применяют периодический процесс. При алкилировании высококипящими жидкими олефинами проводят реакцию в аппарате с мешалкой и рубашкой для обогрева паром или охлаждения водой. В него загружают фенол и катализатор, нагревают их до 90 °С, после чего при перемешивании и охлаждении подают жидкий олефин (диизобутен, тример или тетрамер пропилена, стирол). Во второй половине реакции, наоборот, необходимо подогревать реакционную массу. Общая продолжительность операции составляет 2…4 ч. После этого реакционную массу нейтрализуют в смесителе (5 % щелочью, взятой в эквивалентном количестве к кислоте-катализатору), нагревая смесь острым паром. При этом отгоняется непрореагировавший олефин, который после конденсации паров отделяется в сепараторе от воды и может повторно использоваться для алкилирования. Нейтрализованный органический слой сырых алкилфенолов отделяют от водного раствора солей и направляют на вакуум-перегонку, при которой отгоняются вода, остатки олефина и непревращенный фенол.
В процессах получения алкилфенолов из газообразных олефинов целесообразно использовать не реактор с мешалкой, а пустотелую колонну, в которой реакционная масса перемешивается за счет барботирования олефина. Тепло реакции можно отводить с помощью внутренних или выносных холодильников. Для перехода на непрерывный процесс в целях его интенсификации и улучшения состава реакционной массы, как и при других необратимых последовательно-параллельных реакциях, выгоднее применять каскад таких реакторов.
В процессе алкилирования фенола в присутствии ионообменных смол катализатор суспензирован в жидкости, находящейся в реакционной колонне. В низ колонны непрерывно подаются фенол и олефин. Реакционная масса отфильтровывается от частиц катализатора и поступает на перегонку. Расход катализатора составляет 0,4 % от массы полученных алкилфенолов.
Заключение
В данной работе мы рассмотрели теоретические основы алкилирования ароматических углеводородов.
Список использованных источников
1 Дьячкова, Т.П. Химическая технология органических веществ /Т.П. Дьячкова, В.С. Орехов, К.В. Брянкин, М.Ю. Субочева. – Тамбов: Издательство ТГТУ, 2008.– Ч.2. – 100 с.
2 Днепровский, А.С. Теоретические основы органической химии/А.С. Днепровский, Т.И. Темнекова. – Ленинград: Химия, 1991.– 601 с.
|