Ферментативный катализ используется людьми тысячи лет, задолго до появления самого понятия «катализ». Получение молочно-кислых продуктов, сыра, приготовление теста, вина, красителей и др. продуктов включало применение ферментативных процессов. Технология этих процессов передавалась из поколения в поколение и была эмпирически отработана до совершенства. Считают, что в эволюции жизни и появлении сложных биологических систем (включая человека) важную роль сыграл ферментативный катализ.
Ферменты (энзимы) – биологические катализаторы обладают уникальными свойствами: высокой производительностью в расчете на один реакционный центр и селективностью, связанной со специфичностью действия. Работают ферменты в очень мягких условиях, при атмосферном давлении и температуре до 40о
. В биологических системах отсутствуют неводные растворители и сильные кислоты и основания ( рН ≈ 7 ). Например фермент уреаза гидролизует только молекулы мочевины, не обращая внимания на другие амиды, и делает это гораздо эффективнее обычных кислотных катализаторов (табл.).
Таблица
| Реакция и субстрат |
Катализатор |
Константа ско-рости второго по-рядка, моль-1
∙с-1
|
Температура, о
С |
Гидролиз сложных эфиров
Этилбензоат
Этиловый эфир N-бензоил-L-тирозина
|
Н3
О+
Химотрипсин
|
9,0∙10-5
1,9∙104
|
54
25
|
| Гидролиз аденозин-трифосфата (АТФ ) |
Н3
О+
Миозин
|
4,7∙10-6
8,2∙106
|
40
25
|
Гидролиз амидов
Бензамид
Амид N-бензоил-
L-тирозина
Мочевина
|
Н3
О+
Химотрипсин
Н3
О+
Уреаза
|
2,4∙10-6
14,9
7,4∙10-6
5,0∙106
|
52
25
62
21
|
Международные правила номенклатуры ферментов в зависимости от выполняемых ими функций выделяют шесть основных классов с соответствующими подклассами внутри каждого класса (табл.).
Таблица
| Класс. Функция |
Подклассы |
Класс, функция |
Подклассы |
1. Оксидоредукта-зы
Катализируют окисли-тельно-восстанови-тельные превращения функциональных групп (см. подклассы)
|
СН-NH2
|
2. Транс-феразы
Переносят сле-дующие груп-пы (см. под-классы)
|
алкильные (кроме СН3
) и арильные группы
|
3. Гидролазы
Гидролизуют соедине-ния следующих класс-сов (см. подклассы)
|
4. Лиазы
Отщепляют группы с обра-зованием двой-ной связи и присоединяют группы к двой-ным связям (см. подкласс-сы)
|
5. Изомеразы
Проводят реакции изо-меризации различного типа (см. подклассы)
|
6. Лигазы (синтетазы)
Одновременно с расщеплени-ем АТФ обра-зуют связи (см. подклассы)
|
Приведенная таблица может помочь ориентироваться во множестве уже известных ферментов их названий.
Ферментом может быть глобулярный белок, в активном центре которого собраны функциональные группы, входящие в состав аминокислотных остатков этого белка. В других случаях в состав активного центра входит прочно связанная с белковой цепью простетическая группа (например, липоевая кислота) или слабо связанный кофермент (например, АТФ). Фермент в целом называют холоферментом, а то, что остается после удаления кофермента, - апоферментом.
Реклама

В соответствии с требованиями, предъявляемыми при подборе катализаторов-фементов, их подразделяют на следующие группы:
1. Ферменты без коферментов – простые гидролазы, лиазы и изомеразы.
2. Ферменты, которые не требуют наличия кофермента (содержат прочно связанную простетическую группу, например, флавиновую или пиридоксальную) – трансаминазы, пероксидазы и т. п.
3. Ферменты, которые требуют регенерации кофермента, обычно АТФ или НАД(Ф)Н - например, киназы, большинство оксидоредуктаз.
4. Ферменты, которые встречаются в многоферментных системах.
Ферменты первой группы используются пока шире, часто и в промышленном масштабе (синтез L-аминокислот, 6-аминопеницилиновой кислоты, изомеризация глюкозы во фруктозу и т. д.). Остальные группы ферментов требуют создания особых условий и до сих пор находят применение только в лабораторных синтезах.
Что такое ферменты и за счет каких факторов они работают так эффективно?
Объяснение состоит в том, что фермент обладает способностью формировать так называемый активный центр
и создавать в нем специфическое окружение, в котором протекание катализируемой реакции происходит несоизмеримо быстрее, чем в растворе.
В активном центре происходит специфическое связывание субстрата. Например, сбраживание глюкозы в спирт дрожжами требует участия более 12 ферментов, каждый из которых выполняет свою функцию. Это возможно только благо даря высокой специфичности.
Различают абсолютную специфичность
– специфичность по отношению к одному конкретному субстрату (уреаза – мочевина; галактокиназа переносит фосфат от АТФ только на Д-галактозу, но не на ее стерео изомеры Д-глюкозу и Д-маннозу );
абсолютную групповую специфичность
– специфичность к определенному классу субстратов (спирты, альдегиды, простые или сложные эфиры). Так, протеолитический фермент пепсин специфичен в отношении гидролиза пептидной связи. Алкогольдегидраза окисляет только спирты, а лактикодегидраза – только α-оксикислоты;
относительная групповая специфичность
– фермент действует предпочтительно на один класс соединений, но может в некоторой степени действовать и на представителей других классов, превращая их с меньшими скоростями, чем представителей основного класса. Трипсин способен расщеплять как пептидные, так и сложноэфирные связи.
Оптическая специфичность
– общее свойство большей части ферментов взаимодействовать с веществами, имеющими определенную оптическую активность.
Реклама

Основу ферментов составляют белки, поэтому можно сказать, что ферменты – это белки, способные катализировать химические реакции. Открыты ферменты были в 30-е годы 19-го века, и примерно сто лет ушло на то, чтобы прийти к приведенному определению. Не всякий белок может быть ферментом. По внешней форме белки бывают линейные (фибриллярные) и глобулярные. Только глобулярные белки могут быть ферментами. Белки – это полипептиды, т.е. полимеры, состоящие из аминокислотных остатков, соединенных пептидной связью. Ниже показана реакция образования дипептида. Все природные белки построены из примерно 20 различных аминокислотных
NH2
-CH-COOH + H2
N-CH-COOH → NH2
-CH-CO-HN-CH-COOH + H2
O
   
X1
X2
X1
X2
остатков, отличающихся строением группы Х. Каталитические свойства могут проявлять полипептиды (белки), имеющие молярную массу не менее 5000.
Строение белков имеет три разных уровня.
Первичная структура определяется последовательностью аминокислотных остатков, образующих полипептидную цепь.
Вторичную структуру белка определяют дополнительные связи, возникающие между группами, принадлежащими различным аминокислотным остаткам, находящимся в разных частях полипептидной цепи. К числу таких связей относятся водородные, электростатические, координационные, гидрофобно-гидрофобные и Ван-дер-Ваальсовы взаимодействия. В результате образования дополнительных связей отдельные участки полипептидной цепи образуют α-спирали, петли и β-тяжи.
Третичная структура белка формируется в результате сворачивания отдельных участков полипептидной цепи в относительно автономные глобулярные образования, называемые доменами. Окончательное формирование третичной структуры происходит благодаря специфическим взаимодействиям, возникающим между отдельными доменами, каждый из которых сворачивается самостоятельно. Длинные полипептидные цепи обычно формируют несколько доменов, величина которых значительно варьирует, составляя в среднем 150 аминокислотных остатков. Взаимодействия между доменами приводят к образованию глобулы.
Домены характеризуются тем, что число взаимодействий между аминокислотными остатками в составе домена значительно превышает таковое между соседними доменами. Благодаря этому междоменные области оказываются сравнительно легко доступными для растворителя и содержат полости объемом 20-30 кубических ангстрем, включающие несколько молекул воды. «Архитектурные принципы» построения отдельных доменов различны, что можетбыть связано с выполнением ими разных функций.
Активные центры мультидоменных (в большинстве случаев – двухдоменных) ферментов, как правило, располагаются в междоменной области. Таким образом, каждый из доменов вносит свой вклад в связывание участников реакции.
Важным следствием расположения активного центра на границе между доменами является обеспечение гибкости, подвижности данной области молекулы благодаря тому, что в ходе конформационных изменений, вызываемых связыванием субстратов, домены претерпевают взаимное перемещение.
Между размером молекулы биологического катализатора (т. е. длиной его полипептидной цепи) и сложностью выполняемой им функции существует прямая зависимость. Усложнение функциональных свойств достигается как за счет формирования активного центра на границе раздела между двумя каталитическими доменами, так и за счет появления дополнительных доменов, ответственных за регуляцию активности. Такие ферменты, как лизоцим и гликогенфосфорилаза, резко различаются по размерам (129 аминокислотных остатков в первом и 842 – во втором), хотя оба катализируют реакции расщепления гликозидной связи. Функциональный смысл «утяжеления» молекулы гликогенфосфорилазы состоит в придании ей дополнительной способности координировать работу активного центра в соответствии с сигналами, поступающими из внешней среды (изменение концентраций метаболитов, нервные и гормональные сигналы).
К факторам, определяющим высокую эффективность ферментов, относят:
1. Концентрационный эффект.
2. Ориентационный эффект.
3. Полифункциональность реакционного центра.
Сущность концентрационного эффекта в случае ферментов ничем не отличается от концентрационного эффекта в гетерогенном катализе. Фермент в своем реакционном центре создает локальную концентрацию субстрата, которая существенно выше, чем средняя концентрация в растворе. В реакционном центре фермента селективно концентрируются молекулы, которые должны прореагировать между собой. Такой эффект может приводить к ускорению реакции на несколько порядков.
При протекании обычных химических реакций важно, какими частями происходит столкновение реагирующих молекул. То есть, молекулы при столкновении должны быть соответствующим образом ориентированы друг относительно друга. В реакционном центре фермента при координации молекулы субстрата и образовании фермент-субстратного комплекса происходит четкая ориентация реагирующих молекул за счет взаимодействия с функциональными группами реакционного центра. Это приводит к ускорению реакций примерно на три порядка.
Под полифункциональностью реакционного центра фермента понимают одновременное или согласованное воздействие функциональных групп, входящих в состав реакционного центра, на молекулу субстрата. При этом происходит не только фиксация превращающейся молекулы в строго определенном положении (см. предыдущий пункт), но и изменение характеристик самой молекулы: растягивание связей, изменение валентных углов. Эти изменения приводят к повышению реакционной способности субстратов, т.е., к их активации и ускорению их превращения.
Кинетика ферментативного катализа имеет некоторые особенности. Способность ферментов специфически связывать свои субстраты обусловливает важнейшую особенность катализируемых ими реакций: они начинаются с образования фермент-субстратного комплекса. Связывание субстратов ограничивает их подвижность, сближает и ориентирует их относительно друг друга оптимальным образом для осуществления реакции; уменьшение степеней свободы поступательного и вращательного движения приводит к снижению энтропии. Важным следствием сближения и взаимной ориентации реагирующих групп субстратов, с одной стороны, и функциональных групп фермента, с другой, является то, что катализ становится внутримолекулярным. Это существенно увеличивает его эффективность, так как продуктивные столкновения между молекулами в растворе относительно редки.
По Л. Михаэлису и М. Ментен образование фермент-субстратного комплекса осуществляется в результате сравнительно быстрой обратимой стадии:
k1
 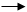 E + SES E + SES
k-1
Затем комплекс более медленно распадается с образованием продукта и высвобождением фермента:
k2
 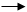 ESE + P ESE + P
k-2
Вторая стадия реакции является лимитирующей. Общая скорость реакции пропорциональна концентрации фермент-субстратного комплекса. В начальный период реакции концентрация продукта пренебрежимо мала, и вторую стадию можно считать необратимой. В таком случае начальная скорость ферментативной реакции выражается уравнением:
Ro
= k2
[ES]
Приняв, что [Eo
] – общая концентрация фермента, а ([Eo
] - [ES]) соответствует концентрации свободного фермента, а также что [S] >> [Eo
], можно получить выражение для [ES]:
[ES] = ([Eo
]∙ [S]/{ [S] + (k2
+ k-1
)/k1
}
Отношение (k2
+ k-1
)/k1
называется константой Михаэлиса ( КМ
); с учетом этого концент-
рация фермент-субстратного комплекса и начальная скорость могут быть описаны уравне-ниями:
[ES] = [Eo
]∙ [S]/ (КМ
+ [S])
Ro
= k2
[ES] = k2
[Eo
]∙ [S]/ (КМ
+ [S])
Последнее уравнение называют уравнением Михаэлиса-Ментен. Необходимо отметить, что величина КМ
совпадает с термодинамической константой диссоциации фермент-субстратного комплекса только в случае квазиравновесия первой стадии и лимитирования процесса второй стадией. Во всех остальных случаях КМ
является сложным комплексом констант скорости стадий ферментативного процесса.
Рассмотрим механизм функционирования ферментативного катализатора на примере гидролитического фермента химотрипсина.
Химотрипсин – фермент поджелудочной железы, функция которого в организме заключается в расщеплении белков пищи, т.е. пептидной связи. Кроме этого химотрипсин может катализировать гидролиз сложных эфиров и некоторые другие реакции. Брутто формула химотрипсина, включающего 241 остаток аминокислот, не несет информации о строении: С1105
H1732
O344
N300
S12
, также как перечисление количества аминокислотных остатков: аланин22
аргинин3
аспарагиновая кислота8
аспарагин14
глутаминовая кислота3
глутамин10
глицин24
гистидин2
изолейцин10
лейцин19
лизин14
метионин2
полуцистин10
пролин9
серин28
треонин22
триптофан8
тирозин4
валин23
фенилаланин6
. Перечисленные аминокислотные остатки соединены в полипептидную цепь в определенной последовательности (первичная структура). Отдельные части полипептидной цепи за счет образования дополнительных связей (см.выше) скручиваются в α-спирали, β-тяжи и петли (вторичная структура). Перечисленные элементы вторичной структуры за счет дополнительных взаимодействий сворачиваются в два домена, в месте соприкосновения которых возникает активный центр фермента, включающий остаток серина (Х – -СН2
ОН ), аспарагиновой кислоты ( Х - -СН2
СОО-
), гистидина.
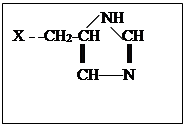
Механизм реакции гидролиза сложного эфира показан на схеме. 2. При подходе субстрата к активному центру фермента неполярная гидрофобная часть субстрата взаимодействует с гидрофобной частью активного центра, протон от серина переходит на азот гистидина, а протон от второго азота гистидина смещается к аниону остатка аспарагиновой кислоты. Образовавшийся из гидроксильной группы серина сильный нуклеофил - -О атакует электрофильный углерод субстрата, в то время как нуклеофильная часть субстрата взаимодействует с протоном, связанным с гистидином. В результате этих взаимодействий образуется фермент-субстратный комплекс. На следующей стадии рвется связь С-Х в субстрате, уходит молекула НХ, а ее место в активном центре занимает молекула воды. Протон от остатка аспарагиновой кислоты возвращается к второму азоту гистидина. Затем рвется предварительно активированная связь О-Н в молекуле воды (протон связывается с первым азотом гистидина, а гидроксил – с углеродом бывшего субстрата). Протон от второго азота гистидина опять возвращается к остатку аспарагиновой кислоты. И наконец выделяется кислота, место которой занимает новый субстрат или активный центр возвращается в исходное состояние.
Рекомендуемая литература
1. Г. Хенрици-Оливэ顟 С. Оливэ. Химия каталитического гидрирования СО. Москва, Мир, 1987 г.
2. Ф. Басоло, Р. Джонсон. Химия координационных соединений. Москва, Мир, 1966.
3. Под ред. Г. Цейсса. Химия металлоорганических соединений. Москва, Мир, 1964.
4. Э. Фишер, Г. Вернер. π-Комплексы металлов. Москва, Мир, 1968.
|