РЕФЕРАТ
по дисциплине «Естествознание»
по теме: «Энтропия и ее связь с тепловой энергией»
Содержание
Введение
1.Теплота и энтропия
2.Энтропия Вселенной, теория тепловой смерти
Заключение
Список использованной литературы
Введение
Энтропия принадлежит к числу важнейших понятий физики. Энтропия как физическая величина была введена в термодинамику Р. Клаузиусом в 1865 г. и оказалась настолько важной и общезначимой, что быстро завоевала сначала другие области физики, а затем проникла и в смежные науки: химию, биологию, теорию информации и т.д.
Понятие энтропии с самого начала оказалось трудным для восприятия в отличие, например, от другой физической величины – температуры. Эта трудность сохранилась и для тех, кто впервые знакомится с термодинамикой. Она носит чисто психологический характер и связана с невозможностью непосредственного восприятия энтропии, отсутствием «градусника», который бы измерял энтропию, как измеряют температуру.
Вместе с тем более глубокое понимание температуры, завершившееся формулировкой «нулевого начала», показывает, что понятие температуры и энтропии одинаковы по сложности. Понятие температуры вводится «нулевым началом», понятие энтропии – вторым началом[1]
. Термодинамика в силу феноменологического характера не может вскрыть физический смысл, как энтропии, так и температуры. Эту задачу решает статистическая физика. Статистическая интерпретация энтропии позволила математикам обобщить понятие энтропии и ввести метрическую энтропию как абстрактную величину, характеризующую поведение неустойчивых динамических систем с экспоненциальной расходимостью близких в начальный момент времени траекторий (энтропия Крылова–Колмогорова–Синая)[2]
. Метрическая энтропия – абстрактное математическое понятие, слишком далеко находящееся от практических задач.
Актуальность данной темы определяется значительной ролью понятия энтропии не только для физики, но и для биологии, синергетики, современных концепций теории информации.
Целью настоящей работы является исследование физического смысла понятия энтропии и его применения для описания реальных явлений.
В связи с поставленной целью можно формулировать следующие задачи исследования:
Реклама

· дать определение термина «энтропия» и рассмотреть его связь с тепловой энергией;
· рассмотреть применимость энтропии как функции состояния термодинамической системы для описания и прогноза эволюции реальных систем.
Реферат состоит из 5 разделов. В первом сформулированы цель и задачи исследования, во втором раскрывается физический смысл энтропии, в третьем дается обзор теории тепловой смерти вселенной, в четвертом сделаны основные выводы по содержанию работы, в пятом указаны первоисточники по теме работы.
1. Теплота и энтропия
Энтропия вводится вторым началом термодинамики. В формулировке А. Зоммерфельда оно звучит так: «Каждая термодинамическая система обладает функцией состояния, называемой энтропией. Энтропия вычисляется следующим образом. Система переводится из произвольно выбранного начального состояния в соответствующее конечное состояние через последовательность состояний равновесия, вычисляются все подводимые при этом порции тепла δQ, делятся каждая на соответствующую ей абсолютную температуру, и все полученные таким образом значения суммируются. При реальных (в современной терминологии – необратимых) процессах энтропия замкнутой системы возрастает»[3]
.
Таким образом,
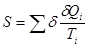 (1) (1)
или
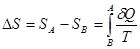 (2) (2)
Подчеркнем, что выбор отдельных обратимых процессов в уравнении 1 или пути интегрирования в уравнении 2 могут не иметь ничего общего с тем, каким образом в действительности система переходит из состояния В в состояние А. Реальные процессы, как правило, необратимы. Однако в равенствах (1) и (2) δQ соответствуют обратимым переходам. Поскольку энтропия является функцией состояния, то есть величиной, которая не зависит от того, каким путем было достигнуто это состояние, то выбор пути обратимого процесса не имеет значения. В качестве примера рассмотрим изменение энтропии при расширении газа в пустоту. Пусть первоначально газ находился в объеме V1
, объем V2
- V1 пустой (рис. 1).
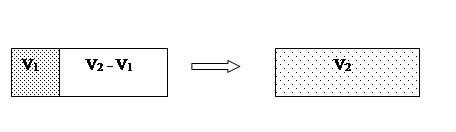
Рис.1
После удаления перегородки газ свободно расширяется, занимая весь объем V2
. Этот процесс является необратимым. Газ самопроизвольно не может вернуться в первоначальное состояние, то есть снова оказаться в объеме V1
(вероятность такой гигантской флуктуации чрезвычайно мала). В соответствии со вторым началом энтропия в таком процессе должна возрастать. Вместе с тем величина
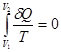 (3) (3)
не является энтропией. В формуле (2) стоит δQ, соответствующее мысленному обратимому процессу. В качестве такого мыслимого процесса удобно выбрать обратимый изотермический процесс расширения с участием поршня и подводом тепла δQ(рис. 2).
Реклама

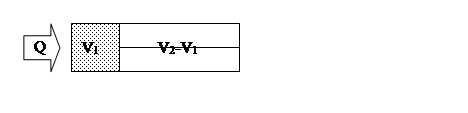
Рис.2
В этом случае в соответствии с первым началом термодинамики δQ = dU + pdV. Если ограничиться случаем идеального газа, для которого U зависит только от температуры и поэтому dU= 0, то δQ = pdV и
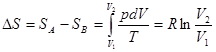 (4) (4)
Расчет проведен для одного моля газа, поэтому pV = RT[4]
.
Вернемся к анализу самого понятия энтропии. Второе начало термодинамики вводит энтропию формальным путем как некую новую функцию состояния, не вскрывая ее физического смысла. Термодинамика не устанавливает связи энтропии с внутренними молекулярными свойствами системы и не дает способа, с помощью которого эту связь можно установить. В этом состоит основная трудность для всех начинающих изучать термодинамику. Свойства и физический смысл энтропии раскрываются, как и в случае с температурой, в рамках статистической физики. Прежде чем обсуждать физический смысл энтропии, необходимо ответить на вопрос, зачем потребовалось вводить это понятие. В практике тепловых измерений точно фиксируется количество теплоты, переданное и отнятое у тела в определенном процессе.
Например, при нагревании 1 г воды на 1°С необходимо затратить 1 калорию (1 кал = 4,1868 Дж). Однако говорить о количестве теплоты, содержащейся в теле, бессмысленно. Тепло может переходить в работу, создаваться при трении, но не сохраняется. В общем случае можно сказать, что тепло передается, но не сохраняется. Сохраняющейся величиной в определенных условиях является энтропия. Например, энтропия сохраняется при обратимом адиабатическом процессе, когда отсутствует передача тепла. Изменение энтропии при возвращении системы в исходное состояние после произвольного кругового обратимого процесса также равно нулю. Это утверждение следует, например, из анализа цикла Карно (рис. 3). Коэффициент полезного действия в цикле Карно
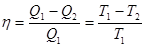 (5) (5)
откуда следует равенство
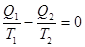 (6) (6)
имеющее ясный физический смысл. Приращение энтропии на изотерме 1–2 компенсируется убыванием энтропии на изотерме 3–4. Изменение энтропии на адиабатах 2–3 и 4–1 равно нулю.
Из факта возвращения энтропии к своему первоначальному значению после произвольного обратимого кругового процесса следует вывод, что энтропия в данном состоянии не зависит от способа достижения этого состояния, а определяется параметрами этого состояния, то есть является функцией состояния, как утверждает второе начало. Таким образом, можно говорить о количестве энтропии в данном состоянии. В этом принципиальное отличие энтропии от теплоты. В общем случае для энтропии нет закона сохранения. При обратимых процессах энтропия может переходить от системы к окружающей среде и наоборот. При необратимых процессах возникающая в системе энтропия всегда положительна.
Необходимость введения энтропии не ограничивается потребностью замены количества тепла на новую функцию состояния. Все термодинамические величины образуют пары, их называют парами сопряженных величин, например, давление и объем. Они входят в выражение для работы ΔА = pΔV. Какая величина сопряжена температуре? Поскольку выражение для количества тепла, переданного в обратимом процессе, имеет вид ΔQ = TΔS, то можно говорить, что сопряженной величиной для температуры является энтропия. Среди сопряженных величин одна зависит от объема (например, S в паре S и Т), другая нет (например, р в паре р и V).
Таким образом, с введением энтропии завершился этап формирования основных понятий термодинамики.
Физический смысл энтропии выясняется при рассмотрении микросостояний вещества. Л. Больцман был первым, кто установил связь энтропии с вероятностью состояния. В формулировке М. Планка утверждение, выражающее эту связь и называемое принципом Больцмана, представляется простой формулой
S = kB
lnW. (7)
Сам Больцман никогда не писал этой формулы. Это сделал Планк. Ему же принадлежит введение постоянной Больцмана kB
. Термин «принцип Больцмана» был введен А. Эйнштейном. Термодинамическая вероятность состояния W или статистический вес этого состояния – это число способов (число микросостояний), с помощью которых можно реализовать данное макросостояние. На квантовом языке статистический вес – это число различных квантовых микросостояний, реализующих данное макросостояние с данной энергией.
Подчеркнем, что термодинамическая вероятность W отличается от математической вероятности, которая всегда выражается некоторой дробью, меньшей или равной единице. Указанное различие несущественно, поскольку в большинстве практических расчетов вычисляется разность энтропии, то есть относительная вероятность W/W0
. Установление связи между столь несхожими понятиями, как энтропия и вероятность, является важнейшим научным достижением. Энтропия и вероятность – величины разной природы. Энтропия – величина физическая, а термодинамическая вероятность – математическая. Численное значение физической величины зависит от выбранной системы единиц, математическая величина – это число, число способов. Согласованность левой и правой частей (7) обеспечивается постоянной Больцмана. Эта же постоянная обеспечивает совпадение термодинамической энтропии с энтропией, определяемой из принципа Больцмана.
2. Энтропия Вселенной, теория тепловой смерти
Наиболее драматическая формулировка второго начала принадлежит Р.Ю.Э. Клаузиусу:
1) энергия Мира постоянна;
2) энтропия Мира стремится к максимуму.
Из этой формулировки следует, что в конце эволюционного процесса Вселенная должна прийти в состояние термодинамического равновесия (в состояние тепловой смерти), которому соответствует полная дезорганизация системы. Представление о тепловой смерти Вселенной, вытекающее из формулировки второго начала, предложенной Клаузиусом, – пример неправомерного перенесения законов термодинамики в область, где она уже не работает[5]
.
Законы термодинамики применимы, как известно, только к термодинамическим системам. Одним из обязательных признаков термодинамической системы является аддитивность некоторых ее характеристик, например энергии. Это свойство состоит в следующем. Если равновесную систему разбить на отдельные равновесные макроскопические части, то энергия всей системы будет суммой энергий отдельных ее частей.
Таким образом, энергия системы должна быть пропорциональна ее объему. Этим признаком Вселенная не обладает. Причина состоит в том, что гравитационное взаимодействие является дальнодействующим и неэкранируемым, поэтому гравитационная энергия Вселенной непропорциональна ее объему. Полная энергия Вселенной также непропорциональна объему и поэтому не является аддитивной величиной. Кроме того, Вселенная расширяется, то есть она не находится в стационарном состоянии. Таким образом, говорить об энтропии Вселенной в термодинамическом смысле нельзя, поскольку Вселенная не является термодинамической системой.
Однако во Вселенной можно выделить подсистемы, к которым применимо термодинамическое описание. Такими подсистемами являются, например, все компактные объекты (звезды, планеты и др.) или реликтовое излучение (тепловое излучение с температурой 2,73 К). Реликтовое излучение возникло в момент Большого взрыва, приведшего к образованию Вселенной, и имело температуру ~4000 К. В наше время, то есть спустя 10-20 млрд. лет после Большого взрыва, это первичное (реликтовое) излучение, прожившее все эти годы в расширяющейся Вселенной, охладилось до указанной температуры.
Расчеты показывают, что полная энтропия всех наблюдаемых компактных объектов ничтожно мала по сравнению с энтропией реликтового излучения. Причина этого, прежде всего в том, что число реликтовых фотонов очень велико: на каждый атом во Вселенной приходится примерно 109
фотонов. Энтропийное рассмотрение компонент Вселенной позволяет сделать еще один вывод. По современным оценкам, полная энтропия той части Вселенной, которая доступна наблюдению, порядка 1090
kB
. Кроме того, энтропия вещества этой же части Вселенной, сконденсированной в черную дыру, составляет порядка 10124
kB
[6]
.
Сравнение этих цифр показывает, насколько далека окружающая нас часть Вселенной от максимально неупорядоченного состояния.
Заключение
Среди всех физических величин, вошедших в науку в XIX в., энтропия занимает особое место в силу своей необыкновенной судьбы. С самого начала энтропия утвердилась в теории тепловых машин. Однако очень скоро рамки этой теории оказались ей тесны, и она проникла в другие области физики, прежде всего в теорию излучения. Экспансия энтропии этим не ограничилась. В отличие, например, от других термодинамических величин энтропия довольно быстро перешагнула границы физики.
Энтропия является фундаментальной физической величиной. С введением энтропии завершился этап формирования основных понятий термодинамики. Следующий этап начался с выяснения физического смысла энтропии. Трактовка энтропии с помощью принципа Больцмана, то есть установление связи между энтропией и вероятностью состояния системы или ее статистическим весом, позволила энтропии выйти за пределы термодинамики и равновесной статистической физики и проникнуть в другие области науки, например в теорию информации.
Научный потенциал энтропии далеко не исчерпан уже существующими приложениями. В перспективе проникновение энтропии в новую область науки – синергетику, которая занимается изучением закономерностей образования и распада пространственно-временных структур в системах различной природы: физических, химических, биологических, экономических, социальных и т.д. Триумфальное шествие энтропии продолжается.
Список использованной литературы
1. Зоммерфельд А. Термодинамика и статистическая физика. М.: Изд-во Иностр. лит., 1955.
2. Киржниц Д.А. Горячие «черные дыры»: Новое в понимании природы теплоты // Соросовский Образовательный Журнал. 1997. № 6. С. 84.
3. Осипов А.И. Термодинамика вчера, сегодня и завтра // Соросовский Образовательный Журнал. 1999. № 4. С. 79.
4. Осипов А.И., Уваров А.В. Энтропия и ее роль в науке // Соросовский Образовательный Журнал. 2004. № 1. С. 70-78.
5. Ребане К.К. Энергия, энтропия, среда обитания. Таллин: Валгус, 1984.
6. Смородинский Я.А. Температура. М.: Наука, 1981 (Б-ка «Квант»; Вып. 12).
7. Шамбадаль П. Развитие и приложения понятия энтропии. М.: Наука, 1967.
[1]
Зоммерфельд А. Термодинамика и статистическая физика. М.: Изд-во Иностр. лит., 1955 С.54
[2]
Шамбадаль П. Развитие и приложения понятия энтропии. М.: Наука, 1967. С.29
[3]
Зоммерфельд А. Термодинамика и статистическая физика. М.: Изд-во Иностр. лит., 1955 С.16
[4]
Осипов А.И.Термодинамика вчера, сегодня и завтра // Соросовский Образовательный Журнал. 1999. № 4. С. 79; № 5.С. 91.
[5]
Зоммерфельд А. Термодинамика и статистическая физика. М.: Изд-во Иностр. лит., 1955 С.79
[6]
Киржниц Д.А. Горячие «черные дыры»: Новое в понимании природы теплоты // Соросовский Образовательный Журнал. 1997. № 6. С. 84.
|